認知症治療剤とその製造方法、認知症の治療方法
【課題】NGF合成促進活性に優れた認知症治療剤の提供。
【解決手段】サンゴハリタケ由来の活性物質を含むことを特徴とする認知症治療剤。
【解決手段】サンゴハリタケ由来の活性物質を含むことを特徴とする認知症治療剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、認知症治療剤とその製造方法、認知症の治療方法に関する。より詳しくは、サンゴハリタケ(Hericium ramosum)由来の認知症治療剤とその製造方法、該認知症治療剤を用いる認知症の治療方法に関する。
【背景技術】
【0002】
近年、社会の高齢化がますます進み、アルツハイマー型認知症や脳血管性認知症などの認知症の患者の急増が、深刻な社会問題として注目されている。中でもアルツハイマー型認知症は、神経細胞の変性などを原因とするものであり、本人の気付かないうちにその症状が徐々に進行することが特徴である。しかも、現在の医学では根本的な治療法はまだ確立されていないので、一旦発症すれば完治は難しい。よって、病状が進行する前または発症する前の段階において、何らかの活性物質により神経細胞変性のリスクを低減したり、症状を緩和したりすることが非常に重要であると考えられている。
【0003】
アルツハイマー型認知症の発症機序の解明や新しい薬品の探索などの研究開発が盛んに進められている。例えば、アルツハイマー型認知症の患者の脳においては、神経原繊維の変化、神経細胞の萎縮、神経細胞数の減少といった障害が認められ、これらの病態は、記憶や学習能に関連する前脳基底核コリン作動性神経細胞の障害とよく一致している。この前脳基底核コリン作動性神経細胞に対する栄養因子が神経成長因子(nerve growth factor;NGF)であることから、NGFの欠乏がアルツハイマー型認知症の誘因の一つであると考えられている。また、脳血管性認知症においても、NGFの欠乏が一因であると考えられている。
【0004】
ここで、神経成長因子を代表とするニューロトロフィンファミリーは、神経細胞の機能維持に関わっている。これらが正常に機能しないと、上記のとおりアルツハイマー病などの痴呆症を引き起こすと考えられている。これらの栄養因子はタンパク質であるため、血液脳関門(blood−brain barrier;BBB)を通過できず、経口や注射で投与することはできない。そこで、脳の中でNGFなどを産生しているアストログリア細胞などを刺激して、脳中でNGFを作らせることが、痴呆症の予防や治療に有効とされている。
【0005】
このような脳中でのNGF合成を促進させる方法として、サンゴハリタケ科(Hericiaceae)、サンゴハリタケ属(Hericium)に分類される食用きのこであるヤマブシタケ(Hericium erinaceum、非特許文献1参照)の天然物が、NGF合成促進物質であるヘリセノン類やエリナシンを有していることが発見された(非特許文献2参照)。NGFの合成を促す物質が動物以外の天然成分の中から発見されたのはヤマブシタケが最初であったこともあり、ヤマブシタケの産生する生理活性物質については大いに注目され、これまで様々な研究が進められてきている。
【0006】
一例として、非特許文献3によれば、ヤマブシタケ由来の成分であるヘリセノンCやエリナシンAを使用したラットを用いた動物実験では、アルツハイマー病のモデルに加え、人工的に血管を詰まらせる脳血管性痴呆のモデルでも明らかに記憶の保持や学習能力の向上が見られると記載されている。
【0007】
ここで、生物分類学上ヤマブシタケと近縁な食用きのことしてサンゴハリタケ(Hericium ramosum)が知られており、現在、サンゴハリタケ属にはサンゴハリタケとヤマブシタケの2種のみが属するとされている。ヤマブシタケはその代謝産物の特異性が高いことが知られていた一方、同じサンゴハリタケ科にも関わらず、サンゴハリタケはヤマブシタケとは全く違う物質群を産生することがよく知られていた(非特許文献4)。そのため、サンゴハリタケはヤマブシタケとは逆にこれまでほとんど注目されておらず、認知症治療剤としてもほとんど注目されていなかった。
【0008】
サンゴハリタケの生理活性物質に関する報告としては、例えば、神経成長因子(NGF)産生促進作用を有するヤマブシタケ由来のエリナシンEに対し、サンゴハリタケ由来のエリナシンEがk−オピオイド受容体のアゴニストであることが報告されている例がある程度であった(非特許文献5)。すなわち、サンゴハリタケが含有する生理活性物質や機能性成分に注目した例はほとんど知られていなかった。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】「Ainsworth & Bisby's Dictionary of Fungi」 9th edition, Commonwealth Agricultural Bureaux Commonwealth Mycological Institute、2001年12月15日、p.224
【非特許文献2】河岸洋和,「キノコの機能性とそれを司る物質」, FOOD Style 21, 7(9),70−73 (2003)
【非特許文献3】河岸洋和, 「キノコが造り出す生体調節機能物質」, 食品と開発, 37(3),14−17 (2002)
【非特許文献4】河岸洋和, 「機能性食品と薬理栄養」, J・JSMUFF, 3(3), 189−194 (2006)
【非特許文献5】Saito, T. et al., Erinacine E as a kappa opioid receptor agonist and its new analogs from a basidiomycete, Hericium ramosum., J. Antibiot., vol.51, p.983−990(1998年)
【発明の概要】
【発明が解決しようとする課題】
【0010】
このような状況のもと、本発明者がヤマブシタケ菌糸体の凍結乾燥物を用いてin vivoでマウス脳内におけるNGF合成促進作用を検討したところ、海馬内のNGF産生量は確かに増加することがわかった。しかしながら、ヤマブシタケを用いた場合であっても、認知症の治療や予防が確実にできるという状況には至っていないのが実情である。すなわち、認知症の治療および予防をより有効にする観点から、従来よりもさらにNGF合成活性が高い物質が求められているのが実情であった。
【0011】
本発明は、上記実情に鑑みてなされたものであり、本発明が解決しようとする課題は、NGF合成促進活性に優れた認知症治療剤を提供することにある。
【課題を解決するための手段】
【0012】
本発明者が上記課題を解決することを目的として鋭意研究したところ、サンゴハリタケ菌糸体の凍結乾燥物を用いて、in vivoでマウス脳内におけるNGF合成促進活性を検討したところ、ヤマブシタケ菌糸体の凍結乾燥物を用いた場合よりもNGF産生量が多くなることを見出すに至った。
【0013】
すなわち、前記課題を解決するための具体的手段である本発明は、以下のとおりである。
[1] サンゴハリタケ由来の活性物質を含むことを特徴とする認知症治療剤。
[2] 経口治療剤であることを特徴とする[1]に記載の認知症治療剤。
[3] 前記サンゴハリタケ由来の活性物質が、サンゴハリタケの菌糸体由来であることを特徴とする[1]または[2]に記載の認知症治療剤。
[4] 前記サンゴハリタケ由来の活性物質が、サンゴハリタケ菌糸体の凍結乾燥物であることを特徴とする[1]または[2]に記載の認知症治療剤。
[5] アルツハイマー型認知症または脳血管性認知症の治療剤であることを特徴とする[1]〜[4]のいずれか一項に記載の認知症治療剤。
[6] [1]〜[5]のいずれか一項に記載の認知症治療剤を、経口で投与することを特徴とする認知症の治療方法。
[7] サンゴハリタケ由来の活性物質を哺乳動物に投与することにより、脳の海馬中に神経成長因子を増加させる方法。
[8] 前記サンゴハリタケ由来の活性物質を経口摂取させることを特徴とする[7]に記載の方法。
[9] 前記哺乳動物がヒトであることを特徴とする[7]または[8]に記載の方法。
[10] サンゴハリタケを凍結乾燥する工程を含むことを特徴とする認知症治療剤の製造方法。
【発明の効果】
【0014】
本発明によれば、NGF合成促進活性に優れた認知症治療剤を提供することができる。
【図面の簡単な説明】
【0015】
【図1】図1はサンゴハリタケ菌糸体とヤマブシタケ菌糸体のNGF合成促進活性比較試験の結果のグラフである。
【図2】図2はサンゴハリタケ菌糸体のNGF合成促進活性における用量依存性試験の結果のグラフである。
【図3】図3は各種キノコ菌糸体の抗酸化活性比較試験の結果のグラフである。
【図4】図4は各種キノコ菌糸体の総ポリフェノール量比較試験の結果のグラフである。
【発明を実施するための形態】
【0016】
以下、本発明の認知症治療剤について、詳細に説明する。
以下に記載する構成要件の説明は、本発明の代表的な実施態様に基づいてなされることがあるが、本発明はそのような実施態様に限定されるものではない。なお、本明細書において「〜」を用いて表される数値範囲は、「〜」の前後に記載される数値を下限値および上限値として含む範囲を意味する。
【0017】
[認知症治療剤]
本発明の認知症治療剤は、サンゴハリタケ由来の活性物質(活性成分)を含むことを特徴とする。
以下、本発明の認知症治療剤について説明する。なお、本明細書中、認知症治療剤という用語は、予防剤を含む概念を表す用語として用いることがある。
【0018】
(活性物質)
前記活性物質としては、サンゴハリタケ由来であれば特に制限はない。サンゴハリタケは子実体と菌糸体のいずれの状態のものを用いてもよいが、品質、規格を一定に保ち、安定化、均一化のためには栽培菌糸体を用いる方が望ましい。すなわち、本発明の認知症治療剤は、前記サンゴハリタケ由来の活性物質が、サンゴハリタケの菌糸体由来であることが好ましい。
【0019】
本発明において、子実体とは、菌類が胞子形成のために、菌糸により形成する構造体であり、一般的にキノコの食用とされる構造体を指す。一方、菌糸体とは、胞子が発芽し、細胞分裂を繰り返して形成された菌糸の集合体を指す。
【0020】
(活性物質の作用)
本発明の認知症治療剤は、NGF産生促進(誘導)作用を有する。そのため、アルツハイマー型認知症の治療薬または予防薬や、アルツハイマー型以外の若年性認知症である(脳)血管性認知症(脳梗塞後の後遺症に伴う認知症)の治療薬または予防薬として有用である。これらの作用に加え、空間認知力や学習能力向上、記憶力改善などの効果を有していることも好ましい。
【0021】
本発明の認知症治療剤は、サンゴハリタケ由来の活性物質を被険体に投与することにより、被険体の脳の海馬中に神経成長因子を増加させることができる。さらに、本発明の認知症治療剤は、前記サンゴハリタケ由来の活性物質を好ましくは経口摂取させて、被険体の脳の海馬中に神経成長因子(NGF)を増加させることができる。このとき、脳内におけるNGFの測定方法としては特に制限はないが、外科手術的な手法によって摘出し、酵素免疫吸着測定法(ELISA)やNGF Emax ImmunoAssay Sysyemを用いて、各脳組織の中の神経成長因子の含有量を測定することができる。
このような本発明の認知症治療剤は、前記被険体が特に哺乳動物である場合に上記の作用を奏する。哺乳動物の中にはヒトも含まれ、本発明の認知症治療剤はヒトに好ましく投与することができる。
【0022】
また、本発明の認知症治療剤に用いられる前記サンゴハリタケ由来の活性物質は、抗酸化活性を奏することが好ましい。
【0023】
なお、本発明の認知症治療剤はその他の脳機能を改善してもよく、例えば、精神安定作用、イライラ感や動悸の抑制、リラックス感の増強、ストレス蓄積の防止、α波の発生等が挙げられる。
【0024】
(形態)
本発明の認知症治療剤は、一般的な添加成分を加えた組成物とした上で、医薬品、保健食品、一般食品などとして利用することが可能である。かかる添加成分としては、例えば従来から用いられている薬学的に許容された界面活性剤、溶媒、増粘剤、安定剤、保存料、酸化防止剤、香味料などの添加剤、他のNGF産生促進活性を有する成分や化合物、別の機能性(血流改善効果や血圧上昇抑制効果など)を有する成分や化合物などを挙げることができる。
【0025】
本発明の認知症治療剤の形態としては、粉末、錠剤、カプセル、軟カプセル、ペーストもしくはトローチ、ガムまたは飲用可能な溶液、分散液もしくは乳濁液(以下、これらをまとめて薬液とも言う)などが挙げられるがこれらに限定されるものではない。また、これらの形態は従来から知られている方法によって作製することができる。
【0026】
その中でも本発明の認知症治療剤は、粉末または薬液であることが好ましい。すなわち、サンゴハリタケを任意の方法で粉末とするか、サンゴハリタケを任意のvehicleを用いて薬液とすることが好ましい。さらに、本発明の認知症治療剤は薬液であることがより好ましい。なお、前記vehicleとしては特に制限はなく、本発明の属する分野で従来知られているものを用いることができる。
【0027】
[認知症治療剤の製造方法]
サンゴハリタケからの活性物質の調製方法は特に制限はなく、サンゴハリタケの生体を用いても、乾燥したものを用いてもよい。また、サンゴハリタケから公知の方法により活性物質を抽出してもよい。また、抽出した活性物質は、一般的な方法での精製を行ってもよい。本発明では、サンゴハリタケを乾燥したものを用いることが好ましい。
【0028】
粉末状の認知症治療剤を調製する場合は、サンゴハリタケを凍結乾燥したものを粉砕し、粉末とすることが好ましい。一方、薬液状の認知症治療剤を調製する場合は、vehicleとして水を用いてサンゴハリタケを水溶液または水分散液とすることが好ましく、そのときサンゴハリタケの凍結乾燥物を水溶液または水分散液とすることがより好ましい。但し、前記薬液にその他液体または一般的な添加成分を加えてもよく、その他本発明の趣旨に反しない限りにおいて任意の他の認知症治療剤の活性成分を添加してもよい。
なお、本発明の認知症治療剤における前記活性物質は、水溶性であっても、水に不溶性であっても、脂溶性であってもよい。また、前記活性物質が複数含まれていてもよく、その場合は、例えば水溶性成分と脂溶性成分とが含まれていてもよい。本発明の認知症治療剤を水分散液とする場合、特にその水分散液の特定の画分を分離や精製して用いて調製してもよいが、サンゴハリタケの水分散液全体を用いることが好ましい。
【0029】
さらに、本発明の認知症治療剤は、前記サンゴハリタケ由来の活性物質が、サンゴハリタケ菌糸体の凍結乾燥物由来であることが好ましく、サンゴハリタケ菌糸体の凍結乾燥物であることがより好ましい。すなわち、本発明の認知症治療剤の製造方法は、サンゴハリタケを凍結乾燥する工程を含むことが好ましい。
なお、凍結乾燥の方法としては特に制限はない。また、凍結乾燥前のサンゴハリタケ中の成分を凍結乾燥する工程を通じて変化させて前記活性物質として用いてもよく、凍結乾燥前のサンゴハリタケ中の成分を凍結乾燥する工程を通じて変化させせずそのまま前記活性物質として用いてもよい。
【0030】
[認知症の治療方法]
(投与方法)
また、本発明の認知症治療剤は、本発明の実施例で実証されているとおり血液脳関門を通過することができ、in vivoでマウス脳内の海馬でのNGF産生量を増加させることができる。そのため、いかなる理論に拘泥するものでもないが、NGF合成促進物質であると推測される。
そのため、本発明の認知症治療剤は、局所投与する必要が無く、注射投与や経口投与が可能である。
【0031】
本発明の認知症治療剤は、認知症治療剤として簡易に用いることができる観点から、経口治療剤であることがより好ましい。
また、本発明の認知症治療剤は、食用であるサンゴハリタケ由来のものであることから、安全性が高く、毎日の服用も可能であると考えられる。そのため、本発明の認知症治療剤に含まれる前記活性物質は、認知症の症状を改善する治療剤としてのみでなく、恒常的な服用も可能な認知症予防剤としても利用できる。
【0032】
本発明の認知症治療剤は、前記活性物質の被険体の体重1kg当たりの用量は特に制限はなく、摂取する被険体(対象)の年齢、体重などによって変わり得る。例えば、5mg/kg以上であることが好ましく、5〜25mg/kgであることがより好ましく、25〜30mg/kgであることが特に好ましい。
【0033】
本発明の認知症治療剤は、投与回数に特に制限はないが、例えば1日当たり1回〜1日当たり4回投与することができ、1日当たり2〜4回投与することが好ましく、1日当たり1回投与することが好ましい。
また、投与間隔についても特に制限はないが、例えば、6〜8時間ごとに投与することが好ましく、12〜36時間ごとに1回投与されることが好ましい。
また、投与期間についても特に制限はないが、例えば2週間以上であることが好ましく、2〜16週間であることがより好ましい。なお、例えば2週間投与した場合、NGFの産生量を増加させることができることがわかっている。
【0034】
(調製方法)
本発明の認知症治療剤は、既知の方法にしたがって調整することが可能である。薬液としたときの前記活性物質の濃度は、本発明の効果が得られる範囲内で調整することができる。
【実施例】
【0035】
以下に実施例を挙げて本発明の特徴をさらに具体的に説明する。
以下の実施例に示す材料、使用量、割合、処理内容、処理手順等は、本発明の趣旨を逸脱しない限り適宜変更することができる。したがって、本発明の範囲は以下に示す具体例により限定的に解釈されるべきものではない。
【0036】
[実施例1]
(サンゴハリタケ菌糸体とヤマブシタケ菌糸体のNGF合成促進活性比較)
サンゴハリタケ菌糸体の凍結乾燥物と、ヤマブシタケ菌糸体の凍結乾燥物を常法にしたがって調製した。
上記にて調製した各凍結乾燥物の試料を用いて300mg/kgの濃度の薬液を調製した。なお、薬液のvehicleとして脱イオン水を用い、水分散液とした。なお、このとき、各凍結乾燥物は水に完全に可溶はしなかったものの、一部の水への可溶性成分は水に溶けたと予想される。
得られた各薬液を、マウス体重10g当たり0.2mlの用量で、1日1回ずつ、2週間にわたって経口投与した。このとき、7週歳の健康なマウスをそれぞれ10匹ずつ用いた。
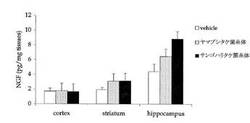
各薬液を2週間投与したマウスから、脳内の神経核団である大脳皮質(cortex)、大脳線状(striatum)および海馬(hippocampus)をそれぞれ摘出し、酵素免疫吸着測定法(ELISA)を用いて、各脳組織の中の神経成長因子(NGF)の含有量を測定した。
得られた結果を図1に示す。なお、図1中、各脳組織におけるグラフは、左から順にvehicleのみの投与、ヤマブシタケ菌糸体の凍結乾燥物の投与、サンゴハリタケ菌糸体の凍結乾燥物の投与を行ったときのNGFの含有量を表す。
【0037】
図1より、海馬(hippocampus)では、vehicleのみを投与したときに対する薬液を投与したときのNGF産出量の増加量は、サンゴハリタケ菌糸体の凍結乾燥物を用いた本発明の認知症治療剤である薬液を投与したマウスでは、ヤマブシタケ菌糸体の凍結乾燥物を用いた薬液を投与したマウスの2倍とであったことがわかった。
また、大脳線状(striatum)でもvehicleのみを投与したときに対して、サンゴハリタケ菌糸体の凍結乾燥物を用いた本発明の認知症治療剤である薬液を投与したときのNGF産出量の増加が見られた。さらに、大脳線状(striatum)におけるNGF産出量の増加についても、サンゴハリタケ菌糸体の凍結乾燥物を用いた本発明の認知症治療剤である薬液は、ヤマブシタケ菌糸体の凍結乾燥物を用いた薬液と同程度であることがわかった。
【0038】
[実施例2]
(サンゴハリタケ菌糸体のNGF合成促進活性における用量依存性試験)
サンゴハリタケ菌糸体の凍結乾燥物を用いて、薬液1kg当たりの濃度を100mg(100mg/kg)、300mg(300mg/kg;実施例1と同濃度)、600mg(600mg/kg)に変更した以外は実施例1と同様にして、薬液を調製した。
得られた各薬液を実施例1と同様に、マウス体重10g当たり0.2mlの用量で、1日1回ずつ、2週間にわたって経口投与した。このとき、7週歳の健康なマウスをそれぞれ10匹ずつ用いた。
各薬液を2週間投与したマウスから海馬(hippocampus)をそれぞれ摘出し、酵素免疫吸着測定法(ELISA)を用いて、各脳組織の中の神経成長因子(NGF)の含有量を測定した。
得られた結果を図2に示す。なお、図2中、各脳組織におけるグラフは、左から順にvehicleのみの投与、サンゴハリタケ菌糸体の凍結乾燥物100mg/kgの投与、サンゴハリタケ菌糸体の凍結乾燥物300mg/kgの投与、サンゴハリタケ菌糸体の凍結乾燥物600mg/kgの投与を行ったときのNGFの含有量を表す。
【0039】
図2より、海馬(hippocampus)では、vehicleのみを投与したときに対する薬液を投与したときのNGF産出量の増加量は、サンゴハリタケ菌糸体の凍結乾燥物を用いた薬液の濃度(すなわち、サンゴハリタケ菌糸体の凍結乾燥物の用量)に応じて増加することがわかった。
【0040】
上記実施例1および実施例2の結果のとおり、vehicleのみを投与したときと比較して、本発明のサンゴハリタケ菌糸体由来の認知症治療剤投与群では、各神経核団の中のNGF含有量がいずれも増加する傾向が見られた。特に、海馬でのNGF含有量の増加量が大きく、その増加量は従来公知のヤマブシタケ菌糸体を用いた場合の2倍となることがわかった。すなわち、サンゴハリタケ菌糸体の凍結乾燥物を用いた本発明の認知症治療剤は、特に海馬においてNGF産出量を増加させることができることから、アルツハイマー型認知症の治療薬または予防薬や、アルツハイマー型以外の若年性認知症である(脳)血管性認知症(脳梗塞後の後遺症に伴う認知症)の治療薬または予防薬として有用であることがわかった。
【0041】
[実施例3]
(サンゴハリタケ菌糸体の抗酸化活性)
in vitroにて、各種キノコの菌糸体の抗酸化活性(DPPH radical scavenging activity)を測定した。なお、各キノコの菌糸体は凍結乾燥したものを粉末にして用いた。一般的な抗酸化活性の指標である、各粉末1g当たりのトロロックス(Trolox: 6−hydroxy−2,5,7,8−tetramethyl−chroman−2−carboxylic acid)生成量(μmol)を測定した。その結果を図3に示した。図3中、横軸は、1はムキタケ;2はホンシメジ;3はムラサキシメジ;4はシロタモギタケ;5はナメコ;6はヌメリスギタケモドキ;7はハナビラタケ;8はタマチョレイタケ;9はアシグロタケ;10はマスタケ;11はマイタケ;12はチョレイマイタケ;13はシイタケ;14カバノアナタケ(チャーガ);15はサンゴハリタケ;16はヤマブシタケ;17はマンネンタケ(レイシ);18はコフキサルノコシカケ;19はブナハリタケ;20はアガリクスを表す。
図3より、サンゴハリタケ(15)はこれらの中で最も抗酸化活性が高く、特にヤマブシタケ(16)よりも抗酸化活性が高いことがわかった。
【0042】
上記実施例3のとおり、サンゴハリタケ由来の活性物質を含む本発明の認知症治療剤は、実際にその抗酸化活性が高いため、活性酸素を効率的に除去できると予想できることがわかった。脳内の活性酸素(フリーラジカル)は認知症発症の原因の一つと現在予想されていることから、このような本発明の認知症治療剤は、このような観点からも、認知症の予防剤としても有用であることがわかった。
【0043】
[実施例4]
(サンゴハリタケ菌糸体の総ポリフェノール量)
in vitroにて、各種キノコの菌糸体の総ポリフェノール量を測定した。なお、各キノコの菌糸体は凍結乾燥したものを粉末にして用いた。各粉末100g当たりの総ポリフェノール量を測定した。その結果を図4に示した。図4の横軸は、図3の横軸と同様である。
図4より、サンゴハリタケ(15)はこれらの中で最も総ポリフェノール量が多く、特にヤマブシタケ(16)と同程度ながらもある程度多いことがわかった。
【0044】
抗酸化物質の一つであるポリフェノール類は、アルツハイマー病の原因遺伝子と予想されているアポE4遺伝子の発現を抑制したり、実際に摂取を続けることでアルツハイマー病になりにくくしたりできるとの報告もいくつか知られている。上記実施例4のとおり、総ポリフェノール量が多い本発明の認知症治療剤は、このような観点からも、アルツハイマー病の予防剤としても有用であることがわかった。
【技術分野】
【0001】
本発明は、認知症治療剤とその製造方法、認知症の治療方法に関する。より詳しくは、サンゴハリタケ(Hericium ramosum)由来の認知症治療剤とその製造方法、該認知症治療剤を用いる認知症の治療方法に関する。
【背景技術】
【0002】
近年、社会の高齢化がますます進み、アルツハイマー型認知症や脳血管性認知症などの認知症の患者の急増が、深刻な社会問題として注目されている。中でもアルツハイマー型認知症は、神経細胞の変性などを原因とするものであり、本人の気付かないうちにその症状が徐々に進行することが特徴である。しかも、現在の医学では根本的な治療法はまだ確立されていないので、一旦発症すれば完治は難しい。よって、病状が進行する前または発症する前の段階において、何らかの活性物質により神経細胞変性のリスクを低減したり、症状を緩和したりすることが非常に重要であると考えられている。
【0003】
アルツハイマー型認知症の発症機序の解明や新しい薬品の探索などの研究開発が盛んに進められている。例えば、アルツハイマー型認知症の患者の脳においては、神経原繊維の変化、神経細胞の萎縮、神経細胞数の減少といった障害が認められ、これらの病態は、記憶や学習能に関連する前脳基底核コリン作動性神経細胞の障害とよく一致している。この前脳基底核コリン作動性神経細胞に対する栄養因子が神経成長因子(nerve growth factor;NGF)であることから、NGFの欠乏がアルツハイマー型認知症の誘因の一つであると考えられている。また、脳血管性認知症においても、NGFの欠乏が一因であると考えられている。
【0004】
ここで、神経成長因子を代表とするニューロトロフィンファミリーは、神経細胞の機能維持に関わっている。これらが正常に機能しないと、上記のとおりアルツハイマー病などの痴呆症を引き起こすと考えられている。これらの栄養因子はタンパク質であるため、血液脳関門(blood−brain barrier;BBB)を通過できず、経口や注射で投与することはできない。そこで、脳の中でNGFなどを産生しているアストログリア細胞などを刺激して、脳中でNGFを作らせることが、痴呆症の予防や治療に有効とされている。
【0005】
このような脳中でのNGF合成を促進させる方法として、サンゴハリタケ科(Hericiaceae)、サンゴハリタケ属(Hericium)に分類される食用きのこであるヤマブシタケ(Hericium erinaceum、非特許文献1参照)の天然物が、NGF合成促進物質であるヘリセノン類やエリナシンを有していることが発見された(非特許文献2参照)。NGFの合成を促す物質が動物以外の天然成分の中から発見されたのはヤマブシタケが最初であったこともあり、ヤマブシタケの産生する生理活性物質については大いに注目され、これまで様々な研究が進められてきている。
【0006】
一例として、非特許文献3によれば、ヤマブシタケ由来の成分であるヘリセノンCやエリナシンAを使用したラットを用いた動物実験では、アルツハイマー病のモデルに加え、人工的に血管を詰まらせる脳血管性痴呆のモデルでも明らかに記憶の保持や学習能力の向上が見られると記載されている。
【0007】
ここで、生物分類学上ヤマブシタケと近縁な食用きのことしてサンゴハリタケ(Hericium ramosum)が知られており、現在、サンゴハリタケ属にはサンゴハリタケとヤマブシタケの2種のみが属するとされている。ヤマブシタケはその代謝産物の特異性が高いことが知られていた一方、同じサンゴハリタケ科にも関わらず、サンゴハリタケはヤマブシタケとは全く違う物質群を産生することがよく知られていた(非特許文献4)。そのため、サンゴハリタケはヤマブシタケとは逆にこれまでほとんど注目されておらず、認知症治療剤としてもほとんど注目されていなかった。
【0008】
サンゴハリタケの生理活性物質に関する報告としては、例えば、神経成長因子(NGF)産生促進作用を有するヤマブシタケ由来のエリナシンEに対し、サンゴハリタケ由来のエリナシンEがk−オピオイド受容体のアゴニストであることが報告されている例がある程度であった(非特許文献5)。すなわち、サンゴハリタケが含有する生理活性物質や機能性成分に注目した例はほとんど知られていなかった。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】「Ainsworth & Bisby's Dictionary of Fungi」 9th edition, Commonwealth Agricultural Bureaux Commonwealth Mycological Institute、2001年12月15日、p.224
【非特許文献2】河岸洋和,「キノコの機能性とそれを司る物質」, FOOD Style 21, 7(9),70−73 (2003)
【非特許文献3】河岸洋和, 「キノコが造り出す生体調節機能物質」, 食品と開発, 37(3),14−17 (2002)
【非特許文献4】河岸洋和, 「機能性食品と薬理栄養」, J・JSMUFF, 3(3), 189−194 (2006)
【非特許文献5】Saito, T. et al., Erinacine E as a kappa opioid receptor agonist and its new analogs from a basidiomycete, Hericium ramosum., J. Antibiot., vol.51, p.983−990(1998年)
【発明の概要】
【発明が解決しようとする課題】
【0010】
このような状況のもと、本発明者がヤマブシタケ菌糸体の凍結乾燥物を用いてin vivoでマウス脳内におけるNGF合成促進作用を検討したところ、海馬内のNGF産生量は確かに増加することがわかった。しかしながら、ヤマブシタケを用いた場合であっても、認知症の治療や予防が確実にできるという状況には至っていないのが実情である。すなわち、認知症の治療および予防をより有効にする観点から、従来よりもさらにNGF合成活性が高い物質が求められているのが実情であった。
【0011】
本発明は、上記実情に鑑みてなされたものであり、本発明が解決しようとする課題は、NGF合成促進活性に優れた認知症治療剤を提供することにある。
【課題を解決するための手段】
【0012】
本発明者が上記課題を解決することを目的として鋭意研究したところ、サンゴハリタケ菌糸体の凍結乾燥物を用いて、in vivoでマウス脳内におけるNGF合成促進活性を検討したところ、ヤマブシタケ菌糸体の凍結乾燥物を用いた場合よりもNGF産生量が多くなることを見出すに至った。
【0013】
すなわち、前記課題を解決するための具体的手段である本発明は、以下のとおりである。
[1] サンゴハリタケ由来の活性物質を含むことを特徴とする認知症治療剤。
[2] 経口治療剤であることを特徴とする[1]に記載の認知症治療剤。
[3] 前記サンゴハリタケ由来の活性物質が、サンゴハリタケの菌糸体由来であることを特徴とする[1]または[2]に記載の認知症治療剤。
[4] 前記サンゴハリタケ由来の活性物質が、サンゴハリタケ菌糸体の凍結乾燥物であることを特徴とする[1]または[2]に記載の認知症治療剤。
[5] アルツハイマー型認知症または脳血管性認知症の治療剤であることを特徴とする[1]〜[4]のいずれか一項に記載の認知症治療剤。
[6] [1]〜[5]のいずれか一項に記載の認知症治療剤を、経口で投与することを特徴とする認知症の治療方法。
[7] サンゴハリタケ由来の活性物質を哺乳動物に投与することにより、脳の海馬中に神経成長因子を増加させる方法。
[8] 前記サンゴハリタケ由来の活性物質を経口摂取させることを特徴とする[7]に記載の方法。
[9] 前記哺乳動物がヒトであることを特徴とする[7]または[8]に記載の方法。
[10] サンゴハリタケを凍結乾燥する工程を含むことを特徴とする認知症治療剤の製造方法。
【発明の効果】
【0014】
本発明によれば、NGF合成促進活性に優れた認知症治療剤を提供することができる。
【図面の簡単な説明】
【0015】
【図1】図1はサンゴハリタケ菌糸体とヤマブシタケ菌糸体のNGF合成促進活性比較試験の結果のグラフである。
【図2】図2はサンゴハリタケ菌糸体のNGF合成促進活性における用量依存性試験の結果のグラフである。
【図3】図3は各種キノコ菌糸体の抗酸化活性比較試験の結果のグラフである。
【図4】図4は各種キノコ菌糸体の総ポリフェノール量比較試験の結果のグラフである。
【発明を実施するための形態】
【0016】
以下、本発明の認知症治療剤について、詳細に説明する。
以下に記載する構成要件の説明は、本発明の代表的な実施態様に基づいてなされることがあるが、本発明はそのような実施態様に限定されるものではない。なお、本明細書において「〜」を用いて表される数値範囲は、「〜」の前後に記載される数値を下限値および上限値として含む範囲を意味する。
【0017】
[認知症治療剤]
本発明の認知症治療剤は、サンゴハリタケ由来の活性物質(活性成分)を含むことを特徴とする。
以下、本発明の認知症治療剤について説明する。なお、本明細書中、認知症治療剤という用語は、予防剤を含む概念を表す用語として用いることがある。
【0018】
(活性物質)
前記活性物質としては、サンゴハリタケ由来であれば特に制限はない。サンゴハリタケは子実体と菌糸体のいずれの状態のものを用いてもよいが、品質、規格を一定に保ち、安定化、均一化のためには栽培菌糸体を用いる方が望ましい。すなわち、本発明の認知症治療剤は、前記サンゴハリタケ由来の活性物質が、サンゴハリタケの菌糸体由来であることが好ましい。
【0019】
本発明において、子実体とは、菌類が胞子形成のために、菌糸により形成する構造体であり、一般的にキノコの食用とされる構造体を指す。一方、菌糸体とは、胞子が発芽し、細胞分裂を繰り返して形成された菌糸の集合体を指す。
【0020】
(活性物質の作用)
本発明の認知症治療剤は、NGF産生促進(誘導)作用を有する。そのため、アルツハイマー型認知症の治療薬または予防薬や、アルツハイマー型以外の若年性認知症である(脳)血管性認知症(脳梗塞後の後遺症に伴う認知症)の治療薬または予防薬として有用である。これらの作用に加え、空間認知力や学習能力向上、記憶力改善などの効果を有していることも好ましい。
【0021】
本発明の認知症治療剤は、サンゴハリタケ由来の活性物質を被険体に投与することにより、被険体の脳の海馬中に神経成長因子を増加させることができる。さらに、本発明の認知症治療剤は、前記サンゴハリタケ由来の活性物質を好ましくは経口摂取させて、被険体の脳の海馬中に神経成長因子(NGF)を増加させることができる。このとき、脳内におけるNGFの測定方法としては特に制限はないが、外科手術的な手法によって摘出し、酵素免疫吸着測定法(ELISA)やNGF Emax ImmunoAssay Sysyemを用いて、各脳組織の中の神経成長因子の含有量を測定することができる。
このような本発明の認知症治療剤は、前記被険体が特に哺乳動物である場合に上記の作用を奏する。哺乳動物の中にはヒトも含まれ、本発明の認知症治療剤はヒトに好ましく投与することができる。
【0022】
また、本発明の認知症治療剤に用いられる前記サンゴハリタケ由来の活性物質は、抗酸化活性を奏することが好ましい。
【0023】
なお、本発明の認知症治療剤はその他の脳機能を改善してもよく、例えば、精神安定作用、イライラ感や動悸の抑制、リラックス感の増強、ストレス蓄積の防止、α波の発生等が挙げられる。
【0024】
(形態)
本発明の認知症治療剤は、一般的な添加成分を加えた組成物とした上で、医薬品、保健食品、一般食品などとして利用することが可能である。かかる添加成分としては、例えば従来から用いられている薬学的に許容された界面活性剤、溶媒、増粘剤、安定剤、保存料、酸化防止剤、香味料などの添加剤、他のNGF産生促進活性を有する成分や化合物、別の機能性(血流改善効果や血圧上昇抑制効果など)を有する成分や化合物などを挙げることができる。
【0025】
本発明の認知症治療剤の形態としては、粉末、錠剤、カプセル、軟カプセル、ペーストもしくはトローチ、ガムまたは飲用可能な溶液、分散液もしくは乳濁液(以下、これらをまとめて薬液とも言う)などが挙げられるがこれらに限定されるものではない。また、これらの形態は従来から知られている方法によって作製することができる。
【0026】
その中でも本発明の認知症治療剤は、粉末または薬液であることが好ましい。すなわち、サンゴハリタケを任意の方法で粉末とするか、サンゴハリタケを任意のvehicleを用いて薬液とすることが好ましい。さらに、本発明の認知症治療剤は薬液であることがより好ましい。なお、前記vehicleとしては特に制限はなく、本発明の属する分野で従来知られているものを用いることができる。
【0027】
[認知症治療剤の製造方法]
サンゴハリタケからの活性物質の調製方法は特に制限はなく、サンゴハリタケの生体を用いても、乾燥したものを用いてもよい。また、サンゴハリタケから公知の方法により活性物質を抽出してもよい。また、抽出した活性物質は、一般的な方法での精製を行ってもよい。本発明では、サンゴハリタケを乾燥したものを用いることが好ましい。
【0028】
粉末状の認知症治療剤を調製する場合は、サンゴハリタケを凍結乾燥したものを粉砕し、粉末とすることが好ましい。一方、薬液状の認知症治療剤を調製する場合は、vehicleとして水を用いてサンゴハリタケを水溶液または水分散液とすることが好ましく、そのときサンゴハリタケの凍結乾燥物を水溶液または水分散液とすることがより好ましい。但し、前記薬液にその他液体または一般的な添加成分を加えてもよく、その他本発明の趣旨に反しない限りにおいて任意の他の認知症治療剤の活性成分を添加してもよい。
なお、本発明の認知症治療剤における前記活性物質は、水溶性であっても、水に不溶性であっても、脂溶性であってもよい。また、前記活性物質が複数含まれていてもよく、その場合は、例えば水溶性成分と脂溶性成分とが含まれていてもよい。本発明の認知症治療剤を水分散液とする場合、特にその水分散液の特定の画分を分離や精製して用いて調製してもよいが、サンゴハリタケの水分散液全体を用いることが好ましい。
【0029】
さらに、本発明の認知症治療剤は、前記サンゴハリタケ由来の活性物質が、サンゴハリタケ菌糸体の凍結乾燥物由来であることが好ましく、サンゴハリタケ菌糸体の凍結乾燥物であることがより好ましい。すなわち、本発明の認知症治療剤の製造方法は、サンゴハリタケを凍結乾燥する工程を含むことが好ましい。
なお、凍結乾燥の方法としては特に制限はない。また、凍結乾燥前のサンゴハリタケ中の成分を凍結乾燥する工程を通じて変化させて前記活性物質として用いてもよく、凍結乾燥前のサンゴハリタケ中の成分を凍結乾燥する工程を通じて変化させせずそのまま前記活性物質として用いてもよい。
【0030】
[認知症の治療方法]
(投与方法)
また、本発明の認知症治療剤は、本発明の実施例で実証されているとおり血液脳関門を通過することができ、in vivoでマウス脳内の海馬でのNGF産生量を増加させることができる。そのため、いかなる理論に拘泥するものでもないが、NGF合成促進物質であると推測される。
そのため、本発明の認知症治療剤は、局所投与する必要が無く、注射投与や経口投与が可能である。
【0031】
本発明の認知症治療剤は、認知症治療剤として簡易に用いることができる観点から、経口治療剤であることがより好ましい。
また、本発明の認知症治療剤は、食用であるサンゴハリタケ由来のものであることから、安全性が高く、毎日の服用も可能であると考えられる。そのため、本発明の認知症治療剤に含まれる前記活性物質は、認知症の症状を改善する治療剤としてのみでなく、恒常的な服用も可能な認知症予防剤としても利用できる。
【0032】
本発明の認知症治療剤は、前記活性物質の被険体の体重1kg当たりの用量は特に制限はなく、摂取する被険体(対象)の年齢、体重などによって変わり得る。例えば、5mg/kg以上であることが好ましく、5〜25mg/kgであることがより好ましく、25〜30mg/kgであることが特に好ましい。
【0033】
本発明の認知症治療剤は、投与回数に特に制限はないが、例えば1日当たり1回〜1日当たり4回投与することができ、1日当たり2〜4回投与することが好ましく、1日当たり1回投与することが好ましい。
また、投与間隔についても特に制限はないが、例えば、6〜8時間ごとに投与することが好ましく、12〜36時間ごとに1回投与されることが好ましい。
また、投与期間についても特に制限はないが、例えば2週間以上であることが好ましく、2〜16週間であることがより好ましい。なお、例えば2週間投与した場合、NGFの産生量を増加させることができることがわかっている。
【0034】
(調製方法)
本発明の認知症治療剤は、既知の方法にしたがって調整することが可能である。薬液としたときの前記活性物質の濃度は、本発明の効果が得られる範囲内で調整することができる。
【実施例】
【0035】
以下に実施例を挙げて本発明の特徴をさらに具体的に説明する。
以下の実施例に示す材料、使用量、割合、処理内容、処理手順等は、本発明の趣旨を逸脱しない限り適宜変更することができる。したがって、本発明の範囲は以下に示す具体例により限定的に解釈されるべきものではない。
【0036】
[実施例1]
(サンゴハリタケ菌糸体とヤマブシタケ菌糸体のNGF合成促進活性比較)
サンゴハリタケ菌糸体の凍結乾燥物と、ヤマブシタケ菌糸体の凍結乾燥物を常法にしたがって調製した。
上記にて調製した各凍結乾燥物の試料を用いて300mg/kgの濃度の薬液を調製した。なお、薬液のvehicleとして脱イオン水を用い、水分散液とした。なお、このとき、各凍結乾燥物は水に完全に可溶はしなかったものの、一部の水への可溶性成分は水に溶けたと予想される。
得られた各薬液を、マウス体重10g当たり0.2mlの用量で、1日1回ずつ、2週間にわたって経口投与した。このとき、7週歳の健康なマウスをそれぞれ10匹ずつ用いた。
各薬液を2週間投与したマウスから、脳内の神経核団である大脳皮質(cortex)、大脳線状(striatum)および海馬(hippocampus)をそれぞれ摘出し、酵素免疫吸着測定法(ELISA)を用いて、各脳組織の中の神経成長因子(NGF)の含有量を測定した。
得られた結果を図1に示す。なお、図1中、各脳組織におけるグラフは、左から順にvehicleのみの投与、ヤマブシタケ菌糸体の凍結乾燥物の投与、サンゴハリタケ菌糸体の凍結乾燥物の投与を行ったときのNGFの含有量を表す。
【0037】
図1より、海馬(hippocampus)では、vehicleのみを投与したときに対する薬液を投与したときのNGF産出量の増加量は、サンゴハリタケ菌糸体の凍結乾燥物を用いた本発明の認知症治療剤である薬液を投与したマウスでは、ヤマブシタケ菌糸体の凍結乾燥物を用いた薬液を投与したマウスの2倍とであったことがわかった。
また、大脳線状(striatum)でもvehicleのみを投与したときに対して、サンゴハリタケ菌糸体の凍結乾燥物を用いた本発明の認知症治療剤である薬液を投与したときのNGF産出量の増加が見られた。さらに、大脳線状(striatum)におけるNGF産出量の増加についても、サンゴハリタケ菌糸体の凍結乾燥物を用いた本発明の認知症治療剤である薬液は、ヤマブシタケ菌糸体の凍結乾燥物を用いた薬液と同程度であることがわかった。
【0038】
[実施例2]
(サンゴハリタケ菌糸体のNGF合成促進活性における用量依存性試験)
サンゴハリタケ菌糸体の凍結乾燥物を用いて、薬液1kg当たりの濃度を100mg(100mg/kg)、300mg(300mg/kg;実施例1と同濃度)、600mg(600mg/kg)に変更した以外は実施例1と同様にして、薬液を調製した。
得られた各薬液を実施例1と同様に、マウス体重10g当たり0.2mlの用量で、1日1回ずつ、2週間にわたって経口投与した。このとき、7週歳の健康なマウスをそれぞれ10匹ずつ用いた。
各薬液を2週間投与したマウスから海馬(hippocampus)をそれぞれ摘出し、酵素免疫吸着測定法(ELISA)を用いて、各脳組織の中の神経成長因子(NGF)の含有量を測定した。
得られた結果を図2に示す。なお、図2中、各脳組織におけるグラフは、左から順にvehicleのみの投与、サンゴハリタケ菌糸体の凍結乾燥物100mg/kgの投与、サンゴハリタケ菌糸体の凍結乾燥物300mg/kgの投与、サンゴハリタケ菌糸体の凍結乾燥物600mg/kgの投与を行ったときのNGFの含有量を表す。
【0039】
図2より、海馬(hippocampus)では、vehicleのみを投与したときに対する薬液を投与したときのNGF産出量の増加量は、サンゴハリタケ菌糸体の凍結乾燥物を用いた薬液の濃度(すなわち、サンゴハリタケ菌糸体の凍結乾燥物の用量)に応じて増加することがわかった。
【0040】
上記実施例1および実施例2の結果のとおり、vehicleのみを投与したときと比較して、本発明のサンゴハリタケ菌糸体由来の認知症治療剤投与群では、各神経核団の中のNGF含有量がいずれも増加する傾向が見られた。特に、海馬でのNGF含有量の増加量が大きく、その増加量は従来公知のヤマブシタケ菌糸体を用いた場合の2倍となることがわかった。すなわち、サンゴハリタケ菌糸体の凍結乾燥物を用いた本発明の認知症治療剤は、特に海馬においてNGF産出量を増加させることができることから、アルツハイマー型認知症の治療薬または予防薬や、アルツハイマー型以外の若年性認知症である(脳)血管性認知症(脳梗塞後の後遺症に伴う認知症)の治療薬または予防薬として有用であることがわかった。
【0041】
[実施例3]
(サンゴハリタケ菌糸体の抗酸化活性)
in vitroにて、各種キノコの菌糸体の抗酸化活性(DPPH radical scavenging activity)を測定した。なお、各キノコの菌糸体は凍結乾燥したものを粉末にして用いた。一般的な抗酸化活性の指標である、各粉末1g当たりのトロロックス(Trolox: 6−hydroxy−2,5,7,8−tetramethyl−chroman−2−carboxylic acid)生成量(μmol)を測定した。その結果を図3に示した。図3中、横軸は、1はムキタケ;2はホンシメジ;3はムラサキシメジ;4はシロタモギタケ;5はナメコ;6はヌメリスギタケモドキ;7はハナビラタケ;8はタマチョレイタケ;9はアシグロタケ;10はマスタケ;11はマイタケ;12はチョレイマイタケ;13はシイタケ;14カバノアナタケ(チャーガ);15はサンゴハリタケ;16はヤマブシタケ;17はマンネンタケ(レイシ);18はコフキサルノコシカケ;19はブナハリタケ;20はアガリクスを表す。
図3より、サンゴハリタケ(15)はこれらの中で最も抗酸化活性が高く、特にヤマブシタケ(16)よりも抗酸化活性が高いことがわかった。
【0042】
上記実施例3のとおり、サンゴハリタケ由来の活性物質を含む本発明の認知症治療剤は、実際にその抗酸化活性が高いため、活性酸素を効率的に除去できると予想できることがわかった。脳内の活性酸素(フリーラジカル)は認知症発症の原因の一つと現在予想されていることから、このような本発明の認知症治療剤は、このような観点からも、認知症の予防剤としても有用であることがわかった。
【0043】
[実施例4]
(サンゴハリタケ菌糸体の総ポリフェノール量)
in vitroにて、各種キノコの菌糸体の総ポリフェノール量を測定した。なお、各キノコの菌糸体は凍結乾燥したものを粉末にして用いた。各粉末100g当たりの総ポリフェノール量を測定した。その結果を図4に示した。図4の横軸は、図3の横軸と同様である。
図4より、サンゴハリタケ(15)はこれらの中で最も総ポリフェノール量が多く、特にヤマブシタケ(16)と同程度ながらもある程度多いことがわかった。
【0044】
抗酸化物質の一つであるポリフェノール類は、アルツハイマー病の原因遺伝子と予想されているアポE4遺伝子の発現を抑制したり、実際に摂取を続けることでアルツハイマー病になりにくくしたりできるとの報告もいくつか知られている。上記実施例4のとおり、総ポリフェノール量が多い本発明の認知症治療剤は、このような観点からも、アルツハイマー病の予防剤としても有用であることがわかった。
【特許請求の範囲】
【請求項1】
サンゴハリタケ由来の活性物質を含むことを特徴とする認知症治療剤。
【請求項2】
経口治療剤であることを特徴とする請求項1に記載の認知症治療剤。
【請求項3】
前記サンゴハリタケ由来の活性物質が、サンゴハリタケの菌糸体由来であることを特徴とする請求項1または2に記載の認知症治療剤。
【請求項4】
前記サンゴハリタケ由来の活性物質が、サンゴハリタケ菌糸体の凍結乾燥物であることを特徴とする請求項1または2に記載の認知症治療剤。
【請求項5】
アルツハイマー型認知症または脳血管性認知症の治療剤であることを特徴とする請求項1〜4のいずれか一項に記載の認知症治療剤。
【請求項6】
請求項1〜5のいずれか一項に記載の認知症治療剤を、経口で投与することを特徴とする認知症の治療方法。
【請求項7】
サンゴハリタケ由来の活性物質を哺乳動物に投与することにより、脳の海馬中に神経成長因子を増加させる方法。
【請求項8】
前記サンゴハリタケ由来の活性物質を経口摂取させることを特徴とする請求項7に記載の方法。
【請求項9】
前記哺乳動物がヒトであることを特徴とする請求項7または8に記載の方法。
【請求項10】
サンゴハリタケを凍結乾燥する工程を含むことを特徴とする認知症治療剤の製造方法。
【請求項1】
サンゴハリタケ由来の活性物質を含むことを特徴とする認知症治療剤。
【請求項2】
経口治療剤であることを特徴とする請求項1に記載の認知症治療剤。
【請求項3】
前記サンゴハリタケ由来の活性物質が、サンゴハリタケの菌糸体由来であることを特徴とする請求項1または2に記載の認知症治療剤。
【請求項4】
前記サンゴハリタケ由来の活性物質が、サンゴハリタケ菌糸体の凍結乾燥物であることを特徴とする請求項1または2に記載の認知症治療剤。
【請求項5】
アルツハイマー型認知症または脳血管性認知症の治療剤であることを特徴とする請求項1〜4のいずれか一項に記載の認知症治療剤。
【請求項6】
請求項1〜5のいずれか一項に記載の認知症治療剤を、経口で投与することを特徴とする認知症の治療方法。
【請求項7】
サンゴハリタケ由来の活性物質を哺乳動物に投与することにより、脳の海馬中に神経成長因子を増加させる方法。
【請求項8】
前記サンゴハリタケ由来の活性物質を経口摂取させることを特徴とする請求項7に記載の方法。
【請求項9】
前記哺乳動物がヒトであることを特徴とする請求項7または8に記載の方法。
【請求項10】
サンゴハリタケを凍結乾燥する工程を含むことを特徴とする認知症治療剤の製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−23472(P2013−23472A)
【公開日】平成25年2月4日(2013.2.4)
【国際特許分類】
【出願番号】特願2011−159770(P2011−159770)
【出願日】平成23年7月21日(2011.7.21)
【出願人】(000141509)株式会社紀文食品 (39)
【Fターム(参考)】
【公開日】平成25年2月4日(2013.2.4)
【国際特許分類】
【出願日】平成23年7月21日(2011.7.21)
【出願人】(000141509)株式会社紀文食品 (39)
【Fターム(参考)】
[ Back to top ]

