麻疹ウイルス検出方法、メンブレンアッセイ用試験具およびメンブレンアッセイ用試験キット
【課題】従来より簡便に麻疹ウイルスを検出可能な麻疹ウイルス検出方法を提供する。
【解決手段】
図1に示される試験キットは、ラテラルフロー式メンブレンアッセイ法に用いられる試験キットであって、試料を収容するための試験容器1と、一端側4aから試験容器1に挿入されて用いられるメンブレンアッセイ用試験具4と、検体と混合することによって測定試料を調製するための検体処理液15を収容した検体処理容器14とを備える。このような試験キットを作製することにより、簡便に麻疹ウイルスを検出することができる。
【解決手段】
図1に示される試験キットは、ラテラルフロー式メンブレンアッセイ法に用いられる試験キットであって、試料を収容するための試験容器1と、一端側4aから試験容器1に挿入されて用いられるメンブレンアッセイ用試験具4と、検体と混合することによって測定試料を調製するための検体処理液15を収容した検体処理容器14とを備える。このような試験キットを作製することにより、簡便に麻疹ウイルスを検出することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、麻疹ウイルス抗原に結合可能な抗麻疹ウイルスモノクローナル抗体を用いて、試料中の麻疹ウイルスを検出するための麻疹ウイルス検出方法に関する。また、本発明は、麻疹ウイルスを検出するためのラテラルフロー式メンブレンアッセイ用試験具、およびこれを用いたメンブレンアッセイ用試験キットに関する。また、本発明は、麻疹ウイルスを検出するためのフロースルー式メンブレンアッセイ用試験キットに関する。
【背景技術】
【0002】
麻疹ウイルスは、パラミクソウイルス科モルビリウイルス属に属し、直径100〜250nmのエンベロープを有する一本鎖RNAウイルスである。麻疹ウイルスに感染すると、麻疹ウイルスは呼吸器上皮細胞にて最初に増殖し、その後リンパ節、脾臓、胸腺など全身のリンパ組織を中心に増殖してリンパ球減少や免疫抑制などを発症させる。麻疹ウイルスは感染力が非常に強く、一旦ヒトに感染すれば二次感染を引き起こす虞もあるため、麻疹感染の検査は極めて重要である。
【0003】
麻疹感染の有無を検査する方法として、被験者の体内に存在する、麻疹ウイルスに対する抗体を検出する方法が知られている。例えば特許文献1には、麻疹特異的免疫グロブリンIgMによって認識される少なくとも1つのエピトープを含む組み換え麻疹核タンパク質抗原と、ヒト血清試料とを接触させ、前記抗原に結合した麻疹特異的免疫グロブリンIgMの存在を検出する方法が記載されている。
【0004】
しかしながら、特許文献1に記載の方法には、次の点で問題がある。すなわち、麻疹ウイルスに感染しても、感染者の体内においてIgMの抗体価が上昇するまでには少なくとも3日程度の時間がかかるため、上記の方法では麻疹ウイルスの感染を早期に発見することができない。そればかりか、麻疹ウイルスに感染してからIgMの抗体価が上昇するまでの間に上記の方法によって検査を行えば、擬陰性と判断してしまうおそれもある。
【0005】
特許文献1における問題を解決する方法として、特許文献2には、検体試料中に含まれる麻疹ウイルスを検出する方法が記載されている。具体的には、微小固体担体の表面にウイルス表層のタンパク質に親和性のある分子を固定させたウイルス凝集検査薬として、抗麻疹ウイルスモノクローナル抗体を微小固体担体の表面に固定させた麻疹ウイルス検査薬が記載されている。
【0006】
【特許文献1】国際公開WO93/22683号公報
【特許文献2】国際公開WO97/07400号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
しかしながら、特許文献2に記載の方法によれば、麻疹ウイルスの感染を早期に発見することはできるものの、上記方法においては、検体の測定とは別に陽性対照の測定と陰性対照の測定とを行う必要があるため、検査に要する作業が煩雑である。
【0008】
本発明は、このような事情に鑑みてなされたものであり、陽性対照および陰性対照の測定を行う必要がなく、従来より簡便に麻疹ウイルスを検出することが可能な麻疹ウイルス検出方法を提供することを目的とする。また、本発明は、上記の麻疹ウイルス検出方法を実現可能なメンブレンアッセイ用試験具、およびメンブレンアッセイ用試験キットを提供することを目的とする。
【課題を解決するための手段】
【0009】
上記の課題に鑑み、本発明の第1の観点による麻疹ウイルス検出方法は、麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体と、麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し、且つ標識された第2のモノクローナル抗体とを用いて、検体に含まれる麻疹ウイルスを検出することを特徴とする。
【0010】
また、本発明の第2の観点による、検体に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験具は、麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体が担持された判定部を含む展開用膜担体と、麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し、且つ標識された第2のモノクローナル抗体を保持する標識保持部材とを備えることを特徴とする。
【0011】
また、本発明の第3の観点による、測定試料に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験キットは、上記のようなメンブレンアッセイ用試験具と、非イオン性界面活性剤を含み、検体と混合して測定試料を調製するための検体処理液と、を備えることを特徴とする。
【0012】
また、本発明の第4の観点による、検体に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験キットは、麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体が担持された判定部を含む膜担体を備える試験具と、麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し、且つ標識された第2のモノクローナル抗体を含む標識液とを備えることを特徴とする。
【発明の効果】
【0013】
本発明によれば、検体に含まれる麻疹ウイルスの核タンパク質を第1のモノクローナル抗体によって捕捉するとともに、第2のモノクローナル抗体によって捕捉された麻疹ウイルス核タンパク質を標識することができる。したがって、標識された麻疹ウイルス核タンパク質を検出することで検体に含まれる麻疹ウイルス核タンパク質の存否を判定することができ、陽性対照あるいは陰性対照の測定を行うことなく、検体の測定のみで簡便に麻疹ウイルスを検出することができる。さらに、本発明によれば、簡便に麻疹ウイルスを検出可能なラテラルフロー式メンブレンアッセイ用試験具、およびこれを用いたメンブレンアッセイ用試験キットを提供することができる。さらに、本発明によれば、簡便に麻疹ウイルスを検出可能なフロースルー式メンブレンアッセイ用試験キットを提供することができる。
【図面の簡単な説明】
【0014】
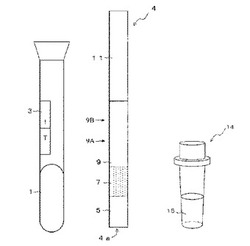
【図1】ラテラルフロー式メンブレンアッセイ用(イムノクロマトグラフィー用)試験キットの概略構成図である。
【図2】図1のメンブレンアッセイ用試験キットの試験具の(a)平面図、(b)側面図である。
【図3】検体処理容器の分解平面図である。
【図4】図1のメンブレンアッセイ用試験キットの使用状態を示す図である。
【図5】メンブレンアッセイ用試験具の他の一例を示す図である。
【図6】フロースルー式メンブレンアッセイ用試験キットの概略構成図である。
【図7】図6の試験具の(a)平面図、(b)X−X矢視断面図である。
【図8】エピトープ解析の結果を示す図である。
【発明を実施するための最良の形態】
【0015】
本明細書における「モノクローナル抗体」とは、モノクローナル抗体のフラグメントおよびその誘導体をも含む。モノクローナル抗体のフラグメント及びその誘導体としては、具体的にはFab、Fab´、F(ab)2及びsFvフラグメントなどが例示される。モノクローナル抗体のサブクラスはIgGに限定されず、IgMでもよい。
【0016】
抗麻疹ウイルスモノクローナル抗体は、麻疹ウイルスの核タンパク質に結合可能なものが用いられる。核タンパク質は、エンベロープのような他の構造タンパク質に比べて抗原性が強く、患者検体中に多く含まれ得ると考えられることから、抗麻疹ウイルスモノクローナル抗体による検出感度を高くすることが可能だからである。
【0017】
抗麻疹モノクローナル抗体は、公知の免疫学的手法を用い、麻疹ウイルス抗原を被免疫動物に免疫し、被免疫動物の細胞を用いてハイブリドーマを作製することにより得ることができる。2649抗体を産生することができるハイブリドーマMV2−2649は受託番号NITE BP−563、3241抗体を産生することができるハイブリドーマMV2−3241は受託番号NITE BP−564、3707抗体を産生することができるハイブリドーマMV2−3707は受託番号NITE BP−565、320抗体を産生することができるハイブリドーマMV3−320は受託番号NITE BP−566として独立行政法人製品評価技術基盤機構特許微生物寄託センターに寄託されている(受託日:2009年7月22日)。
【0018】
麻疹ウイルス抗原は、麻疹感染者の生体試料から精製して得ることができる。また、麻疹ウイルス抗原は、麻疹ウイルス核タンパク質をコードするDNAをプラスミドに組み込み、これを宿主細胞に導入して発現させることにより得ることもできる。
【0019】
抗原を被免疫動物に免疫する際は、アジュバントを投与することが好ましい。アジュバントを用いることによって被免疫動物の抗原への免疫応答性を高めることができる。アジュバントの種類は特に限定されないが、例えばフロイント完全アジュバント(FCA)、フロイント不完全アジュバント(FIA)、モノフォスフォリルリピッドA(MPL、商品名Ribi)、トレハロースジマイコレート(TDM、商品名RIBI)、モノフォスフォリルリピッドAおよびトレハロースジマイクレート混合液(MPL+TDM、商品名RIBI Adjuvant System)、百日咳ワクチン(Bordetella pertussis Vaccine)、ムラミルジペプチド(MDP)、アルミニウムアジュバント(ALUM)などが用いられる。また、これらのうち複数のアジュバントを組み合わせて用いてもよい。初回免疫時にFCA、二回目以降の免疫時にFIAやRibiを用いるのが好ましい。
【0020】
アジュバント投与の有無や投与経路、被免疫動物の種類などによって免疫のスケジュールを適宜変更させることができる。以下は、被免疫動物としてマウスを用いた場合の免疫について説明する。
初回免疫として、アジュバント混合麻疹ウイルス抗原溶液を腹腔内、皮下又は筋肉内に注射する。注射するアジュバント混合麻疹ウイルス抗原溶液の体積は0.05ml〜1mlであることが好ましく、含まれる麻疹抗原の質量は10〜200μgであることが好ましい。アジュバントを用いない場合は、麻疹ウイルス抗原の含有量を多くして腹腔内注射することにより免疫してもよい。初回免疫から約2〜4週間毎に1〜6回追加免疫を行う。追加免疫から約1〜4週間後に、麻疹ウイルス抗原溶液を静脈注射することにより最終免疫を行う。最終免疫から約3〜5日後、マウスからの脾細胞を分離して、抗体産生細胞を得ることができる。
【0021】
上記のようにして作製された抗体産生細胞は、骨髄腫細胞と融合される。骨髄腫細胞の由来は特に限定されず、マウス、ラット、ヒトなどを由来とするものが用いられるが、被免疫動物と同種の動物由来の骨髄腫を用いることが好ましく、さらに好ましくは同種同系統の動物由来の骨髄腫が用いられる。骨髄腫の由来としてマウスを用いる場合には、例えばマウスミエローマP3X63−Ag8、P3X−63−Ag8−U1、P3NS1−Ag4、SP2/o−Ag14、P3X63−Ag8/653などの株化骨髄腫細胞を用いるのが好ましい。骨髄腫細胞にはイムノグロブリン軽鎖を産生しているものがあり、このような骨髄腫細胞を融合対象として用いると、抗体産生細胞が産生するイムノグロブリン重鎖とこの軽鎖とが結合する場合がある。そのため、好ましくはイムノグロブリン軽鎖を産生しない骨髄腫細胞、例えばP3X63−Ag8・653やSP2/o−Ag14などを用いることが好ましい。
【0022】
抗体産生細胞と骨髄腫細胞とを融合させてハイブリドーマを作製する方法としては、公知の方法を用いることができる。例えば、ポリエチレングリコール(PEG)を用いる方法(PEG法)、センダイウイルスを用いる方法、電気融合装置を用いる方法などが挙げられる。PEG法の場合、約30〜60%のPEG(平均分子量1000〜6000)を含む適当な培地又は緩衝液中に脾細胞と骨髄腫細胞を1:1から10:1、好ましくは5:1から10:1の混合比で懸濁し、温度約25〜37度、pH6〜8の条件下で、約30秒〜3分間程度反応させればよい。反応終了後、細胞を洗浄し、PEG溶液を除いてヒポキサンチン−チミジン培地(HT培地)などに再懸濁し、例えばマイクロタイタープレート中に播種して培養を続けることができる。
【0023】
融合後の細胞は選択培地で培養して、ハイブリドーマの選択を行う。選択培地としては、親細胞株が死滅し、融合細胞のみが増殖し得る培地であれば特に限定されない。通常はヒポキサンチン−アミノプテリン−チミジン培地(HAT培地)が使用される。ハイブリドーマの選択は、通常融合操作の1日後に、選択培地を添加、または、培地の一部、好ましくは約半量を選択培地と交換することによって開始し、7〜10日間培養することによって行う。
【0024】
生育しているハイブリドーマが所望の抗体を産生しているか否かは、培養上清を採取して抗体価アッセイを行うことによって確認することができる。抗体価アッセイとしては公知の方法を用いることができ、特に限定されない。例えば、固相化した抗原に段階希釈した上記上清を添加して反応させ、さらに蛍光物質、酵素、又は放射性同位体(RI)などで標識した二次抗体(抗グロブリン抗体、抗IgG抗体、抗IgM抗体など)を反応させれば、上記上清中に産生されている抗体を検出することができ、また抗体価を測定することができる。このようにプレートの各ウェルの培養上清をスクリーニングし、所望の抗体を産生しているハイブリドーマを得ることができる。
【0025】
次に、単一クローンを分離する。分離法としては、公知の方法を用いることができ特に限定されない。例えば、限界希釈法、軟寒天法、蛍光励起セルソーターを用いる方法などが挙げられる。例えば限界希釈法の場合、ハイブリドーマを1cell/wellとなるように培地で段階希釈し、培養プレートへ播き込こんだ後、培養する。約10日間培養後、1 colony/wellの培養上清中に目的とするモノクローナル抗体が産生されているか確認することで、目的のハイブリドーマクローンを単離することができる。得られたハイブリドーマクローンは、約10w/v%のジメチルスルホキシド(DMSO)又はグリセリンなどの凍結保護剤の共存下に凍結させて−196〜−70度で保存すると、半永久的に保存可能である。細胞は用時37度前後の恒温槽中で急速に融解して使用できる。凍結保護剤の細胞毒性が残存しないようによく洗浄してから使用することが好ましい。
【0026】
ハイブリドーマが産生する抗体のイムノグロブリンサブクラスを調べるためには、ハイブリドーマを一般的な条件で培養し、その培養上清中に分泌された抗体を市販の抗体クラス・サブクラス判定用キットなどを用いるとよい。
【0027】
ハイブリドーマからのモノクローナル抗体の取得方法は、必要量やハイブリドーマの性状などによって適宜選択して用いる。例えば、ハイブリドーマを移植したマウスの腹水から取得する方法、細胞培養により培養上清から取得する方法などが例示される。マウス腹腔内で増殖可能なハイブリドーマであれば、腹水から数mg/mlの高濃度のモノクローナル抗体を得ることができる。in vivoで増殖できないハイブリドーマは細胞培養の培養上清から取得する。細胞培養によるモノクローナル抗体の取得方法は、in vivoで行なう方法に比べて、抗体産生量は少ないがマウス腹腔内に含まれるイムノグロブリンや他の夾雑物質の混入が少なく生成が容易であるという利点を有する。
【0028】
モノクローナル抗体を、ハイブリドーマを移植したマウス腹水から取得する場合、例えば予めプリスタン(2,6,10,14−テトラメチルペンタデカン)などの免疫抑制作用を有する物質を投与したマウスの腹腔内へハイブリドーマを移植し、約1週間後から貯留した腹水を採取する。異なる動物種の細胞を融合させたハイブリドーマ(例えばマウスとラット)の場合には、ヌードマウス、放射線処理マウスを使用することが好ましい。
【0029】
細胞培養上清から抗体を取得する場合、例えば、細胞維持に用いられる静置培養法、高密度培養方法、スピナーフラスコ培養方法などの培養法を用いることができる。これらのうち何れかの方法を用いることにより、ハイブリドーマを培養し抗体を含有する培養上清を得る。
【0030】
腹水や培養上清からのモノクローナル抗体の精製は、公知のイムノグロブリン精製法を用いることによって行なうことができる。イムノグロブリン精製法としては特に限定されず、例えば、硫酸アンモニウムや硫酸ナトリウムを用いた塩析による分画法、PEG分画法、エタノール分画法、DEAEイオン交換クロマトグラフィー法、ゲル濾過法などが挙げられる。
【0031】
さらに、モノクローナル抗体がマウスIgGである場合、プロテインA結合担体或いは抗マウスイムノグロブリン結合担体を用いたアフィニティークロマトグラフィー法により精製することが可能である。
【0032】
以上のようにして作製された抗麻疹ウイルスモノクローナル抗体は、検体または検体を用いて調製された試料に含まれる麻疹ウイルスを検出するためのイムノアッセイに用いることができる。麻疹ウイルスを検出するためのイムノアッセイ法としては、麻疹ウイルスに対する第1及び第2の抗体を用い、固相に固定された第1の抗体と、標識された第2の抗体と、麻疹ウイルスとを含む複合体を形成させる工程を含む、いわゆるサンドイッチ法を検出原理とするものが好ましい。
【0033】
さらに、本発明は、抗麻疹ウイルスモノクローナル抗体として、麻疹ウイルス核タンパク質の135位から241位のアミノ酸配列を認識して結合するモノクローナル抗体(135−241抗体)、麻疹ウイルス核タンパク質の485位から525位のアミノ酸配列を認識して結合するモノクローナル抗体(485−525抗体)、および麻疹ウイルス核タンパク質の91位から134位のアミノ酸配列を認識して結合するモノクローナル抗体(91−134抗体)の3種のモノクローナル抗体を提供する。ここで、麻疹ウイルス核タンパク質のアミノ酸配列としては、配列番号9に記載のものが挙げられる。
サンドイッチ法による麻疹ウイルスの検出においては、上記3種のモノクローナル抗体のうち一の抗体を標識される抗体として、他の抗体を固相に固定される抗体として用いることができる。使用される抗体の組み合わせは特に限定されないが、固相に固定される第1の抗体として、135−241抗体または485−525抗体を使用し、標識される第2の抗体として、91−134抗体を使用することが検出感度を向上させる観点から好ましい。なお、第1の抗体に加えて、第1および第2の抗体と異なる第3の抗体を固相に固定してもよく、135−241抗体および485−525抗体の両方を同じ固相に固定して用いる形態であってもよい。
【0034】
サンドイッチ法によって麻疹ウイルスを検出するに際して、抗体が固定される固相としては、抗体を従来公知の方法によって固定可能なものを用いることができ、例えば、メンブレン、ビーズ、粒子、ナノ粒子、試験管、マイクロタイタープレートなど公知のものを用いることができる。また、抗体を標識するための標識物質としては、酵素、放射性同位元素、蛍光発光性標識物質、着色粒子、コロイド粒子などを用いることができる。
【0035】
上記において示した種々のサンドイッチ法を検出原理とするイムノアッセイ法の中でも、特に検査の簡便性、ひいては迅速性の観点から、固相にメンブレンを用いたメンブレンアッセイ法が好ましい。メンブレンアッセイ法としては、ラテラルフロー式メンブレンアッセイ法と、フロースルー式メンブレンアッセイ法が挙げられ、本実施形態による抗麻疹ウイルスモノクローナル抗体は、そのいずれの方法にも適用することができる。
【0036】
ここで、ラテラルフロー式メンブレンアッセイ法とは、捕捉物質が固定化された判定領域を含むメンブレンに試料を滴下し、試料をメンブレンに対して平行に展開させることで、判定領域に捕捉された測定対象物を検出する方法である。一方、フロースルー式メンブレンアッセイ法とは、測定対象物(抗原)を捕捉するための捕捉物質(抗体)を表面に固定化させたメンブレンに、被測定対象物を含む試料を滴下し、試料をメンブレンに対して垂直に通過させることで膜表面に捕捉された測定対象物を検出する方法である。いずれの方法においても、測定対象物は所定の標識物質によって標識されるため、メンブレン上に標識が現れるか否かによって測定対象物の存否を確認することができる。
以下、本実施形態によるメンブレンアッセイ用試験キットについて、図面を参照しながら説明する。
【0037】
図1は、第1の実施形態によるメンブレンアッセイ用試験キット(以下、試験キットと呼称する)の外観を示した図である。この試験キットは、ラテラルフロー式メンブレンアッセイ法(ラテラルフロー式イムノクロマトグラフィー法)に用いられる試験キットであって、試料を収容するための試験容器1と、一端側4aから試験容器1に挿入されて用いられるメンブレンアッセイ用試験具4(以下、試験具4と呼称する)と、検体と混合することによって測定試料を調製するための検体処理液15を収容した検体処理容器14とを備える。図2は、図1の試験具4の(a)平面図、(b)側面図である。
【0038】
試験具4は、図2に示すように、表面に粘着層を有するプラスチック板からなる基材12上に、コットンの不織布からなる試料添加用部材5と、グラスファイバーの不織布からなる標識保持部材7と、ニトロセルロースの多孔体からなるクロマトグラフィー用膜担体(以下、クロマト用膜担体と呼称する)9と、セルロースの不織布からなる吸収部材11とを備える。
標識保持部材7は、試料添加用部材5に接触して配置され、麻疹抗原に特異的に結合可能であり、且つ標識された抗麻疹ウイルスモノクローナル抗体(以下、標識化抗体と呼称する)と、対照用標識物質を保持する。標識化抗体は、青色ラテックス粒子で標識された抗麻疹ウイルスモノクローナル抗体であり、対照用標識物質は、赤色ラテックス粒子で標識されたストレプトアビジンである。クロマト用膜担体9は、標識保持部材7に接触して配置され、上流側から順に、ライン状の判定部9Aおよび対照部9Bを有する。判定部9Aには麻疹ウイルス抗原に特異的に結合可能な抗麻疹ウイルスモノクローナル抗体(以下、捕捉用抗体と呼称する)が、対照部9Bにはビオチンが固定されている。
吸収部材11は、クロマト用膜担体9と接触するように配置されている。
【0039】
試料中に麻疹ウイルスが含まれていると、標識保持部材7に保持された標識化抗体は、麻疹ウイルスの所定部位を認識して、抗原抗体反応により結合して複合体を形成する。次に、クロマト用膜担体9の判定部9Aに固定された捕捉用抗体は、麻疹ウイルスの別の部位を認識して複合体を捕捉する。複合体が捕捉されると、判定部9Aには青色のラインが現れ、麻疹ウイルスの存在が目視により判定される。
【0040】
また、アビジンは、クロマト用膜担体9にある捕捉用抗体には捕捉されないが、ビオチンと特異的に結合するので、対照用標識物質は対照部9Bに固定されたビオチンに捕捉される。対照用標識物質が捕捉されると、対照部9Bには赤色のラインが現れ、対照用標識物質が対照部9Bに到達したことが目視によって確認される。対照部9Bは、判定部9Aの下流に設けられるので、赤色のラインを確認することにより、試料が判定部9Aを通過したことが確認される。
【0041】
試験容器1は、開口1bを有するテーパー状の受け入れ部16と、底部1aに試料を収容する試料収容部17とを有する試験管状の有底筒状の容器から構成されている。
【0042】
試験容器1の外壁面には、ラベル3が貼付されている。ラベル3は、試験具4を試験容器1に挿入した際の試験具4の判定部9Aおよび対照部9Bに対応する位置に、試験具4の判定部9Aおよび対照部9Bを示す表示24a、24bを有している。図に示すように、このラベル3の表示24a、24bは、それぞれ、「T」、「!」である。
【0043】
図3は、検体処理容器14の分解平面図である。図に示すように、検体処理容器14は、プラスチックボトル141、ノズル142およびキャップ143を備えて構成されている。ボトル141は、その内部に検体処理液15を収容しており、キャップ143によりボトル141の開口が密閉された状態で保存されている。ノズル142は先端に試料排出口を備えており、内側にはろ過部材が装着されている。
【0044】
ノズル142の内側に装着されたろ過部材は、第1ガラス繊維濾紙と、第1ガラス繊維濾紙より膜口径が大である第2ガラス繊維濾紙と、不織布状のガラスフィルターとが、この順に積層されたものである。また、このろ過部材は、ガラスフィルターがノズル142のボトル141との装着部側に、第1ガラス繊維濾紙が試料排出口側になるようにノズル142に装着されている。なお、ろ過部材は、この構成に限定されるものではないが、検体中の粘性成分を除去するために不織布状のガラスフィルターを用いることが好ましく、この不織布状のガラスフィルターにガラス繊維濾紙を1枚もしくは2枚組み合わせて用いることが好ましい。
【0045】
検体処理液15は、界面活性剤を含有する水溶液であることが好ましい。これは麻疹ウイルスが外皮(エンベロープ)を有しているため、界面活性剤により外皮に孔をあけて内部の抗原タンパク質を検体処理液中に放出させるためである。
【0046】
界面活性剤の種類は特に限定されず、陰イオン性界面活性剤、陽イオン性界面活性剤、両性界面活性剤、あるいは非イオン性界面活性剤など広範のものを使用することができる。
【0047】
非イオン性界面活性剤は、好ましくはポリオキシエチレン系のものを使用することができ、より好ましくはエーテル型のものを使用することができる。具体的には、ポリオキシエチレン(9)オクチルフェニルエーテル、ポリオキシエチレン(10)オクチルフェニルエーテル、ポリオキシエチレン(9)ノニルフェニルエーテル等のポリオキシエチレンアルキルフェニルエーテル、ポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノオレエート等のポリオキシエチレンソルビタン脂肪酸エステル、ポリオキシエチレン/ポリオキシプロピレン共重合体、ポリオキシエチレンアルキルエーテルからなる群より選ばれる一種又は二種以上の混合物が好ましく用いられる。
【0048】
両性界面活性剤は、特に限定されないが、3-〔(3-コラミドプロピル)ジメチルアンモニオ〕-1-プロパンスルホネート(CHAPS)等が好ましく用いられる。また、非イオン性界面活性剤の検体処理液15への添加量を多くする場合には、その溶解性を向上させて検体処理液の保存安定性を高めるために両性界面活性剤を併用するようにしてもよい。
【0049】
陰イオン性界面活性剤は、特に限定されないが、ドデシル硫酸ナトリウム、ドデシルスルホン酸ナトリウム、ドデシル−N−サルコシン酸ナトリウム、コール酸ナトリウム、デオキシコール酸ナトリウム、タウロデオキシコール酸ナトリウム等が好ましく用いられる。
【0050】
検体処理液15は、非特異反応を防止するためにチオシアン酸系化合物を含有することが好ましい。チオシアン酸系化合物は、チオシアン酸(HNCS)の他、チオシアン酸エステルやチオシアン酸塩等水溶性であれば、特に制限はない。チオシアン酸を構成する塩としては、ナトリウム、カリウム等の金属を含む無機塩基、あるいは有機塩基アンモニウム塩等が挙げられる。さらに、その塩の水和物や溶媒和物をも包含する。具体的には、チオシアン酸ナトリウム、チオシアン酸カリウム、チオシアン酸アンモニウム、チオシアン酸グアニジン等が挙げられる。好ましくはチオシアン酸カリウム、チオシアン酸グアニジンが適用される。
【0051】
また、検体処理液15は、検体(特に鼻汁、鼻腔吸引液、鼻腔拭い液および咽頭ぬぐい液)中に存在する高粘性物質の粘性を低下させるために、還元剤を含有することが好ましい。また、還元剤としては含硫還元性化合物が好ましく、例えば、メルカプトエチルアミン、メルカプトエチルアミン塩酸塩、メルカプトエタノール、ジチオスレイトール、システイン、N−アセチル−Lシステイン、二臭化水素酸S−2アミノエチルイソチオ尿素、トリス(2−カルボキシエチル)ホスフィン、ハイドロサルファイト塩、亜硫酸塩等が挙げられる。
【0052】
また、検体処理液15は、抗原タンパクを分解する酵素活性を抑えたり、非特異反応を低下させるためにキレート剤を含有しても良い。キレート剤としては、例えば、エチレンジアミン4酢酸、1,2−シクロヘキサンジアミン4酢酸、ヘキサメチレンジアミン4酢酸、イミノ2酢酸、ヒドロキシエチルイミノ2酢酸、1,3−ジアミノプロパン−2−オール4酢酸、ジエチレントリアミン5酢酸、エチレンジアミン2酢酸、エチレンジアミン2酢酸2プロピオン酸、エチレンビス(オキシエチレンニトリロ)4酢酸、エチレンジアミン−テトラキス(メチレンホスホン酸)、エチレンジアミン2プロピオン酸、ヒドロキシエチルエチレンジアミン3酢酸、N−(2−ヒドロキシルエチル)エチレンジアミン3酢酸、ニトリロ3酢酸、ニトリロ3プロピオン酸、ニトリロトリス(メチレンホスホン酸)、2(ヒドロキシエチル)グリシンおよび1,2−ジアミノプロパン4酢酸、およびこれらの塩を挙げることができる。
【0053】
また、検体処理液15にアルカリ金属イオンを含有させるようにしてもよい。アルカリ金属イオンとしては、リチウム+(Li+)、ナトリウム+(Na+)、カリウム+(K+)、ルビジウム+(Rb+)、セシウム+(Cs+)、フランシウム+(Fr+)等が例示されるが、好ましくはナトリウム、カリウムを使用することができる。又アルカリ金属イオンは一種又は二種以上使用することができる。このようなアルカリ金属イオンを生じうる化合物は特に限定されないが、例えば塩化ナトリウム、塩化カリウム、水酸化ナトリウム、水酸化カリウム、EDTAナトリウム塩、アジ化ナトリウムからなる群より選ばれる一種又は二種以上の混合物を使用することができる。アルカリ金属イオンの添加により非特異反応を抑制することができる。アルカリ金属イオンの含有量は、0.3M〜2.0M、好ましくは0.4M〜1.5M、より好ましくは0.45M〜1.0Mである。
【0054】
また、検体処理液15は、緩衝剤を含有することが好ましく、例えば、MES、Bis-Tris、ADA、PIPES、ACES、MOPSO、BES、MOPS、TES、HEPES、DIPSO、TAPSO、POPSO、HEPPSO、EPPS、Tricine、Bicine、TAPS、CHES、CAPSO、CAPSなどのGood緩衝剤を挙げることができ、ADA、PIPES、ACES、MOPSO、BES、MOPS、TES、HEPES、DIPSO、TAPSO、POPSO、HEPPSO、EPPSが好ましく、PIPES、ACES、MOPSO、BES、MOPS、TES、HEPESがより好ましい。検体処理液のpHは5〜10、好ましくは5.5〜9.0、より好ましくは6.0〜8.0である。
【0055】
検体処理液15と混合される検体は、被検者から採取された生体成分であれば特に限定されない。例えば、血液、血清、尿、鼻汁、唾液、鼻腔拭い液、鼻腔吸引液または咽頭拭い液が挙げられ、特に麻疹感染者において麻疹ウイルスが検出されやすい唾液、鼻汁、鼻腔拭い液または咽頭拭い液が好ましい。
【0056】
次に、本実施形態による試験キットの使用方法について、図4を用いて説明する。
まず、検体処理容器14のキャップ143を開け、採取した検体をボトル141内に加え、検体処理液15と混和し、測定試料13を調製する。その後、キャップ143に代えてノズル142をボトル141の開口部に装着し、測定試料13をろ過部材44を介して試料排出口46から試験容器1に供給する。次に、試験具4を一端4aから試験容器1に挿入し、一端4aを試験容器1の底部1aに接触させる(なお、ここでいう「底部」とは、試験容器1の丸みを帯びた部分を意味する)。これにより、試験具4と試験容器1とが上下方向に位置合わせされる。この状態で、10〜20分程度放置すると、測定試料13が毛管現象により、試料添加用部材5、標識保持部材7、クロマト用膜担体9、吸収部材11を順次移動する。測定試料13が、標識保持部材7を通過する際に、標識保持部材7に保持されている標識物質(標識化抗麻疹モノクローナル抗体及び対照用標識物質)が測定試料中に溶出する。測定試料13に麻疹ウイルスが含まれていると、上述した作用により、判定部9Aには青色のラインが現れる。また、ウイルスの有無に関わらず、対照部9Bに赤色のラインが現れる。
【0057】
なお、以上においては特定の実施形態を例にとって説明したが、本実施形態による試験キットは、このような例に限られず、種々の変更を伴ない得るものである。
【0058】
例えば、試料添加用部材5として、コットンに代えて、グラスファイバー、セルロースファイバーなどの材質のものを用いてもよい。また、標識保持部材7として、グラスファイバーに代えて、セルロースファイバーを用いてもよい。また、標識化抗体および対照用標識物質は、着色ラテックス粒子以外にも、酵素、蛍光発光性標識、磁性体標識、放射性同位元素、金コロイド等によって標識されていてもよい。また、クロマト用膜担体9として、ニトロセルロースに代えて、ナイロン(例えば、カルボキシル基やアルキル基を置換基として有してもよいアミノ基が導入された修飾ナイロン)、ポリビニリデンジフルオリド(PVDF)、セルロースアセテートを用いてもよい。また、吸収部材11として、セルロースに代えて、グラスファイバーを用いてもよい。
このように、試料添加用部材5、標識保持部材7、クロマト用膜担体9及び吸収部材11には、不織布又は多孔質部材以外にも、毛管現象により試料を展開可能な種々の構造のものを用いることができる。
【0059】
また、上記実施形態においては、判定部9Aが一種類の抗麻疹モノクローナル抗体のみを担持した構成を例示したが、このような構成に限らず、判定部は二種類以上の抗麻疹モノクローナル抗体を担持した構成であってもよい。例えば、試験具4を、二種類以上の抗麻疹モノクローナル抗体を含む試料をクロマト用膜担体9に塗布することによって作製してもよい。このように二種類以上の抗麻疹モノクローナル抗体を判定部に備えた構成とすることにより、麻疹ウイルスの検出感度が向上し、ひいては偽陰性のおそれを低減することができる。また、二種類の抗麻疹モノクローナル抗体を、クロマト用膜担体9上に別々に担持させることにより、判定部を二つ以上設けた構成としてもよい。
【0060】
また、上記実施形態においては、測定試料13を収容するための試験容器1を備え、試験具4を試験容器1に挿入することによって検査を行う構成を例示したが、このような構成に限らず、試験容器1を備えない構成であってもよい。例えば、検体処理液15によって調製された測定試料13を試料添加用部材5に直接に滴下するように構成してもよい。このように構成する場合には、試験具4を、例えば、試料添加用部材5、クロマト用担体9および吸収部材11に対応する位置に開口を有するケースに収容した構成とすることが好ましい。このような構成の試験具4の一例を図5に示す。図5に示すように、試験具4をケース40に収容することにより、試験具4の各部材から測定試料が漏れ出ることを防止でき、衛生的に検査を行うことができる。加えて、ケース40に設けられた複数の開口によって、測定試料13に含まれる液体成分が蒸発し易くなり、測定試料の展開が促進される。
なお、図5に示した構成においては、ケース40の試料添加用部材5に対応する位置に設けられた開口50は、内側に向かって開口面積が小さくなるように、いわゆるテーパー状に形成されている。このような構成により、試料用添加部材5に滴下された測定試料は、開口50に一定量貯留されるため、過剰に測定試料を滴下したとしても、測定試料が試験具4から溢れにくくなっている。また、測定試料が一定量貯留されることにより、貯留された測定試料が試験具4上を順次展開していくため、少量の測定試料を定期的に滴下する手間が省け、検査を簡便に行うことができる。
【0061】
以上においては、ラテラルフロー式メンブレンアッセイ用試験キットについて説明したが、本実施形態による抗麻疹モノクローナル抗体は、フロースルー式メンブレンアッセイ用試験キットに適用することも可能である。以下、図面を参照しながら、フロースルー式メンブレンアッセイ用試験キットについて説明する。
【0062】
図6は、第2の実施形態によるメンブレンアッセイ用試験キットを示す図である。この試験キットは、フロースルー式メンブレンアッセイ法に用いられる試験キットであって、試験具31と、検体と混合して測定試料を調製するための検体処理液37を収容する検体処理容器36とを備える。
【0063】
図7(a)は、試験具31の平面図、図7(b)は、X−X矢視断面図である。試験具31は、下層から順に吸収部材35と、膜担体34と、カバー部材32とを備え、これらが積層されて構成されている。カバー部材32は開口33を有し、この開口33を介して、下層に配置された膜担体34の判定部34Aが露出されるように構成されている。判定部34Aには、捕捉用抗体が担持されている。
【0064】
検体処理容器36は、第1の実施形態における検体処理容器14と同様の構成である。検体処理容器36に収容された検体処理液37は、第1の実施形態における検体処理液15と同様の成分を含み、さらに本実施形態における検体処理液37は、標識化抗体を含有している。
【0065】
次に、本実施形態による試験キットの使用方法について説明する。
まず、第1の実施形態において説明したように、検体を検体処理液37に懸濁し、測定試料を調製する。検体に麻疹ウイルスが含まれていると、検体処理液37に含まれる標識化抗体と麻疹ウイルスとが抗原抗体反応により結合し、測定試料中に麻疹ウイルス−標識化抗体からなる複合体が形成される。
次に、調製された測定試料を、第1の実施形態において説明した手順と同様にして、試験具31の開口33に所定量滴下する。この状態で20分程度放置すると、測定試料が膜担体34を通過し、その下層に配置された吸収部材35によって吸収される。測定試料に麻疹ウイルスが含まれていると、膜担体34の判定部34Aに担持された捕捉用抗体が、標識化抗体と麻疹ウイルスとの結合部位と異なる部位を認識して麻疹ウイルスに結合し、判定部34A上に標識化抗体−麻疹ウイルス−捕捉用抗体からなる複合体が形成される。これにより、判定部34Aに青色のラインが現れる。よって、判定部34Aに青色のラインが現れたか否かを目視で判定することにより、麻疹ウイルスの存在を知ることができる。
【0066】
なお、本実施形態においては、標識化抗体を検体処理液37と同じ容器に収容した構成について説明したが、このような構成に限られない。例えば、標識化抗体と検体処理液37とを別々の容器に収容した構成であってもよい。また、例えば、標識化抗体を測定試料に含まれる液体成分によって遊離可能に膜担体34に保持させた構成であってもよい。
【0067】
以上説明したように、本実施形態によれば、抗麻疹モノクローナル抗体を用いて簡便且つ迅速に麻疹ウイルスを検出可能な試験キットを提供することができる。さらに、第1の実施形態によるメンブレンアッセイ用試験キットであれば、試験容器1と、試験具4と、検体処理容器14とによって、第2の実施形態によるメンブレンアッセイ用試験キットであれば、試験具31と、検体処理容器36とによって、少ない部品点数で麻疹ウイルスを検出することができ、簡便に検査を行うことができる。
【実施例】
【0068】
1.モノクローナル抗体の作製
1−1.麻疹ウイルス核タンパク質の作製
野生の各麻疹ウイルス株より抽出したRNAから、逆転写反応によって、cDNAを合成した。合成した各cDNAから、ポリメラーゼ連鎖反応(PCR)によって、麻疹ウイルス核タンパク質のDNA産物を合成し、小麦胚芽無細胞発現用試薬キット ENDEXT(登録商標)Wheat Germ Expression TRI-GG Kit(セルフリーサイエンス社)を用いて、キット付属のベクターにDNA産物を組み込み、麻疹ウイルス核タンパク質を発現させ、抗原液を作製した。シークエンサー(Applied Biosystems社製)及び配列解析ソフト(日立ソフト社製)を用いて、遺伝子配列解析及び予測アミノ酸配列解析を行った。ここで得られた麻疹ウイルス核タンパク質のアミノ酸配列を、配列表の配列番号1〜9に示す。以下、配列番号1のアミノ酸配列からなる麻疹ウイルス核タンパク質をAg1、配列番号2のアミノ酸配列からなる麻疹ウイルス核タンパク質を麻疹抗原Ag2というように、配列番号Nのアミノ酸配列からなる麻疹ウイルス核タンパク質をAgNと呼称する。
1−2.マウスの免疫
Advanced Biotechnologies Inc.(以下ABI社)より入手した麻疹ウイルス株(商品名:Rubeola (Measles) Virus Infected Cell Extract)60μgを含有するリン酸緩衝液(PBS)100μLにフロイント完全アジュバント(FCA)100μlを添加し、乳化させた後、FCA混合麻疹ウイルス抗原溶液を200μLを調製した。また、FCAではなくフロイント不完全アジュバント(FIA)を用いること以外は同様にしてFIA混合麻疹ウイルス抗原溶液200μLを作製した。
FCA混合麻疹ウイルス抗原溶液200μLを7週齢の雌Balb/cマウスに腹腔内投与することにより初回免疫した。初回免疫後、二週間毎にFIA混合麻疹ウイルス抗原溶液200μLを用いて追加免疫を行った。最終免疫は、アジュバントを使用せず、ABI社麻疹ウイルス株に代えて、1−1.において作製されたAg5を50μg含有するPBS500μLを静脈注射することにより行った(免疫実験1)。
【0069】
免疫用抗原として、ABI社麻疹ウイルス株に代えて1−1.において作製されたAg5もしくはAg8を使用した点を除いては上記免疫実験1と同様にして、マウスへの免疫を行った(免疫実験2)。
【0070】
最終免疫から4日後に脾細胞を分離し、P3X63−Ag8・653マウス骨髄腫細胞とPEG法により融合させ、ハイブリドーマを作製した。
【0071】
1−2.ハイブリドーマの培養
ハイブリドーマを2.5×106cells/mLとなるようにHAT培地に懸濁させ、96穴プレート(コーニング社製;以下、培養用プレートとする)の各ウェルに2.5×105cell/wellとなるように分注した。培養用プレートを37度、8%CO2の恒温槽内に静置し、ハイブリドーマの培養を開始した。翌日、HAT培地を25μLずつ培養用プレートの各ウェルに添加し、さらに培養を継続した。10日間培養してハイブリドーマのコロニーを出現させたところで、モノクローナル抗体を産生するハイブリドーマのスクリーニングを行った。
【0072】
1−3.ハイブリドーマのスクリーニング
0.1w/v%NaN3を含む0.1M リン酸緩衝液(PBS, pH7.5)に、タンパク質濃度が0.5μg/mLとなるように希釈した麻疹ウイルス(ABI社製)を添加し、感作用麻疹ウイルス溶液を調製した。この感作用麻疹ウイルス溶液100μLを96穴プレート(NUNC社製)の各ウェルに分注した(以下、抗原固定プレートとする)。4度で一晩静置した後、0.05%の濃度でTween20を含むPBS(以下、第1緩衝液とする)で三回洗浄した。洗浄後、抗原固定プレートの各ウェルに1w/v%の濃度でBSAを含むPBS(以下、第2緩衝液とする)300μLを添加し、2〜8℃で4時間以上静置保存した。抗原固定プレートは使用時まで2〜8℃で保存した。
【0073】
第2緩衝液を抗原固定プレートの各ウェルに75μLずつ添加し、1−3.で作製したハイブリドーマ培養上清を培養用プレートの各ウェルから取り出し、抗原固定プレートの各ウェルに25μLずつ添加した。第2緩衝液及び培養上清添加後、室温で一時間インキュベートした。インキュベート後、300μLの第1緩衝液で抗原固定プレートの各ウェルを洗浄した。洗浄後、第2緩衝液で10000倍希釈したセイヨウワサビペルオキシダーゼ標識抗マウスIgポリクローナル抗体(DAKO社製;Code No. P0447)を抗原固定プレートの各ウェルに100μLずつ添加した。室温で30分間反応させた後、300μLの第1緩衝液で抗原固定プレートの各ウェルを洗浄した。洗浄後、PODに対する基質であるオルトフェニレンジアミン(OPD)を含む基質液を100μLずつ加え、室温で10分間静置した。ついで、2N H2SO4を含む反応停止液を抗原固定プレートの各ウェルに100μLずつ加えた後、各ウェル中の反応液について、マイクロプレートリーダ(Molecular Devices社製)を用いて、492nmの吸光度を測定した。
その結果、作製されたハイブリドーマが、抗麻疹モノクローナル抗体を産生していることが確認された。
【0074】
2.抗麻疹モノクローナル抗体の反応性の確認
上記1.において作製されたハイブリドーマによって産生された抗麻疹モノクローナル抗体の反応性を以下の実験によって確認した。
【0075】
2−1.反応性試験
1−1.において作製されたAg1〜Ag9を含む抗原液を、それぞれ第2緩衝液によって10倍に希釈した。
市販の抗マウスIgG抗体と、セファロースビーズ(Amersham Biosciences社製)とを結合させた粒子を15v/v%の濃度で含有するセファロースビーズ−抗マウスIgG抗体懸濁液を調製した。このセファローズビーズ−抗マウスIgG抗体懸濁液と、Ag1〜Ag9を含む抗原液をそれぞれ第2緩衝液で0.2〜0.5μg/mLに希釈した抗原希釈液と、第2緩衝液とを等量で混合し、抗原試料調製した。
【0076】
96穴V字プレート(サンプラテック社製)の各ウェルに、抗原試料60μLと、本実施例による抗麻疹ウイルスモノクローナル抗体を第2緩衝液で1.0μg/mLの濃度に希釈した抗体液を30μLずつ加え、室温で60分間攪拌させたのち、10分間静置し、セファロースビーズを沈降させた。
【0077】
次に、以下の要領で、抗麻疹ウイルスモノクローナル抗体が感作されたマイクロタイタープレートを調製した。マイクロタイタープレートに感作される抗麻疹ウイルスモノクローナル抗体として、ハイブリドーマMV1−225によって産生される225抗体を用いた。
225抗体液を、0.1w/v%NaN3を含む0.1M リン酸緩衝液(PBS, pH7.5)によって10μg/mL濃度に希釈し、この225抗体希釈溶液をマイクロタイタープレート(NUNC社製)の各ウェルに100μLずつ分注し、4℃で一晩静置した。第1緩衝液を用いて各ウェルを3回洗浄したのち、各ウェルに第2緩衝液を300μLずつ分注して、ブロッキングした(以下、このマイクロタイタープレートを225抗体感作プレートと呼称する)。ブロッキング後、2〜8℃で4時間以上静置保存した。225抗体感作プレートは使用時まで2〜8℃で保存した。
なお、ハイブリドーマMV1−225は、シスメックス株式会社によって独立行政法人製品評価技術基盤機構特許微生物寄託センターに寄託されており、受領番号NITE BP-599が付与されている(受託日:2009年7月22日)。
【0078】
次に、ビオチン標識された抗麻疹ウイルスモノクローナル抗体液が0.25μg/mlとなるように、また、ストレプトアビジン標識化ペルオキシダーゼ(POD)溶液が40mU/mlとなるように第2緩衝液にて混合し、POD標識化抗体液を調製した。
ビオチン標識される抗麻疹ウイルスモノクローナル抗体として、ハイブリドーマMV1−1117によって産生される1117抗体を用いた。ハイブリドーマMV1−1117は、シスメックス株式会社によって独立行政法人製品評価技術基盤機構特許微生物寄託センターに寄託されており、受領番号NITE NP−600が付与されている(受託日:2009年7月22日)。
【0079】
225抗体感作プレート中の第2緩衝液を除去した。除去後、上述のPOD標識化抗体液50μLおよび96穴V字プレートの反応液の上清50μLを、225抗体感作プレートの各ウェルに加え、60分間攪拌させた。その後、225抗体感作プレートの各ウェルを、第2緩衝液で3回洗浄した。
このとき、本実施例による抗麻疹ウイルスモノクローナル抗体の抗原に対する反応性によって、96穴V字プレートの反応液の上清に抗原が含まれる場合と、含まれない場合とがありうる。
すなわち、本実施例による抗麻疹ウイルスモノクローナル抗体が抗原に対して反応性がある(抗体と抗原とが結合している)場合には、反応液中にはセファロースビーズ−抗マウスIgG−抗麻疹モノクローナル抗体−抗原からなる複合体が形成される。この複合体は、セファロースビーズの重みによって96穴V字プレートのウェルにおいて沈降するため、上清には抗原が含まれない。一方、本実施例による抗麻疹ウイルスモノクローナル抗体が抗原に対して反応性がない(抗体と抗原とが結合していない)場合には、反応液中に上記のような複合体は形成されず抗原が沈降しないため、上清には抗原が含まれることになる。
よって、本実施例による抗麻疹ウイルスモノクローナル抗体が抗原に対して反応性を示さなかった場合には、上記の操作によって225抗体−抗原−POD標識化抗体からなる複合体が225抗体感作プレートのウェルに形成され、反応性を示した場合には、上記複合体は形成されない。
【0080】
ついで225抗体感作プレートの各ウェルに、PODに対する基質であるOPDを含む基質液を100μLずつ加え、室温で10分間静置した。その後、反応停止液(2N H2SO4を含む)を225抗体感作プレートの各ウェルに100μLずつ加え、各ウェル中の反応液の吸光度をマイクロプレートリーダ(Molecular Devices社製)を用いて492nmの吸光度を測定した。ここで得られた吸光度を吸光度Aとする。
なお、上記の説明から明らかなように、吸光度Aは225抗体感作プレートのウェル上の複合体の有無を示している。すなわち、吸光度が低いほど複合体が少なく、本実施例による抗麻疹ウイルスモノクローナル抗体と抗原との反応性が高いことを示す。
【0081】
対照実験として、1.0μg/mL抗体液に換えて第2緩衝液を用いた対照試料を調製し、同様の実験を行って吸光度を測定した。ここで得られた吸光度を吸光度Bとする。
また、対照実験として、1.0μg/mL抗体液と抗原試料に換えて第2緩衝液を用いた対照試料を調製し、同様の実験を行って吸光度を測定した。ここで得られた吸光度を吸光度Cとする。
【0082】
得られた吸光度A〜Cを用いて、下記式(1)により、本実施例によって得られた抗麻疹ウイルスモノクローナル抗体を用いて得られた測定試料の吸光率を求めた。得られた吸光率を表1に、吸光率に基づく反応性の評価結果を表2に示した。表2において、「+++」は式(1)によって求められる吸光率が90%以上、「++」は50%以上、「+」は30%以上、「−」は30%であることを示している。
吸収率(%)={1−(A−C)/(B−C)}×100 ・・・(1)
【0083】
【表1】

【0084】
【表2】

【0085】
表1および表2に示したとおり、本実施例によって得られた2649抗体、3707抗体、3241抗体および320抗体のいずれも、麻疹ウイルス核タンパク質Ag1〜Ag9の全てに対して高い反応性を示した。
この結果から、本実施例による抗麻疹ウイルスモノクローナル抗体は、麻疹ウイルス核タンパク質に結合可能であり、且つ、核タンパク質のアミノ酸配列の一部の置換変異によっては結合能が変化しないことがわかった。
【0086】
3.抗麻疹ウイルスモノクローナル抗体の麻疹ウイルス抗原に対する結合部位のスクリーニング
本実施例による抗麻疹ウイルスモノクローナル抗体の麻疹ウイルス核タンパク質に対する結合部位を、以下の実験によって確認した。
【0087】
3−1.抗原試料の調製
上記1−1.において調製された麻疹ウイルス核タンパク質Ag3を含む抗原液を第2緩衝液によって0.15μg/mLに希釈し、Ag3を含む抗原試料を調製した。
【0088】
3−2.阻害試験
上記2−1.において記載した要領と同様にして、225抗体感作プレートを作製した。この225抗体感作プレートの各ウェルに、Ag3を含む抗原試料100μLを加え、30分間攪拌した。その後、225抗体感作プレートの各ウェルを、第1緩衝液で3回洗浄した。
【0089】
ビオチン標識された3707抗体溶液が0.5μg/mlとなるように、また、ストレプトアビジン標識化ペルオキシダーゼ(POD)溶液が40mU/mlとなるように第2緩衝液にて混合し、POD標識化抗体液を調製した。
【0090】
225抗体感作プレートの各ウェルに、本実施例によって得られた2649抗体を第2緩衝液で10μg/mLの濃度に希釈した抗体液50μLと、上述のPOD標識抗体液50μLとを加え、室温で60分間攪拌した。攪拌したのち、225抗体感作プレートを第1緩衝液で3回洗浄した。
【0091】
ついで、225抗体感作プレートの各ウェルに、OPDを含む基質液を100μLずつ加え、室温で10分間静置した。反応停止液(2N H2SO4を含む)を225抗体感作プレートの各ウェルに100μLずつ加えたのち、マイクロプレートリーダを用いて、492nmの吸光度を測定した。ここで得られた吸光度を吸光度Dとする。
【0092】
対照実験として、10μg/mL抗体液に換えて第2緩衝液を用いた対照試料を調製し、同様の実験を行って吸光度を測定した。ここで得られた吸光度を吸光度Eとする。
また、対照実験として、10μg/mL抗体液と抗原試料に換えて第2緩衝液を用いた対照試料を調製し、同様の実験を行って吸光度を測定した。ここで得られた吸光度を吸光度Fとする。
【0093】
得られた吸光度D〜Fを用いて、下記式(2)により、上記実験例における測定試料の吸光率を求めた。そして、得られた吸光率に基づいて、2649抗体および3707抗体の、麻疹ウイルス核タンパク質に対する結合部位の相同性を評価した。
得られた吸光率を表3に、吸光率に基づく相同性の評価結果を表4に示した。表4において、「+++」は式(2)によって求められる吸光率が90%以上、「++」は50%以上、「+」は30%以上、「−」は30%であることを示している。
なお、上記実験例を例にとれば、(2)によって求められる吸光率が高ければ高いほど、2649抗体と3707抗体の、麻疹ウイルス核タンパク質に対する結合部位の相同性が高いことを意味する。
吸収率(%)={1−(D−F)/(E−F)}×100 ・・・(2)
【0094】
この実験は、上記実験例における10μg/mLの抗体液に含まれる抗体と、ビオチン標識される抗体との組み合わせを、2649抗体、3707抗体、3241抗体および320抗体の中から選択されうるすべての組み合わせについて行った。
【0095】
【表3】

【0096】
【表4】

【0097】
表3および表4の結果から、2649抗体と3707抗体とは、麻疹ウイルス核タンパク質に対する結合部位の相同性が低く、両抗体は、麻疹ウイルス核タンパク質の異なる部位を認識して結合しうる抗体であることが示唆された。また、2649抗体と3241抗体の組み合わせ、320抗体と3707抗体との組み合わせ、320抗体と3241抗体との組み合わせについても同様のことが示唆された。
【0098】
以上の結果から、本実施例による抗麻疹ウイルスモノクローナル抗体を、特定の組み合わせにしたがって用いることにより、抗麻疹ウイルスモノクローナル抗体を麻疹ウイルス核タンパク質の互いに異なる第1の結合部位と第2の結合部位とに結合させることができ、サンドイッチ法によって麻疹ウイルスを検出できることが示唆された。
【0099】
4.試験具の作製
本実施例による抗麻疹ウイルスモノクローナル抗体を用いて、図1に示されるようなラテラルフロー式メンブレンアッセイ用試験具を作製した。
試験具1
標識保持部材7に保持される第1のモノクローナル抗体として、320抗体を使用した。クロマト用膜担体9の判定部9Aに担持される第2モノクローナル抗体として、2649抗体と3707抗体を使用した。
まず、図1に示すように、ニトロセルロースメンブレンからなるクロマト用膜担体9の判定部9Aに、リン酸緩衝液(pH7.0)で2.0mg IgG/mLの濃度になるように希釈した3707抗体を含む抗体液を、抗体塗布機(BioDot社)を用いて1mm幅で塗布し、さらに1mm位置をずらして、同様に2649抗体を含む抗体液を塗布し、50℃で30分間乾燥させた。
乾燥後のクロマト用膜担体9をBSAを含有するリン酸緩衝液(pH7.0)に浸漬し、クロマト用膜担体9上に抗体を固定した。その後、洗浄液(SDSを含有するリン酸緩衝液(pH7.0))で洗浄し、40℃で120分間乾燥させ、クロマト用膜担体9を得た。
【0100】
次に、320抗体を青色着色ポリスチレンラテックス粒子(粒径0.3μm)に感作し、分散用緩衝液(BSA及びシュークロースを含有するリン酸緩衝液(pH7.0))に懸濁し、320抗体感作ラテックス粒子懸濁液を作製した。320抗体の濃度は、1%ラテックス粒子懸濁液1mL中に200μg IgGとなる濃度とした。この320抗体感作ラテックス粒子懸濁液を、ガラス繊維製パッドに添加後、真空乾燥機で乾燥させ、標識保持部材7を得た。
試料添加部材5、吸収部材11、および基材12については、上記実施形態において説明したとおりの部材を使用して、試験具1を得た。
クロマト用膜担体9の判定部9Aに担持される抗体として、3707抗体に代えて3241抗体を用いた点を除いては上記と同様にして、試験具2を得た。
【0101】
5.性能試験
5−1.培養麻疹ウイルスの検出実験
4.において作製された試験具1および試験具2を使用して、試料中の麻疹ウイルスを検出する実験を行った。
本試験例では、下記の表5に示した2種類の野生型麻疹ウイルスをVero/SLAM細胞にて培養し、得られたウイルスを1%BSAを含有するリン酸ナトリウム緩衝液で希釈したものをウイルス液として用いた。なお、IC−B株およびEdmonston株は、いずれも野生型の麻疹ウイルス株であり、IC−B株のアミノ酸配列は配列番号10に示したとおりである。また、Edmonston株のアミノ酸配列は、配列番号9によって示されたものと同じである。
ウイルス液中のウイルス濃度は、プラーク法によって定量し、その定量値をPFUで表す。各ウイルス液中のウイルス濃度は、表5に示したとおりである。PFU(plaque-forming unit)は、100%コンフルエントの細胞にウイルスを感染させ、感染させた細胞が作るプラークによって確認できるウイルス感染細胞数から算出されたウイルス数を表す単位である。なお、表5にはおいては、PFUを対数表示によって表記してある。
【0102】
次に、0.3w/v% NP−40(ポリオキシエチレン(9)オクチルフェニルエーテル)を含むリン酸緩衝液(pH7.3) 800μLに、所定濃度のウイルス液150μLを加えて混合し、抗原試料とした。
抗原試料約200μLをガラス試験管に滴下し、このガラス試験管に上記方法で作製した試験具1の上流(試料添加部材1)側を浸漬した状態で約10分間静置した。その後、判定部9Aにおけるラテックス粒子による呈色を肉眼で判定した。判定は、呈色が認められたものを(+)、呈色が認められなかったものを(−)として評価した。これらの結果を表5に示す。
【0103】
【表5】

【0104】
表5に示したように、抗原試料中のウイルス濃度が所定濃度以上である場合には、試験具1および試験具2のいずれの判定部9Aにも呈色が認められ、麻疹ウイルスを検出することができた。以上より、本実施形態によるメンブレンアッセイ用試験キットによれば、麻疹ウイルスを確実に検出でき、さらに野生型の麻疹ウイルスをも検出できることが実証された。
【0105】
5−2.患者検体の麻疹ウイルス検出実験
4.において作製された試験具1および試験具2を使用して、患者から採取された検体中の麻疹ウイルスを検出する実験を行った。
なお、5−1.においては、判定部9Aに塗布される2種類の抗体液を、別々の位置に塗布して得られた試験具を使用したが、本実験例においては、2種類の抗体液を混合して得られたものを判定部9Aに塗布することにより試験具を作製し、使用した。
【0106】
RT−PCR法によるスクリーニングにより麻疹感染陽性と判定された各患者から、綿棒を用いて咽頭拭い液を採取した。この綿棒を1w/v%SDS溶液75μLに浸漬して、咽頭拭い液をSDS溶液に溶出させた。
溶液中のウイルス濃度は、リアルタイムPCR法によって得られたCt値を、5−1.に記載の方法で定量した濃度既知試料のCT値と比較することにより算出した。
【0107】
ついで、0.3w/v% NP−40(ポリオキシエチレン(9)オクチルフェニルエーテル)を含むリン酸緩衝液(pH7.3) 800μLに、上記のSDS溶液を添加して混合し、抗原試料とした。
この抗原試料を用いて、5−1.に記載の手順および判定条件に基づいて、判定部9Aにおけるラテックス粒子による呈色を判定した。これらの判定結果を表6に示す。
【0108】
【表6】

【0109】
表6に示したとおり、本実施例によって作製された試験具1および試験具2のいずれによっても、患者検体すべてにおいて麻疹ウイルスを検出することができた。
この結果から、本実施例による試験具によって、患者検体中の麻疹ウイルスを確実に検出できることが実証された。また、この結果から、患者から検体を採取して測定試料を調製し、この測定試料とメンブレンアッセイ用試験具とを用いることにより、肉眼での判定という簡便な方法により、麻疹ウイルスを検出できることが実証された。
【0110】
6.エピトープ解析
本実施例による抗麻疹ウイルスモノクローナル抗体の麻疹ウイルス核タンパク質に対する抗原認識部位を、以下の実験によって確認した。
【0111】
6−1.麻疹ウイルス部位欠損核タンパク質の作製
グルタチオン S−トランスフェラーゼ(以下、GSTと呼称する)融合タンパク質発現用ベクターpGEX−4T−3(GEヘルスケア社製)から、制限酵素NotIによる認識配列(以下、NotI配列と呼称する)を含む配列番号1のプライマーと、制限酵素BamHIによる認識配列(以下、BamHI配列と呼称する)を含む配列番号2のプライマーとを用いてポリメラーゼ連鎖反応(PCR)を行い、GST配列の上流側にNotI配列を、下流側にBamHI配列を組み込んだcDNAを合成した。
【0112】
合成されたcDNAを制限酵素NotIおよび制限酵素BamHIで処理した。同様に、小麦胚芽無細胞発現用試薬キット ENDEXT(登録商標)Wheat Germ Expression TRI−GG Kit(セルフリーサイエンス社)付属のベクターを、制限酵素NotIおよび制限酵素BamHIで処理した。
【0113】
得られた制限酵素処理産物同士をライゲーションし、GST配列を含む小麦胚芽無細胞発現用ベクターを構築した。
【0114】
麻疹ウイルスのEdomonston株より抽出したRNAから、逆転写反応によって、cDNAを合成した。合成した麻疹ウイルスcDNAから、制限酵素XhoIによる認識配列(以下、XhoI配列と呼称する)を含む配列番号3のプライマーと、配列番号4のプライマーとを用いてPCRを行った。ついで、得られたPCR産物を鋳型として、配列番号3のプライマーと、NotI配列を含む配列番号5のプライマーとを用いてPCRを行った。これにより、麻疹ウイルス核タンパク質の配列の上流側にXhoI配列を含み、下流側にNotI配列を含むDNA産物が合成された。
【0115】
合成されたDNA産物を制限酵素XhoIおよび制限酵素NotIで処理した。同様に、GST配列を含む小麦胚芽無細胞発現用ベクターを、制限酵素XhoIおよび制限酵素NotIで処理した。得られた制限酵素処理産物同士をライゲーションし、麻疹ウイルス核タンパク質配列およびGST配列を含む小麦胚芽無細胞発現用ベクター(以下、全長核タンパク質発現ベクターと呼称する)を構築した。構築した全長核タンパク質発現ベクターから、小麦胚芽無細胞発現用試薬キット ENDEXT(登録商標)Wheat Germ Expression TRI−GG Kit(セルフリーサイエンス社)を用いて、核タンパク質全長を発現させた。
【0116】
2649抗体、3707抗体、3241抗体および320抗体の抗原認識部位解析のために、麻疹ウイルス核タンパク質全長からC末端を除去した、部位欠損核タンパク質Truncate−1〜4を、以下に記載の方法によって作製した。作製した部位欠損核タンパク質を模式的に図9に示す。
【0117】
核タンパク質全長発現ベクターを基に、配列番号6のプライマーと、配列番号7のプライマーと、KOD plus Mutagenesis Kit(東洋紡社製)とを用いて、麻疹ウイルス核タンパク質の399位からC末端(525位)までのアミノ酸を除くプラスミド全周を増幅し、Truncate−1発現用ベクターを構築した。構築したTruncate−1発現用ベクターから、小麦胚芽無細胞発現用試薬キット ENDEXT(登録商標)Wheat Germ Expression TRI−GG Kit(セルフリーサイエンス社)を用いて、Truncate−1を発現させた。これにより、399位からC末端までのアミノ酸が欠損した核タンパク質が得られた。
【0118】
Truncate−2は、配列番号7のプライマーに代えて、配列番号8のプライマーを用いた点を除いては、Truncate−1と同様の手法によって得られた。これにより麻疹ウイルス核タンパク質の321位からC末端までのアミノ酸が欠損した核タンパク質が得られた。
【0119】
Truncate−3は、配列番号7のプライマーに代えて、配列番号9のプライマーを用いた点を除いては、Truncate−1と同様の手法によって得られた。これにより麻疹ウイルス核タンパク質の242位からC末端までのアミノ酸が欠損した核タンパク質が得られた。
【0120】
Truncate−3は、配列番号7のプライマーに代えて、配列番号10のプライマーを用いた点を除いては、Truncate−1と同様の手法によって得られた。これにより麻疹ウイルス核タンパク質の135位からC末端までのアミノ酸が欠損した核タンパク質が得られた。
【0121】
つぎに、核タンパク質のN末端から398位のアミノ酸までを欠損したTrancate−5を作製した。
【0122】
Truncate−5は、配列番号3のプライマーに代えて、配列番号11のプライマーを用いた点を除いて、上述の核タンパク質全長発現ベクターの作製およびベクターの発現と同様の手法により得られた。なお、配列番号11のプライマーは、麻疹ウイルス核タンパク質のcDNAの1195塩基から下流の塩基配列に対応するプライマーであって、XhoI配列を含むプライマーである。
【0123】
さらに詳細な2649抗体、3707抗体、3241抗体および320抗体の抗原認識部位解析のために、部位欠損核タンパク質Truncate−6〜14を作製した。作製した部位欠損核タンパク質を図9に示す。
【0124】
核タンパク質全長発現ベクターを基に、配列番号12のプライマーと配列番号13のプライマーとを用いて、KOD plus Mutagenesis Kit(東洋紡社製)の用法にしたがって麻疹ウイルス核タンパク質のN末端から44位までのアミノ酸を除くプラスミド全周を増幅し、Truncate−6発現用ベクターを構築した。構築したTruncate−6発現用ベクターから、小麦胚芽無細胞発現用試薬キット ENDEXT(登録商標)Wheat Germ Expression TRI−GG Kit(セルフリーサイエンス社)を用いて、Truncate−6を発現させた。これにより、N末端から44位までのアミノ酸が欠損した核タンパク質が得られた。
【0125】
Truncate−7は、配列番号12のプライマーに代えて、配列番号14のプライマーを用い、配列番号13のプライマーに代えて配列番号15のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の45位から90位までのアミノ酸が欠損した核タンパク質が得られた。
【0126】
Truncate−8は、配列番号12のプライマーに代えて、配列番号16のプライマーを用い、配列番号13のプライマーに代えて配列番号17のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の91位から134位までのアミノ酸が欠損した核タンパク質が得られた。
【0127】
Truncate−9は、配列番号12のプライマーに代えて、配列番号18のプライマーを用い、配列番号13のプライマーに代えて配列番号10のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の135位から170位までのアミノ酸が欠損した核タンパク質が得られた。
【0128】
Truncate−10は、配列番号12のプライマーに代えて、配列番号19のプライマーを用い、配列番号13のプライマーに代えて配列番号20のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の171位から206位までのアミノ酸が欠損した核タンパク質が得られた。
【0129】
Truncate−11は、配列番号12のプライマーに代えて、配列番号21のプライマーを用い、配列番号13のプライマーに代えて配列番号22のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の207位から241位までのアミノ酸が欠損した核タンパク質が得られた。
【0130】
Truncate−12は、配列番号12のプライマーに代えて、配列番号23のプライマーを用い、配列番号13のプライマーに代えて配列番号7のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の399位から441位までのアミノ酸が欠損した核タンパク質が得られた。
【0131】
Truncate−13は、配列番号12のプライマーに代えて、配列番号24のプライマーを用い、配列番号13のプライマーに代えて配列番号25のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の442位から484位までのアミノ酸が欠損した核タンパク質が得られた。
【0132】
Truncate−14は、配列番号12のプライマーに代えて、配列番号6のプライマーを用い、配列番号13のプライマーに代えて配列番号26のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の485位から525位までのアミノ酸が欠損した核タンパク質が得られた。
【0133】
得られた全長核タンパク質およびTrancate1〜14を、Glutation Sepharose 4B 50%(GEヘルスケア社製)を用いて、GST結合タンパク質として精製した。
【0134】
陰性コントロールとして、小麦胚芽無細胞発現キット付属のベクターにGST配列を付加したプラスミドを組み込み、転写・翻訳した後、タンパク質を精製した。得られたタンパク質を抗原認識部位の陰性コントロールとした。
【0135】
6−2.抗原認識部位の解析
上記6−1.において調製された全長核タンパク質およびTrancate1〜14の各抗原液を第2緩衝液によって希釈し、抗原試料を調製した。
【0136】
以下の要領で、抗GST抗体(GEヘルスケア社製)が感作されたマイクロタイタープレートを調製した。
【0137】
抗GST抗体液を、0.1w/v%NaN3を含む0.1M リン酸緩衝液(PBS, pH7.5)によって5μg/mL濃度に希釈し、この抗GST抗体希釈溶液をマイクロタイタープレート(NUNC社製)の各ウェルに50μLずつ分注し、4℃で一晩静置した。第1緩衝液を用いて各ウェルを3回洗浄したのち、各ウェルに第2緩衝液を300μLずつ分注して、ブロッキングした(以下、このマイクロタイタープレートを抗GST抗体感作プレートと呼称する)。ブロッキング後、2〜8℃で4時間以上静置保存した。抗GST抗体感作プレートは使用時まで2〜8℃で保存した。
【0138】
抗GST抗体感作プレート中の第2緩衝液を除去した。除去後、上述の核タンパク質全長およびTrancate1〜14の各抗原試料50μLを、抗GST抗体感作プレートの各ウェルに加え、30分間攪拌させた。その後、抗GST抗体感作プレートの各ウェルを、第2緩衝液で3回洗浄した。
【0139】
次に、2649抗体、3707抗体、3241抗体および320抗体が10μg/mlとなるように第2緩衝液にて希釈し、各抗体反応液を調製した。各抗体反応液50μLを、抗GST抗体感作プレートの各ウェルに加え、30分間攪拌させた。その後、抗GST抗体感作プレートの各ウェルを、第2緩衝液で3回洗浄した。
【0140】
ペルオキシダーゼ(POD)結合抗マウスIgG抗体(DAKO Cytomation社製)溶液が20mU/mlとなるように第2緩衝液にて希釈し、POD結合抗マウスIgG抗体液を調製した。POD結合抗マウスIgG抗体液50μLを、抗GST抗体感作プレートの各ウェルに加え、30分間攪拌させた。その後、抗GST抗体感作プレートの各ウェルを、第2緩衝液で3回洗浄した。
【0141】
ついで、抗GST抗体感作プレートの各ウェルに、OPDを含む基質液を100μLずつ加え、室温で10分間静置した。反応停止液(2N H2SO4を含む)を抗GST抗体感作プレートの各ウェルに100μLずつ加えたのち、マイクロプレートリーダを用いて、492nmの吸光度を測定した。
【0142】
得られた吸光度を表7に、吸光度に基づく各抗体の核タンパク質全長およびTrancate1〜14の各抗原に対する評価結果を表8に示した。表8において、「+++」は吸光度が1.5以上、「++」は0.5以上且つ1.5未満、「+」は陰性コントロールの3SDの値以上0.5未満、「−」は陰性コントロールの3SD以下であることを示している。
【0143】
【表7−1】

【0144】
【表7−2】

【0145】
【表7−3】

【0146】
【表7−4】

【0147】
【表8−1】

【0148】
【表8−2】

【0149】
【表8−3】

【0150】
表7および表8の結果から、2649抗体は、麻疹ウイルス核タンパク質の135残基から241残基のアミノ酸配列を認識して結合することが示唆された。3707抗体と3241抗体は、麻疹ウイルス核タンパク質の485残基から525残基のアミノ酸配列を認識して結合することが示唆された。さらに、320抗体は、麻疹ウイルス核タンパク質の91残基から134残基のアミノ酸配列を認識することが実証された。
【符号の説明】
【0151】
1 試験容器
1a 試験容器底部
1b 開口
3 ラベル
4 メンブレンアッセイ用試験具
4a 試験具の一端
5 試料添加用部材
7 標識保持部材
9 クロマトグラフィー用膜担体
9A 判定部
9B 対照部
11 吸収部材
12 基材
13 試料
14 検体処理容器
15 検体処理液
31 試験具
32 カバー部材
33 開口
34 膜担体
34A 判定部
35 吸収部材
【技術分野】
【0001】
本発明は、麻疹ウイルス抗原に結合可能な抗麻疹ウイルスモノクローナル抗体を用いて、試料中の麻疹ウイルスを検出するための麻疹ウイルス検出方法に関する。また、本発明は、麻疹ウイルスを検出するためのラテラルフロー式メンブレンアッセイ用試験具、およびこれを用いたメンブレンアッセイ用試験キットに関する。また、本発明は、麻疹ウイルスを検出するためのフロースルー式メンブレンアッセイ用試験キットに関する。
【背景技術】
【0002】
麻疹ウイルスは、パラミクソウイルス科モルビリウイルス属に属し、直径100〜250nmのエンベロープを有する一本鎖RNAウイルスである。麻疹ウイルスに感染すると、麻疹ウイルスは呼吸器上皮細胞にて最初に増殖し、その後リンパ節、脾臓、胸腺など全身のリンパ組織を中心に増殖してリンパ球減少や免疫抑制などを発症させる。麻疹ウイルスは感染力が非常に強く、一旦ヒトに感染すれば二次感染を引き起こす虞もあるため、麻疹感染の検査は極めて重要である。
【0003】
麻疹感染の有無を検査する方法として、被験者の体内に存在する、麻疹ウイルスに対する抗体を検出する方法が知られている。例えば特許文献1には、麻疹特異的免疫グロブリンIgMによって認識される少なくとも1つのエピトープを含む組み換え麻疹核タンパク質抗原と、ヒト血清試料とを接触させ、前記抗原に結合した麻疹特異的免疫グロブリンIgMの存在を検出する方法が記載されている。
【0004】
しかしながら、特許文献1に記載の方法には、次の点で問題がある。すなわち、麻疹ウイルスに感染しても、感染者の体内においてIgMの抗体価が上昇するまでには少なくとも3日程度の時間がかかるため、上記の方法では麻疹ウイルスの感染を早期に発見することができない。そればかりか、麻疹ウイルスに感染してからIgMの抗体価が上昇するまでの間に上記の方法によって検査を行えば、擬陰性と判断してしまうおそれもある。
【0005】
特許文献1における問題を解決する方法として、特許文献2には、検体試料中に含まれる麻疹ウイルスを検出する方法が記載されている。具体的には、微小固体担体の表面にウイルス表層のタンパク質に親和性のある分子を固定させたウイルス凝集検査薬として、抗麻疹ウイルスモノクローナル抗体を微小固体担体の表面に固定させた麻疹ウイルス検査薬が記載されている。
【0006】
【特許文献1】国際公開WO93/22683号公報
【特許文献2】国際公開WO97/07400号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
しかしながら、特許文献2に記載の方法によれば、麻疹ウイルスの感染を早期に発見することはできるものの、上記方法においては、検体の測定とは別に陽性対照の測定と陰性対照の測定とを行う必要があるため、検査に要する作業が煩雑である。
【0008】
本発明は、このような事情に鑑みてなされたものであり、陽性対照および陰性対照の測定を行う必要がなく、従来より簡便に麻疹ウイルスを検出することが可能な麻疹ウイルス検出方法を提供することを目的とする。また、本発明は、上記の麻疹ウイルス検出方法を実現可能なメンブレンアッセイ用試験具、およびメンブレンアッセイ用試験キットを提供することを目的とする。
【課題を解決するための手段】
【0009】
上記の課題に鑑み、本発明の第1の観点による麻疹ウイルス検出方法は、麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体と、麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し、且つ標識された第2のモノクローナル抗体とを用いて、検体に含まれる麻疹ウイルスを検出することを特徴とする。
【0010】
また、本発明の第2の観点による、検体に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験具は、麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体が担持された判定部を含む展開用膜担体と、麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し、且つ標識された第2のモノクローナル抗体を保持する標識保持部材とを備えることを特徴とする。
【0011】
また、本発明の第3の観点による、測定試料に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験キットは、上記のようなメンブレンアッセイ用試験具と、非イオン性界面活性剤を含み、検体と混合して測定試料を調製するための検体処理液と、を備えることを特徴とする。
【0012】
また、本発明の第4の観点による、検体に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験キットは、麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体が担持された判定部を含む膜担体を備える試験具と、麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し、且つ標識された第2のモノクローナル抗体を含む標識液とを備えることを特徴とする。
【発明の効果】
【0013】
本発明によれば、検体に含まれる麻疹ウイルスの核タンパク質を第1のモノクローナル抗体によって捕捉するとともに、第2のモノクローナル抗体によって捕捉された麻疹ウイルス核タンパク質を標識することができる。したがって、標識された麻疹ウイルス核タンパク質を検出することで検体に含まれる麻疹ウイルス核タンパク質の存否を判定することができ、陽性対照あるいは陰性対照の測定を行うことなく、検体の測定のみで簡便に麻疹ウイルスを検出することができる。さらに、本発明によれば、簡便に麻疹ウイルスを検出可能なラテラルフロー式メンブレンアッセイ用試験具、およびこれを用いたメンブレンアッセイ用試験キットを提供することができる。さらに、本発明によれば、簡便に麻疹ウイルスを検出可能なフロースルー式メンブレンアッセイ用試験キットを提供することができる。
【図面の簡単な説明】
【0014】
【図1】ラテラルフロー式メンブレンアッセイ用(イムノクロマトグラフィー用)試験キットの概略構成図である。
【図2】図1のメンブレンアッセイ用試験キットの試験具の(a)平面図、(b)側面図である。
【図3】検体処理容器の分解平面図である。
【図4】図1のメンブレンアッセイ用試験キットの使用状態を示す図である。
【図5】メンブレンアッセイ用試験具の他の一例を示す図である。
【図6】フロースルー式メンブレンアッセイ用試験キットの概略構成図である。
【図7】図6の試験具の(a)平面図、(b)X−X矢視断面図である。
【図8】エピトープ解析の結果を示す図である。
【発明を実施するための最良の形態】
【0015】
本明細書における「モノクローナル抗体」とは、モノクローナル抗体のフラグメントおよびその誘導体をも含む。モノクローナル抗体のフラグメント及びその誘導体としては、具体的にはFab、Fab´、F(ab)2及びsFvフラグメントなどが例示される。モノクローナル抗体のサブクラスはIgGに限定されず、IgMでもよい。
【0016】
抗麻疹ウイルスモノクローナル抗体は、麻疹ウイルスの核タンパク質に結合可能なものが用いられる。核タンパク質は、エンベロープのような他の構造タンパク質に比べて抗原性が強く、患者検体中に多く含まれ得ると考えられることから、抗麻疹ウイルスモノクローナル抗体による検出感度を高くすることが可能だからである。
【0017】
抗麻疹モノクローナル抗体は、公知の免疫学的手法を用い、麻疹ウイルス抗原を被免疫動物に免疫し、被免疫動物の細胞を用いてハイブリドーマを作製することにより得ることができる。2649抗体を産生することができるハイブリドーマMV2−2649は受託番号NITE BP−563、3241抗体を産生することができるハイブリドーマMV2−3241は受託番号NITE BP−564、3707抗体を産生することができるハイブリドーマMV2−3707は受託番号NITE BP−565、320抗体を産生することができるハイブリドーマMV3−320は受託番号NITE BP−566として独立行政法人製品評価技術基盤機構特許微生物寄託センターに寄託されている(受託日:2009年7月22日)。
【0018】
麻疹ウイルス抗原は、麻疹感染者の生体試料から精製して得ることができる。また、麻疹ウイルス抗原は、麻疹ウイルス核タンパク質をコードするDNAをプラスミドに組み込み、これを宿主細胞に導入して発現させることにより得ることもできる。
【0019】
抗原を被免疫動物に免疫する際は、アジュバントを投与することが好ましい。アジュバントを用いることによって被免疫動物の抗原への免疫応答性を高めることができる。アジュバントの種類は特に限定されないが、例えばフロイント完全アジュバント(FCA)、フロイント不完全アジュバント(FIA)、モノフォスフォリルリピッドA(MPL、商品名Ribi)、トレハロースジマイコレート(TDM、商品名RIBI)、モノフォスフォリルリピッドAおよびトレハロースジマイクレート混合液(MPL+TDM、商品名RIBI Adjuvant System)、百日咳ワクチン(Bordetella pertussis Vaccine)、ムラミルジペプチド(MDP)、アルミニウムアジュバント(ALUM)などが用いられる。また、これらのうち複数のアジュバントを組み合わせて用いてもよい。初回免疫時にFCA、二回目以降の免疫時にFIAやRibiを用いるのが好ましい。
【0020】
アジュバント投与の有無や投与経路、被免疫動物の種類などによって免疫のスケジュールを適宜変更させることができる。以下は、被免疫動物としてマウスを用いた場合の免疫について説明する。
初回免疫として、アジュバント混合麻疹ウイルス抗原溶液を腹腔内、皮下又は筋肉内に注射する。注射するアジュバント混合麻疹ウイルス抗原溶液の体積は0.05ml〜1mlであることが好ましく、含まれる麻疹抗原の質量は10〜200μgであることが好ましい。アジュバントを用いない場合は、麻疹ウイルス抗原の含有量を多くして腹腔内注射することにより免疫してもよい。初回免疫から約2〜4週間毎に1〜6回追加免疫を行う。追加免疫から約1〜4週間後に、麻疹ウイルス抗原溶液を静脈注射することにより最終免疫を行う。最終免疫から約3〜5日後、マウスからの脾細胞を分離して、抗体産生細胞を得ることができる。
【0021】
上記のようにして作製された抗体産生細胞は、骨髄腫細胞と融合される。骨髄腫細胞の由来は特に限定されず、マウス、ラット、ヒトなどを由来とするものが用いられるが、被免疫動物と同種の動物由来の骨髄腫を用いることが好ましく、さらに好ましくは同種同系統の動物由来の骨髄腫が用いられる。骨髄腫の由来としてマウスを用いる場合には、例えばマウスミエローマP3X63−Ag8、P3X−63−Ag8−U1、P3NS1−Ag4、SP2/o−Ag14、P3X63−Ag8/653などの株化骨髄腫細胞を用いるのが好ましい。骨髄腫細胞にはイムノグロブリン軽鎖を産生しているものがあり、このような骨髄腫細胞を融合対象として用いると、抗体産生細胞が産生するイムノグロブリン重鎖とこの軽鎖とが結合する場合がある。そのため、好ましくはイムノグロブリン軽鎖を産生しない骨髄腫細胞、例えばP3X63−Ag8・653やSP2/o−Ag14などを用いることが好ましい。
【0022】
抗体産生細胞と骨髄腫細胞とを融合させてハイブリドーマを作製する方法としては、公知の方法を用いることができる。例えば、ポリエチレングリコール(PEG)を用いる方法(PEG法)、センダイウイルスを用いる方法、電気融合装置を用いる方法などが挙げられる。PEG法の場合、約30〜60%のPEG(平均分子量1000〜6000)を含む適当な培地又は緩衝液中に脾細胞と骨髄腫細胞を1:1から10:1、好ましくは5:1から10:1の混合比で懸濁し、温度約25〜37度、pH6〜8の条件下で、約30秒〜3分間程度反応させればよい。反応終了後、細胞を洗浄し、PEG溶液を除いてヒポキサンチン−チミジン培地(HT培地)などに再懸濁し、例えばマイクロタイタープレート中に播種して培養を続けることができる。
【0023】
融合後の細胞は選択培地で培養して、ハイブリドーマの選択を行う。選択培地としては、親細胞株が死滅し、融合細胞のみが増殖し得る培地であれば特に限定されない。通常はヒポキサンチン−アミノプテリン−チミジン培地(HAT培地)が使用される。ハイブリドーマの選択は、通常融合操作の1日後に、選択培地を添加、または、培地の一部、好ましくは約半量を選択培地と交換することによって開始し、7〜10日間培養することによって行う。
【0024】
生育しているハイブリドーマが所望の抗体を産生しているか否かは、培養上清を採取して抗体価アッセイを行うことによって確認することができる。抗体価アッセイとしては公知の方法を用いることができ、特に限定されない。例えば、固相化した抗原に段階希釈した上記上清を添加して反応させ、さらに蛍光物質、酵素、又は放射性同位体(RI)などで標識した二次抗体(抗グロブリン抗体、抗IgG抗体、抗IgM抗体など)を反応させれば、上記上清中に産生されている抗体を検出することができ、また抗体価を測定することができる。このようにプレートの各ウェルの培養上清をスクリーニングし、所望の抗体を産生しているハイブリドーマを得ることができる。
【0025】
次に、単一クローンを分離する。分離法としては、公知の方法を用いることができ特に限定されない。例えば、限界希釈法、軟寒天法、蛍光励起セルソーターを用いる方法などが挙げられる。例えば限界希釈法の場合、ハイブリドーマを1cell/wellとなるように培地で段階希釈し、培養プレートへ播き込こんだ後、培養する。約10日間培養後、1 colony/wellの培養上清中に目的とするモノクローナル抗体が産生されているか確認することで、目的のハイブリドーマクローンを単離することができる。得られたハイブリドーマクローンは、約10w/v%のジメチルスルホキシド(DMSO)又はグリセリンなどの凍結保護剤の共存下に凍結させて−196〜−70度で保存すると、半永久的に保存可能である。細胞は用時37度前後の恒温槽中で急速に融解して使用できる。凍結保護剤の細胞毒性が残存しないようによく洗浄してから使用することが好ましい。
【0026】
ハイブリドーマが産生する抗体のイムノグロブリンサブクラスを調べるためには、ハイブリドーマを一般的な条件で培養し、その培養上清中に分泌された抗体を市販の抗体クラス・サブクラス判定用キットなどを用いるとよい。
【0027】
ハイブリドーマからのモノクローナル抗体の取得方法は、必要量やハイブリドーマの性状などによって適宜選択して用いる。例えば、ハイブリドーマを移植したマウスの腹水から取得する方法、細胞培養により培養上清から取得する方法などが例示される。マウス腹腔内で増殖可能なハイブリドーマであれば、腹水から数mg/mlの高濃度のモノクローナル抗体を得ることができる。in vivoで増殖できないハイブリドーマは細胞培養の培養上清から取得する。細胞培養によるモノクローナル抗体の取得方法は、in vivoで行なう方法に比べて、抗体産生量は少ないがマウス腹腔内に含まれるイムノグロブリンや他の夾雑物質の混入が少なく生成が容易であるという利点を有する。
【0028】
モノクローナル抗体を、ハイブリドーマを移植したマウス腹水から取得する場合、例えば予めプリスタン(2,6,10,14−テトラメチルペンタデカン)などの免疫抑制作用を有する物質を投与したマウスの腹腔内へハイブリドーマを移植し、約1週間後から貯留した腹水を採取する。異なる動物種の細胞を融合させたハイブリドーマ(例えばマウスとラット)の場合には、ヌードマウス、放射線処理マウスを使用することが好ましい。
【0029】
細胞培養上清から抗体を取得する場合、例えば、細胞維持に用いられる静置培養法、高密度培養方法、スピナーフラスコ培養方法などの培養法を用いることができる。これらのうち何れかの方法を用いることにより、ハイブリドーマを培養し抗体を含有する培養上清を得る。
【0030】
腹水や培養上清からのモノクローナル抗体の精製は、公知のイムノグロブリン精製法を用いることによって行なうことができる。イムノグロブリン精製法としては特に限定されず、例えば、硫酸アンモニウムや硫酸ナトリウムを用いた塩析による分画法、PEG分画法、エタノール分画法、DEAEイオン交換クロマトグラフィー法、ゲル濾過法などが挙げられる。
【0031】
さらに、モノクローナル抗体がマウスIgGである場合、プロテインA結合担体或いは抗マウスイムノグロブリン結合担体を用いたアフィニティークロマトグラフィー法により精製することが可能である。
【0032】
以上のようにして作製された抗麻疹ウイルスモノクローナル抗体は、検体または検体を用いて調製された試料に含まれる麻疹ウイルスを検出するためのイムノアッセイに用いることができる。麻疹ウイルスを検出するためのイムノアッセイ法としては、麻疹ウイルスに対する第1及び第2の抗体を用い、固相に固定された第1の抗体と、標識された第2の抗体と、麻疹ウイルスとを含む複合体を形成させる工程を含む、いわゆるサンドイッチ法を検出原理とするものが好ましい。
【0033】
さらに、本発明は、抗麻疹ウイルスモノクローナル抗体として、麻疹ウイルス核タンパク質の135位から241位のアミノ酸配列を認識して結合するモノクローナル抗体(135−241抗体)、麻疹ウイルス核タンパク質の485位から525位のアミノ酸配列を認識して結合するモノクローナル抗体(485−525抗体)、および麻疹ウイルス核タンパク質の91位から134位のアミノ酸配列を認識して結合するモノクローナル抗体(91−134抗体)の3種のモノクローナル抗体を提供する。ここで、麻疹ウイルス核タンパク質のアミノ酸配列としては、配列番号9に記載のものが挙げられる。
サンドイッチ法による麻疹ウイルスの検出においては、上記3種のモノクローナル抗体のうち一の抗体を標識される抗体として、他の抗体を固相に固定される抗体として用いることができる。使用される抗体の組み合わせは特に限定されないが、固相に固定される第1の抗体として、135−241抗体または485−525抗体を使用し、標識される第2の抗体として、91−134抗体を使用することが検出感度を向上させる観点から好ましい。なお、第1の抗体に加えて、第1および第2の抗体と異なる第3の抗体を固相に固定してもよく、135−241抗体および485−525抗体の両方を同じ固相に固定して用いる形態であってもよい。
【0034】
サンドイッチ法によって麻疹ウイルスを検出するに際して、抗体が固定される固相としては、抗体を従来公知の方法によって固定可能なものを用いることができ、例えば、メンブレン、ビーズ、粒子、ナノ粒子、試験管、マイクロタイタープレートなど公知のものを用いることができる。また、抗体を標識するための標識物質としては、酵素、放射性同位元素、蛍光発光性標識物質、着色粒子、コロイド粒子などを用いることができる。
【0035】
上記において示した種々のサンドイッチ法を検出原理とするイムノアッセイ法の中でも、特に検査の簡便性、ひいては迅速性の観点から、固相にメンブレンを用いたメンブレンアッセイ法が好ましい。メンブレンアッセイ法としては、ラテラルフロー式メンブレンアッセイ法と、フロースルー式メンブレンアッセイ法が挙げられ、本実施形態による抗麻疹ウイルスモノクローナル抗体は、そのいずれの方法にも適用することができる。
【0036】
ここで、ラテラルフロー式メンブレンアッセイ法とは、捕捉物質が固定化された判定領域を含むメンブレンに試料を滴下し、試料をメンブレンに対して平行に展開させることで、判定領域に捕捉された測定対象物を検出する方法である。一方、フロースルー式メンブレンアッセイ法とは、測定対象物(抗原)を捕捉するための捕捉物質(抗体)を表面に固定化させたメンブレンに、被測定対象物を含む試料を滴下し、試料をメンブレンに対して垂直に通過させることで膜表面に捕捉された測定対象物を検出する方法である。いずれの方法においても、測定対象物は所定の標識物質によって標識されるため、メンブレン上に標識が現れるか否かによって測定対象物の存否を確認することができる。
以下、本実施形態によるメンブレンアッセイ用試験キットについて、図面を参照しながら説明する。
【0037】
図1は、第1の実施形態によるメンブレンアッセイ用試験キット(以下、試験キットと呼称する)の外観を示した図である。この試験キットは、ラテラルフロー式メンブレンアッセイ法(ラテラルフロー式イムノクロマトグラフィー法)に用いられる試験キットであって、試料を収容するための試験容器1と、一端側4aから試験容器1に挿入されて用いられるメンブレンアッセイ用試験具4(以下、試験具4と呼称する)と、検体と混合することによって測定試料を調製するための検体処理液15を収容した検体処理容器14とを備える。図2は、図1の試験具4の(a)平面図、(b)側面図である。
【0038】
試験具4は、図2に示すように、表面に粘着層を有するプラスチック板からなる基材12上に、コットンの不織布からなる試料添加用部材5と、グラスファイバーの不織布からなる標識保持部材7と、ニトロセルロースの多孔体からなるクロマトグラフィー用膜担体(以下、クロマト用膜担体と呼称する)9と、セルロースの不織布からなる吸収部材11とを備える。
標識保持部材7は、試料添加用部材5に接触して配置され、麻疹抗原に特異的に結合可能であり、且つ標識された抗麻疹ウイルスモノクローナル抗体(以下、標識化抗体と呼称する)と、対照用標識物質を保持する。標識化抗体は、青色ラテックス粒子で標識された抗麻疹ウイルスモノクローナル抗体であり、対照用標識物質は、赤色ラテックス粒子で標識されたストレプトアビジンである。クロマト用膜担体9は、標識保持部材7に接触して配置され、上流側から順に、ライン状の判定部9Aおよび対照部9Bを有する。判定部9Aには麻疹ウイルス抗原に特異的に結合可能な抗麻疹ウイルスモノクローナル抗体(以下、捕捉用抗体と呼称する)が、対照部9Bにはビオチンが固定されている。
吸収部材11は、クロマト用膜担体9と接触するように配置されている。
【0039】
試料中に麻疹ウイルスが含まれていると、標識保持部材7に保持された標識化抗体は、麻疹ウイルスの所定部位を認識して、抗原抗体反応により結合して複合体を形成する。次に、クロマト用膜担体9の判定部9Aに固定された捕捉用抗体は、麻疹ウイルスの別の部位を認識して複合体を捕捉する。複合体が捕捉されると、判定部9Aには青色のラインが現れ、麻疹ウイルスの存在が目視により判定される。
【0040】
また、アビジンは、クロマト用膜担体9にある捕捉用抗体には捕捉されないが、ビオチンと特異的に結合するので、対照用標識物質は対照部9Bに固定されたビオチンに捕捉される。対照用標識物質が捕捉されると、対照部9Bには赤色のラインが現れ、対照用標識物質が対照部9Bに到達したことが目視によって確認される。対照部9Bは、判定部9Aの下流に設けられるので、赤色のラインを確認することにより、試料が判定部9Aを通過したことが確認される。
【0041】
試験容器1は、開口1bを有するテーパー状の受け入れ部16と、底部1aに試料を収容する試料収容部17とを有する試験管状の有底筒状の容器から構成されている。
【0042】
試験容器1の外壁面には、ラベル3が貼付されている。ラベル3は、試験具4を試験容器1に挿入した際の試験具4の判定部9Aおよび対照部9Bに対応する位置に、試験具4の判定部9Aおよび対照部9Bを示す表示24a、24bを有している。図に示すように、このラベル3の表示24a、24bは、それぞれ、「T」、「!」である。
【0043】
図3は、検体処理容器14の分解平面図である。図に示すように、検体処理容器14は、プラスチックボトル141、ノズル142およびキャップ143を備えて構成されている。ボトル141は、その内部に検体処理液15を収容しており、キャップ143によりボトル141の開口が密閉された状態で保存されている。ノズル142は先端に試料排出口を備えており、内側にはろ過部材が装着されている。
【0044】
ノズル142の内側に装着されたろ過部材は、第1ガラス繊維濾紙と、第1ガラス繊維濾紙より膜口径が大である第2ガラス繊維濾紙と、不織布状のガラスフィルターとが、この順に積層されたものである。また、このろ過部材は、ガラスフィルターがノズル142のボトル141との装着部側に、第1ガラス繊維濾紙が試料排出口側になるようにノズル142に装着されている。なお、ろ過部材は、この構成に限定されるものではないが、検体中の粘性成分を除去するために不織布状のガラスフィルターを用いることが好ましく、この不織布状のガラスフィルターにガラス繊維濾紙を1枚もしくは2枚組み合わせて用いることが好ましい。
【0045】
検体処理液15は、界面活性剤を含有する水溶液であることが好ましい。これは麻疹ウイルスが外皮(エンベロープ)を有しているため、界面活性剤により外皮に孔をあけて内部の抗原タンパク質を検体処理液中に放出させるためである。
【0046】
界面活性剤の種類は特に限定されず、陰イオン性界面活性剤、陽イオン性界面活性剤、両性界面活性剤、あるいは非イオン性界面活性剤など広範のものを使用することができる。
【0047】
非イオン性界面活性剤は、好ましくはポリオキシエチレン系のものを使用することができ、より好ましくはエーテル型のものを使用することができる。具体的には、ポリオキシエチレン(9)オクチルフェニルエーテル、ポリオキシエチレン(10)オクチルフェニルエーテル、ポリオキシエチレン(9)ノニルフェニルエーテル等のポリオキシエチレンアルキルフェニルエーテル、ポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノオレエート等のポリオキシエチレンソルビタン脂肪酸エステル、ポリオキシエチレン/ポリオキシプロピレン共重合体、ポリオキシエチレンアルキルエーテルからなる群より選ばれる一種又は二種以上の混合物が好ましく用いられる。
【0048】
両性界面活性剤は、特に限定されないが、3-〔(3-コラミドプロピル)ジメチルアンモニオ〕-1-プロパンスルホネート(CHAPS)等が好ましく用いられる。また、非イオン性界面活性剤の検体処理液15への添加量を多くする場合には、その溶解性を向上させて検体処理液の保存安定性を高めるために両性界面活性剤を併用するようにしてもよい。
【0049】
陰イオン性界面活性剤は、特に限定されないが、ドデシル硫酸ナトリウム、ドデシルスルホン酸ナトリウム、ドデシル−N−サルコシン酸ナトリウム、コール酸ナトリウム、デオキシコール酸ナトリウム、タウロデオキシコール酸ナトリウム等が好ましく用いられる。
【0050】
検体処理液15は、非特異反応を防止するためにチオシアン酸系化合物を含有することが好ましい。チオシアン酸系化合物は、チオシアン酸(HNCS)の他、チオシアン酸エステルやチオシアン酸塩等水溶性であれば、特に制限はない。チオシアン酸を構成する塩としては、ナトリウム、カリウム等の金属を含む無機塩基、あるいは有機塩基アンモニウム塩等が挙げられる。さらに、その塩の水和物や溶媒和物をも包含する。具体的には、チオシアン酸ナトリウム、チオシアン酸カリウム、チオシアン酸アンモニウム、チオシアン酸グアニジン等が挙げられる。好ましくはチオシアン酸カリウム、チオシアン酸グアニジンが適用される。
【0051】
また、検体処理液15は、検体(特に鼻汁、鼻腔吸引液、鼻腔拭い液および咽頭ぬぐい液)中に存在する高粘性物質の粘性を低下させるために、還元剤を含有することが好ましい。また、還元剤としては含硫還元性化合物が好ましく、例えば、メルカプトエチルアミン、メルカプトエチルアミン塩酸塩、メルカプトエタノール、ジチオスレイトール、システイン、N−アセチル−Lシステイン、二臭化水素酸S−2アミノエチルイソチオ尿素、トリス(2−カルボキシエチル)ホスフィン、ハイドロサルファイト塩、亜硫酸塩等が挙げられる。
【0052】
また、検体処理液15は、抗原タンパクを分解する酵素活性を抑えたり、非特異反応を低下させるためにキレート剤を含有しても良い。キレート剤としては、例えば、エチレンジアミン4酢酸、1,2−シクロヘキサンジアミン4酢酸、ヘキサメチレンジアミン4酢酸、イミノ2酢酸、ヒドロキシエチルイミノ2酢酸、1,3−ジアミノプロパン−2−オール4酢酸、ジエチレントリアミン5酢酸、エチレンジアミン2酢酸、エチレンジアミン2酢酸2プロピオン酸、エチレンビス(オキシエチレンニトリロ)4酢酸、エチレンジアミン−テトラキス(メチレンホスホン酸)、エチレンジアミン2プロピオン酸、ヒドロキシエチルエチレンジアミン3酢酸、N−(2−ヒドロキシルエチル)エチレンジアミン3酢酸、ニトリロ3酢酸、ニトリロ3プロピオン酸、ニトリロトリス(メチレンホスホン酸)、2(ヒドロキシエチル)グリシンおよび1,2−ジアミノプロパン4酢酸、およびこれらの塩を挙げることができる。
【0053】
また、検体処理液15にアルカリ金属イオンを含有させるようにしてもよい。アルカリ金属イオンとしては、リチウム+(Li+)、ナトリウム+(Na+)、カリウム+(K+)、ルビジウム+(Rb+)、セシウム+(Cs+)、フランシウム+(Fr+)等が例示されるが、好ましくはナトリウム、カリウムを使用することができる。又アルカリ金属イオンは一種又は二種以上使用することができる。このようなアルカリ金属イオンを生じうる化合物は特に限定されないが、例えば塩化ナトリウム、塩化カリウム、水酸化ナトリウム、水酸化カリウム、EDTAナトリウム塩、アジ化ナトリウムからなる群より選ばれる一種又は二種以上の混合物を使用することができる。アルカリ金属イオンの添加により非特異反応を抑制することができる。アルカリ金属イオンの含有量は、0.3M〜2.0M、好ましくは0.4M〜1.5M、より好ましくは0.45M〜1.0Mである。
【0054】
また、検体処理液15は、緩衝剤を含有することが好ましく、例えば、MES、Bis-Tris、ADA、PIPES、ACES、MOPSO、BES、MOPS、TES、HEPES、DIPSO、TAPSO、POPSO、HEPPSO、EPPS、Tricine、Bicine、TAPS、CHES、CAPSO、CAPSなどのGood緩衝剤を挙げることができ、ADA、PIPES、ACES、MOPSO、BES、MOPS、TES、HEPES、DIPSO、TAPSO、POPSO、HEPPSO、EPPSが好ましく、PIPES、ACES、MOPSO、BES、MOPS、TES、HEPESがより好ましい。検体処理液のpHは5〜10、好ましくは5.5〜9.0、より好ましくは6.0〜8.0である。
【0055】
検体処理液15と混合される検体は、被検者から採取された生体成分であれば特に限定されない。例えば、血液、血清、尿、鼻汁、唾液、鼻腔拭い液、鼻腔吸引液または咽頭拭い液が挙げられ、特に麻疹感染者において麻疹ウイルスが検出されやすい唾液、鼻汁、鼻腔拭い液または咽頭拭い液が好ましい。
【0056】
次に、本実施形態による試験キットの使用方法について、図4を用いて説明する。
まず、検体処理容器14のキャップ143を開け、採取した検体をボトル141内に加え、検体処理液15と混和し、測定試料13を調製する。その後、キャップ143に代えてノズル142をボトル141の開口部に装着し、測定試料13をろ過部材44を介して試料排出口46から試験容器1に供給する。次に、試験具4を一端4aから試験容器1に挿入し、一端4aを試験容器1の底部1aに接触させる(なお、ここでいう「底部」とは、試験容器1の丸みを帯びた部分を意味する)。これにより、試験具4と試験容器1とが上下方向に位置合わせされる。この状態で、10〜20分程度放置すると、測定試料13が毛管現象により、試料添加用部材5、標識保持部材7、クロマト用膜担体9、吸収部材11を順次移動する。測定試料13が、標識保持部材7を通過する際に、標識保持部材7に保持されている標識物質(標識化抗麻疹モノクローナル抗体及び対照用標識物質)が測定試料中に溶出する。測定試料13に麻疹ウイルスが含まれていると、上述した作用により、判定部9Aには青色のラインが現れる。また、ウイルスの有無に関わらず、対照部9Bに赤色のラインが現れる。
【0057】
なお、以上においては特定の実施形態を例にとって説明したが、本実施形態による試験キットは、このような例に限られず、種々の変更を伴ない得るものである。
【0058】
例えば、試料添加用部材5として、コットンに代えて、グラスファイバー、セルロースファイバーなどの材質のものを用いてもよい。また、標識保持部材7として、グラスファイバーに代えて、セルロースファイバーを用いてもよい。また、標識化抗体および対照用標識物質は、着色ラテックス粒子以外にも、酵素、蛍光発光性標識、磁性体標識、放射性同位元素、金コロイド等によって標識されていてもよい。また、クロマト用膜担体9として、ニトロセルロースに代えて、ナイロン(例えば、カルボキシル基やアルキル基を置換基として有してもよいアミノ基が導入された修飾ナイロン)、ポリビニリデンジフルオリド(PVDF)、セルロースアセテートを用いてもよい。また、吸収部材11として、セルロースに代えて、グラスファイバーを用いてもよい。
このように、試料添加用部材5、標識保持部材7、クロマト用膜担体9及び吸収部材11には、不織布又は多孔質部材以外にも、毛管現象により試料を展開可能な種々の構造のものを用いることができる。
【0059】
また、上記実施形態においては、判定部9Aが一種類の抗麻疹モノクローナル抗体のみを担持した構成を例示したが、このような構成に限らず、判定部は二種類以上の抗麻疹モノクローナル抗体を担持した構成であってもよい。例えば、試験具4を、二種類以上の抗麻疹モノクローナル抗体を含む試料をクロマト用膜担体9に塗布することによって作製してもよい。このように二種類以上の抗麻疹モノクローナル抗体を判定部に備えた構成とすることにより、麻疹ウイルスの検出感度が向上し、ひいては偽陰性のおそれを低減することができる。また、二種類の抗麻疹モノクローナル抗体を、クロマト用膜担体9上に別々に担持させることにより、判定部を二つ以上設けた構成としてもよい。
【0060】
また、上記実施形態においては、測定試料13を収容するための試験容器1を備え、試験具4を試験容器1に挿入することによって検査を行う構成を例示したが、このような構成に限らず、試験容器1を備えない構成であってもよい。例えば、検体処理液15によって調製された測定試料13を試料添加用部材5に直接に滴下するように構成してもよい。このように構成する場合には、試験具4を、例えば、試料添加用部材5、クロマト用担体9および吸収部材11に対応する位置に開口を有するケースに収容した構成とすることが好ましい。このような構成の試験具4の一例を図5に示す。図5に示すように、試験具4をケース40に収容することにより、試験具4の各部材から測定試料が漏れ出ることを防止でき、衛生的に検査を行うことができる。加えて、ケース40に設けられた複数の開口によって、測定試料13に含まれる液体成分が蒸発し易くなり、測定試料の展開が促進される。
なお、図5に示した構成においては、ケース40の試料添加用部材5に対応する位置に設けられた開口50は、内側に向かって開口面積が小さくなるように、いわゆるテーパー状に形成されている。このような構成により、試料用添加部材5に滴下された測定試料は、開口50に一定量貯留されるため、過剰に測定試料を滴下したとしても、測定試料が試験具4から溢れにくくなっている。また、測定試料が一定量貯留されることにより、貯留された測定試料が試験具4上を順次展開していくため、少量の測定試料を定期的に滴下する手間が省け、検査を簡便に行うことができる。
【0061】
以上においては、ラテラルフロー式メンブレンアッセイ用試験キットについて説明したが、本実施形態による抗麻疹モノクローナル抗体は、フロースルー式メンブレンアッセイ用試験キットに適用することも可能である。以下、図面を参照しながら、フロースルー式メンブレンアッセイ用試験キットについて説明する。
【0062】
図6は、第2の実施形態によるメンブレンアッセイ用試験キットを示す図である。この試験キットは、フロースルー式メンブレンアッセイ法に用いられる試験キットであって、試験具31と、検体と混合して測定試料を調製するための検体処理液37を収容する検体処理容器36とを備える。
【0063】
図7(a)は、試験具31の平面図、図7(b)は、X−X矢視断面図である。試験具31は、下層から順に吸収部材35と、膜担体34と、カバー部材32とを備え、これらが積層されて構成されている。カバー部材32は開口33を有し、この開口33を介して、下層に配置された膜担体34の判定部34Aが露出されるように構成されている。判定部34Aには、捕捉用抗体が担持されている。
【0064】
検体処理容器36は、第1の実施形態における検体処理容器14と同様の構成である。検体処理容器36に収容された検体処理液37は、第1の実施形態における検体処理液15と同様の成分を含み、さらに本実施形態における検体処理液37は、標識化抗体を含有している。
【0065】
次に、本実施形態による試験キットの使用方法について説明する。
まず、第1の実施形態において説明したように、検体を検体処理液37に懸濁し、測定試料を調製する。検体に麻疹ウイルスが含まれていると、検体処理液37に含まれる標識化抗体と麻疹ウイルスとが抗原抗体反応により結合し、測定試料中に麻疹ウイルス−標識化抗体からなる複合体が形成される。
次に、調製された測定試料を、第1の実施形態において説明した手順と同様にして、試験具31の開口33に所定量滴下する。この状態で20分程度放置すると、測定試料が膜担体34を通過し、その下層に配置された吸収部材35によって吸収される。測定試料に麻疹ウイルスが含まれていると、膜担体34の判定部34Aに担持された捕捉用抗体が、標識化抗体と麻疹ウイルスとの結合部位と異なる部位を認識して麻疹ウイルスに結合し、判定部34A上に標識化抗体−麻疹ウイルス−捕捉用抗体からなる複合体が形成される。これにより、判定部34Aに青色のラインが現れる。よって、判定部34Aに青色のラインが現れたか否かを目視で判定することにより、麻疹ウイルスの存在を知ることができる。
【0066】
なお、本実施形態においては、標識化抗体を検体処理液37と同じ容器に収容した構成について説明したが、このような構成に限られない。例えば、標識化抗体と検体処理液37とを別々の容器に収容した構成であってもよい。また、例えば、標識化抗体を測定試料に含まれる液体成分によって遊離可能に膜担体34に保持させた構成であってもよい。
【0067】
以上説明したように、本実施形態によれば、抗麻疹モノクローナル抗体を用いて簡便且つ迅速に麻疹ウイルスを検出可能な試験キットを提供することができる。さらに、第1の実施形態によるメンブレンアッセイ用試験キットであれば、試験容器1と、試験具4と、検体処理容器14とによって、第2の実施形態によるメンブレンアッセイ用試験キットであれば、試験具31と、検体処理容器36とによって、少ない部品点数で麻疹ウイルスを検出することができ、簡便に検査を行うことができる。
【実施例】
【0068】
1.モノクローナル抗体の作製
1−1.麻疹ウイルス核タンパク質の作製
野生の各麻疹ウイルス株より抽出したRNAから、逆転写反応によって、cDNAを合成した。合成した各cDNAから、ポリメラーゼ連鎖反応(PCR)によって、麻疹ウイルス核タンパク質のDNA産物を合成し、小麦胚芽無細胞発現用試薬キット ENDEXT(登録商標)Wheat Germ Expression TRI-GG Kit(セルフリーサイエンス社)を用いて、キット付属のベクターにDNA産物を組み込み、麻疹ウイルス核タンパク質を発現させ、抗原液を作製した。シークエンサー(Applied Biosystems社製)及び配列解析ソフト(日立ソフト社製)を用いて、遺伝子配列解析及び予測アミノ酸配列解析を行った。ここで得られた麻疹ウイルス核タンパク質のアミノ酸配列を、配列表の配列番号1〜9に示す。以下、配列番号1のアミノ酸配列からなる麻疹ウイルス核タンパク質をAg1、配列番号2のアミノ酸配列からなる麻疹ウイルス核タンパク質を麻疹抗原Ag2というように、配列番号Nのアミノ酸配列からなる麻疹ウイルス核タンパク質をAgNと呼称する。
1−2.マウスの免疫
Advanced Biotechnologies Inc.(以下ABI社)より入手した麻疹ウイルス株(商品名:Rubeola (Measles) Virus Infected Cell Extract)60μgを含有するリン酸緩衝液(PBS)100μLにフロイント完全アジュバント(FCA)100μlを添加し、乳化させた後、FCA混合麻疹ウイルス抗原溶液を200μLを調製した。また、FCAではなくフロイント不完全アジュバント(FIA)を用いること以外は同様にしてFIA混合麻疹ウイルス抗原溶液200μLを作製した。
FCA混合麻疹ウイルス抗原溶液200μLを7週齢の雌Balb/cマウスに腹腔内投与することにより初回免疫した。初回免疫後、二週間毎にFIA混合麻疹ウイルス抗原溶液200μLを用いて追加免疫を行った。最終免疫は、アジュバントを使用せず、ABI社麻疹ウイルス株に代えて、1−1.において作製されたAg5を50μg含有するPBS500μLを静脈注射することにより行った(免疫実験1)。
【0069】
免疫用抗原として、ABI社麻疹ウイルス株に代えて1−1.において作製されたAg5もしくはAg8を使用した点を除いては上記免疫実験1と同様にして、マウスへの免疫を行った(免疫実験2)。
【0070】
最終免疫から4日後に脾細胞を分離し、P3X63−Ag8・653マウス骨髄腫細胞とPEG法により融合させ、ハイブリドーマを作製した。
【0071】
1−2.ハイブリドーマの培養
ハイブリドーマを2.5×106cells/mLとなるようにHAT培地に懸濁させ、96穴プレート(コーニング社製;以下、培養用プレートとする)の各ウェルに2.5×105cell/wellとなるように分注した。培養用プレートを37度、8%CO2の恒温槽内に静置し、ハイブリドーマの培養を開始した。翌日、HAT培地を25μLずつ培養用プレートの各ウェルに添加し、さらに培養を継続した。10日間培養してハイブリドーマのコロニーを出現させたところで、モノクローナル抗体を産生するハイブリドーマのスクリーニングを行った。
【0072】
1−3.ハイブリドーマのスクリーニング
0.1w/v%NaN3を含む0.1M リン酸緩衝液(PBS, pH7.5)に、タンパク質濃度が0.5μg/mLとなるように希釈した麻疹ウイルス(ABI社製)を添加し、感作用麻疹ウイルス溶液を調製した。この感作用麻疹ウイルス溶液100μLを96穴プレート(NUNC社製)の各ウェルに分注した(以下、抗原固定プレートとする)。4度で一晩静置した後、0.05%の濃度でTween20を含むPBS(以下、第1緩衝液とする)で三回洗浄した。洗浄後、抗原固定プレートの各ウェルに1w/v%の濃度でBSAを含むPBS(以下、第2緩衝液とする)300μLを添加し、2〜8℃で4時間以上静置保存した。抗原固定プレートは使用時まで2〜8℃で保存した。
【0073】
第2緩衝液を抗原固定プレートの各ウェルに75μLずつ添加し、1−3.で作製したハイブリドーマ培養上清を培養用プレートの各ウェルから取り出し、抗原固定プレートの各ウェルに25μLずつ添加した。第2緩衝液及び培養上清添加後、室温で一時間インキュベートした。インキュベート後、300μLの第1緩衝液で抗原固定プレートの各ウェルを洗浄した。洗浄後、第2緩衝液で10000倍希釈したセイヨウワサビペルオキシダーゼ標識抗マウスIgポリクローナル抗体(DAKO社製;Code No. P0447)を抗原固定プレートの各ウェルに100μLずつ添加した。室温で30分間反応させた後、300μLの第1緩衝液で抗原固定プレートの各ウェルを洗浄した。洗浄後、PODに対する基質であるオルトフェニレンジアミン(OPD)を含む基質液を100μLずつ加え、室温で10分間静置した。ついで、2N H2SO4を含む反応停止液を抗原固定プレートの各ウェルに100μLずつ加えた後、各ウェル中の反応液について、マイクロプレートリーダ(Molecular Devices社製)を用いて、492nmの吸光度を測定した。
その結果、作製されたハイブリドーマが、抗麻疹モノクローナル抗体を産生していることが確認された。
【0074】
2.抗麻疹モノクローナル抗体の反応性の確認
上記1.において作製されたハイブリドーマによって産生された抗麻疹モノクローナル抗体の反応性を以下の実験によって確認した。
【0075】
2−1.反応性試験
1−1.において作製されたAg1〜Ag9を含む抗原液を、それぞれ第2緩衝液によって10倍に希釈した。
市販の抗マウスIgG抗体と、セファロースビーズ(Amersham Biosciences社製)とを結合させた粒子を15v/v%の濃度で含有するセファロースビーズ−抗マウスIgG抗体懸濁液を調製した。このセファローズビーズ−抗マウスIgG抗体懸濁液と、Ag1〜Ag9を含む抗原液をそれぞれ第2緩衝液で0.2〜0.5μg/mLに希釈した抗原希釈液と、第2緩衝液とを等量で混合し、抗原試料調製した。
【0076】
96穴V字プレート(サンプラテック社製)の各ウェルに、抗原試料60μLと、本実施例による抗麻疹ウイルスモノクローナル抗体を第2緩衝液で1.0μg/mLの濃度に希釈した抗体液を30μLずつ加え、室温で60分間攪拌させたのち、10分間静置し、セファロースビーズを沈降させた。
【0077】
次に、以下の要領で、抗麻疹ウイルスモノクローナル抗体が感作されたマイクロタイタープレートを調製した。マイクロタイタープレートに感作される抗麻疹ウイルスモノクローナル抗体として、ハイブリドーマMV1−225によって産生される225抗体を用いた。
225抗体液を、0.1w/v%NaN3を含む0.1M リン酸緩衝液(PBS, pH7.5)によって10μg/mL濃度に希釈し、この225抗体希釈溶液をマイクロタイタープレート(NUNC社製)の各ウェルに100μLずつ分注し、4℃で一晩静置した。第1緩衝液を用いて各ウェルを3回洗浄したのち、各ウェルに第2緩衝液を300μLずつ分注して、ブロッキングした(以下、このマイクロタイタープレートを225抗体感作プレートと呼称する)。ブロッキング後、2〜8℃で4時間以上静置保存した。225抗体感作プレートは使用時まで2〜8℃で保存した。
なお、ハイブリドーマMV1−225は、シスメックス株式会社によって独立行政法人製品評価技術基盤機構特許微生物寄託センターに寄託されており、受領番号NITE BP-599が付与されている(受託日:2009年7月22日)。
【0078】
次に、ビオチン標識された抗麻疹ウイルスモノクローナル抗体液が0.25μg/mlとなるように、また、ストレプトアビジン標識化ペルオキシダーゼ(POD)溶液が40mU/mlとなるように第2緩衝液にて混合し、POD標識化抗体液を調製した。
ビオチン標識される抗麻疹ウイルスモノクローナル抗体として、ハイブリドーマMV1−1117によって産生される1117抗体を用いた。ハイブリドーマMV1−1117は、シスメックス株式会社によって独立行政法人製品評価技術基盤機構特許微生物寄託センターに寄託されており、受領番号NITE NP−600が付与されている(受託日:2009年7月22日)。
【0079】
225抗体感作プレート中の第2緩衝液を除去した。除去後、上述のPOD標識化抗体液50μLおよび96穴V字プレートの反応液の上清50μLを、225抗体感作プレートの各ウェルに加え、60分間攪拌させた。その後、225抗体感作プレートの各ウェルを、第2緩衝液で3回洗浄した。
このとき、本実施例による抗麻疹ウイルスモノクローナル抗体の抗原に対する反応性によって、96穴V字プレートの反応液の上清に抗原が含まれる場合と、含まれない場合とがありうる。
すなわち、本実施例による抗麻疹ウイルスモノクローナル抗体が抗原に対して反応性がある(抗体と抗原とが結合している)場合には、反応液中にはセファロースビーズ−抗マウスIgG−抗麻疹モノクローナル抗体−抗原からなる複合体が形成される。この複合体は、セファロースビーズの重みによって96穴V字プレートのウェルにおいて沈降するため、上清には抗原が含まれない。一方、本実施例による抗麻疹ウイルスモノクローナル抗体が抗原に対して反応性がない(抗体と抗原とが結合していない)場合には、反応液中に上記のような複合体は形成されず抗原が沈降しないため、上清には抗原が含まれることになる。
よって、本実施例による抗麻疹ウイルスモノクローナル抗体が抗原に対して反応性を示さなかった場合には、上記の操作によって225抗体−抗原−POD標識化抗体からなる複合体が225抗体感作プレートのウェルに形成され、反応性を示した場合には、上記複合体は形成されない。
【0080】
ついで225抗体感作プレートの各ウェルに、PODに対する基質であるOPDを含む基質液を100μLずつ加え、室温で10分間静置した。その後、反応停止液(2N H2SO4を含む)を225抗体感作プレートの各ウェルに100μLずつ加え、各ウェル中の反応液の吸光度をマイクロプレートリーダ(Molecular Devices社製)を用いて492nmの吸光度を測定した。ここで得られた吸光度を吸光度Aとする。
なお、上記の説明から明らかなように、吸光度Aは225抗体感作プレートのウェル上の複合体の有無を示している。すなわち、吸光度が低いほど複合体が少なく、本実施例による抗麻疹ウイルスモノクローナル抗体と抗原との反応性が高いことを示す。
【0081】
対照実験として、1.0μg/mL抗体液に換えて第2緩衝液を用いた対照試料を調製し、同様の実験を行って吸光度を測定した。ここで得られた吸光度を吸光度Bとする。
また、対照実験として、1.0μg/mL抗体液と抗原試料に換えて第2緩衝液を用いた対照試料を調製し、同様の実験を行って吸光度を測定した。ここで得られた吸光度を吸光度Cとする。
【0082】
得られた吸光度A〜Cを用いて、下記式(1)により、本実施例によって得られた抗麻疹ウイルスモノクローナル抗体を用いて得られた測定試料の吸光率を求めた。得られた吸光率を表1に、吸光率に基づく反応性の評価結果を表2に示した。表2において、「+++」は式(1)によって求められる吸光率が90%以上、「++」は50%以上、「+」は30%以上、「−」は30%であることを示している。
吸収率(%)={1−(A−C)/(B−C)}×100 ・・・(1)
【0083】
【表1】

【0084】
【表2】

【0085】
表1および表2に示したとおり、本実施例によって得られた2649抗体、3707抗体、3241抗体および320抗体のいずれも、麻疹ウイルス核タンパク質Ag1〜Ag9の全てに対して高い反応性を示した。
この結果から、本実施例による抗麻疹ウイルスモノクローナル抗体は、麻疹ウイルス核タンパク質に結合可能であり、且つ、核タンパク質のアミノ酸配列の一部の置換変異によっては結合能が変化しないことがわかった。
【0086】
3.抗麻疹ウイルスモノクローナル抗体の麻疹ウイルス抗原に対する結合部位のスクリーニング
本実施例による抗麻疹ウイルスモノクローナル抗体の麻疹ウイルス核タンパク質に対する結合部位を、以下の実験によって確認した。
【0087】
3−1.抗原試料の調製
上記1−1.において調製された麻疹ウイルス核タンパク質Ag3を含む抗原液を第2緩衝液によって0.15μg/mLに希釈し、Ag3を含む抗原試料を調製した。
【0088】
3−2.阻害試験
上記2−1.において記載した要領と同様にして、225抗体感作プレートを作製した。この225抗体感作プレートの各ウェルに、Ag3を含む抗原試料100μLを加え、30分間攪拌した。その後、225抗体感作プレートの各ウェルを、第1緩衝液で3回洗浄した。
【0089】
ビオチン標識された3707抗体溶液が0.5μg/mlとなるように、また、ストレプトアビジン標識化ペルオキシダーゼ(POD)溶液が40mU/mlとなるように第2緩衝液にて混合し、POD標識化抗体液を調製した。
【0090】
225抗体感作プレートの各ウェルに、本実施例によって得られた2649抗体を第2緩衝液で10μg/mLの濃度に希釈した抗体液50μLと、上述のPOD標識抗体液50μLとを加え、室温で60分間攪拌した。攪拌したのち、225抗体感作プレートを第1緩衝液で3回洗浄した。
【0091】
ついで、225抗体感作プレートの各ウェルに、OPDを含む基質液を100μLずつ加え、室温で10分間静置した。反応停止液(2N H2SO4を含む)を225抗体感作プレートの各ウェルに100μLずつ加えたのち、マイクロプレートリーダを用いて、492nmの吸光度を測定した。ここで得られた吸光度を吸光度Dとする。
【0092】
対照実験として、10μg/mL抗体液に換えて第2緩衝液を用いた対照試料を調製し、同様の実験を行って吸光度を測定した。ここで得られた吸光度を吸光度Eとする。
また、対照実験として、10μg/mL抗体液と抗原試料に換えて第2緩衝液を用いた対照試料を調製し、同様の実験を行って吸光度を測定した。ここで得られた吸光度を吸光度Fとする。
【0093】
得られた吸光度D〜Fを用いて、下記式(2)により、上記実験例における測定試料の吸光率を求めた。そして、得られた吸光率に基づいて、2649抗体および3707抗体の、麻疹ウイルス核タンパク質に対する結合部位の相同性を評価した。
得られた吸光率を表3に、吸光率に基づく相同性の評価結果を表4に示した。表4において、「+++」は式(2)によって求められる吸光率が90%以上、「++」は50%以上、「+」は30%以上、「−」は30%であることを示している。
なお、上記実験例を例にとれば、(2)によって求められる吸光率が高ければ高いほど、2649抗体と3707抗体の、麻疹ウイルス核タンパク質に対する結合部位の相同性が高いことを意味する。
吸収率(%)={1−(D−F)/(E−F)}×100 ・・・(2)
【0094】
この実験は、上記実験例における10μg/mLの抗体液に含まれる抗体と、ビオチン標識される抗体との組み合わせを、2649抗体、3707抗体、3241抗体および320抗体の中から選択されうるすべての組み合わせについて行った。
【0095】
【表3】

【0096】
【表4】

【0097】
表3および表4の結果から、2649抗体と3707抗体とは、麻疹ウイルス核タンパク質に対する結合部位の相同性が低く、両抗体は、麻疹ウイルス核タンパク質の異なる部位を認識して結合しうる抗体であることが示唆された。また、2649抗体と3241抗体の組み合わせ、320抗体と3707抗体との組み合わせ、320抗体と3241抗体との組み合わせについても同様のことが示唆された。
【0098】
以上の結果から、本実施例による抗麻疹ウイルスモノクローナル抗体を、特定の組み合わせにしたがって用いることにより、抗麻疹ウイルスモノクローナル抗体を麻疹ウイルス核タンパク質の互いに異なる第1の結合部位と第2の結合部位とに結合させることができ、サンドイッチ法によって麻疹ウイルスを検出できることが示唆された。
【0099】
4.試験具の作製
本実施例による抗麻疹ウイルスモノクローナル抗体を用いて、図1に示されるようなラテラルフロー式メンブレンアッセイ用試験具を作製した。
試験具1
標識保持部材7に保持される第1のモノクローナル抗体として、320抗体を使用した。クロマト用膜担体9の判定部9Aに担持される第2モノクローナル抗体として、2649抗体と3707抗体を使用した。
まず、図1に示すように、ニトロセルロースメンブレンからなるクロマト用膜担体9の判定部9Aに、リン酸緩衝液(pH7.0)で2.0mg IgG/mLの濃度になるように希釈した3707抗体を含む抗体液を、抗体塗布機(BioDot社)を用いて1mm幅で塗布し、さらに1mm位置をずらして、同様に2649抗体を含む抗体液を塗布し、50℃で30分間乾燥させた。
乾燥後のクロマト用膜担体9をBSAを含有するリン酸緩衝液(pH7.0)に浸漬し、クロマト用膜担体9上に抗体を固定した。その後、洗浄液(SDSを含有するリン酸緩衝液(pH7.0))で洗浄し、40℃で120分間乾燥させ、クロマト用膜担体9を得た。
【0100】
次に、320抗体を青色着色ポリスチレンラテックス粒子(粒径0.3μm)に感作し、分散用緩衝液(BSA及びシュークロースを含有するリン酸緩衝液(pH7.0))に懸濁し、320抗体感作ラテックス粒子懸濁液を作製した。320抗体の濃度は、1%ラテックス粒子懸濁液1mL中に200μg IgGとなる濃度とした。この320抗体感作ラテックス粒子懸濁液を、ガラス繊維製パッドに添加後、真空乾燥機で乾燥させ、標識保持部材7を得た。
試料添加部材5、吸収部材11、および基材12については、上記実施形態において説明したとおりの部材を使用して、試験具1を得た。
クロマト用膜担体9の判定部9Aに担持される抗体として、3707抗体に代えて3241抗体を用いた点を除いては上記と同様にして、試験具2を得た。
【0101】
5.性能試験
5−1.培養麻疹ウイルスの検出実験
4.において作製された試験具1および試験具2を使用して、試料中の麻疹ウイルスを検出する実験を行った。
本試験例では、下記の表5に示した2種類の野生型麻疹ウイルスをVero/SLAM細胞にて培養し、得られたウイルスを1%BSAを含有するリン酸ナトリウム緩衝液で希釈したものをウイルス液として用いた。なお、IC−B株およびEdmonston株は、いずれも野生型の麻疹ウイルス株であり、IC−B株のアミノ酸配列は配列番号10に示したとおりである。また、Edmonston株のアミノ酸配列は、配列番号9によって示されたものと同じである。
ウイルス液中のウイルス濃度は、プラーク法によって定量し、その定量値をPFUで表す。各ウイルス液中のウイルス濃度は、表5に示したとおりである。PFU(plaque-forming unit)は、100%コンフルエントの細胞にウイルスを感染させ、感染させた細胞が作るプラークによって確認できるウイルス感染細胞数から算出されたウイルス数を表す単位である。なお、表5にはおいては、PFUを対数表示によって表記してある。
【0102】
次に、0.3w/v% NP−40(ポリオキシエチレン(9)オクチルフェニルエーテル)を含むリン酸緩衝液(pH7.3) 800μLに、所定濃度のウイルス液150μLを加えて混合し、抗原試料とした。
抗原試料約200μLをガラス試験管に滴下し、このガラス試験管に上記方法で作製した試験具1の上流(試料添加部材1)側を浸漬した状態で約10分間静置した。その後、判定部9Aにおけるラテックス粒子による呈色を肉眼で判定した。判定は、呈色が認められたものを(+)、呈色が認められなかったものを(−)として評価した。これらの結果を表5に示す。
【0103】
【表5】

【0104】
表5に示したように、抗原試料中のウイルス濃度が所定濃度以上である場合には、試験具1および試験具2のいずれの判定部9Aにも呈色が認められ、麻疹ウイルスを検出することができた。以上より、本実施形態によるメンブレンアッセイ用試験キットによれば、麻疹ウイルスを確実に検出でき、さらに野生型の麻疹ウイルスをも検出できることが実証された。
【0105】
5−2.患者検体の麻疹ウイルス検出実験
4.において作製された試験具1および試験具2を使用して、患者から採取された検体中の麻疹ウイルスを検出する実験を行った。
なお、5−1.においては、判定部9Aに塗布される2種類の抗体液を、別々の位置に塗布して得られた試験具を使用したが、本実験例においては、2種類の抗体液を混合して得られたものを判定部9Aに塗布することにより試験具を作製し、使用した。
【0106】
RT−PCR法によるスクリーニングにより麻疹感染陽性と判定された各患者から、綿棒を用いて咽頭拭い液を採取した。この綿棒を1w/v%SDS溶液75μLに浸漬して、咽頭拭い液をSDS溶液に溶出させた。
溶液中のウイルス濃度は、リアルタイムPCR法によって得られたCt値を、5−1.に記載の方法で定量した濃度既知試料のCT値と比較することにより算出した。
【0107】
ついで、0.3w/v% NP−40(ポリオキシエチレン(9)オクチルフェニルエーテル)を含むリン酸緩衝液(pH7.3) 800μLに、上記のSDS溶液を添加して混合し、抗原試料とした。
この抗原試料を用いて、5−1.に記載の手順および判定条件に基づいて、判定部9Aにおけるラテックス粒子による呈色を判定した。これらの判定結果を表6に示す。
【0108】
【表6】

【0109】
表6に示したとおり、本実施例によって作製された試験具1および試験具2のいずれによっても、患者検体すべてにおいて麻疹ウイルスを検出することができた。
この結果から、本実施例による試験具によって、患者検体中の麻疹ウイルスを確実に検出できることが実証された。また、この結果から、患者から検体を採取して測定試料を調製し、この測定試料とメンブレンアッセイ用試験具とを用いることにより、肉眼での判定という簡便な方法により、麻疹ウイルスを検出できることが実証された。
【0110】
6.エピトープ解析
本実施例による抗麻疹ウイルスモノクローナル抗体の麻疹ウイルス核タンパク質に対する抗原認識部位を、以下の実験によって確認した。
【0111】
6−1.麻疹ウイルス部位欠損核タンパク質の作製
グルタチオン S−トランスフェラーゼ(以下、GSTと呼称する)融合タンパク質発現用ベクターpGEX−4T−3(GEヘルスケア社製)から、制限酵素NotIによる認識配列(以下、NotI配列と呼称する)を含む配列番号1のプライマーと、制限酵素BamHIによる認識配列(以下、BamHI配列と呼称する)を含む配列番号2のプライマーとを用いてポリメラーゼ連鎖反応(PCR)を行い、GST配列の上流側にNotI配列を、下流側にBamHI配列を組み込んだcDNAを合成した。
【0112】
合成されたcDNAを制限酵素NotIおよび制限酵素BamHIで処理した。同様に、小麦胚芽無細胞発現用試薬キット ENDEXT(登録商標)Wheat Germ Expression TRI−GG Kit(セルフリーサイエンス社)付属のベクターを、制限酵素NotIおよび制限酵素BamHIで処理した。
【0113】
得られた制限酵素処理産物同士をライゲーションし、GST配列を含む小麦胚芽無細胞発現用ベクターを構築した。
【0114】
麻疹ウイルスのEdomonston株より抽出したRNAから、逆転写反応によって、cDNAを合成した。合成した麻疹ウイルスcDNAから、制限酵素XhoIによる認識配列(以下、XhoI配列と呼称する)を含む配列番号3のプライマーと、配列番号4のプライマーとを用いてPCRを行った。ついで、得られたPCR産物を鋳型として、配列番号3のプライマーと、NotI配列を含む配列番号5のプライマーとを用いてPCRを行った。これにより、麻疹ウイルス核タンパク質の配列の上流側にXhoI配列を含み、下流側にNotI配列を含むDNA産物が合成された。
【0115】
合成されたDNA産物を制限酵素XhoIおよび制限酵素NotIで処理した。同様に、GST配列を含む小麦胚芽無細胞発現用ベクターを、制限酵素XhoIおよび制限酵素NotIで処理した。得られた制限酵素処理産物同士をライゲーションし、麻疹ウイルス核タンパク質配列およびGST配列を含む小麦胚芽無細胞発現用ベクター(以下、全長核タンパク質発現ベクターと呼称する)を構築した。構築した全長核タンパク質発現ベクターから、小麦胚芽無細胞発現用試薬キット ENDEXT(登録商標)Wheat Germ Expression TRI−GG Kit(セルフリーサイエンス社)を用いて、核タンパク質全長を発現させた。
【0116】
2649抗体、3707抗体、3241抗体および320抗体の抗原認識部位解析のために、麻疹ウイルス核タンパク質全長からC末端を除去した、部位欠損核タンパク質Truncate−1〜4を、以下に記載の方法によって作製した。作製した部位欠損核タンパク質を模式的に図9に示す。
【0117】
核タンパク質全長発現ベクターを基に、配列番号6のプライマーと、配列番号7のプライマーと、KOD plus Mutagenesis Kit(東洋紡社製)とを用いて、麻疹ウイルス核タンパク質の399位からC末端(525位)までのアミノ酸を除くプラスミド全周を増幅し、Truncate−1発現用ベクターを構築した。構築したTruncate−1発現用ベクターから、小麦胚芽無細胞発現用試薬キット ENDEXT(登録商標)Wheat Germ Expression TRI−GG Kit(セルフリーサイエンス社)を用いて、Truncate−1を発現させた。これにより、399位からC末端までのアミノ酸が欠損した核タンパク質が得られた。
【0118】
Truncate−2は、配列番号7のプライマーに代えて、配列番号8のプライマーを用いた点を除いては、Truncate−1と同様の手法によって得られた。これにより麻疹ウイルス核タンパク質の321位からC末端までのアミノ酸が欠損した核タンパク質が得られた。
【0119】
Truncate−3は、配列番号7のプライマーに代えて、配列番号9のプライマーを用いた点を除いては、Truncate−1と同様の手法によって得られた。これにより麻疹ウイルス核タンパク質の242位からC末端までのアミノ酸が欠損した核タンパク質が得られた。
【0120】
Truncate−3は、配列番号7のプライマーに代えて、配列番号10のプライマーを用いた点を除いては、Truncate−1と同様の手法によって得られた。これにより麻疹ウイルス核タンパク質の135位からC末端までのアミノ酸が欠損した核タンパク質が得られた。
【0121】
つぎに、核タンパク質のN末端から398位のアミノ酸までを欠損したTrancate−5を作製した。
【0122】
Truncate−5は、配列番号3のプライマーに代えて、配列番号11のプライマーを用いた点を除いて、上述の核タンパク質全長発現ベクターの作製およびベクターの発現と同様の手法により得られた。なお、配列番号11のプライマーは、麻疹ウイルス核タンパク質のcDNAの1195塩基から下流の塩基配列に対応するプライマーであって、XhoI配列を含むプライマーである。
【0123】
さらに詳細な2649抗体、3707抗体、3241抗体および320抗体の抗原認識部位解析のために、部位欠損核タンパク質Truncate−6〜14を作製した。作製した部位欠損核タンパク質を図9に示す。
【0124】
核タンパク質全長発現ベクターを基に、配列番号12のプライマーと配列番号13のプライマーとを用いて、KOD plus Mutagenesis Kit(東洋紡社製)の用法にしたがって麻疹ウイルス核タンパク質のN末端から44位までのアミノ酸を除くプラスミド全周を増幅し、Truncate−6発現用ベクターを構築した。構築したTruncate−6発現用ベクターから、小麦胚芽無細胞発現用試薬キット ENDEXT(登録商標)Wheat Germ Expression TRI−GG Kit(セルフリーサイエンス社)を用いて、Truncate−6を発現させた。これにより、N末端から44位までのアミノ酸が欠損した核タンパク質が得られた。
【0125】
Truncate−7は、配列番号12のプライマーに代えて、配列番号14のプライマーを用い、配列番号13のプライマーに代えて配列番号15のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の45位から90位までのアミノ酸が欠損した核タンパク質が得られた。
【0126】
Truncate−8は、配列番号12のプライマーに代えて、配列番号16のプライマーを用い、配列番号13のプライマーに代えて配列番号17のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の91位から134位までのアミノ酸が欠損した核タンパク質が得られた。
【0127】
Truncate−9は、配列番号12のプライマーに代えて、配列番号18のプライマーを用い、配列番号13のプライマーに代えて配列番号10のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の135位から170位までのアミノ酸が欠損した核タンパク質が得られた。
【0128】
Truncate−10は、配列番号12のプライマーに代えて、配列番号19のプライマーを用い、配列番号13のプライマーに代えて配列番号20のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の171位から206位までのアミノ酸が欠損した核タンパク質が得られた。
【0129】
Truncate−11は、配列番号12のプライマーに代えて、配列番号21のプライマーを用い、配列番号13のプライマーに代えて配列番号22のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の207位から241位までのアミノ酸が欠損した核タンパク質が得られた。
【0130】
Truncate−12は、配列番号12のプライマーに代えて、配列番号23のプライマーを用い、配列番号13のプライマーに代えて配列番号7のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の399位から441位までのアミノ酸が欠損した核タンパク質が得られた。
【0131】
Truncate−13は、配列番号12のプライマーに代えて、配列番号24のプライマーを用い、配列番号13のプライマーに代えて配列番号25のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の442位から484位までのアミノ酸が欠損した核タンパク質が得られた。
【0132】
Truncate−14は、配列番号12のプライマーに代えて、配列番号6のプライマーを用い、配列番号13のプライマーに代えて配列番号26のプライマーを用いた点を除いては、Truncate−6と同様の手法によって得られた。これにより、麻疹ウイルス核タンパク質の485位から525位までのアミノ酸が欠損した核タンパク質が得られた。
【0133】
得られた全長核タンパク質およびTrancate1〜14を、Glutation Sepharose 4B 50%(GEヘルスケア社製)を用いて、GST結合タンパク質として精製した。
【0134】
陰性コントロールとして、小麦胚芽無細胞発現キット付属のベクターにGST配列を付加したプラスミドを組み込み、転写・翻訳した後、タンパク質を精製した。得られたタンパク質を抗原認識部位の陰性コントロールとした。
【0135】
6−2.抗原認識部位の解析
上記6−1.において調製された全長核タンパク質およびTrancate1〜14の各抗原液を第2緩衝液によって希釈し、抗原試料を調製した。
【0136】
以下の要領で、抗GST抗体(GEヘルスケア社製)が感作されたマイクロタイタープレートを調製した。
【0137】
抗GST抗体液を、0.1w/v%NaN3を含む0.1M リン酸緩衝液(PBS, pH7.5)によって5μg/mL濃度に希釈し、この抗GST抗体希釈溶液をマイクロタイタープレート(NUNC社製)の各ウェルに50μLずつ分注し、4℃で一晩静置した。第1緩衝液を用いて各ウェルを3回洗浄したのち、各ウェルに第2緩衝液を300μLずつ分注して、ブロッキングした(以下、このマイクロタイタープレートを抗GST抗体感作プレートと呼称する)。ブロッキング後、2〜8℃で4時間以上静置保存した。抗GST抗体感作プレートは使用時まで2〜8℃で保存した。
【0138】
抗GST抗体感作プレート中の第2緩衝液を除去した。除去後、上述の核タンパク質全長およびTrancate1〜14の各抗原試料50μLを、抗GST抗体感作プレートの各ウェルに加え、30分間攪拌させた。その後、抗GST抗体感作プレートの各ウェルを、第2緩衝液で3回洗浄した。
【0139】
次に、2649抗体、3707抗体、3241抗体および320抗体が10μg/mlとなるように第2緩衝液にて希釈し、各抗体反応液を調製した。各抗体反応液50μLを、抗GST抗体感作プレートの各ウェルに加え、30分間攪拌させた。その後、抗GST抗体感作プレートの各ウェルを、第2緩衝液で3回洗浄した。
【0140】
ペルオキシダーゼ(POD)結合抗マウスIgG抗体(DAKO Cytomation社製)溶液が20mU/mlとなるように第2緩衝液にて希釈し、POD結合抗マウスIgG抗体液を調製した。POD結合抗マウスIgG抗体液50μLを、抗GST抗体感作プレートの各ウェルに加え、30分間攪拌させた。その後、抗GST抗体感作プレートの各ウェルを、第2緩衝液で3回洗浄した。
【0141】
ついで、抗GST抗体感作プレートの各ウェルに、OPDを含む基質液を100μLずつ加え、室温で10分間静置した。反応停止液(2N H2SO4を含む)を抗GST抗体感作プレートの各ウェルに100μLずつ加えたのち、マイクロプレートリーダを用いて、492nmの吸光度を測定した。
【0142】
得られた吸光度を表7に、吸光度に基づく各抗体の核タンパク質全長およびTrancate1〜14の各抗原に対する評価結果を表8に示した。表8において、「+++」は吸光度が1.5以上、「++」は0.5以上且つ1.5未満、「+」は陰性コントロールの3SDの値以上0.5未満、「−」は陰性コントロールの3SD以下であることを示している。
【0143】
【表7−1】

【0144】
【表7−2】

【0145】
【表7−3】

【0146】
【表7−4】

【0147】
【表8−1】

【0148】
【表8−2】

【0149】
【表8−3】

【0150】
表7および表8の結果から、2649抗体は、麻疹ウイルス核タンパク質の135残基から241残基のアミノ酸配列を認識して結合することが示唆された。3707抗体と3241抗体は、麻疹ウイルス核タンパク質の485残基から525残基のアミノ酸配列を認識して結合することが示唆された。さらに、320抗体は、麻疹ウイルス核タンパク質の91残基から134残基のアミノ酸配列を認識することが実証された。
【符号の説明】
【0151】
1 試験容器
1a 試験容器底部
1b 開口
3 ラベル
4 メンブレンアッセイ用試験具
4a 試験具の一端
5 試料添加用部材
7 標識保持部材
9 クロマトグラフィー用膜担体
9A 判定部
9B 対照部
11 吸収部材
12 基材
13 試料
14 検体処理容器
15 検体処理液
31 試験具
32 カバー部材
33 開口
34 膜担体
34A 判定部
35 吸収部材
【特許請求の範囲】
【請求項1】
麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体と、麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し、且つ標識された第2のモノクローナル抗体とを用いて、検体に含まれる麻疹ウイルスを検出する麻疹ウイルス検出方法。
【請求項2】
検体と、非イオン性界面活性剤を含む検体処理液とを混合して測定試料を調製する工程をさらに備え、
調製された測定試料に含まれる麻疹ウイルスを検出する請求項1に記載の麻疹ウイルス検出方法。
【請求項3】
検体が、唾液、鼻汁、鼻腔拭い液、鼻腔吸引液および咽頭拭い液からなる群から選択される請求項1又は2に記載の麻疹ウイルス検出方法。
【請求項4】
第1のモノクローナル抗体及び第2のモノクローナル抗体が、麻疹ウイルス核タンパク質の135位から241位のアミノ酸配列を認識して結合するモノクローナル抗体、麻疹ウイルス核タンパク質の485位から525位のアミノ酸配列を認識して結合するモノクローナル抗体、および麻疹ウイルス核タンパク質の91位から134位のアミノ酸配列を認識して結合するモノクローナル抗体からなる群から選択される、請求項1乃至3に記載の麻疹ウイルス検出方法。
【請求項5】
第2のモノクローナル抗体が、麻疹ウイルス核タンパク質の91位から134位のアミノ酸配列を認識して結合するモノクローナル抗体である、請求項4に記載の麻疹ウイルス検出方法。
【請求項6】
麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体が担持された判定部を含む展開用膜担体と、
麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し且つ標識された第2のモノクローナル抗体を保持する標識保持部材とを備える、検体に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験具。
【請求項7】
判定部は、麻疹ウイルス核タンパク質に結合可能であって第1および第2のモノクローナル抗体と異なるエピトープに結合する第3のモノクローナル抗体をさらに担持する請求項6に記載のメンブレンアッセイ用試験具。
【請求項8】
請求項6又は7のいずれかに記載のメンブレンアッセイ用試験具と、
非イオン性界面活性剤を含み、検体と混合して測定試料を調製するための検体処理液と、を備える、測定試料に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験キット。
【請求項9】
測定試料を収容可能であり、前記メンブレンアッセイ用試験具が挿入可能に構成された試験容器をさらに備える請求項8に記載のメンブレンアッセイ用試験キット。
【請求項10】
麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体が担持された判定部を含む膜担体を備える試験具と、
麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し且つ標識された第2のモノクローナル抗体を含む標識液を備える、検体に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験キット。
【請求項11】
判定部は、麻疹ウイルス核タンパク質に結合可能であって第1および第2のモノクローナル抗体と異なるエピトープに結合する第3のモノクローナル抗体をさらに担持する請求項10に記載のメンブレンアッセイ用試験キット。
【請求項12】
標識液は、非イオン性界面活性剤をさらに含有する請求項10又は11のいずれかに記載のメンブレンアッセイ用試験キット。
【請求項13】
独立行政法人製品評価技術基盤機構特許微生物寄託センターに寄託された受託番号:NITE BP−563、NITE BP−564、NITE BP−565およびNITE BP−566からなる群から選択されるハイブリドーマ。
【請求項14】
請求項13に記載のハイブリドーマによって産生されたモノクローナル抗体。
【請求項1】
麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体と、麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し、且つ標識された第2のモノクローナル抗体とを用いて、検体に含まれる麻疹ウイルスを検出する麻疹ウイルス検出方法。
【請求項2】
検体と、非イオン性界面活性剤を含む検体処理液とを混合して測定試料を調製する工程をさらに備え、
調製された測定試料に含まれる麻疹ウイルスを検出する請求項1に記載の麻疹ウイルス検出方法。
【請求項3】
検体が、唾液、鼻汁、鼻腔拭い液、鼻腔吸引液および咽頭拭い液からなる群から選択される請求項1又は2に記載の麻疹ウイルス検出方法。
【請求項4】
第1のモノクローナル抗体及び第2のモノクローナル抗体が、麻疹ウイルス核タンパク質の135位から241位のアミノ酸配列を認識して結合するモノクローナル抗体、麻疹ウイルス核タンパク質の485位から525位のアミノ酸配列を認識して結合するモノクローナル抗体、および麻疹ウイルス核タンパク質の91位から134位のアミノ酸配列を認識して結合するモノクローナル抗体からなる群から選択される、請求項1乃至3に記載の麻疹ウイルス検出方法。
【請求項5】
第2のモノクローナル抗体が、麻疹ウイルス核タンパク質の91位から134位のアミノ酸配列を認識して結合するモノクローナル抗体である、請求項4に記載の麻疹ウイルス検出方法。
【請求項6】
麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体が担持された判定部を含む展開用膜担体と、
麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し且つ標識された第2のモノクローナル抗体を保持する標識保持部材とを備える、検体に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験具。
【請求項7】
判定部は、麻疹ウイルス核タンパク質に結合可能であって第1および第2のモノクローナル抗体と異なるエピトープに結合する第3のモノクローナル抗体をさらに担持する請求項6に記載のメンブレンアッセイ用試験具。
【請求項8】
請求項6又は7のいずれかに記載のメンブレンアッセイ用試験具と、
非イオン性界面活性剤を含み、検体と混合して測定試料を調製するための検体処理液と、を備える、測定試料に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験キット。
【請求項9】
測定試料を収容可能であり、前記メンブレンアッセイ用試験具が挿入可能に構成された試験容器をさらに備える請求項8に記載のメンブレンアッセイ用試験キット。
【請求項10】
麻疹ウイルス核タンパク質に結合可能な第1のモノクローナル抗体が担持された判定部を含む膜担体を備える試験具と、
麻疹ウイルス核タンパク質に結合可能であって第1のモノクローナル抗体と異なるエピトープに結合し且つ標識された第2のモノクローナル抗体を含む標識液を備える、検体に含まれる麻疹ウイルスを検出するためのメンブレンアッセイ用試験キット。
【請求項11】
判定部は、麻疹ウイルス核タンパク質に結合可能であって第1および第2のモノクローナル抗体と異なるエピトープに結合する第3のモノクローナル抗体をさらに担持する請求項10に記載のメンブレンアッセイ用試験キット。
【請求項12】
標識液は、非イオン性界面活性剤をさらに含有する請求項10又は11のいずれかに記載のメンブレンアッセイ用試験キット。
【請求項13】
独立行政法人製品評価技術基盤機構特許微生物寄託センターに寄託された受託番号:NITE BP−563、NITE BP−564、NITE BP−565およびNITE BP−566からなる群から選択されるハイブリドーマ。
【請求項14】
請求項13に記載のハイブリドーマによって産生されたモノクローナル抗体。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2010−122205(P2010−122205A)
【公開日】平成22年6月3日(2010.6.3)
【国際特許分類】
【出願番号】特願2009−187024(P2009−187024)
【出願日】平成21年8月12日(2009.8.12)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
【公開日】平成22年6月3日(2010.6.3)
【国際特許分類】
【出願日】平成21年8月12日(2009.8.12)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
[ Back to top ]

