ヒタチ ケミカル リサーチ センター インコーポレイテッドにより出願された特許
11 - 20 / 27
大容量微粒子サンプル中の病原体検出
食品サンプル等のサンプル中の微生物を検出するための方法及びフィルターシステムを開示する。フィルターは、例えば静電荷により、微生物を引きつけるように構成される。微生物の検出を可能にするために、微生物を含有するフィルターをインキュベートして、微生物を増殖させる。フィルターは分解性であってもよく、かつ検出は、微生物又は微生物の分子マーカーを検出用フィルターから抽出することを含んでよい。微生物をマイクロビーズの間を通過させながら、サンプルから汚れや他の混在物質を捕捉するように選択された多孔質マイクロビーズ要素を、フィルターシステムは含んでもよい。このフィルターシステムを使用して、サンプル中の微生物を検出する方法も開示する。この方法は、ポリマー及び/又は微生物検出試薬をフィルターに添加して、微生物の増殖を局在化させるとともに、試薬の蒸発を防止するステップも含んで良い。 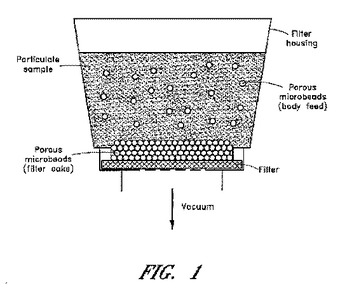 (もっと読む)
(もっと読む)
高配列、高アスペクト比、高密度のシリコンナノワイヤー及びその製造方法
シリコンナノワイヤーの製造方法は、ドープされた材料の形状で基板を提供するステップと、エッチング溶液を処方するステップと、適切な電流密度を適切な長さの時間供給するステップとを含む。少なくとも一部がシリコンナノワイヤーから構成される関連構造体及び装置も記載される。 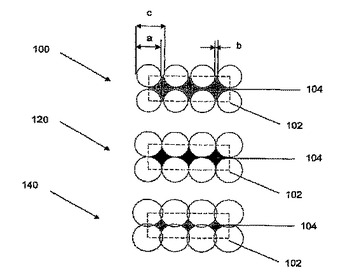 (もっと読む)
(もっと読む)
インターナリンB又はインターナリンAと結合可能な核酸リガンド
本開示は、inlB又はinlBとの結合特性に関して選択された新規の試薬の単離に関する。inlBは、受容体チロシンキナーゼMetと結合し活性化させるリステリア・モノサイトゲネスの表面局在タンパク質である。inlBは、肝細胞、内皮細胞株及び上皮細胞株を含む多くの細胞の浸潤を促進し、細菌のアクチン介在性の内在化を活性化する。inlAは、リステリア菌のゲノムで同定された表面局在ロイシンリッチリピート(LRR)タンパク質の大グループに属する。inlAは、リステリア・モノサイトゲネスをヒト腸上皮等の非食細胞に侵入させることができ、上皮細胞に付着するのに、及び上皮細胞への取り込みを誘導するのに十分である。本開示のinlB及びinlAに対する核酸リガンドは、食品サンプル、臨床サンプル又は環境サンプル中のinlB、inlA、又はリステリア菌の有無を決定するのに有用となり得る。これらは、感染促進inlB又はinlAと結合し、これらを不活性化させることによって、リステリア菌の感染と競合する作用因子としても有用となり得る。1つの目的は、食品サンプル、臨床サンプル又は環境サンプル中のinlB、inlA、又はリステリア菌の有無を検出するように設計した、in vitro診断又はバイオセンサプラットフォームにこれらの核酸リガンドを組み込むことである。もう1つの目的は、リステリア菌の感染を治療又は予防する方法に、これらの核酸リガンドを用いることである。 (もっと読む)
環境からの刺激により変換する電気的性質を有する材料
異なった電気的性質を有する第一状態と第二状態との間で切り替わることができる複合体材料で:環境の刺激に呼応する第一材料;前記第一材料の少なくとも一つの表面の少なくとも一部分上に配置した第二材料で、電気伝導性材料を含む第二材料から形成された複数のナノ堆積物;を含み、環境の刺激に呼応して前記複数のナノ堆積物が第一状態に対応する第一形態と、第二状態に対応する第二形態との間で切り替わることができる複合体材料。関連した装置及び方法も記載されている。 (もっと読む)
薄切りにした腫瘍組織におけるmRNA発現を定量することによって固形腫瘍の薬剤感受性を検査する方法
治療剤に対する新生物組織の感受性を評価する方法、特にこのような方法において薄切りにした生腫瘍組織から得られた細胞におけるアポトーシス促進性のマーカーmRNAを定量する方法を開示する。この方法は、個々の腫瘍又は腫瘍型に対する特定のアポトーシスマーカーmRNAを確認すること、並びにin vitroで個々の腫瘍由来の薄切りにした生癌組織を候補化学療法剤の投薬法に曝した後、この組織でマーカーmRNAのレベルを評価することを含めることができる。  (もっと読む)
(もっと読む)
クローン病患者の末梢血白血球におけるT細胞受容体介在性腫瘍壊死因子スーパーファミリー及びケモカインのmRNA発現の増強
刺激に応じた特定のmRNAレベルを測定することによって、クローン病のヒトがTNFSF又はサイトカインを標的とする治療法に応答する可能性があるか否かを判定する方法を開示する。ヒトにおいてクローン病の治療法の有効性を評価する方法も開示する。さらに、クローン病の治療に用いる化合物のスクリーニング方法を開示する。クローン病患者の疾患状態を経時的にモニタリングする方法も開示する。 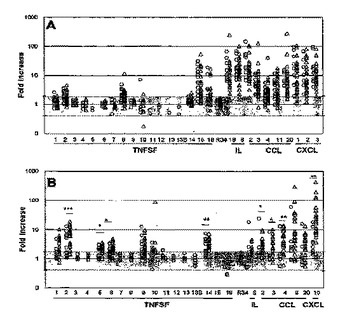 (もっと読む)
(もっと読む)
関節リウマチの患者の末梢血白血球におけるFC受容体媒介性腫瘍壊死因子スーパーファミリ及びケモカインのmRNA発現の増大
TNFSF−3、TNFSF−4、TNFSF−7、TNFSF−11又はTNFSF−14の発現を変化させることを伴う関節リウマチの治療に対する患者の応答性を予測する方法を開示する。このような治療の有効性をモニタリングする方法も開示する。さらに、関節リウマチの治療に用いる化合物のスクリーニング方法を開示する。関節リウマチ患者の疾患状態を経時的にモニタリングする方法も開示する。 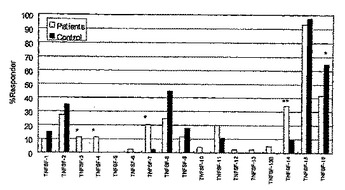 (もっと読む)
(もっと読む)
イオン性ポリマーデバイス及びそれを製造する方法
一実施形態は、複数の導電性粒子を含む2つの拡張電極層であって、複数の導電性粒子が、2つの拡張電極層の各々において濃度勾配を形成する、2つの拡張電極層と、2つの拡張電極層の間のイオン性ポリマー誘電層と、2つの拡張電極層の外側表面上の少なくとも1つの導電層とを含む、イオン性ポリマーデバイスを提供する。別の実施形態は、両表面上に複数の表面形状/特質を有するポリマー複合体と、当該両表面の各々の上の少なくとも1つの導電層とを含む、イオン性ポリマーデバイスを提供する。一実施形態は、部分的に硬化したポリマー−金属塩層を形成すること、金属塩を還元して複数の金属粒子を形成することによって、第1の拡張電極層及び第2の拡張電極層を、イオン性ポリマーデバイスの両表面に且つ両表面付近に形成することを含む、イオン性ポリマーデバイスを製造する方法を提供する。別の実施形態は、イオン性ポリマー溶液中に複数の導電性粒子を含む少なくとも1つの混合物を準備すること、少なくとも1つの混合物を硬化することによって、複数の導電性粒子を含む少なくとも1つの拡張電極層を形成すること、少なくとも1つの拡張電極層の1つの上にイオン性ポリマー誘電層を設けること、及び少なくとも1つの拡張電極層の外側表面上に少なくとも1つの導電層を堆積させることを含む、イオン性ポリマーデバイスを製造する方法を提供する。さらに別の実施形態は、少なくとも1つのインプリンティング用プレートを準備すること、イオン性ポリマー溶液を準備すること、及びイオン性ポリマー溶液を少なくとも1つのインプリンティング用プレート上に塗布することであって、それによって、表面形状/特質を有する少なくとも1つのインプリンティングされたポリマー層を形成する、イオン性ポリマーデバイスを製造する方法を提供する。  (もっと読む)
(もっと読む)
微細液滴パターニングを用いたマイクロテクスチャ加工によってエラストマー材料の生体適合性を改良する方法
シリコーンエラストマー等のエラストマー材料の表面にミクロ構造を導入する単純な方法を記載する。パターンは、シリコーンエラストマー膜上に保護ポリマーの微細液滴を形成し、ポリマーを硬化させ、その後、被覆されていない材料を化学エッチングによって除去することによって形成される。細胞接着性の研究結果から、処理された材料は、未処理の対照に比べて有意に改良された生体適合性を有することが示される。 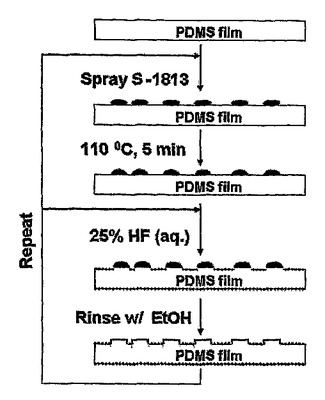 (もっと読む)
(もっと読む)
腫瘍細胞及び刺激された白血球におけるmRNAの発現プロファイルに基づく腫瘍性疾患に対する免疫応答を予測する方法
腫瘍壊死因子(TNF)は、癌細胞の表面上で特定のTNF受容体と相互作用することにより、アポトーシスを誘導することができる。複数の成員のTNFリガンド及び受容体がそれぞれのスーパーファミリー内に存在するので、300を超える様々なリガンド−受容体の組合せが存在する。活性化血液白血球が、癌に対する免疫応答の一部としてTNFを産出し、他の白血球をこの部位に引き込むためにケモカインを産出する。免疫系の相互作用のモデルとして、全血を熱凝集IgG又は抗T受容体抗体に曝したときに、血液白血球において様々なTNFスーパーファミリー亜群及びケモカインmRNAの有意な誘導を検出する方法が開示される。TNF亜群及び誘導されたケモカインにおいて個体間のかなりの変動が見られる。末梢血の白血球が抗癌免疫細胞の供給であるので、血液中の適切なTNFリガンド及びケモカインのex vivo誘導性を定量化することは、個体に合わせた癌の免疫療法に有用である。早期の不可視の転移病変等を有する腫瘍塊が小さい場合、適切なTNFの攻撃が再発を予防するのに十分であり得る。 (もっと読む)
11 - 20 / 27
[ Back to top ]

