Fターム[4H045BA15]の内容
Fターム[4H045BA15]に分類される特許
1,341 - 1,347 / 1,347
中毒性ショック症候群及び敗血症性ショック症状を緩和するペプチド及び模倣体
本発明は、毒素産生性細菌に関連する中毒性ショック症候群、敗血症性ショック、食中毒及び自己免疫疾患を予防する、又は重篤度を緩和するための組成物及び方法に関する。本発明はまた、中毒性ショック症候群、敗血症性ショック、食中毒及び自己免疫疾患、並びにその他の関連疾患、病態及び症候群の予防及び治療用のペプチド、誘導体、模倣薬及び抗体の使用方法に関する。
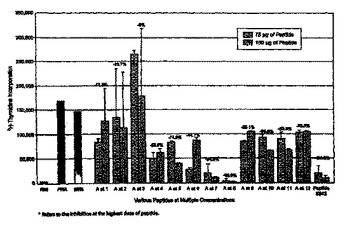 (もっと読む)
(もっと読む)
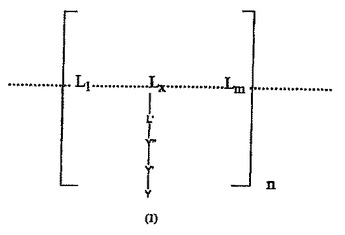
非共有結合により誘導される求核性タンパク質へのリガンドの共有結合
式(1) [式中、L1...Lx...Lmはリガンド決定基を規定する構成要素であり、Lxはアミノ酸残基、糖残基、脂肪酸残基およびヌクレオチドからなる群から選択されるリガンド決定基の構成要素単位であり、L'はLxの官能基であり、Y"は原子、共有結合またはリンカーであり、Y'は場合によっては荷電した基または中性基であり、Yは前記リガンド決定基に結合するレセプターと特異的に反応する共有結合反応性求電子基であり、かつnは1から1000の整数であり、mは1から30の整数である] の共有結合反応性リガンドアナログ(CAL)。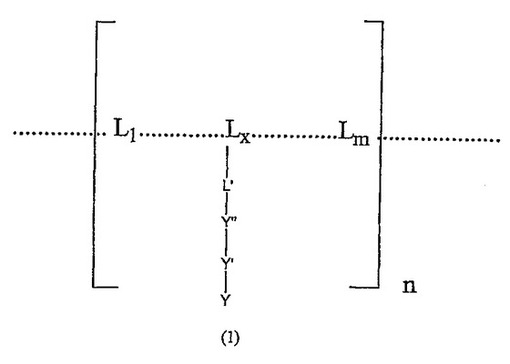
 (もっと読む)
(もっと読む)
PH依存性のポリペプチド凝集およびその使用
本発明は、ポリペプチドの可逆的凝集および/または解離の代替法を提供する。本発明のタンパク質またはポリペプチドは固有の凝集能力を有し、その凝集は、このポリペプチドの自在に不規則になるドメイン中に局在するペプチド反復配列の存在および構造に基づく、ポリペプチドのオリゴマー化である。ペプチド反復配列を含む自在に不規則になるドメインは、タンパク質アミノ酸配列のN末端と非常に近接して位置することが好ましい。それぞれのペプチド反復配列は、アミノ酸配列:PHGGGWGQを有する1〜4個の同一のオクタペプチドを含む配列を有することが好ましい。好ましいタンパク質は、細胞プリオンタンパク質(PrPC)、およびそれぞれ固有の可逆的凝集能力および解離能力を有する改変ポリペプチドまたは融合タンパク質を含む群から選択される。凝集の新たな機構のために、タンパク質のオリゴマー化反応は流体環境中において、この流体環境のpHに応じて可逆的である。オリゴマー化は6.2〜7.8のpHで起こり、モノマーへの解離は4.5〜5.5のpH範囲であると報告されている。
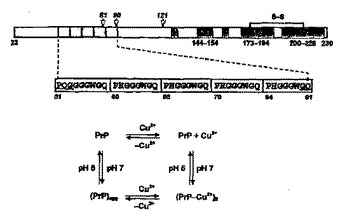 (もっと読む)
(もっと読む)
自己免疫異常に関わるHLA−DRMHCクラスII分子に関するペプチド
HLA-DR分子と呼ばれる共有エピトープを有するMHCクラスII分子に結合する抗原性ペプチドが開示される。より具体的には、HLA-DR分子に対して増加したアフィニティーを有し、かつ慢性関節リウマチに関連する抗原性ペプチドがシトルリン化される。これらの新規なペプチドは慢性関節リウマチ診断および治療の新規な方法の基礎を提供する。 (もっと読む)
タンパク質結合性のドキソルビシン−ペプチド−誘導体
本発明はタンパク質結合性の基を有し、MMP−2またはMMP−9で切断可能なペプチド配列を有する低分子ドキソルビシン−ペプチド−誘導体に関する。 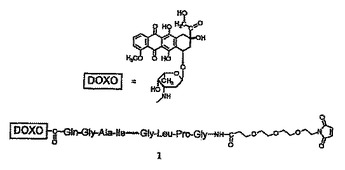 (もっと読む)
(もっと読む)
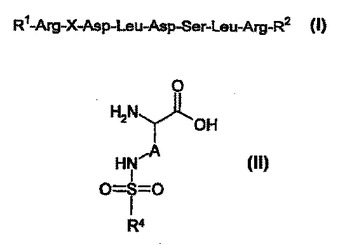
ペプチドスルホンアミド
本発明は、血小板インテグリンGPIIbIIIaならびにαvインテグリン(好ましくはavβsインテグリンおよびαvβ3インテグリン)のリガンドとして生物学的に活性である式(I):R1−Arg−X−Asp−Leu−Asp−Ser−Leu−Arg−R2(I)を有する新規ペプチドに関する。式(I)中、R1はH、アセチルまたはアシルを示し、R2は−Oh、OR3NH2、NHR3、N(R3)2を示し、R3はアルキル、アラルキル、アリール、Hetを示し、Xは式(II)のアミノ酸を示し、式(II)中、Aは(CH2)nを示し、R4はH、アルキル、アラルキルまたはアリールを示し、nは1、2、3、4、5または6を示し、式(II)のアミノ酸は、α−アミノ基のペプチド結合を介して隣接するArgに結合しており、α−カルボキシル基のペプチド結合を介して隣接するAspのα−アミノ基に結合している。
 (もっと読む)
(もっと読む)
リン酸化の増進に起因する疾病及び病状の治療
本発明は、炎症や癌のようなリン酸化の増進に起因する疾病及び病状を治療する方法を提供するものである。また、本発明は細胞、組織、又は器官におけるリン酸化の増進を阻害する方法を提供するものである。上記方法は、リン酸受容体化合物(PAC)を用いるものである。また、本発明は、PACを含む製品を提供するものである。 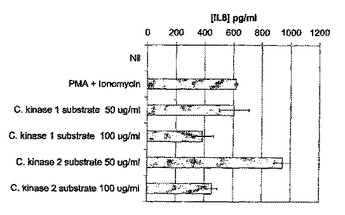 (もっと読む)
(もっと読む)
1,341 - 1,347 / 1,347
[ Back to top ]

