マイボーム腺機能障害を治療する方法
本発明は、マイボーム腺機能障害を治療するための方法を含む。本発明は、更に涙液の脂質組成を改善する、異常なマイボーム腺分泌を治療する、及びマイボーム腺分泌を正常化するための方法を含む。
【発明の詳細な説明】
【技術分野】
【0001】
[001]本発明は、マイボーム腺機能障害を治療するための方法を含む。本発明は、更に涙液の脂質組成を改良する、異常なマイボーム腺分泌を治療する及びマイボーム腺の分泌を正常化するための方法を含む。
【背景技術】
【0002】
[002]マイボーム腺は、上及び下瞼の瞼板中に位置する皮脂腺の一種(即ち、全分泌腺)である。これらの腺は、眼の涙膜の蒸発を防止する油状物質である皮脂の供給に関与しており、頬への涙液の溢流を防止し、そして閉じられた眼瞼を気密にする。概略50の腺が上眼瞼に、そして25の腺が下眼瞼に存在する。マイボーム腺は、皮膚粘膜の眼瞼接合部上の腺房のブドウ様クラスターによって区別され、そして全分泌分解によって眼球表面を被覆するために、この接合部におけるその脂質内容物(皮脂)を空にする。この腺は、極性及び非極性の脂質の両方を製造する細胞によって固定され、ついでこれは、リソソーム中に保存され、これは、まとまってより大きい貯蔵顆粒になる。これらの細胞は、脂質によって拡大し続けるため、これらは、最終的にマイボーム腺開口部へ破裂し、そして皮脂を眼球表面に溢流する。これらの脂質は、室温では液体であり、典型的には約66ないし89°Fの間の融点を持ち、そしてマイバムと呼ばれる薄い滑らかなフィルムで眼球表面に分布される。このマイバムは、水性層の蒸発を防止するために機能する。マイバム組成の変化は、眼瞼周辺部及び眼球表面の健康に深い影響を有することができる。一般的集団のマイボーム腺の機能障害はかなり高く、39%程度と高く推定され(例えば、Hom MM et.al.Optom Vis Sci.,67(9),710−2,1990を参照されたい)、コンタクトレンズの使用者の場合に増加する(例えば、Ong BL.Optom Vis Sci.,73(3),208−10,1996を参照されたい)。
【0003】
[003]マイボーム腺の分泌物は、涙液の脂質層を形成し、そして極性及び非極性脂質からなる。マイバムの脂質の種類、並びに脂肪酸及びアルコールの組成は、極性及び非極性相を伴う複合単層の初期の形成、体温近辺の十分な流動性、及び瞬き中の圧縮及び膨張を受ける能力のような涙液のパラメーターに影響することができる(例えば、McCulley et al.,Adv Exp Med Biol.,506(Pt A),373−8,2002を参照されたい)。ヒトの涙膜の脂質二重層において、極性相の脂質は、14−18個の長さの炭素鎖(C14−18)を伴う脂肪酸を含有し、これは、通常飽和である。これらの特性は、有効な極性脂質の構造化及び流動性のために、非常に重要である(例えば、McCulley et al.,Adv Exp Med Biol.,506(Pt A):373−8,2002を参照されたい)。脂肪酸の飽和のいずれの変化も、脂質の極性相の不安定性に、そしてこれによる涙液の不安定性に導くことができる。マイボーム腺の機能障害に導く眼瞼炎のような症状において、正常な脂肪酸の特性が、時により大きい不飽和に向かう傾向がある。飽和脂肪酸のレベルを改良することができるいずれの薬物も、マイボーム腺の疾病に対して有益である。
【0004】
[004]マイボーム腺機能障害に罹った患者の通常の病状の訴えは、特に接近した作業を行った後のぼやけた又はかすんだ視覚、眼の灼熱又は異物感、過剰な涙液、コンタクトレンズに対する不耐性、羞明、及びヒトが眠りから覚めるために十分な疼痛を含む。この症状を持つ患者は、通常、その涙腺による正常な水性の涙液の産生を有するが、そのマイボーム腺は、萎縮することができ、そしてこれは、これらの腺の導管上皮の異形成をしばしば伴う。眼瞼の皮膚粘膜接合部の前側びらん、並びに眼瞼及び結膜感染、眼瞼周縁の不規則性、角膜上皮の変化、及び角膜の血管新生がしばしば注目される。マイボーム腺機能障害を評価するための普通の臨床試験は、シルマー(Schirmer)涙液試験、蛍光染色(更に、眼球染色又は結膜染色としても知られる)、及び涙液層破壊時間試験(TFBUT)を含み、そのそれぞれを、以下に簡単に記載する。
【0005】
[005]シルマー涙液試験(STT):シルマー涙液試験は、水性の涙液の産生の測定である。これは、ドライアイのために使用される臨床パラメーターであり、そして患者の通常の又は麻酔された眼で行われて、基礎的及び反射性涙を評価する。STTは、含浸された染料及びミリメートルの刻み値を伴う又は伴わない濾紙の標準的な条片を使用して行われる。濾紙の末端を、それぞれの眼の結膜円蓋に置き、そして1分間に産生された涙液の量を測定する。STTの読取りは、動物の種間で変化する。イヌの場合、これは、典型的に10mm濡れ/分より大きい。しばしば、慢性のマイボーム腺機能障害において、角膜上皮は、有意な染料取込みを示す。
【0006】
[006]蛍光染色(a.k.a.眼球染色又は結膜染色):この試験は、角膜上皮の完全性を測定するために使用される。眼に適用されるフルオレセイン染料は、液滴で適用することができる。染料の適用の直後、患者は、瞬くか、又は眼瞼を手で開閉させられるかのいずれかをされる。次いで過剰のフルオレセインを洗眼液で洗浄し、そして次いでたコバルトブルーフィルターを設置された直接検眼鏡で暗室で角膜表面を検査する。いずれの角膜への染料の取込みも、角膜表面上皮の破損の指標である。しばしば、慢性マイボーム腺機能障害において、角膜上皮は、有意な染料の取込みを示す。
【0007】
[007]涙液層破壊時間試験(TFBUT):この試験は、角膜前涙液膜安定性の主観的測定である。TFBUTは、涙が角膜の表面から蒸発するために要する時間を測定する。この試験において、フルオレセイン染料が角膜に適用され、そして染料が角膜上にたまるようにする。眼の検査がコバルトブルーを設置された直接検眼鏡からの青い光線で行われる間、眼瞼は手で開閉される。眼瞼の開放(角膜上の緑色のフィルムの形成)から角膜の緑色の染色内の黒色の部分の最初の出現までの所要時間が測定される。ヒトのTFBUTは、典型的には5秒より少ない。イヌではこれは20秒である。ヒトにおいてTFBUTが3秒より少ない場合、そしてイヌでは10秒より少ない場合、TFBUTは異常であると考えられる。しばしば、慢性マイボーム腺機能障害において、TFBUTは有意に減少する。
【0008】
[008]眼瞼を裏打ちするマイボーム腺は、脂質を産生し、これは、涙液の安定性を促進し、そして涙膜の蒸発を減少するために、マイボーム腺の機能障害は、涙膜を不安定化し、そして涙膜破壊時間の減少及び蒸発性ドライアイを起こす脂質の不十分さに導くことができる(例えば、Sullivan et al.,Ann.NY Acad.Sci.,966,211−222,2002を参照されたい)。
【0009】
[009]マイボーム腺機能障害は、更に、脂質の固化及びマイボーム腺分泌の妨害を起こす、脂質の増加した融点によって特徴づけられる。これは、嚢胞、感染及び涙液中の脂質含有量の減少をもたらすことができる。マイボーム腺機能障害は、更に、過剰の異常に濁った分泌物よって特徴づけられ、これは、濃縮され、そしてマイボームオリフィスを閉塞する。これは、マイボーム導管の異形成(異常な角質化)が続いて起こる。流れに対する遮断及び抵抗は、オリフィス周りの組織の炎症及び血管新生(発赤)をもたらす。炎症性媒体が涙膜中に蓄積し、眼球表面の損傷に導く。これらの現象の後遺症(sequlae)は、導管の炎症性瘢痕であり、狭窄に導く。最初、腺は膨潤し、そして最終的に萎縮する。
【0010】
[0010]普通に使用される治療は、眼瞼周辺部の温めた圧縮、マイボーム導管の機械的調査、涙液脂質の溶融及び分泌を誘導する眼瞼周辺部への赤外デバイス又は化学薬品の使用を含む。炎症に対して、グルココルチコイドが使用される。細菌性要素がある場合、ペニシリン、ドキシサイクリン及びテトラサイクリンのような抗生物質が使用される。
【0011】
[0011]マイボーム腺機能の生理学は、アンドロゲンの制御下にあると信じられる。加齢、閉経、及び前立腺癌のアンドロゲン剥脱療法中に起きるアンドロゲン欠乏の症状は、蒸発性ドライアイが伴い(例えば、Sullivan et.al.,Ann.NY Acad.Sci.,966,211−222,2002を参照されたい)、アンドロゲンがこの症状の病因の主要な部分を演じることができることを示す。19−ノルテストステロンの投与は、ウサギのマイボーム腺分泌物中の全及び中性脂質画分中の脂肪酸特性を調節し(例えば、Sullivan et al.,IOVS,41(12),3732−3742,2000を参照されたい)、アンドロゲンの補充が、このような症状の治療において有益であることができることを示している。
【0012】
[0012]然しながら、伝統的ステロイド剤による全身性アンドロゲン療法は、挫創、脂漏、多毛症及び前立腺肥大に関する懸念を含む幾つかの好ましくない副作用を伴う。毛髪の成長を促進する(局所的)及び前立腺疾患を治療する(全身性)5α−レダクターゼ阻害剤の能力は、アンドロゲン受容体及びテストステロンの代謝産物に対する強力な完全アゴニストであるジヒドロテストステロン(DHT)が、これらの多くの男性化効果の原因であることができることを示唆する。
【0013】
[0013]マイボーム腺機能障害の従来の治療は、典型的には眼瞼又はマイボーム腺の感染と仮定された治療のみに向けられるか、或いはこのような治療を長期間殆ど役に立たなくする特定の不利益を有していた。例えば、マイボーム腺の機能障害を持つ患者は、人工涙液で症状的に治療されているが、しかしこれらの薬剤は、あったとしても制約された改善を提供した。典型的には、眼瞼又は眼球表面に対して適用されるグルココルチコイドは、短期のパルス療法として有効である。然しながら、グルココルチコイドは、潜在的副作用、例えば、白内障及び緑内障のために、良好な長期の解決策ではない。マイボーム腺機能障害は、現時点では治癒可能又は逆転可能ではなく;従って、この症状を持つ患者は、一生治療されなければならない。
【0014】
[0014]従って、マイボーム腺機能障害を治療する新しい方法を開発するための当技術における必要性が存在する。本出願人等は、脂質産生、男性化効果の欠如、及び組織の選択性を促進するその能力のために、マイボーム腺機能障害に対する独特の治療方法を提供する化合物を開発している。本明細書中に記載されるこの方法は、より少ない好ましくない副作用を伴うマイボーム腺機能障害に対する有効な治療を提供する。
【先行技術文献】
【非特許文献】
【0015】
【非特許文献1】Hom MM et.al.Optom Vis Sci.,67(9),710−2,1990;
【非特許文献2】Ong BL.Optom Vis Sci.,73(3),208−10,1996;
【非特許文献3】McCulley et al.,Adv Exp Med Biol.,506(Pt A),373−8,2002;
【非特許文献4】Sullivan et al.,Ann.NY Acad.Sci.,966,211−222,2002;
【非特許文献5】Sullivan et al.,IOVS,41(12),3732−3742,2000。
【発明の概要】
【0016】
[0015]一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺機能障害を治療する方法を提供する。
【0017】
[0016]他の態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液の脂質組成を改善する方法を提供する。
【0018】
[0017]更なる態様において、本発明は、更に、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、次の方法:涙液の脂質組成を改善する、涙液の脂質含有量を増加する、涙液の脂肪酸含有量を増加する、涙液のパルミチン酸:ステアリン酸比を増加する、異常なマイボーム腺分泌を治療する、マイボーム腺機能障害を予防する、ドライアイを治療及び予防する、マイボーム腺分泌を正常化する、マイボーム腺分泌物の粘度を減少する、マイボーム腺分泌物の透明度を増加する、涙液中の脂質の相転移温度を減少する、閉塞された及び/又は妨害されたマイボーム腺の数を減少する、眼瞼周辺部の発赤を減少する、患者の眼の灼熱及び/又は掻痒感を減少する、患者の眼への人口涙液の投与の必要性を減少する、眼のステロイド治療の必要性を減少する、患者の眼の異物感を減少する、マイボーム腺分泌間の時間(不応期)を減少する、眼球の異常感を減少する、涙液層破壊時間を増加する、角膜上皮のびらんを減少する、水性涙液欠乏を減少する、眼球及び結膜の染色を減少する、並びに霞んだ及び/又はファジーな視覚を減少することに関する。
【0019】
[0018]本明細書中に記載されるいずれもの方法の更なる態様において、患者は、哺乳動物である。本明細書中に記載されるいずれもの方法の一つの態様において、患者は、ヒトである。本明細書中に記載されるいずれもの方法の他の態様において、患者は、飼育動物(例えば、ネコ、イヌ)である。
【図面の簡単な説明】
【0020】
【図1】[0019]図1は、実施例3に記載される薬物治療に反応する涙液の脂肪酸組成を示す。
【図2】[0020]図2は、実施例3に記載されるとおりの4週間の洗浄期間後の涙液の脂肪酸組成を示す(a:p<0.05ベヒクルで治療された去勢された動物との比較;b:p<0.05ベヒクルで治療されたインタクトの動物との比較)。
【図3】[0021]図3は、実施例4に記載される薬物治療に反応する涙液の脂肪酸組成を示す(a:p<0.05、事前投与のインタクトのレベルとの比較;b:p<0.05、ベヒクルで治療されたORX動物との比較)。
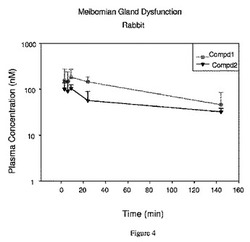
【図4】[0022]図4は、実施例4に記載したとおりの投与の10日後のウサギの血漿試料の薬物動態学的分析を示す。
【発明を実施するための形態】
【0021】
[0023]一つの側面において、本発明は、マイボーム腺機能障害を治療する方法に関する。この方法は、選択的アンドロゲン受容体修飾物質(SARM)化合物を投与することを含む。
【0022】
[0024]従って、一つの態様において、本発明は、以下の式(I):
【0023】
【化1】

【0024】
[式中:
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはプロドラッグ、異性体、代謝産物、医薬的に受容可能な塩、多形、結晶、N−オキシド、医薬製品、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、マイボーム腺機能障害を治療する方法を提供する。
【0025】
[0025]ある態様において、本発明の方法は、式Iの化合物を使用する。一つの態様において、式IのXは、Oである。もう一つの態様において、式IのXは、Sである。もう一つの態様において、式IのGは、Oである。もう一つの態様において、式IのGは、Sである。もう一つの態様において、式IのZは、NO2である。もう一つの態様において、式IのZは、CNである。もう一つの態様において、式IのQは、CNである。もう一つの態様において、式IのQは、Fである。もう一つの態様において、式IのQは、Brである。もう一つの態様において、式IのQは、Clである。もう一つの態様において、式IのQは、I(ヨウ素)である。もう一つの態様において、式IのTは、OHである。もう一つの態様において、式IのR1は、CH3である。
【0026】
[0026]更なる態様において、本明細書中に記載される方法のいずれもは、以下の式:
【0027】
【化2】

【0028】
或いはプロドラッグ、異性体、代謝産物、医薬的に受容可能な塩、医薬製品、多形、結晶、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。
[0027]更なる態様において、明細書中に記載される方法のいずれもは、以下の式:
【0029】
【化3】

【0030】
或いはプロドラッグ、異性体、代謝産物、医薬的に受容可能な塩、医薬製品、多形、結晶、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。
[0028]ある態様において、明細書中に記載される方法のいずれもは、以下の式:
【0031】
【化4】

【0032】
或いはプロドラッグ、異性体、代謝産物、医薬的に受容可能な塩、医薬製品、多形、結晶、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。
[0029]従って、一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺機能障害を治療する方法を提供する。
【0033】
[0030] 一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺機能障害を予防する方法を提供する。もう一つの態様において、患者のマイボーム腺機能障害の再発の発生頻度を予防、抑制、阻害又は減少する方法は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる。
【0034】
[0031]一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、ドライアイを治療又は予防する方法を提供する。もう一つの態様において、患者のドライアイの再発の発生頻度を予防、抑制、阻害又は減少する方法は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる。
【0035】
[0032]更なる態様において、マイボーム腺機能障害は、時に、眼瞼炎、後部眼瞼炎、角膜炎、点状角膜炎、眼球感染、麦粒腫、霰粒腫又は眼性酒さ(ocular rosacea)を伴う。
[0033]もう一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液膜破壊時間(TFBUT)を改善するための方法に関する。もう一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液膜破壊時間(TFBUT)を変化するための方法に関する。ある態様において、涙液膜破壊時間は増加される。他の態様において、涙液膜破壊時間は減少される。
【0036】
[0034]もう一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液の体積を増加(シルマー涙液試験によって測定されるような)するための方法に関する。
【0037】
[0035]もう一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、異物感、掻痒感、眼球の疼痛及び/又は眼の発赤を減少、改善及び/又は予防するための方法に関する。
【0038】
[0036]もう一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、過剰な乾燥による角膜表面の炎症を減少、改善及び/又は予防するための方法に関する。
【0039】
[0037]もう一つの態様において、本明細書中に記載される方法は、涙液の脂質組成を変化する。もう一つの態様において、本明細書中に記載される方法は、涙液の脂質組成を改善する。従って、もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液の脂質組成を変化する方法に関する。もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液の脂質組成を改善する方法に関する。もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液の脂質含有量を減少する方法に関する。
【0040】
[0038]更なる態様において、涙液の脂質組成の改善は、涙液の脂肪酸含有量を増加することを含んでなる。更なる態様において、涙液の脂質組成の改善は、涙液の脂肪酸含有量を減少することを含んでなる。更なる態様において、涙液の脂質組成の改善は、涙液のパルミチン酸:ステアリン酸比を増加することを含んでなる。更なる態様において、涙液の脂質組成の改善は、涙液中の脂質の融点を減少することを含んでなる。
【0041】
[0039]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、異常なマイボーム腺分泌を治療するための方法に関する。
【0042】
[0040]なお更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、異常なマイボーム腺分泌を正常化するための方法に関する。
【0043】
[0041]一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、異常なマイボーム腺分泌物の粘度を減少するための方法に関する。
【0044】
[0042]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺分泌物の透明度を増加する、例えば、一つの態様において、無色の状態にするための方法に関する。
【0045】
[0043]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液中の脂質の相転移温度を変化するための方法に関する。ある態様において、涙液中の脂質の相転移温度は、減少される。
【0046】
[0044]一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液中の脂質のパルミチン酸とステアリン酸の比を増加するための方法に関する。
【0047】
[0045]一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液中の脂質の相転移温度を減少するための方法に関する。
【0048】
[0046]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺の閉塞及び/又は妨害を減少するための方法に関する。一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、閉塞及び/又は妨害されたマイボーム腺の数を減少するための方法に関する。
【0049】
[0047]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼瞼周辺部の発赤を減少するための方法に関する。一つの態様において、発赤の減少は、測光法で測定される。一つの態様において、発赤の減少は、視覚的に測定される。
【0050】
[0048]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼の灼熱及び/又は掻痒感を減少するための方法に関する。
【0051】
[0049]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼への人口涙液を添加する必要性を減少するための方法に関する。
【0052】
[0050]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼のステロイド療法の必要性を減少するための方法に関する。
【0053】
[0051]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼への人口涙液の投与の頻度を減少するための方法に関する。
【0054】
[0052]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼の中の異物感を減少するための方法に関する。
【0055】
[0053]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺分泌間の時間(不応期)を減少するための方法に関する。
【0056】
[0054]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼の異常感を減少するための方法に関する。
【0057】
[0055]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液膜破壊時間を増加するための方法に関する。
【0058】
[0056]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙膜の安定性を増加するための方法に関する。
【0059】
[0057]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、フルオレセイン染色に伴って観察されるような角膜上皮のびらんを減少するための方法に関する。
【0060】
[0058]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、水性涙液の欠乏を減少するための方法に関する。
【0061】
[0059]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、霞んだ及び/又はファジーな視覚を減少するための方法に関する。
【0062】
[0060]更なる態様において、本明細書中に記載される方法は、患者のシルマー試験の読取りを改善する。一つの態様において、この方法は、シルマー試験中の試験紙条片を濡らす患者の涙液のミリメートルの数を増加する。
【0063】
[0061]一つの態様において、本発明の方法は、本明細書中のいずれもの態様に記載されるとおりの化合物、或いはプロドラッグ、異性体、代謝産物、医薬的に受容可能な塩、医薬製品、多形、結晶、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中のいずれもの態様に記載されるとおりの化合物、或いは異性体、代謝産物、医薬的に受容可能な塩、医薬製品、多形、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中のいずれもの態様に記載されるとおりの化合物、或いは異性体、医薬的に受容可能な塩、医薬製品、多形、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中のいずれもの態様に記載されるとおりの化合物、或いは異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中のいずれもの態様に記載されるとおりの化合物、或いは異性体、医薬的に受容可能な塩、又はこれらのいずれもの組合せを投与することを含んでなる。
【0064】
[0062]他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の異性体を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の代謝産物を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の医薬的に受容可能な塩を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の水和物を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物のN−オキシドを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の医薬製品を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物のプロドラッグを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の多形を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の結晶を投与することを含んでなる。
【0065】
[0063]本明細書中に開示される方法において有用な幾つかの化合物が、異なった互変異性及び/又は幾何異性及び/又は光学異性の形態で存在することができることを当業者は認識するものである。Cis異性体、trans異性体、ジアステレオマー混合物、ラセミ体、鏡像異性体の非ラセミ混合物、実質的に純粋な、及び純粋な鏡像異性体を含むこれらの形態の全ては、本発明の範囲内である。実質的に純粋な鏡像異性体は、例えば、2%より多くない、又は1%より多くないような、5重量/重量%より多くない対応する反対の鏡像異性体を含有する。
【0066】
[0064]一つの態様において、用語“異性体”は、化合物の光学異性体を包含することを意味する。一つの態様において、用語“異性体”は、化合物の立体異性体を包含することを意味する。本発明が、いずれもの光学的に活性な、又は立体異性の形態、或いはこれらの混合物を包含し、そしていずれもの適用に対するこれらの使用は、本発明の範囲内と考えられることは理解されることである。
【0067】
[0065]一つの態様において、本明細書中に記載される方法において有用な化合物は、実質的に純粋な(R)−異性体である。もう一つの態様において、本明細書中に記載される方法において有用な化合物は、実質的に純粋な(S)−異性体である。もう一つの態様において、本明細書中に記載される方法において有用な化合物は、(R)及び(S)異性体の混合物である。一つの態様において、本明細書中に記載される方法において有用な化合物は、純粋な(R)−異性体である。もう一つの態様において、本明細書中に記載される化合物は、純粋な(S)−異性体である。
【0068】
[0066]当業者にとって既知であるように、光学異性体は、慣用的な方法によるラセミ混合物の分割によって、例えば光学的に活性な酸又は塩基を使用するジアステレオ異性体の塩の形成、或いは共有結合のジアステレオ異性体の形成によって得ることができる。適当な酸の例は、酒石酸、ジアセチル酒石酸、ジベンゾイル酒石酸、ジトルオイル酒石酸及びカンファースルホン酸である。ジアステレオ異性体の混合物は、その物理的及び/又は化学的差に基づいて、当業者にとって既知の方法によって、例えば、クロマトグラフィー又は分別結晶化によって、その個々のジアステレオ異性体に分離することができる。次いで光学的に活性な塩基又は酸は、分離されたジアステレオ異性体の塩から解放される。光学異性体の分離のための異なった方法は、鏡像異性体の分離を最大にするために最適に選択される慣用的な誘導を伴う又は伴わない、キラルクロマトグラフィー(例えば、キラルHPLCカラム)の使用を含む。適したキラルHPLCカラムは、特に、日常的に選択可能なDiacelによって製造されている、例えばChiracel OD及びChiracel OJである。誘導体化を伴う又は伴わない酵素的分離もまた、有用である。光学的に活性な化合物は、同様に、ラセミ化を起こさない反応条件下のキラル合成法中の光学的に活性な出発物質を使用することによって得ることができる。
【0069】
[0067]適用可能な場合、本発明は、更に、遊離塩基の形態、及びそれに対して塩又はプロドラッグを調製することができる、本発明の全ての化合物の医薬的に受容可能な塩又はプロドラッグのような、本明細書中に開示されるとおりの化合物の有用な形態の投与を含む方法に関する。医薬的に受容可能な塩は、塩基として機能する主化合物を、無機又は有機酸と反応させて塩を形成する、例えば塩酸、硫酸、リン酸、メタンスルホン酸、カンファースルホン酸、シュウ酸、マレイン酸、コハク酸、クエン酸、ギ酸、臭化水素酸、安息香酸、酒石酸、フマル酸、サリチル酸、マンデル酸、及び炭酸の塩を形成することによって得られるものを含む。医薬的に受容可能な塩は、更に、主化合物が酸として機能するものを含み、そして適当な塩基と反応させて、例えば、ナトリウム、カリウム、カルシウム、マグネシウム、アンモニウム、及びコリン塩を形成する。特許請求される化合物の酸付加塩を、化合物の適当な無機又は有機酸との反応によって、多くの既知の方法のいずれによっても調製することができることを、当業者は更に認識するものである。別の方法として、アルカリ及びアルカリ土類金属塩は、本発明の化合物を、適当な塩基と、各種の既知の方法によって反応させて調製することができる。
【0070】
[0068]以下:酢酸塩、アジピン酸塩、アルギン酸塩、クエン酸塩、アスパラギン酸塩、安息香酸塩、ベンゼンスルホン酸塩、重硫酸塩、酪酸塩、樟脳酸塩、ジグルコン酸塩、シクロペンタンプロピオン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、グルコヘプタン酸塩、グリセロリン酸塩、ヘミ硫酸塩、ヘプタン酸塩、ヘキサン酸塩、フマル酸塩、臭化水素酸塩、ヨウ化水素酸塩、2−ヒドロキシ−エタンスルホン酸塩、乳酸塩、マレイン酸塩、メタンスルホン酸塩、ニコチン酸塩、2−ナフタレンスルホン酸塩、シュウ酸塩、パモ酸塩、ペクチネート、過硫酸塩、3−フェニルスルホン酸塩、ピクリン酸塩、ピバル酸塩、プロピオン酸塩、コハク酸塩、酒石酸塩、チオシアン酸塩、トシル酸塩、メシル酸塩及びウンデカン酸塩は、無機又は有機酸との反応によって得ることができる酸塩の更なる例である。
【0071】
[0069]例えば、医薬的に受容可能な塩は、塩酸塩、臭化水素酸塩、ハイドロフォーメート(hydroformate)、マレイン酸塩、又はナトリウム塩であることができる。
【0072】
[0070]ある態様において、形成される塩は、哺乳動物への投与のために医薬的に受容可能である。然しながら、化合物の医薬的に受容不可能な塩は、例えば、化合物を塩として単離し、そして次いで塩をアルカリ試薬による処理によって遊離塩基化合物に戻すために転換する、中間体として適している。次いで遊離塩基は、所望する場合、医薬的に受容可能な酸付加塩に転換される。
【0073】
[0071]更に、本明細書中に記載される幾つかの化合物が、異なった多形の形態で存在することができることを、当業者は認識するものである。当技術において既知であるように、多形性は、一つより多い別個の結晶又は“多形”種として結晶化する化合物の能力である。多形は、固体状態のその化合物分子の少なくとも二つの異なった配列又は多形の形態を持つ化合物の固体の結晶相である。いずれもの与えられた化合物の多形の形態は、同じ化学式又は組成によって定義され、そして二つの異なった化学化合物の結晶構造のように別個の結晶構造である。
【0074】
[0072]本明細書中に記載される幾つかの化合物が、異なった溶媒和物の形態で存在することができることを、当業者は更に認識するものである。本発明の化合物の溶媒和物は、溶媒分子が、結晶化過程中に化合物分子の結晶格子構造中に組込まれた場合、形成することができる。例えば、本明細書中のいずれもの態様中に記載されるような化合物は、例えば、一水和物、半水和物、セスキ水和物、二水和物、三水和物又はこれらのいずれもの組合せのような水和物の形態で存在することができる。
【0075】
[0073]用語“プロドラッグ”は、薬物前駆体である化合物を意味し、これは、患者への投与後、代謝的又は化学的過程によって化学的転換を受けて、本発明の化合物を得る。プロドラッグは、医薬の多くの好ましい品質(例えば、溶解性、生体利用性、製造上、等)を向上することが知られているため、本発明の化合物は、プロドラッグの形態で供給することができる。従って、本発明は、開示される化合物のプロドラッグ及びこれを供給する方法を含む。化合物のプロドラッグは、修飾が日常操作又はin vivoで親化合物に開裂されるような方法で、化合物中に存在する官能基を修飾することによって調製することができる。従って、プロドラッグは、例えば、ヒドロキシ、アミノ、又はカルボキシ基が、プロドラッグが哺乳動物の患者に投与された場合、開裂されて、それぞれ遊離のヒドロキシ、遊離のアミノ、又はカルボン酸を形成するいずれもの基に結合する本発明の化合物を含む。例は、制約されるものではないが、アルコール及びアミン官能基の酢酸、ギ酸及び安息香酸誘導体;並びにメチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec−ブチル、tert−ブチル、シクロプロピル、フェニル、ベンジル、及びフェネチルエステル、等のようなアルキル、炭素環式、アリール、及びアルキルアリールエステルを含む。このようなプロドラッグは、本発明の範囲内であると考えられる。
【0076】
[0074]本発明は、他の態様において、本明細書中に記載される化合物の代謝産物を提供する。一つの態様において、用語“代謝産物”は、代謝作用又は代謝過程によってもう一つの物質から産生されるいずれもの物質を指す。
【0077】
医薬組成物
[0075]本明細書中に記載される化合物は、単独で、又は製剤中の活性成分として投与することができる。従って、本発明は、更に、例えば、一つ又はそれより多い医薬的に受容可能な担体を含有する、本明細書中に記載される化合物の医薬組成物又は医薬製品の投与を含む。
【0078】
[0076]本発明による化合物を投与するために適した各種の製剤を調製するための方法を記載した多くの標準的な参考文献が利用可能である。潜在的な製剤及び調製の例が、例えば、Handbook of Pharmaceutical Excipients,American Pharmaceutical Association(現行版);Marcel Dekker,Inc.によって刊行されたPharmaceutical Dosage Forms:Tablets(Lieberman,Lachman and Schwartz,editors)現行版;並びにRemington’s Pharmaceutical Sciences(Arthur Osol,editor),1553−1593(現行版)中に含有されている。
【0079】
[0077]投与のモード及び剤形は、所定の治療の適用のために好ましい及び効果的である化合物又は組成物の治療的な量に密接に関係する。剤形は、制約されるものではないが、経口、直腸、舌下、粘膜、鼻腔、眼球、皮下、筋肉内、局所、静脈内、経皮、脊髄、髄腔内、関節内、動脈内、くも膜下、気管支、リンパ管、及び子宮(uterile)内投与、並びに活性成分の全身性供給のための他の剤形を含む。
【0080】
[0078]医薬剤形を調製するために、活性成分は、慣用的な医薬配合技術によって医薬的担体と混合することができる。担体は、投与のために好ましい製剤の形態によって幅広い種類の形態をとることができる。
【0081】
[0079]一つの態様において、本発明の方法は、本発明の化合物及び/又はその類似体、誘導体、異性体、代謝産物、医薬的に受容可能な塩、医薬製品、水和物、N−オキシド、又はこれらのいずれもの組合せを含有する医薬組成物を投与することを提供し、ここにおいて、前記投与することは、前記患者に、液体の形態の前記医薬組成物を静脈内、動脈内、又は筋肉内に注射すること;前記患者に、前記医薬組成物を含有するペレットを皮下に植込むこと;前記患者に、液体又は固体の形態の前記医薬組成物を経口投与すること;或いは前記患者の皮膚表面に前記医薬組成物を局所適用することを含んでなる。
【0082】
[0080]一つの態様において、医薬組成物は、経口投与され、そして従って、経口投与のために適した形態、即ち、固体又は液体製剤としてに処方される。適した固体の経口製剤は、錠剤、カプセル、丸薬、顆粒、ペレット等を含む。適した液体の経口製剤は、溶液、懸濁液、分散物、乳液、油等を含む。本発明の一つの態様において、本発明の化合物は、カプセル中に処方される。本発明の一つの態様において、本発明の化合物は、錠剤中に処方される。この態様によれば、本発明の組成物は、不活性担体又は希釈剤を含んでなる。
【0083】
[0081]更に、もう一つの態様において、医薬組成物は、液体製剤の静脈内、動脈内、又は筋肉内注射によって投与される。適した液体製剤は、溶液、懸濁液、分散物、乳液、油等を含む。一つの態様において、医薬組成物は、静脈内に投与され、そして従って、静脈内投与のために適した形態で処方される。もう一つの態様において、医薬組成物は、動脈内に投与され、そして従って、動脈内投与のために適した形態に処方される。もう一つの態様において、医薬組成物は、筋肉内に投与され、そして従って、筋肉内投与のために適した形態に処方される。
【0084】
[0082]一つの態様において、投与のモードは局所である。更なる態様において、本明細書中に記載される化合物は、クリームとして適用される。更なる態様において、本明細書中に記載される化合物は、クリームとしてそれを必要とする患者の眼瞼の側面に適用される。
【0085】
[0083]ある態様において、医薬組成物は、マイボーム腺オリフィスへの製剤の供給のために、眼瞼、眼の周辺部、まつげ及び/又は眼瞼周辺部への局所投与のために適した溶液、懸濁液及び、ある態様において、他の剤形に処方される。ある態様において、液体(水性又は非水性)溶液が、処方の容易さ、並びに眼瞼、まつげ、及び/又は眼瞼周辺部への製剤の適用によりこのような組成物を容易に投与する患者の能力に基づいて使用される。適用は、患者の指、Weck−Cel(登録商標)、Q−チップ、又は製剤をマイボーム腺オリフィスに供給するために、製剤を眼瞼、まつげ及び/又は眼瞼周辺部に供給することが可能な他のデバイス、のような塗布器で行うことができる。然しながら、組成物は、更に、例えば、クリーム、ゲル、軟膏、懸濁液、粘性又は半粘性ゲル、或いは他の種類の固体又は半固体組成物であることもできる。
【0086】
[0084]いずれもの各種の担体を、本発明において使用される製剤中で使用することができる。一つの態様において、担体は、涙膜の抗蒸発性脂質層の増強(増加した涙液膜破壊時間(TFBUT)及び/又は眼球保護指数(OPI)によって証明されるような)による眼球表面の保護、マイボーム腺オリフィスの急性保護を提供し、そしてマイボーム腺オリフィスへの活性剤の滞留時間を延長することによって、最小の視覚破壊(例えば、ぼやけ)、眼の掻痒感、又は眼瞼の固化を伴って、活性剤成分の治療効力を増加する範囲の粘度を有する、非水性担体(例えば、油又は油混合物)である。例えば、非水性担体の粘度は、約50cpsないし約1000cps、約50cpsないし約500cps、約50cpsないし約200cps、又は約60cpsないし約120cpsの範囲であることができる。ある態様において、非水性担体は、油、例えばひまし油、オリーブ油、ピーナツ油、マカデミアナッツ油、クルミ油、アーモンド油、南瓜種子油、綿実油、ゴマ油、コーン油、ダイズ油、アボカド油、パーム油、ヤシ油、ヒマワリ油、紅花油、亜麻仁油、ブドウ種子油、キャノーラ油、低粘度シリコーン油、軽質鉱油、又はいずれものこれらの混合物を含んでなる。
【0087】
[0085]ある態様において、涙液代用薬は、医薬担体として作用することができる。適した涙液代用薬は、制約されるものではないが、グリセロール、プロピレングリコール、及びエチレングリコールのようなモノマーのポリオール;ポリエチレングリコールのようなポリマーのポリオール;ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム及びヒドロキシプロピルセルロースのようなセルロースエステル;デキストラン70のようなデキストラン;ゼラチンのような水溶性タンパク質;ポリビニルアルコール、ポリビニルピロリドン、及びポビドンのようなポリマー;カルボマー934P、カルボマー941、カルボマー940及びカルボマー974Pのようなカルボマー;並びにHP−グアーのようなゴムを含む。多くのこのような涙液代用薬は、商業的に入手可能であり、これらは、制約されるものではないが、Bion TearsTM、Celluvisco、GentealTM、OccuCoat lTM、RefreshTM、Teargen IITM、Tears NaturaleTM、Tears Naturale IITM、Tears Naturale FreeTM、及びTheraTearsTMのようなセルロースエステル;並びにAkwa TearsTM、HypoTearsTM、Moisture EyesTM、Murine LubricatingTM、SystaneTM、Lubricant Eye Drops及びVisine TearsTMのようなポリビニルアルコールを含む。涙液代用薬は、更に商業的に入手可能なLacri−LibeTM軟膏のようなパラフィンを含んでなることができる。涙液代用薬として使用することができる他の商業的に入手可能な軟膏は、例えば、Lubrifresh PMTM、Moisture Eyes PMTM及びRefresh PMTMを含む。
【0088】
[0086]ある態様において、涙液代用薬は、ヒドロキシプロピルメチルセルロースを含有する。ある態様において、涙液代用薬は、GentealTM潤滑性点眼薬である。GenTealTM(CibaVision−Novartis)は、ヒドロキシプロピルメチルセルロースを3mg/g含有する滅菌潤滑性点眼薬であり、そして過ホウ酸ナトリウムで保護されている。
【0089】
[0087]もう一つの態様において、涙液代用薬は、カルボキシメチルセルロースナトリウムを含んでなる。例えば、制約されるものではないが、カルボキシメチルセルロースナトリウムを含んでなる涙液代用薬は、RefreshTM Tearsであることができる。RefreshTM Tearsは、穏やかな非刺激性保存剤である安定化されたオキシクロロ複合体(PuriteTM)を含有する、正常な涙液と同様な潤滑性製剤であり、これは、使用された場合、最終的に天然の涙液の成分に変化する。
【0090】
[0088]更なる担体を、本発明の製剤に所望により含むことができる。更なる担体の例は、例えば、水、水及びC1−7−アルカノール、植物油、鉱油又は0.5ないし5%の非毒性水溶性ポリマーを含んでなる他の油類のような水混和性溶媒、ゼラチン、アルギネート、ペクチン、トラガカントゴム、カラヤゴム、キサンタンゴム、カラゲニン、寒天及びアラビアゴムのような天然の産物、酢酸デンプン、ヒドロキシプロピルデンプンのようなデンプン誘導体を、そして更にポリビニルアルコール、ポリビニルピロリドン、ポリビニルメチルエーテル、ポリエチレンオキシド、例えば天然のCarbopolのような架橋ポリアクリル酸、或いはこれらのポリマーの混合物のような他の合成産物を含む。担体の濃度は、例えば、活性成分の濃度の1ないし100000倍であることができる。
【0091】
[0089]製剤中に含むことができる更なる成分は、例えば、等張性向上剤、保存剤、可溶化剤、非毒性賦形剤、粘滑剤、捕捉剤、pH調節剤、共溶媒、粘度増加剤、及びこれらの組合せを含む。
【0092】
[0090]例えば生理学的pHへのpHの調節のために、緩衝液が有用であることができる。ある態様において、溶液のpHは、約4.0ないし約6.0のような約4.0ないし約8.0の範囲、例えば約6.5ないし約7.8に維持される。例えば、ホウ酸、ホウ酸ナトリウム、クエン酸カリウム、クエン酸、重炭酸ナトリウム、TRIS、及び各種の混合リン酸緩衝液(Na2HPO4、NaH2PO4及びKH2PO4の組合せを含む)及びこれらの混合物のような適した緩衝液を、加えることができる。一般的に、緩衝液は、約0.1ないし約1.5重量パーセントのような、約0.05ないし約2.5重量パーセントの範囲の量で使用することができる。
【0093】
[0091]必要な場合、等張性は、等張性向上剤の使用によって調節することができる。このような薬剤は、例えば、イオン性及び/又は非イオン性の種類であることができる。イオン性等張性向上剤の例は、例えば、例えばCaCl2、KBr、KCl、LiCl、NaI、NaBr又はNaCl、Na2SO4或いはホウ酸のようなアルカリ金属又は土類金属ハロゲン化物を含む。非イオン性等張性向上剤は、例えば、尿素、グリセロール、ソルビトール、マンニトール、プロピレングリコール、又はデキストロースを含む。水溶液は、等張性剤(類)で、塩化ナトリウムの0.9%溶液又はグリセロールの2.5%溶液と同等な、正常な涙液の浸透圧に近似するように調節することができる。一つの態様において、約225ないし約400mOsm/kgの重量モル浸透圧濃度が得られる。一つの態様において、約280ないし約320mOsm/kgの重量モル浸透圧濃度が得られる。
【0094】
[0092]更なる態様において、局所製剤は、更に保存剤を含んでなることができる。保存剤は、典型的には、塩化ベンザルコニウム、塩化ベンゾキソニウム(例えば、塩化N−ベンジル−N−(C8−C18アルキル)−N,N−ジメチルアンモニウム)等のような四級アンモニウム化合物から選択することができる。四級アンモニウム塩と異なる保存剤の例は、例えば、例えばチオメルサール、硝酸フェニル水銀、酢酸フェニル水銀又はホウ酸フェニル水銀のようなチオサリチル酸のアルキル水銀塩、過ホウ酸ナトリウム、亜塩素酸ナトリウム、例えばメチルパラベン又はプロピルパラベンのようなパラベン、例えばクロロブタノール、ベンジルアルコール又はフェニルエタノールのようなアルコール、例えばクロロヘキシジン又はポリヘキサメチレンビグアニドのようなグアニジン誘導体、過ホウ酸ナトリウム、GermalTMII或いはソルビン酸を含む。ある態様において、保存剤は、四級アンモニア化合物、例えば塩化ベンザルコニウム又はPolyquad(例えば米国特許第4,407,791号を参照されたい)のようなその誘導体、アルキル水銀塩及びパラベンである。適当な場合、十分な量の保存剤を眼科組成物に添加して、細菌及び真菌によって起こされる使用中の二次汚染に対する保護を確実にすることができる。
【0095】
[0093]もう一つの態様において、局所製剤は、保存剤を含まない。このような製剤は、コンタクトレンズを使用する、又は幾つかの局所用点眼剤を使用する、及び/又は保存剤に対する制約された暴露が更に好ましいことであることができる既に損なわれた眼球表面を持つ患者のために有用であることができる。
【0096】
[0094]局所製剤は、例えば活性又は不活性成分が懸濁液或いは乳液を形成する傾向がある場合、更に可溶化剤を含むことができる。適した可溶化剤は、制約されるものではないが、チロキサポール、脂肪酸グリセロールポリエチレングリコールエステル、脂肪酸ポリエチレングリコールエステル、ポリエチレングリコール、グリセロールエーテル、シクロデキストリン(例えばアルファ−、ベータ−又はガンマ−シクロデキストリン、例えばアルキル化、ヒドロキシアルキル化、カルボキシアルキル化又はアルコキシカルボニル−アルキル化された誘導体、或いはモノ−又はジグリコシル−アルファ−、ベータ−又はガンマ−シクロデキストリン、モノ−又はジマルトシル−アルファ−、ベータ−又はガンマ−シクロデキストリン、或いはパモシル−シクロデキストリン)、ポリソルベート20、ポリソルベート80又はこれらの化合物の混合物を含む。ある態様において、可溶化剤は、ひまし油及びエチレンオキシドの反応生成物、例えば商業的産物Cremophor ELTM又はCremophor RH40TMである。ひまし油及びエチレンオキシドの反応生成物は、眼によって極めて良く許容される特に良好な可溶化剤であることが証明されている。もう一つの態様において、可溶化剤は、チロキサポール及びシクロデキストリンから選択される。使用される濃度は、特に活性成分の濃度に依存する。加えられる量は、典型的には、活性成分を可溶化するために十分である。例えば、安定剤の濃度は、活性成分の濃度の0.1ないし5000倍である。
【0097】
[0095]製剤は、更に例えば、乳化剤、湿潤剤或いは例えば200、300、400及び600と命名されたポリエチレングリコール、又は1000、1500、4000及び10000と命名されたCarbowaxのような充填剤のような非毒性の賦形剤を含んでなることができる。添加される賦形剤の量及び種類は、特定の要求により、そして一般的に概略0.0001ないし概略90重量%の範囲である。
【0098】
[0096]他の化合物も、担体の粘度を調節(例えば増加)するために、更に本発明の製剤に加えることができる。粘度向上剤の例は、制約されるものではないが、ヒアルロン酸のような多糖及びその塩、硫酸コンドロイチン及びその塩、デキストラン、セルロースファミリーの各種のポリマー;ビニルポリマー;及びアクリル酸ポリマーを含む。
【0099】
[0097]製剤が軟膏である態様において、ある態様において、眼科用軟膏を調製するために使用される軟膏基剤は、慣用的な眼科用軟膏において使用されるものであることができる。例えば、基剤は、液体パラフィン、白色ワセリン、精製ラノリン、ゲル化炭化水素、ポリエチレングリコール、親水性軟膏基剤、白色軟膏基剤、吸収性軟膏基剤、Macrogol(商標)軟膏基剤、単純軟膏基剤、等であることができる。
【0100】
[0098]眼科用軟膏は、更に軟膏基剤以外の慣用的な賦形剤を含んでなることができる。このような賦形剤の例は、制約されるものではないが、例えば、パラヒドキシベンゾエート、クロロブタノール、塩化ベンザルコニウム等のような防腐剤;ポリソルベート80、ステアリン酸ポリオキシル40、ポリオキシエチレン水素化ひまし油等のような界面活性剤;エデト酸ナトリウム、クエン酸、及びその塩のような安定剤;グリセロール、ラノリンアルコール、セタノール等のようなアルコール;ミリスチン酸イソプロピル、リノレイン酸エチル等のようなエステル;オリーブ油のような油、並びに中鎖脂肪酸のトリグリセリドを含む。
【0101】
[0099]更なる態様において、組成物は、眼の表面に薬剤を輸送又は運搬或いは供給することに関係する、液体(水性又は非水性)又は固体充填剤、希釈剤、賦形剤、溶媒又はカプセル化物質のような医薬的に受容可能な物質、組成物又はベヒクルを含んでなることができる。それぞれの担体は、他の組成物の成分と適合性であり、そして患者にとって有害ではないという意味において“受容可能”でなければならない。医薬的に受容可能な担体として役立つことができる物質の幾つかの更なる例は、例えば、(1)ラクトース、グルコース及びスクロースのような糖;(2)コーンスターチ及びジャガイモデンプンのようなデンプン;(3)カルボキシメチルセルロースナトリウム、エチルセルロース及び酢酸セルロースのようなセルロース並びにその誘導体;(4)粉末トラガカントゴム;(5)麦芽;(6)ゼラチン;(7)タルク;(8)ココアバター及び座薬用ワックスのような賦形剤;(9)ひまし油、オリーブ油、ピーナツ油、マカデミアナッツ油、クルミ油、アーモンド油、南瓜種子油、綿実油、ゴマ油、コーン油、ダイズ油、アボカド油、パーム油、ヤシ油、ヒマワリ油、紅花油、亜麻仁油、ブドウ種子油、キャノーラ油、低粘度シリコーン油、軽質鉱油、又はこれらの組合せのような油;(10)プロピレングリコールのようなグルコール;(11)グリセリン、ソルビトール、マンニトール及びポリエチレングリコールのようなポリオール;(12)オレイン酸エチル及びラウリン酸エチルのようなエステル;(13)寒天;(14)水酸化マグネシウム及び水酸化アルミニウムのような緩衝剤;(15)アルギン酸;(16)パイロジェン不含水;(17)等張生理食塩水;(18)リンゲル溶液;(19)エチルアルコール;(20)リン酸緩衝溶液;(21)HP−グアーのようなゴム;(22)ポリマー;並びに(23)医薬製剤中に使用される他の非毒性の適合性物質を含む。
【0102】
[00100]活性成分を含有する医薬組成物の調製は、当技術において十分に理解されている。活性な治療成分は、しばしば医薬的に受容可能であり、そして活性成分と適合性である賦形剤と混合される。
【0103】
[00101]活性成分は、中和された医薬的に受容可能な塩の形態で組成物中に処方することができる。医薬的に受容可能な塩は、例えば、塩酸又はリン酸のような無機酸、或いは酢酸、シュウ酸、酒石酸、マンデリン酸、クエン酸等のような有機酸と形成される酸付加塩(ペプチド又は抗体分子の遊離アミノ基と形成)を含む。遊離カルボキシル基から形成される塩は、更に例えば、ナトリウム、カリウム、アンモニウム、カルシウム、又は水酸化第二鉄のような無機塩基、並びにイソプロピルアミン、トリメチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカイン、等のような有機塩基から誘導することもできる。
【0104】
[00102]医薬における使用のために、本発明の化合物の塩は、医薬的に受容可能な塩である。然しながら、他の塩は、本発明による化合物又はその医薬的に受容可能な塩の調製において有用であることができる。本発明の化合物の適した医薬的に受容可能な塩は、例えば、本発明による化合物の溶液を、塩酸、硫酸、乳酸、酢酸、ギ酸、メタンスルホン酸、フマル酸、マレイン酸、コハク酸、酢酸、安息香酸、シュウ酸、クエン酸、酒石酸、炭酸又はリン酸のような医薬的に受容可能な酸の溶液と混合することによって形成することができる酸付加塩を含む。
【0105】
[00103]幾つかの態様において、本発明の化合物は、単剤療法として投与される。他の態様において、本発明の化合物は、組合せ療法の一部として投与される。例えば、本明細書中に記載される化合物は、本明細書中に記載される化合物が有用である疾病又は症状の治療において使用される他の薬物又は療法との組合せにおいて使用することができる。このような組合せにおいて、それぞれの活性成分は、その通常の投与量範囲で、又はその通常の投与量範囲より下の投与量でのいずれかで投与することができる。例えば、本明細書中に記載される化合物は、抗感染剤(例えば、テトラサイクリン抗生物質)、血管収縮剤、抗アレルギー剤、麻酔剤、鎮痛剤、ドライアイ剤(例えば、分泌促進剤、粘液模倣物質、ポリマー、脂質、抗酸化剤)、等、又はこれらのいずれもの組合せ、との組合せで付属的に投与することができる。
【0106】
[00104]このような他の薬物(類)は、本明細書中に記載される化合物と同時に又は連続して、そのために普通に使用される経路及び量によって投与することができる。本明細書中に記載される化合物が一つ又はそれより多い他の薬物と同時に使用される場合、本明細書中に記載される化合物に加えて、このような他の薬剤を含有する医薬的単位剤形を使用することができる。従って、本発明の医薬組成物は、本明細書中に記載される化合物に加えて、一つ又はそれより多い他の活性成分を更に含有するものを含む。
【0107】
[00105]付属的投与に関して、これは、同一剤形中の化合物の同時投与、別個の剤形中の同時投与、及び化合物の別個投与を意味する。
[00106]一つの態様において、本発明の方法は、各種の投与量の本発明の化合物の投与を含んでなる。一つの態様において、本発明の化合物は、一日当たり約0.01ないし約200mgの投与量で投与される。一つの態様において、本発明の化合物は、約0.1ないし約150mg、又はもう一つの態様において、0.1ないし約100mg、又はもう一つの態様において、約0.1ないし約75mg、又はもう一つの態様において、約0.1ないし約50mg、又はもう一つの態様において、約0.5ないし約100mg、又はもう一つの態様において、約0.5ないし約75mg、又はもう一つの態様において、約0.5ないし約50mg、又はもう一つの態様において、約0.5ないし約25mg、又はもう一つの態様において、約1ないし約100mg、又はもう一つの態様において、約1ないし約75mg、又はもう一つの態様において、約1ないし約50mg、又はもう一つの態様において、約1ないし約25mgの投与量で投与される。
【0108】
[00107]一つの態様において、本発明の方法は、各種の投与量の本発明の化合物の投与を含んでなる。一つの態様において、本発明の化合物は、約0.01mgの投与量で投与される。もう一つの態様において、本発明の化合物は、約0.1mg、約0.25mg、約0.5mg、約0.75mg、約1mg、約1.25mg、約1.5mg、約1.75mg、約2mg、約2.5mg、約5mg、約7.5mg、約10mg、約15mg、約20mg、約25mg、約30mg、約35mg、約40mg、約45mg、約50mg、約55mg、約60mg、約65mg、約70mg、約75mg、約80mg、約85mg、約90mg、約95mg又は約100mgの投与量で投与される。
【0109】
[00108]更なる態様において、本発明の方法は、約0.01mg/kgないし5mg/kg、例えば、約0.1mg/kgないし約3mg/kgの範囲の本発明の化合物の投与を含んでなる。他の態様において、本発明の化合物は、約0.1mg/kg、約0.25mg/kg、約0.5m/kg、約0.625mg/kg、約0.75mg/kg、約1mg/kg、約1.25mg/kg、約1.5mg/kg、約1.75mg/kg、約2mg/kg、約2.5mg/kg、約3mg/kg、約3.5mg/kg、約4.5mg/kg又は約5mg/kgの投与量で投与される。
[00109]用語“治療すること”は、患者の少なくとも一つの症状の徴候を解放、緩和、遅延、軽減、逆転、改善又は予防することを意味する。用語“治療すること”は、異常なマイボーム腺分泌、マイボーム腺機能障害、ドライアイ、マイボーム腺分泌、眼瞼周辺部の発赤、患者の眼の灼熱/掻痒感、眼の異常感、角膜上皮びらん、眼球及び結膜染色から選択される、患者の少なくとも一つの徴候を解放、緩和、遅延、軽減、逆転、改善又は予防すること、並びに霞み及び/又はファジーな視覚を軽減することを指す。用語“治療すること”はまた、発症を抑止、遅延すること(即ち、疾病の臨床顕在化の前の期間)及び/又は症状の進行又は悪化の危険性を減少することを意味することができる。本発明の化合物は、単剤療法として投与することができ、又は組合せ療法の一部として投与することができる。例えば、一つ又はそれより多い本発明の化合物は、当技術において既知の一つ又はそれより多い更なる治療剤と、同時投与されるか、又はそれと組合せて使用することができる。
【0110】
[00110]“有効な量”は、疾病を治療するために患者(例えば、哺乳動物)に投与した場合、疾病に対してこのような治療をもたらすために十分な、本明細書中に記載される化合物の量、又は本発明の目的(例えば、マイボーム腺機能障害を治療すること)を達成するために十分な、本明細書中に記載される化合物の量を意味する。“有効な量”は、化合物、疾病及びその重篤度並びに治療される患者の年齢、体重、等によって変化するものである。
【0111】
[00111]治療化合物の投与が疾病又は疾患の有効な治療計画である被験者又は患者は、好ましくはヒトであるが、しかし臨床試行又はスクリーニング或いは活性実験の文脈における実験動物を含むいずれもの動物であることができる。従って、当業者によって容易に認識されることができるように、本発明の方法、化合物及び組成物は、いずれもの動物、特に、そして制約されるものではないが、ヒト、ネコ又はイヌの被験者のような家畜(例えば、Ofri R,et al.The Veterinary Journal,174,536−540,2007を参照されたい)、制約されるものではないが、ウシ、ウマ、ヤギ、ヒツジ、及びブタの被験者のような農場動物、野生動物(野生又は動物園に関わらず)、マウス、ラット、ウサギ、ヤギ、ヒツジ、ブタ、イヌ、ネコ、等のような研究用動物を含む哺乳動物、ニワトリ、七面鳥、鳴鳥類等のようなトリ種への、即ち獣医学的使用のための投与に特に適している。
【0112】
[00112]用語“約”又は“およそ”は、当業者によって決定されるような特定の数値に対して、受容可能な誤差範囲内であることを意味し、これは、一部その数値が如何に測定又は決定されたか、即ち、測定系の制約に依存するものである。例えば、“約”は、当技術において実行当たり1又は1より多い標準偏差内であることを意味することができる。別の方法として、組成に関する“約”は、プラスマイナス20%迄、好ましくは10%迄、更に好ましくは5%迄の範囲を意味することができる。
【0113】
[00113]用語“パルミチン酸:ステアリン酸比”は、涙液の脂質中の根底にある脂肪酸組成を反映するマーカーの比として使用することができる。
[00114]用語“異常なマイボーム腺分泌”は、例えば、増加した粘度、増加した融点、減少したパルミチン酸とステアリン酸の比、増加した混濁或いは増加した色及び/又は増加した腺分泌間の時間(不応期)、減少したTFBUT、等を伴うマイボーム腺分泌を指す。
【0114】
[00115]用語“マイボーム腺機能障害を正常化すること”は、例えば、粘度の減少、融点の減少、パルミチン酸とステアリン酸の比の増加、マイボーム腺分泌物の混濁の減少又は色の減少及び/又は腺分泌間の時間(不応期)の減少、TFBUTの増加、等を指す。
【0115】
[000116]用語“眼瞼炎”は、異常なマイボーム腺分泌が役割を演じ、そして眼瞼の角質化、眼瞼周辺部円唇化、灰色腺の不明瞭化、増加した眼瞼周辺部透明度、及び増加した血管分布が観察される、眼瞼周辺部の炎症を含んでなる疾患を指す。用語マイボーム腺機能障害及び瞼板腺炎は、殆どの研究者によって眼瞼炎と共通に呼ばれるが、これらが異常なマイボーム腺分泌に伴う別個の疾病であり、そして用語は互換的ではないことを注記することは重要である。
【0116】
[00117]本明細書中に記載されるいずれもの化合物のいずれもの使用は、本明細書中に記載されるような疾病、疾患又は症状の治療において使用することができ、そして本発明の一つの態様であることは理解されることである。
【0117】
[00118]以下の実施例は、本発明の好ましい態様を更に完全に例示するために提供される。然しながら、これらは、本発明の広い範囲を制約するものとしていかなる方法ででも解釈されるべきではない。本発明は、本発明の例示的態様を参照して示され、そして記載されてきたが、このような参照は、本発明の制約を意味するものではなく、そしてこのような制約は暗示されていない。本発明は、本開示の利益を有する関連技術の当業者にとって思いつくものであるような、多くの改変、変更、並びに形態及び機能の均等物が可能である。本発明の示され、そして記載される態様は、例示のみであり、そして本発明の範囲の網羅的なものではない。従って、本発明は、全ての点で均等物に完全な認識を与える、付属する特許請求の範囲の思想及び範囲によってのみ制約されることを意図するものである。
【0118】
[00119]本明細書中に引用される全ての参考文献は、その全てが参考文献として本明細書中に援用される。
【実施例】
【0119】
実施例1
(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミド(化合物1)の合成
【0120】
【化5】

【0121】
[00120](2R)−1−メタクリロイルピロリジン−2−カルボン酸。 D−プロリン、14.93g、0.13mol)を、71mLの2NのNaOH中に溶解し、そして氷浴中で冷却した;得られたアルカリ性溶液を、アセトン(71mL)で希釈した。塩化メタクリロイル(13.56g、0.13mol)のアセトンの溶液(71mL)及び2NのNaOH(71mL)を、氷浴中のD−プロリンの水溶液に40分かけて同時に加えた。混合物のpHを塩化メタクリロイルの添加中10−11℃に保った。撹拌した後(3時間、室温)、混合物を真空中(in vacuo)で35−45℃の温度でエバポレートして、アセトンを除去した。得られた溶液をエチルエーテルで洗浄し、そして濃HClでpH2に酸性化した。酸性の混合物をNaClで飽和し、そしてEtOAc(100mL×3)で抽出した。合わせた抽出物をNa2SO4で乾燥し、セライトを通して濾過し、そして真空中でエバポレートして、粗製生成物を無色の油状物として得た。エチルエーテル及びヘキサンからの油状物の再結晶化により、16.2g(68%)の所望の化合物を無色の結晶として得た:融点102−103℃;この化合物のNMRスペクトルは、表題化合物の二つの回転異性体の存在を示した。1H NMR(300MHz,DMSO−d6)δ 第1の回転異性体に対して5.28(s)及び5.15(s)、第2の回転異性体に対して5.15(s)及び5.03(s)(両方の回転異性体に対して全て2H、ビニルCH2)、第1の回転異性体に対して4.48−4.44、第2の回転異性体に対して4.24−4.20(m)(両方の回転異性体に対して全て1H、キラル中心におけるCH),3.57−3.38(m,2H,CH2),2.27−2.12(1H,CH),1.97−1.72(m,6H,CH2,CH,Me);13C NMR(75MHz,DMSO−d6)δ 主要な回転異性体に対して173.3,169.1,140.9,116.4,58.3,48.7,28.9,24.7,19.5:少数の回転異性体に対して174.0,170.0,141.6,115.2,60.3,45.9,31.0,22.3,19.7;IR(KBr)3437(OH),1737(C=O),1647(CO,COOH),1584,1508,1459,1369,1348,1178cm−1。
【0122】
【化6】

【0123】
[00121](3R,8aR)−3−ブロモメチル−3−メチル−テトラヒドロ−ピロロ[2,1−c][1,4]オキサジン−1,4−ジオン。 NBS(23.5g、0.132mol)の100mLのDMF中の溶液を、(メチル−アクリロイル)−ピロリジン(16.1g、88mmol)の70mLのDMF中の室温のアルゴン下の撹拌された溶液に滴下により加え、そして得られた混合物を3日間撹拌した。溶媒を真空中で除去し、そして黄色の固体が沈殿した。固体を水中に懸濁し、室温で一晩撹拌し、濾過し、そして乾燥して、18.6g(81%)(乾燥したとき、約34%少ない重量)の表題化合物を、黄色の固体として得た:融点152−154℃;1H NMR(300MHz,DMSO−d6)δ 4.69(dd,J=9.6Hz,J=6.7Hz,1H,キラル中心におけるCH),4.02(d,J=11.4Hz,1H,CHHa),3.86(d,J=11.4Hz,1H,CHHb),3.53−3.24(m,4H,CH2),2.30−2.20(m,1H,CH),2.04−1.72(m,3H,CH2及びCH),1.56(s,2H,Me);13C NMR(75MHz,DMSO−d6)δ 167.3,163.1,83.9,57.2,45.4,37.8,29.0,22.9,21.6;IR(KBr)3474,1745(C=O),1687(C=O),1448,1377,1360,1308,1227,1159,1062cm−1;[α]D26+124.5°(c=1.3,クロロホルム)。
【0124】
【化7】

【0125】
[00122](2R)−3−ブロモ−2−ヒドロキシ−2−メチルプロパン酸。 ブロモラクトン(18.5g、71mmol)の300mLの24%HBr中の混合物を、還流で1時間加熱した。得られた溶液を食塩水(200mL)で希釈し、そして酢酸エチル(100mL×4)で抽出した。合わせた抽出物を飽和NaHCO3(100mL×4)で洗浄した。水溶液を濃HClでpH=1に酸性化し、次に酢酸エチル(100mL×4)で抽出した。合わせた有機溶液をNa2SO4で乾燥し、セライトを通して濾過し、そして真空中で乾燥状態までエバポレートした。トルエンからの再結晶化により、10.2g(86%)の所望の化合物を、無色の結晶として得た。融点107−109℃;1H NMR(300MHz,DMSO−d6)δ 3.63(d,J=10.1Hz,1H,CHHa),3.52(d,J=10.1Hz,1H,CHHb),1.35(s,3H,Me);IR(KBr)3434(OH),3300−2500(COOH),1730(C=O),1449,1421,1380,1292,1193,1085cm−1;[α]D26+10.5°(c=2.6,MeOH)。
【0126】
【化8】

【0127】
[00123](2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミド。 塩化チオニル(46.02g、0.39mol)を、(2R)−3−ブロモ−2−ヒドロキシ−2−メチルプロパン酸(51.13g、0.28mol)の300mLのTHF中のアルゴン雰囲気下の冷却された溶液(4℃より低く)に、滴下により加えた。得られた混合物を3時間同一条件下で撹拌した。これに、Et3N(39.14g、0.39mol)を加え、そして20分間同一条件下で撹拌した。20分後、5−アミノ−2−シアノベンゾトリフルオリド(40.0g、0.21mol)、400mLのTHFを加え、そして次いで混合物を一晩室温で撹拌させた。溶媒を減圧下で除去して、固体を得て、これを300mLのH2Oで処理し、EtOAc(2×400mL)で抽出した。合わせた有機抽出物を飽和NaHCO3溶液(2×300mL)及び食塩水(300mL)で洗浄した。有機層をMgSO4で乾燥し、そして減圧下で濃縮して、固体を得て、これをCH2Cl2/EtOAc(80:20)を使用するカラムクロマトグラフィーから精製して、固体を得た。この固体をCH2Cl2/ヘキサンから再結晶化して、55.8g(73.9%)の(2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミドを、明るい黄色の固体として得た。1H NMR(CDCl3/TMS)δ 1.66(s,3H,CH3),3.11(s,1H,OH),3.63(d,J=10.8Hz,1H,CH2),4.05(d,J=10.8Hz,1H,CH2),7.85(d,J =8.4Hz,1H,ArH),7.99(dd,J=2.1,8.4Hz,1H,ArH),8.12(d,J=2.1Hz,1H,ArH),9.04(bs,1H,NH).計算質量:349.99,[M−H]− 349.0.融点:124−126℃。
【0128】
【化9】

【0129】
[00124](S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミド(化合物1)。 ブロモアミド((2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミド、50g、0.14mol)、無水のK2CO3(59.04g、0.43mol)、4−シアノフェノール(25.44g、0.21mol)の500mLの2−プロパノール中の混合物を、還流で3時間加熱し、そして次いで減圧下で濃縮して、固体を得た。得られた残渣を500mLのH2Oで処理し、そして次いでEtOAc(2×300mL)で抽出した。合わせたEtOAc抽出物を10%NaOH(4×200mL)及び食塩水で洗浄した。有機層をMgSO4で乾燥し、そして次いで減圧下で濃縮して、油状物を得て、これを300mLのエタノール及び活性炭で処理した。反応混合物を還流で1時間加熱し、そして次いで熱混合物をセライトを通して濾過した。濾液を減圧下で濃縮して油状物を得た。この油状物をCH2Cl2/EtOAc(80:20)を使用するカラムクロマトフィーによって精製して、油状物を得て、これをCH2Cl2/ヘキサンから結晶化して、33.2g(59.9%)の(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミドを、無色の固体(綿型)として得た。1H NMR(CDCl3/TMS)δ 1.63(s,3H,CH3),3.35(s,1H,OH),4.07(d,J=9.04Hz,1H,CH),4.51(d,J=9.04Hz,1H,CH),6.97−6.99(m,2H,ArH),7.57−7.60(m,2H,ArH),7.81(d,J=8.55Hz,1H,ArH),7.97(dd,J=1.95,8.55Hz,1H,ArH),8.12(d,J=1.95Hz,1H,ArH),9.13(bs,1H,NH).計算質量:389.10,[M−H]−388.1.融点:92−94℃。
【0130】
実施例2
(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノ−3−フルオロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミド(化合物2)
【0131】
【化10】

【0132】
[00125](2R)−1−メタクリロイルピロリジン−2−カルボン酸。
[00126] D−プロリン、14.93g、0.13mol)を、71mLの2NのNaOH中に溶解し、そして氷浴中で冷却した;得られたアルカリ性溶液を、アセトン(71mL)で希釈した。塩化メタクリロイル(13.56g、0.13mol)のアセトンの溶液(71mL)及び2NのNaOH(71mL)を、氷浴中のD−プロリンの水溶液に40分かけて同時に加えた。混合物のpHを塩化メタクリロイルの添加中10−11℃に保った。撹拌した後(3時間、室温)、混合物を真空中で35−45℃の温度でエバポレートして、アセトンを除去した。得られた溶液をエチルエーテルで洗浄し、そして濃HClでpH2に酸性化した。酸性の混合物をNaClで飽和し、そしてEtOAc(100mL×3)で抽出した。合わせた抽出物をNa2SO4で乾燥し、セライトを通して濾過し、そして真空中でエバポレートして、粗製生成物を無色の油状物として得た。エチルエーテル及びヘキサンからの油状物の再結晶化により、16.2g(68%)の所望の化合物を無色の結晶として得た:融点102−103℃;この化合物のNMRスペクトルは、表題化合物の二つの回転異性体の存在を示した。1H NMR(300MHz,DMSO−d6)δ 第1の回転異性体に対して5.28(s)及び5.15(s)、第2の回転異性体に対して5.15(s)及び5.03(s)(両方の回転異性体に対して全て2H、ビニルCH2)、第1の回転異性体に対して4.48−4.44、第2の回転異性体に対して4.24−4.20(m)(両方の回転異性体に対して全て1H、キラル中心におけるCH),3.57−3.38(m,2H,CH2),2.27−2.12(1H,CH),1.97−1.72(m,6H,CH2,CH,Me);13C NMR(75MHz,DMSO−d6)δ 主要な回転異性体に対して173.3,169.1,140.9,116.4,58.3,48.7,28.9,24.7,19.5:少数の回転異性体に対して174.0,170.0,141.6,115.2,60.3,45.9,31.0,22.3,19.7;IR(KBr)3437(OH),1737(C=O),1647(CO,COOH),1584,1508,1459,1369,1348,1178cm−1;[α]D26 +80.8°(c=1,MeOH);C9H13NO3に対する分析計算値:C59.00,H7.15,N7.65.実測値:C59.13,H7.19,N 7.61。
【0133】
【化11】

【0134】
[00127](3R,8aR)−3−ブロモメチル−3−メチル−テトラヒドロ−ピロロ[2,1−c][1,4]オキサジン−1,4−ジオン。 NBS(23.5g、0.132mol)の100mLのDMF中の溶液を、(メタクリロイル)−ピロリジン(16.1g、88mmol)の70mLのDMF中の室温のアルゴン下の撹拌された溶液に滴下により加え、そして得られた混合物を3日間撹拌した。溶媒を真空中で除去し、そして黄色の固体が沈殿した。固体を水中に懸濁し、室温で一晩撹拌し、濾過し、そして乾燥して、18.6g(81%)(乾燥したとき、約34%少ない重量)の表題化合物を、黄色の固体として得た:融点152−154℃;1H NMR(300MHz,DMSO−d6)δ 4.69(dd,J=9.6Hz,J=6.7Hz,1H,キラル中心におけるCH),4.02(d,J=11.4Hz,1H,CHHa),3.86(d,J=11.4Hz,1H,CHHb),3.53−3.24(m,4H,CH2),2.30−2.20(m,1H,CH),2.04−1.72(m,3H,CH2及びCH),1.56(s,2H,Me);13C NMR(75MHz,DMSO−d6)δ 167.3,163.1,83.9,57.2,45.4,37.8,29.0,22.9,21.6;IR(KBr)3474,1745(C=O),1687(C=O),1448,1377,1360,1308,1227,1159,1062cm−1;[α]D26+124.5°(c=1.3,クロロホルム)。
【0135】
【化12】

【0136】
[00128](2R)−3−ブロモ−2−ヒドロキシ−2−メチルプロパン酸。 ブロモラクトン(18.5g、71mmol)の300mLの24%HBr中の混合物を、還流で1時間加熱した。得られた溶液を食塩水(200mL)で希釈し、そして酢酸エチル(100mL×4)で抽出した。合わせた抽出物を飽和NaHCO3(100mL×4)で洗浄した。水溶液を濃HClでpH=1に酸性化し、次に酢酸エチル(100mL×4)で抽出した。合わせた有機溶液をNa2SO4で乾燥し、セライトを通して濾過し、そして真空中で乾燥状態までエバポレートした。トルエンからの再結晶化により、10.2g(86%)の所望の化合物を、無色の結晶として得た。融点107−109℃;1H NMR(300MHz,DMSO−d6)δ 3.63(d,J=10.1Hz,1H,CHHa),3.52(d,J=10.1Hz,1H,CHHb),1.35(s,3H,Me);IR(KBr)3434(OH),3300−2500(COOH),1730(C=O),1449,1421,1380,1292,1193,1085cm−1;[α]D26+10.5°(c=2.6,MeOH)。
【0137】
【化13】

【0138】
[00129](2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミドの合成。 塩化チオニル(46.02g、0.39mol)を、(R)−3−ブロモ−2−ヒドロキシ−2−メチルプロパン酸(51.13g、0.28mol)の300mLのTHF中のアルゴン雰囲気下の冷却された溶液(4℃より低く)に、滴下により加えた。得られた混合物を3時間同一条件下で撹拌した。これに、Et3N(39.14g、0.39mol)を加え、そして20分間同一条件下で撹拌した。20分後、5−アミノ−2−シアノベンゾトリフルオリド(40.0g、0.21mol)、400mLのTHFを加え、そして次いで混合物を一晩室温で撹拌させた。溶媒を減圧下で除去して、固体を得て、これを300mLのH2Oで処理し、EtOAc(2×400mL)で抽出した。合わせた有機抽出物を飽和NaHCO3溶液(2×300mL)及び食塩水(300mL)で洗浄した。有機層をMgSO4で乾燥し、そして減圧下で濃縮して、固体を得て、これをCH2Cl2/EtOAc(80:20)を使用するカラムクロマトグラフィーから精製して、固体を得た。この固体をCH2Cl2/ヘキサンから再結晶化して、55.8g(73.9%)の(2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミドを、明るい黄色の固体として得た。1H NMR(CDCl3/TMS)δ 1.66(s,3H,CH3),3.11(s,1H,OH),3.63(d,J=10.8Hz,1H,CH2),4.05(d,J=10.8Hz,1H,CH2),7.85(d,J =8.4Hz,1H,ArH),7.99(dd,J=2.1,8.4Hz,1H,ArH),8.12(d,J=2.1Hz,1H,ArH),9.04(bs,1H,NH).計算質量:349.99,[M−H]−349.0.融点:124−126℃。
【0139】
【化14】

【0140】
[00130](S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノ−3−フルオロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミド(化合物2)の合成。 ブロモアミド((2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミド(2.0g、5.70mmol)、無水のK2CO3(2.4g、17.1mmol)の50mLのアセトン中の混合物を、還流で2時間加熱し、そして次いで減圧下で濃縮して、固体を得た。得られた固体を、50mLの2−プロパノール中の2−フルオロ−4−ヒドロキシベンゾニトリル(1.2g、8.5mmol)及び無水のK2CO3(1.6g、11.4mmol)で処理し、還流で3時間加熱し、そして次いで減圧下で濃縮して、固体を得た。残渣を100mLのH2Oで処理し、そして次いでEtOAc(2×100mL)で抽出した。合わせたEtOAc抽出物を10%NaOH(4×100mL)及び食塩水で連続して洗浄した。有機層をMgSO4で乾燥し、そして次いで減圧下で濃縮して、油状物を得て、これをCH2Cl2/ヘキサンから結晶化して、0.5g(23%)の(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノ−3−フルオロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミドを、無色の固体として得た。1H NMR(CDCl3/TMS)δ 1.63(s,3H,CH3),3.34(bs,1H,OH),4.08(d,J=9.17Hz,1H,CH),4.50(d,J=9.17Hz,1H,CH),6.74−6.82(m,2H,ArH),7.50−7.55(m,1H,ArH),7.81(d,J=8.50Hz,1H,ArH),7.97(q,J=2.03,8.50Hz,1H,ArH),8.11(d,J=2.03Hz,1H,ArH),9.12(s,1H,NH).計算質量:407.1,[M+Na]+430.0.融点:124−125℃。
【0141】
実施例2A
(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−フルオロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミド(化合物3)の合成。
【0142】
【化15】

【0143】
[00131]ブロモアミド((2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミド(44.0g、125mmol)、無水のK2CO3(51.9g、376mmol)の800mLのアセトン中の混合物を、還流で2時間加熱し、これをTLCによってモニターし、エポキシ中間体への完全な転換を示した。室温に冷却した後、溶液をセライト545のパッドを通して濾過して、不溶性の固体を除去した。溶液を減圧下で濃縮した。フラスコに、800mLのメチルエチルケトン中の更なるK2CO3(34.6g、250mmol)及び4−フルオロフェノール(14.05g、125mmol)を入れ、そして還流で一晩加熱した。次いで溶液をセライト545のパッドを通し、そして減圧下で濃縮し、過剰のEtOAcで希釈し、水、飽和NaHCO3、水で洗浄し、無水のMgSO4で乾燥し、濃縮し、そしてカラムクロマトグラフィー(EtOAc/ヘキサン)によって精製するか、又は塩化メチレンで再結晶化して、所望の化合物3(36.77g、76.9%)を、白色の固体として得た。1H NMR(CDCl3,300MHz)δ 1.59(s,3H,CH3),3.39(bs,1H,OH),3.95(d,J=9.2Hz,1H,CH),4.43(d,J=9.2Hz,1H,CH),6.85(m,2H,ArH),6.98(m,2H,ArH),7.80(d,J=8.4Hz,1H,ArH),7.96(dd,J=8.4,1.8Hz,1H,ArH),8.08(d,J=1.8Hz,1H,ArH),9.13(bs,1H,NH).計算質量:382.1,[M−H]−380.9.融点:143−144℃。
【0144】
実施例3
化合物2による治療後の涙液組成。
[00132]本研究の目的は、急性的に精巣摘出された(ORX)ウサギモデルにおける涙液組成について、プロピオン酸テストステロン(TP)に対する化合物2の効果を比較することである。
【0145】
材料及び方法
[00133]体重がおよそ3ポンドのニュージーランド白ウサギを、研究の開始前4週間順化させた。ウサギを研究の0日目に秤量し、体重によってランダム化し、そして以下の投与群:
1)インタクト、局所ベヒクル(n=3)
2)ORX、局所ベヒクル(n=3)
3)ORX、局所化合物2、2.3mg/kg(n=3)
4)ORX、皮下化合物2、2.5mg/kg(n=3)
5)ORX、皮下プロピオン酸テストステロン(TP)、2.5mg/kg(n=3)
に割当てた。
【0146】
[00134]投与前の涙液及び血液試料を収集した。群2−5の動物にグリコピロレート(glycopyrrolate)(0.02mg/kg)を事前投与し、そして次いでケタミン(15mg/kg):メデトミジン(0.25mg/kg)の組合せで麻酔を導入した。
【0147】
[00135]麻酔をイソフルラン(1リットル/時)で維持した。精巣摘出術を陰嚢切開を使用して行った。動物をアチパメゾール(1mg/kg)SQを使用して麻酔から回復させた。鎮痛をブプレノルフィン(0.05mg/kg)で与えた。動物が麻酔から回復した直後に、これらは先に示した通りの適当な試験物品の最初の投与を受けた。
【0148】
[00136]薬物投与は、一日一回14日間行われた。血液を、薬物の最終投与の投与の60分後に収集し、そして血漿を親薬物濃度のHPLC分析のために分離した。
[00137]涙液を0日目の手術前、薬物の最終投与の24時間後(15日目)、そして更に42日目(研究の開始の6週間後)にシルマー涙液条片(Alcon,TX)を使用して収集した。涙液を、脂質分析前に−80℃で保存した。
【0149】
[00138]脂質を加水分解し、シルマー条片から抽出し、誘導体化し、そして脂質組成を評価するために炎イオン化検出器を伴うガスクロマトグラフィー(GCFID)にかけた。
【0150】
[00139]試料を、28種の飽和及び不飽和脂肪酸の存在に対して評価し、これらは、カプリン酸メチル(C10:0)、ラウリン酸メチル(C12:0)、11−ドデセン酸メチル(C12:1)、ミリスチン酸メチル(C14:0)、ミリストレイン酸メチル(C14:1)、パルミチン酸メチル(C16:0)、パルミトレイン酸メチル(C16:1)、ステアリン酸メチル(C18:0)、オレイン酸メチル(C18:1)、バクセン酸メチル(C18:1)、リノール酸メチル(C18:2)、ガンマ−リノール酸メチル(C18:3)、リノール酸メチル(C18:3)、アラキドン酸メチル(C20:0)、11−エイコセン酸メチル(C20:1)、11,14 エイコサジエン酸メチル(C20:2)、8,11,14エイコサトリエン酸メチル(C20:3)、エイコサペンタエン酸メチル(C20:5)、ベヘン酸メチル(C22:0)、エルカ酸メチル(C22:1)、13,16ドコサエン酸メチル(C22:2)、ドコサテトラエン酸メチル(C22:4)、ドコサペンタエン酸メチル(C22:5)、ドコサヘキサエン酸メチル(C22:6)、リグノセリン酸メチル(C24:0)、及びネルボン酸メチル(C24:1)を含んでいた。
【0151】
[00140]それぞれの個々のピークに対する曲線下面積を、GC ChemStationソフトウェアを使用して決定した。抽出過程中に、七つの試料は水及び溶媒相間の乳化を示し、そして十分に乾燥されなかった。次いで、これらの試料をNaClの飽和溶液+0.1%ギ酸(FA)で洗浄した。四つの試料は、GC−FIDのいずれものピークを示さず、そして分析から除外された。これらの試料は、全て投与前の涙液群であった。投与前の群からの二つの更なる試料及びベヒクル治療されたインタクトの群からの一つの試料は、小さいがしかし明白な、そして別れたピークを有し、これらは分析に含めた。
【0152】
[00141]涙液含有率に対する正規化のために、脂質組成を、去勢によって最も影響される脂質(パルミチン酸)と比較的一定のままのもの(ステアリン酸)との比として表示した。血液を更に研究の15日目(最終の薬物投与の24時間後)にも収集し、血漿を分離し、そして化合物2について分析した。
【0153】
[00142]表1は、涙液の脂肪酸の組成の統計的解析を示す。表1に示すように、投与前の涙液試料の分析は、パルミチン酸:ステアリン酸比が1.71±0.52であったことを示した。局所のベヒクルの投与後、パルミチン酸:ステアリン酸比は、インタクトのベヒクル治療群において2.6±0.28に、そしてORXのベヒクル治療群において2.16±0.85に増加した。TPによる治療後、パルミチン酸:ステアリン酸比の4.18±0.51への有意な増加があった。脂肪酸比の同様な増加(3.96±0.46)は、化合物2の局所投与で見られ、一方、化合物2の皮下投与は、3.12±0.99の脂肪比の中程度の増加を与えた。更に表1を参照されたい。
【0154】
【表1】

【0155】
[00143]局所及び皮下投与後の全身暴露を、研究の最終日の薬物投与の1時間後に収集した末梢血試料中で決定した。化合物2の血漿濃度を、LCMSを使用して測定した。表2を参照されたい。局所投与後の化合物2の平均血漿濃度は、1177±398.72nMであり、一方、平均レベルは、皮下(SQ)投与を受けたウサギで1210±311.93nMであった。これらのデータは、化合物2の有意な全身性吸収が、このベヒクル中の局所投与後に起こったことを示す。
【0156】
【表2】

【0157】
[00144]薬物又はベヒクルの最終用量は、研究の15日目に投与された。動物を、4週間無処置のまま放置(休薬期間)してから、涙液試料を再びシルマー涙液条片で収集し、そして先に示したように分析した。これらの動物からの涙液の分析は、ORXのベヒクル治療された動物は、涙液のパルミチン酸:ステアリン酸比の有意な減少(1.6±0.135)を、インタクトなベヒクル群の動物(2.62±0.395)と比較して示した(図2)。化合物2又はTPで2週間治療(局所又はSQ)され、そして次いで4週間無処置で放置された動物は、ORXのベヒクル群のものと同様な数値(それぞれ、1.66±0.426、1.47±0.172及び1.67±0.17)を伴って、涙液のパルミチン酸:ステアリン酸レベルの有意な低下を示した(図2)。これらのデータは、TP及び化合物2が、涙液の飽和脂肪酸特性を維持するために必須であることを示す。
【0158】
[00145]この研究において、マイボーム腺の抽出物からの代わりにウサギの涙液からの脂肪酸の組成を評価した。先に与えたデータは、去勢が、ウサギの涙液中の飽和脂肪酸のパルミチン酸のレベルを減少する(パルミチン酸:ステアリン酸比によって測定されるように)ことを示す。更に、この研究は、TP又は化合物2による治療が、涙液中のパルミチン酸:ステアリン酸比を、インタクトの動物のそれの2倍に有意に増加することを示し、この脂肪酸が、アンドロゲンの刺激に対して非常に感受性であることを示す。化合物2の局所投与は、恐らく眼瞼への投与後のマイボーム腺への薬物の迅速な利用可能性のために、全身性投与よりはるかに多くパルミチン酸:ステアリン酸比を増加した。ベヒクル治療は、更に、プラセボ効果を示して、パルミチン酸:ステアリン酸比の中程度のしかし僅かな増加を起こした。
【0159】
実施例4
[00146]この研究の目的は、急性的に精巣摘出された(ORX)ウサギモデルの涙液組成の調節における、異なったアンドロゲン潜在性を持つ化合物1及び化合物2の二つの組織選択的SARMの効果を比較することである。
【0160】
材料及び方法
[00147]体重がおよそ3ポンドの20匹のニュージーランド白ウサギを、研究開始前2週間順化させた。動物を研究の0日目に秤量し、体重によってランダム化し、そして以下の投与群:
1)インタクト、偽手術、局所ベヒクル、(n=5)
2)ORX、局所ベヒクル、(n=5)
3)ORX、局所化合物2、2.5mg/kg(n=5)
4)ORX、局所化合物1、2.5mg/kg(n=5)
に割当てた。
【0161】
手術
[00148]研究のための手術を、一日当たりの手術の最大数を6匹に制約するように調整した。それぞれの群から一匹の動物を毎日研究に参加させ、そして偽又は精巣摘出のいずれかを以下に記載するように行った。動物にグリコピロレート(0.02mg/kg)を事前投与し、そしてケタミン(15mg/kg):メデトミジン(0.25mg/kg)の組合せで麻酔を導入した。麻酔をイソフルラン(1リットル/時)で維持した。精巣摘出術を陰嚢切開を使用して行った。偽手術される動物については、陰嚢を切開し、そして皮膚を組織接着剤を使用して閉じた。動物をアチパメゾール(1mg/kg)SQを使用して麻酔から回復させた。鎮痛を、ブプレノルフィン(0.05mg/kg)で与えた。
【0162】
投与及び試料収集
[00149]動物が麻酔から回復した直後に、これらに先に示した通りの適当な試験物品を投与した。薬物投与は、一日一回14日間行われた。血液試料を、11日目の投与量の投与の30、60、120、240及び1440分後に、薬物動態学的分析のために収集した。血漿を、親薬物濃度のHPLC分析のために分離した。涙液を、0日目の手術前及び薬物の最終投与の24時間後(15日目)にシルマー涙液条片(Alcon,TX)を使用して収集した。涙液を、分析のための出荷まで−80℃で保存した。脂質を加水分解し、シルマー条片から抽出し、誘導体化し、そして脂質組成を評価するためにGC−FIDにかけた。試料を、28種の飽和及び不飽和脂肪酸の存在に対して評価し、これらは、カプリン酸メチル(C10:0)、ラウリン酸メチル(C12:0)、11−ドデセン酸メチル(C12:1)、ミリスチン酸メチル(C14:0)、ミリストレイン酸メチル(C14:1)、パルミチン酸メチル(C16:0)、パルミトレイン酸メチル(C16:1)、ステアリン酸メチル(C18:0)、オレイン酸メチル(C18:1)、バクセン酸メチル(C18:1)、リノール酸メチル(C18:2)、ガンマ−リノール酸メチル(C18:3)、リノール酸メチル(C18:3)、アラキドン酸メチル(C20:0)、11−エイコセン酸メチル(C20:1)、11,14 エイコサジエン酸メチル(C20:2)、8,11,14エイコサトリエン酸メチル(C20:3)、エイコサペンタエン酸メチル(C20:5)、ベヘン酸メチル(C22:0)、エルカ酸メチル(C22:1)、13,16ドコサエン酸メチル(C22:2)、ドコサテトラエン酸メチル(C22:4)、ドコサペンタエン酸メチル(C22:5)、ドコサヘキサエン酸メチル(C22:6)、リグノセリン酸メチル(C24:0)、及びネルボン酸メチル(C24:1)を含んでいた。それぞれの個々のピークに対する曲線下面積を、GC ChemStationソフトウェアを使用して決定した。涙液含有率に対する正規化のために、脂質組成を、去勢によって最も影響される脂質(パルミチン酸)の比較的一定のままのもの(ステアリン酸)との比として表示した。
【0163】
[00150]研究の終りに、動物を安楽死させた。左のハーダー腺及びマイボーム腺を、脂質分析のために収集し、そしてエタノール:ドライアイス浴を使用して瞬間冷凍した。試料を分析のための出荷まで−80℃で保存した。右の眼瞼をOCT媒体中に包埋し、そして組織分析及び脂質のオイル−レッド−O定量のためにParagon Biosciences(Washington DC)に出荷した。三つの別個の部分の画像を、それぞれの眼瞼から無作為に撮り、そしてそれぞれの部分の赤に染色した細胞の量を、商業的に入手可能なソフトウェアを使用して採点した。採点法は、染色強度を評価するために0−4の基準を採用し、0=<1%の細胞が染色され、1+は、2−5%の細胞が染色され、2+=6−10%の染色、3+=11−20%染色され、4+は、>20%の細胞が染色された。
【0164】
薬物動態学的データ分析
[00151]11日目の投与後に収集した血漿試料を、LCMS/MS法を使用して分析した。簡単には、血漿試料を、タンパク質沈殿抽出よって調製した。(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−クロロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミドを、血漿試料に対する内部標準として使用した。化合物1及び化合物2の分析を、MDS/Sciex 4000 Q−TrapTM質量分光計を伴うAgilent 1100 HPLCからなるLC−MS/MS装置を使用して行った。分離は、C18ガードカラム(SecurityGuardTM4.0×2.0 mm内径、Phenomenex)によって保護されたC18分析カラム(AlltimaTM、2.1×100mm、3μm)を使用して達成した。移動相は、60%のアセトニトリル、40%の水及び0.1%のギ酸からなっていた。移動相を0.3mL/分の流速で供給した。多重反応モニタリング(MRM)スキャンを500℃の熱源温度で遮蔽ガス中で行った。分子イオンを、−4500Vのイオンスプレー電圧を使用して形成した。生成物イオンを、窒素ガス中で、−55V(化合物1)、−64V(化合物2)、及び−78V(内部標準)のデクラスタリング電位で、そして−24.0V(化合物1、m/z 388.0→117.9)、−26.0V(化合物2、m/z 406.1→135.9)、及び−22.4V(内部標準、m/z 396.9→241.0)の衝突エネルギーで形成した。血漿濃度−時間データを、WinNonlin(Version 3.1,Pharsight Corporation,Mountain View,CA,USA)を使用する非コンパートメント法によって解析した。時間ゼロから無限大までの血漿濃度−時間曲線下の面積(AUC)を、無限大時間への外挿を伴う台形則によって計算した。表3は、涙液の脂肪酸組成の統計的解析を示す。
【0165】
【表3】

【0166】
[00152]投与前の涙液試料の分析は、パルミチン酸:ステアリン酸比が2.14±0.526であることを示した。表3に示すように、局所ベヒクルの投与後、パルミチン酸:ステアリン酸比は、インタクトのベヒクル治療群において3.3±0.812に、そしてORXのベヒクル治療群において1.94±0.193に増加した(表3)。化合物2による治療後、パルミチン酸:ステアリン酸比の5.31±1.56への有意な増加があった。脂肪酸比の同様な増加(2.97±0.678)が、化合物1の局所投与で見られた。化合物1及び2で見られた脂肪酸の変化は、ORXのベヒクル治療ウサギ及び投与前のインタクトのウサギと比較して統計的に有意であった(図3及び表3)。
【0167】
[00153]ハーダー腺の脂質分析は、動物間の高い程度の変化を示した。ハーダー腺において、化合物2は、パルミチン酸:ステアリン酸比の、対照動物において観察されたものと比較して有意な増加を示した。然しながら、化合物1では変化が見られなかった(表3)。マイボーム腺の脂質レベルは、化合物1でパルミチン酸:ステアリン酸比の2倍の増加を示した。化合物2による治療は、軽度の増加を示した(表3)。
【0168】
[00154]オイル−レッド−Oは、組織学的切片中の脂質含有細胞を染色するために普通に使用される親油性染料である。それぞれの切片中のオイル−レッド−O染料の量は、脂質を合成又は貯蔵する細胞の数に比例する。相対的採点法を適用して、研究中の治療された及び治療されない動物からのマイボーム腺切片の脂質含有量の差を評価した。偽手術された動物は、3.75のオイル−レッド−O得点を有し、一方、ORXのベヒクルで治療されたウサギは、約15%の中程度の減少を示した(得点=3.2)。化合物2による治療後、脂質の染色は、インタクトの動物のそれまで増加することが見られた(得点=3.8)。化合物1で治療された動物は、ORXの動物のそれに対して軽度の増加を示した(得点=3.4)。
【0169】
[00155]ウサギ血漿の薬物動態学的分析
薬物の局所投与後の全身暴露を、薬物投与の30、60、90、120及び1440分後に末梢血試料を収集することによって決定した。図4は、10日間の投与後のウサギの血漿試料の薬物動態学的分析を示す。化合物1及び化合物2の時間に対する平均血漿濃度(AUC)は、それぞれ25.2(±9.57)μM/時及び12.2(±4.93)μM/時であり、同一ベヒクルの局所投与後の薬物の全身性吸収の有意な差を示した。
【0170】
[00156]この研究において、ウサギの涙液、マイボーム腺及びハーダー腺からの脂肪酸の組成を評価した。データは、去勢が、ウサギの涙液及びマイボーム腺中の飽和脂肪酸のパルミチン酸のレベルを、ステアリン酸のそれに対して減少することを示す。化合物1による治療は、パルミチン酸のレベルを、去勢されベヒクルで治療されたウサギと比較して有意に増加した(増加したパルミチン酸:ステアリン酸比によって示されるように)。化合物2は、パルミチン酸:ステアリン酸比を、ORXのベヒクルで治療された動物のそれのおよそ2.5倍、そしてインタクトのベヒクルで治療された動物のそれに対して殆ど1.5倍増加した。驚くべきことに、化合物2で治療された動物において、涙液の脂質の比の大幅な増加に、マイボーム腺の脂質含有量の同時の増加を伴わなかった。然しながら、対照の動物と比較したハーダー腺の脂質含有量の増加が、個々の動物間の変動は極めて大きかったものの、これらの動物においてみられた。更に、ハーダー腺の脂質含有量は、この研究で試験された2週間では去勢によって有意に影響されなかった。腺の脂質組成において見られた大きい変化は、脂質分析のために、ハーダー又はマイボーム腺の一部のみが抽出されたための、分析上の人為的結果であるかもしれない。この研究の結果は、化合物2が、適当なマイボーム腺の機能を強く支持することを示す。ベヒクル治療は、更にパルミチン酸:ステアリン酸比の中程度の、しかし僅かな増加を起こし、プラセボ効果を示した。
【0171】
実施例5
[00157]この研究の目的は、涙液組成に対する化合物1及び2の投与量の影響を決定することである。
【0172】
材料及び方法
[00158]体重がおよそ3ポンドの30匹のニュージーランド白ウサギを、研究の開始前2週間順化させた。動物を研究の0日目に秤量し、体重によってランダム化し、そして以下の精巣摘出された(ORX)投与群:
1)ORX、偽治療(n=5)
2)ORX、局所ベヒクル(n=5)
3)ORX、局所化合物1、1.25mg/kg(n=5)
4)ORX、局所化合物1、0.625mg/kg(n=5)
5)ORX、局所化合物2、1.25mg/kg(n=5)
6)ORX、局所化合物2、0.625mg/kg(n=5)
に割当てた。
【0173】
手術
[00159]研究のための手術を、一日当たりの手術の最大数を6匹に制約するように調整した。それぞれの群から一匹の動物を毎日研究に参加させ、そして去勢を以下に記載するように行った。動物にグリコピロレート(0.02mg/kg)を事前投与し、そしてケタミン(15mg/kg):メデトミジン(0.25mg/kg)の組合せで麻酔を導入した。麻酔をイソフルラン(1リットル/時)で維持した。精巣摘出術を陰嚢切開を使用して行った。動物をアチパメゾール(1mg/kg)SQを使用して麻酔から回復させた。鎮痛を、ブプレノルフィン(0.05mg/kg)SQで、動物が腹這い位(sternal recumbency)を回復した直後に与えた。
【0174】
投与量
[00160]麻酔から回復した直後、動物に先に示したように適当な試験物品を投与した。薬物の投与は、一日一回、14日間行われた。血液試料を、投与の11日目の投与後30、60、120、240及び1440分に収集し、そして血漿を、親薬物濃度のLCMS分析のために分離した。涙液を、0日目の手術前及び薬物の最終投与の24時間後(15日目)にシルマー涙液条片(Alcon,TX)を使用して収集した。涙液を、脂質分析のための出荷まで−80℃で保存した。脂質を加水分解し、シルマー条片から抽出し、誘導体化し、そして脂質組成を評価するためにGCFIDにかけた。試料を、28種の飽和及び不飽和脂肪酸の存在に対して評価し、これらは、カプリン酸メチル(C10:0)、ラウリン酸メチル(C12:0)、11−ドデセン酸メチル(C12:1)、ミリスチン酸メチル(C14:0)、ミリストレイン酸メチル(C14:1)、パルミチン酸メチル(C16:0)、パルミトレイン酸メチル(C16:1)、ステアリン酸メチル(C18:0)、オレイン酸メチル(C18:1)、バクセン酸メチル(C18:1)、リノール酸メチル(C18:2)、ガンマ−リノール酸メチル(C18:3)、リノール酸メチル(C18:3)、アラキドン酸メチル(C20:0)、11−エイコセン酸メチル(C20:1)、11,14 エイコサジエン酸メチル(C20:2)、8,11,14エイコサトリエン酸メチル(C20:3)、エイコサペンタエン酸メチル(C20:5)、ベヘン酸メチル(C22:0)、エルカ酸メチル(C22:1)、13,16ドコサエン酸メチル(C22:2)、ドコサテトラエン酸メチル(C22:4)、ドコサペンタエン酸メチル(C22:5)、ドコサヘキサエン酸メチル(C22:6)、リグノセリン酸メチル(C24:0)、及びネルボン酸メチル(C24:1)を含んでいた。それぞれの個々のピークに対する曲線下面積を、GC ChemStationソフトウェアを使用して決定した。涙液含有率に対する正規化のために、脂質組成を、去勢によって最も影響される脂質(パルミチン酸)と比較的一定のままのもの(ステアリン酸)の比として表示した。
【0175】
[00161]研究の終りに、動物を安楽死させた。ハーダー腺及びマイボーム腺を、脂質分析のために収集し、そしてエタノール:ドライアイス浴を使用して瞬間冷凍した。試料を分析のための出荷できるまで−80℃で保存した。
【0176】
薬物動態学的データの解析
[00162]投与後に収集した血漿試料を、LCMS/MS法を使用して分析した。簡単には、血漿試料を、タンパク質沈殿抽出よって調製した。(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−クロロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミドを、内部標準として使用した。化合物1及び化合物2の分析を、MDS/Sciex 4000 Q−TrapTM質量分光計を伴うAgilent 1100 HPLCからなるLC−MS/MS装置を使用して行った。分離は、C18ガードカラム(SecurityGuardTM4.0×2.0 mm内径、Phenomenex)によって保護されたC18分析カラム(AlltimaTM、2.1×100mm、3μm)を使用して達成した。移動相は、60%のアセトニトリル、40%の水及び0.1%のギ酸からなっていた。移動相を0.3mL/分の流速で供給した。多重反応モニタリング(MRM)スキャンを500℃の熱源温度で遮蔽ガス中で行った。分子イオンを、−4500Vのイオンスプレー電圧を使用して形成した。生成物イオンを、窒素ガス中で、−55V(化合物1)、−64V(化合物2)、及び−78V(内部標準)のデクラスタリング電位で、そして−24.0V(化合物1、m/z 388.0→117.9)、−26.0V(化合物2、m/z 406.1→135.9)、及び−22.4V(内部標準、m/z 396.9→241.0)の衝突エネルギーで形成した。血漿濃度−時間データを、WinNonlin(Version 3.1,Pharsight Corporation,Mountain View,CA,USA)を使用する非コンパートメント法によって解析した。時間ゼロから無限大までの血漿濃度−時間曲線下の面積(AUC)を、無限大時間への外挿を伴う台形則によって計算した。表4は、涙液の脂肪酸組成の統計的解析を示す。
【0177】
【表4】

【0178】
[00163]表4に示すように、投与前の涙液試料の分析は、パルミチン酸:ステアリン酸比が1.57±0.365であることを示した。いずれもの治療を受けなかった(偽)ORX(群2)の動物は、そのパルミチン酸:ステアリン酸比の僅かな減少(1.41±0.152)を示した。ORX動物をベヒクル単独で治療した場合、脂質比の1.78±0.218への軽度の増加があった。化合物2で治療されたORX動物において、パルミチン酸:ステアリン酸比の投与量依存性の増加があった(表4)。化合物1も、更に0.625及び1.25mg/kgの薬物による治療に対して、パルミチン酸:ステアリン酸比のそれぞれ2.64±0.858及び2.73±0.892の増加を示した(表4)。然しながら、化合物1で治療された動物において、パルミチン酸:ステアリン酸比の有意な容量依存性の変化は見られなかった。化合物2に対するパルミチン酸:ステアリン酸比の増加は、化合物1に対して観察されたものより高かった。
【0179】
ハーダー腺及びマイボーム腺の脂質組成に対する化合物1並びに化合物2の増加する投与量の影響
[00164]ウサギの涙液中の脂質は、ハーダー腺及びマイボーム腺の分泌物に由来するものである。これらの腺の脂質含有量をGCMSを使用して分析した。表5は、ハーダー腺がSARMによる治療によって最も影響されたことを示す。パルミチン酸:ステアリン酸比の投与量依存性の増加は、化合物1及び化合物2の両方で見られた。脂質比は、化合物1(1.25mg/kg)によって2倍より多く増加し、一方、化合物2の影響は、試験された最高の投与量(1.25mg/kg)において見られた殆ど3倍の脂質比の増加を伴いなお大きかった。化合物1又は化合物2のいずれかによるマイボーム腺脂質の統計的に有意な変化は見られなかった。
【0180】
【表5】

【0181】
ウサギの血漿の薬物動態学的解析
[00165]血液の局所投与後の全身暴露を、研究の11日目の薬物投与の30、60、90、120及び1440分後に得た末梢血試料で決定した。表6に示すように、化合物2の全身暴露(即ちAUC値)は、0.625から1.25mg/kgへの投与量の増加に伴って3.2μM*時から6.92μM*時に増加した。化合物1の暴露は、0.625から1.25mg/kgへの投与量の増加に伴い、2.87μM*時から3.99μM*時へのレベルの増加を示した。
【0182】
【表6】

【0183】
[00166]この研究において、化合物1及び2による治療後の、ウサギの涙液、マイボーム腺及びハーダー腺からの脂肪酸の組成を評価した。データは、ORXがウサギの涙液及びハーダー腺中の飽和脂肪酸のパルミチン酸のレベルを減少することを示す。パルミチン酸は、飽和脂肪酸であり、そして脂肪酸合成経路の正常な産物である。パルミチン酸は、長鎖の飽和及び不飽和脂肪酸の形成のための前駆体である。前駆体分子のいずれもの減少は、他の脂肪酸のレベルの欠損に漸進的に導くものである。次いで脂肪酸の減少は、涙膜形成の不安定さに導き、マイボーム腺の疾病によって包含される各種の疾患に導くことができる。先に与えた結果と同様に、化合物1及び化合物2による治療は、涙液のパルミチン酸:ステアリン酸比を、ORXウサギのそれと比較して増加した。低い投与量を使用することによって、全身循環に吸収される薬物の量は、2.5mg/kgの投与量における暴露(表6)と比較した場合、化合物1及び化合物2において1/8th及び1/4thそれぞれ減少される。全身暴露のこの減少は、涙液の脂質組成を変化する効力を失うことなく起こる。更に、使用される化合物1及び化合物2の投与量は、プラセボのベヒクル治療された動物と比較して、2−3倍のハーダー腺における脂質産生を刺激するために十分であった。これらのデータは、全身暴露が、局部組織(local tissue)の機能を変化するために必要ではなく、そして眼瞼を経由する眼球供給の方法が、涙液組成のホルモン欠損誘導の脂質の変化を予防するために十分であることを示す。
【0184】
[00167]本発明のある種の特徴が、本明細書中に例示され、そして記載されてきたが、多くの改変、置換、変更、及び均等物が、ここに当業者にとって思い浮かぶものである。従って、付属する特許請求の範囲が、本発明の真の思想に入るような全てのこのような改変及び変更を包含することを意図していることは理解されるべきである。
【技術分野】
【0001】
[001]本発明は、マイボーム腺機能障害を治療するための方法を含む。本発明は、更に涙液の脂質組成を改良する、異常なマイボーム腺分泌を治療する及びマイボーム腺の分泌を正常化するための方法を含む。
【背景技術】
【0002】
[002]マイボーム腺は、上及び下瞼の瞼板中に位置する皮脂腺の一種(即ち、全分泌腺)である。これらの腺は、眼の涙膜の蒸発を防止する油状物質である皮脂の供給に関与しており、頬への涙液の溢流を防止し、そして閉じられた眼瞼を気密にする。概略50の腺が上眼瞼に、そして25の腺が下眼瞼に存在する。マイボーム腺は、皮膚粘膜の眼瞼接合部上の腺房のブドウ様クラスターによって区別され、そして全分泌分解によって眼球表面を被覆するために、この接合部におけるその脂質内容物(皮脂)を空にする。この腺は、極性及び非極性の脂質の両方を製造する細胞によって固定され、ついでこれは、リソソーム中に保存され、これは、まとまってより大きい貯蔵顆粒になる。これらの細胞は、脂質によって拡大し続けるため、これらは、最終的にマイボーム腺開口部へ破裂し、そして皮脂を眼球表面に溢流する。これらの脂質は、室温では液体であり、典型的には約66ないし89°Fの間の融点を持ち、そしてマイバムと呼ばれる薄い滑らかなフィルムで眼球表面に分布される。このマイバムは、水性層の蒸発を防止するために機能する。マイバム組成の変化は、眼瞼周辺部及び眼球表面の健康に深い影響を有することができる。一般的集団のマイボーム腺の機能障害はかなり高く、39%程度と高く推定され(例えば、Hom MM et.al.Optom Vis Sci.,67(9),710−2,1990を参照されたい)、コンタクトレンズの使用者の場合に増加する(例えば、Ong BL.Optom Vis Sci.,73(3),208−10,1996を参照されたい)。
【0003】
[003]マイボーム腺の分泌物は、涙液の脂質層を形成し、そして極性及び非極性脂質からなる。マイバムの脂質の種類、並びに脂肪酸及びアルコールの組成は、極性及び非極性相を伴う複合単層の初期の形成、体温近辺の十分な流動性、及び瞬き中の圧縮及び膨張を受ける能力のような涙液のパラメーターに影響することができる(例えば、McCulley et al.,Adv Exp Med Biol.,506(Pt A),373−8,2002を参照されたい)。ヒトの涙膜の脂質二重層において、極性相の脂質は、14−18個の長さの炭素鎖(C14−18)を伴う脂肪酸を含有し、これは、通常飽和である。これらの特性は、有効な極性脂質の構造化及び流動性のために、非常に重要である(例えば、McCulley et al.,Adv Exp Med Biol.,506(Pt A):373−8,2002を参照されたい)。脂肪酸の飽和のいずれの変化も、脂質の極性相の不安定性に、そしてこれによる涙液の不安定性に導くことができる。マイボーム腺の機能障害に導く眼瞼炎のような症状において、正常な脂肪酸の特性が、時により大きい不飽和に向かう傾向がある。飽和脂肪酸のレベルを改良することができるいずれの薬物も、マイボーム腺の疾病に対して有益である。
【0004】
[004]マイボーム腺機能障害に罹った患者の通常の病状の訴えは、特に接近した作業を行った後のぼやけた又はかすんだ視覚、眼の灼熱又は異物感、過剰な涙液、コンタクトレンズに対する不耐性、羞明、及びヒトが眠りから覚めるために十分な疼痛を含む。この症状を持つ患者は、通常、その涙腺による正常な水性の涙液の産生を有するが、そのマイボーム腺は、萎縮することができ、そしてこれは、これらの腺の導管上皮の異形成をしばしば伴う。眼瞼の皮膚粘膜接合部の前側びらん、並びに眼瞼及び結膜感染、眼瞼周縁の不規則性、角膜上皮の変化、及び角膜の血管新生がしばしば注目される。マイボーム腺機能障害を評価するための普通の臨床試験は、シルマー(Schirmer)涙液試験、蛍光染色(更に、眼球染色又は結膜染色としても知られる)、及び涙液層破壊時間試験(TFBUT)を含み、そのそれぞれを、以下に簡単に記載する。
【0005】
[005]シルマー涙液試験(STT):シルマー涙液試験は、水性の涙液の産生の測定である。これは、ドライアイのために使用される臨床パラメーターであり、そして患者の通常の又は麻酔された眼で行われて、基礎的及び反射性涙を評価する。STTは、含浸された染料及びミリメートルの刻み値を伴う又は伴わない濾紙の標準的な条片を使用して行われる。濾紙の末端を、それぞれの眼の結膜円蓋に置き、そして1分間に産生された涙液の量を測定する。STTの読取りは、動物の種間で変化する。イヌの場合、これは、典型的に10mm濡れ/分より大きい。しばしば、慢性のマイボーム腺機能障害において、角膜上皮は、有意な染料取込みを示す。
【0006】
[006]蛍光染色(a.k.a.眼球染色又は結膜染色):この試験は、角膜上皮の完全性を測定するために使用される。眼に適用されるフルオレセイン染料は、液滴で適用することができる。染料の適用の直後、患者は、瞬くか、又は眼瞼を手で開閉させられるかのいずれかをされる。次いで過剰のフルオレセインを洗眼液で洗浄し、そして次いでたコバルトブルーフィルターを設置された直接検眼鏡で暗室で角膜表面を検査する。いずれの角膜への染料の取込みも、角膜表面上皮の破損の指標である。しばしば、慢性マイボーム腺機能障害において、角膜上皮は、有意な染料の取込みを示す。
【0007】
[007]涙液層破壊時間試験(TFBUT):この試験は、角膜前涙液膜安定性の主観的測定である。TFBUTは、涙が角膜の表面から蒸発するために要する時間を測定する。この試験において、フルオレセイン染料が角膜に適用され、そして染料が角膜上にたまるようにする。眼の検査がコバルトブルーを設置された直接検眼鏡からの青い光線で行われる間、眼瞼は手で開閉される。眼瞼の開放(角膜上の緑色のフィルムの形成)から角膜の緑色の染色内の黒色の部分の最初の出現までの所要時間が測定される。ヒトのTFBUTは、典型的には5秒より少ない。イヌではこれは20秒である。ヒトにおいてTFBUTが3秒より少ない場合、そしてイヌでは10秒より少ない場合、TFBUTは異常であると考えられる。しばしば、慢性マイボーム腺機能障害において、TFBUTは有意に減少する。
【0008】
[008]眼瞼を裏打ちするマイボーム腺は、脂質を産生し、これは、涙液の安定性を促進し、そして涙膜の蒸発を減少するために、マイボーム腺の機能障害は、涙膜を不安定化し、そして涙膜破壊時間の減少及び蒸発性ドライアイを起こす脂質の不十分さに導くことができる(例えば、Sullivan et al.,Ann.NY Acad.Sci.,966,211−222,2002を参照されたい)。
【0009】
[009]マイボーム腺機能障害は、更に、脂質の固化及びマイボーム腺分泌の妨害を起こす、脂質の増加した融点によって特徴づけられる。これは、嚢胞、感染及び涙液中の脂質含有量の減少をもたらすことができる。マイボーム腺機能障害は、更に、過剰の異常に濁った分泌物よって特徴づけられ、これは、濃縮され、そしてマイボームオリフィスを閉塞する。これは、マイボーム導管の異形成(異常な角質化)が続いて起こる。流れに対する遮断及び抵抗は、オリフィス周りの組織の炎症及び血管新生(発赤)をもたらす。炎症性媒体が涙膜中に蓄積し、眼球表面の損傷に導く。これらの現象の後遺症(sequlae)は、導管の炎症性瘢痕であり、狭窄に導く。最初、腺は膨潤し、そして最終的に萎縮する。
【0010】
[0010]普通に使用される治療は、眼瞼周辺部の温めた圧縮、マイボーム導管の機械的調査、涙液脂質の溶融及び分泌を誘導する眼瞼周辺部への赤外デバイス又は化学薬品の使用を含む。炎症に対して、グルココルチコイドが使用される。細菌性要素がある場合、ペニシリン、ドキシサイクリン及びテトラサイクリンのような抗生物質が使用される。
【0011】
[0011]マイボーム腺機能の生理学は、アンドロゲンの制御下にあると信じられる。加齢、閉経、及び前立腺癌のアンドロゲン剥脱療法中に起きるアンドロゲン欠乏の症状は、蒸発性ドライアイが伴い(例えば、Sullivan et.al.,Ann.NY Acad.Sci.,966,211−222,2002を参照されたい)、アンドロゲンがこの症状の病因の主要な部分を演じることができることを示す。19−ノルテストステロンの投与は、ウサギのマイボーム腺分泌物中の全及び中性脂質画分中の脂肪酸特性を調節し(例えば、Sullivan et al.,IOVS,41(12),3732−3742,2000を参照されたい)、アンドロゲンの補充が、このような症状の治療において有益であることができることを示している。
【0012】
[0012]然しながら、伝統的ステロイド剤による全身性アンドロゲン療法は、挫創、脂漏、多毛症及び前立腺肥大に関する懸念を含む幾つかの好ましくない副作用を伴う。毛髪の成長を促進する(局所的)及び前立腺疾患を治療する(全身性)5α−レダクターゼ阻害剤の能力は、アンドロゲン受容体及びテストステロンの代謝産物に対する強力な完全アゴニストであるジヒドロテストステロン(DHT)が、これらの多くの男性化効果の原因であることができることを示唆する。
【0013】
[0013]マイボーム腺機能障害の従来の治療は、典型的には眼瞼又はマイボーム腺の感染と仮定された治療のみに向けられるか、或いはこのような治療を長期間殆ど役に立たなくする特定の不利益を有していた。例えば、マイボーム腺の機能障害を持つ患者は、人工涙液で症状的に治療されているが、しかしこれらの薬剤は、あったとしても制約された改善を提供した。典型的には、眼瞼又は眼球表面に対して適用されるグルココルチコイドは、短期のパルス療法として有効である。然しながら、グルココルチコイドは、潜在的副作用、例えば、白内障及び緑内障のために、良好な長期の解決策ではない。マイボーム腺機能障害は、現時点では治癒可能又は逆転可能ではなく;従って、この症状を持つ患者は、一生治療されなければならない。
【0014】
[0014]従って、マイボーム腺機能障害を治療する新しい方法を開発するための当技術における必要性が存在する。本出願人等は、脂質産生、男性化効果の欠如、及び組織の選択性を促進するその能力のために、マイボーム腺機能障害に対する独特の治療方法を提供する化合物を開発している。本明細書中に記載されるこの方法は、より少ない好ましくない副作用を伴うマイボーム腺機能障害に対する有効な治療を提供する。
【先行技術文献】
【非特許文献】
【0015】
【非特許文献1】Hom MM et.al.Optom Vis Sci.,67(9),710−2,1990;
【非特許文献2】Ong BL.Optom Vis Sci.,73(3),208−10,1996;
【非特許文献3】McCulley et al.,Adv Exp Med Biol.,506(Pt A),373−8,2002;
【非特許文献4】Sullivan et al.,Ann.NY Acad.Sci.,966,211−222,2002;
【非特許文献5】Sullivan et al.,IOVS,41(12),3732−3742,2000。
【発明の概要】
【0016】
[0015]一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺機能障害を治療する方法を提供する。
【0017】
[0016]他の態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液の脂質組成を改善する方法を提供する。
【0018】
[0017]更なる態様において、本発明は、更に、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、次の方法:涙液の脂質組成を改善する、涙液の脂質含有量を増加する、涙液の脂肪酸含有量を増加する、涙液のパルミチン酸:ステアリン酸比を増加する、異常なマイボーム腺分泌を治療する、マイボーム腺機能障害を予防する、ドライアイを治療及び予防する、マイボーム腺分泌を正常化する、マイボーム腺分泌物の粘度を減少する、マイボーム腺分泌物の透明度を増加する、涙液中の脂質の相転移温度を減少する、閉塞された及び/又は妨害されたマイボーム腺の数を減少する、眼瞼周辺部の発赤を減少する、患者の眼の灼熱及び/又は掻痒感を減少する、患者の眼への人口涙液の投与の必要性を減少する、眼のステロイド治療の必要性を減少する、患者の眼の異物感を減少する、マイボーム腺分泌間の時間(不応期)を減少する、眼球の異常感を減少する、涙液層破壊時間を増加する、角膜上皮のびらんを減少する、水性涙液欠乏を減少する、眼球及び結膜の染色を減少する、並びに霞んだ及び/又はファジーな視覚を減少することに関する。
【0019】
[0018]本明細書中に記載されるいずれもの方法の更なる態様において、患者は、哺乳動物である。本明細書中に記載されるいずれもの方法の一つの態様において、患者は、ヒトである。本明細書中に記載されるいずれもの方法の他の態様において、患者は、飼育動物(例えば、ネコ、イヌ)である。
【図面の簡単な説明】
【0020】
【図1】[0019]図1は、実施例3に記載される薬物治療に反応する涙液の脂肪酸組成を示す。
【図2】[0020]図2は、実施例3に記載されるとおりの4週間の洗浄期間後の涙液の脂肪酸組成を示す(a:p<0.05ベヒクルで治療された去勢された動物との比較;b:p<0.05ベヒクルで治療されたインタクトの動物との比較)。
【図3】[0021]図3は、実施例4に記載される薬物治療に反応する涙液の脂肪酸組成を示す(a:p<0.05、事前投与のインタクトのレベルとの比較;b:p<0.05、ベヒクルで治療されたORX動物との比較)。
【図4】[0022]図4は、実施例4に記載したとおりの投与の10日後のウサギの血漿試料の薬物動態学的分析を示す。
【発明を実施するための形態】
【0021】
[0023]一つの側面において、本発明は、マイボーム腺機能障害を治療する方法に関する。この方法は、選択的アンドロゲン受容体修飾物質(SARM)化合物を投与することを含む。
【0022】
[0024]従って、一つの態様において、本発明は、以下の式(I):
【0023】
【化1】

【0024】
[式中:
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはプロドラッグ、異性体、代謝産物、医薬的に受容可能な塩、多形、結晶、N−オキシド、医薬製品、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、マイボーム腺機能障害を治療する方法を提供する。
【0025】
[0025]ある態様において、本発明の方法は、式Iの化合物を使用する。一つの態様において、式IのXは、Oである。もう一つの態様において、式IのXは、Sである。もう一つの態様において、式IのGは、Oである。もう一つの態様において、式IのGは、Sである。もう一つの態様において、式IのZは、NO2である。もう一つの態様において、式IのZは、CNである。もう一つの態様において、式IのQは、CNである。もう一つの態様において、式IのQは、Fである。もう一つの態様において、式IのQは、Brである。もう一つの態様において、式IのQは、Clである。もう一つの態様において、式IのQは、I(ヨウ素)である。もう一つの態様において、式IのTは、OHである。もう一つの態様において、式IのR1は、CH3である。
【0026】
[0026]更なる態様において、本明細書中に記載される方法のいずれもは、以下の式:
【0027】
【化2】

【0028】
或いはプロドラッグ、異性体、代謝産物、医薬的に受容可能な塩、医薬製品、多形、結晶、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。
[0027]更なる態様において、明細書中に記載される方法のいずれもは、以下の式:
【0029】
【化3】

【0030】
或いはプロドラッグ、異性体、代謝産物、医薬的に受容可能な塩、医薬製品、多形、結晶、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。
[0028]ある態様において、明細書中に記載される方法のいずれもは、以下の式:
【0031】
【化4】

【0032】
或いはプロドラッグ、異性体、代謝産物、医薬的に受容可能な塩、医薬製品、多形、結晶、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。
[0029]従って、一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺機能障害を治療する方法を提供する。
【0033】
[0030] 一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺機能障害を予防する方法を提供する。もう一つの態様において、患者のマイボーム腺機能障害の再発の発生頻度を予防、抑制、阻害又は減少する方法は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる。
【0034】
[0031]一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、ドライアイを治療又は予防する方法を提供する。もう一つの態様において、患者のドライアイの再発の発生頻度を予防、抑制、阻害又は減少する方法は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる。
【0035】
[0032]更なる態様において、マイボーム腺機能障害は、時に、眼瞼炎、後部眼瞼炎、角膜炎、点状角膜炎、眼球感染、麦粒腫、霰粒腫又は眼性酒さ(ocular rosacea)を伴う。
[0033]もう一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液膜破壊時間(TFBUT)を改善するための方法に関する。もう一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液膜破壊時間(TFBUT)を変化するための方法に関する。ある態様において、涙液膜破壊時間は増加される。他の態様において、涙液膜破壊時間は減少される。
【0036】
[0034]もう一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液の体積を増加(シルマー涙液試験によって測定されるような)するための方法に関する。
【0037】
[0035]もう一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、異物感、掻痒感、眼球の疼痛及び/又は眼の発赤を減少、改善及び/又は予防するための方法に関する。
【0038】
[0036]もう一つの態様において、本発明は、本明細書中に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、過剰な乾燥による角膜表面の炎症を減少、改善及び/又は予防するための方法に関する。
【0039】
[0037]もう一つの態様において、本明細書中に記載される方法は、涙液の脂質組成を変化する。もう一つの態様において、本明細書中に記載される方法は、涙液の脂質組成を改善する。従って、もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液の脂質組成を変化する方法に関する。もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液の脂質組成を改善する方法に関する。もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液の脂質含有量を減少する方法に関する。
【0040】
[0038]更なる態様において、涙液の脂質組成の改善は、涙液の脂肪酸含有量を増加することを含んでなる。更なる態様において、涙液の脂質組成の改善は、涙液の脂肪酸含有量を減少することを含んでなる。更なる態様において、涙液の脂質組成の改善は、涙液のパルミチン酸:ステアリン酸比を増加することを含んでなる。更なる態様において、涙液の脂質組成の改善は、涙液中の脂質の融点を減少することを含んでなる。
【0041】
[0039]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、異常なマイボーム腺分泌を治療するための方法に関する。
【0042】
[0040]なお更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、異常なマイボーム腺分泌を正常化するための方法に関する。
【0043】
[0041]一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、異常なマイボーム腺分泌物の粘度を減少するための方法に関する。
【0044】
[0042]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺分泌物の透明度を増加する、例えば、一つの態様において、無色の状態にするための方法に関する。
【0045】
[0043]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液中の脂質の相転移温度を変化するための方法に関する。ある態様において、涙液中の脂質の相転移温度は、減少される。
【0046】
[0044]一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液中の脂質のパルミチン酸とステアリン酸の比を増加するための方法に関する。
【0047】
[0045]一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液中の脂質の相転移温度を減少するための方法に関する。
【0048】
[0046]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺の閉塞及び/又は妨害を減少するための方法に関する。一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、閉塞及び/又は妨害されたマイボーム腺の数を減少するための方法に関する。
【0049】
[0047]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼瞼周辺部の発赤を減少するための方法に関する。一つの態様において、発赤の減少は、測光法で測定される。一つの態様において、発赤の減少は、視覚的に測定される。
【0050】
[0048]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼の灼熱及び/又は掻痒感を減少するための方法に関する。
【0051】
[0049]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼への人口涙液を添加する必要性を減少するための方法に関する。
【0052】
[0050]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼のステロイド療法の必要性を減少するための方法に関する。
【0053】
[0051]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼への人口涙液の投与の頻度を減少するための方法に関する。
【0054】
[0052]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼の中の異物感を減少するための方法に関する。
【0055】
[0053]もう一つの態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、マイボーム腺分泌間の時間(不応期)を減少するための方法に関する。
【0056】
[0054]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、眼の異常感を減少するための方法に関する。
【0057】
[0055]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙液膜破壊時間を増加するための方法に関する。
【0058】
[0056]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、涙膜の安定性を増加するための方法に関する。
【0059】
[0057]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、フルオレセイン染色に伴って観察されるような角膜上皮のびらんを減少するための方法に関する。
【0060】
[0058]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、水性涙液の欠乏を減少するための方法に関する。
【0061】
[0059]更なる態様において、本発明は、本明細書中のいずれもの態様に記載されるとおりの化合物を、それを必要とする患者に投与することを含んでなる、霞んだ及び/又はファジーな視覚を減少するための方法に関する。
【0062】
[0060]更なる態様において、本明細書中に記載される方法は、患者のシルマー試験の読取りを改善する。一つの態様において、この方法は、シルマー試験中の試験紙条片を濡らす患者の涙液のミリメートルの数を増加する。
【0063】
[0061]一つの態様において、本発明の方法は、本明細書中のいずれもの態様に記載されるとおりの化合物、或いはプロドラッグ、異性体、代謝産物、医薬的に受容可能な塩、医薬製品、多形、結晶、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中のいずれもの態様に記載されるとおりの化合物、或いは異性体、代謝産物、医薬的に受容可能な塩、医薬製品、多形、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中のいずれもの態様に記載されるとおりの化合物、或いは異性体、医薬的に受容可能な塩、医薬製品、多形、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中のいずれもの態様に記載されるとおりの化合物、或いは異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物又はこれらのいずれもの組合せを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中のいずれもの態様に記載されるとおりの化合物、或いは異性体、医薬的に受容可能な塩、又はこれらのいずれもの組合せを投与することを含んでなる。
【0064】
[0062]他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の異性体を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の代謝産物を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の医薬的に受容可能な塩を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の水和物を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物のN−オキシドを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の医薬製品を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物のプロドラッグを投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の多形を投与することを含んでなる。他の態様において、本発明の方法は、本明細書中に記載されるとおりの化合物の結晶を投与することを含んでなる。
【0065】
[0063]本明細書中に開示される方法において有用な幾つかの化合物が、異なった互変異性及び/又は幾何異性及び/又は光学異性の形態で存在することができることを当業者は認識するものである。Cis異性体、trans異性体、ジアステレオマー混合物、ラセミ体、鏡像異性体の非ラセミ混合物、実質的に純粋な、及び純粋な鏡像異性体を含むこれらの形態の全ては、本発明の範囲内である。実質的に純粋な鏡像異性体は、例えば、2%より多くない、又は1%より多くないような、5重量/重量%より多くない対応する反対の鏡像異性体を含有する。
【0066】
[0064]一つの態様において、用語“異性体”は、化合物の光学異性体を包含することを意味する。一つの態様において、用語“異性体”は、化合物の立体異性体を包含することを意味する。本発明が、いずれもの光学的に活性な、又は立体異性の形態、或いはこれらの混合物を包含し、そしていずれもの適用に対するこれらの使用は、本発明の範囲内と考えられることは理解されることである。
【0067】
[0065]一つの態様において、本明細書中に記載される方法において有用な化合物は、実質的に純粋な(R)−異性体である。もう一つの態様において、本明細書中に記載される方法において有用な化合物は、実質的に純粋な(S)−異性体である。もう一つの態様において、本明細書中に記載される方法において有用な化合物は、(R)及び(S)異性体の混合物である。一つの態様において、本明細書中に記載される方法において有用な化合物は、純粋な(R)−異性体である。もう一つの態様において、本明細書中に記載される化合物は、純粋な(S)−異性体である。
【0068】
[0066]当業者にとって既知であるように、光学異性体は、慣用的な方法によるラセミ混合物の分割によって、例えば光学的に活性な酸又は塩基を使用するジアステレオ異性体の塩の形成、或いは共有結合のジアステレオ異性体の形成によって得ることができる。適当な酸の例は、酒石酸、ジアセチル酒石酸、ジベンゾイル酒石酸、ジトルオイル酒石酸及びカンファースルホン酸である。ジアステレオ異性体の混合物は、その物理的及び/又は化学的差に基づいて、当業者にとって既知の方法によって、例えば、クロマトグラフィー又は分別結晶化によって、その個々のジアステレオ異性体に分離することができる。次いで光学的に活性な塩基又は酸は、分離されたジアステレオ異性体の塩から解放される。光学異性体の分離のための異なった方法は、鏡像異性体の分離を最大にするために最適に選択される慣用的な誘導を伴う又は伴わない、キラルクロマトグラフィー(例えば、キラルHPLCカラム)の使用を含む。適したキラルHPLCカラムは、特に、日常的に選択可能なDiacelによって製造されている、例えばChiracel OD及びChiracel OJである。誘導体化を伴う又は伴わない酵素的分離もまた、有用である。光学的に活性な化合物は、同様に、ラセミ化を起こさない反応条件下のキラル合成法中の光学的に活性な出発物質を使用することによって得ることができる。
【0069】
[0067]適用可能な場合、本発明は、更に、遊離塩基の形態、及びそれに対して塩又はプロドラッグを調製することができる、本発明の全ての化合物の医薬的に受容可能な塩又はプロドラッグのような、本明細書中に開示されるとおりの化合物の有用な形態の投与を含む方法に関する。医薬的に受容可能な塩は、塩基として機能する主化合物を、無機又は有機酸と反応させて塩を形成する、例えば塩酸、硫酸、リン酸、メタンスルホン酸、カンファースルホン酸、シュウ酸、マレイン酸、コハク酸、クエン酸、ギ酸、臭化水素酸、安息香酸、酒石酸、フマル酸、サリチル酸、マンデル酸、及び炭酸の塩を形成することによって得られるものを含む。医薬的に受容可能な塩は、更に、主化合物が酸として機能するものを含み、そして適当な塩基と反応させて、例えば、ナトリウム、カリウム、カルシウム、マグネシウム、アンモニウム、及びコリン塩を形成する。特許請求される化合物の酸付加塩を、化合物の適当な無機又は有機酸との反応によって、多くの既知の方法のいずれによっても調製することができることを、当業者は更に認識するものである。別の方法として、アルカリ及びアルカリ土類金属塩は、本発明の化合物を、適当な塩基と、各種の既知の方法によって反応させて調製することができる。
【0070】
[0068]以下:酢酸塩、アジピン酸塩、アルギン酸塩、クエン酸塩、アスパラギン酸塩、安息香酸塩、ベンゼンスルホン酸塩、重硫酸塩、酪酸塩、樟脳酸塩、ジグルコン酸塩、シクロペンタンプロピオン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、グルコヘプタン酸塩、グリセロリン酸塩、ヘミ硫酸塩、ヘプタン酸塩、ヘキサン酸塩、フマル酸塩、臭化水素酸塩、ヨウ化水素酸塩、2−ヒドロキシ−エタンスルホン酸塩、乳酸塩、マレイン酸塩、メタンスルホン酸塩、ニコチン酸塩、2−ナフタレンスルホン酸塩、シュウ酸塩、パモ酸塩、ペクチネート、過硫酸塩、3−フェニルスルホン酸塩、ピクリン酸塩、ピバル酸塩、プロピオン酸塩、コハク酸塩、酒石酸塩、チオシアン酸塩、トシル酸塩、メシル酸塩及びウンデカン酸塩は、無機又は有機酸との反応によって得ることができる酸塩の更なる例である。
【0071】
[0069]例えば、医薬的に受容可能な塩は、塩酸塩、臭化水素酸塩、ハイドロフォーメート(hydroformate)、マレイン酸塩、又はナトリウム塩であることができる。
【0072】
[0070]ある態様において、形成される塩は、哺乳動物への投与のために医薬的に受容可能である。然しながら、化合物の医薬的に受容不可能な塩は、例えば、化合物を塩として単離し、そして次いで塩をアルカリ試薬による処理によって遊離塩基化合物に戻すために転換する、中間体として適している。次いで遊離塩基は、所望する場合、医薬的に受容可能な酸付加塩に転換される。
【0073】
[0071]更に、本明細書中に記載される幾つかの化合物が、異なった多形の形態で存在することができることを、当業者は認識するものである。当技術において既知であるように、多形性は、一つより多い別個の結晶又は“多形”種として結晶化する化合物の能力である。多形は、固体状態のその化合物分子の少なくとも二つの異なった配列又は多形の形態を持つ化合物の固体の結晶相である。いずれもの与えられた化合物の多形の形態は、同じ化学式又は組成によって定義され、そして二つの異なった化学化合物の結晶構造のように別個の結晶構造である。
【0074】
[0072]本明細書中に記載される幾つかの化合物が、異なった溶媒和物の形態で存在することができることを、当業者は更に認識するものである。本発明の化合物の溶媒和物は、溶媒分子が、結晶化過程中に化合物分子の結晶格子構造中に組込まれた場合、形成することができる。例えば、本明細書中のいずれもの態様中に記載されるような化合物は、例えば、一水和物、半水和物、セスキ水和物、二水和物、三水和物又はこれらのいずれもの組合せのような水和物の形態で存在することができる。
【0075】
[0073]用語“プロドラッグ”は、薬物前駆体である化合物を意味し、これは、患者への投与後、代謝的又は化学的過程によって化学的転換を受けて、本発明の化合物を得る。プロドラッグは、医薬の多くの好ましい品質(例えば、溶解性、生体利用性、製造上、等)を向上することが知られているため、本発明の化合物は、プロドラッグの形態で供給することができる。従って、本発明は、開示される化合物のプロドラッグ及びこれを供給する方法を含む。化合物のプロドラッグは、修飾が日常操作又はin vivoで親化合物に開裂されるような方法で、化合物中に存在する官能基を修飾することによって調製することができる。従って、プロドラッグは、例えば、ヒドロキシ、アミノ、又はカルボキシ基が、プロドラッグが哺乳動物の患者に投与された場合、開裂されて、それぞれ遊離のヒドロキシ、遊離のアミノ、又はカルボン酸を形成するいずれもの基に結合する本発明の化合物を含む。例は、制約されるものではないが、アルコール及びアミン官能基の酢酸、ギ酸及び安息香酸誘導体;並びにメチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec−ブチル、tert−ブチル、シクロプロピル、フェニル、ベンジル、及びフェネチルエステル、等のようなアルキル、炭素環式、アリール、及びアルキルアリールエステルを含む。このようなプロドラッグは、本発明の範囲内であると考えられる。
【0076】
[0074]本発明は、他の態様において、本明細書中に記載される化合物の代謝産物を提供する。一つの態様において、用語“代謝産物”は、代謝作用又は代謝過程によってもう一つの物質から産生されるいずれもの物質を指す。
【0077】
医薬組成物
[0075]本明細書中に記載される化合物は、単独で、又は製剤中の活性成分として投与することができる。従って、本発明は、更に、例えば、一つ又はそれより多い医薬的に受容可能な担体を含有する、本明細書中に記載される化合物の医薬組成物又は医薬製品の投与を含む。
【0078】
[0076]本発明による化合物を投与するために適した各種の製剤を調製するための方法を記載した多くの標準的な参考文献が利用可能である。潜在的な製剤及び調製の例が、例えば、Handbook of Pharmaceutical Excipients,American Pharmaceutical Association(現行版);Marcel Dekker,Inc.によって刊行されたPharmaceutical Dosage Forms:Tablets(Lieberman,Lachman and Schwartz,editors)現行版;並びにRemington’s Pharmaceutical Sciences(Arthur Osol,editor),1553−1593(現行版)中に含有されている。
【0079】
[0077]投与のモード及び剤形は、所定の治療の適用のために好ましい及び効果的である化合物又は組成物の治療的な量に密接に関係する。剤形は、制約されるものではないが、経口、直腸、舌下、粘膜、鼻腔、眼球、皮下、筋肉内、局所、静脈内、経皮、脊髄、髄腔内、関節内、動脈内、くも膜下、気管支、リンパ管、及び子宮(uterile)内投与、並びに活性成分の全身性供給のための他の剤形を含む。
【0080】
[0078]医薬剤形を調製するために、活性成分は、慣用的な医薬配合技術によって医薬的担体と混合することができる。担体は、投与のために好ましい製剤の形態によって幅広い種類の形態をとることができる。
【0081】
[0079]一つの態様において、本発明の方法は、本発明の化合物及び/又はその類似体、誘導体、異性体、代謝産物、医薬的に受容可能な塩、医薬製品、水和物、N−オキシド、又はこれらのいずれもの組合せを含有する医薬組成物を投与することを提供し、ここにおいて、前記投与することは、前記患者に、液体の形態の前記医薬組成物を静脈内、動脈内、又は筋肉内に注射すること;前記患者に、前記医薬組成物を含有するペレットを皮下に植込むこと;前記患者に、液体又は固体の形態の前記医薬組成物を経口投与すること;或いは前記患者の皮膚表面に前記医薬組成物を局所適用することを含んでなる。
【0082】
[0080]一つの態様において、医薬組成物は、経口投与され、そして従って、経口投与のために適した形態、即ち、固体又は液体製剤としてに処方される。適した固体の経口製剤は、錠剤、カプセル、丸薬、顆粒、ペレット等を含む。適した液体の経口製剤は、溶液、懸濁液、分散物、乳液、油等を含む。本発明の一つの態様において、本発明の化合物は、カプセル中に処方される。本発明の一つの態様において、本発明の化合物は、錠剤中に処方される。この態様によれば、本発明の組成物は、不活性担体又は希釈剤を含んでなる。
【0083】
[0081]更に、もう一つの態様において、医薬組成物は、液体製剤の静脈内、動脈内、又は筋肉内注射によって投与される。適した液体製剤は、溶液、懸濁液、分散物、乳液、油等を含む。一つの態様において、医薬組成物は、静脈内に投与され、そして従って、静脈内投与のために適した形態で処方される。もう一つの態様において、医薬組成物は、動脈内に投与され、そして従って、動脈内投与のために適した形態に処方される。もう一つの態様において、医薬組成物は、筋肉内に投与され、そして従って、筋肉内投与のために適した形態に処方される。
【0084】
[0082]一つの態様において、投与のモードは局所である。更なる態様において、本明細書中に記載される化合物は、クリームとして適用される。更なる態様において、本明細書中に記載される化合物は、クリームとしてそれを必要とする患者の眼瞼の側面に適用される。
【0085】
[0083]ある態様において、医薬組成物は、マイボーム腺オリフィスへの製剤の供給のために、眼瞼、眼の周辺部、まつげ及び/又は眼瞼周辺部への局所投与のために適した溶液、懸濁液及び、ある態様において、他の剤形に処方される。ある態様において、液体(水性又は非水性)溶液が、処方の容易さ、並びに眼瞼、まつげ、及び/又は眼瞼周辺部への製剤の適用によりこのような組成物を容易に投与する患者の能力に基づいて使用される。適用は、患者の指、Weck−Cel(登録商標)、Q−チップ、又は製剤をマイボーム腺オリフィスに供給するために、製剤を眼瞼、まつげ及び/又は眼瞼周辺部に供給することが可能な他のデバイス、のような塗布器で行うことができる。然しながら、組成物は、更に、例えば、クリーム、ゲル、軟膏、懸濁液、粘性又は半粘性ゲル、或いは他の種類の固体又は半固体組成物であることもできる。
【0086】
[0084]いずれもの各種の担体を、本発明において使用される製剤中で使用することができる。一つの態様において、担体は、涙膜の抗蒸発性脂質層の増強(増加した涙液膜破壊時間(TFBUT)及び/又は眼球保護指数(OPI)によって証明されるような)による眼球表面の保護、マイボーム腺オリフィスの急性保護を提供し、そしてマイボーム腺オリフィスへの活性剤の滞留時間を延長することによって、最小の視覚破壊(例えば、ぼやけ)、眼の掻痒感、又は眼瞼の固化を伴って、活性剤成分の治療効力を増加する範囲の粘度を有する、非水性担体(例えば、油又は油混合物)である。例えば、非水性担体の粘度は、約50cpsないし約1000cps、約50cpsないし約500cps、約50cpsないし約200cps、又は約60cpsないし約120cpsの範囲であることができる。ある態様において、非水性担体は、油、例えばひまし油、オリーブ油、ピーナツ油、マカデミアナッツ油、クルミ油、アーモンド油、南瓜種子油、綿実油、ゴマ油、コーン油、ダイズ油、アボカド油、パーム油、ヤシ油、ヒマワリ油、紅花油、亜麻仁油、ブドウ種子油、キャノーラ油、低粘度シリコーン油、軽質鉱油、又はいずれものこれらの混合物を含んでなる。
【0087】
[0085]ある態様において、涙液代用薬は、医薬担体として作用することができる。適した涙液代用薬は、制約されるものではないが、グリセロール、プロピレングリコール、及びエチレングリコールのようなモノマーのポリオール;ポリエチレングリコールのようなポリマーのポリオール;ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム及びヒドロキシプロピルセルロースのようなセルロースエステル;デキストラン70のようなデキストラン;ゼラチンのような水溶性タンパク質;ポリビニルアルコール、ポリビニルピロリドン、及びポビドンのようなポリマー;カルボマー934P、カルボマー941、カルボマー940及びカルボマー974Pのようなカルボマー;並びにHP−グアーのようなゴムを含む。多くのこのような涙液代用薬は、商業的に入手可能であり、これらは、制約されるものではないが、Bion TearsTM、Celluvisco、GentealTM、OccuCoat lTM、RefreshTM、Teargen IITM、Tears NaturaleTM、Tears Naturale IITM、Tears Naturale FreeTM、及びTheraTearsTMのようなセルロースエステル;並びにAkwa TearsTM、HypoTearsTM、Moisture EyesTM、Murine LubricatingTM、SystaneTM、Lubricant Eye Drops及びVisine TearsTMのようなポリビニルアルコールを含む。涙液代用薬は、更に商業的に入手可能なLacri−LibeTM軟膏のようなパラフィンを含んでなることができる。涙液代用薬として使用することができる他の商業的に入手可能な軟膏は、例えば、Lubrifresh PMTM、Moisture Eyes PMTM及びRefresh PMTMを含む。
【0088】
[0086]ある態様において、涙液代用薬は、ヒドロキシプロピルメチルセルロースを含有する。ある態様において、涙液代用薬は、GentealTM潤滑性点眼薬である。GenTealTM(CibaVision−Novartis)は、ヒドロキシプロピルメチルセルロースを3mg/g含有する滅菌潤滑性点眼薬であり、そして過ホウ酸ナトリウムで保護されている。
【0089】
[0087]もう一つの態様において、涙液代用薬は、カルボキシメチルセルロースナトリウムを含んでなる。例えば、制約されるものではないが、カルボキシメチルセルロースナトリウムを含んでなる涙液代用薬は、RefreshTM Tearsであることができる。RefreshTM Tearsは、穏やかな非刺激性保存剤である安定化されたオキシクロロ複合体(PuriteTM)を含有する、正常な涙液と同様な潤滑性製剤であり、これは、使用された場合、最終的に天然の涙液の成分に変化する。
【0090】
[0088]更なる担体を、本発明の製剤に所望により含むことができる。更なる担体の例は、例えば、水、水及びC1−7−アルカノール、植物油、鉱油又は0.5ないし5%の非毒性水溶性ポリマーを含んでなる他の油類のような水混和性溶媒、ゼラチン、アルギネート、ペクチン、トラガカントゴム、カラヤゴム、キサンタンゴム、カラゲニン、寒天及びアラビアゴムのような天然の産物、酢酸デンプン、ヒドロキシプロピルデンプンのようなデンプン誘導体を、そして更にポリビニルアルコール、ポリビニルピロリドン、ポリビニルメチルエーテル、ポリエチレンオキシド、例えば天然のCarbopolのような架橋ポリアクリル酸、或いはこれらのポリマーの混合物のような他の合成産物を含む。担体の濃度は、例えば、活性成分の濃度の1ないし100000倍であることができる。
【0091】
[0089]製剤中に含むことができる更なる成分は、例えば、等張性向上剤、保存剤、可溶化剤、非毒性賦形剤、粘滑剤、捕捉剤、pH調節剤、共溶媒、粘度増加剤、及びこれらの組合せを含む。
【0092】
[0090]例えば生理学的pHへのpHの調節のために、緩衝液が有用であることができる。ある態様において、溶液のpHは、約4.0ないし約6.0のような約4.0ないし約8.0の範囲、例えば約6.5ないし約7.8に維持される。例えば、ホウ酸、ホウ酸ナトリウム、クエン酸カリウム、クエン酸、重炭酸ナトリウム、TRIS、及び各種の混合リン酸緩衝液(Na2HPO4、NaH2PO4及びKH2PO4の組合せを含む)及びこれらの混合物のような適した緩衝液を、加えることができる。一般的に、緩衝液は、約0.1ないし約1.5重量パーセントのような、約0.05ないし約2.5重量パーセントの範囲の量で使用することができる。
【0093】
[0091]必要な場合、等張性は、等張性向上剤の使用によって調節することができる。このような薬剤は、例えば、イオン性及び/又は非イオン性の種類であることができる。イオン性等張性向上剤の例は、例えば、例えばCaCl2、KBr、KCl、LiCl、NaI、NaBr又はNaCl、Na2SO4或いはホウ酸のようなアルカリ金属又は土類金属ハロゲン化物を含む。非イオン性等張性向上剤は、例えば、尿素、グリセロール、ソルビトール、マンニトール、プロピレングリコール、又はデキストロースを含む。水溶液は、等張性剤(類)で、塩化ナトリウムの0.9%溶液又はグリセロールの2.5%溶液と同等な、正常な涙液の浸透圧に近似するように調節することができる。一つの態様において、約225ないし約400mOsm/kgの重量モル浸透圧濃度が得られる。一つの態様において、約280ないし約320mOsm/kgの重量モル浸透圧濃度が得られる。
【0094】
[0092]更なる態様において、局所製剤は、更に保存剤を含んでなることができる。保存剤は、典型的には、塩化ベンザルコニウム、塩化ベンゾキソニウム(例えば、塩化N−ベンジル−N−(C8−C18アルキル)−N,N−ジメチルアンモニウム)等のような四級アンモニウム化合物から選択することができる。四級アンモニウム塩と異なる保存剤の例は、例えば、例えばチオメルサール、硝酸フェニル水銀、酢酸フェニル水銀又はホウ酸フェニル水銀のようなチオサリチル酸のアルキル水銀塩、過ホウ酸ナトリウム、亜塩素酸ナトリウム、例えばメチルパラベン又はプロピルパラベンのようなパラベン、例えばクロロブタノール、ベンジルアルコール又はフェニルエタノールのようなアルコール、例えばクロロヘキシジン又はポリヘキサメチレンビグアニドのようなグアニジン誘導体、過ホウ酸ナトリウム、GermalTMII或いはソルビン酸を含む。ある態様において、保存剤は、四級アンモニア化合物、例えば塩化ベンザルコニウム又はPolyquad(例えば米国特許第4,407,791号を参照されたい)のようなその誘導体、アルキル水銀塩及びパラベンである。適当な場合、十分な量の保存剤を眼科組成物に添加して、細菌及び真菌によって起こされる使用中の二次汚染に対する保護を確実にすることができる。
【0095】
[0093]もう一つの態様において、局所製剤は、保存剤を含まない。このような製剤は、コンタクトレンズを使用する、又は幾つかの局所用点眼剤を使用する、及び/又は保存剤に対する制約された暴露が更に好ましいことであることができる既に損なわれた眼球表面を持つ患者のために有用であることができる。
【0096】
[0094]局所製剤は、例えば活性又は不活性成分が懸濁液或いは乳液を形成する傾向がある場合、更に可溶化剤を含むことができる。適した可溶化剤は、制約されるものではないが、チロキサポール、脂肪酸グリセロールポリエチレングリコールエステル、脂肪酸ポリエチレングリコールエステル、ポリエチレングリコール、グリセロールエーテル、シクロデキストリン(例えばアルファ−、ベータ−又はガンマ−シクロデキストリン、例えばアルキル化、ヒドロキシアルキル化、カルボキシアルキル化又はアルコキシカルボニル−アルキル化された誘導体、或いはモノ−又はジグリコシル−アルファ−、ベータ−又はガンマ−シクロデキストリン、モノ−又はジマルトシル−アルファ−、ベータ−又はガンマ−シクロデキストリン、或いはパモシル−シクロデキストリン)、ポリソルベート20、ポリソルベート80又はこれらの化合物の混合物を含む。ある態様において、可溶化剤は、ひまし油及びエチレンオキシドの反応生成物、例えば商業的産物Cremophor ELTM又はCremophor RH40TMである。ひまし油及びエチレンオキシドの反応生成物は、眼によって極めて良く許容される特に良好な可溶化剤であることが証明されている。もう一つの態様において、可溶化剤は、チロキサポール及びシクロデキストリンから選択される。使用される濃度は、特に活性成分の濃度に依存する。加えられる量は、典型的には、活性成分を可溶化するために十分である。例えば、安定剤の濃度は、活性成分の濃度の0.1ないし5000倍である。
【0097】
[0095]製剤は、更に例えば、乳化剤、湿潤剤或いは例えば200、300、400及び600と命名されたポリエチレングリコール、又は1000、1500、4000及び10000と命名されたCarbowaxのような充填剤のような非毒性の賦形剤を含んでなることができる。添加される賦形剤の量及び種類は、特定の要求により、そして一般的に概略0.0001ないし概略90重量%の範囲である。
【0098】
[0096]他の化合物も、担体の粘度を調節(例えば増加)するために、更に本発明の製剤に加えることができる。粘度向上剤の例は、制約されるものではないが、ヒアルロン酸のような多糖及びその塩、硫酸コンドロイチン及びその塩、デキストラン、セルロースファミリーの各種のポリマー;ビニルポリマー;及びアクリル酸ポリマーを含む。
【0099】
[0097]製剤が軟膏である態様において、ある態様において、眼科用軟膏を調製するために使用される軟膏基剤は、慣用的な眼科用軟膏において使用されるものであることができる。例えば、基剤は、液体パラフィン、白色ワセリン、精製ラノリン、ゲル化炭化水素、ポリエチレングリコール、親水性軟膏基剤、白色軟膏基剤、吸収性軟膏基剤、Macrogol(商標)軟膏基剤、単純軟膏基剤、等であることができる。
【0100】
[0098]眼科用軟膏は、更に軟膏基剤以外の慣用的な賦形剤を含んでなることができる。このような賦形剤の例は、制約されるものではないが、例えば、パラヒドキシベンゾエート、クロロブタノール、塩化ベンザルコニウム等のような防腐剤;ポリソルベート80、ステアリン酸ポリオキシル40、ポリオキシエチレン水素化ひまし油等のような界面活性剤;エデト酸ナトリウム、クエン酸、及びその塩のような安定剤;グリセロール、ラノリンアルコール、セタノール等のようなアルコール;ミリスチン酸イソプロピル、リノレイン酸エチル等のようなエステル;オリーブ油のような油、並びに中鎖脂肪酸のトリグリセリドを含む。
【0101】
[0099]更なる態様において、組成物は、眼の表面に薬剤を輸送又は運搬或いは供給することに関係する、液体(水性又は非水性)又は固体充填剤、希釈剤、賦形剤、溶媒又はカプセル化物質のような医薬的に受容可能な物質、組成物又はベヒクルを含んでなることができる。それぞれの担体は、他の組成物の成分と適合性であり、そして患者にとって有害ではないという意味において“受容可能”でなければならない。医薬的に受容可能な担体として役立つことができる物質の幾つかの更なる例は、例えば、(1)ラクトース、グルコース及びスクロースのような糖;(2)コーンスターチ及びジャガイモデンプンのようなデンプン;(3)カルボキシメチルセルロースナトリウム、エチルセルロース及び酢酸セルロースのようなセルロース並びにその誘導体;(4)粉末トラガカントゴム;(5)麦芽;(6)ゼラチン;(7)タルク;(8)ココアバター及び座薬用ワックスのような賦形剤;(9)ひまし油、オリーブ油、ピーナツ油、マカデミアナッツ油、クルミ油、アーモンド油、南瓜種子油、綿実油、ゴマ油、コーン油、ダイズ油、アボカド油、パーム油、ヤシ油、ヒマワリ油、紅花油、亜麻仁油、ブドウ種子油、キャノーラ油、低粘度シリコーン油、軽質鉱油、又はこれらの組合せのような油;(10)プロピレングリコールのようなグルコール;(11)グリセリン、ソルビトール、マンニトール及びポリエチレングリコールのようなポリオール;(12)オレイン酸エチル及びラウリン酸エチルのようなエステル;(13)寒天;(14)水酸化マグネシウム及び水酸化アルミニウムのような緩衝剤;(15)アルギン酸;(16)パイロジェン不含水;(17)等張生理食塩水;(18)リンゲル溶液;(19)エチルアルコール;(20)リン酸緩衝溶液;(21)HP−グアーのようなゴム;(22)ポリマー;並びに(23)医薬製剤中に使用される他の非毒性の適合性物質を含む。
【0102】
[00100]活性成分を含有する医薬組成物の調製は、当技術において十分に理解されている。活性な治療成分は、しばしば医薬的に受容可能であり、そして活性成分と適合性である賦形剤と混合される。
【0103】
[00101]活性成分は、中和された医薬的に受容可能な塩の形態で組成物中に処方することができる。医薬的に受容可能な塩は、例えば、塩酸又はリン酸のような無機酸、或いは酢酸、シュウ酸、酒石酸、マンデリン酸、クエン酸等のような有機酸と形成される酸付加塩(ペプチド又は抗体分子の遊離アミノ基と形成)を含む。遊離カルボキシル基から形成される塩は、更に例えば、ナトリウム、カリウム、アンモニウム、カルシウム、又は水酸化第二鉄のような無機塩基、並びにイソプロピルアミン、トリメチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカイン、等のような有機塩基から誘導することもできる。
【0104】
[00102]医薬における使用のために、本発明の化合物の塩は、医薬的に受容可能な塩である。然しながら、他の塩は、本発明による化合物又はその医薬的に受容可能な塩の調製において有用であることができる。本発明の化合物の適した医薬的に受容可能な塩は、例えば、本発明による化合物の溶液を、塩酸、硫酸、乳酸、酢酸、ギ酸、メタンスルホン酸、フマル酸、マレイン酸、コハク酸、酢酸、安息香酸、シュウ酸、クエン酸、酒石酸、炭酸又はリン酸のような医薬的に受容可能な酸の溶液と混合することによって形成することができる酸付加塩を含む。
【0105】
[00103]幾つかの態様において、本発明の化合物は、単剤療法として投与される。他の態様において、本発明の化合物は、組合せ療法の一部として投与される。例えば、本明細書中に記載される化合物は、本明細書中に記載される化合物が有用である疾病又は症状の治療において使用される他の薬物又は療法との組合せにおいて使用することができる。このような組合せにおいて、それぞれの活性成分は、その通常の投与量範囲で、又はその通常の投与量範囲より下の投与量でのいずれかで投与することができる。例えば、本明細書中に記載される化合物は、抗感染剤(例えば、テトラサイクリン抗生物質)、血管収縮剤、抗アレルギー剤、麻酔剤、鎮痛剤、ドライアイ剤(例えば、分泌促進剤、粘液模倣物質、ポリマー、脂質、抗酸化剤)、等、又はこれらのいずれもの組合せ、との組合せで付属的に投与することができる。
【0106】
[00104]このような他の薬物(類)は、本明細書中に記載される化合物と同時に又は連続して、そのために普通に使用される経路及び量によって投与することができる。本明細書中に記載される化合物が一つ又はそれより多い他の薬物と同時に使用される場合、本明細書中に記載される化合物に加えて、このような他の薬剤を含有する医薬的単位剤形を使用することができる。従って、本発明の医薬組成物は、本明細書中に記載される化合物に加えて、一つ又はそれより多い他の活性成分を更に含有するものを含む。
【0107】
[00105]付属的投与に関して、これは、同一剤形中の化合物の同時投与、別個の剤形中の同時投与、及び化合物の別個投与を意味する。
[00106]一つの態様において、本発明の方法は、各種の投与量の本発明の化合物の投与を含んでなる。一つの態様において、本発明の化合物は、一日当たり約0.01ないし約200mgの投与量で投与される。一つの態様において、本発明の化合物は、約0.1ないし約150mg、又はもう一つの態様において、0.1ないし約100mg、又はもう一つの態様において、約0.1ないし約75mg、又はもう一つの態様において、約0.1ないし約50mg、又はもう一つの態様において、約0.5ないし約100mg、又はもう一つの態様において、約0.5ないし約75mg、又はもう一つの態様において、約0.5ないし約50mg、又はもう一つの態様において、約0.5ないし約25mg、又はもう一つの態様において、約1ないし約100mg、又はもう一つの態様において、約1ないし約75mg、又はもう一つの態様において、約1ないし約50mg、又はもう一つの態様において、約1ないし約25mgの投与量で投与される。
【0108】
[00107]一つの態様において、本発明の方法は、各種の投与量の本発明の化合物の投与を含んでなる。一つの態様において、本発明の化合物は、約0.01mgの投与量で投与される。もう一つの態様において、本発明の化合物は、約0.1mg、約0.25mg、約0.5mg、約0.75mg、約1mg、約1.25mg、約1.5mg、約1.75mg、約2mg、約2.5mg、約5mg、約7.5mg、約10mg、約15mg、約20mg、約25mg、約30mg、約35mg、約40mg、約45mg、約50mg、約55mg、約60mg、約65mg、約70mg、約75mg、約80mg、約85mg、約90mg、約95mg又は約100mgの投与量で投与される。
【0109】
[00108]更なる態様において、本発明の方法は、約0.01mg/kgないし5mg/kg、例えば、約0.1mg/kgないし約3mg/kgの範囲の本発明の化合物の投与を含んでなる。他の態様において、本発明の化合物は、約0.1mg/kg、約0.25mg/kg、約0.5m/kg、約0.625mg/kg、約0.75mg/kg、約1mg/kg、約1.25mg/kg、約1.5mg/kg、約1.75mg/kg、約2mg/kg、約2.5mg/kg、約3mg/kg、約3.5mg/kg、約4.5mg/kg又は約5mg/kgの投与量で投与される。
[00109]用語“治療すること”は、患者の少なくとも一つの症状の徴候を解放、緩和、遅延、軽減、逆転、改善又は予防することを意味する。用語“治療すること”は、異常なマイボーム腺分泌、マイボーム腺機能障害、ドライアイ、マイボーム腺分泌、眼瞼周辺部の発赤、患者の眼の灼熱/掻痒感、眼の異常感、角膜上皮びらん、眼球及び結膜染色から選択される、患者の少なくとも一つの徴候を解放、緩和、遅延、軽減、逆転、改善又は予防すること、並びに霞み及び/又はファジーな視覚を軽減することを指す。用語“治療すること”はまた、発症を抑止、遅延すること(即ち、疾病の臨床顕在化の前の期間)及び/又は症状の進行又は悪化の危険性を減少することを意味することができる。本発明の化合物は、単剤療法として投与することができ、又は組合せ療法の一部として投与することができる。例えば、一つ又はそれより多い本発明の化合物は、当技術において既知の一つ又はそれより多い更なる治療剤と、同時投与されるか、又はそれと組合せて使用することができる。
【0110】
[00110]“有効な量”は、疾病を治療するために患者(例えば、哺乳動物)に投与した場合、疾病に対してこのような治療をもたらすために十分な、本明細書中に記載される化合物の量、又は本発明の目的(例えば、マイボーム腺機能障害を治療すること)を達成するために十分な、本明細書中に記載される化合物の量を意味する。“有効な量”は、化合物、疾病及びその重篤度並びに治療される患者の年齢、体重、等によって変化するものである。
【0111】
[00111]治療化合物の投与が疾病又は疾患の有効な治療計画である被験者又は患者は、好ましくはヒトであるが、しかし臨床試行又はスクリーニング或いは活性実験の文脈における実験動物を含むいずれもの動物であることができる。従って、当業者によって容易に認識されることができるように、本発明の方法、化合物及び組成物は、いずれもの動物、特に、そして制約されるものではないが、ヒト、ネコ又はイヌの被験者のような家畜(例えば、Ofri R,et al.The Veterinary Journal,174,536−540,2007を参照されたい)、制約されるものではないが、ウシ、ウマ、ヤギ、ヒツジ、及びブタの被験者のような農場動物、野生動物(野生又は動物園に関わらず)、マウス、ラット、ウサギ、ヤギ、ヒツジ、ブタ、イヌ、ネコ、等のような研究用動物を含む哺乳動物、ニワトリ、七面鳥、鳴鳥類等のようなトリ種への、即ち獣医学的使用のための投与に特に適している。
【0112】
[00112]用語“約”又は“およそ”は、当業者によって決定されるような特定の数値に対して、受容可能な誤差範囲内であることを意味し、これは、一部その数値が如何に測定又は決定されたか、即ち、測定系の制約に依存するものである。例えば、“約”は、当技術において実行当たり1又は1より多い標準偏差内であることを意味することができる。別の方法として、組成に関する“約”は、プラスマイナス20%迄、好ましくは10%迄、更に好ましくは5%迄の範囲を意味することができる。
【0113】
[00113]用語“パルミチン酸:ステアリン酸比”は、涙液の脂質中の根底にある脂肪酸組成を反映するマーカーの比として使用することができる。
[00114]用語“異常なマイボーム腺分泌”は、例えば、増加した粘度、増加した融点、減少したパルミチン酸とステアリン酸の比、増加した混濁或いは増加した色及び/又は増加した腺分泌間の時間(不応期)、減少したTFBUT、等を伴うマイボーム腺分泌を指す。
【0114】
[00115]用語“マイボーム腺機能障害を正常化すること”は、例えば、粘度の減少、融点の減少、パルミチン酸とステアリン酸の比の増加、マイボーム腺分泌物の混濁の減少又は色の減少及び/又は腺分泌間の時間(不応期)の減少、TFBUTの増加、等を指す。
【0115】
[000116]用語“眼瞼炎”は、異常なマイボーム腺分泌が役割を演じ、そして眼瞼の角質化、眼瞼周辺部円唇化、灰色腺の不明瞭化、増加した眼瞼周辺部透明度、及び増加した血管分布が観察される、眼瞼周辺部の炎症を含んでなる疾患を指す。用語マイボーム腺機能障害及び瞼板腺炎は、殆どの研究者によって眼瞼炎と共通に呼ばれるが、これらが異常なマイボーム腺分泌に伴う別個の疾病であり、そして用語は互換的ではないことを注記することは重要である。
【0116】
[00117]本明細書中に記載されるいずれもの化合物のいずれもの使用は、本明細書中に記載されるような疾病、疾患又は症状の治療において使用することができ、そして本発明の一つの態様であることは理解されることである。
【0117】
[00118]以下の実施例は、本発明の好ましい態様を更に完全に例示するために提供される。然しながら、これらは、本発明の広い範囲を制約するものとしていかなる方法ででも解釈されるべきではない。本発明は、本発明の例示的態様を参照して示され、そして記載されてきたが、このような参照は、本発明の制約を意味するものではなく、そしてこのような制約は暗示されていない。本発明は、本開示の利益を有する関連技術の当業者にとって思いつくものであるような、多くの改変、変更、並びに形態及び機能の均等物が可能である。本発明の示され、そして記載される態様は、例示のみであり、そして本発明の範囲の網羅的なものではない。従って、本発明は、全ての点で均等物に完全な認識を与える、付属する特許請求の範囲の思想及び範囲によってのみ制約されることを意図するものである。
【0118】
[00119]本明細書中に引用される全ての参考文献は、その全てが参考文献として本明細書中に援用される。
【実施例】
【0119】
実施例1
(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミド(化合物1)の合成
【0120】
【化5】

【0121】
[00120](2R)−1−メタクリロイルピロリジン−2−カルボン酸。 D−プロリン、14.93g、0.13mol)を、71mLの2NのNaOH中に溶解し、そして氷浴中で冷却した;得られたアルカリ性溶液を、アセトン(71mL)で希釈した。塩化メタクリロイル(13.56g、0.13mol)のアセトンの溶液(71mL)及び2NのNaOH(71mL)を、氷浴中のD−プロリンの水溶液に40分かけて同時に加えた。混合物のpHを塩化メタクリロイルの添加中10−11℃に保った。撹拌した後(3時間、室温)、混合物を真空中(in vacuo)で35−45℃の温度でエバポレートして、アセトンを除去した。得られた溶液をエチルエーテルで洗浄し、そして濃HClでpH2に酸性化した。酸性の混合物をNaClで飽和し、そしてEtOAc(100mL×3)で抽出した。合わせた抽出物をNa2SO4で乾燥し、セライトを通して濾過し、そして真空中でエバポレートして、粗製生成物を無色の油状物として得た。エチルエーテル及びヘキサンからの油状物の再結晶化により、16.2g(68%)の所望の化合物を無色の結晶として得た:融点102−103℃;この化合物のNMRスペクトルは、表題化合物の二つの回転異性体の存在を示した。1H NMR(300MHz,DMSO−d6)δ 第1の回転異性体に対して5.28(s)及び5.15(s)、第2の回転異性体に対して5.15(s)及び5.03(s)(両方の回転異性体に対して全て2H、ビニルCH2)、第1の回転異性体に対して4.48−4.44、第2の回転異性体に対して4.24−4.20(m)(両方の回転異性体に対して全て1H、キラル中心におけるCH),3.57−3.38(m,2H,CH2),2.27−2.12(1H,CH),1.97−1.72(m,6H,CH2,CH,Me);13C NMR(75MHz,DMSO−d6)δ 主要な回転異性体に対して173.3,169.1,140.9,116.4,58.3,48.7,28.9,24.7,19.5:少数の回転異性体に対して174.0,170.0,141.6,115.2,60.3,45.9,31.0,22.3,19.7;IR(KBr)3437(OH),1737(C=O),1647(CO,COOH),1584,1508,1459,1369,1348,1178cm−1。
【0122】
【化6】

【0123】
[00121](3R,8aR)−3−ブロモメチル−3−メチル−テトラヒドロ−ピロロ[2,1−c][1,4]オキサジン−1,4−ジオン。 NBS(23.5g、0.132mol)の100mLのDMF中の溶液を、(メチル−アクリロイル)−ピロリジン(16.1g、88mmol)の70mLのDMF中の室温のアルゴン下の撹拌された溶液に滴下により加え、そして得られた混合物を3日間撹拌した。溶媒を真空中で除去し、そして黄色の固体が沈殿した。固体を水中に懸濁し、室温で一晩撹拌し、濾過し、そして乾燥して、18.6g(81%)(乾燥したとき、約34%少ない重量)の表題化合物を、黄色の固体として得た:融点152−154℃;1H NMR(300MHz,DMSO−d6)δ 4.69(dd,J=9.6Hz,J=6.7Hz,1H,キラル中心におけるCH),4.02(d,J=11.4Hz,1H,CHHa),3.86(d,J=11.4Hz,1H,CHHb),3.53−3.24(m,4H,CH2),2.30−2.20(m,1H,CH),2.04−1.72(m,3H,CH2及びCH),1.56(s,2H,Me);13C NMR(75MHz,DMSO−d6)δ 167.3,163.1,83.9,57.2,45.4,37.8,29.0,22.9,21.6;IR(KBr)3474,1745(C=O),1687(C=O),1448,1377,1360,1308,1227,1159,1062cm−1;[α]D26+124.5°(c=1.3,クロロホルム)。
【0124】
【化7】

【0125】
[00122](2R)−3−ブロモ−2−ヒドロキシ−2−メチルプロパン酸。 ブロモラクトン(18.5g、71mmol)の300mLの24%HBr中の混合物を、還流で1時間加熱した。得られた溶液を食塩水(200mL)で希釈し、そして酢酸エチル(100mL×4)で抽出した。合わせた抽出物を飽和NaHCO3(100mL×4)で洗浄した。水溶液を濃HClでpH=1に酸性化し、次に酢酸エチル(100mL×4)で抽出した。合わせた有機溶液をNa2SO4で乾燥し、セライトを通して濾過し、そして真空中で乾燥状態までエバポレートした。トルエンからの再結晶化により、10.2g(86%)の所望の化合物を、無色の結晶として得た。融点107−109℃;1H NMR(300MHz,DMSO−d6)δ 3.63(d,J=10.1Hz,1H,CHHa),3.52(d,J=10.1Hz,1H,CHHb),1.35(s,3H,Me);IR(KBr)3434(OH),3300−2500(COOH),1730(C=O),1449,1421,1380,1292,1193,1085cm−1;[α]D26+10.5°(c=2.6,MeOH)。
【0126】
【化8】

【0127】
[00123](2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミド。 塩化チオニル(46.02g、0.39mol)を、(2R)−3−ブロモ−2−ヒドロキシ−2−メチルプロパン酸(51.13g、0.28mol)の300mLのTHF中のアルゴン雰囲気下の冷却された溶液(4℃より低く)に、滴下により加えた。得られた混合物を3時間同一条件下で撹拌した。これに、Et3N(39.14g、0.39mol)を加え、そして20分間同一条件下で撹拌した。20分後、5−アミノ−2−シアノベンゾトリフルオリド(40.0g、0.21mol)、400mLのTHFを加え、そして次いで混合物を一晩室温で撹拌させた。溶媒を減圧下で除去して、固体を得て、これを300mLのH2Oで処理し、EtOAc(2×400mL)で抽出した。合わせた有機抽出物を飽和NaHCO3溶液(2×300mL)及び食塩水(300mL)で洗浄した。有機層をMgSO4で乾燥し、そして減圧下で濃縮して、固体を得て、これをCH2Cl2/EtOAc(80:20)を使用するカラムクロマトグラフィーから精製して、固体を得た。この固体をCH2Cl2/ヘキサンから再結晶化して、55.8g(73.9%)の(2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミドを、明るい黄色の固体として得た。1H NMR(CDCl3/TMS)δ 1.66(s,3H,CH3),3.11(s,1H,OH),3.63(d,J=10.8Hz,1H,CH2),4.05(d,J=10.8Hz,1H,CH2),7.85(d,J =8.4Hz,1H,ArH),7.99(dd,J=2.1,8.4Hz,1H,ArH),8.12(d,J=2.1Hz,1H,ArH),9.04(bs,1H,NH).計算質量:349.99,[M−H]− 349.0.融点:124−126℃。
【0128】
【化9】

【0129】
[00124](S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミド(化合物1)。 ブロモアミド((2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミド、50g、0.14mol)、無水のK2CO3(59.04g、0.43mol)、4−シアノフェノール(25.44g、0.21mol)の500mLの2−プロパノール中の混合物を、還流で3時間加熱し、そして次いで減圧下で濃縮して、固体を得た。得られた残渣を500mLのH2Oで処理し、そして次いでEtOAc(2×300mL)で抽出した。合わせたEtOAc抽出物を10%NaOH(4×200mL)及び食塩水で洗浄した。有機層をMgSO4で乾燥し、そして次いで減圧下で濃縮して、油状物を得て、これを300mLのエタノール及び活性炭で処理した。反応混合物を還流で1時間加熱し、そして次いで熱混合物をセライトを通して濾過した。濾液を減圧下で濃縮して油状物を得た。この油状物をCH2Cl2/EtOAc(80:20)を使用するカラムクロマトフィーによって精製して、油状物を得て、これをCH2Cl2/ヘキサンから結晶化して、33.2g(59.9%)の(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミドを、無色の固体(綿型)として得た。1H NMR(CDCl3/TMS)δ 1.63(s,3H,CH3),3.35(s,1H,OH),4.07(d,J=9.04Hz,1H,CH),4.51(d,J=9.04Hz,1H,CH),6.97−6.99(m,2H,ArH),7.57−7.60(m,2H,ArH),7.81(d,J=8.55Hz,1H,ArH),7.97(dd,J=1.95,8.55Hz,1H,ArH),8.12(d,J=1.95Hz,1H,ArH),9.13(bs,1H,NH).計算質量:389.10,[M−H]−388.1.融点:92−94℃。
【0130】
実施例2
(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノ−3−フルオロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミド(化合物2)
【0131】
【化10】

【0132】
[00125](2R)−1−メタクリロイルピロリジン−2−カルボン酸。
[00126] D−プロリン、14.93g、0.13mol)を、71mLの2NのNaOH中に溶解し、そして氷浴中で冷却した;得られたアルカリ性溶液を、アセトン(71mL)で希釈した。塩化メタクリロイル(13.56g、0.13mol)のアセトンの溶液(71mL)及び2NのNaOH(71mL)を、氷浴中のD−プロリンの水溶液に40分かけて同時に加えた。混合物のpHを塩化メタクリロイルの添加中10−11℃に保った。撹拌した後(3時間、室温)、混合物を真空中で35−45℃の温度でエバポレートして、アセトンを除去した。得られた溶液をエチルエーテルで洗浄し、そして濃HClでpH2に酸性化した。酸性の混合物をNaClで飽和し、そしてEtOAc(100mL×3)で抽出した。合わせた抽出物をNa2SO4で乾燥し、セライトを通して濾過し、そして真空中でエバポレートして、粗製生成物を無色の油状物として得た。エチルエーテル及びヘキサンからの油状物の再結晶化により、16.2g(68%)の所望の化合物を無色の結晶として得た:融点102−103℃;この化合物のNMRスペクトルは、表題化合物の二つの回転異性体の存在を示した。1H NMR(300MHz,DMSO−d6)δ 第1の回転異性体に対して5.28(s)及び5.15(s)、第2の回転異性体に対して5.15(s)及び5.03(s)(両方の回転異性体に対して全て2H、ビニルCH2)、第1の回転異性体に対して4.48−4.44、第2の回転異性体に対して4.24−4.20(m)(両方の回転異性体に対して全て1H、キラル中心におけるCH),3.57−3.38(m,2H,CH2),2.27−2.12(1H,CH),1.97−1.72(m,6H,CH2,CH,Me);13C NMR(75MHz,DMSO−d6)δ 主要な回転異性体に対して173.3,169.1,140.9,116.4,58.3,48.7,28.9,24.7,19.5:少数の回転異性体に対して174.0,170.0,141.6,115.2,60.3,45.9,31.0,22.3,19.7;IR(KBr)3437(OH),1737(C=O),1647(CO,COOH),1584,1508,1459,1369,1348,1178cm−1;[α]D26 +80.8°(c=1,MeOH);C9H13NO3に対する分析計算値:C59.00,H7.15,N7.65.実測値:C59.13,H7.19,N 7.61。
【0133】
【化11】

【0134】
[00127](3R,8aR)−3−ブロモメチル−3−メチル−テトラヒドロ−ピロロ[2,1−c][1,4]オキサジン−1,4−ジオン。 NBS(23.5g、0.132mol)の100mLのDMF中の溶液を、(メタクリロイル)−ピロリジン(16.1g、88mmol)の70mLのDMF中の室温のアルゴン下の撹拌された溶液に滴下により加え、そして得られた混合物を3日間撹拌した。溶媒を真空中で除去し、そして黄色の固体が沈殿した。固体を水中に懸濁し、室温で一晩撹拌し、濾過し、そして乾燥して、18.6g(81%)(乾燥したとき、約34%少ない重量)の表題化合物を、黄色の固体として得た:融点152−154℃;1H NMR(300MHz,DMSO−d6)δ 4.69(dd,J=9.6Hz,J=6.7Hz,1H,キラル中心におけるCH),4.02(d,J=11.4Hz,1H,CHHa),3.86(d,J=11.4Hz,1H,CHHb),3.53−3.24(m,4H,CH2),2.30−2.20(m,1H,CH),2.04−1.72(m,3H,CH2及びCH),1.56(s,2H,Me);13C NMR(75MHz,DMSO−d6)δ 167.3,163.1,83.9,57.2,45.4,37.8,29.0,22.9,21.6;IR(KBr)3474,1745(C=O),1687(C=O),1448,1377,1360,1308,1227,1159,1062cm−1;[α]D26+124.5°(c=1.3,クロロホルム)。
【0135】
【化12】

【0136】
[00128](2R)−3−ブロモ−2−ヒドロキシ−2−メチルプロパン酸。 ブロモラクトン(18.5g、71mmol)の300mLの24%HBr中の混合物を、還流で1時間加熱した。得られた溶液を食塩水(200mL)で希釈し、そして酢酸エチル(100mL×4)で抽出した。合わせた抽出物を飽和NaHCO3(100mL×4)で洗浄した。水溶液を濃HClでpH=1に酸性化し、次に酢酸エチル(100mL×4)で抽出した。合わせた有機溶液をNa2SO4で乾燥し、セライトを通して濾過し、そして真空中で乾燥状態までエバポレートした。トルエンからの再結晶化により、10.2g(86%)の所望の化合物を、無色の結晶として得た。融点107−109℃;1H NMR(300MHz,DMSO−d6)δ 3.63(d,J=10.1Hz,1H,CHHa),3.52(d,J=10.1Hz,1H,CHHb),1.35(s,3H,Me);IR(KBr)3434(OH),3300−2500(COOH),1730(C=O),1449,1421,1380,1292,1193,1085cm−1;[α]D26+10.5°(c=2.6,MeOH)。
【0137】
【化13】

【0138】
[00129](2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミドの合成。 塩化チオニル(46.02g、0.39mol)を、(R)−3−ブロモ−2−ヒドロキシ−2−メチルプロパン酸(51.13g、0.28mol)の300mLのTHF中のアルゴン雰囲気下の冷却された溶液(4℃より低く)に、滴下により加えた。得られた混合物を3時間同一条件下で撹拌した。これに、Et3N(39.14g、0.39mol)を加え、そして20分間同一条件下で撹拌した。20分後、5−アミノ−2−シアノベンゾトリフルオリド(40.0g、0.21mol)、400mLのTHFを加え、そして次いで混合物を一晩室温で撹拌させた。溶媒を減圧下で除去して、固体を得て、これを300mLのH2Oで処理し、EtOAc(2×400mL)で抽出した。合わせた有機抽出物を飽和NaHCO3溶液(2×300mL)及び食塩水(300mL)で洗浄した。有機層をMgSO4で乾燥し、そして減圧下で濃縮して、固体を得て、これをCH2Cl2/EtOAc(80:20)を使用するカラムクロマトグラフィーから精製して、固体を得た。この固体をCH2Cl2/ヘキサンから再結晶化して、55.8g(73.9%)の(2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミドを、明るい黄色の固体として得た。1H NMR(CDCl3/TMS)δ 1.66(s,3H,CH3),3.11(s,1H,OH),3.63(d,J=10.8Hz,1H,CH2),4.05(d,J=10.8Hz,1H,CH2),7.85(d,J =8.4Hz,1H,ArH),7.99(dd,J=2.1,8.4Hz,1H,ArH),8.12(d,J=2.1Hz,1H,ArH),9.04(bs,1H,NH).計算質量:349.99,[M−H]−349.0.融点:124−126℃。
【0139】
【化14】

【0140】
[00130](S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノ−3−フルオロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミド(化合物2)の合成。 ブロモアミド((2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミド(2.0g、5.70mmol)、無水のK2CO3(2.4g、17.1mmol)の50mLのアセトン中の混合物を、還流で2時間加熱し、そして次いで減圧下で濃縮して、固体を得た。得られた固体を、50mLの2−プロパノール中の2−フルオロ−4−ヒドロキシベンゾニトリル(1.2g、8.5mmol)及び無水のK2CO3(1.6g、11.4mmol)で処理し、還流で3時間加熱し、そして次いで減圧下で濃縮して、固体を得た。残渣を100mLのH2Oで処理し、そして次いでEtOAc(2×100mL)で抽出した。合わせたEtOAc抽出物を10%NaOH(4×100mL)及び食塩水で連続して洗浄した。有機層をMgSO4で乾燥し、そして次いで減圧下で濃縮して、油状物を得て、これをCH2Cl2/ヘキサンから結晶化して、0.5g(23%)の(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−シアノ−3−フルオロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミドを、無色の固体として得た。1H NMR(CDCl3/TMS)δ 1.63(s,3H,CH3),3.34(bs,1H,OH),4.08(d,J=9.17Hz,1H,CH),4.50(d,J=9.17Hz,1H,CH),6.74−6.82(m,2H,ArH),7.50−7.55(m,1H,ArH),7.81(d,J=8.50Hz,1H,ArH),7.97(q,J=2.03,8.50Hz,1H,ArH),8.11(d,J=2.03Hz,1H,ArH),9.12(s,1H,NH).計算質量:407.1,[M+Na]+430.0.融点:124−125℃。
【0141】
実施例2A
(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−フルオロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミド(化合物3)の合成。
【0142】
【化15】

【0143】
[00131]ブロモアミド((2R)−3−ブロモ−N−[4−シアノ−3−(トリフルオロメチル)フェニル]−2−ヒドロキシ−2−メチルプロパンアミド(44.0g、125mmol)、無水のK2CO3(51.9g、376mmol)の800mLのアセトン中の混合物を、還流で2時間加熱し、これをTLCによってモニターし、エポキシ中間体への完全な転換を示した。室温に冷却した後、溶液をセライト545のパッドを通して濾過して、不溶性の固体を除去した。溶液を減圧下で濃縮した。フラスコに、800mLのメチルエチルケトン中の更なるK2CO3(34.6g、250mmol)及び4−フルオロフェノール(14.05g、125mmol)を入れ、そして還流で一晩加熱した。次いで溶液をセライト545のパッドを通し、そして減圧下で濃縮し、過剰のEtOAcで希釈し、水、飽和NaHCO3、水で洗浄し、無水のMgSO4で乾燥し、濃縮し、そしてカラムクロマトグラフィー(EtOAc/ヘキサン)によって精製するか、又は塩化メチレンで再結晶化して、所望の化合物3(36.77g、76.9%)を、白色の固体として得た。1H NMR(CDCl3,300MHz)δ 1.59(s,3H,CH3),3.39(bs,1H,OH),3.95(d,J=9.2Hz,1H,CH),4.43(d,J=9.2Hz,1H,CH),6.85(m,2H,ArH),6.98(m,2H,ArH),7.80(d,J=8.4Hz,1H,ArH),7.96(dd,J=8.4,1.8Hz,1H,ArH),8.08(d,J=1.8Hz,1H,ArH),9.13(bs,1H,NH).計算質量:382.1,[M−H]−380.9.融点:143−144℃。
【0144】
実施例3
化合物2による治療後の涙液組成。
[00132]本研究の目的は、急性的に精巣摘出された(ORX)ウサギモデルにおける涙液組成について、プロピオン酸テストステロン(TP)に対する化合物2の効果を比較することである。
【0145】
材料及び方法
[00133]体重がおよそ3ポンドのニュージーランド白ウサギを、研究の開始前4週間順化させた。ウサギを研究の0日目に秤量し、体重によってランダム化し、そして以下の投与群:
1)インタクト、局所ベヒクル(n=3)
2)ORX、局所ベヒクル(n=3)
3)ORX、局所化合物2、2.3mg/kg(n=3)
4)ORX、皮下化合物2、2.5mg/kg(n=3)
5)ORX、皮下プロピオン酸テストステロン(TP)、2.5mg/kg(n=3)
に割当てた。
【0146】
[00134]投与前の涙液及び血液試料を収集した。群2−5の動物にグリコピロレート(glycopyrrolate)(0.02mg/kg)を事前投与し、そして次いでケタミン(15mg/kg):メデトミジン(0.25mg/kg)の組合せで麻酔を導入した。
【0147】
[00135]麻酔をイソフルラン(1リットル/時)で維持した。精巣摘出術を陰嚢切開を使用して行った。動物をアチパメゾール(1mg/kg)SQを使用して麻酔から回復させた。鎮痛をブプレノルフィン(0.05mg/kg)で与えた。動物が麻酔から回復した直後に、これらは先に示した通りの適当な試験物品の最初の投与を受けた。
【0148】
[00136]薬物投与は、一日一回14日間行われた。血液を、薬物の最終投与の投与の60分後に収集し、そして血漿を親薬物濃度のHPLC分析のために分離した。
[00137]涙液を0日目の手術前、薬物の最終投与の24時間後(15日目)、そして更に42日目(研究の開始の6週間後)にシルマー涙液条片(Alcon,TX)を使用して収集した。涙液を、脂質分析前に−80℃で保存した。
【0149】
[00138]脂質を加水分解し、シルマー条片から抽出し、誘導体化し、そして脂質組成を評価するために炎イオン化検出器を伴うガスクロマトグラフィー(GCFID)にかけた。
【0150】
[00139]試料を、28種の飽和及び不飽和脂肪酸の存在に対して評価し、これらは、カプリン酸メチル(C10:0)、ラウリン酸メチル(C12:0)、11−ドデセン酸メチル(C12:1)、ミリスチン酸メチル(C14:0)、ミリストレイン酸メチル(C14:1)、パルミチン酸メチル(C16:0)、パルミトレイン酸メチル(C16:1)、ステアリン酸メチル(C18:0)、オレイン酸メチル(C18:1)、バクセン酸メチル(C18:1)、リノール酸メチル(C18:2)、ガンマ−リノール酸メチル(C18:3)、リノール酸メチル(C18:3)、アラキドン酸メチル(C20:0)、11−エイコセン酸メチル(C20:1)、11,14 エイコサジエン酸メチル(C20:2)、8,11,14エイコサトリエン酸メチル(C20:3)、エイコサペンタエン酸メチル(C20:5)、ベヘン酸メチル(C22:0)、エルカ酸メチル(C22:1)、13,16ドコサエン酸メチル(C22:2)、ドコサテトラエン酸メチル(C22:4)、ドコサペンタエン酸メチル(C22:5)、ドコサヘキサエン酸メチル(C22:6)、リグノセリン酸メチル(C24:0)、及びネルボン酸メチル(C24:1)を含んでいた。
【0151】
[00140]それぞれの個々のピークに対する曲線下面積を、GC ChemStationソフトウェアを使用して決定した。抽出過程中に、七つの試料は水及び溶媒相間の乳化を示し、そして十分に乾燥されなかった。次いで、これらの試料をNaClの飽和溶液+0.1%ギ酸(FA)で洗浄した。四つの試料は、GC−FIDのいずれものピークを示さず、そして分析から除外された。これらの試料は、全て投与前の涙液群であった。投与前の群からの二つの更なる試料及びベヒクル治療されたインタクトの群からの一つの試料は、小さいがしかし明白な、そして別れたピークを有し、これらは分析に含めた。
【0152】
[00141]涙液含有率に対する正規化のために、脂質組成を、去勢によって最も影響される脂質(パルミチン酸)と比較的一定のままのもの(ステアリン酸)との比として表示した。血液を更に研究の15日目(最終の薬物投与の24時間後)にも収集し、血漿を分離し、そして化合物2について分析した。
【0153】
[00142]表1は、涙液の脂肪酸の組成の統計的解析を示す。表1に示すように、投与前の涙液試料の分析は、パルミチン酸:ステアリン酸比が1.71±0.52であったことを示した。局所のベヒクルの投与後、パルミチン酸:ステアリン酸比は、インタクトのベヒクル治療群において2.6±0.28に、そしてORXのベヒクル治療群において2.16±0.85に増加した。TPによる治療後、パルミチン酸:ステアリン酸比の4.18±0.51への有意な増加があった。脂肪酸比の同様な増加(3.96±0.46)は、化合物2の局所投与で見られ、一方、化合物2の皮下投与は、3.12±0.99の脂肪比の中程度の増加を与えた。更に表1を参照されたい。
【0154】
【表1】

【0155】
[00143]局所及び皮下投与後の全身暴露を、研究の最終日の薬物投与の1時間後に収集した末梢血試料中で決定した。化合物2の血漿濃度を、LCMSを使用して測定した。表2を参照されたい。局所投与後の化合物2の平均血漿濃度は、1177±398.72nMであり、一方、平均レベルは、皮下(SQ)投与を受けたウサギで1210±311.93nMであった。これらのデータは、化合物2の有意な全身性吸収が、このベヒクル中の局所投与後に起こったことを示す。
【0156】
【表2】

【0157】
[00144]薬物又はベヒクルの最終用量は、研究の15日目に投与された。動物を、4週間無処置のまま放置(休薬期間)してから、涙液試料を再びシルマー涙液条片で収集し、そして先に示したように分析した。これらの動物からの涙液の分析は、ORXのベヒクル治療された動物は、涙液のパルミチン酸:ステアリン酸比の有意な減少(1.6±0.135)を、インタクトなベヒクル群の動物(2.62±0.395)と比較して示した(図2)。化合物2又はTPで2週間治療(局所又はSQ)され、そして次いで4週間無処置で放置された動物は、ORXのベヒクル群のものと同様な数値(それぞれ、1.66±0.426、1.47±0.172及び1.67±0.17)を伴って、涙液のパルミチン酸:ステアリン酸レベルの有意な低下を示した(図2)。これらのデータは、TP及び化合物2が、涙液の飽和脂肪酸特性を維持するために必須であることを示す。
【0158】
[00145]この研究において、マイボーム腺の抽出物からの代わりにウサギの涙液からの脂肪酸の組成を評価した。先に与えたデータは、去勢が、ウサギの涙液中の飽和脂肪酸のパルミチン酸のレベルを減少する(パルミチン酸:ステアリン酸比によって測定されるように)ことを示す。更に、この研究は、TP又は化合物2による治療が、涙液中のパルミチン酸:ステアリン酸比を、インタクトの動物のそれの2倍に有意に増加することを示し、この脂肪酸が、アンドロゲンの刺激に対して非常に感受性であることを示す。化合物2の局所投与は、恐らく眼瞼への投与後のマイボーム腺への薬物の迅速な利用可能性のために、全身性投与よりはるかに多くパルミチン酸:ステアリン酸比を増加した。ベヒクル治療は、更に、プラセボ効果を示して、パルミチン酸:ステアリン酸比の中程度のしかし僅かな増加を起こした。
【0159】
実施例4
[00146]この研究の目的は、急性的に精巣摘出された(ORX)ウサギモデルの涙液組成の調節における、異なったアンドロゲン潜在性を持つ化合物1及び化合物2の二つの組織選択的SARMの効果を比較することである。
【0160】
材料及び方法
[00147]体重がおよそ3ポンドの20匹のニュージーランド白ウサギを、研究開始前2週間順化させた。動物を研究の0日目に秤量し、体重によってランダム化し、そして以下の投与群:
1)インタクト、偽手術、局所ベヒクル、(n=5)
2)ORX、局所ベヒクル、(n=5)
3)ORX、局所化合物2、2.5mg/kg(n=5)
4)ORX、局所化合物1、2.5mg/kg(n=5)
に割当てた。
【0161】
手術
[00148]研究のための手術を、一日当たりの手術の最大数を6匹に制約するように調整した。それぞれの群から一匹の動物を毎日研究に参加させ、そして偽又は精巣摘出のいずれかを以下に記載するように行った。動物にグリコピロレート(0.02mg/kg)を事前投与し、そしてケタミン(15mg/kg):メデトミジン(0.25mg/kg)の組合せで麻酔を導入した。麻酔をイソフルラン(1リットル/時)で維持した。精巣摘出術を陰嚢切開を使用して行った。偽手術される動物については、陰嚢を切開し、そして皮膚を組織接着剤を使用して閉じた。動物をアチパメゾール(1mg/kg)SQを使用して麻酔から回復させた。鎮痛を、ブプレノルフィン(0.05mg/kg)で与えた。
【0162】
投与及び試料収集
[00149]動物が麻酔から回復した直後に、これらに先に示した通りの適当な試験物品を投与した。薬物投与は、一日一回14日間行われた。血液試料を、11日目の投与量の投与の30、60、120、240及び1440分後に、薬物動態学的分析のために収集した。血漿を、親薬物濃度のHPLC分析のために分離した。涙液を、0日目の手術前及び薬物の最終投与の24時間後(15日目)にシルマー涙液条片(Alcon,TX)を使用して収集した。涙液を、分析のための出荷まで−80℃で保存した。脂質を加水分解し、シルマー条片から抽出し、誘導体化し、そして脂質組成を評価するためにGC−FIDにかけた。試料を、28種の飽和及び不飽和脂肪酸の存在に対して評価し、これらは、カプリン酸メチル(C10:0)、ラウリン酸メチル(C12:0)、11−ドデセン酸メチル(C12:1)、ミリスチン酸メチル(C14:0)、ミリストレイン酸メチル(C14:1)、パルミチン酸メチル(C16:0)、パルミトレイン酸メチル(C16:1)、ステアリン酸メチル(C18:0)、オレイン酸メチル(C18:1)、バクセン酸メチル(C18:1)、リノール酸メチル(C18:2)、ガンマ−リノール酸メチル(C18:3)、リノール酸メチル(C18:3)、アラキドン酸メチル(C20:0)、11−エイコセン酸メチル(C20:1)、11,14 エイコサジエン酸メチル(C20:2)、8,11,14エイコサトリエン酸メチル(C20:3)、エイコサペンタエン酸メチル(C20:5)、ベヘン酸メチル(C22:0)、エルカ酸メチル(C22:1)、13,16ドコサエン酸メチル(C22:2)、ドコサテトラエン酸メチル(C22:4)、ドコサペンタエン酸メチル(C22:5)、ドコサヘキサエン酸メチル(C22:6)、リグノセリン酸メチル(C24:0)、及びネルボン酸メチル(C24:1)を含んでいた。それぞれの個々のピークに対する曲線下面積を、GC ChemStationソフトウェアを使用して決定した。涙液含有率に対する正規化のために、脂質組成を、去勢によって最も影響される脂質(パルミチン酸)の比較的一定のままのもの(ステアリン酸)との比として表示した。
【0163】
[00150]研究の終りに、動物を安楽死させた。左のハーダー腺及びマイボーム腺を、脂質分析のために収集し、そしてエタノール:ドライアイス浴を使用して瞬間冷凍した。試料を分析のための出荷まで−80℃で保存した。右の眼瞼をOCT媒体中に包埋し、そして組織分析及び脂質のオイル−レッド−O定量のためにParagon Biosciences(Washington DC)に出荷した。三つの別個の部分の画像を、それぞれの眼瞼から無作為に撮り、そしてそれぞれの部分の赤に染色した細胞の量を、商業的に入手可能なソフトウェアを使用して採点した。採点法は、染色強度を評価するために0−4の基準を採用し、0=<1%の細胞が染色され、1+は、2−5%の細胞が染色され、2+=6−10%の染色、3+=11−20%染色され、4+は、>20%の細胞が染色された。
【0164】
薬物動態学的データ分析
[00151]11日目の投与後に収集した血漿試料を、LCMS/MS法を使用して分析した。簡単には、血漿試料を、タンパク質沈殿抽出よって調製した。(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−クロロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミドを、血漿試料に対する内部標準として使用した。化合物1及び化合物2の分析を、MDS/Sciex 4000 Q−TrapTM質量分光計を伴うAgilent 1100 HPLCからなるLC−MS/MS装置を使用して行った。分離は、C18ガードカラム(SecurityGuardTM4.0×2.0 mm内径、Phenomenex)によって保護されたC18分析カラム(AlltimaTM、2.1×100mm、3μm)を使用して達成した。移動相は、60%のアセトニトリル、40%の水及び0.1%のギ酸からなっていた。移動相を0.3mL/分の流速で供給した。多重反応モニタリング(MRM)スキャンを500℃の熱源温度で遮蔽ガス中で行った。分子イオンを、−4500Vのイオンスプレー電圧を使用して形成した。生成物イオンを、窒素ガス中で、−55V(化合物1)、−64V(化合物2)、及び−78V(内部標準)のデクラスタリング電位で、そして−24.0V(化合物1、m/z 388.0→117.9)、−26.0V(化合物2、m/z 406.1→135.9)、及び−22.4V(内部標準、m/z 396.9→241.0)の衝突エネルギーで形成した。血漿濃度−時間データを、WinNonlin(Version 3.1,Pharsight Corporation,Mountain View,CA,USA)を使用する非コンパートメント法によって解析した。時間ゼロから無限大までの血漿濃度−時間曲線下の面積(AUC)を、無限大時間への外挿を伴う台形則によって計算した。表3は、涙液の脂肪酸組成の統計的解析を示す。
【0165】
【表3】

【0166】
[00152]投与前の涙液試料の分析は、パルミチン酸:ステアリン酸比が2.14±0.526であることを示した。表3に示すように、局所ベヒクルの投与後、パルミチン酸:ステアリン酸比は、インタクトのベヒクル治療群において3.3±0.812に、そしてORXのベヒクル治療群において1.94±0.193に増加した(表3)。化合物2による治療後、パルミチン酸:ステアリン酸比の5.31±1.56への有意な増加があった。脂肪酸比の同様な増加(2.97±0.678)が、化合物1の局所投与で見られた。化合物1及び2で見られた脂肪酸の変化は、ORXのベヒクル治療ウサギ及び投与前のインタクトのウサギと比較して統計的に有意であった(図3及び表3)。
【0167】
[00153]ハーダー腺の脂質分析は、動物間の高い程度の変化を示した。ハーダー腺において、化合物2は、パルミチン酸:ステアリン酸比の、対照動物において観察されたものと比較して有意な増加を示した。然しながら、化合物1では変化が見られなかった(表3)。マイボーム腺の脂質レベルは、化合物1でパルミチン酸:ステアリン酸比の2倍の増加を示した。化合物2による治療は、軽度の増加を示した(表3)。
【0168】
[00154]オイル−レッド−Oは、組織学的切片中の脂質含有細胞を染色するために普通に使用される親油性染料である。それぞれの切片中のオイル−レッド−O染料の量は、脂質を合成又は貯蔵する細胞の数に比例する。相対的採点法を適用して、研究中の治療された及び治療されない動物からのマイボーム腺切片の脂質含有量の差を評価した。偽手術された動物は、3.75のオイル−レッド−O得点を有し、一方、ORXのベヒクルで治療されたウサギは、約15%の中程度の減少を示した(得点=3.2)。化合物2による治療後、脂質の染色は、インタクトの動物のそれまで増加することが見られた(得点=3.8)。化合物1で治療された動物は、ORXの動物のそれに対して軽度の増加を示した(得点=3.4)。
【0169】
[00155]ウサギ血漿の薬物動態学的分析
薬物の局所投与後の全身暴露を、薬物投与の30、60、90、120及び1440分後に末梢血試料を収集することによって決定した。図4は、10日間の投与後のウサギの血漿試料の薬物動態学的分析を示す。化合物1及び化合物2の時間に対する平均血漿濃度(AUC)は、それぞれ25.2(±9.57)μM/時及び12.2(±4.93)μM/時であり、同一ベヒクルの局所投与後の薬物の全身性吸収の有意な差を示した。
【0170】
[00156]この研究において、ウサギの涙液、マイボーム腺及びハーダー腺からの脂肪酸の組成を評価した。データは、去勢が、ウサギの涙液及びマイボーム腺中の飽和脂肪酸のパルミチン酸のレベルを、ステアリン酸のそれに対して減少することを示す。化合物1による治療は、パルミチン酸のレベルを、去勢されベヒクルで治療されたウサギと比較して有意に増加した(増加したパルミチン酸:ステアリン酸比によって示されるように)。化合物2は、パルミチン酸:ステアリン酸比を、ORXのベヒクルで治療された動物のそれのおよそ2.5倍、そしてインタクトのベヒクルで治療された動物のそれに対して殆ど1.5倍増加した。驚くべきことに、化合物2で治療された動物において、涙液の脂質の比の大幅な増加に、マイボーム腺の脂質含有量の同時の増加を伴わなかった。然しながら、対照の動物と比較したハーダー腺の脂質含有量の増加が、個々の動物間の変動は極めて大きかったものの、これらの動物においてみられた。更に、ハーダー腺の脂質含有量は、この研究で試験された2週間では去勢によって有意に影響されなかった。腺の脂質組成において見られた大きい変化は、脂質分析のために、ハーダー又はマイボーム腺の一部のみが抽出されたための、分析上の人為的結果であるかもしれない。この研究の結果は、化合物2が、適当なマイボーム腺の機能を強く支持することを示す。ベヒクル治療は、更にパルミチン酸:ステアリン酸比の中程度の、しかし僅かな増加を起こし、プラセボ効果を示した。
【0171】
実施例5
[00157]この研究の目的は、涙液組成に対する化合物1及び2の投与量の影響を決定することである。
【0172】
材料及び方法
[00158]体重がおよそ3ポンドの30匹のニュージーランド白ウサギを、研究の開始前2週間順化させた。動物を研究の0日目に秤量し、体重によってランダム化し、そして以下の精巣摘出された(ORX)投与群:
1)ORX、偽治療(n=5)
2)ORX、局所ベヒクル(n=5)
3)ORX、局所化合物1、1.25mg/kg(n=5)
4)ORX、局所化合物1、0.625mg/kg(n=5)
5)ORX、局所化合物2、1.25mg/kg(n=5)
6)ORX、局所化合物2、0.625mg/kg(n=5)
に割当てた。
【0173】
手術
[00159]研究のための手術を、一日当たりの手術の最大数を6匹に制約するように調整した。それぞれの群から一匹の動物を毎日研究に参加させ、そして去勢を以下に記載するように行った。動物にグリコピロレート(0.02mg/kg)を事前投与し、そしてケタミン(15mg/kg):メデトミジン(0.25mg/kg)の組合せで麻酔を導入した。麻酔をイソフルラン(1リットル/時)で維持した。精巣摘出術を陰嚢切開を使用して行った。動物をアチパメゾール(1mg/kg)SQを使用して麻酔から回復させた。鎮痛を、ブプレノルフィン(0.05mg/kg)SQで、動物が腹這い位(sternal recumbency)を回復した直後に与えた。
【0174】
投与量
[00160]麻酔から回復した直後、動物に先に示したように適当な試験物品を投与した。薬物の投与は、一日一回、14日間行われた。血液試料を、投与の11日目の投与後30、60、120、240及び1440分に収集し、そして血漿を、親薬物濃度のLCMS分析のために分離した。涙液を、0日目の手術前及び薬物の最終投与の24時間後(15日目)にシルマー涙液条片(Alcon,TX)を使用して収集した。涙液を、脂質分析のための出荷まで−80℃で保存した。脂質を加水分解し、シルマー条片から抽出し、誘導体化し、そして脂質組成を評価するためにGCFIDにかけた。試料を、28種の飽和及び不飽和脂肪酸の存在に対して評価し、これらは、カプリン酸メチル(C10:0)、ラウリン酸メチル(C12:0)、11−ドデセン酸メチル(C12:1)、ミリスチン酸メチル(C14:0)、ミリストレイン酸メチル(C14:1)、パルミチン酸メチル(C16:0)、パルミトレイン酸メチル(C16:1)、ステアリン酸メチル(C18:0)、オレイン酸メチル(C18:1)、バクセン酸メチル(C18:1)、リノール酸メチル(C18:2)、ガンマ−リノール酸メチル(C18:3)、リノール酸メチル(C18:3)、アラキドン酸メチル(C20:0)、11−エイコセン酸メチル(C20:1)、11,14 エイコサジエン酸メチル(C20:2)、8,11,14エイコサトリエン酸メチル(C20:3)、エイコサペンタエン酸メチル(C20:5)、ベヘン酸メチル(C22:0)、エルカ酸メチル(C22:1)、13,16ドコサエン酸メチル(C22:2)、ドコサテトラエン酸メチル(C22:4)、ドコサペンタエン酸メチル(C22:5)、ドコサヘキサエン酸メチル(C22:6)、リグノセリン酸メチル(C24:0)、及びネルボン酸メチル(C24:1)を含んでいた。それぞれの個々のピークに対する曲線下面積を、GC ChemStationソフトウェアを使用して決定した。涙液含有率に対する正規化のために、脂質組成を、去勢によって最も影響される脂質(パルミチン酸)と比較的一定のままのもの(ステアリン酸)の比として表示した。
【0175】
[00161]研究の終りに、動物を安楽死させた。ハーダー腺及びマイボーム腺を、脂質分析のために収集し、そしてエタノール:ドライアイス浴を使用して瞬間冷凍した。試料を分析のための出荷できるまで−80℃で保存した。
【0176】
薬物動態学的データの解析
[00162]投与後に収集した血漿試料を、LCMS/MS法を使用して分析した。簡単には、血漿試料を、タンパク質沈殿抽出よって調製した。(S)−N−(4−シアノ−3−(トリフルオロメチル)フェニル)−3−(4−クロロフェノキシ)−2−ヒドロキシ−2−メチルプロパンアミドを、内部標準として使用した。化合物1及び化合物2の分析を、MDS/Sciex 4000 Q−TrapTM質量分光計を伴うAgilent 1100 HPLCからなるLC−MS/MS装置を使用して行った。分離は、C18ガードカラム(SecurityGuardTM4.0×2.0 mm内径、Phenomenex)によって保護されたC18分析カラム(AlltimaTM、2.1×100mm、3μm)を使用して達成した。移動相は、60%のアセトニトリル、40%の水及び0.1%のギ酸からなっていた。移動相を0.3mL/分の流速で供給した。多重反応モニタリング(MRM)スキャンを500℃の熱源温度で遮蔽ガス中で行った。分子イオンを、−4500Vのイオンスプレー電圧を使用して形成した。生成物イオンを、窒素ガス中で、−55V(化合物1)、−64V(化合物2)、及び−78V(内部標準)のデクラスタリング電位で、そして−24.0V(化合物1、m/z 388.0→117.9)、−26.0V(化合物2、m/z 406.1→135.9)、及び−22.4V(内部標準、m/z 396.9→241.0)の衝突エネルギーで形成した。血漿濃度−時間データを、WinNonlin(Version 3.1,Pharsight Corporation,Mountain View,CA,USA)を使用する非コンパートメント法によって解析した。時間ゼロから無限大までの血漿濃度−時間曲線下の面積(AUC)を、無限大時間への外挿を伴う台形則によって計算した。表4は、涙液の脂肪酸組成の統計的解析を示す。
【0177】
【表4】

【0178】
[00163]表4に示すように、投与前の涙液試料の分析は、パルミチン酸:ステアリン酸比が1.57±0.365であることを示した。いずれもの治療を受けなかった(偽)ORX(群2)の動物は、そのパルミチン酸:ステアリン酸比の僅かな減少(1.41±0.152)を示した。ORX動物をベヒクル単独で治療した場合、脂質比の1.78±0.218への軽度の増加があった。化合物2で治療されたORX動物において、パルミチン酸:ステアリン酸比の投与量依存性の増加があった(表4)。化合物1も、更に0.625及び1.25mg/kgの薬物による治療に対して、パルミチン酸:ステアリン酸比のそれぞれ2.64±0.858及び2.73±0.892の増加を示した(表4)。然しながら、化合物1で治療された動物において、パルミチン酸:ステアリン酸比の有意な容量依存性の変化は見られなかった。化合物2に対するパルミチン酸:ステアリン酸比の増加は、化合物1に対して観察されたものより高かった。
【0179】
ハーダー腺及びマイボーム腺の脂質組成に対する化合物1並びに化合物2の増加する投与量の影響
[00164]ウサギの涙液中の脂質は、ハーダー腺及びマイボーム腺の分泌物に由来するものである。これらの腺の脂質含有量をGCMSを使用して分析した。表5は、ハーダー腺がSARMによる治療によって最も影響されたことを示す。パルミチン酸:ステアリン酸比の投与量依存性の増加は、化合物1及び化合物2の両方で見られた。脂質比は、化合物1(1.25mg/kg)によって2倍より多く増加し、一方、化合物2の影響は、試験された最高の投与量(1.25mg/kg)において見られた殆ど3倍の脂質比の増加を伴いなお大きかった。化合物1又は化合物2のいずれかによるマイボーム腺脂質の統計的に有意な変化は見られなかった。
【0180】
【表5】

【0181】
ウサギの血漿の薬物動態学的解析
[00165]血液の局所投与後の全身暴露を、研究の11日目の薬物投与の30、60、90、120及び1440分後に得た末梢血試料で決定した。表6に示すように、化合物2の全身暴露(即ちAUC値)は、0.625から1.25mg/kgへの投与量の増加に伴って3.2μM*時から6.92μM*時に増加した。化合物1の暴露は、0.625から1.25mg/kgへの投与量の増加に伴い、2.87μM*時から3.99μM*時へのレベルの増加を示した。
【0182】
【表6】

【0183】
[00166]この研究において、化合物1及び2による治療後の、ウサギの涙液、マイボーム腺及びハーダー腺からの脂肪酸の組成を評価した。データは、ORXがウサギの涙液及びハーダー腺中の飽和脂肪酸のパルミチン酸のレベルを減少することを示す。パルミチン酸は、飽和脂肪酸であり、そして脂肪酸合成経路の正常な産物である。パルミチン酸は、長鎖の飽和及び不飽和脂肪酸の形成のための前駆体である。前駆体分子のいずれもの減少は、他の脂肪酸のレベルの欠損に漸進的に導くものである。次いで脂肪酸の減少は、涙膜形成の不安定さに導き、マイボーム腺の疾病によって包含される各種の疾患に導くことができる。先に与えた結果と同様に、化合物1及び化合物2による治療は、涙液のパルミチン酸:ステアリン酸比を、ORXウサギのそれと比較して増加した。低い投与量を使用することによって、全身循環に吸収される薬物の量は、2.5mg/kgの投与量における暴露(表6)と比較した場合、化合物1及び化合物2において1/8th及び1/4thそれぞれ減少される。全身暴露のこの減少は、涙液の脂質組成を変化する効力を失うことなく起こる。更に、使用される化合物1及び化合物2の投与量は、プラセボのベヒクル治療された動物と比較して、2−3倍のハーダー腺における脂質産生を刺激するために十分であった。これらのデータは、全身暴露が、局部組織(local tissue)の機能を変化するために必要ではなく、そして眼瞼を経由する眼球供給の方法が、涙液組成のホルモン欠損誘導の脂質の変化を予防するために十分であることを示す。
【0184】
[00167]本発明のある種の特徴が、本明細書中に例示され、そして記載されてきたが、多くの改変、置換、変更、及び均等物が、ここに当業者にとって思い浮かぶものである。従って、付属する特許請求の範囲が、本発明の真の思想に入るような全てのこのような改変及び変更を包含することを意図していることは理解されるべきである。
【特許請求の範囲】
【請求項1】
マイボーム腺機能障害を治療する方法であって、以下の式I:
【化1】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項2】
前記化合物が、以下の構造:
【化2】

から選択される、請求項1に記載の方法。
【請求項3】
涙液の脂質組成を改善する方法であって、以下の式I:
【化3】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項4】
前記化合物が、以下の構造:
【化4】

から選択される、請求項3に記載の方法。
【請求項5】
異常なマイボーム腺分泌を治療する方法であって、以下の式I:
【化5】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項6】
前記化合物が、以下の構造:
【化6】

から選択される、請求項5に記載の方法。
【請求項7】
マイボーム腺分泌を正常化する方法であって、以下の式I:
【化7】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項8】
前記化合物が、以下の構造:
【化8】

から選択される、請求項7に記載の方法。
【請求項9】
前記涙液の脂肪酸含有量が改善される、請求項1−8のいずれか1項に記載の方法。
【請求項10】
前記涙液の脂質含有量が改善される、請求項1−8のいずれか1項に記載の方法。
【請求項11】
前記涙液の脂肪酸含有量が増加される、請求項1−8のいずれか1項に記載の方法。
【請求項12】
前記涙液のパルミチン酸:ステアリン酸比が増加される、請求項1−8のいずれか1項に記載の方法。
【請求項13】
前記閉塞されたマイボーム腺の数が減少される、請求項1−8のいずれか1項に記載の方法。
【請求項14】
涙液膜破壊時間が増加される、請求項1−8のいずれか1項に記載の方法。
【請求項15】
マイボーム腺分泌物の粘度が減少される、請求項1−8のいずれか1項に記載の方法。
【請求項16】
マイボーム腺分泌物の透明度が増加される、請求項1−8のいずれか1項に記載の方法。
【請求項17】
前記マイボーム腺分泌間の時間が減少される、請求項1−8のいずれか1項に記載の方法。
【請求項18】
患者の眼の異物感を減少する方法であって、以下の式I:
【化9】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項19】
前記化合物が、以下の構造:
【化10】

から選択される、請求項18に記載の方法。
【請求項20】
患者の眼瞼周辺部の発赤を減少する方法であって、以下の式I:
【化11】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項21】
前記化合物が、以下の構造:
【化12】

から選択される、請求項20に記載の方法。
【請求項22】
前記発赤の減少が測光法で測定される、請求項20−21のいずれか1項に記載の方法。
【請求項23】
前記発赤の減少が視覚的に測定される、請求項20−21のいずれか1項に記載の方法。
【請求項24】
涙液膜破壊時間を改善する方法であって、以下の式I:
【化13】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項25】
前記化合物が、以下の構造:
【化14】

から選択される、請求項24に記載の方法。
【請求項26】
前記涙液膜破壊時間が増加される、請求項24−25のいずれか1項に記載の方法。
【請求項27】
前記涙液膜破壊時間が減少される、請求項24−25のいずれか1項に記載の方法。
【請求項28】
マイボーム腺の閉塞を改善する方法であって、以下の式I:
【化15】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項29】
前記化合物が、以下の構造:
【化16】

から選択される、請求項28に記載の方法。
【請求項30】
前記マイボーム腺の閉塞が減少される、請求項28−29のいずれか1項に記載の方法。
【請求項31】
前記眼瞼周辺部の発赤が減少される、請求項28−29のいずれか1項に記載の方法。
【請求項32】
前記マイボーム腺分泌の特性が変化される、請求項28−29のいずれか1項に記載の方法。
【請求項33】
涙液中の脂質の相転移温度を変化する方法であって、以下の式I:
【化17】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項34】
前記化合物が、以下の構造:
【化18】

から選択される、請求項33に記載の方法。
【請求項35】
前記相転移温度が減少される、請求項33−34のいずれか1項に記載の方法。
【請求項36】
眼球又は結膜の染色を減少する方法であって、以下の式I:
【化19】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項37】
前記化合物が、以下の構造:
【化20】

から選択される、請求項36に記載の方法。
【請求項38】
眼の灼熱及び/又は掻痒感を改善する方法であって、以下の式I:
【化21】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項39】
前記化合物が、以下の構造:
【化22】

から選択される、請求項38に記載の方法。
【請求項40】
前記眼の灼熱及び/又は掻痒感が減少される、請求項38−39のいずれか1項に記載の方法。
【請求項41】
眼への人工涙液の投与の頻度を減少する方法であって、以下の式I:
【化23】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項42】
前記化合物が、以下の構造:
【化24】

から選択される、請求項41に記載の方法。
【請求項43】
眼のステロイド療法の必要性を減少する方法であって、以下の式I:
【化25】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項44】
前記化合物が、以下の構造:
【化26】

から選択される、請求項43に記載の方法。
【請求項45】
前記投与することが、前記患者の眼の周辺部への前記医薬製品を局所適用すること含んでなり、ここにおいて、前記医薬製品が、眼科用溶液、懸濁液、エリキシル、ゲル、軟膏又はクリームである、請求項1、3、5、7、18、20、24、28、33、36、38、41及び43のいずれか1項に記載の方法。
【請求項46】
前記投与することが、前記医薬製品を経口適用すること含んでなり、ここにおいて、前記医薬製品が、錠剤又はカプセル製剤である、請求項1、3、5、7、18、20、24、28、33、36、38、41及び43のいずれか1項に記載の方法。
【請求項1】
マイボーム腺機能障害を治療する方法であって、以下の式I:
【化1】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項2】
前記化合物が、以下の構造:
【化2】

から選択される、請求項1に記載の方法。
【請求項3】
涙液の脂質組成を改善する方法であって、以下の式I:
【化3】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項4】
前記化合物が、以下の構造:
【化4】

から選択される、請求項3に記載の方法。
【請求項5】
異常なマイボーム腺分泌を治療する方法であって、以下の式I:
【化5】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項6】
前記化合物が、以下の構造:
【化6】

から選択される、請求項5に記載の方法。
【請求項7】
マイボーム腺分泌を正常化する方法であって、以下の式I:
【化7】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項8】
前記化合物が、以下の構造:
【化8】

から選択される、請求項7に記載の方法。
【請求項9】
前記涙液の脂肪酸含有量が改善される、請求項1−8のいずれか1項に記載の方法。
【請求項10】
前記涙液の脂質含有量が改善される、請求項1−8のいずれか1項に記載の方法。
【請求項11】
前記涙液の脂肪酸含有量が増加される、請求項1−8のいずれか1項に記載の方法。
【請求項12】
前記涙液のパルミチン酸:ステアリン酸比が増加される、請求項1−8のいずれか1項に記載の方法。
【請求項13】
前記閉塞されたマイボーム腺の数が減少される、請求項1−8のいずれか1項に記載の方法。
【請求項14】
涙液膜破壊時間が増加される、請求項1−8のいずれか1項に記載の方法。
【請求項15】
マイボーム腺分泌物の粘度が減少される、請求項1−8のいずれか1項に記載の方法。
【請求項16】
マイボーム腺分泌物の透明度が増加される、請求項1−8のいずれか1項に記載の方法。
【請求項17】
前記マイボーム腺分泌間の時間が減少される、請求項1−8のいずれか1項に記載の方法。
【請求項18】
患者の眼の異物感を減少する方法であって、以下の式I:
【化9】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項19】
前記化合物が、以下の構造:
【化10】

から選択される、請求項18に記載の方法。
【請求項20】
患者の眼瞼周辺部の発赤を減少する方法であって、以下の式I:
【化11】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項21】
前記化合物が、以下の構造:
【化12】

から選択される、請求項20に記載の方法。
【請求項22】
前記発赤の減少が測光法で測定される、請求項20−21のいずれか1項に記載の方法。
【請求項23】
前記発赤の減少が視覚的に測定される、請求項20−21のいずれか1項に記載の方法。
【請求項24】
涙液膜破壊時間を改善する方法であって、以下の式I:
【化13】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項25】
前記化合物が、以下の構造:
【化14】

から選択される、請求項24に記載の方法。
【請求項26】
前記涙液膜破壊時間が増加される、請求項24−25のいずれか1項に記載の方法。
【請求項27】
前記涙液膜破壊時間が減少される、請求項24−25のいずれか1項に記載の方法。
【請求項28】
マイボーム腺の閉塞を改善する方法であって、以下の式I:
【化15】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項29】
前記化合物が、以下の構造:
【化16】

から選択される、請求項28に記載の方法。
【請求項30】
前記マイボーム腺の閉塞が減少される、請求項28−29のいずれか1項に記載の方法。
【請求項31】
前記眼瞼周辺部の発赤が減少される、請求項28−29のいずれか1項に記載の方法。
【請求項32】
前記マイボーム腺分泌の特性が変化される、請求項28−29のいずれか1項に記載の方法。
【請求項33】
涙液中の脂質の相転移温度を変化する方法であって、以下の式I:
【化17】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項34】
前記化合物が、以下の構造:
【化18】

から選択される、請求項33に記載の方法。
【請求項35】
前記相転移温度が減少される、請求項33−34のいずれか1項に記載の方法。
【請求項36】
眼球又は結膜の染色を減少する方法であって、以下の式I:
【化19】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項37】
前記化合物が、以下の構造:
【化20】

から選択される、請求項36に記載の方法。
【請求項38】
眼の灼熱及び/又は掻痒感を改善する方法であって、以下の式I:
【化21】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項39】
前記化合物が、以下の構造:
【化22】

から選択される、請求項38に記載の方法。
【請求項40】
前記眼の灼熱及び/又は掻痒感が減少される、請求項38−39のいずれか1項に記載の方法。
【請求項41】
眼への人工涙液の投与の頻度を減少する方法であって、以下の式I:
【化23】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項42】
前記化合物が、以下の構造:
【化24】

から選択される、請求項41に記載の方法。
【請求項43】
眼のステロイド療法の必要性を減少する方法であって、以下の式I:
【化25】

[式中
Xは、O又はSであり;
Gは、O又はSであり;
Zは、NO2又はCNであり;
Yは、ハロゲン又はCF3であり;
Qは、ハロゲン、NHCOR又はCNであり;
Tは、OH、OR又はNHCORであり;
Rは、アルキル、アリール、アルケニル、ハロゲン又はOHであり;
R1は、CH3、CF3、CH2F、CHF2、CH2CH3又はCF2CF3であり;そして
nは、0又は1である;]
の化合物、或いはその異性体、医薬的に受容可能な塩、医薬製品、N−オキシド、水和物、又はこれらのいずれもの組合せを、それを必要とする患者に投与することを含んでなる、前記方法。
【請求項44】
前記化合物が、以下の構造:
【化26】

から選択される、請求項43に記載の方法。
【請求項45】
前記投与することが、前記患者の眼の周辺部への前記医薬製品を局所適用すること含んでなり、ここにおいて、前記医薬製品が、眼科用溶液、懸濁液、エリキシル、ゲル、軟膏又はクリームである、請求項1、3、5、7、18、20、24、28、33、36、38、41及び43のいずれか1項に記載の方法。
【請求項46】
前記投与することが、前記医薬製品を経口適用すること含んでなり、ここにおいて、前記医薬製品が、錠剤又はカプセル製剤である、請求項1、3、5、7、18、20、24、28、33、36、38、41及び43のいずれか1項に記載の方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2013−516501(P2013−516501A)
【公表日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願番号】特願2012−549006(P2012−549006)
【出願日】平成23年1月11日(2011.1.11)
【国際出願番号】PCT/US2011/020871
【国際公開番号】WO2011/085385
【国際公開日】平成23年7月14日(2011.7.14)
【出願人】(504206621)ジーティーエックス・インコーポレイテッド (20)
【Fターム(参考)】
【公表日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願日】平成23年1月11日(2011.1.11)
【国際出願番号】PCT/US2011/020871
【国際公開番号】WO2011/085385
【国際公開日】平成23年7月14日(2011.7.14)
【出願人】(504206621)ジーティーエックス・インコーポレイテッド (20)
【Fターム(参考)】
[ Back to top ]

