測定方法及び表面プラズモン増強蛍光測定装置
【課題】非特異吸着が生じている状態においても、特異吸着による信号を分離し、S/N比を向上させることが可能な表面プラズモン増強蛍光測定装置の測定方法を提供する。
【解決手段】検体が特異的に反応する1次抗体が固定化された前記反応場に補足された抗体に、前記振動付与手段により振動を与えるステップと、
前記金属薄膜の一方の面に励起光を照射し、他方の面側の電場を増強させることにより前記抗体に付された蛍光物質を励起させるステップと、
前記蛍光物質からの蛍光を測定し、出力信号を周波数解析することにより検体の分析を行うステップと、を有することを特徴とする表面プラズモン増強蛍光測定装置の測定方法。
【解決手段】検体が特異的に反応する1次抗体が固定化された前記反応場に補足された抗体に、前記振動付与手段により振動を与えるステップと、
前記金属薄膜の一方の面に励起光を照射し、他方の面側の電場を増強させることにより前記抗体に付された蛍光物質を励起させるステップと、
前記蛍光物質からの蛍光を測定し、出力信号を周波数解析することにより検体の分析を行うステップと、を有することを特徴とする表面プラズモン増強蛍光測定装置の測定方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、表面プラズモン励起増強蛍光分光法(SPFS;Surface Plasmon-field enhanced Fluorescence Spectroscopy)の原理に基づいた表面プラズモン増強蛍光測定装置を用いた測定方法、及び表面プラズモン増強蛍光測定装置に関する。
【背景技術】
【0002】
従来より、表面プラズモン励起増強蛍光分光法(SPFS)の原理に基づき、例えば生体内の極微少なアナライトの検出が行われている。表面プラズモン励起増強蛍光分光法(SPFS)は、光源より照射したレーザ光(励起光)が金属薄膜表面で全反射減衰(ATR;attenuated total reflectance)する条件において、金属薄膜表面に粗密波(表面プラズモン)を発生させることによって、光源より照射したレーザ光(励起光)が有するフォトン量を数十倍〜数百倍に増やし(表面プラズモンの電場増強効果)、これにより金属薄膜近傍の蛍光物質を効率良く励起させることによって、極微量および/または極低濃度のアナライトを検出する方法である。
【0003】
近年、このような表面プラズモン励起増強蛍光分光法(SPFS)の原理に基づいた表面プラズモン増強蛍光測定装置の開発が進められており、例えば特許文献1や特許文献2などにその技術開示がなされている。
【0004】
このような表面プラズモン増強蛍光測定装置10は、図9に示したように基本的な構造において、誘電体部材106の表面に金属薄膜102、更にその表面に反応場104が設けられたチップ構造体108を備えている。
【0005】
そして、チップ構造体108の誘電体部材106側には、誘電体部材106内に入射され、金属薄膜102に向かって励起光b1を照射する光源112を備え、さらに光源112から照射され金属薄膜102で反射した金属薄膜反射光b2を受光する受光手段116が備えられている。
【0006】
一方、チップ構造体108の反応場104側には、反応場104で捕捉されたアナライトを標識した蛍光物質が発する蛍光b3を受光する光検出部120が設けられている。
【0007】
なお、反応場104と光検出部120との間には、蛍光b3を効率よく集光するための集光部材122と、蛍光b3以外に含まれる光を除去し、必要な蛍光のみを選択するフィルタ124が設けられている。
【0008】
そして、表面プラズモン増強蛍光測定装置10の使用においては、あらかじめ金属薄膜102の表面上には検出対象のDNA等のアナライトに含まれる抗原に特異的に結合する1次抗体があらかじめ固定されている。金属薄膜102に接する反応場104に、アナライト及び当該アナライトに特異的に結合する2次抗体を順に送液して、2次抗体を反応場104で捕捉させる。アナライトとともに捕捉される2次抗体は蛍光物質で標識されている。
【0009】
捕捉された反応場104に光源112より誘電体部材106内に励起光b1を照射し、この励起光b1が特定の角度(共鳴角)θ1で金属薄膜102に入射することで、金属薄膜102上に粗密波(表面プラズモン)を生ずるようになっている。なお、金属薄膜102上に粗密波(表面プラズモン)が生ずる際には、励起光b1と金属薄膜102中の電子振動とがカップリングし、金属薄膜反射光b2の光量減少という現象が生ずる。
【0010】
受光手段116及び光源112とは対となって金属薄膜102の照射領域を中心として回動し、金属薄膜102への入射角度を変更することができる。入射角度を変化させ、その際の受光手段116で受光される金属薄膜反射光b2のシグナルが変化(光量が減少)する地点を見つければ、粗密波(表面プラズモン)が生ずる共鳴角θ1を得ることができる。
【0011】
そして、この粗密波(表面プラズモン)を生ずる現象により、金属薄膜102上の反応場104の蛍光物質が効率良く励起され、これにより蛍光物質が発する蛍光b3の光量が増大することとなる。
【0012】
この増大した蛍光b3を、集光部材122およびフィルタ124を介して光検出部120で受光することで、極微量および/または極低濃度のアナライトを検出することができるようになっている。
【0013】
このように、表面プラズモン増強蛍光測定装置10は、特に生体分子間などの微細な分子活動を観察可能とする高感度計測センサである。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】特許第3294605号公報
【特許文献2】特開2008−102117号公報
【発明の概要】
【発明が解決しようとする課題】
【0015】
アナライトは必ずしも均一な成分ではなく不均一の場合が多い。このような場合には反応場での吸着は特異吸着だけではなく、これ以外の非特異吸着も少なからず発生する。微量の検体で分析するために分析感度を上げるが、その場合に特異吸着による信号のみならず非特異吸着による信号も増加してしまうためにS/N比の向上には結びつかない。
【0016】
本願発明はこのような問題に鑑み非特異吸着が生じている状態においても、特異吸着による信号を分離し、S/N比を向上させることが可能な表面プラズモン増強蛍光測定装置を用いた測定方法、及び表面プラズモン増強蛍光測定装置を提供することを目的とする。
【課題を解決するための手段】
【0017】
上記の目的は、下記に記載する発明により達成される。
【0018】
1.金属薄膜が設けられた反応場に所定の周波数で振動を与える振動付与手段を有する表面プラズモン増強蛍光測定装置を用いた測定方法であって、
検体が特異的に反応する1次抗体が固定化された前記反応場に補足された抗体に、前記振動付与手段により振動を与えるステップと、
前記金属薄膜の一方の面に励起光を照射し、他方の面側の電場を増強させることにより前記抗体に付された蛍光物質を励起させるステップと、
前記蛍光物質からの蛍光を測定し、出力信号を周波数解析することにより検体の分析を行うステップと、
を有することを特徴とする測定方法。
【0019】
2.前記振動付与手段により与える振動の周波数は前記反応場に固定化された前記抗体が共振する周波数よりも低く、振動により前記抗体を強制振動させることを特徴とする前記1に記載の測定方法。
【0020】
3.前記振動付与手段により与える振動の周波数は、前記反応場に固定化された前記抗体が共振する周波数であることを特徴とする前記1に記載の測定方法。
【0021】
4.前記増強された電場は、前記金属薄膜からの距離により異なっており、
前記振動付与手段により与える振動により、前記蛍光物質の前記金属薄膜からの距離を周期的に変化させ、前記蛍光物質の前記金属薄膜からの距離の変化により蛍光の強度を変化させることを特徴とする前記1から3の何れか一項に記載の測定方法。
【0022】
5.金属薄膜が設けられ、検体が特異的に反応する1次抗体が固定化された反応場と、
前記反応場に所定の周波数で振動を与える振動付与手段と、
前記金属薄膜の一方の面に励起光を照射し、他方の面側の電場を増強させ前記反応場に補足された抗体に付与された蛍光物質を励起させる発光部と、
前記蛍光物質からの励起光を検出する光検出部と、
前記反応場に補足された抗体に前記振動付与手段により振動を与えた状態で、抗体に付された蛍光物質からの蛍光を前記光検出部で測定し、出力信号を周波数解析し、得られた信号強度から検体の分析を行う解析手段と、
を有することを特徴とする表面プラズモン増強蛍光測定装置。
【0023】
6.前記振動付与手段により与える振動の周波数は前記反応場に固定化された前記抗体が共振する周波数よりも低く、振動により前記抗体を強制振動させることを特徴とする前記5に記載の表面プラズモン増強蛍光測定装置。
【0024】
7.前記振動付与手段により与える振動の周波数は、該反応場に固定化された前記抗体が共振する周波数であることを特徴とする前記5に記載の表面プラズモン増強蛍光測定装置。
【0025】
8.前記抗体、あるいは前記蛍光物質は、電荷を帯びており、
前記振動付与手段は、前記反応場に交番電界を印加することを特徴とする前記6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【0026】
9.前記振動付与手段は、前記反応場を一の壁面とする流路の、前記反応場以外の他の壁面を振動させることを特徴とする前記6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【0027】
10.前記振動付与手段は、前記反応場を一の壁面とする流路に、液体を往復して送液し、往復運動により前記検体に振動を与えることを特徴とする前記6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【発明の効果】
【0028】
本願発明によれば、反応場の特異吸着spを所定の周期で振動させ、特異吸着spの蛍光物質からの蛍光からの信号を周波数解析し、得られた信号強度から検体の分析を行うことにより、特異吸着のみならず非特異吸着が生じている状態においても、特異吸着による信号を分離し、S/N比を向上させることが可能となる。
【図面の簡単な説明】
【0029】
【図1】マイクロチップ送液システムを用いた表面プラズモン増強蛍光測定装置の概略図である。
【図2】図2(a)は、マイクロチップ14周辺の断面図であり、図2(b)はその一部の上面図である。
【図3】反応場104の検体の振動状態を説明する模式図である。
【図4】金属薄膜102からの距離と電場強度との関係を示す図である。
【図5】倒立振り子モデルを説明する図である。
【図6】制御部18が実行する制御フローである。
【図7】光検出部120の出力信号に対して周波数解析を行った例である。
【図8】振動付与手段の第1の変形例として、微細流路143の壁面を機械的に往復運動させて反応場に振動を与えるものである。
【図9】従来の表面プラズモン増強蛍光測定装置の概略図である。
【発明を実施するための形態】
【0030】
本発明を実施の形態に基づいて説明するが、本発明は該実施の形態に限られない。
【0031】
図1、図2は、実施形態に係るマイクロチップ送液システムを用いた表面プラズモン増強蛍光測定装置の概略図である。
【0032】
表面プラズモン増強蛍光測定装置は、励起光を金属薄膜に照射して粗密波(表面プラズモン)を生じさせて励起された蛍光物質が生ずる蛍光を正確に検出し、検出感度を上げても超高精度に蛍光検出を行うことを可能とするものである。
【0033】
[表面プラズモン増強蛍光測定装置10]
本発明の表面プラズモン増強蛍光測定装置10は、図1に示したように、まず金属薄膜102と、金属薄膜102の一方側面に形成された反応場104と、他方側面に形成された誘電体部材106と、を有するチップ構造体108を備えている。
【0034】
そして、チップ構造体108の誘電体部材106側には、誘電体部材106内に入射され、金属薄膜102に向かって励起光b1を照射する「発光部」として機能する光源112を備え、さらに光源112から照射され金属薄膜102に反射した金属薄膜反射光b2を受光する受光手段116を備えている。
【0035】
ここで光源112から照射される励起光b1としてはレーザ光が好ましく、波長200〜1000nmのガスレーザまたは固体レーザ、波長385〜800nmの半導体レーザが好適である。
【0036】
一方、チップ構造体108の反応場104側には、反応場104で生じた蛍光b3を受光する光検出部120が設けられている。
【0037】
光検出部120としては、超高感度の光電子増倍管、または多点計測が可能なCCDイメージセンサを用いることが好ましい。
【0038】
なお、チップ構造体108の反応場104と光検出部120との間には、光を効率よく集光するための集光部材122と、光の内で蛍光b3とは異なる波長の光の透過を低減して蛍光b3を選択的に透過するように形成されたフィルタ124が設けられている。
【0039】
集光部材122としては、光検出部120に蛍光シグナルを効率よく集光することを目的とするものであれば、任意の集光系で良い。簡易な集光系としては、顕微鏡などで使用されている市販の対物レンズを転用してもよい。対物レンズの倍率としては、10〜100倍が好ましい。
【0040】
一方、フィルタ124としては、光学フィルタ、カットフィルタなどを用いることができる。光学フィルタとしては、減光(ND)フィルタ、ダイアフラムレンズなどが挙げられる。さらにカットフィルタとしては、外光(装置外の照明光)、励起光(励起光の透過成分)、迷光(各所での励起光の散乱成分)、プラズモンの散乱光(励起光を起源とし、プラズモン励起センサ表面上の構造体または付着物などの影響で発生する散乱光)、酵素蛍光基質の自家蛍光などの各種ノイズ光を除去するフィルタであって、例えば干渉フィルタ、色フィルタなどが挙げられる。
【0041】
制御部18は、CPUやメモリを備えており、メモリに記憶されているプログラムを実行することにより、光源112、光検出部120、後述のポンプ130等を制御する。また制御部18の周波数解析部181は「解析手段」として機能し、光検出部120からの信号に対して、FFTや特定の周波数を除去等の周波数解析を行うことができる。
【0042】
そして、このような表面プラズモン増強蛍光測定装置10を用いたアナライト検出方法では、反応場104に接する側の金属薄膜102表面上には1次抗体を結合させたSAM膜(Self-Assembled Monolayer:「自己組織化単分子膜」ともいう)や高分子材料が設けられている。1次抗体はSAM膜や高分子材料の一方の端部に結合されており、SAM膜や高分子材料の他方の端部は、直接若しくは間接に金属薄膜102表面に固定されている。高分子材料は複数種類が介在していてもよい。SAM膜としては例えばHOOC−(CH2)11−SHなどの置換脂肪族チオールで形成された膜、高分子材料としては例えばポリエチレングリコール(polyethylene glycol、以下「PEG」と記す。)やMPCポリマー等が挙げられる。これは使用時に調製しても、予めこれらを結合させた基板を用いてもよい。また、1次抗体に対する反応性基(または反応性基に変換可能な官能基)を備えたポリマーを直接金基板上に固定化し、その上に1次抗体を固定化してもよい。各種反応性基を利用して抗体やポリマーを結合させる際には、スクシンイミジル化を経たアミド化縮合反応や、マレイミド化を経た付加反応等が一般的である。
【0043】
このようにして構成した反応場104に標的物質としてのアナライト(検体ともいう)の抗原を含む溶液(以下、検体液ともいう)と、2次抗体を含む試薬液の送液を行う。固定化した1次抗体によって抗原を捕捉することが可能である。これに対しさらに蛍光物質で標識した2次抗体を含む試薬液を作用させることで捕捉された抗原を標識している。なお予め抗原と2次抗体とを反応させておいてから1次抗体を作用させてもよい。
【0044】
蛍光物質で標識されたアナライトの検出は、アナライトが捕捉された反応場104に光源112より誘電体部材106に励起光b1を照射し、この励起光b1が金属薄膜102に対して特定の入射角度(共鳴角θ1)で金属薄膜102に入射することで、金属薄膜102上に粗密波(表面プラズモン)を生ずるようになる。
【0045】
なお、金属薄膜102上に粗密波(表面プラズモン)が生ずる際には、励起光b1と金属薄膜102中の電子振動とがカップリングし、金属薄膜反射光b2のシグナルが変化(光量が減少)することとなるため、受光手段116で受光される金属薄膜反射光b2のシグナルが変化(光量が減少)する地点を見つければ良い。
【0046】
そして、この粗密波(表面プラズモン)により、金属薄膜102上の反応場104で生じた蛍光物質が効率良く励起され、これにより蛍光物質が発する蛍光b3の光量が増大し、この蛍光b3を集光部材122およびフィルタ124を介して光検出部120で受光することで、極微量および/または極低濃度のアナライトを検出することができる。
【0047】
なお、チップ構造体108の金属薄膜102の材質としては、好ましくは金、銀、アルミニウム、銅、および白金からなる群から選ばれる少なくとも1種の金属からなり、より好ましくは金からなり、さらにこれら金属の合金から成ることである。
【0048】
このような金属は、酸化に対して安定であり、かつ粗密波(表面プラズモン)による電場増強が大きくなることから金属薄膜102に好適である。
【0049】
また、金属薄膜102の形成方法としては、例えばスパッタリング法、蒸着法(抵抗加熱蒸着法、電子線蒸着法など)、電解メッキ、無電解メッキ法などが挙げられる。中でもスパッタリング法、蒸着法は、薄膜形成条件の調整が容易であるため好ましい。
【0050】
さらに金属薄膜102の厚さとしては、金:5〜500nm、銀:5〜500nm、アルミニウム:5〜500nm、銅:5〜500nm、白金:5〜500nm、およびそれらの合金:5〜500nmの範囲内であることが好ましい。
【0051】
電場増強効果の観点からは、金:20〜70nm、銀:20〜70nm、アルミニウム:10〜50nm、銅:20〜70nm、白金:20〜70nm、およびそれらの合金:10〜70nmの範囲内であることがより好ましい。
【0052】
金属薄膜102の厚さが上記範囲内であれば、粗密波(表面プラズモン)が発生し易く好適である。また、このような厚さを有する金属薄膜102であれば、大きさ(縦×横)は特に限定されないものである。
【0053】
電場強度は、金属薄膜102に近い程強く離れるにつれて弱くなる。但し、金属薄膜の表面近傍(表面〜数十nm)では電場増強が生じても、金属薄膜へエネルギーの移動が発生しても励起状態が消光してしまう消光現象が発生する。そのため、電場強度のピークは、消光現象が生じない範囲で最も近い距離にそのピークを持つ(後述の図4参照)。
【0054】
また、誘電体部材106としては、高屈折率の60度プリズムを用いることができる。材料としては光学的に透明な各種の無機物、天然ポリマー、合成ポリマーを用いることができ、化学的安定性、製造安定性および光学的透明性の観点から、二酸化ケイ素(SiO2)または二酸化チタン(TiO2)を含むことが好ましい。
【0055】
さらに、このような表面プラズモン増強蛍光測定装置10は、光源112から金属薄膜102に照射される励起光b1による表面プラズモン共鳴の最適角(共鳴角θ1)を調整するため、角度可変部(図示せず)を有している。
【0056】
ここで、角度可変部(図示せず)は制御部18により制御され、「共鳴角スキャン工程」においては角度可変部のサーボモータで全反射減衰(ATR)条件を求めるために受光手段116と光源112とを同期して、照射領域を中心として回動し、45〜85°の範囲で角度変更を可能としている。また分解能は0.01°以上であることが好ましい。
【0057】
図2(a)は、マイクロチップ14周辺の断面図であり、図2(b)はその一部の上面図である。図2(a)では図1に示した誘電体部材106にマイクロチップ14を取り付けている。マイクロチップ14は少なくとも反応場104の周辺は蛍光b3を透過する基材を用いる必要があり、本実施形態としては基材として石英を用いている。そして石英基板142には微細流路143が設けられており、図2(a)に示す状態では微細流路143の底面はその表面に金属薄膜102が形成された誘電体部材106で構成されている。周囲を固定具161により支持された石英基板142は、誘電体部材106と隙間なく固定されている。
【0058】
微細流路143の経路中には、前述の反応場104が設けられている。微細流路143の一方の端部には開口144aが、他方の端部には開口144bがそれぞれ設けられている。また開口144a側には接続部145が設けられている。反応場104の金属薄膜102と相対する側には蛍光b3の測定に支障がないように透明なITO基板146A(ITO:Indium-Tin Oxide)が設けられている。ITO基板146Aについては図3の説明で後述する。
【0059】
接続部145は、ピペット150が接続可能である。接続部145は弾性体材料で構成されており、ピペット150を装填する際にはシール部材として機能する。他方の開口144bの先には不要な液体を廃棄する貯留部148が設けられている。なお貯留部148の上部には不図示の微細な空気孔が設けられている。
【0060】
微細流路143の幅(Y方向長さ)は1mm〜3mm、高さ(Z方向)は50μm〜500μm、反応場104の幅は微細流路143の幅と同等であり、長さは1mm〜3mmとするが、必ずしも限定されるものではない。また微細流路143の両端の開口144a、144bの大きさは微細流路143の幅と同等のφ1mm〜φ3mmである。ピペット150の先端は開口144aとほぼ同等の形状であり、根元部分はこれよりも太い軸径の円柱形状である。貯留部148は流路方向で開口144bよりも大きな断面形状であり、例えば2〜4mm角の形状としている。なお図2(b)においては略正方形の断面形状としているが、円形の断面形状としてもよい。
【0061】
図2(a)においては、ピペット150を装填した状態を示している。なお、貯留部148はマイクロチップ14に固定した例を示しているが、ピペット150と同様に取り外し可能な構成としてもよい。なおピペット150は材料としてはポリプロピレンを用いており、接続部145を介して容易に脱着が可能であり、供給した検体液とともにピペット150の廃棄を容易に行うことができる。またポンプ130は例えばシリンジポンプであり、所定量の液体を吐出あるいは吸引することが可能である。なお本願においては、「吐出」とはポンプ130から液体あるいは空気を送りだすことにより、ピペット150の内部の液体を順方向(図2(a)の微細流路143において右方向)に搬送することであり、「吸引」とはその逆である。
【0062】
制御部18がポンプ130を制御することにより、ピペット150の内部に貯留した検体液等の液体をマイクロチップ14の内部に吐出したり、吸引したりすることが可能である。このようにして微細流路143には蛍光物質が標識された2次抗体等が含まれる試薬液や、アナライトが含まれる検体液がポンプ130により送液される。
【0063】
検体としては、血液、血清、血漿、尿、鼻孔液、唾液、便、体腔液(髄液、腹水、胸水等)などが挙げられる。検体中に含有されるアナライトは、例えば、核酸(一本鎖であっても二本鎖であってもよいDNA、RNA、ポリヌクレオチド、オリゴヌクレオチド、PNA(ペプチド核酸)等、またはヌクレオシド、ヌクレオチドおよびそれらの修飾分子)、タンパク質(ポリペプチド、オリゴペプチド等)、アミノ酸(修飾アミノ酸も含む。)、糖質(オリゴ糖、多糖類、糖鎖等)、脂質、またはこれらの修飾分子、複合体などが挙げられ、具体的には、AFP(αフェトプロテイン)等のがん胎児性抗原や腫瘍マーカー、シグナル伝達物質、ホルモンなどであってもよく、特に限定されない。
【0064】
さらに蛍光物質としては、所定の励起光b1を照射するか、または電界効果を利用することで励起し、蛍光b3を発する物質であれば特に限定されないものである。なお本明細書でいう蛍光b3とは、燐光など各種の発光も含まれるものである。
【0065】
[振動付与手段]
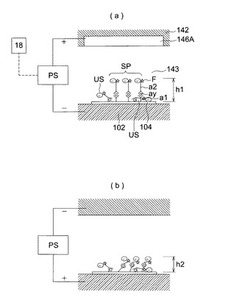
図3は、反応場104の検体の振動状態を説明する模式図である。同図に示すように、金属薄膜102とITO基板146Aは高圧電源PSにより接続されている。高圧電源PSは交流電圧あるいは極性を交互に入れ替えたパルス状の電圧を出力することが可能であり、反応場104に対して極性を所定の周波数で変化する交番電界を与えることができる。電圧としては例えば数百V、好ましくは数十V以下である。である。高圧電源PS及びITO基板146Aが振動付与手段として機能する。所定の周波数は、反応場104において特異吸着している検体が共振する周波数あるいはこれよりも低い周波数に設定している。当該周波数としては概ね数Hzから数十Hzである。振動を与えることにより特異吸着spは共振あるいは強制振動させられる。
【0066】
同図において、1次抗体a1は反応場104に固定されており、当該1次抗体a1に特異的に反応する検体ayと検体ayに特異的に反応する2次抗体a2とは、この順で繋がっている。また2次抗体a2は蛍光標識Fが修飾されている。なお、微細流路143の内部は液体が充填されているが図示は省略している。
【0067】
同図に示すように特異吸着sp(1次抗体a1、検体ay、2次抗体a2の連結)に混じって、特異吸着以外の非特異吸着us(同図の例では、検体ay、2次抗体a2の組み合わせ)が混在している。同図に示す例では、特異吸着sp及び非特異吸着usは負の電荷を帯びており、反応場104及び反応場104周辺の微細流路143に高圧電源PSにより所定の周波数で交番電界を印加することにより、これらの物質は上下方向に力を受けることになる。
【0068】
図3(a)のように特異吸着spが上方に力を受ける状態では、特異吸着spは伸びた状態となるので、蛍光標識Fの金属薄膜102からの距離h1は長くなる。一方で、図3(b)のように下方に力を受ける状態では、特異吸着spは縮んだ状態となるので蛍光標識Fの金属薄膜102からの距離h2は短くなる。
【0069】
ここで、前述のとおり、消光現象により金属薄膜102と近接する領域では電場強度は小さく、離れる程大きくなる。図4は、金属薄膜102からの距離と電場強度との関係を示す図である。同図に示すように金属薄膜102に接する距離ゼロにおいては、消光現象により電場強度はゼロに近く、距離が離れるほどその影響は小さくなるので電場強度は大きくなる。一方で、近傍以外では金属薄膜102から離れるほど電場強度は小さくなるので、距離hpをピークとして離れるほど電場強度は徐々に小さくなってゆく。距離hx(一般的には200〜500nm)以上ではほぼゼロとなる。
【0070】
また距離hpは例えば30〜50nmであり、特異吸着spの長さは20〜30nmであるので、距離hp≧h1>h2の関係となっている。このようなことから、蛍光標識Fに対する電場強度は、図3(a)の状態での距離h1の方が、図3(b)状態での距離h2のときよりも強い。つまり、蛍光標識Fの金属薄膜102表面からの距離が、距離hp以下の範囲内で変化する場合には、蛍光の強度も距離に応じて変化することになる。
【0071】
このような特性から、特異吸着spに振動を与えることにより金属薄膜102からの距離が周期的に変化し、当該振動により蛍光標識Fから発する蛍光の強度も振動することになる。一方で、非特異吸着usは、特異吸着spとは長さ及び重さが異なる。特に非特異吸着としては主に(1)蛍光標識された2次抗体a2だけが、SAM膜上に横たわっている状態(2)2次抗体a2が検体ayに直接付着している状態、がある。非特異吸着usが上記(1)であれば振動を付与させても振動せずに蛍光の強度は一定(DC成分)となり、上記(2)であれば特異吸着spよりも長さが短く、質量も小さいので、共振周波数は特異吸着spと比較して大きなものとなる。よって後述の周波数解析により特異吸着spの振動成分を取り出すことにより、S/N比を向上させた分析を行うことが可能となる。
【0072】
[共振周波数]
ここで特異吸着spの共振周波数について説明する。特異吸着spの共振周波数を算出するために、まずは図5に示す様な倒立振り子モデルを用いてタンパクの運動方程式について検討する。
【0073】
mはタンパクの質量、lはタンパクの長さ、kはバネ定数、hはバネの作用点までの長さ、Cは溶媒により粘性減衰係数としたとき、以下のようになる。
慣性モーメント:J=ml2
転倒モーメント:mg・l・sinθ≒mgl・θ
バネの復元力:−k・hθ
復元モーメント:−k・hθ・h=−kh2・θ
上記の元で、運動方程式は以下の数式1で表される。
【0074】
【数1】

【0075】
数式1は、数式2となり、重力とバネ復元力による共振角周波数をWnとすると、数式3、数式4のようになり、数式2は数式5で表される。
【0076】
【数2】

【0077】
溶媒の粘性減衰を含めたトータルでの共振周期Tは、以下の数式6のとおりとなる。
【0078】
【数3】

【0079】
h=l=1.8×10−9(m)、M=6.17×10−22(kg)、g=9.8(m/t2)、またk=2.5(N/m)=2.5(kg/t2)として、
kt=kh2−mgl≒0.81×10−15(kgm2/t2)
J=M×l2=6.17×10−22×(18×10−9)2=1.99908×10−37(kgm2)
wn=√(kt/J)≒0.636×1011(Hz)
溶媒が水であれば粘度η=0.89(cP)=0.89×10−3(kg/(mt))、
タンパクの大きさを半径r=5nmとすると
体積V=4/3πr3=5.236×10−25(m3)
粘性減衰係数:C=η×V=5.236×10−25×0.89×10−3≒4.66004×10−28(kgm2/t)
減衰比:ζ=C/(2Wn×J)=4.66004×10−28/(2×0.636×1011×1.99908×10−37)≒0.0183
共振周期T=2π/(Wn×√(1−ζ2))≒9.88×10−11(t)
共振周波数f=1/T≒10(Ghz)となる。
【0080】
溶媒の種類を選択して、より粘度の高いものにすることにより特異吸着spが共振する共振周波数f1を任意の値に設定することができる。共振周波数f1としては数Hz程度に抑えることが望ましい。
【0081】
[制御フロー]
図6は、表面プラズモン増強蛍光測定装置の制御部18が実行する制御フローである。ステップS11では、ポンプ130を作動させることにより、ピペット150内のアナライトが含まれる検体液を、微細流路143を通じて貯留部148に送液する。当該行為により反応場104の固定されている1次抗体にアナライトが補足される。続いて、ピペット150の交換を行う。交換されたピペット150には、蛍光標識が修飾された2次抗体が含まれる2次抗体液が充填されており、2次抗体液を、微細流路143を通じて貯留部148まで送液する。2次抗体はアナライトに特異的に反応するので、反応場104には、1次抗体、アナライト、2次抗体の順で連結した状態(特異吸着sp)で補足されることになる。
【0082】
ステップS12では反応場104の洗浄工程として、同様にピペット150を交換し、内部の水等の洗浄液を、微細流路143を通じて貯留部148まで送液する。
【0083】
ステップS11、S12により反応場104は、図3のように特異吸着spが形成される。またこの際に、ステップS12の洗浄工程でも除去できなかった非特異吸着usが少なからず反応場104に存在している。
【0084】
ステップS13では、制御部18は、振動付与手段としての高圧電源PSを作動させて、反応場104に所定の周波数の交番電界を印加することにより所定の周波数で特異吸着spに振動を与える。
【0085】
ステップS14では、光源112からの励起光b1により生じる電場増強により、反応場の蛍光標識Fからの蛍光を光検出部120で測定する。
【0086】
ステップS15では、周波数解析部181により、ステップS14で得られて出力信号を周波数解析することにより、特異吸着spにより信号を分離する。周波数解析としては例えば(1)特異吸着spが強制振動により振動した周波数あるいは共振周波数f1(以下、これらを総称して振動周波数fspという)以外の信号成分を除去するようにバンドパスフィルタあるいはローパスフィルタをかけ、得られた信号からアナライトの定量等を行う、あるいは(2)FFT(高速フーリエ変換)の様な周波数変換処理を行い、振動周波数fspの信号強度からアナライトの定量等を行う、がある。また更に(3)FFTの後に、振動周波数fspを通すフィルタをかけ、その後にIFFT(高速フーリエ逆変換)の様な周波数逆変換処理を行うことにより上記(1)の様に定量等を行ってもよい。
【0087】
図7は、光検出部120の出力信号に対して周波数解析を行った例である。図7(a)は、バンドパスフィルタにより出力信号から振動周波数fsp以外の信号成分を除去した例である。図7(b)は、出力信号にFFT処理をかけた例である。
【0088】
このように、反応場の特異吸着spを所定の周期で振動させ、特異吸着spの蛍光物質からの蛍光からの信号を周波数解析し、得られた信号強度から検体の分析を行うことにより、特異吸着のみならず非特異吸着が生じ、両者が混在している状態においても、特異吸着による信号を分離し、S/N比を向上させることが可能となる。
【0089】
[振動付与手段の他の実施形態]
以下に、振動付与手段の変形例について説明する。以下においては振動付与手段以外の構成は図1から図7で説明した構成と同一であり、説明は省略する。
【0090】
図8は、振動付与手段の第1の変形例として、微細流路143の壁面を機械的に往復運動させて反応場に振動を与えるものである。同図に示す例では、微細流路143のうち、反応場104とは反対側の壁面が可動壁146Bとなっており、圧電素子17を駆動させることにより可動壁146Bは微細流路143の高さ方向(図示矢印方向)に可動する。
【0091】
圧電素子17を所定周期で駆動させることにより反応場104の特異吸着spを振動させることが可能となる。
【0092】
また、第2の変形例としては、ポンプ130を制御することにより、ピペット150の内部の液体を吐出させたり吸引させたりすることにより微細流路143の内部の液体を所定の周期で往復運動させる。そして液体の往復運動により特異吸着spを倒立振り子のように振動させることができる。
【0093】
第3の変形例としては、励起光b1及び蛍光b3(図1参照)とは波長が重複しない、例えば赤外波長の光を、別の光源により反応場104周辺に照射させるものである。当該照射をパルス状で所定周期で行うことにより、反応場104周辺を加熱することにより、特異吸着spを振動させることが可能となる。
【符号の説明】
【0094】
10 増強蛍光測定装置
14 マイクロチップ
18 制御部
181 周波数解析部
PS 高圧電源
146A ITO基板
146B 可動壁
17 圧電素子
142 石英基板
143 微細流路
148 貯留部
150 ピペット
161 固定具
102 金属薄膜
104 反応場
112 光源
116 受光手段
120 光検出部
b1 励起光
b2 金属薄膜反射光
b3 蛍光
【技術分野】
【0001】
本発明は、表面プラズモン励起増強蛍光分光法(SPFS;Surface Plasmon-field enhanced Fluorescence Spectroscopy)の原理に基づいた表面プラズモン増強蛍光測定装置を用いた測定方法、及び表面プラズモン増強蛍光測定装置に関する。
【背景技術】
【0002】
従来より、表面プラズモン励起増強蛍光分光法(SPFS)の原理に基づき、例えば生体内の極微少なアナライトの検出が行われている。表面プラズモン励起増強蛍光分光法(SPFS)は、光源より照射したレーザ光(励起光)が金属薄膜表面で全反射減衰(ATR;attenuated total reflectance)する条件において、金属薄膜表面に粗密波(表面プラズモン)を発生させることによって、光源より照射したレーザ光(励起光)が有するフォトン量を数十倍〜数百倍に増やし(表面プラズモンの電場増強効果)、これにより金属薄膜近傍の蛍光物質を効率良く励起させることによって、極微量および/または極低濃度のアナライトを検出する方法である。
【0003】
近年、このような表面プラズモン励起増強蛍光分光法(SPFS)の原理に基づいた表面プラズモン増強蛍光測定装置の開発が進められており、例えば特許文献1や特許文献2などにその技術開示がなされている。
【0004】
このような表面プラズモン増強蛍光測定装置10は、図9に示したように基本的な構造において、誘電体部材106の表面に金属薄膜102、更にその表面に反応場104が設けられたチップ構造体108を備えている。
【0005】
そして、チップ構造体108の誘電体部材106側には、誘電体部材106内に入射され、金属薄膜102に向かって励起光b1を照射する光源112を備え、さらに光源112から照射され金属薄膜102で反射した金属薄膜反射光b2を受光する受光手段116が備えられている。
【0006】
一方、チップ構造体108の反応場104側には、反応場104で捕捉されたアナライトを標識した蛍光物質が発する蛍光b3を受光する光検出部120が設けられている。
【0007】
なお、反応場104と光検出部120との間には、蛍光b3を効率よく集光するための集光部材122と、蛍光b3以外に含まれる光を除去し、必要な蛍光のみを選択するフィルタ124が設けられている。
【0008】
そして、表面プラズモン増強蛍光測定装置10の使用においては、あらかじめ金属薄膜102の表面上には検出対象のDNA等のアナライトに含まれる抗原に特異的に結合する1次抗体があらかじめ固定されている。金属薄膜102に接する反応場104に、アナライト及び当該アナライトに特異的に結合する2次抗体を順に送液して、2次抗体を反応場104で捕捉させる。アナライトとともに捕捉される2次抗体は蛍光物質で標識されている。
【0009】
捕捉された反応場104に光源112より誘電体部材106内に励起光b1を照射し、この励起光b1が特定の角度(共鳴角)θ1で金属薄膜102に入射することで、金属薄膜102上に粗密波(表面プラズモン)を生ずるようになっている。なお、金属薄膜102上に粗密波(表面プラズモン)が生ずる際には、励起光b1と金属薄膜102中の電子振動とがカップリングし、金属薄膜反射光b2の光量減少という現象が生ずる。
【0010】
受光手段116及び光源112とは対となって金属薄膜102の照射領域を中心として回動し、金属薄膜102への入射角度を変更することができる。入射角度を変化させ、その際の受光手段116で受光される金属薄膜反射光b2のシグナルが変化(光量が減少)する地点を見つければ、粗密波(表面プラズモン)が生ずる共鳴角θ1を得ることができる。
【0011】
そして、この粗密波(表面プラズモン)を生ずる現象により、金属薄膜102上の反応場104の蛍光物質が効率良く励起され、これにより蛍光物質が発する蛍光b3の光量が増大することとなる。
【0012】
この増大した蛍光b3を、集光部材122およびフィルタ124を介して光検出部120で受光することで、極微量および/または極低濃度のアナライトを検出することができるようになっている。
【0013】
このように、表面プラズモン増強蛍光測定装置10は、特に生体分子間などの微細な分子活動を観察可能とする高感度計測センサである。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】特許第3294605号公報
【特許文献2】特開2008−102117号公報
【発明の概要】
【発明が解決しようとする課題】
【0015】
アナライトは必ずしも均一な成分ではなく不均一の場合が多い。このような場合には反応場での吸着は特異吸着だけではなく、これ以外の非特異吸着も少なからず発生する。微量の検体で分析するために分析感度を上げるが、その場合に特異吸着による信号のみならず非特異吸着による信号も増加してしまうためにS/N比の向上には結びつかない。
【0016】
本願発明はこのような問題に鑑み非特異吸着が生じている状態においても、特異吸着による信号を分離し、S/N比を向上させることが可能な表面プラズモン増強蛍光測定装置を用いた測定方法、及び表面プラズモン増強蛍光測定装置を提供することを目的とする。
【課題を解決するための手段】
【0017】
上記の目的は、下記に記載する発明により達成される。
【0018】
1.金属薄膜が設けられた反応場に所定の周波数で振動を与える振動付与手段を有する表面プラズモン増強蛍光測定装置を用いた測定方法であって、
検体が特異的に反応する1次抗体が固定化された前記反応場に補足された抗体に、前記振動付与手段により振動を与えるステップと、
前記金属薄膜の一方の面に励起光を照射し、他方の面側の電場を増強させることにより前記抗体に付された蛍光物質を励起させるステップと、
前記蛍光物質からの蛍光を測定し、出力信号を周波数解析することにより検体の分析を行うステップと、
を有することを特徴とする測定方法。
【0019】
2.前記振動付与手段により与える振動の周波数は前記反応場に固定化された前記抗体が共振する周波数よりも低く、振動により前記抗体を強制振動させることを特徴とする前記1に記載の測定方法。
【0020】
3.前記振動付与手段により与える振動の周波数は、前記反応場に固定化された前記抗体が共振する周波数であることを特徴とする前記1に記載の測定方法。
【0021】
4.前記増強された電場は、前記金属薄膜からの距離により異なっており、
前記振動付与手段により与える振動により、前記蛍光物質の前記金属薄膜からの距離を周期的に変化させ、前記蛍光物質の前記金属薄膜からの距離の変化により蛍光の強度を変化させることを特徴とする前記1から3の何れか一項に記載の測定方法。
【0022】
5.金属薄膜が設けられ、検体が特異的に反応する1次抗体が固定化された反応場と、
前記反応場に所定の周波数で振動を与える振動付与手段と、
前記金属薄膜の一方の面に励起光を照射し、他方の面側の電場を増強させ前記反応場に補足された抗体に付与された蛍光物質を励起させる発光部と、
前記蛍光物質からの励起光を検出する光検出部と、
前記反応場に補足された抗体に前記振動付与手段により振動を与えた状態で、抗体に付された蛍光物質からの蛍光を前記光検出部で測定し、出力信号を周波数解析し、得られた信号強度から検体の分析を行う解析手段と、
を有することを特徴とする表面プラズモン増強蛍光測定装置。
【0023】
6.前記振動付与手段により与える振動の周波数は前記反応場に固定化された前記抗体が共振する周波数よりも低く、振動により前記抗体を強制振動させることを特徴とする前記5に記載の表面プラズモン増強蛍光測定装置。
【0024】
7.前記振動付与手段により与える振動の周波数は、該反応場に固定化された前記抗体が共振する周波数であることを特徴とする前記5に記載の表面プラズモン増強蛍光測定装置。
【0025】
8.前記抗体、あるいは前記蛍光物質は、電荷を帯びており、
前記振動付与手段は、前記反応場に交番電界を印加することを特徴とする前記6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【0026】
9.前記振動付与手段は、前記反応場を一の壁面とする流路の、前記反応場以外の他の壁面を振動させることを特徴とする前記6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【0027】
10.前記振動付与手段は、前記反応場を一の壁面とする流路に、液体を往復して送液し、往復運動により前記検体に振動を与えることを特徴とする前記6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【発明の効果】
【0028】
本願発明によれば、反応場の特異吸着spを所定の周期で振動させ、特異吸着spの蛍光物質からの蛍光からの信号を周波数解析し、得られた信号強度から検体の分析を行うことにより、特異吸着のみならず非特異吸着が生じている状態においても、特異吸着による信号を分離し、S/N比を向上させることが可能となる。
【図面の簡単な説明】
【0029】
【図1】マイクロチップ送液システムを用いた表面プラズモン増強蛍光測定装置の概略図である。
【図2】図2(a)は、マイクロチップ14周辺の断面図であり、図2(b)はその一部の上面図である。
【図3】反応場104の検体の振動状態を説明する模式図である。
【図4】金属薄膜102からの距離と電場強度との関係を示す図である。
【図5】倒立振り子モデルを説明する図である。
【図6】制御部18が実行する制御フローである。
【図7】光検出部120の出力信号に対して周波数解析を行った例である。
【図8】振動付与手段の第1の変形例として、微細流路143の壁面を機械的に往復運動させて反応場に振動を与えるものである。
【図9】従来の表面プラズモン増強蛍光測定装置の概略図である。
【発明を実施するための形態】
【0030】
本発明を実施の形態に基づいて説明するが、本発明は該実施の形態に限られない。
【0031】
図1、図2は、実施形態に係るマイクロチップ送液システムを用いた表面プラズモン増強蛍光測定装置の概略図である。
【0032】
表面プラズモン増強蛍光測定装置は、励起光を金属薄膜に照射して粗密波(表面プラズモン)を生じさせて励起された蛍光物質が生ずる蛍光を正確に検出し、検出感度を上げても超高精度に蛍光検出を行うことを可能とするものである。
【0033】
[表面プラズモン増強蛍光測定装置10]
本発明の表面プラズモン増強蛍光測定装置10は、図1に示したように、まず金属薄膜102と、金属薄膜102の一方側面に形成された反応場104と、他方側面に形成された誘電体部材106と、を有するチップ構造体108を備えている。
【0034】
そして、チップ構造体108の誘電体部材106側には、誘電体部材106内に入射され、金属薄膜102に向かって励起光b1を照射する「発光部」として機能する光源112を備え、さらに光源112から照射され金属薄膜102に反射した金属薄膜反射光b2を受光する受光手段116を備えている。
【0035】
ここで光源112から照射される励起光b1としてはレーザ光が好ましく、波長200〜1000nmのガスレーザまたは固体レーザ、波長385〜800nmの半導体レーザが好適である。
【0036】
一方、チップ構造体108の反応場104側には、反応場104で生じた蛍光b3を受光する光検出部120が設けられている。
【0037】
光検出部120としては、超高感度の光電子増倍管、または多点計測が可能なCCDイメージセンサを用いることが好ましい。
【0038】
なお、チップ構造体108の反応場104と光検出部120との間には、光を効率よく集光するための集光部材122と、光の内で蛍光b3とは異なる波長の光の透過を低減して蛍光b3を選択的に透過するように形成されたフィルタ124が設けられている。
【0039】
集光部材122としては、光検出部120に蛍光シグナルを効率よく集光することを目的とするものであれば、任意の集光系で良い。簡易な集光系としては、顕微鏡などで使用されている市販の対物レンズを転用してもよい。対物レンズの倍率としては、10〜100倍が好ましい。
【0040】
一方、フィルタ124としては、光学フィルタ、カットフィルタなどを用いることができる。光学フィルタとしては、減光(ND)フィルタ、ダイアフラムレンズなどが挙げられる。さらにカットフィルタとしては、外光(装置外の照明光)、励起光(励起光の透過成分)、迷光(各所での励起光の散乱成分)、プラズモンの散乱光(励起光を起源とし、プラズモン励起センサ表面上の構造体または付着物などの影響で発生する散乱光)、酵素蛍光基質の自家蛍光などの各種ノイズ光を除去するフィルタであって、例えば干渉フィルタ、色フィルタなどが挙げられる。
【0041】
制御部18は、CPUやメモリを備えており、メモリに記憶されているプログラムを実行することにより、光源112、光検出部120、後述のポンプ130等を制御する。また制御部18の周波数解析部181は「解析手段」として機能し、光検出部120からの信号に対して、FFTや特定の周波数を除去等の周波数解析を行うことができる。
【0042】
そして、このような表面プラズモン増強蛍光測定装置10を用いたアナライト検出方法では、反応場104に接する側の金属薄膜102表面上には1次抗体を結合させたSAM膜(Self-Assembled Monolayer:「自己組織化単分子膜」ともいう)や高分子材料が設けられている。1次抗体はSAM膜や高分子材料の一方の端部に結合されており、SAM膜や高分子材料の他方の端部は、直接若しくは間接に金属薄膜102表面に固定されている。高分子材料は複数種類が介在していてもよい。SAM膜としては例えばHOOC−(CH2)11−SHなどの置換脂肪族チオールで形成された膜、高分子材料としては例えばポリエチレングリコール(polyethylene glycol、以下「PEG」と記す。)やMPCポリマー等が挙げられる。これは使用時に調製しても、予めこれらを結合させた基板を用いてもよい。また、1次抗体に対する反応性基(または反応性基に変換可能な官能基)を備えたポリマーを直接金基板上に固定化し、その上に1次抗体を固定化してもよい。各種反応性基を利用して抗体やポリマーを結合させる際には、スクシンイミジル化を経たアミド化縮合反応や、マレイミド化を経た付加反応等が一般的である。
【0043】
このようにして構成した反応場104に標的物質としてのアナライト(検体ともいう)の抗原を含む溶液(以下、検体液ともいう)と、2次抗体を含む試薬液の送液を行う。固定化した1次抗体によって抗原を捕捉することが可能である。これに対しさらに蛍光物質で標識した2次抗体を含む試薬液を作用させることで捕捉された抗原を標識している。なお予め抗原と2次抗体とを反応させておいてから1次抗体を作用させてもよい。
【0044】
蛍光物質で標識されたアナライトの検出は、アナライトが捕捉された反応場104に光源112より誘電体部材106に励起光b1を照射し、この励起光b1が金属薄膜102に対して特定の入射角度(共鳴角θ1)で金属薄膜102に入射することで、金属薄膜102上に粗密波(表面プラズモン)を生ずるようになる。
【0045】
なお、金属薄膜102上に粗密波(表面プラズモン)が生ずる際には、励起光b1と金属薄膜102中の電子振動とがカップリングし、金属薄膜反射光b2のシグナルが変化(光量が減少)することとなるため、受光手段116で受光される金属薄膜反射光b2のシグナルが変化(光量が減少)する地点を見つければ良い。
【0046】
そして、この粗密波(表面プラズモン)により、金属薄膜102上の反応場104で生じた蛍光物質が効率良く励起され、これにより蛍光物質が発する蛍光b3の光量が増大し、この蛍光b3を集光部材122およびフィルタ124を介して光検出部120で受光することで、極微量および/または極低濃度のアナライトを検出することができる。
【0047】
なお、チップ構造体108の金属薄膜102の材質としては、好ましくは金、銀、アルミニウム、銅、および白金からなる群から選ばれる少なくとも1種の金属からなり、より好ましくは金からなり、さらにこれら金属の合金から成ることである。
【0048】
このような金属は、酸化に対して安定であり、かつ粗密波(表面プラズモン)による電場増強が大きくなることから金属薄膜102に好適である。
【0049】
また、金属薄膜102の形成方法としては、例えばスパッタリング法、蒸着法(抵抗加熱蒸着法、電子線蒸着法など)、電解メッキ、無電解メッキ法などが挙げられる。中でもスパッタリング法、蒸着法は、薄膜形成条件の調整が容易であるため好ましい。
【0050】
さらに金属薄膜102の厚さとしては、金:5〜500nm、銀:5〜500nm、アルミニウム:5〜500nm、銅:5〜500nm、白金:5〜500nm、およびそれらの合金:5〜500nmの範囲内であることが好ましい。
【0051】
電場増強効果の観点からは、金:20〜70nm、銀:20〜70nm、アルミニウム:10〜50nm、銅:20〜70nm、白金:20〜70nm、およびそれらの合金:10〜70nmの範囲内であることがより好ましい。
【0052】
金属薄膜102の厚さが上記範囲内であれば、粗密波(表面プラズモン)が発生し易く好適である。また、このような厚さを有する金属薄膜102であれば、大きさ(縦×横)は特に限定されないものである。
【0053】
電場強度は、金属薄膜102に近い程強く離れるにつれて弱くなる。但し、金属薄膜の表面近傍(表面〜数十nm)では電場増強が生じても、金属薄膜へエネルギーの移動が発生しても励起状態が消光してしまう消光現象が発生する。そのため、電場強度のピークは、消光現象が生じない範囲で最も近い距離にそのピークを持つ(後述の図4参照)。
【0054】
また、誘電体部材106としては、高屈折率の60度プリズムを用いることができる。材料としては光学的に透明な各種の無機物、天然ポリマー、合成ポリマーを用いることができ、化学的安定性、製造安定性および光学的透明性の観点から、二酸化ケイ素(SiO2)または二酸化チタン(TiO2)を含むことが好ましい。
【0055】
さらに、このような表面プラズモン増強蛍光測定装置10は、光源112から金属薄膜102に照射される励起光b1による表面プラズモン共鳴の最適角(共鳴角θ1)を調整するため、角度可変部(図示せず)を有している。
【0056】
ここで、角度可変部(図示せず)は制御部18により制御され、「共鳴角スキャン工程」においては角度可変部のサーボモータで全反射減衰(ATR)条件を求めるために受光手段116と光源112とを同期して、照射領域を中心として回動し、45〜85°の範囲で角度変更を可能としている。また分解能は0.01°以上であることが好ましい。
【0057】
図2(a)は、マイクロチップ14周辺の断面図であり、図2(b)はその一部の上面図である。図2(a)では図1に示した誘電体部材106にマイクロチップ14を取り付けている。マイクロチップ14は少なくとも反応場104の周辺は蛍光b3を透過する基材を用いる必要があり、本実施形態としては基材として石英を用いている。そして石英基板142には微細流路143が設けられており、図2(a)に示す状態では微細流路143の底面はその表面に金属薄膜102が形成された誘電体部材106で構成されている。周囲を固定具161により支持された石英基板142は、誘電体部材106と隙間なく固定されている。
【0058】
微細流路143の経路中には、前述の反応場104が設けられている。微細流路143の一方の端部には開口144aが、他方の端部には開口144bがそれぞれ設けられている。また開口144a側には接続部145が設けられている。反応場104の金属薄膜102と相対する側には蛍光b3の測定に支障がないように透明なITO基板146A(ITO:Indium-Tin Oxide)が設けられている。ITO基板146Aについては図3の説明で後述する。
【0059】
接続部145は、ピペット150が接続可能である。接続部145は弾性体材料で構成されており、ピペット150を装填する際にはシール部材として機能する。他方の開口144bの先には不要な液体を廃棄する貯留部148が設けられている。なお貯留部148の上部には不図示の微細な空気孔が設けられている。
【0060】
微細流路143の幅(Y方向長さ)は1mm〜3mm、高さ(Z方向)は50μm〜500μm、反応場104の幅は微細流路143の幅と同等であり、長さは1mm〜3mmとするが、必ずしも限定されるものではない。また微細流路143の両端の開口144a、144bの大きさは微細流路143の幅と同等のφ1mm〜φ3mmである。ピペット150の先端は開口144aとほぼ同等の形状であり、根元部分はこれよりも太い軸径の円柱形状である。貯留部148は流路方向で開口144bよりも大きな断面形状であり、例えば2〜4mm角の形状としている。なお図2(b)においては略正方形の断面形状としているが、円形の断面形状としてもよい。
【0061】
図2(a)においては、ピペット150を装填した状態を示している。なお、貯留部148はマイクロチップ14に固定した例を示しているが、ピペット150と同様に取り外し可能な構成としてもよい。なおピペット150は材料としてはポリプロピレンを用いており、接続部145を介して容易に脱着が可能であり、供給した検体液とともにピペット150の廃棄を容易に行うことができる。またポンプ130は例えばシリンジポンプであり、所定量の液体を吐出あるいは吸引することが可能である。なお本願においては、「吐出」とはポンプ130から液体あるいは空気を送りだすことにより、ピペット150の内部の液体を順方向(図2(a)の微細流路143において右方向)に搬送することであり、「吸引」とはその逆である。
【0062】
制御部18がポンプ130を制御することにより、ピペット150の内部に貯留した検体液等の液体をマイクロチップ14の内部に吐出したり、吸引したりすることが可能である。このようにして微細流路143には蛍光物質が標識された2次抗体等が含まれる試薬液や、アナライトが含まれる検体液がポンプ130により送液される。
【0063】
検体としては、血液、血清、血漿、尿、鼻孔液、唾液、便、体腔液(髄液、腹水、胸水等)などが挙げられる。検体中に含有されるアナライトは、例えば、核酸(一本鎖であっても二本鎖であってもよいDNA、RNA、ポリヌクレオチド、オリゴヌクレオチド、PNA(ペプチド核酸)等、またはヌクレオシド、ヌクレオチドおよびそれらの修飾分子)、タンパク質(ポリペプチド、オリゴペプチド等)、アミノ酸(修飾アミノ酸も含む。)、糖質(オリゴ糖、多糖類、糖鎖等)、脂質、またはこれらの修飾分子、複合体などが挙げられ、具体的には、AFP(αフェトプロテイン)等のがん胎児性抗原や腫瘍マーカー、シグナル伝達物質、ホルモンなどであってもよく、特に限定されない。
【0064】
さらに蛍光物質としては、所定の励起光b1を照射するか、または電界効果を利用することで励起し、蛍光b3を発する物質であれば特に限定されないものである。なお本明細書でいう蛍光b3とは、燐光など各種の発光も含まれるものである。
【0065】
[振動付与手段]
図3は、反応場104の検体の振動状態を説明する模式図である。同図に示すように、金属薄膜102とITO基板146Aは高圧電源PSにより接続されている。高圧電源PSは交流電圧あるいは極性を交互に入れ替えたパルス状の電圧を出力することが可能であり、反応場104に対して極性を所定の周波数で変化する交番電界を与えることができる。電圧としては例えば数百V、好ましくは数十V以下である。である。高圧電源PS及びITO基板146Aが振動付与手段として機能する。所定の周波数は、反応場104において特異吸着している検体が共振する周波数あるいはこれよりも低い周波数に設定している。当該周波数としては概ね数Hzから数十Hzである。振動を与えることにより特異吸着spは共振あるいは強制振動させられる。
【0066】
同図において、1次抗体a1は反応場104に固定されており、当該1次抗体a1に特異的に反応する検体ayと検体ayに特異的に反応する2次抗体a2とは、この順で繋がっている。また2次抗体a2は蛍光標識Fが修飾されている。なお、微細流路143の内部は液体が充填されているが図示は省略している。
【0067】
同図に示すように特異吸着sp(1次抗体a1、検体ay、2次抗体a2の連結)に混じって、特異吸着以外の非特異吸着us(同図の例では、検体ay、2次抗体a2の組み合わせ)が混在している。同図に示す例では、特異吸着sp及び非特異吸着usは負の電荷を帯びており、反応場104及び反応場104周辺の微細流路143に高圧電源PSにより所定の周波数で交番電界を印加することにより、これらの物質は上下方向に力を受けることになる。
【0068】
図3(a)のように特異吸着spが上方に力を受ける状態では、特異吸着spは伸びた状態となるので、蛍光標識Fの金属薄膜102からの距離h1は長くなる。一方で、図3(b)のように下方に力を受ける状態では、特異吸着spは縮んだ状態となるので蛍光標識Fの金属薄膜102からの距離h2は短くなる。
【0069】
ここで、前述のとおり、消光現象により金属薄膜102と近接する領域では電場強度は小さく、離れる程大きくなる。図4は、金属薄膜102からの距離と電場強度との関係を示す図である。同図に示すように金属薄膜102に接する距離ゼロにおいては、消光現象により電場強度はゼロに近く、距離が離れるほどその影響は小さくなるので電場強度は大きくなる。一方で、近傍以外では金属薄膜102から離れるほど電場強度は小さくなるので、距離hpをピークとして離れるほど電場強度は徐々に小さくなってゆく。距離hx(一般的には200〜500nm)以上ではほぼゼロとなる。
【0070】
また距離hpは例えば30〜50nmであり、特異吸着spの長さは20〜30nmであるので、距離hp≧h1>h2の関係となっている。このようなことから、蛍光標識Fに対する電場強度は、図3(a)の状態での距離h1の方が、図3(b)状態での距離h2のときよりも強い。つまり、蛍光標識Fの金属薄膜102表面からの距離が、距離hp以下の範囲内で変化する場合には、蛍光の強度も距離に応じて変化することになる。
【0071】
このような特性から、特異吸着spに振動を与えることにより金属薄膜102からの距離が周期的に変化し、当該振動により蛍光標識Fから発する蛍光の強度も振動することになる。一方で、非特異吸着usは、特異吸着spとは長さ及び重さが異なる。特に非特異吸着としては主に(1)蛍光標識された2次抗体a2だけが、SAM膜上に横たわっている状態(2)2次抗体a2が検体ayに直接付着している状態、がある。非特異吸着usが上記(1)であれば振動を付与させても振動せずに蛍光の強度は一定(DC成分)となり、上記(2)であれば特異吸着spよりも長さが短く、質量も小さいので、共振周波数は特異吸着spと比較して大きなものとなる。よって後述の周波数解析により特異吸着spの振動成分を取り出すことにより、S/N比を向上させた分析を行うことが可能となる。
【0072】
[共振周波数]
ここで特異吸着spの共振周波数について説明する。特異吸着spの共振周波数を算出するために、まずは図5に示す様な倒立振り子モデルを用いてタンパクの運動方程式について検討する。
【0073】
mはタンパクの質量、lはタンパクの長さ、kはバネ定数、hはバネの作用点までの長さ、Cは溶媒により粘性減衰係数としたとき、以下のようになる。
慣性モーメント:J=ml2
転倒モーメント:mg・l・sinθ≒mgl・θ
バネの復元力:−k・hθ
復元モーメント:−k・hθ・h=−kh2・θ
上記の元で、運動方程式は以下の数式1で表される。
【0074】
【数1】

【0075】
数式1は、数式2となり、重力とバネ復元力による共振角周波数をWnとすると、数式3、数式4のようになり、数式2は数式5で表される。
【0076】
【数2】

【0077】
溶媒の粘性減衰を含めたトータルでの共振周期Tは、以下の数式6のとおりとなる。
【0078】
【数3】

【0079】
h=l=1.8×10−9(m)、M=6.17×10−22(kg)、g=9.8(m/t2)、またk=2.5(N/m)=2.5(kg/t2)として、
kt=kh2−mgl≒0.81×10−15(kgm2/t2)
J=M×l2=6.17×10−22×(18×10−9)2=1.99908×10−37(kgm2)
wn=√(kt/J)≒0.636×1011(Hz)
溶媒が水であれば粘度η=0.89(cP)=0.89×10−3(kg/(mt))、
タンパクの大きさを半径r=5nmとすると
体積V=4/3πr3=5.236×10−25(m3)
粘性減衰係数:C=η×V=5.236×10−25×0.89×10−3≒4.66004×10−28(kgm2/t)
減衰比:ζ=C/(2Wn×J)=4.66004×10−28/(2×0.636×1011×1.99908×10−37)≒0.0183
共振周期T=2π/(Wn×√(1−ζ2))≒9.88×10−11(t)
共振周波数f=1/T≒10(Ghz)となる。
【0080】
溶媒の種類を選択して、より粘度の高いものにすることにより特異吸着spが共振する共振周波数f1を任意の値に設定することができる。共振周波数f1としては数Hz程度に抑えることが望ましい。
【0081】
[制御フロー]
図6は、表面プラズモン増強蛍光測定装置の制御部18が実行する制御フローである。ステップS11では、ポンプ130を作動させることにより、ピペット150内のアナライトが含まれる検体液を、微細流路143を通じて貯留部148に送液する。当該行為により反応場104の固定されている1次抗体にアナライトが補足される。続いて、ピペット150の交換を行う。交換されたピペット150には、蛍光標識が修飾された2次抗体が含まれる2次抗体液が充填されており、2次抗体液を、微細流路143を通じて貯留部148まで送液する。2次抗体はアナライトに特異的に反応するので、反応場104には、1次抗体、アナライト、2次抗体の順で連結した状態(特異吸着sp)で補足されることになる。
【0082】
ステップS12では反応場104の洗浄工程として、同様にピペット150を交換し、内部の水等の洗浄液を、微細流路143を通じて貯留部148まで送液する。
【0083】
ステップS11、S12により反応場104は、図3のように特異吸着spが形成される。またこの際に、ステップS12の洗浄工程でも除去できなかった非特異吸着usが少なからず反応場104に存在している。
【0084】
ステップS13では、制御部18は、振動付与手段としての高圧電源PSを作動させて、反応場104に所定の周波数の交番電界を印加することにより所定の周波数で特異吸着spに振動を与える。
【0085】
ステップS14では、光源112からの励起光b1により生じる電場増強により、反応場の蛍光標識Fからの蛍光を光検出部120で測定する。
【0086】
ステップS15では、周波数解析部181により、ステップS14で得られて出力信号を周波数解析することにより、特異吸着spにより信号を分離する。周波数解析としては例えば(1)特異吸着spが強制振動により振動した周波数あるいは共振周波数f1(以下、これらを総称して振動周波数fspという)以外の信号成分を除去するようにバンドパスフィルタあるいはローパスフィルタをかけ、得られた信号からアナライトの定量等を行う、あるいは(2)FFT(高速フーリエ変換)の様な周波数変換処理を行い、振動周波数fspの信号強度からアナライトの定量等を行う、がある。また更に(3)FFTの後に、振動周波数fspを通すフィルタをかけ、その後にIFFT(高速フーリエ逆変換)の様な周波数逆変換処理を行うことにより上記(1)の様に定量等を行ってもよい。
【0087】
図7は、光検出部120の出力信号に対して周波数解析を行った例である。図7(a)は、バンドパスフィルタにより出力信号から振動周波数fsp以外の信号成分を除去した例である。図7(b)は、出力信号にFFT処理をかけた例である。
【0088】
このように、反応場の特異吸着spを所定の周期で振動させ、特異吸着spの蛍光物質からの蛍光からの信号を周波数解析し、得られた信号強度から検体の分析を行うことにより、特異吸着のみならず非特異吸着が生じ、両者が混在している状態においても、特異吸着による信号を分離し、S/N比を向上させることが可能となる。
【0089】
[振動付与手段の他の実施形態]
以下に、振動付与手段の変形例について説明する。以下においては振動付与手段以外の構成は図1から図7で説明した構成と同一であり、説明は省略する。
【0090】
図8は、振動付与手段の第1の変形例として、微細流路143の壁面を機械的に往復運動させて反応場に振動を与えるものである。同図に示す例では、微細流路143のうち、反応場104とは反対側の壁面が可動壁146Bとなっており、圧電素子17を駆動させることにより可動壁146Bは微細流路143の高さ方向(図示矢印方向)に可動する。
【0091】
圧電素子17を所定周期で駆動させることにより反応場104の特異吸着spを振動させることが可能となる。
【0092】
また、第2の変形例としては、ポンプ130を制御することにより、ピペット150の内部の液体を吐出させたり吸引させたりすることにより微細流路143の内部の液体を所定の周期で往復運動させる。そして液体の往復運動により特異吸着spを倒立振り子のように振動させることができる。
【0093】
第3の変形例としては、励起光b1及び蛍光b3(図1参照)とは波長が重複しない、例えば赤外波長の光を、別の光源により反応場104周辺に照射させるものである。当該照射をパルス状で所定周期で行うことにより、反応場104周辺を加熱することにより、特異吸着spを振動させることが可能となる。
【符号の説明】
【0094】
10 増強蛍光測定装置
14 マイクロチップ
18 制御部
181 周波数解析部
PS 高圧電源
146A ITO基板
146B 可動壁
17 圧電素子
142 石英基板
143 微細流路
148 貯留部
150 ピペット
161 固定具
102 金属薄膜
104 反応場
112 光源
116 受光手段
120 光検出部
b1 励起光
b2 金属薄膜反射光
b3 蛍光
【特許請求の範囲】
【請求項1】
金属薄膜が設けられた反応場に所定の周波数で振動を与える振動付与手段を有する表面プラズモン増強蛍光測定装置を用いた測定方法であって、
検体が特異的に反応する1次抗体が固定化された前記反応場に補足された抗体に、前記振動付与手段により振動を与えるステップと、
前記金属薄膜の一方の面に励起光を照射し、他方の面側の電場を増強させることにより前記抗体に付された蛍光物質を励起させるステップと、
前記蛍光物質からの蛍光を測定し、出力信号を周波数解析することにより検体の分析を行うステップと、
を有することを特徴とする測定方法。
【請求項2】
前記振動付与手段により与える振動の周波数は前記反応場に固定化された前記抗体が共振する周波数よりも低く、振動により前記抗体を強制振動させることを特徴とする請求項1に記載の測定方法。
【請求項3】
前記振動付与手段により与える振動の周波数は、前記反応場に固定化された前記抗体が共振する周波数であることを特徴とする請求項1に記載の測定方法。
【請求項4】
前記増強された電場は、前記金属薄膜からの距離により異なっており、
前記振動付与手段により与える振動により、前記蛍光物質の前記金属薄膜からの距離を周期的に変化させ、前記蛍光物質の前記金属薄膜からの距離の変化により蛍光の強度を変化させることを特徴とする請求項1から3の何れか一項に記載の測定方法。
【請求項5】
金属薄膜が設けられ、検体が特異的に反応する1次抗体が固定化された反応場と、
前記反応場に所定の周波数で振動を与える振動付与手段と、
前記金属薄膜の一方の面に励起光を照射し、他方の面側の電場を増強させ前記反応場に補足された抗体に付与された蛍光物質を励起させる発光部と、
前記蛍光物質からの励起光を検出する光検出部と、
前記反応場に補足された抗体に前記振動付与手段により振動を与えた状態で、抗体に付された蛍光物質からの蛍光を前記光検出部で測定し、出力信号を周波数解析し、得られた信号強度から検体の分析を行う解析手段と、
を有することを特徴とする表面プラズモン増強蛍光測定装置。
【請求項6】
前記振動付与手段により与える振動の周波数は前記反応場に固定化された前記抗体が共振する周波数よりも低く、振動により前記抗体を強制振動させることを特徴とする請求項5に記載の表面プラズモン増強蛍光測定装置。
【請求項7】
前記振動付与手段により与える振動の周波数は、該反応場に固定化された前記抗体が共振する周波数であることを特徴とする請求項5に記載の表面プラズモン増強蛍光測定装置。
【請求項8】
前記抗体、あるいは前記蛍光物質は、電荷を帯びており、
前記振動付与手段は、前記反応場に交番電界を印加することを特徴とする請求項6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【請求項9】
前記振動付与手段は、前記反応場を一の壁面とする流路の、前記反応場以外の他の壁面を振動させることを特徴とする請求項6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【請求項10】
前記振動付与手段は、前記反応場を一の壁面とする流路に、液体を往復して送液し、往復運動により前記検体に振動を与えることを特徴とする請求項6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【請求項1】
金属薄膜が設けられた反応場に所定の周波数で振動を与える振動付与手段を有する表面プラズモン増強蛍光測定装置を用いた測定方法であって、
検体が特異的に反応する1次抗体が固定化された前記反応場に補足された抗体に、前記振動付与手段により振動を与えるステップと、
前記金属薄膜の一方の面に励起光を照射し、他方の面側の電場を増強させることにより前記抗体に付された蛍光物質を励起させるステップと、
前記蛍光物質からの蛍光を測定し、出力信号を周波数解析することにより検体の分析を行うステップと、
を有することを特徴とする測定方法。
【請求項2】
前記振動付与手段により与える振動の周波数は前記反応場に固定化された前記抗体が共振する周波数よりも低く、振動により前記抗体を強制振動させることを特徴とする請求項1に記載の測定方法。
【請求項3】
前記振動付与手段により与える振動の周波数は、前記反応場に固定化された前記抗体が共振する周波数であることを特徴とする請求項1に記載の測定方法。
【請求項4】
前記増強された電場は、前記金属薄膜からの距離により異なっており、
前記振動付与手段により与える振動により、前記蛍光物質の前記金属薄膜からの距離を周期的に変化させ、前記蛍光物質の前記金属薄膜からの距離の変化により蛍光の強度を変化させることを特徴とする請求項1から3の何れか一項に記載の測定方法。
【請求項5】
金属薄膜が設けられ、検体が特異的に反応する1次抗体が固定化された反応場と、
前記反応場に所定の周波数で振動を与える振動付与手段と、
前記金属薄膜の一方の面に励起光を照射し、他方の面側の電場を増強させ前記反応場に補足された抗体に付与された蛍光物質を励起させる発光部と、
前記蛍光物質からの励起光を検出する光検出部と、
前記反応場に補足された抗体に前記振動付与手段により振動を与えた状態で、抗体に付された蛍光物質からの蛍光を前記光検出部で測定し、出力信号を周波数解析し、得られた信号強度から検体の分析を行う解析手段と、
を有することを特徴とする表面プラズモン増強蛍光測定装置。
【請求項6】
前記振動付与手段により与える振動の周波数は前記反応場に固定化された前記抗体が共振する周波数よりも低く、振動により前記抗体を強制振動させることを特徴とする請求項5に記載の表面プラズモン増強蛍光測定装置。
【請求項7】
前記振動付与手段により与える振動の周波数は、該反応場に固定化された前記抗体が共振する周波数であることを特徴とする請求項5に記載の表面プラズモン増強蛍光測定装置。
【請求項8】
前記抗体、あるいは前記蛍光物質は、電荷を帯びており、
前記振動付与手段は、前記反応場に交番電界を印加することを特徴とする請求項6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【請求項9】
前記振動付与手段は、前記反応場を一の壁面とする流路の、前記反応場以外の他の壁面を振動させることを特徴とする請求項6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【請求項10】
前記振動付与手段は、前記反応場を一の壁面とする流路に、液体を往復して送液し、往復運動により前記検体に振動を与えることを特徴とする請求項6から7の何れか一項に記載の表面プラズモン増強蛍光測定装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2011−80935(P2011−80935A)
【公開日】平成23年4月21日(2011.4.21)
【国際特許分類】
【出願番号】特願2009−234986(P2009−234986)
【出願日】平成21年10月9日(2009.10.9)
【出願人】(000001270)コニカミノルタホールディングス株式会社 (4,463)
【Fターム(参考)】
【公開日】平成23年4月21日(2011.4.21)
【国際特許分類】
【出願日】平成21年10月9日(2009.10.9)
【出願人】(000001270)コニカミノルタホールディングス株式会社 (4,463)
【Fターム(参考)】
[ Back to top ]

