神経細胞とグリア細胞を共培養する方法
【課題】生体における中枢神経系の情報伝達ネットワークをより反映し得るような、神経細胞とグリア細胞との共培養系を、低コストかつ簡便に確立することを目的とし、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法を提供すること。
【解決手段】以下の工程を含む、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法により解決される:
1)単一個体から採取された組織を用いて、神経幹細胞の分散した試料を調製する工程;
2)神経幹細胞の分散した試料を培地に添加し、神経幹細胞を細胞増殖因子を含む培地にて培養する工程;および、
3)同一容器内で、神経幹細胞から分化誘導された神経細胞およびグリア細胞を培養する工程。
【解決手段】以下の工程を含む、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法により解決される:
1)単一個体から採取された組織を用いて、神経幹細胞の分散した試料を調製する工程;
2)神経幹細胞の分散した試料を培地に添加し、神経幹細胞を細胞増殖因子を含む培地にて培養する工程;および、
3)同一容器内で、神経幹細胞から分化誘導された神経細胞およびグリア細胞を培養する工程。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞増殖因子の存在下で単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法に関する。
【背景技術】
【0002】
中枢神経系は、神経細胞とグリア細胞(アストロサイト、ミクログリア、オリゴデンドロサイト)などにより主に構成されている。中枢神経系における記憶・学習などの神経活動、あるいは脳梗塞やアルツハイマー病などの各種神経疾患の所為は、神経細胞を含む各種細胞間に構築されるネットワークより行われると考えられている。中枢神経系を構成する細胞群の機能解析は、インビトロ実験系では、高い純度の各種細胞の単独培養系により実施されている場合が多い。実際の生体内で構築される神経細胞とグリア細胞間の情報ネットワークを維持する観点からの機能解析は、各種細胞の共培養系により行われる必要がある。
【0003】
各種細胞の共培養系は、高純度の神経細胞やアストロサイト等の各種細胞を用意してから、共培養のためにそれぞれの細胞集団を混ぜることにより構築する必要がある。しかしながら、この方法ではそれぞれの細胞集団を用意するのに時間と労力を有する。さらに、それぞれの細胞集団を異なる週齢の実験動物(マウスやラット)から調製する必要があり、経済的および労力的に大きな負担がある。またアストロサイトの場合は、細胞の性質上、単独培養系ではほとんどが扁平形状のタイプI(type I)のアストロサイトに変化してしまい、生体脳内で見られるような多数の突起を持つタイプII(type II)のアストロサイトが皆無となってしまう。
【0004】
非特許文献1では、成体マウスの脳室下帯から取り出した細胞組織にEGFを添加し、分裂増殖させることにより、神経細胞やグリア細胞を生み出す細胞塊を分離したことが報告されている。特許文献2には、ニューロスフェア(神経塊)を、EGFおよびbFGFの存在下において培養することにより、神経細胞とアストロサイトを分化誘導したことが開示されている。さらに非特許文献2および3では、FGFが神経幹細胞の増殖・維持に重要であることが報告されている。神経幹細胞は、in vitroで未分化性を維持するために浮遊培養を行った場合、塊状態のニューロスフェアを形成する。生体内では神経幹細胞はニューロスフェアを介さずに神経細胞やグリア細胞に分化誘導されるが、生体脳に近い条件で神経細胞とグリア細胞とを共培養可能な系についての報告はない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2004−236607号公開公報
【非特許文献】
【0006】
【非特許文献1】Reynolds BA, Weiss S , Science 255:11707-17104.(1992)
【非特許文献2】Cavanagh JF, Mione MC, Pappas IS, Parnavelas JG., Cereb Cortex. 7:293-302.(1997)
【非特許文献3】Hulspas R, Tiarks C, Reilly J, Hsieh CC, Recht L, Quesenberry PJ., Exp Neurol. 148:147-156.(1997)
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、生体における中枢神経系の情報伝達ネットワークをより反映し得るような、神経細胞とグリア細胞との共培養系を、低コストかつ簡便に確立することを目的とし、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは鋭意検討した結果、細胞増殖因子の存在下で、単一個体由来の神経幹細胞を培養することにより、同一容器内で当該神経幹細胞から神経細胞とグリア細胞とを分化誘導し得ることを見出し、単一個体由来の神経細胞とグリア細胞との共培養が可能となることに着目し、本発明を達成した。
【0009】
すなわち、本発明は以下の通りである。
1.以下の工程を含む、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法:
1)単一個体から採取された組織を用いて、神経幹細胞の分散した試料を調製する工程;
2)神経幹細胞の分散した試料を培地に添加し、神経幹細胞を細胞増殖因子を含む培地にて培養する工程;および、
3)同一容器内で、神経幹細胞から分化誘導された神経細胞およびグリア細胞を培養する工程。
2.細胞増殖因子がEGFおよびFGFを含む、前項1に記載の共培養方法。
3.グリア細胞がアストロサイトである、前項1または2に記載の共培養方法。
4.アストロサイトがタイプIIアストロサイトを含む、前項3に記載の共培養方法。
5.培養が接着培養法により行われる、前項1〜4のいずれか1に記載の共培養方法。
6.神経幹細胞が、マウスの脳組織から採取されたものである、前項1〜5のいずれか1に記載の共培養方法。
7.前項1〜6のいずれか1に記載の共培養方法により得られる、神経細胞とグリア細胞を含む組成物。
8.前項7に記載の組成物を用いて、神経細胞および/またはグリア細胞の機能を解析する方法。
9.アデノウイルスを用いて、グリア細胞の内在遺伝子に変異を導入する、および/または、グリア細胞に外来遺伝子を導入することを含む、前項8に記載の神経細胞および/またはグリア細胞の機能を解析する方法。
【発明の効果】
【0010】
本発明により、細胞増殖因子(例えばEGFやFGF)を利用することにより、安価かつ簡便に、神経細胞とグリア細胞との共培養系の確立することができた。例えば、同一マウス胎児脳由来の神経幹細胞を利用して本発明の共培養方法を行った場合、生体の脳内において見られるタイプIIアストロサイトを多数分化誘導することができた。本発明の共培養方法によれば、神経細胞とグリア細胞が同一容器内でネットワークを構成している可能性が高く、従来の単培養系と単培養系を混合してなる共培養系に比べて、より生体脳に近い条件での研究を行うことができると考えられる。
さらに本発明の共培養方法では、使用が容易でありかつ、操作が簡便なアデノウイルスを用いて、グリア細胞(特にアストロサイト)特異的に遺伝子工学的な手法により機能を操作することが可能である。よって、本発明の共培養方法を用いてグリア細胞共存下での神経細胞の機能解析や、あるいは逆に神経細共存下でのアストロサイトの機能解析を行うことが可能である。
【図面の簡単な説明】
【0011】
【図1】神経幹細胞と、神経細胞および各種グリア細胞の関係を示す図である。
【図2】実施例1の実験の流れを説明した図である。
【図3】神経幹細胞を8日間培養した細胞のHoechest33342染色像を示す。(実施例1)
【図4】神経幹細胞を8日間培養した細胞のMAP2染色像を示す。(実施例1)
【図5】神経幹細胞を8日間培養した細胞のGFAP染色像を示す。(実施例1)
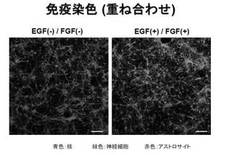
【図6】神経幹細胞を8日間培養した細胞のHoechest33342、MAP2およびGFAP染色像の重ね合わせ画像を示す。(実施例1)
【図7】実施例2の実験の流れを説明した図である。
【図8】神経細胞とアストロサイト共培養系において細胞にAdV-GFPを感染させた場合の、GFP蛍光像(AdV-GFP)、MAP2染色像(MAP)およびHoechest33342染色像(Hoechest)、さらにそれらの画像の重ね合わせ画像(Merge)を示す。(実施例2)
【図9】図8の各種染色像および重ね合わせ画像の拡大画像を示す。(実施例2)
【図10】神経細胞とアストロサイト共培養系において細胞にAdV-GFPを感染させた場合の、GFP蛍光像(AdV-GFP)、GFAP染色像(GFAP)およびHoechest33342染色像(Hoechest)、さらにそれら画像の重ね合わせ画像(Merge)を示す。(実施例2)
【図11】図10の各種染色像および重ね合わせ画像の拡大画像を示す。(実施例2)
【発明を実施するための形態】
【0012】
本発明は、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法であって、以下の工程を含む共培養方法を対象とする。
1)単一個体から採取された組織を用いて、神経幹細胞の分散した試料を調製する工程。
2)神経幹細胞の分散した試料を培地に添加し、神経幹細胞を細胞増殖因子を含む培地にて培養する工程。
3)同一容器内で、神経幹細胞から分化誘導された神経細胞およびグリア細胞を培養する工程。
まず図1を参照しながら各細胞について説明した後、工程1)〜3)について説明する。
【0013】
生体内において情報の伝達と処理を行う一連の器官を神経系と呼ぶ。神経系を構成する細胞としては神経細胞(neuron)とグリア細胞(glial cell)が挙げられ、両者は協働して神経系の維持や情報伝達を行っている。グリア細胞には、アストロサイト(astorocyte)、 オリゴデンドロサイト(oligodendrocyte)、マイクログリア、上衣細胞等が含まれる。神経細胞とグリア細胞は、生体内において神経幹細胞から分化誘導されると考えられている。
【0014】
本明細書において神経幹細胞とは、神経細胞や、アストロサイトおよびオリゴデンドロサイトなどのグリア細胞に分化しうる多分化能を有し、かつ自己複製能を有する中枢神経系多能性未分化細胞である。神経幹細胞は生体の脳内において、神経細胞、アストロサイトやオリゴデンドロサイトを供給する役割を担っていると考えられる。本発明において、神経幹細胞は細胞増殖因子を含む培地により培養されることにより、神経細胞およびグリア細胞(特にアストロサイト)に分化誘導される。一般的に神経幹細胞は、神経前駆細胞を経て神経細胞に誘導され、アストロサイト前駆細胞を経てアストロサイトに誘導され、オリゴデントロサイト前駆細胞を経てオリゴデントロサイトに誘導される。神経幹細胞は、ネスチン(Nestin)、RC2、ムサシ1(Musashi1)等のマーカーの発現を指標として、例えば、対応する遺伝子の発現を慣用の核酸の検出方法により調べること又はタンパク質の発現を免疫細胞組織化学的手法により調べることにより同定されうる。
【0015】
神経細胞とは、他の神経細胞または刺激受容細胞からの刺激を受け、別の神経細胞、筋または腺細胞に刺激を伝える機能を有する細胞である。また神経細胞の形態的特徴としては、細胞体、樹状突起、軸索、軸索成長円錐等が挙げられる。
【0016】
神経細胞は、神経細胞が産生する情報伝達物質の違いにより分類されるが、本発明においては情報伝達物質の種類については特に限定しない。情報伝達物質としては、ペプチド性、非ペプチド性のいずれも包含される。非ペプチド性の情報伝達物質のうち代表的な物質としては、ドーパミン、アセチルコリン、γアミノ酪酸等が挙げられる。より詳しくは、ドーパミン、ノルアドレナリン、アドレナリン、セロトニン、アセチルコリン、γアミノ酪酸、グルタミン酸が挙げられる。ペプチド性の情報伝達物質のうち、代表的な物質としては副腎皮質刺激ホルモン(ACTH)、α-エンドルフィン、β-エンドルフィン、γ-エンドルフィン、バソプレッシン等が挙げられるが、これらに限定されるものではない。
【0017】
神経細胞は、MAP2、NeuN、NSE、Neurofilament、βIIItubulin等のマーカーの発現を指標として、例えば、対応する遺伝子の発現を慣用の核酸の検出方法により調べること又はタンパク質の発現を免疫細胞組織化学的手法により調べることにより同定されうる。
【0018】
グリア細胞は、神経細胞と神経細胞との隙間を埋め、神経細胞の代謝の仲介をするとともに、支持組織として働く細胞である。グリア細胞としては、中枢神経系では、アストロサイト、オリゴデンドロサイト及びミクログリオサイトが挙げられる。グリア細胞のうちアストロサイトは、単なる神経細胞の支持細胞として捉えられるのではなく、神経情報伝達や各種神経疾患の病態生理に深く積極的に関与することが分かっている。
【0019】
アストロサイトには、扁平形状(アメーバ状)の形態を持つタイプIアストロサイトや多数の突起(線維状の形態)を持つタイプIIアストロサイトがある。タイプIアストロサイトは、神経幹細胞からアストロサイトを単独で分化誘導させた培養系において見られる。タイプIIアストロサイトは、生体の脳内において見られるものであるが、神経幹細胞からアストロサイトを単独で分化誘導させた培養系においてはほとんど分化誘導することができない。本発明の共培養方法においてはタイプIIアストロサイトが多数存在する共培養系を得ることができる。
【0020】
なおアストロサイトは、グリア繊維性酸性タンパク質(GFAP)や、S100β等のマーカーの発現を指標として、オリゴデントロサイトは、O4、GC、GD3、NG2等のマーカーの発現を指標として、例えば、対応する遺伝子の発現を慣用の核酸の検出方法により調べること又はタンパク質の発現を免疫細胞組織化学的手法により調べることにより同定されうる。
【0021】
(神経幹細胞の分散した試料を調製する工程)
本発明において、神経幹細胞の分散した試料は、単一の個体(生体)から採取された組織を用いて調製される。神経幹細胞の分散した試料は、単一の個体から、神経幹細胞を含む組織を採取し、当該組織から神経幹細胞を分離し調製すればよい。神経幹細胞を分離する組織としては神経幹細胞を含むものであれば特に限定されない。神経幹細胞を分離する組織としては、胎児の場合は脳組織(例えば大脳、小脳、脳幹)であれば部位は特に限定されず、例えば大脳皮質および/または海馬を用いることができ、成体の場合は海馬を用いることが好ましい。なお、脳組織は、腫瘍化した組織や遺伝子が変異した組織、病変のある組織等でもよいし、正常組織であってもよい。
【0022】
神経幹細胞を分離する生体としては、例えば温血動物、好ましくは哺乳動物が挙げられる。哺乳動物としては、例えば、マウス、ラット、モルモット、ハムスター、ウサギ、ネコ、イヌ、ヒツジ、ブタ、ウシ、ウマ、ヤギ、サル、ヒト等が挙げられ、好ましくは、マウス、ラット、サル、ヒト等が挙げられる。
【0023】
組織から神経幹細胞の分散した試料を調製するためにはまず、組織から神経幹細胞を分離する必要がある。組織から神経幹細胞を分離する方法としては、自体公知の分離方法、例えば酵素処理や機械的処理で分離する方法等が挙げられる。細胞へのダメージや、培養系の安定性を考慮すれば、酵素処理で分離するのが好ましい。酵素処理に用いられる酵素としては、例えば、トリプシン、ディスパーゼ、コラゲナーゼ、パパイン等が挙げられ、好ましくはトリプシンである。該酵素処理の条件は、細胞にダメージを与えず、本発明の方法により、神経幹細胞から神経細胞とグリア細胞を分化誘導し得るものである限り、特に限定されない。
【0024】
本発明において、組織から分離された神経幹細胞は、いかなる形態であってもよく、上記酵素処理後に遠心分離され、細胞ペレットの形態として存在しているものであってもよい。当該細胞ペレットには、神経幹細胞以外の細胞が含まれていてもよく、例えば、神経細胞を含むものであってもよい。後述する実施例のように胎生15日齢マウスの大脳皮質を用いて、細胞ペレットを作製した場合は、アストロサイトは実質的に含まれていない。
【0025】
組織から分離された神経幹細胞を使用して、神経幹細胞の分散した試料を調製する。神経幹細胞の分散した試料の調製方法は特に限定されないが、神経幹細胞(例えば細胞ペレット)を、培養に使用する培地に分散させることにより調製することができる。本明細書において「神経幹細胞の分散した」とは、複数の細胞が集まって細胞塊を形成していることがなく、単一の細胞ごとにバラバラに分散している状態を意味する。本発明の神経幹細胞の分散した試料においては、試料中の全細胞が分散していてもよいが、全細胞のうち80%以上、好ましくは90%以上の細胞が分散した状態で存在すればよい。従来、神経幹細胞の未分化性を維持するためにin vitroで浮遊培養を行った場合、複数の細胞が集まった塊状態のニューロスフェアを形成するが、本明細書における神経幹細胞の分散した試料はニューロスフェアを形成しているものではない。本発明においては、組織から調製した神経幹細胞の分散した試料を培地に添加することにより、神経幹細胞が分散した状態での培養が可能となり、個々の細胞が別個に神経細胞やグリア細胞に分化することができる。個々の細胞が別個に神経細胞やグリア細胞に分化することにより、培養系内に神経細胞とグリア細胞が万遍なく混在し、生体の脳内と同様に神経細胞とグリア細胞が情報ネットワークを維持し得るような共培養系が得られるものと考えられる。
【0026】
細胞を分散させる手法はいかなる手法であってもよいが、例えば自体公知のフィルターなどを用いて細胞を分散させることができる。また、ニューロスフェアを用いて神経幹細胞の分散した試料を調製する場合には、細胞を分散させる際に細胞にダメージが加わり細胞死を引き起こす可能性があるとともに、均一に分散した試料を得ることが困難である。よって本発明においては、ニューロスフェアを介さずに神経幹細胞の分散した試料が調製される。なおニューロスフェアとは、およそ50μm〜150μmの大きさの神経幹細胞の塊を意味する。
【0027】
(神経幹細胞を培養する工程)
本発明の共培養方法では、上述のようにして得られた神経幹細胞の分散した試料を培地に添加し、神経幹細胞を細胞増殖因子を含む培地にて培養する。培地中における細胞の濃度は、神経幹細胞から神経細胞とグリア細胞を分化誘導し得るものである限り、特に限定されない。例えば、細胞培養プレート上の培地に神経幹細胞の分散した試料を添加する場合は、細胞の密度が約1×104〜1×106cells/cm2、好ましくは約10×104〜100×104cells/cm2、より好ましくは約50×104〜75×104cells/cm2であればよい。
【0028】
本発明において使用される細胞増殖因子は、神経幹細胞から神経細胞とグリア細胞を分化誘導し得るものである限り、特に限定されない。細胞増殖因子としては、EGF、FGF、Neurotrophin/NGF、Interleukin 6、TGF-βが挙げられるが、中でもEGFやFGFが好ましい。本発明の方法においては、特にEGFを用いることが好ましく、さらにEGFとFGF(好ましくはbFGF)の2種類を用いることが好ましい。
【0029】
培養培地中の細胞増殖因子の濃度は、細胞密度により変動し、特に限定されないが、例えば、EGFが含まれる場合、EGFの濃度としては75×104cells/cm2に対して0.1〜100ng/ml、より好ましくは1〜50ng/ml、FGFが含まれる場合、FGFの濃度としては75×104cells/cm2に対して0.1〜100ng/ml、より好ましくは1〜50ng/mlが例示される。また細胞増殖因子は、培養の開始時に培地に添加されることが好ましい。
【0030】
本発明の方法に用いられる培地は、本発明の方法により神経幹細胞から神経細胞とグリア細胞を分化誘導し得るものであれば、特に限定されないが、例えば、自体公知の培地(DMEM、EMEM、RPMI-1640、α-MEM、F-12、F-10、M-199、HAM、L-15、ERDF等)を挙げることができる。また、神経細胞培養用等に改変された培地(Neurobasal等)を用いてもよく、上記培地の混合物(DMEM/F12等)を用いてもよい。
【0031】
本発明において用いられる培地には、各種のホルモンが添加されていることが好ましい。好適なホルモンとしては、インスリン、トランスフェリン、プロゲステロン、β-エストラジオール、トリヨードチロシン、プトレシン、亜セレン酸ナトリウム等が例示される。本発明において用いられる培地には、これらの全てのホルモンが添加されていることが好ましい。
【0032】
また本発明において用いられる培地には、上記ホルモン以外の自体公知の添加物が含まれ得る。添加物としては、例えば、有機酸(例えばピルビン酸ナトリウム等)、アミノ酸(例えばL-グルタミン等)、還元剤(例えば2-メルカプトエタノール、脂質、セレン等)、緩衝剤(例えばHEPES等)、抗生物質(例えばストレプトマイシン、ペニシリン、ゲンタマイシン等)、アルブミン等が挙げられる。当該添加物は、それぞれ自体公知の濃度範囲内で含まれることが好ましい。
【0033】
培地は、血清を含まない無血清培地を用いることが好ましい。無血清培地とは、無調製または未精製の血清を含まない培地を意味し、精製された血液由来成分や動物組織由来成分(例えば、細胞増殖因子)が混入している培地は無血清培地に該当するものとする。
【0034】
本発明においては、神経幹細胞は接着培養法により培養される。神経幹細胞の未分化性を維持する場合は一般的に接着培養法ではなく浮遊培養法が用いられるが、神経幹細胞を浮遊培養するとニューロスフェアが形成されることが知られているため、本発明においては接着培養法が用いられる。
【0035】
接着培養法は、細胞を培地中において、細胞培養器の接触面に対し、接着させた状態で培養する方法である。接着培養法では、細胞は2次元構造で培養され得る。接着の強度は、本発明の方法により神経幹細胞から神経細胞とグリア細胞が分化誘導され得る強度範囲であれば特に限定されないが、好ましくは、タッピング処理、ピペッティング処理等の人為的処理によらなければ、生存性を維持したまま細胞を剥離することができない程度の強度である。
【0036】
接着培養法では、接着性を増強させるため、細胞接着性の培養器、例えば細胞外マトリックス(例えばラミニン、テネイシン、フィブロネクチン、コラーゲン)、ポリ−D-リジン、ポリ−L−リジン、ポリエチレンイミン等によりコーティング処理した培養器を使用することが好ましい。
【0037】
神経幹細胞の培養条件は特に限定されず、通常当分野で実施される条件で実施することができる。例えば、5%CO2雰囲気下、37℃で4〜10日間培養される。培地は、2〜5日間に一度交換することが好ましい。
【0038】
(神経細胞およびグリア細胞を培養する工程)
上述のようにして神経幹細胞を培養することにより、神経幹細胞から神経細胞およびグリア細胞を分化誘導することができ、同一容器内における単一個体由来の神経細胞およびグリア細胞の共培養系が構築され、神経細胞およびグリア細胞を共培養することが可能となる。
【0039】
本発明にて構築される共培養系は神経細胞とグリア細胞を含む組成物である。本発明における共培養系は、神経細胞とグリア細胞が均一に分散して共存するものであり、同一細胞集団で密集して存在しているものではない。本発明にて構築される共培養系において、神経細胞とグリア細胞の割合は100:50〜1000であり、好ましくは100:100〜300である。
【0040】
本発明にて構築される共培養系においては、グリア細胞としてアストロサイトが分化誘導されることが好ましい。当該共培養系に存在するアストロサイトは、タイプIアストロサイトがほとんど存在せず、タイプIIアストロサイトが多数存在する。本発明にて構築される共培養系におけるタイプIアストロサイトとタイプIIアストロサイトの割合は1〜5:100であり、好ましくは1〜2:100である。
【0041】
(共培養系を用いた解析方法)
本発明により構築された共培養系を用いて、神経細胞および/またはグリア細胞の機能を解析することができる。当該共培養系を用いて、外来遺伝子(例えば遺伝学的に同定された各種神経疾患の原因遺伝子)を神経細胞および/またはグリア細胞に導入し神経細胞および/またはグリア細胞の機能を解析する方法、あるいは、神経細胞またはグリア細胞の内在遺伝子に変異を導入することにより、当該内在遺伝子の神経ネットワーク上での機能を解析する方法などが、解析方法として例示される。神経細胞またはグリア細胞の機能について、自体公知の分析手法により解析すればよい。
【0042】
グリア細胞への遺伝子導入はアデノウイルスを用いて行うことができる。アデノウイルスによるグリア細胞への遺伝子導入は自体公知の手法により行えばよい。
例えば、CreLoxPシステムを利用した各種floxマウスを用いて共培養系を構築し、Cre recombinaseアデノウイルス(理化学研究所)を感染させることにより、目的の遺伝子をアストロサイトのみで簡便に欠損させることが可能である。
【実施例】
【0043】
以下の実施例により本発明をさらに具体的に説明するが、本発明は実施例によって限定されるものではない。なお本実施例は金沢大学動物実験指針に基づいて行った。
【0044】
(実施例1)神経細胞とアストロサイトの共培養系の構築
1)神経幹細胞を分散した試料の調製と神経幹細胞の培養
神経幹細胞を分散した試料の調製と神経幹細胞の培養において、まず使用した動物および試薬について説明し、その後手法について説明をする。
(i)胎生15日齢マウス(E15マウス)
(ii)10%Hormone mix/DMEM(10%HM/DMEM)
DMEM Powder(Invitrogen, 12100)(NaHCO3 1.125 g、Glucose 5.05 g、HEPES 1.2 g、Glutamine 0.292 g)と、100×antibiotic(Penicillin-Streptomycin, liquid)(Invitrogen, 15140-122)を10 mlと、超純水 900mlとを混合して、フィルトレーションを行った。
6.25 mg/ml インスリン(Insulin) 160 μl (final: 5 ug/ml)、12.5 mg/ml トランスフェリン(Transferrin) 8 ml (final: 0.5 mg/ml)、1 mM プロゲステロン(Progesterone) 40 μl (final: 0.2 uM)、1 nM β-エストラジオール(β-Estradiol) 2 ml (final: 0.01 nM)、3 μM トリヨードチロシン(Triiodothyronine) 2 ml (final: 0.03 μM)、10 mM プトレシン(Putrescine) 20 ml (final: 1 mM)、4 μg/ml 亜セレン酸ナトリウム(Sodium selenite:Na2SeO3)) 4 ml (final: 0.08 ug/ml)、超純水 200 mlを混合し、10×Hormone mixを作製した。6.25 mg/ml インスリンは、Sigma社 I-6634の粉末 6.25 mg と、0.01 N HCl 1 mlを溶解したものである。12.5 mg/ml トランスフェリンは、Sigma社 T-2252の粉末 500 mgを超純水に溶解して40 mlに調整したものである。1 mM プロゲステロンは、Sigma社 P-8738(apo-Transferrin)の粉末3.14 mgをEtOHに溶解して超純水で10 mlに調整したものである。1 nM β-エストラジオールは、Sigma社 E-2758の粉末2.72 mgをEtOHに溶解して超純水で10 mlに調整して1mMの溶液を得て希釈したものである。3 μM トリヨードチロシン(Triiodothyronine)は、Sigma社 T-6397(3,3',5-Triiodo-L-thyronine)の粉末 2.019 mgを0.1 N NaOH 1.0 mlに溶解して3mMの溶液を得て、超純水で希釈したものである。10 mM プトレシンは、Sigma社 P-5780の粉末32.22 mgを超純水20 mlに溶解したものである。4 μg/ml 亜セレン酸ナトリウムは、Sigma社 S-5261の粉末4.0 mgを超純水1.0 mlに溶解して4mg/mlの溶液を得て、超純水で希釈したものである。
(iii)PBS(Phosphate buffered saline)
NaCl(nacalai tesque, 31320-34) 80.0 g、Na2HPO4, anhydrous(Wako, 197-02865) 11.5 g、KCl(Wako, 163-03545) 2.0 g、KH2PO4(Wako, 169-04245) 2.0 g、超純水 1 Lに溶解して、溶液をオートクレーブして、10×PBSを作製した。1×PBSは、10×PBSを希釈して作製した。なお、以下特に記載しない限り「PBS」と記載するものは1×PBSを使用した。
(iv)トリプシン液
1.25 g Trypsin (Difco 1:250)、2.5 g Glucose、50 mL 10×PBS(Ca, Mg-free PBS)を混合し、450mLの滅菌水に加えて、4℃で一晩、スターラーで攪拌しながら溶解させた。フィルトレーション後、分注した。
(v)馬血清(Gibco, Cat# 16050-122)
(vi)DNase液
DNase(Sigma, DN-25)を超純水にて10 mg/mlの濃度に調整した。フィルトレーションした後、小分けした。
(vii)Poly-lysine-coated Dish
Poly-L-lysine (Sigma, P-1399)を、超純水にて500μg/mlの濃度に調整し、フィルトレーションした後、使用時まで冷凍保存した。使用時は、75μg/mlに超純水にて希釈し、フィルトレーションした後に使用した。Dishのコーティングは、75μg/mlのPoly-lysine液をDishに添加し、4〜16時間インキュベーターで放置して行った。その後、滅菌精製水で2回洗浄した。16時間以上コーティングした場合は3回洗浄した。
(viii)EGF(human epidermal growth factor)
Biomedical Technologies, BT-102の粉末50μgを、滅菌精製水5 mlに溶解して、フィルトレーションをして、10μg/ml EGF溶液を作製した。
(ix)FGF (human fibroblast growth factor)
Biomedical Technologies, BT-108の粉末10μgを、滅菌精製水1 mlに溶解して、フィルトレーションをして、10μg/ml FGF溶液を作製した。
【0045】
本実施例の手法の概略図を図2に示す。
E15マウスを培養室に運び、一匹ずつ脳組織を取り出し、冷PBS中に移した。
顕微鏡下で脳組織から海馬あるいは大脳皮質を切り出し、冷PBS中に移した。
50 mL遠沈管に、海馬あるいは大脳皮質の組織片をそのままいれ、5 mLのトリプシン液を加えて、20分間、37℃でトリプシン処理を行った。トリプシン処理後の遠沈管に、馬血清5 ml(トリプシンと等量)とDNase液 50 μl(1/100量)を加え、1500 rpmで1.5分間、遠心処理を行った。遠心後、上清を除き、0.9 mLの10%HM/DMEMを加えて、ピペッティングして細胞を分散させた。分散させた後、4 mlの10%HM/DMEMを加えて、めがね用フィルター(Kodac)で細胞をろ過し、神経幹細胞を分散した試料を得た。
神経幹細胞を分散した試料について、計数盤を用いて細胞をカウントし、10%HM/DMEMに20 ng/ml EGFおよび20ng/ml FGFを加えた培地を用いて、150x104 cells/mlの濃度になるように希釈して調整した。Poly-lysine-coated Dishに75×104cells/cm2となるよう細胞を播種して、培養を5%CO2気相下、37℃で行った。4日に1回の頻度で培地を全量、新しい培地(10%HM/DMEMに20 ng/ml EGFおよび20ng/ml FGFを加えたもの)に交換し、合計8日間培養を行った。
【0046】
2)免疫染色
神経幹細胞の培養後、分化誘導された細胞の分析のために免疫染色を行った。免疫染色に用いた試薬をまず説明し、その後手法について説明をする。
(i)PFA(パラホルムアルデヒド:Paraformaldehyde)溶液
0.2M リン酸緩衝液(PB)を、Na2HPO4 46.28gとNaH2PO4 5.16gを超純水に溶解して、1000mlに調整した。
パラホルムアルデヒド(Wako, 162-16065)40 gを、超純水300mLに加えて、ドラフト内で65℃に加熱しながらスターラーで撹拌した。さらに5N NaOH 160μLを加えて完全に溶解させた。溶解後、超純水を加えて500mLに調整し、再び攪拌を行った後、溶液が透明にし、8%PFA in 超純水を得た。得られた8%PFA in 超純水を使用時まで氷冷して保存した。
8%PFA in 超純水と、0.2M PBを等量混合することにより、4%PFA in 0.1M PBを得た。4%PFA in 0.1M PBは用時調整して用いた。
(ii)PBS/0.1%TritonX-100
10%TritonXを、上記実施例1の1)にて用いたPBSで100倍希釈して、0.1%TritonX-100を作製した。。
(iii)normal goat serum (フナコシ, VEC S-1000)
(iv)一次抗体溶液
マウス抗MAP2抗体(SIGMA, M4403)またはウサギ抗GFAP抗体(SIGMA, G9269)をそれぞれ、3% normal goat serumを含むPBS/0.1%TritonX-100にて1500倍あるいは500倍に希釈した。
(v)二次抗体溶液
Alexa 488標識化抗マウスIgG抗体(Invitrogen, T20912)またはAlexa594標識化抗ウサギIgG抗体(Invitrogen, A31631)をそれぞれ、PBSにて1000倍あるいは500倍に希釈した。
(vi)ヘキスト溶液
Hoechest33342(SIGMA)をPBSにて1000倍に希釈した。
【0047】
実施例1の1)にて8日間培養した細胞を、PBSにて洗浄した。洗浄後、細胞を4%PFA in 0.1M PBにて15分間処理した。その後、PBSで3回洗浄した。さらに洗浄後の細胞を、PBS / 0.1% TritonX-100にて15分間処理を行い、PBSで3回洗浄した。その後、10% normal goat serumを含むPBS / 0.1%TritonX-100にて1時間処理を行った。一次抗体溶液を添加して、4℃にて16時間処理を行い、PBSで1回洗浄した。さらに、二次抗体溶液を添加して、4℃にて16時間処理を行い、PBSで2回洗浄した。ヘキスト溶液にて、室温にて10分間処理を行った。処理後、0.1M PBにて細胞を洗浄した後、0.1M PBを添加し、観察を行った。観察は、共焦点レーザー顕微鏡(LSM710、Carl Zeiss)を用いて行った。
【0048】
結果を図3〜6に示す。図3は、Hoechst33342により細胞を染色した写真であり、生細胞を可視化したものである。図4は、抗MAP抗体により細胞を染色した写真であり、神経細胞を可視化したものである。図5は、抗GFAP抗体により細胞を染色した写真であり、アストロサイトを可視化したものである。図6は、図3〜図5を重ね合わせたものである。培地に細胞増殖因子であるEGFとFGFを添加することにより、多数の突起を持ったアストロサイト数の顕著な増加が認められた。観察した結果、アストロサイトと神経細胞は単一細胞で存在し、培地中において偏らずに混在していることがわかった。
【0049】
(実施例2)共培養系におけるアストロサイト特異的な遺伝子の導入
共培養系においてアデノウイルスを用いて感染させることで、アストロサイト特異的に遺伝子を導入し、その後免疫染色を行い細胞を観察した。神経幹細胞を含む試料の調製と神経幹細胞の培養と免疫染色は、実施例1の方法と同様にして行った。実施例1に記載されていない試薬についてまず以下に説明し、その後手法について説明する。
(i)緑色蛍光タンパク質(GFP)過剰発現用アデノウイルス(AdV-GFP)感染溶液
AdV-GFPは、理化学研究所バイオリソースセンターよりAx1 CA gfp(RDB#1727)として購入した。500μLの10%HM/DMEMにAdV-GFP (109 pfu/ml)を10μl 加えてAdV-GFP感染溶液を用いた。
(ii)一次抗体溶液
ウサギ抗MAP2抗体(Abcam, ab32454)あるいはウサギ抗GFAP抗体(SIGMA, G9269)をそれぞれ、3% normal goat serumを含むPBS / 0.1%TritonX-100にて1000倍あるいは500倍に希釈した。
(iii)二次抗体溶液
Alexa 594標識化抗ウサギIgG抗体をPBSにて1000倍に希釈した。
【0050】
実施例1の1)と同様の方法により神経幹細胞を分散した試料を調製し、神経幹細胞を培養した。培養8日目に、培地をAdV-GFP感染溶液に置換し、その後5%CO2気相下、37℃で4日間培養を行った。その後、一次抗体溶液と二次抗体溶液を上記のものを用いた以外は実施例1の手法と同様にして免疫染色を行い、細胞の観察を行った。
【0051】
結果を図8〜11に示す。図8は、抗MAP2抗体により細胞を染色した写真であり、図9はその拡大図である。図10は、抗GFAP抗体により細胞を染色した写真であり、図11はその拡大図である。図8および図10における写真中のバーは、100μmの大きさを示しており、図9および図11における写真中のバーは、10μmの大きさを示す。EGFとFGF存在下での培養した細胞に、アデノウイルス(AdV)を用いてGFPを感染させると、GFAP陽性を示すアストロサイト選択的にGFPが発現し、MAP2陽性の神経細胞にはGFPが全く発現しなかった。AdV-GFPを感染させて免疫染色した画像において、30個のGFP陽性細胞のうち、MAP2もしくはGFAPに陽性な細胞の数を計測したところ、MAP2に陽性な細胞の数は0個であり、GFAPに陽性な細胞の数は30個全てであった。従って、実施例1の手法により構築された共培養系においてアストロサイト特異的に外来遺伝子を導入することが可能であることがわかった。
【産業上の利用可能性】
【0052】
本発明によれば、生体の脳に近い条件下で、神経細胞とグリア細胞とを共培養することが可能となる。グリア細胞のうちアストロサイトは近年、単なる神経細胞の支持細胞として捉えられるのではなく、神経情報伝達や各種神経疾患の病態生理に深く、積極的に関与することが分かってきた。本発明における共培養系を用いれば、遺伝学的に同定された各種神経疾患の原因遺伝子を、アデノウイルスを用いてアストロサイト選択的に導入して、アストロサイト機能変動に伴う神経細胞の機能解析を行うことが可能である。また本発明の共培養系によれば、神経細胞とアストロサイトの共存条件下で、注目する遺伝子をアストロサイトのみで簡便に欠損させることができ、神経細胞とアストロサイト間の連関を解析することが可能となる。また、本発明により難治性疾患患者から共培養系を構築することにより、神経細胞とアストロサイト間の連関異常に起因する種々の中枢神経系疾患の発症メカニズム解明と、その後の創薬戦略展開に大きく貢献することが可能になると期待される。
【技術分野】
【0001】
本発明は、細胞増殖因子の存在下で単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法に関する。
【背景技術】
【0002】
中枢神経系は、神経細胞とグリア細胞(アストロサイト、ミクログリア、オリゴデンドロサイト)などにより主に構成されている。中枢神経系における記憶・学習などの神経活動、あるいは脳梗塞やアルツハイマー病などの各種神経疾患の所為は、神経細胞を含む各種細胞間に構築されるネットワークより行われると考えられている。中枢神経系を構成する細胞群の機能解析は、インビトロ実験系では、高い純度の各種細胞の単独培養系により実施されている場合が多い。実際の生体内で構築される神経細胞とグリア細胞間の情報ネットワークを維持する観点からの機能解析は、各種細胞の共培養系により行われる必要がある。
【0003】
各種細胞の共培養系は、高純度の神経細胞やアストロサイト等の各種細胞を用意してから、共培養のためにそれぞれの細胞集団を混ぜることにより構築する必要がある。しかしながら、この方法ではそれぞれの細胞集団を用意するのに時間と労力を有する。さらに、それぞれの細胞集団を異なる週齢の実験動物(マウスやラット)から調製する必要があり、経済的および労力的に大きな負担がある。またアストロサイトの場合は、細胞の性質上、単独培養系ではほとんどが扁平形状のタイプI(type I)のアストロサイトに変化してしまい、生体脳内で見られるような多数の突起を持つタイプII(type II)のアストロサイトが皆無となってしまう。
【0004】
非特許文献1では、成体マウスの脳室下帯から取り出した細胞組織にEGFを添加し、分裂増殖させることにより、神経細胞やグリア細胞を生み出す細胞塊を分離したことが報告されている。特許文献2には、ニューロスフェア(神経塊)を、EGFおよびbFGFの存在下において培養することにより、神経細胞とアストロサイトを分化誘導したことが開示されている。さらに非特許文献2および3では、FGFが神経幹細胞の増殖・維持に重要であることが報告されている。神経幹細胞は、in vitroで未分化性を維持するために浮遊培養を行った場合、塊状態のニューロスフェアを形成する。生体内では神経幹細胞はニューロスフェアを介さずに神経細胞やグリア細胞に分化誘導されるが、生体脳に近い条件で神経細胞とグリア細胞とを共培養可能な系についての報告はない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2004−236607号公開公報
【非特許文献】
【0006】
【非特許文献1】Reynolds BA, Weiss S , Science 255:11707-17104.(1992)
【非特許文献2】Cavanagh JF, Mione MC, Pappas IS, Parnavelas JG., Cereb Cortex. 7:293-302.(1997)
【非特許文献3】Hulspas R, Tiarks C, Reilly J, Hsieh CC, Recht L, Quesenberry PJ., Exp Neurol. 148:147-156.(1997)
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、生体における中枢神経系の情報伝達ネットワークをより反映し得るような、神経細胞とグリア細胞との共培養系を、低コストかつ簡便に確立することを目的とし、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは鋭意検討した結果、細胞増殖因子の存在下で、単一個体由来の神経幹細胞を培養することにより、同一容器内で当該神経幹細胞から神経細胞とグリア細胞とを分化誘導し得ることを見出し、単一個体由来の神経細胞とグリア細胞との共培養が可能となることに着目し、本発明を達成した。
【0009】
すなわち、本発明は以下の通りである。
1.以下の工程を含む、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法:
1)単一個体から採取された組織を用いて、神経幹細胞の分散した試料を調製する工程;
2)神経幹細胞の分散した試料を培地に添加し、神経幹細胞を細胞増殖因子を含む培地にて培養する工程;および、
3)同一容器内で、神経幹細胞から分化誘導された神経細胞およびグリア細胞を培養する工程。
2.細胞増殖因子がEGFおよびFGFを含む、前項1に記載の共培養方法。
3.グリア細胞がアストロサイトである、前項1または2に記載の共培養方法。
4.アストロサイトがタイプIIアストロサイトを含む、前項3に記載の共培養方法。
5.培養が接着培養法により行われる、前項1〜4のいずれか1に記載の共培養方法。
6.神経幹細胞が、マウスの脳組織から採取されたものである、前項1〜5のいずれか1に記載の共培養方法。
7.前項1〜6のいずれか1に記載の共培養方法により得られる、神経細胞とグリア細胞を含む組成物。
8.前項7に記載の組成物を用いて、神経細胞および/またはグリア細胞の機能を解析する方法。
9.アデノウイルスを用いて、グリア細胞の内在遺伝子に変異を導入する、および/または、グリア細胞に外来遺伝子を導入することを含む、前項8に記載の神経細胞および/またはグリア細胞の機能を解析する方法。
【発明の効果】
【0010】
本発明により、細胞増殖因子(例えばEGFやFGF)を利用することにより、安価かつ簡便に、神経細胞とグリア細胞との共培養系の確立することができた。例えば、同一マウス胎児脳由来の神経幹細胞を利用して本発明の共培養方法を行った場合、生体の脳内において見られるタイプIIアストロサイトを多数分化誘導することができた。本発明の共培養方法によれば、神経細胞とグリア細胞が同一容器内でネットワークを構成している可能性が高く、従来の単培養系と単培養系を混合してなる共培養系に比べて、より生体脳に近い条件での研究を行うことができると考えられる。
さらに本発明の共培養方法では、使用が容易でありかつ、操作が簡便なアデノウイルスを用いて、グリア細胞(特にアストロサイト)特異的に遺伝子工学的な手法により機能を操作することが可能である。よって、本発明の共培養方法を用いてグリア細胞共存下での神経細胞の機能解析や、あるいは逆に神経細共存下でのアストロサイトの機能解析を行うことが可能である。
【図面の簡単な説明】
【0011】
【図1】神経幹細胞と、神経細胞および各種グリア細胞の関係を示す図である。
【図2】実施例1の実験の流れを説明した図である。
【図3】神経幹細胞を8日間培養した細胞のHoechest33342染色像を示す。(実施例1)
【図4】神経幹細胞を8日間培養した細胞のMAP2染色像を示す。(実施例1)
【図5】神経幹細胞を8日間培養した細胞のGFAP染色像を示す。(実施例1)
【図6】神経幹細胞を8日間培養した細胞のHoechest33342、MAP2およびGFAP染色像の重ね合わせ画像を示す。(実施例1)
【図7】実施例2の実験の流れを説明した図である。
【図8】神経細胞とアストロサイト共培養系において細胞にAdV-GFPを感染させた場合の、GFP蛍光像(AdV-GFP)、MAP2染色像(MAP)およびHoechest33342染色像(Hoechest)、さらにそれらの画像の重ね合わせ画像(Merge)を示す。(実施例2)
【図9】図8の各種染色像および重ね合わせ画像の拡大画像を示す。(実施例2)
【図10】神経細胞とアストロサイト共培養系において細胞にAdV-GFPを感染させた場合の、GFP蛍光像(AdV-GFP)、GFAP染色像(GFAP)およびHoechest33342染色像(Hoechest)、さらにそれら画像の重ね合わせ画像(Merge)を示す。(実施例2)
【図11】図10の各種染色像および重ね合わせ画像の拡大画像を示す。(実施例2)
【発明を実施するための形態】
【0012】
本発明は、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法であって、以下の工程を含む共培養方法を対象とする。
1)単一個体から採取された組織を用いて、神経幹細胞の分散した試料を調製する工程。
2)神経幹細胞の分散した試料を培地に添加し、神経幹細胞を細胞増殖因子を含む培地にて培養する工程。
3)同一容器内で、神経幹細胞から分化誘導された神経細胞およびグリア細胞を培養する工程。
まず図1を参照しながら各細胞について説明した後、工程1)〜3)について説明する。
【0013】
生体内において情報の伝達と処理を行う一連の器官を神経系と呼ぶ。神経系を構成する細胞としては神経細胞(neuron)とグリア細胞(glial cell)が挙げられ、両者は協働して神経系の維持や情報伝達を行っている。グリア細胞には、アストロサイト(astorocyte)、 オリゴデンドロサイト(oligodendrocyte)、マイクログリア、上衣細胞等が含まれる。神経細胞とグリア細胞は、生体内において神経幹細胞から分化誘導されると考えられている。
【0014】
本明細書において神経幹細胞とは、神経細胞や、アストロサイトおよびオリゴデンドロサイトなどのグリア細胞に分化しうる多分化能を有し、かつ自己複製能を有する中枢神経系多能性未分化細胞である。神経幹細胞は生体の脳内において、神経細胞、アストロサイトやオリゴデンドロサイトを供給する役割を担っていると考えられる。本発明において、神経幹細胞は細胞増殖因子を含む培地により培養されることにより、神経細胞およびグリア細胞(特にアストロサイト)に分化誘導される。一般的に神経幹細胞は、神経前駆細胞を経て神経細胞に誘導され、アストロサイト前駆細胞を経てアストロサイトに誘導され、オリゴデントロサイト前駆細胞を経てオリゴデントロサイトに誘導される。神経幹細胞は、ネスチン(Nestin)、RC2、ムサシ1(Musashi1)等のマーカーの発現を指標として、例えば、対応する遺伝子の発現を慣用の核酸の検出方法により調べること又はタンパク質の発現を免疫細胞組織化学的手法により調べることにより同定されうる。
【0015】
神経細胞とは、他の神経細胞または刺激受容細胞からの刺激を受け、別の神経細胞、筋または腺細胞に刺激を伝える機能を有する細胞である。また神経細胞の形態的特徴としては、細胞体、樹状突起、軸索、軸索成長円錐等が挙げられる。
【0016】
神経細胞は、神経細胞が産生する情報伝達物質の違いにより分類されるが、本発明においては情報伝達物質の種類については特に限定しない。情報伝達物質としては、ペプチド性、非ペプチド性のいずれも包含される。非ペプチド性の情報伝達物質のうち代表的な物質としては、ドーパミン、アセチルコリン、γアミノ酪酸等が挙げられる。より詳しくは、ドーパミン、ノルアドレナリン、アドレナリン、セロトニン、アセチルコリン、γアミノ酪酸、グルタミン酸が挙げられる。ペプチド性の情報伝達物質のうち、代表的な物質としては副腎皮質刺激ホルモン(ACTH)、α-エンドルフィン、β-エンドルフィン、γ-エンドルフィン、バソプレッシン等が挙げられるが、これらに限定されるものではない。
【0017】
神経細胞は、MAP2、NeuN、NSE、Neurofilament、βIIItubulin等のマーカーの発現を指標として、例えば、対応する遺伝子の発現を慣用の核酸の検出方法により調べること又はタンパク質の発現を免疫細胞組織化学的手法により調べることにより同定されうる。
【0018】
グリア細胞は、神経細胞と神経細胞との隙間を埋め、神経細胞の代謝の仲介をするとともに、支持組織として働く細胞である。グリア細胞としては、中枢神経系では、アストロサイト、オリゴデンドロサイト及びミクログリオサイトが挙げられる。グリア細胞のうちアストロサイトは、単なる神経細胞の支持細胞として捉えられるのではなく、神経情報伝達や各種神経疾患の病態生理に深く積極的に関与することが分かっている。
【0019】
アストロサイトには、扁平形状(アメーバ状)の形態を持つタイプIアストロサイトや多数の突起(線維状の形態)を持つタイプIIアストロサイトがある。タイプIアストロサイトは、神経幹細胞からアストロサイトを単独で分化誘導させた培養系において見られる。タイプIIアストロサイトは、生体の脳内において見られるものであるが、神経幹細胞からアストロサイトを単独で分化誘導させた培養系においてはほとんど分化誘導することができない。本発明の共培養方法においてはタイプIIアストロサイトが多数存在する共培養系を得ることができる。
【0020】
なおアストロサイトは、グリア繊維性酸性タンパク質(GFAP)や、S100β等のマーカーの発現を指標として、オリゴデントロサイトは、O4、GC、GD3、NG2等のマーカーの発現を指標として、例えば、対応する遺伝子の発現を慣用の核酸の検出方法により調べること又はタンパク質の発現を免疫細胞組織化学的手法により調べることにより同定されうる。
【0021】
(神経幹細胞の分散した試料を調製する工程)
本発明において、神経幹細胞の分散した試料は、単一の個体(生体)から採取された組織を用いて調製される。神経幹細胞の分散した試料は、単一の個体から、神経幹細胞を含む組織を採取し、当該組織から神経幹細胞を分離し調製すればよい。神経幹細胞を分離する組織としては神経幹細胞を含むものであれば特に限定されない。神経幹細胞を分離する組織としては、胎児の場合は脳組織(例えば大脳、小脳、脳幹)であれば部位は特に限定されず、例えば大脳皮質および/または海馬を用いることができ、成体の場合は海馬を用いることが好ましい。なお、脳組織は、腫瘍化した組織や遺伝子が変異した組織、病変のある組織等でもよいし、正常組織であってもよい。
【0022】
神経幹細胞を分離する生体としては、例えば温血動物、好ましくは哺乳動物が挙げられる。哺乳動物としては、例えば、マウス、ラット、モルモット、ハムスター、ウサギ、ネコ、イヌ、ヒツジ、ブタ、ウシ、ウマ、ヤギ、サル、ヒト等が挙げられ、好ましくは、マウス、ラット、サル、ヒト等が挙げられる。
【0023】
組織から神経幹細胞の分散した試料を調製するためにはまず、組織から神経幹細胞を分離する必要がある。組織から神経幹細胞を分離する方法としては、自体公知の分離方法、例えば酵素処理や機械的処理で分離する方法等が挙げられる。細胞へのダメージや、培養系の安定性を考慮すれば、酵素処理で分離するのが好ましい。酵素処理に用いられる酵素としては、例えば、トリプシン、ディスパーゼ、コラゲナーゼ、パパイン等が挙げられ、好ましくはトリプシンである。該酵素処理の条件は、細胞にダメージを与えず、本発明の方法により、神経幹細胞から神経細胞とグリア細胞を分化誘導し得るものである限り、特に限定されない。
【0024】
本発明において、組織から分離された神経幹細胞は、いかなる形態であってもよく、上記酵素処理後に遠心分離され、細胞ペレットの形態として存在しているものであってもよい。当該細胞ペレットには、神経幹細胞以外の細胞が含まれていてもよく、例えば、神経細胞を含むものであってもよい。後述する実施例のように胎生15日齢マウスの大脳皮質を用いて、細胞ペレットを作製した場合は、アストロサイトは実質的に含まれていない。
【0025】
組織から分離された神経幹細胞を使用して、神経幹細胞の分散した試料を調製する。神経幹細胞の分散した試料の調製方法は特に限定されないが、神経幹細胞(例えば細胞ペレット)を、培養に使用する培地に分散させることにより調製することができる。本明細書において「神経幹細胞の分散した」とは、複数の細胞が集まって細胞塊を形成していることがなく、単一の細胞ごとにバラバラに分散している状態を意味する。本発明の神経幹細胞の分散した試料においては、試料中の全細胞が分散していてもよいが、全細胞のうち80%以上、好ましくは90%以上の細胞が分散した状態で存在すればよい。従来、神経幹細胞の未分化性を維持するためにin vitroで浮遊培養を行った場合、複数の細胞が集まった塊状態のニューロスフェアを形成するが、本明細書における神経幹細胞の分散した試料はニューロスフェアを形成しているものではない。本発明においては、組織から調製した神経幹細胞の分散した試料を培地に添加することにより、神経幹細胞が分散した状態での培養が可能となり、個々の細胞が別個に神経細胞やグリア細胞に分化することができる。個々の細胞が別個に神経細胞やグリア細胞に分化することにより、培養系内に神経細胞とグリア細胞が万遍なく混在し、生体の脳内と同様に神経細胞とグリア細胞が情報ネットワークを維持し得るような共培養系が得られるものと考えられる。
【0026】
細胞を分散させる手法はいかなる手法であってもよいが、例えば自体公知のフィルターなどを用いて細胞を分散させることができる。また、ニューロスフェアを用いて神経幹細胞の分散した試料を調製する場合には、細胞を分散させる際に細胞にダメージが加わり細胞死を引き起こす可能性があるとともに、均一に分散した試料を得ることが困難である。よって本発明においては、ニューロスフェアを介さずに神経幹細胞の分散した試料が調製される。なおニューロスフェアとは、およそ50μm〜150μmの大きさの神経幹細胞の塊を意味する。
【0027】
(神経幹細胞を培養する工程)
本発明の共培養方法では、上述のようにして得られた神経幹細胞の分散した試料を培地に添加し、神経幹細胞を細胞増殖因子を含む培地にて培養する。培地中における細胞の濃度は、神経幹細胞から神経細胞とグリア細胞を分化誘導し得るものである限り、特に限定されない。例えば、細胞培養プレート上の培地に神経幹細胞の分散した試料を添加する場合は、細胞の密度が約1×104〜1×106cells/cm2、好ましくは約10×104〜100×104cells/cm2、より好ましくは約50×104〜75×104cells/cm2であればよい。
【0028】
本発明において使用される細胞増殖因子は、神経幹細胞から神経細胞とグリア細胞を分化誘導し得るものである限り、特に限定されない。細胞増殖因子としては、EGF、FGF、Neurotrophin/NGF、Interleukin 6、TGF-βが挙げられるが、中でもEGFやFGFが好ましい。本発明の方法においては、特にEGFを用いることが好ましく、さらにEGFとFGF(好ましくはbFGF)の2種類を用いることが好ましい。
【0029】
培養培地中の細胞増殖因子の濃度は、細胞密度により変動し、特に限定されないが、例えば、EGFが含まれる場合、EGFの濃度としては75×104cells/cm2に対して0.1〜100ng/ml、より好ましくは1〜50ng/ml、FGFが含まれる場合、FGFの濃度としては75×104cells/cm2に対して0.1〜100ng/ml、より好ましくは1〜50ng/mlが例示される。また細胞増殖因子は、培養の開始時に培地に添加されることが好ましい。
【0030】
本発明の方法に用いられる培地は、本発明の方法により神経幹細胞から神経細胞とグリア細胞を分化誘導し得るものであれば、特に限定されないが、例えば、自体公知の培地(DMEM、EMEM、RPMI-1640、α-MEM、F-12、F-10、M-199、HAM、L-15、ERDF等)を挙げることができる。また、神経細胞培養用等に改変された培地(Neurobasal等)を用いてもよく、上記培地の混合物(DMEM/F12等)を用いてもよい。
【0031】
本発明において用いられる培地には、各種のホルモンが添加されていることが好ましい。好適なホルモンとしては、インスリン、トランスフェリン、プロゲステロン、β-エストラジオール、トリヨードチロシン、プトレシン、亜セレン酸ナトリウム等が例示される。本発明において用いられる培地には、これらの全てのホルモンが添加されていることが好ましい。
【0032】
また本発明において用いられる培地には、上記ホルモン以外の自体公知の添加物が含まれ得る。添加物としては、例えば、有機酸(例えばピルビン酸ナトリウム等)、アミノ酸(例えばL-グルタミン等)、還元剤(例えば2-メルカプトエタノール、脂質、セレン等)、緩衝剤(例えばHEPES等)、抗生物質(例えばストレプトマイシン、ペニシリン、ゲンタマイシン等)、アルブミン等が挙げられる。当該添加物は、それぞれ自体公知の濃度範囲内で含まれることが好ましい。
【0033】
培地は、血清を含まない無血清培地を用いることが好ましい。無血清培地とは、無調製または未精製の血清を含まない培地を意味し、精製された血液由来成分や動物組織由来成分(例えば、細胞増殖因子)が混入している培地は無血清培地に該当するものとする。
【0034】
本発明においては、神経幹細胞は接着培養法により培養される。神経幹細胞の未分化性を維持する場合は一般的に接着培養法ではなく浮遊培養法が用いられるが、神経幹細胞を浮遊培養するとニューロスフェアが形成されることが知られているため、本発明においては接着培養法が用いられる。
【0035】
接着培養法は、細胞を培地中において、細胞培養器の接触面に対し、接着させた状態で培養する方法である。接着培養法では、細胞は2次元構造で培養され得る。接着の強度は、本発明の方法により神経幹細胞から神経細胞とグリア細胞が分化誘導され得る強度範囲であれば特に限定されないが、好ましくは、タッピング処理、ピペッティング処理等の人為的処理によらなければ、生存性を維持したまま細胞を剥離することができない程度の強度である。
【0036】
接着培養法では、接着性を増強させるため、細胞接着性の培養器、例えば細胞外マトリックス(例えばラミニン、テネイシン、フィブロネクチン、コラーゲン)、ポリ−D-リジン、ポリ−L−リジン、ポリエチレンイミン等によりコーティング処理した培養器を使用することが好ましい。
【0037】
神経幹細胞の培養条件は特に限定されず、通常当分野で実施される条件で実施することができる。例えば、5%CO2雰囲気下、37℃で4〜10日間培養される。培地は、2〜5日間に一度交換することが好ましい。
【0038】
(神経細胞およびグリア細胞を培養する工程)
上述のようにして神経幹細胞を培養することにより、神経幹細胞から神経細胞およびグリア細胞を分化誘導することができ、同一容器内における単一個体由来の神経細胞およびグリア細胞の共培養系が構築され、神経細胞およびグリア細胞を共培養することが可能となる。
【0039】
本発明にて構築される共培養系は神経細胞とグリア細胞を含む組成物である。本発明における共培養系は、神経細胞とグリア細胞が均一に分散して共存するものであり、同一細胞集団で密集して存在しているものではない。本発明にて構築される共培養系において、神経細胞とグリア細胞の割合は100:50〜1000であり、好ましくは100:100〜300である。
【0040】
本発明にて構築される共培養系においては、グリア細胞としてアストロサイトが分化誘導されることが好ましい。当該共培養系に存在するアストロサイトは、タイプIアストロサイトがほとんど存在せず、タイプIIアストロサイトが多数存在する。本発明にて構築される共培養系におけるタイプIアストロサイトとタイプIIアストロサイトの割合は1〜5:100であり、好ましくは1〜2:100である。
【0041】
(共培養系を用いた解析方法)
本発明により構築された共培養系を用いて、神経細胞および/またはグリア細胞の機能を解析することができる。当該共培養系を用いて、外来遺伝子(例えば遺伝学的に同定された各種神経疾患の原因遺伝子)を神経細胞および/またはグリア細胞に導入し神経細胞および/またはグリア細胞の機能を解析する方法、あるいは、神経細胞またはグリア細胞の内在遺伝子に変異を導入することにより、当該内在遺伝子の神経ネットワーク上での機能を解析する方法などが、解析方法として例示される。神経細胞またはグリア細胞の機能について、自体公知の分析手法により解析すればよい。
【0042】
グリア細胞への遺伝子導入はアデノウイルスを用いて行うことができる。アデノウイルスによるグリア細胞への遺伝子導入は自体公知の手法により行えばよい。
例えば、CreLoxPシステムを利用した各種floxマウスを用いて共培養系を構築し、Cre recombinaseアデノウイルス(理化学研究所)を感染させることにより、目的の遺伝子をアストロサイトのみで簡便に欠損させることが可能である。
【実施例】
【0043】
以下の実施例により本発明をさらに具体的に説明するが、本発明は実施例によって限定されるものではない。なお本実施例は金沢大学動物実験指針に基づいて行った。
【0044】
(実施例1)神経細胞とアストロサイトの共培養系の構築
1)神経幹細胞を分散した試料の調製と神経幹細胞の培養
神経幹細胞を分散した試料の調製と神経幹細胞の培養において、まず使用した動物および試薬について説明し、その後手法について説明をする。
(i)胎生15日齢マウス(E15マウス)
(ii)10%Hormone mix/DMEM(10%HM/DMEM)
DMEM Powder(Invitrogen, 12100)(NaHCO3 1.125 g、Glucose 5.05 g、HEPES 1.2 g、Glutamine 0.292 g)と、100×antibiotic(Penicillin-Streptomycin, liquid)(Invitrogen, 15140-122)を10 mlと、超純水 900mlとを混合して、フィルトレーションを行った。
6.25 mg/ml インスリン(Insulin) 160 μl (final: 5 ug/ml)、12.5 mg/ml トランスフェリン(Transferrin) 8 ml (final: 0.5 mg/ml)、1 mM プロゲステロン(Progesterone) 40 μl (final: 0.2 uM)、1 nM β-エストラジオール(β-Estradiol) 2 ml (final: 0.01 nM)、3 μM トリヨードチロシン(Triiodothyronine) 2 ml (final: 0.03 μM)、10 mM プトレシン(Putrescine) 20 ml (final: 1 mM)、4 μg/ml 亜セレン酸ナトリウム(Sodium selenite:Na2SeO3)) 4 ml (final: 0.08 ug/ml)、超純水 200 mlを混合し、10×Hormone mixを作製した。6.25 mg/ml インスリンは、Sigma社 I-6634の粉末 6.25 mg と、0.01 N HCl 1 mlを溶解したものである。12.5 mg/ml トランスフェリンは、Sigma社 T-2252の粉末 500 mgを超純水に溶解して40 mlに調整したものである。1 mM プロゲステロンは、Sigma社 P-8738(apo-Transferrin)の粉末3.14 mgをEtOHに溶解して超純水で10 mlに調整したものである。1 nM β-エストラジオールは、Sigma社 E-2758の粉末2.72 mgをEtOHに溶解して超純水で10 mlに調整して1mMの溶液を得て希釈したものである。3 μM トリヨードチロシン(Triiodothyronine)は、Sigma社 T-6397(3,3',5-Triiodo-L-thyronine)の粉末 2.019 mgを0.1 N NaOH 1.0 mlに溶解して3mMの溶液を得て、超純水で希釈したものである。10 mM プトレシンは、Sigma社 P-5780の粉末32.22 mgを超純水20 mlに溶解したものである。4 μg/ml 亜セレン酸ナトリウムは、Sigma社 S-5261の粉末4.0 mgを超純水1.0 mlに溶解して4mg/mlの溶液を得て、超純水で希釈したものである。
(iii)PBS(Phosphate buffered saline)
NaCl(nacalai tesque, 31320-34) 80.0 g、Na2HPO4, anhydrous(Wako, 197-02865) 11.5 g、KCl(Wako, 163-03545) 2.0 g、KH2PO4(Wako, 169-04245) 2.0 g、超純水 1 Lに溶解して、溶液をオートクレーブして、10×PBSを作製した。1×PBSは、10×PBSを希釈して作製した。なお、以下特に記載しない限り「PBS」と記載するものは1×PBSを使用した。
(iv)トリプシン液
1.25 g Trypsin (Difco 1:250)、2.5 g Glucose、50 mL 10×PBS(Ca, Mg-free PBS)を混合し、450mLの滅菌水に加えて、4℃で一晩、スターラーで攪拌しながら溶解させた。フィルトレーション後、分注した。
(v)馬血清(Gibco, Cat# 16050-122)
(vi)DNase液
DNase(Sigma, DN-25)を超純水にて10 mg/mlの濃度に調整した。フィルトレーションした後、小分けした。
(vii)Poly-lysine-coated Dish
Poly-L-lysine (Sigma, P-1399)を、超純水にて500μg/mlの濃度に調整し、フィルトレーションした後、使用時まで冷凍保存した。使用時は、75μg/mlに超純水にて希釈し、フィルトレーションした後に使用した。Dishのコーティングは、75μg/mlのPoly-lysine液をDishに添加し、4〜16時間インキュベーターで放置して行った。その後、滅菌精製水で2回洗浄した。16時間以上コーティングした場合は3回洗浄した。
(viii)EGF(human epidermal growth factor)
Biomedical Technologies, BT-102の粉末50μgを、滅菌精製水5 mlに溶解して、フィルトレーションをして、10μg/ml EGF溶液を作製した。
(ix)FGF (human fibroblast growth factor)
Biomedical Technologies, BT-108の粉末10μgを、滅菌精製水1 mlに溶解して、フィルトレーションをして、10μg/ml FGF溶液を作製した。
【0045】
本実施例の手法の概略図を図2に示す。
E15マウスを培養室に運び、一匹ずつ脳組織を取り出し、冷PBS中に移した。
顕微鏡下で脳組織から海馬あるいは大脳皮質を切り出し、冷PBS中に移した。
50 mL遠沈管に、海馬あるいは大脳皮質の組織片をそのままいれ、5 mLのトリプシン液を加えて、20分間、37℃でトリプシン処理を行った。トリプシン処理後の遠沈管に、馬血清5 ml(トリプシンと等量)とDNase液 50 μl(1/100量)を加え、1500 rpmで1.5分間、遠心処理を行った。遠心後、上清を除き、0.9 mLの10%HM/DMEMを加えて、ピペッティングして細胞を分散させた。分散させた後、4 mlの10%HM/DMEMを加えて、めがね用フィルター(Kodac)で細胞をろ過し、神経幹細胞を分散した試料を得た。
神経幹細胞を分散した試料について、計数盤を用いて細胞をカウントし、10%HM/DMEMに20 ng/ml EGFおよび20ng/ml FGFを加えた培地を用いて、150x104 cells/mlの濃度になるように希釈して調整した。Poly-lysine-coated Dishに75×104cells/cm2となるよう細胞を播種して、培養を5%CO2気相下、37℃で行った。4日に1回の頻度で培地を全量、新しい培地(10%HM/DMEMに20 ng/ml EGFおよび20ng/ml FGFを加えたもの)に交換し、合計8日間培養を行った。
【0046】
2)免疫染色
神経幹細胞の培養後、分化誘導された細胞の分析のために免疫染色を行った。免疫染色に用いた試薬をまず説明し、その後手法について説明をする。
(i)PFA(パラホルムアルデヒド:Paraformaldehyde)溶液
0.2M リン酸緩衝液(PB)を、Na2HPO4 46.28gとNaH2PO4 5.16gを超純水に溶解して、1000mlに調整した。
パラホルムアルデヒド(Wako, 162-16065)40 gを、超純水300mLに加えて、ドラフト内で65℃に加熱しながらスターラーで撹拌した。さらに5N NaOH 160μLを加えて完全に溶解させた。溶解後、超純水を加えて500mLに調整し、再び攪拌を行った後、溶液が透明にし、8%PFA in 超純水を得た。得られた8%PFA in 超純水を使用時まで氷冷して保存した。
8%PFA in 超純水と、0.2M PBを等量混合することにより、4%PFA in 0.1M PBを得た。4%PFA in 0.1M PBは用時調整して用いた。
(ii)PBS/0.1%TritonX-100
10%TritonXを、上記実施例1の1)にて用いたPBSで100倍希釈して、0.1%TritonX-100を作製した。。
(iii)normal goat serum (フナコシ, VEC S-1000)
(iv)一次抗体溶液
マウス抗MAP2抗体(SIGMA, M4403)またはウサギ抗GFAP抗体(SIGMA, G9269)をそれぞれ、3% normal goat serumを含むPBS/0.1%TritonX-100にて1500倍あるいは500倍に希釈した。
(v)二次抗体溶液
Alexa 488標識化抗マウスIgG抗体(Invitrogen, T20912)またはAlexa594標識化抗ウサギIgG抗体(Invitrogen, A31631)をそれぞれ、PBSにて1000倍あるいは500倍に希釈した。
(vi)ヘキスト溶液
Hoechest33342(SIGMA)をPBSにて1000倍に希釈した。
【0047】
実施例1の1)にて8日間培養した細胞を、PBSにて洗浄した。洗浄後、細胞を4%PFA in 0.1M PBにて15分間処理した。その後、PBSで3回洗浄した。さらに洗浄後の細胞を、PBS / 0.1% TritonX-100にて15分間処理を行い、PBSで3回洗浄した。その後、10% normal goat serumを含むPBS / 0.1%TritonX-100にて1時間処理を行った。一次抗体溶液を添加して、4℃にて16時間処理を行い、PBSで1回洗浄した。さらに、二次抗体溶液を添加して、4℃にて16時間処理を行い、PBSで2回洗浄した。ヘキスト溶液にて、室温にて10分間処理を行った。処理後、0.1M PBにて細胞を洗浄した後、0.1M PBを添加し、観察を行った。観察は、共焦点レーザー顕微鏡(LSM710、Carl Zeiss)を用いて行った。
【0048】
結果を図3〜6に示す。図3は、Hoechst33342により細胞を染色した写真であり、生細胞を可視化したものである。図4は、抗MAP抗体により細胞を染色した写真であり、神経細胞を可視化したものである。図5は、抗GFAP抗体により細胞を染色した写真であり、アストロサイトを可視化したものである。図6は、図3〜図5を重ね合わせたものである。培地に細胞増殖因子であるEGFとFGFを添加することにより、多数の突起を持ったアストロサイト数の顕著な増加が認められた。観察した結果、アストロサイトと神経細胞は単一細胞で存在し、培地中において偏らずに混在していることがわかった。
【0049】
(実施例2)共培養系におけるアストロサイト特異的な遺伝子の導入
共培養系においてアデノウイルスを用いて感染させることで、アストロサイト特異的に遺伝子を導入し、その後免疫染色を行い細胞を観察した。神経幹細胞を含む試料の調製と神経幹細胞の培養と免疫染色は、実施例1の方法と同様にして行った。実施例1に記載されていない試薬についてまず以下に説明し、その後手法について説明する。
(i)緑色蛍光タンパク質(GFP)過剰発現用アデノウイルス(AdV-GFP)感染溶液
AdV-GFPは、理化学研究所バイオリソースセンターよりAx1 CA gfp(RDB#1727)として購入した。500μLの10%HM/DMEMにAdV-GFP (109 pfu/ml)を10μl 加えてAdV-GFP感染溶液を用いた。
(ii)一次抗体溶液
ウサギ抗MAP2抗体(Abcam, ab32454)あるいはウサギ抗GFAP抗体(SIGMA, G9269)をそれぞれ、3% normal goat serumを含むPBS / 0.1%TritonX-100にて1000倍あるいは500倍に希釈した。
(iii)二次抗体溶液
Alexa 594標識化抗ウサギIgG抗体をPBSにて1000倍に希釈した。
【0050】
実施例1の1)と同様の方法により神経幹細胞を分散した試料を調製し、神経幹細胞を培養した。培養8日目に、培地をAdV-GFP感染溶液に置換し、その後5%CO2気相下、37℃で4日間培養を行った。その後、一次抗体溶液と二次抗体溶液を上記のものを用いた以外は実施例1の手法と同様にして免疫染色を行い、細胞の観察を行った。
【0051】
結果を図8〜11に示す。図8は、抗MAP2抗体により細胞を染色した写真であり、図9はその拡大図である。図10は、抗GFAP抗体により細胞を染色した写真であり、図11はその拡大図である。図8および図10における写真中のバーは、100μmの大きさを示しており、図9および図11における写真中のバーは、10μmの大きさを示す。EGFとFGF存在下での培養した細胞に、アデノウイルス(AdV)を用いてGFPを感染させると、GFAP陽性を示すアストロサイト選択的にGFPが発現し、MAP2陽性の神経細胞にはGFPが全く発現しなかった。AdV-GFPを感染させて免疫染色した画像において、30個のGFP陽性細胞のうち、MAP2もしくはGFAPに陽性な細胞の数を計測したところ、MAP2に陽性な細胞の数は0個であり、GFAPに陽性な細胞の数は30個全てであった。従って、実施例1の手法により構築された共培養系においてアストロサイト特異的に外来遺伝子を導入することが可能であることがわかった。
【産業上の利用可能性】
【0052】
本発明によれば、生体の脳に近い条件下で、神経細胞とグリア細胞とを共培養することが可能となる。グリア細胞のうちアストロサイトは近年、単なる神経細胞の支持細胞として捉えられるのではなく、神経情報伝達や各種神経疾患の病態生理に深く、積極的に関与することが分かってきた。本発明における共培養系を用いれば、遺伝学的に同定された各種神経疾患の原因遺伝子を、アデノウイルスを用いてアストロサイト選択的に導入して、アストロサイト機能変動に伴う神経細胞の機能解析を行うことが可能である。また本発明の共培養系によれば、神経細胞とアストロサイトの共存条件下で、注目する遺伝子をアストロサイトのみで簡便に欠損させることができ、神経細胞とアストロサイト間の連関を解析することが可能となる。また、本発明により難治性疾患患者から共培養系を構築することにより、神経細胞とアストロサイト間の連関異常に起因する種々の中枢神経系疾患の発症メカニズム解明と、その後の創薬戦略展開に大きく貢献することが可能になると期待される。
【特許請求の範囲】
【請求項1】
以下の工程を含む、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法:
1)単一個体から採取された組織を用いて、神経幹細胞の分散した試料を調製する工程;
2)神経幹細胞の分散した試料を培地に添加し、神経幹細胞を細胞増殖因子を含む培地にて培養する工程;および、
3)同一容器内で、神経幹細胞から分化誘導された神経細胞およびグリア細胞を培養する工程。
【請求項2】
細胞増殖因子がEGFおよびFGFを含む、請求項1に記載の共培養方法。
【請求項3】
グリア細胞がアストロサイトである、請求項1または2に記載の共培養方法。
【請求項4】
アストロサイトがタイプIIアストロサイトを含む、請求項3に記載の共培養方法。
【請求項5】
培養が接着培養法により行われる、請求項1〜4のいずれか1に記載の共培養方法。
【請求項6】
神経幹細胞が、マウスの脳組織から採取されたものである、請求項1〜5のいずれか1に記載の共培養方法。
【請求項7】
請求項1〜6のいずれか1に記載の共培養方法により得られる、神経細胞とグリア細胞を含む組成物。
【請求項8】
請求項7に記載の組成物を用いて、神経細胞および/またはグリア細胞の機能を解析する方法。
【請求項9】
アデノウイルスを用いて、グリア細胞の内在遺伝子に変異を導入する、および/または、グリア細胞に外来遺伝子を導入することを含む、請求項8に記載の神経細胞および/またはグリア細胞の機能を解析する方法。
【請求項1】
以下の工程を含む、単一個体由来の神経幹細胞から分化誘導された神経細胞とグリア細胞とを共培養する方法:
1)単一個体から採取された組織を用いて、神経幹細胞の分散した試料を調製する工程;
2)神経幹細胞の分散した試料を培地に添加し、神経幹細胞を細胞増殖因子を含む培地にて培養する工程;および、
3)同一容器内で、神経幹細胞から分化誘導された神経細胞およびグリア細胞を培養する工程。
【請求項2】
細胞増殖因子がEGFおよびFGFを含む、請求項1に記載の共培養方法。
【請求項3】
グリア細胞がアストロサイトである、請求項1または2に記載の共培養方法。
【請求項4】
アストロサイトがタイプIIアストロサイトを含む、請求項3に記載の共培養方法。
【請求項5】
培養が接着培養法により行われる、請求項1〜4のいずれか1に記載の共培養方法。
【請求項6】
神経幹細胞が、マウスの脳組織から採取されたものである、請求項1〜5のいずれか1に記載の共培養方法。
【請求項7】
請求項1〜6のいずれか1に記載の共培養方法により得られる、神経細胞とグリア細胞を含む組成物。
【請求項8】
請求項7に記載の組成物を用いて、神経細胞および/またはグリア細胞の機能を解析する方法。
【請求項9】
アデノウイルスを用いて、グリア細胞の内在遺伝子に変異を導入する、および/または、グリア細胞に外来遺伝子を導入することを含む、請求項8に記載の神経細胞および/またはグリア細胞の機能を解析する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2013−17434(P2013−17434A)
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願番号】特願2011−154155(P2011−154155)
【出願日】平成23年7月12日(2011.7.12)
【出願人】(504160781)国立大学法人金沢大学 (282)
【Fターム(参考)】
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願日】平成23年7月12日(2011.7.12)
【出願人】(504160781)国立大学法人金沢大学 (282)
【Fターム(参考)】
[ Back to top ]

