血液分析装置
【課題】 蛍光標識抗体を用いることなく、リンパ芽球を検出することが可能な血液分析装置を提供する。
【解決手段】
血液分析装置1は、試料調製部22において、溶血剤と蛍光染色色素とを含有する第1試薬と血液検体とを混合してL−Blast測定試料を調製し、この測定試料を検出部23によって測定し、検出部23から出力される測定データを情報処理ユニット5において処理することにより、リンパ芽球を含む血球群を検出し、この血球群に含まれる血球を計数する。情報処理ユニット2は、この計数結果に基づいてリンパ芽球の有無を判断し、リンパ芽球の有無の情報を含む分析結果画面を出力する。
【解決手段】
血液分析装置1は、試料調製部22において、溶血剤と蛍光染色色素とを含有する第1試薬と血液検体とを混合してL−Blast測定試料を調製し、この測定試料を検出部23によって測定し、検出部23から出力される測定データを情報処理ユニット5において処理することにより、リンパ芽球を含む血球群を検出し、この血球群に含まれる血球を計数する。情報処理ユニット2は、この計数結果に基づいてリンパ芽球の有無を判断し、リンパ芽球の有無の情報を含む分析結果画面を出力する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血液検体を光学的に測定し、血液検体に含まれる細胞群を複数に分類する血液分析装置に関する。
【背景技術】
【0002】
末梢血液の血漿中には、赤血球、血小板、及び白血球が浮遊している。これらの細胞を検査する血液検査によれば、多くの臨床情報を提供することができるため、多数の検体が検査されている。血液検査には血球計数装置が用いられており、これにより血液中の赤血球数、血小板数、白血球数、ヘモグロビン濃度等が自動的に測定される。
【0003】
正常な末梢血液中にはリンパ球、単球、好塩基球、好酸球、及び好中球の5種類の白血球が存在し、多くの血球計数装置は血液検体中の白血球をかかる5つの種類に分類する機能を有している。一方、造血器腫瘍等の疾患においては、正常な血液中には存在しない細胞が出現する。例えば、急性リンパ性白血病(ALL)では、末梢血液中に多数のリンパ芽球が出現する。このため、末梢血液中のリンパ芽球の検出は、急性リンパ性白血病の診断を行う上で極めて有用である。
【0004】
特許文献1には、1)血液試料中の赤血球を測定の障害とならない程度に溶解し、正常又は異常細胞を染色に好適な状態にする溶血剤と混合する工程と、2)前記1)で調製した試料と、特定の構造式で表される細胞中のRNAに特異的に結合し蛍光強度を増加する色素と混合することにより血液試料中の有核細胞を蛍光染色する工程と、3)前記2)で調製した測定試料をフローサイトメータで測定し、散乱光及び蛍光を測定する工程、4)前記3)で測定した散乱光と蛍光の強度さを用いて正常な白血球を少なくとも5つに分類計数する工程と、からなる白血球分類方法が開示されている。この特許文献1には、異型リンパ球を正常白血球と明確に分離し、分類計数することが開示されている。
【0005】
特許文献2には、所定の細胞マーカーに対する抗体を使用して、骨髄球系細胞及びBリンパ球系細胞の文化成熟段階を分類する血液細胞の分類方法が開示されている。かかる特許文献2には、側方散乱光と、蛍光標識CD45抗体とを用いて、リンパ芽球を分類することが開示されている。
【0006】
特許文献3には、細胞核、特にDNAに対して特異性を有する色素あるいはRNAに特異性を有する色素により細胞を染色し、このようにして調製された試料をフローサイトメータに導入し、試料中の染色された細胞のそれぞれについて、散乱光と蛍光を測定し、散乱光ピークの強度差と散乱光幅の差を用いて、血小板凝集及び同時通過細胞と白血球とを分類し、分類された成分の散乱光の強度差と蛍光の強度差を用いて、成熟白血球、DNA量異常白血球及び幼若白血球に分類計数する白血球の分類計数方法が開示されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平10−319010号公報
【特許文献2】特開2007−263958号公報
【特許文献3】国際公開第WO2004/001408号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、上記特許文献1に開示されている白血球分類方法にあっては、異型リンパ球を正常白血球と分類し、計数することはできるが、リンパ芽球を検出することはできない。
【0009】
また、上記特許文献2に開示されている血球細胞の分類方法にあっては、高価な蛍光標識抗体を測定に使用する必要があり、測定コストが嵩むという問題がある。
【0010】
また、上記特許文献3に開示されている白血球の分類計数方法にあっては、リンパ芽球を含むDNA量異常白血球を分類計数することが可能であるが、DNA量異常白血球にはリンパ芽球以外の細胞も含まれるため、リンパ芽球が存在するか否かを正確に検出することはできない。
【0011】
本発明は斯かる事情に鑑みてなされたものであり、その主たる目的は、高価な蛍光標識抗体を用いることなく、リンパ芽球を検出することが可能な血液分析装置を提供することにある。
【課題を解決するための手段】
【0012】
上述した課題を解決するために、本発明の一の態様の血液分析装置は、血液検体を供給する血液検体供給部と、前記血液検体供給部から供給された血液検体と、核酸を染色する蛍光色素とを混合して測定試料を調製する試料調製部と、前記測定試料に光を照射する光源と、前記光が照射された測定試料から発せられる蛍光を受光する光学検出部と、前記光学検出部によって受光された蛍光に基づいて、前記測定試料中に含まれるリンパ芽球及び有核赤血球を含む細胞群を検出する情報処理手段と、前記情報処理手段による検出結果に基づいて、前記血液検体におけるリンパ芽球の出現に関する情報を出力する出力手段と、を備える。
【0013】
この態様においては、前記血液検体供給部が、血液検体から分割された第1血液検体及び第2血液検体を供給するように構成されており、前記試料調製部が、前記第1血液検体と、第1溶血剤及び前記蛍光色素である第1蛍光色素とを混合して第1測定試料を調製し、前記第2血液検体と、前記第1溶血剤とは異なる第2溶血剤及び核酸を染色する第2蛍光色素とを混合して第2測定試料を調製するように構成されており、前記光学検出部が、前記光源が前記第1測定試料に光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記蛍光に応じた第1信号を出力し、前記光源が前記第2測定試料に光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記散乱光及び蛍光に応じた第2信号を出力するように構成されており、前記情報処理手段が、前記光学検出部が出力した前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む前記細胞群を検出し、前記光学検出部が出力した前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を検出するように構成されており、前記出力手段が、前記情報処理手段による前記第1信号に基づく前記リンパ芽球及び有核赤血球を含む細胞群に係る検出結果並びに前記前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果に基づいて、リンパ芽球の出現に関する情報を出力するように構成されていることが好ましい。
【0014】
また、上記態様においては、前記光源が、前記第1測定試料の流れに向けて光を照射するように構成されており、前記光学検出部が、前記光源が前記第1測定試料の流れに光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記第1信号を出力するように構成されており、前記情報処理手段が、前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む細胞群に含まれる細胞を計数するように構成されており、前記出力手段が、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数と、前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果とに基づいて、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されていることが好ましい。
【0015】
また、上記態様においては、前記光源が、前記第2測定試料の流れに向けて光を照射するように構成されており、前記光学検出部が、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、前記情報処理手段が、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、前記出力手段が、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数が有核赤血球の数よりも大きい場合に、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されていることが好ましい。
【0016】
また、上記態様においては、前記光源が、前記第2測定試料の流れに向けて光を照射するように構成されており、前記光学検出部が、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、前記情報処理手段が、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、前記出力手段が、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数から、有核赤血球の数を差し引いた数が所定値よりも大きい場合に、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されていることが好ましい。
【0017】
また、上記態様においては、前記光源が、前記第1測定試料の流れに向けて光を照射するように構成されており、前記光学検出部が、前記光源が前記第1測定試料の流れに光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記第1信号を出力するように構成されており、前記情報処理手段が、前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む細胞群に含まれる細胞を計数するように構成されており、前記出力手段が、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数と、前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果とに基づいて、前記リンパ芽球の計数結果を出力するように構成されていることが好ましい。
【0018】
また、上記態様においては、前記光源が、前記第2測定試料の流れに向けて光を照射するように構成されており、前記光学検出部が、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、前記情報処理手段が、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、前記出力手段が、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数から、有核赤血球の数を差し引いた数を、前記リンパ芽球の計数結果として出力するように構成されていることが好ましい。
【0019】
また、上記態様においては、前記血液分析装置が、前記血液検体に含まれる有核赤血球に係る検出結果に関する情報を入力するための入力手段をさらに備え、前記出力手段が、前記情報処理手段による検出結果及び前記入力手段に入力された有核赤血球の出現に関する情報に基づいて、リンパ芽球の出現に関する情報を出力するように構成されていることが好ましい。
【0020】
また、上記態様においては、前記情報処理手段が、前記光学検出部によって受光された蛍光に基づいて、測定試料中に含まれるリンパ芽球及び有核赤血球を含む第1細胞群と、前記測定試料中に含まれる骨髄芽球及び幼若顆粒球を含む第2細胞群とを検出するように構成されており、前記出力手段が、前記血液検体における骨髄芽球の出現に関する情報、及び前記血液検体における幼若顆粒球の出現に関する情報をさらに出力するように構成されていることが好ましい。
【0021】
また、上記態様においては、前記情報処理手段が、前記光学検出部によって受光された蛍光に基づいて、前記第1細胞群と、前記第2細胞群と、測定試料中に含まれる成熟白血球を含む第3細胞群とを検出するように構成されており、前記出力手段が、成熟白血球の出現に関する情報を出力するように構成されていることが好ましい。
【0022】
また、上記態様においては、前記光学検出部が、さらに前記光が照射された測定試料から発せられる散乱光を受光するように構成されており、前記情報処理手段が、前記光学検出部によって受光された散乱光及び蛍光に基づいて、前記第2細胞群を、骨髄芽球を含む細胞群と、幼若顆粒球を含む細胞群とにさらに検出するように構成されていることが好ましい。
【0023】
また、上記態様においては、前記情報処理手段が、前記光学検出部によって受光された蛍光に基づいて、前記第1細胞群と、前記第2細胞群と、測定試料中に含まれる成熟白血球を含む第3細胞群とを検出し、前記光学検出部によって受光された散乱光及び蛍光に基づいて、前記第3細胞群を、少なくとも3種類の成熟白血球に分類するように構成されていることが好ましい。
【0024】
また、上記態様においては、前記光学検出部が、前記散乱光として、前記光が照射された測定試料から発せられる前方散乱光又は側方散乱光を受光するように構成されていることが好ましい。
【発明の効果】
【0025】
本発明に係る血液分析装置によれば、蛍光標識抗体を用いることなく、リンパ芽球を検出することが可能となる。
【図面の簡単な説明】
【0026】
【図1】実施の形態に係る血液分析装置の外観を示す斜視図。
【図2】検体容器の外観を示す斜視図。
【図3】サンプルラックの外観を示す斜視図。
【図4】実施の形態に係る測定ユニットの構成を示すブロック図。
【図5】光学検出器の概要構成を示す模式図。
【図6】実施の形態に係る検体搬送ユニットの構成を示す平面図。
【図7】検体搬送ユニットの第1ベルトの構成を示す正面図。
【図8】検体搬送ユニットの第2ベルトの構成を示す正面図。
【図9】実施の形態に係る情報処理ユニットの構成を示すブロック図。
【図10】実施の形態に係る血液分析装置の第1測定工程での動作手順を示すフローチャート。
【図11】実施の形態に係る血液分析装置の第2測定工程での動作手順を示すフローチャート。
【図12】実施の形態に係る血液分析装置のデータ処理工程での処理手順を示すフローチャート。
【図13A】第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図13B】第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図14】第2測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図15A】実施の形態に係る血液分析装置の分析結果画面の一例を示す図。
【図15B】実施の形態に係る血液分析装置の分析結果画面の他の例を示す図。
【図15C】実施の形態に係る血液分析装置の分析結果画面のさらに他の例を示す図。
【図16A】リンパ芽球を含むが有核赤血球を含まない血液検体の第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図16B】リンパ芽球を含むが有核赤血球を含まない血液検体の第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図17】リンパ芽球を含むが有核赤血球を含まない血液検体の第2測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図18A】有核赤血球を含むがリンパ芽球を含まない血液検体の第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図18B】有核赤血球を含むがリンパ芽球を含まない血液検体の第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図19】有核赤血球を含むがリンパ芽球を含まない血液検体の第2測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【発明を実施するための形態】
【0027】
以下、本発明の好ましい実施の形態を、図面を参照しながら説明する。
【0028】
本実施の形態は、血液検体と、核酸を染色する蛍光色素とを混合して測定試料を調製し、前記測定試料を光学式フローサイトメータにより測定することにより、前記血液検体中におけるリンパ芽球を検出する血液分析装置である。
【0029】
[血液分析装置の構成]
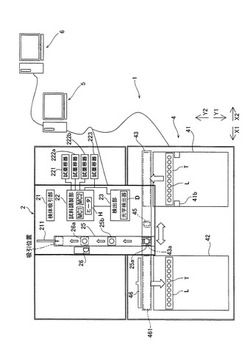
図1は、本実施の形態に係る血液分析装置の外観を示す斜視図である。本実施の形態に係る血液分析装置1は、血液検体に含まれる血球を白血球、赤血球、血小板等を検出し、各血球を計数する多項目血球分析装置である。図1に示すように、血液分析装置1は、測定ユニット2と、測定ユニット2の前面側に配置された検体搬送ユニット4と、測定ユニット2及び検体搬送ユニット4を制御可能な情報処理ユニット5とを備えている。
【0030】
図2は、検体を収容する検体容器の外観を示す斜視図であり、図3は、複数の検体容器を保持するサンプルラックの外観を示す斜視図である。図2に示すように、検体容器Tは、管状をなしており、上端が開口している。内部には患者から採取された血液検体が収容され、上端の開口は蓋部CPにより密封されている。検体容器Tは、透光性を有するガラス又は合成樹脂により構成されており、内部の血液検体が視認可能となっている。また、検体容器Tの側面には、バーコードラベルBL1が貼付されている。このバーコードラベルBL1には、検体IDを示すバーコードが印刷されている。サンプルラックLは、10本の検体容器Tを並べて保持することが可能である。サンプルラックLでは、各検体容器Tが垂直状態(立位状態)で保持される。また、サンプルラックLの側面には、バーコードラベルBL2が貼付されている。このバーコードラベルBL2には、ラックIDを示すバーコードが印刷されている。
【0031】
<測定ユニットの構成>
次に、測定ユニットの構成について説明する。図4は、測定ユニットの構成を示すブロック図である。図4に示すように、測定ユニット2は、検体である血液を検体容器(採血管)Tから吸引する検体吸引部21と、検体吸引部21により吸引した血液から測定に用いられる測定試料を調製する試料調製部22と、試料調製部22により調製された測定試料から血球を検出する検出部23とを有している。また、測定ユニット2は、検体搬送ユニット4のラック搬送部43によって搬送されたサンプルラックLに収容された検体容器Tを測定ユニット2の内部に取り込むための取込口(図1参照)と、サンプルラックLから検体容器Tを測定ユニット2の内部に取り込み、検体吸引部21による吸引位置まで検体容器Tを搬送する検体容器搬送部25とをさらに有している。
【0032】
図4に示すように、検体吸引部21は、吸引管211を有している。また、検体吸引部21はシリンジポンプ(図示せず)を備えている。また、吸引管211は、鉛直方向に移動可能であり、下方に移動されることにより、吸引位置まで搬送された検体容器Tの蓋部CPを前記吸引管が貫通し、内部の血液を吸引するように構成されている。
【0033】
試料調製部22は、第1混合チャンバMC1及び第2混合チャンバMC2を備えている。吸引管211は、シリンジポンプ(図示せず)によって検体容器Tから所定量の全血検体を吸引し、吸引された検体は、第1混合チャンバMC1と第2混合チャンバMC2の位置へ移送され、前記シリンジポンプによって、それぞれのチャンバMC1,MC2へ所定量の全血検体を分配供給する。また、試料調製部22は、第1混合チャンバMC1及び第2混合チャンバMC2を加温するためのヒータHを備えている。
【0034】
試料調製部22は、第1試薬を収容する試薬容器221、第2試薬を収容する試薬容器222a、第3試薬を収容する試薬容器222b、及びシース液(希釈液)を収容する試薬容器223にチューブを介して接続されている。また、試料調製部22は、図示しないコンプレッサに接続されており、当該コンプレッサにより発生される圧力により試薬容器221,222a,222b,223からそれぞれの試薬を分取することが可能となっている。
【0035】
第1試薬は、リンパ芽球と有核赤血球とからなる血球群(以下、「リンパ芽球/有核赤血球群」という)を検出するための試薬である。かかる第1試薬には、溶血剤及び蛍光色素が含有されている。第1試薬に含まれる溶血剤としては、白血球の測定に使用される公知の溶血剤が使用できる。この溶血剤を使用することで、赤血球及び成熟白血球の細胞膜に損傷を与え、損傷した血球を収縮できる。より具体的には、溶血剤には、赤血球及び成熟白血球の細胞膜に損傷を与える界面活性剤と、損傷した血球を収縮させる可溶化剤が含まれている。
【0036】
ここで、溶血剤に含まれる界面活性剤としては、非イオン性界面活性剤が好ましい。非イオン性界面活性剤としては、ポリオキシエチレン系ノニオン界面活性剤が好ましい。具体的なポリオキシエチレン系ノニオン界面活性剤としては、以下の構造式(I)
R1−R2−(CH2CH2O)n−H
(I)
(式中、R1は炭素数9〜25のアルキル基、アルケニル基又はアルキニル基であり、R2は−O−、−COO−又は
【化1】

であり、nは10〜40の整数である)
で示されるものが挙げられる。
【0037】
上記の構造式(I)で表される具体的な界面活性剤としては、ポリオキシエチレン(15)オレイルエーテル、ポリオキシエチレン(15)セチルエーテル、ポリオキシエチレン(16)オレイルエーテル、ポリオキシエチレン(20)オレイルエーテル、ポリオキシエチレン(20)ラウリルエーテル、ポリオキシエチレン(20)ステアリルエーテル、ポリオキシエチレン(20)セチルエーテルなど挙げられ、ポリオキシエチレン(20)オレイルエーテルが好ましい。なお、溶血剤は、界面活性剤を1種類又は2種類以上含むことができる。
【0038】
第1試薬に含まれる界面活性剤の濃度は、界面活性剤の種類又は溶血剤の浸透圧等に応じて適宜選択できる。例えば、界面活性剤がポリオキシエチレンオレイルエーテルである場合、第1試薬に含まれる界面活性剤の濃度は、0.5〜50.0g/Lであり、好ましくは1.0〜20.0g/Lである。
【0039】
溶血剤に含まれる可溶化剤としては、サルコシン誘導体、コール酸誘導体、メチルグルカンアミド、n−オクチルβ−グルコシド、シュークロースモノカプレート、N−ホルミルメチルロイシルアラニンなどが挙げられ、特にサルコシン誘導体が好ましい。なお、溶血剤は、可溶化剤を1種類又は2種類以上含むことができる。
【0040】
サルコシン誘導体としては、以下の構造式(II)
【化2】

(式中、R1はC10−22のアルキル基であり、nは1〜5である。)
で示される化合物及びその塩が挙げられる。具体的なサルコシン誘導体としては、N−ラウロイルサルコシン酸ナトリウム、ラウロイルメチルβ−アラニンナトリウム、ラウロイルサルコシンなどが挙げられ、特にN−ラウロイルサルコシン酸ナトリウムが好ましい。
【0041】
コール酸誘導体としては、以下の構造式(III)
【化3】

(式中、R1は水素原子又は水酸基である。)
で示される化合物及びその塩が挙げられる。具体的なコール酸誘導体としては、CHAPS(3−[(3−コールアミドプロピル)ジメチルアンモニオ]−1−プロパンスルホネート)、CHAPSO([(3−コールアミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホネート)などが挙げられる。
【0042】
メチルグルカンアミドとしては、以下の構造式(IV)
【化4】

(式中、nは5〜7である。)
で示される化合物が挙げられる。具体的なメチルグルカンアミドとしては、MEGA8(オクタノイル−N−メチルグルカミド)、MEGA9(ノナノイル−N−メチルグルカミド)、MEGA10(デカノイル−N−メチルグルカミド)などが挙げられる。
【0043】
第1試薬に含まれる可溶化剤の濃度は、用いる可溶化剤の種類に応じて適宜選択できる。例えば、可溶化剤としてサルコシン誘導体を用いる場合、第1試薬に含まれる可溶化剤の濃度は、0.05〜3.0g/Lであり、好ましくは0.1〜1.0g/Lである。コール酸誘導体を用いる場合、第1試薬に含まれる可溶化剤の濃度は、0.1〜10.0g/Lであり、好ましくは0.2〜2.0g/Lである。メチルグルカンアミドを用いる場合、第1試薬に含まれる可溶化剤の濃度は、1.0〜8.0g/Lであり、好ましくは2.0〜6.0g/Lである。n−オクチルβ−グルコシド、シュークロースモノカプレート、N−ホルミルメチルロイシルアラニンを用いる場合、第1試薬に含まれる可溶化剤の濃度は、0.01〜50.0g/Lであり、好ましくは0.05〜30.0g/Lである。
【0044】
第1試薬に含まれる核酸を染色できる蛍光色素としては、核酸を蛍光染色できるものであれば特に限定されない。このような色素を用いることにより、核酸を持たない赤血球はほとんど染色されず、核酸を有するリンパ芽球及び有核赤血球等の有核の血球は染色される。なお、核酸を染色できる蛍光色素は、光源から照射される光によって適宜選択することができる。具体的な核酸を染色できる蛍光色素としては、例えば、プロピジウムアイオダイド、エチジウムブロマイド、エチジウム−アクリジンヘテロダイマー、エチジウムジアジド、エチジウムホモダイマー−1、エチジウムホモダイマー−2、エチジウムモノアジド、トリメチレンビス[[3‐[[4‐[[(3‐メチルベンゾチアゾール‐3‐イウム)‐2‐イル]メチレン]‐1,4‐ジヒドロキノリン]‐1‐イル]プロピル]ジメチルアミニウム]・テトラヨージド(TOTO−1)、4‐[(3‐メチルベンゾチアゾール‐2(3H)‐イリデン)メチル]‐1‐[3‐(トリメチルアミニオ)プロピル]キノリニウム・ジヨージド(TO−PRO−1)、N,N,N',N'‐テトラメチル‐N,N'‐ビス[3‐[4‐[3‐[(3‐メチルベンゾチアゾール‐3‐イウム)‐2‐イル]‐2‐プロペニリデン]‐1,4‐ジヒドロキノリン‐1‐イル]プロピル]‐1,3‐プロパンジアミニウム・テトラヨージド(TOTO−3)、又は2‐[3‐[[1‐[3‐(トリメチルアミニオ)プロピル]‐1,4‐ジヒドロキノリン]‐4‐イリデン]‐1‐プロペニル]‐3‐メチルベンゾチアゾール‐3‐イウム・ジヨージド(TO−PRO−3)、及び以下の構造式(V)〜(XIII)で示される蛍光色素が挙げられる。
【0045】
<構造式(V)>
【化5】

(式中、R1及びR2は、低級アルキル基であり;nは1又は2であり;X−はアニオンであり;Zは硫黄原子、酸素原子、又は低級アルキル基で置換された炭素原子である)。
【0046】
構造式(V)中、低級アルキル基とは炭素数1〜6の直鎖又は分枝のアルキル基である。具体的な低級アルキル基としては、メチル基、エチル基、プロピル基、ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基、ペンチル基、ヘキシル基などが挙げられ、メチル基、エチル基が好ましい。また、Zとしては、硫黄原子が好ましい。X−におけるアニオンは、ハロゲンイオン(フッ素、塩素、臭素又はヨウ素イオン)、ハロゲン化ホウ素イオン(BF4−、BCl4−、BBr4−など)、リン化合物イオン、ハロゲン酸素酸イオン、フルオロ硫酸イオン、メチル硫酸イオン、芳香環ハロゲン或いはハロゲンをもつアルキル基を置換基として有するテトラフェニルホウ素化合物イオンなどが挙げられ、ヨウ素イオンが好ましい。
【0047】
構造式(V)で示されるもののうち、特に好ましい核酸を染色できる蛍光色素は、次の構造式で示されるNK−321である。
【化6】

【0048】
<構造式(VI)>
【化7】

(式中、R1及びR2は、低級アルキル基であり;nは1又は2であり;X−はアニオンである)。
【0049】
構造式(II)における低級アルキル基、並びにX−のアニオンは、構造式(I)と同様である。
【0050】
構造式(VI)で示されるもののうち、特に好ましい核酸を染色できる蛍光色素は、次の構造式により示される。
【化8】

【0051】
<構造式(VII)>
【化9】

(式中、R1は水素原子又は低級アルキル基であり;R2及びR3は水素原子、低級アルキル基又は低級アルコキシ基であり;R4は水素原子、アシル基又は低級アルキル基であり;R5は水素原子又は置換されていてもよい低級アルキル基であり;Zは硫黄原子、酸素原子、又は低級アルキル基で置換された炭素原子であり;nは1又は2であり;X−はアニオンである)。
【0052】
構造式(VII)における低級アルキル基、並びにX−のアニオンは、構造式(V)と同様である。低級アルコキシ基は、炭素数1〜6のアルコキシ基を示す。具体的な低級アルコキシ基としては、メトキシ基、エトキシ基、プロポキシ基等が挙げられ、特にメトキシ基、エトキシ基が好ましい。アシル基としては、脂肪族カルボン酸から誘導されたアシル基が好ましい。具体的なアシル基としては、アセチル基、プロピオニル基等が挙げられ、特にアセチル基が好ましい。置換されていてもよい低級アルキル基の置換基としては、水酸基やハロゲン原子(フッ素、塩素、臭素又はヨウ素)が挙げられる。置換されていてもよい低級アルキル基は、1〜3個の置換基で置換されることができる。置換されていてもよい低級アルキル基としては、特に1個の水酸基で置換された低級アルキル基が好ましい。なお、Zとしては硫黄原子が好ましく、X−は、臭素イオン又はBF4−が好ましい。
【0053】
構造式(VII)で示されるもののうち、特に好ましい核酸を染色できる蛍光色素は、以下の3つの構造式により示される。
【化10】

【0054】
【化11】

【0055】
【化12】

【0056】
<構造式(VIII)>
【化13】

(式中、X1及びX2は、独立してCl又はIである)
【0057】
<構造式(IX)>
【化14】

【0058】
<構造式(X)>(NK−1570)
【化15】

【0059】
<構造式(XI)>(NK−1049)
【化16】

【0060】
<構造式(XII)>(NK−98)
【化17】

【0061】
<構造式(XIII)>(NK−141)。
【化18】

【0062】
上記の核酸を染色できる蛍光色素のうち、第1試薬に含まれる特に好ましい蛍光色素は、次の構造式で示されるNK−321である。
【化19】

【0063】
上記の核酸を染色できる蛍光色素の第1試薬中の濃度は、10〜500mg/Lが好ましく、特に30〜100mg/Lが好ましい。なお、第1試薬は、核酸を染色できる蛍光色素を1種類又は2種類以上含むことができる。
【0064】
第1試薬のpHは、5.0〜9.0が好ましく、より好ましくは6.5〜7.5、さらに好ましくは6.8〜7.3である。第1試薬のpHは、緩衝剤やpH調整剤で調整できる。緩衝剤としては、例えばHEPES、MOPS(3-morpholinopropanesulfonic acid)又はMOPSO(2-Hydroxy-3-morpholinopropanesulfonic
acid)などのグッド緩衝剤、リン酸緩衝剤などが挙げられる。pH調整剤としては、水酸化ナトリウムや塩酸などが挙げられる。
【0065】
第1試薬の浸透圧は、上述の界面活性剤の種類や第1試薬中の濃度に応じて、適宜設定することができる。具体的な第1試薬の浸透圧としては、10〜600mOsm/kgが挙げられる。また、第1試薬の浸透圧は、糖類、アミノ酸、塩化ナトリウムなどを第1試薬に添加することにより調整してもよい。具体的な糖類としては、単糖類、多糖類、糖アルコールなどが挙げられる。単糖類としては、グルコース、フルクトースが好ましい。多糖類としては、アラビノースが好ましい。糖アルコールとしては、キシリトール、ソルビトール、マンニトール、リビトールが好ましい。ここで、第1試薬に添加する糖類としては、糖アルコールが好ましく、特にキシリトールが好ましい。キシリトールを第1試薬に添加する場合、キシリトールの第1試薬中の濃度は、1.0〜75.0g/L、特に20.0〜50.0g/Lが好ましい。具体的なアミノ酸としては、バリン、プロリン、グリシン、アラニンなどが挙げられ、特にグリシン、アラニンが好ましい。グリシンを第1試薬に添加する場合、グリシンの第1試薬中の濃度は、1.0〜50.0g/L、特に10.0〜30.0g/Lが好ましい。
【0066】
また、第1試薬の電気伝導度は、0.01〜3mS/cmが好ましく、特に0.1〜2mS/cmが好ましい。さらに第1試薬には、キレート剤や防腐剤などを添加することもできる。キレート剤としては、EDTA−2K、EDTA−3Naなどが挙げられる。防腐剤としては、Proxel GXL(Avecia社製)、マテリアルTKM−A(株式会社エーピーアイ コーポレーション)などが挙げられる。
【0067】
第2試薬は、有核赤血球(NRBC)測定用の溶血剤である。このNRBC測定用の溶血剤としては、例えばシスメックス(株)製ストマトライザーNR溶血剤が挙げられる。また、第3試薬は、NRBC測定用の染色液である。このNRBC測定用の染色液としては、例えばシスメックス(株)製ストマトライザーNR染色液が挙げられる。第4試薬は、後述するシースフローセルへと供給されるシース液である。かかるシース液は、希釈液としても使用される。このシース液としては、例えばシスメックス(株)製セルパック(II)が挙げられる。
【0068】
検出部23は、WBC測定(白血球計数)及びDIFF測定(白血球分類)を行うことができる光学検出器Dを有している。この光学検出器Dは、WBC(成熟白血球)、NRBC(有核赤血球)、及びリンパ芽球(L−Blast)の検出を、半導体レーザを使用したフローサイトメトリー法により行うことが可能であるように構成されている。また、この検出部23を使用することにより、白血球を、NEUT(好中球)、LYMPH(リンパ球)、EO(好酸球)、BASO(好塩基球)、及びMONO(単球)の5種類に分類することが可能となっている。リンパ芽球/有核赤血球群の測定を行うときには、血液検体と第1試薬とが混合された測定試料(L−Blast測定試料)が光学検出器Dに供給され、NRBCの測定を行うときには、血液検体と第2試薬と第3試薬とが混合された測定試料(NRBC測定試料)が光学検出器Dに供給される。
【0069】
図5は、光学検出器Dの概要構成を示している。この光学検出器Dは、フローセル231に測定試料及びシース液を送り込み、フローセル231中に液流を発生させ、フローセル231内を通過する液流に含まれる血球に半導体レーザ光を照射して測定するものであり、シースフロー系232、ビームスポット形成系233、前方散乱光受光系234、側方散乱光受光系235、側方蛍光受光系236を有している。
【0070】
シースフロー系232は、フローセル231内を測定試料がフローセル231内をシース液に包まれた状態で流すように構成されている。ビームスポット形成系233は、半導体レーザ237から照射された光が、コリメータレンズ238とコンデンサレンズ239とを通って、フローセル231に照射されるよう構成されている。また、ビームスポット形成系233は、ビームストッパ240も備えている。
【0071】
前方散乱光受光系234は、前方への散乱光を前方集光レンズ241によって集光し、ピンホール242を通った光をフォトダイオード(前方散乱光受光部)243で受光するように構成されている。
【0072】
側方散乱光受光系235は、側方への散乱光を側方集光レンズ244にて集光するとともに、一部の光をダイクロイックミラー245で反射させ、フォトダイオード(側方散乱光受光部)246で受光するよう構成されている。
【0073】
光散乱は、光の進行方向に血球のような粒子が光の進行方向に障害物として存在すると、粒子により光がその進行方向を変えることによって生じる現象である。この散乱光を検出することによって、粒子の大きさや材質に関する情報を得ることができる。特に、前方散乱光からは、粒子(血球)の大きさに関する情報を得ることができる。また、側方散乱光からは、粒子内部の情報を得ることができる。血球粒子にレーザ光が照射された場合、側方散乱光強度は細胞内部の複雑さ(核の形状、大きさ、密度や顆粒の量)に依存する。したがって、これら散乱光強度は、リンパ芽球/有核赤血球群の測定、有核赤血球の測定、及び白血球の分類その他の測定に利用することができる。
【0074】
側方蛍光受光系236は、ダイクロイックミラー245を透過した光をさらに分光フィルタ247に通し、アバランシェフォトダイオード(蛍光受光部)248で受光するよう構成されている。
【0075】
蛍光物質により染色された血球に光を照射すると、照射した光の波長より長い波長の光を発する。蛍光の強度はよく染色されていれば強くなり、この蛍光強度を測定することによって血球の染色度合いに関する情報を得ることができる。したがって、(側方)蛍光強度の差は、リンパ芽球/有核赤血球群の測定、有核赤血球の測定、及び白血球の分類その他の測定に利用することができる。
【0076】
次に、図4に戻って、検体容器搬送部25の構成について説明する。検体容器搬送部25は、検体容器Tを把持可能なハンド部25aを備えている。ハンド部25aは、互いに対向して配置された一対の把持部材を備えており、この把持部材を互いに近接及び離反させることが可能である。かかる把持部材を、検体容器Tを挟んだ状態で近接させることにより、検体容器Tを把持することができる。また、検体容器搬送部25は、ハンド部25aを上下方向及び前後方向(Y方向)に移動させることができ、さらに、ハンド部25aを揺動させることができる。これにより、サンプルラックLに収容され、検体供給位置43aに位置した検体容器Tをハンド部25aにより把持し、その状態でハンド部25aを上方に移動させることによりサンプルラックLから検体容器Tを抜き出し、ハンド部25aを揺動させることにより、検体容器T内の検体を撹拌することができる。
【0077】
また、検体容器搬送部25は、検体容器Tを挿入可能な穴部を有する検体容器セット部25bを備えている。上述したハンド部25aによって把持された検体容器Tは、撹拌完了後移動され、把持した検体容器Tを検体容器セット部25bの穴部に挿入する。その後、把持部材を離反させることにより、ハンド部25aから検体容器Tが開放され、検体容器セット部25bに検体容器Tがセットされる。かかる検体容器セット部25bは、図示しないステッピングモータの動力によって、図中Y1及びY2方向へ水平移動可能である。
【0078】
測定ユニット2の内部には、バーコード読取部26が設けられている。検体容器セット部25bは、バーコード読取部26の近傍のバーコード読取位置26a及び検体吸引部21による吸引位置21aへ移動可能である。検体容器セット部25bがバーコード読取位置26aへ移動したときには、セットされた検体容器Tが図示しない回転機構により水平回転され、バーコード読取部26により検体バーコードが読み取られる。これにより、検体容器TのバーコードラベルBL1がバーコード読取部26に対して反対側に位置する場合でも、検体容器Tを回転させることにより、バーコードラベルBL1をバーコード読取部26へ向けることができ、バーコード読取部26に検体バーコードを読み取らせることが可能である。また、検体容器セット部25bが吸引位置へ移動したときには、検体吸引部21により、セットされた検体容器Tから検体が吸引される。
【0079】
<検体搬送ユニットの構成>
次に、検体搬送ユニット4の構成について説明する。図1に示すように、血液分析装置1の測定ユニット2の前方には、検体搬送ユニット4が配置されている。かかる検体搬送ユニット4は、測定ユニット2へ検体を供給するために、サンプルラックLを搬送することが可能である。
【0080】
図6は、検体搬送ユニット4の構成を示す平面図である。図6に示すように、検体搬送ユニット4は、分析が行われる前の検体を収容する検体容器Tを保持する複数のサンプルラックLを保持することが可能な分析前ラック保持部41と、測定ユニット2によって検体が吸引された検体容器Tを保持する複数のサンプルラックLを保持することが可能な分析後ラック保持部42と、検体を測定ユニット2に供給するために、サンプルラックLを図中矢印X1方向又はX2方向へ水平に直線移動させ、分析前ラック保持部41から受け付けたサンプルラックLを分析後ラック保持部42へ搬送するラック搬送部43とを備えている。
【0081】
分析前ラック保持部41は、平面視において四角形をなしており、その幅はサンプルラックLの幅より若干大きくなっている。この分析前ラック保持部41は、周囲の面よりも一段低く形成されており、その上面に分析前のサンプルラックLが載置される。また、分析前ラック保持部41の両側面からは、内側へ向けてラック送込部41bが突出可能に設けられている。このラック送込部41bが突出することによりサンプルラックLと係合し、この状態で後方(ラック搬送部43に近接する方向)へ移動することにより、サンプルラックLが後方へと移送される。かかるラック送込部41bは、分析前ラック保持部41の下方に設けられた図示しないステッピングモータによって駆動可能に構成されている。
【0082】
ラック搬送部43は、図6に示すように、分析前ラック保持部41によって移送されたサンプルラックLを、前記X方向へと移送可能となっている。このラック搬送部43によるサンプルラックLの搬送経路上には、図4に示すように、測定ユニット2へ検体を供給するための検体供給位置43aが存在する。検体搬送ユニット4は情報処理ユニット5によって制御され、検体供給位置43aに検体を搬送する。このとき、測定ユニット2のハンド部25aが搬送された検体容器Tを把持し、サンプルラックLから検体容器Tを取り出すことで検体の供給が完了する。また、測定ユニット2から検体容器TをサンプルラックLに返還する場合には、ラック搬送部43は、検体容器Tが取り込まれたときから搬送を待機するか、他の位置へとサンプルラックLを搬送した後、検体容器Tが測定ユニット2に取り込まれたことにより空きとなった保持位置を検体供給位置43aに位置させるようにサンプルラックLを搬送する。これにより、検体容器Tが挿入されていない保持位置が検体供給位置43aに位置している状態で、ハンド部25aが、確実に検体容器TをサンプルラックLへと戻すことが可能である。
【0083】
また、ラック搬送部43は、図6に示すように、それぞれ独立して動作可能な第1ベルト431及び第2ベルト432の2つのベルトを有している。また、第1ベルト431及び第2ベルト432の矢印Y方向の幅b1,b2は、それぞれサンプルラックLの矢印Y方向の幅Bの半分以下の大きさである。かかる第1ベルト431及び第2ベルト432は、ラック搬送部43がサンプルラックLを搬送するときにサンプルラックLの幅Bからはみ出ないように並列に配置されている。図7は、第1ベルト431の構成を示す正面図であり、図8は、第2ベルト432の構成を示す正面図である。図7及び図8に示すように、第1ベルト431及び第2ベルト432は、それぞれ環状に形成されており、第1ベルト431はローラ431a〜431cを取り囲むように配置され、第2ベルト432はローラ432a〜432cを取り囲むように配置されている。また、第1ベルト431の外周部には、サンプルラックLのX方向の幅Wよりも若干(例えば、1mm)大きい内幅w1を有するように2つの突起片431dが設けられており、同様に、第2ベルト432の外周部には、前記内幅w1と同程度の内幅w2を有するように2つの突起片432dが設けられている。第1ベルト431は、2つの突起片431dの内側にサンプルラックLを保持した状態において、ステッピングモータ(図示せず)によりローラ431a〜431cの外周を移動されることによって、サンプルラックLを矢印X方向に移動するように構成されている。第2ベルト432は、2つの突起片432dの内側にサンプルラックLを保持した状態において、ステッピングモータ(図示せず)によりローラ432a〜432cの外周を移動されることによって、サンプルラックLを矢印X方向に移動するように構成されている。また、第1ベルト431及び第2ベルト432は、互いに独立してサンプルラックLを移送可能に構成されている。
【0084】
図4に示すように、ラック搬送部43の搬送路上に検体容器センサ45が設けられている。検体容器センサ45は、接触型のセンサであり、のれん形状の接触片、光を出射する発光素子、及び受光素子(図示せず)を有している。検体容器センサ45は、接触片が検出対象の被検出物に当接することにより屈曲され、その結果、発光素子から出射された光が接触片により反射されて受光素子に入射するように構成されている。これにより検体容器センサ45の下方をサンプルラックLに収容された検出対象の検体容器Tが通過する際に、接触片が検体容器Tにより屈曲されて、検体容器Tを検出することが可能である。
【0085】
図4に示すように、ラック搬送部43を挟んで後述する分析後ラック保持部42に対向するようにラック送出部46が配置されている。かかるラック送出部46は、図示しないステッピングモータの駆動力により矢印Y方向に水平に直線移動するように構成されている。これにより、分析後ラック保持部42とラック送出部46との間の位置461(以下、「分析後ラック送出位置」という。)にサンプルラックLが搬送された場合に、ラック送出部46を分析後ラック保持部42側に移動することによって、サンプルラックLを押動させて分析後ラック保持部42内に移動することが可能である。
【0086】
分析後ラック保持部42は、平面視において四角形をなしており、その幅はサンプルラックLの幅より若干大きくなっている。この分析後ラック保持部42は、周囲の面よりも一段低く形成されており、その上面に分析が完了したサンプルラックLが載置される。分析後ラック保持部42は、上記のラック搬送部43に連なっており、上述したように、ラック送出部46によって、ラック搬送部43からサンプルラックLが送り込まれるようになっている。
【0087】
上記のような構成とすることにより、検体搬送ユニット4は、分析前ラック保持部41に載置されたサンプルラックLをラック搬送部43へと移送し、さらにラック搬送部43によって搬送することにより、検体を測定ユニット2へと供給することができる。また、吸引が完了した検体を収容するサンプルラックLは、ラック搬送部43により、分析後ラック送出位置461へと移送され、ラック送出部46により分析後ラック保持部42へ送出される。複数のサンプルラックLが分析前ラック保持部41に載置された場合では、分析が完了した検体を収容するサンプルラックLが次々にラック送出部46により分析後ラック保持部42へと送出され、これらの複数のサンプルラックLが分析後ラック保持部42に貯留されることとなる。
【0088】
<情報処理ユニットの構成>
次に、情報処理ユニット5の構成について説明する。情報処理ユニット5は、コンピュータにより構成されている。図9は、情報処理ユニット5の構成を示すブロック図である。情報処理ユニット5は、コンピュータ5aによって実現される。図9に示すように、コンピュータ5aは、本体51と、画像表示部52と、入力部53とを備えている。本体51は、CPU51a、ROM51b、RAM51c、ハードディスク51d、読出装置51e、入出力インタフェース51f、通信インタフェース51g、及び画像出力インタフェース51hを備えており、CPU51a、ROM51b、RAM51c、ハードディスク51d、読出装置51e、入出力インタフェース51f、通信インタフェース51g、及び画像出力インタフェース51hは、バス51jによって接続されている。
【0089】
CPU51aは、RAM51cにロードされたコンピュータプログラムを実行することが可能である。そして、後述するような血液分析用並びに測定ユニット2及び検体搬送ユニット4の制御用のコンピュータプログラム54aを当該CPU51aが実行することにより、コンピュータ5aが情報処理ユニット5として機能する。
【0090】
ROM51bは、マスクROM、PROM、EPROM、又はEEPROM等によって構成されており、CPU51aに実行されるコンピュータプログラム及びこれに用いるデータ等が記録されている。
【0091】
RAM51cは、SRAMまたはDRAM等によって構成されている。RAM51cは、ハードディスク51dに記録されているコンピュータプログラム54aの読み出しに用いられる。また、CPU51aがコンピュータプログラムを実行するときに、CPU51aの作業領域として利用される。
【0092】
ハードディスク51dは、オペレーティングシステム及びアプリケーションプログラム等、CPU51aに実行させるための種々のコンピュータプログラム及び当該コンピュータプログラムの実行に用いられるデータがインストールされている。後述するコンピュータプログラム54aも、このハードディスク51dにインストールされている。また、このコンピュータプログラム54aは、イベントドリブン型のコンピュータプログラムである。
【0093】
読出装置51eは、フレキシブルディスクドライブ、CD−ROMドライブ、またはDVD−ROMドライブ等によって構成されており、可搬型記録媒体54に記録されたコンピュータプログラムまたはデータを読み出すことができる。また、可搬型記録媒体54には、コンピュータを情報処理ユニット5として機能させるためのコンピュータプログラム54aが格納されており、コンピュータ5aが当該可搬型記録媒体54からコンピュータプログラム54aを読み出し、当該コンピュータプログラム54aをハードディスク51dにインストールすることが可能である。
【0094】
なお、前記コンピュータプログラム54aは、可搬型記録媒体54によって提供されるのみならず、電気通信回線(有線、無線を問わない)によってコンピュータ5aと通信可能に接続された外部の機器から前記電気通信回線を通じて提供することも可能である。例えば、前記コンピュータプログラム54aがインターネット上のサーバコンピュータのハードディスク内に格納されており、このサーバコンピュータにコンピュータ5aがアクセスして、当該コンピュータプログラムをダウンロードし、これをハードディスク51dにインストールすることも可能である。
【0095】
また、ハードディスク51dには、例えば米マイクロソフト社が製造販売するWindows(登録商標)等のマルチタスクオペレーティングシステムがインストールされている。以下の説明においては、本実施の形態に係るコンピュータプログラム54aは当該オペレーティングシステム上で動作するものとしている。
【0096】
入出力インタフェース51fは、例えばUSB,IEEE1394,又はRS-232C等のシリアルインタフェース、SCSI,IDE,又は IEEE1284等のパラレルインタフェース、及びD/A変換器、A/D変換器等からなるアナログインタフェース等から構成されている。入出力インタフェース51fには、キーボード及びマウスからなる入力部53が接続されており、ユーザが当該入力部53を使用することにより、コンピュータ5aにデータを入力することが可能である。また、入出力インタフェース51fは、測定ユニット2及び検体搬送ユニット4に接続されている。これにより、情報処理ユニット5は、測定ユニット2及び検体搬送ユニット4のそれぞれを制御可能となっている。
【0097】
通信インタフェース51gは、Ethernet(登録商標)インタフェースである。通信インタフェース51gはLANを介してホストコンピュータ6に接続されている(図4参照)。コンピュータ5aは、通信インタフェース51gにより、所定の通信プロトコルを使用して当該LANに接続されたホストコンピュータ6との間でデータの送受信が可能である。
【0098】
画像出力インタフェース51hは、LCDまたはCRT等で構成された画像表示部52に接続されており、CPU51aから与えられた画像データに応じた映像信号を画像表示部52に出力するようになっている。画像表示部52は、入力された映像信号にしたがって、画像(画面)を表示する。
【0099】
[血液分析装置1の測定動作]
以下、本実施の形態に係る血液分析装置1の動作について説明する。
【0100】
<検体測定動作>
まず、本実施の形態に係る血液分析装置1の検体測定動作について説明する。血液分析装置1は、光学検出器Dを用いたリンパ芽球/有核赤血球群測定、NRBC(有核赤血球)測定を実行可能である。かかる測定の工程は、L−Blast測定試料を測定する第1測定工程と、NRBC測定試料を測定する第2測定工程と、第1測定工程及び第2測定工程によって得られた測定データを解析処理するデータ処理工程によって構成される。
【0101】
まず、検体容器Tを保持したサンプルラックLがオペレータによって分析前ラック保持部41に載置される。ラック送込部41bが分析前ラック保持部41に載置されたサンプルラックLに係合し、後方へと搬送され、ラック搬送部43へと送られる。その後、ラック搬送部43によって当該サンプルラックLが搬送され、測定対象の検体が収容されている検体容器Tが検体供給位置43aに位置する。次に、測定ユニット2のハンド部25aにより、当該検体容器Tが把持され、サンプルラックLからこの検体容器Tが取り出される。ハンド部25aはその後揺動運動を行い、検体容器Tの内部の検体が撹拌される。次に、検体容器セット部25bにこの検体容器Tが挿入され、Y方向へと検体容器セット部25bが移動し、バーコード読取部26による検体バーコード読み取りを行った後、吸引位置に到達する。その後、以下の第1測定工程及び第2測定工程が実行される。
【0102】
第1測定工程
まず、第1測定工程について説明する。血液分析装置1は、第1測定工程では、全血検体(19.0μL)と第1試薬(1.02mL)とを混合してL−Blast測定試料を作成し、このL−Blast測定試料を光学検出器Dにてフローサイトメトリー法によって測定する。
【0103】
ここで、第1試薬として、以下に示される試薬を用いた。
<第1試薬>
MOPSO 2.25g/L
ポリオキシエチレン(20)オレイルエーテル 10.0g/L
N−ラウロイルサルコシン酸ナトリウム 0.5g/L
Proxel GXL 0.40g/L
EDTA−2K 0.50g/L
キシリトール 40.22g/L
NK−321 1.0mg/L
pH: 7.0
浸透圧: 300mOsm/Kg
電気伝導度: 0.745mS/cm
【0104】
なお、全血検体として以下に示される3つの検体を用いた。
【表1】

表1中、「○」は対象の血球(リンパ芽球又は有核赤血球)が存在することを示し、「×」は対象の血球が存在しないことを示す。
【0105】
図10は、第1測定工程での血液分析装置1の動作手順を示すフローチャートである。まず、CPU51aは、検体吸引部21を制御して、吸引管211により検体容器Tの全血検体を定量吸引する(ステップS101)。ステップS101の処理は、具体的には、吸引管211が検体容器Tの中に挿入され、シリンジポンプの駆動によって、全血検体が定量(39.0μL)吸引される。
【0106】
次に、CPU51aが測定ユニット2を制御することにより、試薬容器221から第1試薬(1.02mL)が、吸引管211から全血検体(19.0μL)が第1混合チャンバMC1にそれぞれ供給される(ステップS102)。CPU51aは、第1混合チャンバMC1への第1試薬及び全血検体の供給から18.5秒間経過したか否かを判定し(ステップS103)、18.5秒間待機する。ここで、ヒータにより第1混合チャンバMC1は35.0℃に加温されており、これにより、第1試薬と血液検体との混合液が35.0℃で18.5秒加温され、L−Blast測定試料が調製される。
【0107】
そして、L−Blast測定試料を対象に光学検出器Dにて光学測定が行われる(ステップS104)。ステップS104の処理においては、具体的には、L−Blast測定試料とシース液とが同時に光学検出器Dのフローセル231に供給され、そのときの前方散乱光がフォトダイオード243で受光され、側方散乱光がフォトダイオード246で受光され、アバランシェフォトダイオード248で受光される。このような光学検出器Dの各受光素子により出力される出力信号(アナログ信号)は図示しないA/D変換器によりデジタル信号に変換され、図示しない信号処理回路により所定の信号処理が施されてデジタルデータである第1測定データに変換され、情報処理ユニット5にこの第1測定データが送信される。この信号処理においては、第1測定データに含まれる特徴パラメータとして、前方散乱光信号(前方散乱光強度)、側方散乱光信号(側方散乱光強度)、及び側方蛍光信号(側方蛍光強度)が得られる。これにより、第1測定工程が終了する。また、後述するように、情報処理ユニット5のCPU51aは、第1測定データに対して所定の解析処理を実行することにより、NEUT、LYMPH、EO、BASO、MONO、及びWBC等の数値データを含む分析結果データを生成し、ハードディスク51dに分析結果データを記憶する。
【0108】
第2測定工程
次に、第2測定工程について説明する。この第2測定工程は、第1測定工程と時間的に一部重複して実行される。血液分析装置1は、第2測定工程では、全血検体(17.0μL)と第2試薬(1.0mL)と第3試薬(0.030mL)とを混合してNRBC測定試料を作成し、このNRBC測定試料を光学検出器Dにてフローサイトメトリー法によって測定する。ここで第2試薬としては、上述のストマトライザーNR溶血剤を使用し、第3試薬としては、上述のストマトライザーNR染色液を用いた。
【0109】
図11は、第2測定工程での血液分析装置1の動作手順を示すフローチャートである。CPU51aは測定ユニット2を制御することにより、試薬容器222aから第2試薬(1.0mL)を、試薬容器222bから第3試薬(0.030mL)を、吸引管211から全血検体(17.0μL)を第2混合チャンバMC2にそれぞれ供給する(ステップS201)。このステップS201において第2混合チャンバMC2に供給される検体は、上述したステップS101において吸引管211により吸引された全血検体の一部である。つまり、ステップS101においては、第1混合チャンバMC1に供給する検体と、第2混合チャンバMC2に供給される検体とが一度に検体容器Tから吸引される。
【0110】
次に、CPU51aは、第2混合チャンバMC2への第2試薬、第3試薬及び全血検体の供給から7.0秒間経過したか否かを判定し(ステップS202)、7.0秒間待機する。ここで、ヒータにより第2混合チャンバMC2は41.0℃に加温されており、これにより、第2試薬と第3試薬と血液検体との混合液が41.0℃で7.0秒加温され、NRBC測定試料が調製される。
【0111】
そして、NRBC測定試料を対象に光学検出器Dにて光学測定が行われる(ステップS203)。ステップS203の処理においては、具体的には、NRBC測定試料とシース液とが同時に光学検出器Dのフローセル231に供給され、そのときの前方散乱光がフォトダイオード243で受光され、側方散乱光がフォトダイオード246で受光され、アバランシェフォトダイオード248で受光される。このような光学検出器Dの各受光素子により出力される出力信号(アナログ信号)は、上述した第1測定工程と同様に、デジタル信号に変換され、所定の信号処理が施されてデジタルデータである第2測定データに変換され、情報処理ユニット5にこの第2測定データが送信される。この信号処理においては、第2測定データに含まれる特徴パラメータとして、前方散乱光信号(前方散乱光強度)、側方散乱光信号(側方散乱光強度)、及び側方蛍光信号の(側方蛍光強度)が得られる。これにより、第2測定工程が終了する。また、後述するように、情報処理ユニット5のCPU51aは、第2測定データに対して所定の解析処理を実行することにより、NRBCの数値データを含む分析結果データを生成し、ハードディスク51dに分析結果データを記憶する。
【0112】
データ処理工程
次に、データ処理工程について説明する。図12は、データ処理工程での血液分析装置1の処理手順を示すフローチャートである。血液分析装置1の情報処理ユニット5は、測定ユニット2から測定データを受信する(ステップS301)。ここで、受信された測定データには第1測定データ及び第2測定データが含まれる。CPU51aによって実行されるコンピュータプログラム54aはイベントドリブン型のプログラムであり、測定データを受信するイベントが発生すると、ステップS302の処理が呼び出される。
【0113】
ステップS302において、CPU51aは、第1測定データを用いてリンパ芽球/有核赤血球群と他の血球群とを分類し、リンパ芽球/有核赤血球群に含まれる血球数を計数する(ステップS302)。かかる処理について詳しく説明する。図13Aは、第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラム(粒度分布図)であり、図13Bは、第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラムである。
【0114】
図13Aに示す第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラムでは、骨髄芽球のクラスター、幼若顆粒球のクラスター、好塩基球のクラスター、好中球と好酸球とによってなる血球群のクラスター、リンパ球のクラスター、単球のクラスター、及びリンパ芽球/有核赤血球群のクラスターが現れる。また、図13Bに示す第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラムでは、幼若顆粒球と骨髄芽球とからなる血球群のクラスターと、顆粒球(好中球と好酸球と好塩基球とからなる血球群)のクラスター、単球のクラスター、リンパ球のクラスター、及びリンパ芽球/有核赤血球群のクラスターが現れる。これらのスキャッタグラムに示されるように、第1測定データの蛍光強度を利用することによって、リンパ芽球/有核赤血球群のクラスターを、他のクラスターから弁別することができる。ステップS302の処理においては、CPU51aは、第1測定データの側方散乱光強度及び蛍光強度を用いて、リンパ芽球/有核赤血球群を他のクラスターと弁別し、これによってリンパ芽球/有核赤血球群を検出する。さらに、CPU51aは、検出されたリンパ芽球/有核赤血球群に含まれる血球の数を計数する。
【0115】
次にステップS303において、CPU51aは、第2測定データを用いて有核赤血球群と他の血球群とを分類し、有核赤血球の数を計数する(ステップS303)。かかる処理について詳しく説明する。図14は、第2測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラムである。図14に示す第2測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラムでは、有核赤血球のクラスター、白血球のクラスター、及び赤血球ゴーストのクラスターが現れる。このスキャッタグラムに示されるように、第2測定データの前方散乱光強度及び側方蛍光強度を利用することにより、有核赤血球のクラスターを、他のクラスターから弁別することができる。ステップS303の処理においては、CPU51aは、第2測定データの前方散乱光強度及び蛍光強度を用いて、有核赤血球を他のクラスターから弁別し、これによって有核赤血球を検出する。さらに、CPU51aは、検出された有核赤血球の数を計数する。
【0116】
次にステップS304において、CPU51aは、ステップS302において取得したリンパ芽球/有核赤血球群に含まれる血球数NLと、ステップS303において取得した有核赤血球数NNとの差が、所定の基準値T以上であるか否かを判定する(ステップS304)。ここで、基準値Tは、NL−NNの値がこの基準値T以上の場合には、血液検体にリンパ芽球が含まれていると考えることができ、NL−NNの値が基準値T未満の場合には、血液検体にリンパ芽球が含まれていないと考えることができるものとして、リンパ芽球/有核赤血球群に含まれる血球数NL及び有核赤血球数NNの誤差を勘案して予め設定される。したがって、この処理においてNL−NN≧Tである場合は(ステップS304においてYES)、血液検体中にリンパ芽球が含まれていると判断することができる。よってこの場合には、CPU51aは、RAM51cに設けられたリンパ芽球フラグに「1」をセットする(ステップS305)。ここで、リンパ芽球フラグは血液検体におけるリンパ芽球の有無を示すフラグであり、「1」がセットされている場合にはリンパ芽球が存在していることを示し、「0」がセットされている場合にはリンパ芽球が存在していないことを示す。その後、CPU51aは、ステップS307へ処理を移す。
【0117】
一方、ステップS304においてNL−NN<Tである場合は(ステップS304においてNO)、血液検体中にリンパ芽球が含まれていないと判断することができる。よってこの場合には、CPU51aは、リンパ芽球フラグに「0」をセットする(ステップS306)。その後、CPU51aは、ステップS307へ処理を移す。
【0118】
ステップS307において、CPU51aは、上述のようにして得た分析結果(有核赤血球数、及びリンパ芽球フラグを含む)をハードディスク51dに格納する(ステップS307)。次にCPU51aは、ハードディスク51dに記憶した分析結果を示す分析結果画面を画像表示部52に表示させ(ステップS308)、処理を終了する。
【0119】
図15A、図15B及び図15Cは、血液分析装置1の分析結果画面を示す図である。図15Aは、血液検体Aの分析結果画面を示している。図15Bは、血液検体Bの分析結果画面を示している。図15Cは、血液検体Cの分析結果画面を示している。図15A〜Cに示すように、分析結果画面R1,R2及びR3においては、測定された測定項目(WBC、RBC、PLT、NRBC等)の数値データが表示される。血液検体Aにはリンパ芽球が含まれており、この血液検体Aに係る分析結果データでは、リンパ芽球フラグが「1」にセットされている。したがって、血液検体Aの分析結果画面R1では、図15Aに示すように、リンパ芽球項目が存在している可能性を示す情報である「L−Blast?」の表示が、Flagの欄Fに付される。一方、血液検体B及び血液検体Cにはリンパ芽球が含まれておらず、血液検体Bに係る分析結果データ及び血液検体Cに係る分析結果データでは、リンパ芽球フラグが「0」にセットされている。したがって、血液検体Bの分析結果画面R2及び血液検体Cの分析結果画面R3では、図15B及び図15CのFlagの欄Fに示すように、上記の「L−Blast?」の表示は付されない。また、血液検体Cは有核赤血球を含んでいるため、血液検体Cの分析結果画面R3では、図15Cに示すように、有核赤血球の存在を示す情報である「NRBC present」の表示が、Flagの欄Fに付される。これによって、オペレータは分析結果画面を見るだけで、その血液検体にリンパ芽球が検出されたか否かを把握することができる。また、この分析結果画面R1,R2及びR3には、第1測定データの側方散乱光強度及び側方蛍光強度のスキャッタグラムSL1,SL2及びSL3が表示される。さらに、この分析結果画面R1,R2及びR3には、第2測定データの側方散乱光強度及び側方蛍光強度のスキャッタグラムSN1,SN2及びSN3が表示される。オペレータはこのスキャッタグラムを参照することによって、血液分析装置1によるリンパ芽球の有無の検出結果の根拠を把握することができ、また血液分析装置1によるリンパ芽球の有無の検出結果の妥当性を判断することができる。
【0120】
ここで、スキャッタグラムの具体例を用いて、リンパ芽球の検出について詳細に説明する。図16Aは、血液検体Aの第1測定データにおける前方散乱光強度及び蛍光強度のスキャッタグラムであり、図16Bは、血液検体Aの第1測定データにおける側方散乱光強度及び蛍光強度のスキャッタグラムである。また、図17は、血液検体Aの第2測定データにおける前方散乱光強度及び蛍光強度のスキャッタグラムである。さらに、図18Aは、血液検体Cの第1測定データにおける前方散乱光強度及び蛍光強度のスキャッタグラムであり、図18Bは、血液検体Cの第1測定データにおける側方散乱光強度及び蛍光強度のスキャッタグラムである。図19は、血液検体Cの第2測定データにおける前方散乱光強度及び蛍光強度のスキャッタグラムである。
【0121】
図16A及び図16Bから明らかなように、血液検体Aでは、リンパ芽球/有核赤血球群のクラスターがスキャッタグラム上で確認できる。一方、図17から明らかなように、血液検体Aでは、有核赤血球のクラスターがスキャッタグラム上で確認できない。このことは、図16A及び図16Bに出現しているリンパ芽球/有核赤血球群のクラスターが主としてリンパ芽球によって形成されているということを示しており、ここから血液検体Aにリンパ芽球が存在することが分かる。
【0122】
また、図18A及び図18Bから明らかなように、血液検体Cでは、リンパ芽球/有核赤血球群のクラスターがスキャッタグラム上で確認できる。加えて、血液検体Cにおけるリンパ芽球/有核赤血球群のクラスターは、血液検体Aにおけるリンパ芽球/有核赤血球群のクラスターよりも規模が小さく、血球数が少ないことが分かる。さらに、図19から明らかなように、血液検体Cでは、有核赤血球のクラスターがスキャッタグラム上で確認できる。このことは、図18A及び図18Bに出現しているリンパ芽球/有核赤血球群のクラスターが主として有核赤血球によって形成されているということを示している。つまり、このことは、血液検体Cにおいては、リンパ芽球ではなく、有核赤血球が存在していることを示唆している。
【0123】
このように、第1測定データ及び第2測定データから得られるスキャッタグラムを参照することで、より正確に血液分析装置1によるリンパ芽球の有無の検出結果の根拠を把握することができ、また血液分析装置1によるリンパ芽球の有無の検出結果の妥当性を判断することができる。
【0124】
以上のような構成とすることにより、血液分析装置1は、血液検体と核酸を染色する蛍光色素が含有された第1試薬とを混合して調製したL−Blast測定試料を光学検出器Dにより測定することにより、リンパ芽球/有核赤血球群を検出し、そのリンパ芽球/有核赤血球群に含まれる血球数を測定することができる。また、この血球数と、第2測定工程によって得られた有核赤血球数とによって、血液検体にリンパ芽球が含まれているか否かを検出することができる。したがって、血液分析装置1の上記測定に蛍光標識抗体が用いられることがなく、測定コストを抑制しつつ、リンパ芽球の検出を行うことが可能である。
【0125】
(その他の実施の形態)
なお、試料調製部22における、血液検体と第1試薬との混合の際の反応温度及び反応時間は、血液検体中の血球の損傷や染色の状態により適宜設定すればよく、特に制限されない。具体的には、反応温度が高いときは反応時間を短くし、反応温度が低いときは反応時間を長くするように調整することができる。より具体的には、血液検体と試薬の混合は、20℃〜40℃の温度において、3〜20秒間行うことが好ましい。
【0126】
また、上述した実施の形態においては、溶血剤及び核酸を染色できる蛍光色素を含む第1試薬を用いて、第1測定工程を行う構成について述べたが、これに限定されるものではない。溶血剤を含む試薬と、核酸染色色素を含む試薬とを別々に設け、これらの2つの試薬を血液検体と混合してL−Blast測定試料を調製し、リンパ芽球/有核赤血球群の検出及びリンパ芽球/有核赤血球群の血球数の測定を行う構成としてもよい。この場合、界面活性剤、可溶化剤及び蛍光色素の濃度は、上記2つの試薬を混合した際に、上述の濃度になるように調整される。ここで、溶血剤を含む試薬及び核酸染色色素を含む試薬の混合比は、1000:1〜10:1が好ましい。
【0127】
上記の試薬キットを用いる場合、試薬キットの各試薬と血液検体とを混合する順序は特に限定されないが、2つの試薬を混合し、次いで混合した試薬に血液検体を混合することが好ましい。
【0128】
また、上述した実施の形態においては、第1測定工程と第2測定工程とを実行し、第1測定工程によって得られる第1測定データ及び第2測定工程によって得られる第2測定データによって血液検体にリンパ芽球が含まれているか否かを検出する構成について述べたが、これに限定されるものではない。図13Aに示すように、リンパ芽球/有核赤血球群のクラスターにおいて、蛍光強度が低い部分にはリンパ芽球のクラスターと有核赤血球のクラスターとが重複し、蛍光強度が高い部分にはリンパ芽球のみが出現している。つまり、リンパ芽球/有核赤血球群のクラスターにおいて、有核赤血球のクラスターの蛍光強度の上限値付近に蛍光強度の基準値を設け、リンパ芽球/有核赤血球群のクラスター内で蛍光強度がこの基準値以上の粒子が検出された場合には、リンパ芽球が存在すると判断し、蛍光強度が当該基準値以上の粒子が検出されなかった場合には、リンパ芽球が存在しないと判断することもできる。この場合には、有核赤血球の検出のための第2測定工程を行わなくてもリンパ芽球の有無を判断することができるため、より一層血液分析装置1の構成を簡単にすることができ、また測定コストを低減することができる。
【0129】
また、上述した実施の形態においては、第1測定データに基づいてリンパ芽球/有核赤血球群の検出及びリンパ芽球/有核赤血球群に含まれる血球の計数を行い、第2測定データに基づいて有核赤血球の検出及び有核赤血球の計数を行い、リンパ芽球/有核赤血球群の血球数と有核赤血球数との差を求め、この差と基準値Tとの比較によりリンパ芽球の有無を判断する構成について述べたが、これに限定されるものではない。第1測定データに基づいてリンパ芽球/有核赤血球群の検出及び第2測定データに基づいて有核赤血球の検出を行い、リンパ芽球/有核赤血球群として検出される粒子が存在し、且つ、有核赤血球として検出される粒子が存在しない場合には、リンパ芽球が存在すると判断し、それ以外の場合には、リンパ芽球が存在しないと判断する構成としてもよい。また、リンパ芽球/有核赤血球群の血球数と有核赤血球数との差を、リンパ芽球数として分析結果画面に表示することもでき、リンパ芽球/有核赤血球群の血球数と有核赤血球数との差に対して、所定数を差し引いた結果の数を、リンパ芽球数として分析結果画面に表示することもできる。
【0130】
また、上述した実施の形態においては、リンパ芽球/有核赤血球群に含まれる血球数NLと有核赤血球数NNとの差NL−NNが基準値T以上の場合には、血液検体中にリンパ芽球が存在すると判断し、NL−NNが基準値T未満の場合には、血液検体中にリンパ芽球が存在しないと判断する構成について述べたが、リンパ芽球/有核赤血球群に含まれる血球数NLが有核赤血球数NNよりも大きい場合には、血液検体中にリンパ芽球が存在すると判断し、血球数NLが有核赤血球数NN以下の場合には、血液検体中にリンパ芽球が存在しないと判断する構成としてもよい。
【0131】
上述したように、図13Aに示す第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラムでは、骨髄芽球のクラスター、幼若顆粒球のクラスター、好塩基球のクラスター、好中球と好酸球とによってなる血球群のクラスター、リンパ球のクラスター、単球のクラスター、及びリンパ芽球/有核赤血球群のクラスターが現れる。したがって、この第1測定データにおける側方散乱光強度及び側方蛍光強度を用いて、骨髄芽球のクラスターと他のクラスターとを分類し、骨髄芽球のクラスターに含まれる血球が存在する場合には、その存在を示す情報又は骨髄芽球のクラスターに含まれる血球数(骨髄芽球数)を分析結果画面に表示する構成としてもよい。また、第1測定データにおける側方散乱光強度及び側方蛍光強度を用いて、幼若顆粒球のクラスターと他のクラスターとを分類し、幼若顆粒球のクラスターに含まれる血球が存在する場合には、その存在を示す情報又は幼若顆粒球のクラスターに含まれる血球数(幼若顆粒球数)を分析結果画面に表示する構成としてもよい。
【0132】
さらに、第1測定データにおける側方散乱光強度及び側方蛍光強度を用いて、成熟白血球を、リンパ球、好塩基球、単球、及び好中球と好酸球とからなる血球群に分類し、リンパ球、好塩基球、単球、及び好中球と好酸球とからなる血球群に含まれる血球をそれぞれ計数し、分析結果画面にそれぞれの血球数を表示する構成としてもよい。また、上記の好中球と好酸球とからなる血球群に好塩基球も含まれているものとし、顆粒球としてリンパ球及び単球と区別して、成熟白血球をリンパ球、単球及び顆粒球に分類し、それぞれのクラスターに含まれる血球を計数し、リンパ球数、単球数、顆粒球数を分析結果画面に表示する構成としてもよい。
【0133】
また、上述した実施の形態においては、第1測定データにおける側方散乱光強度及び側方蛍光強度を用いて、リンパ芽球/有核赤血球群の検出を行う構成について述べたが、これに限定されるものではない。図13Bに示すように、第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラムでは、幼若顆粒球と骨髄芽球とからなる血球群のクラスター、顆粒球(好中球と好酸球と好塩基球とからなる血球群)のクラスター、単球のクラスター、リンパ球のクラスター、及びリンパ芽球/有核赤血球群のクラスターが現れる。したがって、第1測定データにおける前方散乱光強度及び側方蛍光強度を用いて、リンパ芽球/有核赤血球群の検出を行う構成とし、さらにはリンパ芽球/有核赤血球群に含まれる血球を計数する構成としてもよい。また、第1測定データにおける前方散乱光強度及び側方蛍光強度を用いて、骨髄芽球と幼若顆粒球とからなる血球群のクラスターと他のクラスターとを分類し、骨髄芽球と幼若顆粒球とからなる血球群のクラスターに含まれる血球が存在する場合には、その存在を示す情報又は骨髄芽球と幼若顆粒球とからなる血球群のクラスターに含まれる血球数を分析結果画面に表示する構成としてもよい。
【0134】
さらに、第1測定データにおける前方散乱光強度及び側方蛍光強度を用いて、成熟白血球を、リンパ球、単球、及び顆粒球に分類し、リンパ球、単球、及び顆粒球をそれぞれ計数し、分析結果画面にそれぞれの血球数を表示する構成としてもよい。
【0135】
また、図13A及び図13Bに示すように、第1測定データに含まれる側方蛍光強度だけを用いて、リンパ芽球/有核赤血球群、成熟白血球(リンパ球、単球、及び顆粒球)、及び骨髄芽球と幼若顆粒球とからなる血球群を弁別することができる。したがって、第1測定データに含まれる側方蛍光強度を用いて、リンパ芽球/有核赤血球群の領域(蛍光強度が高い領域)と、成熟白血球(蛍光強度が中程度の領域)と、骨髄芽球と幼若顆粒球とからなる血球群の領域(蛍光強度が低い領域)とに区分し、領域毎に血球を計数し、リンパ芽球/有核赤血球群の血球数、成熟白血球数、及び骨髄芽球と幼若顆粒球とからなる血球群の血球数を取得する構成としてもよい。
【0136】
また、上述した実施の形態においては、血液分析装置1が第2測定工程を実施し、データ処理工程において有核赤血球群を検出する構成について述べたが、これに限定されるものではない。すなわち、有核赤血球群の検出に関する情報を、血液分析装置1とは異なる他の血液分析装置又は用手法により取得し、取得した情報を血液分析装置1の入力手段を用いて入力する構成としても良い。ここで、血液分析装置1の入力手段としては、上述の入力部53及び通信インタフェース51g等が挙げられる。より具体的には、上述の入出力インタフェース51fに接続されているキーボード及びマウスからなる入力部53を用いて有核赤血球群の検出に関する情報を血液分析装置1に入力することができる。また、通信インタフェース51gを用いて血液分析装置1と上記の他の血液分析装置を接続し、通信インタフェース51g介して有核赤血球群の検出に関する情報を血液分析装置1に入力することもできる。
【0137】
また、上述した実施の形態においては、CPU51aが上記のコンピュータプログラム54aを実行することにより、測定ユニット2の制御及び測定データの処理を行う構成について述べたがこれに限定されるものではない。上記コンピュータプログラム54aと同様の処理を実行することが可能なFPGA又はASIC等の専用ハードウェアにより、測定ユニット2の制御及び測定データの処理を実行する構成としてもよい。
【0138】
また、上述した実施の形態においては、単一のコンピュータ5aによりコンピュータプログラム54aの全ての処理を実行する構成について述べたが、これに限定されるものではなく、上述したコンピュータプログラム54aと同様の処理を、複数の装置(コンピュータ)により分散して実行する分散システムとすることも可能である。
【産業上の利用可能性】
【0139】
本発明の検体検査システムは、血液検体を光学的に測定し、血液検体に含まれる細胞群を複数に分類する血液分析装置として有用である。
【符号の説明】
【0140】
1 血液分析装置
2 測定ユニット
22 試料調製部
221,222a,222b,223 試薬容器
23 検出部
231 フローセル
237 半導体レーザ
243 フォトダイオード
246 フォトダイオード
248 アバランシェフォトダイオード
5 情報処理ユニット
5a コンピュータ
51 本体
51a CPU
51b ROM
51c RAM
51d ハードディスク
51h 画像出力インタフェース
52 画像表示部
54a コンピュータプログラム
MC1 第1混合チャンバ
MC2 第2混合チャンバ
H ヒータ
D 光学検出器
R1,R2,R3 分析結果画面
SL1,SL2,SL3 スキャッタグラム
SN1,SN2,SN3 スキャッタグラム
【技術分野】
【0001】
本発明は、血液検体を光学的に測定し、血液検体に含まれる細胞群を複数に分類する血液分析装置に関する。
【背景技術】
【0002】
末梢血液の血漿中には、赤血球、血小板、及び白血球が浮遊している。これらの細胞を検査する血液検査によれば、多くの臨床情報を提供することができるため、多数の検体が検査されている。血液検査には血球計数装置が用いられており、これにより血液中の赤血球数、血小板数、白血球数、ヘモグロビン濃度等が自動的に測定される。
【0003】
正常な末梢血液中にはリンパ球、単球、好塩基球、好酸球、及び好中球の5種類の白血球が存在し、多くの血球計数装置は血液検体中の白血球をかかる5つの種類に分類する機能を有している。一方、造血器腫瘍等の疾患においては、正常な血液中には存在しない細胞が出現する。例えば、急性リンパ性白血病(ALL)では、末梢血液中に多数のリンパ芽球が出現する。このため、末梢血液中のリンパ芽球の検出は、急性リンパ性白血病の診断を行う上で極めて有用である。
【0004】
特許文献1には、1)血液試料中の赤血球を測定の障害とならない程度に溶解し、正常又は異常細胞を染色に好適な状態にする溶血剤と混合する工程と、2)前記1)で調製した試料と、特定の構造式で表される細胞中のRNAに特異的に結合し蛍光強度を増加する色素と混合することにより血液試料中の有核細胞を蛍光染色する工程と、3)前記2)で調製した測定試料をフローサイトメータで測定し、散乱光及び蛍光を測定する工程、4)前記3)で測定した散乱光と蛍光の強度さを用いて正常な白血球を少なくとも5つに分類計数する工程と、からなる白血球分類方法が開示されている。この特許文献1には、異型リンパ球を正常白血球と明確に分離し、分類計数することが開示されている。
【0005】
特許文献2には、所定の細胞マーカーに対する抗体を使用して、骨髄球系細胞及びBリンパ球系細胞の文化成熟段階を分類する血液細胞の分類方法が開示されている。かかる特許文献2には、側方散乱光と、蛍光標識CD45抗体とを用いて、リンパ芽球を分類することが開示されている。
【0006】
特許文献3には、細胞核、特にDNAに対して特異性を有する色素あるいはRNAに特異性を有する色素により細胞を染色し、このようにして調製された試料をフローサイトメータに導入し、試料中の染色された細胞のそれぞれについて、散乱光と蛍光を測定し、散乱光ピークの強度差と散乱光幅の差を用いて、血小板凝集及び同時通過細胞と白血球とを分類し、分類された成分の散乱光の強度差と蛍光の強度差を用いて、成熟白血球、DNA量異常白血球及び幼若白血球に分類計数する白血球の分類計数方法が開示されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平10−319010号公報
【特許文献2】特開2007−263958号公報
【特許文献3】国際公開第WO2004/001408号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、上記特許文献1に開示されている白血球分類方法にあっては、異型リンパ球を正常白血球と分類し、計数することはできるが、リンパ芽球を検出することはできない。
【0009】
また、上記特許文献2に開示されている血球細胞の分類方法にあっては、高価な蛍光標識抗体を測定に使用する必要があり、測定コストが嵩むという問題がある。
【0010】
また、上記特許文献3に開示されている白血球の分類計数方法にあっては、リンパ芽球を含むDNA量異常白血球を分類計数することが可能であるが、DNA量異常白血球にはリンパ芽球以外の細胞も含まれるため、リンパ芽球が存在するか否かを正確に検出することはできない。
【0011】
本発明は斯かる事情に鑑みてなされたものであり、その主たる目的は、高価な蛍光標識抗体を用いることなく、リンパ芽球を検出することが可能な血液分析装置を提供することにある。
【課題を解決するための手段】
【0012】
上述した課題を解決するために、本発明の一の態様の血液分析装置は、血液検体を供給する血液検体供給部と、前記血液検体供給部から供給された血液検体と、核酸を染色する蛍光色素とを混合して測定試料を調製する試料調製部と、前記測定試料に光を照射する光源と、前記光が照射された測定試料から発せられる蛍光を受光する光学検出部と、前記光学検出部によって受光された蛍光に基づいて、前記測定試料中に含まれるリンパ芽球及び有核赤血球を含む細胞群を検出する情報処理手段と、前記情報処理手段による検出結果に基づいて、前記血液検体におけるリンパ芽球の出現に関する情報を出力する出力手段と、を備える。
【0013】
この態様においては、前記血液検体供給部が、血液検体から分割された第1血液検体及び第2血液検体を供給するように構成されており、前記試料調製部が、前記第1血液検体と、第1溶血剤及び前記蛍光色素である第1蛍光色素とを混合して第1測定試料を調製し、前記第2血液検体と、前記第1溶血剤とは異なる第2溶血剤及び核酸を染色する第2蛍光色素とを混合して第2測定試料を調製するように構成されており、前記光学検出部が、前記光源が前記第1測定試料に光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記蛍光に応じた第1信号を出力し、前記光源が前記第2測定試料に光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記散乱光及び蛍光に応じた第2信号を出力するように構成されており、前記情報処理手段が、前記光学検出部が出力した前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む前記細胞群を検出し、前記光学検出部が出力した前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を検出するように構成されており、前記出力手段が、前記情報処理手段による前記第1信号に基づく前記リンパ芽球及び有核赤血球を含む細胞群に係る検出結果並びに前記前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果に基づいて、リンパ芽球の出現に関する情報を出力するように構成されていることが好ましい。
【0014】
また、上記態様においては、前記光源が、前記第1測定試料の流れに向けて光を照射するように構成されており、前記光学検出部が、前記光源が前記第1測定試料の流れに光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記第1信号を出力するように構成されており、前記情報処理手段が、前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む細胞群に含まれる細胞を計数するように構成されており、前記出力手段が、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数と、前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果とに基づいて、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されていることが好ましい。
【0015】
また、上記態様においては、前記光源が、前記第2測定試料の流れに向けて光を照射するように構成されており、前記光学検出部が、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、前記情報処理手段が、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、前記出力手段が、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数が有核赤血球の数よりも大きい場合に、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されていることが好ましい。
【0016】
また、上記態様においては、前記光源が、前記第2測定試料の流れに向けて光を照射するように構成されており、前記光学検出部が、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、前記情報処理手段が、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、前記出力手段が、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数から、有核赤血球の数を差し引いた数が所定値よりも大きい場合に、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されていることが好ましい。
【0017】
また、上記態様においては、前記光源が、前記第1測定試料の流れに向けて光を照射するように構成されており、前記光学検出部が、前記光源が前記第1測定試料の流れに光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記第1信号を出力するように構成されており、前記情報処理手段が、前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む細胞群に含まれる細胞を計数するように構成されており、前記出力手段が、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数と、前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果とに基づいて、前記リンパ芽球の計数結果を出力するように構成されていることが好ましい。
【0018】
また、上記態様においては、前記光源が、前記第2測定試料の流れに向けて光を照射するように構成されており、前記光学検出部が、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、前記情報処理手段が、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、前記出力手段が、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数から、有核赤血球の数を差し引いた数を、前記リンパ芽球の計数結果として出力するように構成されていることが好ましい。
【0019】
また、上記態様においては、前記血液分析装置が、前記血液検体に含まれる有核赤血球に係る検出結果に関する情報を入力するための入力手段をさらに備え、前記出力手段が、前記情報処理手段による検出結果及び前記入力手段に入力された有核赤血球の出現に関する情報に基づいて、リンパ芽球の出現に関する情報を出力するように構成されていることが好ましい。
【0020】
また、上記態様においては、前記情報処理手段が、前記光学検出部によって受光された蛍光に基づいて、測定試料中に含まれるリンパ芽球及び有核赤血球を含む第1細胞群と、前記測定試料中に含まれる骨髄芽球及び幼若顆粒球を含む第2細胞群とを検出するように構成されており、前記出力手段が、前記血液検体における骨髄芽球の出現に関する情報、及び前記血液検体における幼若顆粒球の出現に関する情報をさらに出力するように構成されていることが好ましい。
【0021】
また、上記態様においては、前記情報処理手段が、前記光学検出部によって受光された蛍光に基づいて、前記第1細胞群と、前記第2細胞群と、測定試料中に含まれる成熟白血球を含む第3細胞群とを検出するように構成されており、前記出力手段が、成熟白血球の出現に関する情報を出力するように構成されていることが好ましい。
【0022】
また、上記態様においては、前記光学検出部が、さらに前記光が照射された測定試料から発せられる散乱光を受光するように構成されており、前記情報処理手段が、前記光学検出部によって受光された散乱光及び蛍光に基づいて、前記第2細胞群を、骨髄芽球を含む細胞群と、幼若顆粒球を含む細胞群とにさらに検出するように構成されていることが好ましい。
【0023】
また、上記態様においては、前記情報処理手段が、前記光学検出部によって受光された蛍光に基づいて、前記第1細胞群と、前記第2細胞群と、測定試料中に含まれる成熟白血球を含む第3細胞群とを検出し、前記光学検出部によって受光された散乱光及び蛍光に基づいて、前記第3細胞群を、少なくとも3種類の成熟白血球に分類するように構成されていることが好ましい。
【0024】
また、上記態様においては、前記光学検出部が、前記散乱光として、前記光が照射された測定試料から発せられる前方散乱光又は側方散乱光を受光するように構成されていることが好ましい。
【発明の効果】
【0025】
本発明に係る血液分析装置によれば、蛍光標識抗体を用いることなく、リンパ芽球を検出することが可能となる。
【図面の簡単な説明】
【0026】
【図1】実施の形態に係る血液分析装置の外観を示す斜視図。
【図2】検体容器の外観を示す斜視図。
【図3】サンプルラックの外観を示す斜視図。
【図4】実施の形態に係る測定ユニットの構成を示すブロック図。
【図5】光学検出器の概要構成を示す模式図。
【図6】実施の形態に係る検体搬送ユニットの構成を示す平面図。
【図7】検体搬送ユニットの第1ベルトの構成を示す正面図。
【図8】検体搬送ユニットの第2ベルトの構成を示す正面図。
【図9】実施の形態に係る情報処理ユニットの構成を示すブロック図。
【図10】実施の形態に係る血液分析装置の第1測定工程での動作手順を示すフローチャート。
【図11】実施の形態に係る血液分析装置の第2測定工程での動作手順を示すフローチャート。
【図12】実施の形態に係る血液分析装置のデータ処理工程での処理手順を示すフローチャート。
【図13A】第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図13B】第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図14】第2測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図15A】実施の形態に係る血液分析装置の分析結果画面の一例を示す図。
【図15B】実施の形態に係る血液分析装置の分析結果画面の他の例を示す図。
【図15C】実施の形態に係る血液分析装置の分析結果画面のさらに他の例を示す図。
【図16A】リンパ芽球を含むが有核赤血球を含まない血液検体の第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図16B】リンパ芽球を含むが有核赤血球を含まない血液検体の第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図17】リンパ芽球を含むが有核赤血球を含まない血液検体の第2測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図18A】有核赤血球を含むがリンパ芽球を含まない血液検体の第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図18B】有核赤血球を含むがリンパ芽球を含まない血液検体の第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラム。
【図19】有核赤血球を含むがリンパ芽球を含まない血液検体の第2測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラム。
【発明を実施するための形態】
【0027】
以下、本発明の好ましい実施の形態を、図面を参照しながら説明する。
【0028】
本実施の形態は、血液検体と、核酸を染色する蛍光色素とを混合して測定試料を調製し、前記測定試料を光学式フローサイトメータにより測定することにより、前記血液検体中におけるリンパ芽球を検出する血液分析装置である。
【0029】
[血液分析装置の構成]
図1は、本実施の形態に係る血液分析装置の外観を示す斜視図である。本実施の形態に係る血液分析装置1は、血液検体に含まれる血球を白血球、赤血球、血小板等を検出し、各血球を計数する多項目血球分析装置である。図1に示すように、血液分析装置1は、測定ユニット2と、測定ユニット2の前面側に配置された検体搬送ユニット4と、測定ユニット2及び検体搬送ユニット4を制御可能な情報処理ユニット5とを備えている。
【0030】
図2は、検体を収容する検体容器の外観を示す斜視図であり、図3は、複数の検体容器を保持するサンプルラックの外観を示す斜視図である。図2に示すように、検体容器Tは、管状をなしており、上端が開口している。内部には患者から採取された血液検体が収容され、上端の開口は蓋部CPにより密封されている。検体容器Tは、透光性を有するガラス又は合成樹脂により構成されており、内部の血液検体が視認可能となっている。また、検体容器Tの側面には、バーコードラベルBL1が貼付されている。このバーコードラベルBL1には、検体IDを示すバーコードが印刷されている。サンプルラックLは、10本の検体容器Tを並べて保持することが可能である。サンプルラックLでは、各検体容器Tが垂直状態(立位状態)で保持される。また、サンプルラックLの側面には、バーコードラベルBL2が貼付されている。このバーコードラベルBL2には、ラックIDを示すバーコードが印刷されている。
【0031】
<測定ユニットの構成>
次に、測定ユニットの構成について説明する。図4は、測定ユニットの構成を示すブロック図である。図4に示すように、測定ユニット2は、検体である血液を検体容器(採血管)Tから吸引する検体吸引部21と、検体吸引部21により吸引した血液から測定に用いられる測定試料を調製する試料調製部22と、試料調製部22により調製された測定試料から血球を検出する検出部23とを有している。また、測定ユニット2は、検体搬送ユニット4のラック搬送部43によって搬送されたサンプルラックLに収容された検体容器Tを測定ユニット2の内部に取り込むための取込口(図1参照)と、サンプルラックLから検体容器Tを測定ユニット2の内部に取り込み、検体吸引部21による吸引位置まで検体容器Tを搬送する検体容器搬送部25とをさらに有している。
【0032】
図4に示すように、検体吸引部21は、吸引管211を有している。また、検体吸引部21はシリンジポンプ(図示せず)を備えている。また、吸引管211は、鉛直方向に移動可能であり、下方に移動されることにより、吸引位置まで搬送された検体容器Tの蓋部CPを前記吸引管が貫通し、内部の血液を吸引するように構成されている。
【0033】
試料調製部22は、第1混合チャンバMC1及び第2混合チャンバMC2を備えている。吸引管211は、シリンジポンプ(図示せず)によって検体容器Tから所定量の全血検体を吸引し、吸引された検体は、第1混合チャンバMC1と第2混合チャンバMC2の位置へ移送され、前記シリンジポンプによって、それぞれのチャンバMC1,MC2へ所定量の全血検体を分配供給する。また、試料調製部22は、第1混合チャンバMC1及び第2混合チャンバMC2を加温するためのヒータHを備えている。
【0034】
試料調製部22は、第1試薬を収容する試薬容器221、第2試薬を収容する試薬容器222a、第3試薬を収容する試薬容器222b、及びシース液(希釈液)を収容する試薬容器223にチューブを介して接続されている。また、試料調製部22は、図示しないコンプレッサに接続されており、当該コンプレッサにより発生される圧力により試薬容器221,222a,222b,223からそれぞれの試薬を分取することが可能となっている。
【0035】
第1試薬は、リンパ芽球と有核赤血球とからなる血球群(以下、「リンパ芽球/有核赤血球群」という)を検出するための試薬である。かかる第1試薬には、溶血剤及び蛍光色素が含有されている。第1試薬に含まれる溶血剤としては、白血球の測定に使用される公知の溶血剤が使用できる。この溶血剤を使用することで、赤血球及び成熟白血球の細胞膜に損傷を与え、損傷した血球を収縮できる。より具体的には、溶血剤には、赤血球及び成熟白血球の細胞膜に損傷を与える界面活性剤と、損傷した血球を収縮させる可溶化剤が含まれている。
【0036】
ここで、溶血剤に含まれる界面活性剤としては、非イオン性界面活性剤が好ましい。非イオン性界面活性剤としては、ポリオキシエチレン系ノニオン界面活性剤が好ましい。具体的なポリオキシエチレン系ノニオン界面活性剤としては、以下の構造式(I)
R1−R2−(CH2CH2O)n−H
(I)
(式中、R1は炭素数9〜25のアルキル基、アルケニル基又はアルキニル基であり、R2は−O−、−COO−又は
【化1】

であり、nは10〜40の整数である)
で示されるものが挙げられる。
【0037】
上記の構造式(I)で表される具体的な界面活性剤としては、ポリオキシエチレン(15)オレイルエーテル、ポリオキシエチレン(15)セチルエーテル、ポリオキシエチレン(16)オレイルエーテル、ポリオキシエチレン(20)オレイルエーテル、ポリオキシエチレン(20)ラウリルエーテル、ポリオキシエチレン(20)ステアリルエーテル、ポリオキシエチレン(20)セチルエーテルなど挙げられ、ポリオキシエチレン(20)オレイルエーテルが好ましい。なお、溶血剤は、界面活性剤を1種類又は2種類以上含むことができる。
【0038】
第1試薬に含まれる界面活性剤の濃度は、界面活性剤の種類又は溶血剤の浸透圧等に応じて適宜選択できる。例えば、界面活性剤がポリオキシエチレンオレイルエーテルである場合、第1試薬に含まれる界面活性剤の濃度は、0.5〜50.0g/Lであり、好ましくは1.0〜20.0g/Lである。
【0039】
溶血剤に含まれる可溶化剤としては、サルコシン誘導体、コール酸誘導体、メチルグルカンアミド、n−オクチルβ−グルコシド、シュークロースモノカプレート、N−ホルミルメチルロイシルアラニンなどが挙げられ、特にサルコシン誘導体が好ましい。なお、溶血剤は、可溶化剤を1種類又は2種類以上含むことができる。
【0040】
サルコシン誘導体としては、以下の構造式(II)
【化2】

(式中、R1はC10−22のアルキル基であり、nは1〜5である。)
で示される化合物及びその塩が挙げられる。具体的なサルコシン誘導体としては、N−ラウロイルサルコシン酸ナトリウム、ラウロイルメチルβ−アラニンナトリウム、ラウロイルサルコシンなどが挙げられ、特にN−ラウロイルサルコシン酸ナトリウムが好ましい。
【0041】
コール酸誘導体としては、以下の構造式(III)
【化3】

(式中、R1は水素原子又は水酸基である。)
で示される化合物及びその塩が挙げられる。具体的なコール酸誘導体としては、CHAPS(3−[(3−コールアミドプロピル)ジメチルアンモニオ]−1−プロパンスルホネート)、CHAPSO([(3−コールアミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホネート)などが挙げられる。
【0042】
メチルグルカンアミドとしては、以下の構造式(IV)
【化4】

(式中、nは5〜7である。)
で示される化合物が挙げられる。具体的なメチルグルカンアミドとしては、MEGA8(オクタノイル−N−メチルグルカミド)、MEGA9(ノナノイル−N−メチルグルカミド)、MEGA10(デカノイル−N−メチルグルカミド)などが挙げられる。
【0043】
第1試薬に含まれる可溶化剤の濃度は、用いる可溶化剤の種類に応じて適宜選択できる。例えば、可溶化剤としてサルコシン誘導体を用いる場合、第1試薬に含まれる可溶化剤の濃度は、0.05〜3.0g/Lであり、好ましくは0.1〜1.0g/Lである。コール酸誘導体を用いる場合、第1試薬に含まれる可溶化剤の濃度は、0.1〜10.0g/Lであり、好ましくは0.2〜2.0g/Lである。メチルグルカンアミドを用いる場合、第1試薬に含まれる可溶化剤の濃度は、1.0〜8.0g/Lであり、好ましくは2.0〜6.0g/Lである。n−オクチルβ−グルコシド、シュークロースモノカプレート、N−ホルミルメチルロイシルアラニンを用いる場合、第1試薬に含まれる可溶化剤の濃度は、0.01〜50.0g/Lであり、好ましくは0.05〜30.0g/Lである。
【0044】
第1試薬に含まれる核酸を染色できる蛍光色素としては、核酸を蛍光染色できるものであれば特に限定されない。このような色素を用いることにより、核酸を持たない赤血球はほとんど染色されず、核酸を有するリンパ芽球及び有核赤血球等の有核の血球は染色される。なお、核酸を染色できる蛍光色素は、光源から照射される光によって適宜選択することができる。具体的な核酸を染色できる蛍光色素としては、例えば、プロピジウムアイオダイド、エチジウムブロマイド、エチジウム−アクリジンヘテロダイマー、エチジウムジアジド、エチジウムホモダイマー−1、エチジウムホモダイマー−2、エチジウムモノアジド、トリメチレンビス[[3‐[[4‐[[(3‐メチルベンゾチアゾール‐3‐イウム)‐2‐イル]メチレン]‐1,4‐ジヒドロキノリン]‐1‐イル]プロピル]ジメチルアミニウム]・テトラヨージド(TOTO−1)、4‐[(3‐メチルベンゾチアゾール‐2(3H)‐イリデン)メチル]‐1‐[3‐(トリメチルアミニオ)プロピル]キノリニウム・ジヨージド(TO−PRO−1)、N,N,N',N'‐テトラメチル‐N,N'‐ビス[3‐[4‐[3‐[(3‐メチルベンゾチアゾール‐3‐イウム)‐2‐イル]‐2‐プロペニリデン]‐1,4‐ジヒドロキノリン‐1‐イル]プロピル]‐1,3‐プロパンジアミニウム・テトラヨージド(TOTO−3)、又は2‐[3‐[[1‐[3‐(トリメチルアミニオ)プロピル]‐1,4‐ジヒドロキノリン]‐4‐イリデン]‐1‐プロペニル]‐3‐メチルベンゾチアゾール‐3‐イウム・ジヨージド(TO−PRO−3)、及び以下の構造式(V)〜(XIII)で示される蛍光色素が挙げられる。
【0045】
<構造式(V)>
【化5】

(式中、R1及びR2は、低級アルキル基であり;nは1又は2であり;X−はアニオンであり;Zは硫黄原子、酸素原子、又は低級アルキル基で置換された炭素原子である)。
【0046】
構造式(V)中、低級アルキル基とは炭素数1〜6の直鎖又は分枝のアルキル基である。具体的な低級アルキル基としては、メチル基、エチル基、プロピル基、ブチル基、イソブチル基、sec-ブチル基、tert-ブチル基、ペンチル基、ヘキシル基などが挙げられ、メチル基、エチル基が好ましい。また、Zとしては、硫黄原子が好ましい。X−におけるアニオンは、ハロゲンイオン(フッ素、塩素、臭素又はヨウ素イオン)、ハロゲン化ホウ素イオン(BF4−、BCl4−、BBr4−など)、リン化合物イオン、ハロゲン酸素酸イオン、フルオロ硫酸イオン、メチル硫酸イオン、芳香環ハロゲン或いはハロゲンをもつアルキル基を置換基として有するテトラフェニルホウ素化合物イオンなどが挙げられ、ヨウ素イオンが好ましい。
【0047】
構造式(V)で示されるもののうち、特に好ましい核酸を染色できる蛍光色素は、次の構造式で示されるNK−321である。
【化6】

【0048】
<構造式(VI)>
【化7】

(式中、R1及びR2は、低級アルキル基であり;nは1又は2であり;X−はアニオンである)。
【0049】
構造式(II)における低級アルキル基、並びにX−のアニオンは、構造式(I)と同様である。
【0050】
構造式(VI)で示されるもののうち、特に好ましい核酸を染色できる蛍光色素は、次の構造式により示される。
【化8】

【0051】
<構造式(VII)>
【化9】

(式中、R1は水素原子又は低級アルキル基であり;R2及びR3は水素原子、低級アルキル基又は低級アルコキシ基であり;R4は水素原子、アシル基又は低級アルキル基であり;R5は水素原子又は置換されていてもよい低級アルキル基であり;Zは硫黄原子、酸素原子、又は低級アルキル基で置換された炭素原子であり;nは1又は2であり;X−はアニオンである)。
【0052】
構造式(VII)における低級アルキル基、並びにX−のアニオンは、構造式(V)と同様である。低級アルコキシ基は、炭素数1〜6のアルコキシ基を示す。具体的な低級アルコキシ基としては、メトキシ基、エトキシ基、プロポキシ基等が挙げられ、特にメトキシ基、エトキシ基が好ましい。アシル基としては、脂肪族カルボン酸から誘導されたアシル基が好ましい。具体的なアシル基としては、アセチル基、プロピオニル基等が挙げられ、特にアセチル基が好ましい。置換されていてもよい低級アルキル基の置換基としては、水酸基やハロゲン原子(フッ素、塩素、臭素又はヨウ素)が挙げられる。置換されていてもよい低級アルキル基は、1〜3個の置換基で置換されることができる。置換されていてもよい低級アルキル基としては、特に1個の水酸基で置換された低級アルキル基が好ましい。なお、Zとしては硫黄原子が好ましく、X−は、臭素イオン又はBF4−が好ましい。
【0053】
構造式(VII)で示されるもののうち、特に好ましい核酸を染色できる蛍光色素は、以下の3つの構造式により示される。
【化10】

【0054】
【化11】

【0055】
【化12】

【0056】
<構造式(VIII)>
【化13】

(式中、X1及びX2は、独立してCl又はIである)
【0057】
<構造式(IX)>
【化14】

【0058】
<構造式(X)>(NK−1570)
【化15】

【0059】
<構造式(XI)>(NK−1049)
【化16】

【0060】
<構造式(XII)>(NK−98)
【化17】

【0061】
<構造式(XIII)>(NK−141)。
【化18】

【0062】
上記の核酸を染色できる蛍光色素のうち、第1試薬に含まれる特に好ましい蛍光色素は、次の構造式で示されるNK−321である。
【化19】

【0063】
上記の核酸を染色できる蛍光色素の第1試薬中の濃度は、10〜500mg/Lが好ましく、特に30〜100mg/Lが好ましい。なお、第1試薬は、核酸を染色できる蛍光色素を1種類又は2種類以上含むことができる。
【0064】
第1試薬のpHは、5.0〜9.0が好ましく、より好ましくは6.5〜7.5、さらに好ましくは6.8〜7.3である。第1試薬のpHは、緩衝剤やpH調整剤で調整できる。緩衝剤としては、例えばHEPES、MOPS(3-morpholinopropanesulfonic acid)又はMOPSO(2-Hydroxy-3-morpholinopropanesulfonic
acid)などのグッド緩衝剤、リン酸緩衝剤などが挙げられる。pH調整剤としては、水酸化ナトリウムや塩酸などが挙げられる。
【0065】
第1試薬の浸透圧は、上述の界面活性剤の種類や第1試薬中の濃度に応じて、適宜設定することができる。具体的な第1試薬の浸透圧としては、10〜600mOsm/kgが挙げられる。また、第1試薬の浸透圧は、糖類、アミノ酸、塩化ナトリウムなどを第1試薬に添加することにより調整してもよい。具体的な糖類としては、単糖類、多糖類、糖アルコールなどが挙げられる。単糖類としては、グルコース、フルクトースが好ましい。多糖類としては、アラビノースが好ましい。糖アルコールとしては、キシリトール、ソルビトール、マンニトール、リビトールが好ましい。ここで、第1試薬に添加する糖類としては、糖アルコールが好ましく、特にキシリトールが好ましい。キシリトールを第1試薬に添加する場合、キシリトールの第1試薬中の濃度は、1.0〜75.0g/L、特に20.0〜50.0g/Lが好ましい。具体的なアミノ酸としては、バリン、プロリン、グリシン、アラニンなどが挙げられ、特にグリシン、アラニンが好ましい。グリシンを第1試薬に添加する場合、グリシンの第1試薬中の濃度は、1.0〜50.0g/L、特に10.0〜30.0g/Lが好ましい。
【0066】
また、第1試薬の電気伝導度は、0.01〜3mS/cmが好ましく、特に0.1〜2mS/cmが好ましい。さらに第1試薬には、キレート剤や防腐剤などを添加することもできる。キレート剤としては、EDTA−2K、EDTA−3Naなどが挙げられる。防腐剤としては、Proxel GXL(Avecia社製)、マテリアルTKM−A(株式会社エーピーアイ コーポレーション)などが挙げられる。
【0067】
第2試薬は、有核赤血球(NRBC)測定用の溶血剤である。このNRBC測定用の溶血剤としては、例えばシスメックス(株)製ストマトライザーNR溶血剤が挙げられる。また、第3試薬は、NRBC測定用の染色液である。このNRBC測定用の染色液としては、例えばシスメックス(株)製ストマトライザーNR染色液が挙げられる。第4試薬は、後述するシースフローセルへと供給されるシース液である。かかるシース液は、希釈液としても使用される。このシース液としては、例えばシスメックス(株)製セルパック(II)が挙げられる。
【0068】
検出部23は、WBC測定(白血球計数)及びDIFF測定(白血球分類)を行うことができる光学検出器Dを有している。この光学検出器Dは、WBC(成熟白血球)、NRBC(有核赤血球)、及びリンパ芽球(L−Blast)の検出を、半導体レーザを使用したフローサイトメトリー法により行うことが可能であるように構成されている。また、この検出部23を使用することにより、白血球を、NEUT(好中球)、LYMPH(リンパ球)、EO(好酸球)、BASO(好塩基球)、及びMONO(単球)の5種類に分類することが可能となっている。リンパ芽球/有核赤血球群の測定を行うときには、血液検体と第1試薬とが混合された測定試料(L−Blast測定試料)が光学検出器Dに供給され、NRBCの測定を行うときには、血液検体と第2試薬と第3試薬とが混合された測定試料(NRBC測定試料)が光学検出器Dに供給される。
【0069】
図5は、光学検出器Dの概要構成を示している。この光学検出器Dは、フローセル231に測定試料及びシース液を送り込み、フローセル231中に液流を発生させ、フローセル231内を通過する液流に含まれる血球に半導体レーザ光を照射して測定するものであり、シースフロー系232、ビームスポット形成系233、前方散乱光受光系234、側方散乱光受光系235、側方蛍光受光系236を有している。
【0070】
シースフロー系232は、フローセル231内を測定試料がフローセル231内をシース液に包まれた状態で流すように構成されている。ビームスポット形成系233は、半導体レーザ237から照射された光が、コリメータレンズ238とコンデンサレンズ239とを通って、フローセル231に照射されるよう構成されている。また、ビームスポット形成系233は、ビームストッパ240も備えている。
【0071】
前方散乱光受光系234は、前方への散乱光を前方集光レンズ241によって集光し、ピンホール242を通った光をフォトダイオード(前方散乱光受光部)243で受光するように構成されている。
【0072】
側方散乱光受光系235は、側方への散乱光を側方集光レンズ244にて集光するとともに、一部の光をダイクロイックミラー245で反射させ、フォトダイオード(側方散乱光受光部)246で受光するよう構成されている。
【0073】
光散乱は、光の進行方向に血球のような粒子が光の進行方向に障害物として存在すると、粒子により光がその進行方向を変えることによって生じる現象である。この散乱光を検出することによって、粒子の大きさや材質に関する情報を得ることができる。特に、前方散乱光からは、粒子(血球)の大きさに関する情報を得ることができる。また、側方散乱光からは、粒子内部の情報を得ることができる。血球粒子にレーザ光が照射された場合、側方散乱光強度は細胞内部の複雑さ(核の形状、大きさ、密度や顆粒の量)に依存する。したがって、これら散乱光強度は、リンパ芽球/有核赤血球群の測定、有核赤血球の測定、及び白血球の分類その他の測定に利用することができる。
【0074】
側方蛍光受光系236は、ダイクロイックミラー245を透過した光をさらに分光フィルタ247に通し、アバランシェフォトダイオード(蛍光受光部)248で受光するよう構成されている。
【0075】
蛍光物質により染色された血球に光を照射すると、照射した光の波長より長い波長の光を発する。蛍光の強度はよく染色されていれば強くなり、この蛍光強度を測定することによって血球の染色度合いに関する情報を得ることができる。したがって、(側方)蛍光強度の差は、リンパ芽球/有核赤血球群の測定、有核赤血球の測定、及び白血球の分類その他の測定に利用することができる。
【0076】
次に、図4に戻って、検体容器搬送部25の構成について説明する。検体容器搬送部25は、検体容器Tを把持可能なハンド部25aを備えている。ハンド部25aは、互いに対向して配置された一対の把持部材を備えており、この把持部材を互いに近接及び離反させることが可能である。かかる把持部材を、検体容器Tを挟んだ状態で近接させることにより、検体容器Tを把持することができる。また、検体容器搬送部25は、ハンド部25aを上下方向及び前後方向(Y方向)に移動させることができ、さらに、ハンド部25aを揺動させることができる。これにより、サンプルラックLに収容され、検体供給位置43aに位置した検体容器Tをハンド部25aにより把持し、その状態でハンド部25aを上方に移動させることによりサンプルラックLから検体容器Tを抜き出し、ハンド部25aを揺動させることにより、検体容器T内の検体を撹拌することができる。
【0077】
また、検体容器搬送部25は、検体容器Tを挿入可能な穴部を有する検体容器セット部25bを備えている。上述したハンド部25aによって把持された検体容器Tは、撹拌完了後移動され、把持した検体容器Tを検体容器セット部25bの穴部に挿入する。その後、把持部材を離反させることにより、ハンド部25aから検体容器Tが開放され、検体容器セット部25bに検体容器Tがセットされる。かかる検体容器セット部25bは、図示しないステッピングモータの動力によって、図中Y1及びY2方向へ水平移動可能である。
【0078】
測定ユニット2の内部には、バーコード読取部26が設けられている。検体容器セット部25bは、バーコード読取部26の近傍のバーコード読取位置26a及び検体吸引部21による吸引位置21aへ移動可能である。検体容器セット部25bがバーコード読取位置26aへ移動したときには、セットされた検体容器Tが図示しない回転機構により水平回転され、バーコード読取部26により検体バーコードが読み取られる。これにより、検体容器TのバーコードラベルBL1がバーコード読取部26に対して反対側に位置する場合でも、検体容器Tを回転させることにより、バーコードラベルBL1をバーコード読取部26へ向けることができ、バーコード読取部26に検体バーコードを読み取らせることが可能である。また、検体容器セット部25bが吸引位置へ移動したときには、検体吸引部21により、セットされた検体容器Tから検体が吸引される。
【0079】
<検体搬送ユニットの構成>
次に、検体搬送ユニット4の構成について説明する。図1に示すように、血液分析装置1の測定ユニット2の前方には、検体搬送ユニット4が配置されている。かかる検体搬送ユニット4は、測定ユニット2へ検体を供給するために、サンプルラックLを搬送することが可能である。
【0080】
図6は、検体搬送ユニット4の構成を示す平面図である。図6に示すように、検体搬送ユニット4は、分析が行われる前の検体を収容する検体容器Tを保持する複数のサンプルラックLを保持することが可能な分析前ラック保持部41と、測定ユニット2によって検体が吸引された検体容器Tを保持する複数のサンプルラックLを保持することが可能な分析後ラック保持部42と、検体を測定ユニット2に供給するために、サンプルラックLを図中矢印X1方向又はX2方向へ水平に直線移動させ、分析前ラック保持部41から受け付けたサンプルラックLを分析後ラック保持部42へ搬送するラック搬送部43とを備えている。
【0081】
分析前ラック保持部41は、平面視において四角形をなしており、その幅はサンプルラックLの幅より若干大きくなっている。この分析前ラック保持部41は、周囲の面よりも一段低く形成されており、その上面に分析前のサンプルラックLが載置される。また、分析前ラック保持部41の両側面からは、内側へ向けてラック送込部41bが突出可能に設けられている。このラック送込部41bが突出することによりサンプルラックLと係合し、この状態で後方(ラック搬送部43に近接する方向)へ移動することにより、サンプルラックLが後方へと移送される。かかるラック送込部41bは、分析前ラック保持部41の下方に設けられた図示しないステッピングモータによって駆動可能に構成されている。
【0082】
ラック搬送部43は、図6に示すように、分析前ラック保持部41によって移送されたサンプルラックLを、前記X方向へと移送可能となっている。このラック搬送部43によるサンプルラックLの搬送経路上には、図4に示すように、測定ユニット2へ検体を供給するための検体供給位置43aが存在する。検体搬送ユニット4は情報処理ユニット5によって制御され、検体供給位置43aに検体を搬送する。このとき、測定ユニット2のハンド部25aが搬送された検体容器Tを把持し、サンプルラックLから検体容器Tを取り出すことで検体の供給が完了する。また、測定ユニット2から検体容器TをサンプルラックLに返還する場合には、ラック搬送部43は、検体容器Tが取り込まれたときから搬送を待機するか、他の位置へとサンプルラックLを搬送した後、検体容器Tが測定ユニット2に取り込まれたことにより空きとなった保持位置を検体供給位置43aに位置させるようにサンプルラックLを搬送する。これにより、検体容器Tが挿入されていない保持位置が検体供給位置43aに位置している状態で、ハンド部25aが、確実に検体容器TをサンプルラックLへと戻すことが可能である。
【0083】
また、ラック搬送部43は、図6に示すように、それぞれ独立して動作可能な第1ベルト431及び第2ベルト432の2つのベルトを有している。また、第1ベルト431及び第2ベルト432の矢印Y方向の幅b1,b2は、それぞれサンプルラックLの矢印Y方向の幅Bの半分以下の大きさである。かかる第1ベルト431及び第2ベルト432は、ラック搬送部43がサンプルラックLを搬送するときにサンプルラックLの幅Bからはみ出ないように並列に配置されている。図7は、第1ベルト431の構成を示す正面図であり、図8は、第2ベルト432の構成を示す正面図である。図7及び図8に示すように、第1ベルト431及び第2ベルト432は、それぞれ環状に形成されており、第1ベルト431はローラ431a〜431cを取り囲むように配置され、第2ベルト432はローラ432a〜432cを取り囲むように配置されている。また、第1ベルト431の外周部には、サンプルラックLのX方向の幅Wよりも若干(例えば、1mm)大きい内幅w1を有するように2つの突起片431dが設けられており、同様に、第2ベルト432の外周部には、前記内幅w1と同程度の内幅w2を有するように2つの突起片432dが設けられている。第1ベルト431は、2つの突起片431dの内側にサンプルラックLを保持した状態において、ステッピングモータ(図示せず)によりローラ431a〜431cの外周を移動されることによって、サンプルラックLを矢印X方向に移動するように構成されている。第2ベルト432は、2つの突起片432dの内側にサンプルラックLを保持した状態において、ステッピングモータ(図示せず)によりローラ432a〜432cの外周を移動されることによって、サンプルラックLを矢印X方向に移動するように構成されている。また、第1ベルト431及び第2ベルト432は、互いに独立してサンプルラックLを移送可能に構成されている。
【0084】
図4に示すように、ラック搬送部43の搬送路上に検体容器センサ45が設けられている。検体容器センサ45は、接触型のセンサであり、のれん形状の接触片、光を出射する発光素子、及び受光素子(図示せず)を有している。検体容器センサ45は、接触片が検出対象の被検出物に当接することにより屈曲され、その結果、発光素子から出射された光が接触片により反射されて受光素子に入射するように構成されている。これにより検体容器センサ45の下方をサンプルラックLに収容された検出対象の検体容器Tが通過する際に、接触片が検体容器Tにより屈曲されて、検体容器Tを検出することが可能である。
【0085】
図4に示すように、ラック搬送部43を挟んで後述する分析後ラック保持部42に対向するようにラック送出部46が配置されている。かかるラック送出部46は、図示しないステッピングモータの駆動力により矢印Y方向に水平に直線移動するように構成されている。これにより、分析後ラック保持部42とラック送出部46との間の位置461(以下、「分析後ラック送出位置」という。)にサンプルラックLが搬送された場合に、ラック送出部46を分析後ラック保持部42側に移動することによって、サンプルラックLを押動させて分析後ラック保持部42内に移動することが可能である。
【0086】
分析後ラック保持部42は、平面視において四角形をなしており、その幅はサンプルラックLの幅より若干大きくなっている。この分析後ラック保持部42は、周囲の面よりも一段低く形成されており、その上面に分析が完了したサンプルラックLが載置される。分析後ラック保持部42は、上記のラック搬送部43に連なっており、上述したように、ラック送出部46によって、ラック搬送部43からサンプルラックLが送り込まれるようになっている。
【0087】
上記のような構成とすることにより、検体搬送ユニット4は、分析前ラック保持部41に載置されたサンプルラックLをラック搬送部43へと移送し、さらにラック搬送部43によって搬送することにより、検体を測定ユニット2へと供給することができる。また、吸引が完了した検体を収容するサンプルラックLは、ラック搬送部43により、分析後ラック送出位置461へと移送され、ラック送出部46により分析後ラック保持部42へ送出される。複数のサンプルラックLが分析前ラック保持部41に載置された場合では、分析が完了した検体を収容するサンプルラックLが次々にラック送出部46により分析後ラック保持部42へと送出され、これらの複数のサンプルラックLが分析後ラック保持部42に貯留されることとなる。
【0088】
<情報処理ユニットの構成>
次に、情報処理ユニット5の構成について説明する。情報処理ユニット5は、コンピュータにより構成されている。図9は、情報処理ユニット5の構成を示すブロック図である。情報処理ユニット5は、コンピュータ5aによって実現される。図9に示すように、コンピュータ5aは、本体51と、画像表示部52と、入力部53とを備えている。本体51は、CPU51a、ROM51b、RAM51c、ハードディスク51d、読出装置51e、入出力インタフェース51f、通信インタフェース51g、及び画像出力インタフェース51hを備えており、CPU51a、ROM51b、RAM51c、ハードディスク51d、読出装置51e、入出力インタフェース51f、通信インタフェース51g、及び画像出力インタフェース51hは、バス51jによって接続されている。
【0089】
CPU51aは、RAM51cにロードされたコンピュータプログラムを実行することが可能である。そして、後述するような血液分析用並びに測定ユニット2及び検体搬送ユニット4の制御用のコンピュータプログラム54aを当該CPU51aが実行することにより、コンピュータ5aが情報処理ユニット5として機能する。
【0090】
ROM51bは、マスクROM、PROM、EPROM、又はEEPROM等によって構成されており、CPU51aに実行されるコンピュータプログラム及びこれに用いるデータ等が記録されている。
【0091】
RAM51cは、SRAMまたはDRAM等によって構成されている。RAM51cは、ハードディスク51dに記録されているコンピュータプログラム54aの読み出しに用いられる。また、CPU51aがコンピュータプログラムを実行するときに、CPU51aの作業領域として利用される。
【0092】
ハードディスク51dは、オペレーティングシステム及びアプリケーションプログラム等、CPU51aに実行させるための種々のコンピュータプログラム及び当該コンピュータプログラムの実行に用いられるデータがインストールされている。後述するコンピュータプログラム54aも、このハードディスク51dにインストールされている。また、このコンピュータプログラム54aは、イベントドリブン型のコンピュータプログラムである。
【0093】
読出装置51eは、フレキシブルディスクドライブ、CD−ROMドライブ、またはDVD−ROMドライブ等によって構成されており、可搬型記録媒体54に記録されたコンピュータプログラムまたはデータを読み出すことができる。また、可搬型記録媒体54には、コンピュータを情報処理ユニット5として機能させるためのコンピュータプログラム54aが格納されており、コンピュータ5aが当該可搬型記録媒体54からコンピュータプログラム54aを読み出し、当該コンピュータプログラム54aをハードディスク51dにインストールすることが可能である。
【0094】
なお、前記コンピュータプログラム54aは、可搬型記録媒体54によって提供されるのみならず、電気通信回線(有線、無線を問わない)によってコンピュータ5aと通信可能に接続された外部の機器から前記電気通信回線を通じて提供することも可能である。例えば、前記コンピュータプログラム54aがインターネット上のサーバコンピュータのハードディスク内に格納されており、このサーバコンピュータにコンピュータ5aがアクセスして、当該コンピュータプログラムをダウンロードし、これをハードディスク51dにインストールすることも可能である。
【0095】
また、ハードディスク51dには、例えば米マイクロソフト社が製造販売するWindows(登録商標)等のマルチタスクオペレーティングシステムがインストールされている。以下の説明においては、本実施の形態に係るコンピュータプログラム54aは当該オペレーティングシステム上で動作するものとしている。
【0096】
入出力インタフェース51fは、例えばUSB,IEEE1394,又はRS-232C等のシリアルインタフェース、SCSI,IDE,又は IEEE1284等のパラレルインタフェース、及びD/A変換器、A/D変換器等からなるアナログインタフェース等から構成されている。入出力インタフェース51fには、キーボード及びマウスからなる入力部53が接続されており、ユーザが当該入力部53を使用することにより、コンピュータ5aにデータを入力することが可能である。また、入出力インタフェース51fは、測定ユニット2及び検体搬送ユニット4に接続されている。これにより、情報処理ユニット5は、測定ユニット2及び検体搬送ユニット4のそれぞれを制御可能となっている。
【0097】
通信インタフェース51gは、Ethernet(登録商標)インタフェースである。通信インタフェース51gはLANを介してホストコンピュータ6に接続されている(図4参照)。コンピュータ5aは、通信インタフェース51gにより、所定の通信プロトコルを使用して当該LANに接続されたホストコンピュータ6との間でデータの送受信が可能である。
【0098】
画像出力インタフェース51hは、LCDまたはCRT等で構成された画像表示部52に接続されており、CPU51aから与えられた画像データに応じた映像信号を画像表示部52に出力するようになっている。画像表示部52は、入力された映像信号にしたがって、画像(画面)を表示する。
【0099】
[血液分析装置1の測定動作]
以下、本実施の形態に係る血液分析装置1の動作について説明する。
【0100】
<検体測定動作>
まず、本実施の形態に係る血液分析装置1の検体測定動作について説明する。血液分析装置1は、光学検出器Dを用いたリンパ芽球/有核赤血球群測定、NRBC(有核赤血球)測定を実行可能である。かかる測定の工程は、L−Blast測定試料を測定する第1測定工程と、NRBC測定試料を測定する第2測定工程と、第1測定工程及び第2測定工程によって得られた測定データを解析処理するデータ処理工程によって構成される。
【0101】
まず、検体容器Tを保持したサンプルラックLがオペレータによって分析前ラック保持部41に載置される。ラック送込部41bが分析前ラック保持部41に載置されたサンプルラックLに係合し、後方へと搬送され、ラック搬送部43へと送られる。その後、ラック搬送部43によって当該サンプルラックLが搬送され、測定対象の検体が収容されている検体容器Tが検体供給位置43aに位置する。次に、測定ユニット2のハンド部25aにより、当該検体容器Tが把持され、サンプルラックLからこの検体容器Tが取り出される。ハンド部25aはその後揺動運動を行い、検体容器Tの内部の検体が撹拌される。次に、検体容器セット部25bにこの検体容器Tが挿入され、Y方向へと検体容器セット部25bが移動し、バーコード読取部26による検体バーコード読み取りを行った後、吸引位置に到達する。その後、以下の第1測定工程及び第2測定工程が実行される。
【0102】
第1測定工程
まず、第1測定工程について説明する。血液分析装置1は、第1測定工程では、全血検体(19.0μL)と第1試薬(1.02mL)とを混合してL−Blast測定試料を作成し、このL−Blast測定試料を光学検出器Dにてフローサイトメトリー法によって測定する。
【0103】
ここで、第1試薬として、以下に示される試薬を用いた。
<第1試薬>
MOPSO 2.25g/L
ポリオキシエチレン(20)オレイルエーテル 10.0g/L
N−ラウロイルサルコシン酸ナトリウム 0.5g/L
Proxel GXL 0.40g/L
EDTA−2K 0.50g/L
キシリトール 40.22g/L
NK−321 1.0mg/L
pH: 7.0
浸透圧: 300mOsm/Kg
電気伝導度: 0.745mS/cm
【0104】
なお、全血検体として以下に示される3つの検体を用いた。
【表1】

表1中、「○」は対象の血球(リンパ芽球又は有核赤血球)が存在することを示し、「×」は対象の血球が存在しないことを示す。
【0105】
図10は、第1測定工程での血液分析装置1の動作手順を示すフローチャートである。まず、CPU51aは、検体吸引部21を制御して、吸引管211により検体容器Tの全血検体を定量吸引する(ステップS101)。ステップS101の処理は、具体的には、吸引管211が検体容器Tの中に挿入され、シリンジポンプの駆動によって、全血検体が定量(39.0μL)吸引される。
【0106】
次に、CPU51aが測定ユニット2を制御することにより、試薬容器221から第1試薬(1.02mL)が、吸引管211から全血検体(19.0μL)が第1混合チャンバMC1にそれぞれ供給される(ステップS102)。CPU51aは、第1混合チャンバMC1への第1試薬及び全血検体の供給から18.5秒間経過したか否かを判定し(ステップS103)、18.5秒間待機する。ここで、ヒータにより第1混合チャンバMC1は35.0℃に加温されており、これにより、第1試薬と血液検体との混合液が35.0℃で18.5秒加温され、L−Blast測定試料が調製される。
【0107】
そして、L−Blast測定試料を対象に光学検出器Dにて光学測定が行われる(ステップS104)。ステップS104の処理においては、具体的には、L−Blast測定試料とシース液とが同時に光学検出器Dのフローセル231に供給され、そのときの前方散乱光がフォトダイオード243で受光され、側方散乱光がフォトダイオード246で受光され、アバランシェフォトダイオード248で受光される。このような光学検出器Dの各受光素子により出力される出力信号(アナログ信号)は図示しないA/D変換器によりデジタル信号に変換され、図示しない信号処理回路により所定の信号処理が施されてデジタルデータである第1測定データに変換され、情報処理ユニット5にこの第1測定データが送信される。この信号処理においては、第1測定データに含まれる特徴パラメータとして、前方散乱光信号(前方散乱光強度)、側方散乱光信号(側方散乱光強度)、及び側方蛍光信号(側方蛍光強度)が得られる。これにより、第1測定工程が終了する。また、後述するように、情報処理ユニット5のCPU51aは、第1測定データに対して所定の解析処理を実行することにより、NEUT、LYMPH、EO、BASO、MONO、及びWBC等の数値データを含む分析結果データを生成し、ハードディスク51dに分析結果データを記憶する。
【0108】
第2測定工程
次に、第2測定工程について説明する。この第2測定工程は、第1測定工程と時間的に一部重複して実行される。血液分析装置1は、第2測定工程では、全血検体(17.0μL)と第2試薬(1.0mL)と第3試薬(0.030mL)とを混合してNRBC測定試料を作成し、このNRBC測定試料を光学検出器Dにてフローサイトメトリー法によって測定する。ここで第2試薬としては、上述のストマトライザーNR溶血剤を使用し、第3試薬としては、上述のストマトライザーNR染色液を用いた。
【0109】
図11は、第2測定工程での血液分析装置1の動作手順を示すフローチャートである。CPU51aは測定ユニット2を制御することにより、試薬容器222aから第2試薬(1.0mL)を、試薬容器222bから第3試薬(0.030mL)を、吸引管211から全血検体(17.0μL)を第2混合チャンバMC2にそれぞれ供給する(ステップS201)。このステップS201において第2混合チャンバMC2に供給される検体は、上述したステップS101において吸引管211により吸引された全血検体の一部である。つまり、ステップS101においては、第1混合チャンバMC1に供給する検体と、第2混合チャンバMC2に供給される検体とが一度に検体容器Tから吸引される。
【0110】
次に、CPU51aは、第2混合チャンバMC2への第2試薬、第3試薬及び全血検体の供給から7.0秒間経過したか否かを判定し(ステップS202)、7.0秒間待機する。ここで、ヒータにより第2混合チャンバMC2は41.0℃に加温されており、これにより、第2試薬と第3試薬と血液検体との混合液が41.0℃で7.0秒加温され、NRBC測定試料が調製される。
【0111】
そして、NRBC測定試料を対象に光学検出器Dにて光学測定が行われる(ステップS203)。ステップS203の処理においては、具体的には、NRBC測定試料とシース液とが同時に光学検出器Dのフローセル231に供給され、そのときの前方散乱光がフォトダイオード243で受光され、側方散乱光がフォトダイオード246で受光され、アバランシェフォトダイオード248で受光される。このような光学検出器Dの各受光素子により出力される出力信号(アナログ信号)は、上述した第1測定工程と同様に、デジタル信号に変換され、所定の信号処理が施されてデジタルデータである第2測定データに変換され、情報処理ユニット5にこの第2測定データが送信される。この信号処理においては、第2測定データに含まれる特徴パラメータとして、前方散乱光信号(前方散乱光強度)、側方散乱光信号(側方散乱光強度)、及び側方蛍光信号の(側方蛍光強度)が得られる。これにより、第2測定工程が終了する。また、後述するように、情報処理ユニット5のCPU51aは、第2測定データに対して所定の解析処理を実行することにより、NRBCの数値データを含む分析結果データを生成し、ハードディスク51dに分析結果データを記憶する。
【0112】
データ処理工程
次に、データ処理工程について説明する。図12は、データ処理工程での血液分析装置1の処理手順を示すフローチャートである。血液分析装置1の情報処理ユニット5は、測定ユニット2から測定データを受信する(ステップS301)。ここで、受信された測定データには第1測定データ及び第2測定データが含まれる。CPU51aによって実行されるコンピュータプログラム54aはイベントドリブン型のプログラムであり、測定データを受信するイベントが発生すると、ステップS302の処理が呼び出される。
【0113】
ステップS302において、CPU51aは、第1測定データを用いてリンパ芽球/有核赤血球群と他の血球群とを分類し、リンパ芽球/有核赤血球群に含まれる血球数を計数する(ステップS302)。かかる処理について詳しく説明する。図13Aは、第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラム(粒度分布図)であり、図13Bは、第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラムである。
【0114】
図13Aに示す第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラムでは、骨髄芽球のクラスター、幼若顆粒球のクラスター、好塩基球のクラスター、好中球と好酸球とによってなる血球群のクラスター、リンパ球のクラスター、単球のクラスター、及びリンパ芽球/有核赤血球群のクラスターが現れる。また、図13Bに示す第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラムでは、幼若顆粒球と骨髄芽球とからなる血球群のクラスターと、顆粒球(好中球と好酸球と好塩基球とからなる血球群)のクラスター、単球のクラスター、リンパ球のクラスター、及びリンパ芽球/有核赤血球群のクラスターが現れる。これらのスキャッタグラムに示されるように、第1測定データの蛍光強度を利用することによって、リンパ芽球/有核赤血球群のクラスターを、他のクラスターから弁別することができる。ステップS302の処理においては、CPU51aは、第1測定データの側方散乱光強度及び蛍光強度を用いて、リンパ芽球/有核赤血球群を他のクラスターと弁別し、これによってリンパ芽球/有核赤血球群を検出する。さらに、CPU51aは、検出されたリンパ芽球/有核赤血球群に含まれる血球の数を計数する。
【0115】
次にステップS303において、CPU51aは、第2測定データを用いて有核赤血球群と他の血球群とを分類し、有核赤血球の数を計数する(ステップS303)。かかる処理について詳しく説明する。図14は、第2測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラムである。図14に示す第2測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラムでは、有核赤血球のクラスター、白血球のクラスター、及び赤血球ゴーストのクラスターが現れる。このスキャッタグラムに示されるように、第2測定データの前方散乱光強度及び側方蛍光強度を利用することにより、有核赤血球のクラスターを、他のクラスターから弁別することができる。ステップS303の処理においては、CPU51aは、第2測定データの前方散乱光強度及び蛍光強度を用いて、有核赤血球を他のクラスターから弁別し、これによって有核赤血球を検出する。さらに、CPU51aは、検出された有核赤血球の数を計数する。
【0116】
次にステップS304において、CPU51aは、ステップS302において取得したリンパ芽球/有核赤血球群に含まれる血球数NLと、ステップS303において取得した有核赤血球数NNとの差が、所定の基準値T以上であるか否かを判定する(ステップS304)。ここで、基準値Tは、NL−NNの値がこの基準値T以上の場合には、血液検体にリンパ芽球が含まれていると考えることができ、NL−NNの値が基準値T未満の場合には、血液検体にリンパ芽球が含まれていないと考えることができるものとして、リンパ芽球/有核赤血球群に含まれる血球数NL及び有核赤血球数NNの誤差を勘案して予め設定される。したがって、この処理においてNL−NN≧Tである場合は(ステップS304においてYES)、血液検体中にリンパ芽球が含まれていると判断することができる。よってこの場合には、CPU51aは、RAM51cに設けられたリンパ芽球フラグに「1」をセットする(ステップS305)。ここで、リンパ芽球フラグは血液検体におけるリンパ芽球の有無を示すフラグであり、「1」がセットされている場合にはリンパ芽球が存在していることを示し、「0」がセットされている場合にはリンパ芽球が存在していないことを示す。その後、CPU51aは、ステップS307へ処理を移す。
【0117】
一方、ステップS304においてNL−NN<Tである場合は(ステップS304においてNO)、血液検体中にリンパ芽球が含まれていないと判断することができる。よってこの場合には、CPU51aは、リンパ芽球フラグに「0」をセットする(ステップS306)。その後、CPU51aは、ステップS307へ処理を移す。
【0118】
ステップS307において、CPU51aは、上述のようにして得た分析結果(有核赤血球数、及びリンパ芽球フラグを含む)をハードディスク51dに格納する(ステップS307)。次にCPU51aは、ハードディスク51dに記憶した分析結果を示す分析結果画面を画像表示部52に表示させ(ステップS308)、処理を終了する。
【0119】
図15A、図15B及び図15Cは、血液分析装置1の分析結果画面を示す図である。図15Aは、血液検体Aの分析結果画面を示している。図15Bは、血液検体Bの分析結果画面を示している。図15Cは、血液検体Cの分析結果画面を示している。図15A〜Cに示すように、分析結果画面R1,R2及びR3においては、測定された測定項目(WBC、RBC、PLT、NRBC等)の数値データが表示される。血液検体Aにはリンパ芽球が含まれており、この血液検体Aに係る分析結果データでは、リンパ芽球フラグが「1」にセットされている。したがって、血液検体Aの分析結果画面R1では、図15Aに示すように、リンパ芽球項目が存在している可能性を示す情報である「L−Blast?」の表示が、Flagの欄Fに付される。一方、血液検体B及び血液検体Cにはリンパ芽球が含まれておらず、血液検体Bに係る分析結果データ及び血液検体Cに係る分析結果データでは、リンパ芽球フラグが「0」にセットされている。したがって、血液検体Bの分析結果画面R2及び血液検体Cの分析結果画面R3では、図15B及び図15CのFlagの欄Fに示すように、上記の「L−Blast?」の表示は付されない。また、血液検体Cは有核赤血球を含んでいるため、血液検体Cの分析結果画面R3では、図15Cに示すように、有核赤血球の存在を示す情報である「NRBC present」の表示が、Flagの欄Fに付される。これによって、オペレータは分析結果画面を見るだけで、その血液検体にリンパ芽球が検出されたか否かを把握することができる。また、この分析結果画面R1,R2及びR3には、第1測定データの側方散乱光強度及び側方蛍光強度のスキャッタグラムSL1,SL2及びSL3が表示される。さらに、この分析結果画面R1,R2及びR3には、第2測定データの側方散乱光強度及び側方蛍光強度のスキャッタグラムSN1,SN2及びSN3が表示される。オペレータはこのスキャッタグラムを参照することによって、血液分析装置1によるリンパ芽球の有無の検出結果の根拠を把握することができ、また血液分析装置1によるリンパ芽球の有無の検出結果の妥当性を判断することができる。
【0120】
ここで、スキャッタグラムの具体例を用いて、リンパ芽球の検出について詳細に説明する。図16Aは、血液検体Aの第1測定データにおける前方散乱光強度及び蛍光強度のスキャッタグラムであり、図16Bは、血液検体Aの第1測定データにおける側方散乱光強度及び蛍光強度のスキャッタグラムである。また、図17は、血液検体Aの第2測定データにおける前方散乱光強度及び蛍光強度のスキャッタグラムである。さらに、図18Aは、血液検体Cの第1測定データにおける前方散乱光強度及び蛍光強度のスキャッタグラムであり、図18Bは、血液検体Cの第1測定データにおける側方散乱光強度及び蛍光強度のスキャッタグラムである。図19は、血液検体Cの第2測定データにおける前方散乱光強度及び蛍光強度のスキャッタグラムである。
【0121】
図16A及び図16Bから明らかなように、血液検体Aでは、リンパ芽球/有核赤血球群のクラスターがスキャッタグラム上で確認できる。一方、図17から明らかなように、血液検体Aでは、有核赤血球のクラスターがスキャッタグラム上で確認できない。このことは、図16A及び図16Bに出現しているリンパ芽球/有核赤血球群のクラスターが主としてリンパ芽球によって形成されているということを示しており、ここから血液検体Aにリンパ芽球が存在することが分かる。
【0122】
また、図18A及び図18Bから明らかなように、血液検体Cでは、リンパ芽球/有核赤血球群のクラスターがスキャッタグラム上で確認できる。加えて、血液検体Cにおけるリンパ芽球/有核赤血球群のクラスターは、血液検体Aにおけるリンパ芽球/有核赤血球群のクラスターよりも規模が小さく、血球数が少ないことが分かる。さらに、図19から明らかなように、血液検体Cでは、有核赤血球のクラスターがスキャッタグラム上で確認できる。このことは、図18A及び図18Bに出現しているリンパ芽球/有核赤血球群のクラスターが主として有核赤血球によって形成されているということを示している。つまり、このことは、血液検体Cにおいては、リンパ芽球ではなく、有核赤血球が存在していることを示唆している。
【0123】
このように、第1測定データ及び第2測定データから得られるスキャッタグラムを参照することで、より正確に血液分析装置1によるリンパ芽球の有無の検出結果の根拠を把握することができ、また血液分析装置1によるリンパ芽球の有無の検出結果の妥当性を判断することができる。
【0124】
以上のような構成とすることにより、血液分析装置1は、血液検体と核酸を染色する蛍光色素が含有された第1試薬とを混合して調製したL−Blast測定試料を光学検出器Dにより測定することにより、リンパ芽球/有核赤血球群を検出し、そのリンパ芽球/有核赤血球群に含まれる血球数を測定することができる。また、この血球数と、第2測定工程によって得られた有核赤血球数とによって、血液検体にリンパ芽球が含まれているか否かを検出することができる。したがって、血液分析装置1の上記測定に蛍光標識抗体が用いられることがなく、測定コストを抑制しつつ、リンパ芽球の検出を行うことが可能である。
【0125】
(その他の実施の形態)
なお、試料調製部22における、血液検体と第1試薬との混合の際の反応温度及び反応時間は、血液検体中の血球の損傷や染色の状態により適宜設定すればよく、特に制限されない。具体的には、反応温度が高いときは反応時間を短くし、反応温度が低いときは反応時間を長くするように調整することができる。より具体的には、血液検体と試薬の混合は、20℃〜40℃の温度において、3〜20秒間行うことが好ましい。
【0126】
また、上述した実施の形態においては、溶血剤及び核酸を染色できる蛍光色素を含む第1試薬を用いて、第1測定工程を行う構成について述べたが、これに限定されるものではない。溶血剤を含む試薬と、核酸染色色素を含む試薬とを別々に設け、これらの2つの試薬を血液検体と混合してL−Blast測定試料を調製し、リンパ芽球/有核赤血球群の検出及びリンパ芽球/有核赤血球群の血球数の測定を行う構成としてもよい。この場合、界面活性剤、可溶化剤及び蛍光色素の濃度は、上記2つの試薬を混合した際に、上述の濃度になるように調整される。ここで、溶血剤を含む試薬及び核酸染色色素を含む試薬の混合比は、1000:1〜10:1が好ましい。
【0127】
上記の試薬キットを用いる場合、試薬キットの各試薬と血液検体とを混合する順序は特に限定されないが、2つの試薬を混合し、次いで混合した試薬に血液検体を混合することが好ましい。
【0128】
また、上述した実施の形態においては、第1測定工程と第2測定工程とを実行し、第1測定工程によって得られる第1測定データ及び第2測定工程によって得られる第2測定データによって血液検体にリンパ芽球が含まれているか否かを検出する構成について述べたが、これに限定されるものではない。図13Aに示すように、リンパ芽球/有核赤血球群のクラスターにおいて、蛍光強度が低い部分にはリンパ芽球のクラスターと有核赤血球のクラスターとが重複し、蛍光強度が高い部分にはリンパ芽球のみが出現している。つまり、リンパ芽球/有核赤血球群のクラスターにおいて、有核赤血球のクラスターの蛍光強度の上限値付近に蛍光強度の基準値を設け、リンパ芽球/有核赤血球群のクラスター内で蛍光強度がこの基準値以上の粒子が検出された場合には、リンパ芽球が存在すると判断し、蛍光強度が当該基準値以上の粒子が検出されなかった場合には、リンパ芽球が存在しないと判断することもできる。この場合には、有核赤血球の検出のための第2測定工程を行わなくてもリンパ芽球の有無を判断することができるため、より一層血液分析装置1の構成を簡単にすることができ、また測定コストを低減することができる。
【0129】
また、上述した実施の形態においては、第1測定データに基づいてリンパ芽球/有核赤血球群の検出及びリンパ芽球/有核赤血球群に含まれる血球の計数を行い、第2測定データに基づいて有核赤血球の検出及び有核赤血球の計数を行い、リンパ芽球/有核赤血球群の血球数と有核赤血球数との差を求め、この差と基準値Tとの比較によりリンパ芽球の有無を判断する構成について述べたが、これに限定されるものではない。第1測定データに基づいてリンパ芽球/有核赤血球群の検出及び第2測定データに基づいて有核赤血球の検出を行い、リンパ芽球/有核赤血球群として検出される粒子が存在し、且つ、有核赤血球として検出される粒子が存在しない場合には、リンパ芽球が存在すると判断し、それ以外の場合には、リンパ芽球が存在しないと判断する構成としてもよい。また、リンパ芽球/有核赤血球群の血球数と有核赤血球数との差を、リンパ芽球数として分析結果画面に表示することもでき、リンパ芽球/有核赤血球群の血球数と有核赤血球数との差に対して、所定数を差し引いた結果の数を、リンパ芽球数として分析結果画面に表示することもできる。
【0130】
また、上述した実施の形態においては、リンパ芽球/有核赤血球群に含まれる血球数NLと有核赤血球数NNとの差NL−NNが基準値T以上の場合には、血液検体中にリンパ芽球が存在すると判断し、NL−NNが基準値T未満の場合には、血液検体中にリンパ芽球が存在しないと判断する構成について述べたが、リンパ芽球/有核赤血球群に含まれる血球数NLが有核赤血球数NNよりも大きい場合には、血液検体中にリンパ芽球が存在すると判断し、血球数NLが有核赤血球数NN以下の場合には、血液検体中にリンパ芽球が存在しないと判断する構成としてもよい。
【0131】
上述したように、図13Aに示す第1測定データにおける側方散乱光強度及び側方蛍光強度のスキャッタグラムでは、骨髄芽球のクラスター、幼若顆粒球のクラスター、好塩基球のクラスター、好中球と好酸球とによってなる血球群のクラスター、リンパ球のクラスター、単球のクラスター、及びリンパ芽球/有核赤血球群のクラスターが現れる。したがって、この第1測定データにおける側方散乱光強度及び側方蛍光強度を用いて、骨髄芽球のクラスターと他のクラスターとを分類し、骨髄芽球のクラスターに含まれる血球が存在する場合には、その存在を示す情報又は骨髄芽球のクラスターに含まれる血球数(骨髄芽球数)を分析結果画面に表示する構成としてもよい。また、第1測定データにおける側方散乱光強度及び側方蛍光強度を用いて、幼若顆粒球のクラスターと他のクラスターとを分類し、幼若顆粒球のクラスターに含まれる血球が存在する場合には、その存在を示す情報又は幼若顆粒球のクラスターに含まれる血球数(幼若顆粒球数)を分析結果画面に表示する構成としてもよい。
【0132】
さらに、第1測定データにおける側方散乱光強度及び側方蛍光強度を用いて、成熟白血球を、リンパ球、好塩基球、単球、及び好中球と好酸球とからなる血球群に分類し、リンパ球、好塩基球、単球、及び好中球と好酸球とからなる血球群に含まれる血球をそれぞれ計数し、分析結果画面にそれぞれの血球数を表示する構成としてもよい。また、上記の好中球と好酸球とからなる血球群に好塩基球も含まれているものとし、顆粒球としてリンパ球及び単球と区別して、成熟白血球をリンパ球、単球及び顆粒球に分類し、それぞれのクラスターに含まれる血球を計数し、リンパ球数、単球数、顆粒球数を分析結果画面に表示する構成としてもよい。
【0133】
また、上述した実施の形態においては、第1測定データにおける側方散乱光強度及び側方蛍光強度を用いて、リンパ芽球/有核赤血球群の検出を行う構成について述べたが、これに限定されるものではない。図13Bに示すように、第1測定データにおける前方散乱光強度及び側方蛍光強度のスキャッタグラムでは、幼若顆粒球と骨髄芽球とからなる血球群のクラスター、顆粒球(好中球と好酸球と好塩基球とからなる血球群)のクラスター、単球のクラスター、リンパ球のクラスター、及びリンパ芽球/有核赤血球群のクラスターが現れる。したがって、第1測定データにおける前方散乱光強度及び側方蛍光強度を用いて、リンパ芽球/有核赤血球群の検出を行う構成とし、さらにはリンパ芽球/有核赤血球群に含まれる血球を計数する構成としてもよい。また、第1測定データにおける前方散乱光強度及び側方蛍光強度を用いて、骨髄芽球と幼若顆粒球とからなる血球群のクラスターと他のクラスターとを分類し、骨髄芽球と幼若顆粒球とからなる血球群のクラスターに含まれる血球が存在する場合には、その存在を示す情報又は骨髄芽球と幼若顆粒球とからなる血球群のクラスターに含まれる血球数を分析結果画面に表示する構成としてもよい。
【0134】
さらに、第1測定データにおける前方散乱光強度及び側方蛍光強度を用いて、成熟白血球を、リンパ球、単球、及び顆粒球に分類し、リンパ球、単球、及び顆粒球をそれぞれ計数し、分析結果画面にそれぞれの血球数を表示する構成としてもよい。
【0135】
また、図13A及び図13Bに示すように、第1測定データに含まれる側方蛍光強度だけを用いて、リンパ芽球/有核赤血球群、成熟白血球(リンパ球、単球、及び顆粒球)、及び骨髄芽球と幼若顆粒球とからなる血球群を弁別することができる。したがって、第1測定データに含まれる側方蛍光強度を用いて、リンパ芽球/有核赤血球群の領域(蛍光強度が高い領域)と、成熟白血球(蛍光強度が中程度の領域)と、骨髄芽球と幼若顆粒球とからなる血球群の領域(蛍光強度が低い領域)とに区分し、領域毎に血球を計数し、リンパ芽球/有核赤血球群の血球数、成熟白血球数、及び骨髄芽球と幼若顆粒球とからなる血球群の血球数を取得する構成としてもよい。
【0136】
また、上述した実施の形態においては、血液分析装置1が第2測定工程を実施し、データ処理工程において有核赤血球群を検出する構成について述べたが、これに限定されるものではない。すなわち、有核赤血球群の検出に関する情報を、血液分析装置1とは異なる他の血液分析装置又は用手法により取得し、取得した情報を血液分析装置1の入力手段を用いて入力する構成としても良い。ここで、血液分析装置1の入力手段としては、上述の入力部53及び通信インタフェース51g等が挙げられる。より具体的には、上述の入出力インタフェース51fに接続されているキーボード及びマウスからなる入力部53を用いて有核赤血球群の検出に関する情報を血液分析装置1に入力することができる。また、通信インタフェース51gを用いて血液分析装置1と上記の他の血液分析装置を接続し、通信インタフェース51g介して有核赤血球群の検出に関する情報を血液分析装置1に入力することもできる。
【0137】
また、上述した実施の形態においては、CPU51aが上記のコンピュータプログラム54aを実行することにより、測定ユニット2の制御及び測定データの処理を行う構成について述べたがこれに限定されるものではない。上記コンピュータプログラム54aと同様の処理を実行することが可能なFPGA又はASIC等の専用ハードウェアにより、測定ユニット2の制御及び測定データの処理を実行する構成としてもよい。
【0138】
また、上述した実施の形態においては、単一のコンピュータ5aによりコンピュータプログラム54aの全ての処理を実行する構成について述べたが、これに限定されるものではなく、上述したコンピュータプログラム54aと同様の処理を、複数の装置(コンピュータ)により分散して実行する分散システムとすることも可能である。
【産業上の利用可能性】
【0139】
本発明の検体検査システムは、血液検体を光学的に測定し、血液検体に含まれる細胞群を複数に分類する血液分析装置として有用である。
【符号の説明】
【0140】
1 血液分析装置
2 測定ユニット
22 試料調製部
221,222a,222b,223 試薬容器
23 検出部
231 フローセル
237 半導体レーザ
243 フォトダイオード
246 フォトダイオード
248 アバランシェフォトダイオード
5 情報処理ユニット
5a コンピュータ
51 本体
51a CPU
51b ROM
51c RAM
51d ハードディスク
51h 画像出力インタフェース
52 画像表示部
54a コンピュータプログラム
MC1 第1混合チャンバ
MC2 第2混合チャンバ
H ヒータ
D 光学検出器
R1,R2,R3 分析結果画面
SL1,SL2,SL3 スキャッタグラム
SN1,SN2,SN3 スキャッタグラム
【特許請求の範囲】
【請求項1】
血液検体を供給する血液検体供給部と、
前記血液検体供給部から供給された血液検体と、核酸を染色する蛍光色素とを混合して測定試料を調製する試料調製部と、
前記測定試料に光を照射する光源と、
前記光が照射された測定試料から発せられる蛍光を受光する光学検出部と、
前記光学検出部によって受光された蛍光に基づいて、前記測定試料中に含まれるリンパ芽球を含む細胞群を検出する情報処理手段と、
前記情報処理手段による検出結果に基づいて、前記血液検体におけるリンパ芽球の出現に関する情報を出力する出力手段と、
を備える、血液分析装置。
【請求項2】
前記血液検体供給部は、血液検体から分割された第1血液検体及び第2血液検体を供給するように構成されており、
前記試料調製部は、前記第1血液検体と、第1溶血剤及び前記蛍光色素である第1蛍光色素とを混合して第1測定試料を調製し、前記第2血液検体と、前記第1溶血剤とは異なる第2溶血剤及び核酸を染色する第2蛍光色素とを混合して第2測定試料を調製するように構成されており、
前記光学検出部は、前記光源が前記第1測定試料に光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記蛍光に応じた第1信号を出力し、前記光源が前記第2測定試料に光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記散乱光及び蛍光に応じた第2信号を出力するように構成されており、
前記情報処理手段は、前記光学検出部が出力した前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む前記細胞群を検出し、前記光学検出部が出力した前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を検出するように構成されており、
前記出力手段は、前記情報処理手段による前記第1信号に基づく前記リンパ芽球及び有核赤血球を含む細胞群に係る検出結果並びに前記前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果に基づいて、リンパ芽球の出現に関する情報を出力するように構成されている、請求項1に記載の血液分析装置。
【請求項3】
前記光源は、前記第1測定試料の流れに向けて光を照射するように構成されており、
前記光学検出部は、前記光源が前記第1測定試料の流れに光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記第1信号を出力するように構成されており、
前記情報処理手段は、前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む細胞群に含まれる細胞を計数するように構成されており、
前記出力手段は、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数と、前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果とに基づいて、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されている、請求項2に記載の血液分析装置。
【請求項4】
前記光源は、前記第2測定試料の流れに向けて光を照射するように構成されており、
前記光学検出部は、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、
前記情報処理手段は、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、
前記出力手段は、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数が有核赤血球の数よりも大きい場合に、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されている、請求項3に記載の血液分析装置。
【請求項5】
前記光源は、前記第2測定試料の流れに向けて光を照射するように構成されており、
前記光学検出部は、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、
前記情報処理手段は、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、
前記出力手段は、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数から、有核赤血球の数を差し引いた数が所定値よりも大きい場合に、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されている、請求項3に記載の血液分析装置。
【請求項6】
前記光源は、前記第1測定試料の流れに向けて光を照射するように構成されており、
前記光学検出部は、前記光源が前記第1測定試料の流れに光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記第1信号を出力するように構成されており、
前記情報処理手段は、前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む細胞群に含まれる細胞を計数するように構成されており、
前記出力手段は、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数と、前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果とに基づいて、前記リンパ芽球の計数結果を出力するように構成されている、請求項2に記載の血液分析装置。
【請求項7】
前記光源は、前記第2測定試料の流れに向けて光を照射するように構成されており、
前記光学検出部は、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、
前記情報処理手段は、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、
前記出力手段は、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数から、有核赤血球の数を差し引いた数を、前記リンパ芽球の計数結果として出力するように構成されている、請求項6に記載の血液分析装置。
【請求項8】
前記血液検体に含まれる有核赤血球に係る検出結果に関する情報を入力するための入力手段をさらに備え、
前記出力手段は、前記情報処理手段による検出結果及び前記入力手段に入力された有核赤血球の出現に関する情報に基づいて、リンパ芽球の出現に関する情報を出力するように構成されている、請求項1に記載の血液分析装置。
【請求項9】
前記情報処理手段は、前記光学検出部によって受光された蛍光に基づいて、測定試料中に含まれるリンパ芽球及び有核赤血球を含む第1細胞群と、前記測定試料中に含まれる骨髄芽球及び幼若顆粒球を含む第2細胞群とを検出するように構成されており、
前記出力手段は、前記血液検体における骨髄芽球の出現に関する情報、及び前記血液検体における幼若顆粒球の出現に関する情報をさらに出力するように構成されている、請求項1乃至8の何れかに記載の血液分析装置。
【請求項10】
前記情報処理手段は、前記光学検出部によって受光された蛍光に基づいて、前記第1細胞群と、前記第2細胞群と、測定試料中に含まれる成熟白血球を含む第3細胞群とを検出するように構成されており、
前記出力手段は、成熟白血球の出現に関する情報を出力するように構成されている、請求項9に記載の血液分析装置。
【請求項11】
前記光学検出部は、さらに前記光が照射された測定試料から発せられる散乱光を受光するように構成されており、
前記情報処理手段は、前記光学検出部によって受光された散乱光及び蛍光に基づいて、前記第2細胞群を、骨髄芽球を含む細胞群と、幼若顆粒球を含む細胞群とにさらに分類するように構成されている、請求項9に記載の血液分析装置。
【請求項12】
前記情報処理手段は、前記光学検出部によって受光された蛍光に基づいて、前記第1細胞群と、前記第2細胞群と、測定試料中に含まれる成熟白血球を含む第3細胞群とを検出し、前記光学検出部によって受光された散乱光及び蛍光に基づいて、前記第3細胞群を、少なくとも3種類の成熟白血球に分類するように構成されている、請求項11に記載の血液分析装置。
【請求項13】
前記光学検出部は、前記散乱光として、前記光が照射された測定試料から発せられる前方散乱光又は側方散乱光を受光するように構成されている、請求項11又は12に記載の血液分析装置。
【請求項1】
血液検体を供給する血液検体供給部と、
前記血液検体供給部から供給された血液検体と、核酸を染色する蛍光色素とを混合して測定試料を調製する試料調製部と、
前記測定試料に光を照射する光源と、
前記光が照射された測定試料から発せられる蛍光を受光する光学検出部と、
前記光学検出部によって受光された蛍光に基づいて、前記測定試料中に含まれるリンパ芽球を含む細胞群を検出する情報処理手段と、
前記情報処理手段による検出結果に基づいて、前記血液検体におけるリンパ芽球の出現に関する情報を出力する出力手段と、
を備える、血液分析装置。
【請求項2】
前記血液検体供給部は、血液検体から分割された第1血液検体及び第2血液検体を供給するように構成されており、
前記試料調製部は、前記第1血液検体と、第1溶血剤及び前記蛍光色素である第1蛍光色素とを混合して第1測定試料を調製し、前記第2血液検体と、前記第1溶血剤とは異なる第2溶血剤及び核酸を染色する第2蛍光色素とを混合して第2測定試料を調製するように構成されており、
前記光学検出部は、前記光源が前記第1測定試料に光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記蛍光に応じた第1信号を出力し、前記光源が前記第2測定試料に光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記散乱光及び蛍光に応じた第2信号を出力するように構成されており、
前記情報処理手段は、前記光学検出部が出力した前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む前記細胞群を検出し、前記光学検出部が出力した前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を検出するように構成されており、
前記出力手段は、前記情報処理手段による前記第1信号に基づく前記リンパ芽球及び有核赤血球を含む細胞群に係る検出結果並びに前記前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果に基づいて、リンパ芽球の出現に関する情報を出力するように構成されている、請求項1に記載の血液分析装置。
【請求項3】
前記光源は、前記第1測定試料の流れに向けて光を照射するように構成されており、
前記光学検出部は、前記光源が前記第1測定試料の流れに光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記第1信号を出力するように構成されており、
前記情報処理手段は、前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む細胞群に含まれる細胞を計数するように構成されており、
前記出力手段は、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数と、前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果とに基づいて、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されている、請求項2に記載の血液分析装置。
【請求項4】
前記光源は、前記第2測定試料の流れに向けて光を照射するように構成されており、
前記光学検出部は、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、
前記情報処理手段は、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、
前記出力手段は、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数が有核赤血球の数よりも大きい場合に、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されている、請求項3に記載の血液分析装置。
【請求項5】
前記光源は、前記第2測定試料の流れに向けて光を照射するように構成されており、
前記光学検出部は、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、
前記情報処理手段は、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、
前記出力手段は、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数から、有核赤血球の数を差し引いた数が所定値よりも大きい場合に、前記血液検体におけるリンパ芽球の出現を示す情報を出力するように構成されている、請求項3に記載の血液分析装置。
【請求項6】
前記光源は、前記第1測定試料の流れに向けて光を照射するように構成されており、
前記光学検出部は、前記光源が前記第1測定試料の流れに光を照射したときに前記第1測定試料から発せられる蛍光を受光して前記第1信号を出力するように構成されており、
前記情報処理手段は、前記第1信号に基づいて、前記第1測定試料中に含まれるリンパ芽球及び有核赤血球を含む細胞群に含まれる細胞を計数するように構成されており、
前記出力手段は、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数と、前記第2信号に基づく前記第2測定試料中に含まれる有核赤血球に係る検出結果とに基づいて、前記リンパ芽球の計数結果を出力するように構成されている、請求項2に記載の血液分析装置。
【請求項7】
前記光源は、前記第2測定試料の流れに向けて光を照射するように構成されており、
前記光学検出部は、前記光源が前記第2測定試料の流れに光を照射したときに前記第2測定試料から発せられる散乱光及び蛍光を受光して前記第2信号を出力するように構成されており、
前記情報処理手段は、前記第2信号に基づいて、前記第2測定試料中に含まれる有核赤血球を計数するように構成されており、
前記出力手段は、前記リンパ芽球及び有核赤血球を含む細胞群に含まれる細胞の数から、有核赤血球の数を差し引いた数を、前記リンパ芽球の計数結果として出力するように構成されている、請求項6に記載の血液分析装置。
【請求項8】
前記血液検体に含まれる有核赤血球に係る検出結果に関する情報を入力するための入力手段をさらに備え、
前記出力手段は、前記情報処理手段による検出結果及び前記入力手段に入力された有核赤血球の出現に関する情報に基づいて、リンパ芽球の出現に関する情報を出力するように構成されている、請求項1に記載の血液分析装置。
【請求項9】
前記情報処理手段は、前記光学検出部によって受光された蛍光に基づいて、測定試料中に含まれるリンパ芽球及び有核赤血球を含む第1細胞群と、前記測定試料中に含まれる骨髄芽球及び幼若顆粒球を含む第2細胞群とを検出するように構成されており、
前記出力手段は、前記血液検体における骨髄芽球の出現に関する情報、及び前記血液検体における幼若顆粒球の出現に関する情報をさらに出力するように構成されている、請求項1乃至8の何れかに記載の血液分析装置。
【請求項10】
前記情報処理手段は、前記光学検出部によって受光された蛍光に基づいて、前記第1細胞群と、前記第2細胞群と、測定試料中に含まれる成熟白血球を含む第3細胞群とを検出するように構成されており、
前記出力手段は、成熟白血球の出現に関する情報を出力するように構成されている、請求項9に記載の血液分析装置。
【請求項11】
前記光学検出部は、さらに前記光が照射された測定試料から発せられる散乱光を受光するように構成されており、
前記情報処理手段は、前記光学検出部によって受光された散乱光及び蛍光に基づいて、前記第2細胞群を、骨髄芽球を含む細胞群と、幼若顆粒球を含む細胞群とにさらに分類するように構成されている、請求項9に記載の血液分析装置。
【請求項12】
前記情報処理手段は、前記光学検出部によって受光された蛍光に基づいて、前記第1細胞群と、前記第2細胞群と、測定試料中に含まれる成熟白血球を含む第3細胞群とを検出し、前記光学検出部によって受光された散乱光及び蛍光に基づいて、前記第3細胞群を、少なくとも3種類の成熟白血球に分類するように構成されている、請求項11に記載の血液分析装置。
【請求項13】
前記光学検出部は、前記散乱光として、前記光が照射された測定試料から発せられる前方散乱光又は側方散乱光を受光するように構成されている、請求項11又は12に記載の血液分析装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13A】


【図13B】


【図14】


【図16A】


【図16B】


【図17】


【図18A】


【図18B】


【図19】


【図15A】


【図15B】


【図15C】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13A】


【図13B】


【図14】


【図16A】


【図16B】


【図17】


【図18A】


【図18B】


【図19】


【図15A】


【図15B】


【図15C】


【公開番号】特開2010−237147(P2010−237147A)
【公開日】平成22年10月21日(2010.10.21)
【国際特許分類】
【出願番号】特願2009−87609(P2009−87609)
【出願日】平成21年3月31日(2009.3.31)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
【公開日】平成22年10月21日(2010.10.21)
【国際特許分類】
【出願日】平成21年3月31日(2009.3.31)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
[ Back to top ]

