DNAの損傷量を定量的に測定する方法
【課題】従来のDNA損傷検出の方法とはことなり、安価で迅速、一度に大量処理ができ、信頼性も高いDNA損傷検出の方法を提供する。
【解決手段】げっ歯類の卵巣細胞を、少なくとも付着性細胞用の培地に動物由来血清を配合した培地を用いて培養し、培養したげっ歯類の卵巣細胞からNADを抽出する。そして、酵素サイクリング法を利用し、アルコール脱水素酵素を添加し、NADの量を吸光度で測定することによりDNAの損傷量を定量的に測定する方法である。
【解決手段】げっ歯類の卵巣細胞を、少なくとも付着性細胞用の培地に動物由来血清を配合した培地を用いて培養し、培養したげっ歯類の卵巣細胞からNADを抽出する。そして、酵素サイクリング法を利用し、アルコール脱水素酵素を添加し、NADの量を吸光度で測定することによりDNAの損傷量を定量的に測定する方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、動物細胞のDNAが損傷した際に、損傷に応答して、核内に存在するポリ(ADP−リボース)ポリメラーゼ(PARP)の活性が著しく上昇するに伴い、その基質である、NADの減少を定量的に測定することでDNAの損傷状態や、DNAの損傷やDNA修復に影響を及ぼす物質や作用を定量的に測定して評価する方法、並びにその適用に関するものである。
【背景技術】
【0002】
生物体は、常に酸化ストレスを受けている。酸化ストレスは、生体内で生成する活性酸素種の酸化損傷力と生体内の抗酸化システムの抗酸化ポテンシャルとの差として定義される。そして、現在までに酸化ストレスは様々な疾病に関与している事が報告されている。
【0003】
酸化ストレスの原因の一つに紫外線があり、DNA損傷を引き起こす際の紫外線の作用として、直接作用と間接作用の2種類に分けられる。直接作用は、DNAの吸収領域である260nmの光が直接DNAの塩基を励起し、シクロブタン型ピリミジン二量体(CPD)やピリミジン(6−4)ピリミジノン光産物(6−4PP)などの光産物を生成する。間接作用は、280〜320nmの光によってDNA障害を与える。280〜320nmの光を吸収する生体成分として主に、トリプトファン、チロシンなどがあり、そのタンパク質の芳香族側鎖に損傷をあたえる。
【0004】
また、活性酸素によるDNA損傷もある。
活性酸素のひとつであるまたヒドロキシラジカルは非常に強い酸化還元電位を持っているので、ほとんど全ての塩基を非特異的に損傷し、多様な塩基の分解生成物を産生する。また糖とも反応し、DNA鎖の糖−リン酸結合を切断する。生体内で生成する活性酸素群は、本来、エネルギー生産、侵入異物攻撃、不要な細胞の処理、細胞情報伝達などに際して生産される有用なものだが、生体内の抗酸化システムで捕捉しきれない余剰な活性酸素群が生じる場合、生体の構造や機能を担っている脂質、蛋白質、酵素や、遺伝情報を担う遺伝子DNAを酸化し損傷を与え、生体の構造や機能を乱し、病気を引き起こし、老化が早まり、がんや生活習慣病となる原因である。また、これらの生活習慣病になることで酸化ストレスが増幅されるという悪循環が起き、さらに疾病・老化が進行することになる。このような活性酸素が引き起こす疾病としてはがん、生活習慣病(心不全、高血圧、脳卒中、糖尿病、動脈硬化、アルツハイマー病)、免疫関連疾患(リウマチ、自己免疫疾患、炎症)などが挙げられる。
【0005】
そこで現在は、これ等の疾病の治療として、低分子抗酸化剤(例えばα−トコフェロール、ユビキノン、N−アセチルシステイン、グルタチオン)を用いることが知られている(例えば、特許文献1参照。)。抗酸化活性を有する低分子ペプチドを用いることも知られている(例えば、特許文献2参照。)。これ等のように活性酸素を消去する抗酸化物質の研究が数多く行われている。
【0006】
また、DNAは放射線、紫外線、環境中の変異原、更には体内の代謝産物や活性酸素などにより、たえず損傷を受けている。これらの損傷が残存すれば、細胞死、突然変異、ひいては老化やがん化、遺伝病発症などを引き起こす。
そのような事態を避けるために生物は、DNA損傷から生体を守り遺伝情報を正確に次世代へ伝えるために、DNA損傷を修復するさまざまな機構を進化の過程で獲得してきた。それらの修復機構は、塩基除去修復、ヌクレオチド除去修復、ミスマッチ修復、相同組換え修復、末端結合修復などが挙げられる。
【0007】
また、アルキル化損傷は、ヒトの場合はO6−メチルグアニンDNAメチルトラスフェラーゼがグアニンの6位からアルキル基を取り除くといった特異的なものや、シクロブチルダイマーは、光回復と呼ばれる光依存性の直接的な修復系で修復を受ける。また、このような修復作用を促進する成分の開発も行われている。例えば、ケフラン−ケフィア成分の添加により、紫外線照射によって細胞内で発生した活性酸素量が減少し、アポトーシスが顕著に抑制されたとの報告がされている。同報告においてはさらに、ケフラン−ケフィア成分の添加により経時的にチミンダイマー量が減少したことから、ケフラン−ケフィア成分が活性酸素消去作用だけでなく、DNAの修復機構を増強することが判明している。
【0008】
このようにDNAを損傷する、物理的作用や物質を評価する方法は、新規物質、化学薬品や食品などの変異原試験などにも用いられているだけでなく、DNAの損傷を防止する物質や損傷したDNAの修復を促す物質の探索にもその評価する方法は、盛んに用いられており、非常に重要な技術である。
【0009】
DNA損傷検出の方法は幾つか知られている。例えばコメットアッセイ(シングルセルゲルアッセイ)法がある。コメットアッセイは、細胞懸濁液(または、核の懸濁液)にアガロースを加え、スライドグラス中で寒天ゲルを形成させ、これをSDS、サルコシル硫酸などの界面活性剤で処理することにより,細胞の可溶化、核蛋白質の溶解を行った後に、電気泳動にかけ、DNA部分を染色してDNA損傷がある条件では、核DNAが彗星のように尾を引くことを利用して、DNA損傷を評価する方法である。
【0010】
しかしこの方法は、DNAの二本鎖を一本鎖にする必要があり、そのためアルカリ処理やタンパク溶解や電気泳動といった多くの処理が必要である。これらの実験方法は非常に煩雑であり、時間もかかる。さらに8−ヒドロキシデオキシグアノシン(8−OHdG)測定法は、遺伝子DNA中のグアニン塩基は活性酸素の作用により酸化損傷を受け、この8位の炭素が酸化されることにより、8−ヒドロキシ−デオキシグアノシン(以後8−OHdGと略す)が生成されることに基づく。遺伝子DNAが修復される過程で8−OHdGは、細胞外に排出され、さらに血液を経て尿中に排泄されるため、この8−OHdGを測定するものである。
【0011】
また8−OHdGは比較的安定な物質で、生体内で代謝や分解されることなく尿中に速やかに排泄されることから、活性酸素による生体損傷を鋭敏に反映するDNAの酸化損傷を示す最もよい指標と考えられるが、8−OHdG量を測定する試薬が高額であり、汎用していない。DNA巻き戻し法は、アルカリ溶液中で2本鎖DNAが一本鎖になる時に、DNA損傷がある条件では速やかに短い一本鎖になる性質を利用したDNA損傷を評価する方法である。この方法も、特殊な操作を必要とする上に、多検体を処理する場合に問題があり、DNA損傷検出の方法として満足すべきこのではなかった。
【特許文献1】アメリカ合衆国特許第6187743号公報、
【特許文献2】アメリカ合衆国特許第5683982号公報
【発明の開示】
【発明が解決しようとする課題】
【0012】
本発明者は、従来のDNA損傷検出の方法とは異なり、安価で迅速、一度に大量処理ができ、信頼性も高いDNA損傷検出の方法を提供することを課題とした。
本発明者はポリ(ADP−リボース)ポリメラーゼ1(PARP−1)がDNA損傷時に損傷部位に集まり、損傷の度合いによって修復、アポトーシス、ネクローシスを調節していることに着目し本発明を完成させた。
【0013】
すなわち、DNA損傷時に損傷部位に集まったPARP−1はNADを基質として、ポリ(ADP−リボース)ポリマーを素早くDNA損傷部位に結合させ、その他のDNA修復タンパク質と相互作用する。DNA損傷が大きい場合、細胞内のNAD量は大きく減少する。そこで、DNA損傷部位にPARP−1が結合し、NADを基質としてDNA修復をスタートさせる現象を利用し、細胞内のNAD量をNAD酵素サイクリング法で定量することで細胞が受けた損傷を検出するといった原理を利用している。
この新規DNA損傷検出法と従来の検出法との違いとしては、本検出法は短時間で、実験手順も簡便で、マイクロプレートリーダーを用いて吸光度を測定することにより、一度に大量に正確にDNA損傷を定量できる。
【課題を解決するための手段】
【0014】
上記課題を解決するために請求項1の本発明は、酵素サイクリング法を利用しNADの量を吸光度で測定することによりDNAの損傷量を定量的に測定する方法である。
【0015】
請求項1の本発明では、酵素サイクリング法を利用しNADの量を吸光度で測定することによりDNAの損傷量を定量的に測定することができるため、一度に96検体以上のサンプルを、素早く、安価に、同時に測定することができ、自動化も可能な方法であることから、DNA損傷検出を非常に効率的に行うことが出来る。したがって、本発明のDNA損傷検出法を用いると、多くの天然物や化合物から、DNAの修復作用のある物質やDNAの保護作用のある物質を、容易かつ迅速に選定することができ、選定試験方法として優れている。
【0016】
請求項2の本発明は、下記の(a)、(b)及び(c)の工程を含む請求項1記載のDNAの損傷量を定量的に測定する方法である。
(a)げっ歯類の卵巣細胞を、少なくとも付着性細胞用の培地に動物由来血清を配合した培地を用いて培養し、培養したげっ歯類の卵巣細胞の培養液からげっ歯類の卵巣細胞を取り出し、洗浄を行う。
(b)洗浄後のげっ歯類の卵巣細胞からNADを抽出するために酸液に浸漬し、さらに一定時間静置する。浸漬後、浸漬液をアルカリ水により中和する。中和後の浸漬液を遠心分離により上清を分取しNAD測定用サンプルとする。
(c)少なくとも緩衝液に溶解したホルマゾン系の色素にエタノールを配合した発色液に、上記(b)の工程で調整したNAD測定用サンプルを混合したものに、酵素サイクリング法を利用し、アルコール脱水素酵素を添加し、さらに一定時間静置した後、波長550〜570nmにて吸光度を測定する。
【0017】
請求項2の本発明では、(a)の工程では、げっ歯類の卵巣細胞を、少なくとも付着性細胞用の培地に動物由来血清を配合した培地を用いて培養し、培養したげっ歯類の卵巣細胞の培養液からげっ歯類の卵巣細胞を取り出し、洗浄を行う。このため、DNAの損傷を評価する細胞を容易に培養することができる。動物由来血清は、細胞の生育に必要な各種微量成分を幅広く含むため、細胞の良好な成生育が得られる。げっ歯類の卵巣細胞を使用したため、増殖が速くまた、取扱も容易である。
【0018】
(b)の工程では、洗浄後のげっ歯類の卵巣細胞からNADを抽出するために酸液に浸漬し、さらに一定時間静置する。浸漬後、浸漬液をアルカリ水により中和する。中和後の浸漬液を遠心分離により上清を分取しNAD測定用サンプルとする。このため、NADを分解する酵素を失活させて、NADを安定に抽出することができる。
【0019】
(c)の工程では、少なくとも緩衝液に溶解したホルマゾン系の色素にエタノールを配合した発色液に、上記(b)の工程で調整したNAD測定用サンプルを混合したものに酵素サイクリング法を利用して、アルコール脱水素酵素を添加、さらに一定時間静置した後、波長550〜570nmにて吸光度を測定する。このため、微量のNADを増幅して、酵素サイクリングを使用してNADの量を測定することができ、波長550〜570nmにてNADの量に対する吸光度を測定するため、測定が早く、容易にできる。
【0020】
請求項3の本発明は、動物由来血清は、ウシ胎児血清であり、げっ歯類の卵巣細胞は、チャイニーズハムスター卵巣細胞であるDNAの損傷量を定量的に測定する方法である。
【0021】
請求項3の本発明では、動物由来血清は、ウシ胎児血清であり、げっ歯類の卵巣細胞は、チャイニーズハムスター卵巣細胞であるため、培養が容易であり、倍加時間が短く、無血清培養も可能である。
【0022】
請求項4の本発明は、(a)の工程で、培地にストレプトマイシンとペニシリンを添加するDNAの損傷量を定量的に測定する方法である。
【0023】
請求項4の本発明では、(a)の工程で、培地にストレプトマイシンとペニシリンを添加するため、細菌の繁殖を防止して、供試細胞の培養をすることができる。
【0024】
請求項5の本発明は、(b)の工程で、酸液は、過塩素酸であり、アルカリ水により中和は、水酸化カリウムとリン酸緩衝液の混合物を使用するDNAの損傷量を定量的に測定する方法である。
【0025】
請求項5の本発明では、(b)の工程で、酸液は、過塩素酸であり、アルカリ水により中和は、水酸化カリウムとリン酸緩衝液の混合物を使用するため、アルカリに不安定なNADを安定して抽出することができる。
【0026】
請求項6の本発明は、(c)の工程で、アルコール脱水素酵素は、アルコールデヒドロゲナーゼであり、ホルマゾン系の色素にエタノールを配合した発色液は、ナトリウム・バイシン緩衝液(Na ・Bicine)、MTT(3(4,5−Dimethyl−2−thiazolyl)−2,5−diphenyltetrazolium bromide thiazolyl blue)、フェナジンエトサルフェート(Phenazine ethosulfate )、エチレンジアミン四酢酸、ウシ血清アルブミンの混合液であるDNAの損傷量を定量的に測定する方法である。
【0027】
請求項6の本発明では、(c)の工程で、アルコール脱水素酵素は、アルコールデヒドロゲナーゼであり、ホルマゾン系の色素にエタノールを配合した発色液は、ナトリウム・バイシン緩衝液(Na・Bicine)、MTT(3(4,5−Dimethyl−2−thiazolyl)−2,5−diphenyltetrazolium bromide thiazolyl blue)、フェナジンエトサルフェート(Phenazine ethosulfate)、エチレンジアミン四酢酸、ウシ血清アルブミンの混合液である。このため、酵素サイクリング法により、NADの濃度を増幅し、確実に発色させ、NADの微量な差を迅速に、確実に測定することができる。また、常温操作が可能であり、発色の経時変化が少ない。
【0028】
請求項7の本発明は、吸光度は、550〜570nmの波長をマクロプレートリーダーで測定するDNAの損傷量を定量的に測定する方法である。
【0029】
請求項7の本発明では、吸光度は、550〜570nmの波長をマクロプレートリーダーで測定するため、測定が容易で、早く、多数の検体を同時に測定することができる。また、マイクロプレートリーダーのため、人為的誤差がなく再現性に優れている。
【0030】
請求項8の本発明は、動物細胞のDNAに対する物理的又は化学的処理の影響を評価するために、酵素サイクリング法を利用しNADの量を吸光度で測定することによりDNAの損傷量を定量的に測定する方法である。
【0031】
請求項8の本発明では、本発明を使用して、動物細胞のDNAに対する物理的又は化学的処理の影響を評価するため、動物細胞のDNAについて、物理的又は化学的処理の影響の評価を多数の検体に対して素早く行うことができる。蛍光試薬を使用しないため、試薬の経時変化やロットブレがなく、再現性が優れ微量差を比較することができる。
【0032】
請求項9の本発明は、動物細胞のDNAの修復系を調節し得る物質をスクリーニングするために、酵素サイクリング法を利用しNADの量を吸光度で測定するDNAの損傷量を定量的に測定する方法である。
【0033】
請求項9の本発明では、動物細胞のDNAの修復系を調節し得る物質をスクリーニングするために、酵素サイクリング法を利用しNADの量を吸光度で測定するため、動物細胞のDNAの修復系を調節し得る多数の物質を、素早く、確実にスクリーニングすることができる。
【発明の効果】
【0034】
本発明のDNA損傷検出法を用いると、一度に96検体以上のサンプルを、安価に同時に測定することができ、自動化も可能な方法であることから、DNA損傷検出が非常に効率的に行うことが出来る。したがって、本発明のDNA損傷検出法を用いると、多くの天然物や化合物から、DNAの修復作用のある物質やDNAの保護作用のある物質を、容易かつ迅速に選定することができ、選定試験方法として優れている。
【発明を実施するための最良の形態】
【0035】
以下に、本発明の実施の形態を説明する。
酵素サイクリング法を利用したDNAの定量的測定方法は、次の通りである。
まず、供試細胞を培養する工程は次の通りである。
培地として、Minimum essential medium alpha medium αMEM培地(最少培地)を使用し、その培地に対して、終濃度5%となるように動物由来血清としてウシ胎児血清を添加し、さらに100μg/mlストレプトマイシン、100U/mlペニシリン、2mMグルタミンを添加する。その添加した培地を使用して、培養するげっ歯類の卵巣細胞としてチャイニーズハムスター卵巣細胞を37℃で5%濃度の炭酸ガス(CO2)のインキュベーター内で培養する。増殖が活発な、対数増殖期に維持して培養したチャイニーズハムスター卵巣細胞を供試細胞とする。
その後、培養液からチャイニーズハムスター卵巣細胞を取出し洗浄を行う。
供試細胞の培養では、DNA損傷を評価する細胞として、チャイニーズハムスター卵巣細胞を用いることができる。この場合は、倍加時間が短く、培養が比較的容易であり、無血清培養も可能であるなどのメリットがあるためである。
【0036】
次に、NAD測定用サンプルを作成する工程は次の通りである。
まず、チャイニーズハムスター卵巣細胞の培養液を捨て、十分に水気を取り除き、氷冷したカルシュウムイオンとマグネシュウムイオンを含まないリン酸緩衝生理的食塩水にて2回洗浄した後、0.5M過塩素酸を200μl添加し、氷上で15分間放置した。
その後、反応液を中和させるために1M水酸化カリウムと0.33Mリン酸緩衝液(pH7.2)を100μl添加し、氷上で15分間放置した。そして、15,000rpmで5分間遠心後、上清を回収し、これをNAD測定用サンプルとした。
【0037】
NAD測定用サンプルを作成する工程では、供試細胞を洗浄する必要がある。特にNADが熱やアルカリに不安定なため、氷冷しながら抽出する必要があり、さらに細胞が死滅、もしくは破砕されると、NADを分解する酵素が作用し始め、分解が急速に進行する点を留意して、その酵素を失活させるためにも、酸性である過塩素酸による抽出を行う必要がある。
【0038】
つぎに、細胞内NAD量の測定の工程について説明する。
バイシン緩衝液(Bicine)、MTT(3(4,5−Dimethyl−2−thiazolyl)−2,5−diphenyltetrazolium bromide thiazolyl blue)、フェナジンエトサルフェート(Phenazine ethosulfate)、エチレンジアミン四酢酸(Ethylene diaminetetra acetic acid)、ウシ血清アルブミン(Bovine serum albumin)、エタノール(Ethanol)の混合液に対して、NAD測定用サンプルを作成する工程で調製したNAD測定用サンプルを添加し、37℃、5分間プレインキュベーションした。
【0039】
続いて、アルコールデヒドロゲナーゼ(alcohol dehydrogenase) (オリエンタル酵母社より購入)を添加し、37℃にて20分間インキュベーションした後、マイクロプレートリーダーを使用して、後述するホルマザンの550〜570nmの吸光度を測定することでNADを定量することができる。今回の測定では550nmの吸光度を測定した。550nmの吸光度を測定するにあたり、700nmの吸光度を測定することにより、ゼロ点の補正の比較データとした。
【0040】
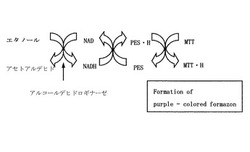
この微量なNAD量(数十〜数百pmol程度)の変化を測定するために、酵素サイクリング法を用いた。この方法では、図1に示すように、まずエタノールをアルコールデヒドロゲナーゼ(ADH)によりアセトアルデヒドにする際に、NADがNADHに還元される。さらにフェナジンエトサルフェート(PES:phenazine ethosulfate)を介してMTTを還元し、紫色のホルマザンが形成される。これと同時にNADHはNADに再び酸化される。MTTの還元速度(発色体の形成)は、NADの還元速度に依存するので、このサイクルがn回繰り返されると、もとのNAD量に対して化学量論的に、n倍の生成物であるホルマザンが得られることになる。さらにこのホルマザンの吸光度をマイクロプレートリーダーを用いて測定することにより、従来より多量のサンプルを迅速に測定することが可能となった。
【0041】
細胞内NAD量の測定の工程では、上記の酵素サイクリング法を用いて細胞内NAD量を測定するが、細胞内のNADの濃度は薄く、そのままでは測定できず、微量の差を比較することが困難であるが、酵素サイクリング法によりNADをリサイクルすることにより、NADの量に対応する生成物であるMTT・Hの量を増幅し、より正確に微量な差を測定することができるようになった。
上記のように、この増幅されたMTT・Hの量をマイクロプレートリーダーを使用して、550〜570nmの吸光度を測定することでNADを定量的に、正確に、微量な差を測定することができる。
【0042】
さらに、動物細胞のDNAに対して、物理的又は化学的処理をすることにより損傷を与える影響を評価するために、本発明を使用すると、動物細胞のDNAに物理的又は化学的処理の影響をあたえる物質を評価することができる。
具体的には、過酸化水素の影響を評価する場合は、チャイニーズハムスター卵巣細胞を培養した後に、チャイニーズハムスター卵巣細胞は種々の細胞密度(5.0x104 cells/wellから2.0x105 cells/well)の状態で過酸化水素終濃度0.05mM〜0.5mMとなるように添加し、炭酸ガス(CO2)インキュベーター内で一定時間培養する。
【0043】
また、紫外線(UVB)照射の影響を評価する場合は、チャイニーズハムスター卵巣細胞は種々の細胞密度(5.0x104 cells/wellから2.0x105 cells/well)の状態でウェルプレートのふたを開けて、100J/m2と200J/m2になるように紫外線を照射し、炭酸ガス(CO2)インキュベーター内で一定時間培養することにより、物理的又は化学的処理の影響を評価することができる。
【0044】
さらに、動物細胞のDNAの修復系を調節し得る物質をスクリーニングするために、本発明を使用すると、DNAの修復系に対して影響を及ぼす物質を特定することができる。
【0045】
本発明のDNAの損傷量を定量的に測定する方法は、DNAの修復プロフィールを確立する、修復関連疾患を診断する、所与の生物学的媒質の修復能力に対する物理的又は化学的処理の影響を評価する、生物学的媒質の修復系を調節し得る物質をスクリーニングする、新規物質に対する発癌性の評価(リスク・アセスメント)等の目的で使用できる。
【実施例】
【0046】
次に、本発明の実施例について説明する。
本発明の実施例に使用するものは以下の通りである。
げっ歯類の卵巣細胞として、チャイニーズハムスター卵巣細胞(以下、CHO細胞という。)を使用し、培地として、αMEM培地(Minimum essential medium alpha medium)(GIBCO社)製試薬)を使用した。
【0047】
上記培地に添加するものは以下のものである。
ウシ胎児血清(バイオウエスト社(Biowest社)製試薬)
100 U/mlペニシリン(シグマ社製試薬)
100 U(マイクロ)g/mlストレプトマイシン(シグマ社製試薬)
2mMグルタミン(ナカライ社製試薬)
【0048】
DNAの損傷量を測定するため、DNA損傷剤を使用し、実験的にDNAを損傷させて測定したが、そのDNA損傷剤は次のものである。
過酸化水素(ナカライ社製試薬)
ニトロソグアニジン(ナカライ社製試薬)
【0049】
抗酸化剤として、次のものを使用した。
N−アセチルシステイン(ナカライ社製試薬)
【0050】
さらに、以下の試薬を使用した。
アルコールデヒドロゲナーゼ(オリエンタル酵母社製試薬)
0.1 Mピロリン酸 緩衝液(ナカライ社製試薬)
10 μg/ml NAD(オリエンタル酵母社製試薬)
エタノール(ナカライ社製試薬)
リン酸緩衝生理的食塩水(ナカライ社製試薬)
水酸化カリウム(ナカライ社製試薬 特級)
0.33Mリン酸緩衝液(pH 7.2)(ナカライ社製試薬 特級)
0.5Mナトリウムバイシン(Na・Bicine)(pH7.8)(ナカライ社製試薬)
5mM MTT(3(4,5−Dimethyl−2−thiazolyl)−2,5−diphenyltetrazolium bromide thiazolyl blue)(ナカライ社製試薬)
20mMフェナジンエトサルフェート(Phenazine ethosulfate)(ナカライ社製試薬)
50mMエチレンジアミン四酢酸(Ethylene diaminetetra acetic acid)(ナカライ社製試薬 特級)
ウシ血清アルブミン(Bovine serum albumin)(ナカライ社製試薬)
【0051】
殺菌剤として、次のものを使用した。
メチルパラベン(和光純薬社製試薬 特級)
エチルパラベン(和光純薬社製試薬 特級)
ブチルパラベン(和光純薬社製試薬 特級)
プロピルパラベン(和光純薬社製試薬 特級)
フェノキシエタノール(和光純薬社製試薬 特級)
【0052】
実施例1として、チャイニーズハムスター卵巣細胞内のNAD含有量の測定をした。
供試細胞の培養は次の通りである。
細胞はCHO細胞をαMEM培地(Minimum essential medium alpha medium)(GIBCO社製)に、5%ウシ胎児血清、100 U(マイクロ)g/mlストレプトマイシン、100U/mlのペニシリン、2mMグルタミンを添加したものを用いて、37℃ 5%炭酸ガス(CO2)インキュベーター内で増殖が活発な、対数増殖期に維持して培養した。なお、上記のとおりDNA損傷剤を使用し、実験的にDNAを損傷させて測定した。
【0053】
次に、NADの抽出を以下のように行った。
DNA損傷を誘導した細胞の培養液を捨て、十分に水気を取り除き、氷冷したリン酸緩衝生理的食塩水にて2回洗浄した後、0.5M過塩素酸を200μl添加し、氷上で15分間放置した。その後、反応液を中和させるために1M水酸化カリウムと0.33Mリン酸緩衝液(pH 7.2)を100μl添加し、氷上で15分間放置した。そして、15,000rpmで5分間遠心後、上清を回収し、これをNAD測定用サンプルとした。
【0054】
つぎに、酵素サイクリング法を用いて、以下のように、細胞内のNAD量を測定した。
96穴プレートに、以下に示す反応混合物を100μl入れ、これに対して、調製したNAD測定用サンプルを50μl添加し、37℃、5分間プレインキュベーションした。続いて、終濃度0.25mg/mlとなるように20μlのアルコールデヒドロゲナーゼ(alcohol dehydrogenase)(オリエンタル酵母社より購入)を添加し、37℃にて20分間インキュベーションした後、マイクロプレートリーダー(MPR−A4i,東ソー株式会社)を用いて、プレートの550nm(対照波長:700nm)の吸光度を測定した。
【0055】
上記で使用した反応混合物は、以下のものである。
0.5M ナトリウムバイシン(NaBicine)緩衝液(pH7.8)20μl
5mM MTT 10μl
20mM フェナジンエトサルフェート(PES) 10μl
50mM エチレンジアミン四酢酸(EDTA)10μl
10mg/ml ウシ血清アルブミン(BSA) 10μl
エタノールと超純水 40μl
全量 100μl
【0056】
酵素サイクリング法により生成したホルマザンの吸光度値に相関するNADの絶対量を求めるために、検量線を作成した。以下に示す各試薬をミクロセルに順次入れて混和し、550nmの波長で吸光度のゼロ合わせをした。続いてアルコールデヒドロゲナーゼ(alcohol dehydrogenase)(原液)を10μlずつ入れて混和し、550nmの波長で吸光度の最高値を測定し、図2に示すように、検量線を作成した。縦軸が吸光度、横軸がNADの濃度(μg/ml)である。
吸光度のゼロ合わせをするための対照液は、0.1Mピロリン酸緩衝液500μl、超純水1000μlとエタノール10μlであり、吸光度測定のサンプルは、0.1Mピロリン酸緩衝液500μl、NAD10μg/mlとエタノール10μlである。
【0057】
上記の反応組成は、検量線を作成するにあたって使用するNADを、ホルマザンに酵素的に変換することにより、その特異的な吸収(550nm)を利用して、モル吸光係数から濃度検定するためである。そのNADを用いて、下記の表1と図2に示す、種々の濃度のNADを作成し、酵素サイクリング法に従い、測定を行った。
【表1】

図2に示すように、NAD量と吸光度は相関があり、本発明のNAD酵素サイクリング法にて、良好に増感されたことが判る。
【0058】
実施例2〜5について、酸化損傷誘導物質の評価を過酸化水素にて行った。CHO細胞を過酸化水素(終濃度0.05mM〜0.4mM)で各時間(0〜60分)処理後、NADを抽出し、そのサンプルをNAD酵素サイクリング法により細胞内のNAD含有量を測定し、各濃度の過酸化水素処理における細胞内のNAD量の結果を表2に示した。
【表2】

実施例2〜5に示すように、過酸化水素の量及び接触時間に伴いNADの量が減っていることから、本発明の方法は、酸化力の強さと、NADの減少に相関があることがわかり、DNAが過酸化水素により損傷されたことを定量的に評価できることが判る。
【0059】
実施例6〜7は、実施例1に従い、表3に示すように、DNA損傷成分としてUVB照射の評価を行った。CHO細胞は種々の細胞密度(5.0x104cells/well, 2.0x105cells/well)の状態でウェルプレートのふたを開けて、200J/m2になるように照射し、炭酸ガス(CO2)インキュベーター内で2〜3時間培養した。
【表3】

実施例6〜7にて、UVの照射量と、NADの減少に一次関数的な関係があることが得られたことから、DNAの損傷量が定量できることが判る。実施例2〜7の結果より、DNAの損傷が物理的および化学的どちらの作用においても、本発明の方法で測定できることが判る。
【0060】
実施例8〜11については、実施例1に従い、DNA損傷成分としてニトロソグアニジンの評価を行った。CHO細胞は種々の細胞密度(5.0x104 cells/well, 2.0x105 cells/well)の状態で終濃度0.02mM〜0.2mMとなるようにニトロソグアニジンを添加し、炭酸ガス(CO2)インキュベーター内で一定時間培養した。その結果を表4に示す。
【表4】

実施例8〜11の結果より、ニトロソグアニジンの添加量と、NAD量の減少量に相関があることから、酸化作用によるDNA損傷で無く、ニトロソグアニジンによるアルキル化作用によるDNA損傷も、測定できることが判明した。
【0061】
実施例12〜15については、実施例1に従い、DNA損傷防止剤としてN−アセチルシステインの効果を測定した。CHO細胞をN−アセチルシステイン(終濃度10mM)で1時間処理し、種々濃度の過酸化水素(終濃度0.05mM〜0.5mM)で15分処理し、一定時間培養後、NADを抽出し、NAD酵素サイクリング法にて細胞内のNAD含有量を測定した。その結果を表5に示す。
【表5】

実施例12〜15において、比較例5に示すように、過酸化水素0.1Mの酸化処理を行うと、NAD量は、2.11から1.58に減少する。しかし、予め、DNAの損傷を防止する物質である、N−アセチルシステイン処理を行うと、NADの減少は1.86に留まっている。従って、本発明の方法により、N−アセチルシステインのDNAの損傷を防止作用が測定できることがわかる。更に、過酸化水素濃度が上昇するとN−アセチルシステインの作用が弱くなることも測定できることが判る。
【0062】
実施例16〜19については、殺菌剤は、動物細胞にも影響を与えると考えられているため、その影響について実施例1に従い測定した。各殺菌剤は、ジメチルスルフオキシドにて希釈し、培地量に対して、1/100量になるように添加した。その結果を表6に示す。
【表6】

実施例16〜19の結果より、実施例18のブチルパラベンがDNAへの影響が大きいことが判明した。殺菌剤のような、似たような作用を持つ化学物質でも、その構造の違いによりDNAへの影響を測定できることが判った。これにより、新規化学物質の変異原性を測定することも可能であることが判る。
【0063】
実施例20〜27については、皮膚常在菌によるDNA修復促進物質分泌の確認を実施した。特開2005−304363号公報にて、皮膚常在菌にトリプトファン、チロシン、ヒスチジン、システイン、フェニルアラニン及びシスチンよりなる群から選ばれた1種類以上のアミノ酸と金属塩を共存させることにより、皮膚常在菌による抗酸化物質の分泌が促進されることが公開されている。
【0064】
今回、実施例1に従い、この抗酸化物質のDNAの損傷防止作用について確認した。
皮膚常在菌分離法として、固体培地を15人(男性5人、女性10人、年齢20〜60歳)の顔に直接押し付けた後、30℃、2日間培養を行った。培地上に出現したコロニーを釣菌し、菌種の異なる常在菌を7菌株(SKA20、SKA30、SKA31、SKA36、SKA48、SKA59、SKA61)分離した。常在菌7菌株を固体培地に一白金耳接種した後、30℃、24時間静置培養を行う。次に、液体培地に各アミノ酸の添加合計2.0g、およびFeSO4・7H2Oを5mg、MnSO4・5H2Oを0.5mg添加した培地に前記固体培地より一白金耳を接種し、30℃、2日間静置培養を行う。更に上記7菌株は180rpmにて振盪培養を行う。培養3日後の培養液(約100ml)を、ロータリーエバポレーターにて、50℃でほぼ乾固に近い状態まで濃縮した後、20mlのエタノールで一晩抽出後3mlに濃縮し、0.45μでろ過し供試検体とした。エタノール抽出を行うことにより、培地中に含まれる塩類の影響を排除した。
【0065】
液体培地として、以下の成分を有する関東化学株式会社製の試薬を使用する。
培地1000ml当たり、グルコースを10g、イーストエキストラクトを5.0g、リン酸水素2カリウムを0.5g、リン酸2水素カリウムを1.5g、硫酸マグネシウム・7H2Oを0.2g、水酸化ナトリウムを0.1g、硝酸カリウムを0.1g、パラアミノ安息香酸(P−Aminobenzoic acid)を20μg、イノシトール(Inositol)を0.2mg、ビタミンH(VitaminH)を2μg、ニコチン酸(Nicotinic acid)を40μg、ビタミンB12(Vitamin B12)を0.5μg、ビタミンB1(VitaminB1)を40μg、パントテン酸カルシウム(Ca−Pantothenate)を0.4mg、ビタミンB2(VitaminB2)を40μg、ビタミンB6(VitaminB6)40μgを含み、pH7.2にて用いる液体培地である。
アミノ酸は、ヒスチジン、システイン、トリプトファン、フェニルアラニン、チロシンから選択し配合した。
【0066】
固体培地として以下の成分を有する関東化学株式会社製の試薬を使用する。
培地100ml当たりグルコースを1.0g、イーストエキストラクトを2.5g、ペプトンを5.0g、寒天を2.0gを含み、pH=7.0にて用いる固体培地である。
CHO細胞をSKA20菌株の培養液由来の供試検体100μlにて1時間処理し、更に過酸化水素(終濃度0.1mM)で1時間処理後、NADを抽出し、NAD酵素サイクリング法にて細胞内のNAD含有量を測定した。
結果を表7に示す。
【表7】

【0067】
SKA20菌株に替えて、SKA30、SKA31、SKA36、SKA48、SKA59、SKA61菌株を用いた場合のNAD含有量結果を表8に示す。
【表8】

培養液に添加したアミノ酸は、ヒスチジン、システイン、トリプトファン、チロシンの等重量混合したものである。
実施例20〜27の結果により、微生物が分泌した未同定の物質で作用機構も判明していない物質でも、DNA損傷を防止する作用があることが判る。これにより、天然物から、細胞やDNAに良い作用がある物質を選定することができることが判明した。
【図面の簡単な説明】
【0068】
【図1】本発明の実施形態における酵素サイクルを示す模式図である。
【図2】本発明の実施形態における吸光度とNADの量との関係を示すグラフである。
【技術分野】
【0001】
本発明は、動物細胞のDNAが損傷した際に、損傷に応答して、核内に存在するポリ(ADP−リボース)ポリメラーゼ(PARP)の活性が著しく上昇するに伴い、その基質である、NADの減少を定量的に測定することでDNAの損傷状態や、DNAの損傷やDNA修復に影響を及ぼす物質や作用を定量的に測定して評価する方法、並びにその適用に関するものである。
【背景技術】
【0002】
生物体は、常に酸化ストレスを受けている。酸化ストレスは、生体内で生成する活性酸素種の酸化損傷力と生体内の抗酸化システムの抗酸化ポテンシャルとの差として定義される。そして、現在までに酸化ストレスは様々な疾病に関与している事が報告されている。
【0003】
酸化ストレスの原因の一つに紫外線があり、DNA損傷を引き起こす際の紫外線の作用として、直接作用と間接作用の2種類に分けられる。直接作用は、DNAの吸収領域である260nmの光が直接DNAの塩基を励起し、シクロブタン型ピリミジン二量体(CPD)やピリミジン(6−4)ピリミジノン光産物(6−4PP)などの光産物を生成する。間接作用は、280〜320nmの光によってDNA障害を与える。280〜320nmの光を吸収する生体成分として主に、トリプトファン、チロシンなどがあり、そのタンパク質の芳香族側鎖に損傷をあたえる。
【0004】
また、活性酸素によるDNA損傷もある。
活性酸素のひとつであるまたヒドロキシラジカルは非常に強い酸化還元電位を持っているので、ほとんど全ての塩基を非特異的に損傷し、多様な塩基の分解生成物を産生する。また糖とも反応し、DNA鎖の糖−リン酸結合を切断する。生体内で生成する活性酸素群は、本来、エネルギー生産、侵入異物攻撃、不要な細胞の処理、細胞情報伝達などに際して生産される有用なものだが、生体内の抗酸化システムで捕捉しきれない余剰な活性酸素群が生じる場合、生体の構造や機能を担っている脂質、蛋白質、酵素や、遺伝情報を担う遺伝子DNAを酸化し損傷を与え、生体の構造や機能を乱し、病気を引き起こし、老化が早まり、がんや生活習慣病となる原因である。また、これらの生活習慣病になることで酸化ストレスが増幅されるという悪循環が起き、さらに疾病・老化が進行することになる。このような活性酸素が引き起こす疾病としてはがん、生活習慣病(心不全、高血圧、脳卒中、糖尿病、動脈硬化、アルツハイマー病)、免疫関連疾患(リウマチ、自己免疫疾患、炎症)などが挙げられる。
【0005】
そこで現在は、これ等の疾病の治療として、低分子抗酸化剤(例えばα−トコフェロール、ユビキノン、N−アセチルシステイン、グルタチオン)を用いることが知られている(例えば、特許文献1参照。)。抗酸化活性を有する低分子ペプチドを用いることも知られている(例えば、特許文献2参照。)。これ等のように活性酸素を消去する抗酸化物質の研究が数多く行われている。
【0006】
また、DNAは放射線、紫外線、環境中の変異原、更には体内の代謝産物や活性酸素などにより、たえず損傷を受けている。これらの損傷が残存すれば、細胞死、突然変異、ひいては老化やがん化、遺伝病発症などを引き起こす。
そのような事態を避けるために生物は、DNA損傷から生体を守り遺伝情報を正確に次世代へ伝えるために、DNA損傷を修復するさまざまな機構を進化の過程で獲得してきた。それらの修復機構は、塩基除去修復、ヌクレオチド除去修復、ミスマッチ修復、相同組換え修復、末端結合修復などが挙げられる。
【0007】
また、アルキル化損傷は、ヒトの場合はO6−メチルグアニンDNAメチルトラスフェラーゼがグアニンの6位からアルキル基を取り除くといった特異的なものや、シクロブチルダイマーは、光回復と呼ばれる光依存性の直接的な修復系で修復を受ける。また、このような修復作用を促進する成分の開発も行われている。例えば、ケフラン−ケフィア成分の添加により、紫外線照射によって細胞内で発生した活性酸素量が減少し、アポトーシスが顕著に抑制されたとの報告がされている。同報告においてはさらに、ケフラン−ケフィア成分の添加により経時的にチミンダイマー量が減少したことから、ケフラン−ケフィア成分が活性酸素消去作用だけでなく、DNAの修復機構を増強することが判明している。
【0008】
このようにDNAを損傷する、物理的作用や物質を評価する方法は、新規物質、化学薬品や食品などの変異原試験などにも用いられているだけでなく、DNAの損傷を防止する物質や損傷したDNAの修復を促す物質の探索にもその評価する方法は、盛んに用いられており、非常に重要な技術である。
【0009】
DNA損傷検出の方法は幾つか知られている。例えばコメットアッセイ(シングルセルゲルアッセイ)法がある。コメットアッセイは、細胞懸濁液(または、核の懸濁液)にアガロースを加え、スライドグラス中で寒天ゲルを形成させ、これをSDS、サルコシル硫酸などの界面活性剤で処理することにより,細胞の可溶化、核蛋白質の溶解を行った後に、電気泳動にかけ、DNA部分を染色してDNA損傷がある条件では、核DNAが彗星のように尾を引くことを利用して、DNA損傷を評価する方法である。
【0010】
しかしこの方法は、DNAの二本鎖を一本鎖にする必要があり、そのためアルカリ処理やタンパク溶解や電気泳動といった多くの処理が必要である。これらの実験方法は非常に煩雑であり、時間もかかる。さらに8−ヒドロキシデオキシグアノシン(8−OHdG)測定法は、遺伝子DNA中のグアニン塩基は活性酸素の作用により酸化損傷を受け、この8位の炭素が酸化されることにより、8−ヒドロキシ−デオキシグアノシン(以後8−OHdGと略す)が生成されることに基づく。遺伝子DNAが修復される過程で8−OHdGは、細胞外に排出され、さらに血液を経て尿中に排泄されるため、この8−OHdGを測定するものである。
【0011】
また8−OHdGは比較的安定な物質で、生体内で代謝や分解されることなく尿中に速やかに排泄されることから、活性酸素による生体損傷を鋭敏に反映するDNAの酸化損傷を示す最もよい指標と考えられるが、8−OHdG量を測定する試薬が高額であり、汎用していない。DNA巻き戻し法は、アルカリ溶液中で2本鎖DNAが一本鎖になる時に、DNA損傷がある条件では速やかに短い一本鎖になる性質を利用したDNA損傷を評価する方法である。この方法も、特殊な操作を必要とする上に、多検体を処理する場合に問題があり、DNA損傷検出の方法として満足すべきこのではなかった。
【特許文献1】アメリカ合衆国特許第6187743号公報、
【特許文献2】アメリカ合衆国特許第5683982号公報
【発明の開示】
【発明が解決しようとする課題】
【0012】
本発明者は、従来のDNA損傷検出の方法とは異なり、安価で迅速、一度に大量処理ができ、信頼性も高いDNA損傷検出の方法を提供することを課題とした。
本発明者はポリ(ADP−リボース)ポリメラーゼ1(PARP−1)がDNA損傷時に損傷部位に集まり、損傷の度合いによって修復、アポトーシス、ネクローシスを調節していることに着目し本発明を完成させた。
【0013】
すなわち、DNA損傷時に損傷部位に集まったPARP−1はNADを基質として、ポリ(ADP−リボース)ポリマーを素早くDNA損傷部位に結合させ、その他のDNA修復タンパク質と相互作用する。DNA損傷が大きい場合、細胞内のNAD量は大きく減少する。そこで、DNA損傷部位にPARP−1が結合し、NADを基質としてDNA修復をスタートさせる現象を利用し、細胞内のNAD量をNAD酵素サイクリング法で定量することで細胞が受けた損傷を検出するといった原理を利用している。
この新規DNA損傷検出法と従来の検出法との違いとしては、本検出法は短時間で、実験手順も簡便で、マイクロプレートリーダーを用いて吸光度を測定することにより、一度に大量に正確にDNA損傷を定量できる。
【課題を解決するための手段】
【0014】
上記課題を解決するために請求項1の本発明は、酵素サイクリング法を利用しNADの量を吸光度で測定することによりDNAの損傷量を定量的に測定する方法である。
【0015】
請求項1の本発明では、酵素サイクリング法を利用しNADの量を吸光度で測定することによりDNAの損傷量を定量的に測定することができるため、一度に96検体以上のサンプルを、素早く、安価に、同時に測定することができ、自動化も可能な方法であることから、DNA損傷検出を非常に効率的に行うことが出来る。したがって、本発明のDNA損傷検出法を用いると、多くの天然物や化合物から、DNAの修復作用のある物質やDNAの保護作用のある物質を、容易かつ迅速に選定することができ、選定試験方法として優れている。
【0016】
請求項2の本発明は、下記の(a)、(b)及び(c)の工程を含む請求項1記載のDNAの損傷量を定量的に測定する方法である。
(a)げっ歯類の卵巣細胞を、少なくとも付着性細胞用の培地に動物由来血清を配合した培地を用いて培養し、培養したげっ歯類の卵巣細胞の培養液からげっ歯類の卵巣細胞を取り出し、洗浄を行う。
(b)洗浄後のげっ歯類の卵巣細胞からNADを抽出するために酸液に浸漬し、さらに一定時間静置する。浸漬後、浸漬液をアルカリ水により中和する。中和後の浸漬液を遠心分離により上清を分取しNAD測定用サンプルとする。
(c)少なくとも緩衝液に溶解したホルマゾン系の色素にエタノールを配合した発色液に、上記(b)の工程で調整したNAD測定用サンプルを混合したものに、酵素サイクリング法を利用し、アルコール脱水素酵素を添加し、さらに一定時間静置した後、波長550〜570nmにて吸光度を測定する。
【0017】
請求項2の本発明では、(a)の工程では、げっ歯類の卵巣細胞を、少なくとも付着性細胞用の培地に動物由来血清を配合した培地を用いて培養し、培養したげっ歯類の卵巣細胞の培養液からげっ歯類の卵巣細胞を取り出し、洗浄を行う。このため、DNAの損傷を評価する細胞を容易に培養することができる。動物由来血清は、細胞の生育に必要な各種微量成分を幅広く含むため、細胞の良好な成生育が得られる。げっ歯類の卵巣細胞を使用したため、増殖が速くまた、取扱も容易である。
【0018】
(b)の工程では、洗浄後のげっ歯類の卵巣細胞からNADを抽出するために酸液に浸漬し、さらに一定時間静置する。浸漬後、浸漬液をアルカリ水により中和する。中和後の浸漬液を遠心分離により上清を分取しNAD測定用サンプルとする。このため、NADを分解する酵素を失活させて、NADを安定に抽出することができる。
【0019】
(c)の工程では、少なくとも緩衝液に溶解したホルマゾン系の色素にエタノールを配合した発色液に、上記(b)の工程で調整したNAD測定用サンプルを混合したものに酵素サイクリング法を利用して、アルコール脱水素酵素を添加、さらに一定時間静置した後、波長550〜570nmにて吸光度を測定する。このため、微量のNADを増幅して、酵素サイクリングを使用してNADの量を測定することができ、波長550〜570nmにてNADの量に対する吸光度を測定するため、測定が早く、容易にできる。
【0020】
請求項3の本発明は、動物由来血清は、ウシ胎児血清であり、げっ歯類の卵巣細胞は、チャイニーズハムスター卵巣細胞であるDNAの損傷量を定量的に測定する方法である。
【0021】
請求項3の本発明では、動物由来血清は、ウシ胎児血清であり、げっ歯類の卵巣細胞は、チャイニーズハムスター卵巣細胞であるため、培養が容易であり、倍加時間が短く、無血清培養も可能である。
【0022】
請求項4の本発明は、(a)の工程で、培地にストレプトマイシンとペニシリンを添加するDNAの損傷量を定量的に測定する方法である。
【0023】
請求項4の本発明では、(a)の工程で、培地にストレプトマイシンとペニシリンを添加するため、細菌の繁殖を防止して、供試細胞の培養をすることができる。
【0024】
請求項5の本発明は、(b)の工程で、酸液は、過塩素酸であり、アルカリ水により中和は、水酸化カリウムとリン酸緩衝液の混合物を使用するDNAの損傷量を定量的に測定する方法である。
【0025】
請求項5の本発明では、(b)の工程で、酸液は、過塩素酸であり、アルカリ水により中和は、水酸化カリウムとリン酸緩衝液の混合物を使用するため、アルカリに不安定なNADを安定して抽出することができる。
【0026】
請求項6の本発明は、(c)の工程で、アルコール脱水素酵素は、アルコールデヒドロゲナーゼであり、ホルマゾン系の色素にエタノールを配合した発色液は、ナトリウム・バイシン緩衝液(Na ・Bicine)、MTT(3(4,5−Dimethyl−2−thiazolyl)−2,5−diphenyltetrazolium bromide thiazolyl blue)、フェナジンエトサルフェート(Phenazine ethosulfate )、エチレンジアミン四酢酸、ウシ血清アルブミンの混合液であるDNAの損傷量を定量的に測定する方法である。
【0027】
請求項6の本発明では、(c)の工程で、アルコール脱水素酵素は、アルコールデヒドロゲナーゼであり、ホルマゾン系の色素にエタノールを配合した発色液は、ナトリウム・バイシン緩衝液(Na・Bicine)、MTT(3(4,5−Dimethyl−2−thiazolyl)−2,5−diphenyltetrazolium bromide thiazolyl blue)、フェナジンエトサルフェート(Phenazine ethosulfate)、エチレンジアミン四酢酸、ウシ血清アルブミンの混合液である。このため、酵素サイクリング法により、NADの濃度を増幅し、確実に発色させ、NADの微量な差を迅速に、確実に測定することができる。また、常温操作が可能であり、発色の経時変化が少ない。
【0028】
請求項7の本発明は、吸光度は、550〜570nmの波長をマクロプレートリーダーで測定するDNAの損傷量を定量的に測定する方法である。
【0029】
請求項7の本発明では、吸光度は、550〜570nmの波長をマクロプレートリーダーで測定するため、測定が容易で、早く、多数の検体を同時に測定することができる。また、マイクロプレートリーダーのため、人為的誤差がなく再現性に優れている。
【0030】
請求項8の本発明は、動物細胞のDNAに対する物理的又は化学的処理の影響を評価するために、酵素サイクリング法を利用しNADの量を吸光度で測定することによりDNAの損傷量を定量的に測定する方法である。
【0031】
請求項8の本発明では、本発明を使用して、動物細胞のDNAに対する物理的又は化学的処理の影響を評価するため、動物細胞のDNAについて、物理的又は化学的処理の影響の評価を多数の検体に対して素早く行うことができる。蛍光試薬を使用しないため、試薬の経時変化やロットブレがなく、再現性が優れ微量差を比較することができる。
【0032】
請求項9の本発明は、動物細胞のDNAの修復系を調節し得る物質をスクリーニングするために、酵素サイクリング法を利用しNADの量を吸光度で測定するDNAの損傷量を定量的に測定する方法である。
【0033】
請求項9の本発明では、動物細胞のDNAの修復系を調節し得る物質をスクリーニングするために、酵素サイクリング法を利用しNADの量を吸光度で測定するため、動物細胞のDNAの修復系を調節し得る多数の物質を、素早く、確実にスクリーニングすることができる。
【発明の効果】
【0034】
本発明のDNA損傷検出法を用いると、一度に96検体以上のサンプルを、安価に同時に測定することができ、自動化も可能な方法であることから、DNA損傷検出が非常に効率的に行うことが出来る。したがって、本発明のDNA損傷検出法を用いると、多くの天然物や化合物から、DNAの修復作用のある物質やDNAの保護作用のある物質を、容易かつ迅速に選定することができ、選定試験方法として優れている。
【発明を実施するための最良の形態】
【0035】
以下に、本発明の実施の形態を説明する。
酵素サイクリング法を利用したDNAの定量的測定方法は、次の通りである。
まず、供試細胞を培養する工程は次の通りである。
培地として、Minimum essential medium alpha medium αMEM培地(最少培地)を使用し、その培地に対して、終濃度5%となるように動物由来血清としてウシ胎児血清を添加し、さらに100μg/mlストレプトマイシン、100U/mlペニシリン、2mMグルタミンを添加する。その添加した培地を使用して、培養するげっ歯類の卵巣細胞としてチャイニーズハムスター卵巣細胞を37℃で5%濃度の炭酸ガス(CO2)のインキュベーター内で培養する。増殖が活発な、対数増殖期に維持して培養したチャイニーズハムスター卵巣細胞を供試細胞とする。
その後、培養液からチャイニーズハムスター卵巣細胞を取出し洗浄を行う。
供試細胞の培養では、DNA損傷を評価する細胞として、チャイニーズハムスター卵巣細胞を用いることができる。この場合は、倍加時間が短く、培養が比較的容易であり、無血清培養も可能であるなどのメリットがあるためである。
【0036】
次に、NAD測定用サンプルを作成する工程は次の通りである。
まず、チャイニーズハムスター卵巣細胞の培養液を捨て、十分に水気を取り除き、氷冷したカルシュウムイオンとマグネシュウムイオンを含まないリン酸緩衝生理的食塩水にて2回洗浄した後、0.5M過塩素酸を200μl添加し、氷上で15分間放置した。
その後、反応液を中和させるために1M水酸化カリウムと0.33Mリン酸緩衝液(pH7.2)を100μl添加し、氷上で15分間放置した。そして、15,000rpmで5分間遠心後、上清を回収し、これをNAD測定用サンプルとした。
【0037】
NAD測定用サンプルを作成する工程では、供試細胞を洗浄する必要がある。特にNADが熱やアルカリに不安定なため、氷冷しながら抽出する必要があり、さらに細胞が死滅、もしくは破砕されると、NADを分解する酵素が作用し始め、分解が急速に進行する点を留意して、その酵素を失活させるためにも、酸性である過塩素酸による抽出を行う必要がある。
【0038】
つぎに、細胞内NAD量の測定の工程について説明する。
バイシン緩衝液(Bicine)、MTT(3(4,5−Dimethyl−2−thiazolyl)−2,5−diphenyltetrazolium bromide thiazolyl blue)、フェナジンエトサルフェート(Phenazine ethosulfate)、エチレンジアミン四酢酸(Ethylene diaminetetra acetic acid)、ウシ血清アルブミン(Bovine serum albumin)、エタノール(Ethanol)の混合液に対して、NAD測定用サンプルを作成する工程で調製したNAD測定用サンプルを添加し、37℃、5分間プレインキュベーションした。
【0039】
続いて、アルコールデヒドロゲナーゼ(alcohol dehydrogenase) (オリエンタル酵母社より購入)を添加し、37℃にて20分間インキュベーションした後、マイクロプレートリーダーを使用して、後述するホルマザンの550〜570nmの吸光度を測定することでNADを定量することができる。今回の測定では550nmの吸光度を測定した。550nmの吸光度を測定するにあたり、700nmの吸光度を測定することにより、ゼロ点の補正の比較データとした。
【0040】
この微量なNAD量(数十〜数百pmol程度)の変化を測定するために、酵素サイクリング法を用いた。この方法では、図1に示すように、まずエタノールをアルコールデヒドロゲナーゼ(ADH)によりアセトアルデヒドにする際に、NADがNADHに還元される。さらにフェナジンエトサルフェート(PES:phenazine ethosulfate)を介してMTTを還元し、紫色のホルマザンが形成される。これと同時にNADHはNADに再び酸化される。MTTの還元速度(発色体の形成)は、NADの還元速度に依存するので、このサイクルがn回繰り返されると、もとのNAD量に対して化学量論的に、n倍の生成物であるホルマザンが得られることになる。さらにこのホルマザンの吸光度をマイクロプレートリーダーを用いて測定することにより、従来より多量のサンプルを迅速に測定することが可能となった。
【0041】
細胞内NAD量の測定の工程では、上記の酵素サイクリング法を用いて細胞内NAD量を測定するが、細胞内のNADの濃度は薄く、そのままでは測定できず、微量の差を比較することが困難であるが、酵素サイクリング法によりNADをリサイクルすることにより、NADの量に対応する生成物であるMTT・Hの量を増幅し、より正確に微量な差を測定することができるようになった。
上記のように、この増幅されたMTT・Hの量をマイクロプレートリーダーを使用して、550〜570nmの吸光度を測定することでNADを定量的に、正確に、微量な差を測定することができる。
【0042】
さらに、動物細胞のDNAに対して、物理的又は化学的処理をすることにより損傷を与える影響を評価するために、本発明を使用すると、動物細胞のDNAに物理的又は化学的処理の影響をあたえる物質を評価することができる。
具体的には、過酸化水素の影響を評価する場合は、チャイニーズハムスター卵巣細胞を培養した後に、チャイニーズハムスター卵巣細胞は種々の細胞密度(5.0x104 cells/wellから2.0x105 cells/well)の状態で過酸化水素終濃度0.05mM〜0.5mMとなるように添加し、炭酸ガス(CO2)インキュベーター内で一定時間培養する。
【0043】
また、紫外線(UVB)照射の影響を評価する場合は、チャイニーズハムスター卵巣細胞は種々の細胞密度(5.0x104 cells/wellから2.0x105 cells/well)の状態でウェルプレートのふたを開けて、100J/m2と200J/m2になるように紫外線を照射し、炭酸ガス(CO2)インキュベーター内で一定時間培養することにより、物理的又は化学的処理の影響を評価することができる。
【0044】
さらに、動物細胞のDNAの修復系を調節し得る物質をスクリーニングするために、本発明を使用すると、DNAの修復系に対して影響を及ぼす物質を特定することができる。
【0045】
本発明のDNAの損傷量を定量的に測定する方法は、DNAの修復プロフィールを確立する、修復関連疾患を診断する、所与の生物学的媒質の修復能力に対する物理的又は化学的処理の影響を評価する、生物学的媒質の修復系を調節し得る物質をスクリーニングする、新規物質に対する発癌性の評価(リスク・アセスメント)等の目的で使用できる。
【実施例】
【0046】
次に、本発明の実施例について説明する。
本発明の実施例に使用するものは以下の通りである。
げっ歯類の卵巣細胞として、チャイニーズハムスター卵巣細胞(以下、CHO細胞という。)を使用し、培地として、αMEM培地(Minimum essential medium alpha medium)(GIBCO社)製試薬)を使用した。
【0047】
上記培地に添加するものは以下のものである。
ウシ胎児血清(バイオウエスト社(Biowest社)製試薬)
100 U/mlペニシリン(シグマ社製試薬)
100 U(マイクロ)g/mlストレプトマイシン(シグマ社製試薬)
2mMグルタミン(ナカライ社製試薬)
【0048】
DNAの損傷量を測定するため、DNA損傷剤を使用し、実験的にDNAを損傷させて測定したが、そのDNA損傷剤は次のものである。
過酸化水素(ナカライ社製試薬)
ニトロソグアニジン(ナカライ社製試薬)
【0049】
抗酸化剤として、次のものを使用した。
N−アセチルシステイン(ナカライ社製試薬)
【0050】
さらに、以下の試薬を使用した。
アルコールデヒドロゲナーゼ(オリエンタル酵母社製試薬)
0.1 Mピロリン酸 緩衝液(ナカライ社製試薬)
10 μg/ml NAD(オリエンタル酵母社製試薬)
エタノール(ナカライ社製試薬)
リン酸緩衝生理的食塩水(ナカライ社製試薬)
水酸化カリウム(ナカライ社製試薬 特級)
0.33Mリン酸緩衝液(pH 7.2)(ナカライ社製試薬 特級)
0.5Mナトリウムバイシン(Na・Bicine)(pH7.8)(ナカライ社製試薬)
5mM MTT(3(4,5−Dimethyl−2−thiazolyl)−2,5−diphenyltetrazolium bromide thiazolyl blue)(ナカライ社製試薬)
20mMフェナジンエトサルフェート(Phenazine ethosulfate)(ナカライ社製試薬)
50mMエチレンジアミン四酢酸(Ethylene diaminetetra acetic acid)(ナカライ社製試薬 特級)
ウシ血清アルブミン(Bovine serum albumin)(ナカライ社製試薬)
【0051】
殺菌剤として、次のものを使用した。
メチルパラベン(和光純薬社製試薬 特級)
エチルパラベン(和光純薬社製試薬 特級)
ブチルパラベン(和光純薬社製試薬 特級)
プロピルパラベン(和光純薬社製試薬 特級)
フェノキシエタノール(和光純薬社製試薬 特級)
【0052】
実施例1として、チャイニーズハムスター卵巣細胞内のNAD含有量の測定をした。
供試細胞の培養は次の通りである。
細胞はCHO細胞をαMEM培地(Minimum essential medium alpha medium)(GIBCO社製)に、5%ウシ胎児血清、100 U(マイクロ)g/mlストレプトマイシン、100U/mlのペニシリン、2mMグルタミンを添加したものを用いて、37℃ 5%炭酸ガス(CO2)インキュベーター内で増殖が活発な、対数増殖期に維持して培養した。なお、上記のとおりDNA損傷剤を使用し、実験的にDNAを損傷させて測定した。
【0053】
次に、NADの抽出を以下のように行った。
DNA損傷を誘導した細胞の培養液を捨て、十分に水気を取り除き、氷冷したリン酸緩衝生理的食塩水にて2回洗浄した後、0.5M過塩素酸を200μl添加し、氷上で15分間放置した。その後、反応液を中和させるために1M水酸化カリウムと0.33Mリン酸緩衝液(pH 7.2)を100μl添加し、氷上で15分間放置した。そして、15,000rpmで5分間遠心後、上清を回収し、これをNAD測定用サンプルとした。
【0054】
つぎに、酵素サイクリング法を用いて、以下のように、細胞内のNAD量を測定した。
96穴プレートに、以下に示す反応混合物を100μl入れ、これに対して、調製したNAD測定用サンプルを50μl添加し、37℃、5分間プレインキュベーションした。続いて、終濃度0.25mg/mlとなるように20μlのアルコールデヒドロゲナーゼ(alcohol dehydrogenase)(オリエンタル酵母社より購入)を添加し、37℃にて20分間インキュベーションした後、マイクロプレートリーダー(MPR−A4i,東ソー株式会社)を用いて、プレートの550nm(対照波長:700nm)の吸光度を測定した。
【0055】
上記で使用した反応混合物は、以下のものである。
0.5M ナトリウムバイシン(NaBicine)緩衝液(pH7.8)20μl
5mM MTT 10μl
20mM フェナジンエトサルフェート(PES) 10μl
50mM エチレンジアミン四酢酸(EDTA)10μl
10mg/ml ウシ血清アルブミン(BSA) 10μl
エタノールと超純水 40μl
全量 100μl
【0056】
酵素サイクリング法により生成したホルマザンの吸光度値に相関するNADの絶対量を求めるために、検量線を作成した。以下に示す各試薬をミクロセルに順次入れて混和し、550nmの波長で吸光度のゼロ合わせをした。続いてアルコールデヒドロゲナーゼ(alcohol dehydrogenase)(原液)を10μlずつ入れて混和し、550nmの波長で吸光度の最高値を測定し、図2に示すように、検量線を作成した。縦軸が吸光度、横軸がNADの濃度(μg/ml)である。
吸光度のゼロ合わせをするための対照液は、0.1Mピロリン酸緩衝液500μl、超純水1000μlとエタノール10μlであり、吸光度測定のサンプルは、0.1Mピロリン酸緩衝液500μl、NAD10μg/mlとエタノール10μlである。
【0057】
上記の反応組成は、検量線を作成するにあたって使用するNADを、ホルマザンに酵素的に変換することにより、その特異的な吸収(550nm)を利用して、モル吸光係数から濃度検定するためである。そのNADを用いて、下記の表1と図2に示す、種々の濃度のNADを作成し、酵素サイクリング法に従い、測定を行った。
【表1】

図2に示すように、NAD量と吸光度は相関があり、本発明のNAD酵素サイクリング法にて、良好に増感されたことが判る。
【0058】
実施例2〜5について、酸化損傷誘導物質の評価を過酸化水素にて行った。CHO細胞を過酸化水素(終濃度0.05mM〜0.4mM)で各時間(0〜60分)処理後、NADを抽出し、そのサンプルをNAD酵素サイクリング法により細胞内のNAD含有量を測定し、各濃度の過酸化水素処理における細胞内のNAD量の結果を表2に示した。
【表2】

実施例2〜5に示すように、過酸化水素の量及び接触時間に伴いNADの量が減っていることから、本発明の方法は、酸化力の強さと、NADの減少に相関があることがわかり、DNAが過酸化水素により損傷されたことを定量的に評価できることが判る。
【0059】
実施例6〜7は、実施例1に従い、表3に示すように、DNA損傷成分としてUVB照射の評価を行った。CHO細胞は種々の細胞密度(5.0x104cells/well, 2.0x105cells/well)の状態でウェルプレートのふたを開けて、200J/m2になるように照射し、炭酸ガス(CO2)インキュベーター内で2〜3時間培養した。
【表3】

実施例6〜7にて、UVの照射量と、NADの減少に一次関数的な関係があることが得られたことから、DNAの損傷量が定量できることが判る。実施例2〜7の結果より、DNAの損傷が物理的および化学的どちらの作用においても、本発明の方法で測定できることが判る。
【0060】
実施例8〜11については、実施例1に従い、DNA損傷成分としてニトロソグアニジンの評価を行った。CHO細胞は種々の細胞密度(5.0x104 cells/well, 2.0x105 cells/well)の状態で終濃度0.02mM〜0.2mMとなるようにニトロソグアニジンを添加し、炭酸ガス(CO2)インキュベーター内で一定時間培養した。その結果を表4に示す。
【表4】

実施例8〜11の結果より、ニトロソグアニジンの添加量と、NAD量の減少量に相関があることから、酸化作用によるDNA損傷で無く、ニトロソグアニジンによるアルキル化作用によるDNA損傷も、測定できることが判明した。
【0061】
実施例12〜15については、実施例1に従い、DNA損傷防止剤としてN−アセチルシステインの効果を測定した。CHO細胞をN−アセチルシステイン(終濃度10mM)で1時間処理し、種々濃度の過酸化水素(終濃度0.05mM〜0.5mM)で15分処理し、一定時間培養後、NADを抽出し、NAD酵素サイクリング法にて細胞内のNAD含有量を測定した。その結果を表5に示す。
【表5】

実施例12〜15において、比較例5に示すように、過酸化水素0.1Mの酸化処理を行うと、NAD量は、2.11から1.58に減少する。しかし、予め、DNAの損傷を防止する物質である、N−アセチルシステイン処理を行うと、NADの減少は1.86に留まっている。従って、本発明の方法により、N−アセチルシステインのDNAの損傷を防止作用が測定できることがわかる。更に、過酸化水素濃度が上昇するとN−アセチルシステインの作用が弱くなることも測定できることが判る。
【0062】
実施例16〜19については、殺菌剤は、動物細胞にも影響を与えると考えられているため、その影響について実施例1に従い測定した。各殺菌剤は、ジメチルスルフオキシドにて希釈し、培地量に対して、1/100量になるように添加した。その結果を表6に示す。
【表6】

実施例16〜19の結果より、実施例18のブチルパラベンがDNAへの影響が大きいことが判明した。殺菌剤のような、似たような作用を持つ化学物質でも、その構造の違いによりDNAへの影響を測定できることが判った。これにより、新規化学物質の変異原性を測定することも可能であることが判る。
【0063】
実施例20〜27については、皮膚常在菌によるDNA修復促進物質分泌の確認を実施した。特開2005−304363号公報にて、皮膚常在菌にトリプトファン、チロシン、ヒスチジン、システイン、フェニルアラニン及びシスチンよりなる群から選ばれた1種類以上のアミノ酸と金属塩を共存させることにより、皮膚常在菌による抗酸化物質の分泌が促進されることが公開されている。
【0064】
今回、実施例1に従い、この抗酸化物質のDNAの損傷防止作用について確認した。
皮膚常在菌分離法として、固体培地を15人(男性5人、女性10人、年齢20〜60歳)の顔に直接押し付けた後、30℃、2日間培養を行った。培地上に出現したコロニーを釣菌し、菌種の異なる常在菌を7菌株(SKA20、SKA30、SKA31、SKA36、SKA48、SKA59、SKA61)分離した。常在菌7菌株を固体培地に一白金耳接種した後、30℃、24時間静置培養を行う。次に、液体培地に各アミノ酸の添加合計2.0g、およびFeSO4・7H2Oを5mg、MnSO4・5H2Oを0.5mg添加した培地に前記固体培地より一白金耳を接種し、30℃、2日間静置培養を行う。更に上記7菌株は180rpmにて振盪培養を行う。培養3日後の培養液(約100ml)を、ロータリーエバポレーターにて、50℃でほぼ乾固に近い状態まで濃縮した後、20mlのエタノールで一晩抽出後3mlに濃縮し、0.45μでろ過し供試検体とした。エタノール抽出を行うことにより、培地中に含まれる塩類の影響を排除した。
【0065】
液体培地として、以下の成分を有する関東化学株式会社製の試薬を使用する。
培地1000ml当たり、グルコースを10g、イーストエキストラクトを5.0g、リン酸水素2カリウムを0.5g、リン酸2水素カリウムを1.5g、硫酸マグネシウム・7H2Oを0.2g、水酸化ナトリウムを0.1g、硝酸カリウムを0.1g、パラアミノ安息香酸(P−Aminobenzoic acid)を20μg、イノシトール(Inositol)を0.2mg、ビタミンH(VitaminH)を2μg、ニコチン酸(Nicotinic acid)を40μg、ビタミンB12(Vitamin B12)を0.5μg、ビタミンB1(VitaminB1)を40μg、パントテン酸カルシウム(Ca−Pantothenate)を0.4mg、ビタミンB2(VitaminB2)を40μg、ビタミンB6(VitaminB6)40μgを含み、pH7.2にて用いる液体培地である。
アミノ酸は、ヒスチジン、システイン、トリプトファン、フェニルアラニン、チロシンから選択し配合した。
【0066】
固体培地として以下の成分を有する関東化学株式会社製の試薬を使用する。
培地100ml当たりグルコースを1.0g、イーストエキストラクトを2.5g、ペプトンを5.0g、寒天を2.0gを含み、pH=7.0にて用いる固体培地である。
CHO細胞をSKA20菌株の培養液由来の供試検体100μlにて1時間処理し、更に過酸化水素(終濃度0.1mM)で1時間処理後、NADを抽出し、NAD酵素サイクリング法にて細胞内のNAD含有量を測定した。
結果を表7に示す。
【表7】

【0067】
SKA20菌株に替えて、SKA30、SKA31、SKA36、SKA48、SKA59、SKA61菌株を用いた場合のNAD含有量結果を表8に示す。
【表8】

培養液に添加したアミノ酸は、ヒスチジン、システイン、トリプトファン、チロシンの等重量混合したものである。
実施例20〜27の結果により、微生物が分泌した未同定の物質で作用機構も判明していない物質でも、DNA損傷を防止する作用があることが判る。これにより、天然物から、細胞やDNAに良い作用がある物質を選定することができることが判明した。
【図面の簡単な説明】
【0068】
【図1】本発明の実施形態における酵素サイクルを示す模式図である。
【図2】本発明の実施形態における吸光度とNADの量との関係を示すグラフである。
【特許請求の範囲】
【請求項1】
酵素サイクリング法を利用しNADの量を吸光度で測定することによりDNAの損傷量を定量的に測定する方法。
【請求項2】
下記の(a)、(b)及び(c)の工程を含む請求項1記載のDNAの損傷量を定量的に測定する方法。
(a)げっ歯類の卵巣細胞を、少なくとも付着性細胞用の培地に動物由来血清を配合した培地を用いて培養し、培養したげっ歯類の卵巣細胞の培養液からげっ歯類の卵巣細胞を取り出し、洗浄を行う。
(b)洗浄後のげっ歯類の卵巣細胞からNADを抽出するために酸液に浸漬し、さらに一定時間静置する。浸漬後、浸漬液をアルカリ水により中和する。中和後の浸漬液を遠心分離により上清を分取しNAD測定用サンプルとする。
(c)少なくとも緩衝液に溶解したホルマゾン系の色素にエタノールを配合した発色液に、上記(b)の工程で調整したNAD測定用サンプルを混合したものに、酵素サイクリング法を利用し、アルコール脱水素酵素を添加し、さらに一定時間静置した後、波長550〜570nmにて吸光度を測定する。
【請求項3】
上記動物由来血清は、ウシ胎児血清であり、上記げっ歯類の卵巣細胞は、チャイニーズハムスター卵巣細胞である請求項2に記載のDNAの損傷量を定量的に測定する方法。
【請求項4】
上記(a)の工程で、上記培地にストレプトマイシンとペニシリンを添加する請求項2又は請求項3に記載のDNAの損傷量を定量的に測定する方法。
【請求項5】
上記(b)の工程で、上記酸液は、過塩素酸であり、アルカリ水により中和は、水酸化カリウムとリン酸緩衝液の混合物を使用する請求項2乃至請求項4のいずれか1項に記載のDNAの損傷量を定量的に測定する方法。
【請求項6】
上記(c)の工程で、アルコール脱水素酵素は、アルコールデヒドロゲナーゼであり、ホルマゾン系の色素にエタノールを配合した発色液は、ナトリウム・バイシン緩衝液(Na ・Bicine)、MTT(3(4,5−Dimethyl−2−thiazolyl)−2,5−diphenyltetrazolium bromide thiazolyl blue)、フェナジンエトサルフェート(Phenazine ethosulfate )、エチレンジアミン四酢酸、 ウシ血清アルブミンの混合液である請求項2乃至請求項5のいずれか1項に記載のDNAの損傷量を定量的に測定する方法。
【請求項7】
上記吸光度は、550〜570nmの波長をマクロプレートリーダーで測定する請求項1乃至請求項6のいずれか1項に記載のDNAの損傷量を定量的に測定する方法。
【請求項8】
動物細胞のDNAに対する物理的又は化学的処理の影響を評価するために、酵素サイクリング法を利用しNADの量を吸光度で測定する請求項1乃至請求項7のいずれか1項に記載のDNAの損傷量を定量的に測定する方法。
【請求項9】
動物細胞のDNAの修復系を調節し得る物質をスクリーニングするために、酵素サイクリング法を利用しNADの量を吸光度で測定する請求項1乃至請求項7のいずれか1項に記載DNAの損傷量を定量的に測定する方法。
【請求項1】
酵素サイクリング法を利用しNADの量を吸光度で測定することによりDNAの損傷量を定量的に測定する方法。
【請求項2】
下記の(a)、(b)及び(c)の工程を含む請求項1記載のDNAの損傷量を定量的に測定する方法。
(a)げっ歯類の卵巣細胞を、少なくとも付着性細胞用の培地に動物由来血清を配合した培地を用いて培養し、培養したげっ歯類の卵巣細胞の培養液からげっ歯類の卵巣細胞を取り出し、洗浄を行う。
(b)洗浄後のげっ歯類の卵巣細胞からNADを抽出するために酸液に浸漬し、さらに一定時間静置する。浸漬後、浸漬液をアルカリ水により中和する。中和後の浸漬液を遠心分離により上清を分取しNAD測定用サンプルとする。
(c)少なくとも緩衝液に溶解したホルマゾン系の色素にエタノールを配合した発色液に、上記(b)の工程で調整したNAD測定用サンプルを混合したものに、酵素サイクリング法を利用し、アルコール脱水素酵素を添加し、さらに一定時間静置した後、波長550〜570nmにて吸光度を測定する。
【請求項3】
上記動物由来血清は、ウシ胎児血清であり、上記げっ歯類の卵巣細胞は、チャイニーズハムスター卵巣細胞である請求項2に記載のDNAの損傷量を定量的に測定する方法。
【請求項4】
上記(a)の工程で、上記培地にストレプトマイシンとペニシリンを添加する請求項2又は請求項3に記載のDNAの損傷量を定量的に測定する方法。
【請求項5】
上記(b)の工程で、上記酸液は、過塩素酸であり、アルカリ水により中和は、水酸化カリウムとリン酸緩衝液の混合物を使用する請求項2乃至請求項4のいずれか1項に記載のDNAの損傷量を定量的に測定する方法。
【請求項6】
上記(c)の工程で、アルコール脱水素酵素は、アルコールデヒドロゲナーゼであり、ホルマゾン系の色素にエタノールを配合した発色液は、ナトリウム・バイシン緩衝液(Na ・Bicine)、MTT(3(4,5−Dimethyl−2−thiazolyl)−2,5−diphenyltetrazolium bromide thiazolyl blue)、フェナジンエトサルフェート(Phenazine ethosulfate )、エチレンジアミン四酢酸、 ウシ血清アルブミンの混合液である請求項2乃至請求項5のいずれか1項に記載のDNAの損傷量を定量的に測定する方法。
【請求項7】
上記吸光度は、550〜570nmの波長をマクロプレートリーダーで測定する請求項1乃至請求項6のいずれか1項に記載のDNAの損傷量を定量的に測定する方法。
【請求項8】
動物細胞のDNAに対する物理的又は化学的処理の影響を評価するために、酵素サイクリング法を利用しNADの量を吸光度で測定する請求項1乃至請求項7のいずれか1項に記載のDNAの損傷量を定量的に測定する方法。
【請求項9】
動物細胞のDNAの修復系を調節し得る物質をスクリーニングするために、酵素サイクリング法を利用しNADの量を吸光度で測定する請求項1乃至請求項7のいずれか1項に記載DNAの損傷量を定量的に測定する方法。
【図1】


【図2】




【図2】


【公開番号】特開2010−22335(P2010−22335A)
【公開日】平成22年2月4日(2010.2.4)
【国際特許分類】
【出願番号】特願2008−191156(P2008−191156)
【出願日】平成20年7月24日(2008.7.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 〔研究集会名〕 日本農芸化学会2008年度大会 〔主催者名〕 社団法人日本農芸化学会 〔開催日〕 平成20年3月28日
【出願人】(304026696)国立大学法人三重大学 (270)
【出願人】(000234166)伯東株式会社 (135)
【Fターム(参考)】
【公開日】平成22年2月4日(2010.2.4)
【国際特許分類】
【出願日】平成20年7月24日(2008.7.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 〔研究集会名〕 日本農芸化学会2008年度大会 〔主催者名〕 社団法人日本農芸化学会 〔開催日〕 平成20年3月28日
【出願人】(304026696)国立大学法人三重大学 (270)
【出願人】(000234166)伯東株式会社 (135)
【Fターム(参考)】
[ Back to top ]

