アレルギー疾患感受性遺伝子発現抑制物質
【課題】本発明は、アレルギー疾患感受性遺伝子の発現機構を標的としたアレルギー疾患感受性遺伝子発現抑制物質を提供することを課題とする。
【解決手段】以下の一般式(I)で表されるアレルギー疾患感受性遺伝子発現抑制物質による。

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
【解決手段】以下の一般式(I)で表されるアレルギー疾患感受性遺伝子発現抑制物質による。

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アレルギー疾患の新規治療薬の開発に際し、アレルギー疾患感受性遺伝子の発現機構を標的としたアレルギー疾患感受性遺伝子発現抑制物質に関する。さらには、当該アレルギー疾患感受性遺伝子発現抑制物質の新規合成方法に関する。
【背景技術】
【0002】
免疫システムは、抗原を排除して体を守るために働く生体の機能であるが、この免疫反応が過度に、又は不適当な形で起こる場合があり、このような場合には組織障害、即ちアレルギー疾患を発症することがある。アレルギー疾患は、以下の機構により生ずる。アレルゲンが生体内に侵入すると、マクロファージ及びTリンパ球を介して刺激されたBリンパ球により、アレルゲン特異的IgE抗体が産生される。この抗体がマスト細胞(肥満細胞)に付着すると、マスト細胞は感作された状態となり、この状態の中に、再度アレルゲンが侵入すると、この感作されたマスト細胞表面上の高親和性IgEレセプター(FCεRI)とアレルゲンが反応する。その結果、マスト細胞から多様な生理活性を有するヒスタミンやロイコトリエンなどのメディエーターが遊離し、平滑筋の収縮や血管透過性亢進が惹起され炎症が生じる。
【0003】
例えばヒスタミンは、上述の如くアレルギー疾患の主要メディエーターであり、標的細胞のヒスタミンH1受容体(以下、単に「H1R」という場合もある。)を解して主要な症状が発現される。抗ヒスタミン薬はH1Rを介するシグナルの遮断を利用したアレルギー疾患治療薬である。一方、アレルギー疾患は代表的な多因子疾患である。アレルギー疾患において発現異常が引き起こされている疾患関連遺伝子として、H1R遺伝子などが見出されている。これらのアレルギー疾患感受性遺伝子を標的とするアレルギー疾患治療薬の意義について、本発明者により報告されている(非特許文献1)。
【0004】
インターロイキン4(以下、単に「IL-4」という。)は、代表的なTh2サイトカインで、活性化されたT細胞や肥満細胞などから放出され、B細胞を活性化するほか、免疫学的にコンピテントな細胞の増殖及び分化に対して重要な効果を有するサイトカインであるため、IL-4遺伝子はアレルギー疾患感受性遺伝子と考えられる。
【0005】
マーキアイン(Maackiain)は、フラボノイドの一種でありプテロカルパン誘導体に分類される天然物由来化合物であり、苦参やその他の植物からも単離されることが確認されている。マーキアインは、制癌剤(特許文献1、2)やNa+/グルコトランスポーター阻害剤(特許文献3)として報告されている。しかしながら、マーキアインの抗アレルギー作用に関する報告はない。
【0006】
さらに、マーキアインは合成することができるが、その際に水銀化合物を用いて合成することが報告されている(非特許文献2)。しかしながら、マーキアインを有効成分として含む医薬組成物として使用する場合は、水銀化合物を用いないでマーキアインを合成することができれば、生体に対しても安全で好ましいと考えられるが、そのような合成方法については、特に開示されていない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開昭60-178815号公報
【特許文献2】特開平3-67045号公報
【特許文献3】特開2009-222622号公報
【非特許文献】
【0008】
【非特許文献1】YAKUGAKU ZASSHI, Vol.127 (1), 15-25 (2007)
【非特許文献2】J. Chem. Soc. Perkin trans I, 04-1809 (1980)
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、アレルギー疾患感受性遺伝子の発現機構を標的としたアレルギー疾患感受性遺伝子発現抑制物質を提供することを課題とする。さらには、当該アレルギー疾患感受性遺伝子発現抑制物質の新規合成方法を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは上記課題を解決するために、苦参抽出物について、IL-4遺伝子を抑制しうる化合物をスクリーニングし、鋭意研究を重ねた結果、フラボノイドの一種でありプテロカルパン誘導体に分類されるマーキアインがアレルギー疾患感受性遺伝子発現抑制作用を有することを見出し、本発明を完成した。
【0011】
即ち本発明は、以下よりなる。
1.以下の一般式(I)で表されるアレルギー疾患感受性遺伝子発現抑制物質。
【化1】

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
2.以下の式(II)で表される、前項1に記載のアレルギー疾患感受性遺伝子発現抑制物質。
【化2】

3.アレルギー疾患感受性遺伝子が、IL-4遺伝子、IL-5遺伝子及び/又はヒスタミンH1受容体遺伝子である、前項1又は2に記載のアレルギー疾患感受性遺伝子発現抑制物質。
4.前項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質を有効成分として含む抗アレルギー剤。
5.前項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質の合成工程において、中間産物である7-ベンジルオキシ-2H-1-ベンゾピラン(7-benzyloxy-2H-1-benzopyran)とセサモールとのカップリング工程が、水銀化合物を用いない工程によることを特徴とする、請求項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質の製造方法。
6.水銀化合物を用いない工程が、臭素化合物を用いる工程により合成する前項5に記載の製造方法。
【発明の効果】
【0012】
一般式(I)で表されるフラボノイドの一種であるプテロカルパン誘導体に分類される本発明の化合物は、アレルギー疾患感受性遺伝子であるIL-4遺伝子、IL-5遺伝子及びH1R遺伝子の発現を抑制する。このことから、一般式(I)で表される化合物、即ち本発明のアレルギー疾患感受性遺伝子発現抑制物質は、アレルギー疾患感受性遺伝子発現抑制物質として効果を示す。さらに、本発明のアレルギー疾患感受性遺伝子発現抑制物質は、アレルギー疾患感受性遺伝子発現を抑制することによる抗アレルギー作用が期待され、新規な抗アレルギー剤の開発に有用である。
【0013】
なお、本発明のアレルギー疾患感受性遺伝子発現抑制物質は、抗酸化作用や、JNK阻害作用が低いことが確認されたため、抗酸化作用や、JNK阻害作用によるものではなく、新規な分子機序に基づく遺伝子発現抑制作用であることが示唆された。これにより、本発明の化合物は、他の多くのフラボノイドとは異なる作用機序により抗アレルギー作用を示すものと考えられる。
【図面の簡単な説明】
【0014】
【図1】マーキアイン全合成のスキームを示す図である。水銀化合物を用いて合成する従来法に係る合成スキームである。(実施例2)
【図2】セサモールの臭素化合物を用いたマーキアインの合成スキームを示す図である。(実施例2)
【図3】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼす苦参熱水抽出物の効果を示す図である。(実施例1)
【図4】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼす酸性画分(苦参熱水抽出液からのpHによる分画)の効果を示す図である。(実施例1)
【図5】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼす塩基性画分(苦参熱水抽出液からのpHによる分画)の効果を示す図である。(実施例1)
【図6】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼす中性画分(苦参熱水抽出液からのpHによる分画)の効果を示す図である。(実施例1)
【図7】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼすCh1画分及びCh2画分(オープンカラムクロマトグラフィーによる分画)の効果を示す図である。(実施例1)
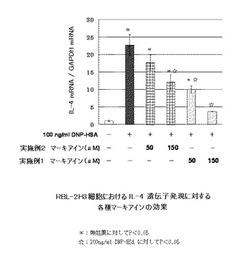
【図8】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼす各種マーキアインの効果を示す図である。(実験例1)
【図9】RBL-2H3細胞におけるIL-5遺伝子発現に及ぼす精製マーキアインの効果を示す図である。(実験例2)
【図10】RBL-2H3細胞におけるH1R遺伝子発現に及ぼす各種マーキアインの効果を示す図である。(実験例3)
【図11】精製マーキアイン(200μM)は、殆ど抗酸化作用を有さないことを示す図である。(参考例1)
【図12】精製マーキアイン(300μM)は、jun N-terminal kinase (JNK)活性には殆ど影響を及ぼさないことを示す図である。(参考例2)
【発明を実施するための形態】
【0015】
本発明は、新規なアレルギー疾患感受性遺伝子発現抑制物質に関する。本発明においてアレルギー疾患感受性遺伝子とは、一般的にアレルギー疾患感受性遺伝子といわれる遺伝子であればよく、特に限定されないが、例えばIL-4遺伝子、IL-5遺伝子、IgE受容体遺伝子、MHCクラスII遺伝子、ヒスタミンH1受容体(H1R)遺伝子、ヒスチジン脱炭素酵素遺伝子等が挙げられる。本発明のアレルギー疾患感受性遺伝子としては、好適にはIL-4遺伝子、IL-5遺伝子、H1R遺伝子が挙げられ、特に好適にはIL-4遺伝子である。
【0016】
本発明のアレルギー疾患感受性遺伝子発現抑制物質は、以下の一般式(I)で表される化合物であり、フラボノイドの一種であるプテロカルパン誘導体に分類される。
【化1】

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
上記において、糖の反応残基とは糖とマーキアイン誘導体との反応により糖分子から一個の水酸基が脱離した構造の糖をいう。糖としては、単糖類や二糖類が挙げられ、具体的にはグルコース、フラクトース、ガラクトースなどの単糖類や、マルトース、スクロース、ラクトース、トレハロースなどの二糖類が好ましい。
【0017】
本発明のアレルギー疾患感受性遺伝子発現抑制物質は、特に好適には以下の式(II)で表される化合物であり、マーキアインとも称する。
【化2】

【0018】
本発明のアレルギー疾患感受性遺伝子発現抑制物質は、天然物より抽出することもできるし、合成により得ることもできる。天然物としては、一般式(I)に示すプテロカルパン誘導体が抽出可能な天然物であればよく、特に限定されないが、例えば、苦参、槐(エンジュ)、群雀 (ムレスズメ)、ムラサキナツフジ、アカクローバー等が挙げられる。天然物より抽出する方法は、特に限定されないが、自体公知の方法によることができる。また、本発明のアレルギー疾患感受性遺伝子発現抑制物質は、合成により生成することもできる。天然物より抽出した場合は、以下の一般式(IV)に示す化合物を容易に得ることができる。また、合成により生成する場合は、以下の一般式(III)及び一般式(IV)に示す化合物が混合するラセミ体の場合が多い。本発明においては、天然物より抽出した化合物と同等の化合物、即ち一般式(IV)に示す化合物が最も好適である。
【0019】
【化3】

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
上記において、Rは特に好適には水素原子である。
【0020】
【化4】

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
上記において、Rは特に好適には水素原子である。
【0021】
本発明において一般式(I)又は式(II)で表される化合物は、さらに、薬学的に許容される塩であってもよい。
【0022】
本発明において、薬学的に許容される塩とは、薬理学的及び製剤学的に許容される一般的な塩が挙げられる。そのような塩として、具体的には以下が例示される。塩基性付加塩としては、例えばナトリウム塩、カリウム塩等のアルカリ金属塩;例えばカルシウム塩、マグネシウム塩等のアルカリ土類金属塩;例えばアンモニウム塩;例えばトリメチルアミン塩、トリエチルアミン塩;ジシクロヘキシルアミン塩、エタノールアミン塩、ジエタノールアミン塩、トリエタノールアミン塩、ブロカイン塩等の脂肪族アミン塩;たとえばN,N−ジベンジルエチレンジアミン等のアラルキルアミン塩;例えばピリジン塩、ピコリン塩、キノリン塩、イソキノリン塩等の複素環芳香族アミン塩;例えばテトラメチルアンモニウム塩、テトラエチルアモニウム塩、ベンジルトリメチルアンモニウム塩、ベンジルトリエチルアンモニウム塩、ベンジルトリブチルアンモニウム塩、メチルトリオクチルアンモニウム塩、テトラブチルアンモニウム塩等の第4級アンモニウム塩;アルギニン塩;リジン塩等の塩基性アミノ酸塩等が挙げられる。
【0023】
酸付加塩としては、例えば塩酸塩、硫酸塩、硝酸塩、リン酸塩、炭酸塩、炭酸水素塩、過塩素酸塩等の無機酸塩;例えば酢酸塩、プロピオン酸塩、乳酸塩、マレイン酸塩、フマール酸塩、酒石酸塩、リンゴ酸塩、クエン酸塩、アスコルビン酸塩等の有機酸塩;例えばメタンスルホン酸塩、イセチオン酸塩、ベンゼンスルホン酸塩、p−トルエンスルホン酸塩等のスルホン酸塩;例えばアスパラギン酸塩、グルタミン酸塩等の酸性アミノ酸等を挙げることができる。
【0024】
本発明のアレルギー疾患感受性遺伝子発現抑制物質、即ち上記一般式(I)に示すプテロカルパン誘導体、特に好適には式(II)に示すマーキアインは、例えば非特許文献2(J. Chem. Soc. Perkin trans I, 04-1809 (1980))に記載の合成方法を参照して合成することができる。しかしながら、非特許文献2に記載の方法では、マーキアイン合成の工程において、中間産物である2-クロロマーキュリオ-4,5-メチレンジオキシフェノール(2-chlormercurio-4,5-methylenedioxyphenol)の合成工程では水銀化合物を用いた方法が開示されている(図1参照)。本発明のアレルギー疾患感受性遺伝子発現抑制物質を有効成分とする医薬品等の場合は、当該アレルギー疾患感受性遺伝子発現抑制物質を水銀化合物を用いないで合成するのが、安全であり、合成廃棄物の処理の観点からも優れている。
【0025】
具体的には、非特許文献2(図1)における水銀化合物を用いた2-クロロマーキュリオ-4,5-メチレンジオキシフェノール(2-chlormercurio-4,5-methylenedioxyphenol)の合成工程は、臭素化合物を用いてセサモールから2-ブロモ-4,5-メチレンジオキシフェノールを合成することで代用できる(図2参照)。このように、水銀化合物を用いないでマーキアインを合成する方法は、従来報告されていない。従って、水銀化合物を用いないアレルギー疾患感受性遺伝子発現抑制物質であるマーキアインの合成方法は、本発明の範囲に包含される。
【0026】
本発明は、アレルギー疾患感受性遺伝子発現抑制物質を有効成分とする抗アレルギー剤にも及ぶ。本明細書において、抗アレルギー剤とは、いわゆるアレルギー疾患に対して効果を有する医薬品等の薬剤をいう。本発明の抗アレルギー剤は、アレルギー疾患に対して予防的又は治療的に使用することができ、好適には治療的に使用することができる。有効成分としてのアレルギー疾患感受性遺伝子発現抑制物質により、アレルギー疾患感受性遺伝子、即ちIL-4遺伝子、IL-5遺伝子、IgE受容体遺伝子、MHCクラスII遺伝子、ヒスタミンH1受容体(H1R)遺伝子、ヒスチジン脱炭素酵素遺伝子に示すいずれかの遺伝子、好適にはIL-4遺伝子、IL-5遺伝子及び/又はH1R遺伝子、より好適にはIL-4遺伝子の発現を抑制することができ、その結果としてアレルギー疾患を予防又は治療することができる。
【0027】
本明細書において、アレルギー疾患とはいわゆるアレルギー性の疾患であればよく、特に限定されないが、例えばI型アレルギー、II型アレルギー又はIV型アレルギーなどが挙げられる。具体的には、例えば花粉症、アレルギー性鼻炎、気管支喘息、アトピー性皮膚炎、植物アレルギー、蕁麻疹、PIE症候群、アナフィラキシーショック等が挙げられる。
【0028】
本発明の抗アレルギー剤を予防的若しくは治療的に使用する場合は、経口又は非経口により有効量投与することができる。その投与量は、投与経路や投与方法により適宜決定することができる。例えば、経口投与の場合には有効成分を成人一日あたり0.01〜1000mgの範囲で用いることができる。
【0029】
経口投与に適する剤形としては、例えば、錠剤、カプセル剤、散剤、細粒剤、顆粒剤、液剤、及びシロップ剤等を挙げることができ、非経口投与に適する剤形としては、例えば、注射剤、点滴剤、坐剤、吸入剤、点眼剤、点鼻剤、軟膏剤、クリーム剤、及び貼付剤等を挙げることができる。
【0030】
経口投与のためには、固型製剤又は液体製剤とすることができる。製剤としては、例えば錠剤、丸剤、散剤、顆粒剤、液剤、懸濁液あるいはカプセル剤などが挙げられる。錠剤を調製する際には常法に従ってラクトース、スターチ、炭酸カルシウム、結晶性セルロース、あるいはケイ酸などの賦形剤;カルボキシメチルセルロース、メチルセルロール、リン酸カルシウム、あるいはポリビニルピロリドン等の結合剤;アルギン酸ナトリウム、重ソウ、ラウリル硫酸ナトリウムやステアリン酸モノグリセライド等の崩壊剤;グリセリン等の潤滑剤;カオリン、コロイド状シリカ等の吸収剤;タルク、粒状ホウ酸などの潤滑剤などの添加剤を用いることができる。
【0031】
丸剤、散剤又は顆粒剤についても上記と同様に添加剤を用いて常法に従って製剤化される。液剤及び懸濁剤などの液体製剤も常法に従って製剤化される。担体としては例えばトリカプリリン、トリアセチン、ヨード化ケシ油脂肪酸エステル等のグリセロールエステル類;水;エタノール等のアルコール類;流動パラフィン、ココナッツ油、大豆油、ゴマ油、トウモロコシ油等の油性基剤が用いられる。上記した散剤、顆粒剤、液体製剤等はゼラチン等のカプセルで包むこともできる。
【0032】
本明細書における薬学的に許容しうる担体には、その他通常必要により用いられる補助剤、芳香剤、等張化剤、pH調節剤、安定化剤、噴射剤、粘着剤や防腐剤等を適宜選択して含むことができる。
【0033】
経皮投与用薬剤の剤形としては、軟膏、クリーム、ローション、液剤等が挙げられる。軟膏の基剤としては、例えばヒマシ油、オリーブ油、ゴマ油、サフラワー油などの脂肪油;ラノリン;白色、黄色若しくは親水ワセリン;ロウ;オレイルアルコール、イソステアリルアルコール、オクチルドデカノール、ヘキシルデカノールなどの高級アルコール類;グリセリン、ジグリセリン、エチレングリコール、プロピレングリコール、ソルビトール、1,3-ブタンジオールなどのグリコール類などが挙げられる。また可溶化剤としてエタノール、ジメチルスルホキシド、ポリエチレングリコールなどを用いてもよい。また必要に応じて、パラオキシ安息香酸エステル、安息香酸ナトリウム、サリチル酸、ソルビン酸、ホウ酸などの保存剤;ブチルヒドロキシアニソール、ジブチルヒドロキシトルエンなどの酸化防止剤などを用いてもよい。
【0034】
また、経皮吸収促進を図るため、ジイソプロピルアジペート、ジエチルセバケート、エチルカプロエート、エチルラウレートなどの吸収促進剤を加えてもよい。また、安定化を図るため、本発明化合物はα,β又はγーシクロデキストリンあるいはメチル化シクロデキストリン等と包接化合物を形成せしめて使用することもできる。
【0035】
軟膏は通常の方法によって製造することができる。クリーム剤としては水中油型クリーム剤の形態が本発明化合物の安定化を図るうえで好ましい。またその基剤としては、前述した如き、脂肪油、高級アルコール類、グリコール類などが用いられ、またジエチレングリコール、プロピレングリコール、ソルビタンモノ脂肪酸エステル、ポリソルベート80、ラウリル硫酸ナトリウムなどの乳化剤が用いられる。更に必要に応じて前述した如き保存剤、酸化防止剤などを添加してもよい。また軟膏剤の場合と同様に、シクロデキストリン、メチル化シクトデキストリンの包接化合物として用いることもできる。クリーム剤は通常の方法によって製造することができる。
【0036】
ローション剤としては、懸濁型、乳剤型、溶液型ローション剤が挙げられる。懸濁型ローション剤は、アルギン酸ナトリウム、トラガント、カルボキシメチルセルロースナトリウムなどの懸濁化剤を用い、必要に応じて酸化防止剤、保存剤などを加えて得られる。乳化型ローション剤は、ソルビタンモノ脂肪酸エステル、ポリソルベート80、ラウリル硫酸ナトリウムなどの乳化剤を用い、通常の方法で得られる。溶液型ローション剤は、アルコール型ローション剤が好ましくエタノールなどのアルコールを用いて通常の方法で得られる。液剤としては、エタノールなどのアルコール溶液に溶解し、必要に応じて酸化防止剤、保存剤などを添加したものが挙げられる。
【0037】
これらの剤形以外でも、パスタ剤、パップ剤、エアゾル剤等の剤形が挙げられる。かかる製剤は通常の方法によって製造することができる。
【0038】
経鼻による投与の製剤は、液状又は粉末状の組成物として与えられる。液状剤の基剤としては水、食塩水、リン酸緩衝液、酢酸緩衝液等が用いられ、さらに界面活性剤、酸化防止剤、安定剤、保存剤、粘性付与剤を含んでいてもよい。粉末状剤の基剤としては、水吸収性のものが好ましく、例えば、水易溶性のポリアクリル酸ナトリウム、ポリアクリル酸カルシウム、ポリアクリル酸アンモニウムなどのポリアクリル酸塩類、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロースナトリウムなどのセルロース低級アルキルエーテル類、ポリエチレングリコール、ポリビニルピロリドン、アミロース、プルランなどが、また水難溶性の結晶セルロース、α−セルロース、架橋カルボキシメチルセルロースナトリウムなどのセルロース類、ヒドロキシプロピン澱粉、カルボキシメチル澱粉、架橋澱粉、アミロース、アミロペクチン、ペクチンなどの澱粉類、ゼラチン、カゼイン、カゼインナトリウムなどのタンパク類、アラビアガム、トラガントガム、グルコマンナンなどのガム類、ポリビニルポリピロリドン、架橋ポリアクリル酸及びその塩、架橋ポリビニルアルコール、ポリヒドロキシエチルメタアクリレートなどの架橋ビニル重合体類などが挙げられ、これらを混合して用いてもよい。さらに粉末状剤には、酸化防止剤、着色剤、保存剤、防腐剤、矯腐剤等を添加してもよい。かかる液状剤、粉末状剤は例えばスプレー器具等を用いて投与することができる。
【0039】
注射による投与の製剤は、無菌の水性あるいは非水溶性液剤、懸濁剤、又は乳化剤として与えられる。非水性の溶液又は懸濁剤は、例えばプロピレングリコール、ポリエチレングリコール又はオリーブ油のような植物油、オレイン酸エチル、ヨード化ケシ油脂肪酸エステルのような注射しうる有機エステル類を薬学的に許容しうる担体とする。このような製剤はまた、防腐剤、湿潤剤、乳化剤、分散剤、安定剤のような補助剤を含むことができ、徐放性にしてもよい。これらの溶液剤、懸濁剤及び乳化剤は、例えばバクテリア保留フィルターを通す濾過、殺菌剤の配合、あるいは照射等の処理を適宜行うことによって無菌化できる。また無菌の固形製剤を製造し、使用直前に無菌水又は無菌の注射用溶媒に溶解して使用することができる。
【実施例】
【0040】
以下、本発明を実施例によりさらに具体的に説明するが、本発明は下記の実施例の範囲に限定されることはない。
【0041】
(実施例1)苦参抽出物からのIL-4遺伝子発現抑制物質の分離
1)苦参熱水抽出液の調製
苦参抽出物からIL-4遺伝子発現抑制物質の分離を試みた。苦参(Sophorae Radix, 小島漢方, Osaka)60 g を水1000 mlに入れて90分熱水抽出を行い、熱時濾過を行なった。これを濃縮し、30 mg/ml となるように調整し、苦参熱水抽出液とした。
【0042】
IL-4遺伝子発現に及ぼす影響は、ラット好塩基球性白血病細胞株(RBL-2H3細胞)に対する抗原抗体刺激によるIL-4遺伝子発現量により確認した。RBL-2H3細胞を35 mmシャーレにて培養し、細胞が70%コンフルーエントになった状態で上述の熱水抽出液を最終濃度1.2〜3.0 mg/mlになるように培地に加え37±0.5℃で24時間インキュベートした。抗原抗体刺激は、抗原刺激18時間前に100 ng/mlの抗ジニトロフェニル (DNP) モノクローナル抗体(SPE-7; SIGMA, St. Louis, USA)を加え細胞を培養した後、100 ng/ml DNP-HSA抗原(DNP-HSA, SIGMA, St. Louis, USA)を加えて行った。抗原刺激2時間後、細胞のかきとりを行い、かき取った細胞よりtotal RNAを調製し、逆転写反応にてcDNAとしたものを試料とし、リアルタイムRT-PCR法により、mRNAレベルを測定した(N=3)。IL-4遺伝子発現量は、IL-4のmRNAレベルをハウスキーピング遺伝子であるGAPDHのmRNAレベルとの相対比により確認した。
【0043】
その結果、苦参熱水抽出液は、DNP-HSA抗原によるIL-4遺伝子発現の上昇を有意に抑制することが確認された(図3)。以下、同手法によりIL-4遺伝子発現量を確認し、有効成分の抽出・単離を行った。
【0044】
ラットIL-4 mRNA測定用プライマーとして、以下の配列番号1及び2に示す配列、プローブは、配列番号3に示す配列のオリゴヌクレオチドを用いた。ラットGAPDH mRNA測定用プライマー・プローブは、市販のTaqMan(R) Rodent GAPDH Control Reagents (VIC Probe)Cat No. 4308313(アプライドバイオシステムズ)を用いた。
(配列番号1)sense primer: 5'-CAGGGTGCTTCGCAAATTTTAC-3'
(配列番号2)anti-sense primer: 5'-CACCGAGAACCCCAGACTTG-3'
(配列番号3)probe: FAM-CCCACGTGATGTACCTCCGTGCTTG-TAMRA
【0045】
2)苦参熱水抽出液からのpHによる分画
苦参熱水抽出液(30 mg/ml)から、各種pH条件により分画を行なった。1 Mの塩酸でpH 3に調整し、これを酢酸エチルで3回抽出し、溶媒を除いたものを酸性画分とした。酸性画分を抽出した残液(水層)を、1 M 水酸化ナトリウム水溶液でpH 10に調整し、酢酸エチルで3回抽出した。得られた抽出物の溶媒を除き、塩基性画分とした。当該塩基性画分を抽出した残液(水層)を、10%クエン酸水溶液でpH 7に調整した。当該抽出した残液(水層)の溶媒を凍結乾燥で除き、中性画分とした。それぞれの画分におけるアルカロイド類の分布を調べた。薄層クロマトグラフィにて各分画を展開し、ドラーゲンドルフ試薬を噴霧した。その結果、酸性画分中にアルカロイド類は検出されず、塩基性画分、中性画分においてアルカロイド類の分布が認められた。
【0046】
これらの画分について、それぞれRBL-2H3細胞を用いてIL-4遺伝子発現に及ぼす影響を調べた。IL-4遺伝子発現レベルは、上記1)に記載の方法と同手法により確認した(N=3)。その結果、酸性画分はIL-4遺伝子発現の上昇を有意に抑制した(図4)。一方、塩基性画分、中性画分はIL-4遺伝子発現に対して抑制作用を示さなかった(図5、図6)。
【0047】
3)オープンカラムクロマトグラフィーによる分画
活性のあった酸性画分について、オープンカラムクロマトグラフィーにより、さらに分離・精製を行なった。固定相にシリカゲル(Silica gel 60N)(関東化学, Tokyo)を用い、移動層にクロロホルム:メタノール(9:1)を用いて溶出し、溶出液を50 mLずつ分取し、画分Ch1〜Ch21を得た。その後、カラムを100%メタノールで洗浄し、さらに50 mLずつ分取し、画分M1〜M7を得た。得られた溶出画分及び洗浄画分の各画分について、溶媒を除き、IL-4遺伝子発現に及ぼす影響を調べた。IL-4遺伝子発現量は、上記1)に記載の方法と同手法により確認した(N=3)。これらの画分の内、Ch1ではIL-4遺伝子発現の抑制傾向がみられ、Ch2では有意な抑制作用が確認された(図7)。残りの画分には抑制作用は認められなかった。
【0048】
4)有効成分の単離・同定
薄層クロマトグラフィによって、Ch1画分とCh2画分に共通のスポットがあることを確認した。そのスポットをさらにシリカゲルオープンカラムクロマトグラフィ(移動層;ヘキサン:酢酸エチル(2:1))で精製し、精製画分についてIL-4遺伝子発現に及ぼす影響を調べた。IL-4遺伝子発現量は、上記1)に記載の方法と同手法により確認した(N=3)。また、当該精製により得られた画分について、これを核磁気共鳴スペクトル(NMR)に供し、有効成分が式(II)に示すマーキアインであることを明らかにした。構造の同定は1次元NMR(1H, 13C)及び2次元NMR(HH-COSY, DEPT, HMBC, HSQC)により行った(日本ブルカー, Kanagawa ; ARX-400)。内部標準としてテトラメチルシラン(tetramethylsilane)を用いた。
【0049】
【化2】

【0050】
上記シリカゲルオープンカラムクロマトグラフィにより精製して得た画分について、さらに高速液体クロマトグラフィ(HPLC)を行い、有効成分の精製を行った。HPLCは、カラムとしてMightysil RP18 GP(関東化学, Tokyo)を用い、65%メタノールまたは55%メタノール、流速0.8 mL/minにて行なった。分取した画分をメタノールで再結晶し、精製品とした。
【0051】
(実施例2)Heck反応を用いたマーキアインの合成
本発明のマーキアインの合成は、非特許文献2の方法(図1参照)の方法を一部改変して行なった。図1の方法では、水銀化合物を用いているのに対し、本実施例では、化合物(3)(7-ベンジルオキシ-2H-1-ベンゾピラン(7-benzyloxy-2H-1-benzopyran))と化合物(1)(セサモール(Sesamol: 1,3-Benzodioxol-5-ol))とのカップリングにおいて、J.S.Yadav (Adv. Synth. Catal. 346: 77-82 (2004))らの方法を一部改変し、水銀化合物を用いず、臭素化合物を用いた(図2参照)。
【0052】
化合物(1)(300 mg, 2.17 mmol)を塩化メチレンに溶解し、氷冷しながらn-ブロモスクシンイミド(n-Bromosuccinimide)(464 mg, 2.606 mmol)をゆっくり添加した。炭酸水素ナトリウム水溶液で反応を止め、塩化エチレン層を濃縮した。これをカラムクロマトグラフィー(シリカゲル、ヘキサン−クロロホルム=1:3)により単離し、化合物(2)(2-ブロモ-4,5-メチレンジオキシフェノール(2-bromo-4,5-methylenedioxyphenol))(295.9 mg, 1.36 mmol, 62%)を得た。
【0053】
非特許文献2に記載の方法に従い、合成した化合物(3)(14.5 mg, 0.061 mmol)と化合物(2)(13.2 mg, 0.061 mmol)を、アセトニトリル(5 mL)に溶解し、トリシクロヘキシルホスフィン(tricyclohexylphosphine)(30% in トルエン、20μl, 0.0183 mmol)とPd2(dba)3・CHCl3 (63 mg, 0.0061 mmol)を混ぜたものを60℃。アルゴン雰囲気下で4時間反応させた。その後、反応液を塩化メチレンで3倍に希釈し、フロリジール(R)(150-250μm)を用いてろ過した後、濃縮し、カラムクロマトグラフィー(シリカゲル、ヘキサン−酢酸エチル=5:1)により目的化合物(4)(マーキアイン)(5.4 mg, 0.0144 mmol, 23.7%)を得た。
【0054】
(実験例1)天然物由来マーキアイン及び合成マーキアインのIL-4遺伝子発現に及ぼす効果
実施例1で抽出・精製した天然物由来マーキアイン及び実施例2で合成して得た合成マーキアインについて、IL-4遺伝子発現に及ぼす影響を調べた。IL-4遺伝子発現量は、上記1)に記載の方法と同手法により確認した。
【0055】
各マーキアインは、いずれもDNP-HSA抗原によるIL-4遺伝子発現を有意に抑制することを確認した(図8)。また、合成マーキアイン(実施例2)は、天然物由来マーキアイン(実施例1)に比べて、IL-4遺伝子発現抑制効果が半減していることが観察された。このことより、合成マーキアインはラセミ体で、光学活性体のうち、片方のみがIL-4遺伝子発現抑制効果を示すと考えられた。また、実施例1の抽出・精製により得たマーキアイン 0.11 g/100 mL (in chloroform) の旋光度を測定し、比旋光度を算出しところ、[α]16D= -176.4 °であった。過去の文献値との比較により、実施例1で得られた天然物由来マーキアインは(-)マーキアインであると考えられ、有効な光学活性体であると考えられた。
【0056】
(実験例2)(-)マーキアインのIL-5遺伝子発現に及ぼす効果
本実験例では、IL-5遺伝子発現に及ぼす(-)マーキアインの効果を確認した。(-)マーキアインは、実施例1で抽出・精製したマーキアインを用いた。
【0057】
IL-5はIL-4と同じくTh2サイトカインに分類され、活性化されたTリンパ球や肥満細胞などから放出され、好酸球の分化、増殖、遊走などに関わる因子であり、遅発相のアレルギー反応を惹起する因子と考えられている。よって、IL-5遺伝子はアレルギー疾患感受性遺伝子であり、アレルギーの慢性化・難治化させる因子である考えられる。
【0058】
IL-5遺伝子発現量は、ヒト好塩基球白血病細胞KU812F細胞を用いて測定した。細胞を35 mmシャーレで培養し、DMSOに溶解した(-)マーキアインを添加して24時間後、マイトージェン(PMA (Phorbol 12-myristate 13-acetate) (20 nM) + イオノマイシン (1 μM))で共刺激を3時間行った。実施例1に記載と同手法により、IL-5のmRNA及びGAPDHのmRNAについて、リアルタイムRT-PCRを行なった。
【0059】
その結果、(-)マーキアインは、マイトージェンによるIL-5遺伝子発現上昇を有意に抑制することが確認された(図9)。
【0060】
ヒトIL-5 mRNA測定用プライマーとして、以下の配列番号4及び5に示す配列、プローブは、配列番号6に示す配列のオリゴヌクレオチドを用いた。ヒトGAPDH mRNA測定用プライマー・プローブは、市販のPre Developed TaqMan(R) Assay Reagent Control Kits (Human GAPDH) Cat No. 4310884E(アプライドバイオシステムズ)を用いた。
(配列番号4)sense primer: 5'-CAC TGA AGA AAT CTT TCA GGG AAT-3'
(配列番号5)anti-sense primer: 5'-CAG TAC CCC CTT GCA CAG TT-3'
(配列番号6)probe: FAM-ACA CTG GA-TAMRA
【0061】
(実験例3)(-)マーキアインのヒスタミンH1受容体(H1R)遺伝子発現に及ぼす効果
本実験例では、H1R遺伝子発現に及ぼす(-)マーキアインの効果を確認した。ヒスタミンは、アレルギー疾患の主要ディエーターであり、標的細胞のH1Rを介して主要症状が発現されることはよく知られている。ここで、H1R遺伝子はアレルギー疾患感受性遺伝子であることが、本発明者により報告されている(非特許文献1)。
【0062】
H1R遺伝子発現量は、ヒト子宮頸癌細胞HeLa細胞を用いて測定した。細胞を35 mmシャーレで培養し、24時間無血清培地で培養することで栄養飢餓(starvation)を行った。無血清培養開始と同時にDMSO溶解の(-)マーキアインを培地に加え、培養細胞を24時間処置した。その後、100 nM PMAによる刺激を3時間行った。実施例1に記載と同手法により、H1RのmRNA及びGAPDHのmRNAについて、リアルタイムRT-PCRを行なった。
【0063】
その結果、(-)マーキアインは、PMAによるH1R遺伝子発現上昇を有意に抑制することが確認された(図10)。
ヒトH1R mRNA測定用プライマーとして、以下の配列番号7及び8に示す配列、プローブは、配列番号9に示す配列のオリゴヌクレオチドを用いた。ヒトGAPDH mRNA測定用プライマー・プローブは、実験例2と同様に市販のものを用いた。
(配列番号7)sense primer: 5'- CAG AGG ATC AGA TGT TAG GTG ATA GC - 3
(配列番号8)anti-sense primer: 5'- AGC GGA GCC TCT TCC AAG TAA - 3'
(配列番号9)probe: FAM- CTT CTC TCG AAC GGA CTC AGA TAC CAC C- TAMRA
【0064】
(参考例1)抗酸化作用
本参考例では、Jung(Arch Pharm Res Vol 28, No5, 534-540, 2005)の方法に基づき、実施例1で抽出・精製した(-)マーキアインの、DPPH(ジフェニル-p-ピクリルヒドラジル)ラジカル消去活性について検討した。
【0065】
フラボノイドは抗アレルギー作用、抗がん作用など多くの生理活性を有することがこれまでに報告されており、その分子基盤の多くはフラボノイドの持つ抗酸化作用に基づくことが公知である。そのため、マーキアインの遺伝子発現抑制作用も他のフラボノイドと同様に抗酸化作用に由来する可能性が考えられた。従来文献的には、マーキアインの抗酸化作用については、DPPHラジカル消去活性、過酸化水素誘導の細胞間活性酸素種消去活性、ONOO-消去活性を指標に検討されており、それによると、マーキアインは他の抗酸化作用を有する物質と比較して著しく抗酸化作用が弱く、抗酸化作用を有さないことが報告されている(Arch Pharm Res Vol 28, No5, 534-540, 2005)。そこで、本参考例では、DPPHラジカル消去活性を指標にマーキアインの抗酸化作用について検討した。
【0066】
ポジティブコントロールとして、アスコルビン酸を使用した。150 μmol/LのDPPH (ジフェニル-p-ピクリルヒドラジル)メタノール溶液 40μL と、最終濃度が50、100、150、200 μmol/Lになるように調整したマーキアインもしくはポジティブコントロールのアスコルビン酸のメタノール溶液を160 μL加え、静かに混和した。室温で30分間放置した後、安定な有機ラジカルであるDPPHラジカルに由来する520nmの吸光度を測定し、コントロール(マーキアイン及びアスコルビン酸を含まないDPPHのみの溶液)との比を下式により算出し、DPPHラジカル消去活性とした。被験試料溶液ブランクとしては、マーキアインを添加しないメタノール溶液を用い、同様の方法で吸光度を測定した。
【0067】
DPPHに対するラジカル消去作用の計算方法は以下の通りである。
DPPHラジカル消去活性(%)={C−(St−Sb)}/C×100
St: 波長520nmにおける被験試料溶液の吸光度
Sb: 波長520nmにおける被験試料溶液ブランクの吸光度
C: コントロール溶液の波長520nmにおける吸光度
【0068】
上記の結果、(-)マーキアインを200μM反応させた場合でも、抗酸化作用を殆ど有しないことが認められ(図11)、マーキアインには抗酸化作用がないことを確認した。このことから、マーキアインの遺伝子発現抑制作用は、他のフラボノイドが有する抗酸化作用によるものではなく、新規メカニズムに基づく遺伝子発現抑制作用であることが示唆された。
【0069】
(参考例2)(-)マーキアインのjun N-terminal kinase (JNK)活性への影響
本参考例では実施例1で抽出・精製した(-)マーキアインについて、JNKの酵素活性の抑制作用を調べた。JNKは転写因子AP-1を構成するタンパク質の一つであるc-Junをリン酸化しAP-1が関与する遺伝子発現を亢進する。フラボノイドには、JNKの酵素活性を抑制することで、様々な生理活性を示すものが多い。
【0070】
そこで、本参考例では、(-)マーキアインのIL-4遺伝子発現抑制作用が、JNKの酵素活性の抑制によるものであるかどうかを検討した。JNKのin vitro キナーゼアッセイは、KinaseSTAR(R) JNK Activity Assay Kit(BioVision)を用い、添付文書に記載の方法に従い行なった。まず、HeLa細胞を70 nMアニソマイシン(Sigma)で30分処置し、JNKを活性化した。キットに附属のJNK 抽出用緩衝液を用いて細胞を粉砕し、遠心上清にJNK特異抗体を加えた後、同キットに附属のProtein A Sepharose(R)によりJNKを免疫沈降することで、活性化JNKを調製した。活性化したJNKにc-jun及びATPを含む基質溶液を加え、30℃で1時間反応させ、生じたリン酸化c-junをリン酸化c-jun特異抗体を用いたウエスタンブロットにより検出した。ポジティブコントロールとしてJNKの阻害薬として知られているSP600125(WAKO)を用いた。
【0071】
上記の結果、(-)マーキアインを300μM反応させた場合でも、JNKによるc-Junのリン酸化を抑制しなかった(図12)。
【産業上の利用可能性】
【0072】
以上詳述したように、一般式(I)で表されるフラボノイドの一種であるプテロカルパン誘導体に分類される本発明の化合物は、アレルギー疾患感受性遺伝子であるIL-4遺伝子、IL-5遺伝子及びH1R遺伝子の発現を抑制する。このことから、一般式(I)で表される化合物、即ち本発明のアレルギー疾患感受性遺伝子発現抑制物質は、アレルギー疾患感受性遺伝子発現抑制物質として効果を示す。さらに、本発明のアレルギー疾患感受性遺伝子発現抑制物質は、アレルギー疾患感受性遺伝子発現を抑制することによる抗アレルギー作用が期待され、新規な抗アレルギー剤の開発に有用である。
【0073】
なお、本発明のアレルギー疾患感受性遺伝子発現抑制物質は、抗酸化作用や、JNK阻害作用が低いことが確認されたため、抗酸化作用や、JNK阻害作用によるものではなく、新規な分子機序に基づく遺伝子発現抑制作用であることが示唆された。これにより、本発明の化合物は、他の多くのフラボノイドとは異なる作用機序により抗アレルギー作用を示すものと考えられる。
【技術分野】
【0001】
本発明は、アレルギー疾患の新規治療薬の開発に際し、アレルギー疾患感受性遺伝子の発現機構を標的としたアレルギー疾患感受性遺伝子発現抑制物質に関する。さらには、当該アレルギー疾患感受性遺伝子発現抑制物質の新規合成方法に関する。
【背景技術】
【0002】
免疫システムは、抗原を排除して体を守るために働く生体の機能であるが、この免疫反応が過度に、又は不適当な形で起こる場合があり、このような場合には組織障害、即ちアレルギー疾患を発症することがある。アレルギー疾患は、以下の機構により生ずる。アレルゲンが生体内に侵入すると、マクロファージ及びTリンパ球を介して刺激されたBリンパ球により、アレルゲン特異的IgE抗体が産生される。この抗体がマスト細胞(肥満細胞)に付着すると、マスト細胞は感作された状態となり、この状態の中に、再度アレルゲンが侵入すると、この感作されたマスト細胞表面上の高親和性IgEレセプター(FCεRI)とアレルゲンが反応する。その結果、マスト細胞から多様な生理活性を有するヒスタミンやロイコトリエンなどのメディエーターが遊離し、平滑筋の収縮や血管透過性亢進が惹起され炎症が生じる。
【0003】
例えばヒスタミンは、上述の如くアレルギー疾患の主要メディエーターであり、標的細胞のヒスタミンH1受容体(以下、単に「H1R」という場合もある。)を解して主要な症状が発現される。抗ヒスタミン薬はH1Rを介するシグナルの遮断を利用したアレルギー疾患治療薬である。一方、アレルギー疾患は代表的な多因子疾患である。アレルギー疾患において発現異常が引き起こされている疾患関連遺伝子として、H1R遺伝子などが見出されている。これらのアレルギー疾患感受性遺伝子を標的とするアレルギー疾患治療薬の意義について、本発明者により報告されている(非特許文献1)。
【0004】
インターロイキン4(以下、単に「IL-4」という。)は、代表的なTh2サイトカインで、活性化されたT細胞や肥満細胞などから放出され、B細胞を活性化するほか、免疫学的にコンピテントな細胞の増殖及び分化に対して重要な効果を有するサイトカインであるため、IL-4遺伝子はアレルギー疾患感受性遺伝子と考えられる。
【0005】
マーキアイン(Maackiain)は、フラボノイドの一種でありプテロカルパン誘導体に分類される天然物由来化合物であり、苦参やその他の植物からも単離されることが確認されている。マーキアインは、制癌剤(特許文献1、2)やNa+/グルコトランスポーター阻害剤(特許文献3)として報告されている。しかしながら、マーキアインの抗アレルギー作用に関する報告はない。
【0006】
さらに、マーキアインは合成することができるが、その際に水銀化合物を用いて合成することが報告されている(非特許文献2)。しかしながら、マーキアインを有効成分として含む医薬組成物として使用する場合は、水銀化合物を用いないでマーキアインを合成することができれば、生体に対しても安全で好ましいと考えられるが、そのような合成方法については、特に開示されていない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開昭60-178815号公報
【特許文献2】特開平3-67045号公報
【特許文献3】特開2009-222622号公報
【非特許文献】
【0008】
【非特許文献1】YAKUGAKU ZASSHI, Vol.127 (1), 15-25 (2007)
【非特許文献2】J. Chem. Soc. Perkin trans I, 04-1809 (1980)
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、アレルギー疾患感受性遺伝子の発現機構を標的としたアレルギー疾患感受性遺伝子発現抑制物質を提供することを課題とする。さらには、当該アレルギー疾患感受性遺伝子発現抑制物質の新規合成方法を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明者らは上記課題を解決するために、苦参抽出物について、IL-4遺伝子を抑制しうる化合物をスクリーニングし、鋭意研究を重ねた結果、フラボノイドの一種でありプテロカルパン誘導体に分類されるマーキアインがアレルギー疾患感受性遺伝子発現抑制作用を有することを見出し、本発明を完成した。
【0011】
即ち本発明は、以下よりなる。
1.以下の一般式(I)で表されるアレルギー疾患感受性遺伝子発現抑制物質。
【化1】

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
2.以下の式(II)で表される、前項1に記載のアレルギー疾患感受性遺伝子発現抑制物質。
【化2】

3.アレルギー疾患感受性遺伝子が、IL-4遺伝子、IL-5遺伝子及び/又はヒスタミンH1受容体遺伝子である、前項1又は2に記載のアレルギー疾患感受性遺伝子発現抑制物質。
4.前項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質を有効成分として含む抗アレルギー剤。
5.前項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質の合成工程において、中間産物である7-ベンジルオキシ-2H-1-ベンゾピラン(7-benzyloxy-2H-1-benzopyran)とセサモールとのカップリング工程が、水銀化合物を用いない工程によることを特徴とする、請求項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質の製造方法。
6.水銀化合物を用いない工程が、臭素化合物を用いる工程により合成する前項5に記載の製造方法。
【発明の効果】
【0012】
一般式(I)で表されるフラボノイドの一種であるプテロカルパン誘導体に分類される本発明の化合物は、アレルギー疾患感受性遺伝子であるIL-4遺伝子、IL-5遺伝子及びH1R遺伝子の発現を抑制する。このことから、一般式(I)で表される化合物、即ち本発明のアレルギー疾患感受性遺伝子発現抑制物質は、アレルギー疾患感受性遺伝子発現抑制物質として効果を示す。さらに、本発明のアレルギー疾患感受性遺伝子発現抑制物質は、アレルギー疾患感受性遺伝子発現を抑制することによる抗アレルギー作用が期待され、新規な抗アレルギー剤の開発に有用である。
【0013】
なお、本発明のアレルギー疾患感受性遺伝子発現抑制物質は、抗酸化作用や、JNK阻害作用が低いことが確認されたため、抗酸化作用や、JNK阻害作用によるものではなく、新規な分子機序に基づく遺伝子発現抑制作用であることが示唆された。これにより、本発明の化合物は、他の多くのフラボノイドとは異なる作用機序により抗アレルギー作用を示すものと考えられる。
【図面の簡単な説明】
【0014】
【図1】マーキアイン全合成のスキームを示す図である。水銀化合物を用いて合成する従来法に係る合成スキームである。(実施例2)
【図2】セサモールの臭素化合物を用いたマーキアインの合成スキームを示す図である。(実施例2)
【図3】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼす苦参熱水抽出物の効果を示す図である。(実施例1)
【図4】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼす酸性画分(苦参熱水抽出液からのpHによる分画)の効果を示す図である。(実施例1)
【図5】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼす塩基性画分(苦参熱水抽出液からのpHによる分画)の効果を示す図である。(実施例1)
【図6】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼす中性画分(苦参熱水抽出液からのpHによる分画)の効果を示す図である。(実施例1)
【図7】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼすCh1画分及びCh2画分(オープンカラムクロマトグラフィーによる分画)の効果を示す図である。(実施例1)
【図8】RBL-2H3細胞におけるIL-4遺伝子発現に及ぼす各種マーキアインの効果を示す図である。(実験例1)
【図9】RBL-2H3細胞におけるIL-5遺伝子発現に及ぼす精製マーキアインの効果を示す図である。(実験例2)
【図10】RBL-2H3細胞におけるH1R遺伝子発現に及ぼす各種マーキアインの効果を示す図である。(実験例3)
【図11】精製マーキアイン(200μM)は、殆ど抗酸化作用を有さないことを示す図である。(参考例1)
【図12】精製マーキアイン(300μM)は、jun N-terminal kinase (JNK)活性には殆ど影響を及ぼさないことを示す図である。(参考例2)
【発明を実施するための形態】
【0015】
本発明は、新規なアレルギー疾患感受性遺伝子発現抑制物質に関する。本発明においてアレルギー疾患感受性遺伝子とは、一般的にアレルギー疾患感受性遺伝子といわれる遺伝子であればよく、特に限定されないが、例えばIL-4遺伝子、IL-5遺伝子、IgE受容体遺伝子、MHCクラスII遺伝子、ヒスタミンH1受容体(H1R)遺伝子、ヒスチジン脱炭素酵素遺伝子等が挙げられる。本発明のアレルギー疾患感受性遺伝子としては、好適にはIL-4遺伝子、IL-5遺伝子、H1R遺伝子が挙げられ、特に好適にはIL-4遺伝子である。
【0016】
本発明のアレルギー疾患感受性遺伝子発現抑制物質は、以下の一般式(I)で表される化合物であり、フラボノイドの一種であるプテロカルパン誘導体に分類される。
【化1】

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
上記において、糖の反応残基とは糖とマーキアイン誘導体との反応により糖分子から一個の水酸基が脱離した構造の糖をいう。糖としては、単糖類や二糖類が挙げられ、具体的にはグルコース、フラクトース、ガラクトースなどの単糖類や、マルトース、スクロース、ラクトース、トレハロースなどの二糖類が好ましい。
【0017】
本発明のアレルギー疾患感受性遺伝子発現抑制物質は、特に好適には以下の式(II)で表される化合物であり、マーキアインとも称する。
【化2】

【0018】
本発明のアレルギー疾患感受性遺伝子発現抑制物質は、天然物より抽出することもできるし、合成により得ることもできる。天然物としては、一般式(I)に示すプテロカルパン誘導体が抽出可能な天然物であればよく、特に限定されないが、例えば、苦参、槐(エンジュ)、群雀 (ムレスズメ)、ムラサキナツフジ、アカクローバー等が挙げられる。天然物より抽出する方法は、特に限定されないが、自体公知の方法によることができる。また、本発明のアレルギー疾患感受性遺伝子発現抑制物質は、合成により生成することもできる。天然物より抽出した場合は、以下の一般式(IV)に示す化合物を容易に得ることができる。また、合成により生成する場合は、以下の一般式(III)及び一般式(IV)に示す化合物が混合するラセミ体の場合が多い。本発明においては、天然物より抽出した化合物と同等の化合物、即ち一般式(IV)に示す化合物が最も好適である。
【0019】
【化3】

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
上記において、Rは特に好適には水素原子である。
【0020】
【化4】

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
上記において、Rは特に好適には水素原子である。
【0021】
本発明において一般式(I)又は式(II)で表される化合物は、さらに、薬学的に許容される塩であってもよい。
【0022】
本発明において、薬学的に許容される塩とは、薬理学的及び製剤学的に許容される一般的な塩が挙げられる。そのような塩として、具体的には以下が例示される。塩基性付加塩としては、例えばナトリウム塩、カリウム塩等のアルカリ金属塩;例えばカルシウム塩、マグネシウム塩等のアルカリ土類金属塩;例えばアンモニウム塩;例えばトリメチルアミン塩、トリエチルアミン塩;ジシクロヘキシルアミン塩、エタノールアミン塩、ジエタノールアミン塩、トリエタノールアミン塩、ブロカイン塩等の脂肪族アミン塩;たとえばN,N−ジベンジルエチレンジアミン等のアラルキルアミン塩;例えばピリジン塩、ピコリン塩、キノリン塩、イソキノリン塩等の複素環芳香族アミン塩;例えばテトラメチルアンモニウム塩、テトラエチルアモニウム塩、ベンジルトリメチルアンモニウム塩、ベンジルトリエチルアンモニウム塩、ベンジルトリブチルアンモニウム塩、メチルトリオクチルアンモニウム塩、テトラブチルアンモニウム塩等の第4級アンモニウム塩;アルギニン塩;リジン塩等の塩基性アミノ酸塩等が挙げられる。
【0023】
酸付加塩としては、例えば塩酸塩、硫酸塩、硝酸塩、リン酸塩、炭酸塩、炭酸水素塩、過塩素酸塩等の無機酸塩;例えば酢酸塩、プロピオン酸塩、乳酸塩、マレイン酸塩、フマール酸塩、酒石酸塩、リンゴ酸塩、クエン酸塩、アスコルビン酸塩等の有機酸塩;例えばメタンスルホン酸塩、イセチオン酸塩、ベンゼンスルホン酸塩、p−トルエンスルホン酸塩等のスルホン酸塩;例えばアスパラギン酸塩、グルタミン酸塩等の酸性アミノ酸等を挙げることができる。
【0024】
本発明のアレルギー疾患感受性遺伝子発現抑制物質、即ち上記一般式(I)に示すプテロカルパン誘導体、特に好適には式(II)に示すマーキアインは、例えば非特許文献2(J. Chem. Soc. Perkin trans I, 04-1809 (1980))に記載の合成方法を参照して合成することができる。しかしながら、非特許文献2に記載の方法では、マーキアイン合成の工程において、中間産物である2-クロロマーキュリオ-4,5-メチレンジオキシフェノール(2-chlormercurio-4,5-methylenedioxyphenol)の合成工程では水銀化合物を用いた方法が開示されている(図1参照)。本発明のアレルギー疾患感受性遺伝子発現抑制物質を有効成分とする医薬品等の場合は、当該アレルギー疾患感受性遺伝子発現抑制物質を水銀化合物を用いないで合成するのが、安全であり、合成廃棄物の処理の観点からも優れている。
【0025】
具体的には、非特許文献2(図1)における水銀化合物を用いた2-クロロマーキュリオ-4,5-メチレンジオキシフェノール(2-chlormercurio-4,5-methylenedioxyphenol)の合成工程は、臭素化合物を用いてセサモールから2-ブロモ-4,5-メチレンジオキシフェノールを合成することで代用できる(図2参照)。このように、水銀化合物を用いないでマーキアインを合成する方法は、従来報告されていない。従って、水銀化合物を用いないアレルギー疾患感受性遺伝子発現抑制物質であるマーキアインの合成方法は、本発明の範囲に包含される。
【0026】
本発明は、アレルギー疾患感受性遺伝子発現抑制物質を有効成分とする抗アレルギー剤にも及ぶ。本明細書において、抗アレルギー剤とは、いわゆるアレルギー疾患に対して効果を有する医薬品等の薬剤をいう。本発明の抗アレルギー剤は、アレルギー疾患に対して予防的又は治療的に使用することができ、好適には治療的に使用することができる。有効成分としてのアレルギー疾患感受性遺伝子発現抑制物質により、アレルギー疾患感受性遺伝子、即ちIL-4遺伝子、IL-5遺伝子、IgE受容体遺伝子、MHCクラスII遺伝子、ヒスタミンH1受容体(H1R)遺伝子、ヒスチジン脱炭素酵素遺伝子に示すいずれかの遺伝子、好適にはIL-4遺伝子、IL-5遺伝子及び/又はH1R遺伝子、より好適にはIL-4遺伝子の発現を抑制することができ、その結果としてアレルギー疾患を予防又は治療することができる。
【0027】
本明細書において、アレルギー疾患とはいわゆるアレルギー性の疾患であればよく、特に限定されないが、例えばI型アレルギー、II型アレルギー又はIV型アレルギーなどが挙げられる。具体的には、例えば花粉症、アレルギー性鼻炎、気管支喘息、アトピー性皮膚炎、植物アレルギー、蕁麻疹、PIE症候群、アナフィラキシーショック等が挙げられる。
【0028】
本発明の抗アレルギー剤を予防的若しくは治療的に使用する場合は、経口又は非経口により有効量投与することができる。その投与量は、投与経路や投与方法により適宜決定することができる。例えば、経口投与の場合には有効成分を成人一日あたり0.01〜1000mgの範囲で用いることができる。
【0029】
経口投与に適する剤形としては、例えば、錠剤、カプセル剤、散剤、細粒剤、顆粒剤、液剤、及びシロップ剤等を挙げることができ、非経口投与に適する剤形としては、例えば、注射剤、点滴剤、坐剤、吸入剤、点眼剤、点鼻剤、軟膏剤、クリーム剤、及び貼付剤等を挙げることができる。
【0030】
経口投与のためには、固型製剤又は液体製剤とすることができる。製剤としては、例えば錠剤、丸剤、散剤、顆粒剤、液剤、懸濁液あるいはカプセル剤などが挙げられる。錠剤を調製する際には常法に従ってラクトース、スターチ、炭酸カルシウム、結晶性セルロース、あるいはケイ酸などの賦形剤;カルボキシメチルセルロース、メチルセルロール、リン酸カルシウム、あるいはポリビニルピロリドン等の結合剤;アルギン酸ナトリウム、重ソウ、ラウリル硫酸ナトリウムやステアリン酸モノグリセライド等の崩壊剤;グリセリン等の潤滑剤;カオリン、コロイド状シリカ等の吸収剤;タルク、粒状ホウ酸などの潤滑剤などの添加剤を用いることができる。
【0031】
丸剤、散剤又は顆粒剤についても上記と同様に添加剤を用いて常法に従って製剤化される。液剤及び懸濁剤などの液体製剤も常法に従って製剤化される。担体としては例えばトリカプリリン、トリアセチン、ヨード化ケシ油脂肪酸エステル等のグリセロールエステル類;水;エタノール等のアルコール類;流動パラフィン、ココナッツ油、大豆油、ゴマ油、トウモロコシ油等の油性基剤が用いられる。上記した散剤、顆粒剤、液体製剤等はゼラチン等のカプセルで包むこともできる。
【0032】
本明細書における薬学的に許容しうる担体には、その他通常必要により用いられる補助剤、芳香剤、等張化剤、pH調節剤、安定化剤、噴射剤、粘着剤や防腐剤等を適宜選択して含むことができる。
【0033】
経皮投与用薬剤の剤形としては、軟膏、クリーム、ローション、液剤等が挙げられる。軟膏の基剤としては、例えばヒマシ油、オリーブ油、ゴマ油、サフラワー油などの脂肪油;ラノリン;白色、黄色若しくは親水ワセリン;ロウ;オレイルアルコール、イソステアリルアルコール、オクチルドデカノール、ヘキシルデカノールなどの高級アルコール類;グリセリン、ジグリセリン、エチレングリコール、プロピレングリコール、ソルビトール、1,3-ブタンジオールなどのグリコール類などが挙げられる。また可溶化剤としてエタノール、ジメチルスルホキシド、ポリエチレングリコールなどを用いてもよい。また必要に応じて、パラオキシ安息香酸エステル、安息香酸ナトリウム、サリチル酸、ソルビン酸、ホウ酸などの保存剤;ブチルヒドロキシアニソール、ジブチルヒドロキシトルエンなどの酸化防止剤などを用いてもよい。
【0034】
また、経皮吸収促進を図るため、ジイソプロピルアジペート、ジエチルセバケート、エチルカプロエート、エチルラウレートなどの吸収促進剤を加えてもよい。また、安定化を図るため、本発明化合物はα,β又はγーシクロデキストリンあるいはメチル化シクロデキストリン等と包接化合物を形成せしめて使用することもできる。
【0035】
軟膏は通常の方法によって製造することができる。クリーム剤としては水中油型クリーム剤の形態が本発明化合物の安定化を図るうえで好ましい。またその基剤としては、前述した如き、脂肪油、高級アルコール類、グリコール類などが用いられ、またジエチレングリコール、プロピレングリコール、ソルビタンモノ脂肪酸エステル、ポリソルベート80、ラウリル硫酸ナトリウムなどの乳化剤が用いられる。更に必要に応じて前述した如き保存剤、酸化防止剤などを添加してもよい。また軟膏剤の場合と同様に、シクロデキストリン、メチル化シクトデキストリンの包接化合物として用いることもできる。クリーム剤は通常の方法によって製造することができる。
【0036】
ローション剤としては、懸濁型、乳剤型、溶液型ローション剤が挙げられる。懸濁型ローション剤は、アルギン酸ナトリウム、トラガント、カルボキシメチルセルロースナトリウムなどの懸濁化剤を用い、必要に応じて酸化防止剤、保存剤などを加えて得られる。乳化型ローション剤は、ソルビタンモノ脂肪酸エステル、ポリソルベート80、ラウリル硫酸ナトリウムなどの乳化剤を用い、通常の方法で得られる。溶液型ローション剤は、アルコール型ローション剤が好ましくエタノールなどのアルコールを用いて通常の方法で得られる。液剤としては、エタノールなどのアルコール溶液に溶解し、必要に応じて酸化防止剤、保存剤などを添加したものが挙げられる。
【0037】
これらの剤形以外でも、パスタ剤、パップ剤、エアゾル剤等の剤形が挙げられる。かかる製剤は通常の方法によって製造することができる。
【0038】
経鼻による投与の製剤は、液状又は粉末状の組成物として与えられる。液状剤の基剤としては水、食塩水、リン酸緩衝液、酢酸緩衝液等が用いられ、さらに界面活性剤、酸化防止剤、安定剤、保存剤、粘性付与剤を含んでいてもよい。粉末状剤の基剤としては、水吸収性のものが好ましく、例えば、水易溶性のポリアクリル酸ナトリウム、ポリアクリル酸カルシウム、ポリアクリル酸アンモニウムなどのポリアクリル酸塩類、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロースナトリウムなどのセルロース低級アルキルエーテル類、ポリエチレングリコール、ポリビニルピロリドン、アミロース、プルランなどが、また水難溶性の結晶セルロース、α−セルロース、架橋カルボキシメチルセルロースナトリウムなどのセルロース類、ヒドロキシプロピン澱粉、カルボキシメチル澱粉、架橋澱粉、アミロース、アミロペクチン、ペクチンなどの澱粉類、ゼラチン、カゼイン、カゼインナトリウムなどのタンパク類、アラビアガム、トラガントガム、グルコマンナンなどのガム類、ポリビニルポリピロリドン、架橋ポリアクリル酸及びその塩、架橋ポリビニルアルコール、ポリヒドロキシエチルメタアクリレートなどの架橋ビニル重合体類などが挙げられ、これらを混合して用いてもよい。さらに粉末状剤には、酸化防止剤、着色剤、保存剤、防腐剤、矯腐剤等を添加してもよい。かかる液状剤、粉末状剤は例えばスプレー器具等を用いて投与することができる。
【0039】
注射による投与の製剤は、無菌の水性あるいは非水溶性液剤、懸濁剤、又は乳化剤として与えられる。非水性の溶液又は懸濁剤は、例えばプロピレングリコール、ポリエチレングリコール又はオリーブ油のような植物油、オレイン酸エチル、ヨード化ケシ油脂肪酸エステルのような注射しうる有機エステル類を薬学的に許容しうる担体とする。このような製剤はまた、防腐剤、湿潤剤、乳化剤、分散剤、安定剤のような補助剤を含むことができ、徐放性にしてもよい。これらの溶液剤、懸濁剤及び乳化剤は、例えばバクテリア保留フィルターを通す濾過、殺菌剤の配合、あるいは照射等の処理を適宜行うことによって無菌化できる。また無菌の固形製剤を製造し、使用直前に無菌水又は無菌の注射用溶媒に溶解して使用することができる。
【実施例】
【0040】
以下、本発明を実施例によりさらに具体的に説明するが、本発明は下記の実施例の範囲に限定されることはない。
【0041】
(実施例1)苦参抽出物からのIL-4遺伝子発現抑制物質の分離
1)苦参熱水抽出液の調製
苦参抽出物からIL-4遺伝子発現抑制物質の分離を試みた。苦参(Sophorae Radix, 小島漢方, Osaka)60 g を水1000 mlに入れて90分熱水抽出を行い、熱時濾過を行なった。これを濃縮し、30 mg/ml となるように調整し、苦参熱水抽出液とした。
【0042】
IL-4遺伝子発現に及ぼす影響は、ラット好塩基球性白血病細胞株(RBL-2H3細胞)に対する抗原抗体刺激によるIL-4遺伝子発現量により確認した。RBL-2H3細胞を35 mmシャーレにて培養し、細胞が70%コンフルーエントになった状態で上述の熱水抽出液を最終濃度1.2〜3.0 mg/mlになるように培地に加え37±0.5℃で24時間インキュベートした。抗原抗体刺激は、抗原刺激18時間前に100 ng/mlの抗ジニトロフェニル (DNP) モノクローナル抗体(SPE-7; SIGMA, St. Louis, USA)を加え細胞を培養した後、100 ng/ml DNP-HSA抗原(DNP-HSA, SIGMA, St. Louis, USA)を加えて行った。抗原刺激2時間後、細胞のかきとりを行い、かき取った細胞よりtotal RNAを調製し、逆転写反応にてcDNAとしたものを試料とし、リアルタイムRT-PCR法により、mRNAレベルを測定した(N=3)。IL-4遺伝子発現量は、IL-4のmRNAレベルをハウスキーピング遺伝子であるGAPDHのmRNAレベルとの相対比により確認した。
【0043】
その結果、苦参熱水抽出液は、DNP-HSA抗原によるIL-4遺伝子発現の上昇を有意に抑制することが確認された(図3)。以下、同手法によりIL-4遺伝子発現量を確認し、有効成分の抽出・単離を行った。
【0044】
ラットIL-4 mRNA測定用プライマーとして、以下の配列番号1及び2に示す配列、プローブは、配列番号3に示す配列のオリゴヌクレオチドを用いた。ラットGAPDH mRNA測定用プライマー・プローブは、市販のTaqMan(R) Rodent GAPDH Control Reagents (VIC Probe)Cat No. 4308313(アプライドバイオシステムズ)を用いた。
(配列番号1)sense primer: 5'-CAGGGTGCTTCGCAAATTTTAC-3'
(配列番号2)anti-sense primer: 5'-CACCGAGAACCCCAGACTTG-3'
(配列番号3)probe: FAM-CCCACGTGATGTACCTCCGTGCTTG-TAMRA
【0045】
2)苦参熱水抽出液からのpHによる分画
苦参熱水抽出液(30 mg/ml)から、各種pH条件により分画を行なった。1 Mの塩酸でpH 3に調整し、これを酢酸エチルで3回抽出し、溶媒を除いたものを酸性画分とした。酸性画分を抽出した残液(水層)を、1 M 水酸化ナトリウム水溶液でpH 10に調整し、酢酸エチルで3回抽出した。得られた抽出物の溶媒を除き、塩基性画分とした。当該塩基性画分を抽出した残液(水層)を、10%クエン酸水溶液でpH 7に調整した。当該抽出した残液(水層)の溶媒を凍結乾燥で除き、中性画分とした。それぞれの画分におけるアルカロイド類の分布を調べた。薄層クロマトグラフィにて各分画を展開し、ドラーゲンドルフ試薬を噴霧した。その結果、酸性画分中にアルカロイド類は検出されず、塩基性画分、中性画分においてアルカロイド類の分布が認められた。
【0046】
これらの画分について、それぞれRBL-2H3細胞を用いてIL-4遺伝子発現に及ぼす影響を調べた。IL-4遺伝子発現レベルは、上記1)に記載の方法と同手法により確認した(N=3)。その結果、酸性画分はIL-4遺伝子発現の上昇を有意に抑制した(図4)。一方、塩基性画分、中性画分はIL-4遺伝子発現に対して抑制作用を示さなかった(図5、図6)。
【0047】
3)オープンカラムクロマトグラフィーによる分画
活性のあった酸性画分について、オープンカラムクロマトグラフィーにより、さらに分離・精製を行なった。固定相にシリカゲル(Silica gel 60N)(関東化学, Tokyo)を用い、移動層にクロロホルム:メタノール(9:1)を用いて溶出し、溶出液を50 mLずつ分取し、画分Ch1〜Ch21を得た。その後、カラムを100%メタノールで洗浄し、さらに50 mLずつ分取し、画分M1〜M7を得た。得られた溶出画分及び洗浄画分の各画分について、溶媒を除き、IL-4遺伝子発現に及ぼす影響を調べた。IL-4遺伝子発現量は、上記1)に記載の方法と同手法により確認した(N=3)。これらの画分の内、Ch1ではIL-4遺伝子発現の抑制傾向がみられ、Ch2では有意な抑制作用が確認された(図7)。残りの画分には抑制作用は認められなかった。
【0048】
4)有効成分の単離・同定
薄層クロマトグラフィによって、Ch1画分とCh2画分に共通のスポットがあることを確認した。そのスポットをさらにシリカゲルオープンカラムクロマトグラフィ(移動層;ヘキサン:酢酸エチル(2:1))で精製し、精製画分についてIL-4遺伝子発現に及ぼす影響を調べた。IL-4遺伝子発現量は、上記1)に記載の方法と同手法により確認した(N=3)。また、当該精製により得られた画分について、これを核磁気共鳴スペクトル(NMR)に供し、有効成分が式(II)に示すマーキアインであることを明らかにした。構造の同定は1次元NMR(1H, 13C)及び2次元NMR(HH-COSY, DEPT, HMBC, HSQC)により行った(日本ブルカー, Kanagawa ; ARX-400)。内部標準としてテトラメチルシラン(tetramethylsilane)を用いた。
【0049】
【化2】

【0050】
上記シリカゲルオープンカラムクロマトグラフィにより精製して得た画分について、さらに高速液体クロマトグラフィ(HPLC)を行い、有効成分の精製を行った。HPLCは、カラムとしてMightysil RP18 GP(関東化学, Tokyo)を用い、65%メタノールまたは55%メタノール、流速0.8 mL/minにて行なった。分取した画分をメタノールで再結晶し、精製品とした。
【0051】
(実施例2)Heck反応を用いたマーキアインの合成
本発明のマーキアインの合成は、非特許文献2の方法(図1参照)の方法を一部改変して行なった。図1の方法では、水銀化合物を用いているのに対し、本実施例では、化合物(3)(7-ベンジルオキシ-2H-1-ベンゾピラン(7-benzyloxy-2H-1-benzopyran))と化合物(1)(セサモール(Sesamol: 1,3-Benzodioxol-5-ol))とのカップリングにおいて、J.S.Yadav (Adv. Synth. Catal. 346: 77-82 (2004))らの方法を一部改変し、水銀化合物を用いず、臭素化合物を用いた(図2参照)。
【0052】
化合物(1)(300 mg, 2.17 mmol)を塩化メチレンに溶解し、氷冷しながらn-ブロモスクシンイミド(n-Bromosuccinimide)(464 mg, 2.606 mmol)をゆっくり添加した。炭酸水素ナトリウム水溶液で反応を止め、塩化エチレン層を濃縮した。これをカラムクロマトグラフィー(シリカゲル、ヘキサン−クロロホルム=1:3)により単離し、化合物(2)(2-ブロモ-4,5-メチレンジオキシフェノール(2-bromo-4,5-methylenedioxyphenol))(295.9 mg, 1.36 mmol, 62%)を得た。
【0053】
非特許文献2に記載の方法に従い、合成した化合物(3)(14.5 mg, 0.061 mmol)と化合物(2)(13.2 mg, 0.061 mmol)を、アセトニトリル(5 mL)に溶解し、トリシクロヘキシルホスフィン(tricyclohexylphosphine)(30% in トルエン、20μl, 0.0183 mmol)とPd2(dba)3・CHCl3 (63 mg, 0.0061 mmol)を混ぜたものを60℃。アルゴン雰囲気下で4時間反応させた。その後、反応液を塩化メチレンで3倍に希釈し、フロリジール(R)(150-250μm)を用いてろ過した後、濃縮し、カラムクロマトグラフィー(シリカゲル、ヘキサン−酢酸エチル=5:1)により目的化合物(4)(マーキアイン)(5.4 mg, 0.0144 mmol, 23.7%)を得た。
【0054】
(実験例1)天然物由来マーキアイン及び合成マーキアインのIL-4遺伝子発現に及ぼす効果
実施例1で抽出・精製した天然物由来マーキアイン及び実施例2で合成して得た合成マーキアインについて、IL-4遺伝子発現に及ぼす影響を調べた。IL-4遺伝子発現量は、上記1)に記載の方法と同手法により確認した。
【0055】
各マーキアインは、いずれもDNP-HSA抗原によるIL-4遺伝子発現を有意に抑制することを確認した(図8)。また、合成マーキアイン(実施例2)は、天然物由来マーキアイン(実施例1)に比べて、IL-4遺伝子発現抑制効果が半減していることが観察された。このことより、合成マーキアインはラセミ体で、光学活性体のうち、片方のみがIL-4遺伝子発現抑制効果を示すと考えられた。また、実施例1の抽出・精製により得たマーキアイン 0.11 g/100 mL (in chloroform) の旋光度を測定し、比旋光度を算出しところ、[α]16D= -176.4 °であった。過去の文献値との比較により、実施例1で得られた天然物由来マーキアインは(-)マーキアインであると考えられ、有効な光学活性体であると考えられた。
【0056】
(実験例2)(-)マーキアインのIL-5遺伝子発現に及ぼす効果
本実験例では、IL-5遺伝子発現に及ぼす(-)マーキアインの効果を確認した。(-)マーキアインは、実施例1で抽出・精製したマーキアインを用いた。
【0057】
IL-5はIL-4と同じくTh2サイトカインに分類され、活性化されたTリンパ球や肥満細胞などから放出され、好酸球の分化、増殖、遊走などに関わる因子であり、遅発相のアレルギー反応を惹起する因子と考えられている。よって、IL-5遺伝子はアレルギー疾患感受性遺伝子であり、アレルギーの慢性化・難治化させる因子である考えられる。
【0058】
IL-5遺伝子発現量は、ヒト好塩基球白血病細胞KU812F細胞を用いて測定した。細胞を35 mmシャーレで培養し、DMSOに溶解した(-)マーキアインを添加して24時間後、マイトージェン(PMA (Phorbol 12-myristate 13-acetate) (20 nM) + イオノマイシン (1 μM))で共刺激を3時間行った。実施例1に記載と同手法により、IL-5のmRNA及びGAPDHのmRNAについて、リアルタイムRT-PCRを行なった。
【0059】
その結果、(-)マーキアインは、マイトージェンによるIL-5遺伝子発現上昇を有意に抑制することが確認された(図9)。
【0060】
ヒトIL-5 mRNA測定用プライマーとして、以下の配列番号4及び5に示す配列、プローブは、配列番号6に示す配列のオリゴヌクレオチドを用いた。ヒトGAPDH mRNA測定用プライマー・プローブは、市販のPre Developed TaqMan(R) Assay Reagent Control Kits (Human GAPDH) Cat No. 4310884E(アプライドバイオシステムズ)を用いた。
(配列番号4)sense primer: 5'-CAC TGA AGA AAT CTT TCA GGG AAT-3'
(配列番号5)anti-sense primer: 5'-CAG TAC CCC CTT GCA CAG TT-3'
(配列番号6)probe: FAM-ACA CTG GA-TAMRA
【0061】
(実験例3)(-)マーキアインのヒスタミンH1受容体(H1R)遺伝子発現に及ぼす効果
本実験例では、H1R遺伝子発現に及ぼす(-)マーキアインの効果を確認した。ヒスタミンは、アレルギー疾患の主要ディエーターであり、標的細胞のH1Rを介して主要症状が発現されることはよく知られている。ここで、H1R遺伝子はアレルギー疾患感受性遺伝子であることが、本発明者により報告されている(非特許文献1)。
【0062】
H1R遺伝子発現量は、ヒト子宮頸癌細胞HeLa細胞を用いて測定した。細胞を35 mmシャーレで培養し、24時間無血清培地で培養することで栄養飢餓(starvation)を行った。無血清培養開始と同時にDMSO溶解の(-)マーキアインを培地に加え、培養細胞を24時間処置した。その後、100 nM PMAによる刺激を3時間行った。実施例1に記載と同手法により、H1RのmRNA及びGAPDHのmRNAについて、リアルタイムRT-PCRを行なった。
【0063】
その結果、(-)マーキアインは、PMAによるH1R遺伝子発現上昇を有意に抑制することが確認された(図10)。
ヒトH1R mRNA測定用プライマーとして、以下の配列番号7及び8に示す配列、プローブは、配列番号9に示す配列のオリゴヌクレオチドを用いた。ヒトGAPDH mRNA測定用プライマー・プローブは、実験例2と同様に市販のものを用いた。
(配列番号7)sense primer: 5'- CAG AGG ATC AGA TGT TAG GTG ATA GC - 3
(配列番号8)anti-sense primer: 5'- AGC GGA GCC TCT TCC AAG TAA - 3'
(配列番号9)probe: FAM- CTT CTC TCG AAC GGA CTC AGA TAC CAC C- TAMRA
【0064】
(参考例1)抗酸化作用
本参考例では、Jung(Arch Pharm Res Vol 28, No5, 534-540, 2005)の方法に基づき、実施例1で抽出・精製した(-)マーキアインの、DPPH(ジフェニル-p-ピクリルヒドラジル)ラジカル消去活性について検討した。
【0065】
フラボノイドは抗アレルギー作用、抗がん作用など多くの生理活性を有することがこれまでに報告されており、その分子基盤の多くはフラボノイドの持つ抗酸化作用に基づくことが公知である。そのため、マーキアインの遺伝子発現抑制作用も他のフラボノイドと同様に抗酸化作用に由来する可能性が考えられた。従来文献的には、マーキアインの抗酸化作用については、DPPHラジカル消去活性、過酸化水素誘導の細胞間活性酸素種消去活性、ONOO-消去活性を指標に検討されており、それによると、マーキアインは他の抗酸化作用を有する物質と比較して著しく抗酸化作用が弱く、抗酸化作用を有さないことが報告されている(Arch Pharm Res Vol 28, No5, 534-540, 2005)。そこで、本参考例では、DPPHラジカル消去活性を指標にマーキアインの抗酸化作用について検討した。
【0066】
ポジティブコントロールとして、アスコルビン酸を使用した。150 μmol/LのDPPH (ジフェニル-p-ピクリルヒドラジル)メタノール溶液 40μL と、最終濃度が50、100、150、200 μmol/Lになるように調整したマーキアインもしくはポジティブコントロールのアスコルビン酸のメタノール溶液を160 μL加え、静かに混和した。室温で30分間放置した後、安定な有機ラジカルであるDPPHラジカルに由来する520nmの吸光度を測定し、コントロール(マーキアイン及びアスコルビン酸を含まないDPPHのみの溶液)との比を下式により算出し、DPPHラジカル消去活性とした。被験試料溶液ブランクとしては、マーキアインを添加しないメタノール溶液を用い、同様の方法で吸光度を測定した。
【0067】
DPPHに対するラジカル消去作用の計算方法は以下の通りである。
DPPHラジカル消去活性(%)={C−(St−Sb)}/C×100
St: 波長520nmにおける被験試料溶液の吸光度
Sb: 波長520nmにおける被験試料溶液ブランクの吸光度
C: コントロール溶液の波長520nmにおける吸光度
【0068】
上記の結果、(-)マーキアインを200μM反応させた場合でも、抗酸化作用を殆ど有しないことが認められ(図11)、マーキアインには抗酸化作用がないことを確認した。このことから、マーキアインの遺伝子発現抑制作用は、他のフラボノイドが有する抗酸化作用によるものではなく、新規メカニズムに基づく遺伝子発現抑制作用であることが示唆された。
【0069】
(参考例2)(-)マーキアインのjun N-terminal kinase (JNK)活性への影響
本参考例では実施例1で抽出・精製した(-)マーキアインについて、JNKの酵素活性の抑制作用を調べた。JNKは転写因子AP-1を構成するタンパク質の一つであるc-Junをリン酸化しAP-1が関与する遺伝子発現を亢進する。フラボノイドには、JNKの酵素活性を抑制することで、様々な生理活性を示すものが多い。
【0070】
そこで、本参考例では、(-)マーキアインのIL-4遺伝子発現抑制作用が、JNKの酵素活性の抑制によるものであるかどうかを検討した。JNKのin vitro キナーゼアッセイは、KinaseSTAR(R) JNK Activity Assay Kit(BioVision)を用い、添付文書に記載の方法に従い行なった。まず、HeLa細胞を70 nMアニソマイシン(Sigma)で30分処置し、JNKを活性化した。キットに附属のJNK 抽出用緩衝液を用いて細胞を粉砕し、遠心上清にJNK特異抗体を加えた後、同キットに附属のProtein A Sepharose(R)によりJNKを免疫沈降することで、活性化JNKを調製した。活性化したJNKにc-jun及びATPを含む基質溶液を加え、30℃で1時間反応させ、生じたリン酸化c-junをリン酸化c-jun特異抗体を用いたウエスタンブロットにより検出した。ポジティブコントロールとしてJNKの阻害薬として知られているSP600125(WAKO)を用いた。
【0071】
上記の結果、(-)マーキアインを300μM反応させた場合でも、JNKによるc-Junのリン酸化を抑制しなかった(図12)。
【産業上の利用可能性】
【0072】
以上詳述したように、一般式(I)で表されるフラボノイドの一種であるプテロカルパン誘導体に分類される本発明の化合物は、アレルギー疾患感受性遺伝子であるIL-4遺伝子、IL-5遺伝子及びH1R遺伝子の発現を抑制する。このことから、一般式(I)で表される化合物、即ち本発明のアレルギー疾患感受性遺伝子発現抑制物質は、アレルギー疾患感受性遺伝子発現抑制物質として効果を示す。さらに、本発明のアレルギー疾患感受性遺伝子発現抑制物質は、アレルギー疾患感受性遺伝子発現を抑制することによる抗アレルギー作用が期待され、新規な抗アレルギー剤の開発に有用である。
【0073】
なお、本発明のアレルギー疾患感受性遺伝子発現抑制物質は、抗酸化作用や、JNK阻害作用が低いことが確認されたため、抗酸化作用や、JNK阻害作用によるものではなく、新規な分子機序に基づく遺伝子発現抑制作用であることが示唆された。これにより、本発明の化合物は、他の多くのフラボノイドとは異なる作用機序により抗アレルギー作用を示すものと考えられる。
【特許請求の範囲】
【請求項1】
以下の一般式(I)で表されるアレルギー疾患感受性遺伝子発現抑制物質。
【化1】

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
【請求項2】
以下の式(II)で表される、請求項1に記載のアレルギー疾患感受性遺伝子発現抑制物質。
【化2】

【請求項3】
アレルギー疾患感受性遺伝子が、IL-4遺伝子、IL-5遺伝子及び/又はヒスタミンH1受容体遺伝子である、請求項1又は2に記載のアレルギー疾患感受性遺伝子発現抑制物質。
【請求項4】
請求項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質を有効成分として含む抗アレルギー剤。
【請求項5】
請求項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質の合成工程において、中間産物である7-ベンジルオキシ-2H-1-ベンゾピラン(7-benzyloxy-2H-1-benzopyran)とセサモールとのカップリング工程が、水銀化合物を用いない工程によることを特徴とする、請求項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質の製造方法。
【請求項6】
水銀化合物を用いない工程が、臭素化合物を用いる工程により合成する請求項5に記載の製造方法。
【請求項1】
以下の一般式(I)で表されるアレルギー疾患感受性遺伝子発現抑制物質。
【化1】

(式中、Rは水素原子又は直鎖状若しくは分岐状の飽和若しくは不飽和脂肪族炭化水素基、置換基を有していてもよいシクロアルキル基、アリール基、アラルキル基、アルキルオキシ基、アルケニルオキシ基、アルキニルオキシ基、アリールオキシ基若しくはアラルキルオキシ基、あるいは糖の残基を表す。)
【請求項2】
以下の式(II)で表される、請求項1に記載のアレルギー疾患感受性遺伝子発現抑制物質。
【化2】

【請求項3】
アレルギー疾患感受性遺伝子が、IL-4遺伝子、IL-5遺伝子及び/又はヒスタミンH1受容体遺伝子である、請求項1又は2に記載のアレルギー疾患感受性遺伝子発現抑制物質。
【請求項4】
請求項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質を有効成分として含む抗アレルギー剤。
【請求項5】
請求項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質の合成工程において、中間産物である7-ベンジルオキシ-2H-1-ベンゾピラン(7-benzyloxy-2H-1-benzopyran)とセサモールとのカップリング工程が、水銀化合物を用いない工程によることを特徴とする、請求項1〜3のいずれか1に記載のアレルギー疾患感受性遺伝子発現抑制物質の製造方法。
【請求項6】
水銀化合物を用いない工程が、臭素化合物を用いる工程により合成する請求項5に記載の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2011−126791(P2011−126791A)
【公開日】平成23年6月30日(2011.6.30)
【国際特許分類】
【出願番号】特願2009−284069(P2009−284069)
【出願日】平成21年12月15日(2009.12.15)
【出願人】(304020292)国立大学法人徳島大学 (307)
【Fターム(参考)】
【公開日】平成23年6月30日(2011.6.30)
【国際特許分類】
【出願日】平成21年12月15日(2009.12.15)
【出願人】(304020292)国立大学法人徳島大学 (307)
【Fターム(参考)】
[ Back to top ]

