シリカ系メソ多孔体−光学異性相互変換酵素複合体
【課題】光学異性の相互変換を触媒し、また、酵素の回収、再利用、連続利用を容易とするシリカ系メソ多孔体−光学異性相互変換酵素複合体、その製造方法及び用途を提供する。
【解決手段】光学異性の相互変換を触媒する酵素とシリカ系メソ多孔体の複合体であり、シリカ系メソ多孔体へ固定化された酵素が、光学異性の相互変換を触媒する活性を有していることで特徴付けられるシリカ系メソ多孔体−光学異性相互変換酵素複合体、及びシリカ系メソ多孔体と光学異性の相互変換を触媒する酵素の溶解した溶液とを混合することにより、光学異性相互変換酵素をシリカ系メソ多孔体に固定化するシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法、その複合体及び酵素固定化機能性部材。
【効果】酵素の再利用性と保存性を高めたシリカ系メソ多孔体−光学異性相互変換酵素複合体、その製法及び機能性部材を提供する。
【解決手段】光学異性の相互変換を触媒する酵素とシリカ系メソ多孔体の複合体であり、シリカ系メソ多孔体へ固定化された酵素が、光学異性の相互変換を触媒する活性を有していることで特徴付けられるシリカ系メソ多孔体−光学異性相互変換酵素複合体、及びシリカ系メソ多孔体と光学異性の相互変換を触媒する酵素の溶解した溶液とを混合することにより、光学異性相互変換酵素をシリカ系メソ多孔体に固定化するシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法、その複合体及び酵素固定化機能性部材。
【効果】酵素の再利用性と保存性を高めたシリカ系メソ多孔体−光学異性相互変換酵素複合体、その製法及び機能性部材を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、シリカ系メソ多孔体と光学異性相互変換酵素の複合体に関するものであり、更に詳しくは、表面に未処理あるいは適切な溶液で官能基を付与する処理等が施されたシリカ系メソ多孔体への酵素の吸着現象を、酸素の固定化法として利用して複合化した、シリカ系メソ多孔体−光学異性相互変換酵素複合体、その製造方法及びその用途に関するものである。
【0002】
本発明は、表面を未処理あるいは適切な溶液で官能基を付与する処理等を施したシリカ系メソ多孔体への酵素の吸着現象を、酵素の固定化法として利用し、シリカ系メソ多孔体の細孔内もしくは表面に、酵素を安定に固定し、かつその酵素の機能を発揮させることを可能とすると共に、酵素の再利用性と保存性を高めたシリカ系メソ多孔体−光学異性相互変換酵素複合体、その製造方法、及び、その機能性部材としての用途に関する新技術・新製品を提供するものである。
【背景技術】
【0003】
酵素を用いた生化学品、食品製造の技術分野においては、従来、酵素を水に溶解させて用いることが多い。この操作法では、タンパク質である酵素の溶解度に限界があり、ある一定濃度以上の酵素が高密度に存在すると、該酵素が、凝集を起こし、活性を失うことがしばしばである。一方、酵素反応を用いた反応系では、酵素の存在量が多いほど、反応速度、ひいては反応生成物の生産速度を高められることが、容易に予想される。
【0004】
その一方で、シリカ系メソ多孔体は、2〜50nmの直径の細孔を有することを特徴としており、その細孔内部への酵素の導入、固定が可能である。したがって、シリカ系メソ多孔体は、数nmから十数nmの大きさを有する酵素、すなわち、タンパク質の吸着、固定に対して、有効な表面を多く有している、有望な担体材料と見なすことができる。
【0005】
このようなシリカ系メソ多孔体を、酵素の固定化のための担体として使用した場合、ある一定濃度以上の高密度に存在する酵素の凝集を防ぐことが可能となり、活性を有する酵素の高集積化が可能となる。このことは、酵素を用いた反応系において、通常の酵素溶液においては、凝集を起こしてしまう量を越えて、酵素を存在させることが可能になることを意味すると考えられる。更には、酵素が容易に凝集を起こしてしまうpH領域においても、酵素が固定化されていることから、凝集を起こさないため、そのようなpH領域でも、反応系を構築できる可能性があると考えられる。
【0006】
一般に、担体に、酵素を固定化して用いることは、従前より行われてきたことであるが、その目的は、酵素の分離、及び再利用に関するものがほとんどである。例えば、従来の酵素を用いた生化学品、食品製造の技術分野においては、酵素を水に溶解させて用いることが多く、この操作法では、反応生成物と酵素の分離操作が必要不可欠であり、また、分離された酵素は、廃棄されることが一般的である。この酵素の分離工程を省く目的で、酵素を、担体に固定化して用いるための、酵素の固定化技術が盛んに開発されている。
【0007】
酵素の固定化法としては、例えば、酵素を、樹脂ビーズ等に直接固定化する方法や、酵素へのポリマーの被覆によるマイクロカプセル化、酵素タンパク質表面を修飾して安定化させる表面修飾法等が提案されている。しかしながら、これらの方法は、酵素が固定化担体の表面上に固定されているだけであり、酵素の高集積化や、固定化による酵素機能の向上を目指したものではない
【0008】
酵素の再利用を目的とした酵素の固定化も検討されているが、この方法の場合も、分離工程の排除を目的とした方法と大きな違いはなく、酵素の各種担体表面への単純な固定を行っているものが多い。酵素を、高分子発泡体に固定化する方法も用いられており、この場合は、発泡体を圧縮することにより、反応生成物を含む溶液を分離すること、等が行われている。
【0009】
酵素の固定化法の開発により、酵素を用いた生産プロセスにおいて、反応後の酵素の分離回収や、その再利用が可能となり、酵素の固定化が、酵素を用いた生産プロセスの効率化に貢献していることは事実である。しかし、酵素の固定化により、酵素の高集積化や、酵素機能そのものの向上を目的とした検討は、十分には行われていないのが実情である。
【0010】
このような状況の中で、本発明者らは、酵素の固定化により、酵素の高集積化や、酵素機能そのものの向上を目的として、酵素の担体として有望なシリカ系メソ多孔体への酵素、すなわちタンパク質の吸着・固定化現象を研究し(特許文献1参照)、この過程で、酵素、すなわちタンパク質のシリカ系メソ多孔体の細孔内への固定や、タンパク質の熱安定性や有機溶媒耐性の向上を見出し、シリカ系メソ多孔体を用いたタンパク質の機能賦活方法(特許文献1、及び非特許文献1)を開発するに至った。
【0011】
シリカ系メソ多孔体としては、一般に、MCM、FSM、SBAタイプ等の材料系が知られている。これらのシリカ系メソ多孔体は、2〜50nmの直径の細孔を有することを特徴とする。酵素、すなわちタンパク質は、数nmから十数nmの大きさを有しており、シリカ系メソ多孔体の有する細孔径と同程度の大きさの分布を有している。
【0012】
このことから、シリカ系メソ多孔体を、酵素の固定化担体として用いた場合、酵素を、表面のみならずシリカ系メソ多孔体の細孔内にも固定化することができ、シリカ系メソ多孔体の、酵素の固定化に対する有効な表面積が、従来の技術によるものより極めて大きくなり、シリカ系メソ多孔体に大量の酵素を固定化することが可能である。
【0013】
シリカ系メソ多孔体に、種々の酵素を固定化しようとする試みには、いくつかの報告がある(非特許文献2、3、4)。しかしながら、工業的な利用を想定した場合、種々の問題が未解決であると思われ、また、これらの報告では、光学異性の相互変換を触媒する酵素は、取り扱われた例がない。
【0014】
このような問題を解決するために、シリカ系メソ多孔体の表面に処理を加え、酵素との結合を形成する官能基を、シリカ系メソ多孔体の表面に形成される方法が報告された(非特許文献5)。しかしながら、ここで用いられている表面処理の方法は、極めて煩雑で、効率の悪いものであり、また、価格的にも利点が少ないものである。生化学品、食品製造の技術分野においては、簡便な方法で、酵素の固定化が行われることが望ましいことは言うまでもない。
【0015】
生体内のアミノ酸は、ほとんどがL形であり、D形は、ある種の生理活性ペプチドの構成成分として存在する。このことから、D形アミノ酸を含む物質が、医薬品、生化学品において、特異な性質を示し、ひいては有用な材料となることがしばしばである。それらの製造において、D形、L形のアミノ酸を任意に入手できる技術が需要であり、この反応に、光学異性の相互変換を触媒する酵素を利用することが有効である。
【0016】
すなわち、天然に存在するL形アミノ酸を、D形に変換したり、D形とL形の存在比率を変化させたりすることを効率的に進行させるには、光学異性の相互変換を触媒する多種多様な酵素の働きを利用することが重要である。このことは、工業的な医薬品、生化学品の製造において、シリカ系メソ多孔体−光学異性相互変換酵素複合体を利用、適用する上でも重要なことである。
【0017】
光学異性の相互変換を触媒する酵素以外の酵素を、シリカ系メソ多孔体に固定化した例としては、α−アミラーゼを、MCMもしくはSBAタイプのシリカ系メソ多孔体に固定化した例がある(非特許文献6)。しかしながら、光学異性の相互変換を触媒する酵素を固定化した例はほとんどなく、また、入手が容易ではない光学異性の相互変換を触媒する酵素は、繰り返し利用ができることが望ましく、多種多様なシリカ系メソ多孔体−光学異性相互変換酵素複合体の開発が望まれる。
【0018】
そのため、当該技術分野においては、シリカ系メソ多孔体において、その細孔内に、光学異性の相互変換を触媒する酵素を固定化することが可能であり、また、高度に集積化することも可能であるシリカ系メソ多孔体−光学異性相互変換酵素複合体、その製造方法及び該酵素の機能賦活技術を確立することが強く望まれていた。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】特開2007−51076号公報
【非特許文献】
【0020】
【非特許文献1】ChemBioChem,Vol.8(2007)668−674
【非特許文献2】J.Mol.Catal.B2(1996)115−126
【非特許文献3】J.Mol.Catal.B10(2000)453−469
【非特許文献4】J.Mol.Catal.B22(2003)119−133
【非特許文献5】Micropor.Mesopor.Mater.77(2005)67−77
【非特許文献6】J.Mol.Catal.B35(2005)154−160
【発明の概要】
【発明が解決しようとする課題】
【0021】
このような状況下において、本発明者らは、上記従来技術に鑑みて、光学異性の相互変換を触媒する酵素とシリカ系メソ多孔体とを複合化させた、シリカ系メソ多孔体−光学異性相互変換酵素複合体を開発することを目標として鋭意研究を行った結果、シリカ系メソ多孔体に、光学異性の相互変換を触媒する酵素を、吸着現象を利用して固定化させることで、その酵素が固定化され、シリカ系メソ多孔体−光学異性相互変換酵素複合体が形成されること、更に、このシリカ系メソ多孔体−光学異性相互変換酵素複合体を用いて、酵素反応及び酵素の繰り返し利用の特性評価を行い、固定化された酵素が、所定の活性を有していること、該酵素の繰り返し利用に対して高活性を維持し得ること及び高い再利用性を有すること等を見出し、本発明を完成するに至った。
【0022】
本発明は、アミノ酸等の光学異性を相互変換する際に、酵素の分離・回収を容易にし、繰り返し使用も可能とすると共に、基質を連続的に供給することで、光学異性の相互変換を連続的に進行させることができる、シリカ系メソ多孔体−光学異性相互変換酵素複合体を提供することを目的とするものである。また、本発明は、一般性、及び普遍性が高く、かつ簡単・簡略な操作による光学異性相互変換酵素を利用した連続生産技術を確立することを可能とするシリカ系メソ多孔体−光学異性相互変換酵素複合体を提供することを目的とするものである。
【課題を解決するための手段】
【0023】
上記課題を解決するための本発明は、以下の技術的手段から構成される。
(1)光学異性の相互変換を触媒する酵素とシリカ系メソ多孔体との複合体であり、シリカ系メソ多孔体へ固定化された酵素が、光学異性の相互変換を触媒する活性を有していることを特徴とする、シリカ系メソ多孔体−光学異性相互変換酵素複合体。
(2)光学異性の相互変換を触媒する酵素が、アミノ酸類に作用するラセマーゼ、ヒドロキシ酸類に作用するラセマーゼ、あるいは炭水化物及びその類縁体に作用するエピメラーゼであり、複合体が、当該酵素と、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体との複合体であり、光学異性相互変換反応に、繰り返して使用できる再利用性を有する、前記(1)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
(3)シリカ系メソ多孔体が、ケイ素と酸素を必須成分として含む化合物の多孔体である、前記(1)又は(2)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
(4)シリカ系メソ多孔体が、2〜50nmの直径の細孔を有する、前記(1)から(3)のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
(5)シリカ系メソ多孔体が、0.1〜3.5ml/gの全細孔体積を有する、前記(1)から(4)のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
(6)シリカ系メソ多孔体が、200〜1500m2の比表面積を有する、前記(1)から(5)のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
(7)シリカ系メソ多孔体と、光学異性の相互変換を触媒する酵素の溶解した溶液とを混合することにより、光学異性の相互変換を触媒する酵素を、シリカ系メソ多孔体に固定化することを特徴とする、シリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
(8)シリカ系メソ多孔体の中心細孔径を変えることにより、固定化される酵素の量と活性を制御する、前記(7)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
(9)シリカ系メソ多孔体に、酵素を固定化させる操作を繰り返すことにより、酵素の固定化量を制御もしくは増大する、前記(8)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
(10)シリカ系メソ多孔体が、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体あり、該メソ多孔体に、酵素を固定化することにより、該酵素の保存性を向上させたシリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する、前記(7)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
(11)シリカ系メソ多孔体が、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体あり、該メソ多孔体に、酵素を固定化することにより、該酵素の再利用性を向上させたシリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する、前記(7)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
(12)前記(1)から(6)のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体からなり、機能性を有する酵素を、シリカ系メソ多孔体上、及び細孔内に、安定に吸着、保持させたことを特徴とする酵素固定化機能性部材。
【0024】
次に、本発明について更に詳細に説明する。
本発明は、シリカ系メソ多孔体−光学異性相互交換酵素複合体であって、光学異性の相互変換を触媒する酵素とシリカ系メソ多孔体との複合体であり、シリカ系メソ多孔体へ固定化された酵素が、光学異性の相互変換を触媒する活性を有していることを特徴とするものである。
【0025】
本発明では、光学異性の相互変換を触媒する酵素が、アミノ酸類に作用するラセマーゼ、ヒドロキシ酸類に作用するラセマーゼ、あるいは炭水化物及びその類縁体に作用するエピメラーゼであり、複合体が、当該酵素と、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体との複合体であり、光学異性相互変換反応に、繰り返して使用できる再利用性を有すること、シリカ系メソ多孔体が、2〜50nmの直径の細孔を有すること、シリカ系メソ多孔体が、0.1〜3.5ml/gの全細孔体積を有すること、シリカ系メソ多孔体が、200〜1500m2の比表面積を有すること、を好ましい実施の態様としている。
【0026】
また、本発明は、上記シリカ系メソ多孔体−光学異性相互交換酵素複合体を製造する方法であって、シリカ系メソ多孔体と酵素の溶解した溶液とを混合することにより、光学異性の相互変換を触媒する酵素を、シリカ系メソ多孔体に固定化することを特徴とするものである。本発明では、シリカ系メソ多孔体の中心細孔径を変えることにより、固定化される酵素の量や活性を制御すること、シリカ系メソ多孔体に酵素を固定化させる操作を繰り返すことにより、固定化量を制御もしくは増大すること、を好ましい実施の態様としている。
【0027】
更に、本発明は、酵素固定化機能性部材であって、上記シリカ系メソ多孔体−光学異性相互変換酵素複合体からなり、機能性を有する酵素を、シリカ系メソ多孔体上、及び細孔内に、安定に吸着、保持させたことを特徴とするものである。
【0028】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体を構成するシリカ系メソ多孔体としては、MCM、FSM、SBAタイプ等の材料系が用いられる。これらの材料系は、その作製法の違いにより分類されるが、基本的構造は、類似したものである。MCMやFSMタイプのメソ多孔体は、カチオン性界面活性剤を用いて形成されるミセルを鋳型として合成される。FSMタイプは、層状化合物であるカネマイトを原料として合成される。一方、SBAでは、中性の非イオン性界面活性剤のブロックコポリマーを用いて形成されるミセルを鋳型としている。
【0029】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体では、このような複数のタイプのシリカ系メソ多孔体が、光学異性の相互変換を触媒する酵素の固定用担体として使用される。しかし、基本的には、シリカ系メソ多孔体の構造を持つものであって、同様の機能・能力を有している限り、全て使用可能であり、シリカ系メソ多孔体−光学異性相互変換酵素複合体を構成するシリカ系メソ多孔体としては、上述のタイプのものに限定されるものではない。
【0030】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体の作製に際しては、合成されたシリカ系メソ多孔体に対し、特段の表面処理を施すことなく、洗浄の操作のみを行ったものを用いることが可能である。光学異性の相互変換を触媒する酵素を、シリカ系メソ多孔体に固定する操作は、光学異性の相互変換を触媒する酵素を溶解した溶液中に、当該シリカ系メソ多孔体を浸漬・混合する操作のみにより行われ、これらの操作自体は、極めて簡便で、単純な方法である。この場合、シリカ系メソ多孔体に対する表面処理は、必ずしも必要ではない。
【0031】
しかしながら、シリカ系メソ多孔体−光学異性相互変換酵素複合体を構成するシリカ系メソ多孔体の、酵素に対する固定化の機能・能力は、基本的には、シリカ系メソ多孔体と酵素との間の吸着現象で発揮される。その際には、シリカ系メソ多孔体表面と酵素との間の親和性が重要となる上に、また、酵素の吸着は、その分散溶媒、分散溶媒中での酵素安定性、更には、分散溶媒のpH等で影響されることが多い。
【0032】
したがって、対象とする酵素及びそれを含む溶液の成分状況に応じて、本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、それを構成するシリカ系メソ多孔体の表面の状態で、酵素に対する固定化の機能・能力が変わることがある。例えば、シリカ系メソ多孔体の表面に残るシラノール基は、反応性が高いため、酵素に対する固定化の機能・能力に悪影響を与えることが多い。そこで、上記複合体を、シラン処理によりシラノール基が不活性化もしくは減らされたシリカ系メソ多孔体で構成することが好ましい。
【0033】
本発明では、シリカ系メソ多孔体−光学異性相互変換酵素複合体の作製に際し、シリカ系メソ多孔体に表面処理を施すことは、適宜可能であるが、その表面処理の有無、処理の方法等は特に限定されるものではない。シリカ系メソ多孔体表面に形成されるべき官能基としては、固定化する酵素との親和性を確保できる官能基、例えば、アルコキシ基、オクタデシル基、オクチル基、フェニル基、ニトリル基、アミノ基、メルカプトプロピル基、チオール基等が挙げられる。これらは、基本的には、シリカ系メソ多孔体の表面に形成可能な官能基であれば良く、ここに例示した官能基に限定されるものではない。
【0034】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体を構成する元素は、一般には、ケイ素と酸素であるが、ケイ素の一部が他の元素に置換したシリカ系メソ多孔体も、酵素の固定化機能を有する限り、使用することができる。シリカ系メソ多孔体を構成するケイ素と置換可能な元素の典型としては、例えば、アルミニウム、ホウ素、燐、ガリウム、ニオブ、チタン、錫、鉄、コバルト、銅、ニッケル、亜鉛、クロム、バナジウム、マンガン、ジルコニウム、タンタル、ハフニウム等が挙げられる。
【0035】
しかし、これらに留まるものではなく、基本的に、シリカ系メソ多孔体の構造を破壊しないものであれば、いずれでも良い。また、その置換量に関しても、シリカ系メソ多孔体の構造を破壊しない量であれば、置換量は、いかなる量でも良く、これらの置換シリカ系メソ多孔体も、酵素固定化用の担体として使用することが可能である。
【0036】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体を構成するシリカ系メソ多孔体は、いずれも、熱安定性、化学安定性に優れており、しかも、環境に対する負荷が低い物質であるので、本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、例えば、生化学品製造、医薬品製造にとって極めて有用であり、その技術的並びに経済効果は、非常に優れたものと言える。
【0037】
シリカ系メソ多孔体は、一般には、数nmの細孔径を有する。そして、その細孔径は、シリカ系メソ多孔体の合成条件により制御することが可能である。例えば、固定化すべき酵素が5nmの大きさを有していた場合、その酵素の大きさに相応した細孔径を有するシリカ系メソ多孔体を合成して、酵素固定化用担体として用いる選択肢があり、それにより、酵素の固定量を増加させたり、酵素の安定性を向上させたりすることが可能である。
【0038】
本発明において、シリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する際には、シリカ系メソ多孔体の細孔径を制御することが不可欠である。本発明では、シリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する際に、シリカ系メソ多孔体の細孔径を制御することで、好適なシリカ系メソ多孔体−光学異性相互変換酵素複合体を作製し、提供することが可能である。
【0039】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体では、光学異性の相互変換を触媒する酵素として、アミノ酸類に作用するラセマーゼ、ヒドロキシ酸類に作用するラセマーゼ、炭水化物及びその類縁体に作用するエピメラーゼを用いることができる。しかし、基本的には、光学異性の相互変換を行う酵素であれば、どのような種に由来するものでも良く、ここに例示した酵素に限定されるものではない。
【0040】
本発明では、いずれの酵素を用いた場合であっても、シリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する際に、シリカ系メソ多孔体の細孔径を制御すること、及び、シリカ系メソ多孔体表面上の官能基を制御すること、が重要である。本発明では、選択された酵素に対して、シリカ系メソ多孔体に対して、最適ないし好適化の処理を施すことが重要である。
【0041】
本発明は、例えば、酵素を利用した生化学品、医薬品、食品製造の技術分野において、酵素の安定性や耐久性、生産速度の向上等により、連続的生産手法を構築することを可能とすると共に、反応生産物からの酵素の分離工程を排除することを可能とするものであり、その工程を、従来技術に比べ、大幅に効率化、簡略化することができるものである。
【0042】
本発明では、シリカ系メソ多孔体の細孔への光学異性相互変換酵素の吸着条件、操作方法の具体的な構成は特に限定されるものではなく、固定化すべき酵素に応じて任意に設計することができる。本発明においては、シリカ系メソ多孔体−光学異性相互変換酵素複合体は、単に、シリカ系メソ多孔体にラセマーゼを固定化しただけのものではない。
【0043】
本発明では、これらのシリカ系メソ多孔体とラセマーゼとを複合化することにより、通常の固定化酵素の場合と比較して、1)高い酵素作用が維持できること、2)その耐熱性を向上させることができること、3)酵素の繰り返し利用による活性の低下が抑制できること、更に、4)酵素の回収を容易にできること、等の、従来の技術常識からは予期し得ない、かつシリカ系メソ多孔体とラセマーゼとを組み合わせた場合に特異的に生起される格別の作用効果を得ることを可能とするものであり、これらは、後記する実施例で、具体的かつ詳細に示したように、格別の実験をしてはじめて実証し得たものである。
【0044】
更に、後記する実施例に記載されるように、酵素の保存性についての評価を行うために、シリカ系メソ多孔体−光学異性相互変換酵素複合体の酵素活性測定において、例えば、酵素活性の測定に用いたものと同様のGeoRacAが固定化された試料を20mM リン酸カリウム(pH 7.5),50mM KCl溶液中にて、4℃で4ヶ月間保存し、比較のため、シリカ系メソ多孔体に固定化されていない溶液に分散した状態のGeoRacAも4℃で4ヶ月間保存し、両者のそれぞれ2μgを、2.5mlの10mM リン酸カリウム(pH7.5),3mM L−アラニンを含む溶液に添加し、30℃で204nmのCDの変化を3分間測定し、活性を評価した。
【0045】
両者の活性評価の結果、溶液に分散した状態のGeoRacAは、4ヶ月保存することによって、14%しか活性を保持していなかったが、シリカ系メソ多孔体に固定化されたGeoRacAは94%の活性を保持していた。このことは、シリカ系メソ多孔体−光学異性相互変換酵素複合体が酵素の保存性を確保していることを示しているものであり、酵素を一時的に保存し、再利用する等の実使用上の利便性は計り知れない。
【発明の効果】
【0046】
本発明により、以下のような効果が奏される。
(1)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることで、反応系中に、高濃度に酵素を存在させることが容易に達成できる。
(2)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることにより、通常の酵素反応溶液の場合と比較して、酵素濃度が高くても、酵素の凝集を生じさせることなく、酵素反応を進行させることが容易である。
(3)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることにより、溶液中に分散した状態の酵素では、容易に凝集を起こしてしまうpH領域においても、酵素の凝集を生じさせることなく、酵素反応を進行させることが容易である。
(4)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることにより、酵素の安定性が向上し、酵素の耐熱性が増大することから、反応温度を上昇させることができ、酵素を失活させることなく、酵素反応を進行させることが容易である。
(5)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることにより、酵素の回収が容易である。
(6)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることにより、酵素の繰り返し使用が可能である。
【0047】
(7)アミノ酸や糖類の光学異性の相互変換に際し、原料の性状や特性に応じて最適ないし好適な酵素を選択して、その酵素を用いたシリカ系メソ多孔体−光学異性相互変換酵素複合体を、固定化酵素として利用することができる。
(8)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体を用いることで、多種多様なアミノ酸や糖類原料を対象として、酵素反応により光学異性の相互変換が施されたアミノ酸類や糖類を生成させることができる。
(9)光学異性の相互変換を触媒する酵素として、アミノ酸類に作用するラセマーゼ、ヒドロキシ酸類に作用するラセマーゼ、炭水化物及びその類縁体に作用するエピメラーゼを用いることができ、これらの酵素を固定化した、シリカ系メソ多孔体−光学異性相互変換酵素複合体を提供することができる。
【0048】
(10)シリカ系メソ多孔体の、酵素の導入可能な細孔径を制御することで、酵素の吸着可能な表面を大きくして、酵素の高集積化が可能になる。
(11)シリカ系メソ多孔体へ、酵素の固定化を繰り返すことにより、より多量な酵素を固定化することが可能である。
(12)高集積化された酵素を、反応系中に存在させることができるため、酵素反応を、より効率的に進めることができる。
(13)酵素の凝集を避けることができるため、酵素を、溶液に溶解した状態よりも高濃度に反応系中に存在させることが可能となり、酵素反応を、より効率的に進めることが可能である。
(14)酵素が溶液中に分散した状態では、容易に凝集を起こしてしまうpH領域においても、酵素の凝集を生じさせることなく、酵素反応を進行させることが可能である。
(15)酵素の安定性が向上し、酵素の耐熱性が増大することから、反応温度を上昇させることができ、酵素を失活させることなく、酵素反応を進行させることが可能となる。
【0049】
(16)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体では、酵素の回収が容易であり、酵素の繰り返し使用が可能であり、基質を連続的にシリカ系メソ多孔体−光学異性相互変換酵素複合体と接触して流通させ、連続的な酵素反応の実施が可能である。
(17)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、環境に負荷の少ない材料系で構成され、作製原材料は、入手しやすく、作製方法が簡単で、安価である。
(18)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、適切な溶液による処理で官能基を形成することで、固定化される酵素の量や、固定化状態を制御することができる。
(19)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、その作製条件の制御により、シリカ系メソ多孔体の中心細孔径を変えることが可能であり、それにより、固定化される酵素の量や、活性を制御することができる。
(20)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、その作製条件の制御により、シリカ系メソ多孔体の中心細孔径を変えることが可能であり、それにより、固定化される酵素の安定性や、耐久性を向上させることができる。
(21)上記の効果を組み合わせて利用することにより、新規の光学異性の相互変換プロセスを確立することができる。
(22)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体では、固定化された酵素の保存性が確保されるため、酵素を固定化して長期間保存した後でも使用することが可能である。
(23)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体では、固定化された酵素の保存性が確保されるため、酵素の繰り返し使用時に反応を一時停止して、酵素を一時的に保存し、再利用することも可能である。
【図面の簡単な説明】
【0050】
【図1】図1は、シリカ系メソ多孔体への光学異性相互変換酵素の吸着等温線を示す。
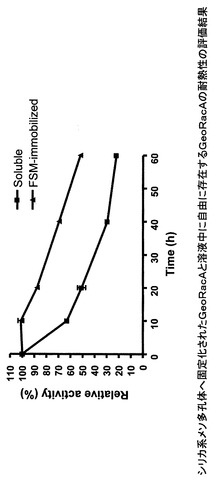
【図2】図2は、シリカ系メソ多孔体へ固定化されたGeoRacAと溶液中に自由に存在するGeoRacAの耐熱性の評価結果を示す。
【図3】図3は、シリカ系メソ多孔体へ固定化されたGeoRacAの繰り返し使用の評価結果を示す。
【図4】窒素吸着/脱着等温線及びFSMの細孔径分布を示す。図中、(A)は、窒素吸着/脱着等温線:FSM−4吸着(▲)、FSM−4脱着(△)、FSM−8.5吸着(■)、FSM−8.5脱着(□)、(B)は、細孔径分布:FSM−4(▲)、FSM−8.5(■)。等温線はNOVA3000分析器を用いて測定した。細孔径分布は、BJH法を用いて決定した。試料は、真空下で、200℃、3時間、前処理(脱ガス等)を行った。
【図5】試料(1μg)は、5−12%ポリアクリルアミドの濃度勾配による電気泳動で分離し、ゲルは、Bio−Safe Coomassie Stainで染色した。
【図6】FSM−4(▲)及びFSM−8.5(■)上でのGeoRacAの吸着等温線を示す。GeoRacA(1mL)の各種濃度を、10mgのFSMに、4℃で、24時間吸着させ、上清の蛋白質濃度を測定した。
【図7】フリー及びFSM−固定化GeoRacAの熱安定性を示す。フリー(■)又はFSM−固定化(▲)GeoRacA(0.2mg/mL)を、80℃で、所定時間インキュベートし、残存する活性を測定した。比活性は、熱処理していない試料の活性に対して計算した。
【図8】GeoRacAの静電気表面ポテンシャル(図中、赤に相当する薄い部分はマイナス、青に相当する濃い部分はプラス)を、GRASP2プログラムを用いて計算した。
【図9】FSM−固定化GeoRacAの再利用を示す。各サイクルで、FSM−固定化GeoRacA(4μgの蛋白質)を、30℃で、1分間、3mM L−Ala(3.5mL)でインキュベートし、D−Alaの濃度を測定した。数値は、最初のサイクルでの活性を100%とした場合の比活性として示したものである。
【発明を実施するための形態】
【0051】
次に、実施例に基づいて本発明を具体的に説明するが、本発明は、以下の実施例によって何ら制約を受けるものではない。
【実施例1】
【0052】
本実施例では、シリカ系メソ多孔体−光学異性相互変換酵素複合体を合成した。
(1)シリカ系メソ多孔体の合成1
シリカ系メソ多孔体のうち、まず、FSMタイプに属するシリカ系メソ多孔体の作製法を示す。カチオン性界面活性剤である塩化ベヘニルトリメチルアンモニウムを主成分とし、エチルアルコールとの混合物である界面活性剤(アーカード、ライオン株式会社製)8gを、超純水100gに混合し、70℃で、30分間、撹拌混合した。
【0053】
この撹拌混合には、ホモミキサーを用いた。別途、カネマイト(プリフィード、トクヤマシルテック株式会社製)5.336gを、超純水104.7gと混合し、70℃で、撹拌混合した。シリカ系メソ多孔体の細孔径を制御する目的で、要する場合に、膨張剤として、トリイソプロピルベンゼンを添加した。
【0054】
この撹拌混合には、マグネチックスターラーを用いた。それぞれの溶液の所定の撹拌時間を経た後、両者を混合し、更に、70℃で、2時間、ホモミキサーを用いて、撹拌混合した。この撹拌混合の後、2規定の塩酸を、約1時間かけて滴下し、溶液の状態をpH8.5とした。溶液のpHが8.5となった後、更に、3時間、撹拌混合した。
【0055】
この溶液を、吸引濾過した後、分離された固形物を、70℃の温水に再分散し、更に、濾過を繰り返した。この操作を3回繰り返した後、固形物を、60℃で、24時間、乾燥した。更に、空気気流中において、550℃で、6時間焼成することにより、各種の細孔径を有するシリカ系メソ多孔体を得た。
【0056】
上記手法により合成されたシリカ系メソ多孔体について、粉末X線回折法、走査電子顕微鏡法、透過電子顕微鏡法、及び窒素吸着等温線の測定を適用した。粉末X線回折法は、Bruker製AXS D8−ADVANCE Vario−1を用いて実施した。得られたX線回折パターンより、上記手法により作製されたシリカ系メソ多孔体は、2次元ヘキサゴナルの細孔配列構造を有していることが分かった。また、回折ピーク位置の解析から、合成時、膨張剤を用いなかった場合のシリカ系メソ多孔体に比較して、膨張剤を用いた場合のシリカ系メソ多孔体の方が、シリカ系メソ多孔体の細孔径が大きくなっていることが確認された。
【0057】
走査電子顕微鏡による観察から、合成されたシリカ系メソ多孔体は、不定形顆粒状の形態として観察された。また、透過電子顕微鏡による観察から、合成時に、膨張剤を用いなかった場合のシリカ系メソ多孔体では、4nm径の細孔が分布していることが確認された。膨張剤として、トリイソプロピルベンゼンを4.5ml添加した場合のシリカ系メソ多孔体では、7.5nm径の細孔が分布していることが確認され、また、膨張剤として、トリイソプロピルベンゼンを6ml添加した場合のシリカ系メソ多孔体では、8.5nm径の細孔が分布していることが確認された。
【0058】
窒素吸着等温線の測定は、Quantachrome社製Autosorbによって行った。測定の結果から、膨張剤の添加量に依存して、異なる吸着等温線が得られた。吸着等温線の解析から、細孔径分布等を知ることは容易である。測定の結果、合成時に、膨張剤を用いなかった場合のシリカ系メソ多孔体では、4nm径の細孔が分布していることが確認された。膨張剤として、トリイソピルベンゼンを4.5ml、及び6ml添加した場合のシリカ系メソ多孔体の場合では、それぞれ7.5nm,8.5nm径の細孔が分布していることが確認された。
【0059】
以下、合成時に、膨張剤を用いなかった場合の、4nm径に細孔径分布のピークを持つシリカ系メソ多孔体を「FSM−4」と表記し、膨張剤として、トリイソピルベンゼンを4.5ml添加して合成した場合の、7.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体を「FSM−7.5」と表記し、同じく、膨張剤として、トリイソピルベンゼンを6ml添加して合成した場合の、8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体を「FSM−8.5」と表記する。
【0060】
(2)シリカ系メソ多孔体の合成2
次に、シリカ系メソ多孔体のうち、SBAタイプに属するシリカ系メソ多孔体の作製法を示す。中性の非イオン性界面活性剤のブロックコポリマー[poly(ethylene glycol)−block−poly(propylene glycol)−block−poly(ethylene glycol)](分子量:〜5800、EO:PO:EO=20:70:20)12gを、超純水449mlに混合し、更に、これに、35%の塩酸20mlを加えて、35℃で、一晩、撹拌混合した。
【0061】
その後、シリカ源として、TEOS(Tetraethly Orthosilicate)を27.4ml加え、35℃で、20時間、撹拌混合した。この撹拌混合には、マグネチックスターラーを用いた。この反応液を、オートクレーブ容器に装填し、35,75,100,130℃の各温度で、24時間静置した。この溶液を、吸引濾過した後、60℃で、24時間、乾燥した。更に、空気気流中において、550℃で、6時間焼成することにより、各種の細孔径を有するシリカ系メソ多孔体を得た。この合成法によるSBAは、P6mm構造のSBAであった。オートクレーブ容器の保持温度により、細孔径が制御された。
【0062】
Ia3d構造のSBAを合成するために、中性の非イオン性界面活性剤のブロックコポリマー[poly(ethylene glycol)−block−poly(propylene glycol)−block−poly(ethylene glycol)](分子量:〜5800、EO:PO:EO=20:70:20)12gを、超純水434mlに混合し、更に、これに、35%の塩酸20mlを加えた。しばらく撹拌混合した後、これに、ブタノール14.8mlを加えて、35℃で、一晩、撹拌混合した。
【0063】
その後、シリカ源として、TEOS(Tetraethly Orthosilicate)を27.4ml加え、35℃で、20時間、撹拌混合した。この撹拌混合には、マグネチックスターラーを用いた。この反応液を、オートクレーブ容器に装填し、35,75,100,130℃の各温度で、24時間静置した。この溶液を、吸引濾過した後、60℃で、24時間、乾燥した。更に、空気気流中において、550℃で、6時間焼成することにより、各種の細孔径を有するシリカ系メソ多孔体を得た。
【実施例2】
【0064】
(1)光学異性相互変換酵素ラセマーゼの準備
ラセマーゼのクローニングは、以下の手順により行った。
準備したラセマーゼは、以下のものである。
・Bacillus subtilis グルタミン酸ラセマーゼ(BsRacE)
・Lactobacillus fermenti グルタミン酸ラセマーゼ(LfRacE)
・Geobacillus stearothermophilus アラニンラセマーゼ(GeoRacA)
・Pyrococcus horikoshiiOT3 アスパラギン酸ラセマーゼ(PhRacD)
【0065】
それぞれの遺伝子の入手は、以下により行った。
Bacillus subtilis菌体は、納豆(おかめ納豆、タカノフーズ株式会社製)より単離した。Geobacillus stearothermophilus菌体(NBRC12550)、Lactobacillus fermenti菌体(NBRC3071)、及びPyrococcus horikoshiiOT3 アスパラギン酸ラセマーゼ遺伝子を含むゲノムDNAクローン(S2LA209)は、独立行政法人製品評価技術基盤機構バイオテクノロジー本部より購入した。
【0066】
PCRプライマーとしては、それぞれ、以下のものを用いた。
1)BsRacA:
・ N−terminal 5‘−AGAGACATATGGAACAACCAATAGGAGTCATTGATTCC
・ C−terminal 5‘−GAGACTCGAGCTATCTTTTAATCGGTTCTTGCAGTGAGAT
【0067】
2)LfRacE:
・ N−terminal 5‘−AGAGACATATGGACAATCGCCCAATTGGAGTGA
・ C−terminal 5‘−GAGACTCGAGTTAATCCCCCTCTTCAATTTGGGCGGT
【0068】
3)GeoRacA:
・ N−terminal 5‘−AGAGACATATGAACGACTTTCATCGCGATACGTG
・ C−terminal 5‘−GAGACTCGAGTGAAGCAGATTATGCACTGCTTTCCC
【0069】
4)PhRacD:
・ N−terminal 5‘−GAGACATATGAAAACGATAGGTATACTTGGTG
・ C−terminal 5‘−GAGACTCGAGTTACTTTTCTAATGCAACCTTAACG
【0070】
(2)ラセマーゼ遺伝子のクローニング方法
次に、ラセマーゼ遺伝子をクローニングする方法を示す。各バクテリア菌体のラセマーゼの全長遺伝子に、上記PCRプライマーを使用し、iProof High−Fiderity DNA Polymerase(バイオラッド社製)により、遺伝子の増幅を行った。鋳型として、BsRacE,LfRacE,GeoRacAは、それぞれの菌体より、ゲノムDNAを抽出したものを使用し、PhRacDについては、ゲノムDNAクローン(S2LA209)を用いた。
【0071】
PCR反応の後、増幅されたDNAの末端を、ゲル精製した後、ポリヌクレオチドキナーゼにより、リン酸化した。これらのインサートを、pBluescript IIベクター(ストラタジーン)のEcoRV部位に挿入し、大腸菌TOP10株(インビトロジェン社製)にトランスフォームして培養した後、クローンを回収した。得られたクローンは、ダイデオキシ法により、DNA配列の確認を行った。
【0072】
次に、正しい配列のラセマーゼ遺伝子を、制限酵素NdeI、及びXhoIで切断し、発現ベクターpET28b(Novagen、ノバジェン社製)のNdeI−XhoI部位に挿入することにより、組換えタンパク質のアミノ酸末端に、6xHisタグを有する発現プラスミドを作製した。これを、TOP10株にトランスフォームし、プラスミドを回収した。
【0073】
更に、アミノ酸末端側のDNA配列を確認して、フレームが正しいことを確認した後、BsRacE,LfRacE,GeoRacAは、発現用大腸菌BL21star(DE3)株(インビトロジェン社製)に、PhRacDは、Rosetta2(DE3)株(ノバジェン社製)にトランスフォームした。得られたコロニーから、小スケールで培養を行い、タンパク質の発現を確認した。
【0074】
(3)ラセマーゼの大量発現
発現の確認されたクローンについて、シングルコロニーを、30mlの1.5%グルコース及び50μg/mlのカナマイシンを含むTurbo Broth(モレキュラーディメンジョン社製)で、37℃において、一晩、振盪培養した。このうちの15mlもしくは20mlを、1.5Lもしくは2Lの上記培地に移し、37℃で、OD600が0.6になるまで振盪培養した。
【0075】
次に、最終濃度1mMのIsopropyl−β−D−1−thiogalactoside(IPTG)を加え、更に、37℃で、4時間、もしくは20℃で、10〜20時間振盪培養することにより、ラセマーゼを発現させた。7500×gで、4℃、5分間遠心し、菌体を回収した。菌体を、80mlのCell lysis buffer[20mM Tris−HCl(pH7.5),500mM NaCl]に懸濁した後、液体窒素で凍結させ、−80℃で保存した。
【0076】
(4)ラセマーゼの精製
−80℃で保存していた菌体を溶解した後、最終濃度1mM Phenylmethyl−sulfonyl fluoride (PMSF),10μg/ml PepstatinA,10mM 2−mercaptoethanol(2−ME)及び1mg/mlリゾチームを加え、氷上で、1時間静置した。次に、S−250ソニファイアー(ブランソン社製)を使用して、超音波処理を行い、菌体を破砕した。100000×gで、4℃、40分間遠心して、上清を回収し、0.45μmフィルターでろ過して、クルードサンプルを得た。
【0077】
クルードサンプルを、Aバッファー[20mM リン酸カリウム(pH7.5),500mM KCl,10mM imidazole]で平衡化したHis−Trap HP カラム(5ml×2本連結,GEヘルスケアバイオサイエンス社製)に通して、ラセマーゼを吸着させた。次に、Aバッファーで、カラムを洗浄後、Bバッファー[20mM リン酸カリウム(pH7.5),500mM KCl,500mM imidazole]の0%から100%のグラジエントをかけて、ラセマーゼを溶出させた。尚、上記の操作は、AKTA10S中圧クロマトグラフィー装置(GEヘルスケアバイオサイエンス社製)を用いて行った。
【0078】
各フラクションのSDS−PAGEを行い、ラセマーゼを含むフラクションを集めた。集めたフラクションを、透析バッファー(ピアス)に入れ、2Lの透析バック[20mM リン酸カリウム(pH7.5),50mM KCl]で、4℃において、一晩透析した。透析後、サンプルを、Amicon Ultra−15MWCF10000(ミリポア社製)を用いて、タンパク質濃度約5〜10mg/mlに濃縮した。タンパク質濃度は、Protein Assay Kit(バイオラッド社製)を使用して、γ−グロブリンをスタンダードとして、測定した。
【0079】
また、活性測定を行って、ラセマーゼ活性を保持していることを確認した。活性測定法として、基質溶液[BsRacEについては、20mM リン酸カリウム(pH8.0),1mM L−グルタミン酸、LfRacAについては、20mM リン酸カリウム(pH8.0),2mM L−グルタミン酸、GeoRacAについては、10mM リン酸カリウム(pH7.5),3mM L−Amino acidアラニン]に濃縮したサンプルを加え、30℃で、204nmの円二色性の変化を、J−820円二色性分散計(日本分光社製)を用いて測定することにより、評価した。
【0080】
(5)シリカ系メソ多孔体−光学異性相互変換酵素複合体の作製
光学異性の相互変換を触媒する酵素の固定化用担体として用いたシリカ系メソ多孔体を、以下に示す。また、表1に、各種シリカ系メソ多孔体の表記法、メソ多孔体の分類合成時設定温度[℃]、窒素吸着による細孔径[nm]を示す。
・P6mm構造のSBA4種:窒素吸着による細孔径が、6.2nm、6.7nm、8.0nm、11.1nmのシリカ系メソ多孔体。
・Ia3d構造のSBA4種:窒素吸着による細孔径が、6.1nm、6.7nm、9.9nm、11.0nmのシリカ系メソ多孔体。
・FSMタイプのもの3種:窒素吸着による細孔径が、4nm、7.5nm、8.5nmのシリカ系メソ多孔体。
【0081】
【表1】

【0082】
光学異性の相互変換を触媒する酵素としては、BsRacE,LfRacE,GeoRacA,PhRacDのラセマーゼを用いた。本実施例では、代表例として、ラセマーゼとして、GeoRacAを用い、シリカ系メソ多孔体として、細孔径が4nmであるFSM(FSM−4と表記)と、細孔径が8.5nmであるFSM(FSM−8.5と表記)を用いた。尚、その他のラセマーゼ、及びシリカ系メソ多孔体を用いた場合についても、以下に示す同様の実験を行って、同様の結果を得ている。表2に、シリカ系メソ多孔体−光学異性相互変換酵素複合体の酵素活性評価用に用いたシリカ系メソ多孔体の特性を示す。これら2種のシリカ系メソ多孔体の特性は、窒素吸着等温線の測定結果、及びその結果の解析から、表2のようにまとめられる。
【0083】
【表2】

【0084】
1.[20mM リン酸カリウム(pH 7.5),50mM KCl]のバッファーを使用し、該バッファーに溶かした各種濃度のGeoRacA溶液1mlと、10mgのメソポーラスシリカを混合し、4℃で、一晩、転倒混和した。
2.これを遠心して、上清を除いた。
3.上清に遊離してきたGeoRacAを定量することで、吸着したGeoRacA量を算出し、それぞれの濃度における吸着量を算出した。
【0085】
その結果を、図1に示す。図1は、シリカ系メソ多孔体への光学異性相互変換酵素の吸着等温線をまとめたものである。その結果、FSM−8.5に対する吸着量の方が、FSM−4に対する吸着量よりも多いことが分かった。これは、GeoRacAの大きさが、8.2×5.2×4.2nmであることから、GeoRacAが、FSM−8.5の細孔内に、より容易に入り込むためと理解できる。
【0086】
酵素活性を評価するための、シリカ系メソ多孔体−光学異性相互変換酵素複合体の作製は、以下の手順により行った。FSM−8.5、30mgに対して、適当なバッファーに溶解した1.26mgのGeoRacAを混ぜ、4℃で、24時間、ゆっくりと回転振盪した。このGeoRacAの量は、全量吸着する量に設定されるようにした。
【0087】
遠心分離により、固定化された酵素、すなわち、シリカ系メソ多孔体−光学異性相互変換酵素複合体を分離回収し、20mM リン酸カリウム(pH7.5)、50mM KCl溶液で、3回以上洗浄し、酵素量が0.2mg/mlとなるように、懸濁状態のシリカ系メソ多孔体−光学異性相互変換酵素複合体を含む溶液を得た。
【0088】
(6)酵素の固定化状態の評価
上記の懸濁状態のシリカ系メソ多孔体−光学異性相互変換酵素複合体を含む溶液を、乾燥させて粉末とし、窒素吸着等温線の測定を行った。Quantachrome社製Autosorbを用いて行った測定の結果、メソ孔内に酵素が取り込まれ、細孔体積が減少していることが確認された。
【0089】
(7)シリカ系メソ多孔体−光学異性相互変換酵素複合体の酵素活性測定
GeoRacAは、アラニンの光学異性相互変換を触媒する酵素である。その活性は、アラニンの光学活性相互変換を測定することにより行った。L−アラニン、D−アラニンは、それぞれ、23.0及び−23.0mdeg/cm/mMの旋光性を示す。L−アラニンからD−アラニンへの変換、もしくはその反対の変換により、旋光性が変化する。その変化を、204nmの円二色性の変化を、J−820円二色性分散計(日本分光社製)を用いて測定することにより、評価した。
【0090】
実際の測定手順は、以下のようにした。
1.10mMのリン酸カリウム(pH7.5)の溶液に、L−アラニン、D−アラニンがそれぞれ、0.5,1.0,2.0,3.0,4.0,5.0,6.0,8.0,10.0mM入った各種溶液を用意した。
【0091】
2.FSM−8.5に固定化されたGeoRacAと、溶液中に分散しているGeoRacAの、それぞれ2μgを、上記1の各種溶液のそれぞれ2.5mlに、30℃にて、混ぜた。
3.次いで、204nmの円二色性の変化を測定した。
【0092】
その結果を、図2に示す。この結果を元にして、最大酵素反応速度(Vmax)と、Vmaxの半分の速度を示す時の基質の濃度(Km)値を、グラフ解析ソフトウエアを用いて算出した。その算出結果を、表3に示す。表3は、シリカ系メソ多孔体へ固定化されたGeoRacAと溶液中に自由に存在するGeoRacAの酵素活性評価をまとめたものである。
【0093】
Km値を比較すると、FSM−8.5に固定化されたGeoRacAの方が、少し大きな値を示している。一方、Vmax値は、溶液に分散したGeoRacAの方が、大きい。このことは、メソ孔内に固定化されている酵素の方が、基質との接触割合が低くなることから、容易に予想されることである。一般的に、固定化された酵素は、Km値は高く、Vmax値は低くなる傾向が知られている(非特許文献6)。更に、基質に対する酵素の作用効率の指標として、Vmax/Kmの値が用いられることがあり、この数値が高いほど、酵素の作用が高いことを示す。
【0094】
表2に示されるように、GeoRacAの場合、FSM−8.5に固定化されても、51%のVmax/Kmの値を示しており、一般的な固定化酵素が30%以下の数値になるのに比較して、高い数値を維持していることが分かる。このことは、本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体が、一般的な固定化酵素の場合と比較して、非常に酵素作用が高く、優れたものであることを示していることに他ならない。
【0095】
【表3】

【0096】
(8)シリカ系メソ多孔体−光学異性相互変換酵素複合体の熱安定性の評価
酵素を工業的な製造プロセスに用いる場合、その耐熱性の向上は、非常に重要な因子である。シリカ系メソ多孔体−光学異性相互変換酵素複合体を構成した酵素が、溶液中に自由に分散しているときに比較して、熱安定性が向上しているかどうかを評価した。その結果を、図2に示す。図2は、シリカ系メソ多孔体へ固定化されたGeoRacAと溶液中に自由に存在するGeoRacAの耐熱性の評価結果をまとめたものである。評価は、シリカ系メソ多孔体−光学異性相互変換酵素複合体を構成した酵素と、溶液中に自由に分散している状態の酵素を、それぞれ80℃に保持した後、どの程度の酵素活性を有しているかを見る方法により行った。
【0097】
本実施例では、GeoRacAを、酵素として用い、シリカ系メソ多孔体として、FSM−8.5を用いた。その結果は、溶液中に自由に分散した酵素の場合、80℃に、10分間保持することで、酵素活性は、60%に減少した。一方、シリカ系メソ多孔体−光学異性相互変換酵素複合体を構成した酵素の場合、80℃、10分間の保持では、100%の酵素活性を示した。80℃に、60分間保持しても、50%の活性を有していた。このことは、シリカ系メソ多孔体−光学異性相互変換酵素複合体が、酵素の耐熱性を大幅に向上させる効果を有していることを示している。
【0098】
(9)酵素の繰り返し利用についての評価
技術的並びに経済的効果の観点から、酵素が繰り返し利用できることは非常に重要な因子である。シリカ系メソ多孔体−光学異性相互変換酵素複合体の繰り返し使用による、酵素活性の変化を評価した。用いた酵素は、同様に、GeoRacAであり、シリカ系メソ多孔体としては、FSM−8.5を用いた。
【0099】
その結果を、図3に示す。図3は、シリカ系メソ多孔体へ固定化されたGeoRacAの繰り返し使用の評価結果をまとめたものである。最初の活性を100%として、5回再使用した場合でも、50%の活性を保持していることが分かり、10回までの使用では、少しずつ活性が低下していくが、それ以降は、一定の値に落ち着いてくることが分かる。このことは、シリカ系メソ多孔体−光学異性相互変換酵素複合体には、酵素の繰り返し使用を可能とする非常に優れた効果があることを示している。
【0100】
また、本発明で、特に重要なことは、光学異性の相互変換のための反応系において、シリカ系メソ多孔体に固定化されたラセマーゼを共存させることにより、その溶解度を超えた量のラセマーゼを反応系内に存在させることが可能であることである。このことは、反応速度、すなわち光学異性の相互変換速度の向上に大きく寄与するものであり、また、反応生成物からも、酵素を容易に回収できることを意味するものである。
【0101】
一般に、酵素、すなわち、タンパク質の溶解度には、限界があり、それを越えると、凝集という現象を起こす。光学異性相互変換酵素の場合も例外ではなく、15mg/mlを越えるような高濃度にすると、凝集が起こり、凝集を起こした酵素は、活性に寄与しない。特に、ラセマーゼは、等電点付近のpH領域での凝集が激しい傾向があり、そのpH域では、1mg/ml程度の濃度でも、凝集を避けることは困難である。
【0102】
一方で、シリカ系メソ多孔体に固定化されたラセマーゼの場合、例えば、FSM−8.5 10mgに対して、光学異性相互変換酵素が、0.42mg程度、吸着・固定されたシリカ系メソ多孔体−光学異性相互変換酵素複合体を、1mlの反応基質、すなわち、反応基質の溶解した溶液中に、50mg分散させることは容易である。
【0103】
この反応系においては、溶液1mlに、ラセマーゼを、0.42×50/10=2.1mg、活性を有した状態で存在させることができる。したがって、1mg/mlを超えた酵素量を、反応系内に容易に存在させることができる。この状況は、凝集の激しい等電点付近のpH領域においても、同様に適用でき、本来であれば容易に凝集を起こしてしまうようなpH領域の反応系内に、酵素を、凝集を起こすことなく、活性を有した状態で、安定に存在させることが可能である。
【0104】
更に、本発明では、光学異性相互変換酵素が固定化されたシリカ系メソ多孔体−光学異性相互変換酵素複合体を、更に固定して、そこに、反応基質を含む溶液を流すような装置を構成することにより、連続的な酵素反応装置の構築と連続的な酵素反応の実施が容易に可能である。
【実施例3】
【0105】
(1)材料
本実施例では、実験材料として、G.stearothermophilus(NBRC12550)、ドコシルトリメチルアンモニウムクロライド[C22H45N(CH3)3Cl;C22−TMA](ライオン株式会社)、カネマイト(層状ポリシリケート)(徳山シルテック株式会社)、1,3,5−トリイソプロピルベンゼン(TIPB)(東京化学工業株式会社)、D−Ala、L−Ala,β−D−チオガラクトピラノシド(IPTG)(和光純薬工業株式会社)を使用した。
【0106】
(2)FSMの合成
ここでは、FSM−4(細孔径4nm)については、カネマイト(5.35g)を、C22−TMA(8.16g)含有水溶液(205mL)に分散させ、70℃で、2時間撹拌した。得られた懸濁液のpHを、2NHClで8.5に調整し、更に、70℃で、3時間インキュベートした。FSM−8.5(細孔径8.5nm)を合成するためには、カネマイトを加える前に、5.5mLのTIPBを、C22−TMA溶液に混合した。合成したFSMは、脱イオン水で洗い、60℃で、一夜乾燥し、空気中で、550℃で、6時間焼成して有機化合物を除いた。
【0107】
(3)GeoRacAのクローニング及び大量発現
GeoRacA遺伝子を、テンプレートとしてG.stearothermophilus(NBRC12550)のゲノムDNAを、プライマーとして、フォワードの5’−AGAGACATATGAACGACTTTCATCGCGATACGTG−3’及びリバースの5’−GAGACTCGAGTGAAGCAGATTATGCACTGCTTTCCC−3’を用いて、PCRにより増幅させた。
【0108】
PCR反応物を、pBluescript II(SK+)プラスミド(Stratagene社、CA、USA)に連結させ、dideoxynucleotide−chain−termination法を用いて、配列を決定した。pET28bベクターのNdeI−XhoIサイトにクローンを挿入することによって、N−末端にヘキサヒスチジンタグを持つGeoRacAを作製した。
【0109】
Escherichia coli株BL21Star(DE3、Invitrogen社、CA、USA)を、GeoRacA発現ベクターで形質転換した。GeoRacAの発現は、ターボブロス中で、IPTGを最終濃度0.5mM加えることにより誘導した。更に、20℃で、21時間インキュベートした後、7500×g、5分の遠心により細胞を得た。この細胞を、20mMのトリス−HCl(pH7.5)、10mM 2−メルカプトエタノール、500mM NaClに再懸濁し、液体N2で凍結し、−80℃で保存した。
【0110】
(4)GeoRacAの精製
解凍させた細胞に、1mMフェニルメチルスルフォニルフルオライド、1μg/mLペプスタチンA、0.5mg/mLリゾチーム、1mM MgCl2、100ユニットのDNaseI、10μMピリドキサール−5’−リン酸、及び10mMイミダゾールを加えた。4℃で、30分培養した後、細胞を超音波処理して破砕し、4℃で、100,000×g、45分間遠心した。上清を、0.45μmフィルターで濾過し、AKTA Explorer液体クロマトグラフィーシステム(GE Healthcare UK社)のHisTrapHPカラム(GE Healthcare UK社、Buckinghamshire、England)にかけた。
【0111】
蛋白質を、20mMリン酸カリウム(pH7.5)、500mM KCl中の10−500mMイミダゾールの濃度勾配により溶出させた。ピークフラクションを集め、Amicon(登録商標)Ultra−15遠心フィルターユニット(Millipore社、MA、USA)で濃縮し、20mMリン酸カリウム(pH7.5)、50mM KCl、で透析した。酵素の純度は、SDS−PAGEによって確認した。
【0112】
(5)FSMへのGeoRacAの吸着
FSMへのGeoRacAの吸着を調べるために、一定量のFSM(10mg)を、各濃度(0.1−4mg/mL)の1mL GeoRacA溶液で、Rotator RT−50(タイテック株式会社)で、4℃で、24時間振盪した。FSMを、4℃で、20,800×g、5分間の遠心で除き、上清液中の蛋白質濃度を測定した。吸着した蛋白質量は、遠心後の上清の蛋白質量を、吸着前のGeoRacAの量から引くことにより計算した。
【0113】
酵素活性を調べるために、30mgのFSM−8.5を、20mMリン酸カリウム(pH7.5)、50mM KCl中の1.26mgのGeoRacA(1mg/mL)と、4℃で、24時間インキュベートした。FSM−固定化GeoRacAを、4℃で、10,600×g、3分の遠心で集めた。固定化GeoRacAの量は、上清の未結合の蛋白質を測定することによって計算した。FSM−固定化GeoRacAを3回洗い、緩衝液に懸濁して、蛋白質濃度0.2mg/mLとした。
【0114】
(6)キャラクタリゼーション
窒素吸着等温線を、液体N2(77K)の濃度で、NOVA300分析器(Quantachvome Instrument社、FL、USA)を用いて、測定した。測定の前に、真空下で、試料を、200℃で、3時間脱ガス処理した。比表面積を、Brunaur−Emmett−Teller(BET)法で、P/P0=0.05−0.30の相対圧力範囲の吸着データを用いて計算した。総細孔体積は、最大相対圧力におけるN2吸着から推定した。細孔径分布は、Barrett−Joyner−Halenda(BJH)法を用いて、吸着曲線から決定した。
【0115】
(7)酵素活性
アラニンラセマーゼ活性は、Jasco J−820 CD分光施光計(日本分光株式会社)を用いて、204nmでのモル楕円率の変化をモニターすることによって測定した。L−Ala及びD−Alaのモル楕円率は、それぞれ23.0及び−23.0mdeg/cm/mMであった。反応速度定数は、10mMリン酸カリウム(pH7.5)中での、L−Ala又はD−Alaの各濃度(0.5、1.0、2.0、3.0、4.0、5.0、6.0、8.0及び10mM)での酵素活性を測定することによって計算した。
【0116】
FSMに固定化した、又はフリーのGeoRacA試料(2μg蛋白質)を2.5mLの10mMリン酸カリウム(pH7.5)、3mM L−Alaに加えた。30℃での204nmのモル楕円率の減少割合から酵素活性を計算した。Vmax及びKm値は、Prism4ソフト(GraphPad Software社、CA、USA)を用いて、曲線を外挿して計算した。
【0117】
(8)熱安定性試験
酵素の熱安定性を調べるために、0.2mg/mL FSM−固定化又はフリーのGeoRacA試料の50μL量を、80℃で処理した。その後、10μLの試料を、2.5mLの10mMリン酸カリウム(pH7.5)、3mM L−Alaに加え、30℃で酵素の残存活性を測定した。
【0118】
(9)再利用試験
FSM−固定化GeoRacAの再利用性を評価するために、4μgのFSM−固定化GeoRacAを10mMリン酸カリウム(pH7.5)、3mM L−Alaに加え、30℃で、1分間振盪した。4℃、2150×gで5分遠心することによってFSM−固定化GeoRacAを沈殿させ、上清のD−Alaの濃度を測定した。更に、沈殿に新たな3.5mLの10mMリン酸カリウム(pH7.5)、3mM L−Alaを加えた。このサイクルを繰り返した。
【0119】
(10)実験結果
1)FSMのキャラクタリゼーション
細孔径4nm(FSM−4)及び8.5nm(FSM−8.5)のFSMを合成した。窒素吸着等温線及び細孔分布を図4A及びBに示す。FSMsの構造パラメータを、表4に示す。
【0120】
【表4】

【0121】
図4Aに示されるように、FSM−4及びFSM−8.5の窒素吸着等温線は、IUPAC分類により、メソポーラスシリカの特徴であるタイプIVであった。FSM−4及びFSM−8.5の細孔径は、4及び8.5nmであり(図4B)、これらの総細孔体積は、1.30及び2.57cm3/gであった。それらの表面積は、両者とも約1100m2/g(表4)であった。
【0122】
これらの値は、MCM−41及びSBAのような、同様の細孔径を有する他のMPsの値と比べて、非常に高い。また、FSM−8.5の細孔径分布は、FSM−4のものよりも広かった(図4B)。尚、FSMの細孔径は、膨潤剤の量の増加に応じて増加するが、細孔径分布も広くなる傾向がある。
【0123】
2)GeoRacAの分離及び精製
GeoRacAのcDNAクローンを、バクテリア発現ベクターpET28bにサブクローンして、N−末端にヘキサヒスチジンをタグを有した蛋白質を発現させた。
【0124】
GeoRacA発現ベクターを、E.coli株(BL21Star(DE3)に導入し、GeoRacA蛋白質発現を誘導させた。GeoRacAは、HisTrapHPカラムで精製した。精製GeoRacAの最終の収量は、培養1L当たり〜300mgであった。また、図5に示されるように、ほぼ均一に精製された。
【0125】
精製GeoRacAは、5−7のpH範囲の緩衝液中では凝集、沈殿が起こったため、塩(50mM KCl)を含んでいるpH7.5の緩衝液を用いて、凝集を抑えた。GeoRacAの等電点(pI)は6.7であり、該pIでは、GeoRacAは不安定であり、沈殿すると考えられる。
【0126】
3)FSMに対するGeoRacAの吸着
図6に、FSM−4及びFSM−8.5でのGeoRacAの吸着等温線を示す。飽和能力は、FSM−4よりも細孔の大きいFSM8.5がより高い(28及び62mg/g)。
【0127】
GeoRacAは、43kDaの2つの同一のサブユニットからなり、ユニットセル寸法は、88×52×42Åである(文献:J.P.Shaw,G.A.Petsko,D.Ringe,Biochemistry 36(1997)1329−1342)。GeoRacAの寸法は、FSM−4の細孔径より大きいので、吸着された少量は、粒子の細孔入口及び/又は外表面に存在していると考えられる。
【0128】
FSM−4及びFSM−8.5の表面積は、同様であるが、FSM−8.5の総細孔体積は、FSM−4の約2倍の大きさであり(表4)、その細孔径は、GeoRacAより大きいことから、GeoRacAは、FSM−8.5の細孔内に固定化されていることが示唆される。
【0129】
FSMに吸着されたGeoRacAの量を、他の蛋白質の吸着と比べると、HRP(183mg/g)及びヘモグロビン(212mg/g)のものより低かった[文献:1)H.Takahashi,B.Li,T.Sasaki,C.Miyazaki,T.Kajino,S.Inagaki,Chem.Mater.12(2000)3301−3305、2)Y.Urabe,T.Shiomi,T.Itoh,A.Kawai,T.Tsunoda,F.Mizukami,K.Sakaguchi,Chembiochem.8(2007)668−674]。この低い吸着は、用いた緩衝液のpHがGeoRacAのpIより高いことによると考えられる。
【0130】
一般的に、シリカ支持体への酵素の吸着は、緩衝液のpHが蛋白質のpI付近で、最大化され、そのpIより上では減少する。本実施例で用いた緩衝液のpHは、7.5であり、GeoRacAのpI(6.7)より高い。このとき、GeoRacAは全体的にはマイナス電荷を有していると考えられる。また、シリカ支持体の表面は、pH<2でマイナスに電荷を有している。よって、pHは、7.5の緩衝液中では、シリカ表面及びGeoRacAは共にマイナスの電荷を有しているので、吸着が低くなる。分子進化のような、分子生物学技術を用いて酵素のpIを修正することは、この問題を解決すると思われる。
【0131】
本実施例では、SBAタイプのメソポーラスシリカも調べた。SBAの細孔径(9.8nm)及び表面積(955m2/g)はFSM−8.5と同様であったが、SBAに吸着されたGeoRacAの量は、FSM−8.5に吸着された量の約半分であった。
【0132】
FSMの表面シラノール基の組成は、SBAを含む他のアモルファスシリカと比べて、ユニークである。例えば、アモルファスシリカは、Q2(20%)及びQ3(8%)シラノール基を表面に含んでいるが、FSMのシラノール基は、Q3である。FSMの表層シラノール基は、アモルファスシリカのものよりも、より酸性である。
【0133】
FSMのこれらのユニークな表面特性は、SBAよりも、蛋白質の吸着をより高くさせることが可能である。一般に、高い酵素能力は、固定化酵素支持体の経済性にとって重要であり、酵素が固定化のメリットを最大限に享受されるためには、メソポーラスシリカの細孔内に吸着される必要があると考えられる[文献:1)S.Hudson,J.Cooney,E.Magner,Angew.Chem.Int.Ed.47(2008)8582−8594、2)C.Ispas,I.Sokolov,S.Andreescu,Anal.Bioanal.Chem.393(2009)543−554]。
【0134】
4)FSM−固定化及びフリーGeoRacAの反応速度
表5に、フリー、又はFSM−固定化GeoRacAの反応速度定数を示す。FSM−固定化GeoRacAのL−からD−Ala、及び、D−からL−AlaへのKm値は、4.35及び3.39mMであり、フリーのGeoRacAより少し高かった(3.71及び2.13mM)。
【0135】
【表5】

【0136】
Vmax値は、固定化によって減少した。これらの結果は、固定化酵素は、その基質との接触が制限されていることを示唆している。酵素の形態の変化及び/又は活性部位のブロックは、酵素−支持体の相互作用によって誘導されると考えられる。GeoRacAは、ホモ二量体であり、各サブユニットの相互作用は、活性部位を維持する上で重要である。したがって、二量体の活性は、単量体酵素よりも、形態変化に対してより影響される可能性がある。
【0137】
FSM−固定化、又はフリーのGeoRacAのVmax/Km比(これは、基質に対する酵素の触媒効率に影響する)は、両方向で0.058/min及び0.114/minである。触媒効率は、FSM上の固定酵素によって減少するとしても、51%の効率が、非固定酵素と比べて残っている。この値は、酵素の固定化に用いられる支持体として合理的なものであると思われる。
【0138】
5)FSM−固定化及びフリーのGeoRacAの熱安定性
HRP及びヘモグロビンの熱安定性が、それらをFSMの細孔中に固定化することによって増加することが報告されている[文献:1)H.Takahashi,B.Li,T.Sasaki,C.Miyazaki,T.Kajino,S.Inagaki,Chem.Mater.12(2000)3301−3305、2)Y.Urabe,T.Shiomi,T.Itoh,A.Kawai,T.Tsunoda,F.Mizukami,K.Sakaguchi,Chembiochem.8(2007)668−674]。熱安定性を調べるために、フリー、又はFSM−固定GeoRacAを、80℃でインキュベートした後に残っている活性を測定した。図7に示されるように、非固定酵素の活性は、10分間のインキュベーションで、60%に減少し、その後、活性は減少し続けた。
【0139】
これに対し、FSM−固定GeoRacAは、10分後で、活性が100%残存し、60分後でも、50%の活性が残存した。この結果は、酵素の熱安定性は、FSMの細孔に固定化することによって、促進されたことを明白に示している。
【0140】
フリーのGeoRacAでは糸くず様の沈殿が熱処理後に見られたが、これはフリーの酵素は、熱処理により変性、凝集したことを示している。これに対し、蛋白質の変性は、FSMへの固定化によって防がれた。この理由として、酵素の表面がFSMの細孔の壁の多数箇所との結合することにより、熱による酵素の構造の揺らぎが制限されるために、熱安定性が促進される可能性が考えられる。
【0141】
図8に示されるように、マイナスに電荷した点は、GeoRacAの表面に分散して存在している。GeoRacAの総電荷が、用いられる実験条件下(緩衝液pH>pI)でマイナスであるとしても、アルギニン及びリジンの残基は、イオン化しており、このことは、FSM表面のシラノール基と作用できることを意味している。
【0142】
シロキサン結合に由来するFSM表面の疎水性の特性も、酵素の表面との結合に関与している。酵素の熱安定性は、狭いシリカ細孔中における分子の水和によって与えられ、シリカ表面のシラノール基の特異的な水−構造を与える性質によって誘導される(文献:R.Ravindra,Z.Shuang,H.Gies,R.Winter,J.Am.Chem.Soc.126(2004)12224−12225)。FSM−固定化GeoRacAは、4℃で、4ヶ月間貯蔵した後でも、活性が94%残存していて(0ヶ月で135μmol/分/mgに対し、4ヶ月で、127μmol/分/mgである)、フリーのGeoRacAでは、活性の14%が残存していた(0ヶ月で239μmol/分/mgに対し、4ヶ月で、34.3μmol/分/mgである)。
【0143】
この結果は、FSMへの酵素の固定化は、その活性を維持する助けとなり得ることを示している。酵素は、液相に貯蔵することができ、必要に応じて、調製できるので、上記の結果は、工業的にも有用である。一般に、市販の酵素は粉末形態であるが、分散することが難しく、粉が舞うことによりプラントへのコンタミ等の原因となる。
【0144】
(11)FSM−固定化GeoRacAの再利用性
固定化酵素の再利用性は、経済的理由により、重要である。そこで、FSM−固定化GeoRacAの再利用性を価値する実験を行った。図9に、その実験結果を示す。最初のサイクルにおけるFSM−固定化GeoRacAの当初の活性を100%として、5サイクルの利用後に、当初の活性の50%が残存していた。その後、活性は減少したが、10サイクルで停滞した。
【0145】
この結果は、酵素の固定化の支持体としてのFSMの利用可能性を示している。活性の減少は、各サイクルで固定化酵素が遠心により集められる際に酵素の浸出及び/又は崩壊の結果によるものである可能性がある。シリカ表面のシラノール基は、Alaのアミノ基に作用し得るので、基質(L−Ala)がFSMに吸着され、酵素の活性に影響することも考えられる。
【0146】
Geobacillus stearothermophilus由来のアラニン、ラセマーゼを、直径4又は8.5nmの細孔を有するメソポーラスシリカ(FSM)に固定化して、ラセマーゼの活性、熱安定性、及び再利用性を調べた。大きい細孔径のFSMは、ラセマーゼを多く吸着したが、これは、細孔径が、酵素を吸着するのに十分な大きさを有するからと考えられる。
【0147】
固定化ラセマーゼは、L−アラニン(L−Ala)からD−Ala及びD−AlaからL−Alaの反応の両者におけるフリーの酵素と比べて、約51%の活性が残存していた。ラセマーゼは、顕著な熱安定性を示し、FSMに固定した場合、少なくとも6回使用可能であった。これらの結果は、酵素の固定化の支持体として、FSMの有用性を示すものである。
【産業上の利用可能性】
【0148】
以上詳述したように、本発明は、シリカ系メソ多孔体への酵素の吸着現象を、酵素の固定化法として利用した、シリカ系メソ多孔体−光学異性相互変換酵素複合体、その製造方法及びその用途に係るものであり、本発明により、シリカ系メソ多孔体の表面に未処理もしくは適切な溶液による処理で官能基を付与することにより、また、その合成条件の制御により、細孔径の制御されたシリカ系メソ多孔体に、光学異性相互変換酵素が固定化された、シリカ系メソ多孔体−光学異性相互変換酵素複合体を提供することができる。本発明では、光学異性の相互変換に際し、原料アミノ酸等や糖類等の性状や特性に応じて、好適な酵素を選択して、その酵素を用いたシリカ系メソ多孔体−光学異性相互変換酵素複合体を、固定化された酵素として選択することが可能である。また、本発明では、酵素の回収が容易であり、繰り返し使用も可能となり、更には、基質を連続的にシリカ系メソ多孔体−光学異性相互変換酵素複合体と接触して流通させる連続的な酵素反応の実施も可能である。本発明によれば、固定化により高集積化された酵素を利用することで、酵素の凝集を避けることができ、酵素を溶液に溶解した状態よりも高濃度に反応系中に存在させることが可能となり、酵素反応をより効率的に進めることに寄与できる。本発明は、例えば、多種多様なアミノ酸類や糖類等の原料から、複数の酵素を作用させた状態で、良質な光学異性の相互変換を効率的に進行させることができる新規光学異性相互変換プロセス・システムを構築することを可能にするものとして有用である。
【技術分野】
【0001】
本発明は、シリカ系メソ多孔体と光学異性相互変換酵素の複合体に関するものであり、更に詳しくは、表面に未処理あるいは適切な溶液で官能基を付与する処理等が施されたシリカ系メソ多孔体への酵素の吸着現象を、酸素の固定化法として利用して複合化した、シリカ系メソ多孔体−光学異性相互変換酵素複合体、その製造方法及びその用途に関するものである。
【0002】
本発明は、表面を未処理あるいは適切な溶液で官能基を付与する処理等を施したシリカ系メソ多孔体への酵素の吸着現象を、酵素の固定化法として利用し、シリカ系メソ多孔体の細孔内もしくは表面に、酵素を安定に固定し、かつその酵素の機能を発揮させることを可能とすると共に、酵素の再利用性と保存性を高めたシリカ系メソ多孔体−光学異性相互変換酵素複合体、その製造方法、及び、その機能性部材としての用途に関する新技術・新製品を提供するものである。
【背景技術】
【0003】
酵素を用いた生化学品、食品製造の技術分野においては、従来、酵素を水に溶解させて用いることが多い。この操作法では、タンパク質である酵素の溶解度に限界があり、ある一定濃度以上の酵素が高密度に存在すると、該酵素が、凝集を起こし、活性を失うことがしばしばである。一方、酵素反応を用いた反応系では、酵素の存在量が多いほど、反応速度、ひいては反応生成物の生産速度を高められることが、容易に予想される。
【0004】
その一方で、シリカ系メソ多孔体は、2〜50nmの直径の細孔を有することを特徴としており、その細孔内部への酵素の導入、固定が可能である。したがって、シリカ系メソ多孔体は、数nmから十数nmの大きさを有する酵素、すなわち、タンパク質の吸着、固定に対して、有効な表面を多く有している、有望な担体材料と見なすことができる。
【0005】
このようなシリカ系メソ多孔体を、酵素の固定化のための担体として使用した場合、ある一定濃度以上の高密度に存在する酵素の凝集を防ぐことが可能となり、活性を有する酵素の高集積化が可能となる。このことは、酵素を用いた反応系において、通常の酵素溶液においては、凝集を起こしてしまう量を越えて、酵素を存在させることが可能になることを意味すると考えられる。更には、酵素が容易に凝集を起こしてしまうpH領域においても、酵素が固定化されていることから、凝集を起こさないため、そのようなpH領域でも、反応系を構築できる可能性があると考えられる。
【0006】
一般に、担体に、酵素を固定化して用いることは、従前より行われてきたことであるが、その目的は、酵素の分離、及び再利用に関するものがほとんどである。例えば、従来の酵素を用いた生化学品、食品製造の技術分野においては、酵素を水に溶解させて用いることが多く、この操作法では、反応生成物と酵素の分離操作が必要不可欠であり、また、分離された酵素は、廃棄されることが一般的である。この酵素の分離工程を省く目的で、酵素を、担体に固定化して用いるための、酵素の固定化技術が盛んに開発されている。
【0007】
酵素の固定化法としては、例えば、酵素を、樹脂ビーズ等に直接固定化する方法や、酵素へのポリマーの被覆によるマイクロカプセル化、酵素タンパク質表面を修飾して安定化させる表面修飾法等が提案されている。しかしながら、これらの方法は、酵素が固定化担体の表面上に固定されているだけであり、酵素の高集積化や、固定化による酵素機能の向上を目指したものではない
【0008】
酵素の再利用を目的とした酵素の固定化も検討されているが、この方法の場合も、分離工程の排除を目的とした方法と大きな違いはなく、酵素の各種担体表面への単純な固定を行っているものが多い。酵素を、高分子発泡体に固定化する方法も用いられており、この場合は、発泡体を圧縮することにより、反応生成物を含む溶液を分離すること、等が行われている。
【0009】
酵素の固定化法の開発により、酵素を用いた生産プロセスにおいて、反応後の酵素の分離回収や、その再利用が可能となり、酵素の固定化が、酵素を用いた生産プロセスの効率化に貢献していることは事実である。しかし、酵素の固定化により、酵素の高集積化や、酵素機能そのものの向上を目的とした検討は、十分には行われていないのが実情である。
【0010】
このような状況の中で、本発明者らは、酵素の固定化により、酵素の高集積化や、酵素機能そのものの向上を目的として、酵素の担体として有望なシリカ系メソ多孔体への酵素、すなわちタンパク質の吸着・固定化現象を研究し(特許文献1参照)、この過程で、酵素、すなわちタンパク質のシリカ系メソ多孔体の細孔内への固定や、タンパク質の熱安定性や有機溶媒耐性の向上を見出し、シリカ系メソ多孔体を用いたタンパク質の機能賦活方法(特許文献1、及び非特許文献1)を開発するに至った。
【0011】
シリカ系メソ多孔体としては、一般に、MCM、FSM、SBAタイプ等の材料系が知られている。これらのシリカ系メソ多孔体は、2〜50nmの直径の細孔を有することを特徴とする。酵素、すなわちタンパク質は、数nmから十数nmの大きさを有しており、シリカ系メソ多孔体の有する細孔径と同程度の大きさの分布を有している。
【0012】
このことから、シリカ系メソ多孔体を、酵素の固定化担体として用いた場合、酵素を、表面のみならずシリカ系メソ多孔体の細孔内にも固定化することができ、シリカ系メソ多孔体の、酵素の固定化に対する有効な表面積が、従来の技術によるものより極めて大きくなり、シリカ系メソ多孔体に大量の酵素を固定化することが可能である。
【0013】
シリカ系メソ多孔体に、種々の酵素を固定化しようとする試みには、いくつかの報告がある(非特許文献2、3、4)。しかしながら、工業的な利用を想定した場合、種々の問題が未解決であると思われ、また、これらの報告では、光学異性の相互変換を触媒する酵素は、取り扱われた例がない。
【0014】
このような問題を解決するために、シリカ系メソ多孔体の表面に処理を加え、酵素との結合を形成する官能基を、シリカ系メソ多孔体の表面に形成される方法が報告された(非特許文献5)。しかしながら、ここで用いられている表面処理の方法は、極めて煩雑で、効率の悪いものであり、また、価格的にも利点が少ないものである。生化学品、食品製造の技術分野においては、簡便な方法で、酵素の固定化が行われることが望ましいことは言うまでもない。
【0015】
生体内のアミノ酸は、ほとんどがL形であり、D形は、ある種の生理活性ペプチドの構成成分として存在する。このことから、D形アミノ酸を含む物質が、医薬品、生化学品において、特異な性質を示し、ひいては有用な材料となることがしばしばである。それらの製造において、D形、L形のアミノ酸を任意に入手できる技術が需要であり、この反応に、光学異性の相互変換を触媒する酵素を利用することが有効である。
【0016】
すなわち、天然に存在するL形アミノ酸を、D形に変換したり、D形とL形の存在比率を変化させたりすることを効率的に進行させるには、光学異性の相互変換を触媒する多種多様な酵素の働きを利用することが重要である。このことは、工業的な医薬品、生化学品の製造において、シリカ系メソ多孔体−光学異性相互変換酵素複合体を利用、適用する上でも重要なことである。
【0017】
光学異性の相互変換を触媒する酵素以外の酵素を、シリカ系メソ多孔体に固定化した例としては、α−アミラーゼを、MCMもしくはSBAタイプのシリカ系メソ多孔体に固定化した例がある(非特許文献6)。しかしながら、光学異性の相互変換を触媒する酵素を固定化した例はほとんどなく、また、入手が容易ではない光学異性の相互変換を触媒する酵素は、繰り返し利用ができることが望ましく、多種多様なシリカ系メソ多孔体−光学異性相互変換酵素複合体の開発が望まれる。
【0018】
そのため、当該技術分野においては、シリカ系メソ多孔体において、その細孔内に、光学異性の相互変換を触媒する酵素を固定化することが可能であり、また、高度に集積化することも可能であるシリカ系メソ多孔体−光学異性相互変換酵素複合体、その製造方法及び該酵素の機能賦活技術を確立することが強く望まれていた。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】特開2007−51076号公報
【非特許文献】
【0020】
【非特許文献1】ChemBioChem,Vol.8(2007)668−674
【非特許文献2】J.Mol.Catal.B2(1996)115−126
【非特許文献3】J.Mol.Catal.B10(2000)453−469
【非特許文献4】J.Mol.Catal.B22(2003)119−133
【非特許文献5】Micropor.Mesopor.Mater.77(2005)67−77
【非特許文献6】J.Mol.Catal.B35(2005)154−160
【発明の概要】
【発明が解決しようとする課題】
【0021】
このような状況下において、本発明者らは、上記従来技術に鑑みて、光学異性の相互変換を触媒する酵素とシリカ系メソ多孔体とを複合化させた、シリカ系メソ多孔体−光学異性相互変換酵素複合体を開発することを目標として鋭意研究を行った結果、シリカ系メソ多孔体に、光学異性の相互変換を触媒する酵素を、吸着現象を利用して固定化させることで、その酵素が固定化され、シリカ系メソ多孔体−光学異性相互変換酵素複合体が形成されること、更に、このシリカ系メソ多孔体−光学異性相互変換酵素複合体を用いて、酵素反応及び酵素の繰り返し利用の特性評価を行い、固定化された酵素が、所定の活性を有していること、該酵素の繰り返し利用に対して高活性を維持し得ること及び高い再利用性を有すること等を見出し、本発明を完成するに至った。
【0022】
本発明は、アミノ酸等の光学異性を相互変換する際に、酵素の分離・回収を容易にし、繰り返し使用も可能とすると共に、基質を連続的に供給することで、光学異性の相互変換を連続的に進行させることができる、シリカ系メソ多孔体−光学異性相互変換酵素複合体を提供することを目的とするものである。また、本発明は、一般性、及び普遍性が高く、かつ簡単・簡略な操作による光学異性相互変換酵素を利用した連続生産技術を確立することを可能とするシリカ系メソ多孔体−光学異性相互変換酵素複合体を提供することを目的とするものである。
【課題を解決するための手段】
【0023】
上記課題を解決するための本発明は、以下の技術的手段から構成される。
(1)光学異性の相互変換を触媒する酵素とシリカ系メソ多孔体との複合体であり、シリカ系メソ多孔体へ固定化された酵素が、光学異性の相互変換を触媒する活性を有していることを特徴とする、シリカ系メソ多孔体−光学異性相互変換酵素複合体。
(2)光学異性の相互変換を触媒する酵素が、アミノ酸類に作用するラセマーゼ、ヒドロキシ酸類に作用するラセマーゼ、あるいは炭水化物及びその類縁体に作用するエピメラーゼであり、複合体が、当該酵素と、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体との複合体であり、光学異性相互変換反応に、繰り返して使用できる再利用性を有する、前記(1)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
(3)シリカ系メソ多孔体が、ケイ素と酸素を必須成分として含む化合物の多孔体である、前記(1)又は(2)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
(4)シリカ系メソ多孔体が、2〜50nmの直径の細孔を有する、前記(1)から(3)のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
(5)シリカ系メソ多孔体が、0.1〜3.5ml/gの全細孔体積を有する、前記(1)から(4)のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
(6)シリカ系メソ多孔体が、200〜1500m2の比表面積を有する、前記(1)から(5)のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
(7)シリカ系メソ多孔体と、光学異性の相互変換を触媒する酵素の溶解した溶液とを混合することにより、光学異性の相互変換を触媒する酵素を、シリカ系メソ多孔体に固定化することを特徴とする、シリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
(8)シリカ系メソ多孔体の中心細孔径を変えることにより、固定化される酵素の量と活性を制御する、前記(7)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
(9)シリカ系メソ多孔体に、酵素を固定化させる操作を繰り返すことにより、酵素の固定化量を制御もしくは増大する、前記(8)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
(10)シリカ系メソ多孔体が、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体あり、該メソ多孔体に、酵素を固定化することにより、該酵素の保存性を向上させたシリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する、前記(7)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
(11)シリカ系メソ多孔体が、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体あり、該メソ多孔体に、酵素を固定化することにより、該酵素の再利用性を向上させたシリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する、前記(7)に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
(12)前記(1)から(6)のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体からなり、機能性を有する酵素を、シリカ系メソ多孔体上、及び細孔内に、安定に吸着、保持させたことを特徴とする酵素固定化機能性部材。
【0024】
次に、本発明について更に詳細に説明する。
本発明は、シリカ系メソ多孔体−光学異性相互交換酵素複合体であって、光学異性の相互変換を触媒する酵素とシリカ系メソ多孔体との複合体であり、シリカ系メソ多孔体へ固定化された酵素が、光学異性の相互変換を触媒する活性を有していることを特徴とするものである。
【0025】
本発明では、光学異性の相互変換を触媒する酵素が、アミノ酸類に作用するラセマーゼ、ヒドロキシ酸類に作用するラセマーゼ、あるいは炭水化物及びその類縁体に作用するエピメラーゼであり、複合体が、当該酵素と、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体との複合体であり、光学異性相互変換反応に、繰り返して使用できる再利用性を有すること、シリカ系メソ多孔体が、2〜50nmの直径の細孔を有すること、シリカ系メソ多孔体が、0.1〜3.5ml/gの全細孔体積を有すること、シリカ系メソ多孔体が、200〜1500m2の比表面積を有すること、を好ましい実施の態様としている。
【0026】
また、本発明は、上記シリカ系メソ多孔体−光学異性相互交換酵素複合体を製造する方法であって、シリカ系メソ多孔体と酵素の溶解した溶液とを混合することにより、光学異性の相互変換を触媒する酵素を、シリカ系メソ多孔体に固定化することを特徴とするものである。本発明では、シリカ系メソ多孔体の中心細孔径を変えることにより、固定化される酵素の量や活性を制御すること、シリカ系メソ多孔体に酵素を固定化させる操作を繰り返すことにより、固定化量を制御もしくは増大すること、を好ましい実施の態様としている。
【0027】
更に、本発明は、酵素固定化機能性部材であって、上記シリカ系メソ多孔体−光学異性相互変換酵素複合体からなり、機能性を有する酵素を、シリカ系メソ多孔体上、及び細孔内に、安定に吸着、保持させたことを特徴とするものである。
【0028】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体を構成するシリカ系メソ多孔体としては、MCM、FSM、SBAタイプ等の材料系が用いられる。これらの材料系は、その作製法の違いにより分類されるが、基本的構造は、類似したものである。MCMやFSMタイプのメソ多孔体は、カチオン性界面活性剤を用いて形成されるミセルを鋳型として合成される。FSMタイプは、層状化合物であるカネマイトを原料として合成される。一方、SBAでは、中性の非イオン性界面活性剤のブロックコポリマーを用いて形成されるミセルを鋳型としている。
【0029】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体では、このような複数のタイプのシリカ系メソ多孔体が、光学異性の相互変換を触媒する酵素の固定用担体として使用される。しかし、基本的には、シリカ系メソ多孔体の構造を持つものであって、同様の機能・能力を有している限り、全て使用可能であり、シリカ系メソ多孔体−光学異性相互変換酵素複合体を構成するシリカ系メソ多孔体としては、上述のタイプのものに限定されるものではない。
【0030】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体の作製に際しては、合成されたシリカ系メソ多孔体に対し、特段の表面処理を施すことなく、洗浄の操作のみを行ったものを用いることが可能である。光学異性の相互変換を触媒する酵素を、シリカ系メソ多孔体に固定する操作は、光学異性の相互変換を触媒する酵素を溶解した溶液中に、当該シリカ系メソ多孔体を浸漬・混合する操作のみにより行われ、これらの操作自体は、極めて簡便で、単純な方法である。この場合、シリカ系メソ多孔体に対する表面処理は、必ずしも必要ではない。
【0031】
しかしながら、シリカ系メソ多孔体−光学異性相互変換酵素複合体を構成するシリカ系メソ多孔体の、酵素に対する固定化の機能・能力は、基本的には、シリカ系メソ多孔体と酵素との間の吸着現象で発揮される。その際には、シリカ系メソ多孔体表面と酵素との間の親和性が重要となる上に、また、酵素の吸着は、その分散溶媒、分散溶媒中での酵素安定性、更には、分散溶媒のpH等で影響されることが多い。
【0032】
したがって、対象とする酵素及びそれを含む溶液の成分状況に応じて、本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、それを構成するシリカ系メソ多孔体の表面の状態で、酵素に対する固定化の機能・能力が変わることがある。例えば、シリカ系メソ多孔体の表面に残るシラノール基は、反応性が高いため、酵素に対する固定化の機能・能力に悪影響を与えることが多い。そこで、上記複合体を、シラン処理によりシラノール基が不活性化もしくは減らされたシリカ系メソ多孔体で構成することが好ましい。
【0033】
本発明では、シリカ系メソ多孔体−光学異性相互変換酵素複合体の作製に際し、シリカ系メソ多孔体に表面処理を施すことは、適宜可能であるが、その表面処理の有無、処理の方法等は特に限定されるものではない。シリカ系メソ多孔体表面に形成されるべき官能基としては、固定化する酵素との親和性を確保できる官能基、例えば、アルコキシ基、オクタデシル基、オクチル基、フェニル基、ニトリル基、アミノ基、メルカプトプロピル基、チオール基等が挙げられる。これらは、基本的には、シリカ系メソ多孔体の表面に形成可能な官能基であれば良く、ここに例示した官能基に限定されるものではない。
【0034】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体を構成する元素は、一般には、ケイ素と酸素であるが、ケイ素の一部が他の元素に置換したシリカ系メソ多孔体も、酵素の固定化機能を有する限り、使用することができる。シリカ系メソ多孔体を構成するケイ素と置換可能な元素の典型としては、例えば、アルミニウム、ホウ素、燐、ガリウム、ニオブ、チタン、錫、鉄、コバルト、銅、ニッケル、亜鉛、クロム、バナジウム、マンガン、ジルコニウム、タンタル、ハフニウム等が挙げられる。
【0035】
しかし、これらに留まるものではなく、基本的に、シリカ系メソ多孔体の構造を破壊しないものであれば、いずれでも良い。また、その置換量に関しても、シリカ系メソ多孔体の構造を破壊しない量であれば、置換量は、いかなる量でも良く、これらの置換シリカ系メソ多孔体も、酵素固定化用の担体として使用することが可能である。
【0036】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体を構成するシリカ系メソ多孔体は、いずれも、熱安定性、化学安定性に優れており、しかも、環境に対する負荷が低い物質であるので、本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、例えば、生化学品製造、医薬品製造にとって極めて有用であり、その技術的並びに経済効果は、非常に優れたものと言える。
【0037】
シリカ系メソ多孔体は、一般には、数nmの細孔径を有する。そして、その細孔径は、シリカ系メソ多孔体の合成条件により制御することが可能である。例えば、固定化すべき酵素が5nmの大きさを有していた場合、その酵素の大きさに相応した細孔径を有するシリカ系メソ多孔体を合成して、酵素固定化用担体として用いる選択肢があり、それにより、酵素の固定量を増加させたり、酵素の安定性を向上させたりすることが可能である。
【0038】
本発明において、シリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する際には、シリカ系メソ多孔体の細孔径を制御することが不可欠である。本発明では、シリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する際に、シリカ系メソ多孔体の細孔径を制御することで、好適なシリカ系メソ多孔体−光学異性相互変換酵素複合体を作製し、提供することが可能である。
【0039】
本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体では、光学異性の相互変換を触媒する酵素として、アミノ酸類に作用するラセマーゼ、ヒドロキシ酸類に作用するラセマーゼ、炭水化物及びその類縁体に作用するエピメラーゼを用いることができる。しかし、基本的には、光学異性の相互変換を行う酵素であれば、どのような種に由来するものでも良く、ここに例示した酵素に限定されるものではない。
【0040】
本発明では、いずれの酵素を用いた場合であっても、シリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する際に、シリカ系メソ多孔体の細孔径を制御すること、及び、シリカ系メソ多孔体表面上の官能基を制御すること、が重要である。本発明では、選択された酵素に対して、シリカ系メソ多孔体に対して、最適ないし好適化の処理を施すことが重要である。
【0041】
本発明は、例えば、酵素を利用した生化学品、医薬品、食品製造の技術分野において、酵素の安定性や耐久性、生産速度の向上等により、連続的生産手法を構築することを可能とすると共に、反応生産物からの酵素の分離工程を排除することを可能とするものであり、その工程を、従来技術に比べ、大幅に効率化、簡略化することができるものである。
【0042】
本発明では、シリカ系メソ多孔体の細孔への光学異性相互変換酵素の吸着条件、操作方法の具体的な構成は特に限定されるものではなく、固定化すべき酵素に応じて任意に設計することができる。本発明においては、シリカ系メソ多孔体−光学異性相互変換酵素複合体は、単に、シリカ系メソ多孔体にラセマーゼを固定化しただけのものではない。
【0043】
本発明では、これらのシリカ系メソ多孔体とラセマーゼとを複合化することにより、通常の固定化酵素の場合と比較して、1)高い酵素作用が維持できること、2)その耐熱性を向上させることができること、3)酵素の繰り返し利用による活性の低下が抑制できること、更に、4)酵素の回収を容易にできること、等の、従来の技術常識からは予期し得ない、かつシリカ系メソ多孔体とラセマーゼとを組み合わせた場合に特異的に生起される格別の作用効果を得ることを可能とするものであり、これらは、後記する実施例で、具体的かつ詳細に示したように、格別の実験をしてはじめて実証し得たものである。
【0044】
更に、後記する実施例に記載されるように、酵素の保存性についての評価を行うために、シリカ系メソ多孔体−光学異性相互変換酵素複合体の酵素活性測定において、例えば、酵素活性の測定に用いたものと同様のGeoRacAが固定化された試料を20mM リン酸カリウム(pH 7.5),50mM KCl溶液中にて、4℃で4ヶ月間保存し、比較のため、シリカ系メソ多孔体に固定化されていない溶液に分散した状態のGeoRacAも4℃で4ヶ月間保存し、両者のそれぞれ2μgを、2.5mlの10mM リン酸カリウム(pH7.5),3mM L−アラニンを含む溶液に添加し、30℃で204nmのCDの変化を3分間測定し、活性を評価した。
【0045】
両者の活性評価の結果、溶液に分散した状態のGeoRacAは、4ヶ月保存することによって、14%しか活性を保持していなかったが、シリカ系メソ多孔体に固定化されたGeoRacAは94%の活性を保持していた。このことは、シリカ系メソ多孔体−光学異性相互変換酵素複合体が酵素の保存性を確保していることを示しているものであり、酵素を一時的に保存し、再利用する等の実使用上の利便性は計り知れない。
【発明の効果】
【0046】
本発明により、以下のような効果が奏される。
(1)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることで、反応系中に、高濃度に酵素を存在させることが容易に達成できる。
(2)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることにより、通常の酵素反応溶液の場合と比較して、酵素濃度が高くても、酵素の凝集を生じさせることなく、酵素反応を進行させることが容易である。
(3)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることにより、溶液中に分散した状態の酵素では、容易に凝集を起こしてしまうpH領域においても、酵素の凝集を生じさせることなく、酵素反応を進行させることが容易である。
(4)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることにより、酵素の安定性が向上し、酵素の耐熱性が増大することから、反応温度を上昇させることができ、酵素を失活させることなく、酵素反応を進行させることが容易である。
(5)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることにより、酵素の回収が容易である。
(6)シリカ系メソ多孔体に、光学異性相互変換酵素が固定化されていることにより、酵素の繰り返し使用が可能である。
【0047】
(7)アミノ酸や糖類の光学異性の相互変換に際し、原料の性状や特性に応じて最適ないし好適な酵素を選択して、その酵素を用いたシリカ系メソ多孔体−光学異性相互変換酵素複合体を、固定化酵素として利用することができる。
(8)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体を用いることで、多種多様なアミノ酸や糖類原料を対象として、酵素反応により光学異性の相互変換が施されたアミノ酸類や糖類を生成させることができる。
(9)光学異性の相互変換を触媒する酵素として、アミノ酸類に作用するラセマーゼ、ヒドロキシ酸類に作用するラセマーゼ、炭水化物及びその類縁体に作用するエピメラーゼを用いることができ、これらの酵素を固定化した、シリカ系メソ多孔体−光学異性相互変換酵素複合体を提供することができる。
【0048】
(10)シリカ系メソ多孔体の、酵素の導入可能な細孔径を制御することで、酵素の吸着可能な表面を大きくして、酵素の高集積化が可能になる。
(11)シリカ系メソ多孔体へ、酵素の固定化を繰り返すことにより、より多量な酵素を固定化することが可能である。
(12)高集積化された酵素を、反応系中に存在させることができるため、酵素反応を、より効率的に進めることができる。
(13)酵素の凝集を避けることができるため、酵素を、溶液に溶解した状態よりも高濃度に反応系中に存在させることが可能となり、酵素反応を、より効率的に進めることが可能である。
(14)酵素が溶液中に分散した状態では、容易に凝集を起こしてしまうpH領域においても、酵素の凝集を生じさせることなく、酵素反応を進行させることが可能である。
(15)酵素の安定性が向上し、酵素の耐熱性が増大することから、反応温度を上昇させることができ、酵素を失活させることなく、酵素反応を進行させることが可能となる。
【0049】
(16)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体では、酵素の回収が容易であり、酵素の繰り返し使用が可能であり、基質を連続的にシリカ系メソ多孔体−光学異性相互変換酵素複合体と接触して流通させ、連続的な酵素反応の実施が可能である。
(17)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、環境に負荷の少ない材料系で構成され、作製原材料は、入手しやすく、作製方法が簡単で、安価である。
(18)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、適切な溶液による処理で官能基を形成することで、固定化される酵素の量や、固定化状態を制御することができる。
(19)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、その作製条件の制御により、シリカ系メソ多孔体の中心細孔径を変えることが可能であり、それにより、固定化される酵素の量や、活性を制御することができる。
(20)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体は、その作製条件の制御により、シリカ系メソ多孔体の中心細孔径を変えることが可能であり、それにより、固定化される酵素の安定性や、耐久性を向上させることができる。
(21)上記の効果を組み合わせて利用することにより、新規の光学異性の相互変換プロセスを確立することができる。
(22)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体では、固定化された酵素の保存性が確保されるため、酵素を固定化して長期間保存した後でも使用することが可能である。
(23)本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体では、固定化された酵素の保存性が確保されるため、酵素の繰り返し使用時に反応を一時停止して、酵素を一時的に保存し、再利用することも可能である。
【図面の簡単な説明】
【0050】
【図1】図1は、シリカ系メソ多孔体への光学異性相互変換酵素の吸着等温線を示す。
【図2】図2は、シリカ系メソ多孔体へ固定化されたGeoRacAと溶液中に自由に存在するGeoRacAの耐熱性の評価結果を示す。
【図3】図3は、シリカ系メソ多孔体へ固定化されたGeoRacAの繰り返し使用の評価結果を示す。
【図4】窒素吸着/脱着等温線及びFSMの細孔径分布を示す。図中、(A)は、窒素吸着/脱着等温線:FSM−4吸着(▲)、FSM−4脱着(△)、FSM−8.5吸着(■)、FSM−8.5脱着(□)、(B)は、細孔径分布:FSM−4(▲)、FSM−8.5(■)。等温線はNOVA3000分析器を用いて測定した。細孔径分布は、BJH法を用いて決定した。試料は、真空下で、200℃、3時間、前処理(脱ガス等)を行った。
【図5】試料(1μg)は、5−12%ポリアクリルアミドの濃度勾配による電気泳動で分離し、ゲルは、Bio−Safe Coomassie Stainで染色した。
【図6】FSM−4(▲)及びFSM−8.5(■)上でのGeoRacAの吸着等温線を示す。GeoRacA(1mL)の各種濃度を、10mgのFSMに、4℃で、24時間吸着させ、上清の蛋白質濃度を測定した。
【図7】フリー及びFSM−固定化GeoRacAの熱安定性を示す。フリー(■)又はFSM−固定化(▲)GeoRacA(0.2mg/mL)を、80℃で、所定時間インキュベートし、残存する活性を測定した。比活性は、熱処理していない試料の活性に対して計算した。
【図8】GeoRacAの静電気表面ポテンシャル(図中、赤に相当する薄い部分はマイナス、青に相当する濃い部分はプラス)を、GRASP2プログラムを用いて計算した。
【図9】FSM−固定化GeoRacAの再利用を示す。各サイクルで、FSM−固定化GeoRacA(4μgの蛋白質)を、30℃で、1分間、3mM L−Ala(3.5mL)でインキュベートし、D−Alaの濃度を測定した。数値は、最初のサイクルでの活性を100%とした場合の比活性として示したものである。
【発明を実施するための形態】
【0051】
次に、実施例に基づいて本発明を具体的に説明するが、本発明は、以下の実施例によって何ら制約を受けるものではない。
【実施例1】
【0052】
本実施例では、シリカ系メソ多孔体−光学異性相互変換酵素複合体を合成した。
(1)シリカ系メソ多孔体の合成1
シリカ系メソ多孔体のうち、まず、FSMタイプに属するシリカ系メソ多孔体の作製法を示す。カチオン性界面活性剤である塩化ベヘニルトリメチルアンモニウムを主成分とし、エチルアルコールとの混合物である界面活性剤(アーカード、ライオン株式会社製)8gを、超純水100gに混合し、70℃で、30分間、撹拌混合した。
【0053】
この撹拌混合には、ホモミキサーを用いた。別途、カネマイト(プリフィード、トクヤマシルテック株式会社製)5.336gを、超純水104.7gと混合し、70℃で、撹拌混合した。シリカ系メソ多孔体の細孔径を制御する目的で、要する場合に、膨張剤として、トリイソプロピルベンゼンを添加した。
【0054】
この撹拌混合には、マグネチックスターラーを用いた。それぞれの溶液の所定の撹拌時間を経た後、両者を混合し、更に、70℃で、2時間、ホモミキサーを用いて、撹拌混合した。この撹拌混合の後、2規定の塩酸を、約1時間かけて滴下し、溶液の状態をpH8.5とした。溶液のpHが8.5となった後、更に、3時間、撹拌混合した。
【0055】
この溶液を、吸引濾過した後、分離された固形物を、70℃の温水に再分散し、更に、濾過を繰り返した。この操作を3回繰り返した後、固形物を、60℃で、24時間、乾燥した。更に、空気気流中において、550℃で、6時間焼成することにより、各種の細孔径を有するシリカ系メソ多孔体を得た。
【0056】
上記手法により合成されたシリカ系メソ多孔体について、粉末X線回折法、走査電子顕微鏡法、透過電子顕微鏡法、及び窒素吸着等温線の測定を適用した。粉末X線回折法は、Bruker製AXS D8−ADVANCE Vario−1を用いて実施した。得られたX線回折パターンより、上記手法により作製されたシリカ系メソ多孔体は、2次元ヘキサゴナルの細孔配列構造を有していることが分かった。また、回折ピーク位置の解析から、合成時、膨張剤を用いなかった場合のシリカ系メソ多孔体に比較して、膨張剤を用いた場合のシリカ系メソ多孔体の方が、シリカ系メソ多孔体の細孔径が大きくなっていることが確認された。
【0057】
走査電子顕微鏡による観察から、合成されたシリカ系メソ多孔体は、不定形顆粒状の形態として観察された。また、透過電子顕微鏡による観察から、合成時に、膨張剤を用いなかった場合のシリカ系メソ多孔体では、4nm径の細孔が分布していることが確認された。膨張剤として、トリイソプロピルベンゼンを4.5ml添加した場合のシリカ系メソ多孔体では、7.5nm径の細孔が分布していることが確認され、また、膨張剤として、トリイソプロピルベンゼンを6ml添加した場合のシリカ系メソ多孔体では、8.5nm径の細孔が分布していることが確認された。
【0058】
窒素吸着等温線の測定は、Quantachrome社製Autosorbによって行った。測定の結果から、膨張剤の添加量に依存して、異なる吸着等温線が得られた。吸着等温線の解析から、細孔径分布等を知ることは容易である。測定の結果、合成時に、膨張剤を用いなかった場合のシリカ系メソ多孔体では、4nm径の細孔が分布していることが確認された。膨張剤として、トリイソピルベンゼンを4.5ml、及び6ml添加した場合のシリカ系メソ多孔体の場合では、それぞれ7.5nm,8.5nm径の細孔が分布していることが確認された。
【0059】
以下、合成時に、膨張剤を用いなかった場合の、4nm径に細孔径分布のピークを持つシリカ系メソ多孔体を「FSM−4」と表記し、膨張剤として、トリイソピルベンゼンを4.5ml添加して合成した場合の、7.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体を「FSM−7.5」と表記し、同じく、膨張剤として、トリイソピルベンゼンを6ml添加して合成した場合の、8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体を「FSM−8.5」と表記する。
【0060】
(2)シリカ系メソ多孔体の合成2
次に、シリカ系メソ多孔体のうち、SBAタイプに属するシリカ系メソ多孔体の作製法を示す。中性の非イオン性界面活性剤のブロックコポリマー[poly(ethylene glycol)−block−poly(propylene glycol)−block−poly(ethylene glycol)](分子量:〜5800、EO:PO:EO=20:70:20)12gを、超純水449mlに混合し、更に、これに、35%の塩酸20mlを加えて、35℃で、一晩、撹拌混合した。
【0061】
その後、シリカ源として、TEOS(Tetraethly Orthosilicate)を27.4ml加え、35℃で、20時間、撹拌混合した。この撹拌混合には、マグネチックスターラーを用いた。この反応液を、オートクレーブ容器に装填し、35,75,100,130℃の各温度で、24時間静置した。この溶液を、吸引濾過した後、60℃で、24時間、乾燥した。更に、空気気流中において、550℃で、6時間焼成することにより、各種の細孔径を有するシリカ系メソ多孔体を得た。この合成法によるSBAは、P6mm構造のSBAであった。オートクレーブ容器の保持温度により、細孔径が制御された。
【0062】
Ia3d構造のSBAを合成するために、中性の非イオン性界面活性剤のブロックコポリマー[poly(ethylene glycol)−block−poly(propylene glycol)−block−poly(ethylene glycol)](分子量:〜5800、EO:PO:EO=20:70:20)12gを、超純水434mlに混合し、更に、これに、35%の塩酸20mlを加えた。しばらく撹拌混合した後、これに、ブタノール14.8mlを加えて、35℃で、一晩、撹拌混合した。
【0063】
その後、シリカ源として、TEOS(Tetraethly Orthosilicate)を27.4ml加え、35℃で、20時間、撹拌混合した。この撹拌混合には、マグネチックスターラーを用いた。この反応液を、オートクレーブ容器に装填し、35,75,100,130℃の各温度で、24時間静置した。この溶液を、吸引濾過した後、60℃で、24時間、乾燥した。更に、空気気流中において、550℃で、6時間焼成することにより、各種の細孔径を有するシリカ系メソ多孔体を得た。
【実施例2】
【0064】
(1)光学異性相互変換酵素ラセマーゼの準備
ラセマーゼのクローニングは、以下の手順により行った。
準備したラセマーゼは、以下のものである。
・Bacillus subtilis グルタミン酸ラセマーゼ(BsRacE)
・Lactobacillus fermenti グルタミン酸ラセマーゼ(LfRacE)
・Geobacillus stearothermophilus アラニンラセマーゼ(GeoRacA)
・Pyrococcus horikoshiiOT3 アスパラギン酸ラセマーゼ(PhRacD)
【0065】
それぞれの遺伝子の入手は、以下により行った。
Bacillus subtilis菌体は、納豆(おかめ納豆、タカノフーズ株式会社製)より単離した。Geobacillus stearothermophilus菌体(NBRC12550)、Lactobacillus fermenti菌体(NBRC3071)、及びPyrococcus horikoshiiOT3 アスパラギン酸ラセマーゼ遺伝子を含むゲノムDNAクローン(S2LA209)は、独立行政法人製品評価技術基盤機構バイオテクノロジー本部より購入した。
【0066】
PCRプライマーとしては、それぞれ、以下のものを用いた。
1)BsRacA:
・ N−terminal 5‘−AGAGACATATGGAACAACCAATAGGAGTCATTGATTCC
・ C−terminal 5‘−GAGACTCGAGCTATCTTTTAATCGGTTCTTGCAGTGAGAT
【0067】
2)LfRacE:
・ N−terminal 5‘−AGAGACATATGGACAATCGCCCAATTGGAGTGA
・ C−terminal 5‘−GAGACTCGAGTTAATCCCCCTCTTCAATTTGGGCGGT
【0068】
3)GeoRacA:
・ N−terminal 5‘−AGAGACATATGAACGACTTTCATCGCGATACGTG
・ C−terminal 5‘−GAGACTCGAGTGAAGCAGATTATGCACTGCTTTCCC
【0069】
4)PhRacD:
・ N−terminal 5‘−GAGACATATGAAAACGATAGGTATACTTGGTG
・ C−terminal 5‘−GAGACTCGAGTTACTTTTCTAATGCAACCTTAACG
【0070】
(2)ラセマーゼ遺伝子のクローニング方法
次に、ラセマーゼ遺伝子をクローニングする方法を示す。各バクテリア菌体のラセマーゼの全長遺伝子に、上記PCRプライマーを使用し、iProof High−Fiderity DNA Polymerase(バイオラッド社製)により、遺伝子の増幅を行った。鋳型として、BsRacE,LfRacE,GeoRacAは、それぞれの菌体より、ゲノムDNAを抽出したものを使用し、PhRacDについては、ゲノムDNAクローン(S2LA209)を用いた。
【0071】
PCR反応の後、増幅されたDNAの末端を、ゲル精製した後、ポリヌクレオチドキナーゼにより、リン酸化した。これらのインサートを、pBluescript IIベクター(ストラタジーン)のEcoRV部位に挿入し、大腸菌TOP10株(インビトロジェン社製)にトランスフォームして培養した後、クローンを回収した。得られたクローンは、ダイデオキシ法により、DNA配列の確認を行った。
【0072】
次に、正しい配列のラセマーゼ遺伝子を、制限酵素NdeI、及びXhoIで切断し、発現ベクターpET28b(Novagen、ノバジェン社製)のNdeI−XhoI部位に挿入することにより、組換えタンパク質のアミノ酸末端に、6xHisタグを有する発現プラスミドを作製した。これを、TOP10株にトランスフォームし、プラスミドを回収した。
【0073】
更に、アミノ酸末端側のDNA配列を確認して、フレームが正しいことを確認した後、BsRacE,LfRacE,GeoRacAは、発現用大腸菌BL21star(DE3)株(インビトロジェン社製)に、PhRacDは、Rosetta2(DE3)株(ノバジェン社製)にトランスフォームした。得られたコロニーから、小スケールで培養を行い、タンパク質の発現を確認した。
【0074】
(3)ラセマーゼの大量発現
発現の確認されたクローンについて、シングルコロニーを、30mlの1.5%グルコース及び50μg/mlのカナマイシンを含むTurbo Broth(モレキュラーディメンジョン社製)で、37℃において、一晩、振盪培養した。このうちの15mlもしくは20mlを、1.5Lもしくは2Lの上記培地に移し、37℃で、OD600が0.6になるまで振盪培養した。
【0075】
次に、最終濃度1mMのIsopropyl−β−D−1−thiogalactoside(IPTG)を加え、更に、37℃で、4時間、もしくは20℃で、10〜20時間振盪培養することにより、ラセマーゼを発現させた。7500×gで、4℃、5分間遠心し、菌体を回収した。菌体を、80mlのCell lysis buffer[20mM Tris−HCl(pH7.5),500mM NaCl]に懸濁した後、液体窒素で凍結させ、−80℃で保存した。
【0076】
(4)ラセマーゼの精製
−80℃で保存していた菌体を溶解した後、最終濃度1mM Phenylmethyl−sulfonyl fluoride (PMSF),10μg/ml PepstatinA,10mM 2−mercaptoethanol(2−ME)及び1mg/mlリゾチームを加え、氷上で、1時間静置した。次に、S−250ソニファイアー(ブランソン社製)を使用して、超音波処理を行い、菌体を破砕した。100000×gで、4℃、40分間遠心して、上清を回収し、0.45μmフィルターでろ過して、クルードサンプルを得た。
【0077】
クルードサンプルを、Aバッファー[20mM リン酸カリウム(pH7.5),500mM KCl,10mM imidazole]で平衡化したHis−Trap HP カラム(5ml×2本連結,GEヘルスケアバイオサイエンス社製)に通して、ラセマーゼを吸着させた。次に、Aバッファーで、カラムを洗浄後、Bバッファー[20mM リン酸カリウム(pH7.5),500mM KCl,500mM imidazole]の0%から100%のグラジエントをかけて、ラセマーゼを溶出させた。尚、上記の操作は、AKTA10S中圧クロマトグラフィー装置(GEヘルスケアバイオサイエンス社製)を用いて行った。
【0078】
各フラクションのSDS−PAGEを行い、ラセマーゼを含むフラクションを集めた。集めたフラクションを、透析バッファー(ピアス)に入れ、2Lの透析バック[20mM リン酸カリウム(pH7.5),50mM KCl]で、4℃において、一晩透析した。透析後、サンプルを、Amicon Ultra−15MWCF10000(ミリポア社製)を用いて、タンパク質濃度約5〜10mg/mlに濃縮した。タンパク質濃度は、Protein Assay Kit(バイオラッド社製)を使用して、γ−グロブリンをスタンダードとして、測定した。
【0079】
また、活性測定を行って、ラセマーゼ活性を保持していることを確認した。活性測定法として、基質溶液[BsRacEについては、20mM リン酸カリウム(pH8.0),1mM L−グルタミン酸、LfRacAについては、20mM リン酸カリウム(pH8.0),2mM L−グルタミン酸、GeoRacAについては、10mM リン酸カリウム(pH7.5),3mM L−Amino acidアラニン]に濃縮したサンプルを加え、30℃で、204nmの円二色性の変化を、J−820円二色性分散計(日本分光社製)を用いて測定することにより、評価した。
【0080】
(5)シリカ系メソ多孔体−光学異性相互変換酵素複合体の作製
光学異性の相互変換を触媒する酵素の固定化用担体として用いたシリカ系メソ多孔体を、以下に示す。また、表1に、各種シリカ系メソ多孔体の表記法、メソ多孔体の分類合成時設定温度[℃]、窒素吸着による細孔径[nm]を示す。
・P6mm構造のSBA4種:窒素吸着による細孔径が、6.2nm、6.7nm、8.0nm、11.1nmのシリカ系メソ多孔体。
・Ia3d構造のSBA4種:窒素吸着による細孔径が、6.1nm、6.7nm、9.9nm、11.0nmのシリカ系メソ多孔体。
・FSMタイプのもの3種:窒素吸着による細孔径が、4nm、7.5nm、8.5nmのシリカ系メソ多孔体。
【0081】
【表1】

【0082】
光学異性の相互変換を触媒する酵素としては、BsRacE,LfRacE,GeoRacA,PhRacDのラセマーゼを用いた。本実施例では、代表例として、ラセマーゼとして、GeoRacAを用い、シリカ系メソ多孔体として、細孔径が4nmであるFSM(FSM−4と表記)と、細孔径が8.5nmであるFSM(FSM−8.5と表記)を用いた。尚、その他のラセマーゼ、及びシリカ系メソ多孔体を用いた場合についても、以下に示す同様の実験を行って、同様の結果を得ている。表2に、シリカ系メソ多孔体−光学異性相互変換酵素複合体の酵素活性評価用に用いたシリカ系メソ多孔体の特性を示す。これら2種のシリカ系メソ多孔体の特性は、窒素吸着等温線の測定結果、及びその結果の解析から、表2のようにまとめられる。
【0083】
【表2】

【0084】
1.[20mM リン酸カリウム(pH 7.5),50mM KCl]のバッファーを使用し、該バッファーに溶かした各種濃度のGeoRacA溶液1mlと、10mgのメソポーラスシリカを混合し、4℃で、一晩、転倒混和した。
2.これを遠心して、上清を除いた。
3.上清に遊離してきたGeoRacAを定量することで、吸着したGeoRacA量を算出し、それぞれの濃度における吸着量を算出した。
【0085】
その結果を、図1に示す。図1は、シリカ系メソ多孔体への光学異性相互変換酵素の吸着等温線をまとめたものである。その結果、FSM−8.5に対する吸着量の方が、FSM−4に対する吸着量よりも多いことが分かった。これは、GeoRacAの大きさが、8.2×5.2×4.2nmであることから、GeoRacAが、FSM−8.5の細孔内に、より容易に入り込むためと理解できる。
【0086】
酵素活性を評価するための、シリカ系メソ多孔体−光学異性相互変換酵素複合体の作製は、以下の手順により行った。FSM−8.5、30mgに対して、適当なバッファーに溶解した1.26mgのGeoRacAを混ぜ、4℃で、24時間、ゆっくりと回転振盪した。このGeoRacAの量は、全量吸着する量に設定されるようにした。
【0087】
遠心分離により、固定化された酵素、すなわち、シリカ系メソ多孔体−光学異性相互変換酵素複合体を分離回収し、20mM リン酸カリウム(pH7.5)、50mM KCl溶液で、3回以上洗浄し、酵素量が0.2mg/mlとなるように、懸濁状態のシリカ系メソ多孔体−光学異性相互変換酵素複合体を含む溶液を得た。
【0088】
(6)酵素の固定化状態の評価
上記の懸濁状態のシリカ系メソ多孔体−光学異性相互変換酵素複合体を含む溶液を、乾燥させて粉末とし、窒素吸着等温線の測定を行った。Quantachrome社製Autosorbを用いて行った測定の結果、メソ孔内に酵素が取り込まれ、細孔体積が減少していることが確認された。
【0089】
(7)シリカ系メソ多孔体−光学異性相互変換酵素複合体の酵素活性測定
GeoRacAは、アラニンの光学異性相互変換を触媒する酵素である。その活性は、アラニンの光学活性相互変換を測定することにより行った。L−アラニン、D−アラニンは、それぞれ、23.0及び−23.0mdeg/cm/mMの旋光性を示す。L−アラニンからD−アラニンへの変換、もしくはその反対の変換により、旋光性が変化する。その変化を、204nmの円二色性の変化を、J−820円二色性分散計(日本分光社製)を用いて測定することにより、評価した。
【0090】
実際の測定手順は、以下のようにした。
1.10mMのリン酸カリウム(pH7.5)の溶液に、L−アラニン、D−アラニンがそれぞれ、0.5,1.0,2.0,3.0,4.0,5.0,6.0,8.0,10.0mM入った各種溶液を用意した。
【0091】
2.FSM−8.5に固定化されたGeoRacAと、溶液中に分散しているGeoRacAの、それぞれ2μgを、上記1の各種溶液のそれぞれ2.5mlに、30℃にて、混ぜた。
3.次いで、204nmの円二色性の変化を測定した。
【0092】
その結果を、図2に示す。この結果を元にして、最大酵素反応速度(Vmax)と、Vmaxの半分の速度を示す時の基質の濃度(Km)値を、グラフ解析ソフトウエアを用いて算出した。その算出結果を、表3に示す。表3は、シリカ系メソ多孔体へ固定化されたGeoRacAと溶液中に自由に存在するGeoRacAの酵素活性評価をまとめたものである。
【0093】
Km値を比較すると、FSM−8.5に固定化されたGeoRacAの方が、少し大きな値を示している。一方、Vmax値は、溶液に分散したGeoRacAの方が、大きい。このことは、メソ孔内に固定化されている酵素の方が、基質との接触割合が低くなることから、容易に予想されることである。一般的に、固定化された酵素は、Km値は高く、Vmax値は低くなる傾向が知られている(非特許文献6)。更に、基質に対する酵素の作用効率の指標として、Vmax/Kmの値が用いられることがあり、この数値が高いほど、酵素の作用が高いことを示す。
【0094】
表2に示されるように、GeoRacAの場合、FSM−8.5に固定化されても、51%のVmax/Kmの値を示しており、一般的な固定化酵素が30%以下の数値になるのに比較して、高い数値を維持していることが分かる。このことは、本発明のシリカ系メソ多孔体−光学異性相互変換酵素複合体が、一般的な固定化酵素の場合と比較して、非常に酵素作用が高く、優れたものであることを示していることに他ならない。
【0095】
【表3】

【0096】
(8)シリカ系メソ多孔体−光学異性相互変換酵素複合体の熱安定性の評価
酵素を工業的な製造プロセスに用いる場合、その耐熱性の向上は、非常に重要な因子である。シリカ系メソ多孔体−光学異性相互変換酵素複合体を構成した酵素が、溶液中に自由に分散しているときに比較して、熱安定性が向上しているかどうかを評価した。その結果を、図2に示す。図2は、シリカ系メソ多孔体へ固定化されたGeoRacAと溶液中に自由に存在するGeoRacAの耐熱性の評価結果をまとめたものである。評価は、シリカ系メソ多孔体−光学異性相互変換酵素複合体を構成した酵素と、溶液中に自由に分散している状態の酵素を、それぞれ80℃に保持した後、どの程度の酵素活性を有しているかを見る方法により行った。
【0097】
本実施例では、GeoRacAを、酵素として用い、シリカ系メソ多孔体として、FSM−8.5を用いた。その結果は、溶液中に自由に分散した酵素の場合、80℃に、10分間保持することで、酵素活性は、60%に減少した。一方、シリカ系メソ多孔体−光学異性相互変換酵素複合体を構成した酵素の場合、80℃、10分間の保持では、100%の酵素活性を示した。80℃に、60分間保持しても、50%の活性を有していた。このことは、シリカ系メソ多孔体−光学異性相互変換酵素複合体が、酵素の耐熱性を大幅に向上させる効果を有していることを示している。
【0098】
(9)酵素の繰り返し利用についての評価
技術的並びに経済的効果の観点から、酵素が繰り返し利用できることは非常に重要な因子である。シリカ系メソ多孔体−光学異性相互変換酵素複合体の繰り返し使用による、酵素活性の変化を評価した。用いた酵素は、同様に、GeoRacAであり、シリカ系メソ多孔体としては、FSM−8.5を用いた。
【0099】
その結果を、図3に示す。図3は、シリカ系メソ多孔体へ固定化されたGeoRacAの繰り返し使用の評価結果をまとめたものである。最初の活性を100%として、5回再使用した場合でも、50%の活性を保持していることが分かり、10回までの使用では、少しずつ活性が低下していくが、それ以降は、一定の値に落ち着いてくることが分かる。このことは、シリカ系メソ多孔体−光学異性相互変換酵素複合体には、酵素の繰り返し使用を可能とする非常に優れた効果があることを示している。
【0100】
また、本発明で、特に重要なことは、光学異性の相互変換のための反応系において、シリカ系メソ多孔体に固定化されたラセマーゼを共存させることにより、その溶解度を超えた量のラセマーゼを反応系内に存在させることが可能であることである。このことは、反応速度、すなわち光学異性の相互変換速度の向上に大きく寄与するものであり、また、反応生成物からも、酵素を容易に回収できることを意味するものである。
【0101】
一般に、酵素、すなわち、タンパク質の溶解度には、限界があり、それを越えると、凝集という現象を起こす。光学異性相互変換酵素の場合も例外ではなく、15mg/mlを越えるような高濃度にすると、凝集が起こり、凝集を起こした酵素は、活性に寄与しない。特に、ラセマーゼは、等電点付近のpH領域での凝集が激しい傾向があり、そのpH域では、1mg/ml程度の濃度でも、凝集を避けることは困難である。
【0102】
一方で、シリカ系メソ多孔体に固定化されたラセマーゼの場合、例えば、FSM−8.5 10mgに対して、光学異性相互変換酵素が、0.42mg程度、吸着・固定されたシリカ系メソ多孔体−光学異性相互変換酵素複合体を、1mlの反応基質、すなわち、反応基質の溶解した溶液中に、50mg分散させることは容易である。
【0103】
この反応系においては、溶液1mlに、ラセマーゼを、0.42×50/10=2.1mg、活性を有した状態で存在させることができる。したがって、1mg/mlを超えた酵素量を、反応系内に容易に存在させることができる。この状況は、凝集の激しい等電点付近のpH領域においても、同様に適用でき、本来であれば容易に凝集を起こしてしまうようなpH領域の反応系内に、酵素を、凝集を起こすことなく、活性を有した状態で、安定に存在させることが可能である。
【0104】
更に、本発明では、光学異性相互変換酵素が固定化されたシリカ系メソ多孔体−光学異性相互変換酵素複合体を、更に固定して、そこに、反応基質を含む溶液を流すような装置を構成することにより、連続的な酵素反応装置の構築と連続的な酵素反応の実施が容易に可能である。
【実施例3】
【0105】
(1)材料
本実施例では、実験材料として、G.stearothermophilus(NBRC12550)、ドコシルトリメチルアンモニウムクロライド[C22H45N(CH3)3Cl;C22−TMA](ライオン株式会社)、カネマイト(層状ポリシリケート)(徳山シルテック株式会社)、1,3,5−トリイソプロピルベンゼン(TIPB)(東京化学工業株式会社)、D−Ala、L−Ala,β−D−チオガラクトピラノシド(IPTG)(和光純薬工業株式会社)を使用した。
【0106】
(2)FSMの合成
ここでは、FSM−4(細孔径4nm)については、カネマイト(5.35g)を、C22−TMA(8.16g)含有水溶液(205mL)に分散させ、70℃で、2時間撹拌した。得られた懸濁液のpHを、2NHClで8.5に調整し、更に、70℃で、3時間インキュベートした。FSM−8.5(細孔径8.5nm)を合成するためには、カネマイトを加える前に、5.5mLのTIPBを、C22−TMA溶液に混合した。合成したFSMは、脱イオン水で洗い、60℃で、一夜乾燥し、空気中で、550℃で、6時間焼成して有機化合物を除いた。
【0107】
(3)GeoRacAのクローニング及び大量発現
GeoRacA遺伝子を、テンプレートとしてG.stearothermophilus(NBRC12550)のゲノムDNAを、プライマーとして、フォワードの5’−AGAGACATATGAACGACTTTCATCGCGATACGTG−3’及びリバースの5’−GAGACTCGAGTGAAGCAGATTATGCACTGCTTTCCC−3’を用いて、PCRにより増幅させた。
【0108】
PCR反応物を、pBluescript II(SK+)プラスミド(Stratagene社、CA、USA)に連結させ、dideoxynucleotide−chain−termination法を用いて、配列を決定した。pET28bベクターのNdeI−XhoIサイトにクローンを挿入することによって、N−末端にヘキサヒスチジンタグを持つGeoRacAを作製した。
【0109】
Escherichia coli株BL21Star(DE3、Invitrogen社、CA、USA)を、GeoRacA発現ベクターで形質転換した。GeoRacAの発現は、ターボブロス中で、IPTGを最終濃度0.5mM加えることにより誘導した。更に、20℃で、21時間インキュベートした後、7500×g、5分の遠心により細胞を得た。この細胞を、20mMのトリス−HCl(pH7.5)、10mM 2−メルカプトエタノール、500mM NaClに再懸濁し、液体N2で凍結し、−80℃で保存した。
【0110】
(4)GeoRacAの精製
解凍させた細胞に、1mMフェニルメチルスルフォニルフルオライド、1μg/mLペプスタチンA、0.5mg/mLリゾチーム、1mM MgCl2、100ユニットのDNaseI、10μMピリドキサール−5’−リン酸、及び10mMイミダゾールを加えた。4℃で、30分培養した後、細胞を超音波処理して破砕し、4℃で、100,000×g、45分間遠心した。上清を、0.45μmフィルターで濾過し、AKTA Explorer液体クロマトグラフィーシステム(GE Healthcare UK社)のHisTrapHPカラム(GE Healthcare UK社、Buckinghamshire、England)にかけた。
【0111】
蛋白質を、20mMリン酸カリウム(pH7.5)、500mM KCl中の10−500mMイミダゾールの濃度勾配により溶出させた。ピークフラクションを集め、Amicon(登録商標)Ultra−15遠心フィルターユニット(Millipore社、MA、USA)で濃縮し、20mMリン酸カリウム(pH7.5)、50mM KCl、で透析した。酵素の純度は、SDS−PAGEによって確認した。
【0112】
(5)FSMへのGeoRacAの吸着
FSMへのGeoRacAの吸着を調べるために、一定量のFSM(10mg)を、各濃度(0.1−4mg/mL)の1mL GeoRacA溶液で、Rotator RT−50(タイテック株式会社)で、4℃で、24時間振盪した。FSMを、4℃で、20,800×g、5分間の遠心で除き、上清液中の蛋白質濃度を測定した。吸着した蛋白質量は、遠心後の上清の蛋白質量を、吸着前のGeoRacAの量から引くことにより計算した。
【0113】
酵素活性を調べるために、30mgのFSM−8.5を、20mMリン酸カリウム(pH7.5)、50mM KCl中の1.26mgのGeoRacA(1mg/mL)と、4℃で、24時間インキュベートした。FSM−固定化GeoRacAを、4℃で、10,600×g、3分の遠心で集めた。固定化GeoRacAの量は、上清の未結合の蛋白質を測定することによって計算した。FSM−固定化GeoRacAを3回洗い、緩衝液に懸濁して、蛋白質濃度0.2mg/mLとした。
【0114】
(6)キャラクタリゼーション
窒素吸着等温線を、液体N2(77K)の濃度で、NOVA300分析器(Quantachvome Instrument社、FL、USA)を用いて、測定した。測定の前に、真空下で、試料を、200℃で、3時間脱ガス処理した。比表面積を、Brunaur−Emmett−Teller(BET)法で、P/P0=0.05−0.30の相対圧力範囲の吸着データを用いて計算した。総細孔体積は、最大相対圧力におけるN2吸着から推定した。細孔径分布は、Barrett−Joyner−Halenda(BJH)法を用いて、吸着曲線から決定した。
【0115】
(7)酵素活性
アラニンラセマーゼ活性は、Jasco J−820 CD分光施光計(日本分光株式会社)を用いて、204nmでのモル楕円率の変化をモニターすることによって測定した。L−Ala及びD−Alaのモル楕円率は、それぞれ23.0及び−23.0mdeg/cm/mMであった。反応速度定数は、10mMリン酸カリウム(pH7.5)中での、L−Ala又はD−Alaの各濃度(0.5、1.0、2.0、3.0、4.0、5.0、6.0、8.0及び10mM)での酵素活性を測定することによって計算した。
【0116】
FSMに固定化した、又はフリーのGeoRacA試料(2μg蛋白質)を2.5mLの10mMリン酸カリウム(pH7.5)、3mM L−Alaに加えた。30℃での204nmのモル楕円率の減少割合から酵素活性を計算した。Vmax及びKm値は、Prism4ソフト(GraphPad Software社、CA、USA)を用いて、曲線を外挿して計算した。
【0117】
(8)熱安定性試験
酵素の熱安定性を調べるために、0.2mg/mL FSM−固定化又はフリーのGeoRacA試料の50μL量を、80℃で処理した。その後、10μLの試料を、2.5mLの10mMリン酸カリウム(pH7.5)、3mM L−Alaに加え、30℃で酵素の残存活性を測定した。
【0118】
(9)再利用試験
FSM−固定化GeoRacAの再利用性を評価するために、4μgのFSM−固定化GeoRacAを10mMリン酸カリウム(pH7.5)、3mM L−Alaに加え、30℃で、1分間振盪した。4℃、2150×gで5分遠心することによってFSM−固定化GeoRacAを沈殿させ、上清のD−Alaの濃度を測定した。更に、沈殿に新たな3.5mLの10mMリン酸カリウム(pH7.5)、3mM L−Alaを加えた。このサイクルを繰り返した。
【0119】
(10)実験結果
1)FSMのキャラクタリゼーション
細孔径4nm(FSM−4)及び8.5nm(FSM−8.5)のFSMを合成した。窒素吸着等温線及び細孔分布を図4A及びBに示す。FSMsの構造パラメータを、表4に示す。
【0120】
【表4】

【0121】
図4Aに示されるように、FSM−4及びFSM−8.5の窒素吸着等温線は、IUPAC分類により、メソポーラスシリカの特徴であるタイプIVであった。FSM−4及びFSM−8.5の細孔径は、4及び8.5nmであり(図4B)、これらの総細孔体積は、1.30及び2.57cm3/gであった。それらの表面積は、両者とも約1100m2/g(表4)であった。
【0122】
これらの値は、MCM−41及びSBAのような、同様の細孔径を有する他のMPsの値と比べて、非常に高い。また、FSM−8.5の細孔径分布は、FSM−4のものよりも広かった(図4B)。尚、FSMの細孔径は、膨潤剤の量の増加に応じて増加するが、細孔径分布も広くなる傾向がある。
【0123】
2)GeoRacAの分離及び精製
GeoRacAのcDNAクローンを、バクテリア発現ベクターpET28bにサブクローンして、N−末端にヘキサヒスチジンをタグを有した蛋白質を発現させた。
【0124】
GeoRacA発現ベクターを、E.coli株(BL21Star(DE3)に導入し、GeoRacA蛋白質発現を誘導させた。GeoRacAは、HisTrapHPカラムで精製した。精製GeoRacAの最終の収量は、培養1L当たり〜300mgであった。また、図5に示されるように、ほぼ均一に精製された。
【0125】
精製GeoRacAは、5−7のpH範囲の緩衝液中では凝集、沈殿が起こったため、塩(50mM KCl)を含んでいるpH7.5の緩衝液を用いて、凝集を抑えた。GeoRacAの等電点(pI)は6.7であり、該pIでは、GeoRacAは不安定であり、沈殿すると考えられる。
【0126】
3)FSMに対するGeoRacAの吸着
図6に、FSM−4及びFSM−8.5でのGeoRacAの吸着等温線を示す。飽和能力は、FSM−4よりも細孔の大きいFSM8.5がより高い(28及び62mg/g)。
【0127】
GeoRacAは、43kDaの2つの同一のサブユニットからなり、ユニットセル寸法は、88×52×42Åである(文献:J.P.Shaw,G.A.Petsko,D.Ringe,Biochemistry 36(1997)1329−1342)。GeoRacAの寸法は、FSM−4の細孔径より大きいので、吸着された少量は、粒子の細孔入口及び/又は外表面に存在していると考えられる。
【0128】
FSM−4及びFSM−8.5の表面積は、同様であるが、FSM−8.5の総細孔体積は、FSM−4の約2倍の大きさであり(表4)、その細孔径は、GeoRacAより大きいことから、GeoRacAは、FSM−8.5の細孔内に固定化されていることが示唆される。
【0129】
FSMに吸着されたGeoRacAの量を、他の蛋白質の吸着と比べると、HRP(183mg/g)及びヘモグロビン(212mg/g)のものより低かった[文献:1)H.Takahashi,B.Li,T.Sasaki,C.Miyazaki,T.Kajino,S.Inagaki,Chem.Mater.12(2000)3301−3305、2)Y.Urabe,T.Shiomi,T.Itoh,A.Kawai,T.Tsunoda,F.Mizukami,K.Sakaguchi,Chembiochem.8(2007)668−674]。この低い吸着は、用いた緩衝液のpHがGeoRacAのpIより高いことによると考えられる。
【0130】
一般的に、シリカ支持体への酵素の吸着は、緩衝液のpHが蛋白質のpI付近で、最大化され、そのpIより上では減少する。本実施例で用いた緩衝液のpHは、7.5であり、GeoRacAのpI(6.7)より高い。このとき、GeoRacAは全体的にはマイナス電荷を有していると考えられる。また、シリカ支持体の表面は、pH<2でマイナスに電荷を有している。よって、pHは、7.5の緩衝液中では、シリカ表面及びGeoRacAは共にマイナスの電荷を有しているので、吸着が低くなる。分子進化のような、分子生物学技術を用いて酵素のpIを修正することは、この問題を解決すると思われる。
【0131】
本実施例では、SBAタイプのメソポーラスシリカも調べた。SBAの細孔径(9.8nm)及び表面積(955m2/g)はFSM−8.5と同様であったが、SBAに吸着されたGeoRacAの量は、FSM−8.5に吸着された量の約半分であった。
【0132】
FSMの表面シラノール基の組成は、SBAを含む他のアモルファスシリカと比べて、ユニークである。例えば、アモルファスシリカは、Q2(20%)及びQ3(8%)シラノール基を表面に含んでいるが、FSMのシラノール基は、Q3である。FSMの表層シラノール基は、アモルファスシリカのものよりも、より酸性である。
【0133】
FSMのこれらのユニークな表面特性は、SBAよりも、蛋白質の吸着をより高くさせることが可能である。一般に、高い酵素能力は、固定化酵素支持体の経済性にとって重要であり、酵素が固定化のメリットを最大限に享受されるためには、メソポーラスシリカの細孔内に吸着される必要があると考えられる[文献:1)S.Hudson,J.Cooney,E.Magner,Angew.Chem.Int.Ed.47(2008)8582−8594、2)C.Ispas,I.Sokolov,S.Andreescu,Anal.Bioanal.Chem.393(2009)543−554]。
【0134】
4)FSM−固定化及びフリーGeoRacAの反応速度
表5に、フリー、又はFSM−固定化GeoRacAの反応速度定数を示す。FSM−固定化GeoRacAのL−からD−Ala、及び、D−からL−AlaへのKm値は、4.35及び3.39mMであり、フリーのGeoRacAより少し高かった(3.71及び2.13mM)。
【0135】
【表5】

【0136】
Vmax値は、固定化によって減少した。これらの結果は、固定化酵素は、その基質との接触が制限されていることを示唆している。酵素の形態の変化及び/又は活性部位のブロックは、酵素−支持体の相互作用によって誘導されると考えられる。GeoRacAは、ホモ二量体であり、各サブユニットの相互作用は、活性部位を維持する上で重要である。したがって、二量体の活性は、単量体酵素よりも、形態変化に対してより影響される可能性がある。
【0137】
FSM−固定化、又はフリーのGeoRacAのVmax/Km比(これは、基質に対する酵素の触媒効率に影響する)は、両方向で0.058/min及び0.114/minである。触媒効率は、FSM上の固定酵素によって減少するとしても、51%の効率が、非固定酵素と比べて残っている。この値は、酵素の固定化に用いられる支持体として合理的なものであると思われる。
【0138】
5)FSM−固定化及びフリーのGeoRacAの熱安定性
HRP及びヘモグロビンの熱安定性が、それらをFSMの細孔中に固定化することによって増加することが報告されている[文献:1)H.Takahashi,B.Li,T.Sasaki,C.Miyazaki,T.Kajino,S.Inagaki,Chem.Mater.12(2000)3301−3305、2)Y.Urabe,T.Shiomi,T.Itoh,A.Kawai,T.Tsunoda,F.Mizukami,K.Sakaguchi,Chembiochem.8(2007)668−674]。熱安定性を調べるために、フリー、又はFSM−固定GeoRacAを、80℃でインキュベートした後に残っている活性を測定した。図7に示されるように、非固定酵素の活性は、10分間のインキュベーションで、60%に減少し、その後、活性は減少し続けた。
【0139】
これに対し、FSM−固定GeoRacAは、10分後で、活性が100%残存し、60分後でも、50%の活性が残存した。この結果は、酵素の熱安定性は、FSMの細孔に固定化することによって、促進されたことを明白に示している。
【0140】
フリーのGeoRacAでは糸くず様の沈殿が熱処理後に見られたが、これはフリーの酵素は、熱処理により変性、凝集したことを示している。これに対し、蛋白質の変性は、FSMへの固定化によって防がれた。この理由として、酵素の表面がFSMの細孔の壁の多数箇所との結合することにより、熱による酵素の構造の揺らぎが制限されるために、熱安定性が促進される可能性が考えられる。
【0141】
図8に示されるように、マイナスに電荷した点は、GeoRacAの表面に分散して存在している。GeoRacAの総電荷が、用いられる実験条件下(緩衝液pH>pI)でマイナスであるとしても、アルギニン及びリジンの残基は、イオン化しており、このことは、FSM表面のシラノール基と作用できることを意味している。
【0142】
シロキサン結合に由来するFSM表面の疎水性の特性も、酵素の表面との結合に関与している。酵素の熱安定性は、狭いシリカ細孔中における分子の水和によって与えられ、シリカ表面のシラノール基の特異的な水−構造を与える性質によって誘導される(文献:R.Ravindra,Z.Shuang,H.Gies,R.Winter,J.Am.Chem.Soc.126(2004)12224−12225)。FSM−固定化GeoRacAは、4℃で、4ヶ月間貯蔵した後でも、活性が94%残存していて(0ヶ月で135μmol/分/mgに対し、4ヶ月で、127μmol/分/mgである)、フリーのGeoRacAでは、活性の14%が残存していた(0ヶ月で239μmol/分/mgに対し、4ヶ月で、34.3μmol/分/mgである)。
【0143】
この結果は、FSMへの酵素の固定化は、その活性を維持する助けとなり得ることを示している。酵素は、液相に貯蔵することができ、必要に応じて、調製できるので、上記の結果は、工業的にも有用である。一般に、市販の酵素は粉末形態であるが、分散することが難しく、粉が舞うことによりプラントへのコンタミ等の原因となる。
【0144】
(11)FSM−固定化GeoRacAの再利用性
固定化酵素の再利用性は、経済的理由により、重要である。そこで、FSM−固定化GeoRacAの再利用性を価値する実験を行った。図9に、その実験結果を示す。最初のサイクルにおけるFSM−固定化GeoRacAの当初の活性を100%として、5サイクルの利用後に、当初の活性の50%が残存していた。その後、活性は減少したが、10サイクルで停滞した。
【0145】
この結果は、酵素の固定化の支持体としてのFSMの利用可能性を示している。活性の減少は、各サイクルで固定化酵素が遠心により集められる際に酵素の浸出及び/又は崩壊の結果によるものである可能性がある。シリカ表面のシラノール基は、Alaのアミノ基に作用し得るので、基質(L−Ala)がFSMに吸着され、酵素の活性に影響することも考えられる。
【0146】
Geobacillus stearothermophilus由来のアラニン、ラセマーゼを、直径4又は8.5nmの細孔を有するメソポーラスシリカ(FSM)に固定化して、ラセマーゼの活性、熱安定性、及び再利用性を調べた。大きい細孔径のFSMは、ラセマーゼを多く吸着したが、これは、細孔径が、酵素を吸着するのに十分な大きさを有するからと考えられる。
【0147】
固定化ラセマーゼは、L−アラニン(L−Ala)からD−Ala及びD−AlaからL−Alaの反応の両者におけるフリーの酵素と比べて、約51%の活性が残存していた。ラセマーゼは、顕著な熱安定性を示し、FSMに固定した場合、少なくとも6回使用可能であった。これらの結果は、酵素の固定化の支持体として、FSMの有用性を示すものである。
【産業上の利用可能性】
【0148】
以上詳述したように、本発明は、シリカ系メソ多孔体への酵素の吸着現象を、酵素の固定化法として利用した、シリカ系メソ多孔体−光学異性相互変換酵素複合体、その製造方法及びその用途に係るものであり、本発明により、シリカ系メソ多孔体の表面に未処理もしくは適切な溶液による処理で官能基を付与することにより、また、その合成条件の制御により、細孔径の制御されたシリカ系メソ多孔体に、光学異性相互変換酵素が固定化された、シリカ系メソ多孔体−光学異性相互変換酵素複合体を提供することができる。本発明では、光学異性の相互変換に際し、原料アミノ酸等や糖類等の性状や特性に応じて、好適な酵素を選択して、その酵素を用いたシリカ系メソ多孔体−光学異性相互変換酵素複合体を、固定化された酵素として選択することが可能である。また、本発明では、酵素の回収が容易であり、繰り返し使用も可能となり、更には、基質を連続的にシリカ系メソ多孔体−光学異性相互変換酵素複合体と接触して流通させる連続的な酵素反応の実施も可能である。本発明によれば、固定化により高集積化された酵素を利用することで、酵素の凝集を避けることができ、酵素を溶液に溶解した状態よりも高濃度に反応系中に存在させることが可能となり、酵素反応をより効率的に進めることに寄与できる。本発明は、例えば、多種多様なアミノ酸類や糖類等の原料から、複数の酵素を作用させた状態で、良質な光学異性の相互変換を効率的に進行させることができる新規光学異性相互変換プロセス・システムを構築することを可能にするものとして有用である。
【特許請求の範囲】
【請求項1】
光学異性の相互変換を触媒する酵素とシリカ系メソ多孔体との複合体であり、シリカ系メソ多孔体へ固定化された酵素が、光学異性の相互変換を触媒する活性を有していることを特徴とする、シリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項2】
光学異性の相互変換を触媒する酵素が、アミノ酸類に作用するラセマーゼ、ヒドロキシ酸類に作用するラセマーゼ、あるいは炭水化物及びその類縁体に作用するエピメラーゼであり、複合体が、当該酵素と、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体との複合体であり、光学異性相互変換反応に、繰り返して使用できる再利用性を有する、請求項1に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項3】
シリカ系メソ多孔体が、ケイ素と酸素を必須成分として含む化合物の多孔体である、請求項1又は2に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項4】
シリカ系メソ多孔体が、2〜50nmの直径の細孔を有する、請求項1から3のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項5】
シリカ系メソ多孔体が、0.1〜3.5ml/gの全細孔体積を有する、請求項1から4のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項6】
シリカ系メソ多孔体が、200〜1500m2の比表面積を有する、請求項1から5のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項7】
シリカ系メソ多孔体と、光学異性の相互変換を触媒する酵素の溶解した溶液とを混合することにより、光学異性の相互変換を触媒する酵素を、シリカ系メソ多孔体に固定化することを特徴とする、シリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
【請求項8】
シリカ系メソ多孔体の中心細孔径を変えることにより、固定化される酵素の量と活性を制御する、請求項7に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
【請求項9】
シリカ系メソ多孔体に、酵素を固定化させる操作を繰り返すことにより、酵素の固定化量を制御もしくは増大する、請求項8に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
【請求項10】
シリカ系メソ多孔体が、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体あり、該メソ多孔体に、酵素を固定化することにより、該酵素の保存性を向上させたシリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する、請求項7に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
【請求項11】
シリカ系メソ多孔体が、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体あり、該メソ多孔体に、酵素を固定化することにより、該酵素の再利用性を向上させたシリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する、請求項7に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
【請求項12】
請求項1から6のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体からなり、機能性を有する酵素を、シリカ系メソ多孔体上、及び細孔内に、安定に吸着、保持させたことを特徴とする酵素固定化機能性部材。
【請求項1】
光学異性の相互変換を触媒する酵素とシリカ系メソ多孔体との複合体であり、シリカ系メソ多孔体へ固定化された酵素が、光学異性の相互変換を触媒する活性を有していることを特徴とする、シリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項2】
光学異性の相互変換を触媒する酵素が、アミノ酸類に作用するラセマーゼ、ヒドロキシ酸類に作用するラセマーゼ、あるいは炭水化物及びその類縁体に作用するエピメラーゼであり、複合体が、当該酵素と、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体との複合体であり、光学異性相互変換反応に、繰り返して使用できる再利用性を有する、請求項1に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項3】
シリカ系メソ多孔体が、ケイ素と酸素を必須成分として含む化合物の多孔体である、請求項1又は2に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項4】
シリカ系メソ多孔体が、2〜50nmの直径の細孔を有する、請求項1から3のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項5】
シリカ系メソ多孔体が、0.1〜3.5ml/gの全細孔体積を有する、請求項1から4のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項6】
シリカ系メソ多孔体が、200〜1500m2の比表面積を有する、請求項1から5のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体。
【請求項7】
シリカ系メソ多孔体と、光学異性の相互変換を触媒する酵素の溶解した溶液とを混合することにより、光学異性の相互変換を触媒する酵素を、シリカ系メソ多孔体に固定化することを特徴とする、シリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
【請求項8】
シリカ系メソ多孔体の中心細孔径を変えることにより、固定化される酵素の量と活性を制御する、請求項7に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
【請求項9】
シリカ系メソ多孔体に、酵素を固定化させる操作を繰り返すことにより、酵素の固定化量を制御もしくは増大する、請求項8に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
【請求項10】
シリカ系メソ多孔体が、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体あり、該メソ多孔体に、酵素を固定化することにより、該酵素の保存性を向上させたシリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する、請求項7に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
【請求項11】
シリカ系メソ多孔体が、7.5nmないし8.5nm径に細孔径分布のピークを持つシリカ系メソ多孔体あり、該メソ多孔体に、酵素を固定化することにより、該酵素の再利用性を向上させたシリカ系メソ多孔体−光学異性相互変換酵素複合体を作製する、請求項7に記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体の製造方法。
【請求項12】
請求項1から6のいずれかに記載のシリカ系メソ多孔体−光学異性相互変換酵素複合体からなり、機能性を有する酵素を、シリカ系メソ多孔体上、及び細孔内に、安定に吸着、保持させたことを特徴とする酵素固定化機能性部材。
【図1】


【図2】


【図3】


【図4】


【図6】


【図7】


【図9】


【図5】


【図8】




【図2】


【図3】


【図4】


【図6】


【図7】


【図9】


【図5】


【図8】


【公開番号】特開2011−15611(P2011−15611A)
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願番号】特願2009−154420(P2009−154420)
【出願日】平成21年6月29日(2009.6.29)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願日】平成21年6月29日(2009.6.29)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

