プロテアソーム活性化剤及び酸化カルボニルタンパク抑制剤
【課題】プロテアソーム活性化剤を提供する。
【解決手段】シリビンマルトシドを有効成分とするプロテアソーム活性化剤。
【解決手段】シリビンマルトシドを有効成分とするプロテアソーム活性化剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、プロテアソーム活性化技術に関する。
【背景技術】
【0002】
近年、活性酸素による生体内の細胞や組織で見られる様々な酸化傷害が問題になっている。活性酸素は非常に反応性が高く、生体の様々な成分を破壊し、脳卒中、心筋梗塞、白内障、リウマチ、癌、胃潰瘍、皮膚におけるしわやしみなどの様々な疾患に関与することが明らかになっている(非特許文献1)。活性酸素を増加させる要因として、加齢、過度の運動、紫外線暴露、精神的ストレスなどが知られている。活性酸素が増加すると、生体内に酸化タンパク質、いわゆる異常タンパク質が蓄積し、前述したような様々な疾患を引き起こす(非特許文献2)。皮膚においては、特に紫外線暴露による酸化障害の影響が大きく、紫外線暴露により、表皮角化細胞や皮膚線維芽細胞のDNA損傷、皮膚の弾性成分であるエラスチンやコラーゲンの分解などが起こり、しわやしみの形成を促進することが知られている(非特許文献3)。
【0003】
これまで、活性酸素による酸化障害を防ぐために、抗酸化物質の摂取、適用により生体内の活性酸素を消去し、タンパク質の酸化を抑制するという試みがなされてきた。代表的な抗酸化物質として、トコフェロール類、カロテノイド類及びフラボノイド類などが知られており、これらのいくつかは食品や化粧品に配合されて利用されている。
しかしながら、抗酸化物質の摂取、適用は、生体内で発生する活性酸素の消去には関与するが、既に蓄積している異常タンパク質の除去には全く関与しない。したがって、生体内に蓄積した異常タンパク質が関与する種々の疾病の改善をするには蓄積している異常タンパク質の除去が必須となる。
【0004】
生体内の異常タンパク質を除去する酵素として、プロテアソームが知られている。プロテアソームは複雑な分子構成をした巨大な多成分複合体であり、近年その生体内における生理機能の研究が注目されている。プロテアソームは、タンパク質が立体構造を形成する過程で正常な折り畳みや分子集合に支障をきたした異常タンパク質の除去を行い、タンパク質の品質管理の役割を担うとともに、紫外線や酸化ストレスなどにより、変性や傷害を受けたタンパク質を除去することにより、ストレス応答にも密接に関係している(非特許文献4)。このように、プロテアソームは異常タンパク質を除去することにより、細胞の恒常性を維持、監視する中心的役割を担う物質である。
【0005】
以上のようなことから、生体内のプロテアソーム活性を促進し、種々の疾病を予防及び改善する組成物が開発されている。例えば、マンネンタケの抽出物を含むプロテアソーム活性促進剤(特許文献1)、特定のペプチド化合物を含むプロテアソーム作用増強剤(特許文献2)、プロテアソーム活性促進作用をもつ大豆由来サポニンを含む異常タンパク質除去用組成物(特許文献3)、及びケール及び/又はその抽出物を含むプロテアソーム活性促進用組成物(特許文献4)が開発されている。
【0006】
さらに、本出願人は、大豆由来サポニンやケール及び/又はその抽出物のプロテアソーム活性促進成分が、生体内の異常タンパク質を除去するのみではなく、紫外線傷害を予防又は改善する作用をもつことを見出し、大豆由来のサポニンを含むことを特徴とする紫外線傷害予防又は改善用組成物(特許文献5)の開発や、シリビン、シラン抽出物、アヤメ抽出物を1種又は2種用いると異常タンパク質を除去する機能があることを発見し、特許出願を行っている(特許文献6)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2002−29996号公報
【特許文献2】国際公開00/04042号パンフレット
【特許文献3】特開2002−179592号公報
【特許文献4】特開2004−91398号公報
【特許文献5】特開2004−131431号公報
【特許文献6】特開2007−99650号公報
【非特許文献】
【0008】
【非特許文献1】老化のメカニズムと制御、藤本大三郎編著、株式会社アイピーシー、平成5年6月30日
【非特許文献2】BIO Clinica、11巻、第5号、1996年
【非特許文献3】化粧品の有用性・評価技術の進歩と将来展望、日本化粧品技術者会編、薬事日報社、2001年3月31日
【非特許文献4】蛋白質 核酸 酵素、第44巻、第6号、766〜775頁、1999年、共立出版社
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、異常タンパクを除去するプロテアソームを活性化するプロテアソーム活性化剤及び酸化カルボニルタンパク抑制剤を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者は、鋭意研究を重ねた結果、シリビンマルトシドに良好なプロテアソーム活性を示すことを知見したことに基づき、本発明を提案する。
【0011】
すなわち、本発明は、
(1)シリビンマルトシドを有効成分とするプロテアソーム活性化剤。
(2)シリビンマルトシドを有効成分とする酸化カルボニルタンパク抑制剤。
【発明の効果】
【0012】
本発明は、シリビンマルトシドが、プロテアソーム活性化能とともに、酸化カルボニルタンパクの生成抑制能を有することが新たに知見できた。
【図面の簡単な説明】
【0013】
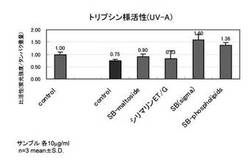
【図1】PDL54の老化した線維芽細胞を用い、紫外線A波照射時の、トリプシン様プロテアソーム活性を示すグラフ
【図2】PDL27の若い線維芽細胞を用い、紫外線B波照射時の、トリプシン様プロテアソーム活性を示すグラフ
【図3】PDL54の老化した線維芽細胞を用い、紫外線A波照射時の、酸化カルボニルタンパク抑制を示すグラフ
【図4】PDL27の老化した線維芽細胞を用い、紫外線B波照射時の、酸化カルボニルタンパク抑制を示すグラフ
【発明を実施するための形態】
【0014】
本発明のプロテアソーム活性化剤及び酸化カルボニルタンパク抑制剤は、紫外線暴露により発生した活性酸素により産生された細胞内の変性タンパク質(異常タンパク質)を分解するプロテアーゼを活性化し、紫外線暴露による細胞傷害を抑制することにより、白内障、皮膚癌、皮膚におけるしわやしみなどの様々な疾患を予防及び改善することができる。また、酸化カルボニルタンパク抑制剤は、紫外線照射による酸化カルボニルタンパク質の生成を抑制することができるものであって、シリビンマルトシドを有効成分とすることを特徴とする。以下に、本発明のプロテアソーム活性化剤について、詳細に説明する。
【0015】
本発明で用いられるシリビンマルトシドは下記式(1)に示されるものであり、文献(Kren V. et al., J.Chem.Soc.,Perkin Trans 1,2467−2474(1997))に従って、シリビンに、ルイス酸を触媒として、パーアセチルマルトースを反応させてグリコシド結合を生成し、脱アセチル化することにより得られるが、市販のものを用いることも可能である。
【0016】
【化1】

【実施例】
【0017】
以下に、実施例をあげて本発明を更に具体的に説明するが、本発明は以下の実施例によりなんら限定されるものではない。
【0018】
[評価検体]
(a)シリビンマルトシド
(b)シリマリンET/G(Indena S.P.A)
(c)シリビン(Sigma)
(d)SILYBIN PHOSPHOLIPIDS(Indena S.P.A)
【0019】
[シリビン配糖体(シリビンマルトシド)の合成]
βマルトースもしくはβラクトースの配糖体化をHelferichの方法に従ってシリビン配糖体を合成した。
シリビン(3.0 g、 6.2 mol、東京化成工業社製)とオクタ-O-アセチル-D-マルトース(6.3 g、 9.2mol、和光純薬社製)とを180 mlのジクロロメタン−アセトニトリル(1:1、v/v、関東化学社製)の溶媒中で、三ふっ化ほう素ジメチルエーテル錯体(1.14ml、 12.4 mmol、Merck Chemicals社製)を窒素存在下、室温で 19時間攪拌反応させた。反応終了後、氷冷しながら飽和炭酸水素ナトリウム水溶液(関東化学社製)を加え、150mlジクロロメタン(関東化学社製)で2回抽出処理し、無水硫酸ナトリウム(関東化学社製)処理後に抽出溶媒をエバポレーターにて除去した。
トリエチルアミン−メタノール−水(1:8:1、関東化学社製)を35℃30時間反応させたのち、エバポレーターにより溶媒を除去した。BONDESIL-C18(Varian)を用いて精製を行い、シリビンマルトシド(1.0 g, 収率20%)を得た。
【0020】
[皮膚由来線維芽細胞におけるプロテアソーム活性測定]
(1)細胞培養および紫外線照射
新生児由来ヒト皮膚線維芽細胞(NHFB、三光純薬)を5%FBS含有DMEM培地でPDL(集団倍加数)をチェックしながら37℃−5%CO2インキュベーターにて継代培養した。下記に定めた線維芽細胞のPDL数に達したところでプロテアソーム活性の試験に供した。
【0021】
紫外線B波照射にはPDL20〜40の若い細胞を用い、紫外線A波照射にはPDL45〜60の老化した細胞を用いた。
トリプシン処理で剥がした線維芽細胞の細胞数をコールターカウンターで計測し、200000cells/mlの細胞密度によるように調整した。
6ウェル平板プレートに細胞を100000cells/wellの密度で播種し、5%FBS含有DMEM(DMSO1%含有)で24h培養した。
紫外線照射前に、各サンプルを最終濃度が10μg/ml(5%FBS含有DMEM;DMSO1%含有)となるように添加し、24h培養した。
培養液をHank’s(−)液に置換し、紫外線照射を行った。
照射終了後、直ちにHank’s(−)液を紫外線照射前と同一濃度条件の評価サンプル含有5%FBS含有DMEM(DMSO1%含有)に置換し、24h培養した。
【0022】
(2)細胞懸濁液回収、プロテアソーム活性溶液調整、タンパク濃度の測定
培養液を除去しPBS(−)で各ウェルを洗浄後、各ウェルにトリプシン−EDTA(Sigma)を800μL添加し、37℃で5分間処理して線維芽細胞をディッシュ底面から剥離させ、10%FBS含有DMEM1.5mlでトリプシン反応を終止した。溶液と一部底着したままの細胞についてはスクレーパー処理で細胞を15ml容遠沈管に回収した。1,500rpm 5minの条件で遠沈して培養液を除去、PBS(−)で洗浄し再び1,500rpm 5minの条件で遠沈してDMEM中の色素(フェノールレッド)を完全に除去した。
この細胞塊をホモジナイズBuffer(50mMトリス塩酸、1mM DTT、5mM MgCl2、5%(v/v)グリセリン、pH=7.5)300μLに懸濁させた。その後、氷冷中でホモジナイズ処理(UD−201超音波破砕装置、TOMY製を使用、条件は「OUT PUT 1、DUTY40、15secを2set」)した。ホモジナイズ溶液を1.5ml容エッペンチューブに全量移し、15,000rpm 10min遠心分離して上清をプロテアソーム活性溶液として回収した。
このプロテアソーム活性溶液について、Bradford法に準拠してBSA(ウシ血清アルブミン SIGMA社製)換算で全タンパク量を求めた。
発色試薬はBio−Rad protein assay(脱イオン水で5倍希釈)を用いた。
平板96ウェルプレートに
プロテアソーム活性溶液/BSA 溶媒:ホモジナイズBuffer 10μl
Bio−Rad protein assay(脱イオン水で5倍希釈)200μl
を加えて10min室温にてプレートごと撹拌反応した。吸光度590nmをプレートリーダーで計測し、BSA溶液で作成した検量線について全タンパク濃度を求めた。
【0023】
(3)プロテアソーム活性の測定
トリプシン様プロテアソーム活性測定用基質Boc−Leu−Arg−Arg−MCA(ペプチド研究所)、
キモトリプシン様プロテアソーム活性測定用基質Suc−Leu−Leu−Val−Tyr−MCA(ペプチド研究所)、
をそれぞれ10mM(溶媒;DMSO)で調整し、30μLずつを分注して−20℃冷凍保存した。使用時に解凍し600μLの反応液で希釈して使用した。
蛍光分析用平板96ウェルプレートに以下の溶液をそれぞれ加えた。
【0024】
1.基質ペプチド(トリプシン様/キモトリプシン様) 10.5μL (蛍光分析 時の基質ペプチド濃度23.8μM)
2.反応液(100mMトリス塩酸、1mM DTT、5mM MgCl2、pH= 8.0) 25μL
3.10mM ATP含有ホモジナイズBuffer 19.5μL(蛍光分析時 のATP濃度は0.975mM)
4.プロテアソーム活性サンプル(cell lysate) 20μL
上記溶液を37℃で1h撹拌反応し、反応終了後に、
5.10%(w/v) SDS(反応停止液) 25μL
6.100mMトリス塩酸(pH=9.0) 100μL (全量200μL/ well)
として、プロテアソームによって基質ペプチドから遊離した7−アミノ−4−メチルクマリン(MCA)由来の蛍光強度(励起波長 Ex380nm、蛍光波長 Em440nm)を測定した。
【0025】
(4)データ処理
(蛍光強度/タンパク濃度)で算出されるプロテアソーム活性について、UV(−)のコントロール群を基準(1.00)とし、平均値で他の各群と比較した。
【0026】
[酸化カルボニルタンパクの定量]
(1)タンパク濃度0.1〜0.2μg/μLの範囲で凍結保存していた線維芽細胞由来のサンプルを自然解凍後にトリクロロ酢酸(TCA)処理してタンパク沈殿し、20μgタンパク重量に相当するサンプルを用意した。そのサンプルについて、カルボニル化蛋白質測定キット(日研ザイル製)で酸化カルボニルタンパク量を定量した。具体的には、前処理したサンプル、スタンダード、コントロール、各200μLをウェルに分注し、プレートをシールして、4℃で一晩反応させた。EIAバッファー 300μL/ウェルにて5回洗浄後に、全てのウェルに「希釈済みブロッキング試薬」を250μL/ウェル分注し、室温にて30分インキュベート後にEIAバッファー 300μL/ウェルにて5回洗浄、そして、ビオチン標識−抗DNP抗体を200μL分注し、37℃にて1時間インキュベートした。EIAバッファー 300μL/ウェルにて5回洗浄、「希釈済みHRP標識−ストレプトアビジン」を200μL分注し、室温にて1時間インキュベートした。EIAバッファー 300μL/ウェルにて5回洗浄、「発色液」を200μL/ウェル分注し、室温にて各ウェルでの反応時間が5分になるよう調整し、「反応停止液」を100μL/ウェル分注し、反応を停止させた。マイクロプレートリーダーで450nmの吸光度を測定した。
【0027】
(2)データ処理
反応生成物であるp−ニトロアニリン由来の吸光度450nmを測定し、カルボニル化蛋白質測定キットに付属している標準カルボニルタンパクで作成した検量線に対する各サンプルのカルボニル化タンパクを測定した。
【0028】
[プロテアソーム活性]
[試験例1]
PDL54の老化した線維芽細胞、以下の評価サンプルを用いて、トリプシン様プロテアソーム活性化評価を行った。
(a)紫外線A波 非照射 コントロール
(b)紫外線A波 照射 コントロール
(c)紫外線A波 照射 シリビンマルトシド(10μg/ml)
(d)紫外線A波 照射 シリマリンET/G(10μg/ml)
(e)紫外線A波 照射 シリビン (10μg/ml)
(f)紫外線A波 照射 SILYBIN PHOSPHOLIPIDS (10μg/ml)
【0029】
図1に紫外線A波照射時のトリプシン様プロテアソーム活性の結果を示す。紫外線A照射(b)でトリプシン様プロテアソーム活性が低下すること、そして紫外線照射前後に評価サンプルを添加する事でプロテアソーム活性が維持・向上される事を確認した。
同一重量%での各サンプルを比較すると、シリビン(e)>SILYBIN PHOSPHOLIPIDS(f)>シリビンマルトシド(c)≒シリマリンET/G(d)の優劣でトリプシン様活性が向上した。
【0030】
[試験例2]
PDL27の若い線維芽細胞を用い、紫外線B波を照射した以外は、実施例1と同様の手順でトリプシン様プロテアソーム活性化評価を行った。評価サンプルを添加した(c)(d)(e)(f)は、紫外線照射によっても変化しない程度にプロテアソーム活性が維持・向上される事を確認した。同一重量%での各サンプルを比較すると、シリマリンET−G(d)>シリビン(e)>SILYBIN PHOSPHOLIPIDS(f)≒シリビンマルトシド(c)の優劣でトリプシン様活性が向上した。
【0031】
[酸化カルボニル抑制]
[試験例3]
PDL54の老化した線維芽細胞、以下の評価サンプルを用いて、酸化カルボニルタンパク抑制の評価を行った。
((a))紫外線A波 非照射 コントロール
(b)紫外線A波 照射 コントロール
(c)紫外線A波 照射 シリビンマルトシド (10μg/ml)
(d)紫外線A波 照射 シリマリンET/G (10μg/ml)
(e)紫外線A波 照射 シリビン (10μg/ml)
(f)紫外線A波 照射 SILYBIN PHOSPHOLIPIDS (10μg/ml)
【0032】
図3に紫外線A波照射時の酸化カルボニルタンパク抑制の結果を示す。紫外線A波を照射した細胞(b)では酸化カルボニルタンパクが4倍前後増加し、評価サンプルを添加した群では顕著な酸化カルボニルタンパクの抑制が認められた。紫外線未照射(a)では酸化カルボニルは0.23nmol/mg protein、紫外線照射した時(b)の酸化カルボニルは1.06nmol/mg proteinであり、評価サンプルを添加した(c)(d)(e)(f)は、紫外線照射によって酸化カルボニルが0.22〜0.36nmol/mg proteinの範囲であり、これは紫外線未照射サンプル(a)に近い量であった。このことから、シリビンマルトシド、シリマリンET/G、シリビン、SILYBIN PHOSPHOLIPIDSには、酸化カルボニルの顕著な抑制効果が認められた。
【0033】
[試験例4]
PDL27の若い線維芽細胞を用い、紫外線B波を照射した以外は、実施例3と同様の手順で酸化カルボニルタンパク抑制の評価を行った。
図4に紫外線B波照射時の酸化カルボニルタンパク抑制の結果を示す。
紫外線B波を照射した細胞では酸化カルボニルタンパクが4倍前後増加し、サンプルを添加した群では顕著な酸化カルボニルタンパクの抑制が認められた。紫外線未照射では酸化カルボニルは0.24nmol/mg protein、紫外線照射した時の酸化カルボニルは1.01nmol/mg proteinであり、評価サンプルを紫外線照射前後に添加した時の酸化カルボニルは0.27〜0.35nmol/mg proteinの範囲であり、これは紫外線未照射サンプルに近い量であった。このことから、シリビンマルトシド、シリマリンET/G、シリビン、SILYBIN PHOSPHOLIPIDSには、酸化カルボニルの顕著な抑制効果が認められた。
【0034】
[考察]
プロテアソームの活性化はシリビン/シリビン修飾体の種類により同一重量%添加条件である程度の順序付けが可能であった。シリビンフィトソームやシリビンマルトシドの修飾体はプロテアソーム活性化が同一重量%比較でシリビン・シリマリンよりも劣っていた。
しかしながら、酸化カルボニルの抑制効果は各シリビン/シリビン修飾体の種類に大差が無く、いずれも顕著に酸化カルボニルを抑制した。
シリビンマルトシドは、シリマリンET−G、シリビン、SILYBIN PHOSPHOLIPIDSと同程度の酸化カルボニルの抑制効果を示したことは、これらの他の試薬と異なる構造部分が、紫外線照射に伴う異常蛋白である酸化カルボニルタンパクの生成を抑制する機能を有することが分かる。
【技術分野】
【0001】
本発明は、プロテアソーム活性化技術に関する。
【背景技術】
【0002】
近年、活性酸素による生体内の細胞や組織で見られる様々な酸化傷害が問題になっている。活性酸素は非常に反応性が高く、生体の様々な成分を破壊し、脳卒中、心筋梗塞、白内障、リウマチ、癌、胃潰瘍、皮膚におけるしわやしみなどの様々な疾患に関与することが明らかになっている(非特許文献1)。活性酸素を増加させる要因として、加齢、過度の運動、紫外線暴露、精神的ストレスなどが知られている。活性酸素が増加すると、生体内に酸化タンパク質、いわゆる異常タンパク質が蓄積し、前述したような様々な疾患を引き起こす(非特許文献2)。皮膚においては、特に紫外線暴露による酸化障害の影響が大きく、紫外線暴露により、表皮角化細胞や皮膚線維芽細胞のDNA損傷、皮膚の弾性成分であるエラスチンやコラーゲンの分解などが起こり、しわやしみの形成を促進することが知られている(非特許文献3)。
【0003】
これまで、活性酸素による酸化障害を防ぐために、抗酸化物質の摂取、適用により生体内の活性酸素を消去し、タンパク質の酸化を抑制するという試みがなされてきた。代表的な抗酸化物質として、トコフェロール類、カロテノイド類及びフラボノイド類などが知られており、これらのいくつかは食品や化粧品に配合されて利用されている。
しかしながら、抗酸化物質の摂取、適用は、生体内で発生する活性酸素の消去には関与するが、既に蓄積している異常タンパク質の除去には全く関与しない。したがって、生体内に蓄積した異常タンパク質が関与する種々の疾病の改善をするには蓄積している異常タンパク質の除去が必須となる。
【0004】
生体内の異常タンパク質を除去する酵素として、プロテアソームが知られている。プロテアソームは複雑な分子構成をした巨大な多成分複合体であり、近年その生体内における生理機能の研究が注目されている。プロテアソームは、タンパク質が立体構造を形成する過程で正常な折り畳みや分子集合に支障をきたした異常タンパク質の除去を行い、タンパク質の品質管理の役割を担うとともに、紫外線や酸化ストレスなどにより、変性や傷害を受けたタンパク質を除去することにより、ストレス応答にも密接に関係している(非特許文献4)。このように、プロテアソームは異常タンパク質を除去することにより、細胞の恒常性を維持、監視する中心的役割を担う物質である。
【0005】
以上のようなことから、生体内のプロテアソーム活性を促進し、種々の疾病を予防及び改善する組成物が開発されている。例えば、マンネンタケの抽出物を含むプロテアソーム活性促進剤(特許文献1)、特定のペプチド化合物を含むプロテアソーム作用増強剤(特許文献2)、プロテアソーム活性促進作用をもつ大豆由来サポニンを含む異常タンパク質除去用組成物(特許文献3)、及びケール及び/又はその抽出物を含むプロテアソーム活性促進用組成物(特許文献4)が開発されている。
【0006】
さらに、本出願人は、大豆由来サポニンやケール及び/又はその抽出物のプロテアソーム活性促進成分が、生体内の異常タンパク質を除去するのみではなく、紫外線傷害を予防又は改善する作用をもつことを見出し、大豆由来のサポニンを含むことを特徴とする紫外線傷害予防又は改善用組成物(特許文献5)の開発や、シリビン、シラン抽出物、アヤメ抽出物を1種又は2種用いると異常タンパク質を除去する機能があることを発見し、特許出願を行っている(特許文献6)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2002−29996号公報
【特許文献2】国際公開00/04042号パンフレット
【特許文献3】特開2002−179592号公報
【特許文献4】特開2004−91398号公報
【特許文献5】特開2004−131431号公報
【特許文献6】特開2007−99650号公報
【非特許文献】
【0008】
【非特許文献1】老化のメカニズムと制御、藤本大三郎編著、株式会社アイピーシー、平成5年6月30日
【非特許文献2】BIO Clinica、11巻、第5号、1996年
【非特許文献3】化粧品の有用性・評価技術の進歩と将来展望、日本化粧品技術者会編、薬事日報社、2001年3月31日
【非特許文献4】蛋白質 核酸 酵素、第44巻、第6号、766〜775頁、1999年、共立出版社
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、異常タンパクを除去するプロテアソームを活性化するプロテアソーム活性化剤及び酸化カルボニルタンパク抑制剤を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者は、鋭意研究を重ねた結果、シリビンマルトシドに良好なプロテアソーム活性を示すことを知見したことに基づき、本発明を提案する。
【0011】
すなわち、本発明は、
(1)シリビンマルトシドを有効成分とするプロテアソーム活性化剤。
(2)シリビンマルトシドを有効成分とする酸化カルボニルタンパク抑制剤。
【発明の効果】
【0012】
本発明は、シリビンマルトシドが、プロテアソーム活性化能とともに、酸化カルボニルタンパクの生成抑制能を有することが新たに知見できた。
【図面の簡単な説明】
【0013】
【図1】PDL54の老化した線維芽細胞を用い、紫外線A波照射時の、トリプシン様プロテアソーム活性を示すグラフ
【図2】PDL27の若い線維芽細胞を用い、紫外線B波照射時の、トリプシン様プロテアソーム活性を示すグラフ
【図3】PDL54の老化した線維芽細胞を用い、紫外線A波照射時の、酸化カルボニルタンパク抑制を示すグラフ
【図4】PDL27の老化した線維芽細胞を用い、紫外線B波照射時の、酸化カルボニルタンパク抑制を示すグラフ
【発明を実施するための形態】
【0014】
本発明のプロテアソーム活性化剤及び酸化カルボニルタンパク抑制剤は、紫外線暴露により発生した活性酸素により産生された細胞内の変性タンパク質(異常タンパク質)を分解するプロテアーゼを活性化し、紫外線暴露による細胞傷害を抑制することにより、白内障、皮膚癌、皮膚におけるしわやしみなどの様々な疾患を予防及び改善することができる。また、酸化カルボニルタンパク抑制剤は、紫外線照射による酸化カルボニルタンパク質の生成を抑制することができるものであって、シリビンマルトシドを有効成分とすることを特徴とする。以下に、本発明のプロテアソーム活性化剤について、詳細に説明する。
【0015】
本発明で用いられるシリビンマルトシドは下記式(1)に示されるものであり、文献(Kren V. et al., J.Chem.Soc.,Perkin Trans 1,2467−2474(1997))に従って、シリビンに、ルイス酸を触媒として、パーアセチルマルトースを反応させてグリコシド結合を生成し、脱アセチル化することにより得られるが、市販のものを用いることも可能である。
【0016】
【化1】

【実施例】
【0017】
以下に、実施例をあげて本発明を更に具体的に説明するが、本発明は以下の実施例によりなんら限定されるものではない。
【0018】
[評価検体]
(a)シリビンマルトシド
(b)シリマリンET/G(Indena S.P.A)
(c)シリビン(Sigma)
(d)SILYBIN PHOSPHOLIPIDS(Indena S.P.A)
【0019】
[シリビン配糖体(シリビンマルトシド)の合成]
βマルトースもしくはβラクトースの配糖体化をHelferichの方法に従ってシリビン配糖体を合成した。
シリビン(3.0 g、 6.2 mol、東京化成工業社製)とオクタ-O-アセチル-D-マルトース(6.3 g、 9.2mol、和光純薬社製)とを180 mlのジクロロメタン−アセトニトリル(1:1、v/v、関東化学社製)の溶媒中で、三ふっ化ほう素ジメチルエーテル錯体(1.14ml、 12.4 mmol、Merck Chemicals社製)を窒素存在下、室温で 19時間攪拌反応させた。反応終了後、氷冷しながら飽和炭酸水素ナトリウム水溶液(関東化学社製)を加え、150mlジクロロメタン(関東化学社製)で2回抽出処理し、無水硫酸ナトリウム(関東化学社製)処理後に抽出溶媒をエバポレーターにて除去した。
トリエチルアミン−メタノール−水(1:8:1、関東化学社製)を35℃30時間反応させたのち、エバポレーターにより溶媒を除去した。BONDESIL-C18(Varian)を用いて精製を行い、シリビンマルトシド(1.0 g, 収率20%)を得た。
【0020】
[皮膚由来線維芽細胞におけるプロテアソーム活性測定]
(1)細胞培養および紫外線照射
新生児由来ヒト皮膚線維芽細胞(NHFB、三光純薬)を5%FBS含有DMEM培地でPDL(集団倍加数)をチェックしながら37℃−5%CO2インキュベーターにて継代培養した。下記に定めた線維芽細胞のPDL数に達したところでプロテアソーム活性の試験に供した。
【0021】
紫外線B波照射にはPDL20〜40の若い細胞を用い、紫外線A波照射にはPDL45〜60の老化した細胞を用いた。
トリプシン処理で剥がした線維芽細胞の細胞数をコールターカウンターで計測し、200000cells/mlの細胞密度によるように調整した。
6ウェル平板プレートに細胞を100000cells/wellの密度で播種し、5%FBS含有DMEM(DMSO1%含有)で24h培養した。
紫外線照射前に、各サンプルを最終濃度が10μg/ml(5%FBS含有DMEM;DMSO1%含有)となるように添加し、24h培養した。
培養液をHank’s(−)液に置換し、紫外線照射を行った。
照射終了後、直ちにHank’s(−)液を紫外線照射前と同一濃度条件の評価サンプル含有5%FBS含有DMEM(DMSO1%含有)に置換し、24h培養した。
【0022】
(2)細胞懸濁液回収、プロテアソーム活性溶液調整、タンパク濃度の測定
培養液を除去しPBS(−)で各ウェルを洗浄後、各ウェルにトリプシン−EDTA(Sigma)を800μL添加し、37℃で5分間処理して線維芽細胞をディッシュ底面から剥離させ、10%FBS含有DMEM1.5mlでトリプシン反応を終止した。溶液と一部底着したままの細胞についてはスクレーパー処理で細胞を15ml容遠沈管に回収した。1,500rpm 5minの条件で遠沈して培養液を除去、PBS(−)で洗浄し再び1,500rpm 5minの条件で遠沈してDMEM中の色素(フェノールレッド)を完全に除去した。
この細胞塊をホモジナイズBuffer(50mMトリス塩酸、1mM DTT、5mM MgCl2、5%(v/v)グリセリン、pH=7.5)300μLに懸濁させた。その後、氷冷中でホモジナイズ処理(UD−201超音波破砕装置、TOMY製を使用、条件は「OUT PUT 1、DUTY40、15secを2set」)した。ホモジナイズ溶液を1.5ml容エッペンチューブに全量移し、15,000rpm 10min遠心分離して上清をプロテアソーム活性溶液として回収した。
このプロテアソーム活性溶液について、Bradford法に準拠してBSA(ウシ血清アルブミン SIGMA社製)換算で全タンパク量を求めた。
発色試薬はBio−Rad protein assay(脱イオン水で5倍希釈)を用いた。
平板96ウェルプレートに
プロテアソーム活性溶液/BSA 溶媒:ホモジナイズBuffer 10μl
Bio−Rad protein assay(脱イオン水で5倍希釈)200μl
を加えて10min室温にてプレートごと撹拌反応した。吸光度590nmをプレートリーダーで計測し、BSA溶液で作成した検量線について全タンパク濃度を求めた。
【0023】
(3)プロテアソーム活性の測定
トリプシン様プロテアソーム活性測定用基質Boc−Leu−Arg−Arg−MCA(ペプチド研究所)、
キモトリプシン様プロテアソーム活性測定用基質Suc−Leu−Leu−Val−Tyr−MCA(ペプチド研究所)、
をそれぞれ10mM(溶媒;DMSO)で調整し、30μLずつを分注して−20℃冷凍保存した。使用時に解凍し600μLの反応液で希釈して使用した。
蛍光分析用平板96ウェルプレートに以下の溶液をそれぞれ加えた。
【0024】
1.基質ペプチド(トリプシン様/キモトリプシン様) 10.5μL (蛍光分析 時の基質ペプチド濃度23.8μM)
2.反応液(100mMトリス塩酸、1mM DTT、5mM MgCl2、pH= 8.0) 25μL
3.10mM ATP含有ホモジナイズBuffer 19.5μL(蛍光分析時 のATP濃度は0.975mM)
4.プロテアソーム活性サンプル(cell lysate) 20μL
上記溶液を37℃で1h撹拌反応し、反応終了後に、
5.10%(w/v) SDS(反応停止液) 25μL
6.100mMトリス塩酸(pH=9.0) 100μL (全量200μL/ well)
として、プロテアソームによって基質ペプチドから遊離した7−アミノ−4−メチルクマリン(MCA)由来の蛍光強度(励起波長 Ex380nm、蛍光波長 Em440nm)を測定した。
【0025】
(4)データ処理
(蛍光強度/タンパク濃度)で算出されるプロテアソーム活性について、UV(−)のコントロール群を基準(1.00)とし、平均値で他の各群と比較した。
【0026】
[酸化カルボニルタンパクの定量]
(1)タンパク濃度0.1〜0.2μg/μLの範囲で凍結保存していた線維芽細胞由来のサンプルを自然解凍後にトリクロロ酢酸(TCA)処理してタンパク沈殿し、20μgタンパク重量に相当するサンプルを用意した。そのサンプルについて、カルボニル化蛋白質測定キット(日研ザイル製)で酸化カルボニルタンパク量を定量した。具体的には、前処理したサンプル、スタンダード、コントロール、各200μLをウェルに分注し、プレートをシールして、4℃で一晩反応させた。EIAバッファー 300μL/ウェルにて5回洗浄後に、全てのウェルに「希釈済みブロッキング試薬」を250μL/ウェル分注し、室温にて30分インキュベート後にEIAバッファー 300μL/ウェルにて5回洗浄、そして、ビオチン標識−抗DNP抗体を200μL分注し、37℃にて1時間インキュベートした。EIAバッファー 300μL/ウェルにて5回洗浄、「希釈済みHRP標識−ストレプトアビジン」を200μL分注し、室温にて1時間インキュベートした。EIAバッファー 300μL/ウェルにて5回洗浄、「発色液」を200μL/ウェル分注し、室温にて各ウェルでの反応時間が5分になるよう調整し、「反応停止液」を100μL/ウェル分注し、反応を停止させた。マイクロプレートリーダーで450nmの吸光度を測定した。
【0027】
(2)データ処理
反応生成物であるp−ニトロアニリン由来の吸光度450nmを測定し、カルボニル化蛋白質測定キットに付属している標準カルボニルタンパクで作成した検量線に対する各サンプルのカルボニル化タンパクを測定した。
【0028】
[プロテアソーム活性]
[試験例1]
PDL54の老化した線維芽細胞、以下の評価サンプルを用いて、トリプシン様プロテアソーム活性化評価を行った。
(a)紫外線A波 非照射 コントロール
(b)紫外線A波 照射 コントロール
(c)紫外線A波 照射 シリビンマルトシド(10μg/ml)
(d)紫外線A波 照射 シリマリンET/G(10μg/ml)
(e)紫外線A波 照射 シリビン (10μg/ml)
(f)紫外線A波 照射 SILYBIN PHOSPHOLIPIDS (10μg/ml)
【0029】
図1に紫外線A波照射時のトリプシン様プロテアソーム活性の結果を示す。紫外線A照射(b)でトリプシン様プロテアソーム活性が低下すること、そして紫外線照射前後に評価サンプルを添加する事でプロテアソーム活性が維持・向上される事を確認した。
同一重量%での各サンプルを比較すると、シリビン(e)>SILYBIN PHOSPHOLIPIDS(f)>シリビンマルトシド(c)≒シリマリンET/G(d)の優劣でトリプシン様活性が向上した。
【0030】
[試験例2]
PDL27の若い線維芽細胞を用い、紫外線B波を照射した以外は、実施例1と同様の手順でトリプシン様プロテアソーム活性化評価を行った。評価サンプルを添加した(c)(d)(e)(f)は、紫外線照射によっても変化しない程度にプロテアソーム活性が維持・向上される事を確認した。同一重量%での各サンプルを比較すると、シリマリンET−G(d)>シリビン(e)>SILYBIN PHOSPHOLIPIDS(f)≒シリビンマルトシド(c)の優劣でトリプシン様活性が向上した。
【0031】
[酸化カルボニル抑制]
[試験例3]
PDL54の老化した線維芽細胞、以下の評価サンプルを用いて、酸化カルボニルタンパク抑制の評価を行った。
((a))紫外線A波 非照射 コントロール
(b)紫外線A波 照射 コントロール
(c)紫外線A波 照射 シリビンマルトシド (10μg/ml)
(d)紫外線A波 照射 シリマリンET/G (10μg/ml)
(e)紫外線A波 照射 シリビン (10μg/ml)
(f)紫外線A波 照射 SILYBIN PHOSPHOLIPIDS (10μg/ml)
【0032】
図3に紫外線A波照射時の酸化カルボニルタンパク抑制の結果を示す。紫外線A波を照射した細胞(b)では酸化カルボニルタンパクが4倍前後増加し、評価サンプルを添加した群では顕著な酸化カルボニルタンパクの抑制が認められた。紫外線未照射(a)では酸化カルボニルは0.23nmol/mg protein、紫外線照射した時(b)の酸化カルボニルは1.06nmol/mg proteinであり、評価サンプルを添加した(c)(d)(e)(f)は、紫外線照射によって酸化カルボニルが0.22〜0.36nmol/mg proteinの範囲であり、これは紫外線未照射サンプル(a)に近い量であった。このことから、シリビンマルトシド、シリマリンET/G、シリビン、SILYBIN PHOSPHOLIPIDSには、酸化カルボニルの顕著な抑制効果が認められた。
【0033】
[試験例4]
PDL27の若い線維芽細胞を用い、紫外線B波を照射した以外は、実施例3と同様の手順で酸化カルボニルタンパク抑制の評価を行った。
図4に紫外線B波照射時の酸化カルボニルタンパク抑制の結果を示す。
紫外線B波を照射した細胞では酸化カルボニルタンパクが4倍前後増加し、サンプルを添加した群では顕著な酸化カルボニルタンパクの抑制が認められた。紫外線未照射では酸化カルボニルは0.24nmol/mg protein、紫外線照射した時の酸化カルボニルは1.01nmol/mg proteinであり、評価サンプルを紫外線照射前後に添加した時の酸化カルボニルは0.27〜0.35nmol/mg proteinの範囲であり、これは紫外線未照射サンプルに近い量であった。このことから、シリビンマルトシド、シリマリンET/G、シリビン、SILYBIN PHOSPHOLIPIDSには、酸化カルボニルの顕著な抑制効果が認められた。
【0034】
[考察]
プロテアソームの活性化はシリビン/シリビン修飾体の種類により同一重量%添加条件である程度の順序付けが可能であった。シリビンフィトソームやシリビンマルトシドの修飾体はプロテアソーム活性化が同一重量%比較でシリビン・シリマリンよりも劣っていた。
しかしながら、酸化カルボニルの抑制効果は各シリビン/シリビン修飾体の種類に大差が無く、いずれも顕著に酸化カルボニルを抑制した。
シリビンマルトシドは、シリマリンET−G、シリビン、SILYBIN PHOSPHOLIPIDSと同程度の酸化カルボニルの抑制効果を示したことは、これらの他の試薬と異なる構造部分が、紫外線照射に伴う異常蛋白である酸化カルボニルタンパクの生成を抑制する機能を有することが分かる。
【特許請求の範囲】
【請求項1】
シリビンマルトシドを有効成分とするプロテアソーム活性化剤。
【請求項2】
シリビンマルトシドを有効成分とする酸化カルボニルタンパク抑制剤。
【請求項1】
シリビンマルトシドを有効成分とするプロテアソーム活性化剤。
【請求項2】
シリビンマルトシドを有効成分とする酸化カルボニルタンパク抑制剤。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−82148(P2012−82148A)
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願番号】特願2010−227764(P2010−227764)
【出願日】平成22年10月7日(2010.10.7)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願日】平成22年10月7日(2010.10.7)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
[ Back to top ]

