核酸分析方法
【課題】本発明の目的は、高いハイブリ効率かつ高スループットな単分子シークエンス法の提供に関する。
【解決手段】高いハイブリ効率かつ高スループットな単分子シークエンス法のためには、総プローブ数が一定であることと、光学分解能以上の距離に最低限の数の反応場がある必要がある。従って、本発明では、複数のプローブが固定された反応場を複数備えており、1個の標的核酸が反応場のプローブのいずれかにハイブリするようにする。ただし、各反応場間の距離は、単分子計測を行うために光学分解能以上離れている必要がある。標的核酸と反応場の比を10倍以上にすることで、全ての標的核酸がプローブとハイブリした場合でも、90%以上の標的核酸は反応場に1個だけハイブリし、複数の標的核酸が1つの反応場にハイブリする確率は10%以下となる。
【解決手段】高いハイブリ効率かつ高スループットな単分子シークエンス法のためには、総プローブ数が一定であることと、光学分解能以上の距離に最低限の数の反応場がある必要がある。従って、本発明では、複数のプローブが固定された反応場を複数備えており、1個の標的核酸が反応場のプローブのいずれかにハイブリするようにする。ただし、各反応場間の距離は、単分子計測を行うために光学分解能以上離れている必要がある。標的核酸と反応場の比を10倍以上にすることで、全ての標的核酸がプローブとハイブリした場合でも、90%以上の標的核酸は反応場に1個だけハイブリし、複数の標的核酸が1つの反応場にハイブリする確率は10%以下となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸分析技術に関する。例えば、蛍光を用いた単一分子計測デバイスに関する。
【背景技術】
【0002】
現在のDNAシークエンス法は、サンガー法と呼ばれるDNA断片調整法と電気泳動法を組合せたキャピラリーシークエンス方式が用いられており、ヒトゲノム解析等に用いられて大きな成果をあげている。しかしながら、テーラーメイド医療などの観点から個人のゲノム解析を考えたとき、従来法で一度に解析できるDNA断片の長さよりもはるかに長い断片を、迅速・簡便・安価に解析できる技術が強く求められている。ヒトゲノム解析では、一人のヒトゲノムを解読するのに約1000万ドルが必要であったが、将来は10000分の1の1000ドルでヒトゲノム解析を行うことが期待されている。従来のキャピラリーシークエンス法の改良のみでは、これらの要求に応えることは不可能であり、新たな方式に基づくDNAシークエンスが待望されている。
【0003】
上記要求を実現するために、走査型電子顕微鏡を用いてDNAを直接シーケンスする方法や、1本鎖DNAがナノメートルサイズの孔(ポア)を通過するときの電圧値を塩基に変換することを利用したナノポアを用いた方法が提案されているが、技術的課題が多く実用化は難しいと考えられている。
【0004】
最も有望な方法として、光技術を用いた超並列解析法があり、既に数社から化学発光や蛍光の原理に基づく装置が市販されている。この方法の特徴は、マイクロビーズや微細加工技術を用いて反応場を区分けすることにより、超並列解析を可能にしたことである。従来のキャピラリーシークエンス方式では、多チャンネル化(〜384本)によって解析効率の向上が図られているが、本方式では1億個以上の超並列解析も可能である。従って、読み取り塩基長では100塩基以下とキャピラリーシークエンスに劣るものの、1日当たり数十ギガ塩基と、キャピラリーシークエンス方式と比較して1000倍以上のスループットが達成できている。また、解析コストも、ヒトゲノム一人当たり約10万ドルと約100分の1となっている。
【0005】
光技術を用いた超並列解析法は、標的核酸をPCRなどにより増幅してから行う方法と、標的核酸を非増幅で行う方法の2つがある。非増幅の場合には、決定した配列に誤りがある可能性があるため、一旦核酸を増幅してから蛍光検出と段階反応によって配列を決定する方法と比較して確実性に劣る。ただし、核酸増幅を行わない分コストが安く済むため、1000ドルゲノムを達成する有力な方法である。
【0006】
単一分子計測方式に基づく非増幅での標的核酸の塩基解読方法は、主に以下の2つである。ひとつは、1本のDNAの末端からエキソヌクレアーゼを用いて、ヌクレオチドを1個ずつ順番に切断して検出するエキソヌクレアーゼ法であり、もうひとつは1本の標的核酸を用意して、その塩基配列と相補的なヌクレオチドをDNAポリメラーゼが1個ずつ取り込むのを検出するポリメラーゼ法である。エキソヌクレアーゼ法は、標識された色素が酵素反応を妨害するという課題を解決できていないが、ポリメラーゼ法は、蛍光標識する部位を工夫することにより、標識された色素が酵素反応を妨害するという困難を解決できる。ヌクレオチドに標識する方法や、酵素とヌクレオチドをそれぞれ異なる蛍光色素で標識して、1〜10nmの極近傍でのみ共鳴エネルギー移動FRET(Fluorescence Resonance Energy Transfer)を起こさせる方法がある。いずれの方法においてもヌクレオチド自体は蛍光量子収率が10-4と低いため、そのままでは単一分子の検出は不可能である。従って蛍光量子収率が0.1以上の蛍光色素で標識した蛍光ヌクレオチドが必要となる。
【0007】
核酸の増幅・非増幅の有無は、ゲノム解析や新規ゲノム解析の場合には問題とならないが、発現解析へ適用する場合には、PCR等による増幅効率が初期鋳型量に必ずしも比例しないことから、非増幅で行う方が好ましい。
【0008】
現状、マイクロアレイで行われている発現解析では、まず健常者・非健常者から数千個の細胞を採取して、mRNAを抽出する。その後、cDNAに変換してPCRで増幅し、Cy3・Cy5でそれぞれ標識する。それらを混合したものをDNAチップにハイブリさせて蛍光スキャナーで検出することにより、非健常者に特異的に発現している遺伝子を特定する。ただし、この方法では非健常者から採取した細胞の中にも健全な細胞が含まれること、PCRによる増幅効率が初期鋳型量に必ずしも比例しないことから、あくまでも平均値での比較でしかない。従って、これまでに得られている様々な生物学的情報は、種々の細胞や組織から得た試料のため、平均化されているのである。平均化された情報を繋ぎ合わせても本当の生命現象は見えてこない。生命システムの基本は細胞であり、細胞に含まれるゲノム,mRNA,タンパク質、あるいは代謝物などの分子情報,反応情報,分布情報を、時間変化も含めて解明することが望まれている。生命現象をシステムとして理解することが今後の課題であり、高精度な発現解析を行うために、究極的には、1細胞から標的核酸を非増幅でシークケンスすることが望まれる。核酸1分子を鋳型として相補鎖合成反応を行うことで、相補鎖合成の反応効率に左右されずに長い核酸配列の解読が可能になるため、1細胞から核酸を増幅することなくシークケンスする方法が期待される。特に、1細胞中の全mRNAを非増幅でシークエンスすることにより、発現しているmRNAの個数を数えて比較するデジタルカウンティングが生命現象の理解に必要となると考えられる。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】P.N.A.S. 2003, Vol. 100, pp. 3960-3964.
【発明の概要】
【発明が解決しようとする課題】
【0010】
本願発明者が単分子シークエンサーを用いた発現解析について鋭意検討した結果、次のような知見を得た。
【0011】
現在、単分子シークエンサーが実用化されつつあり、非増幅で標的核酸をプローブにハイブリさせ、1塩基ずつ蛍光ヌクレオチドで伸長させながらシークエンスしている。1細胞中のmRNA全てをシークエンスする場合、mRNA全てをプローブとハイブリさせる必要がある。ハイブリ効率は、プローブ濃度,mRNA濃度,プローブ−mRNA複合体濃度,プローブ−mRNA複合体の平衡定数により決定される。1細胞中のmRNAは約40万個であり、1μLで抽出したと仮定した場合、mRNA濃度は0.66pMと極めて低い。プローブ数をmRNAの100倍と仮定すると、プローブ濃度は66pMである。また、平衡定数は109とする。以上のパラメータの場合、ハイブリ効率は6.2%と計算され、100%のmRNAをハイブリさせることはできない。従って、1細胞中の全mRNAシークケンスは困難である。mRNAのデジタルカウンティングを行うためには90%以上のハイブリ効率が望まれる。
【0012】
1細胞中のmRNA全てをハイブリさせるためには、プローブ数を増やしてプローブ濃度を上げることが有効である。プローブ濃度を66pMの10倍,100倍,1000倍と上げることにより、ハイブリ効率は39.7%,86.8%,98.5%と高くなる。
【0013】
ただし、別の制約として、単分子シーケンサーでは、単一分子を光学分解能以上の距離(>200nm)に置く必要がある。従って、安易にプローブ濃度(プローブ数)を上げることは、装置のスループット低下に繋がる。例えば、プローブが1μmピッチで固定されていると仮定すると、プローブ濃度66pM(プローブ4000万本)では40mm2の面積が必要となる。顕微鏡で一度に観察できる視野をφ0.5mmとすると、視野面積は約0.2mm2となり、40mm2/0.2mm2で計80回の視野移動が必要である。1回の視野移動に3秒とすると、全ての視野を検出するのに4分かかる。プローブ濃度を10倍,100倍,1000倍と上げることで、ハイブリ効率は39.7%,86.8%,98.5%と高くなるが、視野移動の回数もそれぞれ800,8000,80000回となるため、スループットはプローブ濃度に比例して40分,400分,4000分と悪くなる。この議論は、光学分解能以下の距離にプローブをランダムにばら撒いた後に、確率的に標的核酸が光学分解能以上の距離でハイブリするように標的核酸の濃度を調製する場合にも成立する。
【0014】
本発明の目的は、高いハイブリ効率かつ高スループットな単分子シークエンス法の提供に関する。
【課題を解決するための手段】
【0015】
高いハイブリ効率かつ高スループットな単分子シークエンス法のためには、総プローブ数が一定であることと、光学分解能以上の距離に最低限の数の反応場がある必要がある。
従って、本発明では、複数のプローブが固定された反応場を複数備えており、1個の標的核酸が反応場のプローブのいずれかにハイブリするようにする。ただし、各反応場間の距離は、単分子計測を行うために光学分解能以上離れている必要がある。標的核酸と反応場の比を10倍以上にすることで、全ての標的核酸がプローブとハイブリした場合でも、90%以上の標的核酸は反応場に1個だけハイブリし、複数の標的核酸が1つの反応場にハイブリする確率は10%以下となる。
【発明の効果】
【0016】
本発明により、短時間で高いハイブリ効率を達成でき、かつ解析のスループットが向上する。従って、1細胞中の全mRNAシークケンスによるデジタルカウンティングが可能となる。
【図面の簡単な説明】
【0017】
【図1】核酸分析デバイスの概略。
【図2】1プローブが1反応場に固定されている場合のハイブリ効率。
【図3】10プローブが1反応場に固定されている場合のハイブリ効率。
【図4】100プローブが1反応場に固定されている場合のハイブリ効率。
【図5】1000プローブが1反応場に固定されている場合のハイブリ効率。
【図6】1標的核酸/反応場となる標的核酸の割合。
【図7】K=109におけるハイブリ効率。
【図8】K=109における有効mRNA捕捉率。
【図9】核酸分析装置の概略。
【発明を実施するための形態】
【0018】
実施例は、複数のプローブを固定した反応場を備え、

の条件を満足することにより、前記反応場に1個の標的核酸を捕捉する核酸分析デバイス;
ただし、


であり;
[X]はプローブと標的核酸の複合体濃度、[A]は複合体形成前のプローブ濃度、[B]は複合体形成前の標的核酸濃度であり;
プローブ数をa、標的核酸数をb、反応場数をc、プローブと標的核酸との平衡定数をK、アボガドロ数をNA、反応液量をv(ml)とするものを説明する。
【0019】
また、実施例は、aが4×107〜4×1011、bが4×105〜4×108、cが4×105〜4×108であることを特徴とする核酸分析デバイスを説明する。
【0020】
また、実施例は、a/cが2〜10000であることを特徴とする核酸分析デバイスを説明する。
【0021】
また、実施例は、λが0.5以下であることを特徴とする核酸分析デバイスを説明する。
【0022】
また、実施例は、各反応場間の距離が光学分解能200nm以上であることを特徴とする核酸分析デバイスを説明する。
【0023】
また、実施例は、プローブが捕捉した1個の標的核酸に標識ヌクレオチドを取り込ませてシークエンスすることを特徴とする核酸分析デバイスを説明する。
【0024】
また、実施例は、標識ヌクレオチドを、蛍光または発光により検出することを特徴とする核酸分析デバイスを説明する。
【0025】
また、実施例は、標的核酸が、mRNA,miRNA,cDNA,DNAであることを特徴とする核酸分析デバイスを説明する。
【0026】
また、実施例は、標的核酸が、非増幅の核酸であることを特徴とする核酸分析デバイスを説明する。
【0027】
また、実施例は、プローブが、オリゴヌクレオチド,DNA断片,RNA断片,PNA,抗体,ペプチドのいずれかであることを特徴とする核酸分析デバイスを説明する。
【0028】
また、実施例は、核酸分析デバイスを利用する核酸分析装置であって、核酸分析デバイスに対して、ヌクレオチド,蛍光色素を有するヌクレオチド,核酸合成酵素,プライマ及び核酸試料からなる1種類以上の生体分子を供給する手段と、核酸分析デバイスに光を照射する手段と、核酸分析デバイス上においてヌクレオチド,核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する蛍光検出手段とを備えるものを説明する。
【0029】
上記及びその他の本発明の新規な特徴と効果について図面を参照しながら説明する。尚、図面は説明のために用いるものであり、権利範囲を限定するものではない。
【実施例】
【0030】
プローブをA、標的核酸をBとすると、
【0031】
【数1】

である。平衡定数Kを、
【0032】
【数2】

とおくと、
【0033】
【数3】

と表せる。
【0034】
A,Bの全濃度は、
【0035】
【数4】

【0036】
【数5】

であり、(3)へ代入する。
【0037】
【数6】

【0038】
(6)はXに関する二次方程式であるため、Xは下記の式で表せる。
【0039】
【数7】

【0040】
1細胞中のmRNAは約40万個であり、1μLで抽出したと仮定した場合、mRNA濃度は0.66pMである。またプローブ数(1プローブ/1反応場)はmRNAの100倍の4000万個とする。従って、プローブ濃度は66pMである。平衡定数は温度など条件により大きく変わるが、20塩基同士のオリゴヌクレオチドの平衡定数である109とする。以上の条件を(7)へ代入して、mRNAハイブリ効率を計算すると、6.2%と計算される。従って、90%以上のmRNAはハイブリしないため、シークエンスできない。なお平衡定数が1010の場合のハイブリ効率は39.7%、1011の場合のハイブリ効率は86.7%と計算される。
【0041】
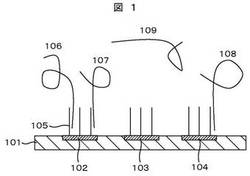
本実施例のデバイスの概念を、図1を用いて説明する。101は、105のプローブを固定するための基板である。102〜104は、単一分子計測を行うための反応場であり、光学分解能200nm以下の面積が良い。ただし、光学分解能以上の面積であっても、一つの標的核酸のみがハイブリしていれば単一分子計測は可能である。反応場102〜104には、複数のプローブ105が固定されている。また、反応場102や反応場103などの各反応場間の距離は、光学分解能200nm以上とする。
【0042】
また、プローブ105は、標的核酸を捕捉するためのプローブであり、標的核酸がmRNAの場合は、ポリAテールをハイブリさせるために、20塩基程度のポリTヌクレオチドであることが望ましい。106〜109は、標的核酸である。2つの標的核酸106及び標的核酸107が、反応場102に固定されたプローブ105にハイブリしている。複数の標的核酸が光学分解能以下の面積である1つの反応場にハイブリした場合、塩基伸長反応に伴うそれぞれの標的核酸からの信号が異なることから、単一分子シーケンスを行うことができない。同様に、反応場103は、一つの標的核酸もハイブリしていないことから、シーケンスを行うことができない。標的核酸109は、プローブにハイブリしていない未反応のmRNAである。標的核酸108は、反応場104に固定されたプローブ105にハイブリしている唯一の核酸のため、単一分子シーケンスが可能である。
【0043】
全ての標的核酸に対して、1つの標的核酸が1つの反応場でハイブリする割合の計算方法を、図1を参考にして以下に概要を示す。まず、全標的核酸数とプローブ数が決まると、(7)式によりハイブリ効率が算出される。従って、全標的核酸のうち何個の標的核酸がプローブとハイブリするかが計算できる。図1では、4つの標的核酸106〜109のうち、3つの標的核酸106〜108がハイブリしていることから、ハイブリ効率は3/4である。次に、ハイブリする3つの標的核酸のうち、何個が1つの反応場に唯一の標的核酸として存在しうるかを計算する。これは、ハイブリする標的核酸数と反応場数から確率論的に算出できる。図1では、3つの標的核酸106〜108のうち、標的核酸108のみがハイブリしていることから、1標的核酸/反応場捕捉率は1/3である。数が多い場合には、ポアソン分布
【0044】
【数8】

を用いてこの確率を計算できる。ここでkは1、λはハイブリする標的核酸/反応場数である。従って、全標的核酸のうち、1標的核酸/反応場となる標的核酸の割合、つまり、有効標的核酸捕捉率は、3/4×1/3で1/4(25%)となる。従って、(7),(8)式より、全ての標的核酸の90%以上を単一分子シーケンスするための条件を算出できる。
【0045】
全ての標的核酸の90%以上を単一分子シーケンスするための条件を以下に計算するが、反応場102〜104のは、標的核酸の10倍以上であることが望ましい。標的核酸と
反応場の比を10倍以上にすることにより、全ての標的核酸がプローブとハイブリした場合でも、90%以上の標的核酸は反応場に1個だけハイブリし、複数の標的核酸が1つの反応場にハイブリする確率は10%以下となるからである。例えば、1細胞中のmRNAは40万個であることから、反応場数は400万個以上あると良い。仮に反応場数を4000万個として、1反応場あたりのプローブ数を10,100,1000個とすると、ハイブリ効率は39.7%,86.8%,98.5%と計算される。また、1標的核酸/反応場となる標的核酸の割合、つまり有効ハイブリ効率は、それぞれ39.5%,86.1%,97.5%となる。
【0046】
図2は、(7)式に基づいて計算したmRNAハイブリ効率である。縦軸にmRNAがハイブリする割合(%)を、横軸に平衡定数をそれぞれ対数表示している。平衡定数は、温度など条件により大きく変わるが、20塩基同士のオリゴヌクレオチドの平衡定数である109を基本として、108〜1012の間で変化させた。計算条件は、1細胞中のmRNA40万個,mRNA濃度0.66pM,プローブ数4000万個、プローブ濃度は66pM,反応場4000万個(1プローブ/反応場)とした。
【0047】
図3は、(7)式に基づいて計算したmRNAハイブリ効率である。縦軸にmRNAがハイブリする割合(%)を、横軸に平衡定数をそれぞれ対数表示している。平衡定数は、温度など条件により大きく変わるが、20塩基同士のオリゴヌクレオチドの平衡定数である109を基本として、108〜1012の間で変化させた。計算条件は、1細胞中のmRNA40万個,mRNA濃度0.66pM,プローブ数4億個,プローブ濃度は660pM,反応場4000万個(10プローブ/反応場)とした。
【0048】
図4は、(7)式に基づいて計算したmRNAハイブリ効率である。縦軸にmRNAがハイブリする割合(%)を、横軸に平衡定数をそれぞれ対数表示している。平衡定数は、温度など条件により大きく変わるが、20塩基同士のオリゴヌクレオチドの平衡定数である109を基本として、108〜1012の間で変化させた。計算条件は、1細胞中のmRNA40万個、mRNA濃度0.66pM、プローブ数40億個、プローブ濃度は6.6nM、反応場4000万個(100プローブ/反応場)とした。
【0049】
図5は、(7)式に基づいて計算したmRNAハイブリ効率である。縦軸にmRNAがハイブリする割合(%)を、横軸に平衡定数をそれぞれ対数表示している。平衡定数は、温度など条件により大きく変わるが、20塩基同士のオリゴヌクレオチドの平衡定数である109を基本として、108〜1012の間で変化させた。計算条件は、1細胞中のmRNA40万個,mRNA濃度0.66pM,プローブ数400億個、プローブ濃度は66nM,反応場4000万個(1000プローブ/反応場)とした。図2〜図5より、反応場数を4000万個、平衡定数を109として、1反応場あたりのプローブ数を1,10,100,1000個とすると、ハイブリ効率は6.2%,39.7%,86.8%,98.5%と高くなることが理解できる。
【0050】
ただし、1反応場あたりのプローブ数が1個の場合でも、平衡定数が109,1010,1011,1012と上がるにつれて、ハイブリ効率は6.2%,39.7%,86.8%,98.5%と高くなる。平衡定数を上げる方法として、ハイブリ温度を下げる、プローブの塩基長を長くする、ハイブリ液の塩濃度を上げる、プローブのGC含量を上げるなどの方法がある。またMinor Groove Binderと呼ばれる分子は、2本鎖核酸の溝に巻きついて分子を安定させる効果を持つ。ただし、いずれの方法でも、平衡定数を3桁上げて1012にすることは難しい。従って、1反応場あたりのプローブ数を増やすことが望ましく、また、上述の平衡定数を上げる方法との併用で、ハイブリ効率は更に高くなる。従って、1反応場あたり数百本のプローブを立てることによりハイブリ効率は90%以上となる。
【0051】
図6は、(8)式に基づいて計算した1mRNA/反応場捕捉率(%)である。1mRNA/反応場捕捉率(%)とは、シーケンス可能な1mRNA/微粒子でハイブリする確率である。この確率は、微粒子数とハイブリするmRNA数の比のみで計算される。一方、複数mRNA/反応場捕捉率(%)とは、シーケンスに適さない複数mRNA/微粒子でハイブリする確率である。以上より、1mRNA/反応場捕捉率が90%以上となるためには、反応場数/ハイブリするmRNA数の比が10以上である必要があり、比が100の場合には、1mRNA/反応場捕捉率が99%以上となる。
【0052】
図7に、平衡定数109における反応場数と、1反応場(site)あたりのプローブ数、とを変化させたときのハイブリ効率をプロットした。また、図8に、平衡定数109における反応場数と、1反応場(site)あたりのプローブ数と、を変化させたときの有効mRNA捕捉率をプロットした。反応場に固定するプローブ数は、プローブ濃度を変えることにより調整できるため、例えば、有効mRNA捕捉率が90%以上となるための条件に設定することにより、1細胞からのmRNAシークエンスが可能となる。
【0053】
図9に、上記核酸デバイスを用いる核酸分析装置について説明する。本装置では、核酸分析デバイスに対して、ヌクレオチド,蛍光色素を有するヌクレオチド,核酸合成酵素,プライマ及び核酸試料からなる1種類以上の生体分子を供給する手段と、核酸分析デバイスに光を照射する手段と、核酸分析デバイス上においてヌクレオチド,核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する蛍光検出手段とを備える。より具体的には、カバープレート601と検出窓602と溶液交換用口である注入口603と排出口604から構成される反応チャンバーに前記のデバイス605を設置する。なお、カバープレート601と検出窓602の材質として、PDMS(Polydimethylsiloxane)を使用する。また、検出窓602の厚さは0.17mmとする。YAGレーザ光源(波長532nm,出力20mW)606およびYAGレーザ光源(波長355nm,出力20mW)607から発振するレーザ光608および609を、レーザ光609のみをλ/4板610によって円偏光し、ダイクロイックミラー611(410nm以下を反射)によって、2つのレーザ光を同軸になるよう調整した後、レンズ612によって集光し、その後、プリズム613を介してデバイス605へ臨界角以上で照射する。本装置によれば、レーザ照射により、デバイス605表面上に存在する金属体において局在型表面プラズモンが発生し、第二の金属に結合したプローブにより捕捉された標的物質の蛍光体は蛍光増強場内に存在することになる。蛍光体はレーザ光で励起され、その増強された蛍光の一部は検出窓602を介して出射される。また、検出窓602より出射される蛍光は、対物レンズ614(×60,NA1.35,作動距離0.15mm)により平行光束とされ、光学フィルタ615により背景光及び励起光が遮断され、結像レンズ616により2次元CCDカメラ617上に結像される。
【0054】
尚、上記実施例では、標識ヌクレオチドを蛍光により検出するものを中心に説明したが、公知の発光技術を応用し、検出してもよい。また、標的核酸がmRNAであるものを中心に説明したが、標的核酸が、miRNA,cDNA,DNAであってもよい。また、プローブが、オリゴヌクレオチドあるもの中心に説明したが、DNA断片,RNA断片,PNA,抗体,ペプチドのいずれかであってもよい。
【符号の説明】
【0055】
101 基板
102〜104 反応場
105 プローブ
106〜108 プローブにハイブリした標的核酸
109 プローブにハイブリしていない標的核酸
601 カバープレート
602 検出窓
603 注入口
604 排出口
605 デバイス
606 YAGレーザ光源(波長532nm,出力20mW)
607 YAGレーザ光源(波長355nm,出力20mW)
608,609 レーザ光
610 λ/4板
611 ダイクロイックミラー
612 レンズ
613 プリズム
614 対物レンズ
615 光学フィルタ
616 結像レンズ
617 2次元CCDカメラ
【技術分野】
【0001】
本発明は、核酸分析技術に関する。例えば、蛍光を用いた単一分子計測デバイスに関する。
【背景技術】
【0002】
現在のDNAシークエンス法は、サンガー法と呼ばれるDNA断片調整法と電気泳動法を組合せたキャピラリーシークエンス方式が用いられており、ヒトゲノム解析等に用いられて大きな成果をあげている。しかしながら、テーラーメイド医療などの観点から個人のゲノム解析を考えたとき、従来法で一度に解析できるDNA断片の長さよりもはるかに長い断片を、迅速・簡便・安価に解析できる技術が強く求められている。ヒトゲノム解析では、一人のヒトゲノムを解読するのに約1000万ドルが必要であったが、将来は10000分の1の1000ドルでヒトゲノム解析を行うことが期待されている。従来のキャピラリーシークエンス法の改良のみでは、これらの要求に応えることは不可能であり、新たな方式に基づくDNAシークエンスが待望されている。
【0003】
上記要求を実現するために、走査型電子顕微鏡を用いてDNAを直接シーケンスする方法や、1本鎖DNAがナノメートルサイズの孔(ポア)を通過するときの電圧値を塩基に変換することを利用したナノポアを用いた方法が提案されているが、技術的課題が多く実用化は難しいと考えられている。
【0004】
最も有望な方法として、光技術を用いた超並列解析法があり、既に数社から化学発光や蛍光の原理に基づく装置が市販されている。この方法の特徴は、マイクロビーズや微細加工技術を用いて反応場を区分けすることにより、超並列解析を可能にしたことである。従来のキャピラリーシークエンス方式では、多チャンネル化(〜384本)によって解析効率の向上が図られているが、本方式では1億個以上の超並列解析も可能である。従って、読み取り塩基長では100塩基以下とキャピラリーシークエンスに劣るものの、1日当たり数十ギガ塩基と、キャピラリーシークエンス方式と比較して1000倍以上のスループットが達成できている。また、解析コストも、ヒトゲノム一人当たり約10万ドルと約100分の1となっている。
【0005】
光技術を用いた超並列解析法は、標的核酸をPCRなどにより増幅してから行う方法と、標的核酸を非増幅で行う方法の2つがある。非増幅の場合には、決定した配列に誤りがある可能性があるため、一旦核酸を増幅してから蛍光検出と段階反応によって配列を決定する方法と比較して確実性に劣る。ただし、核酸増幅を行わない分コストが安く済むため、1000ドルゲノムを達成する有力な方法である。
【0006】
単一分子計測方式に基づく非増幅での標的核酸の塩基解読方法は、主に以下の2つである。ひとつは、1本のDNAの末端からエキソヌクレアーゼを用いて、ヌクレオチドを1個ずつ順番に切断して検出するエキソヌクレアーゼ法であり、もうひとつは1本の標的核酸を用意して、その塩基配列と相補的なヌクレオチドをDNAポリメラーゼが1個ずつ取り込むのを検出するポリメラーゼ法である。エキソヌクレアーゼ法は、標識された色素が酵素反応を妨害するという課題を解決できていないが、ポリメラーゼ法は、蛍光標識する部位を工夫することにより、標識された色素が酵素反応を妨害するという困難を解決できる。ヌクレオチドに標識する方法や、酵素とヌクレオチドをそれぞれ異なる蛍光色素で標識して、1〜10nmの極近傍でのみ共鳴エネルギー移動FRET(Fluorescence Resonance Energy Transfer)を起こさせる方法がある。いずれの方法においてもヌクレオチド自体は蛍光量子収率が10-4と低いため、そのままでは単一分子の検出は不可能である。従って蛍光量子収率が0.1以上の蛍光色素で標識した蛍光ヌクレオチドが必要となる。
【0007】
核酸の増幅・非増幅の有無は、ゲノム解析や新規ゲノム解析の場合には問題とならないが、発現解析へ適用する場合には、PCR等による増幅効率が初期鋳型量に必ずしも比例しないことから、非増幅で行う方が好ましい。
【0008】
現状、マイクロアレイで行われている発現解析では、まず健常者・非健常者から数千個の細胞を採取して、mRNAを抽出する。その後、cDNAに変換してPCRで増幅し、Cy3・Cy5でそれぞれ標識する。それらを混合したものをDNAチップにハイブリさせて蛍光スキャナーで検出することにより、非健常者に特異的に発現している遺伝子を特定する。ただし、この方法では非健常者から採取した細胞の中にも健全な細胞が含まれること、PCRによる増幅効率が初期鋳型量に必ずしも比例しないことから、あくまでも平均値での比較でしかない。従って、これまでに得られている様々な生物学的情報は、種々の細胞や組織から得た試料のため、平均化されているのである。平均化された情報を繋ぎ合わせても本当の生命現象は見えてこない。生命システムの基本は細胞であり、細胞に含まれるゲノム,mRNA,タンパク質、あるいは代謝物などの分子情報,反応情報,分布情報を、時間変化も含めて解明することが望まれている。生命現象をシステムとして理解することが今後の課題であり、高精度な発現解析を行うために、究極的には、1細胞から標的核酸を非増幅でシークケンスすることが望まれる。核酸1分子を鋳型として相補鎖合成反応を行うことで、相補鎖合成の反応効率に左右されずに長い核酸配列の解読が可能になるため、1細胞から核酸を増幅することなくシークケンスする方法が期待される。特に、1細胞中の全mRNAを非増幅でシークエンスすることにより、発現しているmRNAの個数を数えて比較するデジタルカウンティングが生命現象の理解に必要となると考えられる。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】P.N.A.S. 2003, Vol. 100, pp. 3960-3964.
【発明の概要】
【発明が解決しようとする課題】
【0010】
本願発明者が単分子シークエンサーを用いた発現解析について鋭意検討した結果、次のような知見を得た。
【0011】
現在、単分子シークエンサーが実用化されつつあり、非増幅で標的核酸をプローブにハイブリさせ、1塩基ずつ蛍光ヌクレオチドで伸長させながらシークエンスしている。1細胞中のmRNA全てをシークエンスする場合、mRNA全てをプローブとハイブリさせる必要がある。ハイブリ効率は、プローブ濃度,mRNA濃度,プローブ−mRNA複合体濃度,プローブ−mRNA複合体の平衡定数により決定される。1細胞中のmRNAは約40万個であり、1μLで抽出したと仮定した場合、mRNA濃度は0.66pMと極めて低い。プローブ数をmRNAの100倍と仮定すると、プローブ濃度は66pMである。また、平衡定数は109とする。以上のパラメータの場合、ハイブリ効率は6.2%と計算され、100%のmRNAをハイブリさせることはできない。従って、1細胞中の全mRNAシークケンスは困難である。mRNAのデジタルカウンティングを行うためには90%以上のハイブリ効率が望まれる。
【0012】
1細胞中のmRNA全てをハイブリさせるためには、プローブ数を増やしてプローブ濃度を上げることが有効である。プローブ濃度を66pMの10倍,100倍,1000倍と上げることにより、ハイブリ効率は39.7%,86.8%,98.5%と高くなる。
【0013】
ただし、別の制約として、単分子シーケンサーでは、単一分子を光学分解能以上の距離(>200nm)に置く必要がある。従って、安易にプローブ濃度(プローブ数)を上げることは、装置のスループット低下に繋がる。例えば、プローブが1μmピッチで固定されていると仮定すると、プローブ濃度66pM(プローブ4000万本)では40mm2の面積が必要となる。顕微鏡で一度に観察できる視野をφ0.5mmとすると、視野面積は約0.2mm2となり、40mm2/0.2mm2で計80回の視野移動が必要である。1回の視野移動に3秒とすると、全ての視野を検出するのに4分かかる。プローブ濃度を10倍,100倍,1000倍と上げることで、ハイブリ効率は39.7%,86.8%,98.5%と高くなるが、視野移動の回数もそれぞれ800,8000,80000回となるため、スループットはプローブ濃度に比例して40分,400分,4000分と悪くなる。この議論は、光学分解能以下の距離にプローブをランダムにばら撒いた後に、確率的に標的核酸が光学分解能以上の距離でハイブリするように標的核酸の濃度を調製する場合にも成立する。
【0014】
本発明の目的は、高いハイブリ効率かつ高スループットな単分子シークエンス法の提供に関する。
【課題を解決するための手段】
【0015】
高いハイブリ効率かつ高スループットな単分子シークエンス法のためには、総プローブ数が一定であることと、光学分解能以上の距離に最低限の数の反応場がある必要がある。
従って、本発明では、複数のプローブが固定された反応場を複数備えており、1個の標的核酸が反応場のプローブのいずれかにハイブリするようにする。ただし、各反応場間の距離は、単分子計測を行うために光学分解能以上離れている必要がある。標的核酸と反応場の比を10倍以上にすることで、全ての標的核酸がプローブとハイブリした場合でも、90%以上の標的核酸は反応場に1個だけハイブリし、複数の標的核酸が1つの反応場にハイブリする確率は10%以下となる。
【発明の効果】
【0016】
本発明により、短時間で高いハイブリ効率を達成でき、かつ解析のスループットが向上する。従って、1細胞中の全mRNAシークケンスによるデジタルカウンティングが可能となる。
【図面の簡単な説明】
【0017】
【図1】核酸分析デバイスの概略。
【図2】1プローブが1反応場に固定されている場合のハイブリ効率。
【図3】10プローブが1反応場に固定されている場合のハイブリ効率。
【図4】100プローブが1反応場に固定されている場合のハイブリ効率。
【図5】1000プローブが1反応場に固定されている場合のハイブリ効率。
【図6】1標的核酸/反応場となる標的核酸の割合。
【図7】K=109におけるハイブリ効率。
【図8】K=109における有効mRNA捕捉率。
【図9】核酸分析装置の概略。
【発明を実施するための形態】
【0018】
実施例は、複数のプローブを固定した反応場を備え、

の条件を満足することにより、前記反応場に1個の標的核酸を捕捉する核酸分析デバイス;
ただし、


であり;
[X]はプローブと標的核酸の複合体濃度、[A]は複合体形成前のプローブ濃度、[B]は複合体形成前の標的核酸濃度であり;
プローブ数をa、標的核酸数をb、反応場数をc、プローブと標的核酸との平衡定数をK、アボガドロ数をNA、反応液量をv(ml)とするものを説明する。
【0019】
また、実施例は、aが4×107〜4×1011、bが4×105〜4×108、cが4×105〜4×108であることを特徴とする核酸分析デバイスを説明する。
【0020】
また、実施例は、a/cが2〜10000であることを特徴とする核酸分析デバイスを説明する。
【0021】
また、実施例は、λが0.5以下であることを特徴とする核酸分析デバイスを説明する。
【0022】
また、実施例は、各反応場間の距離が光学分解能200nm以上であることを特徴とする核酸分析デバイスを説明する。
【0023】
また、実施例は、プローブが捕捉した1個の標的核酸に標識ヌクレオチドを取り込ませてシークエンスすることを特徴とする核酸分析デバイスを説明する。
【0024】
また、実施例は、標識ヌクレオチドを、蛍光または発光により検出することを特徴とする核酸分析デバイスを説明する。
【0025】
また、実施例は、標的核酸が、mRNA,miRNA,cDNA,DNAであることを特徴とする核酸分析デバイスを説明する。
【0026】
また、実施例は、標的核酸が、非増幅の核酸であることを特徴とする核酸分析デバイスを説明する。
【0027】
また、実施例は、プローブが、オリゴヌクレオチド,DNA断片,RNA断片,PNA,抗体,ペプチドのいずれかであることを特徴とする核酸分析デバイスを説明する。
【0028】
また、実施例は、核酸分析デバイスを利用する核酸分析装置であって、核酸分析デバイスに対して、ヌクレオチド,蛍光色素を有するヌクレオチド,核酸合成酵素,プライマ及び核酸試料からなる1種類以上の生体分子を供給する手段と、核酸分析デバイスに光を照射する手段と、核酸分析デバイス上においてヌクレオチド,核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する蛍光検出手段とを備えるものを説明する。
【0029】
上記及びその他の本発明の新規な特徴と効果について図面を参照しながら説明する。尚、図面は説明のために用いるものであり、権利範囲を限定するものではない。
【実施例】
【0030】
プローブをA、標的核酸をBとすると、
【0031】
【数1】

である。平衡定数Kを、
【0032】
【数2】

とおくと、
【0033】
【数3】

と表せる。
【0034】
A,Bの全濃度は、
【0035】
【数4】

【0036】
【数5】

であり、(3)へ代入する。
【0037】
【数6】

【0038】
(6)はXに関する二次方程式であるため、Xは下記の式で表せる。
【0039】
【数7】

【0040】
1細胞中のmRNAは約40万個であり、1μLで抽出したと仮定した場合、mRNA濃度は0.66pMである。またプローブ数(1プローブ/1反応場)はmRNAの100倍の4000万個とする。従って、プローブ濃度は66pMである。平衡定数は温度など条件により大きく変わるが、20塩基同士のオリゴヌクレオチドの平衡定数である109とする。以上の条件を(7)へ代入して、mRNAハイブリ効率を計算すると、6.2%と計算される。従って、90%以上のmRNAはハイブリしないため、シークエンスできない。なお平衡定数が1010の場合のハイブリ効率は39.7%、1011の場合のハイブリ効率は86.7%と計算される。
【0041】
本実施例のデバイスの概念を、図1を用いて説明する。101は、105のプローブを固定するための基板である。102〜104は、単一分子計測を行うための反応場であり、光学分解能200nm以下の面積が良い。ただし、光学分解能以上の面積であっても、一つの標的核酸のみがハイブリしていれば単一分子計測は可能である。反応場102〜104には、複数のプローブ105が固定されている。また、反応場102や反応場103などの各反応場間の距離は、光学分解能200nm以上とする。
【0042】
また、プローブ105は、標的核酸を捕捉するためのプローブであり、標的核酸がmRNAの場合は、ポリAテールをハイブリさせるために、20塩基程度のポリTヌクレオチドであることが望ましい。106〜109は、標的核酸である。2つの標的核酸106及び標的核酸107が、反応場102に固定されたプローブ105にハイブリしている。複数の標的核酸が光学分解能以下の面積である1つの反応場にハイブリした場合、塩基伸長反応に伴うそれぞれの標的核酸からの信号が異なることから、単一分子シーケンスを行うことができない。同様に、反応場103は、一つの標的核酸もハイブリしていないことから、シーケンスを行うことができない。標的核酸109は、プローブにハイブリしていない未反応のmRNAである。標的核酸108は、反応場104に固定されたプローブ105にハイブリしている唯一の核酸のため、単一分子シーケンスが可能である。
【0043】
全ての標的核酸に対して、1つの標的核酸が1つの反応場でハイブリする割合の計算方法を、図1を参考にして以下に概要を示す。まず、全標的核酸数とプローブ数が決まると、(7)式によりハイブリ効率が算出される。従って、全標的核酸のうち何個の標的核酸がプローブとハイブリするかが計算できる。図1では、4つの標的核酸106〜109のうち、3つの標的核酸106〜108がハイブリしていることから、ハイブリ効率は3/4である。次に、ハイブリする3つの標的核酸のうち、何個が1つの反応場に唯一の標的核酸として存在しうるかを計算する。これは、ハイブリする標的核酸数と反応場数から確率論的に算出できる。図1では、3つの標的核酸106〜108のうち、標的核酸108のみがハイブリしていることから、1標的核酸/反応場捕捉率は1/3である。数が多い場合には、ポアソン分布
【0044】
【数8】

を用いてこの確率を計算できる。ここでkは1、λはハイブリする標的核酸/反応場数である。従って、全標的核酸のうち、1標的核酸/反応場となる標的核酸の割合、つまり、有効標的核酸捕捉率は、3/4×1/3で1/4(25%)となる。従って、(7),(8)式より、全ての標的核酸の90%以上を単一分子シーケンスするための条件を算出できる。
【0045】
全ての標的核酸の90%以上を単一分子シーケンスするための条件を以下に計算するが、反応場102〜104のは、標的核酸の10倍以上であることが望ましい。標的核酸と
反応場の比を10倍以上にすることにより、全ての標的核酸がプローブとハイブリした場合でも、90%以上の標的核酸は反応場に1個だけハイブリし、複数の標的核酸が1つの反応場にハイブリする確率は10%以下となるからである。例えば、1細胞中のmRNAは40万個であることから、反応場数は400万個以上あると良い。仮に反応場数を4000万個として、1反応場あたりのプローブ数を10,100,1000個とすると、ハイブリ効率は39.7%,86.8%,98.5%と計算される。また、1標的核酸/反応場となる標的核酸の割合、つまり有効ハイブリ効率は、それぞれ39.5%,86.1%,97.5%となる。
【0046】
図2は、(7)式に基づいて計算したmRNAハイブリ効率である。縦軸にmRNAがハイブリする割合(%)を、横軸に平衡定数をそれぞれ対数表示している。平衡定数は、温度など条件により大きく変わるが、20塩基同士のオリゴヌクレオチドの平衡定数である109を基本として、108〜1012の間で変化させた。計算条件は、1細胞中のmRNA40万個,mRNA濃度0.66pM,プローブ数4000万個、プローブ濃度は66pM,反応場4000万個(1プローブ/反応場)とした。
【0047】
図3は、(7)式に基づいて計算したmRNAハイブリ効率である。縦軸にmRNAがハイブリする割合(%)を、横軸に平衡定数をそれぞれ対数表示している。平衡定数は、温度など条件により大きく変わるが、20塩基同士のオリゴヌクレオチドの平衡定数である109を基本として、108〜1012の間で変化させた。計算条件は、1細胞中のmRNA40万個,mRNA濃度0.66pM,プローブ数4億個,プローブ濃度は660pM,反応場4000万個(10プローブ/反応場)とした。
【0048】
図4は、(7)式に基づいて計算したmRNAハイブリ効率である。縦軸にmRNAがハイブリする割合(%)を、横軸に平衡定数をそれぞれ対数表示している。平衡定数は、温度など条件により大きく変わるが、20塩基同士のオリゴヌクレオチドの平衡定数である109を基本として、108〜1012の間で変化させた。計算条件は、1細胞中のmRNA40万個、mRNA濃度0.66pM、プローブ数40億個、プローブ濃度は6.6nM、反応場4000万個(100プローブ/反応場)とした。
【0049】
図5は、(7)式に基づいて計算したmRNAハイブリ効率である。縦軸にmRNAがハイブリする割合(%)を、横軸に平衡定数をそれぞれ対数表示している。平衡定数は、温度など条件により大きく変わるが、20塩基同士のオリゴヌクレオチドの平衡定数である109を基本として、108〜1012の間で変化させた。計算条件は、1細胞中のmRNA40万個,mRNA濃度0.66pM,プローブ数400億個、プローブ濃度は66nM,反応場4000万個(1000プローブ/反応場)とした。図2〜図5より、反応場数を4000万個、平衡定数を109として、1反応場あたりのプローブ数を1,10,100,1000個とすると、ハイブリ効率は6.2%,39.7%,86.8%,98.5%と高くなることが理解できる。
【0050】
ただし、1反応場あたりのプローブ数が1個の場合でも、平衡定数が109,1010,1011,1012と上がるにつれて、ハイブリ効率は6.2%,39.7%,86.8%,98.5%と高くなる。平衡定数を上げる方法として、ハイブリ温度を下げる、プローブの塩基長を長くする、ハイブリ液の塩濃度を上げる、プローブのGC含量を上げるなどの方法がある。またMinor Groove Binderと呼ばれる分子は、2本鎖核酸の溝に巻きついて分子を安定させる効果を持つ。ただし、いずれの方法でも、平衡定数を3桁上げて1012にすることは難しい。従って、1反応場あたりのプローブ数を増やすことが望ましく、また、上述の平衡定数を上げる方法との併用で、ハイブリ効率は更に高くなる。従って、1反応場あたり数百本のプローブを立てることによりハイブリ効率は90%以上となる。
【0051】
図6は、(8)式に基づいて計算した1mRNA/反応場捕捉率(%)である。1mRNA/反応場捕捉率(%)とは、シーケンス可能な1mRNA/微粒子でハイブリする確率である。この確率は、微粒子数とハイブリするmRNA数の比のみで計算される。一方、複数mRNA/反応場捕捉率(%)とは、シーケンスに適さない複数mRNA/微粒子でハイブリする確率である。以上より、1mRNA/反応場捕捉率が90%以上となるためには、反応場数/ハイブリするmRNA数の比が10以上である必要があり、比が100の場合には、1mRNA/反応場捕捉率が99%以上となる。
【0052】
図7に、平衡定数109における反応場数と、1反応場(site)あたりのプローブ数、とを変化させたときのハイブリ効率をプロットした。また、図8に、平衡定数109における反応場数と、1反応場(site)あたりのプローブ数と、を変化させたときの有効mRNA捕捉率をプロットした。反応場に固定するプローブ数は、プローブ濃度を変えることにより調整できるため、例えば、有効mRNA捕捉率が90%以上となるための条件に設定することにより、1細胞からのmRNAシークエンスが可能となる。
【0053】
図9に、上記核酸デバイスを用いる核酸分析装置について説明する。本装置では、核酸分析デバイスに対して、ヌクレオチド,蛍光色素を有するヌクレオチド,核酸合成酵素,プライマ及び核酸試料からなる1種類以上の生体分子を供給する手段と、核酸分析デバイスに光を照射する手段と、核酸分析デバイス上においてヌクレオチド,核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により核酸鎖中に取り込まれた蛍光色素の蛍光を測定する蛍光検出手段とを備える。より具体的には、カバープレート601と検出窓602と溶液交換用口である注入口603と排出口604から構成される反応チャンバーに前記のデバイス605を設置する。なお、カバープレート601と検出窓602の材質として、PDMS(Polydimethylsiloxane)を使用する。また、検出窓602の厚さは0.17mmとする。YAGレーザ光源(波長532nm,出力20mW)606およびYAGレーザ光源(波長355nm,出力20mW)607から発振するレーザ光608および609を、レーザ光609のみをλ/4板610によって円偏光し、ダイクロイックミラー611(410nm以下を反射)によって、2つのレーザ光を同軸になるよう調整した後、レンズ612によって集光し、その後、プリズム613を介してデバイス605へ臨界角以上で照射する。本装置によれば、レーザ照射により、デバイス605表面上に存在する金属体において局在型表面プラズモンが発生し、第二の金属に結合したプローブにより捕捉された標的物質の蛍光体は蛍光増強場内に存在することになる。蛍光体はレーザ光で励起され、その増強された蛍光の一部は検出窓602を介して出射される。また、検出窓602より出射される蛍光は、対物レンズ614(×60,NA1.35,作動距離0.15mm)により平行光束とされ、光学フィルタ615により背景光及び励起光が遮断され、結像レンズ616により2次元CCDカメラ617上に結像される。
【0054】
尚、上記実施例では、標識ヌクレオチドを蛍光により検出するものを中心に説明したが、公知の発光技術を応用し、検出してもよい。また、標的核酸がmRNAであるものを中心に説明したが、標的核酸が、miRNA,cDNA,DNAであってもよい。また、プローブが、オリゴヌクレオチドあるもの中心に説明したが、DNA断片,RNA断片,PNA,抗体,ペプチドのいずれかであってもよい。
【符号の説明】
【0055】
101 基板
102〜104 反応場
105 プローブ
106〜108 プローブにハイブリした標的核酸
109 プローブにハイブリしていない標的核酸
601 カバープレート
602 検出窓
603 注入口
604 排出口
605 デバイス
606 YAGレーザ光源(波長532nm,出力20mW)
607 YAGレーザ光源(波長355nm,出力20mW)
608,609 レーザ光
610 λ/4板
611 ダイクロイックミラー
612 レンズ
613 プリズム
614 対物レンズ
615 光学フィルタ
616 結像レンズ
617 2次元CCDカメラ
【特許請求の範囲】
【請求項1】
複数の反応場を有する核酸分析デバイスに対して、ヌクレオチド、蛍光色素を有するヌクレオチド、核酸合成酵素、プローブ、及び標的核酸を供給する工程と、
核酸分析デバイスに光を照射する工程と、
ヌクレオチド、核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により取り込まれた蛍光色素の蛍光を測定する蛍光検出工程と、を含む、核酸分析方法であって、
反応場の数は、400万個以上であり、
反応場の数は、標的核酸の10倍以上であり、
プローブの数は、1反応場あたり100〜1000個であることを特徴とする、核酸分析方法。
【請求項2】
請求項1において、
各反応場間の距離が200nm以上であることを特徴とする核酸分析方法。
【請求項3】
請求項1において、
前記標的核酸が、mRNA,miRNA,cDNA,DNAのいずれかであることを特徴とする核酸分析方法。
【請求項4】
請求項1において、
前記標的核酸が、非増幅の核酸であることを特徴とする核酸分析方法。
【請求項5】
請求項1において、
前記プローブが、オリゴヌクレオチド,DNA断片,RNA断片,PNA,抗体,ペプチドのいずれかであることを特徴とする核酸分析方法。
【請求項6】
複数の反応場を有する核酸分析デバイスに対して、ヌクレオチド、発光色素を有するヌクレオチド、核酸合成酵素、プローブ、及び標的核酸を供給する工程と、
核酸分析デバイスに光を照射する工程と、
ヌクレオチド、核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により取り込まれた発光色素の発光を測定する発光検出工程と、を含む、核酸分析方法であって、
反応場の数は、400万個以上であり、
反応場の数は、標的核酸の10倍以上であり、
プローブの数は、1反応場あたり100〜1000個であることを特徴とする、核酸分析方法。
【請求項1】
複数の反応場を有する核酸分析デバイスに対して、ヌクレオチド、蛍光色素を有するヌクレオチド、核酸合成酵素、プローブ、及び標的核酸を供給する工程と、
核酸分析デバイスに光を照射する工程と、
ヌクレオチド、核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により取り込まれた蛍光色素の蛍光を測定する蛍光検出工程と、を含む、核酸分析方法であって、
反応場の数は、400万個以上であり、
反応場の数は、標的核酸の10倍以上であり、
プローブの数は、1反応場あたり100〜1000個であることを特徴とする、核酸分析方法。
【請求項2】
請求項1において、
各反応場間の距離が200nm以上であることを特徴とする核酸分析方法。
【請求項3】
請求項1において、
前記標的核酸が、mRNA,miRNA,cDNA,DNAのいずれかであることを特徴とする核酸分析方法。
【請求項4】
請求項1において、
前記標的核酸が、非増幅の核酸であることを特徴とする核酸分析方法。
【請求項5】
請求項1において、
前記プローブが、オリゴヌクレオチド,DNA断片,RNA断片,PNA,抗体,ペプチドのいずれかであることを特徴とする核酸分析方法。
【請求項6】
複数の反応場を有する核酸分析デバイスに対して、ヌクレオチド、発光色素を有するヌクレオチド、核酸合成酵素、プローブ、及び標的核酸を供給する工程と、
核酸分析デバイスに光を照射する工程と、
ヌクレオチド、核酸合成酵素、及び核酸試料が共存することにより起きる核酸伸長反応により取り込まれた発光色素の発光を測定する発光検出工程と、を含む、核酸分析方法であって、
反応場の数は、400万個以上であり、
反応場の数は、標的核酸の10倍以上であり、
プローブの数は、1反応場あたり100〜1000個であることを特徴とする、核酸分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−223197(P2012−223197A)
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願番号】特願2012−162257(P2012−162257)
【出願日】平成24年7月23日(2012.7.23)
【分割の表示】特願2008−175172(P2008−175172)の分割
【原出願日】平成20年7月4日(2008.7.4)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願日】平成24年7月23日(2012.7.23)
【分割の表示】特願2008−175172(P2008−175172)の分割
【原出願日】平成20年7月4日(2008.7.4)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

