生理活性判定方法、及び生理活性判定用キット
【課題】 コロニーを形成する微生物集団をコロニーの形態を維持したまま、かつ生存させたまま染色して、微生物の生理活性を適格に判定することが可能な生理活性判定方法、及び生理活性判定用キットを提供する。
【解決手段】 微生物を濾過膜上に捕集して培養した後、該濾過膜の下面側から浸透させた蛍光染色液で前記濾過膜上の微生物を染色する。蛍光染色液中には、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有させる。
【解決手段】 微生物を濾過膜上に捕集して培養した後、該濾過膜の下面側から浸透させた蛍光染色液で前記濾過膜上の微生物を染色する。蛍光染色液中には、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有させる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微生物の生理活性判定方法、及び生理活性判定用キットに関する。更に詳しくは、微生物のコロニー形成過程における生理活性の判定に好適な微生物の生理活性判定方法、及び生理活性判定用キットに関する。
【背景技術】
【0002】
蛍光標識を用いて細胞の生理活性を測定する方法は、動物細胞では様々なシステムが開発されている。例えば、アポトーシスや細胞周期などの測定は、測定用システムが市販されている。
一方微生物については、火炎固定やアルコール固定等により固定化してから、コロニー中の特定のDNA若しくはRNAを蛍光で検出するFISH法などによる観察が行われている。この場合、固定化により、コロニー中の微生物は総て死滅するので、微生物の生理活性は、特定遺伝子の発現状況等から、間接的に判定することになる。
これに対して、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有する蛍光染色液で微生物を染色して、生菌数と死菌数とを個別に計数する技術が開発されている(特許文献1、2)。
また、微生物を濾過膜上に捕集して培養した後に、微生物を固定化しない状態で蛍光染料を上から滴下することにより染色して、コロニー数を計測する技術が開発されている(特許文献3)。
【特許文献1】特開2000−232897号公報
【特許文献2】特開2003−284592号公報
【特許文献3】特開平9−37794号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかし、特許文献1に記載の技術は、液体中で微生物の生理活性を調べるため、土壌中の微生物等、固体表面で生息してコロニーを形成する微生物の生理活性を適格に評価することはできなかった。また、特許文献2では、フローサイトメトリを用いる液体系の蛍光測定だけでなく、レーザスキャニングサイトメータを用いる固体系の蛍光測定についても記載されているが、その具体的な手法は明らかにされていなかった。
一方、特許文献3の技術では、微生物を濾過膜上で培養するので、土壌中の微生物等の生息環境に、より近い状態での評価が可能である。しかしながら、特許文献3の技術では、上から蛍光染料を滴下する時にコロニーが崩れてしまう。そのため、培養されたコロニーの状態をそのまま観察したり、蛍光測定の結果を統計的に評価したりすることができなかった。また、生細胞と死細胞とを区別して検知することもできなかった。
本発明は、上記事情に鑑みてなされたものであって、コロニーを形成する微生物集団をコロニーの形態を維持したまま、かつ生存させたまま染色して、微生物の生理活性を適格に判定することが可能な生理活性判定方法、及び生理活性判定用キットを提供することを課題とする。
【課題を解決するための手段】
【0004】
本発明は、以下の態様を備える。
[1]微生物を濾過膜上に捕集して培養した後、該濾過膜の下面側から浸透させた蛍光染色液で前記濾過膜上の微生物を染色することを特徴とする微生物の生理活性判定方法。
[2]前記培養を特定化合物の存在下で行い、該特定化合物の影響を評価する[1]に記載の生理活性判定方法。
[3]前記蛍光染色液が、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有する[1]または[2]に記載の生理活性判定方法。
[4]微生物を染色した後の前記濾過膜を風乾後、該濾過膜に浸漬油を浸透させ、その後該浸漬油を除去する[1]から[3]の何れかに記載の生理活性判定方法。
[5]微生物を染色した後の前記濾過膜上に励起光を照射し、蛍光顕微鏡で蛍光画像を観察する[1]から[4]の何れかに記載の生理活性判定方法。
[6]微生物を染色した後の前記濾過膜上に励起光を照射し、得られる蛍光強度を測定する[1]から[4]の何れかに記載の生理活性判定方法。
[7][1]から[6]の何れかに記載の生理活性判定方法を行うための生理活性判定用キットであって、濾過膜と、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを備えることを特徴とする生理活性判定用キット。
【発明の効果】
【0005】
[1]〜[6]の発明によれば、コロニーを形成する微生物集団をコロニーの形態を維持したまま、かつ生存させたまま染色して、微生物の生理活性を適格に判定することができる。
[7]の発明によれば、本発明の生理活性判定方法を効率よく実施することができる。
【発明を実施するための最良の形態】
【0006】
[微生物の捕集]
本発明による生理活性判定方法の対象となる微生物は、細菌、酵母、かび及びこれらの芽胞のいずれをも含むが、土壌中の微生物等、固体表面で生息してコロニーを形成する微生物が好ましい。
微生物は、野生株でもよいし特定の変異を加えた変異株でもよい。野生株と変異株とを同一条件で培養して染色することにより、特定の変異が生理活性に与える影響を評価できる。
【0007】
微生物の捕集は、好ましくは0.8μmあるいはこれ以下の孔径を有する濾過膜を使用することが好ましい。濾過膜としては、多孔質濾過膜やデプスフィルターなど、従来から広く採用されているものを使用できる。
濾過膜は親水性が高いことが好ましい。これにより、蛍光染色液の浸透が容易となる。また、濾過膜は、風乾等各種処理工程を経ても平面性を維持できるものが好ましい。これにより染色後の観察や蛍光強度測定が容易となる。これらを考慮すると、合成高分子製の濾過膜が好適である。
具体的には、各種ポリオレフィン、特に塩素やフッ素などのハロゲン置換ポリオレフィン、各種ポリアミド、ポリサルホン、ポリエーテル、ポリカーボネートなどの素材のものを使用できる。また、それらの表面を物理的もしくは化学的に修飾して水酸基、アミノ基、陰イオン交換基、陽イオン交換基などの親水性基を付与した機能性濾過膜なども使用できる。
【0008】
捕集は、常法に従って微生物を含む懸濁液を吸引濾過して捕集することが好ましい。懸濁液中に適当な数の微生物が存在する場合には、吸引濾過することなく単に濾過膜上に懸濁液を付着させることにより捕集してもよい。
【0009】
[微生物の培養]
培養は微生物を捕集した濾過膜を平板培地上に置くことにより行うことが好ましい。培地としては、微生物捕集面の反対面から養分等を円滑に供給できるものであればよく、従来のほとんどの寒天培地が使用できる。特定の検出すべき微生物を対象とする選択培地を使用してもよい。また、好気下もしくは嫌気下いずれの条件も目的に応じて採用できる。
培地中には、微生物の生息環境に近づけるために、生息環境に応じた成分を添加することができる。例えば、土壌中に生息する微生物の場合には、土壌抽出液を添加することができる。
【0010】
培地中には、染料と反応してコロニーとの染色反応を阻害する成分を含まないことが好ましい。もし、染色反応を阻害する成分を含有させざるを得ない場合には、培養後、染色前にろ紙などを使用して培地成分を吸い取るか、洗浄して洗い去ることが必要である。この際、コロニーの濾過膜面からの剥離や移動を避けるようにしなければならないことは当然である。
【0011】
培養は、特定化合物の存在下で行うことができる。この場合、その特定化合物が微生物の生理活性に与える影響を評価することができる。なお、「特定化合物の存在下」とは、特定化合物を培養環境中に存在させた状態をいう。培養環境中に存在させる具体的な方法としては、培地中に特定化合物を添加する方法が挙げられる。また、特定化合物が揮発性の場合には、培地を入れた密閉容器内に特定化合物を入れ、これを気化させる方法が挙げられる。
特定化合物としては、例えば、有用微生物の生理活性を阻害する可能性のある化合物を選択することができる。これにより、有用微生物の有用な作用を効率的に得るための条件を調査することができる。また、抗生物質を特定化合物とすることもできる。この場合、抗生物質の効力のスクリーニング等が可能となる。
【0012】
培養時の温度は、一般的には対象となる微生物の生息環境と同等の温度とする。ただし、温度の影響を評価するために、生息環境とある程度異なる温度で培養を行ってもよい。
培養時間は、微生物の種類や目的とする評価内容によって異なるが、約12時間程度で、統計的な処理が可能となる程度のコロニーが得られる。したがって、12時間以上の時間とすることが好ましい。
【0013】
[微生物の染色]
本発明では、微生物を生存させたまま染色できるので、蛍光染色液には、生細胞のみを選択的に染色する生細胞染色用蛍光染料を含有させることが好ましい。これにより、微生物の生理活性を直接的に確認できる。また、死細胞のみを選択的に染色する死細胞染色用蛍光染料も併せて含有させることが好ましい。これにより、コロニー中の生細胞と死細胞とを判別して生理活性を判定することができる。さらに、対象とした微生物の全細胞を染色する染料を含有させてもよい。なお、2種以上の染料を含有させる場合には、各々の染料による蛍光波長を異なるものとする必要がある。
【0014】
生細胞染色用蛍光染料は、微生物の細胞構造や細胞形成成分が、細胞内への浸透性の良いものか否かによって適宜選択する。
浸透性の悪い生細胞に対しては細胞内への浸透性に優れるアセトキシメチルエステル化したアセトキシメチルエステル化カルセインやアセトキシメチルエステル化ビスカルボキシエチルカルボキシルフルオレセインを用いることができる。また、細胞内への浸透性が比較的良い生細胞にはフルオレセインジアセテートサクシニミジルエステル、カルボキシルフルオレセインジアセテート、フルオレセインジアセテート、ジフルオレセインジアセテートを用いることができる。
【0015】
死細胞染色用蛍光染料染色用蛍光染料としてはプロピデュームイオダイド、エティデュームブロマイド、エティデュームホモダイマーから選ばれる螢光染料を選択することができる。
対象とした微生物の全細胞を染色する染料としては、アクリジンオレンジ、4’,6−ジアミジン−2−フェニルインドール,ジハイドロクロライド、6−ジメチルアミノ−2−[4−[4−(ジメチルアミノ)フェニル]−1,3−ブタジエニル]−1−エチルキノリニウムパークロレート、2’−(4−ヒドロキシフェニル)−5−(4−メチル−1−ピペラジニル)−2,5’−ジ−1H−ベンジミダゾルトリハイドロクロライド、2’−(4−エトキシフェニル)−5−(4−メチル−1−ピペラジニル)−2,5’−ジ−1H−ベンジミダゾルトリハイドロクロライドが挙げられる。
【0016】
蛍光染色液は、上記各種蛍光染料を生理食塩水等の緩衝液に溶解させたものである。蛍光染色液中の蛍光染料は、生理食塩水に対して、各々3〜15μmol/mLの濃度で含有させることが好ましい。
【0017】
蛍光染色液中には、浸透促進剤や流出防止剤を含有させてもよい。浸透促進剤は、微生物細胞中への染料の浸透を促進するもので、例えば、塩類、キチネス、セルラーゼ等が挙げられる。流出防止剤は、細胞中へ浸透した染料の流出を防止するためのもので、例えば、ジエチルスチルベストロール若しくはN,N′−ジシクロヘキシルカーボジイミドが挙げられる。蛍光染色液中には、抗体等を含有させてもよい。
【0018】
染色は、濾過膜の下面側(微生物の捕集面と反対側)から上記蛍光染色液を浸透させることによって行う。具体的には、スライドグラス等の上に少量の蛍光染色液を滴下し、この滴下した蛍光染色液上に、培養後の濾過膜を置くことによって行う。
蛍光染色液の量は、100〜200μLとすることが好ましい。蛍光染色液の量が少なすぎると、濾過膜上の微生物の染色が不充分となる。蛍光染色液の量が多すぎると、染料が無駄になると共に、濾過膜上のコロニーを崩してしまう虞がある。
染色時間は、蛍光染色液が濾過膜上に浸透する時間によっても異なるが、濾過膜を蛍光染色液上に置いてから10〜20分で充分である。染色時の温度は、生菌の活性を促し浸透染色性を高めるため、24〜37℃とすることが好ましい。菌種によっても加温条件は異なるが、真核細胞からなる黴菌類では24〜27℃が好ましく、原核細胞の細菌類では30〜36℃が好ましい。
【0019】
[観察用プレパラートの作成]
染色後は、濾過膜をスライドグラス上に移し風乾させる。風乾後、浸漬油を浸透させる。具体的には、スライドグラス上に滴下した少量の浸漬油上に濾過膜を置き、さらに、濾過膜の上にも少量の浸漬油を滴下する。その後気泡が入らないようにカバーグラスを載せる。
これをそのまま観察用のプレパラートとしても良いが、バックグラウンドの値を下げるためには、この浸漬油を一旦除去することが好ましい。除去は、濾過膜を吸引濾過すること等によって行う。これにより、微生物細胞外の染料の影響を排除できる。最初の浸漬油を除去した後、最初の浸漬油と同様にして新しい浸漬油を濾過膜に浸透させてから、カバーグラスを載せ観察用プレパラートとする。
【0020】
[蛍光画像の観察]
観察用ブレパラートに励起光を照射し、蛍光顕微鏡で観察することにより、各コロニーを、形態を保持したまま、かつコロニー内の微生物を生存させたままの状態で観察できる。また、蛍光染色液が、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有していれば、各コロニー内に存在する生菌と死菌の存在状況を、各々確認できる。また、蛍光顕微鏡で観察した画像をCCDカメラ等で撮影することもできる。励起光の光源としては、例えば水銀ランプ等を使用できる。
【0021】
[蛍光強度の測定]
また、染色後の前記濾過膜に励起光を照射し、得られる蛍光強度をレーザスキャニングサイトメータで測定することにより、微生物の生理活性を統計的に把握することができる。また、蛍光染色液が、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有していれば、各コロニー内に存在する生菌と死菌の存在比率に関する情報も得られる。以下に、レーザスキャニングサイトメータによる蛍光強度測定について詳述する。
【0022】
図1は、本発明に用いるレーザスキャニングサイトメータの一実施形態の概略構成図である。図1に示すように、本実施形態のレーザスキャニングサイトメータは、励起光の光源Lと、観察用プレパラートPに励起光を照射すると共に、観察用プレパラートPから得られる蛍光を収集する対物レンズGと、光源Lからの励起光を対物レンズGに導くミラーM1〜M3と、観察用プレパラートPを載置して移動させるステージSと、対物レンズGからミラーM1〜M3によって導かれた蛍光を波長別に分離するダイクロイックミラーM4〜M6と、ダイクロイックミラーM4〜M6によって反射された各々の蛍光から不要光を取り除くフィルターf1〜f3と、フィルターf1〜f3を透過した蛍光の蛍光強度を各々検出する検出器D1〜D3とを備えている。なお、光源Lとしては、例えばアルゴンイオンレーザ、バイオレットレーザ、ヘリウムイオンレーザ等を使用できる。
【0023】
緑色の蛍光を与える生細胞染色用蛍光染料と、赤色の蛍光を与える死細胞染色用蛍光染料とを含有する蛍光染色液で染色する場合を例にとって、さらに具体的に説明すると、光源Lとしては、488nmのアルゴンイオンレーザを使用する。また、検出器D1には緑色(515〜545nm)の蛍光が入射するように、検出器D2には橙色(570〜630nm)の蛍光が入射するように、検出器D3には緑色(650nm以上)の蛍光が入射するように、ダイクロイックミラーM4〜M6及びフィルターf1〜f3を適宜選択する。
【0024】
測定作業では、光源Lからの励起光をミラーM1〜M3、対物レンズGを経由して観察用プレパラートに照射し、得られる蛍光を対物レンズG、ミラーM3〜M1を経た後、ダイクロイックミラーM4〜M6で波長別に分配する。そして、フィルターf1を経て検出器D1で得た蛍光強度を生細胞に由来する信号として、フィルターf3を経て検出器D3で得た蛍光強度を死細胞に由来する信号として、各々取得する。
そして、ステージSによって、観察用プレパラートPの位置を移動させることにより、所定範囲でスキャンを行い、上記各検出器で得られる蛍光強度の積算を行い、検出器D1で得た蛍光強度の積算値を生細胞の量に対応する情報として、検出器D3で得た蛍光強度の積算値を死細胞の量に対応する情報として、各々取得する。
【0025】
[判定用キット]
本発明の判定用キットは、本発明の判定方法に必要な試薬その他を纏めたものである。本発明の判定用キットは、濾過膜と、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを備えていればよく、緩衝液や希釈用の生理食塩水、あるいは試験管等の分析に必要なその他の試薬や器具を含めることもできる。また、染料を、1回の分析の必要量毎に包装したり、希釈用の目盛付容器に封入したりするなどの形態を適用することができる。
また、測定対象に応じて、前処理のために必要な試薬や器具等を含めることもできる。たとえば、水中の微生物の生理活性を調べるためには、ゴミを除くためのフィルターや濃縮するための器具等を含めることができる。また、土壌中の微生物の生理活性を調べるためには、土壌粒子から微生物を分離するためのフィルター等を含めることができる。
【実施例】
【0026】
以下本発明の実施例を説明するが、本発明の範囲はこれらの実施例に限定されない。
[供試微生物]
以下の微生物を供試微生物として用意した。
(野生株)
PCB/ビフェニル分解菌コマモナス・テストステロニTK102(受託番号:FERM P−14591)を用いた。
TK102株では、図2に示す経路でPCBの分解を行うことが知られている。この経路において、PCBは、まず、ビフェニルジオキシゲナーゼ(BphA)により、2つの水酸基(OH)が付加される。BphAは4つのサブユニット(BphA1、BphA2、BphA3、BphA4)から構成されている。
ついでジヒドロジオールデヒドロゲナーゼ(BphB)によって、BphAの産物から2つの水素が除かれた後、2,3−ジヒドロキシビフェニルジオキシゲナーゼ(BphC)により、BphB産物に酸素1分子が付加され、6-phenyl HODA(BphDの誘導基質)が生成する。
ついで、2−ヒドロキシ−6−オキソ−6−フェニルヘキサ−2,4−ジエン酸ヒドロラーゼ(BphD)が、6-phenyl HODAを安息香酸と2−ヒドロキシペンタ−2,4−ジエノエートとに分解する。そして2−ヒドロキシペンタ−2,4−ジエノエートヒドラターゼ(BphE)、4−ヒドロキシ−2−オキソバレレートアルドラーゼ(BphF)及びアセトアルデヒドデヒドロゲナーゼ(BphG)によりアセチルCoAとピルビン酸に転換されると考えられている。
【0027】
(BphA変異株)
上記野生株のBphA遺伝子を破壊したものである。上記野生株のBphA遺伝子にカンマイシン耐性遺伝子を挿入して機能を破壊することにより得た。
(BphB変異株)
上記野生株のBphB遺伝子を破壊したものである。上記野生株のBphB遺伝子にカンマイシン耐性遺伝子を挿入して機能を破壊することにより得た。
(BphC変異株)
上記野生株のBphC遺伝子を破壊したものである。上記野生株のBphC遺伝子にカンマイシン耐性遺伝子を挿入して機能を破壊することにより得た。
(BphD変異株)
上記野生株のBphD遺伝子を破壊したものである。上記野生株のBphD遺伝子にカンマイシン耐性遺伝子を挿入して機能を破壊することにより得た。
【0028】
[土壌侵出液]
砂質ローム層から生土壌を採取し、生土壌中の水分量を測定した。その後、測定した水分量を用いて生土壌の質量から水分の質量を引いた乾燥土壌質量を求め、この乾燥土壌質量と水分量とが等量となるように純水を加えて懸濁させ、121℃で60分間、高圧条件下で熱水抽出した。熱水抽出後静置して上澄を採取し、遠心分離にかけて細かい粒子を分離した。遠心分離後の上澄をペーパーフィルターでさらにろ過し、その後最初に加えた純水と同じ容量になるように純水を添加して土壌浸出液を得た。
【0029】
[実施例1]
(前培養)
野生株を、直径90mmのシャーレに入れた3倍に希釈したLB培地(3.3g/L バクトトリプトン、1.6g/L酵母エキス、5g/L塩化ナトリウム、15g/L寒天を含む)に白金耳で塗末し、30℃の培養器にて、12時間培養した。
【0030】
(微生物フィルターの作成)
前培養した野生株の寒天培地に1mLの生理食塩水を加え菌体を懸濁させ、その懸濁液を103cells/mLまで希釈して希釈液を得た。次に1mLの希釈液をポリカーボネート製黒色メンブランフィルター(孔径0.20μm、直径25mm、東洋濾紙株式会社製)で吸引ろ過し、微生物フィルターを得た。
【0031】
(微生物の培養)
作成した微生物フィルター上の微生物を、直径90mmのシャーレに入れた選択培地(土壌侵出液に寒天を1.5質量%の濃度となるように添加したもの)20mLの上に置き30℃の培養器にて、所定時間(3時間、6時間、9時間、12時間、15時間、または18時間)培養した。
【0032】
(微生物の染色)
生細胞染色用のジフルオロフルオレセインジアセテイト(商品名:Oregon Green 488 carboxylic acid diacetate, succinimidyl ester、Invitorogen社製)を5μM、及び死細胞染色用のプロピデュームイオダイドを4μMの濃度で含む生理食塩水150μL(蛍光染色液)をスライドグラス上に滴下し、この滴下した蛍光染色液の上に培養した微生物フィルターを置き、生細胞と死細胞とを染色した。
【0033】
(予備プレパラートの作成)
染色後、微生物フィルターをスライドグラス上に置き風乾した。風乾した微生物フィルターの下側に浸漬油(Immersion oil、オリンパス社製)5μLを滴下し、微生物フィルターとカバーグラスの間に気泡が入らないように浸漬油を浸透させた。さらに微生物フィルターの上側に浸漬油を4.5μL滴下し、慎重にカバーグラスをかぶせて予備プレパラートを作成した。
【0034】
(観察用プレパラートの作成)
観察直前に、予備プレパラートのスライドグラスから微生物フィルターをカバーグラスがかかったまま取り出し、カバーグラスをはずした後、油取り紙を載せた吸引濾過器の上に置いた。そして、吸引して微生物フィルターに含浸している浸漬油を油取り紙に吸い取らせた。スライドグラス上の浸漬油も取り除いてから微生物フィルターをスライドグラス上に戻した。次いで、浸漬油をフィルターの上側と下側に4.5μLずつ再度滴下して新しいカバーグラスをかけ、観察用プレパラートとした。
【0035】
(蛍光画像写真の撮影)
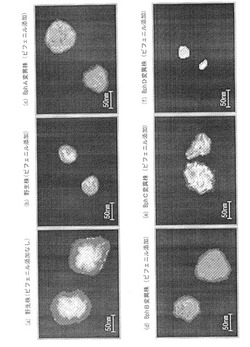
作成した観察用プレパラートに水銀ランプを照射し、CCDカメラで蛍光画像を撮影した。蛍光顕微鏡としては、落射蛍光照明装置、散乱検出器を備えたOLYMPUS BX-50(オリンパス社製)を用いた。結果を図3(a)〜(f)、図4(a)に示す。
図3中0h、3h、6h、9h、12h、15hとあるのは、各々培養時間が、0時間(培養しなかったことを意味する。)、3時間、6時間、9時間、12時間、15時間であることを示す。また、図4(a)に示したものは、培養時間18時間のものである。
なお、以下の実施例の結果も含め、図3及び図4は、CCDカメラで撮影したカラー写真を図面に置き換えたものであり、赤色の領域を白色で、緑色の領域を灰色で示した。
【0036】
(死細胞/生細胞の評価)
培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータ(オリンパス社製、LSC2)を用いて以下の条件でスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「野生株(ビフェニル添加なし)」として示す。
光源:アルゴンイオンレーザ(488nm)
光源光の強度:10.0mW
対物レンズ:10倍
スキャン範囲:2.1cm2
【0037】
[実施例2]
微生物フィルターの培養において、粒状のビフェニル50mgをシャーレの蓋に置いて蓋側を下にし、培養した以外は、実施例1と同様にして観察用プレパラートを作成した。
実施例1と同様にして、培養時間18時間における蛍光画像写真を撮影した。結果を図4(b)に示す。また、実施例1と同様にして培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータを用いてスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「野生株(ビフェニル添加)」として示す。
【0038】
[実施例3]
供試用微生物として、野生株に変えてBphA変異株を用いた以外は、実施例2と同様にして観察用プレパラートを作成した。
実施例1と同様にして、培養時間18時間における蛍光画像写真を撮影した。結果を図4(c)に示す。また、実施例1と同様にして培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータを用いてスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「BphA変異株(ビフェニル添加)」として示す。
【0039】
[実施例4]
供試用微生物として、野生株に変えてBphB変異株を用いた以外は、実施例2と同様にして観察用プレパラートを作成した。
実施例1と同様にして、培養時間18時間における蛍光画像写真を撮影した。結果を図4(d)に示す。また、実施例1と同様にして培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータを用いてスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「BphB変異株(ビフェニル添加)」として示す。
【0040】
[実施例5]
供試用微生物として、野生株に変えてBphC変異株を用いた以外は、実施例2と同様にして観察用プレパラートを作成した。
実施例1と同様にして、培養時間18時間における蛍光画像写真を撮影した。結果を図4(e)に示す。また、実施例1と同様にして培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータを用いてスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「BphC変異株(ビフェニル添加)」として示す。
【0041】
[実施例6]
供試用微生物として、野生株に変えてBphD変異株を用いた以外は、実施例2と同様にして観察用プレパラートを作成した。
実施例1と同様にして、培養時間18時間における蛍光画像写真を撮影した。結果を図4(f)に示す。また、実施例1と同様にして培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータを用いてスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「BphD変異株(ビフェニル添加)」として示す。
【0042】
図3、図4に示すように、本発明によれば、生存している微生物を死滅させることなく、かつコロニーの形態を崩すことなく、微生物の生理活性を画像として観察できることが確認できた。また、図5に示すように、本発明によれば、特定の遺伝子の破壊が生理活性に与える影響等を、統計的に把握できることが確認できた。
【産業上の利用可能性】
【0043】
本発明によれば、有用な微生物、例えば土壌浄化作用を有する微生物の生理活性を効果的に発現させる条件等の調査研究に寄与できる。したがって、微生物を利用したシステム、例えば環境浄化システムの発達等に寄与するものである。
また、微生物に対する抗生物質の作用を評価することが可能であり、医薬開発等に寄与するものである。
【図面の簡単な説明】
【0044】
【図1】本発明に使用するレーザスキャニングサイトメータの概略構成図である。
【図2】本発明の実施例に用いた微生物の代謝経路を示す図である。
【図3】本発明の蛍光顕微鏡による観察結果の写真をトレースした図である。
【図4】本発明の蛍光顕微鏡による観察結果の写真をトレースした図である。
【図5】本発明により求めた死細胞を示す赤色蛍光の積算値と、生細胞を示す緑色の蛍光の積算値の比のグラフである。
【技術分野】
【0001】
本発明は、微生物の生理活性判定方法、及び生理活性判定用キットに関する。更に詳しくは、微生物のコロニー形成過程における生理活性の判定に好適な微生物の生理活性判定方法、及び生理活性判定用キットに関する。
【背景技術】
【0002】
蛍光標識を用いて細胞の生理活性を測定する方法は、動物細胞では様々なシステムが開発されている。例えば、アポトーシスや細胞周期などの測定は、測定用システムが市販されている。
一方微生物については、火炎固定やアルコール固定等により固定化してから、コロニー中の特定のDNA若しくはRNAを蛍光で検出するFISH法などによる観察が行われている。この場合、固定化により、コロニー中の微生物は総て死滅するので、微生物の生理活性は、特定遺伝子の発現状況等から、間接的に判定することになる。
これに対して、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有する蛍光染色液で微生物を染色して、生菌数と死菌数とを個別に計数する技術が開発されている(特許文献1、2)。
また、微生物を濾過膜上に捕集して培養した後に、微生物を固定化しない状態で蛍光染料を上から滴下することにより染色して、コロニー数を計測する技術が開発されている(特許文献3)。
【特許文献1】特開2000−232897号公報
【特許文献2】特開2003−284592号公報
【特許文献3】特開平9−37794号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかし、特許文献1に記載の技術は、液体中で微生物の生理活性を調べるため、土壌中の微生物等、固体表面で生息してコロニーを形成する微生物の生理活性を適格に評価することはできなかった。また、特許文献2では、フローサイトメトリを用いる液体系の蛍光測定だけでなく、レーザスキャニングサイトメータを用いる固体系の蛍光測定についても記載されているが、その具体的な手法は明らかにされていなかった。
一方、特許文献3の技術では、微生物を濾過膜上で培養するので、土壌中の微生物等の生息環境に、より近い状態での評価が可能である。しかしながら、特許文献3の技術では、上から蛍光染料を滴下する時にコロニーが崩れてしまう。そのため、培養されたコロニーの状態をそのまま観察したり、蛍光測定の結果を統計的に評価したりすることができなかった。また、生細胞と死細胞とを区別して検知することもできなかった。
本発明は、上記事情に鑑みてなされたものであって、コロニーを形成する微生物集団をコロニーの形態を維持したまま、かつ生存させたまま染色して、微生物の生理活性を適格に判定することが可能な生理活性判定方法、及び生理活性判定用キットを提供することを課題とする。
【課題を解決するための手段】
【0004】
本発明は、以下の態様を備える。
[1]微生物を濾過膜上に捕集して培養した後、該濾過膜の下面側から浸透させた蛍光染色液で前記濾過膜上の微生物を染色することを特徴とする微生物の生理活性判定方法。
[2]前記培養を特定化合物の存在下で行い、該特定化合物の影響を評価する[1]に記載の生理活性判定方法。
[3]前記蛍光染色液が、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有する[1]または[2]に記載の生理活性判定方法。
[4]微生物を染色した後の前記濾過膜を風乾後、該濾過膜に浸漬油を浸透させ、その後該浸漬油を除去する[1]から[3]の何れかに記載の生理活性判定方法。
[5]微生物を染色した後の前記濾過膜上に励起光を照射し、蛍光顕微鏡で蛍光画像を観察する[1]から[4]の何れかに記載の生理活性判定方法。
[6]微生物を染色した後の前記濾過膜上に励起光を照射し、得られる蛍光強度を測定する[1]から[4]の何れかに記載の生理活性判定方法。
[7][1]から[6]の何れかに記載の生理活性判定方法を行うための生理活性判定用キットであって、濾過膜と、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを備えることを特徴とする生理活性判定用キット。
【発明の効果】
【0005】
[1]〜[6]の発明によれば、コロニーを形成する微生物集団をコロニーの形態を維持したまま、かつ生存させたまま染色して、微生物の生理活性を適格に判定することができる。
[7]の発明によれば、本発明の生理活性判定方法を効率よく実施することができる。
【発明を実施するための最良の形態】
【0006】
[微生物の捕集]
本発明による生理活性判定方法の対象となる微生物は、細菌、酵母、かび及びこれらの芽胞のいずれをも含むが、土壌中の微生物等、固体表面で生息してコロニーを形成する微生物が好ましい。
微生物は、野生株でもよいし特定の変異を加えた変異株でもよい。野生株と変異株とを同一条件で培養して染色することにより、特定の変異が生理活性に与える影響を評価できる。
【0007】
微生物の捕集は、好ましくは0.8μmあるいはこれ以下の孔径を有する濾過膜を使用することが好ましい。濾過膜としては、多孔質濾過膜やデプスフィルターなど、従来から広く採用されているものを使用できる。
濾過膜は親水性が高いことが好ましい。これにより、蛍光染色液の浸透が容易となる。また、濾過膜は、風乾等各種処理工程を経ても平面性を維持できるものが好ましい。これにより染色後の観察や蛍光強度測定が容易となる。これらを考慮すると、合成高分子製の濾過膜が好適である。
具体的には、各種ポリオレフィン、特に塩素やフッ素などのハロゲン置換ポリオレフィン、各種ポリアミド、ポリサルホン、ポリエーテル、ポリカーボネートなどの素材のものを使用できる。また、それらの表面を物理的もしくは化学的に修飾して水酸基、アミノ基、陰イオン交換基、陽イオン交換基などの親水性基を付与した機能性濾過膜なども使用できる。
【0008】
捕集は、常法に従って微生物を含む懸濁液を吸引濾過して捕集することが好ましい。懸濁液中に適当な数の微生物が存在する場合には、吸引濾過することなく単に濾過膜上に懸濁液を付着させることにより捕集してもよい。
【0009】
[微生物の培養]
培養は微生物を捕集した濾過膜を平板培地上に置くことにより行うことが好ましい。培地としては、微生物捕集面の反対面から養分等を円滑に供給できるものであればよく、従来のほとんどの寒天培地が使用できる。特定の検出すべき微生物を対象とする選択培地を使用してもよい。また、好気下もしくは嫌気下いずれの条件も目的に応じて採用できる。
培地中には、微生物の生息環境に近づけるために、生息環境に応じた成分を添加することができる。例えば、土壌中に生息する微生物の場合には、土壌抽出液を添加することができる。
【0010】
培地中には、染料と反応してコロニーとの染色反応を阻害する成分を含まないことが好ましい。もし、染色反応を阻害する成分を含有させざるを得ない場合には、培養後、染色前にろ紙などを使用して培地成分を吸い取るか、洗浄して洗い去ることが必要である。この際、コロニーの濾過膜面からの剥離や移動を避けるようにしなければならないことは当然である。
【0011】
培養は、特定化合物の存在下で行うことができる。この場合、その特定化合物が微生物の生理活性に与える影響を評価することができる。なお、「特定化合物の存在下」とは、特定化合物を培養環境中に存在させた状態をいう。培養環境中に存在させる具体的な方法としては、培地中に特定化合物を添加する方法が挙げられる。また、特定化合物が揮発性の場合には、培地を入れた密閉容器内に特定化合物を入れ、これを気化させる方法が挙げられる。
特定化合物としては、例えば、有用微生物の生理活性を阻害する可能性のある化合物を選択することができる。これにより、有用微生物の有用な作用を効率的に得るための条件を調査することができる。また、抗生物質を特定化合物とすることもできる。この場合、抗生物質の効力のスクリーニング等が可能となる。
【0012】
培養時の温度は、一般的には対象となる微生物の生息環境と同等の温度とする。ただし、温度の影響を評価するために、生息環境とある程度異なる温度で培養を行ってもよい。
培養時間は、微生物の種類や目的とする評価内容によって異なるが、約12時間程度で、統計的な処理が可能となる程度のコロニーが得られる。したがって、12時間以上の時間とすることが好ましい。
【0013】
[微生物の染色]
本発明では、微生物を生存させたまま染色できるので、蛍光染色液には、生細胞のみを選択的に染色する生細胞染色用蛍光染料を含有させることが好ましい。これにより、微生物の生理活性を直接的に確認できる。また、死細胞のみを選択的に染色する死細胞染色用蛍光染料も併せて含有させることが好ましい。これにより、コロニー中の生細胞と死細胞とを判別して生理活性を判定することができる。さらに、対象とした微生物の全細胞を染色する染料を含有させてもよい。なお、2種以上の染料を含有させる場合には、各々の染料による蛍光波長を異なるものとする必要がある。
【0014】
生細胞染色用蛍光染料は、微生物の細胞構造や細胞形成成分が、細胞内への浸透性の良いものか否かによって適宜選択する。
浸透性の悪い生細胞に対しては細胞内への浸透性に優れるアセトキシメチルエステル化したアセトキシメチルエステル化カルセインやアセトキシメチルエステル化ビスカルボキシエチルカルボキシルフルオレセインを用いることができる。また、細胞内への浸透性が比較的良い生細胞にはフルオレセインジアセテートサクシニミジルエステル、カルボキシルフルオレセインジアセテート、フルオレセインジアセテート、ジフルオレセインジアセテートを用いることができる。
【0015】
死細胞染色用蛍光染料染色用蛍光染料としてはプロピデュームイオダイド、エティデュームブロマイド、エティデュームホモダイマーから選ばれる螢光染料を選択することができる。
対象とした微生物の全細胞を染色する染料としては、アクリジンオレンジ、4’,6−ジアミジン−2−フェニルインドール,ジハイドロクロライド、6−ジメチルアミノ−2−[4−[4−(ジメチルアミノ)フェニル]−1,3−ブタジエニル]−1−エチルキノリニウムパークロレート、2’−(4−ヒドロキシフェニル)−5−(4−メチル−1−ピペラジニル)−2,5’−ジ−1H−ベンジミダゾルトリハイドロクロライド、2’−(4−エトキシフェニル)−5−(4−メチル−1−ピペラジニル)−2,5’−ジ−1H−ベンジミダゾルトリハイドロクロライドが挙げられる。
【0016】
蛍光染色液は、上記各種蛍光染料を生理食塩水等の緩衝液に溶解させたものである。蛍光染色液中の蛍光染料は、生理食塩水に対して、各々3〜15μmol/mLの濃度で含有させることが好ましい。
【0017】
蛍光染色液中には、浸透促進剤や流出防止剤を含有させてもよい。浸透促進剤は、微生物細胞中への染料の浸透を促進するもので、例えば、塩類、キチネス、セルラーゼ等が挙げられる。流出防止剤は、細胞中へ浸透した染料の流出を防止するためのもので、例えば、ジエチルスチルベストロール若しくはN,N′−ジシクロヘキシルカーボジイミドが挙げられる。蛍光染色液中には、抗体等を含有させてもよい。
【0018】
染色は、濾過膜の下面側(微生物の捕集面と反対側)から上記蛍光染色液を浸透させることによって行う。具体的には、スライドグラス等の上に少量の蛍光染色液を滴下し、この滴下した蛍光染色液上に、培養後の濾過膜を置くことによって行う。
蛍光染色液の量は、100〜200μLとすることが好ましい。蛍光染色液の量が少なすぎると、濾過膜上の微生物の染色が不充分となる。蛍光染色液の量が多すぎると、染料が無駄になると共に、濾過膜上のコロニーを崩してしまう虞がある。
染色時間は、蛍光染色液が濾過膜上に浸透する時間によっても異なるが、濾過膜を蛍光染色液上に置いてから10〜20分で充分である。染色時の温度は、生菌の活性を促し浸透染色性を高めるため、24〜37℃とすることが好ましい。菌種によっても加温条件は異なるが、真核細胞からなる黴菌類では24〜27℃が好ましく、原核細胞の細菌類では30〜36℃が好ましい。
【0019】
[観察用プレパラートの作成]
染色後は、濾過膜をスライドグラス上に移し風乾させる。風乾後、浸漬油を浸透させる。具体的には、スライドグラス上に滴下した少量の浸漬油上に濾過膜を置き、さらに、濾過膜の上にも少量の浸漬油を滴下する。その後気泡が入らないようにカバーグラスを載せる。
これをそのまま観察用のプレパラートとしても良いが、バックグラウンドの値を下げるためには、この浸漬油を一旦除去することが好ましい。除去は、濾過膜を吸引濾過すること等によって行う。これにより、微生物細胞外の染料の影響を排除できる。最初の浸漬油を除去した後、最初の浸漬油と同様にして新しい浸漬油を濾過膜に浸透させてから、カバーグラスを載せ観察用プレパラートとする。
【0020】
[蛍光画像の観察]
観察用ブレパラートに励起光を照射し、蛍光顕微鏡で観察することにより、各コロニーを、形態を保持したまま、かつコロニー内の微生物を生存させたままの状態で観察できる。また、蛍光染色液が、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有していれば、各コロニー内に存在する生菌と死菌の存在状況を、各々確認できる。また、蛍光顕微鏡で観察した画像をCCDカメラ等で撮影することもできる。励起光の光源としては、例えば水銀ランプ等を使用できる。
【0021】
[蛍光強度の測定]
また、染色後の前記濾過膜に励起光を照射し、得られる蛍光強度をレーザスキャニングサイトメータで測定することにより、微生物の生理活性を統計的に把握することができる。また、蛍光染色液が、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有していれば、各コロニー内に存在する生菌と死菌の存在比率に関する情報も得られる。以下に、レーザスキャニングサイトメータによる蛍光強度測定について詳述する。
【0022】
図1は、本発明に用いるレーザスキャニングサイトメータの一実施形態の概略構成図である。図1に示すように、本実施形態のレーザスキャニングサイトメータは、励起光の光源Lと、観察用プレパラートPに励起光を照射すると共に、観察用プレパラートPから得られる蛍光を収集する対物レンズGと、光源Lからの励起光を対物レンズGに導くミラーM1〜M3と、観察用プレパラートPを載置して移動させるステージSと、対物レンズGからミラーM1〜M3によって導かれた蛍光を波長別に分離するダイクロイックミラーM4〜M6と、ダイクロイックミラーM4〜M6によって反射された各々の蛍光から不要光を取り除くフィルターf1〜f3と、フィルターf1〜f3を透過した蛍光の蛍光強度を各々検出する検出器D1〜D3とを備えている。なお、光源Lとしては、例えばアルゴンイオンレーザ、バイオレットレーザ、ヘリウムイオンレーザ等を使用できる。
【0023】
緑色の蛍光を与える生細胞染色用蛍光染料と、赤色の蛍光を与える死細胞染色用蛍光染料とを含有する蛍光染色液で染色する場合を例にとって、さらに具体的に説明すると、光源Lとしては、488nmのアルゴンイオンレーザを使用する。また、検出器D1には緑色(515〜545nm)の蛍光が入射するように、検出器D2には橙色(570〜630nm)の蛍光が入射するように、検出器D3には緑色(650nm以上)の蛍光が入射するように、ダイクロイックミラーM4〜M6及びフィルターf1〜f3を適宜選択する。
【0024】
測定作業では、光源Lからの励起光をミラーM1〜M3、対物レンズGを経由して観察用プレパラートに照射し、得られる蛍光を対物レンズG、ミラーM3〜M1を経た後、ダイクロイックミラーM4〜M6で波長別に分配する。そして、フィルターf1を経て検出器D1で得た蛍光強度を生細胞に由来する信号として、フィルターf3を経て検出器D3で得た蛍光強度を死細胞に由来する信号として、各々取得する。
そして、ステージSによって、観察用プレパラートPの位置を移動させることにより、所定範囲でスキャンを行い、上記各検出器で得られる蛍光強度の積算を行い、検出器D1で得た蛍光強度の積算値を生細胞の量に対応する情報として、検出器D3で得た蛍光強度の積算値を死細胞の量に対応する情報として、各々取得する。
【0025】
[判定用キット]
本発明の判定用キットは、本発明の判定方法に必要な試薬その他を纏めたものである。本発明の判定用キットは、濾過膜と、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを備えていればよく、緩衝液や希釈用の生理食塩水、あるいは試験管等の分析に必要なその他の試薬や器具を含めることもできる。また、染料を、1回の分析の必要量毎に包装したり、希釈用の目盛付容器に封入したりするなどの形態を適用することができる。
また、測定対象に応じて、前処理のために必要な試薬や器具等を含めることもできる。たとえば、水中の微生物の生理活性を調べるためには、ゴミを除くためのフィルターや濃縮するための器具等を含めることができる。また、土壌中の微生物の生理活性を調べるためには、土壌粒子から微生物を分離するためのフィルター等を含めることができる。
【実施例】
【0026】
以下本発明の実施例を説明するが、本発明の範囲はこれらの実施例に限定されない。
[供試微生物]
以下の微生物を供試微生物として用意した。
(野生株)
PCB/ビフェニル分解菌コマモナス・テストステロニTK102(受託番号:FERM P−14591)を用いた。
TK102株では、図2に示す経路でPCBの分解を行うことが知られている。この経路において、PCBは、まず、ビフェニルジオキシゲナーゼ(BphA)により、2つの水酸基(OH)が付加される。BphAは4つのサブユニット(BphA1、BphA2、BphA3、BphA4)から構成されている。
ついでジヒドロジオールデヒドロゲナーゼ(BphB)によって、BphAの産物から2つの水素が除かれた後、2,3−ジヒドロキシビフェニルジオキシゲナーゼ(BphC)により、BphB産物に酸素1分子が付加され、6-phenyl HODA(BphDの誘導基質)が生成する。
ついで、2−ヒドロキシ−6−オキソ−6−フェニルヘキサ−2,4−ジエン酸ヒドロラーゼ(BphD)が、6-phenyl HODAを安息香酸と2−ヒドロキシペンタ−2,4−ジエノエートとに分解する。そして2−ヒドロキシペンタ−2,4−ジエノエートヒドラターゼ(BphE)、4−ヒドロキシ−2−オキソバレレートアルドラーゼ(BphF)及びアセトアルデヒドデヒドロゲナーゼ(BphG)によりアセチルCoAとピルビン酸に転換されると考えられている。
【0027】
(BphA変異株)
上記野生株のBphA遺伝子を破壊したものである。上記野生株のBphA遺伝子にカンマイシン耐性遺伝子を挿入して機能を破壊することにより得た。
(BphB変異株)
上記野生株のBphB遺伝子を破壊したものである。上記野生株のBphB遺伝子にカンマイシン耐性遺伝子を挿入して機能を破壊することにより得た。
(BphC変異株)
上記野生株のBphC遺伝子を破壊したものである。上記野生株のBphC遺伝子にカンマイシン耐性遺伝子を挿入して機能を破壊することにより得た。
(BphD変異株)
上記野生株のBphD遺伝子を破壊したものである。上記野生株のBphD遺伝子にカンマイシン耐性遺伝子を挿入して機能を破壊することにより得た。
【0028】
[土壌侵出液]
砂質ローム層から生土壌を採取し、生土壌中の水分量を測定した。その後、測定した水分量を用いて生土壌の質量から水分の質量を引いた乾燥土壌質量を求め、この乾燥土壌質量と水分量とが等量となるように純水を加えて懸濁させ、121℃で60分間、高圧条件下で熱水抽出した。熱水抽出後静置して上澄を採取し、遠心分離にかけて細かい粒子を分離した。遠心分離後の上澄をペーパーフィルターでさらにろ過し、その後最初に加えた純水と同じ容量になるように純水を添加して土壌浸出液を得た。
【0029】
[実施例1]
(前培養)
野生株を、直径90mmのシャーレに入れた3倍に希釈したLB培地(3.3g/L バクトトリプトン、1.6g/L酵母エキス、5g/L塩化ナトリウム、15g/L寒天を含む)に白金耳で塗末し、30℃の培養器にて、12時間培養した。
【0030】
(微生物フィルターの作成)
前培養した野生株の寒天培地に1mLの生理食塩水を加え菌体を懸濁させ、その懸濁液を103cells/mLまで希釈して希釈液を得た。次に1mLの希釈液をポリカーボネート製黒色メンブランフィルター(孔径0.20μm、直径25mm、東洋濾紙株式会社製)で吸引ろ過し、微生物フィルターを得た。
【0031】
(微生物の培養)
作成した微生物フィルター上の微生物を、直径90mmのシャーレに入れた選択培地(土壌侵出液に寒天を1.5質量%の濃度となるように添加したもの)20mLの上に置き30℃の培養器にて、所定時間(3時間、6時間、9時間、12時間、15時間、または18時間)培養した。
【0032】
(微生物の染色)
生細胞染色用のジフルオロフルオレセインジアセテイト(商品名:Oregon Green 488 carboxylic acid diacetate, succinimidyl ester、Invitorogen社製)を5μM、及び死細胞染色用のプロピデュームイオダイドを4μMの濃度で含む生理食塩水150μL(蛍光染色液)をスライドグラス上に滴下し、この滴下した蛍光染色液の上に培養した微生物フィルターを置き、生細胞と死細胞とを染色した。
【0033】
(予備プレパラートの作成)
染色後、微生物フィルターをスライドグラス上に置き風乾した。風乾した微生物フィルターの下側に浸漬油(Immersion oil、オリンパス社製)5μLを滴下し、微生物フィルターとカバーグラスの間に気泡が入らないように浸漬油を浸透させた。さらに微生物フィルターの上側に浸漬油を4.5μL滴下し、慎重にカバーグラスをかぶせて予備プレパラートを作成した。
【0034】
(観察用プレパラートの作成)
観察直前に、予備プレパラートのスライドグラスから微生物フィルターをカバーグラスがかかったまま取り出し、カバーグラスをはずした後、油取り紙を載せた吸引濾過器の上に置いた。そして、吸引して微生物フィルターに含浸している浸漬油を油取り紙に吸い取らせた。スライドグラス上の浸漬油も取り除いてから微生物フィルターをスライドグラス上に戻した。次いで、浸漬油をフィルターの上側と下側に4.5μLずつ再度滴下して新しいカバーグラスをかけ、観察用プレパラートとした。
【0035】
(蛍光画像写真の撮影)
作成した観察用プレパラートに水銀ランプを照射し、CCDカメラで蛍光画像を撮影した。蛍光顕微鏡としては、落射蛍光照明装置、散乱検出器を備えたOLYMPUS BX-50(オリンパス社製)を用いた。結果を図3(a)〜(f)、図4(a)に示す。
図3中0h、3h、6h、9h、12h、15hとあるのは、各々培養時間が、0時間(培養しなかったことを意味する。)、3時間、6時間、9時間、12時間、15時間であることを示す。また、図4(a)に示したものは、培養時間18時間のものである。
なお、以下の実施例の結果も含め、図3及び図4は、CCDカメラで撮影したカラー写真を図面に置き換えたものであり、赤色の領域を白色で、緑色の領域を灰色で示した。
【0036】
(死細胞/生細胞の評価)
培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータ(オリンパス社製、LSC2)を用いて以下の条件でスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「野生株(ビフェニル添加なし)」として示す。
光源:アルゴンイオンレーザ(488nm)
光源光の強度:10.0mW
対物レンズ:10倍
スキャン範囲:2.1cm2
【0037】
[実施例2]
微生物フィルターの培養において、粒状のビフェニル50mgをシャーレの蓋に置いて蓋側を下にし、培養した以外は、実施例1と同様にして観察用プレパラートを作成した。
実施例1と同様にして、培養時間18時間における蛍光画像写真を撮影した。結果を図4(b)に示す。また、実施例1と同様にして培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータを用いてスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「野生株(ビフェニル添加)」として示す。
【0038】
[実施例3]
供試用微生物として、野生株に変えてBphA変異株を用いた以外は、実施例2と同様にして観察用プレパラートを作成した。
実施例1と同様にして、培養時間18時間における蛍光画像写真を撮影した。結果を図4(c)に示す。また、実施例1と同様にして培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータを用いてスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「BphA変異株(ビフェニル添加)」として示す。
【0039】
[実施例4]
供試用微生物として、野生株に変えてBphB変異株を用いた以外は、実施例2と同様にして観察用プレパラートを作成した。
実施例1と同様にして、培養時間18時間における蛍光画像写真を撮影した。結果を図4(d)に示す。また、実施例1と同様にして培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータを用いてスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「BphB変異株(ビフェニル添加)」として示す。
【0040】
[実施例5]
供試用微生物として、野生株に変えてBphC変異株を用いた以外は、実施例2と同様にして観察用プレパラートを作成した。
実施例1と同様にして、培養時間18時間における蛍光画像写真を撮影した。結果を図4(e)に示す。また、実施例1と同様にして培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータを用いてスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「BphC変異株(ビフェニル添加)」として示す。
【0041】
[実施例6]
供試用微生物として、野生株に変えてBphD変異株を用いた以外は、実施例2と同様にして観察用プレパラートを作成した。
実施例1と同様にして、培養時間18時間における蛍光画像写真を撮影した。結果を図4(f)に示す。また、実施例1と同様にして培養時間12時間、15時間、18時間の観察用プレパラートについて、レーザスキャニングサイトメータを用いてスキャンし、死細胞を示す赤色蛍光(650nm以上)の積算値と、生細胞を示す緑色の蛍光(515〜545nm)の積算値の比を求めた。結果を図5に、「BphD変異株(ビフェニル添加)」として示す。
【0042】
図3、図4に示すように、本発明によれば、生存している微生物を死滅させることなく、かつコロニーの形態を崩すことなく、微生物の生理活性を画像として観察できることが確認できた。また、図5に示すように、本発明によれば、特定の遺伝子の破壊が生理活性に与える影響等を、統計的に把握できることが確認できた。
【産業上の利用可能性】
【0043】
本発明によれば、有用な微生物、例えば土壌浄化作用を有する微生物の生理活性を効果的に発現させる条件等の調査研究に寄与できる。したがって、微生物を利用したシステム、例えば環境浄化システムの発達等に寄与するものである。
また、微生物に対する抗生物質の作用を評価することが可能であり、医薬開発等に寄与するものである。
【図面の簡単な説明】
【0044】
【図1】本発明に使用するレーザスキャニングサイトメータの概略構成図である。
【図2】本発明の実施例に用いた微生物の代謝経路を示す図である。
【図3】本発明の蛍光顕微鏡による観察結果の写真をトレースした図である。
【図4】本発明の蛍光顕微鏡による観察結果の写真をトレースした図である。
【図5】本発明により求めた死細胞を示す赤色蛍光の積算値と、生細胞を示す緑色の蛍光の積算値の比のグラフである。
【特許請求の範囲】
【請求項1】
微生物を濾過膜上に捕集して培養した後、該濾過膜の下面側から浸透させた蛍光染色液で前記濾過膜上の微生物を染色することを特徴とする微生物の生理活性判定方法。
【請求項2】
前記培養を特定化合物の存在下で行い、該特定化合物の影響を評価する請求項1に記載の生理活性判定方法。
【請求項3】
前記蛍光染色液が、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有する請求項1または2に記載の生理活性判定方法。
【請求項4】
微生物を染色した後の前記濾過膜を風乾後、該濾過膜に浸漬油を浸透させ、その後該浸漬油を除去する請求項1から3の何れかに記載の生理活性判定方法。
【請求項5】
微生物を染色した後の前記濾過膜上に励起光を照射し、蛍光顕微鏡で蛍光画像を観察する請求項1から4の何れかに記載の生理活性判定方法。
【請求項6】
微生物を染色した後の前記濾過膜上に励起光を照射し、得られる蛍光強度を測定する請求項1から4の何れかに記載の生理活性判定方法。
【請求項7】
請求項1から6の何れかに記載の生理活性判定方法を行うための生理活性判定用キットであって、濾過膜と、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを備えることを特徴とする生理活性判定用キット。
【請求項1】
微生物を濾過膜上に捕集して培養した後、該濾過膜の下面側から浸透させた蛍光染色液で前記濾過膜上の微生物を染色することを特徴とする微生物の生理活性判定方法。
【請求項2】
前記培養を特定化合物の存在下で行い、該特定化合物の影響を評価する請求項1に記載の生理活性判定方法。
【請求項3】
前記蛍光染色液が、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを含有する請求項1または2に記載の生理活性判定方法。
【請求項4】
微生物を染色した後の前記濾過膜を風乾後、該濾過膜に浸漬油を浸透させ、その後該浸漬油を除去する請求項1から3の何れかに記載の生理活性判定方法。
【請求項5】
微生物を染色した後の前記濾過膜上に励起光を照射し、蛍光顕微鏡で蛍光画像を観察する請求項1から4の何れかに記載の生理活性判定方法。
【請求項6】
微生物を染色した後の前記濾過膜上に励起光を照射し、得られる蛍光強度を測定する請求項1から4の何れかに記載の生理活性判定方法。
【請求項7】
請求項1から6の何れかに記載の生理活性判定方法を行うための生理活性判定用キットであって、濾過膜と、生細胞染色用蛍光染料と、該生細胞染色用蛍光染料と蛍光波長の異なる死細胞染色用蛍光染料とを備えることを特徴とする生理活性判定用キット。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2007−97532(P2007−97532A)
【公開日】平成19年4月19日(2007.4.19)
【国際特許分類】
【出願番号】特願2005−294550(P2005−294550)
【出願日】平成17年10月7日(2005.10.7)
【出願人】(504147243)国立大学法人 岡山大学 (444)
【Fターム(参考)】
【公開日】平成19年4月19日(2007.4.19)
【国際特許分類】
【出願日】平成17年10月7日(2005.10.7)
【出願人】(504147243)国立大学法人 岡山大学 (444)
【Fターム(参考)】
[ Back to top ]

