神経細胞死抑制作用をもつVI型コラーゲン
【課題】神経細胞死抑制因子、及び/又は神経細胞死抑制剤もしくは神経細胞死抑制方法の提供を目的とする。
【解決手段】神経細胞死抑制作用を有するVI型コラーゲンを含むことにより、神経細胞死を抑制する。
【解決手段】神経細胞死抑制作用を有するVI型コラーゲンを含むことにより、神経細胞死を抑制する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、神経細胞死抑制作用をもつVI型コラーゲンに関する。
【背景技術】
【0002】
哺乳動物の末梢神経軸索が損傷されると、損傷部位より遠位側は変性消失し、近位側断端から軸索の再生が始まる。これらの生体反応には、多数の物質が関与することが予測されているが、その全貌は明らかにされていない。神経細胞死を抑制し軸索を伸展させるためには、神経細胞と細胞外マトリックス(ECM)との相互作用が必要であることが示唆されているが、ECMを構成するどの成分が関与しているのかは、ほとんど不明のままである。
【0003】
ECMの主要な構成成分であるコラーゲンは異なるタイプ(型)の集団であり、現在I型からXIX型までの存在が明らかにされている。これらは、線維構造の構成・接着に関与するものと、網目構造をとるものとに大別される。I型、II型、III型、V型及びXI型コラーゲン等は線維形成型であるのに対し、IV型コラーゲンは基底膜を形成すること、VI型コラーゲンは細線維(microfibril)を形成すること、VII型コラーゲンはアンカリングフィブリルを形成すること、VIII型及びX型コラーゲンは単鎖型でシート構造を形成することが知られている(非特許文献1)。これらのうち、生体内に最も多く存在するのはI型コラーゲンであり、医用材料として多目的に利用されている。例えば、I型コラーゲンを培養容器にコートすることにより、細胞の接着が向上し分化が促進される(特許文献1及び2)。また、I型コラーゲンが培養神経細胞に対して突起の伸展促進作用を有することも報告されている(非特許文献2)。しかしながら、他のコラーゲンと神経細胞との相互作用は、必ずしもI型コラーゲンと同じとは限らない。例えば、損傷神経の瘢痕中に多量に含まれるIV型コラーゲンは神経突起伸展抑制作用を有することが報告されている(非特許文献3)。V型コラーゲンが神経突起の伸展を抑制するという報告もある(非特許文献4)。このように、コラーゲンは型によって神経再生促進的に作用することもあれば、抑制的に作用することもありうる。ここで述べた型以外のコラーゲンが神経再生に与える効果に関しては、ほとんど調べられていない。
【0004】
神経細胞死を伴う病態の解明と治療法の確立は、中枢神経系でも重要な課題となっている。なかでも、アルツハイマー病やパーキンソン病に代表される神経変性疾患の治療法の開発に対する社会要請はたいへん強い。例えば、アルツハイマー病により誘発される神経細胞死はアポトーシスによるものであると考えられているが、その分子機構の解明は近年著しく進展したとはいえ、未知の部分も多い。そこで、アポトーシスを含めた神経細胞死を調節する新しい因子の同定が期待されている。
【0005】
最近、損傷、欠損あるいは変性した生体組織や臓器の再構築を目指して、細胞の分化・増殖能を利用した再生医療の研究が活発になっている。神経再生の研究も例外ではなく、神経細胞を直接病巣に移植することで、薬剤の反復投与による副作用、複雑な薬剤送達系の問題等の解決が期待されている。実際、パーキンソン病の治療において神経細胞移植が行われており、臨床試験においても一定の効果が示されている(非特許文献5)。しかしながら、中絶胎児から得られた神経組織を移植する方法では、1人の移植につき約8体の胎神経組織が必要となるため、ドナー細胞不足が大きな問題となっている。また、倫理的な問題も解決していない。患者自身の交感神経節の組織片を自家移植するにしても、採取された神経細胞の支配領域に障害が生じる恐れがあるため、採取量には限りがある。いずれの場合にせよ、神経細胞の細胞死を抑制して効率よく生着させる方法ならびに移植可能な神経細胞の作出方法の開発が必要とされる。最近脚光を浴びている神経幹細胞移植においても、同様な方法開発によって、細胞の維持に費やされる時間的、経済的負担が軽減されることが見込まれる。
【特許文献1】特開2002−142751
【特許文献2】特開2007−014352
【非特許文献1】コラーゲン代謝と疾患、第112頁、講談社(1982)
【非特許文献2】Cell, vol. 68, no. 2, pp. 303-322, January 24, 1992
【非特許文献3】Journal of Neurotrauma, vol. 23, no. 3-4, pp. 422-436, April 1, 2006
【非特許文献4】Journal of Neuroscience, vol. 21, no. 16, pp. 6125-6135, August 15, 2001
【非特許文献5】Japanese Journal of Neurosurgery (Tokyo), vol. 14, no. 8, pp. 487-492, August 20, 2005
【発明の開示】
【発明が解決しようとする課題】
【0006】
そこで、神経細胞死を抑制する因子の同定、及び神経細胞死抑制剤もしくは神経細胞死抑制方法の開発が切望されている。
【0007】
本発明は上記事情に鑑みてなされたものであり、神経細胞死抑制因子、及び/又は神経細胞死抑制剤もしくは神経細胞死抑制方法の提供を目的とする。
【課題を解決するための手段】
【0008】
神経細胞死の調節機構は未だ明らかになっていない点が多い。そこで本発明では、新たな神経細胞死抑制因子を同定した。
【0009】
すなわち、本発明によれば、VI型コラーゲンを含む、神経細胞死抑制剤が提供される。本神経細胞死抑制剤は、神経細胞死抑制作用を有するVI型コラーゲンを含むため、神経細胞死を抑制する。
【0010】
また、本発明によれば、VI型コラーゲンを含む、神経突起の伸展促進剤が提供される。本神経突起の伸展促進剤は、神経突起の伸展促進作用を有するVI型コラーゲンを含むため、神経突起の伸展を促進する。
【0011】
また、本発明によれば、VI型コラーゲンを含む、神経再生促進剤が提供される。本神経再生促進剤は、神経再生促進作用を有するVI型コラーゲンを含むため、神経再生を促進する。
【0012】
また、本発明によれば、ヒト生体外において神経細胞死を抑制する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞死を抑制する方法が提供される。この方法によれば、神経細胞死抑制作用を有するVI型コラーゲンを神経細胞と接触させるため、神経細胞死を抑制する。
【0013】
また、本発明によれば、ヒト生体外において神経突起の伸展を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経突起の伸展を促進する方法が提供される。この方法によれば、神経突起の伸展促進作用を有するVI型コラーゲンを神経細胞と接触させるため、神経突起の伸展を促進する。
【0014】
また、本発明によれば、ヒト生体外において神経再生を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経再生を促進する方法が提供される。この方法によれば、神経再生促進作用を有するVI型コラーゲンを神経細胞と接触させるため、神経再生を促進する。
【0015】
また、本発明によれば、神経細胞を培養する方法であって、培養容器中で神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞を培養する方法が提供される。この方法によれば、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有するVI型コラーゲンを神経細胞と接触させるため、神経細胞死の抑制、神経突起伸展の促進及び/又は神経再生の促進が起こる。
【0016】
また、本発明によれば、VI型コラーゲン及び培養容器を含む、神経細胞培養キットが提供される。本キットは、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有するVI型コラーゲンを含むため、神経細胞死の抑制、神経突起伸展の促進及び/又は神経再生の促進が起こる。
【0017】
また、本発明によれば、VI型コラーゲンを含む、神経再生のための医療材料が提供される。本医療材料は、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有するVI型コラーゲンを含むため、神経細胞死の抑制、神経突起伸展の促進及び/又は神経再生の促進が起こる。
【発明の効果】
【0018】
本発明によれば、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有するVI型コラーゲンを含むため、神経細胞死の抑制、神経突起伸展の促進及び/又は神経再生の促進が起こる。
【発明を実施するための最良の形態】
【0019】
<用語の説明>
本明細書において、各種用語の意味は、下記の通り定義するものとする。
【0020】
(1)VI型コラーゲン
ここで使用される「VI型コラーゲン」という用語は、天然配列VI型コラーゲン及びVI型コラーゲン変異体を含む。ここに記載されるVI型コラーゲンは、組換え又は合成方法により調製しても種々の供給源から単離してもよい。
【0021】
「天然配列VI型コラーゲン」は、天然由来のVI型コラーゲンのアミノ酸配列を有するポリペプチドである。このような天然配列VI型コラーゲンは、組換え又は合成手段により生産することもでき、種々の供給源から単離することもできる。
【0022】
「VI型コラーゲン変異体」とは、ここに開示される全長天然配列VI型コラーゲンと80%以上のアミノ酸配列同一性を有するVI型コラーゲンを意味する。
【0023】
(VI型コラーゲン変異体ポリヌクレオチド)
「変異体ポリヌクレオチド」とは、ポリペプチドが本来持っている活性を有するポリペプチドをコードする核酸分子であり、ここに開示する全長天然配列VI型コラーゲンポリペプチドをコードする核酸配列に対して80%以上の配列同一性を有する。
【0024】
(2)神経細胞死の抑制
「神経細胞死を抑制する」とは、神経細胞がアポトーシス又はネクローシスにより死滅するのを抑制することである。当業者であれば、トリパンブルー染色やTUNEL法(TUNEL: terminal deoxynucleotidyl transferase (TdT)-mediated dUTP-biotin nick end labeling)などを用いて神経細胞死の測定を行うことができる。また、全ての神経細胞の死を抑制しなくてもよく、神経細胞死を抑制しない場合と比較して、神経細胞死の50%、60%、70%、80%、90%、95%もしくは100%を抑制することを意味する。
【0025】
(3)神経突起の伸展
「神経突起を伸展する」とは、神経細胞から樹状突起あるいは軸索が伸展することである。当業者であれば、形態学的手法や計測用ソフトウェアを用いて神経突起の伸展を測定することができる。また、神経突起の伸展の促進とは、神経突起の伸展を促進しない場合と比較して、10%、20%、30%、40%、50%、60%、70%、80%、90%もしくは100%以上、神経突起の伸展が増加することを意味する。
【0026】
(4)神経の再生
「神経の再生」とは、神経細胞死の抑制、神経細胞の増殖、神経突起の伸展、シナプス(再)形成、神経回路の(再)形成及び/又は標的器官の(再)支配が起こることである。また、神経再生の促進とは、神経再生を促進しない場合と比較して、10%、20%、30%、40%、50%、60%、70%、80%、90%もしくは100%以上、神経再生を誘導することを意味する。
【0027】
(5)神経細胞とVI型コラーゲンの接触
「神経細胞とVI型コラーゲンの接触」とは、VI型コラーゲンが神経細胞に作用し得る状態をいい、作用しさえすれば、特に限定されるものではない。例えば、VI型コラーゲンは神経細胞に直接接着していなくてもよく、神経細胞の一部のみに接着していてもよく、もしくは神経細胞を取り囲む細胞に接着していてもよい。
【0028】
(6)培養
「培養」とは、神経細胞(ここでは分化した神経細胞だけではなく、未分化な神経幹細胞、神経前駆細胞、神経芽細胞をも含む)を分化、増殖、成長及び/又は発育させることをいうが、神経細胞の培養条件については、対応する従来公知の培養条件の中から、適宜適切な条件を適用することができる。神経細胞に対応する培養条件は、当業者であれば、容易に選択し、選択した培養条件に基づいて培養を実施することができる。
【0029】
(7)ベクター
ベクターは、組換えDNA手順に都合よく付すことのできるいずれのベクターであってもよく、またベクターの選択は当該ベクターを導入しようとする宿主細胞に依存することが多い。従って、ベクターは、自己複製ベクター、すなわちその複製が染色体複製から独立している染色体外物質として存在するベクターであってもよい。
【0030】
(8)プロモーター
ここでいう「プロモーター」とは、プロモーター配列の下流に存在するポリペプチドの発現を制御する配列のことをいう。ここでは特に大脳、小脳、脳幹、脊髄および末梢の体性あるいは自律神経節などの神経細胞を含む領域において発現させることが可能なプロモーターが望ましく、当業者であれば適切なプロモーターを選択することができる。
【0031】
以下、本発明の実施の形態について説明する。
【0032】
<VI型コラーゲン>
以下の本実施形態で用いられるVI型コラーゲンは、天然配列VI型コラーゲン及び/又はVI型コラーゲン変異体である。VI型コラーゲン変異体には、全長天然アミノ酸配列のN-又はC-末端において一又は複数(例えば、2、3・・・)のアミノ酸残基が付加、置換若しくは欠失されたVI型コラーゲンが含まれる。通常、VI型コラーゲン変異体は、ここに開示される全長天然アミノ酸配列、ここに開示された全長天然配列VI型コラーゲン配列と80%以上のアミノ酸配列同一性、好ましくは90%以上のアミノ酸配列同一性、より好ましくは95%以上のアミノ酸配列同一性を有している。なお、以下に示す配列番号:1には、全長天然配列VI型コラーゲンα1サブユニットのアミノ酸配列が、配列番号:3には、全長天然配列VI型コラーゲンα2サブユニットのアミノ酸配列が、配列番号:5には、全長天然配列VI型コラーゲンα3サブユニットのアミノ酸配列が示されている。
【0033】
ここに定義される「パーセント(%)アミノ酸配列同一性」は、配列を整列させ、最大のパーセント配列同一性が得られるように間隙を導入してもよく、保存的置換を配列同一性の一部と考えないとした、VI型コラーゲン配列のアミノ酸残基と同一である候補配列中のアミノ酸残基のパーセントとして定義される。パーセントアミノ酸配列同一性を決定する目的のためのアラインメントの選択は、当業者によく知られた方法、例えばBLAST、BLAST−2、ALIGN又はMegAlign(DNASTAR)のような公に入手可能なコンピュータソフトウエアを使用することにより可能である。当業者であれば、比較される配列の全長に対して最大のアラインメントを達成するために必要な任意のアルゴリズムを含むアラインメントを測定するために、適切なパラメータを決定することができる。また、VI型コラーゲンの変異体として、可溶化処理されたVI型コラーゲン、断片化されたVI型コラーゲンなども挙げられる。
【0034】
以下の本実施形態で用いられる変異体ポリヌクレオチドは、ここに開示する全長天然配列VI型コラーゲンポリペプチドをコードする核酸配列に対して80%以上の核酸配列同一性、好ましくは90%の核酸配列同一性、より好ましくは95%の核酸配列同一性を有している。変異体は、天然核酸配列を含まない。なお、以下に示す配列番号:2には、ヒトVI型コラーゲンα1サブユニットをコードする完全長配列が、配列番号:4には、ヒトVI型コラーゲンα2サブユニットをコードする完全長配列が、配列番号:6には、ヒトVI型コラーゲンα3サブユニットをコードする完全長配列が含まれている。
【0035】
ここで同定されるVI型コラーゲンコード化核酸配列に対する「パーセント(%)核酸配列同一性」は、配列を整列させ、最大のパーセント配列同一性が得られるように間隙を導入してもよく、VI型コラーゲンポリペプチドコード化核酸配列のヌクレオチドと同一である候補配列中のヌクレオチドのパーセントとして定義される。パーセント核酸配列同一性を決定する目的のためのアラインメントの選択は、当業者にはよく知られた方法、例えばBLAST、BLAST−2、ALIGN又はMegAlign(DNASTAR)のような公に入手可能なコンピュータソフトウエアを使用することにより可能である。当業者であれば、比較される配列の全長に対して最大のアラインメントを達成するために必要な任意のアルゴリズムを含むアラインメントを測定するために、適切なパラメータを決定することができる。
【0036】
また、「VI型コラーゲン変異体ポリヌクレオチド」とは、VI型コラーゲン変異体ポリペプチドをコードし、好ましくはストリンジェントなハイブリダイゼーション及び洗浄条件下で、配列番号:1に示すポリペプチドをコードする核酸配列にハイブリダイゼーションする核酸分子であってもよい。VI型コラーゲン変異体ポリペプチドは、VI型コラーゲン変異体ポリヌクレオチドにコードされるものであってもよい。
【0037】
VI型コラーゲンには、α1、α2、およびα3の異なるサブユニットが存在する。αサブユニットが2本逆向きに会合したものが2つ集まって四量体を形成する。細胞外ではこれがさらに重合して細線維(microfibril)を形成する。本実施形態で用いられるVI型コラーゲンは、四量体でなくとも二量体であってもよい。また、αサブユニットの構造単位も、α1サブユニット、α2サブユニット及び/又はα3サブユニットの単量体、もしくは二量体であってもよい。
【0038】
<実施形態1:神経細胞死抑制剤>
本実施形態は、VI型コラーゲンを含む、神経細胞死抑制剤である。後述の実施例に示すように、VI型コラーゲンは神経細胞死抑制作用を有するため、それを含む神経細胞死抑制剤も、神経細胞死を抑制する。また、本実施形態の神経細胞死抑制剤は、含まれるコラーゲンの100%がVI型コラーゲンであることが好ましいが、100%であることを必須の条件とするものではなく、50%、60%、70%、80%、90%、もしくは95%以上のVI型コラーゲンが含まれていればよい。
【0039】
<実施形態2:神経突起の伸展促進剤>
本実施形態は、VI型コラーゲンを含む、神経突起の伸展促進剤である。後述の実施例に示すように、VI型コラーゲンは神経突起の伸展促進作用を有するため、それを含む神経細胞死抑制剤も、神経突起の伸展を促進する。また、本実施形態の神経突起の伸展促進剤は、含まれるコラーゲンの100%がVI型コラーゲンであることが好ましいが、100%であることを必須の条件とするものではなく、50%、60%、70%、80%、90%、もしくは95%以上のVI型コラーゲンが含まれていればよい。
【0040】
<実施形態3:神経再生促進剤>
本実施形態は、VI型コラーゲンを含む、神経再生促進剤である。後述の実施例に示すように、VI型コラーゲンは神経再生促進作用を有するため、それを含む神経細胞死抑制剤も、神経再生を促進する。また、本実施形態の神経再生促進剤は、含まれるコラーゲンの100%がVI型コラーゲンであることが好ましいが、100%であることを必須の条件とするものではなく、50%、60%、70%、80%、90%、もしくは95%以上のVI型コラーゲンが含まれていればよい。
【0041】
本実施形態における剤は、単体または製剤上許容される担体を加えて、医薬とすることができる。製剤上許容される担体とは、例えば、賦形剤、希釈剤、添加剤、崩壊剤、結合剤、被覆剤、湿潤剤、滑走剤、滑沢剤、風味剤、甘味剤、可溶化剤等を挙げることができ、具体的には、炭酸マグネシウム、二酸化チタン、ラクトース、マンニトール及びその他の糖類、タルク、ゼラチン、デンプン、セルロース及びセルロース誘導体、動物油及び植物油、ポリエチレングリコール、水、一価または多価アルコールを挙げることができる。
【0042】
また、本実施形態における剤の剤形は特に限定されないが、例えばカプセル剤、錠剤、丸剤、液剤、シロップ剤、トローチ剤、散剤、顆粒剤、輸液剤および注射剤等が挙げられるが、好ましくは製剤化が容易な錠剤、顆粒剤、散剤またはカプセル剤である。
【0043】
また、本実施形態の剤は、経口的又は非経口的に投与することができる。すなわち通常用いられる投与形態、例えば粉末、顆粒、カプセル剤、シロップ剤、懸濁液等の剤型で経口的に投与することができ、あるいは、例えば溶液、乳剤、懸濁液等の剤型にしたものを注射の型で非経口に局所に投与することができる他、液状、シート状又はチューブ状にして神経損傷部位に接触するように投与することもできる。
【0044】
さらに、本実施形態における剤は、所望のタンパク質をコードする核酸配列を有するベクターを含む、剤とすることもできる。本実施形態のベクターとして、例えばプラスミド、ファージ、コスミド、ミニクロモゾーム、またはウイルスが挙げられる。あるいはまた、ベクターは、宿主細胞に導入されると宿主細胞ゲノムに一体化されそしてその中に一体化された一つまたは複数のクロモゾームと共に複製されるものであってよい。適切なベクターの例は細菌発現ベクターおよび酵母発現ベクターである。前記ウイルスベクターの例として、アデノウイルス、レトロウイルス、SV40のようなパポバウイルス、ワクシニアウイルス、鶏痘ウイルス、仮性狂犬病ウイルス等のウイルス由来のベクター等が挙げられるがこれらに限定されるものではない。適したプロモーターを選択して作製したベクターを含む剤とすることにより、所望の部位において、所望の量のVI型コラーゲンを発現することができる。
【0045】
また、本実施形態で用いられるVI型コラーゲンは、後述の実施例に示すように、神経細胞の接着を促進する。神経細胞の接着促進作用を有することにより、例えば、神経移植の際に、移植神経細胞の定着促進剤としても用いることができる。
【0046】
また、本実施形態で用いられるVI型コラーゲンは、後述の実施例に示すように、神経再生における神経細胞の足場を形成する。神経細胞の足場形成作用を有することにより、例えば、切断、挫滅等を受けた損傷神経において軸索再生を誘導する薬剤として用いることができる。
【0047】
また、本実施形態で用いられるVI型コラーゲンは、後述の実施例に示すように、神経細胞の接着を促進する。神経細胞の接着促進作用を有することにより、例えば、神経細胞を培養する場合に神経細胞の定着促進剤としても用いることができる。
【0048】
また、本実施形態で用いられるVI型コラーゲンは、後述の実施例に示すように、神経再生における神経細胞の足場を形成する。神経細胞の足場形成作用を有することにより、例えば、ヒト生体外において軸索を伸長させる場合に軸索誘導剤として用いることができる。
【0049】
<実施形態4:神経細胞死を抑制する方法>
本実施形態は、ヒト生体外において神経細胞死を抑制する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞死を抑制する方法である。後述の実施例に示すように、VI型コラーゲンは神経細胞死抑制作用を有するため、それを神経細胞に接触させることにより、神経細胞死を抑制する。
【0050】
<実施形態5:神経突起の伸展を促進する方法>
本実施形態は、ヒト生体外において神経突起の伸展を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経突起の伸展を促進する方法である。後述の実施例に示すように、VI型コラーゲンは神経突起の伸展促進作用を有するため、それを神経細胞に接触させることにより、神経突起の伸展を促進する。
【0051】
<実施形態6:神経再生を促進する方法>
本実施形態は、ヒト生体外において神経再生を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経再生を促進する方法である。後述の実施例に示すように、VI型コラーゲンは神経再生促進作用を有するため、それを神経細胞に接触させることにより、神経再生を促進する。
【0052】
<実施形態7:神経細胞の培養方法>
また、本実施形態は、神経細胞を培養する方法であって、培養容器中で神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞を培養する方法である。後述の実施例に示すように、VI型コラーゲンは神経細胞死抑制作用を有するため、それを神経細胞の培養に用いて神経細胞に接触させることにより、神経細胞死を抑制する。また、後述の実施例では、VI型コラーゲンを被覆したプレートを用いて培養することにより神経細胞死を抑制しているが、VI型コラーゲンと神経細胞を接触させる方法はこれに限られるものではない。例えば、VI型コラーゲン又は可溶化したVI型コラーゲンを培地中に添加することや遺伝子導入することで神経細胞死を抑制することも可能である。
【0053】
また、本実施形態で用いられるVI型コラーゲンは、後述の実施例に示すように、神経細胞の凝集を抑制する。神経細胞の凝集抑制作用を有することにより、神経細胞を効率よく培養することができる。
【0054】
本実施形態の培養方法で使用する培養液は、神経細胞の培養に適切とされる従来公知の組成のものでよく、例えば、市販の神経細胞培養用の培養液を使用することができる。
【0055】
本実施形態の培養に使用するインキュベータは、神経細胞を培養することができれば特に限定されないが、一般的に培養に用いられるものと同様のCO2インキュベータを使用することができる。通常、CO2インキュベータは、CO2濃度5−10%、温度37℃、相対湿度80%以上に設定されていることが多い。
【0056】
本実施形態の培養方法で使用する培養容器は、神経細胞の培養に適切とされる従来公知の培養容器でよく、例えば、市販の培養容器を使用することができる。後述する実施例においては、96穴ポリスチレンプレートを用いているが、4穴、6穴、12穴、24穴、48穴のプレートを用いることもできる他、ディッシュなどを用いることもできる。また、培養容器の素材もポリスチレンに限られるものではなく、メチルペンテン樹脂、ポリカーボネートなど、培養に適切とされる従来公知の素材を用いることができる。
【0057】
また、本実施形態の培養方法で使用する培養容器は、神経細胞とVI型コラーゲンが接触するように加工されている。後述の実施例においては、培養容器がVI型コラーゲンにより被覆されているが、これに限られるものではなく、神経細胞とVI型コラーゲンが接触すればよい。例えば、培養容器の内側全体が被覆されていてもよく、また、内側底面、もしくは内側側面のみが被覆されていてもよい。また、本実施形態において、VI型コラーゲンで被覆しているとは、培養容器素材が完全に被覆されていなくても、神経細胞とVI型コラーゲンが接触可能であればよく、例えばVI型コラーゲンがメッシュ状、フィラメント状に被覆していてもよい。また、VI型コラーゲンでの被覆処理は、VI型コラーゲンが1重、2重、3重など、多重に処理されていてもよく、その厚さも当業者であれば培養に適するように選択することができる。
【0058】
また、本実施形態は、VI型コラーゲン及び培養容器を含む神経細胞培養キットである。本実施形態のキットは、さらに神経細胞の培養に用いる試薬類を含むキットであってもよい。本実施形態のキットに含まれる試薬としては、特に限定するものではないが、例えば、市販の神経細胞用の培養液を好適に用いることができる。例えば、ダルベッコ変法イーグル培地(DMEM:Dulbecco’s modified Eagle’s medium:)、Hanks’F−12培地、又はそれらを1:1で混合したものなどを試薬として好適に使用できる。
【0059】
<実施形態8:医療材料>
本実施形態で用いられるVI型コラーゲンは、医薬として用いずに、医療材料又は培養材料に用いるためにシート状にすることもできる。シート状にして培養容器を被覆することができる他に、神経損傷部位の神経細胞に接触するように、例えば損傷部位を被覆するようにして投与することにより、神経再生の足場として作用することができる。また、シート状にした本実施形態の剤は、神経細胞を含む組成物としても投与することができる。神経細胞を含む形態を採ることにより、神経移植などに用いることができ、神経再生を促進することができる。
【0060】
また、本実施形態で用いられるVI型コラーゲンは、医薬として用いずに、医療材料又は培養材料に用いるためにチューブ状にすることができる。チューブ状にすることにより、中空部において神経細胞の増殖及び/又は神経突起の伸展を効率よく誘起することができ、人工神経管として神経切断部の神経再生を促進することができる。さらに、本実施形態の剤は、生体適合素材に充填して用いることもできる。用いる生体適合素材としては、シリコンやポリ乳酸、グリコール酸、ポリジオキサン酸、乳酸-グリコール酸共重合体、グリコール酸-ポリジオキサン-トリメチレンカーボネートなどの脂肪族ポリエステル系樹脂などを用いることができる。また、これらのシート状又はチューブ状のVI型コラーゲンは、メッシュ状、フィラメント状、スポンジ状などの形態を採ることができ、当業者であれば状況に応じて選択することができる。
【0061】
<その他の成分との併用>
本実施形態では、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有する他の物質と併用することもできる。他の物質の例として、神経成長因子(NGF:nerve growth factor)などの神経栄養因子、ラミニンなどの細胞接着分子、エリスロポイエチンなどのホルモンなどが挙げられるが、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有するものであれば、これらに限られるものではない。
【0062】
以上、本発明の実施形態について述べたが、これらは本発明の例示に過ぎない。
【実施例】
【0063】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0064】
実施例1 神経再生に関与する遺伝子の同定
【0065】
(材料と方法)
外科的処置と組織調製
ウイスター系成体ラット(体重200−300グラム)をジエチルエーテルと抱水クロラール(腹腔内投与、100ミリグラム/キログラム)で麻酔した後、左坐骨神経を切断し、右坐骨神経は未処置のままにした。切断後3、5および7日後に左坐骨神経の近位側切断端と遠位側切断端および右坐骨神経幹を摘出し、使用時まで−80℃に保存した。慢性絞扼モデルラットの作製は、BennettとXie(1988)の方法によって行った。全ての処置は、金沢大学動物実験規程に従って行った。
【0066】
相補DNA(cDNA)ライブラリーの作製
全細胞RNAをChirwinら(1979)の方法によって左坐骨神経の近位側切断端と右坐骨神経幹から抽出し、ポリ(A)+RNAをプロメガ社 (Promega, Madison, WI)の キット(PolyATract mRNA Isolation System III) を使用して精製した。さらに、Diatchenkoら(1996)のサプレッション・サブトラクティブ・ハイブリダイゼーション・ポリメラーゼ鎖反応法(suppression subtractive hybridization PCR)法をクロンテック社のキット(PCR Select;Clontech Laboratories)によって行った。この際、左坐骨神経の近位側切断端、右坐骨神経幹由来cDNAをそれぞれドライバー、テスターとして用いた。左坐骨神経の近位側切断端で発現上昇している遺伝子のcDNA断片のプールを得て、制限酵素Sau3AIとNotIで消化した後、pGEM−3zf(+)(Promega社)をBamHIとNotIで切断して作製したベクターに組み込み、大腸菌コンピテント細胞(TOP10F’、Invitrogen社)を形質転換した。
【0067】
cDNAの塩基配列決定とデータベース解析
クローン化したcDNAの塩基配列は、アプライドバイオシステムズ社(Applied Biosystems, Foster City, CA)の370A DNAシーケンサーを使用してダイデオキシ法にて決定した。得られた配列がコードするタンパクの同定は、BLASTプログラムを用いて 米国National Center for Biotechnology Information(NCBI)のデータベースと照合しながら行った。
【0068】
RNAブロットハイブリダイゼーション解析
左坐骨神経の近位側切断端と遠位側切断端および右坐骨神経幹からChomczynski とSacchi (1987)の方法によって抽出した全細胞RNA(各2μg)を1.0%アガロース−2.2Mホルムアミドゲルの電気泳動で分離した後、ナイロン膜(Zeta−Probe;Bio-Rad Laboratories社, Hercules, CA)に転写し、ラジオアイソトープ標識したcDNAとハイブリダイズさせた。ハイブリダイゼーション液の組成は、50%ホルムアミド、50mMリン酸ナトリウム緩衝液(pH7.0)、5×SSC(1×SSC:は0.15M塩化ナトリウム、0.015Mクエン酸ナトリウム)、250μg/mlサケ精子DNA、0.5%ドデシル硫酸ナトリウム(SDS)、0.1%ウシ血清アルブミン(BSA)、0.1%フィコールおよび0.1%ポリビニルピロリドンであった。一晩42℃でハイブリダイズさせた後、ナイロン膜を最終的に65℃の0.1%SDS含有0.1×SSCでリンスした。オートラジオグラフィーは−30℃で行い、増感スクリーンを用いた。バンドの黒化度の定量にはシオン・イメージ・プログラム(Scion Image program; Scion Corp., Frederick, MD)を使用した。
【0069】
(結果及び考察)
細胞外マトリックスの中から神経再生に関与する遺伝子を同定するために、切断したラット坐骨神経近位側切断端で発現上昇している遺伝子をクローニングした。135のcDNAクローンが単離され、そのうちECMの遺伝子をコードするものは、III型コラーゲン及びVI型コラーゲンのα1鎖、ルミカン、及びラミニンであった。さらに、RNAブロットハイブリダイゼーション分析を行ったところ、4.2kbのmRNAであるVI型コラーゲンが坐骨神経の近位側切断部及び遠位側切断部で発現していることが検出された。特に、近位側切断部では未処理の坐骨神経幹に比較して有意に発現上昇していることが確認された(図1A及びB)。
【0070】
重複する記載となるが、図1Aは、VI型コラーゲンのα1サブユニット及び18SリボソームRNAの発現を示している。それぞれのレーンに、坐骨神経の近位側切断部(Prox)、遠位側切断部(Dist)および坐骨神経幹(Contra)から抽出した2μgの全細胞RNAをロードした。分子量マーカーの位置を左側に示している。図1Bは、VI型コラーゲンのα1サブユニットの発現を、内部標準として18SリボソームRNAを用いて判定量的分析し、神経幹の値を基に標準化した結果を示すものである。バーは、平均値±標準誤差(n=3)を示している。アスタリスク(*)は、神経幹の値と比較した場合に有意差が見られるものを示している(P<0.05)。以上より、VI型コラーゲンの発現が、切断されたラット坐骨神経において上昇していることが明らかとなった。
【0071】
実施例2 VI型コラーゲンの活性の解析
【0072】
(材料と方法)
細胞培養
成体ラットの脊髄後根神経節(DRG:dorsal root ganglion)ニューロンの培養は、Rizzoら(1994)の方法に従った。L4とL5のDRGを摘出して結合組織を除去した後、コラゲナーゼ含有溶液、パパイン含有溶液中で酵素処理した。さらに、ダルベッコ変法イーグル培地(DMEM:Dulbecco’s modified Eagle’s medium:)とHanks’F−12培地を1:1で混合したものに10%牛胎児血清、1.5mg/mlトリプシンインヒビター、1.5mg/mlBSA、100U/mlペニシリンと0.1mg/mlストレプトマイシンを加えた溶液にDRGを移し、ピペッティングによって細胞を分散させた後、96穴のポリスチレンプレート(269620; Nunc社、Roskilde, Denmark)に蒔いた。ポリスチレンプレートは予めVI型コラーゲンで被覆したものとしないものとを用意した。
【0073】
上頚神経節(SCG: superior cervical ganglion)ニューロンの培養は、Fernandez-Fernandezら(1999)の方法に従った。成体ラットからSCGを摘出し、まず4℃のコラゲナーゼ(2mg/ml)溶液中で30分間、次に37℃のトリプシン(0.5mg/ml)溶液中で20分間インキュベートし、先端を細めたパスツールピペットでピペッティングして細胞を分散させてから、遠心した。集めた細胞は、牛胎児血清、2mMグルタミン酸、24mM重炭酸ナトリウム、38mMグルコース、100U/mlペニシリン、0.1mg/mlストレプトマイシンおよび100ng/mlNGFを含むL−15培地に分散して、96穴のポリスチレンプレート(269620; Nunc社)に蒔いた。
【0074】
ラット褐色細胞腫由来PC12細胞(Greeneら、1998)は、37℃、10%CO2、加湿条件下のインキュベーターにおいて、5%牛胎児血清と5%馬血清を含むダルベッコ変法イーグル培地で維持した。これを同じ培養液に250ng/mlNGFを加えたものに分散し、上記と同じ96穴のポリスチレンプレートに一穴あたり2500細胞の密度で蒔いた。
【0075】
神経芽細胞腫×脊髄ニューロンハイブリッド細胞株NSC34(Cashmanら、1992)は、10%牛胎児血清を含むダルベッコ変法イーグル培地で維持培養した後、上記と同様にポリスチレンプレートに蒔いた。
【0076】
神経突起伸展の測定
神経突起伸展の測定は、Turnerら(1989)の方法に従った。PC12細胞を0.125%(w/v)トリプシンと1mMEDTAを含むHanks緩衝塩類溶液で剥し、血清を含まないDMEMで洗滌したのち、96穴のポリスチレンプレート(269620; Nunc社)に蒔いた。穴は未処理のままか、ラミニン(50μg/ml)、ポリ−D−オルニチン(100μg/ml)、ポリ−L−リジン(50μg/ml)、I型コラーゲン(10μg/ml)、あるいはVI型コラーゲン(10μg/ml)溶液で一晩4℃で処理して被覆したものを使用した。細胞は一穴あたり2500個の密度で蒔き、NGFを250ng/mlになるように加えた。細胞体の直径の三倍以上の長さの神経突起を持つ細胞を陽性とし、培養を開始してから3時間、3、6、9、14日後にその数を比較した。
【0077】
細胞死の測定
細胞死の測定は、トリパンブルー(0.4%)染色とTUNEL法によった。TUNEL法は、ロッシュ社のキット(In Situ Cell Death Detection Kit、POD; Roche, Penzberg, Germany)を用いてOsamuraら(2005)の記載に従って実施した。上述のように異なる基質で被覆したポリスチレンプレート上で培養したPC12細胞を4%パラホルムアミドで固定し、10mMトリス緩衝液(pH7.5)に溶かしたプロテイナーゼK(20μg/ml)で30分間処理した。続いて、リン酸緩衝生理食塩水(PBS: phosphate-buffered saline)で洗滌した後、内因性ペルオキシダーゼを不活性化するために3%過酸化水素を含むメタノールに室温にて30分間浸した。再度PBSで洗滌した後、膜透過性を高めるために0.1%クエン酸ナトリウムで希釈した0.1%トリトンX−100を加え、氷上で2分間反応させた。さらに、ターミナルデオキシヌクレオチジルトランスフェラーゼ(TdT: terminal deoxynucleotidyl transferase)とフルオロレセイン標識UTPを含むTUNEL反応混合液と37℃で1時間反応させた。取り込まれたフルオロレセインを検出するために、HRP(horse-radish peroxidase)標識した抗フルオロレセイン抗体と反応させた後、3,3’−ジアミノベンチジンを発色基質として加えた。光学顕微鏡下で標本を観察するとともに、コンピューターに接続したカメラで視覚化した。
【0078】
免疫ペルオキシダーゼ染色
組織切片は、Feltsら(1997)が記載した方法に従って作製した。坐骨神経を切断してから3日後に、ラットをジエチルエーテルと抱水クロラールで深く麻酔し、心臓よりPBS、固定液(4%パラホルムアミド)の順に灌流した。左坐骨神経の近位側切断端と遠位側切断端および右坐骨神経幹を摘出し、同じ固定液(4%パラホルムアミド)に4℃で一晩浸して後固定を施した。さらに、30%ショ糖溶液に4℃で二晩浸して、耐凍性を高めた(cryoprotection)。組織標本は2−16μmの厚さに切り、ポリ−L−リジンで被覆したスライドガラスに載せた。切片をトリトンX−100、1%BSAおよび1%正常ヤギ血清を含むPBSで3時間ブロッキングしたあと、4℃で一晩ウサギポリクローナル抗VI型コラーゲン抗体(H−200;1:200希釈, Santa Cruz Biotechnology, Santa Cruz, CA)と反応させた。免疫反応性を検出するために、ニチレイ社のキット (Histofine Simple Stain MAX PO(M);Nichirei, Tsukiji, Japan)を添付された指示に従って使用した。発色後、切片を脱水、透徹し、カバーグラスを被せて光学顕微鏡下で観察した。
【0079】
蛍光二重染色
坐骨神経を切断してから3日後の組織から、上記と同様に20μm厚の切片を作製し、4℃で一晩ウサギ抗VI型コラーゲン抗体(H−200;1:200希釈; Santa Cruz Biotechnology)と反応させた。同時にマウスモノクローナル抗体として、S−100 タンパク抗体(1:200希釈;Sigma)、抗グリア線維性酸性タンパク(GFAP: glial fibrillary acidic protein)抗体(G−A−5;1:400希釈;Sigma)、抗シグナル制御タンパク(SIRP:signal regulatory protein)抗体(OX−41;1:50希釈;Chemicon International, Temecula, CA)、抗Thy1抗体(MRC OX−7;1:50希釈;Chemicon International)、抗ニューロフィラメント抗体(RT97;1:100希釈;Roche, Mannheim, Germany)、あるいは抗チロシン水酸化酵素抗体(Clone45;1:500希釈;BD Biosciences, Pharmingen, San Diego, CA)を加えて二重染色を行った。二次抗体にはフルオロレセイン・イソチオシアネート(FITC:flurorescein isothiocyanate)標識抗ウサギIgG抗体(1:500希釈;Molecular Probes, Eugene, OR)とテキサス・レッド標識抗マウスIgG抗体(1:500希釈;Molecular Probes)を用いて、4℃で3時間反応させた。切片の観察には共焦点レーザー顕微鏡(LSM5 PASCAL;Carl Zeiss, Gottingen, Germany)を使用し、得られた画像はアドビ・フォトショップ5.5版(Adobe Systems, San Jose, CA)を用いて補正した。
【0080】
(結果)
(VI型コラーゲンが神経突起伸展に与える影響)
VI型コラーゲンが神経突起の伸展に与える影響について、DRGニューロン、SCGニューロン、PC12細胞及びNSC34細胞を用いて試験した。図2に示すように、DRGニューロンにおいて、VI型コラーゲンを被覆したプレートに接着し、神経突起が伸展しているのが観察されたが、被覆処理していないプレートを用いた区では、プレートへの接着がほとんど見られず、最終的に細胞が凝集した。SCGニューロン、PC12細胞及びNSC34細胞においても同様の傾向が観察された。また、以下の実験は、細胞の安定性が優れているPC12細胞を用いて行った。
【0081】
重複する記載となるが、図2は、VI型コラーゲンをコートしたプレート(上段)又は被覆処理していないプレート(下段)で様々な神経細胞を培養し、観察された神経突起の伸展を示す図である。左から、DRGニューロン、SCGニューロン、神経芽細胞腫×脊髄ニューロンハイブリッド細胞株NSC34細胞、褐色細胞腫由来PC12細胞の結果を示している。被覆処理していないプレートで培養した場合、全ての細胞種において神経突起の伸展は観察されず、凝集した。スケールバーは50μmを表している。
【0082】
さらに、PC12細胞を用いて、神経突起が細胞直径の3倍以上伸展した細胞の頻度を計測した。図3に示すように、VI型コラーゲンを被覆したプレートを用いた区(VI型区)で、最も多くの細胞において細胞直径の3倍以上神経突起が伸展していることが観察された。培養後3時間で、12.9±2.6%(n=5;合計257細胞)の細胞で神経突起の伸展が観察された。ラミニンを被覆したプレート及びI型コラーゲンを被覆したプレートを用いた区(それぞれラミニン区及びI型区)においても、神経突起の伸展がそれぞれ9.6±2.9%及び3.9±1.2%(培養後3時間、n=5)観察された。培養3日目では、VI型区とラミニン区であまり差異がみられなかったが、培養6日目では、VI型区において神経突起が細胞直径の3倍以上伸展した細胞が有意に多く観察された。さらに、培養14日目では、VI型区が4.7±1.9%(n=5)であるのに対し、ラミニン区では実質的に0であった。I型区においても神経突起の伸展を示す細胞が観察されたが、培養6日目以降では観察されなかった。また、何も被覆していないプレートを用いた区では、神経突起の伸展が観察されなかった。神経突起の長さは、VI型区の培養後3時間で66.0±2.5μm(n=37)であり、その後培養14日目までほぼ同等の長さ(70.3±5.4μm、n=14)を維持した。ラミニン区でも、同程度の神経突起の長さ(55.7±3.3μm、n=31、培養後3時間)が観察されたが、I型区では他の2区よりも短い神経突起が観察された(45.9±2.5μm、n=19、培養後3時間)。
【0083】
重複する記載となるが、図3は、VI型コラーゲンと他の細胞外マトリックスタンパク質を用いた場合の神経突起の伸展を比較した図である。図3Aは、神経突起の経時的な変化を示す図である。NGF存在下で、VI型コラーゲン、ラミニン又はI型コラーゲンを被覆したプレート、もしくは被覆処理していないプレートを用いてPC12細胞を培養した。写真は、図中に示される時間を経過した後に撮影された。位置を確定するために、プレートの底に針でマークし、アスタリスク(*)で示した。図3Bは、神経突起が伸展した神経細胞の割合の経時的変化を示す図である。神経突起が細胞直径の3倍以上伸展した細胞を計数した。図3Cは、異なる細胞外マトリックスにおける神経突起の長さを測定した図である。それぞれの細胞から延びる最も長い神経突起の長さをScionImageソフトウェアを用いて計測した。バーは、平均値±標準誤差を示している。被覆処理していないプレートを用いた区と比較して有意差が見られた区をアスタリスク(*)を用いて示した(P<0.01)。
【0084】
(VI型コラーゲンが神経細胞死に与える影響)
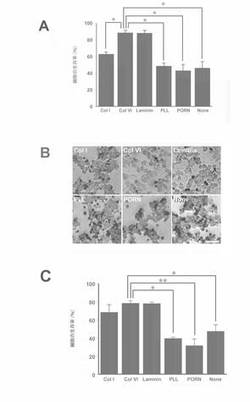
本発明者は、神経突起の伸展についての試験を行っている過程で、VI型コラーゲンを被覆したプレートを用いて培養した神経細胞が、他の物質で被覆したプレートを用いて培養した神経細胞又は被覆処理していないプレートで培養した神経細胞よりも細胞死を起こりにくいことを発見した。そこで、NGFの存在下、様々な物質でコートしたプレート上で神経細胞を培養した。図4Aは、トリパンブルー染色法を用いて神経細胞の生存率の定量分析を行った結果である。被覆処理していないプレートで神経細胞を培養した区(None区)では、46.0±8.1%(n=5)のみが生存していたのに対し、VI型コラーゲンを被覆したプレートで培養した区及びラミニンを被覆したプレートで培養した区(それぞれColVI区及びLaminin区)では、それぞれ88.5±3.1%(n=6、P<0.001)及び88.1±3.7%(n=6、P<0.001)と有意に生存率が増加した(図4A)。I型コラーゲンを被覆したプレートで培養した区、ポリ−L−リジンを被覆したプレートで培養した区及びポリ−D−オルニチンを被覆したプレートで培養した区(それぞれColI区、PLL区及びPORN区)では、神経細胞の生存率がそれぞれ62.7±3.0%(n=6)、48.5±3.8%(n=6)及び42.8±7.7%(n=6)であり、None区に対して有意差はみられなかった。
【0085】
さらに、TUNEL法を用いて神経細胞の生存率を分析した(図4B)。None区では、47.1±7.6%(n=3)のみが生存していたのに対し、ColVI区及びLaminin区では、それぞれ78.2±3.2%(n=3、P<0.01)及び77.8±2.1%(n=3、P<0.01)と有意に生存率が増加した(図4C)。ColI区、PLL区及びPORN区では、神経細胞の生存率がそれぞれ68.2±8.8%(n=3)、39.1±2.0%(n=3)及び31.2±7.7%(n=6)であり、None区に対して有意差はみられなかった。
【0086】
重複する記載となるが、図4は、VI型コラーゲン(ColVI)、I型コラーゲン(ColI)、ラミニン(Laminin)、ポリ−L−リジン(PLL)又はポリ−D−オルニチン(PORN)が神経細胞の生存に与える影響を示す図である。図4Aは、トリパンブルー色素排除試験の結果を示す図である。ColI、ColVI、Laminin、PLL又はPORNを被覆したプレート、もしくは被覆処理していないプレート(None)を用いてPC12細胞を培養し、試験を行い、その生存率を示した。バーは平均±標準誤差を示している。None区と比較して有意差が見られた区をアスタリスク(*)を用いて示した(P<0.01)。図4Bは、TUNEL染色を用いて神経細胞死を視覚化した像である。TUNEL陽性の濃く染色された細胞は、ColVI区とLaminin区で少ないことが示されている。図4Cは、TUNEL染色像をもとに算出した細胞の生存率を示す図である。バーは平均値±標準誤差を示している。None区と比較して有意差が見られた区をアスタリスク(*)を用いて示した(*:P<0.01、**:P<0.001)。
【0087】
(VI型コラーゲンの発現)
VI型コラーゲンの局在を調べるために、免疫ペルオキシダーゼ染色を行った。坐骨神経の近位側切断部では、軸索の周囲(図5aおよびb)、近位切断端の円形の細胞(図5c)、及び血管周囲(図5d)においてVI型コラーゲンの発現が検出された。また、遠位側切断部では、退行性変化が見られる領域の細胞においてVI型コラーゲンの発現が検出された(図5e)。また、健常な坐骨神経幹では、VI型コラーゲンの発現がほとんど検出されなかった(図5f)。
【0088】
重複する記載となるが、図5は、VI型コラーゲンを免疫ペルオキシダーゼ染色した結果を示す図である。左坐骨神経切断後3日の左側(a−e)及び健常な右側(f)の神経を、抗VI型コラーゲン抗体を用いて染色した。左坐骨神経近位切断部では、軸索周囲の細胞で極めて強い反応が観察され(a及びb、矢印で示している)、また、近位切断端の円形の小さい細胞で強く染色された(c、矢頭)。さらに、VI型コラーゲンは、近位切断部の血管周囲に蓄積されていることも観察された(d、矢印)。左坐骨神経遠位切断点では、退行後に残存した細胞においても観察された(e、矢印)。健常な右側の坐骨神経幹では、VI型コラーゲンはほとんど検出されなかった(f)。スケールは、20μmを表している。
【0089】
さらに、蛍光二重染色を行い、VI型コラーゲン陽性細胞の特徴を分析した。図6Aに示すように、VI型コラーゲンは、S−100タンパク質陽性細胞で観察された。近位側切断部では、S−100タンパク陽性細胞周囲に選択的に局在していた。それとは対照的に、遠位側切断部では、S−100タンパク陽性細胞で均一的に観察された。また、ミエリン化シュワン細胞のマーカーであるGFAPとの同時染色においても、同様の傾向が観察された(図6B)。さらに、VI型コラーゲンの発現は、OX−41陽性マクロファージ及びThy−1陽性線維芽細胞においても検出された(図7A及びB)。しかしながら、軸索におけるRT97陽性ニューロフィラメントとVI型コラーゲンとの共局在は観察されなかった(図7C)。
【0090】
重複する記載となるが、図6は、蛍光二重染色の共焦点レーザー顕微鏡による像である。左坐骨神経切断後3日に左側(a−c)及び健常な右側(Contralateral、d1−d3)の神経を採取した。切片を作製し、4℃で一晩ウサギ抗VI型コラーゲン抗体及び抗マウス抗S−100タンパク質抗体で染色し、FITC標識抗ウサギIgG抗体(a1−d1、緑)もしくはテキサス・レッド標識抗マウスIgG抗体(a2−d2、赤)で可視化した。マージ像(Merge)では、黄色がVI型コラーゲン及びS−100タンパク質が共発現していることを示す(a3−d3)(図6A)。図6Bは、抗VI型コラーゲン抗体(e1−h1、緑)及び抗グリア線維性酸性タンパク(GFAP)抗体(e2−h2、赤)を用いて染色したものである。e3−h3はマージ像を示している。スケールは、10μmを表している。
【0091】
また、図7は、蛍光二重染色の共焦点レーザー顕微鏡による像である。左坐骨神経切断後3日に左側(a−e)及び健常な右側(f)の神経を採取した。切片を作製し、4℃で一晩ウサギ抗VI型コラーゲン抗体及びOX−41マウス抗シグナル制御タンパク(SRIP)抗体で染色し、FITC標識抗ウサギIgG抗体(a1−d1、緑)もしくはテキサス・レッド標識抗マウスIgG抗体(a2−d2、赤)で可視化した。マージ像では、黄色がVI型コラーゲン及びOX−41抗原が共発現していることを示す(a3−d3)(図7A)。図7Bは、抗VI型コラーゲン抗体(e1−g1、緑)及び抗Thy−1抗体(e2−g2、赤)を用いて染色したものである。e3−g3はマージ像を示している。図7Cは、抗VI型コラーゲン抗体(h1、緑)及びRT97マウス抗ニューロフィラメント抗体(h2、赤)を用いて染色したものである。h3はマージ像を示しているが、共発現は観察されなかった。スケールは、a、b及びdでは50μmを表し、c、e、f、g及びhでは10μmを表している。
【0092】
(VI型コラーゲンの交感神経線維での発現)
VI型コラーゲンが神経突起の伸展を強く促進すること、及び神経細胞死を抑制することから、VI型コラーゲンが損傷した部位の交感神経線維に局在しているかどうかを確認した。図8に示すように、VI型コラーゲンは交感神経線維に近接して蓄積されていることが観察された。
【0093】
重複する記載となるが、図8は、チロシン水酸化酵素陽性の神経線維の近傍にVI型コラーゲンが損傷坐骨神経に蓄積していることを示す像である。左側の坐骨神経幹を結紮して3週間後の組織を採取し、切片を作製後、ウサギ抗VI型コラーゲン抗体及びマウス抗チロシン水酸化酵素抗体で染色し、FITC標識抗ウサギIgG抗体(A、緑)もしくはテキサス・レッド標識抗マウスIgG抗体(B、赤)で可視化した。スケールは20μmを表している。
【0094】
(考察)
以上より、VI型コラーゲンが神経突起の伸展促進作用、神経細胞死抑制作用、神経再生促進作用を有することが明らかとなった。VI型コラーゲンは、実際の神経組織でも発芽、軸索伸展のための足場として働き、損傷後の再生過程に関与することが示唆される。
【0095】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【図面の簡単な説明】
【0096】
【図1】図1は、RNAブロットハイブリダイゼーション分析の結果を示す図である。
【図2】図2は、VI型コラーゲンを被覆したプレート(上段)又は被覆処理していないプレート(下段)で様々な神経細胞を培養し、観察された神経突起の伸展を示す図である。
【図3】図3は、VI型コラーゲンと他の細胞外マトリックスタンパク質を用いた場合の神経突起の伸展を比較した図である。
【図4】図4は、VI型コラーゲン(ColVI)、I型コラーゲン(ColI)、ラミニン(Laminin)、ポリ−L−リジン(PLL)又はポリ−D−オルニチン(PORN)が神経細胞の生存に与える影響を示す図である。
【図5】図5は、VI型コラーゲンを免疫ペルオキシダーゼ染色した結果を示す図である。
【図6】図6は、蛍光二重染色の共焦点レーザー顕微鏡による像である。
【図7】図7は、蛍光二重染色の共焦点レーザー顕微鏡による像である。
【図8】図8は、損傷坐骨神経のチロシン水酸化酵素陽性の神経線維の近傍にVI型コラーゲンが蓄積していることを示す像である。
【図9】図9は、VI型コラーゲンα1サブユニットのアミノ酸配列を示す図である。
【図10】図10は、VI型コラーゲンα1サブユニットをコードする核酸配列を示す図である。
【図11】図11は、VI型コラーゲンα2サブユニットのアミノ酸配列を示す図である。
【図12】図12は、VI型コラーゲンα2サブユニットをコードする核酸配列を示す図である。
【図13】図13は、VI型コラーゲンα3サブユニットのアミノ酸配列を示す図である。
【図14】図14は、VI型コラーゲンα3サブユニットをコードする核酸配列を示す図である。
【技術分野】
【0001】
本発明は、神経細胞死抑制作用をもつVI型コラーゲンに関する。
【背景技術】
【0002】
哺乳動物の末梢神経軸索が損傷されると、損傷部位より遠位側は変性消失し、近位側断端から軸索の再生が始まる。これらの生体反応には、多数の物質が関与することが予測されているが、その全貌は明らかにされていない。神経細胞死を抑制し軸索を伸展させるためには、神経細胞と細胞外マトリックス(ECM)との相互作用が必要であることが示唆されているが、ECMを構成するどの成分が関与しているのかは、ほとんど不明のままである。
【0003】
ECMの主要な構成成分であるコラーゲンは異なるタイプ(型)の集団であり、現在I型からXIX型までの存在が明らかにされている。これらは、線維構造の構成・接着に関与するものと、網目構造をとるものとに大別される。I型、II型、III型、V型及びXI型コラーゲン等は線維形成型であるのに対し、IV型コラーゲンは基底膜を形成すること、VI型コラーゲンは細線維(microfibril)を形成すること、VII型コラーゲンはアンカリングフィブリルを形成すること、VIII型及びX型コラーゲンは単鎖型でシート構造を形成することが知られている(非特許文献1)。これらのうち、生体内に最も多く存在するのはI型コラーゲンであり、医用材料として多目的に利用されている。例えば、I型コラーゲンを培養容器にコートすることにより、細胞の接着が向上し分化が促進される(特許文献1及び2)。また、I型コラーゲンが培養神経細胞に対して突起の伸展促進作用を有することも報告されている(非特許文献2)。しかしながら、他のコラーゲンと神経細胞との相互作用は、必ずしもI型コラーゲンと同じとは限らない。例えば、損傷神経の瘢痕中に多量に含まれるIV型コラーゲンは神経突起伸展抑制作用を有することが報告されている(非特許文献3)。V型コラーゲンが神経突起の伸展を抑制するという報告もある(非特許文献4)。このように、コラーゲンは型によって神経再生促進的に作用することもあれば、抑制的に作用することもありうる。ここで述べた型以外のコラーゲンが神経再生に与える効果に関しては、ほとんど調べられていない。
【0004】
神経細胞死を伴う病態の解明と治療法の確立は、中枢神経系でも重要な課題となっている。なかでも、アルツハイマー病やパーキンソン病に代表される神経変性疾患の治療法の開発に対する社会要請はたいへん強い。例えば、アルツハイマー病により誘発される神経細胞死はアポトーシスによるものであると考えられているが、その分子機構の解明は近年著しく進展したとはいえ、未知の部分も多い。そこで、アポトーシスを含めた神経細胞死を調節する新しい因子の同定が期待されている。
【0005】
最近、損傷、欠損あるいは変性した生体組織や臓器の再構築を目指して、細胞の分化・増殖能を利用した再生医療の研究が活発になっている。神経再生の研究も例外ではなく、神経細胞を直接病巣に移植することで、薬剤の反復投与による副作用、複雑な薬剤送達系の問題等の解決が期待されている。実際、パーキンソン病の治療において神経細胞移植が行われており、臨床試験においても一定の効果が示されている(非特許文献5)。しかしながら、中絶胎児から得られた神経組織を移植する方法では、1人の移植につき約8体の胎神経組織が必要となるため、ドナー細胞不足が大きな問題となっている。また、倫理的な問題も解決していない。患者自身の交感神経節の組織片を自家移植するにしても、採取された神経細胞の支配領域に障害が生じる恐れがあるため、採取量には限りがある。いずれの場合にせよ、神経細胞の細胞死を抑制して効率よく生着させる方法ならびに移植可能な神経細胞の作出方法の開発が必要とされる。最近脚光を浴びている神経幹細胞移植においても、同様な方法開発によって、細胞の維持に費やされる時間的、経済的負担が軽減されることが見込まれる。
【特許文献1】特開2002−142751
【特許文献2】特開2007−014352
【非特許文献1】コラーゲン代謝と疾患、第112頁、講談社(1982)
【非特許文献2】Cell, vol. 68, no. 2, pp. 303-322, January 24, 1992
【非特許文献3】Journal of Neurotrauma, vol. 23, no. 3-4, pp. 422-436, April 1, 2006
【非特許文献4】Journal of Neuroscience, vol. 21, no. 16, pp. 6125-6135, August 15, 2001
【非特許文献5】Japanese Journal of Neurosurgery (Tokyo), vol. 14, no. 8, pp. 487-492, August 20, 2005
【発明の開示】
【発明が解決しようとする課題】
【0006】
そこで、神経細胞死を抑制する因子の同定、及び神経細胞死抑制剤もしくは神経細胞死抑制方法の開発が切望されている。
【0007】
本発明は上記事情に鑑みてなされたものであり、神経細胞死抑制因子、及び/又は神経細胞死抑制剤もしくは神経細胞死抑制方法の提供を目的とする。
【課題を解決するための手段】
【0008】
神経細胞死の調節機構は未だ明らかになっていない点が多い。そこで本発明では、新たな神経細胞死抑制因子を同定した。
【0009】
すなわち、本発明によれば、VI型コラーゲンを含む、神経細胞死抑制剤が提供される。本神経細胞死抑制剤は、神経細胞死抑制作用を有するVI型コラーゲンを含むため、神経細胞死を抑制する。
【0010】
また、本発明によれば、VI型コラーゲンを含む、神経突起の伸展促進剤が提供される。本神経突起の伸展促進剤は、神経突起の伸展促進作用を有するVI型コラーゲンを含むため、神経突起の伸展を促進する。
【0011】
また、本発明によれば、VI型コラーゲンを含む、神経再生促進剤が提供される。本神経再生促進剤は、神経再生促進作用を有するVI型コラーゲンを含むため、神経再生を促進する。
【0012】
また、本発明によれば、ヒト生体外において神経細胞死を抑制する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞死を抑制する方法が提供される。この方法によれば、神経細胞死抑制作用を有するVI型コラーゲンを神経細胞と接触させるため、神経細胞死を抑制する。
【0013】
また、本発明によれば、ヒト生体外において神経突起の伸展を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経突起の伸展を促進する方法が提供される。この方法によれば、神経突起の伸展促進作用を有するVI型コラーゲンを神経細胞と接触させるため、神経突起の伸展を促進する。
【0014】
また、本発明によれば、ヒト生体外において神経再生を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経再生を促進する方法が提供される。この方法によれば、神経再生促進作用を有するVI型コラーゲンを神経細胞と接触させるため、神経再生を促進する。
【0015】
また、本発明によれば、神経細胞を培養する方法であって、培養容器中で神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞を培養する方法が提供される。この方法によれば、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有するVI型コラーゲンを神経細胞と接触させるため、神経細胞死の抑制、神経突起伸展の促進及び/又は神経再生の促進が起こる。
【0016】
また、本発明によれば、VI型コラーゲン及び培養容器を含む、神経細胞培養キットが提供される。本キットは、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有するVI型コラーゲンを含むため、神経細胞死の抑制、神経突起伸展の促進及び/又は神経再生の促進が起こる。
【0017】
また、本発明によれば、VI型コラーゲンを含む、神経再生のための医療材料が提供される。本医療材料は、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有するVI型コラーゲンを含むため、神経細胞死の抑制、神経突起伸展の促進及び/又は神経再生の促進が起こる。
【発明の効果】
【0018】
本発明によれば、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有するVI型コラーゲンを含むため、神経細胞死の抑制、神経突起伸展の促進及び/又は神経再生の促進が起こる。
【発明を実施するための最良の形態】
【0019】
<用語の説明>
本明細書において、各種用語の意味は、下記の通り定義するものとする。
【0020】
(1)VI型コラーゲン
ここで使用される「VI型コラーゲン」という用語は、天然配列VI型コラーゲン及びVI型コラーゲン変異体を含む。ここに記載されるVI型コラーゲンは、組換え又は合成方法により調製しても種々の供給源から単離してもよい。
【0021】
「天然配列VI型コラーゲン」は、天然由来のVI型コラーゲンのアミノ酸配列を有するポリペプチドである。このような天然配列VI型コラーゲンは、組換え又は合成手段により生産することもでき、種々の供給源から単離することもできる。
【0022】
「VI型コラーゲン変異体」とは、ここに開示される全長天然配列VI型コラーゲンと80%以上のアミノ酸配列同一性を有するVI型コラーゲンを意味する。
【0023】
(VI型コラーゲン変異体ポリヌクレオチド)
「変異体ポリヌクレオチド」とは、ポリペプチドが本来持っている活性を有するポリペプチドをコードする核酸分子であり、ここに開示する全長天然配列VI型コラーゲンポリペプチドをコードする核酸配列に対して80%以上の配列同一性を有する。
【0024】
(2)神経細胞死の抑制
「神経細胞死を抑制する」とは、神経細胞がアポトーシス又はネクローシスにより死滅するのを抑制することである。当業者であれば、トリパンブルー染色やTUNEL法(TUNEL: terminal deoxynucleotidyl transferase (TdT)-mediated dUTP-biotin nick end labeling)などを用いて神経細胞死の測定を行うことができる。また、全ての神経細胞の死を抑制しなくてもよく、神経細胞死を抑制しない場合と比較して、神経細胞死の50%、60%、70%、80%、90%、95%もしくは100%を抑制することを意味する。
【0025】
(3)神経突起の伸展
「神経突起を伸展する」とは、神経細胞から樹状突起あるいは軸索が伸展することである。当業者であれば、形態学的手法や計測用ソフトウェアを用いて神経突起の伸展を測定することができる。また、神経突起の伸展の促進とは、神経突起の伸展を促進しない場合と比較して、10%、20%、30%、40%、50%、60%、70%、80%、90%もしくは100%以上、神経突起の伸展が増加することを意味する。
【0026】
(4)神経の再生
「神経の再生」とは、神経細胞死の抑制、神経細胞の増殖、神経突起の伸展、シナプス(再)形成、神経回路の(再)形成及び/又は標的器官の(再)支配が起こることである。また、神経再生の促進とは、神経再生を促進しない場合と比較して、10%、20%、30%、40%、50%、60%、70%、80%、90%もしくは100%以上、神経再生を誘導することを意味する。
【0027】
(5)神経細胞とVI型コラーゲンの接触
「神経細胞とVI型コラーゲンの接触」とは、VI型コラーゲンが神経細胞に作用し得る状態をいい、作用しさえすれば、特に限定されるものではない。例えば、VI型コラーゲンは神経細胞に直接接着していなくてもよく、神経細胞の一部のみに接着していてもよく、もしくは神経細胞を取り囲む細胞に接着していてもよい。
【0028】
(6)培養
「培養」とは、神経細胞(ここでは分化した神経細胞だけではなく、未分化な神経幹細胞、神経前駆細胞、神経芽細胞をも含む)を分化、増殖、成長及び/又は発育させることをいうが、神経細胞の培養条件については、対応する従来公知の培養条件の中から、適宜適切な条件を適用することができる。神経細胞に対応する培養条件は、当業者であれば、容易に選択し、選択した培養条件に基づいて培養を実施することができる。
【0029】
(7)ベクター
ベクターは、組換えDNA手順に都合よく付すことのできるいずれのベクターであってもよく、またベクターの選択は当該ベクターを導入しようとする宿主細胞に依存することが多い。従って、ベクターは、自己複製ベクター、すなわちその複製が染色体複製から独立している染色体外物質として存在するベクターであってもよい。
【0030】
(8)プロモーター
ここでいう「プロモーター」とは、プロモーター配列の下流に存在するポリペプチドの発現を制御する配列のことをいう。ここでは特に大脳、小脳、脳幹、脊髄および末梢の体性あるいは自律神経節などの神経細胞を含む領域において発現させることが可能なプロモーターが望ましく、当業者であれば適切なプロモーターを選択することができる。
【0031】
以下、本発明の実施の形態について説明する。
【0032】
<VI型コラーゲン>
以下の本実施形態で用いられるVI型コラーゲンは、天然配列VI型コラーゲン及び/又はVI型コラーゲン変異体である。VI型コラーゲン変異体には、全長天然アミノ酸配列のN-又はC-末端において一又は複数(例えば、2、3・・・)のアミノ酸残基が付加、置換若しくは欠失されたVI型コラーゲンが含まれる。通常、VI型コラーゲン変異体は、ここに開示される全長天然アミノ酸配列、ここに開示された全長天然配列VI型コラーゲン配列と80%以上のアミノ酸配列同一性、好ましくは90%以上のアミノ酸配列同一性、より好ましくは95%以上のアミノ酸配列同一性を有している。なお、以下に示す配列番号:1には、全長天然配列VI型コラーゲンα1サブユニットのアミノ酸配列が、配列番号:3には、全長天然配列VI型コラーゲンα2サブユニットのアミノ酸配列が、配列番号:5には、全長天然配列VI型コラーゲンα3サブユニットのアミノ酸配列が示されている。
【0033】
ここに定義される「パーセント(%)アミノ酸配列同一性」は、配列を整列させ、最大のパーセント配列同一性が得られるように間隙を導入してもよく、保存的置換を配列同一性の一部と考えないとした、VI型コラーゲン配列のアミノ酸残基と同一である候補配列中のアミノ酸残基のパーセントとして定義される。パーセントアミノ酸配列同一性を決定する目的のためのアラインメントの選択は、当業者によく知られた方法、例えばBLAST、BLAST−2、ALIGN又はMegAlign(DNASTAR)のような公に入手可能なコンピュータソフトウエアを使用することにより可能である。当業者であれば、比較される配列の全長に対して最大のアラインメントを達成するために必要な任意のアルゴリズムを含むアラインメントを測定するために、適切なパラメータを決定することができる。また、VI型コラーゲンの変異体として、可溶化処理されたVI型コラーゲン、断片化されたVI型コラーゲンなども挙げられる。
【0034】
以下の本実施形態で用いられる変異体ポリヌクレオチドは、ここに開示する全長天然配列VI型コラーゲンポリペプチドをコードする核酸配列に対して80%以上の核酸配列同一性、好ましくは90%の核酸配列同一性、より好ましくは95%の核酸配列同一性を有している。変異体は、天然核酸配列を含まない。なお、以下に示す配列番号:2には、ヒトVI型コラーゲンα1サブユニットをコードする完全長配列が、配列番号:4には、ヒトVI型コラーゲンα2サブユニットをコードする完全長配列が、配列番号:6には、ヒトVI型コラーゲンα3サブユニットをコードする完全長配列が含まれている。
【0035】
ここで同定されるVI型コラーゲンコード化核酸配列に対する「パーセント(%)核酸配列同一性」は、配列を整列させ、最大のパーセント配列同一性が得られるように間隙を導入してもよく、VI型コラーゲンポリペプチドコード化核酸配列のヌクレオチドと同一である候補配列中のヌクレオチドのパーセントとして定義される。パーセント核酸配列同一性を決定する目的のためのアラインメントの選択は、当業者にはよく知られた方法、例えばBLAST、BLAST−2、ALIGN又はMegAlign(DNASTAR)のような公に入手可能なコンピュータソフトウエアを使用することにより可能である。当業者であれば、比較される配列の全長に対して最大のアラインメントを達成するために必要な任意のアルゴリズムを含むアラインメントを測定するために、適切なパラメータを決定することができる。
【0036】
また、「VI型コラーゲン変異体ポリヌクレオチド」とは、VI型コラーゲン変異体ポリペプチドをコードし、好ましくはストリンジェントなハイブリダイゼーション及び洗浄条件下で、配列番号:1に示すポリペプチドをコードする核酸配列にハイブリダイゼーションする核酸分子であってもよい。VI型コラーゲン変異体ポリペプチドは、VI型コラーゲン変異体ポリヌクレオチドにコードされるものであってもよい。
【0037】
VI型コラーゲンには、α1、α2、およびα3の異なるサブユニットが存在する。αサブユニットが2本逆向きに会合したものが2つ集まって四量体を形成する。細胞外ではこれがさらに重合して細線維(microfibril)を形成する。本実施形態で用いられるVI型コラーゲンは、四量体でなくとも二量体であってもよい。また、αサブユニットの構造単位も、α1サブユニット、α2サブユニット及び/又はα3サブユニットの単量体、もしくは二量体であってもよい。
【0038】
<実施形態1:神経細胞死抑制剤>
本実施形態は、VI型コラーゲンを含む、神経細胞死抑制剤である。後述の実施例に示すように、VI型コラーゲンは神経細胞死抑制作用を有するため、それを含む神経細胞死抑制剤も、神経細胞死を抑制する。また、本実施形態の神経細胞死抑制剤は、含まれるコラーゲンの100%がVI型コラーゲンであることが好ましいが、100%であることを必須の条件とするものではなく、50%、60%、70%、80%、90%、もしくは95%以上のVI型コラーゲンが含まれていればよい。
【0039】
<実施形態2:神経突起の伸展促進剤>
本実施形態は、VI型コラーゲンを含む、神経突起の伸展促進剤である。後述の実施例に示すように、VI型コラーゲンは神経突起の伸展促進作用を有するため、それを含む神経細胞死抑制剤も、神経突起の伸展を促進する。また、本実施形態の神経突起の伸展促進剤は、含まれるコラーゲンの100%がVI型コラーゲンであることが好ましいが、100%であることを必須の条件とするものではなく、50%、60%、70%、80%、90%、もしくは95%以上のVI型コラーゲンが含まれていればよい。
【0040】
<実施形態3:神経再生促進剤>
本実施形態は、VI型コラーゲンを含む、神経再生促進剤である。後述の実施例に示すように、VI型コラーゲンは神経再生促進作用を有するため、それを含む神経細胞死抑制剤も、神経再生を促進する。また、本実施形態の神経再生促進剤は、含まれるコラーゲンの100%がVI型コラーゲンであることが好ましいが、100%であることを必須の条件とするものではなく、50%、60%、70%、80%、90%、もしくは95%以上のVI型コラーゲンが含まれていればよい。
【0041】
本実施形態における剤は、単体または製剤上許容される担体を加えて、医薬とすることができる。製剤上許容される担体とは、例えば、賦形剤、希釈剤、添加剤、崩壊剤、結合剤、被覆剤、湿潤剤、滑走剤、滑沢剤、風味剤、甘味剤、可溶化剤等を挙げることができ、具体的には、炭酸マグネシウム、二酸化チタン、ラクトース、マンニトール及びその他の糖類、タルク、ゼラチン、デンプン、セルロース及びセルロース誘導体、動物油及び植物油、ポリエチレングリコール、水、一価または多価アルコールを挙げることができる。
【0042】
また、本実施形態における剤の剤形は特に限定されないが、例えばカプセル剤、錠剤、丸剤、液剤、シロップ剤、トローチ剤、散剤、顆粒剤、輸液剤および注射剤等が挙げられるが、好ましくは製剤化が容易な錠剤、顆粒剤、散剤またはカプセル剤である。
【0043】
また、本実施形態の剤は、経口的又は非経口的に投与することができる。すなわち通常用いられる投与形態、例えば粉末、顆粒、カプセル剤、シロップ剤、懸濁液等の剤型で経口的に投与することができ、あるいは、例えば溶液、乳剤、懸濁液等の剤型にしたものを注射の型で非経口に局所に投与することができる他、液状、シート状又はチューブ状にして神経損傷部位に接触するように投与することもできる。
【0044】
さらに、本実施形態における剤は、所望のタンパク質をコードする核酸配列を有するベクターを含む、剤とすることもできる。本実施形態のベクターとして、例えばプラスミド、ファージ、コスミド、ミニクロモゾーム、またはウイルスが挙げられる。あるいはまた、ベクターは、宿主細胞に導入されると宿主細胞ゲノムに一体化されそしてその中に一体化された一つまたは複数のクロモゾームと共に複製されるものであってよい。適切なベクターの例は細菌発現ベクターおよび酵母発現ベクターである。前記ウイルスベクターの例として、アデノウイルス、レトロウイルス、SV40のようなパポバウイルス、ワクシニアウイルス、鶏痘ウイルス、仮性狂犬病ウイルス等のウイルス由来のベクター等が挙げられるがこれらに限定されるものではない。適したプロモーターを選択して作製したベクターを含む剤とすることにより、所望の部位において、所望の量のVI型コラーゲンを発現することができる。
【0045】
また、本実施形態で用いられるVI型コラーゲンは、後述の実施例に示すように、神経細胞の接着を促進する。神経細胞の接着促進作用を有することにより、例えば、神経移植の際に、移植神経細胞の定着促進剤としても用いることができる。
【0046】
また、本実施形態で用いられるVI型コラーゲンは、後述の実施例に示すように、神経再生における神経細胞の足場を形成する。神経細胞の足場形成作用を有することにより、例えば、切断、挫滅等を受けた損傷神経において軸索再生を誘導する薬剤として用いることができる。
【0047】
また、本実施形態で用いられるVI型コラーゲンは、後述の実施例に示すように、神経細胞の接着を促進する。神経細胞の接着促進作用を有することにより、例えば、神経細胞を培養する場合に神経細胞の定着促進剤としても用いることができる。
【0048】
また、本実施形態で用いられるVI型コラーゲンは、後述の実施例に示すように、神経再生における神経細胞の足場を形成する。神経細胞の足場形成作用を有することにより、例えば、ヒト生体外において軸索を伸長させる場合に軸索誘導剤として用いることができる。
【0049】
<実施形態4:神経細胞死を抑制する方法>
本実施形態は、ヒト生体外において神経細胞死を抑制する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞死を抑制する方法である。後述の実施例に示すように、VI型コラーゲンは神経細胞死抑制作用を有するため、それを神経細胞に接触させることにより、神経細胞死を抑制する。
【0050】
<実施形態5:神経突起の伸展を促進する方法>
本実施形態は、ヒト生体外において神経突起の伸展を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経突起の伸展を促進する方法である。後述の実施例に示すように、VI型コラーゲンは神経突起の伸展促進作用を有するため、それを神経細胞に接触させることにより、神経突起の伸展を促進する。
【0051】
<実施形態6:神経再生を促進する方法>
本実施形態は、ヒト生体外において神経再生を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経再生を促進する方法である。後述の実施例に示すように、VI型コラーゲンは神経再生促進作用を有するため、それを神経細胞に接触させることにより、神経再生を促進する。
【0052】
<実施形態7:神経細胞の培養方法>
また、本実施形態は、神経細胞を培養する方法であって、培養容器中で神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞を培養する方法である。後述の実施例に示すように、VI型コラーゲンは神経細胞死抑制作用を有するため、それを神経細胞の培養に用いて神経細胞に接触させることにより、神経細胞死を抑制する。また、後述の実施例では、VI型コラーゲンを被覆したプレートを用いて培養することにより神経細胞死を抑制しているが、VI型コラーゲンと神経細胞を接触させる方法はこれに限られるものではない。例えば、VI型コラーゲン又は可溶化したVI型コラーゲンを培地中に添加することや遺伝子導入することで神経細胞死を抑制することも可能である。
【0053】
また、本実施形態で用いられるVI型コラーゲンは、後述の実施例に示すように、神経細胞の凝集を抑制する。神経細胞の凝集抑制作用を有することにより、神経細胞を効率よく培養することができる。
【0054】
本実施形態の培養方法で使用する培養液は、神経細胞の培養に適切とされる従来公知の組成のものでよく、例えば、市販の神経細胞培養用の培養液を使用することができる。
【0055】
本実施形態の培養に使用するインキュベータは、神経細胞を培養することができれば特に限定されないが、一般的に培養に用いられるものと同様のCO2インキュベータを使用することができる。通常、CO2インキュベータは、CO2濃度5−10%、温度37℃、相対湿度80%以上に設定されていることが多い。
【0056】
本実施形態の培養方法で使用する培養容器は、神経細胞の培養に適切とされる従来公知の培養容器でよく、例えば、市販の培養容器を使用することができる。後述する実施例においては、96穴ポリスチレンプレートを用いているが、4穴、6穴、12穴、24穴、48穴のプレートを用いることもできる他、ディッシュなどを用いることもできる。また、培養容器の素材もポリスチレンに限られるものではなく、メチルペンテン樹脂、ポリカーボネートなど、培養に適切とされる従来公知の素材を用いることができる。
【0057】
また、本実施形態の培養方法で使用する培養容器は、神経細胞とVI型コラーゲンが接触するように加工されている。後述の実施例においては、培養容器がVI型コラーゲンにより被覆されているが、これに限られるものではなく、神経細胞とVI型コラーゲンが接触すればよい。例えば、培養容器の内側全体が被覆されていてもよく、また、内側底面、もしくは内側側面のみが被覆されていてもよい。また、本実施形態において、VI型コラーゲンで被覆しているとは、培養容器素材が完全に被覆されていなくても、神経細胞とVI型コラーゲンが接触可能であればよく、例えばVI型コラーゲンがメッシュ状、フィラメント状に被覆していてもよい。また、VI型コラーゲンでの被覆処理は、VI型コラーゲンが1重、2重、3重など、多重に処理されていてもよく、その厚さも当業者であれば培養に適するように選択することができる。
【0058】
また、本実施形態は、VI型コラーゲン及び培養容器を含む神経細胞培養キットである。本実施形態のキットは、さらに神経細胞の培養に用いる試薬類を含むキットであってもよい。本実施形態のキットに含まれる試薬としては、特に限定するものではないが、例えば、市販の神経細胞用の培養液を好適に用いることができる。例えば、ダルベッコ変法イーグル培地(DMEM:Dulbecco’s modified Eagle’s medium:)、Hanks’F−12培地、又はそれらを1:1で混合したものなどを試薬として好適に使用できる。
【0059】
<実施形態8:医療材料>
本実施形態で用いられるVI型コラーゲンは、医薬として用いずに、医療材料又は培養材料に用いるためにシート状にすることもできる。シート状にして培養容器を被覆することができる他に、神経損傷部位の神経細胞に接触するように、例えば損傷部位を被覆するようにして投与することにより、神経再生の足場として作用することができる。また、シート状にした本実施形態の剤は、神経細胞を含む組成物としても投与することができる。神経細胞を含む形態を採ることにより、神経移植などに用いることができ、神経再生を促進することができる。
【0060】
また、本実施形態で用いられるVI型コラーゲンは、医薬として用いずに、医療材料又は培養材料に用いるためにチューブ状にすることができる。チューブ状にすることにより、中空部において神経細胞の増殖及び/又は神経突起の伸展を効率よく誘起することができ、人工神経管として神経切断部の神経再生を促進することができる。さらに、本実施形態の剤は、生体適合素材に充填して用いることもできる。用いる生体適合素材としては、シリコンやポリ乳酸、グリコール酸、ポリジオキサン酸、乳酸-グリコール酸共重合体、グリコール酸-ポリジオキサン-トリメチレンカーボネートなどの脂肪族ポリエステル系樹脂などを用いることができる。また、これらのシート状又はチューブ状のVI型コラーゲンは、メッシュ状、フィラメント状、スポンジ状などの形態を採ることができ、当業者であれば状況に応じて選択することができる。
【0061】
<その他の成分との併用>
本実施形態では、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有する他の物質と併用することもできる。他の物質の例として、神経成長因子(NGF:nerve growth factor)などの神経栄養因子、ラミニンなどの細胞接着分子、エリスロポイエチンなどのホルモンなどが挙げられるが、神経細胞死抑制作用、神経突起の伸展促進作用及び/又は神経再生促進作用を有するものであれば、これらに限られるものではない。
【0062】
以上、本発明の実施形態について述べたが、これらは本発明の例示に過ぎない。
【実施例】
【0063】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0064】
実施例1 神経再生に関与する遺伝子の同定
【0065】
(材料と方法)
外科的処置と組織調製
ウイスター系成体ラット(体重200−300グラム)をジエチルエーテルと抱水クロラール(腹腔内投与、100ミリグラム/キログラム)で麻酔した後、左坐骨神経を切断し、右坐骨神経は未処置のままにした。切断後3、5および7日後に左坐骨神経の近位側切断端と遠位側切断端および右坐骨神経幹を摘出し、使用時まで−80℃に保存した。慢性絞扼モデルラットの作製は、BennettとXie(1988)の方法によって行った。全ての処置は、金沢大学動物実験規程に従って行った。
【0066】
相補DNA(cDNA)ライブラリーの作製
全細胞RNAをChirwinら(1979)の方法によって左坐骨神経の近位側切断端と右坐骨神経幹から抽出し、ポリ(A)+RNAをプロメガ社 (Promega, Madison, WI)の キット(PolyATract mRNA Isolation System III) を使用して精製した。さらに、Diatchenkoら(1996)のサプレッション・サブトラクティブ・ハイブリダイゼーション・ポリメラーゼ鎖反応法(suppression subtractive hybridization PCR)法をクロンテック社のキット(PCR Select;Clontech Laboratories)によって行った。この際、左坐骨神経の近位側切断端、右坐骨神経幹由来cDNAをそれぞれドライバー、テスターとして用いた。左坐骨神経の近位側切断端で発現上昇している遺伝子のcDNA断片のプールを得て、制限酵素Sau3AIとNotIで消化した後、pGEM−3zf(+)(Promega社)をBamHIとNotIで切断して作製したベクターに組み込み、大腸菌コンピテント細胞(TOP10F’、Invitrogen社)を形質転換した。
【0067】
cDNAの塩基配列決定とデータベース解析
クローン化したcDNAの塩基配列は、アプライドバイオシステムズ社(Applied Biosystems, Foster City, CA)の370A DNAシーケンサーを使用してダイデオキシ法にて決定した。得られた配列がコードするタンパクの同定は、BLASTプログラムを用いて 米国National Center for Biotechnology Information(NCBI)のデータベースと照合しながら行った。
【0068】
RNAブロットハイブリダイゼーション解析
左坐骨神経の近位側切断端と遠位側切断端および右坐骨神経幹からChomczynski とSacchi (1987)の方法によって抽出した全細胞RNA(各2μg)を1.0%アガロース−2.2Mホルムアミドゲルの電気泳動で分離した後、ナイロン膜(Zeta−Probe;Bio-Rad Laboratories社, Hercules, CA)に転写し、ラジオアイソトープ標識したcDNAとハイブリダイズさせた。ハイブリダイゼーション液の組成は、50%ホルムアミド、50mMリン酸ナトリウム緩衝液(pH7.0)、5×SSC(1×SSC:は0.15M塩化ナトリウム、0.015Mクエン酸ナトリウム)、250μg/mlサケ精子DNA、0.5%ドデシル硫酸ナトリウム(SDS)、0.1%ウシ血清アルブミン(BSA)、0.1%フィコールおよび0.1%ポリビニルピロリドンであった。一晩42℃でハイブリダイズさせた後、ナイロン膜を最終的に65℃の0.1%SDS含有0.1×SSCでリンスした。オートラジオグラフィーは−30℃で行い、増感スクリーンを用いた。バンドの黒化度の定量にはシオン・イメージ・プログラム(Scion Image program; Scion Corp., Frederick, MD)を使用した。
【0069】
(結果及び考察)
細胞外マトリックスの中から神経再生に関与する遺伝子を同定するために、切断したラット坐骨神経近位側切断端で発現上昇している遺伝子をクローニングした。135のcDNAクローンが単離され、そのうちECMの遺伝子をコードするものは、III型コラーゲン及びVI型コラーゲンのα1鎖、ルミカン、及びラミニンであった。さらに、RNAブロットハイブリダイゼーション分析を行ったところ、4.2kbのmRNAであるVI型コラーゲンが坐骨神経の近位側切断部及び遠位側切断部で発現していることが検出された。特に、近位側切断部では未処理の坐骨神経幹に比較して有意に発現上昇していることが確認された(図1A及びB)。
【0070】
重複する記載となるが、図1Aは、VI型コラーゲンのα1サブユニット及び18SリボソームRNAの発現を示している。それぞれのレーンに、坐骨神経の近位側切断部(Prox)、遠位側切断部(Dist)および坐骨神経幹(Contra)から抽出した2μgの全細胞RNAをロードした。分子量マーカーの位置を左側に示している。図1Bは、VI型コラーゲンのα1サブユニットの発現を、内部標準として18SリボソームRNAを用いて判定量的分析し、神経幹の値を基に標準化した結果を示すものである。バーは、平均値±標準誤差(n=3)を示している。アスタリスク(*)は、神経幹の値と比較した場合に有意差が見られるものを示している(P<0.05)。以上より、VI型コラーゲンの発現が、切断されたラット坐骨神経において上昇していることが明らかとなった。
【0071】
実施例2 VI型コラーゲンの活性の解析
【0072】
(材料と方法)
細胞培養
成体ラットの脊髄後根神経節(DRG:dorsal root ganglion)ニューロンの培養は、Rizzoら(1994)の方法に従った。L4とL5のDRGを摘出して結合組織を除去した後、コラゲナーゼ含有溶液、パパイン含有溶液中で酵素処理した。さらに、ダルベッコ変法イーグル培地(DMEM:Dulbecco’s modified Eagle’s medium:)とHanks’F−12培地を1:1で混合したものに10%牛胎児血清、1.5mg/mlトリプシンインヒビター、1.5mg/mlBSA、100U/mlペニシリンと0.1mg/mlストレプトマイシンを加えた溶液にDRGを移し、ピペッティングによって細胞を分散させた後、96穴のポリスチレンプレート(269620; Nunc社、Roskilde, Denmark)に蒔いた。ポリスチレンプレートは予めVI型コラーゲンで被覆したものとしないものとを用意した。
【0073】
上頚神経節(SCG: superior cervical ganglion)ニューロンの培養は、Fernandez-Fernandezら(1999)の方法に従った。成体ラットからSCGを摘出し、まず4℃のコラゲナーゼ(2mg/ml)溶液中で30分間、次に37℃のトリプシン(0.5mg/ml)溶液中で20分間インキュベートし、先端を細めたパスツールピペットでピペッティングして細胞を分散させてから、遠心した。集めた細胞は、牛胎児血清、2mMグルタミン酸、24mM重炭酸ナトリウム、38mMグルコース、100U/mlペニシリン、0.1mg/mlストレプトマイシンおよび100ng/mlNGFを含むL−15培地に分散して、96穴のポリスチレンプレート(269620; Nunc社)に蒔いた。
【0074】
ラット褐色細胞腫由来PC12細胞(Greeneら、1998)は、37℃、10%CO2、加湿条件下のインキュベーターにおいて、5%牛胎児血清と5%馬血清を含むダルベッコ変法イーグル培地で維持した。これを同じ培養液に250ng/mlNGFを加えたものに分散し、上記と同じ96穴のポリスチレンプレートに一穴あたり2500細胞の密度で蒔いた。
【0075】
神経芽細胞腫×脊髄ニューロンハイブリッド細胞株NSC34(Cashmanら、1992)は、10%牛胎児血清を含むダルベッコ変法イーグル培地で維持培養した後、上記と同様にポリスチレンプレートに蒔いた。
【0076】
神経突起伸展の測定
神経突起伸展の測定は、Turnerら(1989)の方法に従った。PC12細胞を0.125%(w/v)トリプシンと1mMEDTAを含むHanks緩衝塩類溶液で剥し、血清を含まないDMEMで洗滌したのち、96穴のポリスチレンプレート(269620; Nunc社)に蒔いた。穴は未処理のままか、ラミニン(50μg/ml)、ポリ−D−オルニチン(100μg/ml)、ポリ−L−リジン(50μg/ml)、I型コラーゲン(10μg/ml)、あるいはVI型コラーゲン(10μg/ml)溶液で一晩4℃で処理して被覆したものを使用した。細胞は一穴あたり2500個の密度で蒔き、NGFを250ng/mlになるように加えた。細胞体の直径の三倍以上の長さの神経突起を持つ細胞を陽性とし、培養を開始してから3時間、3、6、9、14日後にその数を比較した。
【0077】
細胞死の測定
細胞死の測定は、トリパンブルー(0.4%)染色とTUNEL法によった。TUNEL法は、ロッシュ社のキット(In Situ Cell Death Detection Kit、POD; Roche, Penzberg, Germany)を用いてOsamuraら(2005)の記載に従って実施した。上述のように異なる基質で被覆したポリスチレンプレート上で培養したPC12細胞を4%パラホルムアミドで固定し、10mMトリス緩衝液(pH7.5)に溶かしたプロテイナーゼK(20μg/ml)で30分間処理した。続いて、リン酸緩衝生理食塩水(PBS: phosphate-buffered saline)で洗滌した後、内因性ペルオキシダーゼを不活性化するために3%過酸化水素を含むメタノールに室温にて30分間浸した。再度PBSで洗滌した後、膜透過性を高めるために0.1%クエン酸ナトリウムで希釈した0.1%トリトンX−100を加え、氷上で2分間反応させた。さらに、ターミナルデオキシヌクレオチジルトランスフェラーゼ(TdT: terminal deoxynucleotidyl transferase)とフルオロレセイン標識UTPを含むTUNEL反応混合液と37℃で1時間反応させた。取り込まれたフルオロレセインを検出するために、HRP(horse-radish peroxidase)標識した抗フルオロレセイン抗体と反応させた後、3,3’−ジアミノベンチジンを発色基質として加えた。光学顕微鏡下で標本を観察するとともに、コンピューターに接続したカメラで視覚化した。
【0078】
免疫ペルオキシダーゼ染色
組織切片は、Feltsら(1997)が記載した方法に従って作製した。坐骨神経を切断してから3日後に、ラットをジエチルエーテルと抱水クロラールで深く麻酔し、心臓よりPBS、固定液(4%パラホルムアミド)の順に灌流した。左坐骨神経の近位側切断端と遠位側切断端および右坐骨神経幹を摘出し、同じ固定液(4%パラホルムアミド)に4℃で一晩浸して後固定を施した。さらに、30%ショ糖溶液に4℃で二晩浸して、耐凍性を高めた(cryoprotection)。組織標本は2−16μmの厚さに切り、ポリ−L−リジンで被覆したスライドガラスに載せた。切片をトリトンX−100、1%BSAおよび1%正常ヤギ血清を含むPBSで3時間ブロッキングしたあと、4℃で一晩ウサギポリクローナル抗VI型コラーゲン抗体(H−200;1:200希釈, Santa Cruz Biotechnology, Santa Cruz, CA)と反応させた。免疫反応性を検出するために、ニチレイ社のキット (Histofine Simple Stain MAX PO(M);Nichirei, Tsukiji, Japan)を添付された指示に従って使用した。発色後、切片を脱水、透徹し、カバーグラスを被せて光学顕微鏡下で観察した。
【0079】
蛍光二重染色
坐骨神経を切断してから3日後の組織から、上記と同様に20μm厚の切片を作製し、4℃で一晩ウサギ抗VI型コラーゲン抗体(H−200;1:200希釈; Santa Cruz Biotechnology)と反応させた。同時にマウスモノクローナル抗体として、S−100 タンパク抗体(1:200希釈;Sigma)、抗グリア線維性酸性タンパク(GFAP: glial fibrillary acidic protein)抗体(G−A−5;1:400希釈;Sigma)、抗シグナル制御タンパク(SIRP:signal regulatory protein)抗体(OX−41;1:50希釈;Chemicon International, Temecula, CA)、抗Thy1抗体(MRC OX−7;1:50希釈;Chemicon International)、抗ニューロフィラメント抗体(RT97;1:100希釈;Roche, Mannheim, Germany)、あるいは抗チロシン水酸化酵素抗体(Clone45;1:500希釈;BD Biosciences, Pharmingen, San Diego, CA)を加えて二重染色を行った。二次抗体にはフルオロレセイン・イソチオシアネート(FITC:flurorescein isothiocyanate)標識抗ウサギIgG抗体(1:500希釈;Molecular Probes, Eugene, OR)とテキサス・レッド標識抗マウスIgG抗体(1:500希釈;Molecular Probes)を用いて、4℃で3時間反応させた。切片の観察には共焦点レーザー顕微鏡(LSM5 PASCAL;Carl Zeiss, Gottingen, Germany)を使用し、得られた画像はアドビ・フォトショップ5.5版(Adobe Systems, San Jose, CA)を用いて補正した。
【0080】
(結果)
(VI型コラーゲンが神経突起伸展に与える影響)
VI型コラーゲンが神経突起の伸展に与える影響について、DRGニューロン、SCGニューロン、PC12細胞及びNSC34細胞を用いて試験した。図2に示すように、DRGニューロンにおいて、VI型コラーゲンを被覆したプレートに接着し、神経突起が伸展しているのが観察されたが、被覆処理していないプレートを用いた区では、プレートへの接着がほとんど見られず、最終的に細胞が凝集した。SCGニューロン、PC12細胞及びNSC34細胞においても同様の傾向が観察された。また、以下の実験は、細胞の安定性が優れているPC12細胞を用いて行った。
【0081】
重複する記載となるが、図2は、VI型コラーゲンをコートしたプレート(上段)又は被覆処理していないプレート(下段)で様々な神経細胞を培養し、観察された神経突起の伸展を示す図である。左から、DRGニューロン、SCGニューロン、神経芽細胞腫×脊髄ニューロンハイブリッド細胞株NSC34細胞、褐色細胞腫由来PC12細胞の結果を示している。被覆処理していないプレートで培養した場合、全ての細胞種において神経突起の伸展は観察されず、凝集した。スケールバーは50μmを表している。
【0082】
さらに、PC12細胞を用いて、神経突起が細胞直径の3倍以上伸展した細胞の頻度を計測した。図3に示すように、VI型コラーゲンを被覆したプレートを用いた区(VI型区)で、最も多くの細胞において細胞直径の3倍以上神経突起が伸展していることが観察された。培養後3時間で、12.9±2.6%(n=5;合計257細胞)の細胞で神経突起の伸展が観察された。ラミニンを被覆したプレート及びI型コラーゲンを被覆したプレートを用いた区(それぞれラミニン区及びI型区)においても、神経突起の伸展がそれぞれ9.6±2.9%及び3.9±1.2%(培養後3時間、n=5)観察された。培養3日目では、VI型区とラミニン区であまり差異がみられなかったが、培養6日目では、VI型区において神経突起が細胞直径の3倍以上伸展した細胞が有意に多く観察された。さらに、培養14日目では、VI型区が4.7±1.9%(n=5)であるのに対し、ラミニン区では実質的に0であった。I型区においても神経突起の伸展を示す細胞が観察されたが、培養6日目以降では観察されなかった。また、何も被覆していないプレートを用いた区では、神経突起の伸展が観察されなかった。神経突起の長さは、VI型区の培養後3時間で66.0±2.5μm(n=37)であり、その後培養14日目までほぼ同等の長さ(70.3±5.4μm、n=14)を維持した。ラミニン区でも、同程度の神経突起の長さ(55.7±3.3μm、n=31、培養後3時間)が観察されたが、I型区では他の2区よりも短い神経突起が観察された(45.9±2.5μm、n=19、培養後3時間)。
【0083】
重複する記載となるが、図3は、VI型コラーゲンと他の細胞外マトリックスタンパク質を用いた場合の神経突起の伸展を比較した図である。図3Aは、神経突起の経時的な変化を示す図である。NGF存在下で、VI型コラーゲン、ラミニン又はI型コラーゲンを被覆したプレート、もしくは被覆処理していないプレートを用いてPC12細胞を培養した。写真は、図中に示される時間を経過した後に撮影された。位置を確定するために、プレートの底に針でマークし、アスタリスク(*)で示した。図3Bは、神経突起が伸展した神経細胞の割合の経時的変化を示す図である。神経突起が細胞直径の3倍以上伸展した細胞を計数した。図3Cは、異なる細胞外マトリックスにおける神経突起の長さを測定した図である。それぞれの細胞から延びる最も長い神経突起の長さをScionImageソフトウェアを用いて計測した。バーは、平均値±標準誤差を示している。被覆処理していないプレートを用いた区と比較して有意差が見られた区をアスタリスク(*)を用いて示した(P<0.01)。
【0084】
(VI型コラーゲンが神経細胞死に与える影響)
本発明者は、神経突起の伸展についての試験を行っている過程で、VI型コラーゲンを被覆したプレートを用いて培養した神経細胞が、他の物質で被覆したプレートを用いて培養した神経細胞又は被覆処理していないプレートで培養した神経細胞よりも細胞死を起こりにくいことを発見した。そこで、NGFの存在下、様々な物質でコートしたプレート上で神経細胞を培養した。図4Aは、トリパンブルー染色法を用いて神経細胞の生存率の定量分析を行った結果である。被覆処理していないプレートで神経細胞を培養した区(None区)では、46.0±8.1%(n=5)のみが生存していたのに対し、VI型コラーゲンを被覆したプレートで培養した区及びラミニンを被覆したプレートで培養した区(それぞれColVI区及びLaminin区)では、それぞれ88.5±3.1%(n=6、P<0.001)及び88.1±3.7%(n=6、P<0.001)と有意に生存率が増加した(図4A)。I型コラーゲンを被覆したプレートで培養した区、ポリ−L−リジンを被覆したプレートで培養した区及びポリ−D−オルニチンを被覆したプレートで培養した区(それぞれColI区、PLL区及びPORN区)では、神経細胞の生存率がそれぞれ62.7±3.0%(n=6)、48.5±3.8%(n=6)及び42.8±7.7%(n=6)であり、None区に対して有意差はみられなかった。
【0085】
さらに、TUNEL法を用いて神経細胞の生存率を分析した(図4B)。None区では、47.1±7.6%(n=3)のみが生存していたのに対し、ColVI区及びLaminin区では、それぞれ78.2±3.2%(n=3、P<0.01)及び77.8±2.1%(n=3、P<0.01)と有意に生存率が増加した(図4C)。ColI区、PLL区及びPORN区では、神経細胞の生存率がそれぞれ68.2±8.8%(n=3)、39.1±2.0%(n=3)及び31.2±7.7%(n=6)であり、None区に対して有意差はみられなかった。
【0086】
重複する記載となるが、図4は、VI型コラーゲン(ColVI)、I型コラーゲン(ColI)、ラミニン(Laminin)、ポリ−L−リジン(PLL)又はポリ−D−オルニチン(PORN)が神経細胞の生存に与える影響を示す図である。図4Aは、トリパンブルー色素排除試験の結果を示す図である。ColI、ColVI、Laminin、PLL又はPORNを被覆したプレート、もしくは被覆処理していないプレート(None)を用いてPC12細胞を培養し、試験を行い、その生存率を示した。バーは平均±標準誤差を示している。None区と比較して有意差が見られた区をアスタリスク(*)を用いて示した(P<0.01)。図4Bは、TUNEL染色を用いて神経細胞死を視覚化した像である。TUNEL陽性の濃く染色された細胞は、ColVI区とLaminin区で少ないことが示されている。図4Cは、TUNEL染色像をもとに算出した細胞の生存率を示す図である。バーは平均値±標準誤差を示している。None区と比較して有意差が見られた区をアスタリスク(*)を用いて示した(*:P<0.01、**:P<0.001)。
【0087】
(VI型コラーゲンの発現)
VI型コラーゲンの局在を調べるために、免疫ペルオキシダーゼ染色を行った。坐骨神経の近位側切断部では、軸索の周囲(図5aおよびb)、近位切断端の円形の細胞(図5c)、及び血管周囲(図5d)においてVI型コラーゲンの発現が検出された。また、遠位側切断部では、退行性変化が見られる領域の細胞においてVI型コラーゲンの発現が検出された(図5e)。また、健常な坐骨神経幹では、VI型コラーゲンの発現がほとんど検出されなかった(図5f)。
【0088】
重複する記載となるが、図5は、VI型コラーゲンを免疫ペルオキシダーゼ染色した結果を示す図である。左坐骨神経切断後3日の左側(a−e)及び健常な右側(f)の神経を、抗VI型コラーゲン抗体を用いて染色した。左坐骨神経近位切断部では、軸索周囲の細胞で極めて強い反応が観察され(a及びb、矢印で示している)、また、近位切断端の円形の小さい細胞で強く染色された(c、矢頭)。さらに、VI型コラーゲンは、近位切断部の血管周囲に蓄積されていることも観察された(d、矢印)。左坐骨神経遠位切断点では、退行後に残存した細胞においても観察された(e、矢印)。健常な右側の坐骨神経幹では、VI型コラーゲンはほとんど検出されなかった(f)。スケールは、20μmを表している。
【0089】
さらに、蛍光二重染色を行い、VI型コラーゲン陽性細胞の特徴を分析した。図6Aに示すように、VI型コラーゲンは、S−100タンパク質陽性細胞で観察された。近位側切断部では、S−100タンパク陽性細胞周囲に選択的に局在していた。それとは対照的に、遠位側切断部では、S−100タンパク陽性細胞で均一的に観察された。また、ミエリン化シュワン細胞のマーカーであるGFAPとの同時染色においても、同様の傾向が観察された(図6B)。さらに、VI型コラーゲンの発現は、OX−41陽性マクロファージ及びThy−1陽性線維芽細胞においても検出された(図7A及びB)。しかしながら、軸索におけるRT97陽性ニューロフィラメントとVI型コラーゲンとの共局在は観察されなかった(図7C)。
【0090】
重複する記載となるが、図6は、蛍光二重染色の共焦点レーザー顕微鏡による像である。左坐骨神経切断後3日に左側(a−c)及び健常な右側(Contralateral、d1−d3)の神経を採取した。切片を作製し、4℃で一晩ウサギ抗VI型コラーゲン抗体及び抗マウス抗S−100タンパク質抗体で染色し、FITC標識抗ウサギIgG抗体(a1−d1、緑)もしくはテキサス・レッド標識抗マウスIgG抗体(a2−d2、赤)で可視化した。マージ像(Merge)では、黄色がVI型コラーゲン及びS−100タンパク質が共発現していることを示す(a3−d3)(図6A)。図6Bは、抗VI型コラーゲン抗体(e1−h1、緑)及び抗グリア線維性酸性タンパク(GFAP)抗体(e2−h2、赤)を用いて染色したものである。e3−h3はマージ像を示している。スケールは、10μmを表している。
【0091】
また、図7は、蛍光二重染色の共焦点レーザー顕微鏡による像である。左坐骨神経切断後3日に左側(a−e)及び健常な右側(f)の神経を採取した。切片を作製し、4℃で一晩ウサギ抗VI型コラーゲン抗体及びOX−41マウス抗シグナル制御タンパク(SRIP)抗体で染色し、FITC標識抗ウサギIgG抗体(a1−d1、緑)もしくはテキサス・レッド標識抗マウスIgG抗体(a2−d2、赤)で可視化した。マージ像では、黄色がVI型コラーゲン及びOX−41抗原が共発現していることを示す(a3−d3)(図7A)。図7Bは、抗VI型コラーゲン抗体(e1−g1、緑)及び抗Thy−1抗体(e2−g2、赤)を用いて染色したものである。e3−g3はマージ像を示している。図7Cは、抗VI型コラーゲン抗体(h1、緑)及びRT97マウス抗ニューロフィラメント抗体(h2、赤)を用いて染色したものである。h3はマージ像を示しているが、共発現は観察されなかった。スケールは、a、b及びdでは50μmを表し、c、e、f、g及びhでは10μmを表している。
【0092】
(VI型コラーゲンの交感神経線維での発現)
VI型コラーゲンが神経突起の伸展を強く促進すること、及び神経細胞死を抑制することから、VI型コラーゲンが損傷した部位の交感神経線維に局在しているかどうかを確認した。図8に示すように、VI型コラーゲンは交感神経線維に近接して蓄積されていることが観察された。
【0093】
重複する記載となるが、図8は、チロシン水酸化酵素陽性の神経線維の近傍にVI型コラーゲンが損傷坐骨神経に蓄積していることを示す像である。左側の坐骨神経幹を結紮して3週間後の組織を採取し、切片を作製後、ウサギ抗VI型コラーゲン抗体及びマウス抗チロシン水酸化酵素抗体で染色し、FITC標識抗ウサギIgG抗体(A、緑)もしくはテキサス・レッド標識抗マウスIgG抗体(B、赤)で可視化した。スケールは20μmを表している。
【0094】
(考察)
以上より、VI型コラーゲンが神経突起の伸展促進作用、神経細胞死抑制作用、神経再生促進作用を有することが明らかとなった。VI型コラーゲンは、実際の神経組織でも発芽、軸索伸展のための足場として働き、損傷後の再生過程に関与することが示唆される。
【0095】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【図面の簡単な説明】
【0096】
【図1】図1は、RNAブロットハイブリダイゼーション分析の結果を示す図である。
【図2】図2は、VI型コラーゲンを被覆したプレート(上段)又は被覆処理していないプレート(下段)で様々な神経細胞を培養し、観察された神経突起の伸展を示す図である。
【図3】図3は、VI型コラーゲンと他の細胞外マトリックスタンパク質を用いた場合の神経突起の伸展を比較した図である。
【図4】図4は、VI型コラーゲン(ColVI)、I型コラーゲン(ColI)、ラミニン(Laminin)、ポリ−L−リジン(PLL)又はポリ−D−オルニチン(PORN)が神経細胞の生存に与える影響を示す図である。
【図5】図5は、VI型コラーゲンを免疫ペルオキシダーゼ染色した結果を示す図である。
【図6】図6は、蛍光二重染色の共焦点レーザー顕微鏡による像である。
【図7】図7は、蛍光二重染色の共焦点レーザー顕微鏡による像である。
【図8】図8は、損傷坐骨神経のチロシン水酸化酵素陽性の神経線維の近傍にVI型コラーゲンが蓄積していることを示す像である。
【図9】図9は、VI型コラーゲンα1サブユニットのアミノ酸配列を示す図である。
【図10】図10は、VI型コラーゲンα1サブユニットをコードする核酸配列を示す図である。
【図11】図11は、VI型コラーゲンα2サブユニットのアミノ酸配列を示す図である。
【図12】図12は、VI型コラーゲンα2サブユニットをコードする核酸配列を示す図である。
【図13】図13は、VI型コラーゲンα3サブユニットのアミノ酸配列を示す図である。
【図14】図14は、VI型コラーゲンα3サブユニットをコードする核酸配列を示す図である。
【特許請求の範囲】
【請求項1】
VI型コラーゲンを含む、神経細胞死抑制剤。
【請求項2】
VI型コラーゲンを含む、神経突起の伸展促進剤。
【請求項3】
VI型コラーゲンを含む、神経再生促進剤。
【請求項4】
ヒト生体外において神経細胞死を抑制する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞死を抑制する方法。
【請求項5】
ヒト生体外において神経突起の伸展を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経突起の伸展を促進する方法。
【請求項6】
ヒト生体外において神経再生を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経再生を促進する方法。
【請求項7】
神経細胞を培養する方法であって、培養容器中で神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞を培養する方法。
【請求項8】
前記培養容器が、VI型コラーゲンで被覆したものである、請求項5に記載の培養方法。
【請求項9】
VI型コラーゲン及び培養容器を含む、神経細胞培養キット。
【請求項10】
前記培養容器が、VI型コラーゲンで被覆したものである、請求項9に記載の神経細胞培養キット。
【請求項11】
VI型コラーゲンを含む、神経再生のための医療材料。
【請求項12】
前記VI型コラーゲンがシート状である、請求項11に記載の医療材料。
【請求項13】
前記VI型コラーゲンがチューブ状である、請求項11に記載の医療材料。
【請求項14】
前記VI型コラーゲンが生体適合素材に充填されたものである、請求項11に記載の医療材料。
【請求項1】
VI型コラーゲンを含む、神経細胞死抑制剤。
【請求項2】
VI型コラーゲンを含む、神経突起の伸展促進剤。
【請求項3】
VI型コラーゲンを含む、神経再生促進剤。
【請求項4】
ヒト生体外において神経細胞死を抑制する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞死を抑制する方法。
【請求項5】
ヒト生体外において神経突起の伸展を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経突起の伸展を促進する方法。
【請求項6】
ヒト生体外において神経再生を促進する方法であって、神経細胞とVI型コラーゲンを接触させる工程を含む、神経再生を促進する方法。
【請求項7】
神経細胞を培養する方法であって、培養容器中で神経細胞とVI型コラーゲンを接触させる工程を含む、神経細胞を培養する方法。
【請求項8】
前記培養容器が、VI型コラーゲンで被覆したものである、請求項5に記載の培養方法。
【請求項9】
VI型コラーゲン及び培養容器を含む、神経細胞培養キット。
【請求項10】
前記培養容器が、VI型コラーゲンで被覆したものである、請求項9に記載の神経細胞培養キット。
【請求項11】
VI型コラーゲンを含む、神経再生のための医療材料。
【請求項12】
前記VI型コラーゲンがシート状である、請求項11に記載の医療材料。
【請求項13】
前記VI型コラーゲンがチューブ状である、請求項11に記載の医療材料。
【請求項14】
前記VI型コラーゲンが生体適合素材に充填されたものである、請求項11に記載の医療材料。
【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図10】


【図11】


【図12】


【図13】


【図14】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2010−37316(P2010−37316A)
【公開日】平成22年2月18日(2010.2.18)
【国際特許分類】
【出願番号】特願2008−205468(P2008−205468)
【出願日】平成20年8月8日(2008.8.8)
【出願人】(504160781)国立大学法人金沢大学 (282)
【Fターム(参考)】
【公開日】平成22年2月18日(2010.2.18)
【国際特許分類】
【出願日】平成20年8月8日(2008.8.8)
【出願人】(504160781)国立大学法人金沢大学 (282)
【Fターム(参考)】
[ Back to top ]

