粒子を操作する方法及びマイクロ流体装置
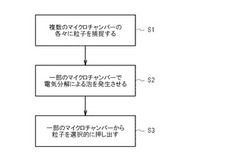
【課題】穏やかな条件で確実に粒子を操作する方法を提供する。
【解決手段】本発明に係る方法は、各々が電気分解用の陽極及び陰極のうち少なくとも一方の電極を有する複数のマイクロチャンバーに操作の対象とする粒子を捕捉し(S1)、前記複数のマイクロチャンバーのうち一部のマイクロチャンバーの前記電極に選択的に電圧を印加することにより水を電気分解して泡を発生させ(S2)、前記泡の発生に伴い作動するアクチュエーターによって、前記一部のマイクロチャンバーから選択的に前記粒子を押し出す(S3)方法である。
【解決手段】本発明に係る方法は、各々が電気分解用の陽極及び陰極のうち少なくとも一方の電極を有する複数のマイクロチャンバーに操作の対象とする粒子を捕捉し(S1)、前記複数のマイクロチャンバーのうち一部のマイクロチャンバーの前記電極に選択的に電圧を印加することにより水を電気分解して泡を発生させ(S2)、前記泡の発生に伴い作動するアクチュエーターによって、前記一部のマイクロチャンバーから選択的に前記粒子を押し出す(S3)方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、粒子を操作する方法及びマイクロ流体装置に関し、特に、電気分解による泡の発生を利用して粒子を操作する方法及び装置に関する。
【背景技術】
【0002】
大量の細胞を高速にアレイ化し高感度で解析するマイクロ流体システムは、医療診断や新薬開発等の産業応用に加え、基礎科学の分野でも重要な解析ツールとしての役割を発揮してきた。
【0003】
そして、さらに発展したマイクロ流体システムとして、例えば、アレイ化された大量の細胞を解析した後、特異的な反応を示した細胞の遺伝子やタンパク質を詳細に解析するために、当該大量の細胞のうちから特定の細胞を選択的に取り出す機能を備えたシステムの開発が望まれている。
【0004】
そこで、従来、例えば、非特許文献1において、アルミニウムパッチが配置された複数のマイクロチャンバーの各々にマイクロビーズを1つずつ捕捉し、特定のマイクロチャンバーのアルミニウムパッチにレーザーを照射して溶液を局所的に沸騰させることにより泡を発生させ、当該特定のマイクロチャンバーから選択的にマイクロビーズを解放する技術が提案されている。
【0005】
また、例えば、非特許文献2において、電気泳動力によってマイクロビーズや細胞をマイクロウェルから取り出す技術が提案されている。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Wei-Heong Tan and Shoji Takeuchi (2007) Proc Natl Acad Sci USA, 104,1146-1151.
【非特許文献2】Ching-Yu Chang et al. (2009) Lab Chip, 9, 1185-1192.
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、上記非特許文献1に記載の技術においては、例えば、(1)溶液を部分的に沸騰させるため細胞を傷つけてしまう可能性がある、(2)レーザーを発生させる装置が高価である、(3)標的とするマイクロチャンバーに正確にレーザーを照射するために高い技術力を要する、といった問題があった。
【0008】
また、上記非特許文献2に記載の技術においては、電気泳動力が小さいため、例えば、受精卵等の比較的大きな細胞を確実に操ることができないといった問題があった。
【0009】
本発明は、上記課題に鑑みて為されたものであり、穏やかな条件で確実に粒子を操作する方法及びマイクロ流体装置を提供することをその目的の一つとする。
【課題を解決するための手段】
【0010】
上記課題を解決するための本発明の一実施形態に係る方法は、各々が電気分解用の陽極及び陰極のうち少なくとも一方の電極を有する複数のマイクロチャンバーに操作の対象とする粒子を捕捉し、前記複数のマイクロチャンバーのうち一部のマイクロチャンバーの前記電極に電圧を印加することにより水を電気分解して泡を発生させ、前記泡の発生に伴い作動するアクチュエーターによって、前記一部のマイクロチャンバーから選択的に前記粒子を押し出すことを特徴とする。本発明によれば、穏やかな条件で確実に粒子を操作する方法を提供することができる。
【0011】
また、前記アクチュエーターは、浮遊する前記泡又は前記泡の発生に伴い流動する前記マイクロチャンバー内の液体であることとしてもよい。また、前記アクチュエーターは、前記マイクロチャンバーにおいて前記電極と前記粒子との間に設けられ前記泡の発生に伴い前記粒子を押し出すように変形する伸縮性の膜であることとしてもよい。
【0012】
また、前記粒子は細胞であり、前記複数のマイクロチャンバーの各々に前記細胞を1つずつ捕捉して培養し、前記複数のマイクロチャンバーで培養された複数の前記細胞のうち一部を回収すべき細胞として決定し、前記複数のマイクロチャンバーのうち前記回収すべき細胞が捕捉されている一部のマイクロチャンバーの前記電極に電圧を印加することにより水を電気分解して泡を発生させ、前記泡の発生に伴い作動する前記アクチュエーターによって、前記一部のマイクロチャンバーから選択的に前記細胞を押し出すこととしてもよい。この場合、前記細胞は受精卵であり、前記一部のマイクロチャンバーから選択的に押し出された前記受精卵を生きた状態で回収することとしてもよい。
【0013】
上記課題を解決するための本発明の一実施形態に係るマイクロ流体装置は、粒子を捕捉するための複数のマイクロチャンバーと、前記複数のマイクロチャンバーが開口する共通流路と、を備えたマイクロ流体装置であって、前記複数のマイクロチャンバーの各々には、電気分解用の陽極及び陰極のうち少なくとも一方の電極が配置されていることを特徴とする。本発明によれば、穏やかな条件で確実に粒子を操作することのできるマイクロ流体装置を提供することができる。
【0014】
また、前記複数のマイクロチャンバーが設けられた第一部材と、前記第一部材に積層された第二部材と、を備え、前記複数のマイクロチャンバーの各々には、前記陽極及び陰極のうち一方の電極が配置され、前記第二部材には、前記陽極及び陰極のうち他方の電極が配置されていることとしてもよい。また、前記複数のマイクロチャンバーの各々には、前記陽極及び陰極の両方の電極が配置されていることとしてもよい。
【0015】
また、前記複数のマイクロチャンバーの各々は、前記共通流路に開口し前記粒子が収容される収容室と、前記収容室に連通して設けられ前記電極が配置された電気分解室と、を有することとしてもよい。また、前記複数のマイクロチャンバーの各々は、前記共通流路に開口し前記粒子が収容される収容室と、前記電極が配置された電気分解室と、前記収容室と前記電気分解室との間に設けられ前記電気分解室における水の電気分解による泡の発生に伴って前記粒子を前記収容室から押し出すように変形する伸縮性の膜と、を有することとしてもよい。
【発明の効果】
【0016】
本発明によれば、穏やかな条件で確実に粒子を操作する方法及びマイクロ流体装置を提供することができる。
【図面の簡単な説明】
【0017】
【図1】本発明の一実施形態に係る方法に含まれる主な工程を示す説明図である。
【図2】本発明の一実施形態に係るマイクロ流体装置の一例についての平面図である。
【図3】図2に示すIII−III線で切断したマイクロ流体装置の断面図である。
【図4】本発明の一実施形態に係るマイクロチャンバーを形成する工程の一例を示す説明図である。
【図5】図2及び図3に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図6】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の平面図である。
【図7】図6に示すVII−VII線で切断したマイクロ流体装置の断面図である。
【図8】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の平面図である。
【図9】図8に示すIX−IX線で切断したマイクロ流体装置の断面図である。
【図10】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の断面図である。
【図11】図10に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図12】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の断面図である。
【図13】図12に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図14】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の断面図である。
【図15】図14に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図16】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の平面図である。
【図17】図16に示すXVII−XVII線で切断したマイクロ流体装置の断面図である。
【図18】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の断面図である。
【図19】図18に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図20】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の平面図である。
【図21】図20に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図22】本発明の一実施形態に係るマイクロ流体装置の顕微鏡写真の一例を示す説明図である。
【図23】本発明の一実施形態に係るマイクロ流体装置の顕微鏡写真の他の例を示す説明図である。
【図24】本発明の一実施形態に係るマイクロ流体装置におけるマイクロビーズの選択的解放を撮影したタイムラプスビデオ画像の一例を示す説明図である。
【図25】本発明の一実施形態に係るマイクロ流体装置において電気分解による泡の発生が細胞の生存率に与える影響を評価した結果の一例を示す説明図である。
【発明を実施するための形態】
【0018】
以下に、本発明の一実施形態について説明する。なお、本発明は、本実施形態に限られるものではない。
【0019】
まず、本実施形態に係る方法(以下、「本方法」という。)について説明する。図1は、本方法に含まれる主な工程を示す説明図である。
【0020】
図1に示すように、本方法においては、各々が電気分解用の陽極及び陰極のうち少なくとも一方の電極を有する複数のマイクロチャンバーに操作の対象とする粒子を捕捉し(工程S1)、当該複数のマイクロチャンバーのうち一部のマイクロチャンバーの当該電極に電圧を印加することにより水を電気分解して泡を発生させ(工程S2)、当該泡の発生に伴い作動するアクチュエーターによって、当該一部のマイクロチャンバーから選択的に当該粒子を押し出す(工程S3)。
【0021】
すなわち、第一の工程S1では、まず、電気分解用の電極を有する複数のマイクロチャンバーを準備する。このマイクロチャンバーについては、後に詳しく説明するが、複数のマイクロチャンバーの各々は、互いに独立に電圧を印加することのできる電気分解用の電極を有している。
【0022】
次いで、各マイクロチャンバーに操作の対象とする粒子(以下、「対象粒子」という。)を入れる。ここで、対象粒子は、液体の流れに乗せて運搬できる粒子であれば特に限られず、例えば、細胞やマイクロビーズを用いることができる。
【0023】
細胞の種類は特に限られず、例えば、ヒト又はヒト以外の動物の細胞を好ましく用いることができる。より具体的には、例えば、ヒト又はヒト以外の動物に由来する様々な分化細胞や未分化細胞(幹細胞、ES細胞、iPS細胞等)、また、受精卵を用いることもできる。細胞としては、単一の細胞を用いることができ、また、複数の細胞が集合して形成された細胞組織体を用いることもできる。
【0024】
マイクロビーズとしては、例えば、樹脂ビーズやゲルビーズを用いることができる。また、細胞や細胞組織体をゲルで被覆して形成されたマイクロカプセルを用いることもできる。なお、対象粒子としては、これら細胞やマイクロビーズ等の球状体を好ましく用いることができるが、その形状は球状に限られない。
【0025】
対象粒子のサイズは、液体中で浮遊させてマイクロチャンバーから押し出すことのできる範囲であれば特に限られないが、対象粒子が球状体である場合には、その直径は、例えば、1μm以上とすることができ、好ましくは数十〜数百μmの範囲とすることができる。
【0026】
続く第二の工程S2では、対象粒子が捕捉された複数のマイクロチャンバーのうち、一部のマイクロチャンバーの電極に選択的に電圧を印加し、当該一部のマイクロチャンバーで水の電気分解を行って泡を発生させる。
【0027】
すなわち、選択された一部のマイクロチャンバーが有する電極のみを電源に接続して通電することによって、当該一部のマイクロチャンバーで当該電極から泡を発生させる。なお、水の電気分解によって、陰極では水素ガスが発生し、陽極では酸素ガスが発生する。
【0028】
印加する電圧の大きさは、水を電気分解して泡を発生させることのできる範囲であれば特に限られないが、対象粒子として細胞を用いる場合には、当該細胞の生存を適切に維持できる比較的小さな範囲とすることが好ましい。
【0029】
具体的には、例えば、3〜10Vの範囲とすることができ、4〜6Vの範囲とすることが好ましい。ただし、印加すべき電圧の大きさは、これに限られず、本方法で用いるマイクロ流体装置の構造や電気分解の対象となる水溶液の組成等の条件に応じて適宜設定することができる。
【0030】
第三の工程S3では、泡の発生に伴い作動するアクチュエーターによって、一部のマイクロチャンバーから選択的に対象粒子を解放する。このアクチュエーターについては、後に詳しく説明するが、当該アクチュエータは、例えば、電気分解により発生した浮遊する泡又は当該泡の発生に伴い流動するマイクロチャンバー内の液体とすることができる。
【0031】
すなわち、本方法においては、例えば、マイクロチャンバーで発生し浮遊する泡をアクチュエータとして利用することで、当該泡によって当該マイクロチャンバーから対象粒子を押し出すことができる。また、本方法においては、例えば、マイクロチャンバーで泡の発生に伴い流動する液体をアクチュエーターとして利用することで、当該液体の流れに乗せて当該マイクロチャンバーから対象粒子を押し出すことができる。
【0032】
また、本方法におけるアクチュエーターは、例えば、マイクロチャンバーにおいて電極と対象粒子との間に設けられ泡の発生に伴い当該対象粒子を押し出すように変形する伸縮性の膜とすることもできる。この膜についても後に詳しく説明するが、本方法においては、泡の発生に伴う圧力によってマイクロチャンバーから対象粒子を押し出すように変形する膜をアクチュエーターとして利用することもできる。
【0033】
このような本方法によれば、複数のマイクロチャンバーのうち特定のマイクロチャンバーからの選択的な対象粒子の解放を、穏やかな条件で確実に実現することができる。
【0034】
すなわち本方法は、電気分解による泡の発生を利用するため、例えば、(1)発生する熱が極めて小さく対象粒子(特に細胞)に対するダメージが小さい、(2)レーザー照射装置等の特殊な装置を必要としないため汎用性が高い、(3)汎用的なエレクトロニクス技術を用いて電極の配置及び配線をすることで狙ったマイクロチャンバーにのみ簡便に且つ確実に泡を発生させることができる、といった利点を有する。
【0035】
また、本方法は、泡の発生に伴う圧力を利用するため、電気泳動力では操ることのできないような対象粒子であっても確実に操作することができるといった利点も有する。
【0036】
したがって、本方法においては、例えば、哺乳動物の受精卵のように、比較的大きく、且つ環境の条件に敏感でダメージを受けやすい細胞を無傷のまま効率よく且つ確実に操作することができる。
【0037】
具体的に、例えば、畜産分野においては、和牛の受精卵をホルスタインの胎内に入れて、当該ホルスタインに和牛を産ませるといった畜産技術の開発が進められている。この場合、受精卵は胚盤胞を形成するまで生体外で培養し、その後、胚盤胞となった受精卵を母胎の子宮に移植することになる。
【0038】
また、通常、複数の受精卵を準備して培養し、胚盤胞を形成した複数の受精卵のうち、移植に適した良好な状態のものを選択的に回収し、実際の移植に用いる。受精卵が移植に適した良好な状態であるか否かは、顕微鏡下の観察において、その大きさや形状によって目視で判別することができる。一方、受精卵は環境条件に敏感でありダメージを受けやすいため、その選択的な回収は穏やかな条件下で行う必要がある。
【0039】
そこで、上述のような利点を有する本方法によれば、複数のマイクロチャンバーの各々で受精卵を胚盤胞となるまで培養し、その後、胚盤胞を形成した複数の受精卵のうち移植に適していると判断された特定の受精卵を選択的に良好な状態のまま回収することが可能となる。
【0040】
すなわち、この場合、本方法においては、複数のマイクロチャンバーの各々に受精卵を1つずつ捕捉して培養し(工程S1)、当該複数のマイクロチャンバーで培養された複数の当該受精卵のうち一部を回収すべき受精卵として決定し、当該複数のマイクロチャンバーのうち当該回収すべき受精卵が捕捉されている一部のマイクロチャンバーの電極に電圧を印加することにより水を電気分解して泡を発生させ(工程S2)、当該泡の発生に伴い作動するアクチュエーターによって、当該一部のマイクロチャンバーから選択的に当該受精卵を押し出し、押し出された当該受精卵を生きた状態で回収する(工程S3)。
【0041】
具体的に、第一の工程S1においては、複数の受精卵と、複数のマイクロチャンバーと、を準備し、当該複数のマイクロチャンバーの各々に当該受精卵を1つずつ入れて培養する。この培養によって、各受精卵から胚盤胞を形成させる。
【0042】
第二の工程S2においては、まず、各マイクロチャンバーで胚盤胞を形成した受精卵の形態を観察し、当該観察の結果に基づいて、複数の受精卵のうち回収すべき受精卵を決定する。
【0043】
次いで、この回収すべき受精卵が培養されている特定のマイクロチャンバーの電極に選択的に電圧を印加することにより、当該特定のマイクロチャンバーで電気分解を行い、泡を発生させる。
【0044】
そして、第三の工程S3においては、電気分解により発生し浮遊する泡又は当該泡の発生に伴う特定のマイクロチャンバー内の培養液の流れによって、当該特定のマイクロチャンバーから標的の受精卵を選択的に解放する。その後、解放された受精卵を回収して移植に用いる。
【0045】
このように、本方法によれば、マイクロチャンバーを用いて大量の和牛の受精卵をアレイ化して培養した後、当該大量の受精卵のうち活性の高い受精卵のみを無傷で選択的に回収することができる。
【0046】
すなわち、大量の受精卵から好ましい受精卵のみを選択的に且つ高速で回収するというマイクロ流体システムを実現することができる。このようなマイクロ流体システムにおいては、受精卵の培養や選択的な回収を自動化することも可能である。なお、このような本方法においては、受精卵に代えて、上述したような任意の1種類又は2種類以上の細胞を用いることもできる。すなわち、細胞としては、単一の細胞を用いることができ、また、複数の細胞が集合して形成された細胞組織体(細胞塊)を用いることもできる。また、単一の細胞又は細胞組織体を内包するマイクロカプセルを用いることもできる。また、受精卵も含め、対象粒子として細胞を用いる場合には、マイクロチャンバーから押し出された細胞を回収することができるが、当該細胞は必ずしも生きた状態で回収される必要はない。生きた状態で回収されないとしても、細胞の遺伝子やタンパク質の発現等の特性を解析することは可能である。
【0047】
次に、本実施形態に係るマイクロ流体装置(以下、「本装置」という。)について説明する。なお、上述した本方法は、以下に説明する本装置を用いることにより好ましく実施することができるが、これに限られず、他の装置を用いても実施することができる。
【0048】
本装置は、対象粒子を捕捉するための複数のマイクロチャンバーと、当該複数のマイクロチャンバーが開口する共通流路と、を備え、当該複数のマイクロチャンバーの各々には、電気分解用の陽極及び陰極のうち少なくとも一方の電極が配置されている。すなわち、本装置においては、複数のマイクロチャンバーの各々が、互いに独立に電圧を印加できる電気分解用の電極を有している。
【0049】
図2は、本装置1の一例についての平面図である。図3は、図2に示すIII−III線で切断した本装置1の断面図である。
【0050】
この例に係る本装置1は、図2及び図3に示すように、複数(図2では9つ)のマイクロチャンバー10が設けられた第一部材20と、当該第一部材20に積層された第二部材30と、を備え、当該複数のマイクロチャンバー10の各々には、電気分解用の陽極及び陰極のうち一方の電極40が配置され、当該第二部材30には、当該陽極及び陰極のうち他方の電極41が配置されている。
【0051】
なお、図2においては、説明の便宜のため、第二部材30を取り外した状態の本装置1の平面図を示している。また、以下の説明において、本装置1が複数の同様の部分を有する場合には、当該複数の部分の符号に小文字のアルファベットを付して区別することがある(例えば、マイクロチャンバー10a,10b,10c)が、これらを特に区別する必要のない場合には、当該小文字のアルファベットは省略することとする。
【0052】
図3に示すように、第一部材20は、第一基板21と、当該第一基板21に積層された被覆層22と、当該第一部材20と第二部材30との間に共通流路24を形成するためのスペーサ23と、を有している。
【0053】
第一基板21、被覆層22及びスペーサ23はいずれも非導電性の材料で形成される。この非導電性材料は特に限られず、例えば、ガラスや非導電性樹脂を好ましく用いることができる。すなわち、例えば、第一基板21をガラス基板とし、被覆層22を非導電性樹脂からなるフォトレジスト層とし、スペーサ23をシリコーンゴム成形体とすることができる。
【0054】
マイクロチャンバー10は、被覆層22の表面に開口する有底の穴として形成されている。なお、図3には、第一部材20が第一基板21と被覆層22とを有する積層体である例を示しているが、例えば、当該第一部材20は単一の非導電性基板とすることもでき、この場合には、マイクロチャンバー10は、当該非導電性基板の表面に開口するよう形成される。
【0055】
すなわち、マイクロチャンバー10は、非導電性の第一部材20の表面に開口するものであれば、図3及び他の図面に示す例に限られない。また、対象粒子として細胞を用いる場合には、マイクロチャンバー10の内面は、当該細胞が接着しない、いわゆる細胞非接着性の表面とすることが好ましい。
【0056】
なお、図2及び図3には、マイクロチャンバー10の底部及び開口部が円形である例を示しているが、当該底部及び開口部の形状はこれに限られず、例えば、楕円形や多角形とすることもできる。
【0057】
マイクロチャンバー10のサイズは、捕捉すべき対象粒子のサイズに応じて任意に設定することができ、例えば、当該対象粒子を1つずつ捕捉する上で適切なサイズとすることができる。
【0058】
具体的に、マイクロチャンバー10の底面積及び開口面積は、例えば、25〜90000μm2の範囲とすることができ、好ましくは100〜400μm2の範囲とすることができる。すなわち、マイクロチャンバー10が円形の有底穴である場合には、その底部及び開口部の直径は、例えば、5〜300μmの範囲とすることができ、好ましくは80〜250μmの範囲とすることができる。また、マイクロチャンバー10の深さは、例えば、5〜300μmの範囲とすることができ、好ましくは80〜250μmの範囲とすることができる。
【0059】
マイクロチャンバー10のサイズが対象粒子のサイズに比べて大きすぎる場合には、1つの当該マイクロチャンバー10に2つ以上の対象粒子が入ることとなる。また、この場合、マイクロチャンバー10で発生した泡が、当該マイクロチャンバー10の内面と、捕捉されている対象粒子と、の間をすり抜けて当該マイクロチャンバー10外に漏出しやすくなるため、当該泡をアクチュエーターとして有効に利用できない場合がある。したがって、例えば、対象粒子としてヒト又はヒト以外の哺乳動物の受精卵を用いる場合には、各マイクロチャンバー10に当該受精卵を1つずつ捕捉するため、当該マイクロチャンバー10の直径は、例えば、80〜250μmの範囲とすることが好ましく、深さは、例えば、80〜250μmの範囲とすることが好ましい。
【0060】
マイクロチャンバー10の底部には、電気分解用の電極40が1つずつ配置されている。なお、図2及び図3に示す例では、マイクロチャンバー10の底部の全体が電極40となっているが、これに限られず、当該底部の一部に電極40を配置することもできる。
【0061】
また、本装置1に形成された複数の電極40は、互いに独立に電気分解用の電圧を印加できるように形成されている。すなわち、複数の電極40は、互いに独立に電源に接続することができる。具体的に、図2に示す例において、3つの電極40a,40b,40cは、3つのマイクロチャンバー10a,10b,10cにそれぞれ配置されるとともに、互いに電気的に独立して形成された3つの配線42a,42b,42cにそれぞれ接続されている。
【0062】
したがって、例えば、3つの配線42a,42b,42cのうち1つの配線42aのみを電源に接続することにより、当該配線42aと接続された1つの電極40aにのみ選択的に電圧を印加することができる。そして、この場合、電圧が印加された電極40aを有する1つのマイクロチャンバー10aでのみ水の電気分解を行い、泡を発生させることができる。
【0063】
電極40及び配線42は、導電性の材料から形成される。この導電性材料は特に限られず、例えば、ITO(Indium Oxide Tin)、金、白金、アルミニウムを用いることができ、特に、透明な電極40及び配線42を簡便且つ確実に形成できるITOを好ましく用いることができる。
【0064】
このような電極40を有するマイクロチャンバー10は、例えば、公知の半導体製造技術を用いて形成することができる。図4は、マイクロチャンバー10を形成する工程の一例を示す説明図である。
【0065】
まず、図4Aに示すように、ガラス基板からなる第一基板21上に、ITOからなる導電性膜27をパターンし、さらに当該導電性膜27のうち、電極40a,40b,40c(図4B参照)のそれぞれに対応する領域にポジ型フォトレジスト28a,28b,28cをパターンする。
【0066】
次いで、図4Bに示すように、所定のエッチング液を用いて導電性膜27をエッチングして、電極40a,40b,40cを形成する。さらに、図4Cに示すように、電極40a,40b,40c上にネガ型フォトレジストからなる非導電性層29をコートする。
【0067】
そして、図4Dに示すように、この非導電性層29のうち、電極40a,40b,40cに対応する位置にマイクロチャンバー10a,10b,10cをパターン形成する。こうして、第一基板21に積層された非導電性の被覆層22の表面に開口し、底部に電極40a,40b,40cを有するマイクロチャンバー10a,10b,10cを形成することができる。
【0068】
一方、第二部材30は、第二基板31と、当該第二基板31の表面に形成された電気分解用の電極41と、を有している。第二基板31は非導電性の材料で形成される。この非導電性材料は特に限られず、例えば、ガラスや非導電性樹脂を好ましく用いることができる。すなわち、例えば、第二基板31はガラス基板とすることができる。
【0069】
図3に示す例において、電極41は、共通流路24を介して複数のマイクロチャンバー10の電極40に対向する位置に形成されている。すなわち、本装置1は、複数のマイクロチャンバー10の底面に配置された複数の電極40と、当該複数の電極40に対向するよう配置された共通の電極41と、を有している。
【0070】
電極41は、導電性の材料から形成される。この導電性材料は特に限られず、例えば、ITO、金、白金、アルミニウムを用いることができ、特に、透明な電極41を簡便且つ確実に形成できるITOを好ましく用いることができる。
【0071】
そして、本装置1は、これら第一部材20と第二部材30とを貼り合わせることにより構成される。共通流路24は、複数のマイクロチャンバー10と第二部材30との間の隙間として形成される。
【0072】
また、図2に示す例において、本装置1は、その内部に液体を流入させるための流入口25と、その内部から液体を流出させるための流出口26と、を有している。すなわち、本装置1においては、流入口25から共通流路24及びマイクロチャンバー10に液体を流入させることができ、また、当該共通流路24及びマイクロチャンバー10内の液体を流出口26から流出させることができる。なお、図2には、流入口25及び流出口26が本装置1の長手方向の端部に開口する例を示しているが、これに限られず、例えば、当該流入口25及び流出口26の少なくとも一方を第二部材30の外表面に開口するよう設けることもできる。
【0073】
図5は、図2及び図3に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。この場合、本方法の第一の工程S1では、図5Aに示すように、複数のマイクロチャンバー10の各々に対象粒子50を捕捉する。
【0074】
すなわち、例えば、本装置1の流入口25(図2参照)から、対象粒子50が分散された水溶液を共通流路24内に注入する。この結果、各マイクロチャンバー10において、底部である電極40上に対象粒子50が載置される。
【0075】
また、各マイクロチャンバー10及び共通流路24は水溶液で満たされる。なお、図5には、1つのマイクロチャンバー10に1つの対象粒子50を捕捉する例を示したが、これに限られず、1つのマイクロチャンバー10に複数の対象粒子50を捕捉することもできる。この場合、マイクロチャンバー10は、複数の対象粒子50を収容できるサイズに形成される。
【0076】
次に、第二の工程S2においては、図5Bに示すように、複数のマイクロチャンバー10a,10b,10cのうち1つのマイクロチャンバー10aの電極40aに選択的に電圧を印加することにより水を電気分解して泡60を発生させる。
【0077】
すなわち、標的とする1つのマイクロチャンバー10aの電極40aと、当該電極40aに対向する第二部材30の電極41と、を電源に接続して陽極及び陰極とし、当該マイクロチャンバー10a内の水溶液を電気分解して泡60を発生させることのできる大きさの電圧を印加する。
【0078】
この結果、複数のマイクロチャンバー10a,10b,10cのうち、標的とする1つのマイクロチャンバー10aにおいてのみ、水溶液の電気分解による泡60を発生させることができる。
【0079】
そして、第三の工程S3においては、図5Bに示すように、電気分解により発生した泡60及び当該泡60の発生に伴い流動するマイクロチャンバー10a内の水溶液のうち少なくとも一方をアクチュエーターとして利用して、当該マイクロチャンバー10aから対象粒子50aを押し出す。
【0080】
すなわち、標的とする1つのマイクロチャンバー10aに捕捉されていた対象粒子50aは、電極40a上で発生して浮上する泡60によって、又は当該泡60の発生に伴い当該マイクロチャンバー10a外に漏出する水溶液の流れによって、共通流路24に押し出される。なお、通常、泡60及び水溶液流れの両方が対象粒子50aに作用する。
【0081】
その後、共通流路24に新たな水溶液を流通させることにより、標的とする1つのマイクロチャンバー10aから解放された1つの対象粒子50aを選択的に回収することができる。一方、図5Cに示すように、電気分解が行われなかった他のマイクロチャンバー10b,10cにおいては、対象粒子50b,50cを捕捉された状態で維持できる。
【0082】
このように、本装置1においては、電極40が、マイクロチャンバー10のうち、対象粒子50が捕捉され保持される位置より奥に配置されているため、当該電極40上での泡の発生によって、当該対象粒子50を当該マイクロチャンバー10から共通流路24に確実に押し出すことができる。
【0083】
図6は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の平面図である。図7は、図6に示すVII−VII線で切断した本装置1の断面図である。
【0084】
この例に係る本装置1は、図6及び図7に示すように、複数のマイクロチャンバー10が設けられた第一部材20と、当該第一部材20に積層された第二部材30と、を備え、当該複数のマイクロチャンバー10の各々には、電気分解用の陽極及び陰極のうち一方の電極40が配置され、当該第二部材30には、当該陽極及び陰極のうち他方の電極41が配置されている。すなわち、マイクロチャンバー10の底部には電極40が配置されている。
【0085】
一方、第二部材30の電極41は、マイクロチャンバー10の電極40に対向する位置には配置されておらず、当該対向する位置からずれた位置に配置されている。すなわち、この例に係る本装置1において、電極41は、第二部材30のうち、複数のマイクロチャンバー10に配置された電極40に対向する位置からずれた位置に配置されている。この場合、本装置1における配線の自由度が比較的高くなる。
【0086】
図8は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の平面図である。図9は、図8に示すIX−IX線で切断した本装置1の断面図である。
【0087】
この例に係る本装置1においては、図8及び図9に示すように、複数のマイクロチャンバー10の各々には、電気分解用の陽極及び陰極の両方の電極40,41が配置されている。すなわち、マイクロチャンバー10の底部の一部には陽極及び陰極のうち一方の電極40が配置され、当該底部の他の一部には、当該陽極及び陰極のうち他方の電極41が配置されている。したがって、図9に示すように、第二部材30には電極は設けられていない。
【0088】
そして、この本装置1においては、標的とする1つのマイクロチャンバー10に配置された一方の電極40と他方の電極41とを選択的に電源に接続して電圧を印加することにより、当該マイクロチャンバー10内で水の電気分解を行い泡を発生させることができる。
【0089】
この場合、電気分解を行うための電極40,41が全て1つのマイクロチャンバー10内に配置されているため、当該マイクロチャンバー10内でのみ電気分解を行うことができる。特に、図9に示すように、両方の電極40,41がマイクロチャンバー10の底部に配置されているため、当該底部近傍でのみ電気分解反応を行うことができる。したがって、発生した泡を制御しやすい。
【0090】
また、電気分解に必要な一対の電極40,41を近接して配置できるため、印加する電圧を効果的に低減することができる。また、第二部材30の構造を簡略化することができ、本装置1の組み立ても容易となる。
【0091】
また、図8及び図9に示す例において、一方の電極40(例えば、陽極)は、マイクロチャンバー10の底部の中央部分を覆うように形成されている。すなわち、一方の電極40の面積を拡大し、且つマイクロチャンバー10の中央部分に配置している。したがって、一方の電極40における泡の発生を利用した対象粒子の押し出しを確実に行うことができる。
【0092】
さらに、他方の電極41(例えば、陰極)は、一方の電極40のうち、マイクロチャンバー10の底部の中央部分を覆う部分を囲むように形成されている。したがって、これら一対の電極40,41に印加する電圧の大きさを低減しつつ、対象粒子の押し出しを確実に行うことができる。なお、電極40を陰極とし、電極41を陽極とすることもできる。
【0093】
図10は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の断面図である。図11は、図10に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。
【0094】
この例に係る本装置1においては、図10及び図11に示すように、複数のマイクロチャンバー10の各々は、共通流路24に開口し対象粒子50が収容される収容室11と、当該収容室11に連通して設けられ電気分解用の電極40,41が配置された電気分解室12と、を有する。
【0095】
すなわち、図10及び図11に示す例において、収容室11と電気分解室12とは連通路13を介して連絡されている。より具体的に、電気分解室12は、収容室11の直下に設けられている。電気分解室12には、電気分解用の陽極及び陰極のうち一方の電極40と他方の電極41との両方が配置されている。
【0096】
また、連通路13は、対象粒子50が通過できないサイズで形成されている。すなわち、収容室11の底部14(図10参照)における連通路13の開口部15は、対象粒子50(図11参照)より小さなサイズで形成されている。すなわち、連通路13の開口部15は、収容室11の底部14の一部において、当該底部14より小さなサイズで形成されている。
【0097】
このため、図11Aに示すように、対象粒子50は、電気分解室12に落下することなく収容室11に保持される。また、このとき、対象粒子50は、収容室11の底部14において、連通路13の開口部15を閉塞するように保持することもできる。
【0098】
なお、図10及び図11には、電極40,41が電気分解室12の底部に配置される例を示しているが、これに限られず、例えば、当該電極40,41の少なくとも一方を当該電気分解室12の他の部分に配置することもできる。
【0099】
この本装置1を用いた本方法の第一の工程S1においては、まず、図11Aに示すように、複数のマイクロチャンバー10の各々の収容室11に対象粒子50を捕捉する。次に、第二の工程S2においては、図11B及び図11Cに示すように、標的とするマイクロチャンバー10の電極40,41に選択的に電圧を印加することにより(図5B参照)、その電気分解室12で水を電気分解して泡60を発生させる。
【0100】
そして、第三の工程S3においては、図11B及び図11Cに示すように、電気分解により発生した泡60及び当該泡60の発生に伴い流動するマイクロチャンバー10内の水溶液のうち少なくとも一方をアクチュエーターとして利用して、当該マイクロチャンバー10から対象粒子50を押し出す。
【0101】
すなわち、例えば、図11Bに示すように、電気分解室12における泡60の発生によって、当該電気分解室12に満たされていた水溶液は連通路13を通って収容室11に押し出され、さらに収容室11に満たされていた水溶液は共通流路24へと押し出される。この電気分解室12から共通流路24に向けた水溶液の流れによって、対象粒子50をマイクロチャンバー10から押し出すことができる。
【0102】
また、例えば、図11Cに示すように、発生した泡60が連通路13を通過して収容室11にまで浮上する場合には、当該浮上する泡60によって対象粒子50を共通流路24に押し出すこともできる。
【0103】
図12は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の断面図である。図13は、図12に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。
【0104】
この例に係る本装置1においては、図12及び図13に示すように、複数のマイクロチャンバー10の各々は、共通流路24に開口し対象粒子50が収容される収容室11と、当該収容室11に連通して設けられ電極40,41が配置された電気分解室12と、を有する。そして、電気分解室12は、収容室11の直下からずれた位置に設けられ、当該電気分解室12と収容室11とは屈曲した連通路13により連絡されている。
【0105】
この本装置1を用いた本方法の第一の工程S1においては、まず、図13Aに示すように、複数のマイクロチャンバー10の各々の収容室11に対象粒子50を捕捉する。次に、第二の工程S2においては、図13Bに示すように、標的とするマイクロチャンバー10の電極40,41に選択的に電圧を印加することにより(図5B参照)、その電気分解室12で水を電気分解して泡60を発生させる。
【0106】
そして、第三の工程S3においては、図13Bに示すように、泡60の発生に伴い流動するマイクロチャンバー10内の水溶液によって、当該マイクロチャンバー10から対象粒子50を押し出す。
【0107】
すなわち、この例に係る本装置1においては、電気分解室12で発生した泡は当該電気分解室12に保持されるため、主に当該泡の発生に伴いマイクロチャンバー10から共通流路24に流出する水溶液の流れをアクチュエーターとして利用する。
【0108】
もちろん、上述の図11Cに示す例と同様に、泡60が連通路13を通過して収容室11まで浮上した場合には、当該泡60をアクチュエーターとして利用して、対象粒子50を押し出すこともできる。
【0109】
図14は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の断面図である。図15は、図14に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。
【0110】
この例に係る本装置1においては、図14及び図15に示すように、複数のマイクロチャンバー10の各々は、共通流路24に開口し対象粒子50が収容される収容室11と、電気分解用の電極40,41が配置された電気分解室12と、当該収容室11と当該電気分解室12との間に設けられ当該電気分解室12における水の電気分解による泡60の発生に伴って当該対象粒子50を当該11収容室から押し出すように変形する伸縮性の膜(以下、「押出膜70」という。)と、を有する。
【0111】
すなわち、図14及び図15に示す例において、この押出膜70は、収容室11と電気分解室12とを仕切るように設けられるとともに、収容室11の底部を構成している。押出膜70は、電気分解室12における泡60の発生によって柔軟に変形できる伸縮性を備えている。なお、押出膜70は、電気分解室12を密閉するよう形成することもできる。
【0112】
押出膜70を構成する材料は、上述の伸縮性を実現できるものであれば特に限られず、例えば、ポリジメチルシロキサン(PDMS)、ポリスチレン、ポリカーボネート、厚型フォトレジスト等のポリマーを用いることができる。また、押出膜70の厚さは、例えば、10〜200μmの範囲とすることができる。
【0113】
このような押出膜70を有するマイクロチャンバー10は、例えば、PDMSをシリコンウェハ上の鋳型にスピンコートすることにより作製することができる。この場合、スピンコート時の回転数によって押出膜70の厚さを任意に制御することができる。
【0114】
この本装置1を用いた本方法の第一の工程S1においては、まず、図15Aに示すように、複数のマイクロチャンバー10の各々の収容室11に対象粒子50を捕捉する。すなわち、収容室11において対象粒子50を押出膜70上に沈降させる。
【0115】
次に、第二の工程S2においては、図15Bに示すように、標的とするマイクロチャンバー10の一対の電極40,41に選択的に電圧を印加することにより、電気分解室12で水を電気分解して泡60を発生させる。
【0116】
そして、第三の工程S3においては、図15Bに示すように、泡60の発生に伴い上方に張り出すように変形した押出膜70によって、マイクロチャンバー10から対象粒子50を押し出す。
【0117】
すなわち、押出膜70は電気分解室12の上方を覆っているため、当該電気分解室12で発生した泡60は浮上して当該押出膜70を下方から押し上げる。押出膜70は伸縮性を有しているため、その一部は上方に変位するよう変形する。
【0118】
その結果、対象粒子50は、押出膜70によって上方に突き上げられて、共通流路24に押し出される。このように、押出膜70をアクチュエーターとして利用することにより、対象粒子50をマイクロチャンバー10から確実に押し出すことができる。
【0119】
図16は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の平面図である。図17は、図16に示すXVII−XVII線で切断した本装置1の断面図である。
【0120】
この例に係る本装置1は、上述の図14及び図15に示した例と同様、押出膜70を有している。ただし、この例に係る押出膜70は、図16に示すように、その中央部分を構成する中央部71と、当該中央部71の一部とマイクロチャンバー10の内壁(被覆層22)とを接続して当該中央部71を部分的に支持する複数(図16では4つ)の接続部72と、を有している。すなわち、この例において、収容室11と電気分解室12とは連通しつつ押出膜70で仕切られている。
【0121】
また、図17に示す例では、押出膜70の中央部71は、その下面73が共通流路24側に窪んだ凹形状となるように形成されている。このため、電気分解室12で発生した泡60を、押出膜70の当該中央部71の窪みに効率よく集めることができ、押出膜70を効率よく変形させることができる。なお、図16に示す押出膜70は、このような窪みを有することなく、図14に示すような平坦な形状で形成することもできる。
【0122】
図18は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の断面図を示す。図19は、図18に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。
【0123】
この例に係る本装置1が備える押出膜70は、図18及び図19に示すように、中空の蛇腹状に形成されて共通流路24側に伸縮可能な伸縮部74と、当該伸縮部74とマイクロチャンバー10の内壁(被覆層22)とを接続して当該伸縮部74を支持する基部75と、を有している。
【0124】
この押出膜70は、上述の図14〜図17に示した例に係る押出膜70と同様の材料を用いて作製することができる。また、伸縮部74及び基部75は、当該伸縮部74及び基部75に対応する形状の鋳型を用いて形成することができる。すなわち、例えば、材料としてPDMS等のポリマーを用いる場合には、伸縮部74に対応する蛇腹状の部分を有する外枠と、当該外枠より一回り小さい同形状の内枠と、を重ね合わせ、当該外枠と内枠との間に当該ポリマーを流し込み硬化させることによって、当該蛇腹状の伸縮部74を有する押出膜70を作製することができる。
【0125】
この本装置1を用いた本方法の第一の工程S1においては、まず、図19Aに示すように、複数のマイクロチャンバー10の各々の収容室11に対象粒子50を捕捉する。すなわち、収容室11において対象粒子50を押出膜70の伸縮部74上に沈降させる。
【0126】
次に、第二の工程S2においては、図19Bに示すように、標的とするマイクロチャンバー10の一対の電極40,41に選択的に電圧を印加することにより、電気分解室12で水を電気分解して泡60を発生させる。
【0127】
そして、第三の工程S3においては、図19Bに示すように、泡60の発生に伴い伸縮部74が上方に変位する押出膜70によって、マイクロチャンバー10から対象粒子50を押し出す。
【0128】
すなわち、押出膜70は電気分解室12の上方を覆っているため、当該電気分解室12で発生した泡60は浮上して当該押出膜70の伸縮部74を下方から押し上げる。このとき、押出膜70の伸縮部74は、その蛇腹形状を活かして効率よく上方に伸びる。その結果、対象粒子50は、押出膜70の伸縮部74によって上方に突き上げられて、共通流路24に押し出される。
【0129】
図20は、本装置1の他の例における複数のマイクロチャンバー10のうち3つのマイクロチャンバー10a,10b,10cの周辺部分の平面図である。図21は、図20に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。
【0130】
この例に係る本装置1は、図20及び図21に示すように、ジグザグに蛇行する共通流路24を備えている。また、共通流路24のうち互いに平行に配置される一部から他の一部へと横切るように複数のマイクロチャンバー10が形成されている。
【0131】
すなわち、各マイクロチャンバー10は、図20に示すように、共通流路24の中途部分に開口するよう設けられ、その奥には電気分解用の電極40が配置され、当該電極40のさらに奥には断面積を縮小させた狭窄路16が形成され、当該狭窄路16は当該共通流路24の他の中途部分に連通している。
【0132】
この本装置1を用いた本方法の第一の工程S1においては、まず、図21Aに示すように、複数のマイクロチャンバー10a,10b,10cの各々に対象粒子50a,50b,50cを捕捉する。
【0133】
この対象粒子50の捕捉は、例えば、上述の非特許文献1に記載されているように、対象粒子50が捕捉されていない状態における共通流路24に沿った蛇行流れ(図20において実線の矢印で示す流れ)の圧力損失が、マイクロチャンバー10及び狭窄路16を介したバイパス流れ(図20において破線の矢印で示す流れ)の圧力損失に比べて大きくなるように、流路の長さや断面積を調整することで実現することができる。
【0134】
次に、第二の工程S2においては、図21Bに示すように、複数のマイクロチャンバー10a,10b,10cのうち、標的とするマイクロチャンバー10aの電極40aに選択的に電圧を印加することにより、当該マイクロチャンバー10aで水を電気分解して泡60を発生させる。
【0135】
そして、第三の工程S3においては、図21Bに示すように、電気分解により発生した泡60及び当該泡60の発生に伴い流動するマイクロチャンバー10a内の水溶液のうち少なくとも一方をアクチュエーターとして利用して、当該マイクロチャンバー10aから対象粒子50aを選択的に押し出す。その後、共通流路24に新たな水溶液を流通させることにより、当該共通流路24に押し出された対象粒子50aを選択的に回収することができる。
【0136】
また、この例に係る本装置1においては、複数のマイクロチャンバー10a,10b,10cのうち一部のマイクロチャンバー10aから解放された対象粒子50aを他のマイクロチャンバー10bに捕捉することもできる。
【0137】
すなわち、例えば、複数のマイクロチャンバー10a,10b,10cのうち1つのマイクロチャンバー10bの電極40bに電圧を印加して当該マイクロチャンバー10bから対象粒子50bを解放した後、より上流側の他のマイクロチャンバー10aの電極40aに電圧を印加して当該マイクロチャンバー10aから対象粒子50aを解放して共通流路24を下流側に流通させることにより、上述の圧力損失のバランスに基づいて、当該対象粒子50aを予め空けられた下流側の当該マイクロチャンバー10bに捕捉することができる。
【0138】
このようにして、複数の対象粒子50の選択的な捕捉と解放とを繰り返すことによって、当該複数の対象粒子50の並べ替えや入れ替えを任意に行うことができる。なお、図20及び図21には、各マイクロチャンバー10に電気分解用の陽極及び陰極のうち一方の電極40が配置される例を示したが、これに限られず、各マイクロチャンバー10に当該陽極及び陰極の両方の電極を設けることもできる。
【0139】
次に、本実施形態に係る具体的な実施例について説明する。
【実施例1】
【0140】
[マイクロ流体装置の作製]図4に示した例と同様の工程で、図3に示すような本装置1を製造した。すなわち、まず、ガラス基板上にITO層を形成した。次いで、標準的なリソグラフィーによって、マイクロチャンバーの底部に配置する電極に対応する位置にポジ型フォトレジストS1818からなるレジスト層をパターンした(図4A参照)。そして、エッチング液(HCl:H2O:HNO3=1:1:0.16)を用いてITO層をエッチングし(50℃で3.25分)、ガラス基板上に電極を形成した(図4B参照)。
【0141】
その後、この電極をネガ型の厚膜フォトレジストSU8でコートし、当該SU8からなるレジスト層を形成した(図4C参照)。そして、このレジスト層をパターンして、各々が底部に電極を有する48個(6×8)のマイクロチャンバーを形成した(図4D参照)。
【0142】
マイクロチャンバーの直径は150μmとし、深さは150μmとした。なお、このマイクロチャンバーのサイズは、哺乳動物の受精卵を1つ捕捉するために適切なサイズとして採用した。
【0143】
さらに、マイクロチャンバーが形成された被覆層(SU8シート)の周囲に、シリコーンゴムのスペーサを置いた。そして、この第一部材を、ガラス基板上にITO層からなる電極が形成されてなる第二部材で覆うことにより、本装置1を作製した。
【0144】
[顕微鏡観察]作製した本装置1を明視野顕微鏡で観察した。本装置1に設けられた電極を構成するITOは透明であるため倒立顕微鏡(Olympus IX71)で観察することができた。なお、マイクロチャンバーの電極は、導電性のラインテープを介して直流電源装置(Agilent E3641A)のプラスに接続し、第二部材の電極は当該直流電源装置のマイナスに接続した。すなわち、マイクロチャンバーの電極を陽極として使用し、対向する第二部材の電極を陰極として使用した。
【0145】
図22には、本装置1の顕微鏡写真の一部を拡大して示す。図22Aに示すように、SU8からなる被覆層に複数のマイクロチャンバー(chamber)が規則的に配置されているのが確認された。また、各マイクロチャンバーの底部にはITO膜のパターンにより形成された電極が配置されていた。なお、電極及び配線を構成するITOは透明であり顕微鏡下で視認することが難しかったため、図22Bには、当該電極及び配線のパターン(ITO)を示した。
【0146】
[マイクロビーズの選択的押し出し]対象粒子として、直径100μmのポリスチレン製マイクロビーズを用いた。また、電解質水溶液としてリン酸緩衝液(Phosphate Buffered Saline:PBS)を用いた。
【0147】
まず、本装置1の内部をPBSで満たした。次いで、マイクロピペットを用いて、PBSに分散したマイクロビーズをマイクロチャンバーに注入した。この結果、48個のマイクロチャンバーのうち、44個のマイクロチャンバーの各々にマイクロビーズを1つずつ入れることができた。マイクロチャンバーに入らなかったマイクロビーズはPBSで洗い流した。図23には、本装置1において各マイクロチャンバー(chamber)にマイクロビーズ(bead)が1つずつ捕捉された様子を撮影した顕微鏡写真の一例を示す。
【0148】
次に、本方法を実施して、複数のマイクロチャンバーのうち1つから選択的にマイクロビーズを解放した。図24には、本方法を実施する過程における本装置1の一部をタイムラプスビデオで経時的に撮影した画像を示す。図24Aは電圧を印加する直前(0秒)の画像を示し、図24Bは電圧を印加してから1.1秒後の画像を示し、図24Cは電圧を印加してから4.3秒後の画像を示す。
【0149】
ここでは、図24Aに示す矢印の指す中央のマイクロチャンバー内のマイクロビーズを標的として選択した。この選択したマイクロチャンバーの底部に配置されている電極を直流電源装置と選択的に接続した。
【0150】
そして、選択されたマイクロチャンバーの電極と、これに対向する第二部材の電極と、の間に5.2Vの電圧を印加し、当該底部のITO電極と上部のITO電極との間に電流を流して、PBSの電気分解を行った。この結果、図24Bに示すように、電圧印加直後に、標的のマイクロチャンバーでのみ、底部に配置された電極から泡(bubble)が発生した。
【0151】
その後、図24Cに示すように、標的のマイクロチャンバーに捕捉されていたマイクロビーズ(bead)は、泡によって当該マイクロチャンバーから押し出され、完全に解放された。一方、図24Cに示すように、電圧を印加していない他のマイクロチャンバーに捕捉されているマイクロビーズは解放されず保持されたままであった。
【0152】
こうして標的とするマイクロビーズを選択的にマイクロチャンバーから解放することができた。なお、直径が10μm又は50μmのポリスチレン製マイクロビーズを用いても、同様にして選択的な解放を実現することができた。
【実施例2】
【0153】
[電気分解が哺乳動物細胞の生存率に及ぼす影響の評価]本装置1として、上述の実施例1で作製したものと同様のマイクロ流体装置を用いた。細胞として、牛動脈内皮細胞を用いた。
【0154】
まず、この細胞を分散した培養培地を本装置1内に注入して当該細胞をマイクロチャンバー内に捕捉し、所定の時間培養した。次いで、マイクロチャンバーに0〜8Vの電圧を10秒間印加した。そして、電圧を印加した直後に、細胞の生存率を評価するための市販の試薬(Live/Dead Assay(登録商標) Viability/Cytotoxicity reagent)をマイクロチャンバー内に注入した。
【0155】
その後、処理された細胞を蛍光顕微鏡下で観察した。上記の試薬により、死細胞は赤色、生細胞は緑色に染色された。顕微鏡下で死細胞の数を計測した。そして、総細胞数(生細胞数+死細胞数)に対する死細胞数の割合(%)を算出した。
【0156】
図25には、この評価結果を示す。図25において、横軸はマイクロチャンバーに印加した電圧(V)を示し、縦軸は死細胞数の割合(%)を示す。また、図25に示す破線より左側の電圧(0V、2V)を印加した場合には泡は発生せず(no bubbles)、当該破線より右側の電圧(4V、6V、8V)を印加した場合に泡が発生した(bubbles formed)。
【0157】
図25に示すように、6Vより大きな電圧は細胞に対してより強いダメージを与えることがわかった。一方、6Vより低い電圧(2V、4V)ではほとんどの細胞が生存していた。したがって、6Vより小さい電圧を印加するという電気分解の条件は、細胞の選択的解放のために十分に穏やかであると確認された。なお、8Vを印加した場合であっても、死細胞の割合は10%未満であり、多くの細胞は生存状態を維持していた。
【0158】
[電気分解前後の温度の測定]また、ITO電極間に5.2Vの電圧を印加している間の本装置1の温度をサーモグラフ装置(Neo Thermo TVS−600、NEC Avio赤外線テクノロジー株式会社)を用いて測定した。
【0159】
その結果、電圧を印加した前後で本装置1内の温度に変化は見られなかった。また、電圧を印加した後においても、本装置1の温度は上昇しなかった。したがって、本方法は、細胞に対して発熱によるダメージを与えることなく実施可能であることが確認できた。
【符号の説明】
【0160】
1 マイクロ流体装置、10 マイクロチャンバー、11 収容室、12 電気分解室、13 連通路、14 底部、15 開口部、16 狭窄路、20 第一部材、21 第一基板、22 被覆層、23 スペーサ、24 共通流路、25 流入口、26 流出口、27 ITO膜、28 ポジ型フォトレジスト層、29 ネガ型フォトレジスト層、30 第二部材、31 第二基板、40,41 電極、42 配線、50 対象粒子、60 泡、70 押出膜、71 中央部、72 接続部、73 下面、74 伸縮部、75 基部。
【技術分野】
【0001】
本発明は、粒子を操作する方法及びマイクロ流体装置に関し、特に、電気分解による泡の発生を利用して粒子を操作する方法及び装置に関する。
【背景技術】
【0002】
大量の細胞を高速にアレイ化し高感度で解析するマイクロ流体システムは、医療診断や新薬開発等の産業応用に加え、基礎科学の分野でも重要な解析ツールとしての役割を発揮してきた。
【0003】
そして、さらに発展したマイクロ流体システムとして、例えば、アレイ化された大量の細胞を解析した後、特異的な反応を示した細胞の遺伝子やタンパク質を詳細に解析するために、当該大量の細胞のうちから特定の細胞を選択的に取り出す機能を備えたシステムの開発が望まれている。
【0004】
そこで、従来、例えば、非特許文献1において、アルミニウムパッチが配置された複数のマイクロチャンバーの各々にマイクロビーズを1つずつ捕捉し、特定のマイクロチャンバーのアルミニウムパッチにレーザーを照射して溶液を局所的に沸騰させることにより泡を発生させ、当該特定のマイクロチャンバーから選択的にマイクロビーズを解放する技術が提案されている。
【0005】
また、例えば、非特許文献2において、電気泳動力によってマイクロビーズや細胞をマイクロウェルから取り出す技術が提案されている。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Wei-Heong Tan and Shoji Takeuchi (2007) Proc Natl Acad Sci USA, 104,1146-1151.
【非特許文献2】Ching-Yu Chang et al. (2009) Lab Chip, 9, 1185-1192.
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、上記非特許文献1に記載の技術においては、例えば、(1)溶液を部分的に沸騰させるため細胞を傷つけてしまう可能性がある、(2)レーザーを発生させる装置が高価である、(3)標的とするマイクロチャンバーに正確にレーザーを照射するために高い技術力を要する、といった問題があった。
【0008】
また、上記非特許文献2に記載の技術においては、電気泳動力が小さいため、例えば、受精卵等の比較的大きな細胞を確実に操ることができないといった問題があった。
【0009】
本発明は、上記課題に鑑みて為されたものであり、穏やかな条件で確実に粒子を操作する方法及びマイクロ流体装置を提供することをその目的の一つとする。
【課題を解決するための手段】
【0010】
上記課題を解決するための本発明の一実施形態に係る方法は、各々が電気分解用の陽極及び陰極のうち少なくとも一方の電極を有する複数のマイクロチャンバーに操作の対象とする粒子を捕捉し、前記複数のマイクロチャンバーのうち一部のマイクロチャンバーの前記電極に電圧を印加することにより水を電気分解して泡を発生させ、前記泡の発生に伴い作動するアクチュエーターによって、前記一部のマイクロチャンバーから選択的に前記粒子を押し出すことを特徴とする。本発明によれば、穏やかな条件で確実に粒子を操作する方法を提供することができる。
【0011】
また、前記アクチュエーターは、浮遊する前記泡又は前記泡の発生に伴い流動する前記マイクロチャンバー内の液体であることとしてもよい。また、前記アクチュエーターは、前記マイクロチャンバーにおいて前記電極と前記粒子との間に設けられ前記泡の発生に伴い前記粒子を押し出すように変形する伸縮性の膜であることとしてもよい。
【0012】
また、前記粒子は細胞であり、前記複数のマイクロチャンバーの各々に前記細胞を1つずつ捕捉して培養し、前記複数のマイクロチャンバーで培養された複数の前記細胞のうち一部を回収すべき細胞として決定し、前記複数のマイクロチャンバーのうち前記回収すべき細胞が捕捉されている一部のマイクロチャンバーの前記電極に電圧を印加することにより水を電気分解して泡を発生させ、前記泡の発生に伴い作動する前記アクチュエーターによって、前記一部のマイクロチャンバーから選択的に前記細胞を押し出すこととしてもよい。この場合、前記細胞は受精卵であり、前記一部のマイクロチャンバーから選択的に押し出された前記受精卵を生きた状態で回収することとしてもよい。
【0013】
上記課題を解決するための本発明の一実施形態に係るマイクロ流体装置は、粒子を捕捉するための複数のマイクロチャンバーと、前記複数のマイクロチャンバーが開口する共通流路と、を備えたマイクロ流体装置であって、前記複数のマイクロチャンバーの各々には、電気分解用の陽極及び陰極のうち少なくとも一方の電極が配置されていることを特徴とする。本発明によれば、穏やかな条件で確実に粒子を操作することのできるマイクロ流体装置を提供することができる。
【0014】
また、前記複数のマイクロチャンバーが設けられた第一部材と、前記第一部材に積層された第二部材と、を備え、前記複数のマイクロチャンバーの各々には、前記陽極及び陰極のうち一方の電極が配置され、前記第二部材には、前記陽極及び陰極のうち他方の電極が配置されていることとしてもよい。また、前記複数のマイクロチャンバーの各々には、前記陽極及び陰極の両方の電極が配置されていることとしてもよい。
【0015】
また、前記複数のマイクロチャンバーの各々は、前記共通流路に開口し前記粒子が収容される収容室と、前記収容室に連通して設けられ前記電極が配置された電気分解室と、を有することとしてもよい。また、前記複数のマイクロチャンバーの各々は、前記共通流路に開口し前記粒子が収容される収容室と、前記電極が配置された電気分解室と、前記収容室と前記電気分解室との間に設けられ前記電気分解室における水の電気分解による泡の発生に伴って前記粒子を前記収容室から押し出すように変形する伸縮性の膜と、を有することとしてもよい。
【発明の効果】
【0016】
本発明によれば、穏やかな条件で確実に粒子を操作する方法及びマイクロ流体装置を提供することができる。
【図面の簡単な説明】
【0017】
【図1】本発明の一実施形態に係る方法に含まれる主な工程を示す説明図である。
【図2】本発明の一実施形態に係るマイクロ流体装置の一例についての平面図である。
【図3】図2に示すIII−III線で切断したマイクロ流体装置の断面図である。
【図4】本発明の一実施形態に係るマイクロチャンバーを形成する工程の一例を示す説明図である。
【図5】図2及び図3に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図6】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の平面図である。
【図7】図6に示すVII−VII線で切断したマイクロ流体装置の断面図である。
【図8】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の平面図である。
【図9】図8に示すIX−IX線で切断したマイクロ流体装置の断面図である。
【図10】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の断面図である。
【図11】図10に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図12】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の断面図である。
【図13】図12に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図14】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の断面図である。
【図15】図14に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図16】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の平面図である。
【図17】図16に示すXVII−XVII線で切断したマイクロ流体装置の断面図である。
【図18】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の断面図である。
【図19】図18に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図20】本発明の一実施形態に係るマイクロ流体装置の他の例の一部の平面図である。
【図21】図20に示すマイクロ流体装置を用いた方法における各工程を示す説明図である。
【図22】本発明の一実施形態に係るマイクロ流体装置の顕微鏡写真の一例を示す説明図である。
【図23】本発明の一実施形態に係るマイクロ流体装置の顕微鏡写真の他の例を示す説明図である。
【図24】本発明の一実施形態に係るマイクロ流体装置におけるマイクロビーズの選択的解放を撮影したタイムラプスビデオ画像の一例を示す説明図である。
【図25】本発明の一実施形態に係るマイクロ流体装置において電気分解による泡の発生が細胞の生存率に与える影響を評価した結果の一例を示す説明図である。
【発明を実施するための形態】
【0018】
以下に、本発明の一実施形態について説明する。なお、本発明は、本実施形態に限られるものではない。
【0019】
まず、本実施形態に係る方法(以下、「本方法」という。)について説明する。図1は、本方法に含まれる主な工程を示す説明図である。
【0020】
図1に示すように、本方法においては、各々が電気分解用の陽極及び陰極のうち少なくとも一方の電極を有する複数のマイクロチャンバーに操作の対象とする粒子を捕捉し(工程S1)、当該複数のマイクロチャンバーのうち一部のマイクロチャンバーの当該電極に電圧を印加することにより水を電気分解して泡を発生させ(工程S2)、当該泡の発生に伴い作動するアクチュエーターによって、当該一部のマイクロチャンバーから選択的に当該粒子を押し出す(工程S3)。
【0021】
すなわち、第一の工程S1では、まず、電気分解用の電極を有する複数のマイクロチャンバーを準備する。このマイクロチャンバーについては、後に詳しく説明するが、複数のマイクロチャンバーの各々は、互いに独立に電圧を印加することのできる電気分解用の電極を有している。
【0022】
次いで、各マイクロチャンバーに操作の対象とする粒子(以下、「対象粒子」という。)を入れる。ここで、対象粒子は、液体の流れに乗せて運搬できる粒子であれば特に限られず、例えば、細胞やマイクロビーズを用いることができる。
【0023】
細胞の種類は特に限られず、例えば、ヒト又はヒト以外の動物の細胞を好ましく用いることができる。より具体的には、例えば、ヒト又はヒト以外の動物に由来する様々な分化細胞や未分化細胞(幹細胞、ES細胞、iPS細胞等)、また、受精卵を用いることもできる。細胞としては、単一の細胞を用いることができ、また、複数の細胞が集合して形成された細胞組織体を用いることもできる。
【0024】
マイクロビーズとしては、例えば、樹脂ビーズやゲルビーズを用いることができる。また、細胞や細胞組織体をゲルで被覆して形成されたマイクロカプセルを用いることもできる。なお、対象粒子としては、これら細胞やマイクロビーズ等の球状体を好ましく用いることができるが、その形状は球状に限られない。
【0025】
対象粒子のサイズは、液体中で浮遊させてマイクロチャンバーから押し出すことのできる範囲であれば特に限られないが、対象粒子が球状体である場合には、その直径は、例えば、1μm以上とすることができ、好ましくは数十〜数百μmの範囲とすることができる。
【0026】
続く第二の工程S2では、対象粒子が捕捉された複数のマイクロチャンバーのうち、一部のマイクロチャンバーの電極に選択的に電圧を印加し、当該一部のマイクロチャンバーで水の電気分解を行って泡を発生させる。
【0027】
すなわち、選択された一部のマイクロチャンバーが有する電極のみを電源に接続して通電することによって、当該一部のマイクロチャンバーで当該電極から泡を発生させる。なお、水の電気分解によって、陰極では水素ガスが発生し、陽極では酸素ガスが発生する。
【0028】
印加する電圧の大きさは、水を電気分解して泡を発生させることのできる範囲であれば特に限られないが、対象粒子として細胞を用いる場合には、当該細胞の生存を適切に維持できる比較的小さな範囲とすることが好ましい。
【0029】
具体的には、例えば、3〜10Vの範囲とすることができ、4〜6Vの範囲とすることが好ましい。ただし、印加すべき電圧の大きさは、これに限られず、本方法で用いるマイクロ流体装置の構造や電気分解の対象となる水溶液の組成等の条件に応じて適宜設定することができる。
【0030】
第三の工程S3では、泡の発生に伴い作動するアクチュエーターによって、一部のマイクロチャンバーから選択的に対象粒子を解放する。このアクチュエーターについては、後に詳しく説明するが、当該アクチュエータは、例えば、電気分解により発生した浮遊する泡又は当該泡の発生に伴い流動するマイクロチャンバー内の液体とすることができる。
【0031】
すなわち、本方法においては、例えば、マイクロチャンバーで発生し浮遊する泡をアクチュエータとして利用することで、当該泡によって当該マイクロチャンバーから対象粒子を押し出すことができる。また、本方法においては、例えば、マイクロチャンバーで泡の発生に伴い流動する液体をアクチュエーターとして利用することで、当該液体の流れに乗せて当該マイクロチャンバーから対象粒子を押し出すことができる。
【0032】
また、本方法におけるアクチュエーターは、例えば、マイクロチャンバーにおいて電極と対象粒子との間に設けられ泡の発生に伴い当該対象粒子を押し出すように変形する伸縮性の膜とすることもできる。この膜についても後に詳しく説明するが、本方法においては、泡の発生に伴う圧力によってマイクロチャンバーから対象粒子を押し出すように変形する膜をアクチュエーターとして利用することもできる。
【0033】
このような本方法によれば、複数のマイクロチャンバーのうち特定のマイクロチャンバーからの選択的な対象粒子の解放を、穏やかな条件で確実に実現することができる。
【0034】
すなわち本方法は、電気分解による泡の発生を利用するため、例えば、(1)発生する熱が極めて小さく対象粒子(特に細胞)に対するダメージが小さい、(2)レーザー照射装置等の特殊な装置を必要としないため汎用性が高い、(3)汎用的なエレクトロニクス技術を用いて電極の配置及び配線をすることで狙ったマイクロチャンバーにのみ簡便に且つ確実に泡を発生させることができる、といった利点を有する。
【0035】
また、本方法は、泡の発生に伴う圧力を利用するため、電気泳動力では操ることのできないような対象粒子であっても確実に操作することができるといった利点も有する。
【0036】
したがって、本方法においては、例えば、哺乳動物の受精卵のように、比較的大きく、且つ環境の条件に敏感でダメージを受けやすい細胞を無傷のまま効率よく且つ確実に操作することができる。
【0037】
具体的に、例えば、畜産分野においては、和牛の受精卵をホルスタインの胎内に入れて、当該ホルスタインに和牛を産ませるといった畜産技術の開発が進められている。この場合、受精卵は胚盤胞を形成するまで生体外で培養し、その後、胚盤胞となった受精卵を母胎の子宮に移植することになる。
【0038】
また、通常、複数の受精卵を準備して培養し、胚盤胞を形成した複数の受精卵のうち、移植に適した良好な状態のものを選択的に回収し、実際の移植に用いる。受精卵が移植に適した良好な状態であるか否かは、顕微鏡下の観察において、その大きさや形状によって目視で判別することができる。一方、受精卵は環境条件に敏感でありダメージを受けやすいため、その選択的な回収は穏やかな条件下で行う必要がある。
【0039】
そこで、上述のような利点を有する本方法によれば、複数のマイクロチャンバーの各々で受精卵を胚盤胞となるまで培養し、その後、胚盤胞を形成した複数の受精卵のうち移植に適していると判断された特定の受精卵を選択的に良好な状態のまま回収することが可能となる。
【0040】
すなわち、この場合、本方法においては、複数のマイクロチャンバーの各々に受精卵を1つずつ捕捉して培養し(工程S1)、当該複数のマイクロチャンバーで培養された複数の当該受精卵のうち一部を回収すべき受精卵として決定し、当該複数のマイクロチャンバーのうち当該回収すべき受精卵が捕捉されている一部のマイクロチャンバーの電極に電圧を印加することにより水を電気分解して泡を発生させ(工程S2)、当該泡の発生に伴い作動するアクチュエーターによって、当該一部のマイクロチャンバーから選択的に当該受精卵を押し出し、押し出された当該受精卵を生きた状態で回収する(工程S3)。
【0041】
具体的に、第一の工程S1においては、複数の受精卵と、複数のマイクロチャンバーと、を準備し、当該複数のマイクロチャンバーの各々に当該受精卵を1つずつ入れて培養する。この培養によって、各受精卵から胚盤胞を形成させる。
【0042】
第二の工程S2においては、まず、各マイクロチャンバーで胚盤胞を形成した受精卵の形態を観察し、当該観察の結果に基づいて、複数の受精卵のうち回収すべき受精卵を決定する。
【0043】
次いで、この回収すべき受精卵が培養されている特定のマイクロチャンバーの電極に選択的に電圧を印加することにより、当該特定のマイクロチャンバーで電気分解を行い、泡を発生させる。
【0044】
そして、第三の工程S3においては、電気分解により発生し浮遊する泡又は当該泡の発生に伴う特定のマイクロチャンバー内の培養液の流れによって、当該特定のマイクロチャンバーから標的の受精卵を選択的に解放する。その後、解放された受精卵を回収して移植に用いる。
【0045】
このように、本方法によれば、マイクロチャンバーを用いて大量の和牛の受精卵をアレイ化して培養した後、当該大量の受精卵のうち活性の高い受精卵のみを無傷で選択的に回収することができる。
【0046】
すなわち、大量の受精卵から好ましい受精卵のみを選択的に且つ高速で回収するというマイクロ流体システムを実現することができる。このようなマイクロ流体システムにおいては、受精卵の培養や選択的な回収を自動化することも可能である。なお、このような本方法においては、受精卵に代えて、上述したような任意の1種類又は2種類以上の細胞を用いることもできる。すなわち、細胞としては、単一の細胞を用いることができ、また、複数の細胞が集合して形成された細胞組織体(細胞塊)を用いることもできる。また、単一の細胞又は細胞組織体を内包するマイクロカプセルを用いることもできる。また、受精卵も含め、対象粒子として細胞を用いる場合には、マイクロチャンバーから押し出された細胞を回収することができるが、当該細胞は必ずしも生きた状態で回収される必要はない。生きた状態で回収されないとしても、細胞の遺伝子やタンパク質の発現等の特性を解析することは可能である。
【0047】
次に、本実施形態に係るマイクロ流体装置(以下、「本装置」という。)について説明する。なお、上述した本方法は、以下に説明する本装置を用いることにより好ましく実施することができるが、これに限られず、他の装置を用いても実施することができる。
【0048】
本装置は、対象粒子を捕捉するための複数のマイクロチャンバーと、当該複数のマイクロチャンバーが開口する共通流路と、を備え、当該複数のマイクロチャンバーの各々には、電気分解用の陽極及び陰極のうち少なくとも一方の電極が配置されている。すなわち、本装置においては、複数のマイクロチャンバーの各々が、互いに独立に電圧を印加できる電気分解用の電極を有している。
【0049】
図2は、本装置1の一例についての平面図である。図3は、図2に示すIII−III線で切断した本装置1の断面図である。
【0050】
この例に係る本装置1は、図2及び図3に示すように、複数(図2では9つ)のマイクロチャンバー10が設けられた第一部材20と、当該第一部材20に積層された第二部材30と、を備え、当該複数のマイクロチャンバー10の各々には、電気分解用の陽極及び陰極のうち一方の電極40が配置され、当該第二部材30には、当該陽極及び陰極のうち他方の電極41が配置されている。
【0051】
なお、図2においては、説明の便宜のため、第二部材30を取り外した状態の本装置1の平面図を示している。また、以下の説明において、本装置1が複数の同様の部分を有する場合には、当該複数の部分の符号に小文字のアルファベットを付して区別することがある(例えば、マイクロチャンバー10a,10b,10c)が、これらを特に区別する必要のない場合には、当該小文字のアルファベットは省略することとする。
【0052】
図3に示すように、第一部材20は、第一基板21と、当該第一基板21に積層された被覆層22と、当該第一部材20と第二部材30との間に共通流路24を形成するためのスペーサ23と、を有している。
【0053】
第一基板21、被覆層22及びスペーサ23はいずれも非導電性の材料で形成される。この非導電性材料は特に限られず、例えば、ガラスや非導電性樹脂を好ましく用いることができる。すなわち、例えば、第一基板21をガラス基板とし、被覆層22を非導電性樹脂からなるフォトレジスト層とし、スペーサ23をシリコーンゴム成形体とすることができる。
【0054】
マイクロチャンバー10は、被覆層22の表面に開口する有底の穴として形成されている。なお、図3には、第一部材20が第一基板21と被覆層22とを有する積層体である例を示しているが、例えば、当該第一部材20は単一の非導電性基板とすることもでき、この場合には、マイクロチャンバー10は、当該非導電性基板の表面に開口するよう形成される。
【0055】
すなわち、マイクロチャンバー10は、非導電性の第一部材20の表面に開口するものであれば、図3及び他の図面に示す例に限られない。また、対象粒子として細胞を用いる場合には、マイクロチャンバー10の内面は、当該細胞が接着しない、いわゆる細胞非接着性の表面とすることが好ましい。
【0056】
なお、図2及び図3には、マイクロチャンバー10の底部及び開口部が円形である例を示しているが、当該底部及び開口部の形状はこれに限られず、例えば、楕円形や多角形とすることもできる。
【0057】
マイクロチャンバー10のサイズは、捕捉すべき対象粒子のサイズに応じて任意に設定することができ、例えば、当該対象粒子を1つずつ捕捉する上で適切なサイズとすることができる。
【0058】
具体的に、マイクロチャンバー10の底面積及び開口面積は、例えば、25〜90000μm2の範囲とすることができ、好ましくは100〜400μm2の範囲とすることができる。すなわち、マイクロチャンバー10が円形の有底穴である場合には、その底部及び開口部の直径は、例えば、5〜300μmの範囲とすることができ、好ましくは80〜250μmの範囲とすることができる。また、マイクロチャンバー10の深さは、例えば、5〜300μmの範囲とすることができ、好ましくは80〜250μmの範囲とすることができる。
【0059】
マイクロチャンバー10のサイズが対象粒子のサイズに比べて大きすぎる場合には、1つの当該マイクロチャンバー10に2つ以上の対象粒子が入ることとなる。また、この場合、マイクロチャンバー10で発生した泡が、当該マイクロチャンバー10の内面と、捕捉されている対象粒子と、の間をすり抜けて当該マイクロチャンバー10外に漏出しやすくなるため、当該泡をアクチュエーターとして有効に利用できない場合がある。したがって、例えば、対象粒子としてヒト又はヒト以外の哺乳動物の受精卵を用いる場合には、各マイクロチャンバー10に当該受精卵を1つずつ捕捉するため、当該マイクロチャンバー10の直径は、例えば、80〜250μmの範囲とすることが好ましく、深さは、例えば、80〜250μmの範囲とすることが好ましい。
【0060】
マイクロチャンバー10の底部には、電気分解用の電極40が1つずつ配置されている。なお、図2及び図3に示す例では、マイクロチャンバー10の底部の全体が電極40となっているが、これに限られず、当該底部の一部に電極40を配置することもできる。
【0061】
また、本装置1に形成された複数の電極40は、互いに独立に電気分解用の電圧を印加できるように形成されている。すなわち、複数の電極40は、互いに独立に電源に接続することができる。具体的に、図2に示す例において、3つの電極40a,40b,40cは、3つのマイクロチャンバー10a,10b,10cにそれぞれ配置されるとともに、互いに電気的に独立して形成された3つの配線42a,42b,42cにそれぞれ接続されている。
【0062】
したがって、例えば、3つの配線42a,42b,42cのうち1つの配線42aのみを電源に接続することにより、当該配線42aと接続された1つの電極40aにのみ選択的に電圧を印加することができる。そして、この場合、電圧が印加された電極40aを有する1つのマイクロチャンバー10aでのみ水の電気分解を行い、泡を発生させることができる。
【0063】
電極40及び配線42は、導電性の材料から形成される。この導電性材料は特に限られず、例えば、ITO(Indium Oxide Tin)、金、白金、アルミニウムを用いることができ、特に、透明な電極40及び配線42を簡便且つ確実に形成できるITOを好ましく用いることができる。
【0064】
このような電極40を有するマイクロチャンバー10は、例えば、公知の半導体製造技術を用いて形成することができる。図4は、マイクロチャンバー10を形成する工程の一例を示す説明図である。
【0065】
まず、図4Aに示すように、ガラス基板からなる第一基板21上に、ITOからなる導電性膜27をパターンし、さらに当該導電性膜27のうち、電極40a,40b,40c(図4B参照)のそれぞれに対応する領域にポジ型フォトレジスト28a,28b,28cをパターンする。
【0066】
次いで、図4Bに示すように、所定のエッチング液を用いて導電性膜27をエッチングして、電極40a,40b,40cを形成する。さらに、図4Cに示すように、電極40a,40b,40c上にネガ型フォトレジストからなる非導電性層29をコートする。
【0067】
そして、図4Dに示すように、この非導電性層29のうち、電極40a,40b,40cに対応する位置にマイクロチャンバー10a,10b,10cをパターン形成する。こうして、第一基板21に積層された非導電性の被覆層22の表面に開口し、底部に電極40a,40b,40cを有するマイクロチャンバー10a,10b,10cを形成することができる。
【0068】
一方、第二部材30は、第二基板31と、当該第二基板31の表面に形成された電気分解用の電極41と、を有している。第二基板31は非導電性の材料で形成される。この非導電性材料は特に限られず、例えば、ガラスや非導電性樹脂を好ましく用いることができる。すなわち、例えば、第二基板31はガラス基板とすることができる。
【0069】
図3に示す例において、電極41は、共通流路24を介して複数のマイクロチャンバー10の電極40に対向する位置に形成されている。すなわち、本装置1は、複数のマイクロチャンバー10の底面に配置された複数の電極40と、当該複数の電極40に対向するよう配置された共通の電極41と、を有している。
【0070】
電極41は、導電性の材料から形成される。この導電性材料は特に限られず、例えば、ITO、金、白金、アルミニウムを用いることができ、特に、透明な電極41を簡便且つ確実に形成できるITOを好ましく用いることができる。
【0071】
そして、本装置1は、これら第一部材20と第二部材30とを貼り合わせることにより構成される。共通流路24は、複数のマイクロチャンバー10と第二部材30との間の隙間として形成される。
【0072】
また、図2に示す例において、本装置1は、その内部に液体を流入させるための流入口25と、その内部から液体を流出させるための流出口26と、を有している。すなわち、本装置1においては、流入口25から共通流路24及びマイクロチャンバー10に液体を流入させることができ、また、当該共通流路24及びマイクロチャンバー10内の液体を流出口26から流出させることができる。なお、図2には、流入口25及び流出口26が本装置1の長手方向の端部に開口する例を示しているが、これに限られず、例えば、当該流入口25及び流出口26の少なくとも一方を第二部材30の外表面に開口するよう設けることもできる。
【0073】
図5は、図2及び図3に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。この場合、本方法の第一の工程S1では、図5Aに示すように、複数のマイクロチャンバー10の各々に対象粒子50を捕捉する。
【0074】
すなわち、例えば、本装置1の流入口25(図2参照)から、対象粒子50が分散された水溶液を共通流路24内に注入する。この結果、各マイクロチャンバー10において、底部である電極40上に対象粒子50が載置される。
【0075】
また、各マイクロチャンバー10及び共通流路24は水溶液で満たされる。なお、図5には、1つのマイクロチャンバー10に1つの対象粒子50を捕捉する例を示したが、これに限られず、1つのマイクロチャンバー10に複数の対象粒子50を捕捉することもできる。この場合、マイクロチャンバー10は、複数の対象粒子50を収容できるサイズに形成される。
【0076】
次に、第二の工程S2においては、図5Bに示すように、複数のマイクロチャンバー10a,10b,10cのうち1つのマイクロチャンバー10aの電極40aに選択的に電圧を印加することにより水を電気分解して泡60を発生させる。
【0077】
すなわち、標的とする1つのマイクロチャンバー10aの電極40aと、当該電極40aに対向する第二部材30の電極41と、を電源に接続して陽極及び陰極とし、当該マイクロチャンバー10a内の水溶液を電気分解して泡60を発生させることのできる大きさの電圧を印加する。
【0078】
この結果、複数のマイクロチャンバー10a,10b,10cのうち、標的とする1つのマイクロチャンバー10aにおいてのみ、水溶液の電気分解による泡60を発生させることができる。
【0079】
そして、第三の工程S3においては、図5Bに示すように、電気分解により発生した泡60及び当該泡60の発生に伴い流動するマイクロチャンバー10a内の水溶液のうち少なくとも一方をアクチュエーターとして利用して、当該マイクロチャンバー10aから対象粒子50aを押し出す。
【0080】
すなわち、標的とする1つのマイクロチャンバー10aに捕捉されていた対象粒子50aは、電極40a上で発生して浮上する泡60によって、又は当該泡60の発生に伴い当該マイクロチャンバー10a外に漏出する水溶液の流れによって、共通流路24に押し出される。なお、通常、泡60及び水溶液流れの両方が対象粒子50aに作用する。
【0081】
その後、共通流路24に新たな水溶液を流通させることにより、標的とする1つのマイクロチャンバー10aから解放された1つの対象粒子50aを選択的に回収することができる。一方、図5Cに示すように、電気分解が行われなかった他のマイクロチャンバー10b,10cにおいては、対象粒子50b,50cを捕捉された状態で維持できる。
【0082】
このように、本装置1においては、電極40が、マイクロチャンバー10のうち、対象粒子50が捕捉され保持される位置より奥に配置されているため、当該電極40上での泡の発生によって、当該対象粒子50を当該マイクロチャンバー10から共通流路24に確実に押し出すことができる。
【0083】
図6は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の平面図である。図7は、図6に示すVII−VII線で切断した本装置1の断面図である。
【0084】
この例に係る本装置1は、図6及び図7に示すように、複数のマイクロチャンバー10が設けられた第一部材20と、当該第一部材20に積層された第二部材30と、を備え、当該複数のマイクロチャンバー10の各々には、電気分解用の陽極及び陰極のうち一方の電極40が配置され、当該第二部材30には、当該陽極及び陰極のうち他方の電極41が配置されている。すなわち、マイクロチャンバー10の底部には電極40が配置されている。
【0085】
一方、第二部材30の電極41は、マイクロチャンバー10の電極40に対向する位置には配置されておらず、当該対向する位置からずれた位置に配置されている。すなわち、この例に係る本装置1において、電極41は、第二部材30のうち、複数のマイクロチャンバー10に配置された電極40に対向する位置からずれた位置に配置されている。この場合、本装置1における配線の自由度が比較的高くなる。
【0086】
図8は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の平面図である。図9は、図8に示すIX−IX線で切断した本装置1の断面図である。
【0087】
この例に係る本装置1においては、図8及び図9に示すように、複数のマイクロチャンバー10の各々には、電気分解用の陽極及び陰極の両方の電極40,41が配置されている。すなわち、マイクロチャンバー10の底部の一部には陽極及び陰極のうち一方の電極40が配置され、当該底部の他の一部には、当該陽極及び陰極のうち他方の電極41が配置されている。したがって、図9に示すように、第二部材30には電極は設けられていない。
【0088】
そして、この本装置1においては、標的とする1つのマイクロチャンバー10に配置された一方の電極40と他方の電極41とを選択的に電源に接続して電圧を印加することにより、当該マイクロチャンバー10内で水の電気分解を行い泡を発生させることができる。
【0089】
この場合、電気分解を行うための電極40,41が全て1つのマイクロチャンバー10内に配置されているため、当該マイクロチャンバー10内でのみ電気分解を行うことができる。特に、図9に示すように、両方の電極40,41がマイクロチャンバー10の底部に配置されているため、当該底部近傍でのみ電気分解反応を行うことができる。したがって、発生した泡を制御しやすい。
【0090】
また、電気分解に必要な一対の電極40,41を近接して配置できるため、印加する電圧を効果的に低減することができる。また、第二部材30の構造を簡略化することができ、本装置1の組み立ても容易となる。
【0091】
また、図8及び図9に示す例において、一方の電極40(例えば、陽極)は、マイクロチャンバー10の底部の中央部分を覆うように形成されている。すなわち、一方の電極40の面積を拡大し、且つマイクロチャンバー10の中央部分に配置している。したがって、一方の電極40における泡の発生を利用した対象粒子の押し出しを確実に行うことができる。
【0092】
さらに、他方の電極41(例えば、陰極)は、一方の電極40のうち、マイクロチャンバー10の底部の中央部分を覆う部分を囲むように形成されている。したがって、これら一対の電極40,41に印加する電圧の大きさを低減しつつ、対象粒子の押し出しを確実に行うことができる。なお、電極40を陰極とし、電極41を陽極とすることもできる。
【0093】
図10は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の断面図である。図11は、図10に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。
【0094】
この例に係る本装置1においては、図10及び図11に示すように、複数のマイクロチャンバー10の各々は、共通流路24に開口し対象粒子50が収容される収容室11と、当該収容室11に連通して設けられ電気分解用の電極40,41が配置された電気分解室12と、を有する。
【0095】
すなわち、図10及び図11に示す例において、収容室11と電気分解室12とは連通路13を介して連絡されている。より具体的に、電気分解室12は、収容室11の直下に設けられている。電気分解室12には、電気分解用の陽極及び陰極のうち一方の電極40と他方の電極41との両方が配置されている。
【0096】
また、連通路13は、対象粒子50が通過できないサイズで形成されている。すなわち、収容室11の底部14(図10参照)における連通路13の開口部15は、対象粒子50(図11参照)より小さなサイズで形成されている。すなわち、連通路13の開口部15は、収容室11の底部14の一部において、当該底部14より小さなサイズで形成されている。
【0097】
このため、図11Aに示すように、対象粒子50は、電気分解室12に落下することなく収容室11に保持される。また、このとき、対象粒子50は、収容室11の底部14において、連通路13の開口部15を閉塞するように保持することもできる。
【0098】
なお、図10及び図11には、電極40,41が電気分解室12の底部に配置される例を示しているが、これに限られず、例えば、当該電極40,41の少なくとも一方を当該電気分解室12の他の部分に配置することもできる。
【0099】
この本装置1を用いた本方法の第一の工程S1においては、まず、図11Aに示すように、複数のマイクロチャンバー10の各々の収容室11に対象粒子50を捕捉する。次に、第二の工程S2においては、図11B及び図11Cに示すように、標的とするマイクロチャンバー10の電極40,41に選択的に電圧を印加することにより(図5B参照)、その電気分解室12で水を電気分解して泡60を発生させる。
【0100】
そして、第三の工程S3においては、図11B及び図11Cに示すように、電気分解により発生した泡60及び当該泡60の発生に伴い流動するマイクロチャンバー10内の水溶液のうち少なくとも一方をアクチュエーターとして利用して、当該マイクロチャンバー10から対象粒子50を押し出す。
【0101】
すなわち、例えば、図11Bに示すように、電気分解室12における泡60の発生によって、当該電気分解室12に満たされていた水溶液は連通路13を通って収容室11に押し出され、さらに収容室11に満たされていた水溶液は共通流路24へと押し出される。この電気分解室12から共通流路24に向けた水溶液の流れによって、対象粒子50をマイクロチャンバー10から押し出すことができる。
【0102】
また、例えば、図11Cに示すように、発生した泡60が連通路13を通過して収容室11にまで浮上する場合には、当該浮上する泡60によって対象粒子50を共通流路24に押し出すこともできる。
【0103】
図12は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の断面図である。図13は、図12に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。
【0104】
この例に係る本装置1においては、図12及び図13に示すように、複数のマイクロチャンバー10の各々は、共通流路24に開口し対象粒子50が収容される収容室11と、当該収容室11に連通して設けられ電極40,41が配置された電気分解室12と、を有する。そして、電気分解室12は、収容室11の直下からずれた位置に設けられ、当該電気分解室12と収容室11とは屈曲した連通路13により連絡されている。
【0105】
この本装置1を用いた本方法の第一の工程S1においては、まず、図13Aに示すように、複数のマイクロチャンバー10の各々の収容室11に対象粒子50を捕捉する。次に、第二の工程S2においては、図13Bに示すように、標的とするマイクロチャンバー10の電極40,41に選択的に電圧を印加することにより(図5B参照)、その電気分解室12で水を電気分解して泡60を発生させる。
【0106】
そして、第三の工程S3においては、図13Bに示すように、泡60の発生に伴い流動するマイクロチャンバー10内の水溶液によって、当該マイクロチャンバー10から対象粒子50を押し出す。
【0107】
すなわち、この例に係る本装置1においては、電気分解室12で発生した泡は当該電気分解室12に保持されるため、主に当該泡の発生に伴いマイクロチャンバー10から共通流路24に流出する水溶液の流れをアクチュエーターとして利用する。
【0108】
もちろん、上述の図11Cに示す例と同様に、泡60が連通路13を通過して収容室11まで浮上した場合には、当該泡60をアクチュエーターとして利用して、対象粒子50を押し出すこともできる。
【0109】
図14は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の断面図である。図15は、図14に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。
【0110】
この例に係る本装置1においては、図14及び図15に示すように、複数のマイクロチャンバー10の各々は、共通流路24に開口し対象粒子50が収容される収容室11と、電気分解用の電極40,41が配置された電気分解室12と、当該収容室11と当該電気分解室12との間に設けられ当該電気分解室12における水の電気分解による泡60の発生に伴って当該対象粒子50を当該11収容室から押し出すように変形する伸縮性の膜(以下、「押出膜70」という。)と、を有する。
【0111】
すなわち、図14及び図15に示す例において、この押出膜70は、収容室11と電気分解室12とを仕切るように設けられるとともに、収容室11の底部を構成している。押出膜70は、電気分解室12における泡60の発生によって柔軟に変形できる伸縮性を備えている。なお、押出膜70は、電気分解室12を密閉するよう形成することもできる。
【0112】
押出膜70を構成する材料は、上述の伸縮性を実現できるものであれば特に限られず、例えば、ポリジメチルシロキサン(PDMS)、ポリスチレン、ポリカーボネート、厚型フォトレジスト等のポリマーを用いることができる。また、押出膜70の厚さは、例えば、10〜200μmの範囲とすることができる。
【0113】
このような押出膜70を有するマイクロチャンバー10は、例えば、PDMSをシリコンウェハ上の鋳型にスピンコートすることにより作製することができる。この場合、スピンコート時の回転数によって押出膜70の厚さを任意に制御することができる。
【0114】
この本装置1を用いた本方法の第一の工程S1においては、まず、図15Aに示すように、複数のマイクロチャンバー10の各々の収容室11に対象粒子50を捕捉する。すなわち、収容室11において対象粒子50を押出膜70上に沈降させる。
【0115】
次に、第二の工程S2においては、図15Bに示すように、標的とするマイクロチャンバー10の一対の電極40,41に選択的に電圧を印加することにより、電気分解室12で水を電気分解して泡60を発生させる。
【0116】
そして、第三の工程S3においては、図15Bに示すように、泡60の発生に伴い上方に張り出すように変形した押出膜70によって、マイクロチャンバー10から対象粒子50を押し出す。
【0117】
すなわち、押出膜70は電気分解室12の上方を覆っているため、当該電気分解室12で発生した泡60は浮上して当該押出膜70を下方から押し上げる。押出膜70は伸縮性を有しているため、その一部は上方に変位するよう変形する。
【0118】
その結果、対象粒子50は、押出膜70によって上方に突き上げられて、共通流路24に押し出される。このように、押出膜70をアクチュエーターとして利用することにより、対象粒子50をマイクロチャンバー10から確実に押し出すことができる。
【0119】
図16は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の平面図である。図17は、図16に示すXVII−XVII線で切断した本装置1の断面図である。
【0120】
この例に係る本装置1は、上述の図14及び図15に示した例と同様、押出膜70を有している。ただし、この例に係る押出膜70は、図16に示すように、その中央部分を構成する中央部71と、当該中央部71の一部とマイクロチャンバー10の内壁(被覆層22)とを接続して当該中央部71を部分的に支持する複数(図16では4つ)の接続部72と、を有している。すなわち、この例において、収容室11と電気分解室12とは連通しつつ押出膜70で仕切られている。
【0121】
また、図17に示す例では、押出膜70の中央部71は、その下面73が共通流路24側に窪んだ凹形状となるように形成されている。このため、電気分解室12で発生した泡60を、押出膜70の当該中央部71の窪みに効率よく集めることができ、押出膜70を効率よく変形させることができる。なお、図16に示す押出膜70は、このような窪みを有することなく、図14に示すような平坦な形状で形成することもできる。
【0122】
図18は、本装置1の他の例における複数のマイクロチャンバー10のうち1つの周辺部分の断面図を示す。図19は、図18に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。
【0123】
この例に係る本装置1が備える押出膜70は、図18及び図19に示すように、中空の蛇腹状に形成されて共通流路24側に伸縮可能な伸縮部74と、当該伸縮部74とマイクロチャンバー10の内壁(被覆層22)とを接続して当該伸縮部74を支持する基部75と、を有している。
【0124】
この押出膜70は、上述の図14〜図17に示した例に係る押出膜70と同様の材料を用いて作製することができる。また、伸縮部74及び基部75は、当該伸縮部74及び基部75に対応する形状の鋳型を用いて形成することができる。すなわち、例えば、材料としてPDMS等のポリマーを用いる場合には、伸縮部74に対応する蛇腹状の部分を有する外枠と、当該外枠より一回り小さい同形状の内枠と、を重ね合わせ、当該外枠と内枠との間に当該ポリマーを流し込み硬化させることによって、当該蛇腹状の伸縮部74を有する押出膜70を作製することができる。
【0125】
この本装置1を用いた本方法の第一の工程S1においては、まず、図19Aに示すように、複数のマイクロチャンバー10の各々の収容室11に対象粒子50を捕捉する。すなわち、収容室11において対象粒子50を押出膜70の伸縮部74上に沈降させる。
【0126】
次に、第二の工程S2においては、図19Bに示すように、標的とするマイクロチャンバー10の一対の電極40,41に選択的に電圧を印加することにより、電気分解室12で水を電気分解して泡60を発生させる。
【0127】
そして、第三の工程S3においては、図19Bに示すように、泡60の発生に伴い伸縮部74が上方に変位する押出膜70によって、マイクロチャンバー10から対象粒子50を押し出す。
【0128】
すなわち、押出膜70は電気分解室12の上方を覆っているため、当該電気分解室12で発生した泡60は浮上して当該押出膜70の伸縮部74を下方から押し上げる。このとき、押出膜70の伸縮部74は、その蛇腹形状を活かして効率よく上方に伸びる。その結果、対象粒子50は、押出膜70の伸縮部74によって上方に突き上げられて、共通流路24に押し出される。
【0129】
図20は、本装置1の他の例における複数のマイクロチャンバー10のうち3つのマイクロチャンバー10a,10b,10cの周辺部分の平面図である。図21は、図20に示す本装置1を用いて本方法を実施する場合における各工程を示す説明図である。
【0130】
この例に係る本装置1は、図20及び図21に示すように、ジグザグに蛇行する共通流路24を備えている。また、共通流路24のうち互いに平行に配置される一部から他の一部へと横切るように複数のマイクロチャンバー10が形成されている。
【0131】
すなわち、各マイクロチャンバー10は、図20に示すように、共通流路24の中途部分に開口するよう設けられ、その奥には電気分解用の電極40が配置され、当該電極40のさらに奥には断面積を縮小させた狭窄路16が形成され、当該狭窄路16は当該共通流路24の他の中途部分に連通している。
【0132】
この本装置1を用いた本方法の第一の工程S1においては、まず、図21Aに示すように、複数のマイクロチャンバー10a,10b,10cの各々に対象粒子50a,50b,50cを捕捉する。
【0133】
この対象粒子50の捕捉は、例えば、上述の非特許文献1に記載されているように、対象粒子50が捕捉されていない状態における共通流路24に沿った蛇行流れ(図20において実線の矢印で示す流れ)の圧力損失が、マイクロチャンバー10及び狭窄路16を介したバイパス流れ(図20において破線の矢印で示す流れ)の圧力損失に比べて大きくなるように、流路の長さや断面積を調整することで実現することができる。
【0134】
次に、第二の工程S2においては、図21Bに示すように、複数のマイクロチャンバー10a,10b,10cのうち、標的とするマイクロチャンバー10aの電極40aに選択的に電圧を印加することにより、当該マイクロチャンバー10aで水を電気分解して泡60を発生させる。
【0135】
そして、第三の工程S3においては、図21Bに示すように、電気分解により発生した泡60及び当該泡60の発生に伴い流動するマイクロチャンバー10a内の水溶液のうち少なくとも一方をアクチュエーターとして利用して、当該マイクロチャンバー10aから対象粒子50aを選択的に押し出す。その後、共通流路24に新たな水溶液を流通させることにより、当該共通流路24に押し出された対象粒子50aを選択的に回収することができる。
【0136】
また、この例に係る本装置1においては、複数のマイクロチャンバー10a,10b,10cのうち一部のマイクロチャンバー10aから解放された対象粒子50aを他のマイクロチャンバー10bに捕捉することもできる。
【0137】
すなわち、例えば、複数のマイクロチャンバー10a,10b,10cのうち1つのマイクロチャンバー10bの電極40bに電圧を印加して当該マイクロチャンバー10bから対象粒子50bを解放した後、より上流側の他のマイクロチャンバー10aの電極40aに電圧を印加して当該マイクロチャンバー10aから対象粒子50aを解放して共通流路24を下流側に流通させることにより、上述の圧力損失のバランスに基づいて、当該対象粒子50aを予め空けられた下流側の当該マイクロチャンバー10bに捕捉することができる。
【0138】
このようにして、複数の対象粒子50の選択的な捕捉と解放とを繰り返すことによって、当該複数の対象粒子50の並べ替えや入れ替えを任意に行うことができる。なお、図20及び図21には、各マイクロチャンバー10に電気分解用の陽極及び陰極のうち一方の電極40が配置される例を示したが、これに限られず、各マイクロチャンバー10に当該陽極及び陰極の両方の電極を設けることもできる。
【0139】
次に、本実施形態に係る具体的な実施例について説明する。
【実施例1】
【0140】
[マイクロ流体装置の作製]図4に示した例と同様の工程で、図3に示すような本装置1を製造した。すなわち、まず、ガラス基板上にITO層を形成した。次いで、標準的なリソグラフィーによって、マイクロチャンバーの底部に配置する電極に対応する位置にポジ型フォトレジストS1818からなるレジスト層をパターンした(図4A参照)。そして、エッチング液(HCl:H2O:HNO3=1:1:0.16)を用いてITO層をエッチングし(50℃で3.25分)、ガラス基板上に電極を形成した(図4B参照)。
【0141】
その後、この電極をネガ型の厚膜フォトレジストSU8でコートし、当該SU8からなるレジスト層を形成した(図4C参照)。そして、このレジスト層をパターンして、各々が底部に電極を有する48個(6×8)のマイクロチャンバーを形成した(図4D参照)。
【0142】
マイクロチャンバーの直径は150μmとし、深さは150μmとした。なお、このマイクロチャンバーのサイズは、哺乳動物の受精卵を1つ捕捉するために適切なサイズとして採用した。
【0143】
さらに、マイクロチャンバーが形成された被覆層(SU8シート)の周囲に、シリコーンゴムのスペーサを置いた。そして、この第一部材を、ガラス基板上にITO層からなる電極が形成されてなる第二部材で覆うことにより、本装置1を作製した。
【0144】
[顕微鏡観察]作製した本装置1を明視野顕微鏡で観察した。本装置1に設けられた電極を構成するITOは透明であるため倒立顕微鏡(Olympus IX71)で観察することができた。なお、マイクロチャンバーの電極は、導電性のラインテープを介して直流電源装置(Agilent E3641A)のプラスに接続し、第二部材の電極は当該直流電源装置のマイナスに接続した。すなわち、マイクロチャンバーの電極を陽極として使用し、対向する第二部材の電極を陰極として使用した。
【0145】
図22には、本装置1の顕微鏡写真の一部を拡大して示す。図22Aに示すように、SU8からなる被覆層に複数のマイクロチャンバー(chamber)が規則的に配置されているのが確認された。また、各マイクロチャンバーの底部にはITO膜のパターンにより形成された電極が配置されていた。なお、電極及び配線を構成するITOは透明であり顕微鏡下で視認することが難しかったため、図22Bには、当該電極及び配線のパターン(ITO)を示した。
【0146】
[マイクロビーズの選択的押し出し]対象粒子として、直径100μmのポリスチレン製マイクロビーズを用いた。また、電解質水溶液としてリン酸緩衝液(Phosphate Buffered Saline:PBS)を用いた。
【0147】
まず、本装置1の内部をPBSで満たした。次いで、マイクロピペットを用いて、PBSに分散したマイクロビーズをマイクロチャンバーに注入した。この結果、48個のマイクロチャンバーのうち、44個のマイクロチャンバーの各々にマイクロビーズを1つずつ入れることができた。マイクロチャンバーに入らなかったマイクロビーズはPBSで洗い流した。図23には、本装置1において各マイクロチャンバー(chamber)にマイクロビーズ(bead)が1つずつ捕捉された様子を撮影した顕微鏡写真の一例を示す。
【0148】
次に、本方法を実施して、複数のマイクロチャンバーのうち1つから選択的にマイクロビーズを解放した。図24には、本方法を実施する過程における本装置1の一部をタイムラプスビデオで経時的に撮影した画像を示す。図24Aは電圧を印加する直前(0秒)の画像を示し、図24Bは電圧を印加してから1.1秒後の画像を示し、図24Cは電圧を印加してから4.3秒後の画像を示す。
【0149】
ここでは、図24Aに示す矢印の指す中央のマイクロチャンバー内のマイクロビーズを標的として選択した。この選択したマイクロチャンバーの底部に配置されている電極を直流電源装置と選択的に接続した。
【0150】
そして、選択されたマイクロチャンバーの電極と、これに対向する第二部材の電極と、の間に5.2Vの電圧を印加し、当該底部のITO電極と上部のITO電極との間に電流を流して、PBSの電気分解を行った。この結果、図24Bに示すように、電圧印加直後に、標的のマイクロチャンバーでのみ、底部に配置された電極から泡(bubble)が発生した。
【0151】
その後、図24Cに示すように、標的のマイクロチャンバーに捕捉されていたマイクロビーズ(bead)は、泡によって当該マイクロチャンバーから押し出され、完全に解放された。一方、図24Cに示すように、電圧を印加していない他のマイクロチャンバーに捕捉されているマイクロビーズは解放されず保持されたままであった。
【0152】
こうして標的とするマイクロビーズを選択的にマイクロチャンバーから解放することができた。なお、直径が10μm又は50μmのポリスチレン製マイクロビーズを用いても、同様にして選択的な解放を実現することができた。
【実施例2】
【0153】
[電気分解が哺乳動物細胞の生存率に及ぼす影響の評価]本装置1として、上述の実施例1で作製したものと同様のマイクロ流体装置を用いた。細胞として、牛動脈内皮細胞を用いた。
【0154】
まず、この細胞を分散した培養培地を本装置1内に注入して当該細胞をマイクロチャンバー内に捕捉し、所定の時間培養した。次いで、マイクロチャンバーに0〜8Vの電圧を10秒間印加した。そして、電圧を印加した直後に、細胞の生存率を評価するための市販の試薬(Live/Dead Assay(登録商標) Viability/Cytotoxicity reagent)をマイクロチャンバー内に注入した。
【0155】
その後、処理された細胞を蛍光顕微鏡下で観察した。上記の試薬により、死細胞は赤色、生細胞は緑色に染色された。顕微鏡下で死細胞の数を計測した。そして、総細胞数(生細胞数+死細胞数)に対する死細胞数の割合(%)を算出した。
【0156】
図25には、この評価結果を示す。図25において、横軸はマイクロチャンバーに印加した電圧(V)を示し、縦軸は死細胞数の割合(%)を示す。また、図25に示す破線より左側の電圧(0V、2V)を印加した場合には泡は発生せず(no bubbles)、当該破線より右側の電圧(4V、6V、8V)を印加した場合に泡が発生した(bubbles formed)。
【0157】
図25に示すように、6Vより大きな電圧は細胞に対してより強いダメージを与えることがわかった。一方、6Vより低い電圧(2V、4V)ではほとんどの細胞が生存していた。したがって、6Vより小さい電圧を印加するという電気分解の条件は、細胞の選択的解放のために十分に穏やかであると確認された。なお、8Vを印加した場合であっても、死細胞の割合は10%未満であり、多くの細胞は生存状態を維持していた。
【0158】
[電気分解前後の温度の測定]また、ITO電極間に5.2Vの電圧を印加している間の本装置1の温度をサーモグラフ装置(Neo Thermo TVS−600、NEC Avio赤外線テクノロジー株式会社)を用いて測定した。
【0159】
その結果、電圧を印加した前後で本装置1内の温度に変化は見られなかった。また、電圧を印加した後においても、本装置1の温度は上昇しなかった。したがって、本方法は、細胞に対して発熱によるダメージを与えることなく実施可能であることが確認できた。
【符号の説明】
【0160】
1 マイクロ流体装置、10 マイクロチャンバー、11 収容室、12 電気分解室、13 連通路、14 底部、15 開口部、16 狭窄路、20 第一部材、21 第一基板、22 被覆層、23 スペーサ、24 共通流路、25 流入口、26 流出口、27 ITO膜、28 ポジ型フォトレジスト層、29 ネガ型フォトレジスト層、30 第二部材、31 第二基板、40,41 電極、42 配線、50 対象粒子、60 泡、70 押出膜、71 中央部、72 接続部、73 下面、74 伸縮部、75 基部。
【特許請求の範囲】
【請求項1】
各々が電気分解用の陽極及び陰極のうち少なくとも一方の電極を有する複数のマイクロチャンバーに操作の対象とする粒子を捕捉し、
前記複数のマイクロチャンバーのうち一部のマイクロチャンバーの前記電極に電圧を印加することにより水を電気分解して泡を発生させ、
前記泡の発生に伴い作動するアクチュエーターによって、前記一部のマイクロチャンバーから選択的に前記粒子を押し出す
ことを特徴とする方法。
【請求項2】
前記アクチュエーターは、浮遊する前記泡又は前記泡の発生に伴い流動する前記マイクロチャンバー内の液体である
ことを特徴とする請求項1に記載された方法。
【請求項3】
前記アクチュエーターは、前記マイクロチャンバーにおいて前記電極と前記粒子との間に設けられ前記泡の発生に伴い前記粒子を押し出すように変形する伸縮性の膜である
ことを特徴とする請求項1に記載された方法。
【請求項4】
前記粒子は細胞であり、
前記複数のマイクロチャンバーの各々に前記細胞を1つずつ捕捉して培養し、
前記複数のマイクロチャンバーで培養された複数の前記細胞のうち一部を回収すべき細胞として決定し、
前記複数のマイクロチャンバーのうち前記回収すべき細胞が捕捉されている一部のマイクロチャンバーの前記電極に電圧を印加することにより水を電気分解して泡を発生させ、
前記泡の発生に伴い作動する前記アクチュエーターによって、前記一部のマイクロチャンバーから選択的に前記細胞を押し出す
ことを特徴とする請求項1乃至3のいずれかに記載された方法。
【請求項5】
前記細胞は受精卵であり、
前記一部のマイクロチャンバーから選択的に押し出された前記受精卵を生きた状態で回収する
ことを特徴とする請求項4に記載された方法。
【請求項6】
粒子を捕捉するための複数のマイクロチャンバーと、
前記複数のマイクロチャンバーが開口する共通流路と、
を備えたマイクロ流体装置であって、
前記複数のマイクロチャンバーの各々には、電気分解用の陽極及び陰極のうち少なくとも一方の電極が配置されている
ことを特徴とするマイクロ流体装置。
【請求項7】
前記複数のマイクロチャンバーが設けられた第一部材と、
前記第一部材に積層された第二部材と、
を備え、
前記複数のマイクロチャンバーの各々には、前記陽極及び陰極のうち一方の電極が配置され、
前記第二部材には、前記陽極及び陰極のうち他方の電極が配置されている
ことを特徴とする請求項6に記載されたマイクロ流体装置。
【請求項8】
前記複数のマイクロチャンバーの各々には、前記陽極及び陰極の両方の電極が配置されている
ことを特徴とする請求項6に記載されたマイクロ流体装置。
【請求項9】
前記複数のマイクロチャンバーの各々は、前記共通流路に開口し前記粒子が収容される収容室と、前記収容室に連通して設けられ前記電極が配置された電気分解室と、を有する
ことを特徴とする請求項6乃至8のいずれかに記載されたマイクロ流体装置。
【請求項10】
前記複数のマイクロチャンバーの各々は、前記共通流路に開口し前記粒子が収容される収容室と、前記電極が配置された電気分解室と、前記収容室と前記電気分解室との間に設けられ前記電気分解室における水の電気分解による泡の発生に伴って前記粒子を前記収容室から押し出すように変形する伸縮性の膜と、を有する
ことを特徴とする請求項6乃至8のいずれかに記載されたマイクロ流体装置。
【請求項1】
各々が電気分解用の陽極及び陰極のうち少なくとも一方の電極を有する複数のマイクロチャンバーに操作の対象とする粒子を捕捉し、
前記複数のマイクロチャンバーのうち一部のマイクロチャンバーの前記電極に電圧を印加することにより水を電気分解して泡を発生させ、
前記泡の発生に伴い作動するアクチュエーターによって、前記一部のマイクロチャンバーから選択的に前記粒子を押し出す
ことを特徴とする方法。
【請求項2】
前記アクチュエーターは、浮遊する前記泡又は前記泡の発生に伴い流動する前記マイクロチャンバー内の液体である
ことを特徴とする請求項1に記載された方法。
【請求項3】
前記アクチュエーターは、前記マイクロチャンバーにおいて前記電極と前記粒子との間に設けられ前記泡の発生に伴い前記粒子を押し出すように変形する伸縮性の膜である
ことを特徴とする請求項1に記載された方法。
【請求項4】
前記粒子は細胞であり、
前記複数のマイクロチャンバーの各々に前記細胞を1つずつ捕捉して培養し、
前記複数のマイクロチャンバーで培養された複数の前記細胞のうち一部を回収すべき細胞として決定し、
前記複数のマイクロチャンバーのうち前記回収すべき細胞が捕捉されている一部のマイクロチャンバーの前記電極に電圧を印加することにより水を電気分解して泡を発生させ、
前記泡の発生に伴い作動する前記アクチュエーターによって、前記一部のマイクロチャンバーから選択的に前記細胞を押し出す
ことを特徴とする請求項1乃至3のいずれかに記載された方法。
【請求項5】
前記細胞は受精卵であり、
前記一部のマイクロチャンバーから選択的に押し出された前記受精卵を生きた状態で回収する
ことを特徴とする請求項4に記載された方法。
【請求項6】
粒子を捕捉するための複数のマイクロチャンバーと、
前記複数のマイクロチャンバーが開口する共通流路と、
を備えたマイクロ流体装置であって、
前記複数のマイクロチャンバーの各々には、電気分解用の陽極及び陰極のうち少なくとも一方の電極が配置されている
ことを特徴とするマイクロ流体装置。
【請求項7】
前記複数のマイクロチャンバーが設けられた第一部材と、
前記第一部材に積層された第二部材と、
を備え、
前記複数のマイクロチャンバーの各々には、前記陽極及び陰極のうち一方の電極が配置され、
前記第二部材には、前記陽極及び陰極のうち他方の電極が配置されている
ことを特徴とする請求項6に記載されたマイクロ流体装置。
【請求項8】
前記複数のマイクロチャンバーの各々には、前記陽極及び陰極の両方の電極が配置されている
ことを特徴とする請求項6に記載されたマイクロ流体装置。
【請求項9】
前記複数のマイクロチャンバーの各々は、前記共通流路に開口し前記粒子が収容される収容室と、前記収容室に連通して設けられ前記電極が配置された電気分解室と、を有する
ことを特徴とする請求項6乃至8のいずれかに記載されたマイクロ流体装置。
【請求項10】
前記複数のマイクロチャンバーの各々は、前記共通流路に開口し前記粒子が収容される収容室と、前記電極が配置された電気分解室と、前記収容室と前記電気分解室との間に設けられ前記電気分解室における水の電気分解による泡の発生に伴って前記粒子を前記収容室から押し出すように変形する伸縮性の膜と、を有する
ことを特徴とする請求項6乃至8のいずれかに記載されたマイクロ流体装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【公開番号】特開2011−79(P2011−79A)
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願番号】特願2009−146736(P2009−146736)
【出願日】平成21年6月19日(2009.6.19)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度、独立行政法人農業・食品産業技術総合研究機構、「生物系産業創出のための異分野融合研究支援事業」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成23年1月6日(2011.1.6)
【国際特許分類】
【出願日】平成21年6月19日(2009.6.19)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度、独立行政法人農業・食品産業技術総合研究機構、「生物系産業創出のための異分野融合研究支援事業」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

