自家弾性軟骨を用いてカプセル化した移植物及びその作製方法
【課題】 本発明者は臨床へ効率的かつ事実的に利用可能な免疫隔離された移植物を提供するため、移植物を受領する個体由来の弾性軟骨を分離して分離された弾性軟骨を継代培養して増幅させた後、弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させるようにし、移植物が弾性軟骨によりカプセル化されて作製されたマイクロ粒子を作製方法して、前記のマイクロ粒子は受領する個体由来の軟骨細胞で作製されているため、受領する個体の免疫機構は非自己(non−self)と認識せず自己(self)であると認識することは勿論、軟骨細胞によって細胞及び補体等の免疫に関わる分子の浸透が処断され免疫拒絶反応は防止でき、栄養分と気体の拡散は円滑であり、移植物の本来の機能を長期間の維持ができることを確認して本発明を完成した。
【解決手段】 本発明の一観点によれば、移植物が、前記移植物を受領する個体由来の弾性軟骨によってカプセル化された移植用マイクロ粒子を提供することである。
本発明の他の観点によれば、(1)移植物を受領する個体由来の弾性軟骨を分離する段階;(2)このように分離された弾性軟骨を継代培養して増幅する段階;(3)弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させる段階;及び(4)移植物が弾性軟骨によりカプセル化されて作製されたマイクロ粒子を分離する段階を含む移植用マイクロ粒子の作製方法が提供される。
【解決手段】 本発明の一観点によれば、移植物が、前記移植物を受領する個体由来の弾性軟骨によってカプセル化された移植用マイクロ粒子を提供することである。
本発明の他の観点によれば、(1)移植物を受領する個体由来の弾性軟骨を分離する段階;(2)このように分離された弾性軟骨を継代培養して増幅する段階;(3)弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させる段階;及び(4)移植物が弾性軟骨によりカプセル化されて作製されたマイクロ粒子を分離する段階を含む移植用マイクロ粒子の作製方法が提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、自家由来の弾性軟骨を用いてカプセル化した移植物及びその作製方法に関するもので、移植物が、前記移植物を受領する個体由来の弾性軟骨によってカプセル化された移植用マイクロ粒子及び移植物を受領する個体由来の弾性軟骨を分離して前記の分離された弾性軟骨を継代培養して増幅させた後、弾性軟骨と移植物を混合し、振とう培養(Shaking culture)することで、移植物を中心として弾性軟骨を接着させるようにし、移植物が弾性軟骨によりカプセル化されたマイクロ粒子を分離する移植用マイクロ粒子の作製方法に関する。
【背景技術】
【0002】
膵島移植は、重症のインスリン依存性1型糖尿病に対する新治療方法である。インスリン投与のみでは解決できない腎不全、網膜症をはじめ神経障害、足部潰瘍等の続発症等の後遺症なく治療が可能であることから根治療法として注目され、最近では、臨床施術の報告が世界的に毎年増加しつつある。
【0003】
しかしながら、臓器提供者の不足、手術後移植片に対する免疫拒絶反応のコントロールなど未だ解決すべき問題点が多い。現行では、終生の免疫抑制剤投与を必要とするが、これも患者の経済的な負担が多く、免疫抑制剤自体がもつ様々な副作用、特に、免疫抑制剤が膵島に直接的に与える有害な影響は重大な問題点として挙げられる。
【0004】
このような欠点を克服するために免疫隔離法(Immunoisolation)が開発された。免疫隔離法とは、理想的な膜を利用してO2及びCO2等の気体、グルコース、アミノ酸等の栄養分及びホルモン等の小さな物質は自由に拡散できるが、免疫担当細胞を含む免疫系の物質は通過できないように包む方法である。このような技術を用いることで移植患者において免疫拒絶反応を引き起こずに移植が可能になる。
【0005】
免疫隔離法の開発初期では、臓器及び組織を包む膜の材料としてアガロース、アルギン酸ナトリウム、ゼラチン、poly(L−lysin)、HEME−MMA、polyvinyl alcohol、polyglycolic acid、polytetrafluoroethylene高分子のように人工的に合成された物質が使われてきた。しかしながら、このような合成物質等は生体内適合性及び耐久性が衰え、材料自体が引き起こす異物反応が原因で実際上臨床適用が不可能であるという問題点がある。
【0006】
人工的に合成された物質の代替として選択した物質が軟骨細胞である。軟骨組織は正常状態では血管、神経、リンパ管が分布しておらず、白血球等の炎症細胞の侵入が不可能である。特に、弾性軟骨は曲げても間もなく元の形に戻る柔軟性と弾力性に優れる。このような性質は細胞や組織等をカプセル化する膜として役割を果たすのに有利である。特に、軟骨組織は加齢に伴う硬化もない。これはコラーゲン、エラスチン、プロテオグリカン等が多量に存在するためだけでなく、コラーゲン線維が非還元性架橋物質であるピリジノリン(pyridinoline)やヒスチジノアラニン(histidino−alanine)によって成熟、安定化されているためと知られている。
【0007】
膵島を膝関節由来の軟骨でカプセル化した技術が開示されている(特許文献1参照。)。しかしながら、この方法は生分解性ポリグリコール酸ポリマーを利用し、移植に必要な膵島を結集させた後、軟骨膜に入れる方式を採択しており、相変らずポリマーのような人工物質を使用しているため異物反応が誘発し得る。特に、上記の方法において軟骨は単層でごく弱いためポリマーのみならず膵島も薄い軟骨の膜を通過して露出してしまう可能性が高いことから深刻な異物反応と免疫拒絶反応が予想される。ここでの培養軟骨膜を利用してのカプセル化は、単純に別途の加わる力なしで(例えば、後述のシート形式の人工膵島開発のとき、カプセル化を促すため駆使した方式である重りで抑える方式及び接着因子が回収過程にシートと同時に離れてくるなどのこと)回収した軟骨膜で膵島を包んでカプセル化を待つ方式であり、膵島を緊密に結合させることが不可能であり、また、単層の軟骨膜を回収するために実験者が使用した細胞スクレーパー(cell scraper)でコンフルエンシーの培養軟骨膜を人為的に剥がすがこのような過程は、脆弱な単層の膜と軟骨細胞が産生したコラーゲンマトリックスをより悪く損傷させる原因となる。さらに膝由来の軟骨を用いたが、これは膝に深刻な後遺症を残すため、臨床への適用が事実上困難である。
【特許文献1】WO 96/40887広報
【0008】
以上のことを考慮して、軟骨組織を収得する臓器は膝より耳の軟骨を選り好むようになった。特に耳由来の軟骨(弾性軟骨)は、美容成形外科において隆鼻術の自家移植材料として採択されており、軟骨採集後は美容的にも傷痕が残らないことからその安全性と容易さは既に確認されたといえる。しかしながら、ラットを含むげっ歯類は弾性軟骨原である耳介及び耳道はごく小さいため、げっ歯類を用いた動物実験はほぼ不可能である。イヌの弾性軟骨は比較的に大きいため、ラットよりは容易に純粋な軟骨組織を採ることできることからイヌを利用した動物実験が進んでいる。しかしながら、動物実験はげっ歯類を利用して基本的な実験を行った後、その実験結果を踏まえて大動物であるイヌを対象として実験することが一般的である。特に、イヌを用いる実験はラットを用いた実験より長期間がかかり、正確かつ迅速な実験を進行させることが困難である。
【0009】
一方、本発明者はイヌの耳から採集した軟骨細胞を培養し、シート状にした後、これらのシートとシートの間に他のイヌ又はげっ歯類から分離した膵臓細胞を挟み込ませて、軟骨細胞とこれから分泌されるコラーゲンによって封入するようにした細胞シート工学(cell sheet engineering)によるマクロカプセル化(macroencapsulated)人工膵島を開示した。しかしながら、げっ歯類の場合、培養を繰り返して継代培養していくと、軟骨細胞以外に線維芽細胞の混入が顕著となり、シート状に作製できなくなる。また、線維芽細胞が細胞間の結合を部分的に弱めてしまい、回収段階のシートに孔の欠損部を生じやすくする。さらに、線維芽細胞は、軟骨細胞を増幅培養する過程において軟骨細胞より活発に分裂するため、軟骨細胞の純度を落とす問題点がある。従って、げっ歯類由来の軟骨細胞は、シート状の作製が困難であるためイヌから軟骨を採集して利用した。どころで、このような人工膵島の作製過程においては軟骨シートを何枚か積層化するなど作製方法が複雑で所要時間も多くかかる。特に単層の軟骨シートは取り扱いのとき、孔の欠損部を生じることやシートのシワができやすいことやシートのふちが丸まるなどの技術的な困難さで熟練の技術を必要とする。シートを積層化する過程では、重さのある重りをシート上に位置させ荷重をかけるが、この操作は、内部に位置する膵島にも直接影響を与えるので加重は膵島の形状を平たくする。平たくなる膵島は機能上障害をみせ、インスリンの産生と放出の機能を衰えさせる。また、軟骨細胞シートを利用して人工臓器を作製する過程は持続的に温度を37℃で維持する必要があり、この条件を満たすためには、培養液の交換する段階及び顕微鏡にて観察する段階でも温度を37℃以下にならないようにする必要がある。また、このように収得した人工臓器はサイズが大きいので生体に直接移植する場合、その大きさに合わせての切開を要求する問題点などがある。
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明者は臨床へ効率的かつ実質的に利用可能な免疫隔離された移植物を提供するため、移植物を受領する個体由来の弾性軟骨を分離し、分離された弾性軟骨を継代培養して増幅させた後、弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させるようにし、移植物が弾性軟骨によりカプセル化されたマイクロ粒子を作製方法して、前記のマイクロ粒子は受領する個体由来の軟骨細胞で作製されているため、受領する個体の免疫機構は非自己(non−self)と認識せず自己(self)であると認識することは勿論、軟骨細胞によって細胞及び補体等の免疫に関わる分子の浸透が処断され免疫拒絶反応は防止でき、栄養分と気体の拡散は円滑であり、移植物の本来の機能を長期間の維持ができることを確認して本発明を完成した。
【課題を解決するための手段】
【0011】
本発明の一観点によれば、移植物が、前記移植物を受領する個体由来の弾性軟骨によってカプセル化された移植用マイクロ粒子を提供することである。
【0012】
本発明の他の観点によれば、(1)移植物を受領する個体由来の弾性軟骨を分離する段階;(2)このように分離された弾性軟骨を継代培養して増幅する段階;(3)弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させる段階;及び(4)移植物が弾性軟骨によりカプセル化されたマイクロ粒子を分離する段階を含む移植用マイクロ粒子の作製方法が提供される。
【発明の効果】
【0013】
本発明のマイクロ粒子は、受領する個体由来の軟骨細胞で作製されているため、受領する個体の免疫機構は非自己(non−self)と認識せず自己(self)であると認識することは勿論、軟骨細胞によってコーティングされているため、細胞及び補体等の免疫に関わる分子の浸透が処断され免疫拒絶反応は防止でき、栄養分と気体の拡散は円滑であり、移植物の本来の機能を長期間維持することができる。
【発明を実施するための最良の形態】
【0014】
本発明は、移植物が前記移植物を受領する個体由来の弾性軟骨によってカプセル化された移植用マイクロ粒子に関する。
【0015】
本発明において、“移植物(transplant)”とは、移植対象臓器及び組織から由来の細胞を意味するが、移植対象の臓器及び組織を細切して収得したマイクロ単位の切片であってもよい。本発明において移植物は細胞単位であるため、特定の機能(例えば、ホルモン分泌)を新たに獲得して保有するものでも本来保有していた特定の機能がさらに増進するように遺伝的に変形された細胞であってもよい。
【0016】
本発明において、移植物の形態は特に制限はない。一の態様においては、移植物が内分泌機能を担当する細胞である場合特定疾病を治療する卓越な効果が期待でき好ましい。一例として移植物が膵臓由来である場合は糖尿病を治療し、移植物が甲状腺由来である場合は甲状腺機能低下症を治療に利用することが可能である。他の例として移植物がエリスロポエチンを分泌する細胞、成長ホルモンを分泌する細胞及び血液凝固因子を分泌する細胞である場合には、各々貧血、小人症、血友病の治療に用いることができる。
【0017】
本発明において移植物は膵臓の膵島細胞(インスリン、グルカゴン等のホルモンを分泌し、血糖を調節する細胞)が好ましいが、これは、軟骨細胞と膵島細胞が相互補完的な関係があるためである。すなわち、軟骨細胞が分泌するコラーゲンマトリクスは膵島細胞に対して保護作用を果たし、膵島が分泌するインスリンは軟骨細胞に対して成長因子として働く。
【0018】
このような移植物をカプセル化する“弾性軟骨”は前記移植物を受領する個体の耳から分離(isolated)された軟骨を意味する。軟骨細胞は生体の様々な部位に存在するが、耳に存在する軟骨細胞は他の部位に存在する軟骨細胞と比べ、比較的に容易に分離及び増殖ができ、生体の機能異常等の後遺症を起こさずに傷跡も残らない点でも優れている。
【0019】
本発明において、移植物は、まずはこれを中心として接着した弾性軟骨によってカプセル化されるが、接着した弾性軟骨がコラーゲンを分泌するため実際にはコラーゲンでできた膜によってカプセル化されたとみなすことができる。このような膜には微細な隙間が多数形成されており、この隙間の孔のサイズは50nmから200nmであり、十分に小さいためこの孔を通って免疫反応に関与する細胞及び補体等の免疫に関わる分子は移動不可能であるが、O2及びCO2等の気体、グルコース、アミノ酸等の栄養分及び移植物が分泌する物質(例えば、ホルモン)等は移動可能である。従って、免疫拒絶反応を引き起こさずに 移植物の本来の機能は発揮できる。
【0020】
移植物が弾性軟骨によってカプセル化された“マイクロ粒子”はそのサイズが150から800μm範囲のものを治療に用いるのが好ましい。マイクロ粒子のサイズが約200μm程度で、より小さいものが好ましが、これは移植物が比較的に厚みの薄い弾性軟骨によってカプセル化されることで、気体及び栄養分の拡散がより円滑にでき、移植物の寿命が延長でき、増殖促進することで移植物の本来の機能を発揮するのにさらに有益に働くためである。しかしながら、マイクロ粒子のサイズが150μmよりも小さい場合は、内部に移植物が封入されない弾性軟骨のみの塊である可能性が高いため注意を要する。
【0021】
本発明は、(1)移植物を受領する個体由来の弾性軟骨を分離する段階;(2)このように分離された弾性軟骨を継代培養して増幅させる段階;(3)弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させる段階;及び(4)移植物が弾性軟骨によりカプセル化されたマイクロ粒子を分離する段階を含む移植用マイクロ粒子の作製方法に関する。
【0022】
本発明による作製方法の段階(1)では、移植物を受領する個体由来の弾性軟骨を分離する。まず、移植物を受領する個体から耳の耳道と耳介を含む弾性軟骨を採集し、皮膚組織、皮下組織、筋肉組織、軟骨膜(perichondrium)、その他の結合組織を除去した後ホモゲナイザー、乳鉢等の粉砕機、ブレンダー、手術用メス、注射器、鉗子、超音波装置等のような物理的な手段でチョッピング(chopping)し、細切する。このとき、弾性軟骨を、時計皿(watch glass)の上に位置させ、手術用の曲刃(curved scissors)を利用してチョッピングするのが好ましい。手術用の曲刃は曲がっているため、凹面の時計皿との密着した接触が容易に得られ、連続する手術用の曲刃による切断運動は時計皿を回転させるようになる。このような円運動は弾性軟骨を中心に集まるようにし、弾性軟骨に強力な手術用の曲刃の切断運動が持続的な作用が可能となり、結果的には短時間でより細かいサイズに細切することができる。弾性軟骨が可能な限り細切されると以降の段階にて消化酵素との接触する断面積がより広くなるため消化もより効率的に行われることから消化時間も短縮できる。
【0023】
チョッピング作業により細かく細切した後は、中性プロテアーゼ、トリプシン、セリンプロテアーゼ、エラスターゼ及びコラゲナーゼ等の中から選択した少なくても一つの蛋白分解酵素で処理して、個体の体温と同一な温度にてオーバーナイトから3〜5日間の長期間においての振とうしながら消化させる。本発明において蛋白分解酵素を処理する温度と時間は蛋白分解酵素の種類及び個体の種等によって異なるが、個体の弾性軟骨が少量である場合、純粋な軟骨細胞を収得するためには消化酵素の処理時間をより長期間維持するのが好ましい。その理由は以下のように説明できる。蛋白分解酵素によって消化させる過程おいて軟骨細胞は、その他の細胞(筋肉細胞、線維芽細胞等)と同時に蛋白分解酵素によって単一細胞として分離される。本発明の消化過程においては、振とう運動を伴うため前記の分離された単一細胞は浮遊状態で維持される。しかしながら、浮遊状態とは培養過程中において培養皿の底に付着しないと増殖できない付着細胞としては、不利な条件であり、時間が経過するとともに代謝率の高い細胞から死滅していき、代謝率の低い軟骨細胞のみ生き残るようになる。これによって軟骨細胞のみに純粋な分離が可能となる。
【0024】
本発明による作製方法の段階(2)では、このように分離された弾性軟骨を継代培養して増幅させる。この段階において、培地としては当業界で公知された任意の軟骨細胞増殖用培地を使用してもよいが、このような培地にはコラーゲン合成に必要なアスコルビン酸を必修的に添加し、その他増殖因子であるFGF(Fibroblast Growth Factor)、HGF(Hepatocyte Growth Factor)、IGF(Insulin−like Growth Factor)等は必要に応じて添加する。本発明においては、弾性軟骨細胞を約4週間の繰り返しの継代培養によって15,000から130,000倍以上増幅できるCBM(CAMBREX.Co.)、CGM SingleQuots(CAMBREX.Co.)及びアスコルビン酸で調整された培地を利用するのが好ましい。培養を継続して約90%のコンフルエンシーに到達するとトリプシン・EDTAを処理して増幅させた軟骨細胞を剥がし、新しい培地で継代培養を行う。本発明において継代培養は3回以下に制限するのが好ましいが、これは、繰り返しの継代培養によって軟骨細胞は、特に第4回目の継代を超えると脱分化(de−differentiation)して本来の性質を失ってしまい、軟骨細胞から分泌する細胞外基質のコラーゲンのタイプがIIからIに変化する等の繊維芽細胞様(fibroblast−like)に変化するためである。上記の条件化で軟骨細胞を約4週間(すなわち、継代回数4回以前まで所要する時間)培養すると少なくても15,000倍以上増幅できる。
【0025】
本発明による作製方法の段階(3)では、弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させる。この段階において、移植物が十分にカプセル化できるように過量の弾性軟骨を添加する必要がある。細胞は本来お互いに接着しようとする性質を持ち、さらに振とう運動を伴うため、人為的に細胞と細胞の間の接触の機会が増加するようになる。従って、移植物を中心として多数の弾性軟骨が迅速に接着するようになり、マイクロ粒子が成長するようになる。特に、軟骨細胞は、高密度で存在するとそのサイズを維持しながら本来の軟骨組織により類似する状態に戻る。すなわち軟骨細胞は固有の細胞外基質であるコラーゲンのタイプIIを豊富に産生して分泌するようになり、結果的には体内存在時のように細胞数は比較的に少なく細胞外基質は豊富な正常軟骨と同様な性質を表すようになる。
【0026】
前記の段階(3)において、培地はインスリン放出分析用培地を利用できるが、前記の培地は、グルコースの含量が0.8mg/mlから1.2mg/mlになるように、RPMIグルコース(−)培地及び/又はHam′s F−12培地にグルコース、熱により不活化されたFBS、HEPES、アスコルビン酸、抗菌剤、抗真菌剤を追加して調整するのが好ましい。振とう培養は立体8字型、平面円形又は平面左右型に移動可能な振とう培養用シェーカーを利用して振動の強度を60から80rpmに設定し、3日から10日間かけて個体の体温と同一な温度の環境で行うことが好ましい。培養容器として、前記の培養容器の表面に細胞が接着できないように考案された非接着性培養皿(すなわち浮遊培養用皿)又はスピナーフラスコ(Spinner flask)を使用する。例えば、約37Lにて親水性になり、細胞が一切接着しないHydroCellTM培養皿(CellSeed.Co.)以上の作業で150から800μmのマイクロ粒子の作製ができる。
【0027】
本発明による作製方法の段階(4)では、移植物が弾性軟骨によりカプセル化されたマイクロ粒子を分離する。前記の段階(3)において振とう培養が3日から10日間経過すると培養皿内に多様なサイズのマイクロ粒子が存在するようになる。これらを単純に分離する及びサイズ別に分離するために、一の態様においては、滅菌処理されたマイクロピペットを用いて、位相差顕微鏡下にて観察しながらマイクロピペットでマイクロ粒子を吸入し、新たな培養皿(浮遊培養用皿)に置き換える方式が利用できる。このとき、培養皿を円運動させ遠心力により、マイクロ粒子を中心に集まるようにしてマイクロピペットのチップ(Tip)を利用して培養液と同時に吸入させるとチップの直径より小さいマイクロ粒子吸入することができる。このように分離したマイクロ粒子はインスリン放出分析用培地に入れて保管することができる。
【0028】
以下記述の実施例、ただ、本発明をより具体的に説明するが、本発明の要旨により本発明の範囲がこれらの実施例によって制限されるものではないことは本発明が属する技術分野で通常の知識を持つ者には自明することである。
【実施例1】
ラットの膵島細胞がイヌ又はラットの軟骨細胞によってカプセル化されたマイクロ粒子の作製及びインスリン放出可否の分析
【0029】
1−A.軟骨細胞の分離及び培養
イヌ(Beagle、12〜24ヵ月齢)又はラット(Brown Norway Rat、350±50g)から耳の耳道と耳介を含む弾性軟骨を採集し、皮膚組織、皮下組織、筋肉組織、軟骨膜、その他の結合組織を除去した後時計皿の上に位置させ、手術用の曲刃を利用してチョッピングし、細切した。そして、0.3%(イヌの場合)又は0.15%(ラットの場合)コラゲナーゼII(collagenase class II:Worthington,Biochemical Co.)及び0.25%トリプシン(Invitrogen Co.)をHam′s F−12培地(Gibco.Co.)、熱により不活化された10%のFBS(ウシ胎児血清)、HEPES、4%の抗菌剤/抗真菌剤混合物(10,000units/mlのペニシリンG、10,000μg/mlのストレプトマイシン硫酸塩及び25μg/mlのアムホテリシンB:Invitrogen Co.)及び50μg/mlのアスコルビン酸で調整した培地に溶解した消化溶液を調整した。イヌ又はラット由来の弾性軟骨は前記の消化溶液で処理し、37℃の恒温水槽にて振とうしながらオーバーナイト(overnight)間消化させて弾性軟骨が単一細胞になりよう分離した。このようにして得られた細胞懸濁液は70μm及び40μmのナイロン製cell−strainer(BD FalconTM:BD Biosciences)で連続的に通過させた後、前記の4%の抗菌剤/抗真菌剤混合物を含有したリン酸幹緩衝液(Invitrogen Co.)を用いて2回洗浄した。
【0030】
このような過程によって得られた単一細胞は軟骨細胞の個数を増幅させるため、増殖用培地に播種し培養した。イヌの場合には、0.5×104で播種し、続いて継代培養に0.25×104で播種した。一方、ラットの場合には、1.0×104で播種し、続いて継代培養に0.5×104で播種した。ここで増殖培地としてCBM(CAMBREX.Co.)、CGM SingleQuots(CAMBREX.Co.)及び50μg/mlのアスコルビン酸で調整された培地を利用し、90%のコンフルエンシーに到達したとき、トリプシン・EDTAを処理して増幅させた軟骨細胞を培養皿から剥がした。
【0031】
1−B.膵島細胞の分離
ラット(Brown Norway Rat及びLewis Rat、350±50g)から膵臓を摘出し、熱により不活化された10%のFBS(JRH Biosciences)及び10mmol/lのHEPESを含有するHanks’Balanced Salt溶液(HBSS:Gibco.Co.)で、コラゲナーゼを2mg/mlの濃度にして添加したコラゲナーゼP(Collagenase P:Roche.Co.)溶液を準備した。これを利用してラットの膵臓を消化させて、Histopaque(Sigma Co.)を利用する濃度勾配法によって純化させ回収した。このように分離した膵島細胞は位相差顕微鏡下にて観察し、その結果を図1に示した。
【0032】
1−C.軟骨細胞による膵島のカプセル化
実施例1−Aによって、イヌの場合には3回の継代培養にて得られた軟骨細胞を、ラットの場合には、1回の継代培養にて得られた軟骨細胞は各々インスリン放出分析用培地を用いて5mlに再懸濁し、軟骨細胞数を1,500×104/5ml調節した。このような軟骨細胞と実施例1−Bによって取得した膵島細胞を混合し、培養容器としては直径60mmのHydroCellTM培養皿(CellSeed.Co.)を使用し、振とう培養用シェーカー(モデル名:NA−201、Nissin Co.)を利用して70rpmの振動を加えながら37℃で7日間培養した。ここで、インスリン放出分析用培地は、50%のHam′s F−12培地(Gibco.Co.)、25mmol/lのHEPESを含有した50%のRPMI−1640(Invitrogen Co.)、前記の1%の抗菌剤/抗真菌剤混合物、熱により不活化された10%のFBS、D−(+)−グルコースを添加してグルコースの濃度が1.0mg/mlになるように調整されたものである。このように培養すると培養開始後12時間からマイクロ粒子は肉眼的に観察でき、収得したマイクロ粒子を位相差顕微鏡下にて観察し、その結果を図2に示した。
【0033】
1−D.組織学的な観察結果
実施例1−Cにおいて、7日間振とう培養して収得したマイクロ粒子は4%パラホルムアルデヒドで固定した。リン酸幹緩衝液(PBS、Invitrogen Co.)で洗浄した後15%及び20%のスクロースを含有したPBSで浸清させた。続いて、マイクロ粒子OCT混合物(Sakura Finetechnical Co.Ltd.)で包埋して直ちに凍結し、5μmの厚さで薄切りしてH&E染色を行い、その結果を図3に示した。
【0034】
1−E.インスリン分泌量の測定
マイクロ粒子は7日間の作製期間を除いた約2週間にかけてインスリン分泌量を測定した。サイズ200μm以上のマイクロ粒子(マイクロ粒子大)とサイズ200μm以下のマイクロ粒子(マイクロ粒子小)に分けて行った。マイクロ粒子は通常の培養皿に位置させ、実施例1−Cにて利用したインスリン放出分析用培地を添加し、37℃、5%CO2の条件下で静置した後、24時間おきに培養液を採集してIMXTMイ

インスリン量を測定した。インスリン量は総13日間測定した。
【0035】
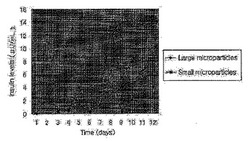
インスリン分泌量の測定結果、図4Aに示したように13日間マイクロ粒子からインスリン分泌が確認でき、8日以降のインスリンの分泌量は増加の傾向を表した。また、3日を経過した時点からは、サイズ200μm以下のマイクロ粒子(マイクロ粒子小)がサイズ200μm以上のマイクロ粒子(マイクロ粒子大)より優れたインスリン分泌作用を有することを確認した。
【0036】
一方、実施例1−Aによって取得したイヌ由来の弾性軟骨細胞300×104/mlと実施例1−Bによって取得した膵島細胞を混合し、実施例1−Cによって得られたマイク

0mmの浮遊細胞用の培養皿の上に位置させ、実施例1−Cにて利用したインスリン放出分析用培地を添加し、37℃、5%CO2の条件下で静置した後、72時間おきに培

インスリン量を測定した。インスリン量は培養第3日目から培養第102日目まで、72時間おきに測定した。
【0037】
このように長期間のインスリン分泌量の測定結果を図4Bに示したが、102日間においてマイクロ粒子からインスリンが分泌することが確認できた。すべての測定期間において、第1測定日である培養第3日目のインスリン量よりは減少の推移を表すが、その程度は穏やかであると判断できる。通常の膵島単独培養において一般的な培養条件化では2週間程度の生存とインスリン分泌が可能であることと比べると画期的に膵島のインスリン分泌能と培養成績を改善したと示唆される。
【実施例2】
ラットの膵島細胞がラットの軟骨細胞によってカプセル化されたマイクロ粒子の作製及び免疫隔離可否の分析
【0038】
2−A.ラットの準備
膵島は、成体雄ラット(Lewis Rat、300±50g)から、耳介軟骨組織は雄ラット(Brown Norway Rat、250±50g)(SLC Japan Co.)から取得した。すべてのラットはメデトミジン(medetomidine、100μg/kg)とミダゾラム(midazolam、0.5mg/kg)の混合物を筋肉内に注射した。麻酔はケタミン(ketamine HCL、40mg/kg)を筋肉内注入して維持した。以上の実験動物の管理及び利用は東京大学大学院農学生命科学研究科の指針に従い行われた。
【0039】
2−B.膵島細胞の分離及び培養
熱により不活化された5%のFBS(JRH Biosciences)及び10mmol/lのHEPESを含有する冷たいHanks’Balanced Salt溶液(HBSS:Gibco.Co.)で、コラゲナーゼを2mg/mlの濃度にして添加したコラゲナーゼP(Collagenase P:Roche.Co.)溶液を準備した。その後、膵臓総胆管にカニューレション(cannulation)し、上記の溶液を注入して膵臓を膨張させた。膨張した膵臓は振とう恒温水槽にて37℃で16分間消化させた。消化物は600μmの鋼鉄製mesh filterを通過させた後Histopaque(Sigma Co.)を利用する濃度勾配法によって純化させ回収した。その後、50%のHam′s F−12培地(Gibco.Co.)、25mmol/lのHEPESを含有した50%のRPMI−1640(Invitrogen Co.)、1%の抗菌剤/抗真菌剤混合物(10,000units/mlのペニシリンG、10,000μg/mlのストレプトマイシン硫酸塩及び25μg/mlのアムホテリシンB:Invitrogen Co.)、50μg/mlのアスコルビン酸(Sigma Co.)、熱により不活化された10%のFBS、D−(+)−グルコースを添加してグルコースの濃度が1.0mg/mlになるように調整されたインスリン放出分析用培地を用いてオーバーナイト間培養した。
【0040】
2−C.耳介軟骨細胞の分離及び培養
ラット(Brown Norway Rat)から耳介軟骨を採集し、皮膚組織、皮下組織、筋肉組織、及び軟骨膜等を除去した後時計皿の上に位置させ、手術用の曲刃を利用してチョッピングし、細切した。そして、0.15%コラゲナーゼII(collagenase class II:Worthington,Biochemical Co.)及び0.25%トリプシン(Invitrogen Co.)をHam′s F−12培地(Gibco.Co.)、熱により不活化された10%のFBS、HEPES、前記の4%の抗菌剤/抗真菌剤混合物及び50μg/mlのアスコルビン酸で調整した培地に溶解した消化溶液を調整した。弾性軟骨は前記の消化溶液で処理し、37℃の振とう恒温水槽にて処理した。このようにして得られた細胞懸濁液は70μm及び40μmのナイロン製cell−strainer(BD FalconTM:BD Biosciences)で連続的に通過させた後、前記の4%の抗菌剤/抗真菌剤混合物を含有したリン酸幹緩衝液(Invitrogen Co.)を用いて2回洗浄した。
このような過程によって得られた細胞は、CBM(CAMBREX.Co.)、CGM SingleQuots(CAMBREX.Co.)及び50μg/mlのアスコルビン酸で調整された培地を利用して、湿らされた空気の37℃、5%CO2の条件下で培養した。培養を開始するとき、1.0×104/cm2で播種し、続いて継代培養に0.5×104/cm2で播種した。培地は1週間で2回交換した。継代培養は1回に制限し、継代培養後に、90%のコンフルエンシーに到達したとき、トリプシン・EDTAを処理して増幅させた軟骨細胞を培養皿から剥がして後述のカプセル化に用いた。
【0041】
2−D.軟骨細胞による膵島のカプセル化
実施例2−Bによって、培養された膵島細胞を培養皿(60mm、HydroCellTM:CellSeed.Co.)培養皿の上に位置させ、実施例2−Cによって、培養された軟骨細胞を、インスリン放出分析用培地を用いて1,500×104/5ml再懸濁した後、添加して振とう培養した。振とう培養用シェーカー(NA−201、Nissin Co.)は水平運動を加えるために使用し、速度は70rpmに設定した。この条件化で6日間かけて軟骨細胞によってカプセル化されたマイクロ粒子が完成した。一方、対照群として前述の過程によって、軟骨細胞を添加せずに膵島細胞のみ振とう培養した膵島細胞(以下‘ヌード膵島細胞’と称する。)を作製した。培養期間ごとに収得したマイクロ粒子を位相差顕微鏡下にて観察し、その結果を図5に示した。図5のAは培養開始時点、Bは30時間経過後、Cは51時間経過後、Dは99時間経過後である。膵島を中心として耳介軟骨細胞が付着し、時間が経つにつれて、マイクロ粒子の輪郭が徐々に滑らかになるのを確認した。培養開始後125時間を経過したマイクロ粒子を位相差顕微鏡下にて観察し、その結果を図6のA(40倍拡大)及びB(100倍拡大)に示した。サイズが小さいマイクロ粒子の場合は、直径が250±100μm、サイズが大きいマイクロ粒子の場合は、直径が600±200μm程度であった
【0042】
2−E.組織学的な観察結果
実施例2−Dにおいて、6日間振とう培養して収得したマイクロ粒子は4%パラホルムアルデヒドで固定した。リン酸幹緩衝液(PBS、Invitrogen Co.)で洗浄した後15%及び20%のスクロースを含有したPBSで浸清させた。続いて、マイクロ粒子OCT混合物(Sakura Finetechnical Co.Ltd.)で包埋して直ちに凍結し、5μmの厚さで薄切りしてH&E染色を行い、その結果を図7Aに示した。
【0043】
また、前記のマイクロ粒子は3−amino−9−ethylcarbazole(AEC)substrate−chromogen solution(DAKO Japan Co.,Ltd.)を使用してavidin−biotin−peroxidase complex technique(LSAB 2 kit/HRP,DAKO JapanCo.,Ltd.)のプロトコールに従ってインスリンに対して免疫組織化学染色を実施した。その結果を図7Bに示したが、濃く染色されるインスリンが存在することが確認できた。これは、マイクロ粒子の内部に存在する膵島細胞が本来の機能であるインスリン分泌能を維持していることを意味する。
【0044】
さらに、前記のマイクロ粒子に封入させた生存の膵島を可視化するため、dithizone染色を行い、その結果を図7Cに示した。dithizoneは膵臓のβ細胞に選択的に結合するが、マイクロ粒子内部の特に濃く染色される部分が存在した。この結果はマイクロ粒子内部に膵島細胞が封入されていることを明確に示している。
【0045】
2−F.マイクロ粒子の免疫隔離能に対する試験管内評価

Costar,Corning,NY.U.S.A.)に入れ、12wellに位置させた。対照群(ヌード膵島細

【0046】
一方、1匹の健康なイヌ(Beagle、雄、15.5kg、6歳齢)由来のイヌの血清を収得し、直ちに−80度で凍結させて試験の前まで保管した。補体依存性細胞毒性を評価するため2種類の培地を用いた。すなわち、インスリン放出分析用培地に熱により不活化された10%のFBSの代わりに10%のイヌの血清(以下‘MCM−Dog培地’と称する。:異種補体含有)及び10%のLewisの血清(以下‘MCM−Lewis培地’と称する。:同種補体含有)を各々添加した培地を利用した。異種群(n=6)に分類されたマイクロ粒子はMCM−Dog培地で培養し、同種群(n=6)に分類されたマイクロ粒子はMCM−Lewis培地で培養し、ヌード群(n=6)は対象群(ヌード膵島細胞)として、MCM−Lewis培地で培養した。72時間かけて培養した後インスリン含量を測定することで間接的に補体の活性を評価した。72時間間隔で各々の培養液から上澄液を分離してこれら

)を利用して分析を行った。
【0047】
測定インスリン量は、図8に示した。ヌード群のインスリン放出は培養第9日目に193.3μU/mlから21.5μU/mlに、培養第18日目には2.4μU/mlに著しく低下した。異種群の場合では、減少の傾向を示したが、試験期間(40日間)にかけて一定に維持でき、培養第12日目以降は多少増加の傾向を示した。
【0048】
補体依存性細胞毒性に対する試験管内評価はインスリン分泌量の百分率に基づいて評価した。転換率は以下の式によって計算した。:(特定日のマイクロ粒子又はヌード膵島細胞からのインスリン分泌量)/(インスリン測定開示日のマイクロ粒子又はヌード膵島細胞からのインスリン分泌量)×100。その結果を図9Aに示した。ヌード群の場合、培養第9日目のインスリン放出はインスリン測定開始日の11.1%、培養第18日目には1.3%まで著しい減少を示した。異種群の場合、減少の傾向を示したが、試験期間(40日間)にかけてインスリン測定開始日の20%の値を一定的に維持できた。同種群の場合、放出量は穏やかな減少傾向を示した。これらの結果は異種の補体がマイクロ粒子に対して細胞毒性活性が一切無かったことを意味する。
【0049】
一方、異種間の補体依存性細胞毒性をより厳格に評価するため、上記と異なる2種類の培地を用いた。すなわち、インスリン放出分析用培地に熱により不活化された10%のFBSの代わりに熱による不活化処理を行わないイヌの血清50%(以下‘XENO−COM培地’と称する。:異種補体含有)及び熱による不活化されたイヌの血清50%(以下‘XENO−HI培地’と称する。:異種の補体は活性を失い、異種間の免疫拒絶反応を引き起こさない。)を各々添加した培地を利用した。マイクロ粒子は各々の培養液にて培養し、インスリンの含量を測定することで間接的に補体活性を評価した。24時間間隔で各々の培養液から上澄液を分離してこれらの試料中のインスリン量を免

【0050】
異種間の補体依存性細胞毒性をより厳格に評価した結果は、図9Bに示した。添加した異種血清に対する熱による不活化の有無に関係なくインスリン分泌量は一定の水準を維持した。この結果は、再び異種の補体がマイクロ粒子に対して細胞毒性活性が一切無かったことを意味する証拠である。
【0051】
すなわち、本発明により作製したマイクロ粒子を移植した場合、異種間の移植においても移植患者側の免疫拒絶反応によって破壊されないことを意味する
【産業上の利用可能性】
【0052】
本発明のマイクロ粒子は受領する個体由来の軟骨細胞で作製されているため、受領する個体の免疫機構は非自己(non−self)と認識せず自己(self)であると認識することは勿論、軟骨細胞によって細胞及び補体等の免疫に関わる分子の浸透が処断され免疫拒絶反応は防止でき、栄養分と気体の拡散は円滑であり、移植物の本来の機能を長期間の維持ができる。また、本発明のマイクロ粒子を用いて移植手術を行うと免疫拒絶反応を引き起こさないことから、終生の免疫抑制剤投与が不要となり、免疫拒絶反応のコントロールができる。さらに、異種臓器も利用可能となり臓器提供者の不足の問題を克服し、解決できる。
【図面の簡単な説明】
【0053】
【図1】本発明の一の態様において、膵島細胞が弾性軟骨によってカプセル化される前段階の状態を示す位相差顕微鏡像の図である。
【図2】本発明の一の態様において、膵島細胞が弾性軟骨によってカプセル化された後の状態を示す位相差顕微鏡像の図である。
【図3】本発明の一の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子のH&E染色を用いた組織学的な観察結果を示す図である。
【図4A】本発明の一の態様において、膵島細胞が弾性軟骨によってカプセル化されたサイズ200μm以下のマイクロ粒子(マイクロ粒子小)とサイズ200μm以上のマイクロ粒子(マイクロ粒子大)の時間経過によるインスリン分泌推移を示すグラフである。
【図4B】本発明の一の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子の長期間のインスリン分泌推移を示すグラフである。
【図5】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されていく過程を示す図である。
【図6】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子を示す図である。
【図7A】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子のH&E染色を用いた組織学的な観察結果を示す図である。
【図7B】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子のインスリンに対する免疫組織化学染色の結果を示す図である。
【図7C】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子の、dithizone染色の結果を示す図である。
【図8】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子の時間経過によるインスリン分泌推移を示すグラフである。
【図9A】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子の免疫隔離効果に対する分析結果を示すグラフである。
【図9B】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子の免疫隔離効果に対する分析結果を示すグラフである。
【技術分野】
【0001】
本発明は、自家由来の弾性軟骨を用いてカプセル化した移植物及びその作製方法に関するもので、移植物が、前記移植物を受領する個体由来の弾性軟骨によってカプセル化された移植用マイクロ粒子及び移植物を受領する個体由来の弾性軟骨を分離して前記の分離された弾性軟骨を継代培養して増幅させた後、弾性軟骨と移植物を混合し、振とう培養(Shaking culture)することで、移植物を中心として弾性軟骨を接着させるようにし、移植物が弾性軟骨によりカプセル化されたマイクロ粒子を分離する移植用マイクロ粒子の作製方法に関する。
【背景技術】
【0002】
膵島移植は、重症のインスリン依存性1型糖尿病に対する新治療方法である。インスリン投与のみでは解決できない腎不全、網膜症をはじめ神経障害、足部潰瘍等の続発症等の後遺症なく治療が可能であることから根治療法として注目され、最近では、臨床施術の報告が世界的に毎年増加しつつある。
【0003】
しかしながら、臓器提供者の不足、手術後移植片に対する免疫拒絶反応のコントロールなど未だ解決すべき問題点が多い。現行では、終生の免疫抑制剤投与を必要とするが、これも患者の経済的な負担が多く、免疫抑制剤自体がもつ様々な副作用、特に、免疫抑制剤が膵島に直接的に与える有害な影響は重大な問題点として挙げられる。
【0004】
このような欠点を克服するために免疫隔離法(Immunoisolation)が開発された。免疫隔離法とは、理想的な膜を利用してO2及びCO2等の気体、グルコース、アミノ酸等の栄養分及びホルモン等の小さな物質は自由に拡散できるが、免疫担当細胞を含む免疫系の物質は通過できないように包む方法である。このような技術を用いることで移植患者において免疫拒絶反応を引き起こずに移植が可能になる。
【0005】
免疫隔離法の開発初期では、臓器及び組織を包む膜の材料としてアガロース、アルギン酸ナトリウム、ゼラチン、poly(L−lysin)、HEME−MMA、polyvinyl alcohol、polyglycolic acid、polytetrafluoroethylene高分子のように人工的に合成された物質が使われてきた。しかしながら、このような合成物質等は生体内適合性及び耐久性が衰え、材料自体が引き起こす異物反応が原因で実際上臨床適用が不可能であるという問題点がある。
【0006】
人工的に合成された物質の代替として選択した物質が軟骨細胞である。軟骨組織は正常状態では血管、神経、リンパ管が分布しておらず、白血球等の炎症細胞の侵入が不可能である。特に、弾性軟骨は曲げても間もなく元の形に戻る柔軟性と弾力性に優れる。このような性質は細胞や組織等をカプセル化する膜として役割を果たすのに有利である。特に、軟骨組織は加齢に伴う硬化もない。これはコラーゲン、エラスチン、プロテオグリカン等が多量に存在するためだけでなく、コラーゲン線維が非還元性架橋物質であるピリジノリン(pyridinoline)やヒスチジノアラニン(histidino−alanine)によって成熟、安定化されているためと知られている。
【0007】
膵島を膝関節由来の軟骨でカプセル化した技術が開示されている(特許文献1参照。)。しかしながら、この方法は生分解性ポリグリコール酸ポリマーを利用し、移植に必要な膵島を結集させた後、軟骨膜に入れる方式を採択しており、相変らずポリマーのような人工物質を使用しているため異物反応が誘発し得る。特に、上記の方法において軟骨は単層でごく弱いためポリマーのみならず膵島も薄い軟骨の膜を通過して露出してしまう可能性が高いことから深刻な異物反応と免疫拒絶反応が予想される。ここでの培養軟骨膜を利用してのカプセル化は、単純に別途の加わる力なしで(例えば、後述のシート形式の人工膵島開発のとき、カプセル化を促すため駆使した方式である重りで抑える方式及び接着因子が回収過程にシートと同時に離れてくるなどのこと)回収した軟骨膜で膵島を包んでカプセル化を待つ方式であり、膵島を緊密に結合させることが不可能であり、また、単層の軟骨膜を回収するために実験者が使用した細胞スクレーパー(cell scraper)でコンフルエンシーの培養軟骨膜を人為的に剥がすがこのような過程は、脆弱な単層の膜と軟骨細胞が産生したコラーゲンマトリックスをより悪く損傷させる原因となる。さらに膝由来の軟骨を用いたが、これは膝に深刻な後遺症を残すため、臨床への適用が事実上困難である。
【特許文献1】WO 96/40887広報
【0008】
以上のことを考慮して、軟骨組織を収得する臓器は膝より耳の軟骨を選り好むようになった。特に耳由来の軟骨(弾性軟骨)は、美容成形外科において隆鼻術の自家移植材料として採択されており、軟骨採集後は美容的にも傷痕が残らないことからその安全性と容易さは既に確認されたといえる。しかしながら、ラットを含むげっ歯類は弾性軟骨原である耳介及び耳道はごく小さいため、げっ歯類を用いた動物実験はほぼ不可能である。イヌの弾性軟骨は比較的に大きいため、ラットよりは容易に純粋な軟骨組織を採ることできることからイヌを利用した動物実験が進んでいる。しかしながら、動物実験はげっ歯類を利用して基本的な実験を行った後、その実験結果を踏まえて大動物であるイヌを対象として実験することが一般的である。特に、イヌを用いる実験はラットを用いた実験より長期間がかかり、正確かつ迅速な実験を進行させることが困難である。
【0009】
一方、本発明者はイヌの耳から採集した軟骨細胞を培養し、シート状にした後、これらのシートとシートの間に他のイヌ又はげっ歯類から分離した膵臓細胞を挟み込ませて、軟骨細胞とこれから分泌されるコラーゲンによって封入するようにした細胞シート工学(cell sheet engineering)によるマクロカプセル化(macroencapsulated)人工膵島を開示した。しかしながら、げっ歯類の場合、培養を繰り返して継代培養していくと、軟骨細胞以外に線維芽細胞の混入が顕著となり、シート状に作製できなくなる。また、線維芽細胞が細胞間の結合を部分的に弱めてしまい、回収段階のシートに孔の欠損部を生じやすくする。さらに、線維芽細胞は、軟骨細胞を増幅培養する過程において軟骨細胞より活発に分裂するため、軟骨細胞の純度を落とす問題点がある。従って、げっ歯類由来の軟骨細胞は、シート状の作製が困難であるためイヌから軟骨を採集して利用した。どころで、このような人工膵島の作製過程においては軟骨シートを何枚か積層化するなど作製方法が複雑で所要時間も多くかかる。特に単層の軟骨シートは取り扱いのとき、孔の欠損部を生じることやシートのシワができやすいことやシートのふちが丸まるなどの技術的な困難さで熟練の技術を必要とする。シートを積層化する過程では、重さのある重りをシート上に位置させ荷重をかけるが、この操作は、内部に位置する膵島にも直接影響を与えるので加重は膵島の形状を平たくする。平たくなる膵島は機能上障害をみせ、インスリンの産生と放出の機能を衰えさせる。また、軟骨細胞シートを利用して人工臓器を作製する過程は持続的に温度を37℃で維持する必要があり、この条件を満たすためには、培養液の交換する段階及び顕微鏡にて観察する段階でも温度を37℃以下にならないようにする必要がある。また、このように収得した人工臓器はサイズが大きいので生体に直接移植する場合、その大きさに合わせての切開を要求する問題点などがある。
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明者は臨床へ効率的かつ実質的に利用可能な免疫隔離された移植物を提供するため、移植物を受領する個体由来の弾性軟骨を分離し、分離された弾性軟骨を継代培養して増幅させた後、弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させるようにし、移植物が弾性軟骨によりカプセル化されたマイクロ粒子を作製方法して、前記のマイクロ粒子は受領する個体由来の軟骨細胞で作製されているため、受領する個体の免疫機構は非自己(non−self)と認識せず自己(self)であると認識することは勿論、軟骨細胞によって細胞及び補体等の免疫に関わる分子の浸透が処断され免疫拒絶反応は防止でき、栄養分と気体の拡散は円滑であり、移植物の本来の機能を長期間の維持ができることを確認して本発明を完成した。
【課題を解決するための手段】
【0011】
本発明の一観点によれば、移植物が、前記移植物を受領する個体由来の弾性軟骨によってカプセル化された移植用マイクロ粒子を提供することである。
【0012】
本発明の他の観点によれば、(1)移植物を受領する個体由来の弾性軟骨を分離する段階;(2)このように分離された弾性軟骨を継代培養して増幅する段階;(3)弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させる段階;及び(4)移植物が弾性軟骨によりカプセル化されたマイクロ粒子を分離する段階を含む移植用マイクロ粒子の作製方法が提供される。
【発明の効果】
【0013】
本発明のマイクロ粒子は、受領する個体由来の軟骨細胞で作製されているため、受領する個体の免疫機構は非自己(non−self)と認識せず自己(self)であると認識することは勿論、軟骨細胞によってコーティングされているため、細胞及び補体等の免疫に関わる分子の浸透が処断され免疫拒絶反応は防止でき、栄養分と気体の拡散は円滑であり、移植物の本来の機能を長期間維持することができる。
【発明を実施するための最良の形態】
【0014】
本発明は、移植物が前記移植物を受領する個体由来の弾性軟骨によってカプセル化された移植用マイクロ粒子に関する。
【0015】
本発明において、“移植物(transplant)”とは、移植対象臓器及び組織から由来の細胞を意味するが、移植対象の臓器及び組織を細切して収得したマイクロ単位の切片であってもよい。本発明において移植物は細胞単位であるため、特定の機能(例えば、ホルモン分泌)を新たに獲得して保有するものでも本来保有していた特定の機能がさらに増進するように遺伝的に変形された細胞であってもよい。
【0016】
本発明において、移植物の形態は特に制限はない。一の態様においては、移植物が内分泌機能を担当する細胞である場合特定疾病を治療する卓越な効果が期待でき好ましい。一例として移植物が膵臓由来である場合は糖尿病を治療し、移植物が甲状腺由来である場合は甲状腺機能低下症を治療に利用することが可能である。他の例として移植物がエリスロポエチンを分泌する細胞、成長ホルモンを分泌する細胞及び血液凝固因子を分泌する細胞である場合には、各々貧血、小人症、血友病の治療に用いることができる。
【0017】
本発明において移植物は膵臓の膵島細胞(インスリン、グルカゴン等のホルモンを分泌し、血糖を調節する細胞)が好ましいが、これは、軟骨細胞と膵島細胞が相互補完的な関係があるためである。すなわち、軟骨細胞が分泌するコラーゲンマトリクスは膵島細胞に対して保護作用を果たし、膵島が分泌するインスリンは軟骨細胞に対して成長因子として働く。
【0018】
このような移植物をカプセル化する“弾性軟骨”は前記移植物を受領する個体の耳から分離(isolated)された軟骨を意味する。軟骨細胞は生体の様々な部位に存在するが、耳に存在する軟骨細胞は他の部位に存在する軟骨細胞と比べ、比較的に容易に分離及び増殖ができ、生体の機能異常等の後遺症を起こさずに傷跡も残らない点でも優れている。
【0019】
本発明において、移植物は、まずはこれを中心として接着した弾性軟骨によってカプセル化されるが、接着した弾性軟骨がコラーゲンを分泌するため実際にはコラーゲンでできた膜によってカプセル化されたとみなすことができる。このような膜には微細な隙間が多数形成されており、この隙間の孔のサイズは50nmから200nmであり、十分に小さいためこの孔を通って免疫反応に関与する細胞及び補体等の免疫に関わる分子は移動不可能であるが、O2及びCO2等の気体、グルコース、アミノ酸等の栄養分及び移植物が分泌する物質(例えば、ホルモン)等は移動可能である。従って、免疫拒絶反応を引き起こさずに 移植物の本来の機能は発揮できる。
【0020】
移植物が弾性軟骨によってカプセル化された“マイクロ粒子”はそのサイズが150から800μm範囲のものを治療に用いるのが好ましい。マイクロ粒子のサイズが約200μm程度で、より小さいものが好ましが、これは移植物が比較的に厚みの薄い弾性軟骨によってカプセル化されることで、気体及び栄養分の拡散がより円滑にでき、移植物の寿命が延長でき、増殖促進することで移植物の本来の機能を発揮するのにさらに有益に働くためである。しかしながら、マイクロ粒子のサイズが150μmよりも小さい場合は、内部に移植物が封入されない弾性軟骨のみの塊である可能性が高いため注意を要する。
【0021】
本発明は、(1)移植物を受領する個体由来の弾性軟骨を分離する段階;(2)このように分離された弾性軟骨を継代培養して増幅させる段階;(3)弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させる段階;及び(4)移植物が弾性軟骨によりカプセル化されたマイクロ粒子を分離する段階を含む移植用マイクロ粒子の作製方法に関する。
【0022】
本発明による作製方法の段階(1)では、移植物を受領する個体由来の弾性軟骨を分離する。まず、移植物を受領する個体から耳の耳道と耳介を含む弾性軟骨を採集し、皮膚組織、皮下組織、筋肉組織、軟骨膜(perichondrium)、その他の結合組織を除去した後ホモゲナイザー、乳鉢等の粉砕機、ブレンダー、手術用メス、注射器、鉗子、超音波装置等のような物理的な手段でチョッピング(chopping)し、細切する。このとき、弾性軟骨を、時計皿(watch glass)の上に位置させ、手術用の曲刃(curved scissors)を利用してチョッピングするのが好ましい。手術用の曲刃は曲がっているため、凹面の時計皿との密着した接触が容易に得られ、連続する手術用の曲刃による切断運動は時計皿を回転させるようになる。このような円運動は弾性軟骨を中心に集まるようにし、弾性軟骨に強力な手術用の曲刃の切断運動が持続的な作用が可能となり、結果的には短時間でより細かいサイズに細切することができる。弾性軟骨が可能な限り細切されると以降の段階にて消化酵素との接触する断面積がより広くなるため消化もより効率的に行われることから消化時間も短縮できる。
【0023】
チョッピング作業により細かく細切した後は、中性プロテアーゼ、トリプシン、セリンプロテアーゼ、エラスターゼ及びコラゲナーゼ等の中から選択した少なくても一つの蛋白分解酵素で処理して、個体の体温と同一な温度にてオーバーナイトから3〜5日間の長期間においての振とうしながら消化させる。本発明において蛋白分解酵素を処理する温度と時間は蛋白分解酵素の種類及び個体の種等によって異なるが、個体の弾性軟骨が少量である場合、純粋な軟骨細胞を収得するためには消化酵素の処理時間をより長期間維持するのが好ましい。その理由は以下のように説明できる。蛋白分解酵素によって消化させる過程おいて軟骨細胞は、その他の細胞(筋肉細胞、線維芽細胞等)と同時に蛋白分解酵素によって単一細胞として分離される。本発明の消化過程においては、振とう運動を伴うため前記の分離された単一細胞は浮遊状態で維持される。しかしながら、浮遊状態とは培養過程中において培養皿の底に付着しないと増殖できない付着細胞としては、不利な条件であり、時間が経過するとともに代謝率の高い細胞から死滅していき、代謝率の低い軟骨細胞のみ生き残るようになる。これによって軟骨細胞のみに純粋な分離が可能となる。
【0024】
本発明による作製方法の段階(2)では、このように分離された弾性軟骨を継代培養して増幅させる。この段階において、培地としては当業界で公知された任意の軟骨細胞増殖用培地を使用してもよいが、このような培地にはコラーゲン合成に必要なアスコルビン酸を必修的に添加し、その他増殖因子であるFGF(Fibroblast Growth Factor)、HGF(Hepatocyte Growth Factor)、IGF(Insulin−like Growth Factor)等は必要に応じて添加する。本発明においては、弾性軟骨細胞を約4週間の繰り返しの継代培養によって15,000から130,000倍以上増幅できるCBM(CAMBREX.Co.)、CGM SingleQuots(CAMBREX.Co.)及びアスコルビン酸で調整された培地を利用するのが好ましい。培養を継続して約90%のコンフルエンシーに到達するとトリプシン・EDTAを処理して増幅させた軟骨細胞を剥がし、新しい培地で継代培養を行う。本発明において継代培養は3回以下に制限するのが好ましいが、これは、繰り返しの継代培養によって軟骨細胞は、特に第4回目の継代を超えると脱分化(de−differentiation)して本来の性質を失ってしまい、軟骨細胞から分泌する細胞外基質のコラーゲンのタイプがIIからIに変化する等の繊維芽細胞様(fibroblast−like)に変化するためである。上記の条件化で軟骨細胞を約4週間(すなわち、継代回数4回以前まで所要する時間)培養すると少なくても15,000倍以上増幅できる。
【0025】
本発明による作製方法の段階(3)では、弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させる。この段階において、移植物が十分にカプセル化できるように過量の弾性軟骨を添加する必要がある。細胞は本来お互いに接着しようとする性質を持ち、さらに振とう運動を伴うため、人為的に細胞と細胞の間の接触の機会が増加するようになる。従って、移植物を中心として多数の弾性軟骨が迅速に接着するようになり、マイクロ粒子が成長するようになる。特に、軟骨細胞は、高密度で存在するとそのサイズを維持しながら本来の軟骨組織により類似する状態に戻る。すなわち軟骨細胞は固有の細胞外基質であるコラーゲンのタイプIIを豊富に産生して分泌するようになり、結果的には体内存在時のように細胞数は比較的に少なく細胞外基質は豊富な正常軟骨と同様な性質を表すようになる。
【0026】
前記の段階(3)において、培地はインスリン放出分析用培地を利用できるが、前記の培地は、グルコースの含量が0.8mg/mlから1.2mg/mlになるように、RPMIグルコース(−)培地及び/又はHam′s F−12培地にグルコース、熱により不活化されたFBS、HEPES、アスコルビン酸、抗菌剤、抗真菌剤を追加して調整するのが好ましい。振とう培養は立体8字型、平面円形又は平面左右型に移動可能な振とう培養用シェーカーを利用して振動の強度を60から80rpmに設定し、3日から10日間かけて個体の体温と同一な温度の環境で行うことが好ましい。培養容器として、前記の培養容器の表面に細胞が接着できないように考案された非接着性培養皿(すなわち浮遊培養用皿)又はスピナーフラスコ(Spinner flask)を使用する。例えば、約37Lにて親水性になり、細胞が一切接着しないHydroCellTM培養皿(CellSeed.Co.)以上の作業で150から800μmのマイクロ粒子の作製ができる。
【0027】
本発明による作製方法の段階(4)では、移植物が弾性軟骨によりカプセル化されたマイクロ粒子を分離する。前記の段階(3)において振とう培養が3日から10日間経過すると培養皿内に多様なサイズのマイクロ粒子が存在するようになる。これらを単純に分離する及びサイズ別に分離するために、一の態様においては、滅菌処理されたマイクロピペットを用いて、位相差顕微鏡下にて観察しながらマイクロピペットでマイクロ粒子を吸入し、新たな培養皿(浮遊培養用皿)に置き換える方式が利用できる。このとき、培養皿を円運動させ遠心力により、マイクロ粒子を中心に集まるようにしてマイクロピペットのチップ(Tip)を利用して培養液と同時に吸入させるとチップの直径より小さいマイクロ粒子吸入することができる。このように分離したマイクロ粒子はインスリン放出分析用培地に入れて保管することができる。
【0028】
以下記述の実施例、ただ、本発明をより具体的に説明するが、本発明の要旨により本発明の範囲がこれらの実施例によって制限されるものではないことは本発明が属する技術分野で通常の知識を持つ者には自明することである。
【実施例1】
ラットの膵島細胞がイヌ又はラットの軟骨細胞によってカプセル化されたマイクロ粒子の作製及びインスリン放出可否の分析
【0029】
1−A.軟骨細胞の分離及び培養
イヌ(Beagle、12〜24ヵ月齢)又はラット(Brown Norway Rat、350±50g)から耳の耳道と耳介を含む弾性軟骨を採集し、皮膚組織、皮下組織、筋肉組織、軟骨膜、その他の結合組織を除去した後時計皿の上に位置させ、手術用の曲刃を利用してチョッピングし、細切した。そして、0.3%(イヌの場合)又は0.15%(ラットの場合)コラゲナーゼII(collagenase class II:Worthington,Biochemical Co.)及び0.25%トリプシン(Invitrogen Co.)をHam′s F−12培地(Gibco.Co.)、熱により不活化された10%のFBS(ウシ胎児血清)、HEPES、4%の抗菌剤/抗真菌剤混合物(10,000units/mlのペニシリンG、10,000μg/mlのストレプトマイシン硫酸塩及び25μg/mlのアムホテリシンB:Invitrogen Co.)及び50μg/mlのアスコルビン酸で調整した培地に溶解した消化溶液を調整した。イヌ又はラット由来の弾性軟骨は前記の消化溶液で処理し、37℃の恒温水槽にて振とうしながらオーバーナイト(overnight)間消化させて弾性軟骨が単一細胞になりよう分離した。このようにして得られた細胞懸濁液は70μm及び40μmのナイロン製cell−strainer(BD FalconTM:BD Biosciences)で連続的に通過させた後、前記の4%の抗菌剤/抗真菌剤混合物を含有したリン酸幹緩衝液(Invitrogen Co.)を用いて2回洗浄した。
【0030】
このような過程によって得られた単一細胞は軟骨細胞の個数を増幅させるため、増殖用培地に播種し培養した。イヌの場合には、0.5×104で播種し、続いて継代培養に0.25×104で播種した。一方、ラットの場合には、1.0×104で播種し、続いて継代培養に0.5×104で播種した。ここで増殖培地としてCBM(CAMBREX.Co.)、CGM SingleQuots(CAMBREX.Co.)及び50μg/mlのアスコルビン酸で調整された培地を利用し、90%のコンフルエンシーに到達したとき、トリプシン・EDTAを処理して増幅させた軟骨細胞を培養皿から剥がした。
【0031】
1−B.膵島細胞の分離
ラット(Brown Norway Rat及びLewis Rat、350±50g)から膵臓を摘出し、熱により不活化された10%のFBS(JRH Biosciences)及び10mmol/lのHEPESを含有するHanks’Balanced Salt溶液(HBSS:Gibco.Co.)で、コラゲナーゼを2mg/mlの濃度にして添加したコラゲナーゼP(Collagenase P:Roche.Co.)溶液を準備した。これを利用してラットの膵臓を消化させて、Histopaque(Sigma Co.)を利用する濃度勾配法によって純化させ回収した。このように分離した膵島細胞は位相差顕微鏡下にて観察し、その結果を図1に示した。
【0032】
1−C.軟骨細胞による膵島のカプセル化
実施例1−Aによって、イヌの場合には3回の継代培養にて得られた軟骨細胞を、ラットの場合には、1回の継代培養にて得られた軟骨細胞は各々インスリン放出分析用培地を用いて5mlに再懸濁し、軟骨細胞数を1,500×104/5ml調節した。このような軟骨細胞と実施例1−Bによって取得した膵島細胞を混合し、培養容器としては直径60mmのHydroCellTM培養皿(CellSeed.Co.)を使用し、振とう培養用シェーカー(モデル名:NA−201、Nissin Co.)を利用して70rpmの振動を加えながら37℃で7日間培養した。ここで、インスリン放出分析用培地は、50%のHam′s F−12培地(Gibco.Co.)、25mmol/lのHEPESを含有した50%のRPMI−1640(Invitrogen Co.)、前記の1%の抗菌剤/抗真菌剤混合物、熱により不活化された10%のFBS、D−(+)−グルコースを添加してグルコースの濃度が1.0mg/mlになるように調整されたものである。このように培養すると培養開始後12時間からマイクロ粒子は肉眼的に観察でき、収得したマイクロ粒子を位相差顕微鏡下にて観察し、その結果を図2に示した。
【0033】
1−D.組織学的な観察結果
実施例1−Cにおいて、7日間振とう培養して収得したマイクロ粒子は4%パラホルムアルデヒドで固定した。リン酸幹緩衝液(PBS、Invitrogen Co.)で洗浄した後15%及び20%のスクロースを含有したPBSで浸清させた。続いて、マイクロ粒子OCT混合物(Sakura Finetechnical Co.Ltd.)で包埋して直ちに凍結し、5μmの厚さで薄切りしてH&E染色を行い、その結果を図3に示した。
【0034】
1−E.インスリン分泌量の測定
マイクロ粒子は7日間の作製期間を除いた約2週間にかけてインスリン分泌量を測定した。サイズ200μm以上のマイクロ粒子(マイクロ粒子大)とサイズ200μm以下のマイクロ粒子(マイクロ粒子小)に分けて行った。マイクロ粒子は通常の培養皿に位置させ、実施例1−Cにて利用したインスリン放出分析用培地を添加し、37℃、5%CO2の条件下で静置した後、24時間おきに培養液を採集してIMXTMイ

インスリン量を測定した。インスリン量は総13日間測定した。
【0035】
インスリン分泌量の測定結果、図4Aに示したように13日間マイクロ粒子からインスリン分泌が確認でき、8日以降のインスリンの分泌量は増加の傾向を表した。また、3日を経過した時点からは、サイズ200μm以下のマイクロ粒子(マイクロ粒子小)がサイズ200μm以上のマイクロ粒子(マイクロ粒子大)より優れたインスリン分泌作用を有することを確認した。
【0036】
一方、実施例1−Aによって取得したイヌ由来の弾性軟骨細胞300×104/mlと実施例1−Bによって取得した膵島細胞を混合し、実施例1−Cによって得られたマイク

0mmの浮遊細胞用の培養皿の上に位置させ、実施例1−Cにて利用したインスリン放出分析用培地を添加し、37℃、5%CO2の条件下で静置した後、72時間おきに培

インスリン量を測定した。インスリン量は培養第3日目から培養第102日目まで、72時間おきに測定した。
【0037】
このように長期間のインスリン分泌量の測定結果を図4Bに示したが、102日間においてマイクロ粒子からインスリンが分泌することが確認できた。すべての測定期間において、第1測定日である培養第3日目のインスリン量よりは減少の推移を表すが、その程度は穏やかであると判断できる。通常の膵島単独培養において一般的な培養条件化では2週間程度の生存とインスリン分泌が可能であることと比べると画期的に膵島のインスリン分泌能と培養成績を改善したと示唆される。
【実施例2】
ラットの膵島細胞がラットの軟骨細胞によってカプセル化されたマイクロ粒子の作製及び免疫隔離可否の分析
【0038】
2−A.ラットの準備
膵島は、成体雄ラット(Lewis Rat、300±50g)から、耳介軟骨組織は雄ラット(Brown Norway Rat、250±50g)(SLC Japan Co.)から取得した。すべてのラットはメデトミジン(medetomidine、100μg/kg)とミダゾラム(midazolam、0.5mg/kg)の混合物を筋肉内に注射した。麻酔はケタミン(ketamine HCL、40mg/kg)を筋肉内注入して維持した。以上の実験動物の管理及び利用は東京大学大学院農学生命科学研究科の指針に従い行われた。
【0039】
2−B.膵島細胞の分離及び培養
熱により不活化された5%のFBS(JRH Biosciences)及び10mmol/lのHEPESを含有する冷たいHanks’Balanced Salt溶液(HBSS:Gibco.Co.)で、コラゲナーゼを2mg/mlの濃度にして添加したコラゲナーゼP(Collagenase P:Roche.Co.)溶液を準備した。その後、膵臓総胆管にカニューレション(cannulation)し、上記の溶液を注入して膵臓を膨張させた。膨張した膵臓は振とう恒温水槽にて37℃で16分間消化させた。消化物は600μmの鋼鉄製mesh filterを通過させた後Histopaque(Sigma Co.)を利用する濃度勾配法によって純化させ回収した。その後、50%のHam′s F−12培地(Gibco.Co.)、25mmol/lのHEPESを含有した50%のRPMI−1640(Invitrogen Co.)、1%の抗菌剤/抗真菌剤混合物(10,000units/mlのペニシリンG、10,000μg/mlのストレプトマイシン硫酸塩及び25μg/mlのアムホテリシンB:Invitrogen Co.)、50μg/mlのアスコルビン酸(Sigma Co.)、熱により不活化された10%のFBS、D−(+)−グルコースを添加してグルコースの濃度が1.0mg/mlになるように調整されたインスリン放出分析用培地を用いてオーバーナイト間培養した。
【0040】
2−C.耳介軟骨細胞の分離及び培養
ラット(Brown Norway Rat)から耳介軟骨を採集し、皮膚組織、皮下組織、筋肉組織、及び軟骨膜等を除去した後時計皿の上に位置させ、手術用の曲刃を利用してチョッピングし、細切した。そして、0.15%コラゲナーゼII(collagenase class II:Worthington,Biochemical Co.)及び0.25%トリプシン(Invitrogen Co.)をHam′s F−12培地(Gibco.Co.)、熱により不活化された10%のFBS、HEPES、前記の4%の抗菌剤/抗真菌剤混合物及び50μg/mlのアスコルビン酸で調整した培地に溶解した消化溶液を調整した。弾性軟骨は前記の消化溶液で処理し、37℃の振とう恒温水槽にて処理した。このようにして得られた細胞懸濁液は70μm及び40μmのナイロン製cell−strainer(BD FalconTM:BD Biosciences)で連続的に通過させた後、前記の4%の抗菌剤/抗真菌剤混合物を含有したリン酸幹緩衝液(Invitrogen Co.)を用いて2回洗浄した。
このような過程によって得られた細胞は、CBM(CAMBREX.Co.)、CGM SingleQuots(CAMBREX.Co.)及び50μg/mlのアスコルビン酸で調整された培地を利用して、湿らされた空気の37℃、5%CO2の条件下で培養した。培養を開始するとき、1.0×104/cm2で播種し、続いて継代培養に0.5×104/cm2で播種した。培地は1週間で2回交換した。継代培養は1回に制限し、継代培養後に、90%のコンフルエンシーに到達したとき、トリプシン・EDTAを処理して増幅させた軟骨細胞を培養皿から剥がして後述のカプセル化に用いた。
【0041】
2−D.軟骨細胞による膵島のカプセル化
実施例2−Bによって、培養された膵島細胞を培養皿(60mm、HydroCellTM:CellSeed.Co.)培養皿の上に位置させ、実施例2−Cによって、培養された軟骨細胞を、インスリン放出分析用培地を用いて1,500×104/5ml再懸濁した後、添加して振とう培養した。振とう培養用シェーカー(NA−201、Nissin Co.)は水平運動を加えるために使用し、速度は70rpmに設定した。この条件化で6日間かけて軟骨細胞によってカプセル化されたマイクロ粒子が完成した。一方、対照群として前述の過程によって、軟骨細胞を添加せずに膵島細胞のみ振とう培養した膵島細胞(以下‘ヌード膵島細胞’と称する。)を作製した。培養期間ごとに収得したマイクロ粒子を位相差顕微鏡下にて観察し、その結果を図5に示した。図5のAは培養開始時点、Bは30時間経過後、Cは51時間経過後、Dは99時間経過後である。膵島を中心として耳介軟骨細胞が付着し、時間が経つにつれて、マイクロ粒子の輪郭が徐々に滑らかになるのを確認した。培養開始後125時間を経過したマイクロ粒子を位相差顕微鏡下にて観察し、その結果を図6のA(40倍拡大)及びB(100倍拡大)に示した。サイズが小さいマイクロ粒子の場合は、直径が250±100μm、サイズが大きいマイクロ粒子の場合は、直径が600±200μm程度であった
【0042】
2−E.組織学的な観察結果
実施例2−Dにおいて、6日間振とう培養して収得したマイクロ粒子は4%パラホルムアルデヒドで固定した。リン酸幹緩衝液(PBS、Invitrogen Co.)で洗浄した後15%及び20%のスクロースを含有したPBSで浸清させた。続いて、マイクロ粒子OCT混合物(Sakura Finetechnical Co.Ltd.)で包埋して直ちに凍結し、5μmの厚さで薄切りしてH&E染色を行い、その結果を図7Aに示した。
【0043】
また、前記のマイクロ粒子は3−amino−9−ethylcarbazole(AEC)substrate−chromogen solution(DAKO Japan Co.,Ltd.)を使用してavidin−biotin−peroxidase complex technique(LSAB 2 kit/HRP,DAKO JapanCo.,Ltd.)のプロトコールに従ってインスリンに対して免疫組織化学染色を実施した。その結果を図7Bに示したが、濃く染色されるインスリンが存在することが確認できた。これは、マイクロ粒子の内部に存在する膵島細胞が本来の機能であるインスリン分泌能を維持していることを意味する。
【0044】
さらに、前記のマイクロ粒子に封入させた生存の膵島を可視化するため、dithizone染色を行い、その結果を図7Cに示した。dithizoneは膵臓のβ細胞に選択的に結合するが、マイクロ粒子内部の特に濃く染色される部分が存在した。この結果はマイクロ粒子内部に膵島細胞が封入されていることを明確に示している。
【0045】
2−F.マイクロ粒子の免疫隔離能に対する試験管内評価

Costar,Corning,NY.U.S.A.)に入れ、12wellに位置させた。対照群(ヌード膵島細

【0046】
一方、1匹の健康なイヌ(Beagle、雄、15.5kg、6歳齢)由来のイヌの血清を収得し、直ちに−80度で凍結させて試験の前まで保管した。補体依存性細胞毒性を評価するため2種類の培地を用いた。すなわち、インスリン放出分析用培地に熱により不活化された10%のFBSの代わりに10%のイヌの血清(以下‘MCM−Dog培地’と称する。:異種補体含有)及び10%のLewisの血清(以下‘MCM−Lewis培地’と称する。:同種補体含有)を各々添加した培地を利用した。異種群(n=6)に分類されたマイクロ粒子はMCM−Dog培地で培養し、同種群(n=6)に分類されたマイクロ粒子はMCM−Lewis培地で培養し、ヌード群(n=6)は対象群(ヌード膵島細胞)として、MCM−Lewis培地で培養した。72時間かけて培養した後インスリン含量を測定することで間接的に補体の活性を評価した。72時間間隔で各々の培養液から上澄液を分離してこれら

)を利用して分析を行った。
【0047】
測定インスリン量は、図8に示した。ヌード群のインスリン放出は培養第9日目に193.3μU/mlから21.5μU/mlに、培養第18日目には2.4μU/mlに著しく低下した。異種群の場合では、減少の傾向を示したが、試験期間(40日間)にかけて一定に維持でき、培養第12日目以降は多少増加の傾向を示した。
【0048】
補体依存性細胞毒性に対する試験管内評価はインスリン分泌量の百分率に基づいて評価した。転換率は以下の式によって計算した。:(特定日のマイクロ粒子又はヌード膵島細胞からのインスリン分泌量)/(インスリン測定開示日のマイクロ粒子又はヌード膵島細胞からのインスリン分泌量)×100。その結果を図9Aに示した。ヌード群の場合、培養第9日目のインスリン放出はインスリン測定開始日の11.1%、培養第18日目には1.3%まで著しい減少を示した。異種群の場合、減少の傾向を示したが、試験期間(40日間)にかけてインスリン測定開始日の20%の値を一定的に維持できた。同種群の場合、放出量は穏やかな減少傾向を示した。これらの結果は異種の補体がマイクロ粒子に対して細胞毒性活性が一切無かったことを意味する。
【0049】
一方、異種間の補体依存性細胞毒性をより厳格に評価するため、上記と異なる2種類の培地を用いた。すなわち、インスリン放出分析用培地に熱により不活化された10%のFBSの代わりに熱による不活化処理を行わないイヌの血清50%(以下‘XENO−COM培地’と称する。:異種補体含有)及び熱による不活化されたイヌの血清50%(以下‘XENO−HI培地’と称する。:異種の補体は活性を失い、異種間の免疫拒絶反応を引き起こさない。)を各々添加した培地を利用した。マイクロ粒子は各々の培養液にて培養し、インスリンの含量を測定することで間接的に補体活性を評価した。24時間間隔で各々の培養液から上澄液を分離してこれらの試料中のインスリン量を免

【0050】
異種間の補体依存性細胞毒性をより厳格に評価した結果は、図9Bに示した。添加した異種血清に対する熱による不活化の有無に関係なくインスリン分泌量は一定の水準を維持した。この結果は、再び異種の補体がマイクロ粒子に対して細胞毒性活性が一切無かったことを意味する証拠である。
【0051】
すなわち、本発明により作製したマイクロ粒子を移植した場合、異種間の移植においても移植患者側の免疫拒絶反応によって破壊されないことを意味する
【産業上の利用可能性】
【0052】
本発明のマイクロ粒子は受領する個体由来の軟骨細胞で作製されているため、受領する個体の免疫機構は非自己(non−self)と認識せず自己(self)であると認識することは勿論、軟骨細胞によって細胞及び補体等の免疫に関わる分子の浸透が処断され免疫拒絶反応は防止でき、栄養分と気体の拡散は円滑であり、移植物の本来の機能を長期間の維持ができる。また、本発明のマイクロ粒子を用いて移植手術を行うと免疫拒絶反応を引き起こさないことから、終生の免疫抑制剤投与が不要となり、免疫拒絶反応のコントロールができる。さらに、異種臓器も利用可能となり臓器提供者の不足の問題を克服し、解決できる。
【図面の簡単な説明】
【0053】
【図1】本発明の一の態様において、膵島細胞が弾性軟骨によってカプセル化される前段階の状態を示す位相差顕微鏡像の図である。
【図2】本発明の一の態様において、膵島細胞が弾性軟骨によってカプセル化された後の状態を示す位相差顕微鏡像の図である。
【図3】本発明の一の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子のH&E染色を用いた組織学的な観察結果を示す図である。
【図4A】本発明の一の態様において、膵島細胞が弾性軟骨によってカプセル化されたサイズ200μm以下のマイクロ粒子(マイクロ粒子小)とサイズ200μm以上のマイクロ粒子(マイクロ粒子大)の時間経過によるインスリン分泌推移を示すグラフである。
【図4B】本発明の一の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子の長期間のインスリン分泌推移を示すグラフである。
【図5】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されていく過程を示す図である。
【図6】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子を示す図である。
【図7A】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子のH&E染色を用いた組織学的な観察結果を示す図である。
【図7B】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子のインスリンに対する免疫組織化学染色の結果を示す図である。
【図7C】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子の、dithizone染色の結果を示す図である。
【図8】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子の時間経過によるインスリン分泌推移を示すグラフである。
【図9A】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子の免疫隔離効果に対する分析結果を示すグラフである。
【図9B】本発明の他の態様において、膵島細胞が弾性軟骨によってカプセル化されたマイクロ粒子の免疫隔離効果に対する分析結果を示すグラフである。
【特許請求の範囲】
【請求項1】
移植物が、前記移植物を受領する個体由来の弾性軟骨によってカプセル化された移植用マイクロ粒子。
【請求項2】
請求項1において、前記移植物は細胞であることを特徴とする移植用マイクロ粒子。
【請求項3】
請求項1又は2において、
前記移植物は、膵臓の膵島から由来したことを特徴とする移植用マイクロ粒子。
【請求項4】
請求項1において、
大きさが150から800μmであることを特徴とする移植用マイクロ粒子。
【請求項5】
(1)移植物を受領する個体由来の弾性軟骨を分離する段階;(2)このように分離された弾性軟骨を継代培養して増幅させる段階;(3)弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させる段階;及び(4)移植物が弾性軟骨によりカプセル化されて作製されたマイクロ粒子を分離する段階を含む移植用マイクロ粒子の作製方法。
【請求項6】
請求項5において、
段階(1)は、弾性軟骨をチョッピングし粉砕した後、蛋白分解酵素を処理して消化させることを特徴とする移植用マイクロ粒子の作製方法。
【請求項7】
請求項6において、
弾性軟骨は、時計皿の上に位置させ、手術用の曲刃を利用してチョッピングすることを特徴とする移植用マイクロ粒子の作製方法。
【請求項8】
請求項6において、
弾性軟骨は、蛋白分解酵素で処理しながら、オーバーナイトから5日間の振とうにより消化させることを特徴とする移植用マイクロ粒子の作製方法。
【請求項9】
請求項5において、
段階(2)の培養にて継代培養の回数は3回以下に制限することを特徴とする移植用マイクロ粒子の作製方法。
【請求項10】
請求項5において、
段階(3)に振とう培養はインスリン分泌分析用培地を利用することを特徴とする移植用マイクロ粒子の作製方法。
【請求項11】
請求項9において、
インスリン分泌分析用培地は、グルコースの含量が0.8mg/mlから1.2mg/mlであることを特徴とする移植用マイクロ粒子の作製方法。
【請求項12】
請求項5において、
段階(3)の振とう培養は、3日から10日間かけて行うことを特徴とする移植用マイクロ粒子の作製方法。
【請求項1】
移植物が、前記移植物を受領する個体由来の弾性軟骨によってカプセル化された移植用マイクロ粒子。
【請求項2】
請求項1において、前記移植物は細胞であることを特徴とする移植用マイクロ粒子。
【請求項3】
請求項1又は2において、
前記移植物は、膵臓の膵島から由来したことを特徴とする移植用マイクロ粒子。
【請求項4】
請求項1において、
大きさが150から800μmであることを特徴とする移植用マイクロ粒子。
【請求項5】
(1)移植物を受領する個体由来の弾性軟骨を分離する段階;(2)このように分離された弾性軟骨を継代培養して増幅させる段階;(3)弾性軟骨と移植物を混合し、振とう培養することで、移植物を中心として弾性軟骨を接着させる段階;及び(4)移植物が弾性軟骨によりカプセル化されて作製されたマイクロ粒子を分離する段階を含む移植用マイクロ粒子の作製方法。
【請求項6】
請求項5において、
段階(1)は、弾性軟骨をチョッピングし粉砕した後、蛋白分解酵素を処理して消化させることを特徴とする移植用マイクロ粒子の作製方法。
【請求項7】
請求項6において、
弾性軟骨は、時計皿の上に位置させ、手術用の曲刃を利用してチョッピングすることを特徴とする移植用マイクロ粒子の作製方法。
【請求項8】
請求項6において、
弾性軟骨は、蛋白分解酵素で処理しながら、オーバーナイトから5日間の振とうにより消化させることを特徴とする移植用マイクロ粒子の作製方法。
【請求項9】
請求項5において、
段階(2)の培養にて継代培養の回数は3回以下に制限することを特徴とする移植用マイクロ粒子の作製方法。
【請求項10】
請求項5において、
段階(3)に振とう培養はインスリン分泌分析用培地を利用することを特徴とする移植用マイクロ粒子の作製方法。
【請求項11】
請求項9において、
インスリン分泌分析用培地は、グルコースの含量が0.8mg/mlから1.2mg/mlであることを特徴とする移植用マイクロ粒子の作製方法。
【請求項12】
請求項5において、
段階(3)の振とう培養は、3日から10日間かけて行うことを特徴とする移植用マイクロ粒子の作製方法。
【図1】


【図2】


【図3】


【図4A】


【図4B】


【図5】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図8】


【図9A】


【図9B】




【図2】


【図3】


【図4A】


【図4B】


【図5】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図8】


【図9A】


【図9B】


【公表番号】特表2009−541019(P2009−541019A)
【公表日】平成21年11月26日(2009.11.26)
【国際特許分類】
【出願番号】特願2009−521691(P2009−521691)
【出願日】平成19年6月26日(2007.6.26)
【国際出願番号】PCT/KR2007/003091
【国際公開番号】WO2008/002059
【国際公開日】平成20年1月3日(2008.1.3)
【出願人】(507071464)
【氏名又は名称原語表記】LEE,Jeong IK
【Fターム(参考)】
【公表日】平成21年11月26日(2009.11.26)
【国際特許分類】
【出願日】平成19年6月26日(2007.6.26)
【国際出願番号】PCT/KR2007/003091
【国際公開番号】WO2008/002059
【国際公開日】平成20年1月3日(2008.1.3)
【出願人】(507071464)

【氏名又は名称原語表記】LEE,Jeong IK
【Fターム(参考)】
[ Back to top ]

