食道ガン転移判定用組成物及び方法
【課題】食道ガンの転移診断に有用なポリヌクレオチドを提供する。
【解決手段】転移のない食道ガン細胞と比較して転移のある食道ガン細胞において発現レベルの変化が認められるポリヌクレオチド、その変異体又はその断片、特定の塩基配列又はその相補的配列を含むポリヌクレオチド、その変異体、又は15以上の連続した塩基を含むその断片、及びそれらのいずれかのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド又はその断片、からなる群から選択される2以上のポリヌクレオチドを含む食道ガン診断用組成物、キット又はDNAチップ、或いは、該組成物、キット又はDNAチップを用いて食道ガンの転移を検出又は予測する方法。
【解決手段】転移のない食道ガン細胞と比較して転移のある食道ガン細胞において発現レベルの変化が認められるポリヌクレオチド、その変異体又はその断片、特定の塩基配列又はその相補的配列を含むポリヌクレオチド、その変異体、又は15以上の連続した塩基を含むその断片、及びそれらのいずれかのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド又はその断片、からなる群から選択される2以上のポリヌクレオチドを含む食道ガン診断用組成物、キット又はDNAチップ、或いは、該組成物、キット又はDNAチップを用いて食道ガンの転移を検出又は予測する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、食道ガンの転移判定又は検出に有用な判定(診断)用組成物、該組成物を利用した食道ガン転移検出又は判定方法、及び該組成物を利用した食道ガン転移診断又は検出キットに関する。
【背景技術】
【0002】
食道は咽頭と胃の間をつなぐ管腔状の臓器であり、大部分は胸腔、一部は頸部と腹腔に存在する。胸腔の上部では気管と脊椎の間にあり、下部では心臓、大動脈と肺に囲まれている。食道は口から食べた食物を胃に送る働きをする。
【0003】
日本人の2001年のガンによる死亡率は10万人中238.8人である。死亡原因の中で食道ガンが占める割合は年々増加しており、2001年度には男性では全ガン死亡例の5.0%、女性では1.4%が食道ガンであった。食道ガンの発症年齢のピークは60〜70歳代にあり、男性に発症が多い。また喫煙、飲酒、熱い嗜好物などの環境要因が発生に密接に関連する。さらに食道壁内部や周辺は血管やリンパ管が豊富であるため、発生したガンの転移が多いことが知られている。
【0004】
食道ガンの治療は進行度(日本食道疾患研究会編 臨床・病理 食道ガン取り扱い規約 1999年)や転移、全身状態を考慮して決定する。食道ガンの標準的な治療法は日本食道疾患研究会編「食道ガン治療ガイドライン」(2002年)に示されている。現在最も一般的な療法は手術療法であり、ガンを含めた食道とリンパ節を含む周囲の組織を切除(リンパ節郭清)した上で、胃など他の臓器を用いて食道を再建する。ただし手術療法、特に広範囲のリンパ節郭清は患者に大きな負担を与え、手術後のQOL低下への配慮も必要である。粘膜内にとどまる早期のガンの場合には内視鏡的粘膜切除術が可能である場合がある。また根治療法、対症療法の両面から放射線照射が行われる場合がある。さらに手術療法や放射線療法と組み合わせて化学療法が行われる。化学療法では現在、5−fluorouracilとcisplatinの併用療法が最も有効と考えられている。
【0005】
食道ガンは嚥下時の違和感、嚥下困難、胸骨後部痛や胸部違和感といった自覚症状を覚えた患者の受診によって発見されることが多い。しかしながらこれらの症状が発現するのは食道内でガンが成長した結果であり、自己所見による受診時に発見されるガンはすでに食道壁外進展や転移が起こっており予後不良であることが多い。したがって手術時には食道周辺のリンパ節拡清を行うことが多いが、この時転移の有無が予見できていれば、拡清の範囲を術前に正確に決定することや、拡清の範囲を限定し術後の患者のQOLに貢献することが可能である。
【0006】
食道ガンは食道造影検査及び内視鏡検査と生検組織検査にて診断が確定される。生検標本は内視鏡検査時や手術時に採取され、病理標本を作製した上で病理組織学的分類によって診断される。この時、内視鏡検査で得られた細胞の性質から食道外への転移の有無が予測できる、迅速で簡便な診断法の開発が求められている。
【0007】
現在までに、食道ガン組織に特異的に含まれるマーカーを用いた分子生物学的診断方法が提案されている。この方法は迅速で客観的な結果をもたらし、迅速な診断の助けとなる。
【0008】
これまでに食道ガンの臨床検査用マーカーとして血清中のタンパク質マーカーであるSCC、CYFRA21−1、CEAなどが活用されているほか、特許文献1、2に記載のタンパク質などが報告されている。しかしこれらのマーカーは感度、特異度が乏しく、もっとも感度が高いとされているCYFRA21−1についても、その感度は33.9%(非特許文献1)から43.9%(非特許文献2)程度である。したがってこれらの血清中マーカー及びその組み合わせの検出によって食道ガン細胞の存在の有無が確定されるという段階には至っていないし、これらを用いて食道ガンの転移を診断することもできていない。
【0009】
また、被験者より採取された生検試料に食道ガン細胞が含まれているか否かを特異的に判断するための遺伝子を利用したマーカーとしては、染色体異常(例えば特許文献3,4参照)や遺伝子の後成的配列(例えば特許文献5)が開示されているほか、DNAチップによる網羅的遺伝子発現解析の結果が複数報告されている(例えば非特許文献3〜8参照)。さらに単独の遺伝子発現を指標としたマーカーとしては特許文献6、非特許文献9、10に示されるSPRR3遺伝子(Small proline―rich protein 3)、非特許文献11に示されるfgf3遺伝子、特許文献6、非特許文献12に示されるCSTB遺伝子(cystatin B、liver thiol proteinase inhibitor)、特許文献7に示されるUCP2遺伝子(mitochondrial uncoupling protein 2)、特許文献6に示されるUPK1A遺伝子(uroplakin 1A)、非特許文献13に示されるHSPA1B遺伝子(Heat Shock 70kDa Protein 1)などが報告されている。しかし、これらによっても食道ガンの転移を診断することは不可能である。
【0010】
一方で、特許文献8ではSHC遺伝子の発現/チロシンリン酸化量が、消化器ガンの進展に影響を与えることが示されているが、食道がんにおけるリンパ節転移を判別できる性能については明確にされていない。
【0011】
さらに特許文献9においてはDNAチップによる網羅的遺伝子発現解析によって、食道ガンの転移を予測するための組成物及び方法が示されている。すなわち特許文献9においては、47種の遺伝子の発現量を測定し、組み合わせて判別式を作成することにより、86%の確率で食道ガンのリンパ節転移を予測することができることが示されている。
【0012】
【特許文献1】特開2003-259872号公報
【特許文献2】特表2000-511536号公報
【特許文献3】特開2001-17200号公報
【特許文献4】特開2002-272497号公報
【特許文献5】特表2004-505612号公報
【特許文献6】国際公開第2003/042661パンフレット
【特許文献7】国際公開第2003/076594パンフレット
【特許文献8】国際公開第2007/084156パンフレット
【特許文献9】国際公開第2006/118308号パンフレット
【0013】
【非特許文献1】Nakamura,T.ら、1998、Diseases of the Esophagus、第11巻、p.35−39
【非特許文献2】Kawaguchi,Hら、2000、Cancer、第89巻、p.1413−1417
【非特許文献3】Luo, A.ら、2004年、Oncogene、第23巻、p.1291-1299
【非特許文献4】Zhi, H.ら、2003年、International Journal of Cancer、第106巻、p.327-333
【非特許文献5】Lu, J.ら、2001年、International Journal of Cancer、第91巻、p.288-294
【非特許文献6】Kazemi-Noureini,S.ら、2004年、World Journal of Gastroenterology 、第10巻、p.1716-1721
【非特許文献7】Xu, S.H.ら、2003年、World Journal of Gastroenterology 、第9巻、p.417-422
【非特許文献8】Su, H.ら、2003年、Cancer Research、第63巻、p.3872-3876
【非特許文献9】Chen, B.S. ら、2000年、Carcinogenesis、第21巻、p.2147-2150
【非特許文献10】Abraham, J.M.ら、1996年、Cell Growth & Differentiation、第7巻、p.855-860.
【非特許文献11】Kitagawa, Y.ら、1991年、Cancer Research、第51巻、p.1504-1508
【非特許文献12】Shiraishi,T.ら、1998年、International Journal of Cancer、第79巻、p.175-178
【非特許文献13】Kawanishi,K.ら、1999年、Cancer、第85巻、p.1649-1657
【発明の開示】
【発明が解決しようとする課題】
【0014】
しかしながら、上記の既存の指標は特異性及び/又は感受性に乏しいことや、生体試料からのその効率的な検出方法が確立していないことから一般に臨床上の利用は行われておらず、また患者の予後を決定する大きな要因である、食道ガン転移の有無を診断マーカーを用いて検出することは、現在不可能と考えられる。そこで特異性及び感受性が高い食道ガン転移のマーカーが切望されている。
【0015】
本発明は、食道ガン転移の診断及び治療に有用な疾患判定用組成物、該組成物を用いた食道ガン転移の判定(又は検出)方法、及び該組成物を利用した食道ガン転移の判定(又は検出又は診断)キットを提供することを目的とする。
【課題を解決するための手段】
【0016】
マーカー探索の方法としては、食道ガン細胞のうち、手術時にリンパ節転移があった患者由来の食道ガン細胞と手術時にリンパ節転移がなかった患者由来の食道ガン細胞における遺伝子発現やタンパク質発現、又は細胞の代謝産物などの量を何らかの手段によって比較する方法や食道ガン患者と非ガン患者の体液中に含まれる遺伝子、タンパク質、代謝産物などの量を測定する方法が挙げられる。
【0017】
DNAアレイを用いた発現遺伝子量解析は、近年、このようなマーカー探索の手法として特に汎用されている。DNAアレイには数百から数万種の遺伝子に対応した塩基配列を利用したプローブが固定されている。被検試料をDNAアレイに添加することによって試料中の遺伝子がプローブと結合し、この結合量を何らかの手段によって測定することにより、被検試料中の遺伝子量を知ることができる。DNAアレイ上に固定化するプローブに対応した遺伝子の選択は自由であり、また被検試料に手術時にリンパ節転移があった患者由来の食道ガン細胞と手術時にリンパ節転移がなかった患者由来の食道ガン細胞胞を用いて、試料中の発現遺伝子量を比較することによって食道転移ガンマーカーとなりうる遺伝子群を推定することが可能である。
【0018】
上記の課題を解決するために、本発明者らは、手術時にリンパ節転移があった患者由来の食道ガン組織と手術時にリンパ節転移がなかった患者由来の食道ガン組織の遺伝子発現をDNAアレイによって解析し、食道ガン転移の検出マーカーに使用可能な遺伝子を見出し、さらにそれらの遺伝子の発現量が、手術時にリンパ節転移がなかった患者由来の食道ガン細胞に比較して手術時にリンパ節転移があった患者由来の食道ガン細胞において有意に減少又は低減していることを見出し、本発明を完成させた。
【0019】
1.発明の概要
本発明は、以下の特徴を有する。
本発明は第1の態様において、下記の(a)〜(e)に示すポリヌクレオチド、その変異体又はその断片からなる群から選択される2以上のポリヌクレオチドを含む、食道ガン転移診断用組成物である。
(a)配列番号1〜10で表される塩基配列からなるポリヌクレオチド、その変異体、又は15以上の連続した塩基を含むその断片
(b)配列番号1〜10で表される塩基配列を含むポリヌクレオチド
(c)配列番号1〜10で表される塩基配列に相補的な塩基配列からなるポリヌクレオチド、その変異体、又は15以上の連続した塩基を含むその断片
(d)配列番号1〜10で表される塩基配列に相補的な塩基配列を含むポリヌクレオチド
(e)前記(a)〜(d)のいずれかのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又は15以上の連続した塩基を含むその断片
その実施形態において、前記断片が、60以上の連続した塩基を含むポリヌクレオチドである上記の組成物である。
【0020】
また別の実施形態において、前記断片が、配列番号1〜10のいずれかで表される塩基配列において、それぞれ配列番号11〜20のいずれかで表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド、又は該ポリヌクレオチドの配列に相補的な塩基配列を含むポリヌクレオチドである、上記の組成物である。
【0021】
また別の実施形態において、前記断片が、配列番号11〜20のいずれかで表される塩基配列、又はこれらに相補的な塩基配列を含むポリヌクレオチドである、上記の組成物である。
【0022】
本発明の第2の態様において、上記のいずれかに記載の(a)〜(e)に示すポリヌクレオチド、その変異体及び/又はその断片の2以上を含む、食道ガン転移診断用キットである。
【0023】
その実施形態において、前記ポリヌクレオチドが、配列番号1〜10のいずれかで表される塩基配列からなるポリヌクレオチド、その相補的配列からなるポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はそれらの15以上の連続した塩基を含む断片である、上記のキットである。
【0024】
また別の実施形態において、前記断片が、60以上の連続した塩基を含むポリヌクレオチドである、上記のキットである。
【0025】
また別の実施形態において、前記断片が、配列番号1〜10のいずれかで表される塩基配列において、それぞれ配列番号11〜20のいずれかで表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド、又は該ポリヌクレオチドの配列に相補的な塩基配列を含むポリヌクレオチドである、上記のキットである。
【0026】
また別の実施形態において、前記断片が、配列番号11〜20のいずれかで表される塩基配列からなるポリヌクレオチドである、上記のキットである。
【0027】
また別の実施形態において、前記ポリヌクレオチドが、別個に又は任意に組み合わせて異なる容器に包装されている、上記のいずれか1項に記載のキットである。
【0028】
本発明の第3の態様において、上記のいずれかに記載の(a)〜(e)に示すポリヌクレオチド、その変異体及び/又はその断片の2以上を含む、食道ガン転移診断用DNAチップである。
【0029】
その実施形態において、配列番号11〜20で表される塩基配列又はその相補的配列を含むポリヌクレオチドの2以上〜全部を含む、上記のDNAチップである。
【0030】
本発明の第4の態様において、上記のいずれかに記載の組成物、上記のいずれかに記載のキット、上記のいずれかに記載のDNAチップ、又はそれらの組み合わせを用いて、被験者由来の生体試料における標的核酸の発現レベルを測定することによって、被験者由来の検体試料中に転移を伴う食道ガン細胞が含まれるかどうかをin vitroで判定する方法である。
【0031】
その実施形態において、DNAチップを用いる上記の方法である。
また別の実施形態において、いずれかに記載の組成物、上記のいずれかに記載のキット、上記のいずれかに記載のDNAチップ、又はそれらの組み合わせを用いて、転移を伴う食道ガン又は転移を伴わない食道ガン細胞を含む組織であることが既知の複数の生体試料中の標的核酸の発現量をin vitroで測定する第1の工程、前記第1の工程で得られた該標的核酸の発現量の測定値を教師とした判別式(サポートベクターマシーン)を作成する第2の工程、被験者の食道由来の検体試料中の該標的核酸の発現量を第1の工程と同様にin vitroで測定する第3の工程、前記第2の工程で得られた判別式に第3の工程で得られた該標的核酸の発現量の測定値を代入し、該判別式から得られた結果に基づいて、検体試料中に転移を伴うガン細胞が含まれないこと及び/又は転移を伴わないガン細胞が含まれることを判定する第4の工程を含む、食道ガン転移を判定する方法である。
【0032】
また別の実施形態において、上記のいずれかに記載の組成物、上記のいずれかに記載のキット、又は上記のいずれかに記載のDNAチップの、食道ガン患者の転移の有無をin vitroで予測するための使用である。
【0033】
本発明の第5の態様において、配列番号1〜10で表される塩基配列によってコードされるポリペプチドに対する2以上の抗体又はその断片を用いて、被験者由来の食道ガン細胞或いは血液中の該ポリペプチドのレベルをin vitroで測定することを含む、被験者の食道ガンの転移の有無をin vitroで予測する方法である。
【0034】
その実施形態において、前記ポリペプチドが、配列番号21〜27で表されるアミノ酸配列を有する、上記の方法である。
【0035】
また別の実施形態において、前記ポリペプチドの発現レベルが、転移のない患者由来の食道ガンと比較して変化している場合、転移が有る患者由来の食道ガンであると決定する。
【0036】
また別の実施形態において、前記ポリペプチドの発現レベルが、転移のある患者由来の食道ガンと比較して変化している場合、転移が無い患者由来の食道ガンであると決定する、上記のいずれかに記載の方法である。
【0037】
2.定義
本明細書中で使用する用語は、以下の定義を有する。
本明細書において「転移を伴う食道ガン」とは、食道ガンが転移性のガンであることを表し、このような食道ガンはリンパ節などの他の組織に転移するか又は転移し易い性質を有している。一方、「転移を伴わない食道ガン」とは、食道ガンが非転移性のガンであることを表す。
【0038】
本明細書中で使用されるヌクレオチド、ポリヌクレオチド、アミノ酸、ペプチド、ポリペプチド、タンパク質などの略号による表示は、「塩基配列又はアミノ酸配列を含む明細書等の作成のためのガイドライン」(日本国特許庁編)及び当技術分野における慣用に従うものとする。
【0039】
本明細書において「ポリヌクレオチド」とは、RNA及びDNAのいずれも包含する核酸として用いられる。なお、上記DNAには、cDNA、ゲノムDNA、及び合成DNAのいずれもが含まれる。また上記RNAには、totalRNA、mRNA、rRNA、及び合成RNAのいずれもが含まれる。また、本明細書では、ポリヌクレオチドは核酸と互換的に使用される。
【0040】
本明細書において「cDNA」とは、遺伝子の発現によって生じたRNAに相補的な配列のDNA鎖全長、及びその部分配列からなるDNA断片、を包含する。cDNAは、RNAを鋳型にして、ポリTプライマーを用いるRT−PCR(逆転写酵素−ポリメラーゼ連鎖反応)によって合成されうる。
【0041】
本明細書において「遺伝子」とは、2本鎖DNAのみならず、それを構成する正鎖(又はセンス鎖)又は相補鎖(又はアンチセンス鎖)などの各1本鎖DNAを包含することを意図して用いられる。またその長さによって特に制限されるものではない。
【0042】
従って、本明細書において「遺伝子」は、特に言及しない限り、ヒトゲノムDNAを含む2本鎖DNA、cDNAを含む1本鎖DNA(正鎖)、該正鎖と相補的な配列を有する1本鎖DNA(相補鎖)、及びこれらの断片のいずれも含む。また該「遺伝子」は特定の塩基配列(又は配列番号)で示される「遺伝子」だけではなく、これらによってコードされるタンパク質と生物学的機能が同等であるタンパク質、例えば同族体(すなわち、ホモログ)、スプライスバリアントなどの変異体、及び誘導体をコードする「遺伝子」が包含される。かかる同族体、変異体又は誘導体をコードする「遺伝子」としては、具体的には、後に記載したストリンジェントな条件下で、上記の配列番号1〜10で示されるいずれかの特定塩基配列の相補配列とハイブリダイズする塩基配列を有する「遺伝子」を挙げることができる。
【0043】
例えばヒト由来のタンパク質の同族体(すなわち、ホモログ)又はそれをコードする遺伝子としては、当該タンパク質又はそれをコードするヒト遺伝子に対応する他生物種のタンパク質又は遺伝子が例示でき、これらのタンパク質又は遺伝子ホモログは、HomoloGene(http://www.ncbi.nlm.nih.gov/homoloGene/)により同定することができる。具体的には特定のヒトアミノ酸又は塩基配列をBLASTプログラム(Karlin,S.ら、Proceedings of the National Academic Sciences U.S.A.、 1993年、第90巻、p.5873―5877、 http://www.ncbi.nlm.nih.gov/BLAST/)にかけて一致する(Scoreが最も高く、E−valueが0でかつIdentifyが100%を示す)配列の登録番号(accession number)を取得することができる。BLASTプログラムとしては、BLASTN(遺伝子)、BLASTX(タンパク質)などが知られている。例えば、遺伝子検索の場合、上記BLAST検索からの登録番号をUniGene(http://www.ncbi.nlm.nih.gov/UniGene/)に入力して得られたUniGeneClusterID(Hs.で示す番号)をHomoloGeneに入力する。結果として得られた他生物種遺伝子とヒト遺伝子との遺伝子ホモログの相関を示したリストから、特定の塩基配列で示されるヒト遺伝子に対応する遺伝子ホモログとして、他生物種の遺伝子を選抜することができる。またこの方法において、BLASTプログラムの代わりにFASTAプログラム(http://www.ddbj.nig.ac.jp/top−j.html)を用いてもよい。
【0044】
なお、「遺伝子」は、機能領域の別を問うものではなく、例えば発現制御領域、コード領域、エキソン又はイントロンを含むことができる。
【0045】
本明細書において「転写産物」とは、遺伝子のDNA配列を鋳型にして合成されたメッセンジャーRNA(mRNA)のことをいう。RNAポリメラーゼが遺伝子の上流にあるプロモーターと呼ばれる部位に結合し、DNAの塩基配列に相補的になるように3'末端にリボヌクレオチドを結合させていく形でメッセンジャーRNAが合成される。このメッセンジャーRNAには遺伝子そのもののみならず、発現制御領域、コード領域、エキソン又はイントロンをはじめとする転写開始点からポリA配列の末端にいたるまでの全配列が含まれる。
【0046】
本明細書において「翻訳産物」とは、転写によって合成されたメッセンジャーRNAが,スプライシングなどの修飾を受ける/受けないにかかわらず、その情報を元に合成されたタンパク質を示す。メッセンジャーRNAの翻訳過程においては、まずリボソームとメッセンジャーRNAが結合し、次にメッセンジャーRNAの塩基配列に従ってアミノ酸がつながっていき、タンパク質が合成される。
【0047】
本明細書において「プローブ」とは、遺伝子の発現によって生じたRNA又はそれに由来するポリヌクレオチドを特異的に検出するために使用されるポリヌクレオチド及び/又はそれに相補的なポリヌクレオチドを包含する。
【0048】
本明細書において「プライマー」とは、遺伝子の発現によって生じたRNA又はそれに由来するポリヌクレオチドを特異的に認識し、増幅する、連続するポリヌクレオチド及び/又はそれに相補的なポリヌクレオチドを包含する。
【0049】
ここで相補的なポリヌクレオチド(相補鎖、逆鎖)とは、配列番号によって定義される塩基配列からなるポリヌクレオチドの全長配列、又はその部分配列(ここでは便宜上、これを正鎖と呼ぶ)に対してA:T(U)、G:Cといった塩基対関係に基づいて、塩基的に相補的な関係にあるポリヌクレオチドを意味する。ただし、かかる相補鎖は、対象とする正鎖の塩基配列と完全に相補配列を形成する場合に限らず、対象とする正鎖とストリンジェントな条件でハイブリダイズできる程度の相補関係を有するものであってもよい。
【0050】
本明細書において「ストリンジェントな条件」とは、プローブが他の配列に対するよりも、検出可能により大きな程度(例えばバックグラウンドよりも少なくとも2倍)で、その標的配列に対してハイブリダイズする条件をいう。ストリンジェントな条件は配列依存性であり、ハイブリダイゼーションが行われる環境によって異なる。ハイブリダイゼーション及び/又は洗浄条件のストリンジェンシーを制御することにより、プローブに対して100%相補的である標的配列が同定され得る。
【0051】
本明細書において「変異体」とは、核酸の場合、多型性、突然変異、転写時の選択的スプライシングなどに起因した天然の変異体、或いは遺伝暗号の縮重に基づく変異体、或いは配列番号1〜10で表される塩基配列又はその部分配列において1以上、好ましくは1もしくは数個、の塩基の欠失、置換、付加又は挿入を含む変異体、或いは該塩基配列又はその部分配列と約80%以上、約85%以上、約90%以上、約95%以上、約97%以上、約98%以上、約99%以上の%同一性を示す変異体、或いは該塩基配列又はその部分配列を含むポリヌクレオチド又はオリゴヌクレオチドと上記定義のストリンジェントな条件でハイブリダイズする核酸を意味し、一方、タンパク質又はペプチドの場合、配列番号21〜27で表されるアミノ酸配列又はその部分配列おいて1以上、好ましくは1もしくは数個、のアミノ酸の欠失、置換、付加又は挿入を含む変異体、或いは該アミノ酸配列又はその部分配列と約80%以上、約85%以上、約90%以上、約95%以上、約97%以上、約98%以上、約99%以上の%同一性を示す変異体を意味する。
【0052】
本明細書において「数個」とは、約10、9、8、7、6、5、4、3又は2個の整数を意味する。
【0053】
本明細書において「%同一性」は、上記のBLASTやFASTAによるタンパク質又は遺伝子の検索システムを用いて、ギャップを導入して、又はギャップを導入しないで、決定することができる(Karlin,S.ら、1993年、Proceedings of the National Academic Sciences U.S.A.、第90巻、p.5873-5877;Altschul,S.F.ら、1990年、Journal of Molecular Biology、第215巻、p.403−410;Pearson,W.R.ら、1988年、Proceedings of the National Academic Sciences U.S.A.、第85巻、p.2444-2448)。%同一性は、簡単に言えば、2つの塩基配列又はアミノ酸配列を、ギャップを導入してか又はギャップを導入しないで整列したときの、塩基又はアミノ酸の総数に対する同一の塩基又はアミノ酸の数の割合(%)をいう。
【0054】
本明細書において「誘導体」とは、核酸の場合、蛍光団などによるラベル化誘導体、修飾ヌクレオチド(例えばハロゲン、メチルなどのアルキル、メトキシなどのアルコキシ、チオ、カルボキシメチルなどの基を含むヌクレオチド及び塩基の再構成、二重結合の飽和、脱アミノ化、酸素分子の硫黄分子への置換などを受けたヌクレオチドなど)を含む誘導体など、一方、タンパク質の場合、アセチル化、アシル化、アルキル化、リン酸化、硫酸化、グリコシル化、ビオチン化などの化学修飾誘導体を意味する。
【0055】
本明細書において「診断(又は検出又は判定)用組成物」とは、食道ガンの罹患の有無、罹患の程度もしくは改善の有無や改善の程度を診断するために、また食道ガンの予防、改善又は治療に有用な候補物質をスクリーニングするために、直接又は間接的に利用されるものをいう。これには食道ガンの罹患に関連して生体内、特に食道組織において発現が変動する遺伝子を特異的に認識し、また結合することのできるヌクレオチド、オリゴヌクレオチド及びポリヌクレオチド、及び該遺伝子の翻訳産物であるタンパク質を検出することができる抗体が包含される。これらのヌクレオチド、オリゴヌクレオチド及びポリヌクレオチドは、上記性質に基づいて生体内、組織や細胞内などで発現した上記遺伝子を検出するためのプローブとして、また生体内で発現した上記遺伝子を増幅するためのプライマーとして有効に利用することができる。
【0056】
本明細書において検出・診断対象となる「生体組織」とは、食道ガンの発生にともない本発明の遺伝子が発現変化する組織を指す。具体的には食道組織及びその周辺のリンパ節、また転移が疑われる他臓器などを指す。
【0057】
本明細書で使用される「SHC1遺伝子」又は「SHC1」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号1)で示されるSHC transforming protein 1遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号1に記載のSHC1遺伝子(GenBank Accession No.NM_003029)やその他生物種ホモログなどが包含される。SHC1遺伝子はPelicci,Gら、1992年、Cell、第70巻、p.93―104に記載される方法によって得ることができる。
【0058】
本明細書で使用される「C1R遺伝子」又は「C1R」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号2)で示されるcomplement component 1, r subcomponent遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号2に記載のC1R遺伝子(GenBank Accession NM_001733)やその他生物種ホモログなどが包含される。C1R遺伝子は、Cohen−Haguenauer, O.ら、1986年、(Abstract)7th Int. CONG. HUM. Genet. Berlin 617 onlyに記載される方法によって得ることができる。
【0059】
本明細書で使用される「LAMA5遺伝子」又は「LAMA5」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号3)で示されるLaminin alpha−5chain precursor遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号3に記載のLAMA5遺伝子(GenBank Accession No. NM_005560)やその他生物種ホモログなどが包含される。LAMA5遺伝子はDurkin,M.E.ら1986年、FEBS Lett. 第70巻、p.296−300に記載される方法によって得ることができる。
【0060】
本明細書で使用される「PGAM1遺伝子」又は「PGAM1」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号4)で示されるPhosphoglycerate mutase 1遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号4に記載のPGAM1遺伝子(GenBank Accession No. NM_002629)やその他生物種ホモログなどが包含される。PGAM1遺伝子はSakoda, S.ら、1988年、Journal of Biological Chemistry、第263巻、p.16899−16905に記載される方法によって得ることができる。
【0061】
本明細書で使用される「ZNF708遺伝子」又は「ZNF708」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号5)で示される71 kDa protein遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号5に記載のZNF708遺伝子(GenBank Accession No.NM_021269)やその他生物種ホモログなどが包含される。ZNF708遺伝子はThiesen,H.J.ら、1990年、The New Biologist、第2巻、p.363−374に記載される方法によって得ることができる。
【0062】
本明細書で使用される「YWHAQ遺伝子」又は「YWHAQ」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号6)で示される14−3−3 protein tau遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号6に記載のYWHAQ遺伝子(GenBank Accession No.NM_006826)やその他生物種ホモログなどが包含される。YWHAQ遺伝子はNielsen,P.J.、1991年、Biochimica et biophysica acta、第1088巻、p. 425−428に記載される方法によって得ることができる。
【0063】
本明細書で使用される「AC004609遺伝子」又は「AC004609」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号7)で示されるHomo sapiens chromosome 19, cosmid F16912と称される遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号7に記載のAC004609遺伝子(GenBank Accession No.AC004609)やその他生物種ホモログなどが包含される。
【0064】
本明細書で使用される「ZNF714遺伝子」又は「ZNF714遺伝子」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号8)で示されるzinc finger protein 714遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号8に記載のZNF714遺伝子遺伝子(GenBank Accession No. NM_182515)やその他生物種ホモログなどが包含される。ZNF714遺伝子はOh,J.H.ら、2005年、Mammalian genome、第16巻、p.942−954に記載される方法によって得ることができる。
【0065】
本明細書で使用される「LOC152667遺伝子」又は「LOC152667」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号9)で示されるLOC152667 NIP30−like 遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号9に記載のLOC152667遺伝子(GenBank Accession No.NR_002228)やその他生物種ホモログなどが包含される。LOC152667遺伝子はMarques,A.C.ら、2005年、PLoS biology、第23巻、p.E357に記載される方法によって得ることができる。
【0066】
本明細書で使用される「ZNF716遺伝子」又は「ZNF716」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号10)で示されるzinc finger protein 716遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号10に記載のZNF716遺伝子(GenBank Accession No.AK131575)やその他生物種ホモログなどが包含される。
【発明の効果】
【0067】
本発明は、食道ガン転移の診断及び治療に有用な疾患判定用組成物及び該組成物を用いた食道転移ガンの判定(又は検出)方法を提供するものであり、これによって、食道ガンの転移に対して特異的かつ高予測率の、及び迅速でかつ簡便な、判定方法を提供するという格別の作用効果を有する。
【発明を実施するための最良の形態】
【0068】
以下に本発明をさらに具体的に説明する
1.食道ガン転移の標的核酸
本発明において、上記定義の食道ガン転移診断用組成物及びキットを使用して食道ガン転移の存在及び/又は不存在、或いは食道ガン転移の可能性の有無、を予測又は判定するための食道ガン転移のマーカーとしての標的核酸には、例えば、配列番号1〜10で表される塩基配列を含むヒト遺伝子(すなわち、それぞれ、SHC1、C1R、LAMA5、PGAM1、ZNF708、YWHAQ、AC004609、ZNF714、LOC152667、ZNF716)、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体が含まれる。ここで、遺伝子、同族体、転写産物、cDNA、変異体及び誘導体は、上記定義のとおりである。好ましい標的核酸は、配列番号1〜10で表される塩基配列を含むヒト遺伝子、それらの転写産物又はcDNA、より好ましくは該転写産物又はcDNAである。
【0069】
本発明において食道ガン転移の標的となる上記遺伝子はいずれも、手術時にリンパ節転移があった患者由来の食道ガン組織に比較して、手術時にリンパ節転移がなかった患者由来の食道ガン組織において発現レベルが有意に増加しているか、或いは低下しているものである(後述の実施例の表1参照)。
【0070】
第1の標的核酸は、SHC1遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。SHC1遺伝子は国際公開第2007/084156パンフレットにおいて消化器ガンの進展に影響を与えることが示されている。
【0071】
第2の標的核酸は、C1R遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにC1R遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0072】
第3の標的核酸は、LAMA5遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにLAMA5遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0073】
第4の標的核酸は、PGAM1遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにPGAM1遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0074】
第5の標的核酸は、ZNF708遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにZNF708遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0075】
第6の標的核酸は、YWHAQ遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにYWHAQ遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0076】
第7の標的核酸は、AC004609遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにAC004609遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0077】
第8の標的核酸は、ZNF714遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにZNF714遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0078】
第9の標的核酸は、LOC152667遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにLOC152667遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0079】
第10の標的核酸は、ZNF716遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにZNF716遺伝子及びその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0080】
2.食道ガン転移の標的ポリペプチド
本発明において、上記定義の食道ガン転移診断用組成物及びキットを使用して食道ガン転移の存在及び/又は不存在を判定するための食道ガン転移のマーカーとしての標的ポリペプチドには、例えば、配列番号1〜10で表される塩基配列を含むヒト遺伝子(すなわち、それぞれ、SHC1、C1R、LAMA5、PGAM1、ZNF708、YWHAQ、AC004609、ZNF714、LOC152667、ZNF716遺伝子)によってコードされるポリペプチド、例えば、配列番号21〜27で表されるアミノ酸配列を含むヒトポリペプチド、それらの同族体、或いはそれらの変異体又は誘導体が含まれる。ここで、ポリペプチド、同族体、変異体及び誘導体は、上記定義のとおりである。好ましい標的ポリペプチドは、配列番号21〜27で表されるアミノ酸配列を含むヒトポリペプチドである。
【0081】
本発明において食道ガン転移の標的となる上記ポリペプチドはいずれも、対応する遺伝子及びその転写産物の発現量と同様に、手術時にリンパ節転移がなかった患者由来の食道ガン組織に比較して、手術時にリンパ節転移があった患者由来の食道ガン組織において発現レベルが有意に増加しているか、又は低下しているものであること、或いは血液中の該ポリペプチドのレベルが手術時にリンパ節転移がなかった被験者と比べて手術時にリンパ節転移があった被験者において有意に増加しているか、又は低下することによって特徴付けられる。
【0082】
3.食道ガン転移診断用組成物
3.1 核酸
本発明において、食道ガン又は食道ガン転移の存在及び/又は不存在を判定又は検出するための、或いは食道ガン転移(又は転移の可能性)の有無を判定又は予測するために使用可能な核酸組成物は、食道ガン転移の標的核酸としての、ヒト由来のSHC1、C1R、LAMA5、PGAM1、ZNF708、YWHAQ、AC004609、ZNF714、LOC152667、ZNF716遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体の存在、発現レベル又は存在量を定性的及び/又は定量的に測定することを可能にする。
【0083】
上記の標的核酸は、手術時にリンパ節転移がなかった患者由来の食道ガン組織に比較して、手術時にリンパ節転移があった患者由来の食道ガン組織においてその発現レベルが有意に増加するか、或いは低下する。それゆえ、本発明の組成物は、手術時にリンパ節転移がなかった患者由来の食道ガン組織と手術時にリンパ節転移があった患者由来の食道ガン組織について標的核酸の発現レベルを測定し、それらを比較するために有効に使用することができる。
【0084】
本発明で使用可能な組成物は、食道ガンに罹患した患者の生体組織において配列番号1〜10で表される塩基配列を含むポリヌクレオチド群及びその相補的ポリヌクレオチド群、該塩基配列に相補的な塩基配列からなるDNAとストリンジェントな条件でそれぞれハイブリダイズするポリヌクレオチド群及びその相補的ポリヌクレオチド群、ならびにそれらのポリヌクレオチド群の塩基配列において15以上、好ましくは20〜30又はそれ以上、より好ましくは40〜50又はそれ以上、さらに好ましくは60以上、の連続した塩基を含むポリヌクレオチド群から選ばれた、2以上、好ましくは3以上、より好ましくは6以上のポリヌクレオチドの組み合わせを含む。ポリヌクレオチドの組み合わせは、互いに異なる遺伝子に由来するポリヌクレオチドを含むことが好ましい。
【0085】
具体的には、本発明の組成物は、以下の2以上のポリヌクレオチド又はその断片を含むことができる。
(1)配列番号1〜10で表される塩基配列からなるポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(2)配列番号1〜10で表される塩基配列を含むポリヌクレオチド群。
(3)配列番号1〜10で表される塩基配列からなるポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(4)配列番号1〜10で表される塩基配列に相補的な塩基配列を含むポリヌクレオチド群。
(5)配列番号1〜10で表される塩基配列の各々と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズするポリヌクレオチド群、又は15以上の連続した塩基を含むそれらの断片。
【0086】
上記(1)〜(5)のポリヌクレオチドの断片は、各ポリヌクレオチドの塩基配列において、例えば、連続する15〜配列の全塩基数、15〜5000塩基、15〜4500塩基、15〜4000塩基、15〜3500塩基、15〜3000塩基、15〜2500塩基、15〜2000塩基、15〜1500塩基、15〜1000塩基、15〜900塩基、15〜800塩基、15〜700塩基、15〜600塩基、15〜500塩基、15〜400塩基、15〜300塩基、15〜250塩基、15〜200塩基、15〜150塩基、15〜140塩基、15〜130塩基、15〜120塩基、15〜110塩基、15〜100塩基、15〜90塩基、15〜80塩基、15〜70塩基、15〜60塩基、15〜50塩基、15〜40塩基、15〜30塩基又は15〜25塩基;25〜配列の全塩基数、25〜1000塩基、25〜900塩基、25〜800塩基、25〜700塩基、25〜600塩基、25〜500塩基、25〜400塩基、25〜300塩基、25〜250塩基、25〜200塩基、25〜150塩基、25〜140塩基、25〜130塩基、25〜120塩基、25〜110塩基、25〜100塩基、25〜90塩基、25〜80塩基、25〜70塩基、25〜60塩基、25〜50塩基又は25〜40塩基;50〜配列の全塩基数、50〜1000塩基、50〜900塩基、50〜800塩基、50〜700塩基、50〜600塩基、50〜500塩基、50〜400塩基、50〜300塩基、50〜250塩基、50〜200塩基、50〜150塩基、50〜140塩基、50〜130塩基、50〜120塩基、50〜110塩基、50〜100塩基、50〜90塩基、50〜80塩基、50〜70塩基又は50〜60塩基;60〜配列の全塩基数、60〜1000塩基、60〜900塩基、60〜800塩基、60〜700塩基、60〜600塩基、60〜500塩基、60〜400塩基、60〜300塩基、60〜250塩基、60〜200塩基、60〜150塩基、60〜140塩基、60〜130塩基、60〜120塩基、60〜110塩基、60〜100塩基、60〜90塩基、60〜80塩基又は60〜70塩基などの範囲の塩基数を含むことができるが、これらに限定されないものとする。
【0087】
本発明の実施形態により、配列番号1〜10で表される塩基配列を含むポリヌクレオチドの断片はそれぞれ、配列番号11〜20で表される塩基配列又はその相補的配列、或いはそれらの連続する15塩基以上の部分配列、を含むことが好ましい。
【0088】
本発明の組成物には、例えば以下のポリヌクレオチドが包含される。
(1)配列番号1〜10で表される塩基配列又はその相補的配列の各々において、15以上の連続した塩基を含むポリヌクレオチド。
(2)配列番号1〜10で表される塩基配列又はその相補的配列の各々において、60以上の連続した塩基を含むポリヌクレオチド。
(3)配列番号1〜10で表される塩基配列において、それぞれ配列番号11〜20で表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド。
(4)配列番号1〜10で表される塩基配列に相補的な配列において、それぞれ配列番号11〜20で表される塩基配列に相補的な配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド。
【0089】
本発明で使用される上記ポリヌクレオチド類又はその断片類はいずれもDNAでもよいしRNAでもよい。
【0090】
本発明の組成物としてのポリヌクレオチドは、DNA組換え技術、PCR法、DNA/RNA自動合成機による方法などの一般的な技術を用いて作製することができる。
【0091】
DNA組換え技術及びPCR法は、例えばAusubelら, Current Protocols in Molecular Biology, John Willey & Sons, US (1993); Sambrookら, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory Press, US (1989)などに記載される技術を使用することができる。
【0092】
ヒト由来の、SHC1、C1R、LAMA5、PGAM1、ZNF708、YWHAQ、AC004609、ZNF714、LOC152667、ZNF716遺伝子は公知であり、前述のようにその取得方法も知られている。このため、これらの遺伝子をクローニングすることによって、本発明の組成物としてのポリヌクレオチドを作製することができる。
【0093】
本発明の組成物を構成するポリヌクレオチドは、DNA自動合成装置を用いて化学的に合成することができる。この合成には一般にホスホアミダイト法が使用され、この方法によって約100塩基までの一本鎖DNAを自動合成することができる。DNA自動合成装置は、例えばPolygen社、ABI社、Applied BioSystems社などから市販されている。
【0094】
或いは、本発明のポリヌクレオチドは、cDNAクローニング法によって作製することもできる。本発明において標的である上記遺伝子が発現される食道組織などの生体組織から抽出したtotal RNAをオリゴdTセルロースカラムで処理して得られるポリA(+)RNAからRT−PCR法によってcDNAライブラリーを作製し、このライブラリーからハイブリダイゼーションスクリーニング、発現スクリーニング、抗体スクリーニングなどのスクリーニングによって目的のcDNAクローンを得ることができる。必要に応じて、cDNAクローンをPCR法によって増幅することもできる。プローブ又はプライマーは、配列番号1〜20に示される塩基配列に基づいて15〜100塩基の連続する配列の中から選択し、合成しうる。cDNAクローニング技術は、例えばSambrook,J.& Russel,D. 著、Molecular Cloning, A LABORATORY MANUAL、Cold Spring Harbor Laboratory Press、2001年1月15日発行、の 第1巻7.42〜7.45、第2巻8.9〜8.17に記載されている。
【0095】
3.2 抗体
本発明はさらに、配列番号1〜10で表される塩基配列によってコードされるポリペプチド、例えば配列番号21〜27で表されるアミノ酸配列を有するポリペプチド、に対する2以上の抗体、その断片、又はそれらの化学修飾誘導体を含む、食道ガン転移の判定、検出、診断又は予測のための組成物を提供する。
【0096】
すなわち、本発明により、食道ガン転移マーカーとしての、上記SHC1、C1R、LAMA5、PGAM1、ZNF708、YWHAQ、AC004609、ZNF714、LOC152667、ZNF716遺伝子によってコードされるポリペプチド、それらの同族体、或いはそれらの変異体又は誘導体を検出するために、これらのポリペプチドに対する抗体を2以上、好ましくは3以上、より好ましくは6以上組み合わせて用いることができる。
【0097】
これらのポリペプチドは、DNA組換え技術によって得ることができる。例えば、上記のようにして得られたcDNAクローンを発現ベクターに組み込み、該ベクターによって形質転換又はトランスフェクションされた原核又は真核宿主細胞を培養することによって該細胞又は培養上清から得ることができる。ベクター及び発現系はNovagen社、宝酒造、第一化学薬品、Qiagen社、Stratagene社、Promega社、Roche Diagnositics社、Invitrogen社、Genetics Institute社、Amersham Bioscience社などから入手可能である。宿主細胞としては、細菌などの原核細胞(例えば大腸菌、枯草菌)、酵母(例えばサッカロマイセス・セレビシアエ)、昆虫細胞(例えばSf細胞)、哺乳動物細胞(例えばCOS、CHO、BHK)などを用いることができる。ベクターには、該ポリペプチドをコードするDNAの他に、調節エレメント、例えばプロモーター、エンハンサー、ポリアデニル化シグナル、リボソーム結合部位、複製開始点、ターミネーター、選択マーカーなどを含むことができる。またポリペプチドの精製を容易にするために標識ペプチドをポリペプチドのC末端又はN末端につけた融合ポリペプチドとしてもよい。代表的な標識ペプチドには、6〜10残基のヒスチジンリピート、FLAG、mycぺプチド、GFPポリペプチドなどが挙げられるが、標識ペプチドはこれらにかぎられるものではない。またDNA組換え技術については、Sambrook, J. & Russel, D.(上記)に記載されている。
【0098】
標識ペプチドを付けずに本発明に係るポリペプチドを生産した場合には、その精製法として例えばイオン交換クロマトグラフィーによる方法を挙げることができる。またこれに加えて、ゲルろ過や疎水性クロマトグラフィー、等電点クロマトグラフィーなどを組み合わせる方法でもよい。一方、当該タンパクにヒスチジンリピート、FLAG、myc、GFPといった標識ペプチドを付けている場合には、一般に用いられるそれぞれの標識ペプチドに適したアフィニティークロマトグラフィーによる方法を挙げることができる。単離・精製が容易となるような発現ベクターを構築するとよい。特にポリペプチドと標識ペプチドとの融合ポリペプチドの形態で発現するように発現ベクターを構築し、遺伝子工学的に当該ポリペプチドを調製すれば、単離・精製も容易である。
【0099】
このようにして得られたポリペプチドを認識する抗体は、抗体の抗原結合部位を介して、該ポリペプチドに特異的に結合し得る。具体的には、配列番号21〜27のアミノ酸配列を有するポリペプチド又はその断片、その変異体ポリペプチド又は融合ポリペプチドなどを、それぞれに免疫反応性である抗体を産生するための免疫原として使用することが可能である。
【0100】
より具体的には、ポリペプチド、断片、変異体、融合ポリペプチドなどは、抗体形成を引き出す抗原決定基又はエピトープを含むが、これら抗原決定基又はエピトープは、直鎖でもよいし、より高次構造(断続的)でもよい。なお、該抗原決定基又はエピトープは、当該技術分野に知られるあらゆる方法によって同定できる。
【0101】
本発明のポリペプチドによってあらゆる態様の抗体が誘導される。該ポリペプチドの全部若しくは一部又はエピトープが単離されていれば、慣用的技術を用いてポリクローナル抗体及びモノクローナル抗体のいずれも調製可能である。方法には例えば、Kennetら(監修),Monoclonal Antibodies,Hybridomas: A New Dimension in Biological Analyses,Ple num Press,New York,1980に挙げられた方法がある。
【0102】
本発明の抗体としては、本発明の標的ポリペプチド又はその断片と特異的に結合するものであれば特に限定されず、モノクローナル抗体でもポリクローナル抗体でも使用することができるが、モノクローナル抗体を使用するのが好ましい。また、本発明の抗体のグロブリンタイプは、上記特徴を有するものである限り特に限定されるものではなく、IgG、IgM、IgA、IgE、IgDのいずれでもよい。
【0103】
<モノクローナル抗体の作製>
(1)免疫及び抗体産生細胞の採取
標的ポリペプチドからなる免疫原を、哺乳動物、例えばラット、マウス(例えば近交系マウスのBalb/c)、ウサギなどに投与する。免疫原の1回の投与量は、免疫動物の種類、投与経路などにより適宜決定されるものであるが、動物1匹当たり約50〜200μgとされる。免疫は主として皮下、腹腔内に免疫原を注入することにより行われる。また、免疫の間隔は特に限定されず、初回免疫後、数日から数週間間隔で、好ましくは1〜4週間間隔で、2〜10回、好ましくは3〜4回追加免疫を行う。初回免疫の後、免疫動物の血清中の抗体価の測定をELISA(Enzyme−Linked Immuno Sorbent Assay)法などにより繰り返し行い、抗体価がプラトーに達したときは、免疫原を静脈内又は腹腔内に注射し、最終免疫とする。そして、最終免疫の日から2〜5日後、好ましくは3日後に、抗体産生細胞を採取する。抗体産生細胞としては、脾臓細胞、リンパ節細胞、末梢血細胞等が挙げられるが、脾臓細胞又は局所リンパ節細胞が好ましい。
【0104】
(2)細胞融合
各標的ポリペプチドに特異的なモノクローナル抗体を産生するハイブリドーマ細胞株を作製する。こうしたハイブリドーマは、慣用的技術によって産生し、そして同定することが可能である。こうしたハイブリドーマ細胞株を産生するための1つの方法は、動物を本発明のタンパク質で免疫し、免疫された動物から脾臓細胞を採取し、該脾臓細胞を骨髄腫細胞株に融合させ、それによりハイブリドーマ細胞を生成し、そして該酵素に結合するモノクローナル抗体を産生するハイブリドーマ細胞株を同定することを含む。抗体産生細胞と融合させる骨髄腫細胞株としては、マウスなどの動物の一般に入手可能な株化細胞を使用することができる。使用する細胞株としては、薬剤選択性を有し、未融合の状態ではHAT選択培地(ヒポキサンチン、アミノプテリン、チミジンを含む)で生存できず、抗体産生細胞と融合した状態でのみ生存できる性質を有するものが好ましい。また株化細胞は、免疫動物と同種系の動物に由来するものが好ましい。骨髄腫細胞株の具体例としては、BALB/cマウス由来のヒポキサンチン・グアニン・ホスホリボシル・トランスフェラーゼ(HGPRT)欠損細胞株であるP3X63−Ag.8株(ATCC TIB9)などが挙げられる。
【0105】
次に、上記骨髄腫細胞株と抗体産生細胞とを細胞融合させる。細胞融合は、血清を含まないDMEM、RPMI−1640培地などの動物細胞培養用培地中で、抗体産生細胞と骨髄腫細胞株とを約1:1〜 20:1の割合で混合し、細胞融合促進剤の存在下にて融合反応を行う。細胞融合促進剤として、平均分子量1500〜4000ダルトンのポリエチレングリコール等を約10〜80%の濃度で使用することができる。また場合によっては、融合効率を高めるために、ジメチルスルホキシドなどの補助剤を併用してもよい。さらに、電気刺激(例えばエレクトロポレーション)を利用した市販の細胞融合装置を用いて抗体産生細胞と骨髄腫細胞株とを融合させることもできる。
【0106】
(3)ハイブリドーマの選別及びクローニング
細胞融合処理後の細胞から目的とするハイブリドーマを選別する。その方法として、細胞懸濁液を、例えばウシ胎児血清含有RPMI−1640培地などで適当に希釈後、マイクロタイタープレート上に200万個/ウエル程度まき、各ウエルに選択培地を加え、以後適当に選択培地を交換して培養を行う。培養温度は、20〜40℃ 、好ましくは約37℃である。ミエローマ細胞がHGPRT欠損株又はチミジンキナーゼ欠損株のものである場合には、ヒポキサンチン・アミノプテリン・チミジンを含む選択培地(HAT培地)を用いることにより、抗体産生能を有する細胞と骨髄腫細胞株のハイブリドーマのみを選択的に培養し、増殖させることができる。その結果、選択培地で培養開始後、約14日前後から生育してくる細胞をハイブリドーマとして得ることができる。
【0107】
次に、増殖してきたハイブリドーマの培養上清中に、目的とする抗体が存在するか否かをスクリーニングする。ハイブリドーマのスクリーニングは、通常の方法に従えばよく、特に限定されない。例えば、ハイブリドーマとして生育したウエルに含まれる培養上清の一部を採取し、酵素免疫測定法(EIA:Enzyme Immuno Assay、及びELISA)、放射免疫測定法(RIA:Radio Immuno Assay)等によって行うことができる。融合細胞のクローニングは、限界希釈法等により行い、最終的にモノクローナル抗体産生細胞であるハイブリドーマを樹立する。本発明のハイブリドーマは、後述するように、RPMI−1640、DMEM等の基本培地中での培養において安定であり、標的ポリペプチドと特異的に反応するモノクローナル抗体を産生、分泌するものである。
【0108】
(4)抗体の回収
モノクローナル抗体は、慣用的技術によって回収可能である。すなわち樹立したハイブリドーマからモノクローナル抗体を採取する方法として、通常の細胞培養法又は腹水形成法等を採用することができる。細胞培養法においては、ハイブリドーマを10% ウシ胎児血清含有RPMI−1640培地、MEM培地又は無血清培地等の動物細胞培養培地中で、通常の培養条件(例えば37℃、5%CO2濃度)で2〜10日間培養し、その培養上清から抗体を取得する。腹水形成法の場合は、ミエローマ細胞由来の哺乳動物と同種系動物の腹腔内にハイブリドーマを約1000万個投与し、ハイブリドーマを大量に増殖させる。そして、1〜2週間後に腹水又は血清を採取する。
【0109】
上記抗体の採取方法において、抗体の精製が必要とされる場合は、硫安塩析法、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、ゲルクロマトグラフィーなどの公知の方法を適宜に選択して、又はこれらを組み合わせることにより、精製されたモノクローナル抗体を得ることができる。
【0110】
<ポリクローナル抗体の作製>
ポリクローナル抗体を作製する場合は、前記と同様にウサギ等の動物を免疫し、最終の免疫日から6〜60日後に、酵素免疫測定法(EIA及びELISA)、放射免疫測定法(RIA)等で抗体価を測定し、最大の抗体価を示した日に採血し、抗血清を得る。その後は、抗血清中のポリクローナル抗体の反応性をELISA法などで測定する。ポリクローナル抗体はさらに、精製ポリペプチドを結合した親和性カラムに結合させることを含む、いわゆる吸収法によって、特異的抗体として調製することができる。
【0111】
本発明で使用可能な抗体又は断片は、上記のポリクローナル抗体及びモノクローナル抗体の他に、合成抗体、組換え抗体、多重特異性抗体(二重特異性抗体を含む)、単鎖抗体(単鎖ダイアボディ、scFvなどを含む)、Fab断片、F(ab’)2断片などを含むことができる。
【0112】
本発明で使用される抗体は、組成物の他にキットの形態をとることができる。キットに含まれる抗体は、個別に又は混合物の形態で存在しうるし、或いは固相担体に結合されていてもよいし又は遊離の形態でもよい。さらに、そのようなキットは、標識二次抗体、担体、洗浄バッファー、試料希釈液、酵素基質、反応停止液、精製された標準物質としてのマーカー(標的)ポリペプチド、使用説明書、等を含むことができる。
【0113】
4.食道ガン転移診断用キット
本発明はまた、本発明の組成物に含まれるものと同じポリヌクレオチド、その変異体及び/又はその断片の1つ又は複数を含む食道ガン診断(検出)用キットを提供する。
【0114】
本発明のキットは、好ましくは、上記3.1に記載したポリヌクレオチド類から選択される2以上、好ましくは3以上、より好ましくは6以上のポリヌクレオチド又はその断片を含む。
【0115】
本発明のキットは、配列番号1〜10で表される塩基配列を含むポリヌクレオチド、その相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はそれらのポリヌクレオチドの断片を少なくとも2つ含むことができる。
【0116】
本発明のキットに含むことができるポリヌクレオチド断片は、例えば下記の(1)〜(5)からなる群より選択される2以上のDNAである:
(1)配列番号1〜10で表される塩基配列又はその相補的配列において、15以上の連続した塩基を含むDNA。
(2)配列番号1〜10で表される塩基配列又はその相補的配列において、60以上の連続した塩基を含むDNA。
(3)配列番号1〜10で表される塩基配列又はその相補的配列において、それぞれ配列番号11〜20で表される塩基配列又はその相補的配列を含み、かつ60以上の連続した塩基を含むDNA。
(4)配列番号11〜20で表される塩基配列からなるDNA。
(5)配列番号11〜20で表される塩基配列に相補的な塩基配列を含むDNA。
【0117】
好ましい実施形態では、前記ポリヌクレオチドが、配列番号1〜10のいずれかで表される塩基配列からなるポリヌクレオチド、その相補的配列からなるポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はそれらの15以上の連続した塩基を含む断片である。
【0118】
好ましい実施形態では、前記断片は、15以上、好ましくは20〜30又はそれ以上、より好ましくは40〜50又はそれ以上、さらに好ましくは60以上の連続した塩基を含むポリヌクレオチドであることができる。
【0119】
別の好ましい実施形態では、前記断片が、配列番号1〜10のいずれかで表される塩基配列において、それぞれ配列番号11〜20のいずれかで表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド、又は該ポリヌクレオチドの配列に相補的な塩基配列を含むポリヌクレオチドである。
【0120】
別の好ましい実施形態では、前記断片が、配列番号11〜20のいずれかで表される塩基配列を含むポリヌクレオチドである。
【0121】
別の好ましい実施形態では、前記断片が、配列番号11〜20のいずれかで表される塩基配列に相補的な塩基配列を含むポリヌクレオチドである。
【0122】
別の好ましい実施形態では、前記断片が、配列番号11〜20のいずれかで表される塩基配列からなるポリヌクレオチドである。
【0123】
上記の組み合わせの具体例は、配列番号1及び2の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜3の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜4の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜5の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜6の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜7の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜8の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜9の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜10の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はその断片である。
【0124】
また、別の組み合わせの具体例は、配列番号2及び3の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜4の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜5の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜5の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜6の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜7の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜8の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜9の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜10の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はその断片である。
【0125】
別のより好ましい実施形態によれば、本発明のキットは、配列番号11〜20で表される塩基配列又はその相補的配列を含むポリヌクレオチドの2以上〜全部を含むことができる。
【0126】
例えば、そのような組み合わせの例は、配列番号12及び13の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜14の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜15の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜15の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜16の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜17の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜18の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜19の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜20の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はその断片である。
【0127】
ポリヌクレオチド又はその断片1個での食道ガン判別確率が60数%に過ぎないが、異なる遺伝子由来のポリヌクレオチド又はその断片2個以上、好ましくは3個以上、より好ましくは6個以上、を組み合わせると80%超から90数%まで確率が向上する。
【0128】
本発明において、ポリヌクレオチドの断片のサイズは、各ポリヌクレオチドの塩基配列において、例えば、連続する15〜配列の全塩基数、15〜5000塩基、15〜4500塩基、15〜4000塩基、15〜3500塩基、15〜3000塩基、15〜2500塩基、15〜2000塩基、15〜1500塩基、15〜1000塩基、15〜900塩基、15〜800塩基、15〜700塩基、15〜600塩基、15〜500塩基、15〜400塩基、15〜300塩基、15〜250塩基、15〜200塩基、15〜150塩基、15〜140塩基、15〜130塩基、15〜120塩基、15〜110塩基、15〜100塩基、15〜90塩基、15〜80塩基、15〜70塩基、15〜60塩基、15〜50塩基、15〜40塩基、15〜30塩基又は15〜25塩基;25〜配列の全塩基数、25〜1000塩基、25〜900塩基、25〜800塩基、25〜700塩基、25〜600塩基、25〜500塩基、25〜400塩基、25〜300塩基、25〜250塩基、25〜200塩基、25〜150塩基、25〜140塩基、25〜130塩基、25〜120塩基、25〜110塩基、25〜100塩基、25〜90塩基、25〜80塩基、25〜70塩基、25〜60塩基、25〜50塩基又は25〜40塩基;50〜配列の全塩基数、50〜1000塩基、50〜900塩基、50〜800塩基、50〜700塩基、50〜600塩基、50〜500塩基、50〜400塩基、50〜300塩基、50〜250塩基、50〜200塩基、50〜150塩基、50〜140塩基、50〜130塩基、50〜120塩基、50〜110塩基、50〜100塩基、50〜90塩基、50〜80塩基、50〜70塩基又は50〜60塩基;60〜配列の全塩基数、60〜1000塩基、60〜900塩基、60〜800塩基、60〜700塩基、60〜600塩基、60〜500塩基、60〜400塩基、60〜300塩基、60〜250塩基、60〜200塩基、60〜150塩基、60〜140塩基、60〜130塩基、60〜120塩基、60〜110塩基、60〜100塩基、60〜90塩基、60〜80塩基又は60〜70塩基などの範囲の塩基数である。
【0129】
本発明のキットを構成する上記の組み合わせは、あくまでも例示であり、他の種々の可能な組み合わせのすべてが本発明に包含されるものとする。
【0130】
本発明のキットには、上で説明した本発明におけるポリヌクレオチド、その変異体又はその断片に加えて、食道ガンの検出を可能とする既知の又は将来見出されるポリヌクレオチドも包含させることができる。
【0131】
本発明のキットに含まれるポリヌクレオチド、その変異体又はその断片は、個別に又は任意に組み合わせて異なる容器に包装される。
【0132】
5.DNAチップ
本発明はさらに、本発明の組成物及び/又はキットに含まれるものと同じポリヌクレオチド(或いは、上記の3.1節の組成物及び/又は4節のキットに記載されたポリヌクレオチド)、変異体、断片及びそれらの組み合わせを含む食道ガン転移診断用DNAチップを提供する。
【0133】
DNAチップの基板としては、DNAを固相化できるものであれば特に制限はなく、スライドガラス、シリコン製チップ、ポリマー製チップ及びナイロンメンブレンなどを例示することができる。またこれらの基板にはポリL−リジンコートやアミノ基、カルボキシル基などの官能基導入などの表面処理がされていてもよい。
【0134】
また固相化法については一般に用いられる方法であれば特に制限はなく、スポッター又はアレイヤーと呼ばれる高密度分注機を用いてDNAをスポットする方法や、ノズルより微少な液滴を圧電素子などにより噴射する装置(インクジェット)を用いてDNAを基板に吹き付ける方法、又は基板上で順次ヌクレオチド合成を行う方法を例示することができる。高密度分注機を用いる場合には、例えば多数のウエルを持つプレートのおのおののウエルに異なった遺伝子溶液を入れておき、この溶液をピン(針)で取り上げて基板上に順番にスポットすることによる。インクジェット法では、ノズルより遺伝子を噴射し、基板上に高速度で遺伝子を整列配置することによる。基板上でのDNA合成は、基板上に結合した塩基を光によって脱離する官能基で保護し、マスクを用いることにより特定部位の塩基だけに光を当て、官能基を脱離させる。その後、塩基を反応液に加えて、基板上の塩基とカップリングさせる工程を繰り返すことによって行われる。
【0135】
固相化されるポリヌクレオチドは、上記で説明した本発明の全てのポリヌクレオチドである。
【0136】
例えば、そのようなポリヌクレオチドは、以下の(1)〜(12)のポリヌクレオチド及びその断片のうち異なる遺伝子由来の2以上、好ましくは3以上、より好ましくは6以上のポリヌクレオチド又はその断片を含むことができる。
(1)配列番号1〜10で表される塩基配列からなるポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(2)配列番号1〜10で表される塩基配列を含むポリヌクレオチド群。
(3)配列番号1〜10で表される塩基配列からなるポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(4)配列番号1〜10で表される塩基配列を含むポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(5)配列番号1〜10で表される塩基配列に相補的な塩基配列からなるポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(6)配列番号1〜10で表される塩基配列に相補的な塩基配列を含むポリヌクレオチド群。
(7)配列番号1〜10で表される塩基配列の各々と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズするポリヌクレオチド群、又は15以上の連続した塩基を含むそれらの断片。
(8)配列番号1〜10で表される塩基配列の各々からなるDNAとストリンジェントな条件でハイブリダイズするポリヌクレオチド群、又は15以上の連続した塩基を含むそれらの断片。
(9)配列番号1〜10で表される塩基配列又はその相補的配列の各々において、15以上の連続した塩基を含むポリヌクレオチド。
(10)配列番号1〜10で表される塩基配列又はその相補的配列の各々において、60以上の連続した塩基を含むポリヌクレオチド。
(11)配列番号1〜10で表される塩基配列において、それぞれ配列番号11〜20で表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド。
(12)配列番号1〜10で表される塩基配列に相補的な配列において、それぞれ配列番号11〜20で表される塩基配列に相補的な配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド。
【0137】
好ましい実施形態によれば、本発明のDNAチップは、配列番号11〜20で表される塩基配列又はその相補的配列を含むポリヌクレオチドの2以上から全部を含むことができる。
【0138】
本発明において、固相化されるポリヌクレオチドは、ゲノムDNA、cDNA、RNA、合成DNA、合成RNAのいずれでもよいし、或いは1本鎖でもよいし又は2本鎖でもよい。
【0139】
標的遺伝子、RNA又はcDNAの発現レベルを検出、測定することができるDNAチップの例としては、Affymetrix社のGene Chip Human Genome U133 Plus 2.0 Array、Agilent社のWhole human genome oligo microarray、タカラバイオ社のIntelliGene(登録商標)HS Human Expression CHIPなどを挙げることができる。
【0140】
DNAマイクロアレイの作製について、例えば予め調製したプローブを固相表面に固定化する方法を使用することができる。予め調製したポリヌクレオチドプローブを固相表面に固定化する方法では、官能基を導入したポリヌクレオチドを合成し、表面処理した固相担体表面にオリゴヌクレオチド又はポリヌクレオチドを点着し、共有結合させる(例えば、J.B.Lamtureら、Nucleic.Acids.Research、1994年、第22巻、p.2121−2125、Z.Guoら、Nucleic.Acids.Research、1994年、第22巻、p.5456−5465)。ポリヌクレオチドは、一般的には、表面処理した固相担体にスペーサ-やクロスリンカーを介して共有結合される。ガラス表面にポリアクリルアミドゲルの微小片を整列させ、そこに合成ポリヌクレオチドを共有結合させる方法も知られている(G.Yershovら、Proceedings of the National Academic Sciences U.S.A.、1996年、第94巻、p.4913)。また、シリカマイクロアレイ上に微小電極のアレイを作製し、電極上にはストレプトアビジンを含むアガロースの浸透層を設けて反応部位とし、この部位をプラスに荷電させることでビオチン化ポリクレオチドを固定し、部位の荷電を制御することで、高速で厳密なハイブリダイゼーションを可能にする方法も知られている(R.G.Sosnowskiら、Proceedings of the National Academic Sciences U.S.A.、1997年、第94巻、p.1119−1123)。
【0141】
6.食道ガン転移の検出法
6.1 核酸
本発明は、本発明の組成物、キット、DNAチップ、又はそれらの組み合わせを用いて、被験者由来の検体試料中にすでに転移を起こした食道ガン細胞が含まれるかどうかをin vitroで判定する方法であって、手術時にリンパ節転移がなかった患者由来の食道ガン組織に比較して、該検体試料中の細胞の標的核酸の発現量が増加しているか又は低下している場合、該検体試料中にすでに転移がある食道ガン細胞が存在すると判定することを含み、ここで、該標的核酸が該組成物、キット又はDNAチップに含まれるポリヌクレオチド、その変異体又はその断片によって検出可能なものである、方法を提供する。
【0142】
本発明はまた、本発明の組成物、キット又はDNAチップの、被験者由来の検体試料中の食道ガン転移のin vivo検出のための使用を提供する。
【0143】
本発明の上記方法において、組成物、キット又はDNAチップは、上で説明したような、本発明のポリヌクレオチド、その変異体又はその断片を単一で或いはあらゆる可能な組み合わせで含むものが使用される。
【0144】
本発明の食道ガン転移の検出、判定又は(遺伝子)診断において、本発明の組成物、キット又はDNAチップに含まれるポリヌクレオチド、その変異体又はその断片は、プライマーとして又はプローブとして用いることができる。プライマーとして用いる場合には、通常15〜50塩基、好ましくは15〜30塩基、より好ましくは18〜25塩基の塩基長を有するものが例示できる。また検出プローブとして用いる場合には、例えば15塩基〜全配列の塩基数、好ましくは25〜1000塩基、より好ましくは25〜100塩基の塩基長を有するものが例示できるが、この範囲に限定されない。
【0145】
本発明の組成物又はキットに含まれるポリヌクレオチド、その変異体又はその断片は、ノーザンブロット法、RT−PCR法、in situ ハイブリダイゼーション法などの、特定遺伝子を特異的に検出する公知の方法において、定法に従ってプライマー又はプローブとして利用することができる。測定対象試料としては、使用する検出方法の種類に応じて、被験者の食道組織又は食道ガン細胞の存在が疑われる生体組織の一部又は全部をバイオプシーなどで採取するか、もしくは手術によって摘出した生体組織から回収する。さらにそこから常法に従って調製したtotal RNAを用いてもよいし、さらに該RNAをもとにして調製される、cDNA、ポリA(+)RNAを含む各種のポリヌクレオチドを用いてもよい。
【0146】
或いは、生体組織における本発明の遺伝子、RNA、cDNAなどの核酸の発現量は、DNAチップ(DNAマクロアレイを含む)を用いて検出或いは定量することができる。この場合、本発明の組成物又はキットはDNAアレイのプローブとして使用することができる(例えば、アフィメトリックス社のHuman Genome U133 Plus 2.0 Arrayでは25塩基の長さのポリヌクレオチドプローブが用いられる。また、東レ株式会社の3D−Gene(登録商標) Human Oligo chip 25kでは69〜70塩基の長さのポリヌクレオチドプローブが用いられる。)。かかるDNAアレイを生体組織から採取したRNAをもとに調製される標識DNA又はRNAとハイブリダイズさせ、該ハイブリダイズによって形成された上記プローブと標識DNA又はRNAとの複合体を、該標識DNA又はRNAの標識を指標として検出することにより、生体組織中での本発明食道ガン転移関連遺伝子の発現の有無又は発現レベル(発現量)を評価することができる。本発明の方法では、DNAチップを好ましく使用できるが、これは、ひとつの生体試料について同時に複数遺伝子の発現の有無又は発現レベルの評価が可能である。
【0147】
本発明の組成物、キット又はDNAチップは、食道ガン転移の診断、判定又は検出(罹患の有無や罹患の程度の診断)のために有用である。具体的には、該組成物、キット又はDNAチップを使用した食道ガン転移の診断は、被験者の食道ガン細胞の存在する生体組織と、手術時にリンパ節転移がなかった患者由来の食道ガン組織及び/又は手術時にリンパ節転移があった患者由来の食道ガン組織との比較、或いは、手術時にリンパ節転移がなかった患者及び/又は手術時にリンパ節転移があった患者の同等の生体組織との比較を行い、該診断用組成物で検出される遺伝子の発現レベルの違いを判定することによって行うことができる。この場合、遺伝子発現レベルの違いには、発現の有無だけではなく、転移がある食道ガン細胞の存在する生体組織と転移がない食道ガン細胞の存在する生体組織の両者ともに発現がある場合でも、両者間の発現量を比較した時の差が検定上有意(p値<0.05)である場合が含まれる。例えばSHC1遺伝子は転移のある食道ガンで発現誘導を示すので、被験者の食道ガン組織では発現しており、該発現量と転移がない食道ガン細胞の存在する生体組織の発現量と比べて検定を行った時に、その差が有意であれば、被験者について食道ガンの転移が疑われる。
【0148】
本発明の組成物、キット又はDNAチップを利用した転移がある食道ガン(細胞)の検出方法は、被験者の生体組織の一部又は全部をバイオプシーなどで採取するか、もしくは手術によって摘出した生体組織から回収し、そこに含まれる遺伝子を、本発明のポリヌクレオチド群から選ばれた単数又は複数のポリヌクレオチド、その変異体又はその断片を用いて検出し、その遺伝子発現量を測定することにより、食道ガンの転移の有無又はその程度を診断することを含む。また本発明の食道ガン転移の検出方法は、例えば食道ガン患者において、該疾患の改善のために治療薬を投与した場合における該疾患の改善の有無又はその程度を検出、判定又は診断することもできる。
【0149】
本発明の方法は、例えば以下の(a)、(b)及び(c)の工程:
(a)被験者由来の検体試料を、本発明の組成物、キット又はDNAチップのポリヌクレオチドと接触させる工程、
(b)生体試料中の標的核酸の発現レベルを、上記ポリヌクレオチドをプローブとして用いて測定する工程、
(c)(b)の結果をもとに、該検体試料中の食道ガン(細胞)転移の存在又は不存在を判定する工程、
を含むことができる。
【0150】
本発明方法で用いられる検体試料としては、被験者の生体組織、例えば食道組織及びその周辺組織、食道ガンの転移が疑われる組織など、から調製される試料を挙げることができる。具体的には該組織から調製されるRNA含有試料、或いはそれからさらに調製されるポリヌクレオチドを含む試料は、被験者の生体組織の一部又は全部をバイオプシーなどで採取するか、もしくは手術によって摘出した生体組織から回収し、そこから常法に従って調製することができる。
【0151】
ここで被験者とは、哺乳動物、例えば非限定的にヒト、サル、マウス、ラットなどを指し、好ましくはヒトである。
【0152】
本発明の方法は、測定対象として用いる生体試料の種類に応じて工程を変更することができる。
【0153】
測定対象物としてRNAを利用する場合、食道ガン(細胞)の検出は、例えば下記の工程(a)、(b)及び(c):
(a)被験者の生体試料から調製されたRNA又はそれから転写された相補的ポリヌクレオチド(cDNA)を、本発明の組成物、キット又はDNAチップのポリヌクレオチドと結合させる工程、
(b) 該ポリヌクレオチドに結合した生体試料由来のRNA又は該RNAから転写された相補的ポリヌクレオチドを、上記ポリヌクレオチドをプローブとして用いて測定する工程、
(c) 上記(b)の測定結果に基づいて、食道ガン(細胞)の存在又は不存在を判定する工程、
を含むことができる。
【0154】
本発明によって食道ガン(細胞)を検出、判定又は診断するために、例えば種々のハイブリダイゼーション法を使用することができる。かようなハイブリダイゼーション法には、例えばノーザンブロット法、サザンブロット法、RT−PCR法、DNAチップ解析法、in situハイブリダイゼーション法、サザンハイブリダイゼーション法などを使用することができる。
【0155】
ノーザンブロット法を利用する場合は、本発明の診断用組成物をプローブとして用いることによって、RNA中の各遺伝子発現の有無やその発現レベルを検出、測定することができる。具体的には、本発明の診断用組成物(相補鎖)を放射性同位元素(32P、33P、35Sなど)や蛍光物質などで標識し、それを常法にしたがってナイロンメンブレンなどにトランスファーした被験者の生体組織由来のRNAとハイブリダイズさせたのち、形成された診断用組成物(DNA)とRNAとの二重鎖を診断用組成物の標識物(放射性同位元素又は蛍光物質)に由来するシグナルを放射線検出器(BAS-1800II、富士写真フィルム株式会社、などを例示できる)又は蛍光検出器(STORM860、Amersham Bioscience社、などを例示できる)で検出、測定する方法を例示することができる。
【0156】
本明細書で使用する「被験者」なる用語は、哺乳動物(例えばヒト、ペット動物、家畜類など)を指し、好ましくはヒトである。
【0157】
定量RT―PCR法を利用する場合には、本発明の上記診断用組成物をプライマーとして用いることによって、RNA中の遺伝子発現の有無やその発現レベルを検出、測定することができる。具体的には、被験者の生体組織由来のRNAから常法にしたがってcDNAを調製して、これを鋳型として標的の各遺伝子の領域が増幅できるように、本発明の診断用組成物から調製した1対のプライマー(上記cDNAに結合する正鎖と逆鎖からなる)をcDNAとハイブリダイズさせて常法によりPCR法を行い、得られた二本鎖DNAを検出する方法を例示することができる。なお、二本鎖DNAの検出法としては、上記PCRをあらかじめ放射性同位元素や蛍光物質で標識しておいたプライマーを用いて行う方法、PCR産物をアガロースゲルで電気泳動し、エチジウムブロマイドなどで二本鎖DNAを染色して検出する方法、産生された二本鎖DNAを常法にしたがってナイロンメンブレンなどにトランスファーさせて標識した診断用組成物をプローブとしてこれとハイブリダイズさせて検出する方法をとることができる。
【0158】
DNAアレイ解析を利用する場合は、本発明の上記診断用組成物をDNAプローブ(一本鎖又は二本鎖)として基板に貼り付けたDNAチップを用いる。遺伝子群を基板に固相化したものには、一般にDNAチップ及びDNAアレイという名称があり、DNAアレイにはDNAマクロアレイとDNAマイクロアレイが包含されるが、本明細書ではDNAチップといった場合、該DNAアレイを含むものとする。
【0159】
ハイブリダイゼーション条件は、限定されないが、例えば30℃〜50℃で、3〜4×SSC、0.1〜0.5% SDS中で1〜24時間のハイブリダイゼーション、より好ましくは40℃〜45℃で、3.4×SSC、0.3%SDS中で1〜24時間のハイブリダイゼーション、そしてその後の洗浄を含む。洗浄条件としては、例えば、2×SSCと0.1%SDSを含む溶液、及び1×SSC溶液、0.2×SSC溶液による室温での連続した洗浄などの条件を挙げることができる。ここで、1×SSCは、150mM塩化ナトリウム及び15mMクエン酸ナトリウムを含む水溶液(pH7.2)である。相補鎖はかかる条件で洗浄しても対象とする正鎖とハイブリダイズ状態を維持するものであることが望ましい。具体的にはこのような相補鎖として、対象の正鎖の塩基配列と完全に相補的な関係にある塩基配列からなる鎖、並びに該鎖と少なくとも80%の相同性を有する塩基配列からなる鎖を例示することができる。
【0160】
本発明の組成物又はキットのポリヌクレオチド断片をプライマーとしてPCRを実施する際のストリンジェントなハイブリダイゼーション条件の例としては、例えば10mMTris−HCL(pH8.3)、50mMKCL、1〜2mM MgCl2などの組成のPCRバッファーを用い、当該プライマーの配列から計算されたTm+5〜10℃において15秒から1分程度処理することなどが挙げられる。かかるTmの計算方法としてTm=2×(アデニン残基数+チミン残基数)+4×(グアニン残基数+シトシン残基数)などが挙げられる。
【0161】
これらのハイブリダイゼーションにおける「ストリンジェントな条件」の他の例については、例えばSambrook, J. & Russel, D. 著、Molecular Cloning, A LABORATORY MANUAL、Cold Spring Harbor Laboratory Press、2001年1月15日発行、の 第1巻7.42〜7.45、第2巻8.9〜8.17などに記載されており、本発明において利用できる。
【0162】
本発明はまた、本発明の組成物、キット、DNAチップ、又はそれらの組み合わせを用いて、被験者由来の検体試料中の標的核酸又は遺伝子の発現量を測定し、食道ガン組織と正常組織の遺伝子発現量を教師(訓練サンプル)としたサポートベクターマシーン(SVM)を判別式として、検体試料中に転移がある食道ガン細胞が含まれないこと及び/又は含まれることを判定する方法を提供する。
【0163】
すなわち、本発明はさらに、本発明の組成物、キット、DNAチップ、又はそれらの組み合わせを用いて、転移がある患者由来の食道ガン細胞を含む組織又は転移がない患者由来の食道ガン細胞であることが既知の複数の生体試料中の標的核酸の発現量をin vitroで測定する第1の工程、前記第1の工程で得られた該標的核酸の発現量の測定値を教師とした判別式(サポートベクターマシーン)を作成する第2の工程、被験者の食道由来の検体試料中の該標的核酸の発現量を第1の工程と同様にin vitroで測定する第3の工程、前記第2の工程で得られた判別式に第3の工程で得られた該標的酢酸の発現量の測定値を代入し、該判別式から得られた結果に基づいて、検体試料中に転移がある食道ガン細胞が含まれないこと及び/又は転移がない食道ガン細胞が含まれることを判定する第4の工程を含む、ここで、該標的核酸が該組成物、キット又はDNAチップに含まれるポリヌクレオチド、その変異体又はその断片によって検出可能なものである、前記方法を提供する。
【0164】
或いは、本発明の方法は、例えば下記の工程(a)、(b)及び(c):
(a)転移がある患者由来の食道ガン細胞を含む組織又は転移がない患者由来の食道ガン細胞組織であることが既知の生体試料中の標的遺伝子の発現量を、本発明による診断(検出)用組成物、キット又はDNAチップを用いて測定する工程、
(b)(a)で測定された発現量の測定値を、下記の数1〜数5の式に代入して、SVMと呼ばれる判別式を作成する工程、
(c)被験者由来の検体試料中の該標的遺伝子の発現量を、本発明による診断(検出)用組成物、キット又はDNAチップを用いて測定し、(b)で作成した判別式にそれらを代入して、得られた結果に基づいて該検体試料中に転移がある食道ガン細胞が含まれるかどうかを判定する工程、
を含むことができる。
【0165】
SVMとは2クラスの分類問題を解くためにつくられた1995年にAT&TのV.Vapnik(The Nature of Statistical Leaning Theory、Springer、1995年発行)によって統計的学習理論の枠組みで提案された学習機械である。SVMは線形の識別器であるが、後述するカーネルを組み合わせることによって非線形問題を扱うことができる。異なるクラスの訓練サンプルについて、それらを識別する多数の超平面のうち、その超平面と訓練サンプルとの最小距離が最大となる超平面を識別面とすることにより、新たに与えられるテストサンプルがどのクラスに属するかを最も正確に識別することができる。
【0166】
SVMでは線形問題のみしか扱うことができないが、本質的に非線形な問題に対応するための方法として、特徴ベクトルを高次元へ非線形変換し、その空間で線形の識別を行う方法が知られている。こうすれば、元の空間で非線形モデルを用いているのと等価となる。しかし高次元への写像を行うと膨大な計算量が必要となり、汎化能力も減少する。SVMでは識別関数が入力パターンの内積のみに依存した形になっており、内積が計算できれば最適な識別関数を構成することが可能である。非線形に写像した空間での二つの要素の内積がそれぞれのもとの空間での入力のみで表現されるような式のことをカーネルと呼び、高次元に写像しながら、実際には写像された空間での特徴の計算を避けてカーネルの計算のみで最適な識別関数、すなわち判別式を構成することができる。
【0167】
本発明の方法で使用可能な判別式の算出例を以下に示す。
SVMを決めるためには食道ガン細胞を含む組織又は正常組織であることが既知の生体試料中の標的遺伝子の発現量を教師(訓練サンプル)として用意し、以下の手順によって識別関数の定数を決定することができる。
【0168】
訓練サンプルxiは(+1、−1)でクラス分けされる、食道ガン細胞を含む組織群、又は正常組織群のいずれかに属しているとする。これらの訓練サンプルが超平面によって線形分離できるとき、識別関数は例えば次式となる。
【0169】
【数1】

(ここで、wは重み係数、bはバイアス定数、xはサンプルの変数を表す。)
ただし、この関数には制約条件:
【0170】
【数2】

(ここで、Tは内積、yはサンプルのクラス、ζはスラック変数を表す。)
があるため、Lagurangeの未定乗数法を用いることによりLagurange乗数αを用いた以下の最適化問題に帰着する。
【0171】
【数3】

ここで、
【0172】
【数4】

(ここで、Cは実験により決定される制限条件パラメーターを表す。)
この問題を解くと最終的に、
【0173】
【数5】

が得られ、識別関数を一義的に得ることができる。この関数に新たに与えられる検体試料(食道ガン細胞を含むかどうか未知の組織の発現遺伝子量)についてのxを代入することによって、f(x)をクラス分け(すなわち、+1又は−1)することができ、検体試料がどちらのクラス(すなわち、転移がある患者由来の食道ガン細胞を含む組織群又は転移がない患者由来の食道ガン細胞)に属するかを識別する。
【0174】
以上に示すように、未知試料のクラス分けを行うためのSVMによる判定式の作成には2群の教師(訓練サンプル)が必要となる。この訓練サンプルは例えば今回の発明の場合、「転移のある食道ガン患者の食道ガン組織から得られた発現遺伝子(遺伝子x1,x2,..xi,...xn)」の各患者に対応したセット、及び「転移のない食道ガン患者の食道ガン組織から得られた発現遺伝子(遺伝子x1,x2,..xi,...xn)」の各患者に対応したセット、の2群である。これらのセットについてそれぞれ測定される発現遺伝子数(n)は実験のデザインによって様々ではあるが、個々の遺伝子については、どのような実験においても2群間で大きく差がある場合と、比較的差が少ない、或いは差がない場合が観察される。SVMによる判別式の精度を上げるためには、訓練サンプルとなる2群に、明確な差があることが条件となるため、遺伝子セットの中から2群間で発現量に差がある遺伝子のみを抽出して利用することが必要である。
【0175】
このように、2群間で差がある遺伝子を抽出する方法としては、平均値の差を検出するパラメトリック解析であるt−検定、ノンパラメトリック解析であるMann―WhitneyのU検定などを利用できる。
【0176】
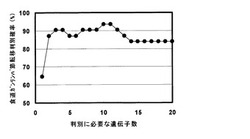
本発明の方法において、例えば、上に記載したような配列番号1〜10に基づく2〜全部、好ましくは3〜全部、さらに好ましくは6〜全部の上記ポリヌクレオチド、並びに/或いは、上に記載したような配列番号11〜20(又は配列番号12〜20)に基づく2〜全部、好ましくは3〜全部、さらに好ましくは6〜全部のポリヌクレオチド、からの任意の組み合わせを用いて、かつ上記の10種の標的遺伝子の発現量がすべて有意に転移がある患者由来の食道ガン組織と転移がない患者由来の食道ガン組織との間で異なり、転移がある患者由来の食道ガン組織において発現が増加しているか、或いは減少していることを指標にして、これら10種の遺伝子について発現量を測定することにより、食道ガンの転移を70%以上、80%以上、好ましくは85%以上、より好ましくは90%以上、さらに好ましくは95%以上の確率で見分けることができる(図1)。
【0177】
6.2 抗体
本発明はさらに、本発明の上記抗体を用いて、被験者由来の食道ガン細胞、血液等の生体試料中の上記ポリペプチドのレベルをin vitroで測定することを含む、被験者の食道ガンの転移の有無をin vitroで予測する方法、或いは食道ガンの転移をin vitroで検出する方法が提供される。
【0178】
具体的には、本発明は、上記10種の遺伝子(例えば、配列番号1〜10に相当する)又はその断片(例えば、配列番号11〜20に相当する)によってコードされるポリペプチド、例えば配列番号21〜27、22〜27などで表されるアミノ酸配列からなるポリペプチド、に対する2〜全部、好ましくは3〜全部、さらに好ましくは6〜全部、の抗体又はその断片を用いて、転移がある患者由来の食道ガン細胞もしくは組織と転移がない患者由来の食道ガン細胞もしくは組織間での該ポリペプチドの発現量、或いは血液中の該ポリペプチドのレベル(又は存在量)、をin vitroで測定することを含む、食道ガン転移の検出方法、或いは食道ガン転移(又は転移の可能性)の有無の予測方法を提供する。
【0179】
測定は、慣用の酵素又は蛍光団で標識した抗体又は断片と、組織切片又はホモゲナイズした組織とを接触させる工程、抗原−抗体複合体を定性的に又は定量的に測定する工程を含むことができる。検出は、例えば免疫電顕により標的ポリペプチドの存在とレベルを測定する方法、ELISAや蛍光抗体法などの慣用法によって標的ポリペプチドのレベルを測定する方法などによって行い、転移がない患者由来の食道ガン細胞もしくは組織と比べて転移がある患者由来の食道ガン細胞もしくは組織において標的ポリペプチドの発現レベル(発現量)が増加しているか又は減少している場合、或いは血液中の該ポリペプチドのレベルが、転移がない食道ガン患者と比べて転移がある食道ガン患者において有意に増加しているか又は低下している場合、食道ガンの転移があると決定する。言い換えれば、前記ポリペプチドの発現量又はレベルが、転移のない患者由来の値と比較して有意に増加又は低下している場合、食道ガンの転移があると決定する。ここで、「有意に」とは、統計学的に有意(p≦0.05)であることを意味する。
【0180】
ポリペプチドの発現レベルは、免疫学的方法によって測定しうる。免疫学的測定法として例えば、酵素免疫測定法(ELISA、EIA)、蛍光免疫測定法、放射免疫測定法(RIA)、発光免疫測定法、免疫比濁法、ラテックス凝集反応、ラテックス比濁法、赤血球凝集反応、粒子凝集反応又はウェスタンブロット法が挙げられる。
【0181】
上記の方法において、標識を用いた免疫測定法により実施する場合には、本発明の抗体を固相化するか、又は試料中の成分を固相化して、それらの免疫学的反応を行うことができる。
【0182】
固相担体としては、ポリスチレン、ポリカーボネート、ポリビニルトルエン、ポリプロピレン、ポリエチレン、ポリ塩化ビニル、ナイロン、ポリメタクリレート、ラテックス、ゼラチン、アガロース、セルロース、セファロース、ガラス、金属、セラミックス又は磁性体等の材質よりなるビーズ、マイクロプレート、試験管、スティック又は試験片等の形状の不溶性担体を用いることができる。
【0183】
固相化は、固相担体と本発明の抗体又は試料成分とを物理的吸着法、化学的結合法又はこれらの併用等の公知の方法に従って結合させることにより行うことができる。
【0184】
さらにまた、本発明においては、本発明の抗体と、試料中の標的ポリペプチドとの反応を容易に検出するために、本発明の抗体を標識することにより該反応を直接検出するか、又は標識二次抗体を用いることにより間接的に検出する。本発明の検出方法においては、感度の点で、後者の間接的検出( 例えばサンドイッチ法など)を利用することが好ましい。
【0185】
標識物質としては、酵素免疫測定法の場合には、ペルオキシダーゼ(POD)、アルカリホスファターゼ、β−ガラクトシダーゼ、ウレアーゼ、カタラーゼ、グルコースオキシダーゼ、乳酸脱水素酵素、アミラーゼ又はビオチン− アビジン複合体等を、蛍光免疫測定法の場合には、フルオレセインイソチオシアネート、テトラメチルローダミンイソチオシアネート、置換ローダミンイソチオシアネート、ジクロロトリアジンイソチオシアネート、Alexa又はAlexaFluoro等を、そして放射免疫測定法の場合にはトリチウム、ヨウ素125又はヨウ素131等を用いることができる。また、発光免疫測定法は、NADH−、FMNH2−、ルシフェラーゼ系、ルミノール−過酸化水素−POD系、アクリジニウムエステル系又はジオキセタン化合物系等を用いることができる。
【0186】
標識物質と抗体との結合法は、酵素免疫測定法の場合にはグルタルアルデヒド法、マレイミド法、ピリジルジスルフィド法又は過ヨウ素酸法等の公知の方法を、放射免疫測定法の場合にはクロラミンT法、ボルトンハンター法等の公知の方法を用いることができる。測定の操作法は、公知の方法(Current protocols in Protein Sciences、1995年、John Wiley & Sons Inc.、Current protocols in Immunology、2001年、John Wiley & Sons Inc.)により行うことができる。例えば、本発明の抗体を直接標識する場合には、試料中の成分を固相化し、標識した本発明の抗体と接触させて、マーカーポリペプチドと本発明の抗体との複合体を形成させる。そして未結合の標識抗体を洗浄分離して、結合標識抗体量又は未結合標識抗体量より試料中の標的ポリペプチドの量を測定することができる。
【0187】
また、例えば標識二次抗体を用いる場合には、本発明の抗体と試料とを反応させ(一次反応)、さらに標識二次抗体を反応させる(二次反応)。一次反応と二次反応は逆の順序で行ってもよいし、同時に行ってもよいし、又は時間をずらして行ってもよい。一次反応及び二次反応により、固相化した標的ポリペプチド−本発明の抗体−標識二次抗体の複合体、又は固相化した本発明の抗体−標的ポリペプチド−標識二次抗体の複合体が形成する。そして未結合の標識二次抗体を洗浄分離して、結合標識二次抗体量又は未結合標識二次抗体量より試料中の標的ポリペプチドの量を測定することができる。
【0188】
具体的には、酵素免疫測定法の場合は標識酵素にその至適条件下で基質を反応させ、その反応生成物の量を光学的方法等により測定する。蛍光免疫測定法の場合には蛍光物質標識による蛍光強度を、放射免疫定法の場合には放射性物質標識による放射能量を測定する。発光免疫測定法の場合は発光反応系による発光量を測定する。
【0189】
本発明の方法では、免疫比濁法、ラテックス凝集反応、ラテックス比濁法、赤血球凝集反応又は粒子凝集反応等における免疫複合体凝集物の生成を、その透過光や散乱光を光学的方法により測るか、目視的に測る測定法により実施する場合には、溶媒としてリン酸緩衝液、グリシン緩衝液、トリス緩衝液又はグッド緩衝液等を用いることができ、更にポリエチレングリコール等の反応促進剤や非特異的反応抑制剤を反応系に含ませてもよい。
【0190】
本発明を以下の実施例によってさらに具体的に説明する。しかし、本発明は、この実施例によって制限されないものとする。
【実施例】
【0191】
1.実験者の臨床病理学的所見
インフォームドコンセントを得た31名の食道ガン患者から、食道ガン摘出手術時又は食道生検実施時に食道の摘出組織を得た。摘出された組織片について肉眼的及び/又は病理組織学的に食道ガン組織を判断し、食道ガン病変部と正常組織部を分けてただちに凍結し、液体窒素中で保存した。別途、周辺の所属リンパ節の採取を行い、食道ガン細胞の転移の有無を病理学的に診断した。
【0192】
2.totalRNA抽出とcDNAの調製
試料として食道ガン患者の食道組織における食道ガン病変部の組織を用いた。おのおのの組織から、Trizol reagent(Invitrogen社)を用いて、同社推奨のプロトコールによりtotalRNAを調製した。
【0193】
上述の方法で得られたtotalRNA 1μgについて、oligo(dT)プライマー及びランダムノナマーを併用し、CyScribe First-Strand cDNA Labeling Kit(GEヘルスケア社)を用いてメーカー推奨のプロトコールで逆転写反応を行った。食道ガン組織由来のtotalRNAにはCy3−dUTP(GEヘルスケア社)を、リファレンスtotalRNA(Stratagene社)にはCy5−dUTP(GEヘルスケア社)を添加して、メーカー推奨のプロトコールで逆転写反応時にcDNAの標識を行った。標識されたcDNAはQIA quick PCR purification Kit(QIAGEN社)で精製してからハイブリダイズに用いた。
【0194】
3.遺伝子絞込みのためのオリゴDNAマイクロアレイ
オリゴDNAマイクロアレイとしてはAffymetrix社GeneChipTM(Human Genome U133 A)と本明細書中で述べる方法に従って作製したガラス製DNAチップ、及び東レ株式会社3D−Gene(登録商標)Human Oligo chip 25kを用いて候補遺伝子の一次絞込みを行い、さらに本明細書中に述べる方法で作製した一次絞込み済みの遺伝子を搭載した3D−Gene基板を利用したオリゴDNAマイクロアレイを用いた。
【0195】
4.遺伝子の一次絞込み
遺伝子の一次絞込みには、Affymetrix社GeneChipTM/ガラス製オリゴDNAマイクロアレイの組合せを用いる方法と、東レ株式会社3D−Gene(登録商標)Human Oligo chip 25kを用いる方法の二通りを利用した。
【0196】
ガラス製オリゴDNAマイクロアレイの作製方法を以下に示す。最初に搭載するオリゴDNAの種類を決定するために、Affymetrix社GeneChipTMを用いて遺伝子の絞込みを行った。GeneChipTMの操作については、Complete GeneChipTM Instrument Systemなどの同社の定める手順に基づいて実施した。Complete GeneChipTMを用いた解析の結果、食道ガンによって発現変動が起こる可能性がある遺伝子及び実験対照となりうる遺伝子を計8961種抽出した。
【0197】
抽出した8961種の遺伝子について、配列の重複をおこさないように配列特異性が高い部位の配列60−70残基をそれぞれ選択して合成した。4倍に希釈したSolution I(タカラバイオ社)に30μMとなるように溶解した、8961種の60又は70merからなる合成オリゴDNAを、MATSUNAMI・DNAマイクロアレイ用コートグラスDMSO対応 TypeIアミノ修飾オリゴDNA固定コート(松浪硝子工業株式会社)上にスポッター(GMS417arrayer,Affymetrix社)を用いて湿度環境50−60%でスポットした。
【0198】
標識したcDNA 1μgをアンチセンスオリゴカクテル(QIAGEN)に溶解し、Gapカバーグラス(松浪硝子工業)を載せたガラス製オリゴDNAマイクロアレイにアプライし、42℃で16時間ハイブリダイズを行った。ハイブリダイズ終了後、DNAチップを2xSSC/0.1%SDS、1xSSC、0.2xSSCで順次洗浄した。
【0199】
上述の方法によりハイブリダイゼーションを行ったDNAチップをAgilentマイクロアレイスキャナー(Agilent社)を用いてスキャンし、画像を取得して蛍光強度を数値化した。統計学的処理はSpeed T.著「Statistical analysis of gene expression microarray data」Chapman & Hall/CRC,及びCauston H.C.ら著「A beginner’s guide Microarray gene expression data analysis」Blackwell publishingを参考にして行った。すなわちハイブリダイズ後の画像解析から得られたデータについて、それぞれの対数値をとり、global normalizationをとLOWESS(locally weighted scatterplot smoother)による平滑化を行い、MADによるスケーリング処理によってノーマライゼーション補正を行った。その結果、転移がある食道ガン病変部における発現量が、転移がない食道ガン病変部よりも多いか又は少ない遺伝子を見出すことができた。これらの遺伝子を食道ガン転移検出用遺伝子として利用することができると考えられる。この結果、255種の遺伝子を絞り込んだ。
【0200】
一方、3D−Gene(登録商標) Human Oligo chip 25kによる遺伝子の一次絞込みについては、6名の食道ガン患者(転移あり3名、転移なし3名)から採取した検体由来の発現遺伝子解析を実施した。それぞれの患者からトータルRNAを採取し、逆転写して標識したcDNA 500ngを東レ株式会社製ハイブリバッファーに溶解し、3D−GeneTM Human 25Kにアプライした後、42℃で16時間ハイブリダイズを行った。ハイブリ終了後にDNAチップを洗浄してPerkin−Elmer株式会社製ProScanArray(登録商標)を用いてスキャンし、画像を取得して蛍光強度を数値化した。この数値化データについてそれぞれの対数値をとり、global normalizationを行った上で、転移がある食道ガン病変部における発現量が、転移がない食道ガン病変部よりも多い/少ない遺伝子を見出すためにStudent’t−test、判別分析、変動倍率のランキングを行って849種の遺伝子を絞り込んだ。
【0201】
5.診断用遺伝子絞込みのためのDNAチップ実験
4.で絞り込んだ診断用遺伝子候補、及び対照遺伝子検出用のプローブとして、それぞれの遺伝子配列から配列60−70残基をそれぞれ選択して、1119種のオリゴヌクレオチドを合成した(配列番号11〜20の配列であるオリゴヌクレオチドをそれぞれ含む)。これらのプローブを東レ株式会社製3D−Gene(登録商標)1332柱基板にそれぞれ1プローブにつき1点ずつスポットし、食道ガン転移判別用DNAチップとして作製した。
【0202】
この食道ガン転移判別用DNAチップに、食道ガン患者の手術検体又は生検検体由来の食道ガン組織から採取したRNAを逆転写・Cy3標識して、同様に逆転写・Cy5標識を行った対照となるUniversal Human Reference RNA(Stratagene社)と、それぞれ300ngを同時にアプライした。42℃で16時間ハイブリダイズを行い、ハイブリ終了後にDNAチップを洗浄してPerkin―Elmer株式会社製ProScanArray(登録商標)を用いてDNAチップをスキャンし、画像を取得してそれぞれのスポットの蛍光強度を数値化した。この数値化データについてCy3蛍光値とCy5蛍光値のブランク補正(プローブをスポットしていない柱領域の蛍光値の平均をそれぞれの蛍光から減算する)、global normalizationを行った上でM値に変換した(M値:検体由来Cy3蛍光/対照由来Cy5蛍光の底2の対数変換値)。
【0203】
6.予測スコアリングシステム
31例の患者から得た食道がん検体(転移あり10例、転移なし21例)のデータをもとに、テストデータに転移ありの検体が必ず3例含まれる条件下で、無作為に学習データ26例、テストデータ5例を分けた。学習データ群において、Leave one out法によって診断用遺伝子の選択と判別用アルゴリズム構築を行った。抜いた1例の学習データとテストデータを予測し、学習データのすべて必ず1回予測対照となるように、26回の試行を行った。サンプリングを変えて、同様の試行を10回繰り返し、そのテストデータを予測する精度の平均によって、判別アルゴリズムの精度を評価したところ、遺伝子5種を用いた場合に最大(76%)の予測精度を得ることが示された。この結果が偶然出ないことを確かめるために、31例の患者について転移あり、なしの情報を無作為に振り分け、データを完全にランダム化して同様の試行を300回実施したところ、判別精度は遺伝子5種で52.3%にとどまり、判別アルゴリズムの精度が偶然でないことが示された。
【0204】
そこで次に、この5種の遺伝子に相当する遺伝子を10回のランダムサンプリング法の試行結果から抽出し、出現頻度順に順位付けした(表1)。この順位を順に遺伝子数を増やしながら、全31検体についてLeave one out法によるSVM判別を行ったところ、上位10遺伝子で、食道ガンのリンパ節転移予測について、精度96.3%を示した。なお、表1に示した遺伝子は、転移がある食道ガン病変部と転移がない食道ガン病変部での遺伝子転写産物の発現量差が上位の遺伝子である。
【0205】
【表1】

【0206】
この一覧から上位から順に遺伝子を選び、食道ガン組織を識別するためのSVMによる判別マシーンを作成したところ、プローブとして配列番号11〜20のポリヌクレオチドを用いて測定した遺伝子発現を検討することにより、転移がある食道ガン病変部と転移がない食道ガン病変部の判別式を作成したところ、用いる遺伝子の数に依存して確率が変動し、93.6%以上の確率で転移がある食道ガン病変部と転移がない食道ガン病変部を判別することができた(図1)。
【0207】
また、任意のプローブによって測定した遺伝子発現を検討することにより、転移がある食道ガン病変部と転移がない食道ガン病変部の判別式を作成したところ、表2のような判別確率を得ることができた(表2)。
【0208】
【表2】

【0209】
図1及び表2に示したような結果は、食道ガン患者からのサンプルでの結果と本質的に一致する。
【産業上の利用可能性】
【0210】
本発明により、特異性、感受性に優れた食道ガン転移判定用組成物を提供することができるため、少なくともリンパ節への食道ガン転移の検出のために非常に有用である。
【図面の簡単な説明】
【0211】
【図1】表1に記載の遺伝子に対応する配列番号11〜20のポリヌクレオチドを組み合わせて用いた場合の食道ガンのリンパ節転移判別確率(%)を示す。縦軸は、食道ガンのリンパ節転移判別確率(%)、すなわち検体中の転移がある食道ガン組織の存在を検出できる確率、横軸は、表1に記載の遺伝子に対応する配列番号11〜20において、配列番号11から20まで1つずつ順番に増やした、転移がある食道ガン検出に必要な遺伝子の合計数をそれぞれ示す。
【技術分野】
【0001】
本発明は、食道ガンの転移判定又は検出に有用な判定(診断)用組成物、該組成物を利用した食道ガン転移検出又は判定方法、及び該組成物を利用した食道ガン転移診断又は検出キットに関する。
【背景技術】
【0002】
食道は咽頭と胃の間をつなぐ管腔状の臓器であり、大部分は胸腔、一部は頸部と腹腔に存在する。胸腔の上部では気管と脊椎の間にあり、下部では心臓、大動脈と肺に囲まれている。食道は口から食べた食物を胃に送る働きをする。
【0003】
日本人の2001年のガンによる死亡率は10万人中238.8人である。死亡原因の中で食道ガンが占める割合は年々増加しており、2001年度には男性では全ガン死亡例の5.0%、女性では1.4%が食道ガンであった。食道ガンの発症年齢のピークは60〜70歳代にあり、男性に発症が多い。また喫煙、飲酒、熱い嗜好物などの環境要因が発生に密接に関連する。さらに食道壁内部や周辺は血管やリンパ管が豊富であるため、発生したガンの転移が多いことが知られている。
【0004】
食道ガンの治療は進行度(日本食道疾患研究会編 臨床・病理 食道ガン取り扱い規約 1999年)や転移、全身状態を考慮して決定する。食道ガンの標準的な治療法は日本食道疾患研究会編「食道ガン治療ガイドライン」(2002年)に示されている。現在最も一般的な療法は手術療法であり、ガンを含めた食道とリンパ節を含む周囲の組織を切除(リンパ節郭清)した上で、胃など他の臓器を用いて食道を再建する。ただし手術療法、特に広範囲のリンパ節郭清は患者に大きな負担を与え、手術後のQOL低下への配慮も必要である。粘膜内にとどまる早期のガンの場合には内視鏡的粘膜切除術が可能である場合がある。また根治療法、対症療法の両面から放射線照射が行われる場合がある。さらに手術療法や放射線療法と組み合わせて化学療法が行われる。化学療法では現在、5−fluorouracilとcisplatinの併用療法が最も有効と考えられている。
【0005】
食道ガンは嚥下時の違和感、嚥下困難、胸骨後部痛や胸部違和感といった自覚症状を覚えた患者の受診によって発見されることが多い。しかしながらこれらの症状が発現するのは食道内でガンが成長した結果であり、自己所見による受診時に発見されるガンはすでに食道壁外進展や転移が起こっており予後不良であることが多い。したがって手術時には食道周辺のリンパ節拡清を行うことが多いが、この時転移の有無が予見できていれば、拡清の範囲を術前に正確に決定することや、拡清の範囲を限定し術後の患者のQOLに貢献することが可能である。
【0006】
食道ガンは食道造影検査及び内視鏡検査と生検組織検査にて診断が確定される。生検標本は内視鏡検査時や手術時に採取され、病理標本を作製した上で病理組織学的分類によって診断される。この時、内視鏡検査で得られた細胞の性質から食道外への転移の有無が予測できる、迅速で簡便な診断法の開発が求められている。
【0007】
現在までに、食道ガン組織に特異的に含まれるマーカーを用いた分子生物学的診断方法が提案されている。この方法は迅速で客観的な結果をもたらし、迅速な診断の助けとなる。
【0008】
これまでに食道ガンの臨床検査用マーカーとして血清中のタンパク質マーカーであるSCC、CYFRA21−1、CEAなどが活用されているほか、特許文献1、2に記載のタンパク質などが報告されている。しかしこれらのマーカーは感度、特異度が乏しく、もっとも感度が高いとされているCYFRA21−1についても、その感度は33.9%(非特許文献1)から43.9%(非特許文献2)程度である。したがってこれらの血清中マーカー及びその組み合わせの検出によって食道ガン細胞の存在の有無が確定されるという段階には至っていないし、これらを用いて食道ガンの転移を診断することもできていない。
【0009】
また、被験者より採取された生検試料に食道ガン細胞が含まれているか否かを特異的に判断するための遺伝子を利用したマーカーとしては、染色体異常(例えば特許文献3,4参照)や遺伝子の後成的配列(例えば特許文献5)が開示されているほか、DNAチップによる網羅的遺伝子発現解析の結果が複数報告されている(例えば非特許文献3〜8参照)。さらに単独の遺伝子発現を指標としたマーカーとしては特許文献6、非特許文献9、10に示されるSPRR3遺伝子(Small proline―rich protein 3)、非特許文献11に示されるfgf3遺伝子、特許文献6、非特許文献12に示されるCSTB遺伝子(cystatin B、liver thiol proteinase inhibitor)、特許文献7に示されるUCP2遺伝子(mitochondrial uncoupling protein 2)、特許文献6に示されるUPK1A遺伝子(uroplakin 1A)、非特許文献13に示されるHSPA1B遺伝子(Heat Shock 70kDa Protein 1)などが報告されている。しかし、これらによっても食道ガンの転移を診断することは不可能である。
【0010】
一方で、特許文献8ではSHC遺伝子の発現/チロシンリン酸化量が、消化器ガンの進展に影響を与えることが示されているが、食道がんにおけるリンパ節転移を判別できる性能については明確にされていない。
【0011】
さらに特許文献9においてはDNAチップによる網羅的遺伝子発現解析によって、食道ガンの転移を予測するための組成物及び方法が示されている。すなわち特許文献9においては、47種の遺伝子の発現量を測定し、組み合わせて判別式を作成することにより、86%の確率で食道ガンのリンパ節転移を予測することができることが示されている。
【0012】
【特許文献1】特開2003-259872号公報
【特許文献2】特表2000-511536号公報
【特許文献3】特開2001-17200号公報
【特許文献4】特開2002-272497号公報
【特許文献5】特表2004-505612号公報
【特許文献6】国際公開第2003/042661パンフレット
【特許文献7】国際公開第2003/076594パンフレット
【特許文献8】国際公開第2007/084156パンフレット
【特許文献9】国際公開第2006/118308号パンフレット
【0013】
【非特許文献1】Nakamura,T.ら、1998、Diseases of the Esophagus、第11巻、p.35−39
【非特許文献2】Kawaguchi,Hら、2000、Cancer、第89巻、p.1413−1417
【非特許文献3】Luo, A.ら、2004年、Oncogene、第23巻、p.1291-1299
【非特許文献4】Zhi, H.ら、2003年、International Journal of Cancer、第106巻、p.327-333
【非特許文献5】Lu, J.ら、2001年、International Journal of Cancer、第91巻、p.288-294
【非特許文献6】Kazemi-Noureini,S.ら、2004年、World Journal of Gastroenterology 、第10巻、p.1716-1721
【非特許文献7】Xu, S.H.ら、2003年、World Journal of Gastroenterology 、第9巻、p.417-422
【非特許文献8】Su, H.ら、2003年、Cancer Research、第63巻、p.3872-3876
【非特許文献9】Chen, B.S. ら、2000年、Carcinogenesis、第21巻、p.2147-2150
【非特許文献10】Abraham, J.M.ら、1996年、Cell Growth & Differentiation、第7巻、p.855-860.
【非特許文献11】Kitagawa, Y.ら、1991年、Cancer Research、第51巻、p.1504-1508
【非特許文献12】Shiraishi,T.ら、1998年、International Journal of Cancer、第79巻、p.175-178
【非特許文献13】Kawanishi,K.ら、1999年、Cancer、第85巻、p.1649-1657
【発明の開示】
【発明が解決しようとする課題】
【0014】
しかしながら、上記の既存の指標は特異性及び/又は感受性に乏しいことや、生体試料からのその効率的な検出方法が確立していないことから一般に臨床上の利用は行われておらず、また患者の予後を決定する大きな要因である、食道ガン転移の有無を診断マーカーを用いて検出することは、現在不可能と考えられる。そこで特異性及び感受性が高い食道ガン転移のマーカーが切望されている。
【0015】
本発明は、食道ガン転移の診断及び治療に有用な疾患判定用組成物、該組成物を用いた食道ガン転移の判定(又は検出)方法、及び該組成物を利用した食道ガン転移の判定(又は検出又は診断)キットを提供することを目的とする。
【課題を解決するための手段】
【0016】
マーカー探索の方法としては、食道ガン細胞のうち、手術時にリンパ節転移があった患者由来の食道ガン細胞と手術時にリンパ節転移がなかった患者由来の食道ガン細胞における遺伝子発現やタンパク質発現、又は細胞の代謝産物などの量を何らかの手段によって比較する方法や食道ガン患者と非ガン患者の体液中に含まれる遺伝子、タンパク質、代謝産物などの量を測定する方法が挙げられる。
【0017】
DNAアレイを用いた発現遺伝子量解析は、近年、このようなマーカー探索の手法として特に汎用されている。DNAアレイには数百から数万種の遺伝子に対応した塩基配列を利用したプローブが固定されている。被検試料をDNAアレイに添加することによって試料中の遺伝子がプローブと結合し、この結合量を何らかの手段によって測定することにより、被検試料中の遺伝子量を知ることができる。DNAアレイ上に固定化するプローブに対応した遺伝子の選択は自由であり、また被検試料に手術時にリンパ節転移があった患者由来の食道ガン細胞と手術時にリンパ節転移がなかった患者由来の食道ガン細胞胞を用いて、試料中の発現遺伝子量を比較することによって食道転移ガンマーカーとなりうる遺伝子群を推定することが可能である。
【0018】
上記の課題を解決するために、本発明者らは、手術時にリンパ節転移があった患者由来の食道ガン組織と手術時にリンパ節転移がなかった患者由来の食道ガン組織の遺伝子発現をDNAアレイによって解析し、食道ガン転移の検出マーカーに使用可能な遺伝子を見出し、さらにそれらの遺伝子の発現量が、手術時にリンパ節転移がなかった患者由来の食道ガン細胞に比較して手術時にリンパ節転移があった患者由来の食道ガン細胞において有意に減少又は低減していることを見出し、本発明を完成させた。
【0019】
1.発明の概要
本発明は、以下の特徴を有する。
本発明は第1の態様において、下記の(a)〜(e)に示すポリヌクレオチド、その変異体又はその断片からなる群から選択される2以上のポリヌクレオチドを含む、食道ガン転移診断用組成物である。
(a)配列番号1〜10で表される塩基配列からなるポリヌクレオチド、その変異体、又は15以上の連続した塩基を含むその断片
(b)配列番号1〜10で表される塩基配列を含むポリヌクレオチド
(c)配列番号1〜10で表される塩基配列に相補的な塩基配列からなるポリヌクレオチド、その変異体、又は15以上の連続した塩基を含むその断片
(d)配列番号1〜10で表される塩基配列に相補的な塩基配列を含むポリヌクレオチド
(e)前記(a)〜(d)のいずれかのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又は15以上の連続した塩基を含むその断片
その実施形態において、前記断片が、60以上の連続した塩基を含むポリヌクレオチドである上記の組成物である。
【0020】
また別の実施形態において、前記断片が、配列番号1〜10のいずれかで表される塩基配列において、それぞれ配列番号11〜20のいずれかで表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド、又は該ポリヌクレオチドの配列に相補的な塩基配列を含むポリヌクレオチドである、上記の組成物である。
【0021】
また別の実施形態において、前記断片が、配列番号11〜20のいずれかで表される塩基配列、又はこれらに相補的な塩基配列を含むポリヌクレオチドである、上記の組成物である。
【0022】
本発明の第2の態様において、上記のいずれかに記載の(a)〜(e)に示すポリヌクレオチド、その変異体及び/又はその断片の2以上を含む、食道ガン転移診断用キットである。
【0023】
その実施形態において、前記ポリヌクレオチドが、配列番号1〜10のいずれかで表される塩基配列からなるポリヌクレオチド、その相補的配列からなるポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はそれらの15以上の連続した塩基を含む断片である、上記のキットである。
【0024】
また別の実施形態において、前記断片が、60以上の連続した塩基を含むポリヌクレオチドである、上記のキットである。
【0025】
また別の実施形態において、前記断片が、配列番号1〜10のいずれかで表される塩基配列において、それぞれ配列番号11〜20のいずれかで表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド、又は該ポリヌクレオチドの配列に相補的な塩基配列を含むポリヌクレオチドである、上記のキットである。
【0026】
また別の実施形態において、前記断片が、配列番号11〜20のいずれかで表される塩基配列からなるポリヌクレオチドである、上記のキットである。
【0027】
また別の実施形態において、前記ポリヌクレオチドが、別個に又は任意に組み合わせて異なる容器に包装されている、上記のいずれか1項に記載のキットである。
【0028】
本発明の第3の態様において、上記のいずれかに記載の(a)〜(e)に示すポリヌクレオチド、その変異体及び/又はその断片の2以上を含む、食道ガン転移診断用DNAチップである。
【0029】
その実施形態において、配列番号11〜20で表される塩基配列又はその相補的配列を含むポリヌクレオチドの2以上〜全部を含む、上記のDNAチップである。
【0030】
本発明の第4の態様において、上記のいずれかに記載の組成物、上記のいずれかに記載のキット、上記のいずれかに記載のDNAチップ、又はそれらの組み合わせを用いて、被験者由来の生体試料における標的核酸の発現レベルを測定することによって、被験者由来の検体試料中に転移を伴う食道ガン細胞が含まれるかどうかをin vitroで判定する方法である。
【0031】
その実施形態において、DNAチップを用いる上記の方法である。
また別の実施形態において、いずれかに記載の組成物、上記のいずれかに記載のキット、上記のいずれかに記載のDNAチップ、又はそれらの組み合わせを用いて、転移を伴う食道ガン又は転移を伴わない食道ガン細胞を含む組織であることが既知の複数の生体試料中の標的核酸の発現量をin vitroで測定する第1の工程、前記第1の工程で得られた該標的核酸の発現量の測定値を教師とした判別式(サポートベクターマシーン)を作成する第2の工程、被験者の食道由来の検体試料中の該標的核酸の発現量を第1の工程と同様にin vitroで測定する第3の工程、前記第2の工程で得られた判別式に第3の工程で得られた該標的核酸の発現量の測定値を代入し、該判別式から得られた結果に基づいて、検体試料中に転移を伴うガン細胞が含まれないこと及び/又は転移を伴わないガン細胞が含まれることを判定する第4の工程を含む、食道ガン転移を判定する方法である。
【0032】
また別の実施形態において、上記のいずれかに記載の組成物、上記のいずれかに記載のキット、又は上記のいずれかに記載のDNAチップの、食道ガン患者の転移の有無をin vitroで予測するための使用である。
【0033】
本発明の第5の態様において、配列番号1〜10で表される塩基配列によってコードされるポリペプチドに対する2以上の抗体又はその断片を用いて、被験者由来の食道ガン細胞或いは血液中の該ポリペプチドのレベルをin vitroで測定することを含む、被験者の食道ガンの転移の有無をin vitroで予測する方法である。
【0034】
その実施形態において、前記ポリペプチドが、配列番号21〜27で表されるアミノ酸配列を有する、上記の方法である。
【0035】
また別の実施形態において、前記ポリペプチドの発現レベルが、転移のない患者由来の食道ガンと比較して変化している場合、転移が有る患者由来の食道ガンであると決定する。
【0036】
また別の実施形態において、前記ポリペプチドの発現レベルが、転移のある患者由来の食道ガンと比較して変化している場合、転移が無い患者由来の食道ガンであると決定する、上記のいずれかに記載の方法である。
【0037】
2.定義
本明細書中で使用する用語は、以下の定義を有する。
本明細書において「転移を伴う食道ガン」とは、食道ガンが転移性のガンであることを表し、このような食道ガンはリンパ節などの他の組織に転移するか又は転移し易い性質を有している。一方、「転移を伴わない食道ガン」とは、食道ガンが非転移性のガンであることを表す。
【0038】
本明細書中で使用されるヌクレオチド、ポリヌクレオチド、アミノ酸、ペプチド、ポリペプチド、タンパク質などの略号による表示は、「塩基配列又はアミノ酸配列を含む明細書等の作成のためのガイドライン」(日本国特許庁編)及び当技術分野における慣用に従うものとする。
【0039】
本明細書において「ポリヌクレオチド」とは、RNA及びDNAのいずれも包含する核酸として用いられる。なお、上記DNAには、cDNA、ゲノムDNA、及び合成DNAのいずれもが含まれる。また上記RNAには、totalRNA、mRNA、rRNA、及び合成RNAのいずれもが含まれる。また、本明細書では、ポリヌクレオチドは核酸と互換的に使用される。
【0040】
本明細書において「cDNA」とは、遺伝子の発現によって生じたRNAに相補的な配列のDNA鎖全長、及びその部分配列からなるDNA断片、を包含する。cDNAは、RNAを鋳型にして、ポリTプライマーを用いるRT−PCR(逆転写酵素−ポリメラーゼ連鎖反応)によって合成されうる。
【0041】
本明細書において「遺伝子」とは、2本鎖DNAのみならず、それを構成する正鎖(又はセンス鎖)又は相補鎖(又はアンチセンス鎖)などの各1本鎖DNAを包含することを意図して用いられる。またその長さによって特に制限されるものではない。
【0042】
従って、本明細書において「遺伝子」は、特に言及しない限り、ヒトゲノムDNAを含む2本鎖DNA、cDNAを含む1本鎖DNA(正鎖)、該正鎖と相補的な配列を有する1本鎖DNA(相補鎖)、及びこれらの断片のいずれも含む。また該「遺伝子」は特定の塩基配列(又は配列番号)で示される「遺伝子」だけではなく、これらによってコードされるタンパク質と生物学的機能が同等であるタンパク質、例えば同族体(すなわち、ホモログ)、スプライスバリアントなどの変異体、及び誘導体をコードする「遺伝子」が包含される。かかる同族体、変異体又は誘導体をコードする「遺伝子」としては、具体的には、後に記載したストリンジェントな条件下で、上記の配列番号1〜10で示されるいずれかの特定塩基配列の相補配列とハイブリダイズする塩基配列を有する「遺伝子」を挙げることができる。
【0043】
例えばヒト由来のタンパク質の同族体(すなわち、ホモログ)又はそれをコードする遺伝子としては、当該タンパク質又はそれをコードするヒト遺伝子に対応する他生物種のタンパク質又は遺伝子が例示でき、これらのタンパク質又は遺伝子ホモログは、HomoloGene(http://www.ncbi.nlm.nih.gov/homoloGene/)により同定することができる。具体的には特定のヒトアミノ酸又は塩基配列をBLASTプログラム(Karlin,S.ら、Proceedings of the National Academic Sciences U.S.A.、 1993年、第90巻、p.5873―5877、 http://www.ncbi.nlm.nih.gov/BLAST/)にかけて一致する(Scoreが最も高く、E−valueが0でかつIdentifyが100%を示す)配列の登録番号(accession number)を取得することができる。BLASTプログラムとしては、BLASTN(遺伝子)、BLASTX(タンパク質)などが知られている。例えば、遺伝子検索の場合、上記BLAST検索からの登録番号をUniGene(http://www.ncbi.nlm.nih.gov/UniGene/)に入力して得られたUniGeneClusterID(Hs.で示す番号)をHomoloGeneに入力する。結果として得られた他生物種遺伝子とヒト遺伝子との遺伝子ホモログの相関を示したリストから、特定の塩基配列で示されるヒト遺伝子に対応する遺伝子ホモログとして、他生物種の遺伝子を選抜することができる。またこの方法において、BLASTプログラムの代わりにFASTAプログラム(http://www.ddbj.nig.ac.jp/top−j.html)を用いてもよい。
【0044】
なお、「遺伝子」は、機能領域の別を問うものではなく、例えば発現制御領域、コード領域、エキソン又はイントロンを含むことができる。
【0045】
本明細書において「転写産物」とは、遺伝子のDNA配列を鋳型にして合成されたメッセンジャーRNA(mRNA)のことをいう。RNAポリメラーゼが遺伝子の上流にあるプロモーターと呼ばれる部位に結合し、DNAの塩基配列に相補的になるように3'末端にリボヌクレオチドを結合させていく形でメッセンジャーRNAが合成される。このメッセンジャーRNAには遺伝子そのもののみならず、発現制御領域、コード領域、エキソン又はイントロンをはじめとする転写開始点からポリA配列の末端にいたるまでの全配列が含まれる。
【0046】
本明細書において「翻訳産物」とは、転写によって合成されたメッセンジャーRNAが,スプライシングなどの修飾を受ける/受けないにかかわらず、その情報を元に合成されたタンパク質を示す。メッセンジャーRNAの翻訳過程においては、まずリボソームとメッセンジャーRNAが結合し、次にメッセンジャーRNAの塩基配列に従ってアミノ酸がつながっていき、タンパク質が合成される。
【0047】
本明細書において「プローブ」とは、遺伝子の発現によって生じたRNA又はそれに由来するポリヌクレオチドを特異的に検出するために使用されるポリヌクレオチド及び/又はそれに相補的なポリヌクレオチドを包含する。
【0048】
本明細書において「プライマー」とは、遺伝子の発現によって生じたRNA又はそれに由来するポリヌクレオチドを特異的に認識し、増幅する、連続するポリヌクレオチド及び/又はそれに相補的なポリヌクレオチドを包含する。
【0049】
ここで相補的なポリヌクレオチド(相補鎖、逆鎖)とは、配列番号によって定義される塩基配列からなるポリヌクレオチドの全長配列、又はその部分配列(ここでは便宜上、これを正鎖と呼ぶ)に対してA:T(U)、G:Cといった塩基対関係に基づいて、塩基的に相補的な関係にあるポリヌクレオチドを意味する。ただし、かかる相補鎖は、対象とする正鎖の塩基配列と完全に相補配列を形成する場合に限らず、対象とする正鎖とストリンジェントな条件でハイブリダイズできる程度の相補関係を有するものであってもよい。
【0050】
本明細書において「ストリンジェントな条件」とは、プローブが他の配列に対するよりも、検出可能により大きな程度(例えばバックグラウンドよりも少なくとも2倍)で、その標的配列に対してハイブリダイズする条件をいう。ストリンジェントな条件は配列依存性であり、ハイブリダイゼーションが行われる環境によって異なる。ハイブリダイゼーション及び/又は洗浄条件のストリンジェンシーを制御することにより、プローブに対して100%相補的である標的配列が同定され得る。
【0051】
本明細書において「変異体」とは、核酸の場合、多型性、突然変異、転写時の選択的スプライシングなどに起因した天然の変異体、或いは遺伝暗号の縮重に基づく変異体、或いは配列番号1〜10で表される塩基配列又はその部分配列において1以上、好ましくは1もしくは数個、の塩基の欠失、置換、付加又は挿入を含む変異体、或いは該塩基配列又はその部分配列と約80%以上、約85%以上、約90%以上、約95%以上、約97%以上、約98%以上、約99%以上の%同一性を示す変異体、或いは該塩基配列又はその部分配列を含むポリヌクレオチド又はオリゴヌクレオチドと上記定義のストリンジェントな条件でハイブリダイズする核酸を意味し、一方、タンパク質又はペプチドの場合、配列番号21〜27で表されるアミノ酸配列又はその部分配列おいて1以上、好ましくは1もしくは数個、のアミノ酸の欠失、置換、付加又は挿入を含む変異体、或いは該アミノ酸配列又はその部分配列と約80%以上、約85%以上、約90%以上、約95%以上、約97%以上、約98%以上、約99%以上の%同一性を示す変異体を意味する。
【0052】
本明細書において「数個」とは、約10、9、8、7、6、5、4、3又は2個の整数を意味する。
【0053】
本明細書において「%同一性」は、上記のBLASTやFASTAによるタンパク質又は遺伝子の検索システムを用いて、ギャップを導入して、又はギャップを導入しないで、決定することができる(Karlin,S.ら、1993年、Proceedings of the National Academic Sciences U.S.A.、第90巻、p.5873-5877;Altschul,S.F.ら、1990年、Journal of Molecular Biology、第215巻、p.403−410;Pearson,W.R.ら、1988年、Proceedings of the National Academic Sciences U.S.A.、第85巻、p.2444-2448)。%同一性は、簡単に言えば、2つの塩基配列又はアミノ酸配列を、ギャップを導入してか又はギャップを導入しないで整列したときの、塩基又はアミノ酸の総数に対する同一の塩基又はアミノ酸の数の割合(%)をいう。
【0054】
本明細書において「誘導体」とは、核酸の場合、蛍光団などによるラベル化誘導体、修飾ヌクレオチド(例えばハロゲン、メチルなどのアルキル、メトキシなどのアルコキシ、チオ、カルボキシメチルなどの基を含むヌクレオチド及び塩基の再構成、二重結合の飽和、脱アミノ化、酸素分子の硫黄分子への置換などを受けたヌクレオチドなど)を含む誘導体など、一方、タンパク質の場合、アセチル化、アシル化、アルキル化、リン酸化、硫酸化、グリコシル化、ビオチン化などの化学修飾誘導体を意味する。
【0055】
本明細書において「診断(又は検出又は判定)用組成物」とは、食道ガンの罹患の有無、罹患の程度もしくは改善の有無や改善の程度を診断するために、また食道ガンの予防、改善又は治療に有用な候補物質をスクリーニングするために、直接又は間接的に利用されるものをいう。これには食道ガンの罹患に関連して生体内、特に食道組織において発現が変動する遺伝子を特異的に認識し、また結合することのできるヌクレオチド、オリゴヌクレオチド及びポリヌクレオチド、及び該遺伝子の翻訳産物であるタンパク質を検出することができる抗体が包含される。これらのヌクレオチド、オリゴヌクレオチド及びポリヌクレオチドは、上記性質に基づいて生体内、組織や細胞内などで発現した上記遺伝子を検出するためのプローブとして、また生体内で発現した上記遺伝子を増幅するためのプライマーとして有効に利用することができる。
【0056】
本明細書において検出・診断対象となる「生体組織」とは、食道ガンの発生にともない本発明の遺伝子が発現変化する組織を指す。具体的には食道組織及びその周辺のリンパ節、また転移が疑われる他臓器などを指す。
【0057】
本明細書で使用される「SHC1遺伝子」又は「SHC1」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号1)で示されるSHC transforming protein 1遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号1に記載のSHC1遺伝子(GenBank Accession No.NM_003029)やその他生物種ホモログなどが包含される。SHC1遺伝子はPelicci,Gら、1992年、Cell、第70巻、p.93―104に記載される方法によって得ることができる。
【0058】
本明細書で使用される「C1R遺伝子」又は「C1R」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号2)で示されるcomplement component 1, r subcomponent遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号2に記載のC1R遺伝子(GenBank Accession NM_001733)やその他生物種ホモログなどが包含される。C1R遺伝子は、Cohen−Haguenauer, O.ら、1986年、(Abstract)7th Int. CONG. HUM. Genet. Berlin 617 onlyに記載される方法によって得ることができる。
【0059】
本明細書で使用される「LAMA5遺伝子」又は「LAMA5」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号3)で示されるLaminin alpha−5chain precursor遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号3に記載のLAMA5遺伝子(GenBank Accession No. NM_005560)やその他生物種ホモログなどが包含される。LAMA5遺伝子はDurkin,M.E.ら1986年、FEBS Lett. 第70巻、p.296−300に記載される方法によって得ることができる。
【0060】
本明細書で使用される「PGAM1遺伝子」又は「PGAM1」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号4)で示されるPhosphoglycerate mutase 1遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号4に記載のPGAM1遺伝子(GenBank Accession No. NM_002629)やその他生物種ホモログなどが包含される。PGAM1遺伝子はSakoda, S.ら、1988年、Journal of Biological Chemistry、第263巻、p.16899−16905に記載される方法によって得ることができる。
【0061】
本明細書で使用される「ZNF708遺伝子」又は「ZNF708」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号5)で示される71 kDa protein遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号5に記載のZNF708遺伝子(GenBank Accession No.NM_021269)やその他生物種ホモログなどが包含される。ZNF708遺伝子はThiesen,H.J.ら、1990年、The New Biologist、第2巻、p.363−374に記載される方法によって得ることができる。
【0062】
本明細書で使用される「YWHAQ遺伝子」又は「YWHAQ」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号6)で示される14−3−3 protein tau遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号6に記載のYWHAQ遺伝子(GenBank Accession No.NM_006826)やその他生物種ホモログなどが包含される。YWHAQ遺伝子はNielsen,P.J.、1991年、Biochimica et biophysica acta、第1088巻、p. 425−428に記載される方法によって得ることができる。
【0063】
本明細書で使用される「AC004609遺伝子」又は「AC004609」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号7)で示されるHomo sapiens chromosome 19, cosmid F16912と称される遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号7に記載のAC004609遺伝子(GenBank Accession No.AC004609)やその他生物種ホモログなどが包含される。
【0064】
本明細書で使用される「ZNF714遺伝子」又は「ZNF714遺伝子」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号8)で示されるzinc finger protein 714遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号8に記載のZNF714遺伝子遺伝子(GenBank Accession No. NM_182515)やその他生物種ホモログなどが包含される。ZNF714遺伝子はOh,J.H.ら、2005年、Mammalian genome、第16巻、p.942−954に記載される方法によって得ることができる。
【0065】
本明細書で使用される「LOC152667遺伝子」又は「LOC152667」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号9)で示されるLOC152667 NIP30−like 遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号9に記載のLOC152667遺伝子(GenBank Accession No.NR_002228)やその他生物種ホモログなどが包含される。LOC152667遺伝子はMarques,A.C.ら、2005年、PLoS biology、第23巻、p.E357に記載される方法によって得ることができる。
【0066】
本明細書で使用される「ZNF716遺伝子」又は「ZNF716」という用語は、配列番号で指定しない限り、特定塩基配列(配列番号10)で示されるzinc finger protein 716遺伝子(DNA)、その同族体、変異体及び誘導体などをコードする遺伝子(DNA)を包含する。具体的には、配列番号10に記載のZNF716遺伝子(GenBank Accession No.AK131575)やその他生物種ホモログなどが包含される。
【発明の効果】
【0067】
本発明は、食道ガン転移の診断及び治療に有用な疾患判定用組成物及び該組成物を用いた食道転移ガンの判定(又は検出)方法を提供するものであり、これによって、食道ガンの転移に対して特異的かつ高予測率の、及び迅速でかつ簡便な、判定方法を提供するという格別の作用効果を有する。
【発明を実施するための最良の形態】
【0068】
以下に本発明をさらに具体的に説明する
1.食道ガン転移の標的核酸
本発明において、上記定義の食道ガン転移診断用組成物及びキットを使用して食道ガン転移の存在及び/又は不存在、或いは食道ガン転移の可能性の有無、を予測又は判定するための食道ガン転移のマーカーとしての標的核酸には、例えば、配列番号1〜10で表される塩基配列を含むヒト遺伝子(すなわち、それぞれ、SHC1、C1R、LAMA5、PGAM1、ZNF708、YWHAQ、AC004609、ZNF714、LOC152667、ZNF716)、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体が含まれる。ここで、遺伝子、同族体、転写産物、cDNA、変異体及び誘導体は、上記定義のとおりである。好ましい標的核酸は、配列番号1〜10で表される塩基配列を含むヒト遺伝子、それらの転写産物又はcDNA、より好ましくは該転写産物又はcDNAである。
【0069】
本発明において食道ガン転移の標的となる上記遺伝子はいずれも、手術時にリンパ節転移があった患者由来の食道ガン組織に比較して、手術時にリンパ節転移がなかった患者由来の食道ガン組織において発現レベルが有意に増加しているか、或いは低下しているものである(後述の実施例の表1参照)。
【0070】
第1の標的核酸は、SHC1遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。SHC1遺伝子は国際公開第2007/084156パンフレットにおいて消化器ガンの進展に影響を与えることが示されている。
【0071】
第2の標的核酸は、C1R遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにC1R遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0072】
第3の標的核酸は、LAMA5遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにLAMA5遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0073】
第4の標的核酸は、PGAM1遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにPGAM1遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0074】
第5の標的核酸は、ZNF708遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにZNF708遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0075】
第6の標的核酸は、YWHAQ遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにYWHAQ遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0076】
第7の標的核酸は、AC004609遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにAC004609遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0077】
第8の標的核酸は、ZNF714遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにZNF714遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0078】
第9の標的核酸は、LOC152667遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにLOC152667遺伝子又はその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0079】
第10の標的核酸は、ZNF716遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体である。これまでにZNF716遺伝子及びその転写産物の発現の減少が食道ガンのマーカーになりうるという報告は知られていない。
【0080】
2.食道ガン転移の標的ポリペプチド
本発明において、上記定義の食道ガン転移診断用組成物及びキットを使用して食道ガン転移の存在及び/又は不存在を判定するための食道ガン転移のマーカーとしての標的ポリペプチドには、例えば、配列番号1〜10で表される塩基配列を含むヒト遺伝子(すなわち、それぞれ、SHC1、C1R、LAMA5、PGAM1、ZNF708、YWHAQ、AC004609、ZNF714、LOC152667、ZNF716遺伝子)によってコードされるポリペプチド、例えば、配列番号21〜27で表されるアミノ酸配列を含むヒトポリペプチド、それらの同族体、或いはそれらの変異体又は誘導体が含まれる。ここで、ポリペプチド、同族体、変異体及び誘導体は、上記定義のとおりである。好ましい標的ポリペプチドは、配列番号21〜27で表されるアミノ酸配列を含むヒトポリペプチドである。
【0081】
本発明において食道ガン転移の標的となる上記ポリペプチドはいずれも、対応する遺伝子及びその転写産物の発現量と同様に、手術時にリンパ節転移がなかった患者由来の食道ガン組織に比較して、手術時にリンパ節転移があった患者由来の食道ガン組織において発現レベルが有意に増加しているか、又は低下しているものであること、或いは血液中の該ポリペプチドのレベルが手術時にリンパ節転移がなかった被験者と比べて手術時にリンパ節転移があった被験者において有意に増加しているか、又は低下することによって特徴付けられる。
【0082】
3.食道ガン転移診断用組成物
3.1 核酸
本発明において、食道ガン又は食道ガン転移の存在及び/又は不存在を判定又は検出するための、或いは食道ガン転移(又は転移の可能性)の有無を判定又は予測するために使用可能な核酸組成物は、食道ガン転移の標的核酸としての、ヒト由来のSHC1、C1R、LAMA5、PGAM1、ZNF708、YWHAQ、AC004609、ZNF714、LOC152667、ZNF716遺伝子、それらの同族体、それらの転写産物又はcDNA、或いはそれらの変異体又は誘導体の存在、発現レベル又は存在量を定性的及び/又は定量的に測定することを可能にする。
【0083】
上記の標的核酸は、手術時にリンパ節転移がなかった患者由来の食道ガン組織に比較して、手術時にリンパ節転移があった患者由来の食道ガン組織においてその発現レベルが有意に増加するか、或いは低下する。それゆえ、本発明の組成物は、手術時にリンパ節転移がなかった患者由来の食道ガン組織と手術時にリンパ節転移があった患者由来の食道ガン組織について標的核酸の発現レベルを測定し、それらを比較するために有効に使用することができる。
【0084】
本発明で使用可能な組成物は、食道ガンに罹患した患者の生体組織において配列番号1〜10で表される塩基配列を含むポリヌクレオチド群及びその相補的ポリヌクレオチド群、該塩基配列に相補的な塩基配列からなるDNAとストリンジェントな条件でそれぞれハイブリダイズするポリヌクレオチド群及びその相補的ポリヌクレオチド群、ならびにそれらのポリヌクレオチド群の塩基配列において15以上、好ましくは20〜30又はそれ以上、より好ましくは40〜50又はそれ以上、さらに好ましくは60以上、の連続した塩基を含むポリヌクレオチド群から選ばれた、2以上、好ましくは3以上、より好ましくは6以上のポリヌクレオチドの組み合わせを含む。ポリヌクレオチドの組み合わせは、互いに異なる遺伝子に由来するポリヌクレオチドを含むことが好ましい。
【0085】
具体的には、本発明の組成物は、以下の2以上のポリヌクレオチド又はその断片を含むことができる。
(1)配列番号1〜10で表される塩基配列からなるポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(2)配列番号1〜10で表される塩基配列を含むポリヌクレオチド群。
(3)配列番号1〜10で表される塩基配列からなるポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(4)配列番号1〜10で表される塩基配列に相補的な塩基配列を含むポリヌクレオチド群。
(5)配列番号1〜10で表される塩基配列の各々と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズするポリヌクレオチド群、又は15以上の連続した塩基を含むそれらの断片。
【0086】
上記(1)〜(5)のポリヌクレオチドの断片は、各ポリヌクレオチドの塩基配列において、例えば、連続する15〜配列の全塩基数、15〜5000塩基、15〜4500塩基、15〜4000塩基、15〜3500塩基、15〜3000塩基、15〜2500塩基、15〜2000塩基、15〜1500塩基、15〜1000塩基、15〜900塩基、15〜800塩基、15〜700塩基、15〜600塩基、15〜500塩基、15〜400塩基、15〜300塩基、15〜250塩基、15〜200塩基、15〜150塩基、15〜140塩基、15〜130塩基、15〜120塩基、15〜110塩基、15〜100塩基、15〜90塩基、15〜80塩基、15〜70塩基、15〜60塩基、15〜50塩基、15〜40塩基、15〜30塩基又は15〜25塩基;25〜配列の全塩基数、25〜1000塩基、25〜900塩基、25〜800塩基、25〜700塩基、25〜600塩基、25〜500塩基、25〜400塩基、25〜300塩基、25〜250塩基、25〜200塩基、25〜150塩基、25〜140塩基、25〜130塩基、25〜120塩基、25〜110塩基、25〜100塩基、25〜90塩基、25〜80塩基、25〜70塩基、25〜60塩基、25〜50塩基又は25〜40塩基;50〜配列の全塩基数、50〜1000塩基、50〜900塩基、50〜800塩基、50〜700塩基、50〜600塩基、50〜500塩基、50〜400塩基、50〜300塩基、50〜250塩基、50〜200塩基、50〜150塩基、50〜140塩基、50〜130塩基、50〜120塩基、50〜110塩基、50〜100塩基、50〜90塩基、50〜80塩基、50〜70塩基又は50〜60塩基;60〜配列の全塩基数、60〜1000塩基、60〜900塩基、60〜800塩基、60〜700塩基、60〜600塩基、60〜500塩基、60〜400塩基、60〜300塩基、60〜250塩基、60〜200塩基、60〜150塩基、60〜140塩基、60〜130塩基、60〜120塩基、60〜110塩基、60〜100塩基、60〜90塩基、60〜80塩基又は60〜70塩基などの範囲の塩基数を含むことができるが、これらに限定されないものとする。
【0087】
本発明の実施形態により、配列番号1〜10で表される塩基配列を含むポリヌクレオチドの断片はそれぞれ、配列番号11〜20で表される塩基配列又はその相補的配列、或いはそれらの連続する15塩基以上の部分配列、を含むことが好ましい。
【0088】
本発明の組成物には、例えば以下のポリヌクレオチドが包含される。
(1)配列番号1〜10で表される塩基配列又はその相補的配列の各々において、15以上の連続した塩基を含むポリヌクレオチド。
(2)配列番号1〜10で表される塩基配列又はその相補的配列の各々において、60以上の連続した塩基を含むポリヌクレオチド。
(3)配列番号1〜10で表される塩基配列において、それぞれ配列番号11〜20で表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド。
(4)配列番号1〜10で表される塩基配列に相補的な配列において、それぞれ配列番号11〜20で表される塩基配列に相補的な配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド。
【0089】
本発明で使用される上記ポリヌクレオチド類又はその断片類はいずれもDNAでもよいしRNAでもよい。
【0090】
本発明の組成物としてのポリヌクレオチドは、DNA組換え技術、PCR法、DNA/RNA自動合成機による方法などの一般的な技術を用いて作製することができる。
【0091】
DNA組換え技術及びPCR法は、例えばAusubelら, Current Protocols in Molecular Biology, John Willey & Sons, US (1993); Sambrookら, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory Press, US (1989)などに記載される技術を使用することができる。
【0092】
ヒト由来の、SHC1、C1R、LAMA5、PGAM1、ZNF708、YWHAQ、AC004609、ZNF714、LOC152667、ZNF716遺伝子は公知であり、前述のようにその取得方法も知られている。このため、これらの遺伝子をクローニングすることによって、本発明の組成物としてのポリヌクレオチドを作製することができる。
【0093】
本発明の組成物を構成するポリヌクレオチドは、DNA自動合成装置を用いて化学的に合成することができる。この合成には一般にホスホアミダイト法が使用され、この方法によって約100塩基までの一本鎖DNAを自動合成することができる。DNA自動合成装置は、例えばPolygen社、ABI社、Applied BioSystems社などから市販されている。
【0094】
或いは、本発明のポリヌクレオチドは、cDNAクローニング法によって作製することもできる。本発明において標的である上記遺伝子が発現される食道組織などの生体組織から抽出したtotal RNAをオリゴdTセルロースカラムで処理して得られるポリA(+)RNAからRT−PCR法によってcDNAライブラリーを作製し、このライブラリーからハイブリダイゼーションスクリーニング、発現スクリーニング、抗体スクリーニングなどのスクリーニングによって目的のcDNAクローンを得ることができる。必要に応じて、cDNAクローンをPCR法によって増幅することもできる。プローブ又はプライマーは、配列番号1〜20に示される塩基配列に基づいて15〜100塩基の連続する配列の中から選択し、合成しうる。cDNAクローニング技術は、例えばSambrook,J.& Russel,D. 著、Molecular Cloning, A LABORATORY MANUAL、Cold Spring Harbor Laboratory Press、2001年1月15日発行、の 第1巻7.42〜7.45、第2巻8.9〜8.17に記載されている。
【0095】
3.2 抗体
本発明はさらに、配列番号1〜10で表される塩基配列によってコードされるポリペプチド、例えば配列番号21〜27で表されるアミノ酸配列を有するポリペプチド、に対する2以上の抗体、その断片、又はそれらの化学修飾誘導体を含む、食道ガン転移の判定、検出、診断又は予測のための組成物を提供する。
【0096】
すなわち、本発明により、食道ガン転移マーカーとしての、上記SHC1、C1R、LAMA5、PGAM1、ZNF708、YWHAQ、AC004609、ZNF714、LOC152667、ZNF716遺伝子によってコードされるポリペプチド、それらの同族体、或いはそれらの変異体又は誘導体を検出するために、これらのポリペプチドに対する抗体を2以上、好ましくは3以上、より好ましくは6以上組み合わせて用いることができる。
【0097】
これらのポリペプチドは、DNA組換え技術によって得ることができる。例えば、上記のようにして得られたcDNAクローンを発現ベクターに組み込み、該ベクターによって形質転換又はトランスフェクションされた原核又は真核宿主細胞を培養することによって該細胞又は培養上清から得ることができる。ベクター及び発現系はNovagen社、宝酒造、第一化学薬品、Qiagen社、Stratagene社、Promega社、Roche Diagnositics社、Invitrogen社、Genetics Institute社、Amersham Bioscience社などから入手可能である。宿主細胞としては、細菌などの原核細胞(例えば大腸菌、枯草菌)、酵母(例えばサッカロマイセス・セレビシアエ)、昆虫細胞(例えばSf細胞)、哺乳動物細胞(例えばCOS、CHO、BHK)などを用いることができる。ベクターには、該ポリペプチドをコードするDNAの他に、調節エレメント、例えばプロモーター、エンハンサー、ポリアデニル化シグナル、リボソーム結合部位、複製開始点、ターミネーター、選択マーカーなどを含むことができる。またポリペプチドの精製を容易にするために標識ペプチドをポリペプチドのC末端又はN末端につけた融合ポリペプチドとしてもよい。代表的な標識ペプチドには、6〜10残基のヒスチジンリピート、FLAG、mycぺプチド、GFPポリペプチドなどが挙げられるが、標識ペプチドはこれらにかぎられるものではない。またDNA組換え技術については、Sambrook, J. & Russel, D.(上記)に記載されている。
【0098】
標識ペプチドを付けずに本発明に係るポリペプチドを生産した場合には、その精製法として例えばイオン交換クロマトグラフィーによる方法を挙げることができる。またこれに加えて、ゲルろ過や疎水性クロマトグラフィー、等電点クロマトグラフィーなどを組み合わせる方法でもよい。一方、当該タンパクにヒスチジンリピート、FLAG、myc、GFPといった標識ペプチドを付けている場合には、一般に用いられるそれぞれの標識ペプチドに適したアフィニティークロマトグラフィーによる方法を挙げることができる。単離・精製が容易となるような発現ベクターを構築するとよい。特にポリペプチドと標識ペプチドとの融合ポリペプチドの形態で発現するように発現ベクターを構築し、遺伝子工学的に当該ポリペプチドを調製すれば、単離・精製も容易である。
【0099】
このようにして得られたポリペプチドを認識する抗体は、抗体の抗原結合部位を介して、該ポリペプチドに特異的に結合し得る。具体的には、配列番号21〜27のアミノ酸配列を有するポリペプチド又はその断片、その変異体ポリペプチド又は融合ポリペプチドなどを、それぞれに免疫反応性である抗体を産生するための免疫原として使用することが可能である。
【0100】
より具体的には、ポリペプチド、断片、変異体、融合ポリペプチドなどは、抗体形成を引き出す抗原決定基又はエピトープを含むが、これら抗原決定基又はエピトープは、直鎖でもよいし、より高次構造(断続的)でもよい。なお、該抗原決定基又はエピトープは、当該技術分野に知られるあらゆる方法によって同定できる。
【0101】
本発明のポリペプチドによってあらゆる態様の抗体が誘導される。該ポリペプチドの全部若しくは一部又はエピトープが単離されていれば、慣用的技術を用いてポリクローナル抗体及びモノクローナル抗体のいずれも調製可能である。方法には例えば、Kennetら(監修),Monoclonal Antibodies,Hybridomas: A New Dimension in Biological Analyses,Ple num Press,New York,1980に挙げられた方法がある。
【0102】
本発明の抗体としては、本発明の標的ポリペプチド又はその断片と特異的に結合するものであれば特に限定されず、モノクローナル抗体でもポリクローナル抗体でも使用することができるが、モノクローナル抗体を使用するのが好ましい。また、本発明の抗体のグロブリンタイプは、上記特徴を有するものである限り特に限定されるものではなく、IgG、IgM、IgA、IgE、IgDのいずれでもよい。
【0103】
<モノクローナル抗体の作製>
(1)免疫及び抗体産生細胞の採取
標的ポリペプチドからなる免疫原を、哺乳動物、例えばラット、マウス(例えば近交系マウスのBalb/c)、ウサギなどに投与する。免疫原の1回の投与量は、免疫動物の種類、投与経路などにより適宜決定されるものであるが、動物1匹当たり約50〜200μgとされる。免疫は主として皮下、腹腔内に免疫原を注入することにより行われる。また、免疫の間隔は特に限定されず、初回免疫後、数日から数週間間隔で、好ましくは1〜4週間間隔で、2〜10回、好ましくは3〜4回追加免疫を行う。初回免疫の後、免疫動物の血清中の抗体価の測定をELISA(Enzyme−Linked Immuno Sorbent Assay)法などにより繰り返し行い、抗体価がプラトーに達したときは、免疫原を静脈内又は腹腔内に注射し、最終免疫とする。そして、最終免疫の日から2〜5日後、好ましくは3日後に、抗体産生細胞を採取する。抗体産生細胞としては、脾臓細胞、リンパ節細胞、末梢血細胞等が挙げられるが、脾臓細胞又は局所リンパ節細胞が好ましい。
【0104】
(2)細胞融合
各標的ポリペプチドに特異的なモノクローナル抗体を産生するハイブリドーマ細胞株を作製する。こうしたハイブリドーマは、慣用的技術によって産生し、そして同定することが可能である。こうしたハイブリドーマ細胞株を産生するための1つの方法は、動物を本発明のタンパク質で免疫し、免疫された動物から脾臓細胞を採取し、該脾臓細胞を骨髄腫細胞株に融合させ、それによりハイブリドーマ細胞を生成し、そして該酵素に結合するモノクローナル抗体を産生するハイブリドーマ細胞株を同定することを含む。抗体産生細胞と融合させる骨髄腫細胞株としては、マウスなどの動物の一般に入手可能な株化細胞を使用することができる。使用する細胞株としては、薬剤選択性を有し、未融合の状態ではHAT選択培地(ヒポキサンチン、アミノプテリン、チミジンを含む)で生存できず、抗体産生細胞と融合した状態でのみ生存できる性質を有するものが好ましい。また株化細胞は、免疫動物と同種系の動物に由来するものが好ましい。骨髄腫細胞株の具体例としては、BALB/cマウス由来のヒポキサンチン・グアニン・ホスホリボシル・トランスフェラーゼ(HGPRT)欠損細胞株であるP3X63−Ag.8株(ATCC TIB9)などが挙げられる。
【0105】
次に、上記骨髄腫細胞株と抗体産生細胞とを細胞融合させる。細胞融合は、血清を含まないDMEM、RPMI−1640培地などの動物細胞培養用培地中で、抗体産生細胞と骨髄腫細胞株とを約1:1〜 20:1の割合で混合し、細胞融合促進剤の存在下にて融合反応を行う。細胞融合促進剤として、平均分子量1500〜4000ダルトンのポリエチレングリコール等を約10〜80%の濃度で使用することができる。また場合によっては、融合効率を高めるために、ジメチルスルホキシドなどの補助剤を併用してもよい。さらに、電気刺激(例えばエレクトロポレーション)を利用した市販の細胞融合装置を用いて抗体産生細胞と骨髄腫細胞株とを融合させることもできる。
【0106】
(3)ハイブリドーマの選別及びクローニング
細胞融合処理後の細胞から目的とするハイブリドーマを選別する。その方法として、細胞懸濁液を、例えばウシ胎児血清含有RPMI−1640培地などで適当に希釈後、マイクロタイタープレート上に200万個/ウエル程度まき、各ウエルに選択培地を加え、以後適当に選択培地を交換して培養を行う。培養温度は、20〜40℃ 、好ましくは約37℃である。ミエローマ細胞がHGPRT欠損株又はチミジンキナーゼ欠損株のものである場合には、ヒポキサンチン・アミノプテリン・チミジンを含む選択培地(HAT培地)を用いることにより、抗体産生能を有する細胞と骨髄腫細胞株のハイブリドーマのみを選択的に培養し、増殖させることができる。その結果、選択培地で培養開始後、約14日前後から生育してくる細胞をハイブリドーマとして得ることができる。
【0107】
次に、増殖してきたハイブリドーマの培養上清中に、目的とする抗体が存在するか否かをスクリーニングする。ハイブリドーマのスクリーニングは、通常の方法に従えばよく、特に限定されない。例えば、ハイブリドーマとして生育したウエルに含まれる培養上清の一部を採取し、酵素免疫測定法(EIA:Enzyme Immuno Assay、及びELISA)、放射免疫測定法(RIA:Radio Immuno Assay)等によって行うことができる。融合細胞のクローニングは、限界希釈法等により行い、最終的にモノクローナル抗体産生細胞であるハイブリドーマを樹立する。本発明のハイブリドーマは、後述するように、RPMI−1640、DMEM等の基本培地中での培養において安定であり、標的ポリペプチドと特異的に反応するモノクローナル抗体を産生、分泌するものである。
【0108】
(4)抗体の回収
モノクローナル抗体は、慣用的技術によって回収可能である。すなわち樹立したハイブリドーマからモノクローナル抗体を採取する方法として、通常の細胞培養法又は腹水形成法等を採用することができる。細胞培養法においては、ハイブリドーマを10% ウシ胎児血清含有RPMI−1640培地、MEM培地又は無血清培地等の動物細胞培養培地中で、通常の培養条件(例えば37℃、5%CO2濃度)で2〜10日間培養し、その培養上清から抗体を取得する。腹水形成法の場合は、ミエローマ細胞由来の哺乳動物と同種系動物の腹腔内にハイブリドーマを約1000万個投与し、ハイブリドーマを大量に増殖させる。そして、1〜2週間後に腹水又は血清を採取する。
【0109】
上記抗体の採取方法において、抗体の精製が必要とされる場合は、硫安塩析法、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、ゲルクロマトグラフィーなどの公知の方法を適宜に選択して、又はこれらを組み合わせることにより、精製されたモノクローナル抗体を得ることができる。
【0110】
<ポリクローナル抗体の作製>
ポリクローナル抗体を作製する場合は、前記と同様にウサギ等の動物を免疫し、最終の免疫日から6〜60日後に、酵素免疫測定法(EIA及びELISA)、放射免疫測定法(RIA)等で抗体価を測定し、最大の抗体価を示した日に採血し、抗血清を得る。その後は、抗血清中のポリクローナル抗体の反応性をELISA法などで測定する。ポリクローナル抗体はさらに、精製ポリペプチドを結合した親和性カラムに結合させることを含む、いわゆる吸収法によって、特異的抗体として調製することができる。
【0111】
本発明で使用可能な抗体又は断片は、上記のポリクローナル抗体及びモノクローナル抗体の他に、合成抗体、組換え抗体、多重特異性抗体(二重特異性抗体を含む)、単鎖抗体(単鎖ダイアボディ、scFvなどを含む)、Fab断片、F(ab’)2断片などを含むことができる。
【0112】
本発明で使用される抗体は、組成物の他にキットの形態をとることができる。キットに含まれる抗体は、個別に又は混合物の形態で存在しうるし、或いは固相担体に結合されていてもよいし又は遊離の形態でもよい。さらに、そのようなキットは、標識二次抗体、担体、洗浄バッファー、試料希釈液、酵素基質、反応停止液、精製された標準物質としてのマーカー(標的)ポリペプチド、使用説明書、等を含むことができる。
【0113】
4.食道ガン転移診断用キット
本発明はまた、本発明の組成物に含まれるものと同じポリヌクレオチド、その変異体及び/又はその断片の1つ又は複数を含む食道ガン診断(検出)用キットを提供する。
【0114】
本発明のキットは、好ましくは、上記3.1に記載したポリヌクレオチド類から選択される2以上、好ましくは3以上、より好ましくは6以上のポリヌクレオチド又はその断片を含む。
【0115】
本発明のキットは、配列番号1〜10で表される塩基配列を含むポリヌクレオチド、その相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はそれらのポリヌクレオチドの断片を少なくとも2つ含むことができる。
【0116】
本発明のキットに含むことができるポリヌクレオチド断片は、例えば下記の(1)〜(5)からなる群より選択される2以上のDNAである:
(1)配列番号1〜10で表される塩基配列又はその相補的配列において、15以上の連続した塩基を含むDNA。
(2)配列番号1〜10で表される塩基配列又はその相補的配列において、60以上の連続した塩基を含むDNA。
(3)配列番号1〜10で表される塩基配列又はその相補的配列において、それぞれ配列番号11〜20で表される塩基配列又はその相補的配列を含み、かつ60以上の連続した塩基を含むDNA。
(4)配列番号11〜20で表される塩基配列からなるDNA。
(5)配列番号11〜20で表される塩基配列に相補的な塩基配列を含むDNA。
【0117】
好ましい実施形態では、前記ポリヌクレオチドが、配列番号1〜10のいずれかで表される塩基配列からなるポリヌクレオチド、その相補的配列からなるポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はそれらの15以上の連続した塩基を含む断片である。
【0118】
好ましい実施形態では、前記断片は、15以上、好ましくは20〜30又はそれ以上、より好ましくは40〜50又はそれ以上、さらに好ましくは60以上の連続した塩基を含むポリヌクレオチドであることができる。
【0119】
別の好ましい実施形態では、前記断片が、配列番号1〜10のいずれかで表される塩基配列において、それぞれ配列番号11〜20のいずれかで表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド、又は該ポリヌクレオチドの配列に相補的な塩基配列を含むポリヌクレオチドである。
【0120】
別の好ましい実施形態では、前記断片が、配列番号11〜20のいずれかで表される塩基配列を含むポリヌクレオチドである。
【0121】
別の好ましい実施形態では、前記断片が、配列番号11〜20のいずれかで表される塩基配列に相補的な塩基配列を含むポリヌクレオチドである。
【0122】
別の好ましい実施形態では、前記断片が、配列番号11〜20のいずれかで表される塩基配列からなるポリヌクレオチドである。
【0123】
上記の組み合わせの具体例は、配列番号1及び2の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜3の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜4の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜5の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜6の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜7の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜8の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜9の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号1〜10の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はその断片である。
【0124】
また、別の組み合わせの具体例は、配列番号2及び3の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜4の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜5の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜5の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜6の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜7の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜8の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜9の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号2〜10の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はその断片である。
【0125】
別のより好ましい実施形態によれば、本発明のキットは、配列番号11〜20で表される塩基配列又はその相補的配列を含むポリヌクレオチドの2以上〜全部を含むことができる。
【0126】
例えば、そのような組み合わせの例は、配列番号12及び13の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜14の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜15の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜15の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜16の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜17の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜18の塩基配列又はその相補的配列を含むポリヌクレオド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜19の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、及び/又はその断片、配列番号12〜20の塩基配列又はその相補的配列を含むポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はその断片である。
【0127】
ポリヌクレオチド又はその断片1個での食道ガン判別確率が60数%に過ぎないが、異なる遺伝子由来のポリヌクレオチド又はその断片2個以上、好ましくは3個以上、より好ましくは6個以上、を組み合わせると80%超から90数%まで確率が向上する。
【0128】
本発明において、ポリヌクレオチドの断片のサイズは、各ポリヌクレオチドの塩基配列において、例えば、連続する15〜配列の全塩基数、15〜5000塩基、15〜4500塩基、15〜4000塩基、15〜3500塩基、15〜3000塩基、15〜2500塩基、15〜2000塩基、15〜1500塩基、15〜1000塩基、15〜900塩基、15〜800塩基、15〜700塩基、15〜600塩基、15〜500塩基、15〜400塩基、15〜300塩基、15〜250塩基、15〜200塩基、15〜150塩基、15〜140塩基、15〜130塩基、15〜120塩基、15〜110塩基、15〜100塩基、15〜90塩基、15〜80塩基、15〜70塩基、15〜60塩基、15〜50塩基、15〜40塩基、15〜30塩基又は15〜25塩基;25〜配列の全塩基数、25〜1000塩基、25〜900塩基、25〜800塩基、25〜700塩基、25〜600塩基、25〜500塩基、25〜400塩基、25〜300塩基、25〜250塩基、25〜200塩基、25〜150塩基、25〜140塩基、25〜130塩基、25〜120塩基、25〜110塩基、25〜100塩基、25〜90塩基、25〜80塩基、25〜70塩基、25〜60塩基、25〜50塩基又は25〜40塩基;50〜配列の全塩基数、50〜1000塩基、50〜900塩基、50〜800塩基、50〜700塩基、50〜600塩基、50〜500塩基、50〜400塩基、50〜300塩基、50〜250塩基、50〜200塩基、50〜150塩基、50〜140塩基、50〜130塩基、50〜120塩基、50〜110塩基、50〜100塩基、50〜90塩基、50〜80塩基、50〜70塩基又は50〜60塩基;60〜配列の全塩基数、60〜1000塩基、60〜900塩基、60〜800塩基、60〜700塩基、60〜600塩基、60〜500塩基、60〜400塩基、60〜300塩基、60〜250塩基、60〜200塩基、60〜150塩基、60〜140塩基、60〜130塩基、60〜120塩基、60〜110塩基、60〜100塩基、60〜90塩基、60〜80塩基又は60〜70塩基などの範囲の塩基数である。
【0129】
本発明のキットを構成する上記の組み合わせは、あくまでも例示であり、他の種々の可能な組み合わせのすべてが本発明に包含されるものとする。
【0130】
本発明のキットには、上で説明した本発明におけるポリヌクレオチド、その変異体又はその断片に加えて、食道ガンの検出を可能とする既知の又は将来見出されるポリヌクレオチドも包含させることができる。
【0131】
本発明のキットに含まれるポリヌクレオチド、その変異体又はその断片は、個別に又は任意に組み合わせて異なる容器に包装される。
【0132】
5.DNAチップ
本発明はさらに、本発明の組成物及び/又はキットに含まれるものと同じポリヌクレオチド(或いは、上記の3.1節の組成物及び/又は4節のキットに記載されたポリヌクレオチド)、変異体、断片及びそれらの組み合わせを含む食道ガン転移診断用DNAチップを提供する。
【0133】
DNAチップの基板としては、DNAを固相化できるものであれば特に制限はなく、スライドガラス、シリコン製チップ、ポリマー製チップ及びナイロンメンブレンなどを例示することができる。またこれらの基板にはポリL−リジンコートやアミノ基、カルボキシル基などの官能基導入などの表面処理がされていてもよい。
【0134】
また固相化法については一般に用いられる方法であれば特に制限はなく、スポッター又はアレイヤーと呼ばれる高密度分注機を用いてDNAをスポットする方法や、ノズルより微少な液滴を圧電素子などにより噴射する装置(インクジェット)を用いてDNAを基板に吹き付ける方法、又は基板上で順次ヌクレオチド合成を行う方法を例示することができる。高密度分注機を用いる場合には、例えば多数のウエルを持つプレートのおのおののウエルに異なった遺伝子溶液を入れておき、この溶液をピン(針)で取り上げて基板上に順番にスポットすることによる。インクジェット法では、ノズルより遺伝子を噴射し、基板上に高速度で遺伝子を整列配置することによる。基板上でのDNA合成は、基板上に結合した塩基を光によって脱離する官能基で保護し、マスクを用いることにより特定部位の塩基だけに光を当て、官能基を脱離させる。その後、塩基を反応液に加えて、基板上の塩基とカップリングさせる工程を繰り返すことによって行われる。
【0135】
固相化されるポリヌクレオチドは、上記で説明した本発明の全てのポリヌクレオチドである。
【0136】
例えば、そのようなポリヌクレオチドは、以下の(1)〜(12)のポリヌクレオチド及びその断片のうち異なる遺伝子由来の2以上、好ましくは3以上、より好ましくは6以上のポリヌクレオチド又はその断片を含むことができる。
(1)配列番号1〜10で表される塩基配列からなるポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(2)配列番号1〜10で表される塩基配列を含むポリヌクレオチド群。
(3)配列番号1〜10で表される塩基配列からなるポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(4)配列番号1〜10で表される塩基配列を含むポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(5)配列番号1〜10で表される塩基配列に相補的な塩基配列からなるポリヌクレオチド群、それらの変異体、又は15以上の連続した塩基を含むそれらの断片。
(6)配列番号1〜10で表される塩基配列に相補的な塩基配列を含むポリヌクレオチド群。
(7)配列番号1〜10で表される塩基配列の各々と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズするポリヌクレオチド群、又は15以上の連続した塩基を含むそれらの断片。
(8)配列番号1〜10で表される塩基配列の各々からなるDNAとストリンジェントな条件でハイブリダイズするポリヌクレオチド群、又は15以上の連続した塩基を含むそれらの断片。
(9)配列番号1〜10で表される塩基配列又はその相補的配列の各々において、15以上の連続した塩基を含むポリヌクレオチド。
(10)配列番号1〜10で表される塩基配列又はその相補的配列の各々において、60以上の連続した塩基を含むポリヌクレオチド。
(11)配列番号1〜10で表される塩基配列において、それぞれ配列番号11〜20で表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド。
(12)配列番号1〜10で表される塩基配列に相補的な配列において、それぞれ配列番号11〜20で表される塩基配列に相補的な配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド。
【0137】
好ましい実施形態によれば、本発明のDNAチップは、配列番号11〜20で表される塩基配列又はその相補的配列を含むポリヌクレオチドの2以上から全部を含むことができる。
【0138】
本発明において、固相化されるポリヌクレオチドは、ゲノムDNA、cDNA、RNA、合成DNA、合成RNAのいずれでもよいし、或いは1本鎖でもよいし又は2本鎖でもよい。
【0139】
標的遺伝子、RNA又はcDNAの発現レベルを検出、測定することができるDNAチップの例としては、Affymetrix社のGene Chip Human Genome U133 Plus 2.0 Array、Agilent社のWhole human genome oligo microarray、タカラバイオ社のIntelliGene(登録商標)HS Human Expression CHIPなどを挙げることができる。
【0140】
DNAマイクロアレイの作製について、例えば予め調製したプローブを固相表面に固定化する方法を使用することができる。予め調製したポリヌクレオチドプローブを固相表面に固定化する方法では、官能基を導入したポリヌクレオチドを合成し、表面処理した固相担体表面にオリゴヌクレオチド又はポリヌクレオチドを点着し、共有結合させる(例えば、J.B.Lamtureら、Nucleic.Acids.Research、1994年、第22巻、p.2121−2125、Z.Guoら、Nucleic.Acids.Research、1994年、第22巻、p.5456−5465)。ポリヌクレオチドは、一般的には、表面処理した固相担体にスペーサ-やクロスリンカーを介して共有結合される。ガラス表面にポリアクリルアミドゲルの微小片を整列させ、そこに合成ポリヌクレオチドを共有結合させる方法も知られている(G.Yershovら、Proceedings of the National Academic Sciences U.S.A.、1996年、第94巻、p.4913)。また、シリカマイクロアレイ上に微小電極のアレイを作製し、電極上にはストレプトアビジンを含むアガロースの浸透層を設けて反応部位とし、この部位をプラスに荷電させることでビオチン化ポリクレオチドを固定し、部位の荷電を制御することで、高速で厳密なハイブリダイゼーションを可能にする方法も知られている(R.G.Sosnowskiら、Proceedings of the National Academic Sciences U.S.A.、1997年、第94巻、p.1119−1123)。
【0141】
6.食道ガン転移の検出法
6.1 核酸
本発明は、本発明の組成物、キット、DNAチップ、又はそれらの組み合わせを用いて、被験者由来の検体試料中にすでに転移を起こした食道ガン細胞が含まれるかどうかをin vitroで判定する方法であって、手術時にリンパ節転移がなかった患者由来の食道ガン組織に比較して、該検体試料中の細胞の標的核酸の発現量が増加しているか又は低下している場合、該検体試料中にすでに転移がある食道ガン細胞が存在すると判定することを含み、ここで、該標的核酸が該組成物、キット又はDNAチップに含まれるポリヌクレオチド、その変異体又はその断片によって検出可能なものである、方法を提供する。
【0142】
本発明はまた、本発明の組成物、キット又はDNAチップの、被験者由来の検体試料中の食道ガン転移のin vivo検出のための使用を提供する。
【0143】
本発明の上記方法において、組成物、キット又はDNAチップは、上で説明したような、本発明のポリヌクレオチド、その変異体又はその断片を単一で或いはあらゆる可能な組み合わせで含むものが使用される。
【0144】
本発明の食道ガン転移の検出、判定又は(遺伝子)診断において、本発明の組成物、キット又はDNAチップに含まれるポリヌクレオチド、その変異体又はその断片は、プライマーとして又はプローブとして用いることができる。プライマーとして用いる場合には、通常15〜50塩基、好ましくは15〜30塩基、より好ましくは18〜25塩基の塩基長を有するものが例示できる。また検出プローブとして用いる場合には、例えば15塩基〜全配列の塩基数、好ましくは25〜1000塩基、より好ましくは25〜100塩基の塩基長を有するものが例示できるが、この範囲に限定されない。
【0145】
本発明の組成物又はキットに含まれるポリヌクレオチド、その変異体又はその断片は、ノーザンブロット法、RT−PCR法、in situ ハイブリダイゼーション法などの、特定遺伝子を特異的に検出する公知の方法において、定法に従ってプライマー又はプローブとして利用することができる。測定対象試料としては、使用する検出方法の種類に応じて、被験者の食道組織又は食道ガン細胞の存在が疑われる生体組織の一部又は全部をバイオプシーなどで採取するか、もしくは手術によって摘出した生体組織から回収する。さらにそこから常法に従って調製したtotal RNAを用いてもよいし、さらに該RNAをもとにして調製される、cDNA、ポリA(+)RNAを含む各種のポリヌクレオチドを用いてもよい。
【0146】
或いは、生体組織における本発明の遺伝子、RNA、cDNAなどの核酸の発現量は、DNAチップ(DNAマクロアレイを含む)を用いて検出或いは定量することができる。この場合、本発明の組成物又はキットはDNAアレイのプローブとして使用することができる(例えば、アフィメトリックス社のHuman Genome U133 Plus 2.0 Arrayでは25塩基の長さのポリヌクレオチドプローブが用いられる。また、東レ株式会社の3D−Gene(登録商標) Human Oligo chip 25kでは69〜70塩基の長さのポリヌクレオチドプローブが用いられる。)。かかるDNAアレイを生体組織から採取したRNAをもとに調製される標識DNA又はRNAとハイブリダイズさせ、該ハイブリダイズによって形成された上記プローブと標識DNA又はRNAとの複合体を、該標識DNA又はRNAの標識を指標として検出することにより、生体組織中での本発明食道ガン転移関連遺伝子の発現の有無又は発現レベル(発現量)を評価することができる。本発明の方法では、DNAチップを好ましく使用できるが、これは、ひとつの生体試料について同時に複数遺伝子の発現の有無又は発現レベルの評価が可能である。
【0147】
本発明の組成物、キット又はDNAチップは、食道ガン転移の診断、判定又は検出(罹患の有無や罹患の程度の診断)のために有用である。具体的には、該組成物、キット又はDNAチップを使用した食道ガン転移の診断は、被験者の食道ガン細胞の存在する生体組織と、手術時にリンパ節転移がなかった患者由来の食道ガン組織及び/又は手術時にリンパ節転移があった患者由来の食道ガン組織との比較、或いは、手術時にリンパ節転移がなかった患者及び/又は手術時にリンパ節転移があった患者の同等の生体組織との比較を行い、該診断用組成物で検出される遺伝子の発現レベルの違いを判定することによって行うことができる。この場合、遺伝子発現レベルの違いには、発現の有無だけではなく、転移がある食道ガン細胞の存在する生体組織と転移がない食道ガン細胞の存在する生体組織の両者ともに発現がある場合でも、両者間の発現量を比較した時の差が検定上有意(p値<0.05)である場合が含まれる。例えばSHC1遺伝子は転移のある食道ガンで発現誘導を示すので、被験者の食道ガン組織では発現しており、該発現量と転移がない食道ガン細胞の存在する生体組織の発現量と比べて検定を行った時に、その差が有意であれば、被験者について食道ガンの転移が疑われる。
【0148】
本発明の組成物、キット又はDNAチップを利用した転移がある食道ガン(細胞)の検出方法は、被験者の生体組織の一部又は全部をバイオプシーなどで採取するか、もしくは手術によって摘出した生体組織から回収し、そこに含まれる遺伝子を、本発明のポリヌクレオチド群から選ばれた単数又は複数のポリヌクレオチド、その変異体又はその断片を用いて検出し、その遺伝子発現量を測定することにより、食道ガンの転移の有無又はその程度を診断することを含む。また本発明の食道ガン転移の検出方法は、例えば食道ガン患者において、該疾患の改善のために治療薬を投与した場合における該疾患の改善の有無又はその程度を検出、判定又は診断することもできる。
【0149】
本発明の方法は、例えば以下の(a)、(b)及び(c)の工程:
(a)被験者由来の検体試料を、本発明の組成物、キット又はDNAチップのポリヌクレオチドと接触させる工程、
(b)生体試料中の標的核酸の発現レベルを、上記ポリヌクレオチドをプローブとして用いて測定する工程、
(c)(b)の結果をもとに、該検体試料中の食道ガン(細胞)転移の存在又は不存在を判定する工程、
を含むことができる。
【0150】
本発明方法で用いられる検体試料としては、被験者の生体組織、例えば食道組織及びその周辺組織、食道ガンの転移が疑われる組織など、から調製される試料を挙げることができる。具体的には該組織から調製されるRNA含有試料、或いはそれからさらに調製されるポリヌクレオチドを含む試料は、被験者の生体組織の一部又は全部をバイオプシーなどで採取するか、もしくは手術によって摘出した生体組織から回収し、そこから常法に従って調製することができる。
【0151】
ここで被験者とは、哺乳動物、例えば非限定的にヒト、サル、マウス、ラットなどを指し、好ましくはヒトである。
【0152】
本発明の方法は、測定対象として用いる生体試料の種類に応じて工程を変更することができる。
【0153】
測定対象物としてRNAを利用する場合、食道ガン(細胞)の検出は、例えば下記の工程(a)、(b)及び(c):
(a)被験者の生体試料から調製されたRNA又はそれから転写された相補的ポリヌクレオチド(cDNA)を、本発明の組成物、キット又はDNAチップのポリヌクレオチドと結合させる工程、
(b) 該ポリヌクレオチドに結合した生体試料由来のRNA又は該RNAから転写された相補的ポリヌクレオチドを、上記ポリヌクレオチドをプローブとして用いて測定する工程、
(c) 上記(b)の測定結果に基づいて、食道ガン(細胞)の存在又は不存在を判定する工程、
を含むことができる。
【0154】
本発明によって食道ガン(細胞)を検出、判定又は診断するために、例えば種々のハイブリダイゼーション法を使用することができる。かようなハイブリダイゼーション法には、例えばノーザンブロット法、サザンブロット法、RT−PCR法、DNAチップ解析法、in situハイブリダイゼーション法、サザンハイブリダイゼーション法などを使用することができる。
【0155】
ノーザンブロット法を利用する場合は、本発明の診断用組成物をプローブとして用いることによって、RNA中の各遺伝子発現の有無やその発現レベルを検出、測定することができる。具体的には、本発明の診断用組成物(相補鎖)を放射性同位元素(32P、33P、35Sなど)や蛍光物質などで標識し、それを常法にしたがってナイロンメンブレンなどにトランスファーした被験者の生体組織由来のRNAとハイブリダイズさせたのち、形成された診断用組成物(DNA)とRNAとの二重鎖を診断用組成物の標識物(放射性同位元素又は蛍光物質)に由来するシグナルを放射線検出器(BAS-1800II、富士写真フィルム株式会社、などを例示できる)又は蛍光検出器(STORM860、Amersham Bioscience社、などを例示できる)で検出、測定する方法を例示することができる。
【0156】
本明細書で使用する「被験者」なる用語は、哺乳動物(例えばヒト、ペット動物、家畜類など)を指し、好ましくはヒトである。
【0157】
定量RT―PCR法を利用する場合には、本発明の上記診断用組成物をプライマーとして用いることによって、RNA中の遺伝子発現の有無やその発現レベルを検出、測定することができる。具体的には、被験者の生体組織由来のRNAから常法にしたがってcDNAを調製して、これを鋳型として標的の各遺伝子の領域が増幅できるように、本発明の診断用組成物から調製した1対のプライマー(上記cDNAに結合する正鎖と逆鎖からなる)をcDNAとハイブリダイズさせて常法によりPCR法を行い、得られた二本鎖DNAを検出する方法を例示することができる。なお、二本鎖DNAの検出法としては、上記PCRをあらかじめ放射性同位元素や蛍光物質で標識しておいたプライマーを用いて行う方法、PCR産物をアガロースゲルで電気泳動し、エチジウムブロマイドなどで二本鎖DNAを染色して検出する方法、産生された二本鎖DNAを常法にしたがってナイロンメンブレンなどにトランスファーさせて標識した診断用組成物をプローブとしてこれとハイブリダイズさせて検出する方法をとることができる。
【0158】
DNAアレイ解析を利用する場合は、本発明の上記診断用組成物をDNAプローブ(一本鎖又は二本鎖)として基板に貼り付けたDNAチップを用いる。遺伝子群を基板に固相化したものには、一般にDNAチップ及びDNAアレイという名称があり、DNAアレイにはDNAマクロアレイとDNAマイクロアレイが包含されるが、本明細書ではDNAチップといった場合、該DNAアレイを含むものとする。
【0159】
ハイブリダイゼーション条件は、限定されないが、例えば30℃〜50℃で、3〜4×SSC、0.1〜0.5% SDS中で1〜24時間のハイブリダイゼーション、より好ましくは40℃〜45℃で、3.4×SSC、0.3%SDS中で1〜24時間のハイブリダイゼーション、そしてその後の洗浄を含む。洗浄条件としては、例えば、2×SSCと0.1%SDSを含む溶液、及び1×SSC溶液、0.2×SSC溶液による室温での連続した洗浄などの条件を挙げることができる。ここで、1×SSCは、150mM塩化ナトリウム及び15mMクエン酸ナトリウムを含む水溶液(pH7.2)である。相補鎖はかかる条件で洗浄しても対象とする正鎖とハイブリダイズ状態を維持するものであることが望ましい。具体的にはこのような相補鎖として、対象の正鎖の塩基配列と完全に相補的な関係にある塩基配列からなる鎖、並びに該鎖と少なくとも80%の相同性を有する塩基配列からなる鎖を例示することができる。
【0160】
本発明の組成物又はキットのポリヌクレオチド断片をプライマーとしてPCRを実施する際のストリンジェントなハイブリダイゼーション条件の例としては、例えば10mMTris−HCL(pH8.3)、50mMKCL、1〜2mM MgCl2などの組成のPCRバッファーを用い、当該プライマーの配列から計算されたTm+5〜10℃において15秒から1分程度処理することなどが挙げられる。かかるTmの計算方法としてTm=2×(アデニン残基数+チミン残基数)+4×(グアニン残基数+シトシン残基数)などが挙げられる。
【0161】
これらのハイブリダイゼーションにおける「ストリンジェントな条件」の他の例については、例えばSambrook, J. & Russel, D. 著、Molecular Cloning, A LABORATORY MANUAL、Cold Spring Harbor Laboratory Press、2001年1月15日発行、の 第1巻7.42〜7.45、第2巻8.9〜8.17などに記載されており、本発明において利用できる。
【0162】
本発明はまた、本発明の組成物、キット、DNAチップ、又はそれらの組み合わせを用いて、被験者由来の検体試料中の標的核酸又は遺伝子の発現量を測定し、食道ガン組織と正常組織の遺伝子発現量を教師(訓練サンプル)としたサポートベクターマシーン(SVM)を判別式として、検体試料中に転移がある食道ガン細胞が含まれないこと及び/又は含まれることを判定する方法を提供する。
【0163】
すなわち、本発明はさらに、本発明の組成物、キット、DNAチップ、又はそれらの組み合わせを用いて、転移がある患者由来の食道ガン細胞を含む組織又は転移がない患者由来の食道ガン細胞であることが既知の複数の生体試料中の標的核酸の発現量をin vitroで測定する第1の工程、前記第1の工程で得られた該標的核酸の発現量の測定値を教師とした判別式(サポートベクターマシーン)を作成する第2の工程、被験者の食道由来の検体試料中の該標的核酸の発現量を第1の工程と同様にin vitroで測定する第3の工程、前記第2の工程で得られた判別式に第3の工程で得られた該標的酢酸の発現量の測定値を代入し、該判別式から得られた結果に基づいて、検体試料中に転移がある食道ガン細胞が含まれないこと及び/又は転移がない食道ガン細胞が含まれることを判定する第4の工程を含む、ここで、該標的核酸が該組成物、キット又はDNAチップに含まれるポリヌクレオチド、その変異体又はその断片によって検出可能なものである、前記方法を提供する。
【0164】
或いは、本発明の方法は、例えば下記の工程(a)、(b)及び(c):
(a)転移がある患者由来の食道ガン細胞を含む組織又は転移がない患者由来の食道ガン細胞組織であることが既知の生体試料中の標的遺伝子の発現量を、本発明による診断(検出)用組成物、キット又はDNAチップを用いて測定する工程、
(b)(a)で測定された発現量の測定値を、下記の数1〜数5の式に代入して、SVMと呼ばれる判別式を作成する工程、
(c)被験者由来の検体試料中の該標的遺伝子の発現量を、本発明による診断(検出)用組成物、キット又はDNAチップを用いて測定し、(b)で作成した判別式にそれらを代入して、得られた結果に基づいて該検体試料中に転移がある食道ガン細胞が含まれるかどうかを判定する工程、
を含むことができる。
【0165】
SVMとは2クラスの分類問題を解くためにつくられた1995年にAT&TのV.Vapnik(The Nature of Statistical Leaning Theory、Springer、1995年発行)によって統計的学習理論の枠組みで提案された学習機械である。SVMは線形の識別器であるが、後述するカーネルを組み合わせることによって非線形問題を扱うことができる。異なるクラスの訓練サンプルについて、それらを識別する多数の超平面のうち、その超平面と訓練サンプルとの最小距離が最大となる超平面を識別面とすることにより、新たに与えられるテストサンプルがどのクラスに属するかを最も正確に識別することができる。
【0166】
SVMでは線形問題のみしか扱うことができないが、本質的に非線形な問題に対応するための方法として、特徴ベクトルを高次元へ非線形変換し、その空間で線形の識別を行う方法が知られている。こうすれば、元の空間で非線形モデルを用いているのと等価となる。しかし高次元への写像を行うと膨大な計算量が必要となり、汎化能力も減少する。SVMでは識別関数が入力パターンの内積のみに依存した形になっており、内積が計算できれば最適な識別関数を構成することが可能である。非線形に写像した空間での二つの要素の内積がそれぞれのもとの空間での入力のみで表現されるような式のことをカーネルと呼び、高次元に写像しながら、実際には写像された空間での特徴の計算を避けてカーネルの計算のみで最適な識別関数、すなわち判別式を構成することができる。
【0167】
本発明の方法で使用可能な判別式の算出例を以下に示す。
SVMを決めるためには食道ガン細胞を含む組織又は正常組織であることが既知の生体試料中の標的遺伝子の発現量を教師(訓練サンプル)として用意し、以下の手順によって識別関数の定数を決定することができる。
【0168】
訓練サンプルxiは(+1、−1)でクラス分けされる、食道ガン細胞を含む組織群、又は正常組織群のいずれかに属しているとする。これらの訓練サンプルが超平面によって線形分離できるとき、識別関数は例えば次式となる。
【0169】
【数1】

(ここで、wは重み係数、bはバイアス定数、xはサンプルの変数を表す。)
ただし、この関数には制約条件:
【0170】
【数2】

(ここで、Tは内積、yはサンプルのクラス、ζはスラック変数を表す。)
があるため、Lagurangeの未定乗数法を用いることによりLagurange乗数αを用いた以下の最適化問題に帰着する。
【0171】
【数3】

ここで、
【0172】
【数4】

(ここで、Cは実験により決定される制限条件パラメーターを表す。)
この問題を解くと最終的に、
【0173】
【数5】

が得られ、識別関数を一義的に得ることができる。この関数に新たに与えられる検体試料(食道ガン細胞を含むかどうか未知の組織の発現遺伝子量)についてのxを代入することによって、f(x)をクラス分け(すなわち、+1又は−1)することができ、検体試料がどちらのクラス(すなわち、転移がある患者由来の食道ガン細胞を含む組織群又は転移がない患者由来の食道ガン細胞)に属するかを識別する。
【0174】
以上に示すように、未知試料のクラス分けを行うためのSVMによる判定式の作成には2群の教師(訓練サンプル)が必要となる。この訓練サンプルは例えば今回の発明の場合、「転移のある食道ガン患者の食道ガン組織から得られた発現遺伝子(遺伝子x1,x2,..xi,...xn)」の各患者に対応したセット、及び「転移のない食道ガン患者の食道ガン組織から得られた発現遺伝子(遺伝子x1,x2,..xi,...xn)」の各患者に対応したセット、の2群である。これらのセットについてそれぞれ測定される発現遺伝子数(n)は実験のデザインによって様々ではあるが、個々の遺伝子については、どのような実験においても2群間で大きく差がある場合と、比較的差が少ない、或いは差がない場合が観察される。SVMによる判別式の精度を上げるためには、訓練サンプルとなる2群に、明確な差があることが条件となるため、遺伝子セットの中から2群間で発現量に差がある遺伝子のみを抽出して利用することが必要である。
【0175】
このように、2群間で差がある遺伝子を抽出する方法としては、平均値の差を検出するパラメトリック解析であるt−検定、ノンパラメトリック解析であるMann―WhitneyのU検定などを利用できる。
【0176】
本発明の方法において、例えば、上に記載したような配列番号1〜10に基づく2〜全部、好ましくは3〜全部、さらに好ましくは6〜全部の上記ポリヌクレオチド、並びに/或いは、上に記載したような配列番号11〜20(又は配列番号12〜20)に基づく2〜全部、好ましくは3〜全部、さらに好ましくは6〜全部のポリヌクレオチド、からの任意の組み合わせを用いて、かつ上記の10種の標的遺伝子の発現量がすべて有意に転移がある患者由来の食道ガン組織と転移がない患者由来の食道ガン組織との間で異なり、転移がある患者由来の食道ガン組織において発現が増加しているか、或いは減少していることを指標にして、これら10種の遺伝子について発現量を測定することにより、食道ガンの転移を70%以上、80%以上、好ましくは85%以上、より好ましくは90%以上、さらに好ましくは95%以上の確率で見分けることができる(図1)。
【0177】
6.2 抗体
本発明はさらに、本発明の上記抗体を用いて、被験者由来の食道ガン細胞、血液等の生体試料中の上記ポリペプチドのレベルをin vitroで測定することを含む、被験者の食道ガンの転移の有無をin vitroで予測する方法、或いは食道ガンの転移をin vitroで検出する方法が提供される。
【0178】
具体的には、本発明は、上記10種の遺伝子(例えば、配列番号1〜10に相当する)又はその断片(例えば、配列番号11〜20に相当する)によってコードされるポリペプチド、例えば配列番号21〜27、22〜27などで表されるアミノ酸配列からなるポリペプチド、に対する2〜全部、好ましくは3〜全部、さらに好ましくは6〜全部、の抗体又はその断片を用いて、転移がある患者由来の食道ガン細胞もしくは組織と転移がない患者由来の食道ガン細胞もしくは組織間での該ポリペプチドの発現量、或いは血液中の該ポリペプチドのレベル(又は存在量)、をin vitroで測定することを含む、食道ガン転移の検出方法、或いは食道ガン転移(又は転移の可能性)の有無の予測方法を提供する。
【0179】
測定は、慣用の酵素又は蛍光団で標識した抗体又は断片と、組織切片又はホモゲナイズした組織とを接触させる工程、抗原−抗体複合体を定性的に又は定量的に測定する工程を含むことができる。検出は、例えば免疫電顕により標的ポリペプチドの存在とレベルを測定する方法、ELISAや蛍光抗体法などの慣用法によって標的ポリペプチドのレベルを測定する方法などによって行い、転移がない患者由来の食道ガン細胞もしくは組織と比べて転移がある患者由来の食道ガン細胞もしくは組織において標的ポリペプチドの発現レベル(発現量)が増加しているか又は減少している場合、或いは血液中の該ポリペプチドのレベルが、転移がない食道ガン患者と比べて転移がある食道ガン患者において有意に増加しているか又は低下している場合、食道ガンの転移があると決定する。言い換えれば、前記ポリペプチドの発現量又はレベルが、転移のない患者由来の値と比較して有意に増加又は低下している場合、食道ガンの転移があると決定する。ここで、「有意に」とは、統計学的に有意(p≦0.05)であることを意味する。
【0180】
ポリペプチドの発現レベルは、免疫学的方法によって測定しうる。免疫学的測定法として例えば、酵素免疫測定法(ELISA、EIA)、蛍光免疫測定法、放射免疫測定法(RIA)、発光免疫測定法、免疫比濁法、ラテックス凝集反応、ラテックス比濁法、赤血球凝集反応、粒子凝集反応又はウェスタンブロット法が挙げられる。
【0181】
上記の方法において、標識を用いた免疫測定法により実施する場合には、本発明の抗体を固相化するか、又は試料中の成分を固相化して、それらの免疫学的反応を行うことができる。
【0182】
固相担体としては、ポリスチレン、ポリカーボネート、ポリビニルトルエン、ポリプロピレン、ポリエチレン、ポリ塩化ビニル、ナイロン、ポリメタクリレート、ラテックス、ゼラチン、アガロース、セルロース、セファロース、ガラス、金属、セラミックス又は磁性体等の材質よりなるビーズ、マイクロプレート、試験管、スティック又は試験片等の形状の不溶性担体を用いることができる。
【0183】
固相化は、固相担体と本発明の抗体又は試料成分とを物理的吸着法、化学的結合法又はこれらの併用等の公知の方法に従って結合させることにより行うことができる。
【0184】
さらにまた、本発明においては、本発明の抗体と、試料中の標的ポリペプチドとの反応を容易に検出するために、本発明の抗体を標識することにより該反応を直接検出するか、又は標識二次抗体を用いることにより間接的に検出する。本発明の検出方法においては、感度の点で、後者の間接的検出( 例えばサンドイッチ法など)を利用することが好ましい。
【0185】
標識物質としては、酵素免疫測定法の場合には、ペルオキシダーゼ(POD)、アルカリホスファターゼ、β−ガラクトシダーゼ、ウレアーゼ、カタラーゼ、グルコースオキシダーゼ、乳酸脱水素酵素、アミラーゼ又はビオチン− アビジン複合体等を、蛍光免疫測定法の場合には、フルオレセインイソチオシアネート、テトラメチルローダミンイソチオシアネート、置換ローダミンイソチオシアネート、ジクロロトリアジンイソチオシアネート、Alexa又はAlexaFluoro等を、そして放射免疫測定法の場合にはトリチウム、ヨウ素125又はヨウ素131等を用いることができる。また、発光免疫測定法は、NADH−、FMNH2−、ルシフェラーゼ系、ルミノール−過酸化水素−POD系、アクリジニウムエステル系又はジオキセタン化合物系等を用いることができる。
【0186】
標識物質と抗体との結合法は、酵素免疫測定法の場合にはグルタルアルデヒド法、マレイミド法、ピリジルジスルフィド法又は過ヨウ素酸法等の公知の方法を、放射免疫測定法の場合にはクロラミンT法、ボルトンハンター法等の公知の方法を用いることができる。測定の操作法は、公知の方法(Current protocols in Protein Sciences、1995年、John Wiley & Sons Inc.、Current protocols in Immunology、2001年、John Wiley & Sons Inc.)により行うことができる。例えば、本発明の抗体を直接標識する場合には、試料中の成分を固相化し、標識した本発明の抗体と接触させて、マーカーポリペプチドと本発明の抗体との複合体を形成させる。そして未結合の標識抗体を洗浄分離して、結合標識抗体量又は未結合標識抗体量より試料中の標的ポリペプチドの量を測定することができる。
【0187】
また、例えば標識二次抗体を用いる場合には、本発明の抗体と試料とを反応させ(一次反応)、さらに標識二次抗体を反応させる(二次反応)。一次反応と二次反応は逆の順序で行ってもよいし、同時に行ってもよいし、又は時間をずらして行ってもよい。一次反応及び二次反応により、固相化した標的ポリペプチド−本発明の抗体−標識二次抗体の複合体、又は固相化した本発明の抗体−標的ポリペプチド−標識二次抗体の複合体が形成する。そして未結合の標識二次抗体を洗浄分離して、結合標識二次抗体量又は未結合標識二次抗体量より試料中の標的ポリペプチドの量を測定することができる。
【0188】
具体的には、酵素免疫測定法の場合は標識酵素にその至適条件下で基質を反応させ、その反応生成物の量を光学的方法等により測定する。蛍光免疫測定法の場合には蛍光物質標識による蛍光強度を、放射免疫定法の場合には放射性物質標識による放射能量を測定する。発光免疫測定法の場合は発光反応系による発光量を測定する。
【0189】
本発明の方法では、免疫比濁法、ラテックス凝集反応、ラテックス比濁法、赤血球凝集反応又は粒子凝集反応等における免疫複合体凝集物の生成を、その透過光や散乱光を光学的方法により測るか、目視的に測る測定法により実施する場合には、溶媒としてリン酸緩衝液、グリシン緩衝液、トリス緩衝液又はグッド緩衝液等を用いることができ、更にポリエチレングリコール等の反応促進剤や非特異的反応抑制剤を反応系に含ませてもよい。
【0190】
本発明を以下の実施例によってさらに具体的に説明する。しかし、本発明は、この実施例によって制限されないものとする。
【実施例】
【0191】
1.実験者の臨床病理学的所見
インフォームドコンセントを得た31名の食道ガン患者から、食道ガン摘出手術時又は食道生検実施時に食道の摘出組織を得た。摘出された組織片について肉眼的及び/又は病理組織学的に食道ガン組織を判断し、食道ガン病変部と正常組織部を分けてただちに凍結し、液体窒素中で保存した。別途、周辺の所属リンパ節の採取を行い、食道ガン細胞の転移の有無を病理学的に診断した。
【0192】
2.totalRNA抽出とcDNAの調製
試料として食道ガン患者の食道組織における食道ガン病変部の組織を用いた。おのおのの組織から、Trizol reagent(Invitrogen社)を用いて、同社推奨のプロトコールによりtotalRNAを調製した。
【0193】
上述の方法で得られたtotalRNA 1μgについて、oligo(dT)プライマー及びランダムノナマーを併用し、CyScribe First-Strand cDNA Labeling Kit(GEヘルスケア社)を用いてメーカー推奨のプロトコールで逆転写反応を行った。食道ガン組織由来のtotalRNAにはCy3−dUTP(GEヘルスケア社)を、リファレンスtotalRNA(Stratagene社)にはCy5−dUTP(GEヘルスケア社)を添加して、メーカー推奨のプロトコールで逆転写反応時にcDNAの標識を行った。標識されたcDNAはQIA quick PCR purification Kit(QIAGEN社)で精製してからハイブリダイズに用いた。
【0194】
3.遺伝子絞込みのためのオリゴDNAマイクロアレイ
オリゴDNAマイクロアレイとしてはAffymetrix社GeneChipTM(Human Genome U133 A)と本明細書中で述べる方法に従って作製したガラス製DNAチップ、及び東レ株式会社3D−Gene(登録商標)Human Oligo chip 25kを用いて候補遺伝子の一次絞込みを行い、さらに本明細書中に述べる方法で作製した一次絞込み済みの遺伝子を搭載した3D−Gene基板を利用したオリゴDNAマイクロアレイを用いた。
【0195】
4.遺伝子の一次絞込み
遺伝子の一次絞込みには、Affymetrix社GeneChipTM/ガラス製オリゴDNAマイクロアレイの組合せを用いる方法と、東レ株式会社3D−Gene(登録商標)Human Oligo chip 25kを用いる方法の二通りを利用した。
【0196】
ガラス製オリゴDNAマイクロアレイの作製方法を以下に示す。最初に搭載するオリゴDNAの種類を決定するために、Affymetrix社GeneChipTMを用いて遺伝子の絞込みを行った。GeneChipTMの操作については、Complete GeneChipTM Instrument Systemなどの同社の定める手順に基づいて実施した。Complete GeneChipTMを用いた解析の結果、食道ガンによって発現変動が起こる可能性がある遺伝子及び実験対照となりうる遺伝子を計8961種抽出した。
【0197】
抽出した8961種の遺伝子について、配列の重複をおこさないように配列特異性が高い部位の配列60−70残基をそれぞれ選択して合成した。4倍に希釈したSolution I(タカラバイオ社)に30μMとなるように溶解した、8961種の60又は70merからなる合成オリゴDNAを、MATSUNAMI・DNAマイクロアレイ用コートグラスDMSO対応 TypeIアミノ修飾オリゴDNA固定コート(松浪硝子工業株式会社)上にスポッター(GMS417arrayer,Affymetrix社)を用いて湿度環境50−60%でスポットした。
【0198】
標識したcDNA 1μgをアンチセンスオリゴカクテル(QIAGEN)に溶解し、Gapカバーグラス(松浪硝子工業)を載せたガラス製オリゴDNAマイクロアレイにアプライし、42℃で16時間ハイブリダイズを行った。ハイブリダイズ終了後、DNAチップを2xSSC/0.1%SDS、1xSSC、0.2xSSCで順次洗浄した。
【0199】
上述の方法によりハイブリダイゼーションを行ったDNAチップをAgilentマイクロアレイスキャナー(Agilent社)を用いてスキャンし、画像を取得して蛍光強度を数値化した。統計学的処理はSpeed T.著「Statistical analysis of gene expression microarray data」Chapman & Hall/CRC,及びCauston H.C.ら著「A beginner’s guide Microarray gene expression data analysis」Blackwell publishingを参考にして行った。すなわちハイブリダイズ後の画像解析から得られたデータについて、それぞれの対数値をとり、global normalizationをとLOWESS(locally weighted scatterplot smoother)による平滑化を行い、MADによるスケーリング処理によってノーマライゼーション補正を行った。その結果、転移がある食道ガン病変部における発現量が、転移がない食道ガン病変部よりも多いか又は少ない遺伝子を見出すことができた。これらの遺伝子を食道ガン転移検出用遺伝子として利用することができると考えられる。この結果、255種の遺伝子を絞り込んだ。
【0200】
一方、3D−Gene(登録商標) Human Oligo chip 25kによる遺伝子の一次絞込みについては、6名の食道ガン患者(転移あり3名、転移なし3名)から採取した検体由来の発現遺伝子解析を実施した。それぞれの患者からトータルRNAを採取し、逆転写して標識したcDNA 500ngを東レ株式会社製ハイブリバッファーに溶解し、3D−GeneTM Human 25Kにアプライした後、42℃で16時間ハイブリダイズを行った。ハイブリ終了後にDNAチップを洗浄してPerkin−Elmer株式会社製ProScanArray(登録商標)を用いてスキャンし、画像を取得して蛍光強度を数値化した。この数値化データについてそれぞれの対数値をとり、global normalizationを行った上で、転移がある食道ガン病変部における発現量が、転移がない食道ガン病変部よりも多い/少ない遺伝子を見出すためにStudent’t−test、判別分析、変動倍率のランキングを行って849種の遺伝子を絞り込んだ。
【0201】
5.診断用遺伝子絞込みのためのDNAチップ実験
4.で絞り込んだ診断用遺伝子候補、及び対照遺伝子検出用のプローブとして、それぞれの遺伝子配列から配列60−70残基をそれぞれ選択して、1119種のオリゴヌクレオチドを合成した(配列番号11〜20の配列であるオリゴヌクレオチドをそれぞれ含む)。これらのプローブを東レ株式会社製3D−Gene(登録商標)1332柱基板にそれぞれ1プローブにつき1点ずつスポットし、食道ガン転移判別用DNAチップとして作製した。
【0202】
この食道ガン転移判別用DNAチップに、食道ガン患者の手術検体又は生検検体由来の食道ガン組織から採取したRNAを逆転写・Cy3標識して、同様に逆転写・Cy5標識を行った対照となるUniversal Human Reference RNA(Stratagene社)と、それぞれ300ngを同時にアプライした。42℃で16時間ハイブリダイズを行い、ハイブリ終了後にDNAチップを洗浄してPerkin―Elmer株式会社製ProScanArray(登録商標)を用いてDNAチップをスキャンし、画像を取得してそれぞれのスポットの蛍光強度を数値化した。この数値化データについてCy3蛍光値とCy5蛍光値のブランク補正(プローブをスポットしていない柱領域の蛍光値の平均をそれぞれの蛍光から減算する)、global normalizationを行った上でM値に変換した(M値:検体由来Cy3蛍光/対照由来Cy5蛍光の底2の対数変換値)。
【0203】
6.予測スコアリングシステム
31例の患者から得た食道がん検体(転移あり10例、転移なし21例)のデータをもとに、テストデータに転移ありの検体が必ず3例含まれる条件下で、無作為に学習データ26例、テストデータ5例を分けた。学習データ群において、Leave one out法によって診断用遺伝子の選択と判別用アルゴリズム構築を行った。抜いた1例の学習データとテストデータを予測し、学習データのすべて必ず1回予測対照となるように、26回の試行を行った。サンプリングを変えて、同様の試行を10回繰り返し、そのテストデータを予測する精度の平均によって、判別アルゴリズムの精度を評価したところ、遺伝子5種を用いた場合に最大(76%)の予測精度を得ることが示された。この結果が偶然出ないことを確かめるために、31例の患者について転移あり、なしの情報を無作為に振り分け、データを完全にランダム化して同様の試行を300回実施したところ、判別精度は遺伝子5種で52.3%にとどまり、判別アルゴリズムの精度が偶然でないことが示された。
【0204】
そこで次に、この5種の遺伝子に相当する遺伝子を10回のランダムサンプリング法の試行結果から抽出し、出現頻度順に順位付けした(表1)。この順位を順に遺伝子数を増やしながら、全31検体についてLeave one out法によるSVM判別を行ったところ、上位10遺伝子で、食道ガンのリンパ節転移予測について、精度96.3%を示した。なお、表1に示した遺伝子は、転移がある食道ガン病変部と転移がない食道ガン病変部での遺伝子転写産物の発現量差が上位の遺伝子である。
【0205】
【表1】

【0206】
この一覧から上位から順に遺伝子を選び、食道ガン組織を識別するためのSVMによる判別マシーンを作成したところ、プローブとして配列番号11〜20のポリヌクレオチドを用いて測定した遺伝子発現を検討することにより、転移がある食道ガン病変部と転移がない食道ガン病変部の判別式を作成したところ、用いる遺伝子の数に依存して確率が変動し、93.6%以上の確率で転移がある食道ガン病変部と転移がない食道ガン病変部を判別することができた(図1)。
【0207】
また、任意のプローブによって測定した遺伝子発現を検討することにより、転移がある食道ガン病変部と転移がない食道ガン病変部の判別式を作成したところ、表2のような判別確率を得ることができた(表2)。
【0208】
【表2】

【0209】
図1及び表2に示したような結果は、食道ガン患者からのサンプルでの結果と本質的に一致する。
【産業上の利用可能性】
【0210】
本発明により、特異性、感受性に優れた食道ガン転移判定用組成物を提供することができるため、少なくともリンパ節への食道ガン転移の検出のために非常に有用である。
【図面の簡単な説明】
【0211】
【図1】表1に記載の遺伝子に対応する配列番号11〜20のポリヌクレオチドを組み合わせて用いた場合の食道ガンのリンパ節転移判別確率(%)を示す。縦軸は、食道ガンのリンパ節転移判別確率(%)、すなわち検体中の転移がある食道ガン組織の存在を検出できる確率、横軸は、表1に記載の遺伝子に対応する配列番号11〜20において、配列番号11から20まで1つずつ順番に増やした、転移がある食道ガン検出に必要な遺伝子の合計数をそれぞれ示す。
【特許請求の範囲】
【請求項1】
下記の(a)〜(e)に示すポリヌクレオチド、その変異体又はその断片からなる群から選択される2以上のポリヌクレオチドを含む、食道ガン転移診断用組成物。
(a)配列番号1〜10で表される塩基配列からなるポリヌクレオチド、その変異体、又は15以上の連続した塩基を含むその断片
(b)配列番号1〜10で表される塩基配列を含むポリヌクレオチド
(c)配列番号1〜10で表される塩基配列に相補的な塩基配列からなるポリヌクレオチド、その変異体、又は15以上の連続した塩基を含むその断片
(d)配列番号1〜10で表される塩基配列に相補的な塩基配列を含むポリヌクレオチド
(e)前記(a)〜(d)のいずれかのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又は15以上の連続した塩基を含むその断片
【請求項2】
前記断片が、60以上の連続した塩基を含むポリヌクレオチドである、請求項1に記載の組成物。
【請求項3】
前記断片が、配列番号1〜10のいずれかで表される塩基配列において、それぞれ配列番号11〜20のいずれかで表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド、又は該ポリヌクレオチドの配列に相補的な塩基配列を含むポリヌクレオチドである、請求項2に記載の組成物。
【請求項4】
前記断片が、配列番号11〜20のいずれかで表される塩基配列、又はこれらに相補的な塩基配列を含むポリヌクレオチドである、請求項2に記載の組成物。
【請求項5】
請求項1〜4のいずれかに記載の(a)〜(e)に示すポリヌクレオチド、その変異体及び/又はその断片の2以上を含む、食道ガン転移診断用キット。
【請求項6】
前記ポリヌクレオチドが、配列番号1〜10のいずれかで表される塩基配列からなるポリヌクレオチド、その相補的配列からなるポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はそれらの15以上の連続した塩基を含む断片である、請求項5に記載のキット。
【請求項7】
前記断片が、60以上の連続した塩基を含むポリヌクレオチドである、請求項6に記載のキット。
【請求項8】
前記断片が、配列番号1〜10のいずれかで表される塩基配列において、それぞれ配列番号11〜20のいずれかで表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド、又は該ポリヌクレオチドの配列に相補的な塩基配列を含むポリヌクレオチドである、請求項7に記載のキット。
【請求項9】
前記断片が、配列番号11〜20のいずれかで表される塩基配列、又はこれらに相補的な塩基配列を含むポリヌクレオチドである、請求項7に記載のキット。
【請求項10】
前記ポリヌクレオチドが、別個に又は任意に組み合わせて異なる容器に包装されている、請求項5〜9のいずれか1項に記載のキット。
【請求項11】
請求項1〜4のいずれかに記載の(a)〜(e)に示すポリヌクレオチド、その変異体及び/又はその断片の2以上を含む、食道ガン転移診断用DNAチップ。
【請求項12】
配列番号11〜20で表される塩基配列又はその相補的配列を含むポリヌクレオチドの2以上〜全部を含む、請求項11に記載のDNAチップ。
【請求項13】
請求項1〜4のいずれかに記載の組成物、請求項5〜10のいずれかに記載のキット、請求項11〜12のいずれかに記載のDNAチップ、又はそれらの組み合わせを用いて、被験者由来の生体試料における標的核酸の発現レベルを測定することによって、被験者由来の検体試料中に転移を伴う食道ガン細胞が含まれるかどうかをin vitroで判定する方法。
【請求項14】
DNAチップを用いる請求項13に記載の方法。
【請求項15】
請求項1〜4のいずれかに記載の組成物、請求項5〜10のいずれかに記載のキット、請求項11〜12のいずれかに記載のDNAチップ、又はそれらの組み合わせを用いて、転移を伴う食道ガン又は転移を伴わない食道ガン細胞を含む組織であることが既知の複数の生体試料中の標的核酸の発現量をin vitroで測定する第1の工程、前記第1の工程で得られた該標的核酸の発現量の測定値を教師とした判別式(サポートベクターマシーン)を作成する第2の工程、被験者の食道由来の検体試料中の該標的核酸の発現量を第1の工程と同様にin vitroで測定する第3の工程、前記第2の工程で得られた判別式に第3の工程で得られた該標的核酸の発現量の測定値を代入し、該判別式から得られた結果に基づいて、検体試料中に転移を伴うガン細胞が含まれないこと及び/又は転移を伴わないガン細胞が含まれることを判定する第4の工程を含む、食道ガン転移を判定する方法。
【請求項16】
請求項1〜4のいずれかに記載の組成物、請求項5〜10のいずれかに記載のキット、請求項11〜12のいずれかに記載のDNAチップの、食道ガン患者の転移の有無をin vitroで予測するための使用。
【請求項17】
配列番号1〜10で表される塩基配列によってコードされるポリペプチドに対する2以上の抗体又はその断片を用いて、被験者由来の食道ガン細胞或いは血液中の該ポリペプチドのレベルをin vitroで測定することを含む、被験者の食道ガンの転移の有無をin vitroで予測する方法。
【請求項18】
前記ポリペプチドが、配列番号21〜27で表されるアミノ酸配列を有する、請求項17に記載の方法。
【請求項19】
前記ポリペプチドの発現レベルが、転移のない患者由来の食道ガンと比較して変化している場合、転移が有る患者由来の食道ガンであると決定する、請求項17に記載の方法。
【請求項20】
前記ポリペプチドの発現レベルが、転移のある患者由来の食道ガンと比較して変化している場合、転移が無い患者由来の食道ガンであると決定する、請求項17に記載の方法。
【請求項1】
下記の(a)〜(e)に示すポリヌクレオチド、その変異体又はその断片からなる群から選択される2以上のポリヌクレオチドを含む、食道ガン転移診断用組成物。
(a)配列番号1〜10で表される塩基配列からなるポリヌクレオチド、その変異体、又は15以上の連続した塩基を含むその断片
(b)配列番号1〜10で表される塩基配列を含むポリヌクレオチド
(c)配列番号1〜10で表される塩基配列に相補的な塩基配列からなるポリヌクレオチド、その変異体、又は15以上の連続した塩基を含むその断片
(d)配列番号1〜10で表される塩基配列に相補的な塩基配列を含むポリヌクレオチド
(e)前記(a)〜(d)のいずれかのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又は15以上の連続した塩基を含むその断片
【請求項2】
前記断片が、60以上の連続した塩基を含むポリヌクレオチドである、請求項1に記載の組成物。
【請求項3】
前記断片が、配列番号1〜10のいずれかで表される塩基配列において、それぞれ配列番号11〜20のいずれかで表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド、又は該ポリヌクレオチドの配列に相補的な塩基配列を含むポリヌクレオチドである、請求項2に記載の組成物。
【請求項4】
前記断片が、配列番号11〜20のいずれかで表される塩基配列、又はこれらに相補的な塩基配列を含むポリヌクレオチドである、請求項2に記載の組成物。
【請求項5】
請求項1〜4のいずれかに記載の(a)〜(e)に示すポリヌクレオチド、その変異体及び/又はその断片の2以上を含む、食道ガン転移診断用キット。
【請求項6】
前記ポリヌクレオチドが、配列番号1〜10のいずれかで表される塩基配列からなるポリヌクレオチド、その相補的配列からなるポリヌクレオチド、それらのポリヌクレオチドとストリンジェントな条件でハイブリダイズするポリヌクレオチド、又はそれらの15以上の連続した塩基を含む断片である、請求項5に記載のキット。
【請求項7】
前記断片が、60以上の連続した塩基を含むポリヌクレオチドである、請求項6に記載のキット。
【請求項8】
前記断片が、配列番号1〜10のいずれかで表される塩基配列において、それぞれ配列番号11〜20のいずれかで表される塩基配列を含み、かつ60以上の連続した塩基を含むポリヌクレオチド、又は該ポリヌクレオチドの配列に相補的な塩基配列を含むポリヌクレオチドである、請求項7に記載のキット。
【請求項9】
前記断片が、配列番号11〜20のいずれかで表される塩基配列、又はこれらに相補的な塩基配列を含むポリヌクレオチドである、請求項7に記載のキット。
【請求項10】
前記ポリヌクレオチドが、別個に又は任意に組み合わせて異なる容器に包装されている、請求項5〜9のいずれか1項に記載のキット。
【請求項11】
請求項1〜4のいずれかに記載の(a)〜(e)に示すポリヌクレオチド、その変異体及び/又はその断片の2以上を含む、食道ガン転移診断用DNAチップ。
【請求項12】
配列番号11〜20で表される塩基配列又はその相補的配列を含むポリヌクレオチドの2以上〜全部を含む、請求項11に記載のDNAチップ。
【請求項13】
請求項1〜4のいずれかに記載の組成物、請求項5〜10のいずれかに記載のキット、請求項11〜12のいずれかに記載のDNAチップ、又はそれらの組み合わせを用いて、被験者由来の生体試料における標的核酸の発現レベルを測定することによって、被験者由来の検体試料中に転移を伴う食道ガン細胞が含まれるかどうかをin vitroで判定する方法。
【請求項14】
DNAチップを用いる請求項13に記載の方法。
【請求項15】
請求項1〜4のいずれかに記載の組成物、請求項5〜10のいずれかに記載のキット、請求項11〜12のいずれかに記載のDNAチップ、又はそれらの組み合わせを用いて、転移を伴う食道ガン又は転移を伴わない食道ガン細胞を含む組織であることが既知の複数の生体試料中の標的核酸の発現量をin vitroで測定する第1の工程、前記第1の工程で得られた該標的核酸の発現量の測定値を教師とした判別式(サポートベクターマシーン)を作成する第2の工程、被験者の食道由来の検体試料中の該標的核酸の発現量を第1の工程と同様にin vitroで測定する第3の工程、前記第2の工程で得られた判別式に第3の工程で得られた該標的核酸の発現量の測定値を代入し、該判別式から得られた結果に基づいて、検体試料中に転移を伴うガン細胞が含まれないこと及び/又は転移を伴わないガン細胞が含まれることを判定する第4の工程を含む、食道ガン転移を判定する方法。
【請求項16】
請求項1〜4のいずれかに記載の組成物、請求項5〜10のいずれかに記載のキット、請求項11〜12のいずれかに記載のDNAチップの、食道ガン患者の転移の有無をin vitroで予測するための使用。
【請求項17】
配列番号1〜10で表される塩基配列によってコードされるポリペプチドに対する2以上の抗体又はその断片を用いて、被験者由来の食道ガン細胞或いは血液中の該ポリペプチドのレベルをin vitroで測定することを含む、被験者の食道ガンの転移の有無をin vitroで予測する方法。
【請求項18】
前記ポリペプチドが、配列番号21〜27で表されるアミノ酸配列を有する、請求項17に記載の方法。
【請求項19】
前記ポリペプチドの発現レベルが、転移のない患者由来の食道ガンと比較して変化している場合、転移が有る患者由来の食道ガンであると決定する、請求項17に記載の方法。
【請求項20】
前記ポリペプチドの発現レベルが、転移のある患者由来の食道ガンと比較して変化している場合、転移が無い患者由来の食道ガンであると決定する、請求項17に記載の方法。
【図1】




【公開番号】特開2010−41(P2010−41A)
【公開日】平成22年1月7日(2010.1.7)
【国際特許分類】
【出願番号】特願2008−161942(P2008−161942)
【出願日】平成20年6月20日(2008.6.20)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度、独立行政法人新エネルギー・産業技術総合開発機構「食道がん及び腎臓がん診断用DNAチップの評価・検証及び成果普及事業」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(000003159)東レ株式会社 (7,677)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
【公開日】平成22年1月7日(2010.1.7)
【国際特許分類】
【出願日】平成20年6月20日(2008.6.20)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度、独立行政法人新エネルギー・産業技術総合開発機構「食道がん及び腎臓がん診断用DNAチップの評価・検証及び成果普及事業」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(000003159)東レ株式会社 (7,677)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
[ Back to top ]

