N−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物とそれを用いたN−アセチルグルコサミンまたはグルコサミン生産方法
本発明は、グルコサミン−6−ホスフェートアセチルトランスフェラーゼ活性を保有するN−アセチルグルコサミンを生産する変異コリネバクテリウム属微生物と、それを用いたN−アセチルグルコサミンまたはグルコサミンを生産する方法に関するものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、N−アセチルグルコサミンを生産する遺伝的に組み換えられたコリネバクテリウム属微生物、およびそれを用いてN−アセチルグルコサミンまたはグルコサミンを生産する方法に関するものである。
【背景技術】
【0002】
グルコサミンは、グルコースのアミノ誘導体であり、N−アセチルグルコサミンは、グルコサミンがアセチル化された誘導体であり、これらは多くの天然ポリサッカライドの重要な構成成分であって、細胞壁を構成する細胞構造物質を形成する。
【0003】
N−アセチルグルコサミンは、組織再生に関与する蛋白質合成に重要な成分であるため、胃炎、飲食物アレルギー、炎症性腸疾患(inflammatory bowel disease:IBD)、憩室炎 (diverticulitis)および骨関節組織の代謝障害から引き起こされる病理学的疾患だけでなく、急性および慢性型リウマチ関節炎、並びに骨関節炎のような広範囲な疾病を予防且つ治療するにあって可能性を有している。グルコサミンもやはり、ヒトの骨関節炎疾患の予防および治療に適用する機能性食品として使用されている。
【0004】
グルコサミンは、N−アセチルグルコサミンから誘導された複合炭水化物であるキチンの酸加水分解方法、およびキトサンの酸分解によって製造される。原材料のキチンは、N−アセチルグルコサミンとグルコサミンとの共重合体であって、甲殻類およびかびから発見されたありふれた天然物質である。キチンは、甲殻類(ロブスター、エビ、オキアミ、カニおよびクルマエビの外骨格)から主に生産されており、最近では、クエン酸(citric acid)の生産に用いられるかびバイオマス(biomass)のような安い原料から収得することができる。
【0005】
通常の産業的実施は、ミネラル、蛋白質などを伴った他の不純物を除去するために、酸と塩基との組合せで処理してキチンを精製し、高い温度で長時間高濃度の塩酸を用いて低収率かつ一段階でキチンを分解し、脱アセチル化してグルコサミンとすることである。グルコサミンは、遊離塩基であって、極めて不安定であり、分解されやすいから、塩酸塩のような安定した塩が生産される。
【0006】
甲殻類の外殻およびかびバイオマスにおけるグルコサミン含有量が少ないため、大容量の廃棄物が発生し、製造工程それ自体は相対的に低収率であるのに、エネルギーおよび化学的に集約的であるため、グルコサミンは高価である。また、一般的な形態のグルコサミン、すなわち甲殻類に由来するグルコサミンの場合、甲殻類に敏感なヒトにはアレルギー反応を起こす可能性があることが知られている。さらに、原料物質(例えば、カニの殻のようなキチンの原料)の利用可能性が徐々に制限されてきている。したがって、商業的な販売と利用のために高収率でグルコサミンおよびN−アセチルグルコサミンを製造できる費用効果的な方法が必要である。
【0007】
アレルギー反応の可能性を除去するために、国際公開第02/66667号は、微生物バイオマスからグルコサミンを製造する方法を開示している。しかし、前記の製造方法は、甲殻類アレルギーと関連した問題などは解決したが、低収率という重大な問題点を有している。前記の方法は、クエン酸のような他の物質の発酵中に生成されたバイオマス廃棄物に依存するため、増加する市場の要求を満足させ得る十分な量のグルコサミンを製造するには不十分である。
【0008】
一方、N−アセチルグルコサミンは、現在無水酢酸のような有機アセチル化試薬を用い、グルコサミンのアセチル化によって製造されているが、この製造方法は高コストを要する。また、低い生産収率のため、大量生産が容易でない。
【0009】
これを克服するための一方法として、米国特許第7,332,304号は、大腸菌発酵によってN−アセチルグルコサミンを製造する方法を開示している。この方法は、既存の複雑な工程によるN−アセチルグルコサミンの低生産収率を含む問題点を画期的に解決する、高収率のN−アセチルグルコサミン大腸菌発酵を示唆している。また、N−アセチルグルコサミンは、簡単な酸処理によって脱アセチル化されてグルコサミンになり得ることは公知の事実(Novikov V.Y. et al. Russ. J. Appl. Chem. 1997:1467-1470)であるため、高収率のグルコサミン生産も可能である。
【0010】
しかし、この方法は、大腸菌の使用が毒性を示す可能性のあるエンドトキシンを生成するため、健康食品素材を生産する方法として適していない。また、N−アセチルグルコサミン生産に必須の酵素であるグルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)(図1参照:GNA1)が大腸菌内にはないため、イーストなどの他の微生物から導入しなければならないが、このような重要酵素の発現のためには、必ず誘導発現システムを用いなければならないという制約がある(Deng M.D. et al. Met Eng. 2005:201-214)。重要な酵素の発現を調節できない場合、深刻な細胞増殖阻害を誘発するからである。誘導発現システムは、誘導物質を用いなければならないという原価上昇の短所と、誘導時点を合わせなければならないという困難性があるため、大規模発酵による産業的生産には適さないと考えられえる。前記の発明は、生産の安全性および産業的適用の可能性を勘案する場合、大腸菌と誘導発現システムを用いる短所を有している。
【0011】
現在まで原料物質供給の不安定性の解消と高収率生産のための大腸菌発酵技術の開発はあったが、ヒトと動物に使用するのに安全なN−アセチルグルコサミンおよびグルコサミンの生産に適した生産菌株がなかったし、また、産業的な酵素生成を促進するような、主要酵素発現システムを誘導発現システム以外に構成的発現システムを用いた生産菌株の生成については報告されていない。
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の一つの目的は、N−アセチルグルコサミンを生産する遺伝的に組み換えられたコリネバクテリウム属微生物、好ましくはグルコサミン−6−ホスフェートアセチルトランスフェラーゼ活性を有し、グルコサミン−6−ホスフェートデアミナーゼ(glucosamine-6-phosphate deaminase)活性が減少または欠失したコリネバクテリウム属微生物を提供することにある。
【0013】
本発明の他の一つの目的は、前記のコリネバクテリウム属微生物を用いてN−アセチルグルコサミンまたはグルコサミンを製造する方法を提供することにある。
【課題を解決するための手段】
【0014】
本発明者らは、前記の言及された問題点を解決するため、環境問題を誘発することなく、物質生産安定性と産業適用性を実現できるN−アセチルグルコサミンおよびグルコサミンの大規模な発酵生産のためのコリネバクテリウム属微生物と、該微生物を用いてN−アセチルグルコサミンおよびグルコサミンを生産する方法を開発し、本発明を完成した。
【発明の効果】
【0015】
本発明は、N−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物を作成し、当該微生物を用いてN−アセチルグルコサミンまたはグルコサミンを生産することによって、アレルギー反応の危険がなく、大量供給が可能なN−アセチルグルコサミンおよびグルコサミンを提供するのに有用に利用され得る。また、健康食品および治療用素材の安全な生産と主要酵素の構成的発現で産業への適用が容易である。
【図面の簡単な説明】
【0016】
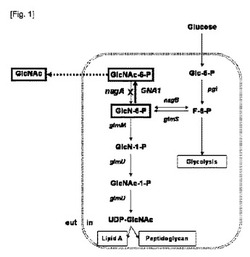
【図1】図1は、N−アセチルグルコサミン生合成経路およびN−アセチルグルコサミン生産菌株の遺伝子組み換えを図式化したものである。本発明では、nagAを不活性化させ、外来遺伝子であるGNA1を増幅した。
【図2】図2は、pDZ−nagA1STベクター構造を示した図である。pDZに停止コドンが入ったnagA1をクローニングした。
【図3】図3は、pECCG117−PEFTU−GNA1ベクター構造を示した図である。pECCG117ベクターに構成的発現プロモーターであるPEFTUを1次クローニングし、GNA1をさらにクローニングして作成された。
【図4】図4は、pVWEx2−GNA1ベクター構造を示した図である。pVWEx2ベクターにGNA1をクローニングして作成された。
【発明を実施するための形態】
【0017】
一つの態様として、本発明は、グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)活性を有し、グルコサミン−6−ホスフェートデアミナーゼ(glucosamine-6-phosphate deaminase)活性が減少または欠失したコリネバクテリウム属微生物であって、N−アセチルグルコサミンおよびグルコサミン生産能を有するコリネバクテリウム属微生物に関するものである。
【0018】
本発明において、グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)は、グルコサミン−6−ホスフェートをアセチル化してN−アセチルグルコサミン−6−ホスフェートとする酵素をいう。前記の酵素は、サッカロマイセス(Saccharomyces)属微生物などに存在するが、本願のコリネバクテリウム属微生物には存在しない。
【0019】
したがって、本発明において使用された用語、“グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)活性を有する”または“グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)活性を有するコリネバクテリウム属微生物”は、コリネバクテリウム属微生物には存在しないグルコサミン−6−ホスフェートアセチルトランスフェラーゼ遺伝子をコリネバクテリウム属微生物内に導入してコリネバクテリウム属微生物がグルコサミン−6−ホスフェートアセチルトランスフェラーゼを発現し、それを用いてコリネバクテリウム属微生物がN−グルコサミン−6−ホスフェートをN−アセチルグルコサミン−6−ホスフェートに変換できることをいう。
【0020】
遺伝子導入により、コリネバクテリウム属微生物にグルコサミン−6−ホスフェートアセチルトランスフェラーゼ活性を保持させる方法としては、当該分野において良く知られた様々な方法の適用が可能である。本発明の具体的な実施態様では、グルコサミン−6−ホスフェートアセチルトランスフェラーゼをコードする核酸配列をベクターに導入し、その組み換えベクターがコリネバクテリウム属微生物の形質転換に用いられた。
【0021】
前記のグルコサミン−6−ホスフェートアセチルトランスフェラーゼ遺伝子は、コリネバクテリウム属微生物で作動可能な核酸配列を有する遺伝子であれば足りる。一つの具体的な実施態様では、サッカロマイセス・セレビシエ(Saccharomyces cerevisiae)から由来したものであって、好ましくは、配列番号11の核酸配列である。特に、前記のグルコサミン−6−ホスフェートアセチルトランスフェラーゼをコードする配列は、その活性を維持する限り、一定程度組み換えが可能である。 本技術分野の当業者ならば、人為的な組み換えによって70%以上の相同性が維持される核酸配列が本発明において望ましい遺伝子活性を保持する限り、本発明の前記核酸配列から由来したものと同質であることが簡単に理解できるだろう。
【0022】
本発明のグルコサミン−6−ホスフェートアセチルトランスフェラーゼ遺伝子には、好ましくは、前記遺伝子の発現を誘導するようにプロモーターが作動可能に連結される。本発明の目的に照らしてより好ましくは、前記プロモーターは、コリネバクテリウム属微生物によるグルコサミン−6−ホスフェートアセチルトランスフェラーゼの構成的または誘導発現を誘導するプロモーターであり、コリネバクテリウム属微生物に導入されたグルコサミン−6−ホスフェートアセチルトランスフェラーゼの構成的または誘導発現を誘導し得る遺伝子である。一つの具体的な実施態様において、前記の構成的発現プロモーターは、EFTUプロモーターであり、前記の誘導発現プロモーターは、laclq−Ptacプロモーターである。大腸菌において、グルコサミン−6−ホスフェートアセチルトランスフェラーゼの発現が増殖初期に誘導された場合、深刻な増殖抑制を生じて誘導発現システムのみが使用できる (Deng M.D. et al. Met Eng. 2005:201-214)。一方、本発明のコリネバクテリウム属微生物は、前記酵素の誘導または構成的発現により増殖が影響を受けないという利点を有する。
【0023】
本発明において、グルコサミン−6−ホスフェート デアミナーゼ(glucosamine-6-phosphate deaminase)は、アセチルグルコサミン−6−ホスフェートをグルコサミン−6−ホスフェートに変換する酵素をいう。したがって、本発明の目的のためには、本発明のコリネバクテリウム属微生物は、グルコサミン−6−ホスフェートデアミナーゼをコードする核酸配列の部分的または全体的な欠失/突然変異により、天然に存在する遺伝子に比べて該酵素をコードする遺伝子の発現が少ないか全く発現しないことを特徴とする。前記のようにグルコサミン−6−ホスフェート デアミナーゼをコードする核酸配列が部分的にまたは全体的に欠失するか突然変異して、天然に存在する核酸配列に比べて発現が少ないか全く発現しないことを、本発明では“減少”または“欠失”と表現することができる。
【0024】
グルコサミン−6−ホスフェート デアミナーゼ遺伝子の無発現または低発現を誘導するために、たとえば、構造遺伝子(structure gene)の上流に位置したプロモーター領域および調節領域が変異され得る。構造遺伝子の上流に取り付けられた調節カセットも同様の作用をすることができる。発現を減少させるようにプロモーターを修飾したり、m−RNAの安定性を減少させることによって、遺伝子翻訳を調節して発現を減少させ得る。また、部位特異的組み換えDNA技術によって、遺伝子の一部または全部を欠失または変異した断片で置換して、グルコサミン−6−ホスフェート デアミナーゼ活性を減少または欠失させ得る。しかし、このような方法の他にも、当該分野で周知の様々な方法を用いて、遺伝子の無発現または低発現を達成できるということは当業者に自明だろう。
【0025】
本発明において、“N−アセチルグルコサミン生産能”という用語は、N−アセチルグルコサミンを生産する能力であって、本発明のコリネバクテリウム属微生物を培地で培養する場合、培地中にN−アセチルグルコサミンを生産して蓄積する本発明のコリネバクテリウム属微生物の能力をいう。本発明において、“グルコサミン生産能”という用語は、微生物の発酵によって生産された物質からグルコサミンを生産する能力であって、培地中に蓄積されたN−アセチルグルコサミンを公知の様々な方法によって脱アセチル化し、グルコサミンを生産、蓄積する本発明のコリネバクテリウム属微生物の能力をいう。
【0026】
本発明において、“N−アセチルグルコサミンおよび/またはグルコサミン生産能を有する微生物”は、コリネバクテリウム(Corynebacterium)属に属する微生物である。好ましくは、コリネバクテリウム・グルタミクム(例えば、ATCC13032)、コリネバクテリウム・アンモニアゲネス(例えば、ATCC6872)、ブレビバクテリウム・ラクトファーメンタム(Brevibacterium lactofermentum)(例えば、ATCC13869)、ブレビバクテリウム・フラバム(Brevibacterium flavum)(例えば、ATCC14067)、コリネバクテリウム・サーモアミノゲネス(Corynebacterium thermoaminogenes)(例えば、FERM-BP1539)、コリネバクテリウム・エフィシエンス(Corynebacterium efficiens)(例えば、C.efficiens str. YS-314)などであるが、必ずしもこれに限定されるのではない。より好ましくは、コリネバクテリウム・グルタミクムであり、さらに好ましくは、2008年9月29日付で大韓民国ソウル特別市西大門区弘済1洞361−221番地に所在する国際寄託機関である韓国種菌協会付設韓国微生物保存センターに受託番号KCCM10967Pで寄託されたコリネバクテリウム・グルタミクムCJNAG1である。
【0027】
他の一つの態様として、本発明は、N−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物を培養して、N−アセチルグルコサミンまたはグルコサミンを生産する方法に関するものである。
【0028】
具体的に、本発明は、(a)本発明のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物を培養する段階および(b)前記培養段階で生産されたN−アセチルグルコサミンまたはグルコサミンを収集する段階を含むN−アセチルグルコサミンまたはグルコサミンの生産方法に関するものである。
【0029】
本発明の前記培養は、当業界に知られている適当な培地と培養条件によってなされ得る。培養方法は、当業者ならば選択される菌株により容易に調整して使用することができる。前記培養方法の例には、回分式、連続式および流加式培養が含まれるが、これに限定されるものではない。このような様々な培養方法は、例えば、“Biochemical Engineering”by James M. Lee,Prentice-Hall International Editions,pp 138-176に開示されている。培養に使用される培地は、特定の菌株の培養条件に合致しなければならない。
【0030】
本発明で用いられる培地は、ブドウ糖を炭素源として使用し、その他の適切量の炭素源は様々に利用され得る。使用され得る窒素源の例としては、ペプトン、酵母抽出物、肉汁、麦芽抽出物、とうもろこし浸漬液、および大豆、小麦のような有機窒素源および、尿素、硫酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、炭酸アンモニウムおよび硝酸アンモニウムのような無機窒素源が含まれる。これらの窒素源は、単独または組合わせて使用され得る。前記の培地にはリン源として、リン酸二水素カリウム、リン酸水素二カリウムおよび対応するナトリウム−含有塩が含まれ得る。また、硫酸マグネシウムまたは硫酸鉄のような金属塩を含むことができる。その他に、アミノ酸、ビタミン、および適切な前駆体などが含まれ得る。これらの培地または前駆体は、培養物に回分式または連続式で添加され得る。
【0031】
培養中に水酸化アンモニウム、水酸化カリウム、アンモニア、リン酸および硫酸のような化合物を培養物に適宜添加し、培養物のpHを調整することができる。また、培養中には、脂肪酸ポリグリコールエステルのような消泡剤を使用して気泡生成を抑制することができる。また、培養物の好気状態を維持するために、培養物内に酸素または、酸素−含有気体を注入したり、嫌気および微好気状態を維持するために、気体を注入せず、あるいは窒素、水素、または二酸化炭素ガスを注入することができる。培養物の温度は、普通30℃〜37℃であり、好ましくは35℃〜37℃である。培養期間は、所望量の所望物質が得られるまで継続され、好ましくは10〜160時間である。
【0032】
本発明の前記培養段階で生産されたN−アセチルグルコサミンまたはグルコサミンを収集および/または回収する段階は、培養方法、例えば、回分式、連続式または流加式培養方法などによって当該分野に公知の適当な方法を用いて、培養液から目的とするN−アセチルグルコサミンまたはグルコサミンを収集および/または回収することにより行われる。
【0033】
また、本発明は、前記の収集されたN−アセチルグルコサミンを脱アセチル化してグルコサミンに変換する段階をさらに含むことができる。そのような変換が、当該分野に広く知られている方法(例えば、ノビコフなど(Novikov V.Y. et al. Russ. J. Appl. Chem. 1997:1467-1470))によりなし得ることは、当業者に自明だろう。
【実施例】
【0034】
以下、実施例を介して本発明をより詳細に説明しようとする。しかし、これら実施例は、本発明を例示的に説明するためのものであって、本発明の範囲がこれらの実施例に限定されるのではない。
【0035】
実施例1:N−アセチルグルコサミン−6−ホスフェートデアミナーゼ(glucosamine-6-phosphate deaminase)変異体の作成および染色体核酸置換組み換えベクターpDZ−nagAST作成
野生型コリネバクテリウム・グルタミクム(Corynebacterium glutamicum ATCC13102)のN−アセチルグルコサミン−6−ホスフェートの利用を防ぐために、N−アセチルグルコサミン−6−ホスフェートを基質として用いるN−アセチルグルコサミン−6−ホスフェートデアミナーゼをコードするnagA1(NCgl2556,配列番号1)の不活性化を行った。
不活性化の方法は、遺伝子除去および追加配列導入などの様々な方法があり得るが、本実施例ではnagA1遺伝子のORF(open reading frame)内に停止コドン(stop codon)を挿入して、遺伝子の翻訳(translation)を不能とさせた。
具体的に、コリネバクテリウム・グルタミクム(Corynebacterium glutamicum ATCC13102)の染色体遺伝子を分離し、これを鋳型として配列番号2と配列番号3のプライマーを用いてポリメラーゼ連鎖反応を介してN−アセチルグルコサミン−6−ホスフェートデアミナーゼをコードする遺伝子(nagA1:NCgl2556)を得た。
nagA1遺伝子を増幅するために使用されたプライマーなどの配列は、それぞれ次の通りである。
配列番号2(nagA1−5)
5’−GGAATTCATGGCAGAAGTGGTGCATTATCAAG−3’
配列番号3(nagA1−3)
5’−GCTCTAGAGATGATGTCCATGGTCGGACTCC−3’
得られたN−アセチルグルコサミン−6−ホスフェートデアミナーゼの野生型遺伝子を用いてORF内停止コドン(stop codon)が入ったN−アセチルグルコサミン−6−ホスフェートデアミナーゼ変異体を製造するために、さらにプライマー(配列番号4および5)を作成して、アミノ酸配列196番目のイソロイシンと197番目のアラニンとの間に停止コドン(stop codon)を挿入した。
具体的な方法としては、ポリメラーゼ連鎖反応で得られた野生型のnagA1を鋳型として配列番号2と4を用いたポリメラーゼ連鎖反応と、配列番号3と5を用いたポリメラーゼ連鎖反応とをそれぞれ行った。得られた2種の産物は、nagA1の一部分であって、元の大きさの半分程度の大きさである。この2種の産物を同時に鋳型として使用し、配列番号2と3を用いて再びポリメラーゼ連鎖反応を行った。この過程を介してN−アセチルグルコサミン−6−ホスフェートデアミナーゼが不活性化された変異体をコードする遺伝子などを得た。前記の不活性化されたnagA1遺伝子断片を、制限酵素EcoRI(New England Biolabs,Beverly,MA)とXbaI(New England Biolabs,Beverly,MA)を用いて、大韓民国公開特許第2008−0025355号などに開示された公知の分子生物学的技術により染色体核酸置換用ベクターpDZに導入して、pDZ−nagA1STベクターを作成した(図2)。
配列番号4(nagA1ST−5)
5’−GTGCCCGAAGGAAGCTTAAATGATGTGGTGCGC−3’
配列番号5(nagA1ST−3)
5’−GCGCACCACATCATTTAAGCTTCCTTCGGGCAC−3’
【0036】
実施例2:コリネバクテリウム・グルタミクムCJNAGKOの作成
作成されたpDZ−nagA1STベクターで野生型コリネバクテリウム・グルタミクム(Corynebacterium glutamicum ATCC13102)菌株を形質転換するために、大韓民国公開特許第2008−0025355号に記述されたように、2次交差(crossover)過程を経て染色体上の遺伝子nagA1のORF内に停止コドン(stop codon)を挿入した。最終的に、アミノ酸配列196番目のイソロイシンと197番目のアラニンとの間に停止コドン(stop codon)が導入されたCJNAGKOを作成した。
【0037】
実施例3:グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)の構成的発現ベクター作成
N−アセチルグルコサミンの生産のために、グルコサミン−6−ホスフェートを基質として使用してN−アセチルグルコサミン−6−ホスフェートを生成する酵素であるグルコサミン−6−ホスフェートアセチルトランスフェラーゼを発現するベクターを作成した。産業的な適用が容易になるようにするために、細胞の増殖時に酵素を構成的発現できるようにするプロモーター(constitutitive promoter)を用いて作成した。発現には、酵母の一種であるサッカロマイセス・セレビシエ(Saccharomyces cerevisiae)の公知のグルコサミン−6−ホスフェートアセチルトランスフェラーゼ遺伝子、GNA1を使用した。
酵素の構成的発現のためには、コリネバクテリウム・グルタミクムで構成的発現プロモーターとして知られているEFTUプロモーター(Judith B. et al. Appl Environ Microbiol. 2005:8587-8596)を用いた。コリネバクテリウム・グルタミクムから分離した染色体を鋳型として用い、配列番号6と7をプライマーとして使用して、ポリメラーゼ連鎖反応を介してEFTUプロモーター(配列番号8)を得た。得られたEFTUプロモーター産物を、制限酵素NdeI(New England Biolabs,Beverly,MA)とHindIII(New England Biolabs,Beverly,MA)を用いて、公知の分子生物学的技術によりpECCG1117ベクター(Biotechnology letters vol 13,No.10,p.721-726(1991)または、大韓民国特許公告第92-7401号)に導入した。このように作成されたベクターをpECCG117−PEFTUと命名した。また、サッカロマイセス・セレビシエ(Saccharomyces cerevisiae)の染色体を分離し、これを鋳型として、配列番号9と10をプライマーとして使用してポリメラーゼ連鎖反応を介してGNA1(配列番号11)を得た。得られたGNA1は、Spe1(New England Biolabs,Beverly,MA)とXbaI(New England Biolabs,Beverly,MA)を用いてpECCG117−PEFTUベクターに導入し、pECCG117−PEFTU−GNA1ベクターを作成した(図3)。
EFTUプロモーターおよびGNA1遺伝子を増幅するために使用されたプライマーなどの配列は、それぞれ次の通りである。
配列番号6(EFTU−5)
5’−GACTAGTATGTTCGGTTACGTCGGTGACCTTC−3’
配列番号7(EFTU−3)
5’−CCCAAGCTTCTATTTTCTAATTTGCATTTCCACGCCTGC−3’
配列番号9(GNA1−5)
5’−GGAATTCCATATGAGCTTACCCGATGGATTTTATATAAGG−3’
配列番号10(GNA1−3)
5’−GCTCTAGACTATTTTCTAATTTGCATTTCCACGCC−3’
【0038】
実施例4:グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)の誘導発現ベクター作成
コリネバクテリウム・グルタミクムの誘導発現システムを作成して、実施例3のコリネバクテリウム・グルタミクムの構成的発現システムと比較を試みた。
具体的に、分離したサッカロマイセス・セレビシエ(Saccharomyces cerevisiae)の染色体を鋳型とし、配列番号9と10をプライマーとして使用してポリメラーゼ連鎖反応を介してGNA1を得、PstI(New England Biolabs,Beverly,MA)とXbaI(New England Biolabs,Beverly,MA)を用いて、コリネバクテリウム・グルタミクムで誘導発現システムとして良く知られているpVWEx2ベクター(Appl. Microbiol. Biotechnol. 2007.76:545-552)に導入して、pVWEx2−GNA1ベクターを作成した(図4)。前記誘導発現には、lacIq−Ptacプロモーターを用いた。使用されたプライマーなどの配列は、それぞれ次の通りである。
配列番号12(Vw2−GNA1−5)
5’−AACTGCAGATGAGCTTACCCGATGGATTTTATATAAGG−3’
配列番号13(Vw2−GNA1−3)
5’−GCTCTAGACTATTTTCTAATTTGCATTTCCACGCCTGC−3’
【0039】
実施例5:GNA1が導入されたコリネバクテリウム・グルタミクムCJNAGKOを用いたN−アセチルグルコサミンの生産
コリネバクテリウム・グルタミクムを用いてN−アセチルグルコサミンを生産するために、染色体内N−アセチルグルコサミン−6−ホスフェートデアミナーゼ(nagA1)ORFに停止コドン(stop codon)を有する変異体CJNAGKOに、グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(GNA1)を導入した。すなわち、実施例3および4で作成されたp117−PEFTU−GNA1とpVWEx2−GNA1のそれぞれでCJNAGKOを形質転換し、N−アセチルグルコサミン−6−ホスフェートデアミナーゼ活性を有さず、グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(GNA1)活性を有する菌株を作成した。作成されたこれら菌株のそれぞれをCJNAG1(KCCM10967P)、CJNAG2と命名した(表1)。
作成された菌株がN−アセチルグルコサミンを生産するか否かを試験するために、N−アセチルグルコサミン−6−ホスフェートデアミナーゼのみ不活性化された菌株(対照群2)と、グルコサミン−6−ホスフェートアセチルトランスフェラーゼのみ増幅された菌株(対照群3)をそれぞれ作成し、対照群として使用した。そして、野生型のコリネバクテリウム・グルタミクムも対照群(対照群1)として使用して、最終的にN−アセチルグルコサミンの生成を分析した(表1)。
使用された培地組成および培養方法は、以下の通りである。試験管にシード(seed)培地(500ml蒸溜水中トリプトン(trypton)5g、酵母エキス(yeast extract)2.5g、塩化ナトリウム(NaCl)5g、ブレーンハートインフュージョン(Brain heart infusion)18.5g、500ml蒸溜水中ソルビトール(sorbitol)91g、それぞれ高温高圧殺菌後に混ぜる)5mlを入れた後、試験菌株を接種し、30℃で12時間培養した。本培養培地(蒸溜水1Lあたり、別途殺菌したブドウ糖90g、硫酸アンモニウム((NH4)2SO4)40g、大豆蛋白質(Soy Protein)2.5g、コーンスティープソリッド(Corn Steep Solids)5g、尿素3g、リン酸二水素カリウム(KH2PO4)1g、硫酸マグネシウム七水和物(MgSO4・7H2O)0.5g、ビオチン100μg、チアミン塩酸塩1000μg、カルシウム−パントテン酸2000μg、ニコチンアミド3000μg、別途殺菌した炭酸カルシウム(CaCO3)30g)20mlを250mlの三角フラスコに分注した後、シード培養液200ulを接種して30℃で42時間発酵させた。特に、pVWEx2−GNA1で形質転換した菌株である‘対照群3’と‘CJNAG2’には、細胞の吸光度(optical density:OD)が600nmで1.0となった時に、IPTGを100uM加えた。それぞれの菌株について3個のフラスコによる試験(flask test)を行い、平均細胞濃度とN−アセチルグルコサミンを測定した。発酵の結果、構成的発現と誘導発現に関係なく約1.0g/L以上のN−アセチルグルコサミンが生産された(表1)。既存の大腸菌を用いたNAG生産の場合、増殖期と生産期の分離が可能な誘導発現システムだけが適用可能であったが、コリネバクテリウムの場合、構成的発現システムも使用可能であることが確認できた。
【0040】
【表1】

【0041】
前記の生産されたN−アセチルグルコサミンを、ノビコフなど(Novikov V.Y. et al. Russ. J. Appl. Chem. 1997:1467-1470)に記載された公知の酸処理方法による脱アセチル化によりグルコサミンを生産することができ、N−アセチルグルコサミンを生産すれば、グルコサミンも容易に追加生産することができる。
【0042】
本発明の様々な実施例が詳細に記述されているが、当業界で本実施例の変形および応用が可能であることは明白である。したがって、そのような変形および応用は、以下の請求項に記載された本発明の範囲内に属するものとして明確に理解されなければならない。
【0043】

【技術分野】
【0001】
本発明は、N−アセチルグルコサミンを生産する遺伝的に組み換えられたコリネバクテリウム属微生物、およびそれを用いてN−アセチルグルコサミンまたはグルコサミンを生産する方法に関するものである。
【背景技術】
【0002】
グルコサミンは、グルコースのアミノ誘導体であり、N−アセチルグルコサミンは、グルコサミンがアセチル化された誘導体であり、これらは多くの天然ポリサッカライドの重要な構成成分であって、細胞壁を構成する細胞構造物質を形成する。
【0003】
N−アセチルグルコサミンは、組織再生に関与する蛋白質合成に重要な成分であるため、胃炎、飲食物アレルギー、炎症性腸疾患(inflammatory bowel disease:IBD)、憩室炎 (diverticulitis)および骨関節組織の代謝障害から引き起こされる病理学的疾患だけでなく、急性および慢性型リウマチ関節炎、並びに骨関節炎のような広範囲な疾病を予防且つ治療するにあって可能性を有している。グルコサミンもやはり、ヒトの骨関節炎疾患の予防および治療に適用する機能性食品として使用されている。
【0004】
グルコサミンは、N−アセチルグルコサミンから誘導された複合炭水化物であるキチンの酸加水分解方法、およびキトサンの酸分解によって製造される。原材料のキチンは、N−アセチルグルコサミンとグルコサミンとの共重合体であって、甲殻類およびかびから発見されたありふれた天然物質である。キチンは、甲殻類(ロブスター、エビ、オキアミ、カニおよびクルマエビの外骨格)から主に生産されており、最近では、クエン酸(citric acid)の生産に用いられるかびバイオマス(biomass)のような安い原料から収得することができる。
【0005】
通常の産業的実施は、ミネラル、蛋白質などを伴った他の不純物を除去するために、酸と塩基との組合せで処理してキチンを精製し、高い温度で長時間高濃度の塩酸を用いて低収率かつ一段階でキチンを分解し、脱アセチル化してグルコサミンとすることである。グルコサミンは、遊離塩基であって、極めて不安定であり、分解されやすいから、塩酸塩のような安定した塩が生産される。
【0006】
甲殻類の外殻およびかびバイオマスにおけるグルコサミン含有量が少ないため、大容量の廃棄物が発生し、製造工程それ自体は相対的に低収率であるのに、エネルギーおよび化学的に集約的であるため、グルコサミンは高価である。また、一般的な形態のグルコサミン、すなわち甲殻類に由来するグルコサミンの場合、甲殻類に敏感なヒトにはアレルギー反応を起こす可能性があることが知られている。さらに、原料物質(例えば、カニの殻のようなキチンの原料)の利用可能性が徐々に制限されてきている。したがって、商業的な販売と利用のために高収率でグルコサミンおよびN−アセチルグルコサミンを製造できる費用効果的な方法が必要である。
【0007】
アレルギー反応の可能性を除去するために、国際公開第02/66667号は、微生物バイオマスからグルコサミンを製造する方法を開示している。しかし、前記の製造方法は、甲殻類アレルギーと関連した問題などは解決したが、低収率という重大な問題点を有している。前記の方法は、クエン酸のような他の物質の発酵中に生成されたバイオマス廃棄物に依存するため、増加する市場の要求を満足させ得る十分な量のグルコサミンを製造するには不十分である。
【0008】
一方、N−アセチルグルコサミンは、現在無水酢酸のような有機アセチル化試薬を用い、グルコサミンのアセチル化によって製造されているが、この製造方法は高コストを要する。また、低い生産収率のため、大量生産が容易でない。
【0009】
これを克服するための一方法として、米国特許第7,332,304号は、大腸菌発酵によってN−アセチルグルコサミンを製造する方法を開示している。この方法は、既存の複雑な工程によるN−アセチルグルコサミンの低生産収率を含む問題点を画期的に解決する、高収率のN−アセチルグルコサミン大腸菌発酵を示唆している。また、N−アセチルグルコサミンは、簡単な酸処理によって脱アセチル化されてグルコサミンになり得ることは公知の事実(Novikov V.Y. et al. Russ. J. Appl. Chem. 1997:1467-1470)であるため、高収率のグルコサミン生産も可能である。
【0010】
しかし、この方法は、大腸菌の使用が毒性を示す可能性のあるエンドトキシンを生成するため、健康食品素材を生産する方法として適していない。また、N−アセチルグルコサミン生産に必須の酵素であるグルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)(図1参照:GNA1)が大腸菌内にはないため、イーストなどの他の微生物から導入しなければならないが、このような重要酵素の発現のためには、必ず誘導発現システムを用いなければならないという制約がある(Deng M.D. et al. Met Eng. 2005:201-214)。重要な酵素の発現を調節できない場合、深刻な細胞増殖阻害を誘発するからである。誘導発現システムは、誘導物質を用いなければならないという原価上昇の短所と、誘導時点を合わせなければならないという困難性があるため、大規模発酵による産業的生産には適さないと考えられえる。前記の発明は、生産の安全性および産業的適用の可能性を勘案する場合、大腸菌と誘導発現システムを用いる短所を有している。
【0011】
現在まで原料物質供給の不安定性の解消と高収率生産のための大腸菌発酵技術の開発はあったが、ヒトと動物に使用するのに安全なN−アセチルグルコサミンおよびグルコサミンの生産に適した生産菌株がなかったし、また、産業的な酵素生成を促進するような、主要酵素発現システムを誘導発現システム以外に構成的発現システムを用いた生産菌株の生成については報告されていない。
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の一つの目的は、N−アセチルグルコサミンを生産する遺伝的に組み換えられたコリネバクテリウム属微生物、好ましくはグルコサミン−6−ホスフェートアセチルトランスフェラーゼ活性を有し、グルコサミン−6−ホスフェートデアミナーゼ(glucosamine-6-phosphate deaminase)活性が減少または欠失したコリネバクテリウム属微生物を提供することにある。
【0013】
本発明の他の一つの目的は、前記のコリネバクテリウム属微生物を用いてN−アセチルグルコサミンまたはグルコサミンを製造する方法を提供することにある。
【課題を解決するための手段】
【0014】
本発明者らは、前記の言及された問題点を解決するため、環境問題を誘発することなく、物質生産安定性と産業適用性を実現できるN−アセチルグルコサミンおよびグルコサミンの大規模な発酵生産のためのコリネバクテリウム属微生物と、該微生物を用いてN−アセチルグルコサミンおよびグルコサミンを生産する方法を開発し、本発明を完成した。
【発明の効果】
【0015】
本発明は、N−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物を作成し、当該微生物を用いてN−アセチルグルコサミンまたはグルコサミンを生産することによって、アレルギー反応の危険がなく、大量供給が可能なN−アセチルグルコサミンおよびグルコサミンを提供するのに有用に利用され得る。また、健康食品および治療用素材の安全な生産と主要酵素の構成的発現で産業への適用が容易である。
【図面の簡単な説明】
【0016】
【図1】図1は、N−アセチルグルコサミン生合成経路およびN−アセチルグルコサミン生産菌株の遺伝子組み換えを図式化したものである。本発明では、nagAを不活性化させ、外来遺伝子であるGNA1を増幅した。
【図2】図2は、pDZ−nagA1STベクター構造を示した図である。pDZに停止コドンが入ったnagA1をクローニングした。
【図3】図3は、pECCG117−PEFTU−GNA1ベクター構造を示した図である。pECCG117ベクターに構成的発現プロモーターであるPEFTUを1次クローニングし、GNA1をさらにクローニングして作成された。
【図4】図4は、pVWEx2−GNA1ベクター構造を示した図である。pVWEx2ベクターにGNA1をクローニングして作成された。
【発明を実施するための形態】
【0017】
一つの態様として、本発明は、グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)活性を有し、グルコサミン−6−ホスフェートデアミナーゼ(glucosamine-6-phosphate deaminase)活性が減少または欠失したコリネバクテリウム属微生物であって、N−アセチルグルコサミンおよびグルコサミン生産能を有するコリネバクテリウム属微生物に関するものである。
【0018】
本発明において、グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)は、グルコサミン−6−ホスフェートをアセチル化してN−アセチルグルコサミン−6−ホスフェートとする酵素をいう。前記の酵素は、サッカロマイセス(Saccharomyces)属微生物などに存在するが、本願のコリネバクテリウム属微生物には存在しない。
【0019】
したがって、本発明において使用された用語、“グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)活性を有する”または“グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)活性を有するコリネバクテリウム属微生物”は、コリネバクテリウム属微生物には存在しないグルコサミン−6−ホスフェートアセチルトランスフェラーゼ遺伝子をコリネバクテリウム属微生物内に導入してコリネバクテリウム属微生物がグルコサミン−6−ホスフェートアセチルトランスフェラーゼを発現し、それを用いてコリネバクテリウム属微生物がN−グルコサミン−6−ホスフェートをN−アセチルグルコサミン−6−ホスフェートに変換できることをいう。
【0020】
遺伝子導入により、コリネバクテリウム属微生物にグルコサミン−6−ホスフェートアセチルトランスフェラーゼ活性を保持させる方法としては、当該分野において良く知られた様々な方法の適用が可能である。本発明の具体的な実施態様では、グルコサミン−6−ホスフェートアセチルトランスフェラーゼをコードする核酸配列をベクターに導入し、その組み換えベクターがコリネバクテリウム属微生物の形質転換に用いられた。
【0021】
前記のグルコサミン−6−ホスフェートアセチルトランスフェラーゼ遺伝子は、コリネバクテリウム属微生物で作動可能な核酸配列を有する遺伝子であれば足りる。一つの具体的な実施態様では、サッカロマイセス・セレビシエ(Saccharomyces cerevisiae)から由来したものであって、好ましくは、配列番号11の核酸配列である。特に、前記のグルコサミン−6−ホスフェートアセチルトランスフェラーゼをコードする配列は、その活性を維持する限り、一定程度組み換えが可能である。 本技術分野の当業者ならば、人為的な組み換えによって70%以上の相同性が維持される核酸配列が本発明において望ましい遺伝子活性を保持する限り、本発明の前記核酸配列から由来したものと同質であることが簡単に理解できるだろう。
【0022】
本発明のグルコサミン−6−ホスフェートアセチルトランスフェラーゼ遺伝子には、好ましくは、前記遺伝子の発現を誘導するようにプロモーターが作動可能に連結される。本発明の目的に照らしてより好ましくは、前記プロモーターは、コリネバクテリウム属微生物によるグルコサミン−6−ホスフェートアセチルトランスフェラーゼの構成的または誘導発現を誘導するプロモーターであり、コリネバクテリウム属微生物に導入されたグルコサミン−6−ホスフェートアセチルトランスフェラーゼの構成的または誘導発現を誘導し得る遺伝子である。一つの具体的な実施態様において、前記の構成的発現プロモーターは、EFTUプロモーターであり、前記の誘導発現プロモーターは、laclq−Ptacプロモーターである。大腸菌において、グルコサミン−6−ホスフェートアセチルトランスフェラーゼの発現が増殖初期に誘導された場合、深刻な増殖抑制を生じて誘導発現システムのみが使用できる (Deng M.D. et al. Met Eng. 2005:201-214)。一方、本発明のコリネバクテリウム属微生物は、前記酵素の誘導または構成的発現により増殖が影響を受けないという利点を有する。
【0023】
本発明において、グルコサミン−6−ホスフェート デアミナーゼ(glucosamine-6-phosphate deaminase)は、アセチルグルコサミン−6−ホスフェートをグルコサミン−6−ホスフェートに変換する酵素をいう。したがって、本発明の目的のためには、本発明のコリネバクテリウム属微生物は、グルコサミン−6−ホスフェートデアミナーゼをコードする核酸配列の部分的または全体的な欠失/突然変異により、天然に存在する遺伝子に比べて該酵素をコードする遺伝子の発現が少ないか全く発現しないことを特徴とする。前記のようにグルコサミン−6−ホスフェート デアミナーゼをコードする核酸配列が部分的にまたは全体的に欠失するか突然変異して、天然に存在する核酸配列に比べて発現が少ないか全く発現しないことを、本発明では“減少”または“欠失”と表現することができる。
【0024】
グルコサミン−6−ホスフェート デアミナーゼ遺伝子の無発現または低発現を誘導するために、たとえば、構造遺伝子(structure gene)の上流に位置したプロモーター領域および調節領域が変異され得る。構造遺伝子の上流に取り付けられた調節カセットも同様の作用をすることができる。発現を減少させるようにプロモーターを修飾したり、m−RNAの安定性を減少させることによって、遺伝子翻訳を調節して発現を減少させ得る。また、部位特異的組み換えDNA技術によって、遺伝子の一部または全部を欠失または変異した断片で置換して、グルコサミン−6−ホスフェート デアミナーゼ活性を減少または欠失させ得る。しかし、このような方法の他にも、当該分野で周知の様々な方法を用いて、遺伝子の無発現または低発現を達成できるということは当業者に自明だろう。
【0025】
本発明において、“N−アセチルグルコサミン生産能”という用語は、N−アセチルグルコサミンを生産する能力であって、本発明のコリネバクテリウム属微生物を培地で培養する場合、培地中にN−アセチルグルコサミンを生産して蓄積する本発明のコリネバクテリウム属微生物の能力をいう。本発明において、“グルコサミン生産能”という用語は、微生物の発酵によって生産された物質からグルコサミンを生産する能力であって、培地中に蓄積されたN−アセチルグルコサミンを公知の様々な方法によって脱アセチル化し、グルコサミンを生産、蓄積する本発明のコリネバクテリウム属微生物の能力をいう。
【0026】
本発明において、“N−アセチルグルコサミンおよび/またはグルコサミン生産能を有する微生物”は、コリネバクテリウム(Corynebacterium)属に属する微生物である。好ましくは、コリネバクテリウム・グルタミクム(例えば、ATCC13032)、コリネバクテリウム・アンモニアゲネス(例えば、ATCC6872)、ブレビバクテリウム・ラクトファーメンタム(Brevibacterium lactofermentum)(例えば、ATCC13869)、ブレビバクテリウム・フラバム(Brevibacterium flavum)(例えば、ATCC14067)、コリネバクテリウム・サーモアミノゲネス(Corynebacterium thermoaminogenes)(例えば、FERM-BP1539)、コリネバクテリウム・エフィシエンス(Corynebacterium efficiens)(例えば、C.efficiens str. YS-314)などであるが、必ずしもこれに限定されるのではない。より好ましくは、コリネバクテリウム・グルタミクムであり、さらに好ましくは、2008年9月29日付で大韓民国ソウル特別市西大門区弘済1洞361−221番地に所在する国際寄託機関である韓国種菌協会付設韓国微生物保存センターに受託番号KCCM10967Pで寄託されたコリネバクテリウム・グルタミクムCJNAG1である。
【0027】
他の一つの態様として、本発明は、N−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物を培養して、N−アセチルグルコサミンまたはグルコサミンを生産する方法に関するものである。
【0028】
具体的に、本発明は、(a)本発明のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物を培養する段階および(b)前記培養段階で生産されたN−アセチルグルコサミンまたはグルコサミンを収集する段階を含むN−アセチルグルコサミンまたはグルコサミンの生産方法に関するものである。
【0029】
本発明の前記培養は、当業界に知られている適当な培地と培養条件によってなされ得る。培養方法は、当業者ならば選択される菌株により容易に調整して使用することができる。前記培養方法の例には、回分式、連続式および流加式培養が含まれるが、これに限定されるものではない。このような様々な培養方法は、例えば、“Biochemical Engineering”by James M. Lee,Prentice-Hall International Editions,pp 138-176に開示されている。培養に使用される培地は、特定の菌株の培養条件に合致しなければならない。
【0030】
本発明で用いられる培地は、ブドウ糖を炭素源として使用し、その他の適切量の炭素源は様々に利用され得る。使用され得る窒素源の例としては、ペプトン、酵母抽出物、肉汁、麦芽抽出物、とうもろこし浸漬液、および大豆、小麦のような有機窒素源および、尿素、硫酸アンモニウム、塩化アンモニウム、リン酸アンモニウム、炭酸アンモニウムおよび硝酸アンモニウムのような無機窒素源が含まれる。これらの窒素源は、単独または組合わせて使用され得る。前記の培地にはリン源として、リン酸二水素カリウム、リン酸水素二カリウムおよび対応するナトリウム−含有塩が含まれ得る。また、硫酸マグネシウムまたは硫酸鉄のような金属塩を含むことができる。その他に、アミノ酸、ビタミン、および適切な前駆体などが含まれ得る。これらの培地または前駆体は、培養物に回分式または連続式で添加され得る。
【0031】
培養中に水酸化アンモニウム、水酸化カリウム、アンモニア、リン酸および硫酸のような化合物を培養物に適宜添加し、培養物のpHを調整することができる。また、培養中には、脂肪酸ポリグリコールエステルのような消泡剤を使用して気泡生成を抑制することができる。また、培養物の好気状態を維持するために、培養物内に酸素または、酸素−含有気体を注入したり、嫌気および微好気状態を維持するために、気体を注入せず、あるいは窒素、水素、または二酸化炭素ガスを注入することができる。培養物の温度は、普通30℃〜37℃であり、好ましくは35℃〜37℃である。培養期間は、所望量の所望物質が得られるまで継続され、好ましくは10〜160時間である。
【0032】
本発明の前記培養段階で生産されたN−アセチルグルコサミンまたはグルコサミンを収集および/または回収する段階は、培養方法、例えば、回分式、連続式または流加式培養方法などによって当該分野に公知の適当な方法を用いて、培養液から目的とするN−アセチルグルコサミンまたはグルコサミンを収集および/または回収することにより行われる。
【0033】
また、本発明は、前記の収集されたN−アセチルグルコサミンを脱アセチル化してグルコサミンに変換する段階をさらに含むことができる。そのような変換が、当該分野に広く知られている方法(例えば、ノビコフなど(Novikov V.Y. et al. Russ. J. Appl. Chem. 1997:1467-1470))によりなし得ることは、当業者に自明だろう。
【実施例】
【0034】
以下、実施例を介して本発明をより詳細に説明しようとする。しかし、これら実施例は、本発明を例示的に説明するためのものであって、本発明の範囲がこれらの実施例に限定されるのではない。
【0035】
実施例1:N−アセチルグルコサミン−6−ホスフェートデアミナーゼ(glucosamine-6-phosphate deaminase)変異体の作成および染色体核酸置換組み換えベクターpDZ−nagAST作成
野生型コリネバクテリウム・グルタミクム(Corynebacterium glutamicum ATCC13102)のN−アセチルグルコサミン−6−ホスフェートの利用を防ぐために、N−アセチルグルコサミン−6−ホスフェートを基質として用いるN−アセチルグルコサミン−6−ホスフェートデアミナーゼをコードするnagA1(NCgl2556,配列番号1)の不活性化を行った。
不活性化の方法は、遺伝子除去および追加配列導入などの様々な方法があり得るが、本実施例ではnagA1遺伝子のORF(open reading frame)内に停止コドン(stop codon)を挿入して、遺伝子の翻訳(translation)を不能とさせた。
具体的に、コリネバクテリウム・グルタミクム(Corynebacterium glutamicum ATCC13102)の染色体遺伝子を分離し、これを鋳型として配列番号2と配列番号3のプライマーを用いてポリメラーゼ連鎖反応を介してN−アセチルグルコサミン−6−ホスフェートデアミナーゼをコードする遺伝子(nagA1:NCgl2556)を得た。
nagA1遺伝子を増幅するために使用されたプライマーなどの配列は、それぞれ次の通りである。
配列番号2(nagA1−5)
5’−GGAATTCATGGCAGAAGTGGTGCATTATCAAG−3’
配列番号3(nagA1−3)
5’−GCTCTAGAGATGATGTCCATGGTCGGACTCC−3’
得られたN−アセチルグルコサミン−6−ホスフェートデアミナーゼの野生型遺伝子を用いてORF内停止コドン(stop codon)が入ったN−アセチルグルコサミン−6−ホスフェートデアミナーゼ変異体を製造するために、さらにプライマー(配列番号4および5)を作成して、アミノ酸配列196番目のイソロイシンと197番目のアラニンとの間に停止コドン(stop codon)を挿入した。
具体的な方法としては、ポリメラーゼ連鎖反応で得られた野生型のnagA1を鋳型として配列番号2と4を用いたポリメラーゼ連鎖反応と、配列番号3と5を用いたポリメラーゼ連鎖反応とをそれぞれ行った。得られた2種の産物は、nagA1の一部分であって、元の大きさの半分程度の大きさである。この2種の産物を同時に鋳型として使用し、配列番号2と3を用いて再びポリメラーゼ連鎖反応を行った。この過程を介してN−アセチルグルコサミン−6−ホスフェートデアミナーゼが不活性化された変異体をコードする遺伝子などを得た。前記の不活性化されたnagA1遺伝子断片を、制限酵素EcoRI(New England Biolabs,Beverly,MA)とXbaI(New England Biolabs,Beverly,MA)を用いて、大韓民国公開特許第2008−0025355号などに開示された公知の分子生物学的技術により染色体核酸置換用ベクターpDZに導入して、pDZ−nagA1STベクターを作成した(図2)。
配列番号4(nagA1ST−5)
5’−GTGCCCGAAGGAAGCTTAAATGATGTGGTGCGC−3’
配列番号5(nagA1ST−3)
5’−GCGCACCACATCATTTAAGCTTCCTTCGGGCAC−3’
【0036】
実施例2:コリネバクテリウム・グルタミクムCJNAGKOの作成
作成されたpDZ−nagA1STベクターで野生型コリネバクテリウム・グルタミクム(Corynebacterium glutamicum ATCC13102)菌株を形質転換するために、大韓民国公開特許第2008−0025355号に記述されたように、2次交差(crossover)過程を経て染色体上の遺伝子nagA1のORF内に停止コドン(stop codon)を挿入した。最終的に、アミノ酸配列196番目のイソロイシンと197番目のアラニンとの間に停止コドン(stop codon)が導入されたCJNAGKOを作成した。
【0037】
実施例3:グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)の構成的発現ベクター作成
N−アセチルグルコサミンの生産のために、グルコサミン−6−ホスフェートを基質として使用してN−アセチルグルコサミン−6−ホスフェートを生成する酵素であるグルコサミン−6−ホスフェートアセチルトランスフェラーゼを発現するベクターを作成した。産業的な適用が容易になるようにするために、細胞の増殖時に酵素を構成的発現できるようにするプロモーター(constitutitive promoter)を用いて作成した。発現には、酵母の一種であるサッカロマイセス・セレビシエ(Saccharomyces cerevisiae)の公知のグルコサミン−6−ホスフェートアセチルトランスフェラーゼ遺伝子、GNA1を使用した。
酵素の構成的発現のためには、コリネバクテリウム・グルタミクムで構成的発現プロモーターとして知られているEFTUプロモーター(Judith B. et al. Appl Environ Microbiol. 2005:8587-8596)を用いた。コリネバクテリウム・グルタミクムから分離した染色体を鋳型として用い、配列番号6と7をプライマーとして使用して、ポリメラーゼ連鎖反応を介してEFTUプロモーター(配列番号8)を得た。得られたEFTUプロモーター産物を、制限酵素NdeI(New England Biolabs,Beverly,MA)とHindIII(New England Biolabs,Beverly,MA)を用いて、公知の分子生物学的技術によりpECCG1117ベクター(Biotechnology letters vol 13,No.10,p.721-726(1991)または、大韓民国特許公告第92-7401号)に導入した。このように作成されたベクターをpECCG117−PEFTUと命名した。また、サッカロマイセス・セレビシエ(Saccharomyces cerevisiae)の染色体を分離し、これを鋳型として、配列番号9と10をプライマーとして使用してポリメラーゼ連鎖反応を介してGNA1(配列番号11)を得た。得られたGNA1は、Spe1(New England Biolabs,Beverly,MA)とXbaI(New England Biolabs,Beverly,MA)を用いてpECCG117−PEFTUベクターに導入し、pECCG117−PEFTU−GNA1ベクターを作成した(図3)。
EFTUプロモーターおよびGNA1遺伝子を増幅するために使用されたプライマーなどの配列は、それぞれ次の通りである。
配列番号6(EFTU−5)
5’−GACTAGTATGTTCGGTTACGTCGGTGACCTTC−3’
配列番号7(EFTU−3)
5’−CCCAAGCTTCTATTTTCTAATTTGCATTTCCACGCCTGC−3’
配列番号9(GNA1−5)
5’−GGAATTCCATATGAGCTTACCCGATGGATTTTATATAAGG−3’
配列番号10(GNA1−3)
5’−GCTCTAGACTATTTTCTAATTTGCATTTCCACGCC−3’
【0038】
実施例4:グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)の誘導発現ベクター作成
コリネバクテリウム・グルタミクムの誘導発現システムを作成して、実施例3のコリネバクテリウム・グルタミクムの構成的発現システムと比較を試みた。
具体的に、分離したサッカロマイセス・セレビシエ(Saccharomyces cerevisiae)の染色体を鋳型とし、配列番号9と10をプライマーとして使用してポリメラーゼ連鎖反応を介してGNA1を得、PstI(New England Biolabs,Beverly,MA)とXbaI(New England Biolabs,Beverly,MA)を用いて、コリネバクテリウム・グルタミクムで誘導発現システムとして良く知られているpVWEx2ベクター(Appl. Microbiol. Biotechnol. 2007.76:545-552)に導入して、pVWEx2−GNA1ベクターを作成した(図4)。前記誘導発現には、lacIq−Ptacプロモーターを用いた。使用されたプライマーなどの配列は、それぞれ次の通りである。
配列番号12(Vw2−GNA1−5)
5’−AACTGCAGATGAGCTTACCCGATGGATTTTATATAAGG−3’
配列番号13(Vw2−GNA1−3)
5’−GCTCTAGACTATTTTCTAATTTGCATTTCCACGCCTGC−3’
【0039】
実施例5:GNA1が導入されたコリネバクテリウム・グルタミクムCJNAGKOを用いたN−アセチルグルコサミンの生産
コリネバクテリウム・グルタミクムを用いてN−アセチルグルコサミンを生産するために、染色体内N−アセチルグルコサミン−6−ホスフェートデアミナーゼ(nagA1)ORFに停止コドン(stop codon)を有する変異体CJNAGKOに、グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(GNA1)を導入した。すなわち、実施例3および4で作成されたp117−PEFTU−GNA1とpVWEx2−GNA1のそれぞれでCJNAGKOを形質転換し、N−アセチルグルコサミン−6−ホスフェートデアミナーゼ活性を有さず、グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(GNA1)活性を有する菌株を作成した。作成されたこれら菌株のそれぞれをCJNAG1(KCCM10967P)、CJNAG2と命名した(表1)。
作成された菌株がN−アセチルグルコサミンを生産するか否かを試験するために、N−アセチルグルコサミン−6−ホスフェートデアミナーゼのみ不活性化された菌株(対照群2)と、グルコサミン−6−ホスフェートアセチルトランスフェラーゼのみ増幅された菌株(対照群3)をそれぞれ作成し、対照群として使用した。そして、野生型のコリネバクテリウム・グルタミクムも対照群(対照群1)として使用して、最終的にN−アセチルグルコサミンの生成を分析した(表1)。
使用された培地組成および培養方法は、以下の通りである。試験管にシード(seed)培地(500ml蒸溜水中トリプトン(trypton)5g、酵母エキス(yeast extract)2.5g、塩化ナトリウム(NaCl)5g、ブレーンハートインフュージョン(Brain heart infusion)18.5g、500ml蒸溜水中ソルビトール(sorbitol)91g、それぞれ高温高圧殺菌後に混ぜる)5mlを入れた後、試験菌株を接種し、30℃で12時間培養した。本培養培地(蒸溜水1Lあたり、別途殺菌したブドウ糖90g、硫酸アンモニウム((NH4)2SO4)40g、大豆蛋白質(Soy Protein)2.5g、コーンスティープソリッド(Corn Steep Solids)5g、尿素3g、リン酸二水素カリウム(KH2PO4)1g、硫酸マグネシウム七水和物(MgSO4・7H2O)0.5g、ビオチン100μg、チアミン塩酸塩1000μg、カルシウム−パントテン酸2000μg、ニコチンアミド3000μg、別途殺菌した炭酸カルシウム(CaCO3)30g)20mlを250mlの三角フラスコに分注した後、シード培養液200ulを接種して30℃で42時間発酵させた。特に、pVWEx2−GNA1で形質転換した菌株である‘対照群3’と‘CJNAG2’には、細胞の吸光度(optical density:OD)が600nmで1.0となった時に、IPTGを100uM加えた。それぞれの菌株について3個のフラスコによる試験(flask test)を行い、平均細胞濃度とN−アセチルグルコサミンを測定した。発酵の結果、構成的発現と誘導発現に関係なく約1.0g/L以上のN−アセチルグルコサミンが生産された(表1)。既存の大腸菌を用いたNAG生産の場合、増殖期と生産期の分離が可能な誘導発現システムだけが適用可能であったが、コリネバクテリウムの場合、構成的発現システムも使用可能であることが確認できた。
【0040】
【表1】

【0041】
前記の生産されたN−アセチルグルコサミンを、ノビコフなど(Novikov V.Y. et al. Russ. J. Appl. Chem. 1997:1467-1470)に記載された公知の酸処理方法による脱アセチル化によりグルコサミンを生産することができ、N−アセチルグルコサミンを生産すれば、グルコサミンも容易に追加生産することができる。
【0042】
本発明の様々な実施例が詳細に記述されているが、当業界で本実施例の変形および応用が可能であることは明白である。したがって、そのような変形および応用は、以下の請求項に記載された本発明の範囲内に属するものとして明確に理解されなければならない。
【0043】

【特許請求の範囲】
【請求項1】
グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)活性を有し、グルコサミン−6−ホスフェート デアミナーゼ(glucosamine-6-phosphate deaminase)活性が減少または欠失したコリネバクテリウム属微生物であって、N−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項2】
前記グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)は、配列番号11の核酸配列でコードされたことを特徴とする請求項1に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項3】
前記グルコサミン−6−ホスフェートアセチルトランスフェラーゼが誘導発現または、構成的発現されることを特徴とする請求項1に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項4】
前記構成的発現は、EFTUプロモーターを用いたことを特徴とする請求項3に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項5】
前記誘導発現は、lacIq−Ptacプロモーターを用いたことを特徴とする請求項3に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項6】
前記微生物は、コリネバクテリウム・グルタミクムであることを特徴とする請求項1に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項7】
前記微生物は、コリネバクテリウム・グルタミクムCJNAG1(KCCM10967P)であることを特徴とする請求項1に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項8】
(a)請求項1乃至7のうち、いずれか一項におけるN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物を培養する段階および
(b)前記培養段階で生産されたN−アセチルグルコサミンまたはグルコサミンを収集する段階を含むN−アセチルグルコサミンまたはグルコサミンを生産する方法。
【請求項9】
前記(b)段階で収集されたN−アセチルグルコサミンを脱アセチル化してグルコサミンを製造する段階をさらに含む請求項8に記載のN−アセチルグルコサミンまたはグルコサミンを生産する方法。
【請求項1】
グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)活性を有し、グルコサミン−6−ホスフェート デアミナーゼ(glucosamine-6-phosphate deaminase)活性が減少または欠失したコリネバクテリウム属微生物であって、N−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項2】
前記グルコサミン−6−ホスフェートアセチルトランスフェラーゼ(glucosamine-6-phosphate acetyltransferase)は、配列番号11の核酸配列でコードされたことを特徴とする請求項1に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項3】
前記グルコサミン−6−ホスフェートアセチルトランスフェラーゼが誘導発現または、構成的発現されることを特徴とする請求項1に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項4】
前記構成的発現は、EFTUプロモーターを用いたことを特徴とする請求項3に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項5】
前記誘導発現は、lacIq−Ptacプロモーターを用いたことを特徴とする請求項3に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項6】
前記微生物は、コリネバクテリウム・グルタミクムであることを特徴とする請求項1に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項7】
前記微生物は、コリネバクテリウム・グルタミクムCJNAG1(KCCM10967P)であることを特徴とする請求項1に記載のN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物。
【請求項8】
(a)請求項1乃至7のうち、いずれか一項におけるN−アセチルグルコサミン生産能を有するコリネバクテリウム属微生物を培養する段階および
(b)前記培養段階で生産されたN−アセチルグルコサミンまたはグルコサミンを収集する段階を含むN−アセチルグルコサミンまたはグルコサミンを生産する方法。
【請求項9】
前記(b)段階で収集されたN−アセチルグルコサミンを脱アセチル化してグルコサミンを製造する段階をさらに含む請求項8に記載のN−アセチルグルコサミンまたはグルコサミンを生産する方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2012−505667(P2012−505667A)
【公表日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願番号】特願2011−533101(P2011−533101)
【出願日】平成21年10月20日(2009.10.20)
【国際出願番号】PCT/KR2009/006063
【国際公開番号】WO2010/047516
【国際公開日】平成22年4月29日(2010.4.29)
【出願人】(511023598)シージェイ チェイルジェダン コーポレイション (6)
【Fターム(参考)】
【公表日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願日】平成21年10月20日(2009.10.20)
【国際出願番号】PCT/KR2009/006063
【国際公開番号】WO2010/047516
【国際公開日】平成22年4月29日(2010.4.29)
【出願人】(511023598)シージェイ チェイルジェダン コーポレイション (6)
【Fターム(参考)】
[ Back to top ]

