国際特許分類[C07C255/30]の内容
化学;冶金 (1,075,549) | 有機化学 (230,229) | 非環式化合物または炭素環式化合物 (64,036) | カルボン酸ニトリル (1,628) | 非環式炭素原子に結合しているシアノ基をもつもの (847) | シアノ基と,同じ不飽和非環式炭素骨格に結合しており,さらに異種原子に結合していない単結合の窒素原子とを含有するもの (21)
国際特許分類[C07C255/30]に分類される特許
11 - 20 / 21
液晶用材料、液晶エラストマー、液晶用材料の製造方法、及び液晶エラストマーの製造方法
【課題】液晶から液体へ変化する時のエンタルピー変化の大きい安定な液晶を発現できるとともに、エラストマー弾性が損なわれないようにする液晶用材料及びその液晶用材料を包含した液晶エラストマーを提供する。
【解決手段】ビニル基(炭素・炭素二重結合)を末端に置換した2つのビフェニル基を有し、液晶から液体へ変化する時のエンタルピー変化の大きく安定な液晶状態となり、昇温過程及び降温過程のいずれにおいても明瞭な液晶性を示すとともにその液晶温度範囲が広く、さらに、ポリブタジエンと混合して有機溶剤に溶かした後に有機溶剤を蒸発させ、残った固体を180℃から250℃まで加熱すると、ポリブタジエン鎖に側鎖として結合されるとともに、ポリブタジエン間に架橋が起こってエラストマーとなる。
(もっと読む)
疾病の処置に有用な置換アセチレン化合物
本発明は、式IaおよびIb: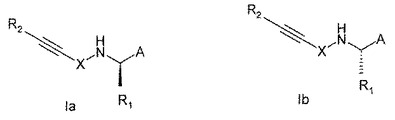
[式中、
Aは、置換または不置換の、C1-10ヘテロアリール、C6-14アリールまたはC6-10ヘテロシクロアルキルアリールを表し、
R1は、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ヒドロキシアルキル、C1-6ハロアルキル、C1-6アミノ、C3-6シクロアルキルまたはC1-6ヘテロシクロアルキルであり、これらはいずれも、置換されていてもよく;
Xは、-CR3R4-(CR5R6)n-(CR7=CR8)m-(C6-14アリール)r-(C1-10ヘテロアリール)s-(CR9R10)p-(CR11=CR12)qを表し;
R2は、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ヒドロキシアルキル、C1-6ハロアルキル、C1-6アミノ、C1-12アルキルシリル、C6-30アルキルアリールシリル、C1-10ヘテロアリール、C6-14アリール、C1-10ヘテロシクロアルキル、C1-10ヘテロシクロアルケニル、C1-8シクロアルキル、C1-18シクロアルケニルを表し、これらはいずれも、置換されていてもよく、あるいはR2は水素、カルボキシまたはヒドロキシを表す。]
で示される新規化合物または薬学的に許容し得るその塩、溶媒和物もしくはエステル;その製法;医療に使用する該化合物;該化合物を含有する医薬組成物に関し、該化合物は例えば、CaSR活性の変調が関連する疾患(例えば副甲状腺機能亢進症)を処置するのに有用である。 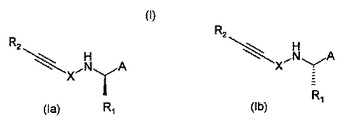 (もっと読む)
(もっと読む)
置換アクリル酸系化合物、及び光電変換素子の半導体電極形成用増感色素
【課題】酸化チタン等の半導体薄膜に含浸させることにより、高い光電変換効率と黄色発色を実現する有機系色素化合物を用いて、高効率の光電変換材料、半導体電極及び光電変換素子を提供する。
【解決手段】下記一般式(I)で表される置換アクリル酸系化合物。この置換アクリル酸系化合物を含有する半導体電極形成用増感色素。
(式中、R1、R2は、各々独立して、置換基を有していてもよい芳香環基、または置換基を有していてもよいアルキル基を表し、R3〜R5は、各々独立して、水素原子、置換基を有していてもよい炭素数1〜20の有機基、またはハロゲン原子を表し、R6は置換基を有していてもよい芳香環基または電子吸引性置換基を表す。nは1〜5の整数である。)
(もっと読む)
新規の有効な末端分化誘発剤およびその使用方法
【課題】腫瘍性細胞の末端分化を選択的に誘発する新規化合物を提供する。
【解決手段】式(I)で示される化合物である。(式中、R1 およびR2 は、シクロアルキルアミノ、ピリジンアミノ、ピペリジノ、9-プリン-6- アミン、もしくはチアゾールアミノ基であって、R3 およびR4 は、水素原子、ヒドロキシル基、置換アルキル、アルケニル、シクロアルキル、アリール、アルキロキシ、アリーロキシ、アリールアルキロキシまたはピリジン基であり、かつnは 4ないし 8の整数である。)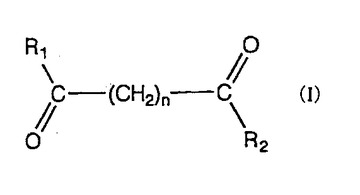 (もっと読む)
(もっと読む)
メロシアニン誘導体を使用することによる紫外線による劣化に対するボディケア及び家庭用品の安定化
【課題】メロシアニン誘導体を使用することによる紫外線による劣化に対するボディケア及び家庭用品の安定化を提供すること。
【解決手段】記載されているのは光分解及び酸化的劣化からボディケア及び家庭用品を保護するための特定のメロシアニン誘導体の使用である。
これらの化合物は、優れた紫外線吸収性を示す。
(もっと読む)
スフィンゴシンキナーゼ阻害剤
本発明は、式(I)の置換アダマンタン化合物、その医薬組成物、それらの製造方法ならびにスフィンゴシンキナーゼの阻害方法および過剰増殖性疾患、炎症性疾患または血管新生性疾患の治療方法または予防方法に関する。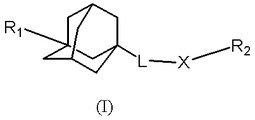
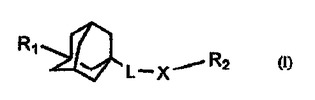 (もっと読む)
(もっと読む)
3−シアノ−キノリンと、それにより製造される中間体とを調製する方法
本発明は、本発明の方法により得られる置換3−シアノキノリンと中間体とを調製する方法に関するものである。本発明の方法は、N−アリール−2−プロパンイミドと塩化ホスホリルとを反応させて、置換3−シアノキノリンを製造することを含む。この3−シアノキノリンを製造する方法では、2通りの経路を利用する。どちらの経路も、N−アリール−2−プロペン誘導体を生成するものであり、次いで、この誘導体を塩化ホスホリルで処理すると、3−シアノキノリンが得られる。本発明の方法はさらに、アリールアミン、オルトギ酸および活性メチレンを反応させて、N−アリール−2−プロペンアミドを製造することを含むものである。 (もっと読む)
アルコール溶媒中での有機フルオロ化合物の調製方法
本発明は、放射性同位元素フッ素18を含んだ有機フルオロ化合物の調製方法に関するもので、より詳細には、放射性同位元素フッ素18を含んだフッ素塩とアルキルハライドまたはアルキルスルホナートとを反応させて有機フルオロ化合物を調製する方法において、下記の化学式1で表わされるアルコールを溶媒に使用することによって、有機フルオロ化合物を高収率で調製する有機フルオロ化合物の調製方法に関するものであり、本発明による合成は、穏和な反応条件下で行うことができ、反応時間を短縮させるだけではなくその収率を顕著に向上させることにより、有機フルオロ化合物の大量生成に好適である。 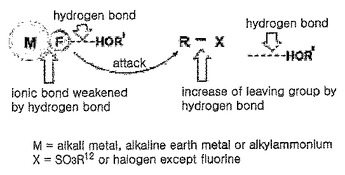 (もっと読む)
(もっと読む)
農薬
(式中、
X、Y及びZは独立してH、ハロゲン、C1〜4アルキル(例えばメチル)、ハロ(C1〜4)アルキル(例えばトリフルオロメチル)、C2〜4アルケニル、ハロ(C2〜4)アルケニル、C2〜4アルキニル、ハロ(C2〜4)アルキニル、C1〜4アルコキシ(例えば、メトキシ)、ハロ(C1〜4)アルコキシ(例えば、トリフルオロメトキシ)、−S(O)n(C1〜4)アルキルであり、ここで
nは、0、1又は2であり、そして当該アルキル基は任意にフルオロ(例えば、メチルチオ、トリフルオロメチルスルホニル)、−OSO2(C1〜4)アルキルであり、ここで当該アルキル基は任意にフルオロ(例えば、トリフルオロメチルスルホニルオキシ)、シアノ、ニトロ、C1〜4アルコキシカルボニル、−CONR’R''、−COR’、−NR’COR''又は−NR’COOR'''でありここで、R’及びR''は独立してH又はC1〜4アルキルでありそしてR'''はC1〜4アルキル(例えば、アセチル、−NHCOCH3及び−NHCO2CH3)であり、但しX及びZのうち少なくとも1つはHではなく;
R1はC1〜4アルキル、C2〜4アルケニル又はC2〜4アルキニルでありここで当該アルキル、アルケニル及びアルキニル基は任意にそれらの末端の炭素原子上で1、2又は3個のハロゲン原子(例えば2,2,2−トリフルオロエチル)で、シアノ基(例えば、シアノメチル)で、C1〜4アルキルカルボニル基(例えば、アセチルメチル)で、C1〜4アルコキシカルボニル基(例えばメトキシカルボニルメチル及びメトキシカルボニルエチル)でかあるいはヒドロキシ基(例えば、ヒドロキシメチル)で置換されており;
R2はH、C1〜4アルキル、C1〜4アルコキシメチル又はベンジルオキシメチルであり、ここで当該ベンジル成分のフェニル環は任意にC1〜4アルコキシで置換されており;
R3及びR4は独立してH、C1〜3アルキル、C2〜3アルケニル又はC2〜3アルキニルであり、但し両方がHではなく、そして両方がHでない場合、それらの組み合わせた炭素の合計は4を超えず、又は
R3及びR4は炭素原子に対して結合し3又は4員の炭素環を形成し、それは任意に1個のO、SもしくはN原子を含み、そして任意にハロもしくはC1〜4アルキルで置換されており;そして
R5は置換されていないC3〜4アルキル、置換されていないC3〜6シクロアルキルもしくはC1〜4アルキルもしくはC3〜6シクロアルキルであり、ここで当該アルキル及びシクロアルキル基は、ハロ、ヒドロキシ、C1〜6アルコキシ、シアノ、C1〜4アルキルカルボニルオキシ、アミノカルボニルオキシ、モノ−又はジ(C1〜4)アルキルアミノカルボニルオキシ、−S(O)n(C1〜6)アルキル(ここでnは0、1又は2である)、トリアゾリル(例えば1,2,4−トリアゾール−1−イル)、トリ(C1〜4)アルキルシリルオキシ、任意に置換されたフェノキシ、任意に置換されたチエニルオキシ、任意に置換されたベンジルオキシ又は任意に置換されたチエニルメトキシで置換されており、ここで任意に、フェノキシ、チエニルオキシ、ベンジルオキシ及びチエニルメトキシの置換されたフェニル及び、チエニル環は任意に、1、2又は3個の、ハロ、ヒドロキシ、メルカプト、C1〜4アルキル、C2〜4アルケニル、C2〜4アルキニル、C1〜4アルコキシ、C2〜4アルケニルオキシ、C2〜4アルキニルオキシ、ハロ(C1〜4)アルキル、ハロ(C1〜4)アルコキシ、C1〜4アルキルチオ、ハロ(C1〜4)アルキルチオ、ヒドロキシ(C1〜4)アルキル、C1〜4アルコキシ(C1〜4)アルキル、C3〜6シクロアルキル、C3〜6シクロアルキル(C1〜4)アルキル、フェノキシ、ベンジルオキシ、ベンゾイルオキシ、シアノ、イソシアノ、チオシアネート、イソチオシアネート、ニトロ、−NRmRn、−NHCORm、−NHCONRmRn、−CONRmRn、−SO2Rm、−OSO2Rm、−CORm、−CRm=NRn又は−N=CRmRnから選択された置換基で置換されておりここで、Rm及びRnは独立して水素、C1〜4アルキル、ハロ(C1〜4)アルキル、C1〜4アルコキシ、ハロ(C1〜4)アルコキシ、C1〜4アルキルチオ、C3〜6シクロアルキル、C3〜6シクロアルキル(C1〜4)アルキル、フェニル又はベンジル、であり、当該フェニル及びベンジル基は任意にハロゲン、C1〜4アルキル又はC1〜4アルコキシで置換されている)化合物に関連する。 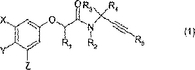 (もっと読む)
(もっと読む)
アミノニトリルの回収方法
【課題】 Strecker反応などにより得られたアミノニトリルを工業的に簡便な手段で且つ高収率で反応液から回収するための新規回収方法を提供する。
【解決手段】 アンモニアを含むアミノニトリル水溶液に、無機塩を添加した後、アンモニアを留去し、次いでアミノニトリル相を分離することを特徴とするアミノニトリルの回収方法。無機塩の添加量はアンモニアを含むアミノニトリル水溶液中の水分量に対して10〜40質量%が好ましく、アンモニアを含むアミノニトリル水溶液中のアミノニトリル含量とアンモニア含量のモル比が1:1〜10であることが好ましい。
(もっと読む)
11 - 20 / 21
[ Back to top ]


