新規制御エレメントを含むベクター
【課題】真核細胞において作動可能に連結された発現性核酸配列の非常に高レベルの発現を提供する転写エンハンサーを含む、新規のDNA分子およびベクターを提供する。
【解決手段】組換えタンパク質の高レベレの発現を得るために有用な、モルモットサイトメガロウイルス前初期プロモーター/エンハンサーに由来するプロモーター。異種遺伝子の真核生物細胞における発現は、RNAポリメラーゼIIによる転写を必要とするが、RNAポリメラーゼIIは、プロモーターおよびエンハンサーとして知られるcisに作用する遺伝的エレメントによって駆動される。
【解決手段】組換えタンパク質の高レベレの発現を得るために有用な、モルモットサイトメガロウイルス前初期プロモーター/エンハンサーに由来するプロモーター。異種遺伝子の真核生物細胞における発現は、RNAポリメラーゼIIによる転写を必要とするが、RNAポリメラーゼIIは、プロモーターおよびエンハンサーとして知られるcisに作用する遺伝的エレメントによって駆動される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、組換えDNA技術の分野に関し、そして具体的には、組換えタンパク質の発現のためのベクターの開発に関する。
【背景技術】
【0002】
異種遺伝子の真核生物細胞における発現は、多くの学術的用途および商業的用途を有する、生物工学の根本的な局面である。そのような遺伝子の発現は、RNAポリメラーゼII(Pol II)による転写を必要とする。Pol IIは、プロモーターおよびエンハンサーとして知られる、cisに作用する遺伝的エレメントによって駆動される。
【0003】
単純な用語において、プロモーターは、100未満(通常は、50未満)のヌクレオチド塩基対(bp)下流に位置する配列の転写を開始するように作用する指向性エレメントである。プロモーターは、転写の開始、および開始前(pre−initiation)複合体として公知のマルチサブユニット複合体のアセンブリに関与する種々のタンパク質のための結合部位として作用する、多数の短いコンセンサスヌクレオチド配列を含有する(非特許文献1)。ほとんどの遺伝子において、これは、TATAボックス(TATAAA)として公知の非常に広範に保存された配列において起こる。このTATAボックスに対して、TATAボックス結合タンパク質(TBP、一般的な転写因子であるTFIIDのサブユニット)が結合する。10を超えるさらなる転写因子の定序アセンブリが続き、最終的にPol IIホロ酵素複合体を形成する。RNA転写は、実際には、約25〜30ベース下流の開始部位において開始する(非特許文献2)。この開始部位にも、TBPは結合する。
【0004】
ほとんどの機能的プロモーターは、さらに上流プロモーターエレメント(UPS)を含有する。このUPSの中で、最も高度に保存されているのは、約70bp〜200bp上流のCAATボックス(CCAAT、転写因子CBF、C/EBPおよびNF−1に対する結合部位)、および類似の距離だけ上流のGCボックス(GGGCGG、一般的な転写因子であるSp−1に対する結合部位)である。基本的なレベルの転写はTATAボックスのみから起こるが、ほとんどのプロモーターについて、少なくともCAATボックスおよびGCボックスが、最適なレベルの転写のために必要とされる。
【0005】
エンハンサーは、非指向性に作用し、局所的に位置しているが必ずしも直接隣接するわけではない(数キロベース離れている)プロモーターからの転写を増加させる配列である(非特許文献3)。エンハンサーは、広範な転写活性化因子タンパク質に対する結合部位を代表する短い(8〜12bp)コンセンサス配列を含む(非特許文献4)。この転写活性化因子タンパク質は、プロモーターエレメントとも結合する、NF−1およびSP−1のようなものを含む。これらの配列は、しばしばタンデムの繰り返しまたは逆向きの繰り返しにおいて複製される。
【0006】
サイトメガロウイルスのような多くのDNAウイルスにおける非常に活性な前初期遺伝子転写単位を含む、いくつかの天然の転写単位では、エンハンサーエレメントおよびプロモーターエレメントは、効果的な1つの拡張された上流エレメントに、機能的に合わされ得る。
【0007】
プロモーターは、制御され得、細胞型、温度、金属イオンまたは他の因子に応答性であり得るか;または構成的であり得、そのような因子に応答しない転写を与え得る。多くの目的のため、全てではないにしても多くの細胞型において一貫した高い転写レベルを与える、強力で構成的なプロモーターは、非常に有利である。何年もの間、ヒトサイトメガロウイルスにおける前初期遺伝子発現を駆動するエンハンサー/プロモーターエレメントは、真核生物の発現ベクターにおける異種遺伝子のそのような発現を駆動するため、非常に広範に用いられてきた(非特許文献5)。
【0008】
ヒトサイトメガロウイルス(CMV)は、ベータヘルペスウイルス科のメンバーであり、かつ、胃腸感染および呼吸感染、肝炎、ならびに網膜炎の原因である。他のヘルペスウイルスと同様に、CMVは、潜伏感染中に存続し得、そして、免疫無防御状態の個体内で再活性化され得る。細胞培養において、ヒトCMVは、繊維芽細胞、上皮細胞および内皮細胞のような最終的に分化された細胞、ならびに単球由来のマクロファージ中で増殖的に複製する(非特許文献6およびそれらの参考文献)。
【0009】
増殖性感染の間、前初期(IE)、初期または後期と呼ばれている、CMV遺伝子セットの定序発現が存在する。ヒトCMV IE遺伝子は、複製の効率性において必須の役割を果たすと考えられている(非特許文献7に総説されている)。
【0010】
ヒトCMV IEプロモーターの上流領域は、三つの領域である調節領域、特有領域、およびエンハンサーに分けられる。上記エンハンサーはまた、遠位エンハンサーおよび近位エンハンサーに分けられる。上記の遠位プロモーターは、効率的なIE遺伝子の発現および低いMOIでのウイルス複製に必要である。ヒトCMVは、IE遺伝子の発現のための非常に強力なエンハンサーを有する。上記ヒトCMVは、NF-κB結合部位またはr
el結合部位を含む18bpの4回繰り返しエレメント、CREB結合部位またはATF結合部位、二つのAP−1結合部位、および複数のSP−1部位を含む19bpの5回繰り返しエレメントを有する(非特許文献8;非特許文献9)。上記のマウスCMVエンハンサーは、6つのNF-κB結合部位またはrel結合部位、1つのCREB結合部位ま
たはATF結合部位、および少なくとも7つのAP−1結合部位を含む(非特許文献10)。上記の異なるcisに作用するエレメントは、個別的または相乗的に作用して、上記プロモーター上の上記RNAポリメラーゼII転写開始複合体を安定化する。
【0011】
多くの場合、正確な分類および交差種の血縁の程度は、暫定的であるが、主に異種宿主に感染する多数のサイトメガロウイルスが、公知である。多数の霊長類動物種(アフリカミドリザル、アカゲザルおよびピグミーチンパンジーを含む)ならびに齧歯類動物(マウス、ラットおよびモルモットを含む)に感染するサイトメガロウイルス様ウイルスが、認識されている。上記サイトメガロウイルス様ウイルスのうちで、マウスプロモーターおよびラットプロモーターのみが、詳細な機能解析を受けている。それらの種とヒトCMVとの比較は、おそらくは、認識されていないcisに作用するエレメントであって、異種の細胞中の下流の転写に寄与するエレメントの存在のため、上記IEプロモーター−エンハンサーの機能が、直接比較できないことを示す(非特許文献11)。
【0012】
しかしながら、ヒトCMV IEプロモーター−エンハンサーとマウスCMV IEプロモーター−エンハンサーの両者は、真核生物発現ベクターにおいて異種遺伝子の高レベルの構成的発現を生じ、そして、生物工学において広く用いられる。上記ヒトCMVプロモーターのそのような使用は、特許文献1(Stinski/University of Iowa)に開示された。上記プロモーター、エンハンサー、および機能的に完全な5’(上流)非翻訳領域であって、上記ヒトサイトメガロウイルスの主要な前初期遺伝子における第1イントロンを含む非翻訳領域の使用が、特許文献2により特許請求されている(Bebbington/Celltech)。ここで、上記非翻訳領域は、その天然のDNAをコードする配列と直接的に連結していない。上記マウスCMV IEエンハンサーの使用は、特許文献3(Koszinowskiら)により開示されている。
【0013】
モルモットCMV(GPCMV)は、ヒトCMV感染の病理との多くの類似点を有するモルモットにおける疾患を生じる。GPCMVのゲノムを特徴づける試み(非特許文献12;非特許文献13)は、上記ゲノムの構成機構が、ヘルペスウイルスの間で特有であることを示唆した。ヒトCMVとマウスCMVとの類似したサイズにも関わらず、上記のGPCMVのゲノムは、ヒトCMVのゲノムよりもはるかに単純であって、かつ、マウスCMVのゲノムと最もよく似ていた。しかしながら、上記のGPCMVのゲノムは、特にその末端領域の構造において、いくつかの珍しい特徴を有していた。IE遺伝子発現の最新の研究は、ヒトCMVとの配列の比較によりIE領域を同定し(非特許文献14)、そして、IE転写産物の発現およびプロセシングが、解析された。しかしながら、異種遺伝子の発現のためのIEプロモーター−エンハンサーの有用性の解析は、存在しなかった。
【0014】
IE1コード配列の5’末端および上記上流プロモーター/エンハンサー領域を含む、GPCMVゲノムの「HRv」(HindIII−EcoRV)前初期上流フラグメントの配列は、配列決定され(非特許文献15)、そして、CMV IE制御領域に典型的な繰り返し配列の領域を含むことが示された。三つの短い繰り返しであるGP−1、GP−2およびGP−3が、同定された。GP−1は、9回存在し、NF-κB結合部位を含み、そしてHCMVの18bpの繰り返しに対応している、18bpの繰り返し(GGCCCGGGACTTTCCAコンセンサスに73〜100%類似する)である。GP−2は、10回存在し、共通のSRE(血清応答エレメント)に類似するコア配列を含む、17bpの繰り返し(TGTCCTTTTTGGCAAAコンセンサスに86〜100%類似する)である。GP−3は、その近位上流領域内で4回繰り返され、そしてc−junまたはGCN4のための結合部位として同定された配列であるGTGACTTTを含む(非特許文献16)。
【0015】
この研究は上記GPCMV IE上流領域が強力なプロモーターを含むことを示唆したが、レポーター構築物が作成される方法に起因して、特定のの人工物が除去され得なかった。第一に、上記HRvフラグメントは、上記IE1遺伝子の第1エキソン、および第1イントロンの一部を含む。このイントロンは、3コピーの推定NF-1結合部位を含み、
このことが、上記プロモーターの見かけの強度を人工的に押し上げ得る。第二に、上記GPCMVフラグメントを試験するために用いられるレポーター構築物は、SV40プロモーター(それ自体が、強力なウイルス性プロモーターである)を含んでいた。その結果、レポーターの発現は、二重のGPCMV/SV40プロモーターの効果の結果であった。結果として、一般的に、上記GPCMVエンハンサー/プロモーター単独と他の強力なプロモーターとの比較、または上記GPCMVエンハンサー/プロモーター単独と他のCMV IEエンハンサー/プロモーターとの比較ですら、行うことが不可能である。
【0016】
本明細書中に参考として援用される、本出願人の同時係属特許出願であるPCT/GB99/02357(特許文献4)は、天然のクロマチンの状況において、普遍的に発現されるハウスキーピング遺伝子から排他的に構成される位置にわたって開いたクロマチン構造を確立する役割を担うエレメントについて説明する。これらのエレメントは、遺伝子座制御領域(Locus Control Region)(LCR)に由来せず、かつ、広範なメチル化していないCpGアイランドを含む。用語「普遍的クロマチンオープンエレメント(Ubiquitous Chromatin Opening Element)(UCOE)」は、そのようなエレメントを説明するために用いられている。
【0017】
哺乳動物のDNAにおいて、ジヌクレオチドCpGは、シトシンを5−メチルシトシンにメチル化するDNAメチルトランスフェラーゼ酵素により認識される。しかしながら、5−メチルシトシンは不安定であり、チミンへ変換される。結果として、CpGジヌクレオチドは、偶然に予期するよりも極めて低頻度でしか存在しない。それにも拘らず、ゲノムDNAのうちのいくつかの部分は、予期されるものにより近い頻度のCpGを有し、これらの配列は、「CpGアイランド」として公知である。本明細書中に用いられる場合、「CpGアイランド」は、少なくとも200bpの、少なくとも50%のGC含量および少なくとも0.6の観察/予期CpG含量比率(すなわち、偶然に予期されるもののうちの少なくとも60%のCpGジヌクレオチド含量)を有するDNA配列として定義される(非特許文献17;非特許文献18)。
【0018】
メチル化していないCpGアイランドは、当該分野において周知であり(非特許文献19、非特許文献20)、そのシトシン残基の相当量がメチル化しておらず、通常二つの近くに位置した(0.1〜3kb)分岐転写される(divergently transcribed)遺伝子の5’末端にわたり広がる、メチル化していないCpGアイランドとして定義され得る。DNAのこれらの領域は、発達を通じて全組織において低メチル化されたままであることが報告されている(非特許文献21)。上記のメチル化していないCpGアイランドは、しばしば、普遍的に発現される遺伝子、ならびに組織限定的発現プロファイルを示す遺伝子のうちの推定40%の遺伝子の5’末端に結合される(非特許文献22;非特許文献23)。そして、上記のメチル化していないCpGアイランドは、活性化クロマチンの領域に局在されることが公知である(非特許文献24)。
【0019】
「広範な」メチル化していないCpGアイランドは、1より多い転写開始部位を含む領域にわたり広がり、かつ/または300bpより多く、そして好ましくは、500bpより多くに広がる、メチル化していないCpGアイランドである。上記広範なメチル化していないCpGアイランドの境界は、上記領域にわたり、エンドヌクレアーゼ制限酵素と組み合わせてPCRを使用することにより、機能的に規定される。上記エンドヌクレアーゼ制限酵素がそれらの認識配列でDNAを消化(切断)する能力は、存在する任意のCpGアイランドのメチル化状態に対して感受性である。そのような一つの酵素は、HpaIIである。HpaIIは、CpGアイランド内でよく見出されるCCGG部位を認識および切断するが、上記部位の中央のCG残基がメチル化されていない場合に限られる。従って、HpaIIで消化されたDNAを用いて、HpaII部位を有する領域にわたり行われたPCRは、そのDNAがメチル化されていない場合、HpaII消化に起因して増幅産物を生じない。DNAがメチル化されている場合にのみ、PCRは増幅産物を生じ得る。従って、HpaIIがDNAを消化しないメチル化していない領域を超えて、PCR増幅産物が観察され得、それによって、上記の「広範なメチル化していないCpGアイランド」の境界を規定し得る。
【0020】
国際出願で特許文献4は、ヒトTATA結合タンパク質(TBP)/プロテオソーム構成成分−B1(PSMBI)およびヘテロ核リボ核タンパク質A2/B1(hnRNPA2)/ヘテロクロマチンタンパク質1Hsγ(HP1Hsγ)遺伝子座由来の、二重の分岐転写されるプロモーターを含む、メチル化していないCpGアイランドにわたる領域が、増加されたレベルの遺伝子発現を作動可能に連結された遺伝子に与えることを実証する。活性的に転写されるプロモーターと結合されたメチル化していないCpGアイランドは、クロマチンを再構築する能力を所有し、それゆえ、ハウスキーピング遺伝子座でのオープンドメインを確立および維持する主要な決定因子と考えられている。
【0021】
UCOEは、導入遺伝子発現のレベルおよび安定性における改良を含む、生産的な遺伝子の組込み事象の割合の増加を与える。このことは、トランスジェニック動物および培養細胞における組換えタンパク質産物の生成を含む、重要な研究および生物工学的適用を有する。
【0022】
特許文献4は、およそ4.0kbの機能的UCOEフラグメント、特に、図21のヌクレオチド4102〜8286により規定される(第11頁の第6行および第7行に開示されている通りの)「5.5RNP」フラグメントを開示する。同じ出願が、「1.5RNP」フラグメント(図22および図29、第51頁の第1〜5行に記載されている誘導体)を開示する。しかしながら、この「1.5RNP」フラグメントは、実際には、上記出願の図21のヌクレオチド4102〜6267からなる、上記の「5.5RNP」フラグメントの2165bpのBamHI−Tth111Iフラグメントである。
【0023】
さらなる出願(特許文献5)は、人工的に構築された、天然に存在するCpGアイランドのフラグメントから構成されているUCOEを開示する。第三の出願(特許文献6)は、UCOEの小さな機能的フラグメントを含むポリヌクレオチドを開示する。そのようなポリヌクレオチドは、わずかおよそ2kbのメチル化されていないCpGアイランド、またはより大きなそのようなアイランドのせいぜいおよそ2kbのフラグメントを含む。
【特許文献1】米国特許第5,168,062号明細書
【特許文献2】米国特許第5,591,639号明細書
【特許文献3】米国特許第4,968,615号明細書
【特許文献4】国際公開第00/05393号パンフレット
【特許文献5】国際公開第02/24930号パンフレット
【特許文献6】国際公開第04/067701号パンフレット
【非特許文献1】MCKnight and Tjian,Cell,1987年,46,p.795−805
【非特許文献2】Breathnach and Chambon,Annu Rev Biochem,1981年,50:p.349−393
【非特許文献3】Kadonaga著、Cell、2004年、第116巻、p.247−257
【非特許文献4】Ondekら著、Science、1988年、第236巻、p.1237−1244
【非特許文献5】Foecking and Hoffstetter、Gene、1986年、第45巻、p.101−105
【非特許文献6】IsomuraおよびStinski著、J Virol、2003年、第77巻、p.3602−3614
【非特許文献7】CastilloおよびKowalik著、Gene、2002年、第290巻、p.19−34
【非特許文献8】Thomsenら著、Proc Natl Acad Sci USA、1984年、第81巻、p.659−663
【非特許文献9】MeierおよびStinski著、Intervirology、1996年、第39巻、p.331−342
【非特許文献10】Dorsch−Haslerら著、Proc Natl Acad Sci USA、1985年、第82巻、p.8325−8329
【非特許文献11】IsomuraおよびStinski著、J Virol、2003年、第77巻、p.3602−3614
【非特許文献12】Isomら著、J Virology、1984年、第49巻、p.426−436
【非特許文献13】GaoおよびIsom著、J Virology、1984年、第52巻、p.436−447
【非特許文献14】Yinら著、J Virol、1990年、第64巻、p.1537−1548
【非特許文献15】Yin著、「Guinea pig cytomegalovirus immediate−early gene expression」、PhD thesis、Pennsylvania State University、USA、1991年
【非特許文献16】Hillら著、Science、1984年、第234巻、p.451−457
【非特許文献17】Gardiner−Green MおよびFrommer M.著、J MoI Biol、1987年、第196巻、p.261−282
【非特許文献18】Rice P、Longden IおよびBleasby A著、Trends Genet、2000年、第16巻、p.276−277
【非特許文献19】Birdら著、Cell、1985年、第40巻、p.91−99
【非特許文献20】TaziおよびBird著、Cell、1990年、第60巻、p.909−920
【非特許文献21】WiseおよびPravtcheva著、Genomics、1999年、第60巻、p.258−271
【非特許文献22】Antequera、F. and Bird,A.著、Proc.Natl.Acad.Sci.USA、1993年、第90巻、p.1195−11999
【非特許文献23】Cross,S.H. and Bird,A.P.、Curr.Opin,Genet.Dev.、1995年、第5巻、p.309−314
【非特許文献24】Tazi,J. and Bird,A.、Cell、1990年、第60巻、p.909−920
【発明の概要】
【発明が解決しようとする課題】
【0024】
生物工学における組換えタンパク質発現の重要性を考慮すると、新規のプロモーター/エンハンサーの組み合わせを含む、改良された発現ベクターが、依然として必要である。
【課題を解決するための手段】
【0025】
(発明の要旨)
本明細書の説明および特許請求の範囲を通じて、用語「含む(comprise)」および「含む(contain)」および上記用語の改変(例えば、「含む(comprising)」および「含む(comprises)」)は、「を含むが、これに限定されない」ことを意味し、他の部分、付加物、構成要素、整数または工程を除外することを意図されていない(そして除外しない)。
【0026】
本明細書の内容がそうでないことを必要としない限り、単数形は、本明細書の説明および特許請求の範囲を通じて、複数形を包含する。特に、不定冠詞が用いられる場合、本明細書の内容がそうでないことを必要としない限り、本明細書は、単数形だけでなく複数形も企図するものとして理解されるべきである。
【0027】
本発明の特定の局面、実施形態または実施例と関連して記載される図、整数、特徴、化合物、化学部分または化学基は、それらと適合しない場合を除いて、本明細書中に記載される任意の他の局面、実施形態または実施例に適用可能であると理解される。
【0028】
本明細書中に用いられる場合、用語「作動可能に連結されている」は、本発明のポリヌクレオチドにおけるエレメント間の作動可能性の関係を指す。「作動可能に連結されている」は、当業者に周知の、cisに作用するDNA配列間の機能的関係を説明する用語である。正確な構造関係は、関連があることもあるし、ないこともあり、異なる型のエレメントについて相違する。プロモーターに関して、プロモーターは、そのプロモーターが駆動するオープンリーディングフレームに対して5’の、本質的に隣接した(通常、100bp未満内の)位置を包含する。広範なメチル化していないCpGアイランドの場合、クロマチン構造における領域的な効果は、遺伝子発現のレベルおよび一貫性の増加を担う。例として、広範なメチル化していないCpGアイランドを包含するエレメントは、上記の遺伝子の転写を制御する発現性エンハンサー/発現性プロモーターの5’位に位置し得る。しかしながら「作動可能に連結される」は、明確な機能的効果が示されている限り、それ以外の場所に位置する可能性を包含する。
【0029】
「機能的ホモログ」により、開示されている配列に対して、ストリンジェントな条件下でハイブリダイズする能力を有し、かつ、二つ以上の組織中にて作動可能に連結されている発現性オープンリーディングフレームの増加された発現を与える類似の性質を有する配列が、意味される。ストリンジェントなハイブリダイゼーション/洗浄条件は、当該分野において周知である。例えば、0.1×SSC、0.1%SDSにおいて60℃で洗浄の後に安定である核酸ハイブリッド。上記核酸の配列が公知である場合、最適なハイブリダイゼーション条件が計算され得ることは、当該分野において周知である。例えば、ハイブリダイゼーション条件は、ハイブリダイゼーションに供される核酸のGC含量により決定され得る。Sambrookら著(1989),Molecular Cloning;A Laboratory Approachを参照のこと。特定のホモロジーの核酸分子間のハイブリダイゼーションを達成するために必要とされるストリンジェンシー条件を計算するための一般式は、以下:
【0030】
【数1】

である。
【0031】
本発明の目的は、真核細胞において作動可能に連結された発現性核酸配列の非常に高レベルの発現を提供する転写エンハンサーを含む、新規のDNA分子およびベクターを提供することである。有利に、上記エンハンサーは、転写を増加させる、それらの天然に関連しているプロモーターおよび/または他の遺伝的エレメントと組み合わせて用いられ得る。
【0032】
本発明は、特に、組換えタンパク質の高レベルの発現を得るための、モルモットサイトメガロウイルス前初期プロモーター/エンハンサーおよび発現ベクターにおけるその使用に関する。本発明は、ヒトまたはマウスのCMV IEエンハンサー/プロモーターエレメントから入手可能なものよりも増加されたレベルの発現を多数の細胞型において提供する能力を有する真核生物の発現ベクターを提供する。
【0033】
モルモットサイトメガロウイルス前初期上流制御領域は、E1遺伝子のおよそ1500bp上流および、より具体的には、図1および配列番号1により開示されている配列からなる。この制御領域は、プロモーターエレメントおよびエンハンサーエレメントの双方を含む。「プロモーター」により、少なくとも図1(配列番号1)のヌクレオチド779〜880を含むフラグメントまたはその機能的ホモログである、転写開始部位(TATAボックスおよびCAATボックス)が意味される。
【0034】
従って、本発明は、図1および配列番号1に記載されるモルモットCMV前初期制御領域のうちの少なくとも100個、好ましくは200個、そしてより好ましくは少なくとも500個の連続したポリヌクレオチドを含む単離されたポリヌクレオチド、ならびに発現性ポリヌクレオチドの配列を提供する。該発現性ポリヌクレオチド配列の転写は、エンハンサーと遺伝子または他の発現性配列との間に位置するプロモーターによって駆動される。このプロモーターは、内因性のモルモットCMV前初期プロモーターまたは天然には上記エンハンサーと結合していない他の異種プロモーターであり得る。上記の発現性ポリヌクレオチド配列は、モルモットCMV前初期遺伝子ではなく、かつ、上記プロモーターと天然には作動可能に連結していない。環状の単離されたポリヌクレオチド(プラスミドベクターのような)の場合、「間」によって、直接的に作動可能に連結されているポリヌクレオチド配列の上流(そのセンス鎖に対して5’)および作動可能に連結されているエンハンサーの下流(3’)が意味されていることが、当業者によって理解され得る。そのような単離されたポリヌクレオチドが、(選択マーカーの発現に必要な配列または他のエレメントに関連する配列のような)目的の挿入された発現性配列の発現と関連していない他のプロモーターを含み得ることが、理解される。
【0035】
よって、上記の単離されたポリヌクレオチドは、以下
a) 配列番号1の少なくとも200個、好ましくは少なくとも500個の連続するヌクレオチドを含むエレメント、ならびに
b) 発現性ポリヌクレオチド配列を含むエレメント、を含み;
上記の単離されたポリヌクレオチドは、上記発現性ポリヌクレオチドのセンス鎖に対して5’から3’の方向で、エンハンサー、単一のプロモーター、および上記発現性ポリヌクレオチド配列を含み、ここで上記エンハンサーは、上記プロモーターに作動可能に連結され、上記エンハンサーは、上記発現性ポリヌクレオチド配列に直接的に作動可能に連結され、ここで上記プロモーターは、天然には上記発現性ポリヌクレオチド配列に作動可能に連結されていないことによって特徴づけられる。
本発明はまた、以下の項目を提供する。
(項目1)
単離されたポリヌクレオチドであって、以下
a.配列番号1の少なくとも200個の連続するヌクレオチドを含むエレメントであって該200個の連続するヌクレオチドは、プロモーターおよび/またはエンハンサーエレメントを含む、エレメント、ならびに
b.発現性ポリヌクレオチド配列を含むエレメント
を含み、該単離されたポリヌクレオチドは、該発現性ポリヌクレオチドのセンス鎖に対して5’から3’の方向で、エンハンサー、単一のプロモーター、および該発現性ポリヌクレオチド配列を含み、ここで該エンハンサーは該プロモーターに作動可能に連結され、該プロモーターは該発現性ポリヌクレオチド配列に直接的に作動可能に連結され、ここで該プロモーターは、天然には該発現性ポリヌクレオチド配列に作動可能に連結されていない、単離されたポリヌクレオチド。
(項目2)
配列番号1の少なくとも500個の連続するヌクレオチドを含む、項目1に記載の単離されたポリヌクレオチド。
(項目3)
配列番号1のヌクレオチド50〜550を含む、項目1または2のいずれか1項に記載の単離されたポリヌクレオチド。
(項目4)
配列番号1のヌクレオチド275〜775を含む、項目1または2のいずれか1項に記載の単離されたポリヌクレオチド。
(項目5)
発現性核酸配列に直接的に作動可能に連結されたモルモットCMVの前初期制御領域由来のプロモーターを含み、該プロモーターは、天然には該発現性核酸配列に作動可能に連結されていない、項目1または2のいずれか1項に記載の単離されたポリヌクレオチド。
(項目6)
配列番号1のヌクレオチド679〜880を含む、項目5に記載の単離されたポリヌクレオチド。
(項目7)
配列番号1のヌクレオチド1〜887を含む、項目1〜6のいずれか1項に記載の単離されたポリヌクレオチド。
(項目8)
上記発現性核酸配列に作動可能に連結された、広範なメチル化していないCpGアイランドをさらに含む、項目1〜7のいずれか1項に記載の単離されたポリヌクレオチド。
(項目9)
項目1〜8のいずれか1項に記載のポリヌクレオチドを含む、ベクター。
(項目10)
項目9に記載の、真核生物発現ベクター。
(項目11)
配列番号2のヌクレオチド1〜1003、および1747〜5749のポリヌクレオチド配列を含む、項目9または項目10のいずれか1項に記載のベクター。
(項目12)
配列番号3のヌクレオチド1〜9328、および10072〜14119を含む、項目9または項目10のいずれか1項に記載のベクター。
(項目13)
配列番号4のヌクレオチド1〜2592、および3336〜7383を含む、項目9または項目10のいずれか1項に記載のベクター。
(項目14)
項目1〜5のいずれか1項に記載の単離されたポリヌクレオチド、または項目11〜13のいずれか1項に記載のベクターを含む、宿主細胞。
(項目15)
ポリペプチドを発現させる方法であって、該ポリペプチドをコードする発現性核酸配列を項目11〜13のいずれか1項に記載の発現ベクターに挿入し、該ベクターを適切な宿主細胞に挿入する工程、および該宿主細胞を、発現を可能にする適した条件において培養する工程、を包含する、方法。
(項目16)
上記ポリペプチドは、治療的に有用なポリペプチドである、項目15に記載の方法。
(項目17)
上記ポリペプチドは、免疫グロブリン、免疫グロブリンの機能的エピトープ結合フラグメント、成長因子、可溶性レセプターおよび血液凝固因子からなる群より選択される、項目16に記載の方法。
(項目18)
項目1〜8のいずれか1項に記載のポリヌクレオチド、項目11〜13のいずれか1項に記載のベクター、または項目14に記載の宿主細胞と、薬学的に受容可能なキャリア、賦形剤、緩衝液または媒体とを含む、薬学的調製物。
【図面の簡単な説明】
【0036】
【図1】図1は、GPCMV IEエンハンサー/プロモーター(配列番号1)のヌクレオチド配列を示す。転写因子AP−1、NF-κB、SRFおよびGCN4の潜在的結合部位が、CAATボックスおよびTATAボックス、CRS開始部位および転写開始(矢印)と共に示されている。
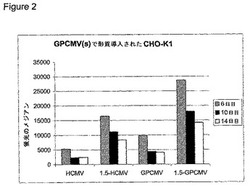
【図2】図2は、CHO−K1細胞において多数のEGFPレポーター構築物で得られた発現レベルを示す。この発現レベルは、FACSにより測定された場合の蛍光のメジアンとして表されている。結果は、1.5kbのhnRNP UCOEエレメントを含む、および含まない、ヒトCMV IEエンハンサー/プロモーターとモルモットCMV IEエンハンサー/プロモーターとを比較する。
【図3】図3は、強化緑色蛍光タンパク質レポーター遺伝子(EGFP)の発現を駆動するGPCMV IEエンハンサー/プロモーターを含むレポータープラスミドCET 1005 GPCMV−EGFPのマップを示す。上記の真核生物の選択マーカーは、マウスのホスホグリセレートキナーゼプロモーターから発現されるピューロマイシン耐性遺伝子である。上記の原核生物の選択マーカーは、アンピシリン耐性である。
【図4】図4は、レポータープラスミドCET 1015 8kb−GPCMV−EGFPのマップを示す。これは、CET 1015 GPCMV−EGFPと類似しており、GPCMV IEエンハンサー/プロモーターの上流に8kbのhnRNP UCOEエレメントが付加されている。
【図5】図5は、レポータープラスミドCET 1015 1.5kb−GPCMV−EGFPのマップを示す。これは、CET 1015 8kb−GPCMV−EGFPと類似しており、8kbのhnRNP UCOEエレメントが1.5kbのhnRNP UCOEエレメントで置換されている。
【図6】図6は、HEK293細胞(せん断されたアデノウイルス5型DNAで形質転換されたヒト胚性腎細胞)におけるヒトCMV IEエンハンサー/プロモーターエレメントにより駆動されるEGFPの発現と、モルモットCMV IEエンハンサー/プロモーターにより駆動されるEGFPの発現とを比較する。
【図7】図7は、ルシフェラーゼに基づいたレポーター構築物を用いた同様の比較を示す。
【発明を実施するための形態】
【0037】
好ましくは、上記の単離されたポリヌクレオチドは、ヌクレオチド50〜550を含む前初期制御領域の5’フラグメント、または代替的に、ヌクレオチド275〜775を含む3’フラグメントを含む。そのようなフラグメントは、内因性プロモーターを含ずに、機能的エンハンサーフラグメントを含む。
【0038】
従って、一実施形態では、本発明の単離されたポリヌクレオチドは、少なくとも、発現性ヌクレオチド配列に直接的に作動可能に連結されている(天然には作動可能に連結されていない)モルモットCMV前初期制御領域由来のプロモーターを含む。この該プロモーターは、好ましくは、配列番号1のヌクレオチド779〜880を含む。「直接的に作動可能に連結されている」によって、上記遺伝子または他の発現性核酸は上記プロモーターにより直接的に駆動されることが、意味されている。
【0039】
好ましくは、上記の単離されたポリヌクレオチドは、モルモットCMVの主要前初期制御領域をさらに含み、より好ましくは、配列番号1のヌクレオチド1〜887を含む。
【0040】
一つの好ましい実施形態では、上記の単離されたポリヌクレオチドは、記発現性核酸配列に作動可能に連結されている広範なメチル化していないCpGアイランドをさらに含む。より好ましくは、上記の広範なメチル化していないCpGアイランドは、一つ以上のさらなるプロモーター、特に分岐して転写する二重プロモーターまたは二指向性プロモーターを含む。よって、本発明は、上記発現性ポリヌクレオチドに作動可能に連結している、図1(配列番号1)の少なくとも200個の連続するヌクレオチドを含み、さらに上記発現性ポリヌクレオチド配列に作動可能に連結されている広範なメチル化していないCpGアイランドを含む、単離されたポリヌクレオチドを提供する。そのような広範なメチル化していないCpGアイランドは、簡便に、上記エンハンサー配列の隣に、および上流に位置され得る。好ましくは、そのような単離されたポリヌクレオチドは、図1(配列番号1)の少なくとも500個の連続するポリヌクレオチド、より好ましくは、ヌクレオチド50〜550を含む前初期制御領域の5’フラグメント、または、代替的に、ヌクレオチド275〜775を含む3’フラグメントを含む。最もより好ましくは、そのような単離されたポリヌクレオチドは、配列番号1のヌクレオチド1〜887を含む。
【0041】
一実施形態では、上記の広範なメチル化していないCpGアイランドは、ヒトTATA結合タンパク質遺伝子ならびに5’隣接配列および3’隣接配列の各12kb、またはそれらの機能的フラグメントにわたる44kbのDNAフラグメントを含む。好ましくは、上記の機能的フラグメントは、1kbの5’隣接配列および5kbの3’隣接配列を有するヒトTATA結合性タンパク質遺伝子、またはそれらの機能的フラグメントにわたる25kbのDNAフラグメントを含む。より好ましくは、TATA結合タンパク質遺伝子関連の広範なメチル化していないCpGアイランドの機能的フラグメントは、多くても2kbであり、さらに好ましくはわずか1kbであり、最も好ましくは、987bpのBspE1−Esp31制限フラグメントを含む。
【0042】
第二の実施形態では、上記の広範なメチル化していないCpGアイランドは、30kbの5’隣接配列および20kbの3’隣接配列を有するヒトhnRNP A2遺伝子、またはそれらの機能的フラグメントにわたる60kbのDNAフラグメントを含む。好ましくは、上記の機能的フラグメントは、5kbの5’隣接配列および1.5kbの3’隣接配列を有するヒトhnRNP A2遺伝子にわたる16kbのDNAフラグメント、より好ましくは、わずか2kbの、より好ましくはわずか1.6kbの、1546bpのEsp3I制限酵素フラグメントを含むヒトhnRNP A2遺伝子のフラグメントを含む。好ましくは、そのフラグメントは、フォワード方向を向いている。
【0043】
第三の実施形態では、本発明の単離されたポリヌクレオチドは、好ましくはヒト起源の、βアクチン CpGアイランド/プロモーター領域のフラグメント、より好ましくは、上記のヒトβアクチン CpGアイランド/プロモーター領域にわたる100bp〜2kbの範囲内のDNAフラグメントを含む。
【0044】
第四の実施形態では、本発明の単離されたポリヌクレオチドは、好ましくはヒト起源の、PDCD2 CpGアイランド/プロモーター領域のフラグメント、より好ましくは、上記のヒトPDCD2 CpGアイランド/プロモーター領域にわたる100bp〜2kbの範囲内のDNAフラグメントを含む。
【0045】
最後の代替的実施形態では、上記の広範なCpGリッチのメチル化していないCpGアイランドは、ヒトβアクチン CpGアイランド/プロモーター領域にわたる100bp〜1.9kbの範囲内のDNAフラグメント、およびヒトPDCD2 CpGアイランド/プロモーター領域にわたる100bp〜2kbの範囲内のDNAフラグメントを含む、天然には存在しない人工配列である。好ましくは、上記のフラグメントは、多方向に向けられたそれらのプロモーターに直接的に隣接している。
【0046】
さらなる局面では、本発明は、上述の単離されたポリヌクレオチドを含むベクターを提供する。上記ベクターは、DNAを細胞へ移す能力を有する任意のベクターであり得る。好ましくは、上記ベクターは、真核生物の発現ベクターである。そのようなベクターは、真核細胞において転写を指向および促進する能力を有するプロモーターおよびエンハンサーのようなエレメントを含む。上記エレメントはまた、好ましくは、それらの機能を促進または最適化する他の特徴も含む。そのような特徴としては、上記の適切な真核生物宿主細胞中、および上記ベクター自体を製造するために用いられる原核細胞中でも複製を可能にするために選択される複製起点、いずれかの細胞型において上記ベクターを含む細胞を選択することを可能にする一つ以上の選択マーカー(しばしば、抗生物質または毒素に対する耐性を与える)、上記ベクターまたはその組み込まれたフラグメントの複製を可能にするエレメント、ならびに所望のポリペプチド産物をコードする発現性ポリヌクレオチド配列(一般的に、「インサート」と呼ばれる)の簡単な挿入を可能にするための、主要なエンハンサー/プロモーターの下流に簡便に位置されるポリリンカーまたはマルチクローニング部位が挙げられる。そのような改良は、当該分野において周知である。
【0047】
好ましくは、上記ベクターは、組込み型ベクターまたはエピソームベクターである。
【0048】
好ましい組込み型ベクターとしては、組換えレトロウイルスベクターが挙げられる。組換えレトロウイルスベクターは、レトロウイルスゲノムの少なくとも一部のDNAを含み、この部分は、その標的細胞に感染する能力を有する。用語「感染」は、ウイルスが遺伝的物質をその宿主細胞または標的細胞へ移すプロセスを意味するために用いられる。好ましくは、本発明のベクターの構築に用いられるレトロウイルスはまた、上記標的細胞におけるウイルス複製の影響を除去するために複製欠損にされる。そのような場合、上記複製欠損ウイルスのゲノムは、慣習的な技術に従ってヘルパーウイルスによってパッケージングされ得る。一般的に、感染性および機能遺伝子伝達能という上記の基準を満たす任意のレトロウイルスが、本発明の実施において採用され得る。
【0049】
適切なレトロウイルスベクターとしては、当業者に周知のpLJ、pZip、pWeおよびpEMが挙げられるが、これらに限定されない。複製欠損レトロウイルスのための適切なパッケージングウイルス株としては、例えば、ΨCrip、ΨCre、Ψ2およびΨAmが挙げられる。
【0050】
本発明に有用な他のベクターとしては、アデノウイルス、アデノ随伴ウイルス、SV40ウイルス、ワクシニアウイルス、HSVおよびポックスウイルスが挙げられる。好ましいベクターは、上記アデノウイルスである。アデノウイルスベクターは、当業者に周知であり、そして、気道上皮、骨格筋、肝臓、脳および皮膚を含む多数の細胞型への遺伝子を送達するために用いられてきた(Hittら著,1997;Anderson,1998)。
【0051】
さらに好ましいベクターは、上記アデノ随伴(AAV)ベクターである。AAVベクターは、当業者に周知であり、そして、ヒトTリンパ球、繊維芽細胞、鼻ポリープ、骨格筋、脳、赤血球および遺伝子治療適用の造血幹細胞を安定的に伝達するために用いられてきた。国際特許出願である、国際公開91/18088号パンフレットは、特定のAAVに基づくベクターを開示している。
【0052】
好ましいエピソームベクターは、一過性の複製しないエピソームベクター、およびEBV、ヒトパポバウイルス(BK)およびBPV−1由来のもののようなウイルス性複製起点に由来する機能を有する自己複製するエピソームベクターを含む。そのような組込み型ベクターおよびエピソームベクターは、当業者に周知であり、かつ、当業者に周知の文献本体中に十分に説明されている。特に、適切なエピソームベクターは、国際公開98/07876号パンフレットに開示されている。
【0053】
哺乳動物の人工的染色体も、本発明におけるベクターとして用いられ得る。哺乳動物の人工的染色体は、Calos(1996)によって議論されている。
【0054】
好ましい実施形態では、本発明のベクターは、プラスミドである。上記プラスミドは、非複製、非組込み型プラスミドであり得る。
【0055】
本明細書中に用いられる場合、用語「プラスミド」は、発現性遺伝子をコードする任意の核酸を指し、そして、線状の核酸または環状の核酸、および二本鎖核酸または一本鎖核酸を含む。上記核酸は、DNAまたはRNAあり得、改変されたヌクレオチドまたはリボヌクレオチドを含み得、そしてメチル化、あるいは保護基またはキャップ構造もしくはテイル構造を含めるような方法により化学的に改変され得る。
【0056】
非複製の、非組込み型プラスミドは、宿主細胞に形質導入されるときに、複製せず、かつ上記宿主細胞ゲノムに特異的に組込みをしない(すなわち、高頻度で組込みをせず、かつ特定の部位で組込みをしない)核酸である。
【0057】
本発明のベクターの極めて好ましい実施形態は、配列番号2のヌクレオチド1〜1003および1747〜5749;配列番号3のヌクレオチド1〜9328および10072〜14119;または配列番号4のヌクレオチド1〜2592および3336〜7383を含み、この実施形態は、全長配列によってコードされた例示的な強化緑色蛍光タンパク質レポーターの代わりに、発現性配列を挿入するために適切な発現ベクターである。
【0058】
本発明はまた、本発明のベクターで形質導入された宿主細胞も提供する。上記宿主細胞は、任意の真核細胞であり得る。好ましくは、上記宿主細胞は、哺乳動物細胞、より好ましくはヒト細胞または齧歯類細胞である。
【0059】
核酸濃縮剤の使用、エレクトロポレーション、アスベスト、ポリブレン、DEAEセルロース、デキストラン、リポソーム、陽イオン性リポソーム、リポポリアミン、ポリオルニチンとの複合化、粒子線照射、および直接的なマイクロインジェクションを含む多数の技術が公知であり、かつ、本発明に従って、本明細書中に記載されているベクターを細胞へ送達するために有用である。
【0060】
本発明のベクターは、宿主細胞へ非特異的または特異的に(すなわち、宿主細胞の指定されたサブセットへ)、ウイルス性または非ウイルス性の送達手段を介して輸送され得る。ウイルス起源の好ましい送達方法としては、本発明のベクターの形質導入レシピエントとしてのウイルス粒子生成パッケージング細胞株が挙げられる。上記パッケージング細胞株には、アデノウイルス、ヘルペスウイルスまたはパポバウイルスのもののようなウイルス性パッケージングシグナルが組み込まれている。好ましい非ウイルス性ベースの遺伝子送達手段または方法もまた、本発明において用いられ得、かつ、直接的な裸の核酸の注入、核酸濃縮ぺプチドおよび非ペプチド、カチオン性リポソームならびにリポソームにおける被包化を含み得る。
【0061】
本発明によるベクターの送達は、核酸濃縮ペプチドを用いることが企図される。上記ベクターを濃縮し、かつ上記ベクターを細胞に輸送するために特に有用な、核酸濃縮ペプチドは、国際特許出願である国際公開第96/41606号パンフレットに開示されている。国際公開第96/41606号パンフレットに記載されている通り、官能基は、ベクターの送達に有用なペプチドに結合され得る。これらの官能基は、モノクローナル抗体、インスリン、トランスフェリン、アシアログリコプロテインまたは糖のような、特定の細胞型を標的とするリガンドを含み得る。従って、上記リガンドは、非特異的な様式で細胞を標的としてもよいし、細胞型に制限された特異的様式で細胞を標的としてもよい。
【0062】
上記官能基はまた、パルミトイル、オレイルまたはステアロイルのような脂質;ポリエチレングリコール(PEG)またはポリビニルピロリジン(PVP)のような中性親水性ポリマー;インフルエンザウイルスのHAペプチドのような融合性(fusogenic)ペプチド;またはリコンビナーゼもしくはインテグラーゼを含み得る。上記官能基は、核局在配列(NLS)のような細胞内輸送タンパク質、膜破壊性ペプチドのようなエンドソーム離脱シグナル、またはタンパク質を直接的にその細胞質へ方向付けるシグナルも含み得る。
【0063】
本発明はさらに、本明細書中に記載されている単離されたポリヌクレオチドまたはベクターを含む宿主細胞を提供する。好ましくは、上記細胞は、真核生物細胞、より好ましくは哺乳動物細胞、さらに好ましくは、ヒト細胞または齧歯類細胞である。
【0064】
さらなる局面では、本発明は、発現性ポリヌクレオチド、好ましくは、ポリペプチドをコードする発現性ポリヌクレオチドを発現する方法を提供する。この方法は、本発明による単離されたポリヌクレオチドを、本明細書中に記載されている適切な発現ベクターに挿入する工程、およびさらに上記ベクターを本明細書中に記載されている適切な宿主細胞に挿入する工程、および上記宿主細胞を発現させるのに適した条件において培養する工程を包含する。
【0065】
好ましくは、上記ポリペプチドは、治療上有用なポリペプチドであり、好ましくは、免疫グロブリンまたは免疫グロブリンの機能的エピトープ結合性フラグメント、増殖因子、受容体またはその溶解性フラグメント、および血液凝固因子からなる群から選択される。
【0066】
本発明によるポリヌクレオチド、ベクターまたは宿主細胞と、薬学的に受容可能なキャリア、賦形剤、緩衝液または媒体とを含む薬学的調製物もまた、提供される。
【実施例】
【0067】
(実施例1)
(hCMVプロモーターまたはgpCMVプロモーターのいずれかを含むベクターを用いて安定的に形質転換した、CHO−K1細胞の生成)
上記プラスミド構築物を、以下の通り生成した。アンピシリン耐性遺伝子を、pBluescript(登録商標)(Stratagene)からPCRにより、プライマー
【0068】
【数2】

の各末端にNruI部位を組み込みながら単離した。PCR産物を、pMaeII(Nucleic Acids Research 2001 29:E26)のPvuII部位に挿入し、pCA1を生成した。以下のオリゴヌクレオチド:
【0069】
【数3】

をアニーリングさせ(1と2;3と4;5と6;そしてその後、これらの三つの二量体を一緒にアニーリングさせた)、そして、上記オリゴヌクレオチドを、pCA1のXhoI部位とNotI部位の間のマルチクローニング部位を置換するために用い、これらの部位を構築の間に破壊した。これにより、pCA1MCSを生成した。AgeI部位を、AgeI制限酵素切断し、次いでT4 DNA ポリメラーゼを用いて平滑末端化(blunting)し、再ライゲーションすることにより、pPGK−Puro−bgh内のPGKプロモーターから欠失させた。上記PGKのピューロマイシンpAカセットを、EcoRI−XhoIフラグメントとしてこのベクターから除去し、そして、同様にEcoRIおよびXhoIで消化したpCA1MCSにライゲーションさせた。このベクターをpCIA−Puro(CET 1000)と命名した。pCIA−Puro内のbghpAを、HSVのTkpAで置換した。上記のHSVのTk polyAを、BstBI−Eco1091フラグメントとしてpEGFP−N1から除去し、T4 DNA ポリメラーゼで平滑末端化し、そして、SacIで消化してT4 DNA ポリメラーゼで平滑末端化したpCIA−Puroにライゲーションした。このベクターを、CET 1005と命名した。
【0070】
pCET1005 1.5kb−GPCMV−EGFPを構築するために、1.5kb hnRNP UCOEフラグメントを、BsmBIを用いて(上記のように)PCET20から切除し、T4 ポリメラーゼで平滑末端化し、そしてpEGFP−N1の平滑末端XhoI部位(Clontech,Palo Alto,CA,USA)にクローニングして、pEGFP−N1 1.5kb−EGFPを生成した。その後NheI(平滑末端)/NotIを用いて、2.4kbの「hnRNP−EGFP」カセットを、このプラスミドから切除し、そして、SwaI/NotIで消化したpCET1005−EGFPの骨格にサブクローニングして、pCET10051.5kb−EGFPを生成した。その後、GPCMVプロモーターを、NheIおよびEcoRIを用いてpPCRScript GPCMV(Geneart,Regensburg,Germanyにより合成された)から切除し、平滑末端化し、そして、このプラスミドの平滑末端BamHIにサブクローニングして、pCET1005 1.5kb−GPCMV− EGFPを生成した。PmeI/SacIを用いて1.5kb hnRNP UCOEを切除し、平滑末端化し、そしてその骨格を再ライゲーションすることにより、pCET1005 GPCMV− EGFPを生成した。
【0071】
pCET1005 8kb−GPCMV−EGFPを構築するために、pCET1005 1.5kb−GPCMV−EGFPの5.3kbのSacI(平滑末端)/PacIフラグメントを、AscI(平滑末端)/PacIで消化したpCET1005骨格にサブクローニングした。pCET20由来の平滑末端化した1.5kb hnRNP BsmBIフラグメントをpCET1005−EGFPの平滑末端ClaI部位にサブクローニングすることにより、プラスミドpCET1005 1.5kb−HCMV−EGFPを構築した。
【0072】
CHO−K1細胞を、10%のFoetal Calf Serum(Invitroge,UK)ならびに5U/mlのペニシリンおよび5U/mlのストレプトマイシンの混合物(Sigma,UK)を補充したF12(HAM)栄養混合物(Gibco,UK)中にて維持した。CHO−K1の安定した形質導入のため、プラスミドを、PciIで線状化し、フェノール;クロロホルム;イソアミルアルコールおよびクロロホルム中に抽出し、エタノール中に沈殿させ、そして、滅菌水中に0.25μg/μlの濃度で再懸濁した。滅菌エレクトロポレーションキュベットにおいてて、線状化した等モル量のプラスミドを、滅菌水中にて希釈して25μlとし(pCET1005−EGFP 1.39μg、pCET1005 1.5kb−HCMV−EGFP 1.78μg、pCET1005 GPCMV−EGFP 1.45μg、pCET1005 1.5kb−GPCMV−EGFP 1.85μg)、そして250μlの増殖倍地中にて5×106個のCHO−K1細胞と混合した。15分間の氷上でのインキュベーションの後、上記細胞を、250V/975μF(BioRad Gene Pulser IITM)でエレクトロポレーションし、そして室温でさらに10分間インキュベートした。細胞を10mlの増殖培地に移し、遠心分離により回収し、そして、計50mlの増殖培地で225cm2組織培養フラスコへ移した。ピューロマイシン(Sigma,UK)を12.5μg/mlの濃度まで添加する前に、細胞を、24時間37℃にて5%CO2インキュベーター内でインキュベートした。安定な形質導入株を回収し、(選択を維持するための)6ウェルの組織培養ディッシュ内にて継代培養し、そして、EGFPを可視化するためのFL1チャネルを用いた蛍光活性化細胞選別により解析する前に、細胞を(4日後に選択培地を交換しながら)8日間培養した。図2は、gpCMVを含む二つの構築物であるpCET1005 GPCMV−EGFP(図3)およびpCET1005 1.5kb−GPCMV−EGFP(図5)が、それぞれhCMVプロモーターを用いる構築物であるpCET1005−EGFPおよびpCET1005−1.5kb−HCMV−EGFPよりも高いレベルまでトランスジーンを発現するプールを生成することを明確に示す。
【0073】
(実施例2)
HEK293細胞を、10%のFoetal Calf Serumならびに5U/mlのペニシリンおよび5U/mlのストレプトマイシンの混合物(Sigma,UK)を補充したDulbecco’s Modified Eagle Medium(DMEM;Sigma,UK)中にて維持した。安定した形質導入のため、HEK293細胞を、6ウェルディッシュ内にて1×106個の細胞/ウェルの密度で播種し、そして、24時間37℃にて5%CO2インキュベーター内でインキュベートした。その後、細胞を、(PciIで線形化した)4μgの上記に示されたプラスミド(pCET1005−EGFPまたはpCET1005−gpCMV−EGFP)で、10μlのLipofectamine 2000(Invitrogen,UK)を用いて形質導入した。上記DNAおよびLipofectamine 2000を、別々に250μlのOptiMEM I(Gibco,UK)中にて希釈し、室温での5分間のインキュベーションの後、一緒に混合し、そしてさらに20分間インキュベートした。増殖培地を、15%のFCSを補充した1mlのOptiMEM Iで交換し、その後、上記のDNA/Lipofectamine 2000混合物を添加した。10%のFCSを補充した3.5mlのOptiMEM Iを添加する前に、細胞を、37℃で5%CO2インキュベーター内で5時間インキュベートした。細胞を、次いで37℃にて5%CO2インキュベーター内で24時間インキュベートし、その後、細胞を回収し、0.5μg/mlのピューロマイシンを補充した全50mlのDMEM増殖培地において225cm2組織培養フラスコへ移した。安定な形質導入株を遠心分離により回収し、(選択を維持するための)6ウェルの組織培養ディッシュ内にて継代培養し、そして、EGFPを可視化するためのFL1チャネルを用いた蛍光活性化細胞選別により解析する前に、細胞を、(3〜4日毎に選択培地を交換しながら)約14日間増殖させた。図6は、gpCMV構築物で生成したプールが、hCMV構築物で生成したプールよりも3倍〜4倍高いEGFPの発現レベルを与えることを示す。
【0074】
(実施例3)
CHO−K1細胞を、実施例1に記載の通りに培養した。1.5×105個のCHO−K1細胞を、形質導入の12時間前に12ウェルへ播種した。24時間後に、細胞を、1.5μlのFUGENE(Roche,UK)を用いて1μgのルシフェラーゼレポータープラスミド(phCMV−LucまたはpgpCMV−Luc)で形質導入した。形質導入のために、FUGENEおよびDNAの双方を、別々にOpti−MEM I(Invitrogen)中にて希釈し、一緒に混合し、そして、上記細胞に添加する前に30分室温でインキュベートした。ルシフェラーゼの発現を、24時間後に、Berthold luminometer(Berthold,Wildbad,Germany)を用いて解析した。一般的に、細胞の溶解およびルシフェラーゼレポーターアッセイを、上述(Lipinskiら著,Gene Therapy,2001(8):274−281)のように行った。形質導入は三連で行い、一つの代表的な実験結果の平均値および標準偏差を示している(図7)。明らかに、gpCMVベクターは、hCMVプラスミドよりも少なくとも2倍活性のルシフェラーゼであった。
【0075】
プラスミドhCMV−Lucは、上述されている(Lipinskiら著,Gene Therapy,(2001)8:274−281)。プラスミドgpCMV−Lucを、pCRScript/gpCMV(customer gene synthesis company:Geneart,Regensburg,Germany)由来のNdeI/EcoRIフラグメントを調製することにより生成し、そして、このgpCMVプロモーターフラグメントをPGL3basic(Promega)の平滑末端XhoI部位にクローニングした。
【技術分野】
【0001】
本発明は、組換えDNA技術の分野に関し、そして具体的には、組換えタンパク質の発現のためのベクターの開発に関する。
【背景技術】
【0002】
異種遺伝子の真核生物細胞における発現は、多くの学術的用途および商業的用途を有する、生物工学の根本的な局面である。そのような遺伝子の発現は、RNAポリメラーゼII(Pol II)による転写を必要とする。Pol IIは、プロモーターおよびエンハンサーとして知られる、cisに作用する遺伝的エレメントによって駆動される。
【0003】
単純な用語において、プロモーターは、100未満(通常は、50未満)のヌクレオチド塩基対(bp)下流に位置する配列の転写を開始するように作用する指向性エレメントである。プロモーターは、転写の開始、および開始前(pre−initiation)複合体として公知のマルチサブユニット複合体のアセンブリに関与する種々のタンパク質のための結合部位として作用する、多数の短いコンセンサスヌクレオチド配列を含有する(非特許文献1)。ほとんどの遺伝子において、これは、TATAボックス(TATAAA)として公知の非常に広範に保存された配列において起こる。このTATAボックスに対して、TATAボックス結合タンパク質(TBP、一般的な転写因子であるTFIIDのサブユニット)が結合する。10を超えるさらなる転写因子の定序アセンブリが続き、最終的にPol IIホロ酵素複合体を形成する。RNA転写は、実際には、約25〜30ベース下流の開始部位において開始する(非特許文献2)。この開始部位にも、TBPは結合する。
【0004】
ほとんどの機能的プロモーターは、さらに上流プロモーターエレメント(UPS)を含有する。このUPSの中で、最も高度に保存されているのは、約70bp〜200bp上流のCAATボックス(CCAAT、転写因子CBF、C/EBPおよびNF−1に対する結合部位)、および類似の距離だけ上流のGCボックス(GGGCGG、一般的な転写因子であるSp−1に対する結合部位)である。基本的なレベルの転写はTATAボックスのみから起こるが、ほとんどのプロモーターについて、少なくともCAATボックスおよびGCボックスが、最適なレベルの転写のために必要とされる。
【0005】
エンハンサーは、非指向性に作用し、局所的に位置しているが必ずしも直接隣接するわけではない(数キロベース離れている)プロモーターからの転写を増加させる配列である(非特許文献3)。エンハンサーは、広範な転写活性化因子タンパク質に対する結合部位を代表する短い(8〜12bp)コンセンサス配列を含む(非特許文献4)。この転写活性化因子タンパク質は、プロモーターエレメントとも結合する、NF−1およびSP−1のようなものを含む。これらの配列は、しばしばタンデムの繰り返しまたは逆向きの繰り返しにおいて複製される。
【0006】
サイトメガロウイルスのような多くのDNAウイルスにおける非常に活性な前初期遺伝子転写単位を含む、いくつかの天然の転写単位では、エンハンサーエレメントおよびプロモーターエレメントは、効果的な1つの拡張された上流エレメントに、機能的に合わされ得る。
【0007】
プロモーターは、制御され得、細胞型、温度、金属イオンまたは他の因子に応答性であり得るか;または構成的であり得、そのような因子に応答しない転写を与え得る。多くの目的のため、全てではないにしても多くの細胞型において一貫した高い転写レベルを与える、強力で構成的なプロモーターは、非常に有利である。何年もの間、ヒトサイトメガロウイルスにおける前初期遺伝子発現を駆動するエンハンサー/プロモーターエレメントは、真核生物の発現ベクターにおける異種遺伝子のそのような発現を駆動するため、非常に広範に用いられてきた(非特許文献5)。
【0008】
ヒトサイトメガロウイルス(CMV)は、ベータヘルペスウイルス科のメンバーであり、かつ、胃腸感染および呼吸感染、肝炎、ならびに網膜炎の原因である。他のヘルペスウイルスと同様に、CMVは、潜伏感染中に存続し得、そして、免疫無防御状態の個体内で再活性化され得る。細胞培養において、ヒトCMVは、繊維芽細胞、上皮細胞および内皮細胞のような最終的に分化された細胞、ならびに単球由来のマクロファージ中で増殖的に複製する(非特許文献6およびそれらの参考文献)。
【0009】
増殖性感染の間、前初期(IE)、初期または後期と呼ばれている、CMV遺伝子セットの定序発現が存在する。ヒトCMV IE遺伝子は、複製の効率性において必須の役割を果たすと考えられている(非特許文献7に総説されている)。
【0010】
ヒトCMV IEプロモーターの上流領域は、三つの領域である調節領域、特有領域、およびエンハンサーに分けられる。上記エンハンサーはまた、遠位エンハンサーおよび近位エンハンサーに分けられる。上記の遠位プロモーターは、効率的なIE遺伝子の発現および低いMOIでのウイルス複製に必要である。ヒトCMVは、IE遺伝子の発現のための非常に強力なエンハンサーを有する。上記ヒトCMVは、NF-κB結合部位またはr
el結合部位を含む18bpの4回繰り返しエレメント、CREB結合部位またはATF結合部位、二つのAP−1結合部位、および複数のSP−1部位を含む19bpの5回繰り返しエレメントを有する(非特許文献8;非特許文献9)。上記のマウスCMVエンハンサーは、6つのNF-κB結合部位またはrel結合部位、1つのCREB結合部位ま
たはATF結合部位、および少なくとも7つのAP−1結合部位を含む(非特許文献10)。上記の異なるcisに作用するエレメントは、個別的または相乗的に作用して、上記プロモーター上の上記RNAポリメラーゼII転写開始複合体を安定化する。
【0011】
多くの場合、正確な分類および交差種の血縁の程度は、暫定的であるが、主に異種宿主に感染する多数のサイトメガロウイルスが、公知である。多数の霊長類動物種(アフリカミドリザル、アカゲザルおよびピグミーチンパンジーを含む)ならびに齧歯類動物(マウス、ラットおよびモルモットを含む)に感染するサイトメガロウイルス様ウイルスが、認識されている。上記サイトメガロウイルス様ウイルスのうちで、マウスプロモーターおよびラットプロモーターのみが、詳細な機能解析を受けている。それらの種とヒトCMVとの比較は、おそらくは、認識されていないcisに作用するエレメントであって、異種の細胞中の下流の転写に寄与するエレメントの存在のため、上記IEプロモーター−エンハンサーの機能が、直接比較できないことを示す(非特許文献11)。
【0012】
しかしながら、ヒトCMV IEプロモーター−エンハンサーとマウスCMV IEプロモーター−エンハンサーの両者は、真核生物発現ベクターにおいて異種遺伝子の高レベルの構成的発現を生じ、そして、生物工学において広く用いられる。上記ヒトCMVプロモーターのそのような使用は、特許文献1(Stinski/University of Iowa)に開示された。上記プロモーター、エンハンサー、および機能的に完全な5’(上流)非翻訳領域であって、上記ヒトサイトメガロウイルスの主要な前初期遺伝子における第1イントロンを含む非翻訳領域の使用が、特許文献2により特許請求されている(Bebbington/Celltech)。ここで、上記非翻訳領域は、その天然のDNAをコードする配列と直接的に連結していない。上記マウスCMV IEエンハンサーの使用は、特許文献3(Koszinowskiら)により開示されている。
【0013】
モルモットCMV(GPCMV)は、ヒトCMV感染の病理との多くの類似点を有するモルモットにおける疾患を生じる。GPCMVのゲノムを特徴づける試み(非特許文献12;非特許文献13)は、上記ゲノムの構成機構が、ヘルペスウイルスの間で特有であることを示唆した。ヒトCMVとマウスCMVとの類似したサイズにも関わらず、上記のGPCMVのゲノムは、ヒトCMVのゲノムよりもはるかに単純であって、かつ、マウスCMVのゲノムと最もよく似ていた。しかしながら、上記のGPCMVのゲノムは、特にその末端領域の構造において、いくつかの珍しい特徴を有していた。IE遺伝子発現の最新の研究は、ヒトCMVとの配列の比較によりIE領域を同定し(非特許文献14)、そして、IE転写産物の発現およびプロセシングが、解析された。しかしながら、異種遺伝子の発現のためのIEプロモーター−エンハンサーの有用性の解析は、存在しなかった。
【0014】
IE1コード配列の5’末端および上記上流プロモーター/エンハンサー領域を含む、GPCMVゲノムの「HRv」(HindIII−EcoRV)前初期上流フラグメントの配列は、配列決定され(非特許文献15)、そして、CMV IE制御領域に典型的な繰り返し配列の領域を含むことが示された。三つの短い繰り返しであるGP−1、GP−2およびGP−3が、同定された。GP−1は、9回存在し、NF-κB結合部位を含み、そしてHCMVの18bpの繰り返しに対応している、18bpの繰り返し(GGCCCGGGACTTTCCAコンセンサスに73〜100%類似する)である。GP−2は、10回存在し、共通のSRE(血清応答エレメント)に類似するコア配列を含む、17bpの繰り返し(TGTCCTTTTTGGCAAAコンセンサスに86〜100%類似する)である。GP−3は、その近位上流領域内で4回繰り返され、そしてc−junまたはGCN4のための結合部位として同定された配列であるGTGACTTTを含む(非特許文献16)。
【0015】
この研究は上記GPCMV IE上流領域が強力なプロモーターを含むことを示唆したが、レポーター構築物が作成される方法に起因して、特定のの人工物が除去され得なかった。第一に、上記HRvフラグメントは、上記IE1遺伝子の第1エキソン、および第1イントロンの一部を含む。このイントロンは、3コピーの推定NF-1結合部位を含み、
このことが、上記プロモーターの見かけの強度を人工的に押し上げ得る。第二に、上記GPCMVフラグメントを試験するために用いられるレポーター構築物は、SV40プロモーター(それ自体が、強力なウイルス性プロモーターである)を含んでいた。その結果、レポーターの発現は、二重のGPCMV/SV40プロモーターの効果の結果であった。結果として、一般的に、上記GPCMVエンハンサー/プロモーター単独と他の強力なプロモーターとの比較、または上記GPCMVエンハンサー/プロモーター単独と他のCMV IEエンハンサー/プロモーターとの比較ですら、行うことが不可能である。
【0016】
本明細書中に参考として援用される、本出願人の同時係属特許出願であるPCT/GB99/02357(特許文献4)は、天然のクロマチンの状況において、普遍的に発現されるハウスキーピング遺伝子から排他的に構成される位置にわたって開いたクロマチン構造を確立する役割を担うエレメントについて説明する。これらのエレメントは、遺伝子座制御領域(Locus Control Region)(LCR)に由来せず、かつ、広範なメチル化していないCpGアイランドを含む。用語「普遍的クロマチンオープンエレメント(Ubiquitous Chromatin Opening Element)(UCOE)」は、そのようなエレメントを説明するために用いられている。
【0017】
哺乳動物のDNAにおいて、ジヌクレオチドCpGは、シトシンを5−メチルシトシンにメチル化するDNAメチルトランスフェラーゼ酵素により認識される。しかしながら、5−メチルシトシンは不安定であり、チミンへ変換される。結果として、CpGジヌクレオチドは、偶然に予期するよりも極めて低頻度でしか存在しない。それにも拘らず、ゲノムDNAのうちのいくつかの部分は、予期されるものにより近い頻度のCpGを有し、これらの配列は、「CpGアイランド」として公知である。本明細書中に用いられる場合、「CpGアイランド」は、少なくとも200bpの、少なくとも50%のGC含量および少なくとも0.6の観察/予期CpG含量比率(すなわち、偶然に予期されるもののうちの少なくとも60%のCpGジヌクレオチド含量)を有するDNA配列として定義される(非特許文献17;非特許文献18)。
【0018】
メチル化していないCpGアイランドは、当該分野において周知であり(非特許文献19、非特許文献20)、そのシトシン残基の相当量がメチル化しておらず、通常二つの近くに位置した(0.1〜3kb)分岐転写される(divergently transcribed)遺伝子の5’末端にわたり広がる、メチル化していないCpGアイランドとして定義され得る。DNAのこれらの領域は、発達を通じて全組織において低メチル化されたままであることが報告されている(非特許文献21)。上記のメチル化していないCpGアイランドは、しばしば、普遍的に発現される遺伝子、ならびに組織限定的発現プロファイルを示す遺伝子のうちの推定40%の遺伝子の5’末端に結合される(非特許文献22;非特許文献23)。そして、上記のメチル化していないCpGアイランドは、活性化クロマチンの領域に局在されることが公知である(非特許文献24)。
【0019】
「広範な」メチル化していないCpGアイランドは、1より多い転写開始部位を含む領域にわたり広がり、かつ/または300bpより多く、そして好ましくは、500bpより多くに広がる、メチル化していないCpGアイランドである。上記広範なメチル化していないCpGアイランドの境界は、上記領域にわたり、エンドヌクレアーゼ制限酵素と組み合わせてPCRを使用することにより、機能的に規定される。上記エンドヌクレアーゼ制限酵素がそれらの認識配列でDNAを消化(切断)する能力は、存在する任意のCpGアイランドのメチル化状態に対して感受性である。そのような一つの酵素は、HpaIIである。HpaIIは、CpGアイランド内でよく見出されるCCGG部位を認識および切断するが、上記部位の中央のCG残基がメチル化されていない場合に限られる。従って、HpaIIで消化されたDNAを用いて、HpaII部位を有する領域にわたり行われたPCRは、そのDNAがメチル化されていない場合、HpaII消化に起因して増幅産物を生じない。DNAがメチル化されている場合にのみ、PCRは増幅産物を生じ得る。従って、HpaIIがDNAを消化しないメチル化していない領域を超えて、PCR増幅産物が観察され得、それによって、上記の「広範なメチル化していないCpGアイランド」の境界を規定し得る。
【0020】
国際出願で特許文献4は、ヒトTATA結合タンパク質(TBP)/プロテオソーム構成成分−B1(PSMBI)およびヘテロ核リボ核タンパク質A2/B1(hnRNPA2)/ヘテロクロマチンタンパク質1Hsγ(HP1Hsγ)遺伝子座由来の、二重の分岐転写されるプロモーターを含む、メチル化していないCpGアイランドにわたる領域が、増加されたレベルの遺伝子発現を作動可能に連結された遺伝子に与えることを実証する。活性的に転写されるプロモーターと結合されたメチル化していないCpGアイランドは、クロマチンを再構築する能力を所有し、それゆえ、ハウスキーピング遺伝子座でのオープンドメインを確立および維持する主要な決定因子と考えられている。
【0021】
UCOEは、導入遺伝子発現のレベルおよび安定性における改良を含む、生産的な遺伝子の組込み事象の割合の増加を与える。このことは、トランスジェニック動物および培養細胞における組換えタンパク質産物の生成を含む、重要な研究および生物工学的適用を有する。
【0022】
特許文献4は、およそ4.0kbの機能的UCOEフラグメント、特に、図21のヌクレオチド4102〜8286により規定される(第11頁の第6行および第7行に開示されている通りの)「5.5RNP」フラグメントを開示する。同じ出願が、「1.5RNP」フラグメント(図22および図29、第51頁の第1〜5行に記載されている誘導体)を開示する。しかしながら、この「1.5RNP」フラグメントは、実際には、上記出願の図21のヌクレオチド4102〜6267からなる、上記の「5.5RNP」フラグメントの2165bpのBamHI−Tth111Iフラグメントである。
【0023】
さらなる出願(特許文献5)は、人工的に構築された、天然に存在するCpGアイランドのフラグメントから構成されているUCOEを開示する。第三の出願(特許文献6)は、UCOEの小さな機能的フラグメントを含むポリヌクレオチドを開示する。そのようなポリヌクレオチドは、わずかおよそ2kbのメチル化されていないCpGアイランド、またはより大きなそのようなアイランドのせいぜいおよそ2kbのフラグメントを含む。
【特許文献1】米国特許第5,168,062号明細書
【特許文献2】米国特許第5,591,639号明細書
【特許文献3】米国特許第4,968,615号明細書
【特許文献4】国際公開第00/05393号パンフレット
【特許文献5】国際公開第02/24930号パンフレット
【特許文献6】国際公開第04/067701号パンフレット
【非特許文献1】MCKnight and Tjian,Cell,1987年,46,p.795−805
【非特許文献2】Breathnach and Chambon,Annu Rev Biochem,1981年,50:p.349−393
【非特許文献3】Kadonaga著、Cell、2004年、第116巻、p.247−257
【非特許文献4】Ondekら著、Science、1988年、第236巻、p.1237−1244
【非特許文献5】Foecking and Hoffstetter、Gene、1986年、第45巻、p.101−105
【非特許文献6】IsomuraおよびStinski著、J Virol、2003年、第77巻、p.3602−3614
【非特許文献7】CastilloおよびKowalik著、Gene、2002年、第290巻、p.19−34
【非特許文献8】Thomsenら著、Proc Natl Acad Sci USA、1984年、第81巻、p.659−663
【非特許文献9】MeierおよびStinski著、Intervirology、1996年、第39巻、p.331−342
【非特許文献10】Dorsch−Haslerら著、Proc Natl Acad Sci USA、1985年、第82巻、p.8325−8329
【非特許文献11】IsomuraおよびStinski著、J Virol、2003年、第77巻、p.3602−3614
【非特許文献12】Isomら著、J Virology、1984年、第49巻、p.426−436
【非特許文献13】GaoおよびIsom著、J Virology、1984年、第52巻、p.436−447
【非特許文献14】Yinら著、J Virol、1990年、第64巻、p.1537−1548
【非特許文献15】Yin著、「Guinea pig cytomegalovirus immediate−early gene expression」、PhD thesis、Pennsylvania State University、USA、1991年
【非特許文献16】Hillら著、Science、1984年、第234巻、p.451−457
【非特許文献17】Gardiner−Green MおよびFrommer M.著、J MoI Biol、1987年、第196巻、p.261−282
【非特許文献18】Rice P、Longden IおよびBleasby A著、Trends Genet、2000年、第16巻、p.276−277
【非特許文献19】Birdら著、Cell、1985年、第40巻、p.91−99
【非特許文献20】TaziおよびBird著、Cell、1990年、第60巻、p.909−920
【非特許文献21】WiseおよびPravtcheva著、Genomics、1999年、第60巻、p.258−271
【非特許文献22】Antequera、F. and Bird,A.著、Proc.Natl.Acad.Sci.USA、1993年、第90巻、p.1195−11999
【非特許文献23】Cross,S.H. and Bird,A.P.、Curr.Opin,Genet.Dev.、1995年、第5巻、p.309−314
【非特許文献24】Tazi,J. and Bird,A.、Cell、1990年、第60巻、p.909−920
【発明の概要】
【発明が解決しようとする課題】
【0024】
生物工学における組換えタンパク質発現の重要性を考慮すると、新規のプロモーター/エンハンサーの組み合わせを含む、改良された発現ベクターが、依然として必要である。
【課題を解決するための手段】
【0025】
(発明の要旨)
本明細書の説明および特許請求の範囲を通じて、用語「含む(comprise)」および「含む(contain)」および上記用語の改変(例えば、「含む(comprising)」および「含む(comprises)」)は、「を含むが、これに限定されない」ことを意味し、他の部分、付加物、構成要素、整数または工程を除外することを意図されていない(そして除外しない)。
【0026】
本明細書の内容がそうでないことを必要としない限り、単数形は、本明細書の説明および特許請求の範囲を通じて、複数形を包含する。特に、不定冠詞が用いられる場合、本明細書の内容がそうでないことを必要としない限り、本明細書は、単数形だけでなく複数形も企図するものとして理解されるべきである。
【0027】
本発明の特定の局面、実施形態または実施例と関連して記載される図、整数、特徴、化合物、化学部分または化学基は、それらと適合しない場合を除いて、本明細書中に記載される任意の他の局面、実施形態または実施例に適用可能であると理解される。
【0028】
本明細書中に用いられる場合、用語「作動可能に連結されている」は、本発明のポリヌクレオチドにおけるエレメント間の作動可能性の関係を指す。「作動可能に連結されている」は、当業者に周知の、cisに作用するDNA配列間の機能的関係を説明する用語である。正確な構造関係は、関連があることもあるし、ないこともあり、異なる型のエレメントについて相違する。プロモーターに関して、プロモーターは、そのプロモーターが駆動するオープンリーディングフレームに対して5’の、本質的に隣接した(通常、100bp未満内の)位置を包含する。広範なメチル化していないCpGアイランドの場合、クロマチン構造における領域的な効果は、遺伝子発現のレベルおよび一貫性の増加を担う。例として、広範なメチル化していないCpGアイランドを包含するエレメントは、上記の遺伝子の転写を制御する発現性エンハンサー/発現性プロモーターの5’位に位置し得る。しかしながら「作動可能に連結される」は、明確な機能的効果が示されている限り、それ以外の場所に位置する可能性を包含する。
【0029】
「機能的ホモログ」により、開示されている配列に対して、ストリンジェントな条件下でハイブリダイズする能力を有し、かつ、二つ以上の組織中にて作動可能に連結されている発現性オープンリーディングフレームの増加された発現を与える類似の性質を有する配列が、意味される。ストリンジェントなハイブリダイゼーション/洗浄条件は、当該分野において周知である。例えば、0.1×SSC、0.1%SDSにおいて60℃で洗浄の後に安定である核酸ハイブリッド。上記核酸の配列が公知である場合、最適なハイブリダイゼーション条件が計算され得ることは、当該分野において周知である。例えば、ハイブリダイゼーション条件は、ハイブリダイゼーションに供される核酸のGC含量により決定され得る。Sambrookら著(1989),Molecular Cloning;A Laboratory Approachを参照のこと。特定のホモロジーの核酸分子間のハイブリダイゼーションを達成するために必要とされるストリンジェンシー条件を計算するための一般式は、以下:
【0030】
【数1】

である。
【0031】
本発明の目的は、真核細胞において作動可能に連結された発現性核酸配列の非常に高レベルの発現を提供する転写エンハンサーを含む、新規のDNA分子およびベクターを提供することである。有利に、上記エンハンサーは、転写を増加させる、それらの天然に関連しているプロモーターおよび/または他の遺伝的エレメントと組み合わせて用いられ得る。
【0032】
本発明は、特に、組換えタンパク質の高レベルの発現を得るための、モルモットサイトメガロウイルス前初期プロモーター/エンハンサーおよび発現ベクターにおけるその使用に関する。本発明は、ヒトまたはマウスのCMV IEエンハンサー/プロモーターエレメントから入手可能なものよりも増加されたレベルの発現を多数の細胞型において提供する能力を有する真核生物の発現ベクターを提供する。
【0033】
モルモットサイトメガロウイルス前初期上流制御領域は、E1遺伝子のおよそ1500bp上流および、より具体的には、図1および配列番号1により開示されている配列からなる。この制御領域は、プロモーターエレメントおよびエンハンサーエレメントの双方を含む。「プロモーター」により、少なくとも図1(配列番号1)のヌクレオチド779〜880を含むフラグメントまたはその機能的ホモログである、転写開始部位(TATAボックスおよびCAATボックス)が意味される。
【0034】
従って、本発明は、図1および配列番号1に記載されるモルモットCMV前初期制御領域のうちの少なくとも100個、好ましくは200個、そしてより好ましくは少なくとも500個の連続したポリヌクレオチドを含む単離されたポリヌクレオチド、ならびに発現性ポリヌクレオチドの配列を提供する。該発現性ポリヌクレオチド配列の転写は、エンハンサーと遺伝子または他の発現性配列との間に位置するプロモーターによって駆動される。このプロモーターは、内因性のモルモットCMV前初期プロモーターまたは天然には上記エンハンサーと結合していない他の異種プロモーターであり得る。上記の発現性ポリヌクレオチド配列は、モルモットCMV前初期遺伝子ではなく、かつ、上記プロモーターと天然には作動可能に連結していない。環状の単離されたポリヌクレオチド(プラスミドベクターのような)の場合、「間」によって、直接的に作動可能に連結されているポリヌクレオチド配列の上流(そのセンス鎖に対して5’)および作動可能に連結されているエンハンサーの下流(3’)が意味されていることが、当業者によって理解され得る。そのような単離されたポリヌクレオチドが、(選択マーカーの発現に必要な配列または他のエレメントに関連する配列のような)目的の挿入された発現性配列の発現と関連していない他のプロモーターを含み得ることが、理解される。
【0035】
よって、上記の単離されたポリヌクレオチドは、以下
a) 配列番号1の少なくとも200個、好ましくは少なくとも500個の連続するヌクレオチドを含むエレメント、ならびに
b) 発現性ポリヌクレオチド配列を含むエレメント、を含み;
上記の単離されたポリヌクレオチドは、上記発現性ポリヌクレオチドのセンス鎖に対して5’から3’の方向で、エンハンサー、単一のプロモーター、および上記発現性ポリヌクレオチド配列を含み、ここで上記エンハンサーは、上記プロモーターに作動可能に連結され、上記エンハンサーは、上記発現性ポリヌクレオチド配列に直接的に作動可能に連結され、ここで上記プロモーターは、天然には上記発現性ポリヌクレオチド配列に作動可能に連結されていないことによって特徴づけられる。
本発明はまた、以下の項目を提供する。
(項目1)
単離されたポリヌクレオチドであって、以下
a.配列番号1の少なくとも200個の連続するヌクレオチドを含むエレメントであって該200個の連続するヌクレオチドは、プロモーターおよび/またはエンハンサーエレメントを含む、エレメント、ならびに
b.発現性ポリヌクレオチド配列を含むエレメント
を含み、該単離されたポリヌクレオチドは、該発現性ポリヌクレオチドのセンス鎖に対して5’から3’の方向で、エンハンサー、単一のプロモーター、および該発現性ポリヌクレオチド配列を含み、ここで該エンハンサーは該プロモーターに作動可能に連結され、該プロモーターは該発現性ポリヌクレオチド配列に直接的に作動可能に連結され、ここで該プロモーターは、天然には該発現性ポリヌクレオチド配列に作動可能に連結されていない、単離されたポリヌクレオチド。
(項目2)
配列番号1の少なくとも500個の連続するヌクレオチドを含む、項目1に記載の単離されたポリヌクレオチド。
(項目3)
配列番号1のヌクレオチド50〜550を含む、項目1または2のいずれか1項に記載の単離されたポリヌクレオチド。
(項目4)
配列番号1のヌクレオチド275〜775を含む、項目1または2のいずれか1項に記載の単離されたポリヌクレオチド。
(項目5)
発現性核酸配列に直接的に作動可能に連結されたモルモットCMVの前初期制御領域由来のプロモーターを含み、該プロモーターは、天然には該発現性核酸配列に作動可能に連結されていない、項目1または2のいずれか1項に記載の単離されたポリヌクレオチド。
(項目6)
配列番号1のヌクレオチド679〜880を含む、項目5に記載の単離されたポリヌクレオチド。
(項目7)
配列番号1のヌクレオチド1〜887を含む、項目1〜6のいずれか1項に記載の単離されたポリヌクレオチド。
(項目8)
上記発現性核酸配列に作動可能に連結された、広範なメチル化していないCpGアイランドをさらに含む、項目1〜7のいずれか1項に記載の単離されたポリヌクレオチド。
(項目9)
項目1〜8のいずれか1項に記載のポリヌクレオチドを含む、ベクター。
(項目10)
項目9に記載の、真核生物発現ベクター。
(項目11)
配列番号2のヌクレオチド1〜1003、および1747〜5749のポリヌクレオチド配列を含む、項目9または項目10のいずれか1項に記載のベクター。
(項目12)
配列番号3のヌクレオチド1〜9328、および10072〜14119を含む、項目9または項目10のいずれか1項に記載のベクター。
(項目13)
配列番号4のヌクレオチド1〜2592、および3336〜7383を含む、項目9または項目10のいずれか1項に記載のベクター。
(項目14)
項目1〜5のいずれか1項に記載の単離されたポリヌクレオチド、または項目11〜13のいずれか1項に記載のベクターを含む、宿主細胞。
(項目15)
ポリペプチドを発現させる方法であって、該ポリペプチドをコードする発現性核酸配列を項目11〜13のいずれか1項に記載の発現ベクターに挿入し、該ベクターを適切な宿主細胞に挿入する工程、および該宿主細胞を、発現を可能にする適した条件において培養する工程、を包含する、方法。
(項目16)
上記ポリペプチドは、治療的に有用なポリペプチドである、項目15に記載の方法。
(項目17)
上記ポリペプチドは、免疫グロブリン、免疫グロブリンの機能的エピトープ結合フラグメント、成長因子、可溶性レセプターおよび血液凝固因子からなる群より選択される、項目16に記載の方法。
(項目18)
項目1〜8のいずれか1項に記載のポリヌクレオチド、項目11〜13のいずれか1項に記載のベクター、または項目14に記載の宿主細胞と、薬学的に受容可能なキャリア、賦形剤、緩衝液または媒体とを含む、薬学的調製物。
【図面の簡単な説明】
【0036】
【図1】図1は、GPCMV IEエンハンサー/プロモーター(配列番号1)のヌクレオチド配列を示す。転写因子AP−1、NF-κB、SRFおよびGCN4の潜在的結合部位が、CAATボックスおよびTATAボックス、CRS開始部位および転写開始(矢印)と共に示されている。
【図2】図2は、CHO−K1細胞において多数のEGFPレポーター構築物で得られた発現レベルを示す。この発現レベルは、FACSにより測定された場合の蛍光のメジアンとして表されている。結果は、1.5kbのhnRNP UCOEエレメントを含む、および含まない、ヒトCMV IEエンハンサー/プロモーターとモルモットCMV IEエンハンサー/プロモーターとを比較する。
【図3】図3は、強化緑色蛍光タンパク質レポーター遺伝子(EGFP)の発現を駆動するGPCMV IEエンハンサー/プロモーターを含むレポータープラスミドCET 1005 GPCMV−EGFPのマップを示す。上記の真核生物の選択マーカーは、マウスのホスホグリセレートキナーゼプロモーターから発現されるピューロマイシン耐性遺伝子である。上記の原核生物の選択マーカーは、アンピシリン耐性である。
【図4】図4は、レポータープラスミドCET 1015 8kb−GPCMV−EGFPのマップを示す。これは、CET 1015 GPCMV−EGFPと類似しており、GPCMV IEエンハンサー/プロモーターの上流に8kbのhnRNP UCOEエレメントが付加されている。
【図5】図5は、レポータープラスミドCET 1015 1.5kb−GPCMV−EGFPのマップを示す。これは、CET 1015 8kb−GPCMV−EGFPと類似しており、8kbのhnRNP UCOEエレメントが1.5kbのhnRNP UCOEエレメントで置換されている。
【図6】図6は、HEK293細胞(せん断されたアデノウイルス5型DNAで形質転換されたヒト胚性腎細胞)におけるヒトCMV IEエンハンサー/プロモーターエレメントにより駆動されるEGFPの発現と、モルモットCMV IEエンハンサー/プロモーターにより駆動されるEGFPの発現とを比較する。
【図7】図7は、ルシフェラーゼに基づいたレポーター構築物を用いた同様の比較を示す。
【発明を実施するための形態】
【0037】
好ましくは、上記の単離されたポリヌクレオチドは、ヌクレオチド50〜550を含む前初期制御領域の5’フラグメント、または代替的に、ヌクレオチド275〜775を含む3’フラグメントを含む。そのようなフラグメントは、内因性プロモーターを含ずに、機能的エンハンサーフラグメントを含む。
【0038】
従って、一実施形態では、本発明の単離されたポリヌクレオチドは、少なくとも、発現性ヌクレオチド配列に直接的に作動可能に連結されている(天然には作動可能に連結されていない)モルモットCMV前初期制御領域由来のプロモーターを含む。この該プロモーターは、好ましくは、配列番号1のヌクレオチド779〜880を含む。「直接的に作動可能に連結されている」によって、上記遺伝子または他の発現性核酸は上記プロモーターにより直接的に駆動されることが、意味されている。
【0039】
好ましくは、上記の単離されたポリヌクレオチドは、モルモットCMVの主要前初期制御領域をさらに含み、より好ましくは、配列番号1のヌクレオチド1〜887を含む。
【0040】
一つの好ましい実施形態では、上記の単離されたポリヌクレオチドは、記発現性核酸配列に作動可能に連結されている広範なメチル化していないCpGアイランドをさらに含む。より好ましくは、上記の広範なメチル化していないCpGアイランドは、一つ以上のさらなるプロモーター、特に分岐して転写する二重プロモーターまたは二指向性プロモーターを含む。よって、本発明は、上記発現性ポリヌクレオチドに作動可能に連結している、図1(配列番号1)の少なくとも200個の連続するヌクレオチドを含み、さらに上記発現性ポリヌクレオチド配列に作動可能に連結されている広範なメチル化していないCpGアイランドを含む、単離されたポリヌクレオチドを提供する。そのような広範なメチル化していないCpGアイランドは、簡便に、上記エンハンサー配列の隣に、および上流に位置され得る。好ましくは、そのような単離されたポリヌクレオチドは、図1(配列番号1)の少なくとも500個の連続するポリヌクレオチド、より好ましくは、ヌクレオチド50〜550を含む前初期制御領域の5’フラグメント、または、代替的に、ヌクレオチド275〜775を含む3’フラグメントを含む。最もより好ましくは、そのような単離されたポリヌクレオチドは、配列番号1のヌクレオチド1〜887を含む。
【0041】
一実施形態では、上記の広範なメチル化していないCpGアイランドは、ヒトTATA結合タンパク質遺伝子ならびに5’隣接配列および3’隣接配列の各12kb、またはそれらの機能的フラグメントにわたる44kbのDNAフラグメントを含む。好ましくは、上記の機能的フラグメントは、1kbの5’隣接配列および5kbの3’隣接配列を有するヒトTATA結合性タンパク質遺伝子、またはそれらの機能的フラグメントにわたる25kbのDNAフラグメントを含む。より好ましくは、TATA結合タンパク質遺伝子関連の広範なメチル化していないCpGアイランドの機能的フラグメントは、多くても2kbであり、さらに好ましくはわずか1kbであり、最も好ましくは、987bpのBspE1−Esp31制限フラグメントを含む。
【0042】
第二の実施形態では、上記の広範なメチル化していないCpGアイランドは、30kbの5’隣接配列および20kbの3’隣接配列を有するヒトhnRNP A2遺伝子、またはそれらの機能的フラグメントにわたる60kbのDNAフラグメントを含む。好ましくは、上記の機能的フラグメントは、5kbの5’隣接配列および1.5kbの3’隣接配列を有するヒトhnRNP A2遺伝子にわたる16kbのDNAフラグメント、より好ましくは、わずか2kbの、より好ましくはわずか1.6kbの、1546bpのEsp3I制限酵素フラグメントを含むヒトhnRNP A2遺伝子のフラグメントを含む。好ましくは、そのフラグメントは、フォワード方向を向いている。
【0043】
第三の実施形態では、本発明の単離されたポリヌクレオチドは、好ましくはヒト起源の、βアクチン CpGアイランド/プロモーター領域のフラグメント、より好ましくは、上記のヒトβアクチン CpGアイランド/プロモーター領域にわたる100bp〜2kbの範囲内のDNAフラグメントを含む。
【0044】
第四の実施形態では、本発明の単離されたポリヌクレオチドは、好ましくはヒト起源の、PDCD2 CpGアイランド/プロモーター領域のフラグメント、より好ましくは、上記のヒトPDCD2 CpGアイランド/プロモーター領域にわたる100bp〜2kbの範囲内のDNAフラグメントを含む。
【0045】
最後の代替的実施形態では、上記の広範なCpGリッチのメチル化していないCpGアイランドは、ヒトβアクチン CpGアイランド/プロモーター領域にわたる100bp〜1.9kbの範囲内のDNAフラグメント、およびヒトPDCD2 CpGアイランド/プロモーター領域にわたる100bp〜2kbの範囲内のDNAフラグメントを含む、天然には存在しない人工配列である。好ましくは、上記のフラグメントは、多方向に向けられたそれらのプロモーターに直接的に隣接している。
【0046】
さらなる局面では、本発明は、上述の単離されたポリヌクレオチドを含むベクターを提供する。上記ベクターは、DNAを細胞へ移す能力を有する任意のベクターであり得る。好ましくは、上記ベクターは、真核生物の発現ベクターである。そのようなベクターは、真核細胞において転写を指向および促進する能力を有するプロモーターおよびエンハンサーのようなエレメントを含む。上記エレメントはまた、好ましくは、それらの機能を促進または最適化する他の特徴も含む。そのような特徴としては、上記の適切な真核生物宿主細胞中、および上記ベクター自体を製造するために用いられる原核細胞中でも複製を可能にするために選択される複製起点、いずれかの細胞型において上記ベクターを含む細胞を選択することを可能にする一つ以上の選択マーカー(しばしば、抗生物質または毒素に対する耐性を与える)、上記ベクターまたはその組み込まれたフラグメントの複製を可能にするエレメント、ならびに所望のポリペプチド産物をコードする発現性ポリヌクレオチド配列(一般的に、「インサート」と呼ばれる)の簡単な挿入を可能にするための、主要なエンハンサー/プロモーターの下流に簡便に位置されるポリリンカーまたはマルチクローニング部位が挙げられる。そのような改良は、当該分野において周知である。
【0047】
好ましくは、上記ベクターは、組込み型ベクターまたはエピソームベクターである。
【0048】
好ましい組込み型ベクターとしては、組換えレトロウイルスベクターが挙げられる。組換えレトロウイルスベクターは、レトロウイルスゲノムの少なくとも一部のDNAを含み、この部分は、その標的細胞に感染する能力を有する。用語「感染」は、ウイルスが遺伝的物質をその宿主細胞または標的細胞へ移すプロセスを意味するために用いられる。好ましくは、本発明のベクターの構築に用いられるレトロウイルスはまた、上記標的細胞におけるウイルス複製の影響を除去するために複製欠損にされる。そのような場合、上記複製欠損ウイルスのゲノムは、慣習的な技術に従ってヘルパーウイルスによってパッケージングされ得る。一般的に、感染性および機能遺伝子伝達能という上記の基準を満たす任意のレトロウイルスが、本発明の実施において採用され得る。
【0049】
適切なレトロウイルスベクターとしては、当業者に周知のpLJ、pZip、pWeおよびpEMが挙げられるが、これらに限定されない。複製欠損レトロウイルスのための適切なパッケージングウイルス株としては、例えば、ΨCrip、ΨCre、Ψ2およびΨAmが挙げられる。
【0050】
本発明に有用な他のベクターとしては、アデノウイルス、アデノ随伴ウイルス、SV40ウイルス、ワクシニアウイルス、HSVおよびポックスウイルスが挙げられる。好ましいベクターは、上記アデノウイルスである。アデノウイルスベクターは、当業者に周知であり、そして、気道上皮、骨格筋、肝臓、脳および皮膚を含む多数の細胞型への遺伝子を送達するために用いられてきた(Hittら著,1997;Anderson,1998)。
【0051】
さらに好ましいベクターは、上記アデノ随伴(AAV)ベクターである。AAVベクターは、当業者に周知であり、そして、ヒトTリンパ球、繊維芽細胞、鼻ポリープ、骨格筋、脳、赤血球および遺伝子治療適用の造血幹細胞を安定的に伝達するために用いられてきた。国際特許出願である、国際公開91/18088号パンフレットは、特定のAAVに基づくベクターを開示している。
【0052】
好ましいエピソームベクターは、一過性の複製しないエピソームベクター、およびEBV、ヒトパポバウイルス(BK)およびBPV−1由来のもののようなウイルス性複製起点に由来する機能を有する自己複製するエピソームベクターを含む。そのような組込み型ベクターおよびエピソームベクターは、当業者に周知であり、かつ、当業者に周知の文献本体中に十分に説明されている。特に、適切なエピソームベクターは、国際公開98/07876号パンフレットに開示されている。
【0053】
哺乳動物の人工的染色体も、本発明におけるベクターとして用いられ得る。哺乳動物の人工的染色体は、Calos(1996)によって議論されている。
【0054】
好ましい実施形態では、本発明のベクターは、プラスミドである。上記プラスミドは、非複製、非組込み型プラスミドであり得る。
【0055】
本明細書中に用いられる場合、用語「プラスミド」は、発現性遺伝子をコードする任意の核酸を指し、そして、線状の核酸または環状の核酸、および二本鎖核酸または一本鎖核酸を含む。上記核酸は、DNAまたはRNAあり得、改変されたヌクレオチドまたはリボヌクレオチドを含み得、そしてメチル化、あるいは保護基またはキャップ構造もしくはテイル構造を含めるような方法により化学的に改変され得る。
【0056】
非複製の、非組込み型プラスミドは、宿主細胞に形質導入されるときに、複製せず、かつ上記宿主細胞ゲノムに特異的に組込みをしない(すなわち、高頻度で組込みをせず、かつ特定の部位で組込みをしない)核酸である。
【0057】
本発明のベクターの極めて好ましい実施形態は、配列番号2のヌクレオチド1〜1003および1747〜5749;配列番号3のヌクレオチド1〜9328および10072〜14119;または配列番号4のヌクレオチド1〜2592および3336〜7383を含み、この実施形態は、全長配列によってコードされた例示的な強化緑色蛍光タンパク質レポーターの代わりに、発現性配列を挿入するために適切な発現ベクターである。
【0058】
本発明はまた、本発明のベクターで形質導入された宿主細胞も提供する。上記宿主細胞は、任意の真核細胞であり得る。好ましくは、上記宿主細胞は、哺乳動物細胞、より好ましくはヒト細胞または齧歯類細胞である。
【0059】
核酸濃縮剤の使用、エレクトロポレーション、アスベスト、ポリブレン、DEAEセルロース、デキストラン、リポソーム、陽イオン性リポソーム、リポポリアミン、ポリオルニチンとの複合化、粒子線照射、および直接的なマイクロインジェクションを含む多数の技術が公知であり、かつ、本発明に従って、本明細書中に記載されているベクターを細胞へ送達するために有用である。
【0060】
本発明のベクターは、宿主細胞へ非特異的または特異的に(すなわち、宿主細胞の指定されたサブセットへ)、ウイルス性または非ウイルス性の送達手段を介して輸送され得る。ウイルス起源の好ましい送達方法としては、本発明のベクターの形質導入レシピエントとしてのウイルス粒子生成パッケージング細胞株が挙げられる。上記パッケージング細胞株には、アデノウイルス、ヘルペスウイルスまたはパポバウイルスのもののようなウイルス性パッケージングシグナルが組み込まれている。好ましい非ウイルス性ベースの遺伝子送達手段または方法もまた、本発明において用いられ得、かつ、直接的な裸の核酸の注入、核酸濃縮ぺプチドおよび非ペプチド、カチオン性リポソームならびにリポソームにおける被包化を含み得る。
【0061】
本発明によるベクターの送達は、核酸濃縮ペプチドを用いることが企図される。上記ベクターを濃縮し、かつ上記ベクターを細胞に輸送するために特に有用な、核酸濃縮ペプチドは、国際特許出願である国際公開第96/41606号パンフレットに開示されている。国際公開第96/41606号パンフレットに記載されている通り、官能基は、ベクターの送達に有用なペプチドに結合され得る。これらの官能基は、モノクローナル抗体、インスリン、トランスフェリン、アシアログリコプロテインまたは糖のような、特定の細胞型を標的とするリガンドを含み得る。従って、上記リガンドは、非特異的な様式で細胞を標的としてもよいし、細胞型に制限された特異的様式で細胞を標的としてもよい。
【0062】
上記官能基はまた、パルミトイル、オレイルまたはステアロイルのような脂質;ポリエチレングリコール(PEG)またはポリビニルピロリジン(PVP)のような中性親水性ポリマー;インフルエンザウイルスのHAペプチドのような融合性(fusogenic)ペプチド;またはリコンビナーゼもしくはインテグラーゼを含み得る。上記官能基は、核局在配列(NLS)のような細胞内輸送タンパク質、膜破壊性ペプチドのようなエンドソーム離脱シグナル、またはタンパク質を直接的にその細胞質へ方向付けるシグナルも含み得る。
【0063】
本発明はさらに、本明細書中に記載されている単離されたポリヌクレオチドまたはベクターを含む宿主細胞を提供する。好ましくは、上記細胞は、真核生物細胞、より好ましくは哺乳動物細胞、さらに好ましくは、ヒト細胞または齧歯類細胞である。
【0064】
さらなる局面では、本発明は、発現性ポリヌクレオチド、好ましくは、ポリペプチドをコードする発現性ポリヌクレオチドを発現する方法を提供する。この方法は、本発明による単離されたポリヌクレオチドを、本明細書中に記載されている適切な発現ベクターに挿入する工程、およびさらに上記ベクターを本明細書中に記載されている適切な宿主細胞に挿入する工程、および上記宿主細胞を発現させるのに適した条件において培養する工程を包含する。
【0065】
好ましくは、上記ポリペプチドは、治療上有用なポリペプチドであり、好ましくは、免疫グロブリンまたは免疫グロブリンの機能的エピトープ結合性フラグメント、増殖因子、受容体またはその溶解性フラグメント、および血液凝固因子からなる群から選択される。
【0066】
本発明によるポリヌクレオチド、ベクターまたは宿主細胞と、薬学的に受容可能なキャリア、賦形剤、緩衝液または媒体とを含む薬学的調製物もまた、提供される。
【実施例】
【0067】
(実施例1)
(hCMVプロモーターまたはgpCMVプロモーターのいずれかを含むベクターを用いて安定的に形質転換した、CHO−K1細胞の生成)
上記プラスミド構築物を、以下の通り生成した。アンピシリン耐性遺伝子を、pBluescript(登録商標)(Stratagene)からPCRにより、プライマー
【0068】
【数2】

の各末端にNruI部位を組み込みながら単離した。PCR産物を、pMaeII(Nucleic Acids Research 2001 29:E26)のPvuII部位に挿入し、pCA1を生成した。以下のオリゴヌクレオチド:
【0069】
【数3】

をアニーリングさせ(1と2;3と4;5と6;そしてその後、これらの三つの二量体を一緒にアニーリングさせた)、そして、上記オリゴヌクレオチドを、pCA1のXhoI部位とNotI部位の間のマルチクローニング部位を置換するために用い、これらの部位を構築の間に破壊した。これにより、pCA1MCSを生成した。AgeI部位を、AgeI制限酵素切断し、次いでT4 DNA ポリメラーゼを用いて平滑末端化(blunting)し、再ライゲーションすることにより、pPGK−Puro−bgh内のPGKプロモーターから欠失させた。上記PGKのピューロマイシンpAカセットを、EcoRI−XhoIフラグメントとしてこのベクターから除去し、そして、同様にEcoRIおよびXhoIで消化したpCA1MCSにライゲーションさせた。このベクターをpCIA−Puro(CET 1000)と命名した。pCIA−Puro内のbghpAを、HSVのTkpAで置換した。上記のHSVのTk polyAを、BstBI−Eco1091フラグメントとしてpEGFP−N1から除去し、T4 DNA ポリメラーゼで平滑末端化し、そして、SacIで消化してT4 DNA ポリメラーゼで平滑末端化したpCIA−Puroにライゲーションした。このベクターを、CET 1005と命名した。
【0070】
pCET1005 1.5kb−GPCMV−EGFPを構築するために、1.5kb hnRNP UCOEフラグメントを、BsmBIを用いて(上記のように)PCET20から切除し、T4 ポリメラーゼで平滑末端化し、そしてpEGFP−N1の平滑末端XhoI部位(Clontech,Palo Alto,CA,USA)にクローニングして、pEGFP−N1 1.5kb−EGFPを生成した。その後NheI(平滑末端)/NotIを用いて、2.4kbの「hnRNP−EGFP」カセットを、このプラスミドから切除し、そして、SwaI/NotIで消化したpCET1005−EGFPの骨格にサブクローニングして、pCET10051.5kb−EGFPを生成した。その後、GPCMVプロモーターを、NheIおよびEcoRIを用いてpPCRScript GPCMV(Geneart,Regensburg,Germanyにより合成された)から切除し、平滑末端化し、そして、このプラスミドの平滑末端BamHIにサブクローニングして、pCET1005 1.5kb−GPCMV− EGFPを生成した。PmeI/SacIを用いて1.5kb hnRNP UCOEを切除し、平滑末端化し、そしてその骨格を再ライゲーションすることにより、pCET1005 GPCMV− EGFPを生成した。
【0071】
pCET1005 8kb−GPCMV−EGFPを構築するために、pCET1005 1.5kb−GPCMV−EGFPの5.3kbのSacI(平滑末端)/PacIフラグメントを、AscI(平滑末端)/PacIで消化したpCET1005骨格にサブクローニングした。pCET20由来の平滑末端化した1.5kb hnRNP BsmBIフラグメントをpCET1005−EGFPの平滑末端ClaI部位にサブクローニングすることにより、プラスミドpCET1005 1.5kb−HCMV−EGFPを構築した。
【0072】
CHO−K1細胞を、10%のFoetal Calf Serum(Invitroge,UK)ならびに5U/mlのペニシリンおよび5U/mlのストレプトマイシンの混合物(Sigma,UK)を補充したF12(HAM)栄養混合物(Gibco,UK)中にて維持した。CHO−K1の安定した形質導入のため、プラスミドを、PciIで線状化し、フェノール;クロロホルム;イソアミルアルコールおよびクロロホルム中に抽出し、エタノール中に沈殿させ、そして、滅菌水中に0.25μg/μlの濃度で再懸濁した。滅菌エレクトロポレーションキュベットにおいてて、線状化した等モル量のプラスミドを、滅菌水中にて希釈して25μlとし(pCET1005−EGFP 1.39μg、pCET1005 1.5kb−HCMV−EGFP 1.78μg、pCET1005 GPCMV−EGFP 1.45μg、pCET1005 1.5kb−GPCMV−EGFP 1.85μg)、そして250μlの増殖倍地中にて5×106個のCHO−K1細胞と混合した。15分間の氷上でのインキュベーションの後、上記細胞を、250V/975μF(BioRad Gene Pulser IITM)でエレクトロポレーションし、そして室温でさらに10分間インキュベートした。細胞を10mlの増殖培地に移し、遠心分離により回収し、そして、計50mlの増殖培地で225cm2組織培養フラスコへ移した。ピューロマイシン(Sigma,UK)を12.5μg/mlの濃度まで添加する前に、細胞を、24時間37℃にて5%CO2インキュベーター内でインキュベートした。安定な形質導入株を回収し、(選択を維持するための)6ウェルの組織培養ディッシュ内にて継代培養し、そして、EGFPを可視化するためのFL1チャネルを用いた蛍光活性化細胞選別により解析する前に、細胞を(4日後に選択培地を交換しながら)8日間培養した。図2は、gpCMVを含む二つの構築物であるpCET1005 GPCMV−EGFP(図3)およびpCET1005 1.5kb−GPCMV−EGFP(図5)が、それぞれhCMVプロモーターを用いる構築物であるpCET1005−EGFPおよびpCET1005−1.5kb−HCMV−EGFPよりも高いレベルまでトランスジーンを発現するプールを生成することを明確に示す。
【0073】
(実施例2)
HEK293細胞を、10%のFoetal Calf Serumならびに5U/mlのペニシリンおよび5U/mlのストレプトマイシンの混合物(Sigma,UK)を補充したDulbecco’s Modified Eagle Medium(DMEM;Sigma,UK)中にて維持した。安定した形質導入のため、HEK293細胞を、6ウェルディッシュ内にて1×106個の細胞/ウェルの密度で播種し、そして、24時間37℃にて5%CO2インキュベーター内でインキュベートした。その後、細胞を、(PciIで線形化した)4μgの上記に示されたプラスミド(pCET1005−EGFPまたはpCET1005−gpCMV−EGFP)で、10μlのLipofectamine 2000(Invitrogen,UK)を用いて形質導入した。上記DNAおよびLipofectamine 2000を、別々に250μlのOptiMEM I(Gibco,UK)中にて希釈し、室温での5分間のインキュベーションの後、一緒に混合し、そしてさらに20分間インキュベートした。増殖培地を、15%のFCSを補充した1mlのOptiMEM Iで交換し、その後、上記のDNA/Lipofectamine 2000混合物を添加した。10%のFCSを補充した3.5mlのOptiMEM Iを添加する前に、細胞を、37℃で5%CO2インキュベーター内で5時間インキュベートした。細胞を、次いで37℃にて5%CO2インキュベーター内で24時間インキュベートし、その後、細胞を回収し、0.5μg/mlのピューロマイシンを補充した全50mlのDMEM増殖培地において225cm2組織培養フラスコへ移した。安定な形質導入株を遠心分離により回収し、(選択を維持するための)6ウェルの組織培養ディッシュ内にて継代培養し、そして、EGFPを可視化するためのFL1チャネルを用いた蛍光活性化細胞選別により解析する前に、細胞を、(3〜4日毎に選択培地を交換しながら)約14日間増殖させた。図6は、gpCMV構築物で生成したプールが、hCMV構築物で生成したプールよりも3倍〜4倍高いEGFPの発現レベルを与えることを示す。
【0074】
(実施例3)
CHO−K1細胞を、実施例1に記載の通りに培養した。1.5×105個のCHO−K1細胞を、形質導入の12時間前に12ウェルへ播種した。24時間後に、細胞を、1.5μlのFUGENE(Roche,UK)を用いて1μgのルシフェラーゼレポータープラスミド(phCMV−LucまたはpgpCMV−Luc)で形質導入した。形質導入のために、FUGENEおよびDNAの双方を、別々にOpti−MEM I(Invitrogen)中にて希釈し、一緒に混合し、そして、上記細胞に添加する前に30分室温でインキュベートした。ルシフェラーゼの発現を、24時間後に、Berthold luminometer(Berthold,Wildbad,Germany)を用いて解析した。一般的に、細胞の溶解およびルシフェラーゼレポーターアッセイを、上述(Lipinskiら著,Gene Therapy,2001(8):274−281)のように行った。形質導入は三連で行い、一つの代表的な実験結果の平均値および標準偏差を示している(図7)。明らかに、gpCMVベクターは、hCMVプラスミドよりも少なくとも2倍活性のルシフェラーゼであった。
【0075】
プラスミドhCMV−Lucは、上述されている(Lipinskiら著,Gene Therapy,(2001)8:274−281)。プラスミドgpCMV−Lucを、pCRScript/gpCMV(customer gene synthesis company:Geneart,Regensburg,Germany)由来のNdeI/EcoRIフラグメントを調製することにより生成し、そして、このgpCMVプロモーターフラグメントをPGL3basic(Promega)の平滑末端XhoI部位にクローニングした。
【特許請求の範囲】
【請求項1】
明細書中に記載の発明。
【請求項1】
明細書中に記載の発明。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2011−78415(P2011−78415A)
【公開日】平成23年4月21日(2011.4.21)
【国際特許分類】
【出願番号】特願2010−240204(P2010−240204)
【出願日】平成22年10月26日(2010.10.26)
【分割の表示】特願2007−554658(P2007−554658)の分割
【原出願日】平成18年3月3日(2006.3.3)
【出願人】(390019585)ミリポア・コーポレイション (212)
【氏名又は名称原語表記】MILLIPORE CORPORATION
【Fターム(参考)】
【公開日】平成23年4月21日(2011.4.21)
【国際特許分類】
【出願日】平成22年10月26日(2010.10.26)
【分割の表示】特願2007−554658(P2007−554658)の分割
【原出願日】平成18年3月3日(2006.3.3)
【出願人】(390019585)ミリポア・コーポレイション (212)
【氏名又は名称原語表記】MILLIPORE CORPORATION
【Fターム(参考)】
[ Back to top ]

