発癌予防剤及びシクロアルタン型トリテルペン系化合物の製造方法
【課題】 安全で有効な発癌予防剤を提供する。
【解決手段】 本発明の発癌予防剤は、24−メチルシクロアルタン−3β,24,241−トリオール、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール、シクロアルタン−3,24−ジオン、4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン、24,25−ジヒドロキシシクロアルタン−3−オン、25−ヒドロキシシクロアルト−23−エン−3−オン、25−ヒドロキシ−24−メトキシシクロアルタン−3−オンからなる群から選ばれた少なくとも1種のシクロアルタン型トリテルペン系化合物を含有する。
【解決手段】 本発明の発癌予防剤は、24−メチルシクロアルタン−3β,24,241−トリオール、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール、シクロアルタン−3,24−ジオン、4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン、24,25−ジヒドロキシシクロアルタン−3−オン、25−ヒドロキシシクロアルト−23−エン−3−オン、25−ヒドロキシ−24−メトキシシクロアルタン−3−オンからなる群から選ばれた少なくとも1種のシクロアルタン型トリテルペン系化合物を含有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は発癌予防剤及びシクロアルタン型トリテルペン系化合物の製造方法に関し、特にシクロアルタン型トリテルペン系化合物を含有する発癌予防剤及びシクロアルタン型トリテルペン系化合物の製造方法に関する。
【背景技術】
【0002】
従来から、発癌予防剤としてトリテルペン系化合物は知られている(特許文献1参照)。この特許文献1では、米糠成分を処理して得られるγ−オリザノールを化学的に変換することで、発癌予防に有効な数種のトリテルペン系化合物を得る技術が示されている。
【特許文献1】特開2003−277269号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、発癌予防の大きなニーズに鑑みて、さらに安全で有効な発癌予防剤が得られないものかとの期待は大きい。
本発明は、上述の課題に鑑みてなされたものであり、安全で有効な発癌予防剤を提供することを目的としている。
【課題を解決するための手段】
【0004】
本発明者らは、上記の課題を解決することを目的として、従来から安全性及び優れた発癌予防効果が報告されているシクロアルタン型トリテルペン系化合物に着目し、さらに優れた発癌予防効果を有する化合物を探索すべく鋭意研究を行った。その結果、糸状菌を用いることで、優れた発癌予防効果を有するシクロアルタン型トリテルペン系化合物を得ることができるのを見出した。すなわち本発明の請求項1による発癌予防剤は、シクロユーカレノール、24−メチルシクロアルタン−3β,24,241−トリオール、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール、シクロアルタン−3,24−ジオン、4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン、24,25−ジヒドロキシシクロアルタン−3−オン、25−ヒドロキシシクロアルト−23−エン−3−オン、25−ヒドロキシ−24−メトキシシクロアルタン−3−オンからなる群から選ばれた少なくとも1種のシクロアルタン型トリテルペン系化合物を含有することを特徴とする。
【0005】
上述したシクロアルタン型トリテルペンであれば、発癌予防効果に優れ、かつ、案税も高い。
なお、上述した本発明の化合物には、医学的に使用され薬理学的に許容される各化合物の塩も含むものであるもの。このような塩として、例えば、ナトリウム塩、カリウム塩、リチウム塩、のようなアルカリ金属塩、カルシウム塩、マグネシウム塩、のようなアルカリ土類金属塩、アルミニウム塩、鉄塩、亜鉛塩、銅塩、ニッケル塩、コバルト塩等の金属塩;アンモニウム塩のような無機塩、t−オクチルアミン塩、ジベンジルアミン塩、モルホリン塩、グルコサミン塩、フェニルグリシンアルキルエステル塩、エチレンジアミン塩、N−メチルグルカミン塩、グアニジン塩、ジエチルアミン塩、トリエチルアミン塩、ジシクロヘキシルアミン塩、N,N'−ジベンジルエチレンジアミン塩、クロロプロカイン塩、プロカイン塩、ジエタノールアミン塩、N−ベンジル−フェネチルアミン塩、ピペラジン塩、テトラメチルアンモニア塩、トリス(ヒドロキシメチル)アミノメタン塩のような有機アミン塩;及び、グリシン塩、リジン塩、アルギニン塩、オルニチン塩、アスパラギン塩のようなアミノ酸塩等を挙げることができる。
【0006】
また、上述した請求項1に記載の本発明の化合物が溶剤和物(例えば水和物)を形成する場合は、これらもすべて本発明に含まれる。例えば、本発明の化合物が、大気中に放置されたり、または再結晶することにより、水分を吸収し、吸着水が付着したり、水和物を形成する場合がある。本発明にはこのような溶剤和物も含まれる。
さらに、請求項1に記載の本発明の化合物は、それぞれいくつかの不斉炭素原子を有しており、このため、種々の光学異性体が存在する。本発明においては、特に記述しない限り、ラセミ化合物を含むこれらの異性体及びこれらの異性体の混合物をもすべて含むものである。
【0007】
また、本発明の請求項2による発癌予防剤は、請求項1において、前記シクロアルタン型トリテルペン系化合物は、米糠成分を処理して得た化合物を基質とした糸状菌による微生物変換反応から得られる反応生成物、あるいは米糠成分を処理して得た化合物の化学的変換反応によって得られる反応生成物であることを特徴とする。
さらに、本発明は新規で優れた発癌予防効果を有するシクロアルタン型トリテルペン系化合物を提供するのみでなく、自律神経失調治療薬等としても有用なシクロアルタン型トリテルペン系化合物の新たな製造方法を提供するものである点において重要な意味を有する。すなわち、本発明の請求項3によるは、米糠成分を処理して得られる化合物を基質として糸状菌による微生物変換を行うことでシクロアルタン型トリテルペン系化合物を得ることを特徴とする。
【0008】
米糠成分を処理して得られる化合物を基質として糸状菌による微生物変換を行うことでシクロアルタン型トリテルペン系化合物を得ることができる。これは、より安全なシクロアルタン型トリテルペン系化合物の製造の可能性、糸状菌の大量培養、変換反応の関連遺伝子を組み込んだ形質転換体の培養や糸状菌から抽出される変換反応の関連酵素の利用による大量製造の可能性を示唆するものである。
ここで、用いることができる糸状菌としては、例えばGlomerella属、Mortierella属、Chaetomium属、Aspergillus属などが挙げられる。Glomerella属の中でも、さらにGlomerella fusarioidesが好ましい。
【発明の効果】
【0009】
本発明によれば、安全かつ発癌予防効果に優れた発癌予防剤が提供される。
【発明を実施するための最良の形態】
【0010】
次に、実施例により本発明を具体的に説明する。すなわち、本発明に係る微生物変換反応による発癌予防効果を有する化合物の生成、単離、単離された化合物の同定及び構造解析、並びに、本発明に係る発癌予防剤の効果確認試験について説明する。
[基質の調製]
微生物変換反応の基質であるシクロアルテノール(以下、本明細書では「化合物1」と記すこともある。)、24−メチレンシクロアルタノール(以下、本明細書では「化合物2」と記すこともある。)、及び、シクロアルテノン(以下、本明細書では「化合物3」と記すこともある。)の調製について説明する。
【0011】
まず、γ−オリザノールから、文献記載(L. J. Goad、T. Akihisa、“Analysis of Sterols”、Blackie Academic & Professional、ロンドン、292項、1997年)の方法に基づき、分別再結晶法により、シクロアルテノールフェルラート及び24−メチレンシクロアルタノールフェルラートを調製した。その後、シクロアルテノールフェルラート及び24−メチレンシクロアルタノールフェルラートを、それぞれアルカリ加水分解(5%水酸化カリウム・メタノール溶液;加熱還流;3時間)することで、シクロアルテノール(化合物1)及び24−メチレンシクロアルタノール(化合物2)を調製した。またシクロアルテノン(化合物3)は、化合物1のC3位の水酸基をCrO3/C5H5Nにて化学的に酸化して調製した。
【0012】
[変換反応菌体の調製]
微生物変換反応に用いる糸状菌Glomerella fusarioidesの調製について説明する。まず、糸状菌Glomerella fusarioides、より具体的に本実施例ではGlomerella fusarioides IFO8831(財団法人 発酵研究所)をポテトデキストロース液体培地(PDB、日水製薬株式会社製)400mLにて、室温で5日間、撹拌培養を行った。さらに新たに調製したPDB3Lに植菌し、室温で3日間、大量培養を行った。培養終了後、菌体を水洗浄し、微生物変換反応に用いる変換反応菌体を調製した。
【0013】
なお、本発明においては、変換反応菌体の調製工程における培養方法としては、通常微生物の大量培養に用いられる培養法であれば特に限定はないが、例えば、上記の撹拌培養法、振盪培養法、通気培養法等を挙げることができる。ここで挙げられたいずれの培養法も、好気的条件下で行うことが好ましい。工業的培養には、通気撹拌培養法が適している。
【0014】
[微生物変換反応]
基質をジメチルスルホキシドに溶解させ、これを純水に加えて反応液を調製した。この反応溶液に変換反応菌体を加え、室温で10日間、通気培養を行った。
[化合物の単離]
反応終了後、反応溶液を酢酸エチルにて抽出を行った。この抽出物について、シリカゲルカラムクロマトグラフィー、オクタデシルシリカ(ODS)カラム分取高速液体クロマトグラフィー(HPLC)により分画を行った。なお本実施例で用いた分取HPLCのカラムは、Pegasil ODS((株)センシュー科学製、充填剤:粒子径5μm、カラム:長さ25cm×内径10mm)である。
【0015】
[シクロアルテノールの微生物変換反応]
シクロアルテノール(507mg)を基質として上記の方法で微生物変換反応を行い、その反応溶液から酢酸エチル抽出物(536mg)を得た。以下に、この酢酸エチル抽出物のシリカゲルカラムクロマトグラフィーによる分画、及び分取HPLCによる変換生成物の単離の詳細を示す。
シリカゲルカラムクロマトグラフィーによりFr.1(溶離液、n−ヘキサン:酢酸エチル=95:5;11mg)、Fr.2(n−ヘキサン:酢酸エチル=95:5;42mg)、Fr.3(n−ヘキサン:酢酸エチル=95:5;304mg)、Fr.4(n−ヘキサン:酢酸エチル=95:5;19mg)、Fr.5(n−へキサン:酢酸エチル=9:1;40mg)、Fr.6(n−ヘキサン:酢酸エチル4=1:1;21mg)、Fr.7(酢酸エチル;9mg)、Fr.8(メタノール;55mg)を得た。
【0016】
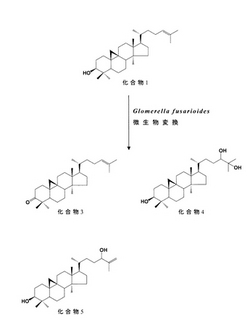
分取HPLC[展開液:メタノール−水−酢酸(95:5:1)、3.0mL/分]を行い、Fr.2から、シクロアルテノン(化合物3;24.7mg;保持時間28.8分)、Fr.4から、シクロアルタン−3β,24,25−トリオール(化合物4;4.8mg;保持時間22.4分)、Fr.5から、シクロアルト−25−エン−3β,24−ジオール(化合物5;4.1mg;保持時間23.2分)を単離した(図1参照)。なお、未反応の基質であるシクロアルテノール(化合物1)はFr.3成分として回収された。
【0017】
[24−メチレンシクロアルタノールの微生物変換反応]
24−メチレンシクロアルタノール(500mg)を基質として用い、上記の方法で微生物変換反応を行い、その反応溶液から酢酸エチル抽出物(442mg)を得た。以下に、この酢酸エチル抽出物のシリカゲルカラムクロマトグラフィーによる分画、及び分取HPLCによる変換生成物の単離の詳細を示す。
【0018】
シリカゲルカラムクロマトグラフィーによりFr.1(溶離液、n−ヘキサン:酢酸エチル=95:5;25mg)、Fr.2(n−ヘキサン:酢酸エチル=95:5;355mg)、Fr.3(n−ヘキサン:酢酸エチル=95:5;23mg)、Fr.4(n−ヘキサン:酢酸エチル=95:5;5mg)、Fr.5(n−ヘキサン:酢酸エチル=9:1;12mg)、Fr.6(n−ヘキサン:酢酸エチル=9:1;19mg)、Fr.7(n−ヘキサン:酢酸エチル=8:2;9mg)、Fr.8(n−ヘキサン:酢酸エチル=1:1;6mg)、Fr.9(酢酸エチル;8mg)、Fr.10(メタノール;31mg)を得た。
【0019】
このうち分取HPLC[展開液:メタノール−酢酸(100:1)、3.0mL/分]を行い、Fr.2からシクロユーカレノール(化合物6;4.8mg;保持時間27.2分)、24−メチルシクロアルタン−3β,24,241−トリオール(化合物7;3.7mg;保持時間8.4分)、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール(化合物8;6.5mg;保持時間18.4分)を単離した。Fr.3からシクロユーカレノール(化合物6;4.8mg;保持時間27.2分)、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール(化合物8;6.5mg;保持時間18.4分)を単離した。また分取HPLC[展開液:メタノール−水−酢酸(95:5:1)、3.0mL/分取により、Fr.5からシクロアルト−25−エン−3β,24−ジオール(化合物5;3.6mg;保持時間26.8分)を単離した(図2参照)。なお、Fr.2に未反応基質である24−メチレンシクロアルタノール(化合物2)はFr.2成分として回収された。
【0020】
[シクロアルテノンの微生物変換反応]
シクロアルテノン(568mg)を基質として上記の方法で微生物変換反応を行い、その反応溶液から酢酸エチル抽出物(546mg)を得た。以下に、この酢酸エチル抽出物のシリカゲルカラムクロマトグラフィーによる分画、及び分取HPLCによる変換生成物の単離の詳細を示す。シリカゲルカラムクロマトグラフィーによりFr.1[溶離液、n−ヘキサン:酢酸エチル=95:5;309mg]、Fr.2[n−ヘキサン:酢酸エチル=8:2;32mg]、Fr.3(n−ヘキサン:酢酸エチル=1:1;130mg)、Fr.4(酢酸エチル;30mg)、Fr.5(メタノール;107mg)を得た。
【0021】
分取HPLC[展開液:メタノール−水−酢酸(95:5:1)、3.0mL/分]を行い、Fr.1から、シクロアルタン−3,24−ジオン(化合物9;3.1mg;保持時間16.2分)、24−ヒドロキシシクロアルト−25−エン−3−オン(化合物11;5.2mg;保持時間13.8分)、24,25−ジヒドロキシシクロアルタン−3−オン(化合物13;5.3mg;保持時間8.7分)、25−ヒドロキシ−24−メトキシシクロアルタン−3−オン(化合物15;42mg;保持時間12.9分)を単離した。Fr.2から、4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン(化合物10;3.5mg;保持時間6.9分)、化合物11(5.2mg;保持時間13.8分)、シクロアルト−25−エン−3,24−ジオン(化合物12;3.0mg;保持時間19.5分)を単離した。Fr.3から、化合物13(5.3mg;保持時間8.7分)、25−ヒドロキシシクロアルト−23−エン−3−オン(化合物14;3.9mg;保持時間16.5分)、を単離した(図3参照)。なお、反応基質であるシクロアルテノンはFr.1成分として回収された。
【0022】
[化合物4〜15の構造解析及び同定について]
上記のようにして単離した12種の化合物4〜15について構造解析及び同定を行ったので説明する。化合物4〜15の構造解析はMS、IR、1H−NMR、13C−NMR、及び2次元NMR法である相関分光法(1H−1HCOSY)、異種核多量子コヒーレンス法(HMQC)、異種核遠隔多量子相関法(HMBC)、及び、核オーバーハウザー交換分光法(NOESY)を用いて行った。構造解析を行った12種の化合物4〜15の化学構造式を図1〜図3に示す。
【0023】
これらのうち、化合物7、8、10、15の4種はこれまで文献記載のない新規化合物である。新規化合物7、8、10、15の1H−NMR及び13C−NMRをHMBCデータとともに表1〜4に示した。また、図4には新規化合物7、8、10、15の炭素番号を示した構造式を、図5にはこれらの新規化合物のNOESYスペクトル法により得られた核オーバーハウザー効果(NOE)相関関係を立体構造式とともに両方向の矢印で示した。これらのNOE相関は化合物7、8、10、15について帰属した構造と矛盾はしない。
【0024】
また既知の化合物4〜6、9、11〜14の構造は、これら各化合物の種々のスペクトル値を文献(以下に示す)値と比較することにより確認した。
化合物4:稲田らPhytochemistry 46巻、2号、379−381頁、1997年
化合物5、11:CabreraらJournal of Natural Products 59巻、343−347頁、1996年
化合物6:秋久らPhytochemistry47巻、6号、1107−1110頁、1998年
化合物9、13:稲田らJournal of Natural Products 58巻、1143−1146頁、1995年
化合物12、14:DePascualらPhytochemistry 26巻、1767−1776頁、1987年
但し、これらの化合物の発癌予防効果については知られていない。
【0025】
新規化合物7、8、10、15の諸性質及びスペクトルデータを次に示す。
(1)24−メチルシクロアルタン−3β,24,241−トリオール(化合物7)
無色結晶.融点:175〜177℃.比旋光度 [α]25D:+25.50(濃度 c=0.10(g/100mL)、溶媒クロロホルム).IR νmax:3407、2928cm-1
EI−MS(m/z値、(相対イオン強度)):474(8)〔M〕+、456(30)[M−H2O]+、441(23)[m/z456−CH3]、423(30)[m/z441−H2O]+、334(23)、203(32)、175(57)、95(100).高分解能EI−MS(m/z値):474.4064(理論値C31H54O3[M−H2O]+474.4073).
1H−NMR及び13C−NMRデータはHMBCデータとともに表1に示した。
化合物7の13C−NMR(150MHz)、1H−NMR(600MHz)及びHMBCスペクトルデータ(溶媒:CDCl3)
【0026】
【表1】

【0027】
(2)241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール(化合物8)
無色結晶.融点:168〜171℃.比旋光度 [α]25D:+4.3°(濃度c=0.10(g/100mL)、溶媒クロロホルム).IR νmax:3409、2938cm-1.
EI−MS(m/z値、(相対イオン強度)):488(13)〔M〕+、470(45)[M−H2O]+、457(100)、438(37)[m/z470−HOCH3]、423(52)[m/z438−CH3]、317(83)、175(44)、95(68).
高分解能EI−MS(m/z値):488.4228(理論値C31H56O3[M]+488.4229).
1H−NMR及び13C−NMRデータはHMBCデータとともに表2に示した。
化合物8の13C−NMR(150MHz)、1H−NMR(600MHz)及びHMBCスペクトルデータ(溶媒:CDCl3)
【0028】
【表2】

【0029】
(3)4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン(化合物10)
無色結晶.融点:165〜168℃.比旋光度 [α]25D:+8.30(濃度c=0.16(g/100mL)、溶媒クロロホルム).IR νmax:2931、1710cm-1.
EI−MS(m/z値、(相対イオン強度)):356(100)〔M〕+、341(52)[M−CH3]+、313(52)[m/z341−CO]、271(26)[m/z313−C3H6]、218(100)[m/z271−C4H6]、175(70)、137(50)、121(47)、107(60)、95(68).
高分解能EI−MS(m/z値):356.2714(理論値C24H36O2[M]+356.2715).
1H−NMR及び13C−NMRデータはHMBCデータとともに表3に示した。
化合物10の13C−NMR(150MHz)、1H−NMR(600MHz)及びHMBCスペクトルデータ(溶媒:CDCl3)
【0030】
【表3】

【0031】
(4)25−ヒドロキシ−24−メトキシシクロアルタン−3−オン(化合物15)
無色結晶.融点:198〜199℃.比旋光度 [α]25D:+16.40(濃度c=0.18(g/100mL)、溶媒クロロホルム).IR νmax:3445、2931、1710cm-1.
EI−MS(m/z値、(相対イオン強度)):472(15)〔M〕+、440(45)[M−HOCH3]+、313(50)[M−側鎖(C9H19O2)]+、271
(5)、73(100).
高分解能EI−MS(m/z値):472.3924(理論値C31H52O3[M]+472.3916)
1H−NMR及び13C−NMRデータはHMBCデータとともに表4に示した
化合物15の13C−NMR(150MHz)、1H−NMR(600MHz)及びHMBCスペクトルデータ(溶媒:CDCl3)
【0032】
【表4】

【0033】
以下に新規化合物7、8、10、15の構造決定について述べる(図4参照)。
化合物7は、高分解能EI−MS(〔M〕+m/z474.4064)及び13C−NMRより分子式C31H54O3を持つ事が示された。また本化合物はIRスペクトル、1H−NMR、13C−NMRからメチレン基〔δH 0.33(d、J=4.4Hz)、0.55(d、J=4.2Hz)〕の存在が示され、シクロプロピル基の存在が示唆された。さらに4個の第3級メチル基〔δH 0.81、0.89、0.97、0.97(各s)〕、1個の第2級メチル基〔δH 0.90(d、J=7.3Hz)〕、インプロピル基〔δH 0.93(d、J=6.3Hz)、0.94(d、J=6.8Hz)〕、そして1個のヒドロキシメチン基〔3407cm-1;δH 3.28(m);δC 78.8〕、1個のヒドロキシメチレン基〔δH 3.47(d、J=11.3Hz)、3.62(d、J=10.7Hz);δC 65.9〕の存在が示唆された。EI−MSではm/z456にH2Oの脱離によるイオン、m/z441に(m/z456−CH3)に対応するイオン、m/z423に(m/z441−H2O)に対応するイオンが観測された。これらの値とシクロアルタン系化合物の文献値(De Pascualら Phytochemistry 26巻、1767−1776頁、1987年)と比較し、化合物7は24−メチルシクロアルタン−3β,24,241−トリオール構造を持つ事が明らかとなった。本構造が正しい事は、1H−1HCOSY、HMQC、HMBC、及びNOESYスペクトルの解析により確認した。
【0034】
化合物8は、高分解能EI−MS(〔M〕+m/z488.4229)及び13C−NMRより分子式C32H56O3を持つ事が示された。また本化合物はIRスペクトル、1H−NMR、13C−NMRからメチレン基〔δH 0.33(d、J=4.4Hz)、0.55(d、J=4.2Hz)〕の存在が示され、シクロプロピル基の存在が示唆された。さらに4個の第3級メチル基〔δH 0.81、0.90、0.97、0.97(各s)〕、1個の第2級メチル基〔δH 0.90(d、J=6.5Hz)〕、インプロピル基〔δH 0.92(d、J=6.3Hz)、0.94(d、J=6.8Hz)〕、そして1個のヒドロキシメチン基〔3409cm-1;δH 3.29(m);δC 78.9〕、1個のメトキシル基〔δH 3.23(m);δC 49.4]の存在が示唆された。EI−MSではm/z470にH2Oの脱離によるイオン、m/z438にC24−C241の開裂によりHOCH3が脱離したイオンが観測された。これらを化合物7のスペクトル値と比較し、化合物8は241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール構造を持つ事が明らかとなった。本構造が正しい事は、1H−1HCOSY、HMQC、HMBC、及びNOESYスペクトルの解析により確認した。
【0035】
化合物10は高分解能EI−MS(〔M〕+m/z356.2714)及び13C−NMRより分子式C24H36O2を持つ事が示された。また本化合物はIRスペクトル、1H−NMR、13C−NMRからメチレン基〔δH 0.57(d、J=4.6Hz)、0.82(d、J=4.3Hz)〕の存在が示され、シクロプロピル基の存在が示唆された。さらに4個の第3級メチル基〔δH 0.93、0.98、1.05、1.10、2.12(各s)〕、そして2個のカルボニル基〔1710cm-1;δC 210.3、216.4〕の存在が示唆された。EI−MSではm/z341にC20‐C21の開裂によりC21メチル基が脱離した開裂イオン、m/z313にC17‐C20の開裂によりCH3COが脱離したイオンが観測された。これらのスペクトル値、及びシクロアルタン系化合物の文献値(BarikらPhytochemistry 35巻、1001−1004頁、1994年)と比較し、化合物10は4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン構造を持つ事が明らかとなった。本構造が正しい事は、1H−1HCOSY、HMQC、HMBC、及びNOESYスペクトルの解析により確認した。
【0036】
化合物15は高分解能EI−MS(〔M〕+m/z472.3924)及び13C−NMRより分子式C31H52O3を持つ事が示された。また本化合物はIRスペクトル、1H−NMR、13C−NMRからメチレン基〔δH 0.57(d、J=4.2Hz)、0.79(d、J=3.7Hz)〕の存在が示され、シクロプロピル基の存在が示唆された。さらに4個の第3級メチル基〔δH 0.91、1.00、1.05、1.10、(各s)〕、1個の第2級メチル基〔δH 0.89(d、J=6.4Hz)〕、インプロピル基〔δH 1.10、1.13(各s)、そしてヒドロキシル基〔3445cm-1〕、カルボニル基〔1710cm-1;δC 213.0〕、メトキシル基(δH 3.23(s);δC 49.1)の存在が示唆された。EI−MSではm/z440にC24位のCH3OH脱離によるイオン、m/z313にC17‐C20の開裂により側鎖(C9H19O2)が脱離した開裂イオン、更にm/z271にC13‐C17とC14‐C15の結合開裂による、1Hを伴ったD環の開裂イオンが観測された。これらの値とシクロアルタン系化合物の文献値(稲田らPhytochemistry 46巻、379−381頁、1997年)、化合物13のスペクトル値との比較により、化合物15は25−ヒドロキシ−24−メトキシシクロアルタン−3−オン構造を持つ事が明らかとなった。本構造が正しい事は、1H−1HCOSY、HMQC、HMBC、及びNOESYスペクトルの解析により確認した。
【0037】
なお、化合物7、8は、24−メチレンシクロアルタノール(化合物2)の化学的変換反応によって得られるものであってもよい。化学的変換反応を用いた化合物7,8の合成方法を以下に示す(図5参照)。
[化合物7の化学的方法による調製]
(1)化合物2(100mg)を塩化メチレンに溶解させ、炭酸水素ナトリウム(250mg)、m−クロロ過安息香酸(500mg)を加え、室温にて48時間、撹拌した。
(2)反応終了後、反応溶液を1N水酸化ナトリウム水溶液にて洗浄し、続いて塩化メチレン層は水で洗浄した。
【0038】
(3)分取HPLC[溶離液:メタノール;流速3.0mL/分]を行い、24,241−エポキシシクロアルタン−3β−オール(化合物16;31.6mg;保持時間16.8分)を得た。
(4)化合物16(8.7mg)を1,2−ジメトキシエタンに溶解させ、過塩素酸水溶液(2mL)を加え、室温にて16時間、撹拌した。
(5)反応終了後、ジエチルエーテルにて抽出し、エーテル層を1M炭酸ナトリウム、続いて水で洗浄した。エーテル抽出部は分取HPLC[溶離液:メタノール;流速3.0mL/分]を行い、化合物7(2.6m;保持時間12.9分)を得た。
【0039】
上述した本発明のシクロアルタン型トリテルペン系化合物は、単独であるいは混合して用いることができる。
また、本発明のシクロアルタン型トリテルペン系化合物は、適当な医薬用の担体又は希釈剤と組み合わせて医薬とすることができ、通常の如何なる方法によっても製剤化でき、経口又は非経口投与するための固体、半固体又は液体の剤形に処方することができる。処方にあたっては、他の医薬活性成分との配合剤としてもよい。
【0040】
例えば、日本薬局方に記載されている各種製剤、即ち、錠剤、丸剤、カプセル剤、顆粒剤、散剤、乾燥エキス剤、トローチ剤等の内用固形製剤、流エキス剤、エリキシル剤、酒精剤、シロップ剤、リモナーデ剤等の内容液剤、チンキ剤、リニメント剤、ローション剤等の外用液剤、硬膏剤、軟膏剤、パップ剤等の外用剤などに製剤化できる。また、投与可能であるならば、吸入剤、エアゾール剤、注射剤、点眼剤、座剤等にも用途に応じて製剤化してもよい。
【0041】
経口投与においては、成人に対し体重1kg当り0.5〜500mg/日の範囲で投与するのが好ましい。
また、本発明のシクロアルタン型トリテルペン系化合物は発癌予防の薬剤として使用するだけでなく、種々の飲食品に添加し、発癌予防に有効な機能性飲食品を製造するのにも有用なものである。このような機能性飲食品の形態の例としては、顆粒、錠菓、ゼリー、飴、飲料などが挙げられる。さらに、本発明のシクロアルタン型トリテルペン系化合物は、人間の食べる食品としてだけでなく、ペット、家畜、競技用動物などの人間以外の動物の飼料に添加して利用され得る。
【0042】
[化合物8の化学的方法による調製]
(1)〜(3) 上記(1)〜(3)と同じようにして、化合物16を得た。
(4)化合物16(8.7mg)を1,2−ジメトキシエタンに溶解させ、過塩素酸/メタノール(2mL)を加え、室温にて16時間、撹拌した。
(5)反応終了後、ジエチルエーテルにて抽出し、エーテル層を1M炭酸ナトリウム、続いて水で洗浄した。エーテル抽出部は分取HPLC[溶離液:メタノール;流速3.0mL/分]を行い、化合物8(1.7mg;保持時間18.3分)を得た。
【0043】
[発癌予防効果の確認試験について]
次に、本発明の効果を確認するために行った試験について説明する。
(Epstein−Barrウイルス(EBV)活性化抑制試験)
本研究者らは、EBVのゲノムを内蔵するバーキット・リンパ腫由来の培養細胞であるRaji(ラジ)株において、EBV・ゲノムの発現を阻害する化合物の多くが、マウス皮膚発癌二段階実験において抗発癌プロモーターとして作用する点に注目した。そして米糠抽出物から得られるシクロアルタン系トリテルペノイドの糸状菌による微生物変換反応から得られた変換生成物からEBV・ゲノムの発現を阻害するウイルス・ゲノム不活性化物質を探索した。EBV・ゲノムの発現阻害作用に着目したこの方法はRaji(ラジ)株培養系に、発癌プロモーターであるTPA(テトラデカノイルホルボールアセタート)と、活性発現のために相乗作用として働くn−酪酸、それに被験物質を加えて培養し、TPAにより活性化された細胞由来の抗体を用いる間接蛍光抗体法で検出する方法である。この方法は、迅速、かつ定量性に優れ、加えて、微量活性成分の検出が可能な点で優れた方法である。
【0044】
まず、試験の手順について図7のスキームを参照しながら説明する。なお、本手順は、徳田らの方法(Cancer Letters、40巻、309頁、1998)に準拠している。
(1)1×106/mLのラジ細胞に、発癌プロモーターとして、20ng/mLの濃度の12−O−テトラデカノイルホルボール−13−アセタート(TPA)を32pmo1加え、さらにTPAの活性発現のために相乗作用として働くn−酪酸を加えた。
(2)そこに、水、エタノール、又はジメチルスルホキシドに溶解した所定量の被験物質を添加して、37℃で48時間培養した。
(3)培養終了後、上咽頭癌患者の血清(TPAにより活性化された細胞由来の抗体を含む)を用いた間接蛍光抗体法によりEBV早期抗原の発現を検出した。
【0045】
上記の手順に従って検定を行った後、TPAのみを加えた群(コントロール)のEBV早期抗原の発現率を100%として、被験物質添加群のEBV早期抗原の発現率を求め、次式(1)により被験物質のEBV早期抗原の発現阻害率(%)を算出した。
EBV早期抗原の発現阻害率(%)=
100−被験物質添加群のEBV早期抗原の発現率(%)・・・式(1)
検定は、前述のように糸状菌Glomerella fusarioidesによるシクロアルタン系トリテルペノイドの変換反応より得た化合物1〜15を被験物質とし、各被験物質を種々の濃度(被験物質/TPAのモル比)に調製して行った。この検定の結果を表5に示す。
シクロアルタン型トリテルペン(化合物1〜15)のEBV早期抗原の発現阻害率(%)
【0046】
【表5】

【0047】
なお、被検物質の濃度が1000倍モル濃度の欄の括弧内の数値は、ラジ細胞の生存率(%)を示す。この数値が高い方が正常細胞に対する悪影響が小さい、すなわち安全性が高いと言える。表5に示されるように、これらの化合物の阻害率は、TPAに対し100倍モル濃度の時28〜37%であり、高い活性を有している。特に24−メチルシクロアノレタン−3β,24,241−トリオール(化合物7)、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール(化合物8)は10倍モル濃度の時15%以上と非常に高い活性を有しており、抗発癌プロモーター活性に優れる事が確認された。また、この阻害率は、ビタミンA誘導体であり、その発がん予防効果が種々の動物実験でも確認されているβ−カロテン(村上ら、Biosci. Biotech. Biochem.、60巻、1頁、1996)よりも高い値を示した。さらに、これらは本検定において高いラジ細胞生存率を示したことから、高い安全性を持つ発癌予防剤として期待できる。
【0048】
さらに、本発明の効果を試験するために化合物1〜15をNO(一酸化窒素)障害に対する抑制試験を行い、活性を示したので説明する。
(NOR1処理による細胞形態変化抑制試験)
(±)−(E)−4−メチル−2−[(E)−ハイドロキシイミノ]−5−ニトロ−6ムメトキシ−3−ヘキセナミド(NOR1)処理による細胞形態変化抑制試験は、発癌イニシエーターの一次スクリーニング法として知られた試験である。NOはガス状のフリーラジカルであり、その過剰産生が慢性化すると、胃がんや大腸がんの危険性が高まるといわれている。このことから、NOの過剰生産を抑制することが発癌予防に有効であるといえる。この試験は迅速、かつ微量活性成分の検出が可能な点で優れた試験である
【0049】
試験方法について説明する。なお、本手順は、秋久らの方法(Cancer Letters 205巻、9−13頁、2004年)に準拠している。
(1)イーグルの最小必要培地より得た5×105/mLのヒト正常肝由来細胞を3日間培養する。
(2)そこに被検物質を加え、その1分後にNOドナーであるNOR1を加えCO2インキュベーターで培養する。
(3)細胞の形態変化を光学顕微鏡にて測定する。(250以上の形態変化を示した細胞数を測定する。)
【0050】
上記の手順に従って試験を行なった後、被検物質を加えない群をコントロールとし、次式によりNOR1処理によるNO産性抑制率を算出した。
NOR1処理による細胞形態変化抑制率
=NOR1のみで形態変化した細胞(%)/NOR1と被検物質を加えたときの形態変化した細胞(%)…式(2)
【0051】
前述のように糸状菌Glomerella fusarioidesによるシクロアルタン系トリテルペノイドの変換反応より得た化合物(1〜15)を被験物質として行った検定の結果を表6に示す。なお、参照化合物として、発癌予防効果が知られているクルクミン(Cancer Letters159巻、135頁、2000年)と、NOスカベンジャーである2−(4−カルボキシフェニル)−4,4,5,5−テトラメチルイミダゾリン−1−オキシル 3−オキシド ナトリウム塩(カルボキシ−PTIO)の値も示した。
シクロアルタン型トリテルペン(化合物1〜15)のNO障害に対する抑制率
【0052】
【表6】

【0053】
表6に示されるように、化合物7、8は参照化合物であるクルクミンと同程度の活性を示した。このことから、これらの化合物は抗発癌イニシエーター活性に優れることが確認された。
【図面の簡単な説明】
【0054】
【図1】糸状菌によるシクロアルテノール(化合物1)の微生物変換反応生成物(化合物3〜5)の化学構造式を示す図である。
【図2】糸状菌による24−メチレンシクロアルタノール(化合物2)の微生物変換反応生成物(化合物5〜8)の化学構造式を示す図である。
【図3】糸状菌によるシクロアルテノン(化合物3)の微生物変換反応生成物(化合物9〜15)の化学構造式を示す図である。
【図4】新規化合物7、8、10、15の化学構造式を示す図である。
【図5】本発明に係る新規化合物7、8、10、15のNOESYスペクトル法により得られた核オーバーハウザー効果(NOE)相関関係を説明する図である。
【図6】化合物7、8を化学的に合成する方法を示す図である。
【図7】EBV活性化抑制試験の手順を説明する図である。
【技術分野】
【0001】
本発明は発癌予防剤及びシクロアルタン型トリテルペン系化合物の製造方法に関し、特にシクロアルタン型トリテルペン系化合物を含有する発癌予防剤及びシクロアルタン型トリテルペン系化合物の製造方法に関する。
【背景技術】
【0002】
従来から、発癌予防剤としてトリテルペン系化合物は知られている(特許文献1参照)。この特許文献1では、米糠成分を処理して得られるγ−オリザノールを化学的に変換することで、発癌予防に有効な数種のトリテルペン系化合物を得る技術が示されている。
【特許文献1】特開2003−277269号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、発癌予防の大きなニーズに鑑みて、さらに安全で有効な発癌予防剤が得られないものかとの期待は大きい。
本発明は、上述の課題に鑑みてなされたものであり、安全で有効な発癌予防剤を提供することを目的としている。
【課題を解決するための手段】
【0004】
本発明者らは、上記の課題を解決することを目的として、従来から安全性及び優れた発癌予防効果が報告されているシクロアルタン型トリテルペン系化合物に着目し、さらに優れた発癌予防効果を有する化合物を探索すべく鋭意研究を行った。その結果、糸状菌を用いることで、優れた発癌予防効果を有するシクロアルタン型トリテルペン系化合物を得ることができるのを見出した。すなわち本発明の請求項1による発癌予防剤は、シクロユーカレノール、24−メチルシクロアルタン−3β,24,241−トリオール、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール、シクロアルタン−3,24−ジオン、4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン、24,25−ジヒドロキシシクロアルタン−3−オン、25−ヒドロキシシクロアルト−23−エン−3−オン、25−ヒドロキシ−24−メトキシシクロアルタン−3−オンからなる群から選ばれた少なくとも1種のシクロアルタン型トリテルペン系化合物を含有することを特徴とする。
【0005】
上述したシクロアルタン型トリテルペンであれば、発癌予防効果に優れ、かつ、案税も高い。
なお、上述した本発明の化合物には、医学的に使用され薬理学的に許容される各化合物の塩も含むものであるもの。このような塩として、例えば、ナトリウム塩、カリウム塩、リチウム塩、のようなアルカリ金属塩、カルシウム塩、マグネシウム塩、のようなアルカリ土類金属塩、アルミニウム塩、鉄塩、亜鉛塩、銅塩、ニッケル塩、コバルト塩等の金属塩;アンモニウム塩のような無機塩、t−オクチルアミン塩、ジベンジルアミン塩、モルホリン塩、グルコサミン塩、フェニルグリシンアルキルエステル塩、エチレンジアミン塩、N−メチルグルカミン塩、グアニジン塩、ジエチルアミン塩、トリエチルアミン塩、ジシクロヘキシルアミン塩、N,N'−ジベンジルエチレンジアミン塩、クロロプロカイン塩、プロカイン塩、ジエタノールアミン塩、N−ベンジル−フェネチルアミン塩、ピペラジン塩、テトラメチルアンモニア塩、トリス(ヒドロキシメチル)アミノメタン塩のような有機アミン塩;及び、グリシン塩、リジン塩、アルギニン塩、オルニチン塩、アスパラギン塩のようなアミノ酸塩等を挙げることができる。
【0006】
また、上述した請求項1に記載の本発明の化合物が溶剤和物(例えば水和物)を形成する場合は、これらもすべて本発明に含まれる。例えば、本発明の化合物が、大気中に放置されたり、または再結晶することにより、水分を吸収し、吸着水が付着したり、水和物を形成する場合がある。本発明にはこのような溶剤和物も含まれる。
さらに、請求項1に記載の本発明の化合物は、それぞれいくつかの不斉炭素原子を有しており、このため、種々の光学異性体が存在する。本発明においては、特に記述しない限り、ラセミ化合物を含むこれらの異性体及びこれらの異性体の混合物をもすべて含むものである。
【0007】
また、本発明の請求項2による発癌予防剤は、請求項1において、前記シクロアルタン型トリテルペン系化合物は、米糠成分を処理して得た化合物を基質とした糸状菌による微生物変換反応から得られる反応生成物、あるいは米糠成分を処理して得た化合物の化学的変換反応によって得られる反応生成物であることを特徴とする。
さらに、本発明は新規で優れた発癌予防効果を有するシクロアルタン型トリテルペン系化合物を提供するのみでなく、自律神経失調治療薬等としても有用なシクロアルタン型トリテルペン系化合物の新たな製造方法を提供するものである点において重要な意味を有する。すなわち、本発明の請求項3によるは、米糠成分を処理して得られる化合物を基質として糸状菌による微生物変換を行うことでシクロアルタン型トリテルペン系化合物を得ることを特徴とする。
【0008】
米糠成分を処理して得られる化合物を基質として糸状菌による微生物変換を行うことでシクロアルタン型トリテルペン系化合物を得ることができる。これは、より安全なシクロアルタン型トリテルペン系化合物の製造の可能性、糸状菌の大量培養、変換反応の関連遺伝子を組み込んだ形質転換体の培養や糸状菌から抽出される変換反応の関連酵素の利用による大量製造の可能性を示唆するものである。
ここで、用いることができる糸状菌としては、例えばGlomerella属、Mortierella属、Chaetomium属、Aspergillus属などが挙げられる。Glomerella属の中でも、さらにGlomerella fusarioidesが好ましい。
【発明の効果】
【0009】
本発明によれば、安全かつ発癌予防効果に優れた発癌予防剤が提供される。
【発明を実施するための最良の形態】
【0010】
次に、実施例により本発明を具体的に説明する。すなわち、本発明に係る微生物変換反応による発癌予防効果を有する化合物の生成、単離、単離された化合物の同定及び構造解析、並びに、本発明に係る発癌予防剤の効果確認試験について説明する。
[基質の調製]
微生物変換反応の基質であるシクロアルテノール(以下、本明細書では「化合物1」と記すこともある。)、24−メチレンシクロアルタノール(以下、本明細書では「化合物2」と記すこともある。)、及び、シクロアルテノン(以下、本明細書では「化合物3」と記すこともある。)の調製について説明する。
【0011】
まず、γ−オリザノールから、文献記載(L. J. Goad、T. Akihisa、“Analysis of Sterols”、Blackie Academic & Professional、ロンドン、292項、1997年)の方法に基づき、分別再結晶法により、シクロアルテノールフェルラート及び24−メチレンシクロアルタノールフェルラートを調製した。その後、シクロアルテノールフェルラート及び24−メチレンシクロアルタノールフェルラートを、それぞれアルカリ加水分解(5%水酸化カリウム・メタノール溶液;加熱還流;3時間)することで、シクロアルテノール(化合物1)及び24−メチレンシクロアルタノール(化合物2)を調製した。またシクロアルテノン(化合物3)は、化合物1のC3位の水酸基をCrO3/C5H5Nにて化学的に酸化して調製した。
【0012】
[変換反応菌体の調製]
微生物変換反応に用いる糸状菌Glomerella fusarioidesの調製について説明する。まず、糸状菌Glomerella fusarioides、より具体的に本実施例ではGlomerella fusarioides IFO8831(財団法人 発酵研究所)をポテトデキストロース液体培地(PDB、日水製薬株式会社製)400mLにて、室温で5日間、撹拌培養を行った。さらに新たに調製したPDB3Lに植菌し、室温で3日間、大量培養を行った。培養終了後、菌体を水洗浄し、微生物変換反応に用いる変換反応菌体を調製した。
【0013】
なお、本発明においては、変換反応菌体の調製工程における培養方法としては、通常微生物の大量培養に用いられる培養法であれば特に限定はないが、例えば、上記の撹拌培養法、振盪培養法、通気培養法等を挙げることができる。ここで挙げられたいずれの培養法も、好気的条件下で行うことが好ましい。工業的培養には、通気撹拌培養法が適している。
【0014】
[微生物変換反応]
基質をジメチルスルホキシドに溶解させ、これを純水に加えて反応液を調製した。この反応溶液に変換反応菌体を加え、室温で10日間、通気培養を行った。
[化合物の単離]
反応終了後、反応溶液を酢酸エチルにて抽出を行った。この抽出物について、シリカゲルカラムクロマトグラフィー、オクタデシルシリカ(ODS)カラム分取高速液体クロマトグラフィー(HPLC)により分画を行った。なお本実施例で用いた分取HPLCのカラムは、Pegasil ODS((株)センシュー科学製、充填剤:粒子径5μm、カラム:長さ25cm×内径10mm)である。
【0015】
[シクロアルテノールの微生物変換反応]
シクロアルテノール(507mg)を基質として上記の方法で微生物変換反応を行い、その反応溶液から酢酸エチル抽出物(536mg)を得た。以下に、この酢酸エチル抽出物のシリカゲルカラムクロマトグラフィーによる分画、及び分取HPLCによる変換生成物の単離の詳細を示す。
シリカゲルカラムクロマトグラフィーによりFr.1(溶離液、n−ヘキサン:酢酸エチル=95:5;11mg)、Fr.2(n−ヘキサン:酢酸エチル=95:5;42mg)、Fr.3(n−ヘキサン:酢酸エチル=95:5;304mg)、Fr.4(n−ヘキサン:酢酸エチル=95:5;19mg)、Fr.5(n−へキサン:酢酸エチル=9:1;40mg)、Fr.6(n−ヘキサン:酢酸エチル4=1:1;21mg)、Fr.7(酢酸エチル;9mg)、Fr.8(メタノール;55mg)を得た。
【0016】
分取HPLC[展開液:メタノール−水−酢酸(95:5:1)、3.0mL/分]を行い、Fr.2から、シクロアルテノン(化合物3;24.7mg;保持時間28.8分)、Fr.4から、シクロアルタン−3β,24,25−トリオール(化合物4;4.8mg;保持時間22.4分)、Fr.5から、シクロアルト−25−エン−3β,24−ジオール(化合物5;4.1mg;保持時間23.2分)を単離した(図1参照)。なお、未反応の基質であるシクロアルテノール(化合物1)はFr.3成分として回収された。
【0017】
[24−メチレンシクロアルタノールの微生物変換反応]
24−メチレンシクロアルタノール(500mg)を基質として用い、上記の方法で微生物変換反応を行い、その反応溶液から酢酸エチル抽出物(442mg)を得た。以下に、この酢酸エチル抽出物のシリカゲルカラムクロマトグラフィーによる分画、及び分取HPLCによる変換生成物の単離の詳細を示す。
【0018】
シリカゲルカラムクロマトグラフィーによりFr.1(溶離液、n−ヘキサン:酢酸エチル=95:5;25mg)、Fr.2(n−ヘキサン:酢酸エチル=95:5;355mg)、Fr.3(n−ヘキサン:酢酸エチル=95:5;23mg)、Fr.4(n−ヘキサン:酢酸エチル=95:5;5mg)、Fr.5(n−ヘキサン:酢酸エチル=9:1;12mg)、Fr.6(n−ヘキサン:酢酸エチル=9:1;19mg)、Fr.7(n−ヘキサン:酢酸エチル=8:2;9mg)、Fr.8(n−ヘキサン:酢酸エチル=1:1;6mg)、Fr.9(酢酸エチル;8mg)、Fr.10(メタノール;31mg)を得た。
【0019】
このうち分取HPLC[展開液:メタノール−酢酸(100:1)、3.0mL/分]を行い、Fr.2からシクロユーカレノール(化合物6;4.8mg;保持時間27.2分)、24−メチルシクロアルタン−3β,24,241−トリオール(化合物7;3.7mg;保持時間8.4分)、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール(化合物8;6.5mg;保持時間18.4分)を単離した。Fr.3からシクロユーカレノール(化合物6;4.8mg;保持時間27.2分)、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール(化合物8;6.5mg;保持時間18.4分)を単離した。また分取HPLC[展開液:メタノール−水−酢酸(95:5:1)、3.0mL/分取により、Fr.5からシクロアルト−25−エン−3β,24−ジオール(化合物5;3.6mg;保持時間26.8分)を単離した(図2参照)。なお、Fr.2に未反応基質である24−メチレンシクロアルタノール(化合物2)はFr.2成分として回収された。
【0020】
[シクロアルテノンの微生物変換反応]
シクロアルテノン(568mg)を基質として上記の方法で微生物変換反応を行い、その反応溶液から酢酸エチル抽出物(546mg)を得た。以下に、この酢酸エチル抽出物のシリカゲルカラムクロマトグラフィーによる分画、及び分取HPLCによる変換生成物の単離の詳細を示す。シリカゲルカラムクロマトグラフィーによりFr.1[溶離液、n−ヘキサン:酢酸エチル=95:5;309mg]、Fr.2[n−ヘキサン:酢酸エチル=8:2;32mg]、Fr.3(n−ヘキサン:酢酸エチル=1:1;130mg)、Fr.4(酢酸エチル;30mg)、Fr.5(メタノール;107mg)を得た。
【0021】
分取HPLC[展開液:メタノール−水−酢酸(95:5:1)、3.0mL/分]を行い、Fr.1から、シクロアルタン−3,24−ジオン(化合物9;3.1mg;保持時間16.2分)、24−ヒドロキシシクロアルト−25−エン−3−オン(化合物11;5.2mg;保持時間13.8分)、24,25−ジヒドロキシシクロアルタン−3−オン(化合物13;5.3mg;保持時間8.7分)、25−ヒドロキシ−24−メトキシシクロアルタン−3−オン(化合物15;42mg;保持時間12.9分)を単離した。Fr.2から、4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン(化合物10;3.5mg;保持時間6.9分)、化合物11(5.2mg;保持時間13.8分)、シクロアルト−25−エン−3,24−ジオン(化合物12;3.0mg;保持時間19.5分)を単離した。Fr.3から、化合物13(5.3mg;保持時間8.7分)、25−ヒドロキシシクロアルト−23−エン−3−オン(化合物14;3.9mg;保持時間16.5分)、を単離した(図3参照)。なお、反応基質であるシクロアルテノンはFr.1成分として回収された。
【0022】
[化合物4〜15の構造解析及び同定について]
上記のようにして単離した12種の化合物4〜15について構造解析及び同定を行ったので説明する。化合物4〜15の構造解析はMS、IR、1H−NMR、13C−NMR、及び2次元NMR法である相関分光法(1H−1HCOSY)、異種核多量子コヒーレンス法(HMQC)、異種核遠隔多量子相関法(HMBC)、及び、核オーバーハウザー交換分光法(NOESY)を用いて行った。構造解析を行った12種の化合物4〜15の化学構造式を図1〜図3に示す。
【0023】
これらのうち、化合物7、8、10、15の4種はこれまで文献記載のない新規化合物である。新規化合物7、8、10、15の1H−NMR及び13C−NMRをHMBCデータとともに表1〜4に示した。また、図4には新規化合物7、8、10、15の炭素番号を示した構造式を、図5にはこれらの新規化合物のNOESYスペクトル法により得られた核オーバーハウザー効果(NOE)相関関係を立体構造式とともに両方向の矢印で示した。これらのNOE相関は化合物7、8、10、15について帰属した構造と矛盾はしない。
【0024】
また既知の化合物4〜6、9、11〜14の構造は、これら各化合物の種々のスペクトル値を文献(以下に示す)値と比較することにより確認した。
化合物4:稲田らPhytochemistry 46巻、2号、379−381頁、1997年
化合物5、11:CabreraらJournal of Natural Products 59巻、343−347頁、1996年
化合物6:秋久らPhytochemistry47巻、6号、1107−1110頁、1998年
化合物9、13:稲田らJournal of Natural Products 58巻、1143−1146頁、1995年
化合物12、14:DePascualらPhytochemistry 26巻、1767−1776頁、1987年
但し、これらの化合物の発癌予防効果については知られていない。
【0025】
新規化合物7、8、10、15の諸性質及びスペクトルデータを次に示す。
(1)24−メチルシクロアルタン−3β,24,241−トリオール(化合物7)
無色結晶.融点:175〜177℃.比旋光度 [α]25D:+25.50(濃度 c=0.10(g/100mL)、溶媒クロロホルム).IR νmax:3407、2928cm-1
EI−MS(m/z値、(相対イオン強度)):474(8)〔M〕+、456(30)[M−H2O]+、441(23)[m/z456−CH3]、423(30)[m/z441−H2O]+、334(23)、203(32)、175(57)、95(100).高分解能EI−MS(m/z値):474.4064(理論値C31H54O3[M−H2O]+474.4073).
1H−NMR及び13C−NMRデータはHMBCデータとともに表1に示した。
化合物7の13C−NMR(150MHz)、1H−NMR(600MHz)及びHMBCスペクトルデータ(溶媒:CDCl3)
【0026】
【表1】

【0027】
(2)241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール(化合物8)
無色結晶.融点:168〜171℃.比旋光度 [α]25D:+4.3°(濃度c=0.10(g/100mL)、溶媒クロロホルム).IR νmax:3409、2938cm-1.
EI−MS(m/z値、(相対イオン強度)):488(13)〔M〕+、470(45)[M−H2O]+、457(100)、438(37)[m/z470−HOCH3]、423(52)[m/z438−CH3]、317(83)、175(44)、95(68).
高分解能EI−MS(m/z値):488.4228(理論値C31H56O3[M]+488.4229).
1H−NMR及び13C−NMRデータはHMBCデータとともに表2に示した。
化合物8の13C−NMR(150MHz)、1H−NMR(600MHz)及びHMBCスペクトルデータ(溶媒:CDCl3)
【0028】
【表2】

【0029】
(3)4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン(化合物10)
無色結晶.融点:165〜168℃.比旋光度 [α]25D:+8.30(濃度c=0.16(g/100mL)、溶媒クロロホルム).IR νmax:2931、1710cm-1.
EI−MS(m/z値、(相対イオン強度)):356(100)〔M〕+、341(52)[M−CH3]+、313(52)[m/z341−CO]、271(26)[m/z313−C3H6]、218(100)[m/z271−C4H6]、175(70)、137(50)、121(47)、107(60)、95(68).
高分解能EI−MS(m/z値):356.2714(理論値C24H36O2[M]+356.2715).
1H−NMR及び13C−NMRデータはHMBCデータとともに表3に示した。
化合物10の13C−NMR(150MHz)、1H−NMR(600MHz)及びHMBCスペクトルデータ(溶媒:CDCl3)
【0030】
【表3】

【0031】
(4)25−ヒドロキシ−24−メトキシシクロアルタン−3−オン(化合物15)
無色結晶.融点:198〜199℃.比旋光度 [α]25D:+16.40(濃度c=0.18(g/100mL)、溶媒クロロホルム).IR νmax:3445、2931、1710cm-1.
EI−MS(m/z値、(相対イオン強度)):472(15)〔M〕+、440(45)[M−HOCH3]+、313(50)[M−側鎖(C9H19O2)]+、271
(5)、73(100).
高分解能EI−MS(m/z値):472.3924(理論値C31H52O3[M]+472.3916)
1H−NMR及び13C−NMRデータはHMBCデータとともに表4に示した
化合物15の13C−NMR(150MHz)、1H−NMR(600MHz)及びHMBCスペクトルデータ(溶媒:CDCl3)
【0032】
【表4】

【0033】
以下に新規化合物7、8、10、15の構造決定について述べる(図4参照)。
化合物7は、高分解能EI−MS(〔M〕+m/z474.4064)及び13C−NMRより分子式C31H54O3を持つ事が示された。また本化合物はIRスペクトル、1H−NMR、13C−NMRからメチレン基〔δH 0.33(d、J=4.4Hz)、0.55(d、J=4.2Hz)〕の存在が示され、シクロプロピル基の存在が示唆された。さらに4個の第3級メチル基〔δH 0.81、0.89、0.97、0.97(各s)〕、1個の第2級メチル基〔δH 0.90(d、J=7.3Hz)〕、インプロピル基〔δH 0.93(d、J=6.3Hz)、0.94(d、J=6.8Hz)〕、そして1個のヒドロキシメチン基〔3407cm-1;δH 3.28(m);δC 78.8〕、1個のヒドロキシメチレン基〔δH 3.47(d、J=11.3Hz)、3.62(d、J=10.7Hz);δC 65.9〕の存在が示唆された。EI−MSではm/z456にH2Oの脱離によるイオン、m/z441に(m/z456−CH3)に対応するイオン、m/z423に(m/z441−H2O)に対応するイオンが観測された。これらの値とシクロアルタン系化合物の文献値(De Pascualら Phytochemistry 26巻、1767−1776頁、1987年)と比較し、化合物7は24−メチルシクロアルタン−3β,24,241−トリオール構造を持つ事が明らかとなった。本構造が正しい事は、1H−1HCOSY、HMQC、HMBC、及びNOESYスペクトルの解析により確認した。
【0034】
化合物8は、高分解能EI−MS(〔M〕+m/z488.4229)及び13C−NMRより分子式C32H56O3を持つ事が示された。また本化合物はIRスペクトル、1H−NMR、13C−NMRからメチレン基〔δH 0.33(d、J=4.4Hz)、0.55(d、J=4.2Hz)〕の存在が示され、シクロプロピル基の存在が示唆された。さらに4個の第3級メチル基〔δH 0.81、0.90、0.97、0.97(各s)〕、1個の第2級メチル基〔δH 0.90(d、J=6.5Hz)〕、インプロピル基〔δH 0.92(d、J=6.3Hz)、0.94(d、J=6.8Hz)〕、そして1個のヒドロキシメチン基〔3409cm-1;δH 3.29(m);δC 78.9〕、1個のメトキシル基〔δH 3.23(m);δC 49.4]の存在が示唆された。EI−MSではm/z470にH2Oの脱離によるイオン、m/z438にC24−C241の開裂によりHOCH3が脱離したイオンが観測された。これらを化合物7のスペクトル値と比較し、化合物8は241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール構造を持つ事が明らかとなった。本構造が正しい事は、1H−1HCOSY、HMQC、HMBC、及びNOESYスペクトルの解析により確認した。
【0035】
化合物10は高分解能EI−MS(〔M〕+m/z356.2714)及び13C−NMRより分子式C24H36O2を持つ事が示された。また本化合物はIRスペクトル、1H−NMR、13C−NMRからメチレン基〔δH 0.57(d、J=4.6Hz)、0.82(d、J=4.3Hz)〕の存在が示され、シクロプロピル基の存在が示唆された。さらに4個の第3級メチル基〔δH 0.93、0.98、1.05、1.10、2.12(各s)〕、そして2個のカルボニル基〔1710cm-1;δC 210.3、216.4〕の存在が示唆された。EI−MSではm/z341にC20‐C21の開裂によりC21メチル基が脱離した開裂イオン、m/z313にC17‐C20の開裂によりCH3COが脱離したイオンが観測された。これらのスペクトル値、及びシクロアルタン系化合物の文献値(BarikらPhytochemistry 35巻、1001−1004頁、1994年)と比較し、化合物10は4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン構造を持つ事が明らかとなった。本構造が正しい事は、1H−1HCOSY、HMQC、HMBC、及びNOESYスペクトルの解析により確認した。
【0036】
化合物15は高分解能EI−MS(〔M〕+m/z472.3924)及び13C−NMRより分子式C31H52O3を持つ事が示された。また本化合物はIRスペクトル、1H−NMR、13C−NMRからメチレン基〔δH 0.57(d、J=4.2Hz)、0.79(d、J=3.7Hz)〕の存在が示され、シクロプロピル基の存在が示唆された。さらに4個の第3級メチル基〔δH 0.91、1.00、1.05、1.10、(各s)〕、1個の第2級メチル基〔δH 0.89(d、J=6.4Hz)〕、インプロピル基〔δH 1.10、1.13(各s)、そしてヒドロキシル基〔3445cm-1〕、カルボニル基〔1710cm-1;δC 213.0〕、メトキシル基(δH 3.23(s);δC 49.1)の存在が示唆された。EI−MSではm/z440にC24位のCH3OH脱離によるイオン、m/z313にC17‐C20の開裂により側鎖(C9H19O2)が脱離した開裂イオン、更にm/z271にC13‐C17とC14‐C15の結合開裂による、1Hを伴ったD環の開裂イオンが観測された。これらの値とシクロアルタン系化合物の文献値(稲田らPhytochemistry 46巻、379−381頁、1997年)、化合物13のスペクトル値との比較により、化合物15は25−ヒドロキシ−24−メトキシシクロアルタン−3−オン構造を持つ事が明らかとなった。本構造が正しい事は、1H−1HCOSY、HMQC、HMBC、及びNOESYスペクトルの解析により確認した。
【0037】
なお、化合物7、8は、24−メチレンシクロアルタノール(化合物2)の化学的変換反応によって得られるものであってもよい。化学的変換反応を用いた化合物7,8の合成方法を以下に示す(図5参照)。
[化合物7の化学的方法による調製]
(1)化合物2(100mg)を塩化メチレンに溶解させ、炭酸水素ナトリウム(250mg)、m−クロロ過安息香酸(500mg)を加え、室温にて48時間、撹拌した。
(2)反応終了後、反応溶液を1N水酸化ナトリウム水溶液にて洗浄し、続いて塩化メチレン層は水で洗浄した。
【0038】
(3)分取HPLC[溶離液:メタノール;流速3.0mL/分]を行い、24,241−エポキシシクロアルタン−3β−オール(化合物16;31.6mg;保持時間16.8分)を得た。
(4)化合物16(8.7mg)を1,2−ジメトキシエタンに溶解させ、過塩素酸水溶液(2mL)を加え、室温にて16時間、撹拌した。
(5)反応終了後、ジエチルエーテルにて抽出し、エーテル層を1M炭酸ナトリウム、続いて水で洗浄した。エーテル抽出部は分取HPLC[溶離液:メタノール;流速3.0mL/分]を行い、化合物7(2.6m;保持時間12.9分)を得た。
【0039】
上述した本発明のシクロアルタン型トリテルペン系化合物は、単独であるいは混合して用いることができる。
また、本発明のシクロアルタン型トリテルペン系化合物は、適当な医薬用の担体又は希釈剤と組み合わせて医薬とすることができ、通常の如何なる方法によっても製剤化でき、経口又は非経口投与するための固体、半固体又は液体の剤形に処方することができる。処方にあたっては、他の医薬活性成分との配合剤としてもよい。
【0040】
例えば、日本薬局方に記載されている各種製剤、即ち、錠剤、丸剤、カプセル剤、顆粒剤、散剤、乾燥エキス剤、トローチ剤等の内用固形製剤、流エキス剤、エリキシル剤、酒精剤、シロップ剤、リモナーデ剤等の内容液剤、チンキ剤、リニメント剤、ローション剤等の外用液剤、硬膏剤、軟膏剤、パップ剤等の外用剤などに製剤化できる。また、投与可能であるならば、吸入剤、エアゾール剤、注射剤、点眼剤、座剤等にも用途に応じて製剤化してもよい。
【0041】
経口投与においては、成人に対し体重1kg当り0.5〜500mg/日の範囲で投与するのが好ましい。
また、本発明のシクロアルタン型トリテルペン系化合物は発癌予防の薬剤として使用するだけでなく、種々の飲食品に添加し、発癌予防に有効な機能性飲食品を製造するのにも有用なものである。このような機能性飲食品の形態の例としては、顆粒、錠菓、ゼリー、飴、飲料などが挙げられる。さらに、本発明のシクロアルタン型トリテルペン系化合物は、人間の食べる食品としてだけでなく、ペット、家畜、競技用動物などの人間以外の動物の飼料に添加して利用され得る。
【0042】
[化合物8の化学的方法による調製]
(1)〜(3) 上記(1)〜(3)と同じようにして、化合物16を得た。
(4)化合物16(8.7mg)を1,2−ジメトキシエタンに溶解させ、過塩素酸/メタノール(2mL)を加え、室温にて16時間、撹拌した。
(5)反応終了後、ジエチルエーテルにて抽出し、エーテル層を1M炭酸ナトリウム、続いて水で洗浄した。エーテル抽出部は分取HPLC[溶離液:メタノール;流速3.0mL/分]を行い、化合物8(1.7mg;保持時間18.3分)を得た。
【0043】
[発癌予防効果の確認試験について]
次に、本発明の効果を確認するために行った試験について説明する。
(Epstein−Barrウイルス(EBV)活性化抑制試験)
本研究者らは、EBVのゲノムを内蔵するバーキット・リンパ腫由来の培養細胞であるRaji(ラジ)株において、EBV・ゲノムの発現を阻害する化合物の多くが、マウス皮膚発癌二段階実験において抗発癌プロモーターとして作用する点に注目した。そして米糠抽出物から得られるシクロアルタン系トリテルペノイドの糸状菌による微生物変換反応から得られた変換生成物からEBV・ゲノムの発現を阻害するウイルス・ゲノム不活性化物質を探索した。EBV・ゲノムの発現阻害作用に着目したこの方法はRaji(ラジ)株培養系に、発癌プロモーターであるTPA(テトラデカノイルホルボールアセタート)と、活性発現のために相乗作用として働くn−酪酸、それに被験物質を加えて培養し、TPAにより活性化された細胞由来の抗体を用いる間接蛍光抗体法で検出する方法である。この方法は、迅速、かつ定量性に優れ、加えて、微量活性成分の検出が可能な点で優れた方法である。
【0044】
まず、試験の手順について図7のスキームを参照しながら説明する。なお、本手順は、徳田らの方法(Cancer Letters、40巻、309頁、1998)に準拠している。
(1)1×106/mLのラジ細胞に、発癌プロモーターとして、20ng/mLの濃度の12−O−テトラデカノイルホルボール−13−アセタート(TPA)を32pmo1加え、さらにTPAの活性発現のために相乗作用として働くn−酪酸を加えた。
(2)そこに、水、エタノール、又はジメチルスルホキシドに溶解した所定量の被験物質を添加して、37℃で48時間培養した。
(3)培養終了後、上咽頭癌患者の血清(TPAにより活性化された細胞由来の抗体を含む)を用いた間接蛍光抗体法によりEBV早期抗原の発現を検出した。
【0045】
上記の手順に従って検定を行った後、TPAのみを加えた群(コントロール)のEBV早期抗原の発現率を100%として、被験物質添加群のEBV早期抗原の発現率を求め、次式(1)により被験物質のEBV早期抗原の発現阻害率(%)を算出した。
EBV早期抗原の発現阻害率(%)=
100−被験物質添加群のEBV早期抗原の発現率(%)・・・式(1)
検定は、前述のように糸状菌Glomerella fusarioidesによるシクロアルタン系トリテルペノイドの変換反応より得た化合物1〜15を被験物質とし、各被験物質を種々の濃度(被験物質/TPAのモル比)に調製して行った。この検定の結果を表5に示す。
シクロアルタン型トリテルペン(化合物1〜15)のEBV早期抗原の発現阻害率(%)
【0046】
【表5】

【0047】
なお、被検物質の濃度が1000倍モル濃度の欄の括弧内の数値は、ラジ細胞の生存率(%)を示す。この数値が高い方が正常細胞に対する悪影響が小さい、すなわち安全性が高いと言える。表5に示されるように、これらの化合物の阻害率は、TPAに対し100倍モル濃度の時28〜37%であり、高い活性を有している。特に24−メチルシクロアノレタン−3β,24,241−トリオール(化合物7)、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール(化合物8)は10倍モル濃度の時15%以上と非常に高い活性を有しており、抗発癌プロモーター活性に優れる事が確認された。また、この阻害率は、ビタミンA誘導体であり、その発がん予防効果が種々の動物実験でも確認されているβ−カロテン(村上ら、Biosci. Biotech. Biochem.、60巻、1頁、1996)よりも高い値を示した。さらに、これらは本検定において高いラジ細胞生存率を示したことから、高い安全性を持つ発癌予防剤として期待できる。
【0048】
さらに、本発明の効果を試験するために化合物1〜15をNO(一酸化窒素)障害に対する抑制試験を行い、活性を示したので説明する。
(NOR1処理による細胞形態変化抑制試験)
(±)−(E)−4−メチル−2−[(E)−ハイドロキシイミノ]−5−ニトロ−6ムメトキシ−3−ヘキセナミド(NOR1)処理による細胞形態変化抑制試験は、発癌イニシエーターの一次スクリーニング法として知られた試験である。NOはガス状のフリーラジカルであり、その過剰産生が慢性化すると、胃がんや大腸がんの危険性が高まるといわれている。このことから、NOの過剰生産を抑制することが発癌予防に有効であるといえる。この試験は迅速、かつ微量活性成分の検出が可能な点で優れた試験である
【0049】
試験方法について説明する。なお、本手順は、秋久らの方法(Cancer Letters 205巻、9−13頁、2004年)に準拠している。
(1)イーグルの最小必要培地より得た5×105/mLのヒト正常肝由来細胞を3日間培養する。
(2)そこに被検物質を加え、その1分後にNOドナーであるNOR1を加えCO2インキュベーターで培養する。
(3)細胞の形態変化を光学顕微鏡にて測定する。(250以上の形態変化を示した細胞数を測定する。)
【0050】
上記の手順に従って試験を行なった後、被検物質を加えない群をコントロールとし、次式によりNOR1処理によるNO産性抑制率を算出した。
NOR1処理による細胞形態変化抑制率
=NOR1のみで形態変化した細胞(%)/NOR1と被検物質を加えたときの形態変化した細胞(%)…式(2)
【0051】
前述のように糸状菌Glomerella fusarioidesによるシクロアルタン系トリテルペノイドの変換反応より得た化合物(1〜15)を被験物質として行った検定の結果を表6に示す。なお、参照化合物として、発癌予防効果が知られているクルクミン(Cancer Letters159巻、135頁、2000年)と、NOスカベンジャーである2−(4−カルボキシフェニル)−4,4,5,5−テトラメチルイミダゾリン−1−オキシル 3−オキシド ナトリウム塩(カルボキシ−PTIO)の値も示した。
シクロアルタン型トリテルペン(化合物1〜15)のNO障害に対する抑制率
【0052】
【表6】

【0053】
表6に示されるように、化合物7、8は参照化合物であるクルクミンと同程度の活性を示した。このことから、これらの化合物は抗発癌イニシエーター活性に優れることが確認された。
【図面の簡単な説明】
【0054】
【図1】糸状菌によるシクロアルテノール(化合物1)の微生物変換反応生成物(化合物3〜5)の化学構造式を示す図である。
【図2】糸状菌による24−メチレンシクロアルタノール(化合物2)の微生物変換反応生成物(化合物5〜8)の化学構造式を示す図である。
【図3】糸状菌によるシクロアルテノン(化合物3)の微生物変換反応生成物(化合物9〜15)の化学構造式を示す図である。
【図4】新規化合物7、8、10、15の化学構造式を示す図である。
【図5】本発明に係る新規化合物7、8、10、15のNOESYスペクトル法により得られた核オーバーハウザー効果(NOE)相関関係を説明する図である。
【図6】化合物7、8を化学的に合成する方法を示す図である。
【図7】EBV活性化抑制試験の手順を説明する図である。
【特許請求の範囲】
【請求項1】
シクロユーカレノール、24−メチルシクロアルタン−3β,24,241−トリオール、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール、シクロアルタン−3,24−ジオン、4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン、24,25−ジヒドロキシシクロアルタン−3−オン、25−ヒドロキシシクロアルト−23−エン−3−オン、25−ヒドロキシ−24−メトキシシクロアルタン−3−オンからなる群から選ばれた少なくとも1種のシクロアルタン型トリテルペン系化合物を含有することを特徴とする発癌予防剤。
【請求項2】
前記シクロアルタン型トリテルペン系化合物は、米糠成分を処理して得た化合物を基質とした糸状菌による微生物変換反応から得られる反応生成物、あるいは米糠成分を処理して得た化合物の化学的変換反応によって得られる反応生成物であることを特徴とする請求項1に記載の発癌予防剤。
【請求項3】
米糠成分を処理して得られる化合物を基質として糸状菌による微生物変換を行うことでシクロアルタン型トリテルペン系化合物を得ることを特徴とするシクロアルタン型トリテルペン系化合物の製造方法。
【請求項1】
シクロユーカレノール、24−メチルシクロアルタン−3β,24,241−トリオール、241−メトキシ−24−メチルシクロアルタン−3β,24−ジオール、シクロアルタン−3,24−ジオン、4,4,14−トリメチル−9,19−シクロプレグナン−3,20−ジオン、24,25−ジヒドロキシシクロアルタン−3−オン、25−ヒドロキシシクロアルト−23−エン−3−オン、25−ヒドロキシ−24−メトキシシクロアルタン−3−オンからなる群から選ばれた少なくとも1種のシクロアルタン型トリテルペン系化合物を含有することを特徴とする発癌予防剤。
【請求項2】
前記シクロアルタン型トリテルペン系化合物は、米糠成分を処理して得た化合物を基質とした糸状菌による微生物変換反応から得られる反応生成物、あるいは米糠成分を処理して得た化合物の化学的変換反応によって得られる反応生成物であることを特徴とする請求項1に記載の発癌予防剤。
【請求項3】
米糠成分を処理して得られる化合物を基質として糸状菌による微生物変換を行うことでシクロアルタン型トリテルペン系化合物を得ることを特徴とするシクロアルタン型トリテルペン系化合物の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2006−131595(P2006−131595A)
【公開日】平成18年5月25日(2006.5.25)
【国際特許分類】
【出願番号】特願2004−325370(P2004−325370)
【出願日】平成16年11月9日(2004.11.9)
【出願人】(899000057)学校法人日本大学 (650)
【Fターム(参考)】
【公開日】平成18年5月25日(2006.5.25)
【国際特許分類】
【出願日】平成16年11月9日(2004.11.9)
【出願人】(899000057)学校法人日本大学 (650)
【Fターム(参考)】
[ Back to top ]

