発癌予防剤
【課題】 安全で有効な発癌予防剤を提供する。
【解決手段】 ニガウリの果実,茎,葉又は根から得られたエキス,又はククルビタン型トリテルペンを発癌予防剤として用いる。これらの成分は,EBV活性化抑制試験で優れた抗発癌プロモーター活性及び安全性を示した。
【解決手段】 ニガウリの果実,茎,葉又は根から得られたエキス,又はククルビタン型トリテルペンを発癌予防剤として用いる。これらの成分は,EBV活性化抑制試験で優れた抗発癌プロモーター活性及び安全性を示した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は発癌予防剤に関し,特にトリテルペンを含有する発癌予防剤に関する。
【背景技術】
【0002】
従来から,発癌予防剤として有効なトリテルペン系化合物は知られている(特許文献1参照)。
【特許文献1】特開平9−25232号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら,特許文献1は,具体的に発癌予防に関して十分な効果を有する特定のトリテルペン系化合物を開示するものではない。一方,発癌予防の大きなニーズに鑑みて,安全で有効な発癌予防剤が得られないものかとの期待は大きい。
ところで,ウリ科の一年生つる草であるニガウリ(Momordica charantia L.)は,東南アジア,西アジアを中心に世界各国で生産される独特の苦味を有する主要な農産物であり,インドなどでは古くから薬用植物として広く利用されている。近年,このニガウリの種子油は,発癌予防作用を有することが報告されており,これは種子油中に含まれている共役リノレン酸に起因すると考えられている(宮下和夫,オレオサイエンス,6巻,333頁,2002年参照)。また,ニガウリ果実の全抽出物,又は凍結乾燥粉末が,血糖値降下作用,血圧降下作用,肥満防止作用,抗ウイルス作用を有することが報告されている(Gangulyら,Eur.J.Cancer Prev.,9巻,283頁,2000年)。ニガウリの苦味成分と言われているのはククルビタン型トリテルペノイドであり,果皮にはモモルジコサイドKやモモルジコサイドLが,一方,葉部にはモモルジシンIIが含まれており,これらの化合物には血糖値降下作用を有することが報告されている(Raman,Lau,Phytomedicine,2巻,349頁,1996年参照)。しかしながら,ニガウリ果実,又はそれ以外の茎,葉や根等に発癌予防作用を有する成分の存在については確認されていない。
本発明は,安全で有効な発癌予防剤を提供することを課題としている。
【課題を解決するための手段】
【0004】
本発明者らは,ニガウリの特性と発癌予防のニーズとに着目し,安全で有効な発癌予防剤が得られないものかと鋭意検討した結果,ニガウリエキス(抽出物)及び本エキスのククルビタン型トリテルペンが発癌予防剤として優れており,とりわけニガウリを処理して得られるククルビタン型トリテルペンが発癌予防剤として特に優れていることを見出し,本発明を完成するに至った。
このように本発明は,特にニガウリエキス及び本エキス成分に発癌予防作用を見出した点に重要な意味を有する。
本発明の請求項1による発癌予防剤は,ニガウリの果実,茎,葉及び根のうちの少なくとも一つを溶媒で抽出して得られる抽出物を含有することを特徴とする。
【0005】
本発明の請求項2による発癌予防剤は,ククルビタン型トリテルペンを含有することを特徴とする。
前記ククルビタン型トリテルペンは,ククルビタン骨格を有するトリテルペン又はその誘導体を意味するが,トリテルペンの配糖体は含まない。誘導体としては,アルキル基,OH基,ケトン基,アセトキシル基,アミノ基,ホルミル基,アルケニル基等の置換基で置換されたトリテルペンがあげられ,これらの中でもOH基で置換されたトリテルペンアルコールが望ましい。
【0006】
本発明の請求項3による発癌予防剤は,請求項2における前記ククルビタン型トリテルペン系化合物が,(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23,25‐トリエン‐3β‐オール(以下,「化合物1」と称すこともある。),(23E)‐3β‐ハイドロキシ‐7β‐メトキシククルビタ‐5,23,25‐トリエン‐19‐アール(以下,「化合物2」と称すこともある。),(23E)‐3β‐ハイドロキシ‐7β,25‐ジメトキシククルビタ‐5,23‐ジエン‐19‐アール(以下,「化合物3」と称すこともある。),(23E)‐5β,19−エポキシ‐19,25‐ジメトキシククルビタ‐6,23‐ジエン‐3β‐オール(以下,「化合物4」と称すこともある。),(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23‐ジエン‐3β,25‐ジオール(以下,「化合物5」と称すこともある。)からなる群から選ばれた少なくとも1種のものであることを特徴とする。
本発明の請求項4による発癌予防剤は,請求項2又は3において,前記ククルビタン型トリテルペンは,ニガウリを処理して得られることを特徴とする。
【発明の効果】
【0007】
本発明によれば,安全かつ発癌予防効果に優れた発癌予防剤が提供される。
【発明を実施するための最良の形態】
【0008】
次に,実施例により本発明を具体的に説明する。すなわち,ニガウリの果実からの発癌予防効果を有するエキスの抽出方法,本発明に係る発癌予防効果を有する化合物1〜5の単離,化合物1〜5の同定及び構造解析,並びに,本発明に係る発癌予防剤の効果確認試験について説明する。
[ニガウリ果実からの抽出について]
本実施例では,乾燥ニガウリの果実から以下のようにして,発癌予防効果を有するエキスを抽出した。
まず,乾燥ニガウリ果実を粉砕し,このうちの5.3kgをメタノールにより抽出し,メタノールエキス(383g)を得た。本エキスを水に懸濁させた後,酢酸エチルを加えて酢酸エチル抽出を行い,酢酸エチル抽出物(53g)を得た。本抽出物の一部(15g)をn‐ヘキサン/メタノール/水(95:95:10)にて分相し,n‐ヘキサン画分(4.2g),及びメタノール/水画分(9.8g)を得た。さらに,上記酢酸エチル抽出残部である水相はn‐ブタノール抽出を行い,n‐ブタノール画分(17g)及び水画分(110g)を得た。
【0009】
上記のようにして得られた,メタノールエキス,n‐ヘキサン画分,メタノール‐水画分,ブタノール画分,及び水画分について,後述するようにEBV早期抗原発現阻害率を測定し,発癌予防効果があることを確認した。
なお,本実施例ではニガウリの果実から抽出しているが,果実以外にもニガウリの茎,葉及び根からエキスを抽出してもよい。
【0010】
また,ニガウリの果実,茎,葉及び根のうちの少なくとも一つから有効成分を抽出するための溶媒しては,水,アルコール類(メタノール,エタノール,イソプロピルアルコール等),ケトン類(アセトン,メチルエチルケトン等),エーテル類(ジエチルエーテル,ジイソプロピルエーテル,ジメトキシエタン,テトラヒドロフラン等),脂肪酸エステル類(酢酸エチル,酢酸ブチル等),ハロゲン化炭化水素類(クロロホルム,塩化メチレン,ジクロロエタン等),芳香族炭化水素類(ベンゼン,トルエン等),脂肪族炭化水素類(n−ヘキサン,シクロヘキサン等)等の溶媒の一種又は二種以上の混合溶媒が使用できる。これらのうちのいずれを用いた場合にも抽出物は発癌予防効果を有するが,後述するように,特にヘキサン等の極性の極小さな溶媒を用いると,抽出物が発癌予防効果に優れるので好ましい。
【0011】
また,抽出方法は,上記方法に限定されず,水溶性又は高極性溶媒から徐々に低極性溶媒に抽出する過程を経ることなく,乾燥ニガウリをヘキサン等の低極性溶媒で直接抽出してもよい。
得られた抽出物は,そのまま又は濃縮し,エキス状で用いてもよいし,溶媒を除去後乾燥粉末にして用いてもよい。
【0012】
また,抽出物は,適当な医薬用の担体又は希釈剤と組み合わせて医薬とすることができ,通常の如何なる方法によっても製剤化でき,経口又は非経口投与するための固体,半固体又は液体の剤形に処方することができる。処方にあたっては,他の医薬活性成分との配合剤としてもよい。例えば,日本薬局方に記載されている各種製剤,即ち,錠剤,丸剤,カプセル剤,顆粒剤,散剤,乾燥エキス剤,トローチ剤等の内用固形製剤,流エキス剤,エリキシル剤,酒精剤,シロップ剤,リモナーデ剤等の内容液剤,チンキ剤,リニメント剤,ローション剤等の外用液剤,硬膏剤,軟膏剤,パップ剤等の外用剤などに製剤化できる。また,投与可能であるならば,吸入剤,エアゾール剤,注射剤,点眼剤,座剤等にも用途に応じて製剤化してもよい。
【0013】
さらに,本発明に係る抽出物は発癌予防の薬剤として使用するだけでなく,種々の飲食品に添加し,発癌予防に有効な機能性飲食品を製造するのにも有用なものである。このような機能性飲食品の形態の例としては,顆粒,錠菓,ゼリー,飴,飲料などが挙げられる。また,本発明に係る抽出物は,人間の食べる食品としてだけでなく,ペット,家畜,競技用動物などの人間以外の動物の飼料に添加して利用され得る。
【0014】
[化合物1〜5の単離について]
次に,上記の抽出物から発癌予防に有効な化合物1〜5を単離した。
まず,前記乾燥ニガウリ果実から有効成分を抽出したn‐ヘキサン画分について,シリカゲル(400g)カラムクロマトグラフィーを行った。溶出液として,n‐ヘキサン/酢酸エチル[1:0(0.5L),95:5(2.4L),9:1(7.2L),4:1(2.3L),7:3(0.2L),1:1(0.4L),1:4(0.9L)],酢酸エチル(0.5L),クロロホルム(0.5L)を用いて順次展開し,7画分(Fr.A〜G:Fr.A(21mg),Fr.B(380mg),Fr.C(267mg),Fr.D(1099mg),Fr.E(517mg),Fr.F(113mg),Fr.G(1928mg))に分画した。
【0015】
Fr.Dについて,更にシリカゲル(100g)カラムクロマトグラフィー(展開液にはn‐ヘキサン:酢酸エチル=4:1〜0:1を用いた)を行い,6画分(Fr.Da〜Df)に分画した。
このFr.Dについてのカラムクロマトグラフィーにおいて,1番目に溶出したFr.Da(39mg)について逆相分取高速液体クロマトグラフィー(HPLC)[カラム:Pegasil ODS 5μ(25cm×内径10mm)カラム,センシュー科学(株)製;溶離液:メタノール;流速3.0mL/分]を行い,10α‐ククルビタジエノール(1.7mg;保持時間24.9分)及びクレロステロール(2.6mg;保持時間33.2分)を得た。
【0016】
また,Fr.Dについてのカラムクロマトグラフィーにおいて,最初から2番目に溶出したFr.Db(151mg)は,分取薄層クロマトグラフィーにて精製し,精製Fr.Db(73mg)を得た。本画分は次に分取HPLC(溶離液:メタノール/水/酢酸=99:1:1;2.0mL/分)を行い,(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23,25‐トリエン‐3β‐オール(化合物1)(8.5mg;保持時間14.2分)を単離した。
【0017】
Fr.Eについて,更にシリカゲル(50g)カラムクロマトグラフィー(展開液にはn‐ヘキサン:酢酸エチル=4:1〜0:1を用いた)を行い,9画分(Fr.Ea〜Ei)に分画を行った。
このFr.Eについてのカラムクロマトグラフィーにおいて4番目に溶出したFr.Ed(69.4mg)について,HPLC(溶離液:メタノール/水/酢酸=99:1:1;2.0mL/分)を行い,(23E)‐5β,19−エポキシ‐19,25‐ジメトキシククルビタ‐6,23‐ジエン‐3β‐オール(化合物4)(4.5mg;保持時間13.3分)を単離した。
【0018】
また,Fr.Eについてのカラムクロマトグラフィーにおいて5番目に溶出したFr.Ee(21.2mg)について,HPLC(溶離液:メタノール/水/酢酸=99:1:1;2.0mL/分)を行い,(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23‐ジエン‐3β,25‐ジオール(化合物5)(4.6mg;保持時間14.8分)を単離した。
【0019】
更に,Fr.Eについてのカラムクロマトグラフィーにおいて7番目の溶出画分であるFr.Eg(102.1mg)について,HPLC(溶離液:メタノール/水=95:5;流速2.0mL/分)を行い,(23E)‐3β‐ハイドロキシ‐7β‐メトキシククルビタ‐5,23,25‐トリエン‐19‐アール(化合物2)(2.9mg;保持時間24.8分)及び(23E)‐3β‐ハイドロキシ‐7β,25‐ジメトキシククルビタ‐5,23‐ジエン‐19‐アール(化合物3)(2.8mg;保持時間14.4分)を単離した。
なお,本実施例では,ニガウリ果実の抽出エキスから化合物1〜5を単離しているが,ニガウリの茎,葉,根及び種子から化合物1〜5を単離してもよい。
【0020】
[化合物1〜5の同定及び構造解析について]
次に,上記のようにして単離した5種の化合物1〜5について,同定及び構造解析を行ったので説明する。
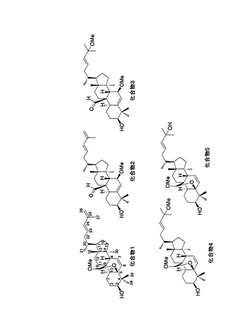
5種の化合物1〜5の構造解析はMS,IR,UV,1H‐NMR,13C‐NMR,NMRの一種である相関分光法(1H−1H COSY),異種核多量子コヒーレンス法(HMQC),異種核遠隔多量子相関法(HMBC),及び,核オーバーハウザー交換分光法(NOESY)を用いて行った。化合物1〜5の化学構造式を図1に示す。これらのうち,化合物1〜3の3種はこれまで文献記載のない新規化合物である。新規化合物1〜3の1H‐NMR及び13C‐NMRデータをHMBCデータとともに表1〜表3に示した。また,図2に,新規化合物1〜3のNOESYスペクトル法により得られた核オーバーハウザー効果(NOE)相関関係を立体構造式とともに両方向の矢印で示したが,これらのNOE相関は化合物1〜3について与えた構造と矛盾はしない。既知の化合物4及び5の構造は,対応する化合物との種々のスペクトルデータの文献値(Mulhollandら,Phytochemistry,45巻,391頁,1997年)との比較により確認した。
【0021】
新規化合物1〜3の諸性質及びスペクトルデータを次に示す。
(1)(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23,25‐トリエン‐3β‐オール(化合物1)
無色結晶
mp:166〜169℃
比旋光度[α]25D:−74.0°(濃度c=0.10(g/100ml),溶媒:アセトン)
UV(溶媒:エタノール)λmax (単位:nm):240(logε4.08),231(logε4.33),225(logε4.30)
IR νmax (単位:cm-1):3479(OH);2941;1650,1605(共役二重結合);879(>C=CH2)
EI‐MS (検出されたそれぞれのピークについて,m/z値,(相対イオン強度),検出された分子の状態を示す):
408(100)[M−HCOOCH3]+,393(14)(m/z408−CH3),390(20)(m/z408−H2O),389(22),375(17)(m/z408−CH3−H2O),327(10)[m/z408−(C22〜C27)],309(m/z327−H2O),299(32)[m/z408−側鎖(C8H13)],281(38)(m/z299−H2O),172(59),109(57)[C8H13]+
FAB‐MS (検出されたそれぞれのピークのm/z値,検出された分子の状態を示す):
507[M+K]+,469[M+H]+,437[M−MeOH]+,419(m/z437−H2O)
高分解能EI‐MS (m/z値):408.3399(理論値C29H44O=[M−HCOOCH3]+,408.339256.2511)
高分解能FAB‐MS (m/z値):507.3244(理論値C31H48O3K=[M+K]+,507.3240)
13C‐NMR,1H‐NMR及びHMBCのデータを表1に示す:
【0022】
【表1】

【0023】
(2)(23E)‐3β‐ハイドロキシ‐7β‐メトキシククルビタ‐5,23,25‐トリエン‐19‐アール(化合物2)
無色結晶
mp:127〜130℃
比旋光度[α]25D:+19.1°(濃度c=0.21(g/100ml),溶媒:クロロホルム)
UV(溶媒:エタノール)λmax (単位:nm):239,231,224
IR νmax (単位:cm-1):3445(OH);2928;1713(>C=O;アルデヒド);1670,1610(共役二重結合);880(>C=CH2);820(>C=CH−)
EI‐MS (検出されたそれぞれのピークについて,m/z値,(相対イオン強度),検出された分子の状態を示す):
468(12)[M]+,450(7) [M−H2O]+,436(4) [M−MeOH]+,408(100) [M−(CH3O+CHO)]+,393(10)(m/z408−CH3),390(10),375(12)(m/z408−CH3−H2O),327(9)[m/z408−(C22〜C27)],309(35)(m/z327−H2O),299(17)[m/z408−側鎖(C8H13)],281(23)(m/z299−H2O),203(35),172(61),109(75)[C8H13]+
高分解能EI‐MS (m/z値):468.3605(理論値C31H48O3=[M]+,468.3603)
13C‐NMR,1H‐NMR及びHMBCのデータを表2に示す:
【0024】
【表2】

【0025】
(3)(23E)‐3β‐ハイドロキシ‐7β,25‐ジメトキシククルビタ‐5,23‐ジエン‐19‐アール(化合物3)
無色結晶
mp:104〜107℃
比旋光度[α]25D :+25.9°(濃度c=0.26(g/100ml),溶媒:クロロホルム)
IR νmax (単位:cm-1):3444(OH);2929;1712(>C=O;アルデヒド);845,820(>C=CH−)
EI‐MS(検出されたそれぞれのピークについて,m/z値,(相対イオン強度),検出された分子の状態を示す):
482(6)[M−H2O]+,440(74) [M−H2O−MeOH]+,421(22),408(100) [M−H2O−2MeOH]+,393(11)(m/z408−CH3),389(15),375(16)(m/z408−CH3−H2O),309(25),299(17)[m/z408−側鎖(C9H17O)],293(13),281(19),172(94),109(86),99(100)
高分解能EI‐MS (m/z値):482.3759(理論値C32H50O3[M−H2O]+,482.3760)
FAB‐MS (m/z値):539[M+K]+
13C‐NMR,1H‐NMR及びHMBCのデータを表3に示す:
【0026】
【表3】

【0027】
なお,化合物1〜3は,上記のような化学構造式で示されるものであれば,天然物から抽出した天然化合物に限られず,天然化合物を修飾し,或いは,化学合成することにより得るものであってもよい。
また,本発明の化合物1〜5には,一般に生体内において遊離形と実質的に同様の生理活性または薬理活性を発揮するもの,例えば,本発明の化合物1〜5のK,Naなどの医薬的に許容され得る塩,水和物なども含まれるものである。
また,本発明の化合物1〜5は,上述の抽出物と同様に,適当な医薬用の担体又は希釈剤と組み合わせて医薬とし,飲食品に添加して発癌予防に有効な機能性飲食品とし,あるいは,飼料に添加して用いることもできる。
【0028】
[発癌予防効果の確認試験について]
次に,本発明の効果を確認するために行った試験について説明する。
(Epstein−Barrウイルス(EBV)活性化抑制試験)
EBV活性化抑制試験は,抗発癌プロモーター探索の一次スクリーニング法として知られた試験であり,迅速,かつ定量性に優れ,加えて,微量活性成分の検出が可能な点で優れた試験である。本試験でEBV活性化を抑制する化合物の多くはマウス皮膚二段階発癌試験で抗発癌プロモーターとして作用することが確認されている。
【0029】
まず,試験の手順について図1のスキームを参照しながら説明する。なお,本手順は,徳田らの方法[Cancer Letters,40巻,309頁(1988)]に準拠している。
(1)1×106/mLのRaji(ラジ)細胞に,発癌プロモーターとして,20ng/mLの濃度の12‐O‐テトラデカノイルホルボール‐13‐アセテート(TPA)を32pmol加え,さらにTPAの活性発現のために相乗作用として働くn‐酪酸を加えた。
(2)そこに,水,エタノール,又はジメチルスルホキシドに溶解した所定量の被検物質を添加して,37℃で48時間培養した。
(3)培養終了後,上咽頭癌患者の血清(TPAにより活性化された細胞由来の抗体を含む)を用いた間接蛍光抗体法によりEBV早期抗原の発現を検出した。
【0030】
上記の手順に従って試験を行った後,TPAのみを加えた群(コントロール)のEBV早期抗原の発現率を100%として,被検物質添加群のEBV早期抗原の発現率を求め,次式(1)により被検物質のEBV早期抗原の発現阻害率(%)を算出した。
EBV早期抗原の発現阻害率(%)=
100 − 被検物質添加群のEBV早期抗原の発現率(%)・・・式(1)
前述の[ニガウリ果実からの抽出について]の項の記載に従って得た,ニガウリメタノールエキス,n‐ヘキサン画分,メタノール‐水画分,ブタノール画分及び水画分を被検物質として用い,EBV早期抗原発現阻害率を測定し,その結果を表4に示した。
【0031】
【表4】

【0032】
なお,被検物質の濃度が100μg/mLの欄の括弧内の数値は,ラジ細胞の生存率(%)を示す。この数値が高い方が正常細胞に対する悪影響が小さい,すなわち安全性が高いと言える。
表4に示すように,ニガウリのメタノールエキスは100μg/mLの濃度で,EBV早期抗原発現を89.3%阻害し,活性を示した。従って,本エキスは抗発癌プロモーター活性を有するとみなすことができる。同様に,n‐ヘキサン画分,メタノール‐水画分,ブタノール画分及び水画分の何れにも活性が認められたが,n‐ヘキサン画分に最も強い活性を認めた(100μg/mLの濃度で91.5%阻害)。
【0033】
また,化合物1〜5を被検物質として行ったEBV活性化抑制試験結果を表5に示した。なお,参照化合物として,ビタミンA誘導体であり,発癌予防効果が種々の動物モデル実験でも確認されているβ‐カロテン[村上ら,Biosci.Biotech.Biochem.,60巻,1頁(1996)]を用い,これについてもEBV活性化抑制試験を行った。
【0034】
【表5】

【0035】
なお,被検物質の濃度が1000倍の欄の括弧内の数値は,ラジ細胞の生存率(%)を示す。
表5に示すように,ニガウリから得たククルビタン型トリテルペンは,前述の5種のβ‐カロテンよりも高いEBV早期抗原発現阻害率を示した。また,これらの化合物1〜5は,試験において高いラジ細胞生存率を示したことから,高い安全性を持つ発癌予防剤として期待できる。
【0036】
さらに,本試験で活性を確認した化合物2及び4について,マウス皮膚二段階発癌試験を行い,活性を確認したので説明する。
(マウス皮膚二段階発癌試験)
(1)発癌イニシエーション抑制作用
ICR雌性マウス背部体毛を剃毛し,翌日に一酸化窒素(NO)産生試薬であるパーオキシナイトライト(Peroxynitrate)を35μg塗布し,イニシエーションを行った。1週間後より,被験マウスを15匹ずつ2群に分け,両群とも同一部位に1μgのTPAを週2回塗布し続けプロモーションを行った。第1群は試験中通常の飲料水を自由摂取させ,これを対象群とした。第2群はイニシエーションを行った前後1週間,0.0025%(2.5mg/100mL水)濃度に調整した被験物質含有飲料水を自由摂取させた。TPA塗布開始後1週間毎にマウスに発生する腫瘍個数の平均値及び発生率を対照群と比較し,抑制効果を算出した。
【0037】
(2)発癌プロモーション抑制作用
ICR雌性マウスの背部皮下に,7,12‐ジメチルベンズ(a)アントラセン(DMBA)390nMolを塗布してイニシエートし,1週間後よりTPA 1.7nMolの塗布を週2回,20週間にわたって行った。それと並行して,85nMolの被験物質(化合物2あるいは4)を,TPA塗布の60分前に同一部位に塗布した。マウスは1群15匹を用いて試験し,腫瘍を形成したマウスの匹数及びマウス1匹当りの腫瘍個数を調べ,被験物質を塗布しない対象群と比較した。
【0038】
化合物2及び化合物4のマウス皮膚二段階発癌試験における発癌イニシエーション抑制効果は図4に示した。対象群では12週後に全てのマウスに腫瘍の発生が認められ,20週後には1匹当り7個の腫瘍が認められたのに対し,化合物2及び4塗布群では何れも腫瘍の発生が明らかに遅延し,20週後でも腫瘍の発生率は80%,また,1匹当りの腫瘍数でも4.5〜4.7個と抑制効果が認められた。
【0039】
また,化合物2及び化合物4のマウス皮膚二段階発癌試験における発癌プロモーション抑制効果効果は図5に示した。対象群では10週後に全てのマウスに腫瘍の発生が認められ,20週後には1匹当り9個の腫瘍が認められたのに対し,化合物2及び4塗布群では何れも腫瘍の発生を明らかに遅延させ,20週後でも腫瘍の発生率は80%,また,1匹当りの腫瘍数でも4.0と著しい抑制効果が認められ,これらが発癌予防物質として期待できることが裏付けられた。
【図面の簡単な説明】
【0040】
【図1】本発明に係る化合物1〜5の化学構造式を示す図である。
【図2】本発明に係る化合物1〜3のNOESYスペクトル法により得られた核オーバーハウザー効果(NOE)相関関係を説明する図である。
【図3】EBV活性化抑制試験の手順を説明する図である。
【図4】マウス皮膚二段階発癌試験における発癌イニシエーション抑制効果を示すグラフである。
【図5】マウス皮膚二段階発癌試験における発癌プロモーション抑制効果効果を示すグラフである。
【技術分野】
【0001】
本発明は発癌予防剤に関し,特にトリテルペンを含有する発癌予防剤に関する。
【背景技術】
【0002】
従来から,発癌予防剤として有効なトリテルペン系化合物は知られている(特許文献1参照)。
【特許文献1】特開平9−25232号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら,特許文献1は,具体的に発癌予防に関して十分な効果を有する特定のトリテルペン系化合物を開示するものではない。一方,発癌予防の大きなニーズに鑑みて,安全で有効な発癌予防剤が得られないものかとの期待は大きい。
ところで,ウリ科の一年生つる草であるニガウリ(Momordica charantia L.)は,東南アジア,西アジアを中心に世界各国で生産される独特の苦味を有する主要な農産物であり,インドなどでは古くから薬用植物として広く利用されている。近年,このニガウリの種子油は,発癌予防作用を有することが報告されており,これは種子油中に含まれている共役リノレン酸に起因すると考えられている(宮下和夫,オレオサイエンス,6巻,333頁,2002年参照)。また,ニガウリ果実の全抽出物,又は凍結乾燥粉末が,血糖値降下作用,血圧降下作用,肥満防止作用,抗ウイルス作用を有することが報告されている(Gangulyら,Eur.J.Cancer Prev.,9巻,283頁,2000年)。ニガウリの苦味成分と言われているのはククルビタン型トリテルペノイドであり,果皮にはモモルジコサイドKやモモルジコサイドLが,一方,葉部にはモモルジシンIIが含まれており,これらの化合物には血糖値降下作用を有することが報告されている(Raman,Lau,Phytomedicine,2巻,349頁,1996年参照)。しかしながら,ニガウリ果実,又はそれ以外の茎,葉や根等に発癌予防作用を有する成分の存在については確認されていない。
本発明は,安全で有効な発癌予防剤を提供することを課題としている。
【課題を解決するための手段】
【0004】
本発明者らは,ニガウリの特性と発癌予防のニーズとに着目し,安全で有効な発癌予防剤が得られないものかと鋭意検討した結果,ニガウリエキス(抽出物)及び本エキスのククルビタン型トリテルペンが発癌予防剤として優れており,とりわけニガウリを処理して得られるククルビタン型トリテルペンが発癌予防剤として特に優れていることを見出し,本発明を完成するに至った。
このように本発明は,特にニガウリエキス及び本エキス成分に発癌予防作用を見出した点に重要な意味を有する。
本発明の請求項1による発癌予防剤は,ニガウリの果実,茎,葉及び根のうちの少なくとも一つを溶媒で抽出して得られる抽出物を含有することを特徴とする。
【0005】
本発明の請求項2による発癌予防剤は,ククルビタン型トリテルペンを含有することを特徴とする。
前記ククルビタン型トリテルペンは,ククルビタン骨格を有するトリテルペン又はその誘導体を意味するが,トリテルペンの配糖体は含まない。誘導体としては,アルキル基,OH基,ケトン基,アセトキシル基,アミノ基,ホルミル基,アルケニル基等の置換基で置換されたトリテルペンがあげられ,これらの中でもOH基で置換されたトリテルペンアルコールが望ましい。
【0006】
本発明の請求項3による発癌予防剤は,請求項2における前記ククルビタン型トリテルペン系化合物が,(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23,25‐トリエン‐3β‐オール(以下,「化合物1」と称すこともある。),(23E)‐3β‐ハイドロキシ‐7β‐メトキシククルビタ‐5,23,25‐トリエン‐19‐アール(以下,「化合物2」と称すこともある。),(23E)‐3β‐ハイドロキシ‐7β,25‐ジメトキシククルビタ‐5,23‐ジエン‐19‐アール(以下,「化合物3」と称すこともある。),(23E)‐5β,19−エポキシ‐19,25‐ジメトキシククルビタ‐6,23‐ジエン‐3β‐オール(以下,「化合物4」と称すこともある。),(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23‐ジエン‐3β,25‐ジオール(以下,「化合物5」と称すこともある。)からなる群から選ばれた少なくとも1種のものであることを特徴とする。
本発明の請求項4による発癌予防剤は,請求項2又は3において,前記ククルビタン型トリテルペンは,ニガウリを処理して得られることを特徴とする。
【発明の効果】
【0007】
本発明によれば,安全かつ発癌予防効果に優れた発癌予防剤が提供される。
【発明を実施するための最良の形態】
【0008】
次に,実施例により本発明を具体的に説明する。すなわち,ニガウリの果実からの発癌予防効果を有するエキスの抽出方法,本発明に係る発癌予防効果を有する化合物1〜5の単離,化合物1〜5の同定及び構造解析,並びに,本発明に係る発癌予防剤の効果確認試験について説明する。
[ニガウリ果実からの抽出について]
本実施例では,乾燥ニガウリの果実から以下のようにして,発癌予防効果を有するエキスを抽出した。
まず,乾燥ニガウリ果実を粉砕し,このうちの5.3kgをメタノールにより抽出し,メタノールエキス(383g)を得た。本エキスを水に懸濁させた後,酢酸エチルを加えて酢酸エチル抽出を行い,酢酸エチル抽出物(53g)を得た。本抽出物の一部(15g)をn‐ヘキサン/メタノール/水(95:95:10)にて分相し,n‐ヘキサン画分(4.2g),及びメタノール/水画分(9.8g)を得た。さらに,上記酢酸エチル抽出残部である水相はn‐ブタノール抽出を行い,n‐ブタノール画分(17g)及び水画分(110g)を得た。
【0009】
上記のようにして得られた,メタノールエキス,n‐ヘキサン画分,メタノール‐水画分,ブタノール画分,及び水画分について,後述するようにEBV早期抗原発現阻害率を測定し,発癌予防効果があることを確認した。
なお,本実施例ではニガウリの果実から抽出しているが,果実以外にもニガウリの茎,葉及び根からエキスを抽出してもよい。
【0010】
また,ニガウリの果実,茎,葉及び根のうちの少なくとも一つから有効成分を抽出するための溶媒しては,水,アルコール類(メタノール,エタノール,イソプロピルアルコール等),ケトン類(アセトン,メチルエチルケトン等),エーテル類(ジエチルエーテル,ジイソプロピルエーテル,ジメトキシエタン,テトラヒドロフラン等),脂肪酸エステル類(酢酸エチル,酢酸ブチル等),ハロゲン化炭化水素類(クロロホルム,塩化メチレン,ジクロロエタン等),芳香族炭化水素類(ベンゼン,トルエン等),脂肪族炭化水素類(n−ヘキサン,シクロヘキサン等)等の溶媒の一種又は二種以上の混合溶媒が使用できる。これらのうちのいずれを用いた場合にも抽出物は発癌予防効果を有するが,後述するように,特にヘキサン等の極性の極小さな溶媒を用いると,抽出物が発癌予防効果に優れるので好ましい。
【0011】
また,抽出方法は,上記方法に限定されず,水溶性又は高極性溶媒から徐々に低極性溶媒に抽出する過程を経ることなく,乾燥ニガウリをヘキサン等の低極性溶媒で直接抽出してもよい。
得られた抽出物は,そのまま又は濃縮し,エキス状で用いてもよいし,溶媒を除去後乾燥粉末にして用いてもよい。
【0012】
また,抽出物は,適当な医薬用の担体又は希釈剤と組み合わせて医薬とすることができ,通常の如何なる方法によっても製剤化でき,経口又は非経口投与するための固体,半固体又は液体の剤形に処方することができる。処方にあたっては,他の医薬活性成分との配合剤としてもよい。例えば,日本薬局方に記載されている各種製剤,即ち,錠剤,丸剤,カプセル剤,顆粒剤,散剤,乾燥エキス剤,トローチ剤等の内用固形製剤,流エキス剤,エリキシル剤,酒精剤,シロップ剤,リモナーデ剤等の内容液剤,チンキ剤,リニメント剤,ローション剤等の外用液剤,硬膏剤,軟膏剤,パップ剤等の外用剤などに製剤化できる。また,投与可能であるならば,吸入剤,エアゾール剤,注射剤,点眼剤,座剤等にも用途に応じて製剤化してもよい。
【0013】
さらに,本発明に係る抽出物は発癌予防の薬剤として使用するだけでなく,種々の飲食品に添加し,発癌予防に有効な機能性飲食品を製造するのにも有用なものである。このような機能性飲食品の形態の例としては,顆粒,錠菓,ゼリー,飴,飲料などが挙げられる。また,本発明に係る抽出物は,人間の食べる食品としてだけでなく,ペット,家畜,競技用動物などの人間以外の動物の飼料に添加して利用され得る。
【0014】
[化合物1〜5の単離について]
次に,上記の抽出物から発癌予防に有効な化合物1〜5を単離した。
まず,前記乾燥ニガウリ果実から有効成分を抽出したn‐ヘキサン画分について,シリカゲル(400g)カラムクロマトグラフィーを行った。溶出液として,n‐ヘキサン/酢酸エチル[1:0(0.5L),95:5(2.4L),9:1(7.2L),4:1(2.3L),7:3(0.2L),1:1(0.4L),1:4(0.9L)],酢酸エチル(0.5L),クロロホルム(0.5L)を用いて順次展開し,7画分(Fr.A〜G:Fr.A(21mg),Fr.B(380mg),Fr.C(267mg),Fr.D(1099mg),Fr.E(517mg),Fr.F(113mg),Fr.G(1928mg))に分画した。
【0015】
Fr.Dについて,更にシリカゲル(100g)カラムクロマトグラフィー(展開液にはn‐ヘキサン:酢酸エチル=4:1〜0:1を用いた)を行い,6画分(Fr.Da〜Df)に分画した。
このFr.Dについてのカラムクロマトグラフィーにおいて,1番目に溶出したFr.Da(39mg)について逆相分取高速液体クロマトグラフィー(HPLC)[カラム:Pegasil ODS 5μ(25cm×内径10mm)カラム,センシュー科学(株)製;溶離液:メタノール;流速3.0mL/分]を行い,10α‐ククルビタジエノール(1.7mg;保持時間24.9分)及びクレロステロール(2.6mg;保持時間33.2分)を得た。
【0016】
また,Fr.Dについてのカラムクロマトグラフィーにおいて,最初から2番目に溶出したFr.Db(151mg)は,分取薄層クロマトグラフィーにて精製し,精製Fr.Db(73mg)を得た。本画分は次に分取HPLC(溶離液:メタノール/水/酢酸=99:1:1;2.0mL/分)を行い,(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23,25‐トリエン‐3β‐オール(化合物1)(8.5mg;保持時間14.2分)を単離した。
【0017】
Fr.Eについて,更にシリカゲル(50g)カラムクロマトグラフィー(展開液にはn‐ヘキサン:酢酸エチル=4:1〜0:1を用いた)を行い,9画分(Fr.Ea〜Ei)に分画を行った。
このFr.Eについてのカラムクロマトグラフィーにおいて4番目に溶出したFr.Ed(69.4mg)について,HPLC(溶離液:メタノール/水/酢酸=99:1:1;2.0mL/分)を行い,(23E)‐5β,19−エポキシ‐19,25‐ジメトキシククルビタ‐6,23‐ジエン‐3β‐オール(化合物4)(4.5mg;保持時間13.3分)を単離した。
【0018】
また,Fr.Eについてのカラムクロマトグラフィーにおいて5番目に溶出したFr.Ee(21.2mg)について,HPLC(溶離液:メタノール/水/酢酸=99:1:1;2.0mL/分)を行い,(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23‐ジエン‐3β,25‐ジオール(化合物5)(4.6mg;保持時間14.8分)を単離した。
【0019】
更に,Fr.Eについてのカラムクロマトグラフィーにおいて7番目の溶出画分であるFr.Eg(102.1mg)について,HPLC(溶離液:メタノール/水=95:5;流速2.0mL/分)を行い,(23E)‐3β‐ハイドロキシ‐7β‐メトキシククルビタ‐5,23,25‐トリエン‐19‐アール(化合物2)(2.9mg;保持時間24.8分)及び(23E)‐3β‐ハイドロキシ‐7β,25‐ジメトキシククルビタ‐5,23‐ジエン‐19‐アール(化合物3)(2.8mg;保持時間14.4分)を単離した。
なお,本実施例では,ニガウリ果実の抽出エキスから化合物1〜5を単離しているが,ニガウリの茎,葉,根及び種子から化合物1〜5を単離してもよい。
【0020】
[化合物1〜5の同定及び構造解析について]
次に,上記のようにして単離した5種の化合物1〜5について,同定及び構造解析を行ったので説明する。
5種の化合物1〜5の構造解析はMS,IR,UV,1H‐NMR,13C‐NMR,NMRの一種である相関分光法(1H−1H COSY),異種核多量子コヒーレンス法(HMQC),異種核遠隔多量子相関法(HMBC),及び,核オーバーハウザー交換分光法(NOESY)を用いて行った。化合物1〜5の化学構造式を図1に示す。これらのうち,化合物1〜3の3種はこれまで文献記載のない新規化合物である。新規化合物1〜3の1H‐NMR及び13C‐NMRデータをHMBCデータとともに表1〜表3に示した。また,図2に,新規化合物1〜3のNOESYスペクトル法により得られた核オーバーハウザー効果(NOE)相関関係を立体構造式とともに両方向の矢印で示したが,これらのNOE相関は化合物1〜3について与えた構造と矛盾はしない。既知の化合物4及び5の構造は,対応する化合物との種々のスペクトルデータの文献値(Mulhollandら,Phytochemistry,45巻,391頁,1997年)との比較により確認した。
【0021】
新規化合物1〜3の諸性質及びスペクトルデータを次に示す。
(1)(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23,25‐トリエン‐3β‐オール(化合物1)
無色結晶
mp:166〜169℃
比旋光度[α]25D:−74.0°(濃度c=0.10(g/100ml),溶媒:アセトン)
UV(溶媒:エタノール)λmax (単位:nm):240(logε4.08),231(logε4.33),225(logε4.30)
IR νmax (単位:cm-1):3479(OH);2941;1650,1605(共役二重結合);879(>C=CH2)
EI‐MS (検出されたそれぞれのピークについて,m/z値,(相対イオン強度),検出された分子の状態を示す):
408(100)[M−HCOOCH3]+,393(14)(m/z408−CH3),390(20)(m/z408−H2O),389(22),375(17)(m/z408−CH3−H2O),327(10)[m/z408−(C22〜C27)],309(m/z327−H2O),299(32)[m/z408−側鎖(C8H13)],281(38)(m/z299−H2O),172(59),109(57)[C8H13]+
FAB‐MS (検出されたそれぞれのピークのm/z値,検出された分子の状態を示す):
507[M+K]+,469[M+H]+,437[M−MeOH]+,419(m/z437−H2O)
高分解能EI‐MS (m/z値):408.3399(理論値C29H44O=[M−HCOOCH3]+,408.339256.2511)
高分解能FAB‐MS (m/z値):507.3244(理論値C31H48O3K=[M+K]+,507.3240)
13C‐NMR,1H‐NMR及びHMBCのデータを表1に示す:
【0022】
【表1】

【0023】
(2)(23E)‐3β‐ハイドロキシ‐7β‐メトキシククルビタ‐5,23,25‐トリエン‐19‐アール(化合物2)
無色結晶
mp:127〜130℃
比旋光度[α]25D:+19.1°(濃度c=0.21(g/100ml),溶媒:クロロホルム)
UV(溶媒:エタノール)λmax (単位:nm):239,231,224
IR νmax (単位:cm-1):3445(OH);2928;1713(>C=O;アルデヒド);1670,1610(共役二重結合);880(>C=CH2);820(>C=CH−)
EI‐MS (検出されたそれぞれのピークについて,m/z値,(相対イオン強度),検出された分子の状態を示す):
468(12)[M]+,450(7) [M−H2O]+,436(4) [M−MeOH]+,408(100) [M−(CH3O+CHO)]+,393(10)(m/z408−CH3),390(10),375(12)(m/z408−CH3−H2O),327(9)[m/z408−(C22〜C27)],309(35)(m/z327−H2O),299(17)[m/z408−側鎖(C8H13)],281(23)(m/z299−H2O),203(35),172(61),109(75)[C8H13]+
高分解能EI‐MS (m/z値):468.3605(理論値C31H48O3=[M]+,468.3603)
13C‐NMR,1H‐NMR及びHMBCのデータを表2に示す:
【0024】
【表2】

【0025】
(3)(23E)‐3β‐ハイドロキシ‐7β,25‐ジメトキシククルビタ‐5,23‐ジエン‐19‐アール(化合物3)
無色結晶
mp:104〜107℃
比旋光度[α]25D :+25.9°(濃度c=0.26(g/100ml),溶媒:クロロホルム)
IR νmax (単位:cm-1):3444(OH);2929;1712(>C=O;アルデヒド);845,820(>C=CH−)
EI‐MS(検出されたそれぞれのピークについて,m/z値,(相対イオン強度),検出された分子の状態を示す):
482(6)[M−H2O]+,440(74) [M−H2O−MeOH]+,421(22),408(100) [M−H2O−2MeOH]+,393(11)(m/z408−CH3),389(15),375(16)(m/z408−CH3−H2O),309(25),299(17)[m/z408−側鎖(C9H17O)],293(13),281(19),172(94),109(86),99(100)
高分解能EI‐MS (m/z値):482.3759(理論値C32H50O3[M−H2O]+,482.3760)
FAB‐MS (m/z値):539[M+K]+
13C‐NMR,1H‐NMR及びHMBCのデータを表3に示す:
【0026】
【表3】

【0027】
なお,化合物1〜3は,上記のような化学構造式で示されるものであれば,天然物から抽出した天然化合物に限られず,天然化合物を修飾し,或いは,化学合成することにより得るものであってもよい。
また,本発明の化合物1〜5には,一般に生体内において遊離形と実質的に同様の生理活性または薬理活性を発揮するもの,例えば,本発明の化合物1〜5のK,Naなどの医薬的に許容され得る塩,水和物なども含まれるものである。
また,本発明の化合物1〜5は,上述の抽出物と同様に,適当な医薬用の担体又は希釈剤と組み合わせて医薬とし,飲食品に添加して発癌予防に有効な機能性飲食品とし,あるいは,飼料に添加して用いることもできる。
【0028】
[発癌予防効果の確認試験について]
次に,本発明の効果を確認するために行った試験について説明する。
(Epstein−Barrウイルス(EBV)活性化抑制試験)
EBV活性化抑制試験は,抗発癌プロモーター探索の一次スクリーニング法として知られた試験であり,迅速,かつ定量性に優れ,加えて,微量活性成分の検出が可能な点で優れた試験である。本試験でEBV活性化を抑制する化合物の多くはマウス皮膚二段階発癌試験で抗発癌プロモーターとして作用することが確認されている。
【0029】
まず,試験の手順について図1のスキームを参照しながら説明する。なお,本手順は,徳田らの方法[Cancer Letters,40巻,309頁(1988)]に準拠している。
(1)1×106/mLのRaji(ラジ)細胞に,発癌プロモーターとして,20ng/mLの濃度の12‐O‐テトラデカノイルホルボール‐13‐アセテート(TPA)を32pmol加え,さらにTPAの活性発現のために相乗作用として働くn‐酪酸を加えた。
(2)そこに,水,エタノール,又はジメチルスルホキシドに溶解した所定量の被検物質を添加して,37℃で48時間培養した。
(3)培養終了後,上咽頭癌患者の血清(TPAにより活性化された細胞由来の抗体を含む)を用いた間接蛍光抗体法によりEBV早期抗原の発現を検出した。
【0030】
上記の手順に従って試験を行った後,TPAのみを加えた群(コントロール)のEBV早期抗原の発現率を100%として,被検物質添加群のEBV早期抗原の発現率を求め,次式(1)により被検物質のEBV早期抗原の発現阻害率(%)を算出した。
EBV早期抗原の発現阻害率(%)=
100 − 被検物質添加群のEBV早期抗原の発現率(%)・・・式(1)
前述の[ニガウリ果実からの抽出について]の項の記載に従って得た,ニガウリメタノールエキス,n‐ヘキサン画分,メタノール‐水画分,ブタノール画分及び水画分を被検物質として用い,EBV早期抗原発現阻害率を測定し,その結果を表4に示した。
【0031】
【表4】

【0032】
なお,被検物質の濃度が100μg/mLの欄の括弧内の数値は,ラジ細胞の生存率(%)を示す。この数値が高い方が正常細胞に対する悪影響が小さい,すなわち安全性が高いと言える。
表4に示すように,ニガウリのメタノールエキスは100μg/mLの濃度で,EBV早期抗原発現を89.3%阻害し,活性を示した。従って,本エキスは抗発癌プロモーター活性を有するとみなすことができる。同様に,n‐ヘキサン画分,メタノール‐水画分,ブタノール画分及び水画分の何れにも活性が認められたが,n‐ヘキサン画分に最も強い活性を認めた(100μg/mLの濃度で91.5%阻害)。
【0033】
また,化合物1〜5を被検物質として行ったEBV活性化抑制試験結果を表5に示した。なお,参照化合物として,ビタミンA誘導体であり,発癌予防効果が種々の動物モデル実験でも確認されているβ‐カロテン[村上ら,Biosci.Biotech.Biochem.,60巻,1頁(1996)]を用い,これについてもEBV活性化抑制試験を行った。
【0034】
【表5】

【0035】
なお,被検物質の濃度が1000倍の欄の括弧内の数値は,ラジ細胞の生存率(%)を示す。
表5に示すように,ニガウリから得たククルビタン型トリテルペンは,前述の5種のβ‐カロテンよりも高いEBV早期抗原発現阻害率を示した。また,これらの化合物1〜5は,試験において高いラジ細胞生存率を示したことから,高い安全性を持つ発癌予防剤として期待できる。
【0036】
さらに,本試験で活性を確認した化合物2及び4について,マウス皮膚二段階発癌試験を行い,活性を確認したので説明する。
(マウス皮膚二段階発癌試験)
(1)発癌イニシエーション抑制作用
ICR雌性マウス背部体毛を剃毛し,翌日に一酸化窒素(NO)産生試薬であるパーオキシナイトライト(Peroxynitrate)を35μg塗布し,イニシエーションを行った。1週間後より,被験マウスを15匹ずつ2群に分け,両群とも同一部位に1μgのTPAを週2回塗布し続けプロモーションを行った。第1群は試験中通常の飲料水を自由摂取させ,これを対象群とした。第2群はイニシエーションを行った前後1週間,0.0025%(2.5mg/100mL水)濃度に調整した被験物質含有飲料水を自由摂取させた。TPA塗布開始後1週間毎にマウスに発生する腫瘍個数の平均値及び発生率を対照群と比較し,抑制効果を算出した。
【0037】
(2)発癌プロモーション抑制作用
ICR雌性マウスの背部皮下に,7,12‐ジメチルベンズ(a)アントラセン(DMBA)390nMolを塗布してイニシエートし,1週間後よりTPA 1.7nMolの塗布を週2回,20週間にわたって行った。それと並行して,85nMolの被験物質(化合物2あるいは4)を,TPA塗布の60分前に同一部位に塗布した。マウスは1群15匹を用いて試験し,腫瘍を形成したマウスの匹数及びマウス1匹当りの腫瘍個数を調べ,被験物質を塗布しない対象群と比較した。
【0038】
化合物2及び化合物4のマウス皮膚二段階発癌試験における発癌イニシエーション抑制効果は図4に示した。対象群では12週後に全てのマウスに腫瘍の発生が認められ,20週後には1匹当り7個の腫瘍が認められたのに対し,化合物2及び4塗布群では何れも腫瘍の発生が明らかに遅延し,20週後でも腫瘍の発生率は80%,また,1匹当りの腫瘍数でも4.5〜4.7個と抑制効果が認められた。
【0039】
また,化合物2及び化合物4のマウス皮膚二段階発癌試験における発癌プロモーション抑制効果効果は図5に示した。対象群では10週後に全てのマウスに腫瘍の発生が認められ,20週後には1匹当り9個の腫瘍が認められたのに対し,化合物2及び4塗布群では何れも腫瘍の発生を明らかに遅延させ,20週後でも腫瘍の発生率は80%,また,1匹当りの腫瘍数でも4.0と著しい抑制効果が認められ,これらが発癌予防物質として期待できることが裏付けられた。
【図面の簡単な説明】
【0040】
【図1】本発明に係る化合物1〜5の化学構造式を示す図である。
【図2】本発明に係る化合物1〜3のNOESYスペクトル法により得られた核オーバーハウザー効果(NOE)相関関係を説明する図である。
【図3】EBV活性化抑制試験の手順を説明する図である。
【図4】マウス皮膚二段階発癌試験における発癌イニシエーション抑制効果を示すグラフである。
【図5】マウス皮膚二段階発癌試験における発癌プロモーション抑制効果効果を示すグラフである。
【特許請求の範囲】
【請求項1】
ニガウリの果実,茎,葉及び根のうちの少なくとも一つを溶媒で抽出して得られる抽出物を含有することを特徴とする発癌予防剤。
【請求項2】
ククルビタン型トリテルペンを含有することを特徴とする発癌予防剤。
【請求項3】
前記ククルビタン型トリテルペンが,(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23,25‐トリエン‐3β‐オール,(23E)‐3β‐ハイドロキシ‐7β‐メトキシククルビタ‐5,23,25‐トリエン‐19‐アール,(23E)‐3β‐ハイドロキシ‐7β,25‐ジメトキシククルビタ‐5,23‐ジエン‐19‐アール,(23E)‐5β,19−エポキシ‐19,25‐ジメトキシククルビタ‐6,23‐ジエン‐3β‐オール,(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23‐ジエン‐3β,25‐ジオールからなる群から選ばれた少なくとも1種のものであることを特徴とする請求項2に記載の発癌予防剤。
【請求項4】
前記ククルビタン型トリテルペンは,ニガウリを処理して得られることを特徴とする請求項2又は3に記載の発癌予防剤。
【請求項1】
ニガウリの果実,茎,葉及び根のうちの少なくとも一つを溶媒で抽出して得られる抽出物を含有することを特徴とする発癌予防剤。
【請求項2】
ククルビタン型トリテルペンを含有することを特徴とする発癌予防剤。
【請求項3】
前記ククルビタン型トリテルペンが,(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23,25‐トリエン‐3β‐オール,(23E)‐3β‐ハイドロキシ‐7β‐メトキシククルビタ‐5,23,25‐トリエン‐19‐アール,(23E)‐3β‐ハイドロキシ‐7β,25‐ジメトキシククルビタ‐5,23‐ジエン‐19‐アール,(23E)‐5β,19−エポキシ‐19,25‐ジメトキシククルビタ‐6,23‐ジエン‐3β‐オール,(23E)‐5β,19−エポキシ‐19‐メトキシククルビタ‐6,23‐ジエン‐3β,25‐ジオールからなる群から選ばれた少なくとも1種のものであることを特徴とする請求項2に記載の発癌予防剤。
【請求項4】
前記ククルビタン型トリテルペンは,ニガウリを処理して得られることを特徴とする請求項2又は3に記載の発癌予防剤。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2006−22018(P2006−22018A)
【公開日】平成18年1月26日(2006.1.26)
【国際特許分類】
【出願番号】特願2004−199472(P2004−199472)
【出願日】平成16年7月6日(2004.7.6)
【出願人】(899000057)学校法人日本大学 (650)
【Fターム(参考)】
【公開日】平成18年1月26日(2006.1.26)
【国際特許分類】
【出願日】平成16年7月6日(2004.7.6)
【出願人】(899000057)学校法人日本大学 (650)
【Fターム(参考)】
[ Back to top ]

