腸内細菌科細菌及びエロモナス属細菌を培養併用インサイチュ−ハイブリダイゼーション法により区別して同定及び/又は計数する方法
【課題】エロモナス属に属する細菌と腸内細菌科に属する細菌が混在する可能性のある試料から、エロモナス菌と腸内細菌科に属する細菌とを区別して、迅速に同定及び又は検出する方法を提供する。
【解決手段】培養併用インサイチューハイブリダイゼーション法を用いて、腸内細菌に属する細菌とエロモナス属に属する菌を同時検出できる方法を開発した。
【解決手段】培養併用インサイチューハイブリダイゼーション法を用いて、腸内細菌に属する細菌とエロモナス属に属する菌を同時検出できる方法を開発した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微生物の検出及び同定の技術分野に属する。具体的には、大腸菌群の中からエロモナス属に属する菌を迅速に検出、同定及び/又は計数する技術に関する。
【背景技術】
【0002】
大腸菌群(coliform)は、好気性又は通性嫌気性の無芽胞桿菌で、乳糖を分解してガスを形成するグラム陰性菌のことで、大腸菌以外に、クレブシエラ、シトロバクター、エンテロバクター等の菌があり、大腸菌群と総称されている。大便汚染指標細菌として重要視されており、本菌群が水、食品から検出されることは、それらが大便により直接又は間接に汚染されていることを意味するとされている。
【0003】
大腸菌群の同定検出には、ブリリアントグリーン乳糖胆汁ブイヨン培地(BGLB)に試料を移植し、45ないし51時間培養しガスの発生を観察し、このときガスの発生により大腸菌群陽性/陰性を判断するLB−BGLB法や、大腸菌群をβ-D-ガラクトシダーゼによるsalmon-GALの分解で確認し、大腸菌であることをX-GLUCのグルコニダーゼによる分解で確認する発色酵素基質法により、クロモカルトコリフォーム培地(Chromocult(R) Coliform Agar)などの選択培地を用いて、培養計数されている。
【0004】
しかしながら、大腸菌群は、分類学的に関連性のない細菌を含み、更に、サルモネラ、赤痢菌等の重要な腸内病原菌は、上記大腸菌群テストでは検出されないという問題がある。
【0005】
そこで、最近では、上記の大腸菌群を指標とすることに代え、腸内細菌科に属する細菌(腸内細菌科細菌と称する)が加工食品の安全性指標に用いられている。現在までに117種の腸内細菌科に属する代表的な菌種を調べたところ、内74種がONPG陽性で、いわゆる大腸菌群テストの対象である。30種がONPG陰性で、13種がONPG反応性が不明である。ONPG陰性の種は、多くが大便より分離され、サルモネラ、シゲラなどの病原菌を含んでいる。既に、これら腸内細菌科細菌を検出するためのプローブとして、本発明者らは、プローブDを開発している(非特許文献1)。さらに、このプローブDを用いて、腸内細菌科の細菌数を、培養併用インサイチュ-ハイブリダイゼーション法で計測してきた(非特許文献2)。
【0006】
エロモナス属菌群は淡水環境の常在細菌であり、魚、及び動物に感染症を引き起こすことから、水・食品(魚・野菜・氷・アイスクリーム)の安全性検査指標となる細菌である。エロモナス属菌には、(1)魚(サケ)のセッソウ病を引き起こす細菌A. salmonicida 、(2)ヒトに感染症を引き起こし、例えば、(i) (井戸水の汚染)等により、下痢(多くは発展途上国、オーストラリアやアメリカ(アイオワ州)で、乳幼児又は老人に多い)を起こす細菌A. hydrophila、(ii)敗血症(白血病・癌・肝臓傷害患者への感染、消化管が侵入門戸と考えられている)を起こす細菌A. hydrophila, A. caviae, A. veronii, A. schubertii, A. media、(iii) 傷感染を起こす細菌などが知られている。
【0007】
エロモナス属菌群の検査は、選択性の無い培地を用いて、菌株を分離した後、約10項目に及ぶ表現形質を調べることで、初めて可能になる。エロモナスと同定できるまでは、数週間から一ヶ月を要している。
【0008】
【非特許文献1】Journal of Applied Microbiology. Vol.93.60-68
【非特許文献2】Journal of Applied Microbiology. Vol.95.1182-1190
【発明の開示】
【発明が解決しようとする課題】
【0009】
エロモナス属に属する細菌は、グラム陰性、通性嫌気性、陸性(塩類要求性が低い)、オキシダーゼ陽性で、現在までに 16種知られており、 一部の種は37℃で乳糖を発酵しガス産生する。
【0010】
エロモナス属に属する細菌の一部であるA. caviae、A hydrophila、A. mediaに属する菌株および他の運動性エロモナス属菌株の中には、37℃で乳糖を発酵してガスを産生する細菌が含まれる。また、A. caviae、A. eucrenophila、A hydrophila、A. media、A. sobriaは、クロモカルトコリフォーム培地(Chromocult(R) Coliform Agar;以下CC培地という)で増殖する。他方、エロモナス属に属する細菌には、A.salmonicida subsp. achromogenes, A.salmonicida subsp. salmonicidaのようにCC培地では増殖しないものもあり、同定が十分でない。
【0011】
他方、大腸菌群検査はCC培地などの選択培地を用いて、培養計数されているが、エアロモナス属に属する細菌が混在していると、大腸菌群数の計数値に正確性を欠くことが知られている。実際に、1962年には、LeclercとButtiauxによって、9,036例の飲料水の3割が、エロモナス細菌の混入による誤った大腸菌群陽性と判断されている。
【0012】
また、上記したプローブDによる方法では、エロモナス属に属する細菌は、検出することができなかった。
【0013】
そこで、本発明は、エロモナス属に属する細菌と腸内細菌科に属する細菌が混在する可能性のある試料から、エロモナス菌と腸内細菌科に属する細菌とを区別して、迅速に同定及び又は検出する方法を提供することを課題とする。
【課題を解決するための手段】
【0014】
現在までに、発明者等は、大腸菌群の代替指標として知られている腸内細菌科を迅速に計数する培養併用インサイチュ-ハイブリダイゼーション法を発明してきた。
【0015】
これに加え、エロモナス細菌を迅速に検出する遺伝子プローブの開発も行ってきた。現在の培養同定法により大腸菌群陽性とされた試料中のエロモナス細菌の混入を調べるため、培養併用インサイチュ-ハイブリダイゼーション法を用いて、腸内細菌科細菌とエロモナス属に属する菌を両者とも検出できるように、その条件を種々検討し、両者を迅速に同時検出する方法を開発し、発明を完成させた。
【0016】
更に、本発明者らは、これら両菌の同時検出のための試料の培養及び/又は調製条件も検討し、大腸菌とA. hydrophilaとが混合した試料を供試した時、微小コロニーを形成する培養条件を定めたところ、30℃、6-7時間で、遺伝子プローブで検出可能な微小コロニーに発達することをあきらかにした。
【発明の効果】
【0017】
本発明の方法を用いることにより腸内細菌科細菌とエロモナス属に属する菌を両者とも検出できる。
【発明を実施するための最良の形態】
【0018】
1.培養併用インサイチュ-ハイブリダイゼーション法
1−1.培養併用インサイチュ-ハイブリダイゼーション法の特徴/利点
従来からの蛍光ラベルしたプローブを用いるインサイチュ-ハイブリダイゼーション法では、次のような問題点があった。(1)特に食品を汚染する微生物の同定検出のためには、蛍光標識プローブでは、微生物が増殖した段階、すなわち汚染が相当に進まないと検出できない。(2)食品汚染においては、特に生菌数が問題となるところ、プローブは死菌に対してもハイブリダイズしてしまうので、生菌と死菌との区別がつかなかった。
【0019】
これに対し、培養併用インサイチュ-ハイブリダイゼーション法では、十分に希釈された試料を1〜10時間程度培養することにより、生菌のみを増殖させ、微小なコロニー状とすることにより、通常の蛍光顕微鏡下で、コロニーを観測、計数することができるようになったものである。
【0020】
1−2.培養併用インサイチュ-ハイブリダイゼーション法の工程
(1)メンブレンフィルター上への試料の捕集
食品、環境等から分離された試料がメンブレンフィルター等の試料捕集体上で吸引される。メンブレンフィルターとしては、例えば、ヌクレオポアフィルター、アイソポアフィルター、マイレクスフィルターを用いることができ、好適には、例えば0.2-0.4μmの孔径のアイソポアメンブレンフィルターを用いることができる。
【0021】
(2)試料の培養 マイクロコロニーの形成
試料が付着したメンブレンフィルター等の試料捕集体は、培地の入ったペトリ皿に移される。30-37℃で、マイクロイコロニーが形成さえるまで、例えば、1−10時間、好適には5−7時間、例えば、6時間培養される。
【0022】
(3)FISHおよび細菌数計測
(イ) エタノールなどでスライドグラス又はフィルター上の細胞が固定される。フィルターはスライドガラスに固定される。
(ロ)エタノール浸漬又はオーブン等で乾燥される。
(ハ)ハイブリダイゼーション用バッファーにスライドガラスごとフィルターは浸漬されハイブリダイゼーション温度でインキュベートする。
(ニ)オリゴヌクレオチドプローブが添加され、インキュベーションを継続する。
(ホ)試料の載せられたフィルター又はスライドガラスを洗浄し、空気乾燥される。
(ヘ)蛍光顕微鏡で観察する。通常X10〜X1000で観察できる。
【0023】
1−3.プローブの調製
1−3−1 腸内細菌科細菌検出用プローブは、先に出願した特開2001−136969号に従い、調整した。
具体的には、(1)腸内細菌科は系統的にPasteurellaceae(パスツレラ科)に最も近く、次にVibrionaceae(ビブリオ科)が近いとされているので、腸内細菌科とパスツレラ科並びにビブリオ科に属する菌種の16S rRNA塩基配列を比較し、腸内細菌科に共通で、かつ、後2者のパスツレラ科及びビブリオ科とは異なる塩基配列を検討対象とした。そのため腸内細菌12属29種(β-ガラクトシラーゼ(+)9属19 種、β-ガラクトシラーゼ(−)5属9 種、β-ガラクトシラーゼ(不明)1種)と、パスツレラ科に属する細菌3属6種、ビブリオ科に属する細菌3属8種の16S rDNA塩基配列情報を収集し、これら配列のマルチプルアライメントを行い腸内細菌科細菌だけに共通な約20塩基の塩基配列を検索した。(2)検索により、腸内細菌科細菌に共通な塩基配列とマルチプルアライメントに用いた上記各菌種(腸内細菌科、パスツレラ科及びビブリオ科)の16S rRNAの同領域の塩基配列を比較し、パスツレラ科及びビブリオ科の菌種14菌種に対しては比較的ミスマッチ数が大きく、腸内細菌科細菌29菌種に対しては少ないものを、5’-GAAGCCACGCCTCAAGGGCACAA-3’ (配列番号1:プローブBと呼ぶ) 及び5’-TGCTCTCGCGAGGTCGCTTCTCTT-3’(配列番号2:プローブDと呼ぶ)を腸内細菌科細菌特異的プローブ候補として選択した。(3)上記腸内細菌科細菌プローブ候補を蛍光標識でラベルして用いて腸内細菌科細菌及び非腸内細菌をFISH法によりアッセイした。その結果β-ガラクトシラーゼ陽性陰性を問わず腸内細菌科細菌試料のほとんどから蛍光が検出され、またプローブを加えないFISHでは蛍光が認められなかった。又、特に、プローブDを用いた場合、腸内細菌科に属する77種中75種をインサイチューハイブリダイゼーション法により検出することができ、しかもエロモナス属、バチラス属、ラクトバチルス属、スタフィロコッカス属、フォトバクテリウム属、ビブリオ属、に属する微生物からは蛍光が検出されなかった。(検出された腸内細菌科細菌は、供試菌34株に対しプローブ1は29株(85%)、プローブ2は32株(94%)であった。一方、非腸内細菌とプローブ1及び同2によるFISHを行った結果、いずれもシグナルが検出されなかった。以上から、腸内細菌科細菌検出用プローブ1及び同2は供試腸内細菌科細菌を特異的に検出することが可能であり、その検出率はいずれも高くプローブ1は85%、プローブ2は94%であった。
【0024】
1−3−2 エアロモナス属検出用プローブ
腸内細菌科細菌検出用プローブと同様に設計を行った。
具体的には、(1)エアロモナス属に属する種及び近縁の系統の細菌、具体的には、Alcaligenes, Vibrio, Shewanella, Brenneria, Pseudoalteromonas,および腸内細菌科に属する菌属する菌の16S rRNAの塩基配列を収集し、エアロモナス属に共通である塩基配列であって、しかも近縁の細菌、具体的にはAlcaligenes, Vibrio, Shewanella, Brenneria, Pseudoalteromonas,および腸内細菌科に属する菌とはミスマッチする約20塩基の塩基配列を検索する。(2)検索により、エロモナス属細菌に共通な塩基配列とマルチプルアライメントに用いた上記各菌種の16S rRNAの同領域の塩基配列を比較し、エロモナス属以外の菌種に対しては比較的ミスマッチ数が大きく、エロモナス菌種に対してはミスマッチの少ないものを、エロモナス属細菌特異的プローブ候補として選択した。この操作は、on-line probemer(http://probemer.cs.loyola.edu/)、リボゾームデータベースプロジェクト(http://rdp.cme.msu.edu/index.jsp)で検証することが可能である。結果を表1に示す。
【0025】
【表1】

【0026】
(3)つぎに、実際に、エロモナス属細菌プローブ候補を用いてエロモナス属細菌及び非エロモナス属をFISH法によりアッセイした。その結果エロモナス属細菌試料のほとんどから蛍光が検出され、またプローブを加えないFISHでは蛍光が認められないプローブをエアロモナス属検出用プローブとすることができる。
【0027】
2.腸内細菌科細菌及びエロモナス属細菌とが共存する試料における、培養併用インサイチュ-ハイブリダイゼーション法の確立
2−1.腸内細菌科細菌の培養併用インサイチュ-ハイブリダイゼーション法による検出の検討
上記1−3−1で選択された腸内細菌科細菌同定用プローブを用いて、腸内細菌科細菌の培養併用インサイチュ-ハイブリダイゼーション法による同定条件を検討した。
【0028】
2−1−1 培養条件の検討
通常の蛍光顕微鏡用いた、16SrRNAに対する蛍光標識プローブによる観察では、細菌1細胞を検出することは困難である。そこで、100倍率の蛍光顕微鏡で観察可能な程度の100細胞に増加する程度培養することとした。例えば、Tryptic Soya Agar培地で37℃で培養する場合、約6時間培養し、微小コロニーを形成させることができる。
【0029】
2−1−2 ハイブリダイゼーション条件の検討
細胞の固定化:通常のFISHでは、パラホルムアルデヒドを用いて固定化を行うが、培養併用インサイチュ-ハイブリダイゼーション法では、エタノールを用いることにより、約5分間で固定化することができる。パラホルムアルデヒドを使用した場合は、パラホルムアルデヒドの除去及び蛍光強度の最大化のためには固定化後の洗浄が必要であるが、エタノールでは不要である。
【0030】
腸内細菌科細菌を、ハイブリダイゼーション温度を45℃から65℃に変化させて、その同定性の検討を行う。例えば、プローブDの場合、腸内細菌科で、プローブDに対応する領域では、ミスマッチが一番多い種は、Serratia rubidaの4塩基であることから、Serratia rubidaeとの比較で、ホルムアミド20%の条件では、60℃でハイブリダイズさせることにより、同定性が高まることを見いだした。又、ハイブリダイゼーションは、DNAプローブを用いる場合は、5分程度でも良い。
【0031】
2−2.腸内細菌科細菌の培養併用インサイチュ-ハイブリダイゼーション法による検出における、エロモナス属菌の同時検出の検討
2−2−1.同時検出用のプローブの選定
腸内細菌科の培養併用インサイチュ-ハイブリダイゼーション法におけるハイブリダイゼーション下で、同時にエロモナス属細菌を検出できるようなプローブ、言い換えれば、腸内細菌科用のプローブが特異性を有するハイブリダイゼーション条件とエロモナス属細菌用のプローブが特異性を有するハイブリダイゼーション条件が重複するようなプローブを選定する。ハイブリダイゼーション条件は、反応液の温度、塩濃度やホルムアミド濃度にも影響を受ける。具体的には、例えば、腸内細菌科細菌の検出にプローブDを用いる場合、ハイブリダイゼーション条件としては、ホルムアミド20%、温度60℃を採用されるが、かかるハイブリダイゼーション条件で特異性の高いエロモナス属菌特異的プローブを選択する。具体的には、AER66(CTACTTTCCCGCTGCCGC:配列番号3)を用いることができる。
【0032】
なお、ハイブリダイゼーション条件の比較は、ハイブリダイゼーション固有特異条件値を比較し、該ハイブリダイゼーション固有特異性条件値が近似する1組の腸内細菌科用のプローブ及びエロモナス属細菌用のプローブを選択することもできる。
【0033】
ここで、ハイブリダイゼーション固有特異性条件値は、当該プローブがハイブリダイゼーションを起こす場合、ハイブリダイゼーション温度及びホルムアミド濃度(%)を用いて次の通り定義される。(ハイブリダイゼーションバッファーとしては、ホルムアミド以外は、同じ組成のものを用い、例えば、ホルムアミド以外の組成が0.9M NaCl、20mM Tris-HCl、0.01% SDS(pH7.4)からなるハイブリダイゼーション溶液を挙げることができる。)
【0034】
[数1]
ハイブリダイズ固有特異性条件値(K)(℃)=ハイブリダイゼーション温度(℃)+ 0.7(℃)Xホルムアミド濃度(%)
【0035】
2−2−2 培養条件の検討
腸内細菌科細菌と、エロモナス属に属する細菌とを共培養し、その後FISHで同定した。
共培養条件として、温度及び時間を変化させた。そして、共培養後、微小コロニーの大きさを測定し、培養併用インサイチュ-ハイブリダイゼーション法に適した、培養条件を決定した。
【0036】
3.エロモナス属細菌と腸内細菌科細菌が含まれている可能性のある試料を同時に同定及び又は計測する方法及びそのためのキット。
(試料の調製)
食品試料の場合、試料を0.8%NaCl溶液でブレンダーでホモジェナイズして検査試料を調製する。
【0037】
(プローブの調製)
腸内細菌科特異的プローブ及びエロモナス属細菌特異的プローブを、それぞれ異なる蛍光波長の蛍光標識である第1の蛍光標識又は第2の蛍光標識で標識する。例えば、腸内細菌科特異的プローブとしては前記プローブDを、エロモナス属細菌特異的プローブとしては、前記AER66を、それぞれ、TAMRA又はFITCで標識することができる。
【0038】
(FISH前培養)
ホモジェナイズした試料は、0.2-0.4μmの特異反応の対象となる細菌を通過させない孔径のメンブレンフィルター、好適には0.4μmの孔径のメンブレンフィルター(Isopore ミリポア社)等の試料捕集体上に真空吸引される。フィルターは適切な培地、含むペトリ皿に移され、2〜8時間、25〜37℃で培養される。培地としては、腸内細菌科細菌及びエロモナス属細菌が同様に増殖する培地を採用することができる。具体的には、例えば、ブイヨン培地、tryptic soya agar(Difco)培地(トリプシン処理大豆カゼイン寒天培地)、普通栄養寒天培地、ブレインハートインフュージョン培地等を挙げることができる。
【0039】
(FISH)
培養されたフィルター等試料捕集体上の細菌を固定する。好適には、室温で、エタノールで固定する。その後フィルターは、透過性のフィルター固定支持体に載せられる。計測を蛍光顕微鏡で行う場合には、固定支持体としては、スライドガラスを用いることができるが、他の蛍光測定装置により計測する場合には、当該蛍光測定装置に取り付けでき計測可能な支持体であれば、いかなる固定支持体も用いることができる。支持体に固定されたフィルターは乾燥される。好適には、80℃、10分間乾燥機で乾燥させる。
【0040】
乾燥されたスライドグラス等の固定支持体に、ハイブリダイゼーションバッファーが与えられる。ハイブリダイゼーションバッファーとしては、例えば、0.9M NaCl、20%ホルムアミド、20mM Tris-HCl、0.01% SDS(pH7.4)からなるハイブリダイゼーション溶液を挙げることができる。ハイブリダイゼーションバッファーで1-5分間のプレインキュベーション後、第1の蛍光標識で標識された腸内細菌科特異的プローブ及び第2の蛍光標識で標識されたエロモナス属細菌特異的プローブを添加する。プローブとのハイブリダイゼーションは、5分−1時間行うことができる。ハイブリダイゼーション後、フィルターの乗せられた固定支持体は、緩衝液で洗浄される。洗浄用の緩衝液としては、例えば、20mM Tris-HCl、180mM NaCl, 0.01%SDS (pH7.4)を含む洗浄液を用いることができる。緩衝液での洗浄後、蒸留水で洗浄する。
【0041】
ハイブリダイゼーション及び洗浄は、前記標識プローブD及び標識AER66を用いた場合には、ハイブリダイゼーションを60℃で、5分−1時間行い、洗浄を60℃で20分行うことができる。
【0042】
洗浄後、乾燥し、液浸し、2波長の励起波長を用いる蛍光を用いる蛍光顕微鏡などの蛍光を観測又は測定する装置を用い、微小コロニーを観測、計数することができる。
【0043】
(キット)
腸内細菌科細菌及びエロモナス属細菌を培養併用インサイチュ-ハイブリダイゼーション法により区別して同定及び/又は計数するための試薬等をキットとすることができる。具体的には、第1の蛍光標識した腸内細菌科細菌特異的プローブ及び第2の蛍光標識をしたエロモナス属に属する細菌に特異的なプローブを含むキット、より具体的には、第1の蛍光標識された配列番号2で表されるDNAからなるプローブ及び第2の蛍光標識された配列番号3で表されるDNAからなるプローブを含むキットが挙げられる。これらキットには、更に、反応液(ハイブリダイゼーションバッファー)、洗浄液(緩衝液)、メンブレンフィルター、又は培地のいずれか又は、その組み合わせを含ませることができる。反応液、洗浄液、及び培地は、前記したものを用いることができる。
【0044】
以下に、本件発明の実施例を記載するが、本件発明が、下記実施例に限定されるものではない。
【実施例1】
【0045】
腸内細菌科細菌特異的プローブDと併用可能なエロモナス属特異的プローブの選択及び検証
腸内細菌科細菌プローブDは、ホルムアミド濃度が20%の反応液を用い、60℃で反応させることにより、特異性の高い結果が得られる。この反応条件で特異性の高いエロモナスプローブを検討した。
【0046】
エロモナスプローブの特異性評価は次のように行った。
1) Aeromonas hydrophilaおよびエロモナス属菌と近縁の細菌(表2―4)をブイヨン培地およびTryptic Soya Broth (Difco)でそれぞれ一晩前培養(30℃および37℃)した細胞を遠心分離で集菌し、この菌体に4%パラホルムアルデヒド‐リン酸緩衝液(PBS)を300μl加え、4℃で1-3時間固定した。
2) この固定した細菌細胞の3マイクロリッターをスライドグラス上に載せ、風乾後、50,80および100%エタノールに順次3分間浸漬することで脱水を行った。
3) スライドグラス上の固定した細菌細胞上へあらかじめ60℃に加温しておいたハイブリダイゼーション溶液(0.9M NaCl, 20mM Tris-HCl, 0.01% SDS, pH 7.4を8マイクロリッターを注加し,60℃で5分間プレハイブリダイゼーションを行った後,5pmol/マイクロリッターのプローブを1マイクロリッター加え、60℃で60分間ハイブリダイゼーションを行った。
4) ハイブリダイゼーション後、スライドグラスをあらかじめ60℃で加温した洗浄液(20mM Tris-HCl, 40-220mM NaCl, 0.01% SDS, pH7.4)に20分間浸漬した後、滅菌蒸留水で残留する洗浄液を洗い流した。
5) スライドグラスを風乾後、ガラス上の細菌細胞を蛍光顕微鏡で観察し、細菌細胞の蛍光具合から両プローブの特異性を判定した。
結果を表2―4に示す。
【0047】
表2に示されるようにAER-mrfプローブは、ホルムアミド濃度が27.5%以上、45%以下の反応液を用い、60℃で反応させることにより、高い特異性を示した。
【0048】
表3に示されるようにAER-mrrプローブは、ホルムアミド濃度が27.5%以上、45%以下の反応液を用い、60℃で反応させること、又はホルムアミド濃度が45%の反応液を用いて、46℃反応させることにより、P.phosphoreum以外とは高い特異性を示した。
【0049】
表4に示されるように、AER66プローブは、ホルムアミド濃度が20%以上、35%以下の反応液を用い、60℃で反応させることにより、高い特異性を示した。
以上から、腸内細菌科細菌特異的プローブDと併用可能なエロモナス属特異的プローブとして、AER66が選択できることがわかった。なお、表2-4中で、温度は、Temp、ホルムアミド濃度%は、FA(%)と記載され、ている。
【0050】
【表2】

【0051】
【表3】

【0052】
【表4】

【実施例2】
【0053】
大腸菌とA. hydrophila固定細胞混在試料に対する腸内細菌特異的プローブDおよびエロモナス属特異的プローブAER66の特異反応性の検証
1)大腸菌とA. hydrophilaの固定菌体を混合した試料をスライドグラス上に載せ、風乾後、50,80および100%エタノールに順次3分間浸漬することで脱水を行った。
2) スライドグラス上の固定した細菌細胞上へあらかじめ60℃に加温しておいたハイブリダイゼーション溶液(0.9M NaCl, 20mM Tris-HCl, 0.01% SDS, pH 7.4)を8マイクロリッターを注加し、60℃で5分間プレハイブリダイゼーションを行った後,プローブDおよびAER66がそれぞれ5pmol/マイクロリッター混合したプローブ溶液を1マイクロリッター加え、60℃で60分間ハイブリダイゼーションを行った。
3) ハイブリダイゼーション後、スライドグラスをあらかじめ60℃で加温した洗浄液(20mM Tris-HCl, 40-220mM NaCl, 0.01% SDS, pH7.4)に20分間浸漬した後、滅菌蒸留水で残留する洗浄液を洗い流した。
4) スライドグラスを風乾後、ガラス上の細菌細胞を蛍光顕微鏡で観察し、細菌細胞の蛍光具合から両プローブの特異性を判定した。
【0054】
又、大腸菌とA. hydrophilaが混在する試料を、0.4μm孔径のヌクレオポアフィルターに捕集し、そのフィルターをTryptic Soy agar上で、30℃で、6時間培養して微小集落を形成させた。この微小集落に対し、エロモナス特異プローブAER66および腸内細菌特異プローブDを混合し、20%ホルムアミドを含むハイブリダイゼーション溶液を用い、60℃の条件でFISH反応を行った。
【0055】
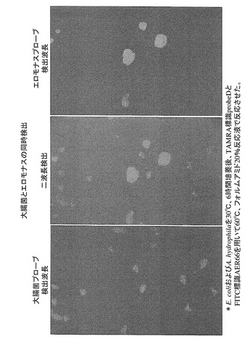
ホルムアミド濃度が20%の反応液を用い、60℃で反応させることにより、A. hydrophilaはAER66プローブと大腸菌はプローブDと高い特異性を示して反応し、それぞれのプローブの蛍光色が明確に区別できた。大腸菌は赤色蛍光を、A. hydrophilaは緑色蛍光を放ち、区別できた。結果を図1に示す。
【実施例3】
【0056】
培養併用インサイチューハイブリダイゼーション法で大腸菌とエロモナスの微小集落を検出する至適培養条件の設定
1) 大腸菌とA. hydrophilaを供試し、0.4μm孔径のヌクレオポアフィルターにそれぞれ捕集した。
2) そのフィルターをTryptic Soya agar(Difco)上で、25℃、30℃又は37℃で、それぞれ2、4、6及び8時間培養し、それぞれの細菌の微小集落を形成させた。
3) 培養後、エタノールでコロニーを固定し、エロモナス特異プローブAER66あるいは腸内細菌特異プローブDをそれぞれ含む、20%ホルムアミドを混合したハイブリダイゼーション溶液を用い、60℃の条件でFISH反応を行った。
4)その後、蛍光顕微鏡で、微小コロニーの形成状況を、微少集落の直径を測定及び、計測することにより調べた。結果を図2に示す。
【0057】
微小コロニーを形成する培養条件としては、30℃、6-7時間で、遺伝子プローブで検出可能な微小コロニーに発達することがあきらかになった。又、この条件で、大腸菌とA. hydrophilaの微小コロニーの直径が同程度の大きさ(50-100μm)に形成された。
【産業上の利用可能性】
【0058】
本願発明は、食中毒細菌の検査及び/又は環境試料の衛生検査に用いることができる。
【図面の簡単な説明】
【0059】
【図1】大腸菌とエロモナスの同時検出 *E. coliおよびA. hydrophilaを30℃、6時間培養後、TAMRA標識probeDとFITC標識AER66を用いて60℃、フォルムアミド20%反応液で反応させ、洗浄後、蛍光顕微鏡で観察した。
【図2】培養併用FISH法で検出できる微小集落が形成される至適温度と時間
【技術分野】
【0001】
本発明は、微生物の検出及び同定の技術分野に属する。具体的には、大腸菌群の中からエロモナス属に属する菌を迅速に検出、同定及び/又は計数する技術に関する。
【背景技術】
【0002】
大腸菌群(coliform)は、好気性又は通性嫌気性の無芽胞桿菌で、乳糖を分解してガスを形成するグラム陰性菌のことで、大腸菌以外に、クレブシエラ、シトロバクター、エンテロバクター等の菌があり、大腸菌群と総称されている。大便汚染指標細菌として重要視されており、本菌群が水、食品から検出されることは、それらが大便により直接又は間接に汚染されていることを意味するとされている。
【0003】
大腸菌群の同定検出には、ブリリアントグリーン乳糖胆汁ブイヨン培地(BGLB)に試料を移植し、45ないし51時間培養しガスの発生を観察し、このときガスの発生により大腸菌群陽性/陰性を判断するLB−BGLB法や、大腸菌群をβ-D-ガラクトシダーゼによるsalmon-GALの分解で確認し、大腸菌であることをX-GLUCのグルコニダーゼによる分解で確認する発色酵素基質法により、クロモカルトコリフォーム培地(Chromocult(R) Coliform Agar)などの選択培地を用いて、培養計数されている。
【0004】
しかしながら、大腸菌群は、分類学的に関連性のない細菌を含み、更に、サルモネラ、赤痢菌等の重要な腸内病原菌は、上記大腸菌群テストでは検出されないという問題がある。
【0005】
そこで、最近では、上記の大腸菌群を指標とすることに代え、腸内細菌科に属する細菌(腸内細菌科細菌と称する)が加工食品の安全性指標に用いられている。現在までに117種の腸内細菌科に属する代表的な菌種を調べたところ、内74種がONPG陽性で、いわゆる大腸菌群テストの対象である。30種がONPG陰性で、13種がONPG反応性が不明である。ONPG陰性の種は、多くが大便より分離され、サルモネラ、シゲラなどの病原菌を含んでいる。既に、これら腸内細菌科細菌を検出するためのプローブとして、本発明者らは、プローブDを開発している(非特許文献1)。さらに、このプローブDを用いて、腸内細菌科の細菌数を、培養併用インサイチュ-ハイブリダイゼーション法で計測してきた(非特許文献2)。
【0006】
エロモナス属菌群は淡水環境の常在細菌であり、魚、及び動物に感染症を引き起こすことから、水・食品(魚・野菜・氷・アイスクリーム)の安全性検査指標となる細菌である。エロモナス属菌には、(1)魚(サケ)のセッソウ病を引き起こす細菌A. salmonicida 、(2)ヒトに感染症を引き起こし、例えば、(i) (井戸水の汚染)等により、下痢(多くは発展途上国、オーストラリアやアメリカ(アイオワ州)で、乳幼児又は老人に多い)を起こす細菌A. hydrophila、(ii)敗血症(白血病・癌・肝臓傷害患者への感染、消化管が侵入門戸と考えられている)を起こす細菌A. hydrophila, A. caviae, A. veronii, A. schubertii, A. media、(iii) 傷感染を起こす細菌などが知られている。
【0007】
エロモナス属菌群の検査は、選択性の無い培地を用いて、菌株を分離した後、約10項目に及ぶ表現形質を調べることで、初めて可能になる。エロモナスと同定できるまでは、数週間から一ヶ月を要している。
【0008】
【非特許文献1】Journal of Applied Microbiology. Vol.93.60-68
【非特許文献2】Journal of Applied Microbiology. Vol.95.1182-1190
【発明の開示】
【発明が解決しようとする課題】
【0009】
エロモナス属に属する細菌は、グラム陰性、通性嫌気性、陸性(塩類要求性が低い)、オキシダーゼ陽性で、現在までに 16種知られており、 一部の種は37℃で乳糖を発酵しガス産生する。
【0010】
エロモナス属に属する細菌の一部であるA. caviae、A hydrophila、A. mediaに属する菌株および他の運動性エロモナス属菌株の中には、37℃で乳糖を発酵してガスを産生する細菌が含まれる。また、A. caviae、A. eucrenophila、A hydrophila、A. media、A. sobriaは、クロモカルトコリフォーム培地(Chromocult(R) Coliform Agar;以下CC培地という)で増殖する。他方、エロモナス属に属する細菌には、A.salmonicida subsp. achromogenes, A.salmonicida subsp. salmonicidaのようにCC培地では増殖しないものもあり、同定が十分でない。
【0011】
他方、大腸菌群検査はCC培地などの選択培地を用いて、培養計数されているが、エアロモナス属に属する細菌が混在していると、大腸菌群数の計数値に正確性を欠くことが知られている。実際に、1962年には、LeclercとButtiauxによって、9,036例の飲料水の3割が、エロモナス細菌の混入による誤った大腸菌群陽性と判断されている。
【0012】
また、上記したプローブDによる方法では、エロモナス属に属する細菌は、検出することができなかった。
【0013】
そこで、本発明は、エロモナス属に属する細菌と腸内細菌科に属する細菌が混在する可能性のある試料から、エロモナス菌と腸内細菌科に属する細菌とを区別して、迅速に同定及び又は検出する方法を提供することを課題とする。
【課題を解決するための手段】
【0014】
現在までに、発明者等は、大腸菌群の代替指標として知られている腸内細菌科を迅速に計数する培養併用インサイチュ-ハイブリダイゼーション法を発明してきた。
【0015】
これに加え、エロモナス細菌を迅速に検出する遺伝子プローブの開発も行ってきた。現在の培養同定法により大腸菌群陽性とされた試料中のエロモナス細菌の混入を調べるため、培養併用インサイチュ-ハイブリダイゼーション法を用いて、腸内細菌科細菌とエロモナス属に属する菌を両者とも検出できるように、その条件を種々検討し、両者を迅速に同時検出する方法を開発し、発明を完成させた。
【0016】
更に、本発明者らは、これら両菌の同時検出のための試料の培養及び/又は調製条件も検討し、大腸菌とA. hydrophilaとが混合した試料を供試した時、微小コロニーを形成する培養条件を定めたところ、30℃、6-7時間で、遺伝子プローブで検出可能な微小コロニーに発達することをあきらかにした。
【発明の効果】
【0017】
本発明の方法を用いることにより腸内細菌科細菌とエロモナス属に属する菌を両者とも検出できる。
【発明を実施するための最良の形態】
【0018】
1.培養併用インサイチュ-ハイブリダイゼーション法
1−1.培養併用インサイチュ-ハイブリダイゼーション法の特徴/利点
従来からの蛍光ラベルしたプローブを用いるインサイチュ-ハイブリダイゼーション法では、次のような問題点があった。(1)特に食品を汚染する微生物の同定検出のためには、蛍光標識プローブでは、微生物が増殖した段階、すなわち汚染が相当に進まないと検出できない。(2)食品汚染においては、特に生菌数が問題となるところ、プローブは死菌に対してもハイブリダイズしてしまうので、生菌と死菌との区別がつかなかった。
【0019】
これに対し、培養併用インサイチュ-ハイブリダイゼーション法では、十分に希釈された試料を1〜10時間程度培養することにより、生菌のみを増殖させ、微小なコロニー状とすることにより、通常の蛍光顕微鏡下で、コロニーを観測、計数することができるようになったものである。
【0020】
1−2.培養併用インサイチュ-ハイブリダイゼーション法の工程
(1)メンブレンフィルター上への試料の捕集
食品、環境等から分離された試料がメンブレンフィルター等の試料捕集体上で吸引される。メンブレンフィルターとしては、例えば、ヌクレオポアフィルター、アイソポアフィルター、マイレクスフィルターを用いることができ、好適には、例えば0.2-0.4μmの孔径のアイソポアメンブレンフィルターを用いることができる。
【0021】
(2)試料の培養 マイクロコロニーの形成
試料が付着したメンブレンフィルター等の試料捕集体は、培地の入ったペトリ皿に移される。30-37℃で、マイクロイコロニーが形成さえるまで、例えば、1−10時間、好適には5−7時間、例えば、6時間培養される。
【0022】
(3)FISHおよび細菌数計測
(イ) エタノールなどでスライドグラス又はフィルター上の細胞が固定される。フィルターはスライドガラスに固定される。
(ロ)エタノール浸漬又はオーブン等で乾燥される。
(ハ)ハイブリダイゼーション用バッファーにスライドガラスごとフィルターは浸漬されハイブリダイゼーション温度でインキュベートする。
(ニ)オリゴヌクレオチドプローブが添加され、インキュベーションを継続する。
(ホ)試料の載せられたフィルター又はスライドガラスを洗浄し、空気乾燥される。
(ヘ)蛍光顕微鏡で観察する。通常X10〜X1000で観察できる。
【0023】
1−3.プローブの調製
1−3−1 腸内細菌科細菌検出用プローブは、先に出願した特開2001−136969号に従い、調整した。
具体的には、(1)腸内細菌科は系統的にPasteurellaceae(パスツレラ科)に最も近く、次にVibrionaceae(ビブリオ科)が近いとされているので、腸内細菌科とパスツレラ科並びにビブリオ科に属する菌種の16S rRNA塩基配列を比較し、腸内細菌科に共通で、かつ、後2者のパスツレラ科及びビブリオ科とは異なる塩基配列を検討対象とした。そのため腸内細菌12属29種(β-ガラクトシラーゼ(+)9属19 種、β-ガラクトシラーゼ(−)5属9 種、β-ガラクトシラーゼ(不明)1種)と、パスツレラ科に属する細菌3属6種、ビブリオ科に属する細菌3属8種の16S rDNA塩基配列情報を収集し、これら配列のマルチプルアライメントを行い腸内細菌科細菌だけに共通な約20塩基の塩基配列を検索した。(2)検索により、腸内細菌科細菌に共通な塩基配列とマルチプルアライメントに用いた上記各菌種(腸内細菌科、パスツレラ科及びビブリオ科)の16S rRNAの同領域の塩基配列を比較し、パスツレラ科及びビブリオ科の菌種14菌種に対しては比較的ミスマッチ数が大きく、腸内細菌科細菌29菌種に対しては少ないものを、5’-GAAGCCACGCCTCAAGGGCACAA-3’ (配列番号1:プローブBと呼ぶ) 及び5’-TGCTCTCGCGAGGTCGCTTCTCTT-3’(配列番号2:プローブDと呼ぶ)を腸内細菌科細菌特異的プローブ候補として選択した。(3)上記腸内細菌科細菌プローブ候補を蛍光標識でラベルして用いて腸内細菌科細菌及び非腸内細菌をFISH法によりアッセイした。その結果β-ガラクトシラーゼ陽性陰性を問わず腸内細菌科細菌試料のほとんどから蛍光が検出され、またプローブを加えないFISHでは蛍光が認められなかった。又、特に、プローブDを用いた場合、腸内細菌科に属する77種中75種をインサイチューハイブリダイゼーション法により検出することができ、しかもエロモナス属、バチラス属、ラクトバチルス属、スタフィロコッカス属、フォトバクテリウム属、ビブリオ属、に属する微生物からは蛍光が検出されなかった。(検出された腸内細菌科細菌は、供試菌34株に対しプローブ1は29株(85%)、プローブ2は32株(94%)であった。一方、非腸内細菌とプローブ1及び同2によるFISHを行った結果、いずれもシグナルが検出されなかった。以上から、腸内細菌科細菌検出用プローブ1及び同2は供試腸内細菌科細菌を特異的に検出することが可能であり、その検出率はいずれも高くプローブ1は85%、プローブ2は94%であった。
【0024】
1−3−2 エアロモナス属検出用プローブ
腸内細菌科細菌検出用プローブと同様に設計を行った。
具体的には、(1)エアロモナス属に属する種及び近縁の系統の細菌、具体的には、Alcaligenes, Vibrio, Shewanella, Brenneria, Pseudoalteromonas,および腸内細菌科に属する菌属する菌の16S rRNAの塩基配列を収集し、エアロモナス属に共通である塩基配列であって、しかも近縁の細菌、具体的にはAlcaligenes, Vibrio, Shewanella, Brenneria, Pseudoalteromonas,および腸内細菌科に属する菌とはミスマッチする約20塩基の塩基配列を検索する。(2)検索により、エロモナス属細菌に共通な塩基配列とマルチプルアライメントに用いた上記各菌種の16S rRNAの同領域の塩基配列を比較し、エロモナス属以外の菌種に対しては比較的ミスマッチ数が大きく、エロモナス菌種に対してはミスマッチの少ないものを、エロモナス属細菌特異的プローブ候補として選択した。この操作は、on-line probemer(http://probemer.cs.loyola.edu/)、リボゾームデータベースプロジェクト(http://rdp.cme.msu.edu/index.jsp)で検証することが可能である。結果を表1に示す。
【0025】
【表1】

【0026】
(3)つぎに、実際に、エロモナス属細菌プローブ候補を用いてエロモナス属細菌及び非エロモナス属をFISH法によりアッセイした。その結果エロモナス属細菌試料のほとんどから蛍光が検出され、またプローブを加えないFISHでは蛍光が認められないプローブをエアロモナス属検出用プローブとすることができる。
【0027】
2.腸内細菌科細菌及びエロモナス属細菌とが共存する試料における、培養併用インサイチュ-ハイブリダイゼーション法の確立
2−1.腸内細菌科細菌の培養併用インサイチュ-ハイブリダイゼーション法による検出の検討
上記1−3−1で選択された腸内細菌科細菌同定用プローブを用いて、腸内細菌科細菌の培養併用インサイチュ-ハイブリダイゼーション法による同定条件を検討した。
【0028】
2−1−1 培養条件の検討
通常の蛍光顕微鏡用いた、16SrRNAに対する蛍光標識プローブによる観察では、細菌1細胞を検出することは困難である。そこで、100倍率の蛍光顕微鏡で観察可能な程度の100細胞に増加する程度培養することとした。例えば、Tryptic Soya Agar培地で37℃で培養する場合、約6時間培養し、微小コロニーを形成させることができる。
【0029】
2−1−2 ハイブリダイゼーション条件の検討
細胞の固定化:通常のFISHでは、パラホルムアルデヒドを用いて固定化を行うが、培養併用インサイチュ-ハイブリダイゼーション法では、エタノールを用いることにより、約5分間で固定化することができる。パラホルムアルデヒドを使用した場合は、パラホルムアルデヒドの除去及び蛍光強度の最大化のためには固定化後の洗浄が必要であるが、エタノールでは不要である。
【0030】
腸内細菌科細菌を、ハイブリダイゼーション温度を45℃から65℃に変化させて、その同定性の検討を行う。例えば、プローブDの場合、腸内細菌科で、プローブDに対応する領域では、ミスマッチが一番多い種は、Serratia rubidaの4塩基であることから、Serratia rubidaeとの比較で、ホルムアミド20%の条件では、60℃でハイブリダイズさせることにより、同定性が高まることを見いだした。又、ハイブリダイゼーションは、DNAプローブを用いる場合は、5分程度でも良い。
【0031】
2−2.腸内細菌科細菌の培養併用インサイチュ-ハイブリダイゼーション法による検出における、エロモナス属菌の同時検出の検討
2−2−1.同時検出用のプローブの選定
腸内細菌科の培養併用インサイチュ-ハイブリダイゼーション法におけるハイブリダイゼーション下で、同時にエロモナス属細菌を検出できるようなプローブ、言い換えれば、腸内細菌科用のプローブが特異性を有するハイブリダイゼーション条件とエロモナス属細菌用のプローブが特異性を有するハイブリダイゼーション条件が重複するようなプローブを選定する。ハイブリダイゼーション条件は、反応液の温度、塩濃度やホルムアミド濃度にも影響を受ける。具体的には、例えば、腸内細菌科細菌の検出にプローブDを用いる場合、ハイブリダイゼーション条件としては、ホルムアミド20%、温度60℃を採用されるが、かかるハイブリダイゼーション条件で特異性の高いエロモナス属菌特異的プローブを選択する。具体的には、AER66(CTACTTTCCCGCTGCCGC:配列番号3)を用いることができる。
【0032】
なお、ハイブリダイゼーション条件の比較は、ハイブリダイゼーション固有特異条件値を比較し、該ハイブリダイゼーション固有特異性条件値が近似する1組の腸内細菌科用のプローブ及びエロモナス属細菌用のプローブを選択することもできる。
【0033】
ここで、ハイブリダイゼーション固有特異性条件値は、当該プローブがハイブリダイゼーションを起こす場合、ハイブリダイゼーション温度及びホルムアミド濃度(%)を用いて次の通り定義される。(ハイブリダイゼーションバッファーとしては、ホルムアミド以外は、同じ組成のものを用い、例えば、ホルムアミド以外の組成が0.9M NaCl、20mM Tris-HCl、0.01% SDS(pH7.4)からなるハイブリダイゼーション溶液を挙げることができる。)
【0034】
[数1]
ハイブリダイズ固有特異性条件値(K)(℃)=ハイブリダイゼーション温度(℃)+ 0.7(℃)Xホルムアミド濃度(%)
【0035】
2−2−2 培養条件の検討
腸内細菌科細菌と、エロモナス属に属する細菌とを共培養し、その後FISHで同定した。
共培養条件として、温度及び時間を変化させた。そして、共培養後、微小コロニーの大きさを測定し、培養併用インサイチュ-ハイブリダイゼーション法に適した、培養条件を決定した。
【0036】
3.エロモナス属細菌と腸内細菌科細菌が含まれている可能性のある試料を同時に同定及び又は計測する方法及びそのためのキット。
(試料の調製)
食品試料の場合、試料を0.8%NaCl溶液でブレンダーでホモジェナイズして検査試料を調製する。
【0037】
(プローブの調製)
腸内細菌科特異的プローブ及びエロモナス属細菌特異的プローブを、それぞれ異なる蛍光波長の蛍光標識である第1の蛍光標識又は第2の蛍光標識で標識する。例えば、腸内細菌科特異的プローブとしては前記プローブDを、エロモナス属細菌特異的プローブとしては、前記AER66を、それぞれ、TAMRA又はFITCで標識することができる。
【0038】
(FISH前培養)
ホモジェナイズした試料は、0.2-0.4μmの特異反応の対象となる細菌を通過させない孔径のメンブレンフィルター、好適には0.4μmの孔径のメンブレンフィルター(Isopore ミリポア社)等の試料捕集体上に真空吸引される。フィルターは適切な培地、含むペトリ皿に移され、2〜8時間、25〜37℃で培養される。培地としては、腸内細菌科細菌及びエロモナス属細菌が同様に増殖する培地を採用することができる。具体的には、例えば、ブイヨン培地、tryptic soya agar(Difco)培地(トリプシン処理大豆カゼイン寒天培地)、普通栄養寒天培地、ブレインハートインフュージョン培地等を挙げることができる。
【0039】
(FISH)
培養されたフィルター等試料捕集体上の細菌を固定する。好適には、室温で、エタノールで固定する。その後フィルターは、透過性のフィルター固定支持体に載せられる。計測を蛍光顕微鏡で行う場合には、固定支持体としては、スライドガラスを用いることができるが、他の蛍光測定装置により計測する場合には、当該蛍光測定装置に取り付けでき計測可能な支持体であれば、いかなる固定支持体も用いることができる。支持体に固定されたフィルターは乾燥される。好適には、80℃、10分間乾燥機で乾燥させる。
【0040】
乾燥されたスライドグラス等の固定支持体に、ハイブリダイゼーションバッファーが与えられる。ハイブリダイゼーションバッファーとしては、例えば、0.9M NaCl、20%ホルムアミド、20mM Tris-HCl、0.01% SDS(pH7.4)からなるハイブリダイゼーション溶液を挙げることができる。ハイブリダイゼーションバッファーで1-5分間のプレインキュベーション後、第1の蛍光標識で標識された腸内細菌科特異的プローブ及び第2の蛍光標識で標識されたエロモナス属細菌特異的プローブを添加する。プローブとのハイブリダイゼーションは、5分−1時間行うことができる。ハイブリダイゼーション後、フィルターの乗せられた固定支持体は、緩衝液で洗浄される。洗浄用の緩衝液としては、例えば、20mM Tris-HCl、180mM NaCl, 0.01%SDS (pH7.4)を含む洗浄液を用いることができる。緩衝液での洗浄後、蒸留水で洗浄する。
【0041】
ハイブリダイゼーション及び洗浄は、前記標識プローブD及び標識AER66を用いた場合には、ハイブリダイゼーションを60℃で、5分−1時間行い、洗浄を60℃で20分行うことができる。
【0042】
洗浄後、乾燥し、液浸し、2波長の励起波長を用いる蛍光を用いる蛍光顕微鏡などの蛍光を観測又は測定する装置を用い、微小コロニーを観測、計数することができる。
【0043】
(キット)
腸内細菌科細菌及びエロモナス属細菌を培養併用インサイチュ-ハイブリダイゼーション法により区別して同定及び/又は計数するための試薬等をキットとすることができる。具体的には、第1の蛍光標識した腸内細菌科細菌特異的プローブ及び第2の蛍光標識をしたエロモナス属に属する細菌に特異的なプローブを含むキット、より具体的には、第1の蛍光標識された配列番号2で表されるDNAからなるプローブ及び第2の蛍光標識された配列番号3で表されるDNAからなるプローブを含むキットが挙げられる。これらキットには、更に、反応液(ハイブリダイゼーションバッファー)、洗浄液(緩衝液)、メンブレンフィルター、又は培地のいずれか又は、その組み合わせを含ませることができる。反応液、洗浄液、及び培地は、前記したものを用いることができる。
【0044】
以下に、本件発明の実施例を記載するが、本件発明が、下記実施例に限定されるものではない。
【実施例1】
【0045】
腸内細菌科細菌特異的プローブDと併用可能なエロモナス属特異的プローブの選択及び検証
腸内細菌科細菌プローブDは、ホルムアミド濃度が20%の反応液を用い、60℃で反応させることにより、特異性の高い結果が得られる。この反応条件で特異性の高いエロモナスプローブを検討した。
【0046】
エロモナスプローブの特異性評価は次のように行った。
1) Aeromonas hydrophilaおよびエロモナス属菌と近縁の細菌(表2―4)をブイヨン培地およびTryptic Soya Broth (Difco)でそれぞれ一晩前培養(30℃および37℃)した細胞を遠心分離で集菌し、この菌体に4%パラホルムアルデヒド‐リン酸緩衝液(PBS)を300μl加え、4℃で1-3時間固定した。
2) この固定した細菌細胞の3マイクロリッターをスライドグラス上に載せ、風乾後、50,80および100%エタノールに順次3分間浸漬することで脱水を行った。
3) スライドグラス上の固定した細菌細胞上へあらかじめ60℃に加温しておいたハイブリダイゼーション溶液(0.9M NaCl, 20mM Tris-HCl, 0.01% SDS, pH 7.4を8マイクロリッターを注加し,60℃で5分間プレハイブリダイゼーションを行った後,5pmol/マイクロリッターのプローブを1マイクロリッター加え、60℃で60分間ハイブリダイゼーションを行った。
4) ハイブリダイゼーション後、スライドグラスをあらかじめ60℃で加温した洗浄液(20mM Tris-HCl, 40-220mM NaCl, 0.01% SDS, pH7.4)に20分間浸漬した後、滅菌蒸留水で残留する洗浄液を洗い流した。
5) スライドグラスを風乾後、ガラス上の細菌細胞を蛍光顕微鏡で観察し、細菌細胞の蛍光具合から両プローブの特異性を判定した。
結果を表2―4に示す。
【0047】
表2に示されるようにAER-mrfプローブは、ホルムアミド濃度が27.5%以上、45%以下の反応液を用い、60℃で反応させることにより、高い特異性を示した。
【0048】
表3に示されるようにAER-mrrプローブは、ホルムアミド濃度が27.5%以上、45%以下の反応液を用い、60℃で反応させること、又はホルムアミド濃度が45%の反応液を用いて、46℃反応させることにより、P.phosphoreum以外とは高い特異性を示した。
【0049】
表4に示されるように、AER66プローブは、ホルムアミド濃度が20%以上、35%以下の反応液を用い、60℃で反応させることにより、高い特異性を示した。
以上から、腸内細菌科細菌特異的プローブDと併用可能なエロモナス属特異的プローブとして、AER66が選択できることがわかった。なお、表2-4中で、温度は、Temp、ホルムアミド濃度%は、FA(%)と記載され、ている。
【0050】
【表2】

【0051】
【表3】

【0052】
【表4】

【実施例2】
【0053】
大腸菌とA. hydrophila固定細胞混在試料に対する腸内細菌特異的プローブDおよびエロモナス属特異的プローブAER66の特異反応性の検証
1)大腸菌とA. hydrophilaの固定菌体を混合した試料をスライドグラス上に載せ、風乾後、50,80および100%エタノールに順次3分間浸漬することで脱水を行った。
2) スライドグラス上の固定した細菌細胞上へあらかじめ60℃に加温しておいたハイブリダイゼーション溶液(0.9M NaCl, 20mM Tris-HCl, 0.01% SDS, pH 7.4)を8マイクロリッターを注加し、60℃で5分間プレハイブリダイゼーションを行った後,プローブDおよびAER66がそれぞれ5pmol/マイクロリッター混合したプローブ溶液を1マイクロリッター加え、60℃で60分間ハイブリダイゼーションを行った。
3) ハイブリダイゼーション後、スライドグラスをあらかじめ60℃で加温した洗浄液(20mM Tris-HCl, 40-220mM NaCl, 0.01% SDS, pH7.4)に20分間浸漬した後、滅菌蒸留水で残留する洗浄液を洗い流した。
4) スライドグラスを風乾後、ガラス上の細菌細胞を蛍光顕微鏡で観察し、細菌細胞の蛍光具合から両プローブの特異性を判定した。
【0054】
又、大腸菌とA. hydrophilaが混在する試料を、0.4μm孔径のヌクレオポアフィルターに捕集し、そのフィルターをTryptic Soy agar上で、30℃で、6時間培養して微小集落を形成させた。この微小集落に対し、エロモナス特異プローブAER66および腸内細菌特異プローブDを混合し、20%ホルムアミドを含むハイブリダイゼーション溶液を用い、60℃の条件でFISH反応を行った。
【0055】
ホルムアミド濃度が20%の反応液を用い、60℃で反応させることにより、A. hydrophilaはAER66プローブと大腸菌はプローブDと高い特異性を示して反応し、それぞれのプローブの蛍光色が明確に区別できた。大腸菌は赤色蛍光を、A. hydrophilaは緑色蛍光を放ち、区別できた。結果を図1に示す。
【実施例3】
【0056】
培養併用インサイチューハイブリダイゼーション法で大腸菌とエロモナスの微小集落を検出する至適培養条件の設定
1) 大腸菌とA. hydrophilaを供試し、0.4μm孔径のヌクレオポアフィルターにそれぞれ捕集した。
2) そのフィルターをTryptic Soya agar(Difco)上で、25℃、30℃又は37℃で、それぞれ2、4、6及び8時間培養し、それぞれの細菌の微小集落を形成させた。
3) 培養後、エタノールでコロニーを固定し、エロモナス特異プローブAER66あるいは腸内細菌特異プローブDをそれぞれ含む、20%ホルムアミドを混合したハイブリダイゼーション溶液を用い、60℃の条件でFISH反応を行った。
4)その後、蛍光顕微鏡で、微小コロニーの形成状況を、微少集落の直径を測定及び、計測することにより調べた。結果を図2に示す。
【0057】
微小コロニーを形成する培養条件としては、30℃、6-7時間で、遺伝子プローブで検出可能な微小コロニーに発達することがあきらかになった。又、この条件で、大腸菌とA. hydrophilaの微小コロニーの直径が同程度の大きさ(50-100μm)に形成された。
【産業上の利用可能性】
【0058】
本願発明は、食中毒細菌の検査及び/又は環境試料の衛生検査に用いることができる。
【図面の簡単な説明】
【0059】
【図1】大腸菌とエロモナスの同時検出 *E. coliおよびA. hydrophilaを30℃、6時間培養後、TAMRA標識probeDとFITC標識AER66を用いて60℃、フォルムアミド20%反応液で反応させ、洗浄後、蛍光顕微鏡で観察した。
【図2】培養併用FISH法で検出できる微小集落が形成される至適温度と時間
【特許請求の範囲】
【請求項1】
腸内細菌科細菌及びエアロモナス属に属する細菌を培養し微小コロニーを形成させ、第1の蛍光標識した腸内細菌科細菌特異的プローブ及び第2の蛍光標識をしたエロモナス属に属する細菌に特異的なプローブを用いて、インサイチュ‐ハイブリダイゼーション法により、腸内細菌科細菌及びエロモナス属に属する細菌を同時に検出及び又は計数する方法。
【請求項2】
前記腸内細菌科細菌特異的プローブ及びエロモナス属に属する細菌に特異的なプローブは、ハイブリダイゼーション条件が重なるプローブである請求項1記載の方法。
【請求項3】
前記腸内細菌科細菌特異的プローブ及びエロモナス属に属する細菌に特異的なプローブがそれぞれ、第1の蛍光標識された配列番号2で表されるDNA又はその相補的DNAからなるプローブ及び第2の蛍光標識された配列番号3で表されるDNA又はその相補的DNAからなるプローブである請求項2記載の方法。
【請求項4】
第1の蛍光標識で標識される微小コロニー及び第2の蛍光標識で標識される微小コロニーを計数することにより、それぞれ、腸内細菌科細菌及びエロモナス属に属する細菌を同時に計数する請求項1〜3いずれか記載の方法。
【請求項5】
第1の蛍光標識と第2の蛍光標識が異なる波長の蛍光を発する請求項1記載の方法。
【請求項6】
第1の蛍光標識と第2の蛍光標識が、TAMRA又はFITCである請求項1記載の方法。
【請求項7】
前記培養を腸内細菌科細菌及びエロモナス属細菌が同様に増殖する培地で4時間から8時間行う請求項1記載の方法。
【請求項8】
第1の蛍光標識した腸内細菌科細菌特異的プローブ及び第2の蛍光標識をしたエロモナス属に属する細菌に特異的なプローブを含む、腸内細菌科細菌及びエロモナス属に属する細菌を同時に検出及び又は計数するためのキット。
【請求項1】
腸内細菌科細菌及びエアロモナス属に属する細菌を培養し微小コロニーを形成させ、第1の蛍光標識した腸内細菌科細菌特異的プローブ及び第2の蛍光標識をしたエロモナス属に属する細菌に特異的なプローブを用いて、インサイチュ‐ハイブリダイゼーション法により、腸内細菌科細菌及びエロモナス属に属する細菌を同時に検出及び又は計数する方法。
【請求項2】
前記腸内細菌科細菌特異的プローブ及びエロモナス属に属する細菌に特異的なプローブは、ハイブリダイゼーション条件が重なるプローブである請求項1記載の方法。
【請求項3】
前記腸内細菌科細菌特異的プローブ及びエロモナス属に属する細菌に特異的なプローブがそれぞれ、第1の蛍光標識された配列番号2で表されるDNA又はその相補的DNAからなるプローブ及び第2の蛍光標識された配列番号3で表されるDNA又はその相補的DNAからなるプローブである請求項2記載の方法。
【請求項4】
第1の蛍光標識で標識される微小コロニー及び第2の蛍光標識で標識される微小コロニーを計数することにより、それぞれ、腸内細菌科細菌及びエロモナス属に属する細菌を同時に計数する請求項1〜3いずれか記載の方法。
【請求項5】
第1の蛍光標識と第2の蛍光標識が異なる波長の蛍光を発する請求項1記載の方法。
【請求項6】
第1の蛍光標識と第2の蛍光標識が、TAMRA又はFITCである請求項1記載の方法。
【請求項7】
前記培養を腸内細菌科細菌及びエロモナス属細菌が同様に増殖する培地で4時間から8時間行う請求項1記載の方法。
【請求項8】
第1の蛍光標識した腸内細菌科細菌特異的プローブ及び第2の蛍光標識をしたエロモナス属に属する細菌に特異的なプローブを含む、腸内細菌科細菌及びエロモナス属に属する細菌を同時に検出及び又は計数するためのキット。
【図1】


【図2】




【図2】


【公開番号】特開2006−141300(P2006−141300A)
【公開日】平成18年6月8日(2006.6.8)
【国際特許分類】
【出願番号】特願2004−336593(P2004−336593)
【出願日】平成16年11月19日(2004.11.19)
【出願人】(504173471)国立大学法人 北海道大学 (971)
【出願人】(000173511)財団法人函館地域産業振興財団 (32)
【Fターム(参考)】
【公開日】平成18年6月8日(2006.6.8)
【国際特許分類】
【出願日】平成16年11月19日(2004.11.19)
【出願人】(504173471)国立大学法人 北海道大学 (971)
【出願人】(000173511)財団法人函館地域産業振興財団 (32)
【Fターム(参考)】
[ Back to top ]

