膜タンパク質機能測定システムおよび膜タンパク質機能測定方法
【課題】微小孔上に展開した脂質二分子膜中に膜タンパク質を再構成することにより、該脂質二分子膜の伸展による膜タンパク質の活性化、および伸展による脂質二分子膜中の受容体の密度変化と活性の関係を測定できる膜タンパク質機能測定システム、ならびに膜タンパク質機能測定方法の提供を目的とする。
【解決手段】穴部11を有する基板本体12の、穴部11の開口11aが膜タンパク質13を含む脂質二分子膜14に覆われており、脂質二分子膜14上に緩衝液15が配置された膜タンパク質機能測定用基板10Aと、脂質二分子膜14を伸展する伸展手段20と、を具備する膜タンパク質機能測定システム1。また、膜タンパク質機能測定システム1を用いた膜タンパク質機能測定方法。
【解決手段】穴部11を有する基板本体12の、穴部11の開口11aが膜タンパク質13を含む脂質二分子膜14に覆われており、脂質二分子膜14上に緩衝液15が配置された膜タンパク質機能測定用基板10Aと、脂質二分子膜14を伸展する伸展手段20と、を具備する膜タンパク質機能測定システム1。また、膜タンパク質機能測定システム1を用いた膜タンパク質機能測定方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、膜タンパク質機能測定システムおよび膜タンパク質機能測定方法に関する。
【背景技術】
【0002】
タンパク質をはじめとする生体分子の機能を理解する上で、その構造を知ることは不可欠である。生体分子が機能する際には、外界(細胞外)からの刺激に伴いその構造を変化させことでその機能を発揮する。
【0003】
タンパク質、脂質、核酸などの生体分子の構造を生体内に近い条件で観察できる手法としては、水溶液中で観察が可能な走査プローブ顕微鏡、特に原子間力顕微鏡(AFM)を用いる方法が広く用いられている。近年、AFMの技術は非常に進歩しており、生体分子の構造解析、および溶液中に添加した低分子化合物やペプチドの結合による生体分子の動的な構造変化の観察への更なる貢献が期待されている。
AFMを用いた測定装置及び測定方法としては、例えば、溶液中において分子レベルまたは原子レベルの分解能が達成された測定装置および測定方法(非特許文献1)や、ビデオレートでの観察を可能とする測定装置(非特許文献2)が挙げられる。
【0004】
生体分子が外界から受ける刺激としては、一部の膜タンパク質では細胞膜の伸展が挙げられる。該膜タンパク質では、細胞膜の伸展によっても活性化され、リン酸化や、カルシウムイオンの透過などの生理活性を示すことが知られている(非特許文献3〜5)。これらの膜タンパク質以外にも、細胞膜の伸展によって活性化するタンパク質が存在する可能性がある。
また、一部の受容体に関しては、受容体密度と活性に相関があることが知られており(非特許文献6)。そのため、近傍の受容体同士の距離と、その機能との関係を詳細に分析し、その関係を明らかにすることも重要である。
しかし、細胞膜の伸展や、受容体同士の距離の変化によるタンパク質の活性化を詳細に評価する測定システムはなく、細胞膜の伸展により活性化する新たなタンパク質を探索することも、受容体同士の距離とその機能の関係を詳細に分析することも困難である。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】T. Fukuma, M. J. Higgins, S. P. Jarvis, Direct imaging of lipid-ion network formation under physiological conditions by frequency modulation atomic force microscopy. Phys. Rev. Lett. 98 (2007) 10601-10603.
【非特許文献2】T. Ando, N. Kodera, E. Takai, D. Maruyama, K. Saito, A. Toda, A high-speed atomic force microscope for stdying biological macromolecules. Proc. Natl. Acad. Sci. USA. 98 (2001) 12468-12472.
【非特許文献3】A. Kloda, L. Kua, R. Hall, D. J. Adams, B. Martinac, Liposome reconstitution and modulation of recombinant N-methyl-D-aspartate receptor channels by membrane stretch, Proc. Natl. Acad. Sci. USA. 104 (2007) 1540-1545.
【非特許文献4】Y. Sawada, M. Tamada, B. J. Dubin-Thaler, O. Cherniavskaya, R. Sakai, S. Tanaka, M. P. Sheetz, Force sensing by mechanical extension of the Src family kinase substrate p130Cas, Cell 127 (2006) 1015-1026.
【非特許文献5】K. Yamamoto, T. Sokabe, T. Matsumoto, K. Yoshimura, M. Shibata, N. Ohura, T. Fukuda, T. Sato, K. Sekine, S. Kato, M. Isshiki, T. Fujita, M. Kobayashi, K. Kawamura, H. Masuda, A. Kamiya, J. Ando, Impaired flow-dependent control of vascular tone and remodeling in P2X4-deficient mice, Nat Med. 12 (2006) 133-137.
【非特許文献6】Y. Fujiwara, Y. Kubo, Density dependent changes of the pore properties of P2X2 receptor channel, J. Physiol. 558 (2004) 31-43.
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、微小孔上に展開した脂質二分子膜中に膜タンパク質を再構成した、該脂質二分子膜の伸展による膜タンパク質の活性化、および伸展による脂質二分子膜中の受容体の密度変化と活性の関係を測定できる膜タンパク質機能測定システム、ならびに膜タンパク質機能測定方法の提供を目的とする。
【課題を解決するための手段】
【0007】
本発明は、前記課題を解決するために以下の構成を採用した。
[1]穴部を有する基板本体の、該穴部の開口が膜タンパク質を含む脂質二分子膜に覆われており、該脂質二分子膜上に緩衝液が配置された膜タンパク質機能測定用基板と、前記脂質二分子膜を伸展する伸展手段と、を具備する膜タンパク質機能測定システム。
[2]前記伸展手段が走査プローブ顕微鏡の深針である、前記[1]に記載の膜タンパク質機能測定システム。
[3]更に、前記脂質二分子膜の表面構造を観察する観察手段を具備する、前記[1]または[2]に記載の膜タンパク質機能測定システム。
[4]更に、前記基板における前記穴部の外部に設けられた第1の電極と、前記穴部の内部に設けられた第2の電極とを具備する、前記[1]〜[3]のいずれかに記載の膜タンパク質機能測定システム。
[5]前記[1]〜[3]のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、前記膜タンパク質がイオンチャネル型膜タンパク質であり、前記穴部の内部に、膜タンパク質を透過するイオンに結合して蛍光を発するイオン感受性蛍光色素が配置され、かつ前記脂質二分子膜上に、膜タンパク質を透過するイオンを含む緩衝液が配置されており、前記伸展手段により前記脂質二分子膜を伸展して、前記イオンチャネル型膜タンパク質のイオンの透過を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
[6]前記[1]〜[3]のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、前記膜タンパク質がイオンチャネル型膜タンパク質であり、前記穴部の内部に、核酸が配置され、かつ前記脂質二分子膜上に、核酸に結合して蛍光が増強する核酸結合性蛍光色素を含む緩衝液が配置されており、前記伸展手段により前記脂質二分子膜を伸展して、前記イオンチャネル型膜タンパク質の前記核酸結合性蛍光色素の透過を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
[7]前記[1]〜[3]のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、前記膜タンパク質がイオンチャネル型膜タンパク質であり、前記穴部の内部に、蛍光標識した細胞外情報伝達物質が配置されており、前記伸展手段により前記脂質二分子膜を伸展して、前記細胞外情報伝達物質の前記穴部の内部から外部への前記イオンチャネル型膜タンパク質を介した移動を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
[8]前記[1]〜[3]のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、前記膜タンパク質が代謝型膜タンパク質であり、前記穴部の内部に、細胞質抽出画分、および膜タンパク質を透過するカルシウムイオンに結合して蛍光を発するカルシウムイオン感受性蛍光色素が配置されており、前記伸展手段により前記脂質二分子膜を伸展して、細胞内シグナル伝達系を介した小胞体からのカルシウムイオンの放出を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
[9]前記[4]に記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、前記膜タンパク質がイオンチャネル型膜タンパク質であり、前記脂質二分子膜上に、膜タンパク質を透過するイオンを含む緩衝液が配置されており、前記伸展手段により前記脂質二分子膜を伸展して、前記第1の電極および第2の電極の間を流れる電流を測定して、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【発明の効果】
【0008】
本発明の膜タンパク質機能測定システムおよび膜タンパク質機能測定方法によれば、脂質二分子膜の伸展による膜タンパク質の活性化、および伸展による脂質二分子膜中の受容体の密度変化と活性の関係を測定できる。
【図面の簡単な説明】
【0009】
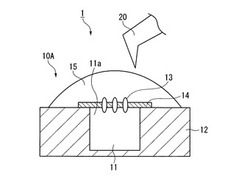
【図1】本発明の膜タンパク質機能測定システムの実施形態の一例を示した概略断面図である。
【図2】本発明の膜タンパク質機能測定システムの他の実施形態例を示した概略断面図である。
【図3】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図4】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図5】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図6】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図7】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図8】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図9】実験例1における基板の共焦点蛍光顕微鏡を用いた蛍光像である。
【図10】実験例2における基板のAFM像である。
【図11】実施例1における基板のAFM像(a)、AFM像(a)中の破線部における脂質二分子膜の高さ情報を示したグラフ(b)、およびAFM像(a)の拡大図(c)である。
【図12】実施例1における穴部を有する基板のAFM像(a)、AFM像(a)中の破線部における脂質二分子膜の高さ情報を示したグラフ(b)、およびAFM像(a)の拡大図(c)である。
【図13】実施例2における蛍光強度の変化を示したグラフ(a)および基板の共焦点蛍光顕微鏡を用いた蛍光像(b)、ならびに実施例3における電流値の変化を示したグラフ(c)である。
【発明を実施するための形態】
【0010】
<膜タンパク質機能測定システム>
本発明の膜タンパク質機能測定システム1(以下、「システム1」という。)は、図1に示すように、膜タンパク質機能測定用基板10A(以下、「基板10A」という。)と、伸展手段20と、を具備する。
基板10Aは、穴部11を有する基板本体12と、穴部11の開口11aを覆う、膜タンパク質13を含む脂質二分子膜14と、脂質二分子膜14上に配置された緩衝液15とを有する。伸展手段20は、脂質二分子膜14を伸展する手段である。
【0011】
基板10Aは、脂質二分子膜14を伸展することによって活性化する膜タンパク質13の構造変化、脂質二分子膜14における局在の観測、蛍光強度の変化の測定による膜タンパク質13の機能測定のための基板である。
基板10Aでは、穴部11を覆う脂質二分子膜14上に緩衝液15が配置され、穴部11の外部と穴部11の内部が脂質二分子膜14によって区切られている。
【0012】
基板本体12の表面は、平坦であることが好ましい。
基板本体12の材質は、表面を平坦に加工できる材質が好ましく、例えば、マイカ、ガラス、シリコンなどが挙げられる。
基板本体12の形状は特に限定されず、用途に応じた形状のものを使用することができ、例えば、平板状の基板が挙げられる。
基板本体12の厚みは特に限定されず、0.1mm〜2mmが好ましい。
【0013】
基板本体12は、穴部11を有する。
基板本体12における穴部11の数は特に限定されず、1〜10,000個が好ましい。
穴部11の形状は、開口11aに脂質二分子膜14を安定に配置でき、必要に応じて蛍光顕微鏡による穴部11の蛍光像の取得、AFMによる表面構造の観察等が可能な形状であればよい。穴部11の形状としては、例えば、円筒状が挙げられる。
穴部11は、凹状の穴であってもよく、貫通孔であってもよい。この例では、穴部11は凹状の穴である。
【0014】
開口11aの直径は、10nm〜10μmが好ましい。開口11aの直径が10nm以上であれば、AFMにより表面構造の観察等が容易になり、また膜タンパク質13の機能測定が容易になる。開口11aの直径が10μm以下であれば、脂質二分子膜14をより安定に形成できる。
また、穴部11の深さは、基板本体12の厚みに応じて設定すればよく、50nm〜2mmが好ましい。
【0015】
基板本体12に穴部11を形成する方法としては、例えば、フォトリソグラフィ法、ドライエッチング法等の微細加工技術が適用できる。また、プラスチックの基板本体12であれば、加熱した注射針を刺すことにより形成してもよい。
【0016】
膜タンパク質13は、イオンチャネル型膜タンパク質もしくは代謝型膜タンパク質などが挙げられる。
イオンチャネル型膜タンパク質としては、例えばイオンチャネル型受容体が挙げられ、TRP(Transient Receptor Potential)チャネル(サブユニットはTRPV1〜TRPV6、TRPA1、TRPC1〜TRPC7、TRPM1〜TRPM8、TRPML1〜TRPML3、TRPP1〜TRPP5)、ATP受容体(サブユニットはP2X1〜P2X7)、セトロニン受容体(サブユニットは5−HT3)、NMDA受容体(サブユニットはNR1、NR2A〜NR2D、NR3A、NR3B)、AMPA受容体(サブユニットはGluR1〜GluR4)、カイニン酸受容体(サブユニットはGluR5〜GluR7、KA−1、KA−2)、GABA受容体(サブユニットはα、β、γ)もしくはGABA受容体(サブタイプはGABAA、GABAC)などが挙げられる。
代謝型膜タンパク質としては、例えばGタンパク共役型受容体が挙げられ、アデノシン受容体(A1、A2A、A2B、A3)、ATP受容体(P2Y1、P2Y2、P2Y4、P2Y6、P2Y11、P2Y12、P2Y13、P2Y14)、セロトニン受容体(サブユニットは5−HT1、5−HT2、5−HT4、5−HT6、5−HT7)、代謝型グルタミン酸受容体(mGluR1〜mGluR3、mGluR5〜mGluR8)、アドレナリン受容体(α、β)、プロテアーゼ活性化受容体(PAR−1〜PAR−4)、ブラジキニン受容体(B1、B2)、GABAB受容体、オピオイド受容体(ν受容体、δ受容体、κ受容体)などが挙げられる。
これら受容体は1種のみを使用してもよく、2種以上を併用してもよい。
【0017】
脂質二分子膜14に膜タンパク質13を再構成する方法は、公知の方法を用いることができ、例えば、ベシクルフュージョン法が挙げられる。
【0018】
脂質二分子膜14は、両親媒性分子であるリン脂質などの脂質分子が二層構造を形成した膜であり、生体膜の最も基本的な構造である。脂質分子は、疎水性部分と親水性部分を有し、疎水性部分同士が会合することにより安定な二分子膜構造を形成する。
脂質分子としては、常温で充分な流動性を持つものであればよく、各脂質の疎水部のアルキル鎖長、二重結合の部位と数は特に限定されない。
脂質分子としては、例えば、卵黄由来フォスファチジルコリン(egg−yolk PC)、ホスファチジルコリン(PC)、ホスファチジルエタノールアミン(PE)、ホスファチジルセリン(PS)、ホスファチジルイノシトール(PI)、ホスファチジルイノシトールホスフェイト(PIP)、ホスファチジン酸(PA)、ホスファチジルグリセロール(PG)、スフィンゴ脂質などが挙げられる。
これら脂質分子は、1種類のみを用いてもよく、2種類以上を用いてもよい。
【0019】
脂質二分子膜14の形成方法としては、例えば、n−デカンなどの有機溶媒に溶解した脂質分子を用いる方法が挙げられる。まず、穴部11に水溶液を配置し、その上部にn−デカンに溶解した脂質分子を配置する。これにより、n−デカン中の脂質分子の親水部がn−デカンと穴部11との界面に次第に集まり、均一な層を形成する。次いで、穴部11のn−デカン上に緩衝液などの水溶液を配置する。これにより、n−デカンと、該n−デカンの上側(外部側)の水溶液との界面にも脂質分子の親水部が次第に集中してくる。n−デカンは室温で揮発するため、最終的に穴部11の開口11aを覆う均一な脂質二分子膜14が形成される。
【0020】
緩衝液15は、充分な蛍光が検出でき、膜タンパク質13の機能を阻害しないものであればよく、例えば、Tris−HClなどが挙げられる。
緩衝液15の量は、脂質二分子膜14を充分に覆う量であればよい。
【0021】
伸展手段20としては、脂質二分子膜14に押し付けて部分的に機械的刺激を与え、脂質二分子膜14を伸展できるものであればよく、AFMなどの走査プローブ顕微鏡の深針が好ましい。
【0022】
また、システム1は、脂質二分子膜14の表面構造を観察する観察手段を具備することが好ましい。
観察手段としては、例えば、AFMが挙げられる。また、膜タンパク質13や脂質二分子膜14を蛍光標識している場合であれば、共焦点レーザースキャン顕微鏡を用いることもできる。
【0023】
また、穴部11の開口11aが大きすぎることで、伸展しなくても脂質二分子膜14が撓んで脂質二分子膜上の構造観察が困難となる場合は、穴部11の開口11aを覆うように網目構造体を形成し、該網目構造体上に脂質二分子膜14を形成するようにしてもよい。
網目構造体はナノ線状体からなる構造体であり、具体的には、ナノ線状体が多数の分岐を有して、網目を形成したものである。
ナノ線状体としては、例えば、ナノチューブ、ナノワイヤー、ナノファイバなどが挙げられ、その材質は特に制限はないが、ナノ線状体を容易に形成できる点では、カーボンが好ましい。
ここで、ナノ線状体とは、長さ方向に垂直な断面の直径が1〜20nmの線状体のことである。ナノ線状体の長さ方向に垂直な断面の直径が前記下限以上であれば、脂質二分子膜を充分に支持することができる。また、前記上限以下であれば、穴部11の上に網目構造体が配置されても、観察目的の生体試料のAFM観察に支障をきたさない。
ナノ線状体としてカーボンナノチューブを用いる場合、その直径を前記範囲にするためには、後述する網目構造体の形成方法において、使用する金属触媒の種類、粒子径および密度や、形成時の温度を適宜選択すればよい。例えば、触媒の粒子径を大きくする程、直径は大きくなる。
【0024】
網目構造体の形成方法としては、例えば、化学気相成長法(CVD法)により形成する方法などが挙げられる。化学気相成長法を適用した場合の炭素源としては、例えば、メタン、エタン、アセチレン、メタノール、エタノールなどが挙げられる。
また、化学気相成長法により網目構造体を形成する場合には、ナノ線状体を容易に形成できることから、鉄などの金属触媒を用いることが好ましい。また、基板本体12の表面にナノ線状体を形成するためには、金属触媒を基板本体12の表面にあらかじめ付着させておくことが好ましい。
【0025】
また、本発明の膜タンパク質機能測定システムの他の実施形態を図2に示す。
膜タンパク質機能測定システム2(以下、「システム2」という。)は、図2に示すように、膜タンパク質機能測定用基板10B(以下、「基板10B」という。)と、伸展手段20と、を具備する。システム2においてシステム1と同じ部分には同じ符号を付して説明を省略する。
基板10Bは、穴部11を有する基板本体12と、穴部11の開口11aを覆う、膜タンパク質13を含む脂質二分子膜14と、脂質二分子膜14上に配置された緩衝液15と、穴部11の外部に設けられ、緩衝液15と接触する第1の電極16と、穴部11の内部に設けられた第2の電極17とを有する。伸展手段20は、脂質二分子膜14を伸展する手段である。
【0026】
第1の電極16および第2の電極17は、穴部11の外部および内部においてそれぞれ緩衝液に接触するように設けられる。第1の電極16および第2の電極17は、それぞれ図示しない電流計に接続され、それら電極間に流れる電流を測定できるようになっている。
第2の電極17は、穴部11の底部に設けられることが好ましい。
電極の材質としては、例えば、銅、アルミニウム、金、銀、塩化銀、白金、クロム、ニッケルなどの金属、および導電性樹脂などの導電性物質が挙げられる。
電極の厚みは50〜500nmであることが好ましい。
【0027】
システム2には、システム1と同様に、AFM、共焦点レーザースキャン顕微鏡などの、脂質二分子膜14の表面構造を観察する観察手段を具備することが好ましい。また、穴部11の開口11aを覆うように網目構造体を形成し、該網目構造体上に脂質二分子膜14を形成するようにしてもよい。
【0028】
<膜タンパク質機能測定方法>
本発明の膜タンパク質機能測定方法は、脂質二分子膜を伸展したときの膜タンパク質の機能、該膜タンパク質(受容体)の脂質二分子膜中での局在を測定する方法であって、前述の本発明の膜タンパク質機能測定システムを用いる方法である。
本発明の膜タンパク質機能測定方法は、機能の測定手段によって、下記方法(I)、方法(II)または方法(III)が挙げられる。
(I)AFMなどの観察手段により脂質二分子膜の表面構造を測定する場合。
(II)膜タンパク質の機能を蛍光強度の変化により光学的に測定する場合。
(III)膜タンパク質の機能を電流値の変化により電気的に測定する場合。
【0029】
また、方法(II)は、測定に用いる膜タンパク質と蛍光物質の種類により下記方法(II−1)〜(II−4)が挙げられる。
(II−1)膜タンパク質がイオンチャネル型膜タンパク質であり、蛍光物質としてイオン感受性蛍光色素を用いる場合。
(II−2)膜タンパク質がイオンチャネル型膜タンパク質であり、蛍光物質として核酸結合性蛍光色素を用いる場合。
(II−3)膜タンパク質がイオンチャネル型膜タンパク質であり、蛍光物質として蛍光標識した細胞外情報伝達物質を用いる場合。
(II−4)膜タンパク質が代謝型膜タンパク質であり、蛍光物質としてイオン感受性蛍光色素を用いる場合。
【0030】
方法(I):
システム1における膜タンパク質13としてイオンチャネル型膜タンパク質13Aと代謝型膜タンパク質13Bを用いたシステム1Aを用い、図3に示すように、AFM探針などの伸展手段20により脂質二分子膜14を伸展し、同時に、図示しない観察手段によりイオンチャネル型膜タンパク質13Aおよび代謝型膜タンパク質13Bを有する脂質二分子膜14の表面構造を観察する。脂質二分子膜14はAFMの探針などの伸展手段20で伸展する。
これにより、脂質二分子膜14の伸展によるイオンチャネル型膜タンパク質13Aと代謝型膜タンパク質13Bの構造変化を調べることができる。同様に、脂質二分子膜14の伸展による、イオンチャネル型膜タンパク質13Aと代謝型膜タンパク質13Bの脂質二分子膜14内の局在の変化を観察することができる。
【0031】
方法(II−1):
システム1において、膜タンパク質13がイオンチャネル型膜タンパク質13Aであり、穴部11の内部に、膜タンパク質13を透過するイオン31に結合して蛍光を発するイオン感受性蛍光色素32が配置され、かつ脂質二分子膜14上に、膜タンパク質13を透過するイオン31を含む緩衝液15が配置されたシステム1Bを用い、図4に示すように、伸展手段20により脂質二分子膜14を伸展し、イオンチャネル型膜タンパク質13Aのイオン31の透過を蛍光強度の変化から測定する。
【0032】
伸展手段20により脂質二分子膜14を伸展すると、その刺激に伴ってイオンチャネル型膜タンパク質13Aの構造が変化し、膜貫通部分のイオンチャネルが開いて穴部11にイオン31が流入する。そして、穴部11に流入したイオン31とイオン感受性蛍光色素32が結合して蛍光を発することで、脂質二分子膜14の伸展によるイオンチャネル型膜タンパク質13Aの活性の変化を測定できる。
イオン感受性蛍光色素32は、緩衝液に含有させて穴部11の内部に配置する。緩衝液は、充分な蛍光が検出でき、イオンチャネル型膜タンパク質13Aの機能を阻害しないものであればよく、例えば、Tris−HClなどが挙げられる。
【0033】
イオン31としては、例えば、カルシウムイオン、ナトリウムイオン、塩化物イオン、カリウムイオンが挙げられる。
緩衝液15中のイオン31の濃度は、測定に応じて適宜決定すればよく、1nM〜500mMが好ましく、10μM〜150mMがより好ましい。
【0034】
イオン感受性蛍光色素32は、イオン31と結合することにより蛍光を発する物質であり、カルシウムイオン(Ca2+)と結合して蛍光を発するできるfura−2、fluo−3、fluo−4、ナトリウムイオン(Na+)と結合して蛍光を発するSBFI、CoroNa、カリウムイオン(K+)と結合して蛍光を発するPBFI、塩化物イオン(Cl−)と結合して蛍光を発するMQAEなどが挙げられる。
穴部11の内部におけるイオン感受性蛍光色素32の濃度は、蛍光強度の変化によりイオンチャネル型膜タンパク質13Aの活性を測定できるのに充分な量であればよく、100nM〜500μMが好ましく、1μM〜100μMがより好ましい
【0035】
方法(II−2):
システム1において、膜タンパク質13がイオンチャネル型膜タンパク質13Aであり、穴部11の内部に核酸33が配置され、かつ脂質二分子膜14上に、核酸33に結合して蛍光が増強する核酸結合性蛍光色素34を含む緩衝液15が配置されたシステム1Cを用い、図5に示すように、伸展手段20により脂質二分子膜14を伸展して、イオンチャネル型膜タンパク質13Aの核酸結合性蛍光色素34の透過を蛍光強度の変化から測定する。
【0036】
伸展手段20により脂質二分子膜14を伸展すると、その刺激に伴ってイオンチャネル型膜タンパク質13Aの構造が変化し、チャネルポアサイズが変化して、核酸結合性蛍光色素34がイオンチャネル型膜タンパク質13Aを介して穴部11の内部に流入する。そして、穴部11に流入した核酸結合性蛍光色素34と核酸33が結合して蛍光を発することで、脂質二分子膜14の伸展によるイオンチャネル型膜タンパク質13Aの活性の変化を測定できる。
核酸33は、緩衝液に含有させて穴部11の内部に配置する。緩衝液は、充分な蛍光が検出でき、イオンチャネル型膜タンパク質13Aの機能を阻害しないものであればよく、例えば、Tris−HClなどが挙げられる。
【0037】
核酸33としては、例えば、デオキシリボ核酸(DNA)、リボ核酸(RNA)が挙げられる。核酸は、人工的に合成したものであっても、細胞から抽出したものであってもよい。また、核酸33の塩基対数は、蛍光強度の変化を定量的に測定することができれば特に限定されない。
穴部11の内部における核酸33の濃度は、核酸の種類、長さによっても異なるが、1ng/μL〜500μg/μLが好ましく、1〜100μg/μLがより好ましい。
【0038】
核酸結合性蛍光色素34としては、例えば、臭化エチジウム、プロピディウムイオダイドなどが挙げられる。
穴部11の内部における核酸結合性蛍光色素34の濃度は、蛍光強度の変化によりイオンチャネル型膜タンパク質13Aの活性を測定できるのに充分な量であればよく、100nM〜500μMが好ましく、1μM〜100μMがより好ましい
【0039】
方法(II−3):
システム1において、膜タンパク質13がイオンチャネル型膜タンパク質13Aであり、穴部11の内部に、蛍光標識した細胞外情報伝達物質35(以下、「リガンド分子35」という。)が配置されたシステム1Dを用い、図6に示すように、伸展手段20により脂質二分子膜14を伸展して、リガンド分子35の穴部11の内部から外部へのイオンチャネル型膜タンパク質13Aを介した移動を蛍光強度の変化から測定する。
【0040】
伸展手段20により脂質二分子膜14を伸展すると、その刺激に伴ってイオンチャネル型膜タンパク質13Aが活性化して構造が変化し、リガンド分子35がイオンチャネル型膜タンパク質13Aを介して穴部11の内部から外部に流出し、穴部11の内部において蛍光強度が小さくなる。そのため、穴部11の内部においてリガンド分子35による蛍光強度の変化を測定することで、脂質二分子膜14の伸展によるイオンチャネル型膜タンパク質13Aの活性の変化を測定できる。
リガンド分子35は、緩衝液に含有させて穴部11の内部に配置する。緩衝液は、充分な蛍光が検出でき、イオンチャネル型膜タンパク質13Aの機能を阻害しないものであればよく、例えば、Tris−HClなどが挙げられる。
【0041】
リガンド分子35は、細胞外情報伝達物質に蛍光物質が結合した化合物である。
細胞外情報伝達物質は、細胞間での情報伝達に用いられる物質であり、例えば、アデノシン三リン酸(ATP)、グルタミン酸が挙げられる。
前記細胞外情報伝達物質に結合する蛍光物質としては、NBD(nitrobenzfurazan)、TexasRed、Alexa Fluor、fluorescein、rhodamine、Cy dyeが好ましい。
リガンド分子35の具体例としては、例えば、ATP−FITC、glutamate−FITCが挙げられる。細胞外情報伝達物質にFITCを結合させる方法は、公知の方法を用いることができる。
リガンド分子35の濃度は、測定の目的に応じて適宜決定すればよく、1nM〜10mMが好ましく、10nM〜100μMがより好ましい。
【0042】
方法(II−4):
システム1において、膜タンパク質13が代謝型膜タンパク質13Bであり、穴部11の内部に、細胞質抽出画分36、およびカルシウムイオンに結合して蛍光を発するカルシウムイオン感受性蛍光色素37が配置されたシステム1Eを用い、図7に示すように、伸展手段20により脂質二分子膜14を伸展して、細胞内シグナル伝達系を介した小胞体からのカルシウムイオンの放出を蛍光強度の変化から測定する。
【0043】
伸展手段20により脂質二分子膜14を伸展すると、代謝型膜タンパク質13Bが活性化する。そして、穴部11の内部に存在する、代謝型膜タンパク質13Bと会合していたグアノシン二リン酸(GDP)結合型Gタンパク質がグアノシン三リン酸(GTP)結合型Gタンパク質と置き換わることで、そのシグナル伝達経路の下流にあるホスホリパーゼC(PLC)を活性化する。PLCは、脂質二分子膜のホスファチジルイノシトールの1種であるPI(4,5)P2を代謝してイノシトール三リン酸(IP3)を産生する。IP3は、小胞体のIP3受容体に結合することでその構造を変化させ、小胞体内に存在するカルシウムイオンを細胞質(本方法(II−4)では穴部11)へ放出させる。放出されたカルシウムイオンは、カルシウムイオン感受性蛍光色素37と結合し、蛍光強度を増加させる。このように、これら一連の反応を介して、脂質二分子膜14の伸展により活性化した代謝型膜タンパク質13Bの活性を測定することができる。
【0044】
細胞質抽出物36は、Gタンパク質共役型受容体を発現する細胞や組織から公知の方法により調製できる。
例えば、細胞の場合は、下記の方法が挙げられる。培養ディッシュ(直径10cm)に播種した細胞を細胞間の隙間がなくなるまで培養する。次いで、細胞をリン酸緩衝液(PBS)で3度洗浄し、セルスクレーバーで細胞を掻き取り、1.5mlセーフロックチューブに入れ、5000rpm(4℃)で遠心して細胞を回収する。次いで、得られた細胞のペレットに純水50μLを加え、10分間氷上にて静置し、低浸透圧刺激により細胞膜を破壊する。その後、ペレットを吸い込まないように上清をとり、プロテアーゼ阻害剤を加えて細胞質抽出画分36とする。
【0045】
カルシウムイオン感受性蛍光色素37としては、例えば、fura−2、fluo−3、fluo−4などが挙げられる。
穴部11の内部におけるカルシウムイオン感受性蛍光色素37の濃度は、蛍光強度の変化によりGタンパク質共役型受容体の活性を測定できる量であればよく、100nM〜500μMが好ましく、1μM〜100μMがより好ましい。
【0046】
方法(III):
システム2において、膜タンパク質13がイオンチャネル型膜タンパク質13Aであり、脂質二分子膜14上に、膜タンパク質を透過するイオン38を含む緩衝液15が配置されており、図8に示すように、伸展手段20により脂質二分子膜14を伸展して、第1の電極16および第2の電極17間の電流を測定する。
伸展手段20により脂質二分子膜14を伸展すると、その刺激に伴ってイオンチャネル型膜タンパク質13Aの構造が変化し、膜貫通部分のイオンチャネルが開いて穴部11にイオン38が流入する。このイオン38の流入により、第1の電極16および第2の電極17間で電流が検出されるので、脂質二分子膜14の伸展によるイオンチャネル型膜タンパク質13Aの活性の変化を測定できる。
【0047】
イオン38は、方法(II−1)で挙げたイオン31と同じものが使用できる。
緩衝液15中のイオン38の濃度は、電流が充分に検出できる量であればよく、1nM〜500mMが好ましく、10μM〜150mMがより好ましい。
穴部11の内部には、緩衝液を配置しておく。穴部11の内部に配置する緩衝液は、脂質二分子膜14上に配置する緩衝液15と同じ緩衝液であることが好ましい。
【0048】
以上説明した本発明の膜タンパク質機能測定システムおよび膜タンパク質機能測定方法によれば、膜タンパク質機能測定基板の穴部上に設けた脂質二分子膜を伸展したときの膜タンパク質の活性の変化を測定することができる。また、方法(I)と、方法(II)または方法(III)との併用、すなわち、AFMなどの観察手段と、光学的もしくは電気的な活性の測定を併用することにより、脂質二分子膜を伸展したときの該脂質二分子膜中の受容体の密度変化と活性の関係を測定することができる。
【0049】
尚、本発明の膜タンパク質機能測定方法は、前述の方法には限定されない。例えば、方法(I)においてイオンチャネル型膜タンパク質のみを用いてもよく、代謝型膜タンパク質のみを用いてもよい。また、方法(II)、方法(III)において、膜タンパク質としてイオンチャネル型膜タンパク質と代謝型膜タンパク質の両方を用いて測定してもよい。
【実施例】
【0050】
以下、実施例及び比較例を示して本発明を詳細に説明する。ただし、本発明は以下の記載によっては限定されない。
本実施例における蛍光像の観察は、共焦点レーザースキャン顕微鏡(商品名:LSM510、ツァイス製)を用いて行った。
【0051】
[実験例1]
卵黄由来のフォスファチジルコリンをクロロホルムに溶解し、アルゴンガス雰囲気下で乾燥し、最終濃度160μg/mLで緩衝液(10mMTris−HCl、pH7.4)に溶解した。該緩衝液を超音波破砕機で処理し、脂質小胞を作製した。次いで、前記脂質小胞に、20質量%のフルオレセインで蛍光標識した脂質(フルオレセイン結合ジヘキサデカノイルグリセロフォスフォエタノールアミン)を最終濃度40μg/mLとなるように加えて、さらに脂質小胞を作製することで、蛍光により観察可能な脂質二分子膜を作製した。該脂質小胞を含む緩衝液に蛍光色素(アレクサ647、最大励起波長650nm、最大蛍光波長668nm、He−Neレーザ使用、最終濃度500μM)を混合し、その状態で穴部(ナノウェル)を有する基板へのベシクルフュージョンを行った。その後、該基板の蛍光像を観察したところ、基板の穴部にてアレクサ647由来の蛍光が観察された(図9(a)、測定領域500×500μm)。基板上に配置した前記緩衝液を、脂質を含まない緩衝液(10mMTris−HCl、pH7.4)で10回置換し、不要物を除去した。その後、該基板の蛍光像を観察したところ、脂質二分子膜が基板に接着している様子が観察され、脂質二分子膜で覆われた部分(図9(b))の穴部にのみアレクサ647由来の蛍光が観察されたことから、該穴部は脂質二分子膜で充分に覆われて密閉されていることが分かった。
【0052】
[実験例2]
ジパルミトイルフォスファチジルコリン、1,2−ジラウロイル−sn−グリセロ−3−フォスフェート、1,2−ジパルミトイル−sn−グリセロ−3−フォスフォチオエタノールを75:23:2の比率で混合し、200μg/mLの濃度で緩衝液(10mMTris−HCl、pH7.4)に溶解して脂質小胞を作製した。該脂質小胞を含む緩衝液を、穴部(ナノウェル)を有する基板に滴下し、穴部を覆う脂質二分子膜を作製し、該脂質二分子膜をAFMの深針により伸展し、AFMにより観察した(図10)。図10における秒数は、伸展の開始時を0秒とした観察経過時間を意味する。
穴部を覆う脂質二分子膜は、その高さ情報から、平らに形成されていることが分かった(図10(a)、15秒)。AFMの深針による機械刺激を次第に強くしていくと、穴部を覆った脂質二分子膜は該穴部の内部側へと押し伸ばされた(図10(a)、15秒〜215秒)。その後、機械刺激を弱くしていくと、押し伸ばされた脂質二分子膜は元のように平らになった(図10(a)、215〜255秒)。このように、本条件では伸展刺激を与えている状態でも、脂質二分子膜が移動することなく基板に接着していることがわかった。
一方、平らに戻った脂質二分子膜に対し、さらに強く機械刺激を加えていくと、最後には穴部を覆っている脂質二分子膜が破れ(図10(b)、110秒)、穴部の左方向に向かって脂質二分子膜が引き剥がされた(図10(b)、140秒)。このとき、高さ情報から穴部では、脂質二分子膜が破れている状態であることがわかった。
【0053】
[実施例1]
バクテリオロドプシン(BR)75質量%および脂質二分子膜25質量%の複合体膜(紫膜)を5μg/mLの濃度で緩衝液(10mMTris−HCl、pH8.0、1MKCl)に溶解し、マイカ基板上に滴下して、30分間室温で静置した。その後、紫膜を含まない緩衝液で10回置換し、マイカ基板に接着していない紫膜を洗い流した。マイカ基板に接着した紫膜は高さが均一な膜状の構造(図11(a)、(b))であり、拡大すると分子が規則的に並んでいる様子が観察された(図11(c))。この観察結果を、D. J. Muller等の研究結果(Journal of Molecular Biology (1999) 285, 1903-1909)と比較したところ、図11(c)における領域X内の分子は三量体のBRタンパク質であると考えられた。
一方、穴部を有する基板に、前記と同様に紫膜を接着させ、該穴部上にあるBRタンパク質の観察を行った(図12、(a))。穴部を覆う紫膜は平らではなく撓んだ状態であった(図12、(b))。この状態でも、個々のBRタンパク質の三量体が観察できた(図12(c)、領域Y)。この観察では、AFMの深針により脂質二分子膜を伸展する刺激によっては、BRタンパク質の顕著な構造変化は観察されず、三量体構造が保たれていた。対照的に、三量体構造間の距離は大きく変化しており、脂質二分子膜内におけるBRタンパク質の局在は変化することが明らかとなった。
このように、本発明の測定方法により、脂質二分子膜を伸展した状態で、膜タンパク質の構造や、膜タンパク質同士の位置関係を観察することができた。
【0054】
[実施例2]
卵黄由来フォスファチジルコリンを160μg/mLの濃度で緩衝液(10mMTris−HCl、pH7.4)に溶解し、穴部を有する基板上に滴下して、該穴部上に脂質二分子膜を作製し、該脂質二分子膜にNMDA受容体を含むプロテオリポソームを融合して受容体を挿入した。穴部の内部には、カルシウム感受性蛍光色素であるfluo−4(10μM)を加え、穴部の外部の緩衝液(10mMTris−HCl、pH7.4)には2mMCaCl2を加えた。脂質二分子膜を伸展(開始時を0秒)すると、観察領域の蛍光強度が増加した(図13(a))。この時の基板の状態を蛍光観察すると、穴部において脂質二分子膜の伸展に伴った蛍光が観測された(図13(b))。この結果、NMDA受容体は脂質二分子膜の伸展により活性化し、穴部外部に存在するカルシウムイオンを穴部内部に透過したことが明らかとなった。
【0055】
[実施例3]
穴部の内部および外部にそれぞれ電極を設けた以外は、実施例2と同様にして穴部にNMDA受容体を含む脂質二分子膜を作製した。AFMの深針により該脂質二分子膜を伸展したところ、電極間の電流値が変化した(図13(c))。
脂質二分子膜には精製したNMDA受容体を挿入していることから、この電流値の変化は脂質二分子膜の伸展によりNMDA受容体が活性化したためであると考えられた。
【産業上の利用可能性】
【0056】
本発明は、脂質二分子膜の伸展に関係する膜タンパク質の機能を解析するための測定システムおよび測定方法として有用であり、例えば、心筋梗塞や高血圧など、体内における脂質二分子膜の伸展に関わる膜タンパク質のスクリーニングシステムとして好適に利用できる。
【符号の説明】
【0057】
1、1A〜1E、2 膜タンパク質機能測定システム 10 膜タンパク質機能測定用基板 11 穴部 12 基板本体 13 膜タンパク質 13A イオンチャネル型膜タンパク質 13B 代謝型膜タンパク質 14 脂質二分子膜 15 緩衝液 16 第1の電極 17 第2の電極 20 伸展手段 31 イオン 32 イオン感受性蛍光色素 33 核酸 34 核酸結合性蛍光色素 35 リガンド分子 36 細胞質抽出画分 37 カルシウムイオン感受性蛍光色素 38 イオン
【技術分野】
【0001】
本発明は、膜タンパク質機能測定システムおよび膜タンパク質機能測定方法に関する。
【背景技術】
【0002】
タンパク質をはじめとする生体分子の機能を理解する上で、その構造を知ることは不可欠である。生体分子が機能する際には、外界(細胞外)からの刺激に伴いその構造を変化させことでその機能を発揮する。
【0003】
タンパク質、脂質、核酸などの生体分子の構造を生体内に近い条件で観察できる手法としては、水溶液中で観察が可能な走査プローブ顕微鏡、特に原子間力顕微鏡(AFM)を用いる方法が広く用いられている。近年、AFMの技術は非常に進歩しており、生体分子の構造解析、および溶液中に添加した低分子化合物やペプチドの結合による生体分子の動的な構造変化の観察への更なる貢献が期待されている。
AFMを用いた測定装置及び測定方法としては、例えば、溶液中において分子レベルまたは原子レベルの分解能が達成された測定装置および測定方法(非特許文献1)や、ビデオレートでの観察を可能とする測定装置(非特許文献2)が挙げられる。
【0004】
生体分子が外界から受ける刺激としては、一部の膜タンパク質では細胞膜の伸展が挙げられる。該膜タンパク質では、細胞膜の伸展によっても活性化され、リン酸化や、カルシウムイオンの透過などの生理活性を示すことが知られている(非特許文献3〜5)。これらの膜タンパク質以外にも、細胞膜の伸展によって活性化するタンパク質が存在する可能性がある。
また、一部の受容体に関しては、受容体密度と活性に相関があることが知られており(非特許文献6)。そのため、近傍の受容体同士の距離と、その機能との関係を詳細に分析し、その関係を明らかにすることも重要である。
しかし、細胞膜の伸展や、受容体同士の距離の変化によるタンパク質の活性化を詳細に評価する測定システムはなく、細胞膜の伸展により活性化する新たなタンパク質を探索することも、受容体同士の距離とその機能の関係を詳細に分析することも困難である。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】T. Fukuma, M. J. Higgins, S. P. Jarvis, Direct imaging of lipid-ion network formation under physiological conditions by frequency modulation atomic force microscopy. Phys. Rev. Lett. 98 (2007) 10601-10603.
【非特許文献2】T. Ando, N. Kodera, E. Takai, D. Maruyama, K. Saito, A. Toda, A high-speed atomic force microscope for stdying biological macromolecules. Proc. Natl. Acad. Sci. USA. 98 (2001) 12468-12472.
【非特許文献3】A. Kloda, L. Kua, R. Hall, D. J. Adams, B. Martinac, Liposome reconstitution and modulation of recombinant N-methyl-D-aspartate receptor channels by membrane stretch, Proc. Natl. Acad. Sci. USA. 104 (2007) 1540-1545.
【非特許文献4】Y. Sawada, M. Tamada, B. J. Dubin-Thaler, O. Cherniavskaya, R. Sakai, S. Tanaka, M. P. Sheetz, Force sensing by mechanical extension of the Src family kinase substrate p130Cas, Cell 127 (2006) 1015-1026.
【非特許文献5】K. Yamamoto, T. Sokabe, T. Matsumoto, K. Yoshimura, M. Shibata, N. Ohura, T. Fukuda, T. Sato, K. Sekine, S. Kato, M. Isshiki, T. Fujita, M. Kobayashi, K. Kawamura, H. Masuda, A. Kamiya, J. Ando, Impaired flow-dependent control of vascular tone and remodeling in P2X4-deficient mice, Nat Med. 12 (2006) 133-137.
【非特許文献6】Y. Fujiwara, Y. Kubo, Density dependent changes of the pore properties of P2X2 receptor channel, J. Physiol. 558 (2004) 31-43.
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、微小孔上に展開した脂質二分子膜中に膜タンパク質を再構成した、該脂質二分子膜の伸展による膜タンパク質の活性化、および伸展による脂質二分子膜中の受容体の密度変化と活性の関係を測定できる膜タンパク質機能測定システム、ならびに膜タンパク質機能測定方法の提供を目的とする。
【課題を解決するための手段】
【0007】
本発明は、前記課題を解決するために以下の構成を採用した。
[1]穴部を有する基板本体の、該穴部の開口が膜タンパク質を含む脂質二分子膜に覆われており、該脂質二分子膜上に緩衝液が配置された膜タンパク質機能測定用基板と、前記脂質二分子膜を伸展する伸展手段と、を具備する膜タンパク質機能測定システム。
[2]前記伸展手段が走査プローブ顕微鏡の深針である、前記[1]に記載の膜タンパク質機能測定システム。
[3]更に、前記脂質二分子膜の表面構造を観察する観察手段を具備する、前記[1]または[2]に記載の膜タンパク質機能測定システム。
[4]更に、前記基板における前記穴部の外部に設けられた第1の電極と、前記穴部の内部に設けられた第2の電極とを具備する、前記[1]〜[3]のいずれかに記載の膜タンパク質機能測定システム。
[5]前記[1]〜[3]のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、前記膜タンパク質がイオンチャネル型膜タンパク質であり、前記穴部の内部に、膜タンパク質を透過するイオンに結合して蛍光を発するイオン感受性蛍光色素が配置され、かつ前記脂質二分子膜上に、膜タンパク質を透過するイオンを含む緩衝液が配置されており、前記伸展手段により前記脂質二分子膜を伸展して、前記イオンチャネル型膜タンパク質のイオンの透過を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
[6]前記[1]〜[3]のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、前記膜タンパク質がイオンチャネル型膜タンパク質であり、前記穴部の内部に、核酸が配置され、かつ前記脂質二分子膜上に、核酸に結合して蛍光が増強する核酸結合性蛍光色素を含む緩衝液が配置されており、前記伸展手段により前記脂質二分子膜を伸展して、前記イオンチャネル型膜タンパク質の前記核酸結合性蛍光色素の透過を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
[7]前記[1]〜[3]のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、前記膜タンパク質がイオンチャネル型膜タンパク質であり、前記穴部の内部に、蛍光標識した細胞外情報伝達物質が配置されており、前記伸展手段により前記脂質二分子膜を伸展して、前記細胞外情報伝達物質の前記穴部の内部から外部への前記イオンチャネル型膜タンパク質を介した移動を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
[8]前記[1]〜[3]のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、前記膜タンパク質が代謝型膜タンパク質であり、前記穴部の内部に、細胞質抽出画分、および膜タンパク質を透過するカルシウムイオンに結合して蛍光を発するカルシウムイオン感受性蛍光色素が配置されており、前記伸展手段により前記脂質二分子膜を伸展して、細胞内シグナル伝達系を介した小胞体からのカルシウムイオンの放出を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
[9]前記[4]に記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、前記膜タンパク質がイオンチャネル型膜タンパク質であり、前記脂質二分子膜上に、膜タンパク質を透過するイオンを含む緩衝液が配置されており、前記伸展手段により前記脂質二分子膜を伸展して、前記第1の電極および第2の電極の間を流れる電流を測定して、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【発明の効果】
【0008】
本発明の膜タンパク質機能測定システムおよび膜タンパク質機能測定方法によれば、脂質二分子膜の伸展による膜タンパク質の活性化、および伸展による脂質二分子膜中の受容体の密度変化と活性の関係を測定できる。
【図面の簡単な説明】
【0009】
【図1】本発明の膜タンパク質機能測定システムの実施形態の一例を示した概略断面図である。
【図2】本発明の膜タンパク質機能測定システムの他の実施形態例を示した概略断面図である。
【図3】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図4】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図5】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図6】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図7】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図8】本発明の膜タンパク質機能測定方法の一工程を示した概略断面図である。
【図9】実験例1における基板の共焦点蛍光顕微鏡を用いた蛍光像である。
【図10】実験例2における基板のAFM像である。
【図11】実施例1における基板のAFM像(a)、AFM像(a)中の破線部における脂質二分子膜の高さ情報を示したグラフ(b)、およびAFM像(a)の拡大図(c)である。
【図12】実施例1における穴部を有する基板のAFM像(a)、AFM像(a)中の破線部における脂質二分子膜の高さ情報を示したグラフ(b)、およびAFM像(a)の拡大図(c)である。
【図13】実施例2における蛍光強度の変化を示したグラフ(a)および基板の共焦点蛍光顕微鏡を用いた蛍光像(b)、ならびに実施例3における電流値の変化を示したグラフ(c)である。
【発明を実施するための形態】
【0010】
<膜タンパク質機能測定システム>
本発明の膜タンパク質機能測定システム1(以下、「システム1」という。)は、図1に示すように、膜タンパク質機能測定用基板10A(以下、「基板10A」という。)と、伸展手段20と、を具備する。
基板10Aは、穴部11を有する基板本体12と、穴部11の開口11aを覆う、膜タンパク質13を含む脂質二分子膜14と、脂質二分子膜14上に配置された緩衝液15とを有する。伸展手段20は、脂質二分子膜14を伸展する手段である。
【0011】
基板10Aは、脂質二分子膜14を伸展することによって活性化する膜タンパク質13の構造変化、脂質二分子膜14における局在の観測、蛍光強度の変化の測定による膜タンパク質13の機能測定のための基板である。
基板10Aでは、穴部11を覆う脂質二分子膜14上に緩衝液15が配置され、穴部11の外部と穴部11の内部が脂質二分子膜14によって区切られている。
【0012】
基板本体12の表面は、平坦であることが好ましい。
基板本体12の材質は、表面を平坦に加工できる材質が好ましく、例えば、マイカ、ガラス、シリコンなどが挙げられる。
基板本体12の形状は特に限定されず、用途に応じた形状のものを使用することができ、例えば、平板状の基板が挙げられる。
基板本体12の厚みは特に限定されず、0.1mm〜2mmが好ましい。
【0013】
基板本体12は、穴部11を有する。
基板本体12における穴部11の数は特に限定されず、1〜10,000個が好ましい。
穴部11の形状は、開口11aに脂質二分子膜14を安定に配置でき、必要に応じて蛍光顕微鏡による穴部11の蛍光像の取得、AFMによる表面構造の観察等が可能な形状であればよい。穴部11の形状としては、例えば、円筒状が挙げられる。
穴部11は、凹状の穴であってもよく、貫通孔であってもよい。この例では、穴部11は凹状の穴である。
【0014】
開口11aの直径は、10nm〜10μmが好ましい。開口11aの直径が10nm以上であれば、AFMにより表面構造の観察等が容易になり、また膜タンパク質13の機能測定が容易になる。開口11aの直径が10μm以下であれば、脂質二分子膜14をより安定に形成できる。
また、穴部11の深さは、基板本体12の厚みに応じて設定すればよく、50nm〜2mmが好ましい。
【0015】
基板本体12に穴部11を形成する方法としては、例えば、フォトリソグラフィ法、ドライエッチング法等の微細加工技術が適用できる。また、プラスチックの基板本体12であれば、加熱した注射針を刺すことにより形成してもよい。
【0016】
膜タンパク質13は、イオンチャネル型膜タンパク質もしくは代謝型膜タンパク質などが挙げられる。
イオンチャネル型膜タンパク質としては、例えばイオンチャネル型受容体が挙げられ、TRP(Transient Receptor Potential)チャネル(サブユニットはTRPV1〜TRPV6、TRPA1、TRPC1〜TRPC7、TRPM1〜TRPM8、TRPML1〜TRPML3、TRPP1〜TRPP5)、ATP受容体(サブユニットはP2X1〜P2X7)、セトロニン受容体(サブユニットは5−HT3)、NMDA受容体(サブユニットはNR1、NR2A〜NR2D、NR3A、NR3B)、AMPA受容体(サブユニットはGluR1〜GluR4)、カイニン酸受容体(サブユニットはGluR5〜GluR7、KA−1、KA−2)、GABA受容体(サブユニットはα、β、γ)もしくはGABA受容体(サブタイプはGABAA、GABAC)などが挙げられる。
代謝型膜タンパク質としては、例えばGタンパク共役型受容体が挙げられ、アデノシン受容体(A1、A2A、A2B、A3)、ATP受容体(P2Y1、P2Y2、P2Y4、P2Y6、P2Y11、P2Y12、P2Y13、P2Y14)、セロトニン受容体(サブユニットは5−HT1、5−HT2、5−HT4、5−HT6、5−HT7)、代謝型グルタミン酸受容体(mGluR1〜mGluR3、mGluR5〜mGluR8)、アドレナリン受容体(α、β)、プロテアーゼ活性化受容体(PAR−1〜PAR−4)、ブラジキニン受容体(B1、B2)、GABAB受容体、オピオイド受容体(ν受容体、δ受容体、κ受容体)などが挙げられる。
これら受容体は1種のみを使用してもよく、2種以上を併用してもよい。
【0017】
脂質二分子膜14に膜タンパク質13を再構成する方法は、公知の方法を用いることができ、例えば、ベシクルフュージョン法が挙げられる。
【0018】
脂質二分子膜14は、両親媒性分子であるリン脂質などの脂質分子が二層構造を形成した膜であり、生体膜の最も基本的な構造である。脂質分子は、疎水性部分と親水性部分を有し、疎水性部分同士が会合することにより安定な二分子膜構造を形成する。
脂質分子としては、常温で充分な流動性を持つものであればよく、各脂質の疎水部のアルキル鎖長、二重結合の部位と数は特に限定されない。
脂質分子としては、例えば、卵黄由来フォスファチジルコリン(egg−yolk PC)、ホスファチジルコリン(PC)、ホスファチジルエタノールアミン(PE)、ホスファチジルセリン(PS)、ホスファチジルイノシトール(PI)、ホスファチジルイノシトールホスフェイト(PIP)、ホスファチジン酸(PA)、ホスファチジルグリセロール(PG)、スフィンゴ脂質などが挙げられる。
これら脂質分子は、1種類のみを用いてもよく、2種類以上を用いてもよい。
【0019】
脂質二分子膜14の形成方法としては、例えば、n−デカンなどの有機溶媒に溶解した脂質分子を用いる方法が挙げられる。まず、穴部11に水溶液を配置し、その上部にn−デカンに溶解した脂質分子を配置する。これにより、n−デカン中の脂質分子の親水部がn−デカンと穴部11との界面に次第に集まり、均一な層を形成する。次いで、穴部11のn−デカン上に緩衝液などの水溶液を配置する。これにより、n−デカンと、該n−デカンの上側(外部側)の水溶液との界面にも脂質分子の親水部が次第に集中してくる。n−デカンは室温で揮発するため、最終的に穴部11の開口11aを覆う均一な脂質二分子膜14が形成される。
【0020】
緩衝液15は、充分な蛍光が検出でき、膜タンパク質13の機能を阻害しないものであればよく、例えば、Tris−HClなどが挙げられる。
緩衝液15の量は、脂質二分子膜14を充分に覆う量であればよい。
【0021】
伸展手段20としては、脂質二分子膜14に押し付けて部分的に機械的刺激を与え、脂質二分子膜14を伸展できるものであればよく、AFMなどの走査プローブ顕微鏡の深針が好ましい。
【0022】
また、システム1は、脂質二分子膜14の表面構造を観察する観察手段を具備することが好ましい。
観察手段としては、例えば、AFMが挙げられる。また、膜タンパク質13や脂質二分子膜14を蛍光標識している場合であれば、共焦点レーザースキャン顕微鏡を用いることもできる。
【0023】
また、穴部11の開口11aが大きすぎることで、伸展しなくても脂質二分子膜14が撓んで脂質二分子膜上の構造観察が困難となる場合は、穴部11の開口11aを覆うように網目構造体を形成し、該網目構造体上に脂質二分子膜14を形成するようにしてもよい。
網目構造体はナノ線状体からなる構造体であり、具体的には、ナノ線状体が多数の分岐を有して、網目を形成したものである。
ナノ線状体としては、例えば、ナノチューブ、ナノワイヤー、ナノファイバなどが挙げられ、その材質は特に制限はないが、ナノ線状体を容易に形成できる点では、カーボンが好ましい。
ここで、ナノ線状体とは、長さ方向に垂直な断面の直径が1〜20nmの線状体のことである。ナノ線状体の長さ方向に垂直な断面の直径が前記下限以上であれば、脂質二分子膜を充分に支持することができる。また、前記上限以下であれば、穴部11の上に網目構造体が配置されても、観察目的の生体試料のAFM観察に支障をきたさない。
ナノ線状体としてカーボンナノチューブを用いる場合、その直径を前記範囲にするためには、後述する網目構造体の形成方法において、使用する金属触媒の種類、粒子径および密度や、形成時の温度を適宜選択すればよい。例えば、触媒の粒子径を大きくする程、直径は大きくなる。
【0024】
網目構造体の形成方法としては、例えば、化学気相成長法(CVD法)により形成する方法などが挙げられる。化学気相成長法を適用した場合の炭素源としては、例えば、メタン、エタン、アセチレン、メタノール、エタノールなどが挙げられる。
また、化学気相成長法により網目構造体を形成する場合には、ナノ線状体を容易に形成できることから、鉄などの金属触媒を用いることが好ましい。また、基板本体12の表面にナノ線状体を形成するためには、金属触媒を基板本体12の表面にあらかじめ付着させておくことが好ましい。
【0025】
また、本発明の膜タンパク質機能測定システムの他の実施形態を図2に示す。
膜タンパク質機能測定システム2(以下、「システム2」という。)は、図2に示すように、膜タンパク質機能測定用基板10B(以下、「基板10B」という。)と、伸展手段20と、を具備する。システム2においてシステム1と同じ部分には同じ符号を付して説明を省略する。
基板10Bは、穴部11を有する基板本体12と、穴部11の開口11aを覆う、膜タンパク質13を含む脂質二分子膜14と、脂質二分子膜14上に配置された緩衝液15と、穴部11の外部に設けられ、緩衝液15と接触する第1の電極16と、穴部11の内部に設けられた第2の電極17とを有する。伸展手段20は、脂質二分子膜14を伸展する手段である。
【0026】
第1の電極16および第2の電極17は、穴部11の外部および内部においてそれぞれ緩衝液に接触するように設けられる。第1の電極16および第2の電極17は、それぞれ図示しない電流計に接続され、それら電極間に流れる電流を測定できるようになっている。
第2の電極17は、穴部11の底部に設けられることが好ましい。
電極の材質としては、例えば、銅、アルミニウム、金、銀、塩化銀、白金、クロム、ニッケルなどの金属、および導電性樹脂などの導電性物質が挙げられる。
電極の厚みは50〜500nmであることが好ましい。
【0027】
システム2には、システム1と同様に、AFM、共焦点レーザースキャン顕微鏡などの、脂質二分子膜14の表面構造を観察する観察手段を具備することが好ましい。また、穴部11の開口11aを覆うように網目構造体を形成し、該網目構造体上に脂質二分子膜14を形成するようにしてもよい。
【0028】
<膜タンパク質機能測定方法>
本発明の膜タンパク質機能測定方法は、脂質二分子膜を伸展したときの膜タンパク質の機能、該膜タンパク質(受容体)の脂質二分子膜中での局在を測定する方法であって、前述の本発明の膜タンパク質機能測定システムを用いる方法である。
本発明の膜タンパク質機能測定方法は、機能の測定手段によって、下記方法(I)、方法(II)または方法(III)が挙げられる。
(I)AFMなどの観察手段により脂質二分子膜の表面構造を測定する場合。
(II)膜タンパク質の機能を蛍光強度の変化により光学的に測定する場合。
(III)膜タンパク質の機能を電流値の変化により電気的に測定する場合。
【0029】
また、方法(II)は、測定に用いる膜タンパク質と蛍光物質の種類により下記方法(II−1)〜(II−4)が挙げられる。
(II−1)膜タンパク質がイオンチャネル型膜タンパク質であり、蛍光物質としてイオン感受性蛍光色素を用いる場合。
(II−2)膜タンパク質がイオンチャネル型膜タンパク質であり、蛍光物質として核酸結合性蛍光色素を用いる場合。
(II−3)膜タンパク質がイオンチャネル型膜タンパク質であり、蛍光物質として蛍光標識した細胞外情報伝達物質を用いる場合。
(II−4)膜タンパク質が代謝型膜タンパク質であり、蛍光物質としてイオン感受性蛍光色素を用いる場合。
【0030】
方法(I):
システム1における膜タンパク質13としてイオンチャネル型膜タンパク質13Aと代謝型膜タンパク質13Bを用いたシステム1Aを用い、図3に示すように、AFM探針などの伸展手段20により脂質二分子膜14を伸展し、同時に、図示しない観察手段によりイオンチャネル型膜タンパク質13Aおよび代謝型膜タンパク質13Bを有する脂質二分子膜14の表面構造を観察する。脂質二分子膜14はAFMの探針などの伸展手段20で伸展する。
これにより、脂質二分子膜14の伸展によるイオンチャネル型膜タンパク質13Aと代謝型膜タンパク質13Bの構造変化を調べることができる。同様に、脂質二分子膜14の伸展による、イオンチャネル型膜タンパク質13Aと代謝型膜タンパク質13Bの脂質二分子膜14内の局在の変化を観察することができる。
【0031】
方法(II−1):
システム1において、膜タンパク質13がイオンチャネル型膜タンパク質13Aであり、穴部11の内部に、膜タンパク質13を透過するイオン31に結合して蛍光を発するイオン感受性蛍光色素32が配置され、かつ脂質二分子膜14上に、膜タンパク質13を透過するイオン31を含む緩衝液15が配置されたシステム1Bを用い、図4に示すように、伸展手段20により脂質二分子膜14を伸展し、イオンチャネル型膜タンパク質13Aのイオン31の透過を蛍光強度の変化から測定する。
【0032】
伸展手段20により脂質二分子膜14を伸展すると、その刺激に伴ってイオンチャネル型膜タンパク質13Aの構造が変化し、膜貫通部分のイオンチャネルが開いて穴部11にイオン31が流入する。そして、穴部11に流入したイオン31とイオン感受性蛍光色素32が結合して蛍光を発することで、脂質二分子膜14の伸展によるイオンチャネル型膜タンパク質13Aの活性の変化を測定できる。
イオン感受性蛍光色素32は、緩衝液に含有させて穴部11の内部に配置する。緩衝液は、充分な蛍光が検出でき、イオンチャネル型膜タンパク質13Aの機能を阻害しないものであればよく、例えば、Tris−HClなどが挙げられる。
【0033】
イオン31としては、例えば、カルシウムイオン、ナトリウムイオン、塩化物イオン、カリウムイオンが挙げられる。
緩衝液15中のイオン31の濃度は、測定に応じて適宜決定すればよく、1nM〜500mMが好ましく、10μM〜150mMがより好ましい。
【0034】
イオン感受性蛍光色素32は、イオン31と結合することにより蛍光を発する物質であり、カルシウムイオン(Ca2+)と結合して蛍光を発するできるfura−2、fluo−3、fluo−4、ナトリウムイオン(Na+)と結合して蛍光を発するSBFI、CoroNa、カリウムイオン(K+)と結合して蛍光を発するPBFI、塩化物イオン(Cl−)と結合して蛍光を発するMQAEなどが挙げられる。
穴部11の内部におけるイオン感受性蛍光色素32の濃度は、蛍光強度の変化によりイオンチャネル型膜タンパク質13Aの活性を測定できるのに充分な量であればよく、100nM〜500μMが好ましく、1μM〜100μMがより好ましい
【0035】
方法(II−2):
システム1において、膜タンパク質13がイオンチャネル型膜タンパク質13Aであり、穴部11の内部に核酸33が配置され、かつ脂質二分子膜14上に、核酸33に結合して蛍光が増強する核酸結合性蛍光色素34を含む緩衝液15が配置されたシステム1Cを用い、図5に示すように、伸展手段20により脂質二分子膜14を伸展して、イオンチャネル型膜タンパク質13Aの核酸結合性蛍光色素34の透過を蛍光強度の変化から測定する。
【0036】
伸展手段20により脂質二分子膜14を伸展すると、その刺激に伴ってイオンチャネル型膜タンパク質13Aの構造が変化し、チャネルポアサイズが変化して、核酸結合性蛍光色素34がイオンチャネル型膜タンパク質13Aを介して穴部11の内部に流入する。そして、穴部11に流入した核酸結合性蛍光色素34と核酸33が結合して蛍光を発することで、脂質二分子膜14の伸展によるイオンチャネル型膜タンパク質13Aの活性の変化を測定できる。
核酸33は、緩衝液に含有させて穴部11の内部に配置する。緩衝液は、充分な蛍光が検出でき、イオンチャネル型膜タンパク質13Aの機能を阻害しないものであればよく、例えば、Tris−HClなどが挙げられる。
【0037】
核酸33としては、例えば、デオキシリボ核酸(DNA)、リボ核酸(RNA)が挙げられる。核酸は、人工的に合成したものであっても、細胞から抽出したものであってもよい。また、核酸33の塩基対数は、蛍光強度の変化を定量的に測定することができれば特に限定されない。
穴部11の内部における核酸33の濃度は、核酸の種類、長さによっても異なるが、1ng/μL〜500μg/μLが好ましく、1〜100μg/μLがより好ましい。
【0038】
核酸結合性蛍光色素34としては、例えば、臭化エチジウム、プロピディウムイオダイドなどが挙げられる。
穴部11の内部における核酸結合性蛍光色素34の濃度は、蛍光強度の変化によりイオンチャネル型膜タンパク質13Aの活性を測定できるのに充分な量であればよく、100nM〜500μMが好ましく、1μM〜100μMがより好ましい
【0039】
方法(II−3):
システム1において、膜タンパク質13がイオンチャネル型膜タンパク質13Aであり、穴部11の内部に、蛍光標識した細胞外情報伝達物質35(以下、「リガンド分子35」という。)が配置されたシステム1Dを用い、図6に示すように、伸展手段20により脂質二分子膜14を伸展して、リガンド分子35の穴部11の内部から外部へのイオンチャネル型膜タンパク質13Aを介した移動を蛍光強度の変化から測定する。
【0040】
伸展手段20により脂質二分子膜14を伸展すると、その刺激に伴ってイオンチャネル型膜タンパク質13Aが活性化して構造が変化し、リガンド分子35がイオンチャネル型膜タンパク質13Aを介して穴部11の内部から外部に流出し、穴部11の内部において蛍光強度が小さくなる。そのため、穴部11の内部においてリガンド分子35による蛍光強度の変化を測定することで、脂質二分子膜14の伸展によるイオンチャネル型膜タンパク質13Aの活性の変化を測定できる。
リガンド分子35は、緩衝液に含有させて穴部11の内部に配置する。緩衝液は、充分な蛍光が検出でき、イオンチャネル型膜タンパク質13Aの機能を阻害しないものであればよく、例えば、Tris−HClなどが挙げられる。
【0041】
リガンド分子35は、細胞外情報伝達物質に蛍光物質が結合した化合物である。
細胞外情報伝達物質は、細胞間での情報伝達に用いられる物質であり、例えば、アデノシン三リン酸(ATP)、グルタミン酸が挙げられる。
前記細胞外情報伝達物質に結合する蛍光物質としては、NBD(nitrobenzfurazan)、TexasRed、Alexa Fluor、fluorescein、rhodamine、Cy dyeが好ましい。
リガンド分子35の具体例としては、例えば、ATP−FITC、glutamate−FITCが挙げられる。細胞外情報伝達物質にFITCを結合させる方法は、公知の方法を用いることができる。
リガンド分子35の濃度は、測定の目的に応じて適宜決定すればよく、1nM〜10mMが好ましく、10nM〜100μMがより好ましい。
【0042】
方法(II−4):
システム1において、膜タンパク質13が代謝型膜タンパク質13Bであり、穴部11の内部に、細胞質抽出画分36、およびカルシウムイオンに結合して蛍光を発するカルシウムイオン感受性蛍光色素37が配置されたシステム1Eを用い、図7に示すように、伸展手段20により脂質二分子膜14を伸展して、細胞内シグナル伝達系を介した小胞体からのカルシウムイオンの放出を蛍光強度の変化から測定する。
【0043】
伸展手段20により脂質二分子膜14を伸展すると、代謝型膜タンパク質13Bが活性化する。そして、穴部11の内部に存在する、代謝型膜タンパク質13Bと会合していたグアノシン二リン酸(GDP)結合型Gタンパク質がグアノシン三リン酸(GTP)結合型Gタンパク質と置き換わることで、そのシグナル伝達経路の下流にあるホスホリパーゼC(PLC)を活性化する。PLCは、脂質二分子膜のホスファチジルイノシトールの1種であるPI(4,5)P2を代謝してイノシトール三リン酸(IP3)を産生する。IP3は、小胞体のIP3受容体に結合することでその構造を変化させ、小胞体内に存在するカルシウムイオンを細胞質(本方法(II−4)では穴部11)へ放出させる。放出されたカルシウムイオンは、カルシウムイオン感受性蛍光色素37と結合し、蛍光強度を増加させる。このように、これら一連の反応を介して、脂質二分子膜14の伸展により活性化した代謝型膜タンパク質13Bの活性を測定することができる。
【0044】
細胞質抽出物36は、Gタンパク質共役型受容体を発現する細胞や組織から公知の方法により調製できる。
例えば、細胞の場合は、下記の方法が挙げられる。培養ディッシュ(直径10cm)に播種した細胞を細胞間の隙間がなくなるまで培養する。次いで、細胞をリン酸緩衝液(PBS)で3度洗浄し、セルスクレーバーで細胞を掻き取り、1.5mlセーフロックチューブに入れ、5000rpm(4℃)で遠心して細胞を回収する。次いで、得られた細胞のペレットに純水50μLを加え、10分間氷上にて静置し、低浸透圧刺激により細胞膜を破壊する。その後、ペレットを吸い込まないように上清をとり、プロテアーゼ阻害剤を加えて細胞質抽出画分36とする。
【0045】
カルシウムイオン感受性蛍光色素37としては、例えば、fura−2、fluo−3、fluo−4などが挙げられる。
穴部11の内部におけるカルシウムイオン感受性蛍光色素37の濃度は、蛍光強度の変化によりGタンパク質共役型受容体の活性を測定できる量であればよく、100nM〜500μMが好ましく、1μM〜100μMがより好ましい。
【0046】
方法(III):
システム2において、膜タンパク質13がイオンチャネル型膜タンパク質13Aであり、脂質二分子膜14上に、膜タンパク質を透過するイオン38を含む緩衝液15が配置されており、図8に示すように、伸展手段20により脂質二分子膜14を伸展して、第1の電極16および第2の電極17間の電流を測定する。
伸展手段20により脂質二分子膜14を伸展すると、その刺激に伴ってイオンチャネル型膜タンパク質13Aの構造が変化し、膜貫通部分のイオンチャネルが開いて穴部11にイオン38が流入する。このイオン38の流入により、第1の電極16および第2の電極17間で電流が検出されるので、脂質二分子膜14の伸展によるイオンチャネル型膜タンパク質13Aの活性の変化を測定できる。
【0047】
イオン38は、方法(II−1)で挙げたイオン31と同じものが使用できる。
緩衝液15中のイオン38の濃度は、電流が充分に検出できる量であればよく、1nM〜500mMが好ましく、10μM〜150mMがより好ましい。
穴部11の内部には、緩衝液を配置しておく。穴部11の内部に配置する緩衝液は、脂質二分子膜14上に配置する緩衝液15と同じ緩衝液であることが好ましい。
【0048】
以上説明した本発明の膜タンパク質機能測定システムおよび膜タンパク質機能測定方法によれば、膜タンパク質機能測定基板の穴部上に設けた脂質二分子膜を伸展したときの膜タンパク質の活性の変化を測定することができる。また、方法(I)と、方法(II)または方法(III)との併用、すなわち、AFMなどの観察手段と、光学的もしくは電気的な活性の測定を併用することにより、脂質二分子膜を伸展したときの該脂質二分子膜中の受容体の密度変化と活性の関係を測定することができる。
【0049】
尚、本発明の膜タンパク質機能測定方法は、前述の方法には限定されない。例えば、方法(I)においてイオンチャネル型膜タンパク質のみを用いてもよく、代謝型膜タンパク質のみを用いてもよい。また、方法(II)、方法(III)において、膜タンパク質としてイオンチャネル型膜タンパク質と代謝型膜タンパク質の両方を用いて測定してもよい。
【実施例】
【0050】
以下、実施例及び比較例を示して本発明を詳細に説明する。ただし、本発明は以下の記載によっては限定されない。
本実施例における蛍光像の観察は、共焦点レーザースキャン顕微鏡(商品名:LSM510、ツァイス製)を用いて行った。
【0051】
[実験例1]
卵黄由来のフォスファチジルコリンをクロロホルムに溶解し、アルゴンガス雰囲気下で乾燥し、最終濃度160μg/mLで緩衝液(10mMTris−HCl、pH7.4)に溶解した。該緩衝液を超音波破砕機で処理し、脂質小胞を作製した。次いで、前記脂質小胞に、20質量%のフルオレセインで蛍光標識した脂質(フルオレセイン結合ジヘキサデカノイルグリセロフォスフォエタノールアミン)を最終濃度40μg/mLとなるように加えて、さらに脂質小胞を作製することで、蛍光により観察可能な脂質二分子膜を作製した。該脂質小胞を含む緩衝液に蛍光色素(アレクサ647、最大励起波長650nm、最大蛍光波長668nm、He−Neレーザ使用、最終濃度500μM)を混合し、その状態で穴部(ナノウェル)を有する基板へのベシクルフュージョンを行った。その後、該基板の蛍光像を観察したところ、基板の穴部にてアレクサ647由来の蛍光が観察された(図9(a)、測定領域500×500μm)。基板上に配置した前記緩衝液を、脂質を含まない緩衝液(10mMTris−HCl、pH7.4)で10回置換し、不要物を除去した。その後、該基板の蛍光像を観察したところ、脂質二分子膜が基板に接着している様子が観察され、脂質二分子膜で覆われた部分(図9(b))の穴部にのみアレクサ647由来の蛍光が観察されたことから、該穴部は脂質二分子膜で充分に覆われて密閉されていることが分かった。
【0052】
[実験例2]
ジパルミトイルフォスファチジルコリン、1,2−ジラウロイル−sn−グリセロ−3−フォスフェート、1,2−ジパルミトイル−sn−グリセロ−3−フォスフォチオエタノールを75:23:2の比率で混合し、200μg/mLの濃度で緩衝液(10mMTris−HCl、pH7.4)に溶解して脂質小胞を作製した。該脂質小胞を含む緩衝液を、穴部(ナノウェル)を有する基板に滴下し、穴部を覆う脂質二分子膜を作製し、該脂質二分子膜をAFMの深針により伸展し、AFMにより観察した(図10)。図10における秒数は、伸展の開始時を0秒とした観察経過時間を意味する。
穴部を覆う脂質二分子膜は、その高さ情報から、平らに形成されていることが分かった(図10(a)、15秒)。AFMの深針による機械刺激を次第に強くしていくと、穴部を覆った脂質二分子膜は該穴部の内部側へと押し伸ばされた(図10(a)、15秒〜215秒)。その後、機械刺激を弱くしていくと、押し伸ばされた脂質二分子膜は元のように平らになった(図10(a)、215〜255秒)。このように、本条件では伸展刺激を与えている状態でも、脂質二分子膜が移動することなく基板に接着していることがわかった。
一方、平らに戻った脂質二分子膜に対し、さらに強く機械刺激を加えていくと、最後には穴部を覆っている脂質二分子膜が破れ(図10(b)、110秒)、穴部の左方向に向かって脂質二分子膜が引き剥がされた(図10(b)、140秒)。このとき、高さ情報から穴部では、脂質二分子膜が破れている状態であることがわかった。
【0053】
[実施例1]
バクテリオロドプシン(BR)75質量%および脂質二分子膜25質量%の複合体膜(紫膜)を5μg/mLの濃度で緩衝液(10mMTris−HCl、pH8.0、1MKCl)に溶解し、マイカ基板上に滴下して、30分間室温で静置した。その後、紫膜を含まない緩衝液で10回置換し、マイカ基板に接着していない紫膜を洗い流した。マイカ基板に接着した紫膜は高さが均一な膜状の構造(図11(a)、(b))であり、拡大すると分子が規則的に並んでいる様子が観察された(図11(c))。この観察結果を、D. J. Muller等の研究結果(Journal of Molecular Biology (1999) 285, 1903-1909)と比較したところ、図11(c)における領域X内の分子は三量体のBRタンパク質であると考えられた。
一方、穴部を有する基板に、前記と同様に紫膜を接着させ、該穴部上にあるBRタンパク質の観察を行った(図12、(a))。穴部を覆う紫膜は平らではなく撓んだ状態であった(図12、(b))。この状態でも、個々のBRタンパク質の三量体が観察できた(図12(c)、領域Y)。この観察では、AFMの深針により脂質二分子膜を伸展する刺激によっては、BRタンパク質の顕著な構造変化は観察されず、三量体構造が保たれていた。対照的に、三量体構造間の距離は大きく変化しており、脂質二分子膜内におけるBRタンパク質の局在は変化することが明らかとなった。
このように、本発明の測定方法により、脂質二分子膜を伸展した状態で、膜タンパク質の構造や、膜タンパク質同士の位置関係を観察することができた。
【0054】
[実施例2]
卵黄由来フォスファチジルコリンを160μg/mLの濃度で緩衝液(10mMTris−HCl、pH7.4)に溶解し、穴部を有する基板上に滴下して、該穴部上に脂質二分子膜を作製し、該脂質二分子膜にNMDA受容体を含むプロテオリポソームを融合して受容体を挿入した。穴部の内部には、カルシウム感受性蛍光色素であるfluo−4(10μM)を加え、穴部の外部の緩衝液(10mMTris−HCl、pH7.4)には2mMCaCl2を加えた。脂質二分子膜を伸展(開始時を0秒)すると、観察領域の蛍光強度が増加した(図13(a))。この時の基板の状態を蛍光観察すると、穴部において脂質二分子膜の伸展に伴った蛍光が観測された(図13(b))。この結果、NMDA受容体は脂質二分子膜の伸展により活性化し、穴部外部に存在するカルシウムイオンを穴部内部に透過したことが明らかとなった。
【0055】
[実施例3]
穴部の内部および外部にそれぞれ電極を設けた以外は、実施例2と同様にして穴部にNMDA受容体を含む脂質二分子膜を作製した。AFMの深針により該脂質二分子膜を伸展したところ、電極間の電流値が変化した(図13(c))。
脂質二分子膜には精製したNMDA受容体を挿入していることから、この電流値の変化は脂質二分子膜の伸展によりNMDA受容体が活性化したためであると考えられた。
【産業上の利用可能性】
【0056】
本発明は、脂質二分子膜の伸展に関係する膜タンパク質の機能を解析するための測定システムおよび測定方法として有用であり、例えば、心筋梗塞や高血圧など、体内における脂質二分子膜の伸展に関わる膜タンパク質のスクリーニングシステムとして好適に利用できる。
【符号の説明】
【0057】
1、1A〜1E、2 膜タンパク質機能測定システム 10 膜タンパク質機能測定用基板 11 穴部 12 基板本体 13 膜タンパク質 13A イオンチャネル型膜タンパク質 13B 代謝型膜タンパク質 14 脂質二分子膜 15 緩衝液 16 第1の電極 17 第2の電極 20 伸展手段 31 イオン 32 イオン感受性蛍光色素 33 核酸 34 核酸結合性蛍光色素 35 リガンド分子 36 細胞質抽出画分 37 カルシウムイオン感受性蛍光色素 38 イオン
【特許請求の範囲】
【請求項1】
穴部を有する基板本体の、該穴部の開口が膜タンパク質を含む脂質二分子膜に覆われており、該脂質二分子膜上に緩衝液が配置された膜タンパク質機能測定用基板と、
前記脂質二分子膜を伸展する伸展手段と、
を具備する膜タンパク質機能測定システム。
【請求項2】
前記伸展手段が走査プローブ顕微鏡の深針である、請求項1に記載の膜タンパク質機能測定システム。
【請求項3】
更に、前記脂質二分子膜の表面構造を観察する観察手段を具備する、請求項1または2に記載の膜タンパク質機能測定システム。
【請求項4】
更に、前記基板における前記穴部の外部に設けられた第1の電極と、前記穴部の内部に設けられた第2の電極とを具備する、請求項1〜3のいずれかに記載の膜タンパク質機能測定システム。
【請求項5】
請求項1〜3のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、
前記膜タンパク質がイオンチャネル型膜タンパク質であり、
前記穴部の内部に、膜タンパク質を透過するイオンに結合して蛍光を発するイオン感受性蛍光色素が配置され、かつ前記脂質二分子膜上に、膜タンパク質を透過するイオンを含む緩衝液が配置されており、
前記伸展手段により前記脂質二分子膜を伸展して、前記イオンチャネル型膜タンパク質のイオンの透過を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【請求項6】
請求項1〜3のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、
前記膜タンパク質がイオンチャネル型膜タンパク質であり、
前記穴部の内部に、核酸が配置され、かつ前記脂質二分子膜上に、核酸に結合して蛍光が増強する核酸結合性蛍光色素を含む緩衝液が配置されており、
前記伸展手段により前記脂質二分子膜を伸展して、前記イオンチャネル型膜タンパク質の前記核酸結合性蛍光色素の透過を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【請求項7】
請求項1〜3のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、
前記膜タンパク質がイオンチャネル型膜タンパク質であり、
前記穴部の内部に、蛍光標識した細胞外情報伝達物質が配置されており、
前記伸展手段により前記脂質二分子膜を伸展して、前記細胞外情報伝達物質の前記穴部の内部から外部への前記イオンチャネル型膜タンパク質を介した移動を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【請求項8】
請求項1〜3のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、
前記膜タンパク質が代謝型膜タンパク質であり、
前記穴部の内部に、細胞質抽出画分、およびカルシウムイオンに結合して蛍光を発するカルシウムイオン感受性蛍光色素が配置されており、
前記伸展手段により前記脂質二分子膜を伸展して、細胞内シグナル伝達系を介した小胞体からのカルシウムイオンの放出を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【請求項9】
請求項4に記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、
前記膜タンパク質がイオンチャネル型膜タンパク質であり、
前記脂質二分子膜上に、膜タンパク質を透過するイオンを含む緩衝液が配置されており、
前記伸展手段により前記脂質二分子膜を伸展して、前記第1の電極および第2の電極の間を流れる電流を測定して、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【請求項1】
穴部を有する基板本体の、該穴部の開口が膜タンパク質を含む脂質二分子膜に覆われており、該脂質二分子膜上に緩衝液が配置された膜タンパク質機能測定用基板と、
前記脂質二分子膜を伸展する伸展手段と、
を具備する膜タンパク質機能測定システム。
【請求項2】
前記伸展手段が走査プローブ顕微鏡の深針である、請求項1に記載の膜タンパク質機能測定システム。
【請求項3】
更に、前記脂質二分子膜の表面構造を観察する観察手段を具備する、請求項1または2に記載の膜タンパク質機能測定システム。
【請求項4】
更に、前記基板における前記穴部の外部に設けられた第1の電極と、前記穴部の内部に設けられた第2の電極とを具備する、請求項1〜3のいずれかに記載の膜タンパク質機能測定システム。
【請求項5】
請求項1〜3のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、
前記膜タンパク質がイオンチャネル型膜タンパク質であり、
前記穴部の内部に、膜タンパク質を透過するイオンに結合して蛍光を発するイオン感受性蛍光色素が配置され、かつ前記脂質二分子膜上に、膜タンパク質を透過するイオンを含む緩衝液が配置されており、
前記伸展手段により前記脂質二分子膜を伸展して、前記イオンチャネル型膜タンパク質のイオンの透過を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【請求項6】
請求項1〜3のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、
前記膜タンパク質がイオンチャネル型膜タンパク質であり、
前記穴部の内部に、核酸が配置され、かつ前記脂質二分子膜上に、核酸に結合して蛍光が増強する核酸結合性蛍光色素を含む緩衝液が配置されており、
前記伸展手段により前記脂質二分子膜を伸展して、前記イオンチャネル型膜タンパク質の前記核酸結合性蛍光色素の透過を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【請求項7】
請求項1〜3のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、
前記膜タンパク質がイオンチャネル型膜タンパク質であり、
前記穴部の内部に、蛍光標識した細胞外情報伝達物質が配置されており、
前記伸展手段により前記脂質二分子膜を伸展して、前記細胞外情報伝達物質の前記穴部の内部から外部への前記イオンチャネル型膜タンパク質を介した移動を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【請求項8】
請求項1〜3のいずれかに記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、
前記膜タンパク質が代謝型膜タンパク質であり、
前記穴部の内部に、細胞質抽出画分、およびカルシウムイオンに結合して蛍光を発するカルシウムイオン感受性蛍光色素が配置されており、
前記伸展手段により前記脂質二分子膜を伸展して、細胞内シグナル伝達系を介した小胞体からのカルシウムイオンの放出を蛍光強度の変化から測定し、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【請求項9】
請求項4に記載の膜タンパク質機能測定システムを用いた膜タンパク質の機能の測定方法であって、
前記膜タンパク質がイオンチャネル型膜タンパク質であり、
前記脂質二分子膜上に、膜タンパク質を透過するイオンを含む緩衝液が配置されており、
前記伸展手段により前記脂質二分子膜を伸展して、前記第1の電極および第2の電極の間を流れる電流を測定して、膜タンパク質の機能を測定する膜タンパク質機能測定方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2011−22076(P2011−22076A)
【公開日】平成23年2月3日(2011.2.3)
【国際特許分類】
【出願番号】特願2009−169079(P2009−169079)
【出願日】平成21年7月17日(2009.7.17)
【出願人】(000004226)日本電信電話株式会社 (13,992)
【Fターム(参考)】
【公開日】平成23年2月3日(2011.2.3)
【国際特許分類】
【出願日】平成21年7月17日(2009.7.17)
【出願人】(000004226)日本電信電話株式会社 (13,992)
【Fターム(参考)】
[ Back to top ]

