血液粘性測定装置
【課題】 血液の流速と血管の太さを測定して血液の粘性を決定すること。
【解決手段】
本願の血液粘性測定装置は、血液の流速と、血管の太さと、血圧を所定の計算式に代入して血液の粘性を算出する。血液の流速は、血流に超音波の連続波を送信し、その反射連続波の周波数の変化量から求める。血管の太さは、血管に超音波のパルス波を送信し、血管の内壁で反射された反射パルス波から内径を求める。一方、血圧は、一般の血圧計などにより測定した値を利用する。血液粘性測定装置は、以上のようにして取得した値のうち、最大流速、最大内径、最大血圧を後述の計算式に入力して血液の粘性を算出する。本願の血液粘性測定装置では、血液流速測定用の超音波送受信素子と血管内径測定用の超音波送受信素子を同一センサに組み込むことができ、同時に同一部位の血液流速と血管内径を測定することができる。このため、血液粘性度の測定精度を向上させることができる。
【解決手段】
本願の血液粘性測定装置は、血液の流速と、血管の太さと、血圧を所定の計算式に代入して血液の粘性を算出する。血液の流速は、血流に超音波の連続波を送信し、その反射連続波の周波数の変化量から求める。血管の太さは、血管に超音波のパルス波を送信し、血管の内壁で反射された反射パルス波から内径を求める。一方、血圧は、一般の血圧計などにより測定した値を利用する。血液粘性測定装置は、以上のようにして取得した値のうち、最大流速、最大内径、最大血圧を後述の計算式に入力して血液の粘性を算出する。本願の血液粘性測定装置では、血液流速測定用の超音波送受信素子と血管内径測定用の超音波送受信素子を同一センサに組み込むことができ、同時に同一部位の血液流速と血管内径を測定することができる。このため、血液粘性度の測定精度を向上させることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血液粘性測定装置に関し、例えば、人体の血液の粘性を非侵襲的に測定するものに関する。
【背景技術】
【0002】
血液を用いた健康状態の検査は広く行われているが、正確な検査のためには血液成分の数値だけでなく、血液の流れ方、即ち血液のレオロジー(流動性)が重要である。
そして、血液のレオロジーを表す指標の1つには血液の粘性があり、一般に「血液のサラサラ度、ドロドロ度」などと呼ばれている。
【0003】
血液の粘性は、人体から採血した血液の粘度をマイクロ流路を用いた測定装置や粘度計測器などで測定することが従来より行われている。
ところが、このように採血を伴う方法は、実施するのに資格が必要であり、血液の流れやすさを日常的にチェックするのは困難であるという問題があった。
そのため、近年では、本出願人による次の特許文献1に示すように、非侵襲で(即ち、生体を切開したり針を刺したりせずに)血液の流速を測定する装置が提案されている。
【0004】
【特許文献1】特開2003−204964公報
【0005】
この技術は、血液に超音波を送信し、その反射波の周波数の変化量から、血液の流速を非侵襲で測定するものである。血液はある方向に流れているので、これに超音波が反射すると、ドップラー効果により反射波の周波数が変化する。この周波数の変化量から血液の流速を求めることができるのである。
【0006】
また、特許文献1の技術では、異なる2方向に反射される反射波をそれぞれ受信し、これらの反射波の周波数の変化量からセンサと血管の成す角度(血液の流れている方向)を測定することができる。そして、測定した角度を考慮することにより流速をより正確に求めている。そして、測定した血液の流速により粘性を推し量ることができる。
【発明の開示】
【発明が解決しようとする課題】
【0007】
ところが、研究を進めるうちに、血液の流速は血液の粘性のみならず、血管の太さにも依存するということがわかった。
即ち、粘性の低い血液でも細い血管では流速が小さくなり、粘性の高い血液でも太い血管では流速が速くなる。
そのため、血液の粘性をより正確に評価するためには、流速だけでなく血管の太さをも測定し、考慮する必要があるという問題が新たに発見された。
【0008】
そこで、本発明の目的は、血液の流速と血管の太さを測定して血液の粘性を決定することである。
【課題を解決するための手段】
【0009】
本発明は、前記目的を達成するために、血管の内部を流れる血液の流速を計測する流速計測手段と、前記計測した流速に対応する前記血管の内径を計測する内径計測手段と、前記計測した流速と内径を用いて前記血液の粘性を決定する粘性決定手段と、を具備したことを特徴とする血液粘性測定装置を提供する(第1の構成)。
第1の構成において、前記計測した流速に対応する前記血管の血圧を取得する血圧取得手段を具備し、前記粘性決定手段は、前記取得した血圧を用いて粘性を決定するように構成することもできる(第2の構成)。
第2の構成において、前記粘性決定手段は、前記計測した流速、前記内径、及び前記取得した血圧のうち、それぞれの最大値を用いて粘性を決定するように構成することもできる(第3の構成)。
第2の構成、又は第3の構成において、前記血圧取得手段は、前記流速と前記内径の計測時と時間差をおいて計測した血圧を取得するように構成することもできる(第4の構成)。
第1の構成から第4の構成において、生体表面から前記血液に連続波を送信する連続波送信手段と、前記送信した連続波のうち、前記血液で反射された反射波を受信する連続波受信手段と、を具備し、前記流速計測手段は、前記受信した2方向の反射波の周波数変化量を用いて流速を算出するように構成することもできる(第5の構成)。
第1の構成から第5の構成において、生体表面から前記血管にパルス波を送信するパルス波送信手段と、前記送信したパルス波のうち、前記血管で反射された反射波を受信するパルス波受信手段と、を具備し、前記内径計測手段は、前記受信したパルス波を用いて前記血管の内径を算出するように構成することもできる(第6の構成)。
第6の構成において、生体表面から生体内に波動を送信する波動送信素子と、前記波動送信素子に連続波とパルス波を選択的に発生させる素子駆動手段と、を具備し、前記素子駆動手段で前記波動送信素子における連続波とパルス波の発生を切り替えることにより、前記波動送信素子は前記流速計測手段で使用する連続波と前記内径計測手段で使用するパルス波を送信するように構成することもできる(第7の構成)。
第2の構成から第7の構成において、定数の入力を受け付ける定数入力受付手段を具備し、前記粘性決定手段は、粘性をη、流速をV、内径をR、血圧をP、前記定数をkとして、粘性をη=k×R2×P÷Vなる式で算出するように構成することもできる(第8の構成)。
【発明の効果】
【0010】
本発明によると、血液の流速と血管の太さを測定して血液の粘性を決定することかできる。
【発明を実施するための最良の形態】
【0011】
(実施の形態の概要)
本実施の形態の血液粘性測定装置は、血液の流速と、血管の太さと、血圧を所定の計算式に代入して血液の粘性を算出する。
血液の流速は、血流に超音波の連続波を送信し、その反射連続波の周波数の変化量(ドップラーシフト)から求める。この測定方法は特許文献1で提案されているものを利用する。
血管の太さは、血管に超音波のパルス波を送信し、血管の内壁で反射された反射パルス波(エコー)から内径を求める。
一方、血圧は、一般の血圧計などにより測定した値を利用する。
【0012】
血液粘性測定装置は、以上のようにして取得した値のうち、最大流速、最大内径、最大血圧を後述の計算式に入力して血液の粘性を算出する。
ここで、各値の最大値を用いたのは、最大血圧時には、血液の流速も血管の内径も最大になるので、変動するこれらの値のうち対応するものを取得できるからである。
【0013】
本実施の形態の血液粘性測定装置では、血液流速測定用の超音波送受信素子と血管内径測定用の超音波送受信素子を同一センサに組み込むことができ、同時に同一部位の血液流速と血管内径を測定することができる。このため、血液粘性度の測定精度を向上させることができる。
また、本実施の形態の血液粘性測定装置は、非侵襲で血液粘性度を測定することができ、また小型化することができる。そのため、ユーザは、家庭などにおいて日常生活の中で血液の状態を日々確認することができ、手軽に健康管理を行うことかできる。
【0014】
(実施の形態の詳細)
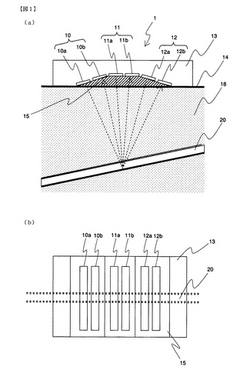
図1は、血液粘性測定装置のセンサ部を示した図であり、図1(a)はセンサ部の断面を示しており、図1(b)はセンサ部の底面(人体に接する面)を示している。
また、図1(a)では、センサ部1が装着された皮膚14、生体内18、血管20も図示してある。
【0015】
センサ部1は、血液の流速と血管の太さ(内径)をセンシングするセンサであって、例えば、人体の手首、指先、腕などに装着される。
より具体的には、例えば、センサ部1をサック状に形成し、ユーザがこれに指先を挿入したり、あるいはセンサ部1をベルトに設置し、このベルトを手首や腕に装着するように構成することができる。
【0016】
更には、センサ部1や後述する計測システムを腕時計に組み込むことも可能である。この場合、腕時計は時間計測モードと血液粘性計測モードを切り替えることができるようになっており、ユーザは腕時計を装着したまま血液粘性計測モードにて粘性の計測を行うことができる。
【0017】
センサ部1は、基底部13、送信素子10aと受信素子10bから成る送受信素子10、送信素子11aと受信素子11bから成る送受信素子11、送信素子12aと受信素子12bから成る送受信素子12、及び整合部15などから構成されている。送信素子10a、11a、12a、は波動送信素子を構成しており、受信素子10b、11b、12bは波動受信素子を構成している。
基底部13は、樹脂などの個体により構成されており、人体に接する方向の面において送受信素子10、送受信素子11、送受信素子12を所定位置に保持する。
【0018】
送受信素子10、送受信素子11、及び送受信素子12を構成する各素子は何れも圧電素子によって構成されており、超音波の送受信に用いられる。
これらのうち、送受信素子10と送受信素子12は血液の流速の測定に用いられ、送受信素子11は血管の内径の測定に用いられる。
【0019】
より詳細には、送受信素子10において、送信素子10aは超音波の連続波(以下、単に連続波と記す)を生体内18に送信する。この連続波は、血管20を流れる血流により反射され、受信素子10bにて受信される。
反射される連続波の周波数は、血液の流速によるドップラー効果により変化しており、この周波数の変化量(ドップラーシフト)を用いて血液の流速を求めることができる。
【0020】
同様に、送受信素子12において、送信素子12aが送信する連続波は血管20を流れる血流により反射され受信素子12bで受信される。
詳細は後述するが、送受信素子10と送受信素子12は、基底部13において所定角度を持って固定されており、血管20に対して異なる方向から連続波を送信するようになっている。これによって、センサ部1と血管20の成す角度を計算することができ、より正確に血液の流速を計算することができる。
【0021】
一方、送受信素子11において、送信素子11aは、超音波によるパルス波(以下、パルス波)を生体内18に送信する。このパルス波は血管20の外壁と内壁により反射され、受信素子11bで受信される。このようにして、センサ部1は、血管20による反射パルス波を検出することができる。
【0022】
送受信素子10、11、12の超音波送受信側の面には整合部15が設けられている。
整合部15は樹脂などの超音波伝達媒体により構成されており、センサ部1と生体内18とのインピーダンスを調節する音響整合層を構成している。
より詳細には、整合部15は、送受信素子10〜送受信素子12のインピーダンスと生体内18のインピーダンスの中間程度のインピーダンスを持つ媒体により構成するのが望ましい。
【0023】
このように、超音波の伝達経路におけるインピーダンスを変化を緩和することにより、センサ部1と生体内18との間での超音波の反射などを低減することができ、超音波の伝達効率を改善することができる。
【0024】
次に、図2を用いて血管20を流れる血液の流速の測定原理について説明する。
図2(a)は、図1におけるセンサ部1と血管20の角度の関係を示しており、図2(b)は、更に、送受信素子10と送受信素子12との角度関係を含め、これらの角度関係を抽出した図である。
【0025】
図に示したように、送受信素子10、送受信素子11、送受信素子12は、血管20の同じ部位における血液の流速と血管20の内径を計測するように配設されている。
そして、送受信素子11がパルス波を送信する方向と血管20の成す角度をγとし、送受信素子10が連続波を送信する方向と血管20の成す方向をθとする。
また、送受信素子10、送受信素子12が生体内18の表面と成す角度をそれぞれα、βとする。
【0026】
以上のように角度を設定し、送受信素子10で検出された周波数の変化量をΔf1、送受信素子12で検出された周波数の変化量をΔf2とすると、これらの変化量は次の式(1)、(2)で与えられる。
【0027】
Δf1=2×v×cosθ×F÷c・・・(1)
Δf2=2×v×cos(θ+α+β)×F÷c・・・(2)
【0028】
以上の式(1)、(2)において、cは生体内18での音速であり約1530[m/s]である。また、Fは生体内18の内部に送信した超音波の周波数であり、vは血液の流速である。式(1)、(2)からθは次の式(3)で表される。
【0029】
tanθ=(Δf2÷Δf1−cos(θ+α+β))÷c・・・(3)
【0030】
このように一度θが求まると、これを(1)に適用して血液の流速vを求めることができる。
また、γは次の式(4)により求めることができる。このγは血管の内径を算出するのに用いられる。
【0031】
γ=θ+α・・・(4)
【0032】
以上のようにして、送受信素子10と送受信素子12で検出した周波数の変化量から、血管20の流速vと、血管20がセンサ部1と成す角度(生体内18での方向)であるθ、γを算出することができる。
【0033】
次に、図3を用いて血管の内径を測定する原理について説明する。
ここで、センサ部1と血管20の位置関係は図2(a)と同じであるとする。
図3(a)は、送信素子11aが送信するパルス波を示しており、図3(b)は、受信素子11bが受信する反射パルス波を示している。何れも、縦軸はパルスの大きさを電圧で示しており、横軸は時間を示している。また、図3(a)、(b)の時間軸は一致させてある。
【0034】
送信素子11aがパルス波22を生体内18の内部に送信すると、血管20で反射された反射パルス波23a〜23dが受信素子11bで受信される。
血管20の形状のうち、センサ部1側の部分の外壁と内壁、及びこの部分と対向する部分の内壁と外壁で反射されたパルス波がこの順序で受信される。また、血管20は管状の形状を有しているため、側面で反射された反射パルス波は生体内18に拡散されてしまう。
【0035】
そのため、反射パルス波23aは、血管20の外壁のうち皮膚14に近い部分で反射されたものであり、反射パルス波23bは、血管20の内壁のうち皮膚14に近い部分から反射されたものであり、反射パルス波23cは、血管20の内壁のうち皮膚14から遠い部分で反射されたものであり、反射パルス波23dは血管20のうち皮膚14から遠い部分で反射されたものであることがわかる。
【0036】
このように、反射パルス波23bと反射パルス波23cが血管20の内壁からのものである。反射パルス23bが受信されてからパルス波23cが受信されるまでの時間差をΔtとすると内径Rは次の式(5)で表される。
【0037】
R=c×Δt×sinγ÷2・・・(5)
【0038】
ここで、γは式(4)により求められるので、Δtを計測することにより式(5)により血管20の内径を算出することができる。
【0039】
次に、図4のブロック図を用いて血液粘性測定装置のシステム構成について説明する。
図4に示したように、本実施の形態の血液粘性測定装置は、センサ部1、回路部2、演算部3、出力部4から構成されている。
センサ部1については既に説明したので、ここでは、回路部2、演算部3、出力部4について説明する。
【0040】
回路部2は、センサ部1を駆動すると共に、センサ部1で検出された信号を演算部3に伝達する機能部であり、連続駆動回路31、受信回路32、受信回路33、パルス駆動回路34、受信回路35などから構成されている。
【0041】
連続駆動回路31は、送信素子10a、送信素子12aと接続しており、これらの素子を駆動して連続波を発生させる。連続駆動回路31により駆動される連続波の周波数は一般に10〜20[MHz]程度であるが、ここでは一例として15[MHz]とする。連続駆動回路31は、連続波送信手段を構成している。
【0042】
超音波は、周波数が高くなると分解能が高くなるが、生体内18に浸透する距離が短くなり、逆に周波数が低くなると生体内18に浸透する距離が長くなるが分解能が低下するという性質があるため、これらの性質を考慮して適当な周波数が選択される。
【0043】
受信回路32は、受信素子10bと接続しており、送信素子10aの出力した連続波の反射連続波を受信して演算部3に出力する。
受信回路33は、受信素子12bと接続しており、送信素子12aの出力した連続波の反射連続波を受信して演算部3に出力する。
受信回路32と受信回路33は、連続波受信手段を構成している。
【0044】
パルス駆動回路34は、送信素子11aに接続しており、これを駆動してパルス波を発生させる。パルス駆動回路34が発生させるパルスの間隔は1[msec]程度に設定されている。パルス駆動回路34はパルス送信手段を構成している。
受信回路35は、受信素子11bに接続しており、送信素子11aの出力したパルス波の反射パルス波を受信して演算部3に出力する。受信回路35はパルス受信手段を構成している。
【0045】
送信素子11aがパルスを発生してから、反射パルスが戻ってくるまでの時間間隔は一般に20〜30[μsec]程度であり、この間隔よりもパルスの発生間隔を十分に長くすることにより、反射パルス波が受信される前に次のパルスを発生するのを防止することができる。これにより、受信された反射パルス波が、何れの時点で送信したパルス波によるものか識別することができる。
【0046】
なお、図示しないが、受信素子10b〜12bと回路部2の間にはそれぞれフィルタが設置されており、対応する送信素子以外の送信素子による反射波が受信されるのを防止してある。
【0047】
演算部3は、周波数変化量検出部41、42、流速出力部43、内径算出部44、粘性計算部45などから構成されている。
周波数変化量検出部41は、受信回路32と接続しており、受信回路32から受信素子10bで検出された反射連続波の周波数を取得する。
【0048】
そして、周波数変化量検出部41は、送信素子10aが生体内18に送信した連続波の周波数と、受信回路32から取得した反射連続波の周波数を比較し、送受信素子10における周波数の変化量を検出する。
周波数変化量検出部41は、送信素子10aが送信する連続波の周波数を記憶しておいても良いし、あるいは、連続駆動回路31から取得するように構成しても良い。
【0049】
周波数変化量検出部42は、受信回路33と接続しており、受信回路33から受信素子12bで検出された反射連続波の周波数を取得する。
そして、周波数変化量検出部41と同様にして、送受信素子12における周波数の変化量を検出する。
【0050】
流速出力部43は、周波数変化量検出部41から送受信素子10における周波数の変化量を取得し、周波数変化量検出部42から送受信素子12における周波数の変化量を取得する。
そして、流速出力部43は、これらの値を式(3)、(4)に代入して血流のv(血液の流速)、θ、γを算出する。流速出力部43は流速計測手段を構成している。
【0051】
内径算出部44は、受信回路35に接続されており、受信回路35から反射パルス波を取得して血管20の内径を算出する。
内径算出部44は、受信回路35から出力されたデータからΔtを検出し、これを式(5)に代入して内径を算出する。また、内径計算で必要な角度であるγは流速出力部43より取得する。内径算出部44は内径計測手段を構成している。
【0052】
粘性計算部45は、流速出力部43より血液の流速を取得し、内径算出部44より血管20の内径を取得し、更に血圧データ47を外部より取得し、これらのデータを用いて血液の粘性を算出する。粘性計算部45は、粘性決定手段を構成している。
【0053】
血圧データ47は、一般の血圧計などを用いて測定した値をユーザが入力するようになっている。このため、演算部3に数値を入力するためのキーボードなどのユーザインターフェースを備えることができる。又はインターフェースを介して血圧計と接続しても良い。
なお、本実施の形態では、後述するように最高血圧を用いて粘性を算出するように構成されているため、血圧データ47として少なくとも最高血圧が入力されるようになっている。このように演算部3は血圧取得手段を備えている。
【0054】
ここで、粘性計算部45が血液の粘性を算出する原理について説明する。
図5(a)は、粘性計算部45が流速出力部43から取得した流速の時間変化を表した図である。なお、縦軸は流速を表しており、横軸は時間を表している。
この図に示したように、流速出力部43で検出される流速は心臓の心拍に伴って上下し拍動している。
【0055】
粘性計算部45は、流速出力部43から取得した流速データから流速の最大値Vmaxを取得する。Vmaxを取得するための流速の最大値は、心拍毎に検出された最大値のうちの何れでも良い。なお、流速データから心拍毎に最大流速を抽出し、これを平均してVmaxとしても良い。
【0056】
図5(b)は、粘性計算部45が内径算出部44から取得した内径の時間変換を表した図である。なお、縦軸は流速を表しており、横軸は時間を表している。更に、時間軸は図5(a)に一致させてある。血管20の内径も心臓の心拍に伴って上下しており、血流が最大となるときに内径も最大となるというように、血流の変化と内径の変化は対応している。
【0057】
粘性計算部45は、内径算出部44から取得した内径データから内径の最大値Rmaxを取得する。なお、Rmaxを取得するための内径の最大値は、図5(a)のVmaxに一致する時刻における値とする。
これにより、粘性計算部45は、血流の最大値Vmaxに対応する内径の最大値Rmaxを取得することができる。
【0058】
なお、Rmaxとしては、内径データから最大値を抽出し、これを平均したものを用いても良い。
粘性測定に要する時間は10秒程度であり、この間に血流の状態が大きく変わることはないため、血管の内径Rmaxは、Vmaxと同時刻のものとする必要はなく、他の内径の最大値をRmaxとすることも可能である。
【0059】
血流速度がVmax、内径がRmaxとなるときの血圧は最大血圧であると考えられるので、粘性計算部45は、血圧データ47による最大血圧を取得して、これをVmax、Rmax取得時の血圧Pmaxとする。
【0060】
なお、本実施の形態では、流速と内径の測定と、血圧の測定と、を別々に行うため、血圧測定による流速、内径の変化を考慮する必要はない。
血圧の測定は、腕を圧迫するなどして血流に変化を生じさせるため、流速、内径の測定を行った後に、血圧の測定を行うのが望ましい。
【0061】
粘性計算部45は、このようにしてVmax、Rmax、及びPmaxを取得すると、これを次の式(6)に代入して血液の粘性ηを算出する。ただし、kは定数である。
【0062】
η=k×(Rmax)2×Pmax÷Vmax・・・(6)
【0063】
なお、式(6)の粘性計算では、流速、内径、血圧の最大値を用いたが、これは、最大値を用いると値対応する流速、内径、血圧の値の取得が容易であるためである。即ち、流速が最大なるときに、内径、血圧も最大になると考えられるため、流速最大値における内径、血圧をそれぞれ最大内径、最大血圧とすることができる。
【0064】
式(6)は、これら最大値でなくても一般に成り立つ式であり、ある流速における内径と血圧がわかる場合は、これらを式(6)に代入して粘性を求めることができる。
【0065】
ところで、式(6)は、ハーゲン・ポアズイユの式から類推して本願発明者らが求めたものである。
ハーゲン・ポアズイユの式とは、ニュートン流体が一定半径Rを有する管内を流れる場合に、その流速を求める式であり、次の式(7)で与えられる。
【0066】
V=R2×(P1−P2)÷(4×η×l)・・・(7)
【0067】
ここで、P1は上流側のある点での流体の圧力、P2は下流側のある点での流体の圧力、lはこの2点間の距離、ηは粘性である。
ハーゲン・ポワズイユの式(7)によると、流体の粘性は、輸送管の断面積と流体の圧力に比例し、流速に反比例することから、粘性を求める式(6)を見いだした。
【0068】
式(6)で導入した定数kは、粘性ηの測定値を校正するのに用いることができる。
即ち、図6を用いて後述するように、ユーザはkを設定することによって、医療機関などで測定した粘性の値と、本願の血液粘性測定装置による測定値を一致させることができる。これについてはより詳細に後述する。
そして、粘性計算部45は、式(6)によって算出した粘性の値ηを出力部4に出力する。
【0069】
演算部3は、以上のようにして粘性ηを算出するために、例えば、CPU(Central Processing Unit)、ROM(Read Only Memory)、RAM(Random Access Memory)、EEPROM(Electrically Erasable and Programmable ROM)などのハードウェアを備えている。
【0070】
CPUは中央処理装置であって、ROM、RAM、EEPROMなどに記憶されているプログラムに従って、各種の演算処理、演算部3全体の制御、回路部2や出力部4とのデータの送受信の制御などを行う。
ROMは、演算部3を機能させるための基本的にパラメータやプログラムなどを記憶した読み出し専用の記憶媒体である。CPUは、これらのパラメータやプログラムを用いて、血液粘性測定装置の起動時にこれを初期状態に設定するなどする。
【0071】
RAMは随時読み出し書き込みが可能な記憶媒体である。RAMは、例えば、CPUが血液の粘性を算出する際に、受信回路32、受信回路33、内径算出部44から取得してデータを記憶するためのエリアを提供したり、また、これらのエリアに記憶されたデータを用いて粘性を算出する際のワーキングエリアを提供する。
【0072】
EEPROMは、電気的な操作によって、後からデータを書き換えたり消去したりすることが可能なROMである。
本実施の形態では、EEPROMには、演算部3を機能させるための基本的なプログラムであるOS(Operating System)や、血液の粘性を算出するための血液粘性算出プログラムなどが記憶されている他、式(6)で用いる定数kの値も記憶されている。
【0073】
CPUは、血液粘性プログラムを実行することにより、周波数変化量検出部41、周波数変化量検出部42、内径算出部44、流速出力部43、粘性計算部45などの各機能部がソフトウェア的に構成される。
【0074】
また、演算部3に、ハードディスクなどの大容量の記憶媒体を備え、ユーザの日々の粘性を蓄積するように構成することもできる。
更に、演算部3に、入出力インターフェースを備え、粘性データを外部のコンピュータなどに出力したり、あるいは、外部からデータやプログラムを読み込むように構成することもできる。
【0075】
また、フレキシブルディスク、光磁気ディスク、半導体メモリなどで構成された外部記憶媒体を駆動する記憶媒体駆動装置を演算部3に備え、粘性データをこれらの外部記憶媒体に書き込んだり、あるいは、外部記憶媒体に書き込まれたデータやプログラムを読み込んだりできるように構成することもできる。
【0076】
以上は、演算部3のハードウェア的な構成の一例であって、これは演算部3の構成を限定するものではなく、周波数変化量検出部41〜粘性計算部45を形成するものであれはどのようなものでも良い。
【0077】
また、センサ部1の出力はアナログデータであり、演算部3で処理するデータはデジタルデータであるので、何れかの段階でアナログデータをサンプリングしてデジタルデータに変換する必要があるが、これは、回路部2で行うように構成しても良いし、あるいは演算部3で行うように構成しても良い。
【0078】
次に出力部4について説明する。出力部4は、結果表示部49を備えており、粘性計算部45から出力された粘性ηを表示する。
表示装置は、例えば、液晶ディスプレイ、プラズマディスプレイ、CRTディスプレイなどで構成されており、ηの値を数値で表示する。また、ηの値をグラフやその他の図表、記号などを用いて表示することも可能である。
【0079】
次に、図6のグラフを用いて定数kの校正の一例を説明する。
図6の縦軸は、医療機関などに設置されている他の血液粘性測定装置による粘性の測定値の大きさを表しており、横軸は本願の血液粘性測定装置による粘性の測定値の大きさを表している。
【0080】
そして、グラフ上には異なる粘性を有する流体の各サンプルについて両測定器による測定値をプロットしてある。
このように、プロットした点は直線上にのっている。このため、定数kの値を適当に設定すれば、両測定器による測定値が一致するように校正することができる。
【0081】
そのため、例えば、ユーザは、行きつけの医療機関などに設置されている他の血液粘性測定装置で粘性を測定すると共に、本願の血液粘性測定装置で粘性を測定し、両者の値が同じになるように定数kを設定して記憶させれば、以後本願の血液粘性測定装置で粘性を測定することができる。
【0082】
血液の粘性を測定する方法はいくつかあり、測定方法や血液粘性測定装置により測定値が異なる場合がある。
そのため、このように測定値の校正機能を持たせることにより、特定の血液粘性測定装置に対応するように本願の血液粘性測定装置を調節することができ、例えば、自宅において、行きつけの病院と同じ条件で血液の粘性を測定することができるようになる。
なお、本願の血液粘性測定装置の出荷時には、設計で定めたデフォルト値が記憶されている。
【0083】
次に、本願の血液粘性測定装置による粘性測定の手順を図7のフローチャートを用いて説明する。
まず、演算部3がセンサ部1を駆動し、送受信素子10、送受信素子12による流速の測定と、送受信素子11による内径の測定を開始する(ステップ5)。
【0084】
次に、回路部2は、これらの測定値をセンサ部1から受信し、演算部3に出力する。演算部3は、回路部2よりこれらの測定値を受信し、RAMなどの記憶装置に記憶する(ステップ10)。
この、測定値を記憶装置に格納する処理は、粘性の測定に必要な測定値が蓄積される間(例えば、10秒間程度)継続され、終了する(ステップ15)。
【0085】
次に、演算部3は、ユーザからの血圧値の入力を受け付け、これを取得して記憶する(ステップ20)。
次に、演算部3は、記憶した測定値から、最大血圧値、最大流速、最大内径を特定し(ステップ25)、これらの測定値を用いて粘性を算出する(ステップ30)。算出した粘性は、出力部4にて出力される。
【0086】
以上、本実施の形態について説明したが、これにより次のような効果を得ることができる。
(1)非侵襲にて血液の粘性を測定することができる。
(2)血液の流速と血管の太さ(内径)を考慮して粘性を求めるため、より正確な粘性を測定することができる。
【0087】
(3)血圧、流速、内径の最大値を特定して粘性を測定するため、血圧、流速、内径の対応する値を用いて粘性を計算することができる。
(4)定数kの設定により、測定値を校正することができる。
(5)センサ部1、回路部2、演算部3、出力部4の何れも小型化が可能なため、ユーザが家庭などに設置して手軽に粘性を測定することができる。また、腕時計などに装着して、随時粘性を測定することができる。
【0088】
なお、本実施の形態では、流速、内径、圧力をパラメータとして粘性を算出したが、圧力を用いずに流速と内径を用いて大まかな粘性の値を求めるように校正することもできる。この場合は、例えば、式(6)においてPmaxをkに含めることにより粘性を算出することができる。
【0089】
この場合、粘性の測定値に血圧変動分の誤差は生じるものの、血圧は短期間に大きく変動することは少ないため、短期間に渡って粘性の推移を大まかに測定したい場合などに有効である。
【0090】
また、本実施の形態では、血液の流速や血管の内径を計測するのに超音波を用いたが、これは計測用の波動を超音波に限定するものではなく、例えば、レーザなど他の波動を用いて計測を行うことも可能である。
【0091】
(変形例1)
次に、本実施の形態の変形例1について説明する。
図8は、変形例1の粘性測定装置に係るセンサ部の構造を示した断面図である。
変形例1は、送受信素子11で連続波とパルス波を選択的に発生させることにより、送受信素子11が血液の流速を測定する機能と血管の内径を測定する機能を兼ね備えるものである。
なお、以降では、先に説明した実施の形態と対応する機能部には同じ符号を付し、実施の形態と同じ動作を行うものについてはその説明を簡略化、あるいは省略することにする。
【0092】
送受信素子10は、実施の形態と同様に超音波の連続波を生体内18に送出し、血管20を流れる血液の血流による周波数の変化を測定時間に渡って継続的に測定する。
送受信素子11は、測定が開始されると一定時間連続波を生体内18に送出し、その後パルス波を送出する。
【0093】
送受信素子11が一定時間送出した連続波と、送受信素子10による連続波により血流の測定に必要な血管20の角度θが式(3)により計算される。一旦θを求めた後は、送受信素子10での検出値を式(1)に適用することにより血液の流速を算出することができる。
【0094】
そして、送受信素子11が連続波に引き続き送出したパルス波により血管20の内径を測定することができる。
このように、血管20の角度θの算出に必要な測定値は、送受信素子11が連続波を送出している間に取得できてしまうため、その後は、送受信素子11の送出するパルス波と送受信素子10が送出する連続波によって粘性の測定を行うことができる。
【0095】
次に、図9のブロック図を用いて変形例1に係る血液粘性測定装置のシステム構成について説明する。
変形例1の血液粘性測定装置は、センサ部1、回路部2、演算部3、出力部4から構成されている。
【0096】
連続駆動回路31は、送信装置10aに接続すると共に、切替回路51を介して送信素子12aに接続している。
また、パルス駆動回路34は、切替回路51を介して送信素子12aに接続している。
【0097】
切替回路51は、送信素子12aを駆動する回路を選択する回路であり、切替回路51を切り替えることにより、送信素子12aを連続駆動回路31又はパルス駆動回路34で駆動することができる。
そして、送信素子12aは、連続駆動回路31によって駆動されているときは生体内18に連続波を送信し、パルス駆動回路34によって駆動されているときはパルス波を送信する。
このように、連続駆動回路31、パルス駆動回路34、及び切替回路51により、連続波とパルス波を選択的に発生される素子駆動手段が構成される。
【0098】
受信回路33は、切替回路52を介して受信素子12bに接続し、また、受信回路35も切替回路52を介して受信素子12bに接続している。
切替回路52は、受信素子12bで検出された反射波を受信する受信回路を選択する回路であり、切替回路52を切り替えることにより、受信回路33、又は受信回路35で反射波が受信される。
【0099】
回路部2は、切替回路51と切替回路52を同期して切り替えを行い、送信素子12aが連続駆動回路31により駆動されているときは、受信素子12bを受信回路33に接続し、送信素子12aがパルス駆動回路34により駆動されているときは、受信素子12bを受信回路35に接続する。
【0100】
このため、送信素子12aが連続波を送信している場合、受信素子12bで受信された反射連続波は受信回路33を介して周波数変化量検出部42に出力され、送信素子12aがパルス波を送信している場合、受信素子12bで受信された反射パルス波は受信回路35を介して内径算出部44に出力される。
このようにして、回路部2は送受信素子12を連続波モード及びパルス波モードに切り替えて、血液の流速の測定と、血管の内径の測定の双方に使用する。
【0101】
図10は、粘性測定時に送受信素子12から送信される超音波のモード切替を説明するための図である。
図10において、縦軸は送信波の出力の大きさを電圧で表しており、横軸は時間を示している。
【0102】
図10に示したように、変形例1の回路部2は、測定開始してから時間T1の間は送受信素子12を連続波モードで駆動し、その後時間T2の間はパルス波モードで駆動する。そして、再び連続波モードに切り替えて、これを時間T3の間継続する。
【0103】
変形例1では、一例として、T1、及びT3は1秒程度とし、T2は10秒程度とした。また、パルス波モードにおいてパルス波の間隔は0.1[msec]程度である。
なお、図示しないが、送受信素子10の方は、測定開始から測定終了まで連続波を送信する。
【0104】
変形例1の血液粘性測定装置は、測定開始後T1の間は、送受信素子10と送受信素子12からの信号を用いてθを算出する。
そして、変形例1の血液粘性測定装置は、時間T2の間は、送受信素子10からの信号により血液の流速を測定し、送受信素子12からの信号により血管20の内径を測定する。
【0105】
そして、変形例1の血液粘性測定装置は、時間T3の間に再度θの測定を行い、時間T1で測定θと一致するか確認する。
変形例1の演算部3は、θが一致する場合はこのθを用いて粘性を計算し、θが一致しない場合は、θの平均値を用いて粘性を計算するか又は再測定とする。
【0106】
以上に説明した変形例1では、センサ部1に装備する送受信素子を2つ(送受信素子10と送受信素子12)にすることができる。
このため、血液粘性測定装置の製造コストを低減することができる。
【0107】
(変形例2)
次に、本実施の形態の変形例2について説明する。
図11は、変形例2の粘性測定装置に係るセンサ部の構造を示した断面図である。
変形例2は、変形例1と同様に送信素子11aを連続波モードとパルス波モードで駆動するが、送信素子10aは装備せず、送信素子10aでの連続波の送信は行わない。
【0108】
送信素子11aは、例えば、0.1[msec]ごとに連続波とパルス波を交互に生体内18に送信する。
送信素子11aが連続波を送信している場合、変形例2の血液粘性測定装置は、血流による反射連続波を受信素子10b、11bで受信し、これら受信した反射連続波の周波数の変化量から血液の流速を求める。
【0109】
送信素子11aがパルス波を送信している場合、変形例2の血液粘性測定装置は、血管20による反射パルス波を受信素子11bで受信し、これを用いて血管20の内径を測定する。なお、受信素子11aで反射パルス波を受信し、これによって血管20の内径を測定するように構成することもできる。
【0110】
次に、図12のブロック図を用いて変形例2に係る血液粘性測定装置のシステム構成について説明する。
変形例2の血液粘性測定装置は、センサ部1、回路部2、演算部3、出力部4から構成されている。
【0111】
連続駆動回路31は、切替回路51を介して送信素子12aに接続している。
また、パルス駆動回路34も、切替回路51を介して送信素子12aに接続している。
【0112】
切替回路51は、送信素子12aを駆動する回路を選択する回路であり、切替回路51を切り替えることにより、送信素子12aを連続駆動回路31又はパルス駆動回路34で駆動することができる。
そして、送信素子12aは、連続駆動回路31によって駆動されているときは生体内18に連続波を送信し、パルス駆動回路34によって駆動されているときはパルス波を送信する。
【0113】
受信回路33は、切替回路52を介して受信素子12bに接続し、また、受信回路35も切替回路52を介して受信素子12bに接続している。
切替回路52は、受信素子12bで検出された反射波を受信する受信回路を選択する回路であり、切替回路52を切り替えることにより、受信回路33、又は受信回路35で反射波が受信される。
【0114】
回路部2は、切替回路51と切替回路52を同期して切り替え、送信素子12aが連続駆動回路31により駆動されているときは、受信素子12bを受信回路33に接続し、送信素子12aがパルス駆動回路34により駆動されているときは、受信素子12bを受信回路35に接続する。
【0115】
このため、送信素子12aが連続波を送信している場合、受信素子10bで受信された連続波は受信回路32を介して周波数変化量検出部41に出力され、一方、受信素子12bで受信された反射連続波は受信回路33を介して周波数変化量検出部42に出力される。これにより血液の流速が算出される。
【0116】
また、送信素子12aがパルス波を送信している場合、受信素子12bで反射パルス波が受信され、受信回路35を介して内径算出部44に出力される。これによって血管20の内径が算出される。
このようにして、回路部2は送受信素子12を連続波モード及びパルス波モードに切り替えて、血液の流速の測定と、血管の内径の測定の双方に使用する。
【0117】
図13は、粘性測定時に送受信素子12から送信される超音波のモード切替を説明するための図である。
図10において、縦軸は送信波の出力の大きさを電圧で表しており、横軸は時間を示している。
【0118】
図10に示したように、変形例2の回路部2は、測定開始してから時間T4ごとにパルス波モードと連続波モードを切り替え、血液の流速の測定と血管20の内径の測定を交互に行う。T4は例えば、0.1[msec]程度である。
【0119】
このように、変形例2では、血液の流速を測定している間は血管20の内径を測定することができず、逆に血管20の内径を測定している間は血液の流速を測定することはできない。即ち、血液の流速と血管20の内径を同時に測定することはできない。
【0120】
しかし、10秒程度の測定時間中に血液の流速や血管20の状態が大きく変化することは考えにくいため、このように、T4ごとに血液の流速と血管20の内径を交互に測定するようにしても正確な粘性を測定することができる。
また、センサ部1において変形例1の発振素子10aを省略することができ、更にコストの低減を図ることができる。
【0121】
(血管内径の測定方法の変形例)
以上に説明した実施の形態及び変形例1、2では、式(5)にて血管20の内径の算出を行ったが、ここで、他の方法により血管20を内径を計測する方法について説明する。
【0122】
ここでは、血管20の太さが太いほど反射パルス波の強度が大きくなることを利用して血管20の内径を見積もる。
図14は、図1においてセンサ部1を血管20の方向に見たところを示した断面図である。
送受信素子11が送信したパルス波は血管20に当たり反射するが、血管20の部分のうち、センサ部1に面する部分60の面積が広いほど反射パルス波の強度が大きくなる。
【0123】
一般に、血管20は管状形状を有しているため、反射パルス波の強度を血管20の太さに対応すると考えられる。また、測定部位を特定すれば、血管壁の厚さの個人差は小さいと考えられるため、反射パルス波の強度を血管20の内径に対応させることが可能である。
【0124】
図15(a)は、本変形例において、送信素子aが送出するパルス波を示しており、図15(b)は、受信素子11bが受信する反射パルス波を示している。
何れも縦軸は強度を電圧にて表しており、横軸は時間を表している。また、両者の時間軸は一致させてある。
図15(b)に示したΔVは、血管20の部分60による反射パルス波の強度を示しており、本変形例はこのΔVから血管の太さを求めるものである。
【0125】
多くのサンプルを用いて反射パルス波の強度と血管20の内径の関係を統計的に分析し、これをデータベース化しておけば、反射パルス波の強度から血管20の内径を推測することが可能となる。
なお、なお、血管20の内壁から反射された反射パルス波を用いて血管20の内径を推定することも可能である。
【0126】
図16は、水中に各太さのチューブを沈め、これによる反射パルス波の電圧を計測してプロットしたグラフである。縦軸に反射パルス波の出力電圧をとり、横軸にチューブ径をとっている。
図に示したように、チューブ径0.5[mm]のチューブに対しては、0.2[mVpp]程度の出力電圧が得られ、1.0[mm]のチューブに対しては、0.3[mVpp]程度の出力電圧が得られている。
【0127】
同様に、2.0[mm]、3.0[mm]とチューブ径が増すと、反射パルス波の出力電圧も増している。
そして、これらのデータは、略直線上に存在している。このため、反射パルス波の出力電圧からチューブ径を推定することが可能となる。
血管20に対しても血管径と反射パルス波の出力電圧について同様の関係が成り立つと考えられるため、反射パルス波の電圧から血管径を推定することが可能となる。
【図面の簡単な説明】
【0128】
【図1】血液粘性測定装置のセンサ部を示した図である。
【図2】血液の流速を測定する原理を説明するための図である。
【図3】血管の内径を測定する原理を説明するための図である。
【図4】血液粘性測定装置の構成を説明するためのブロック図である。
【図5】血液の流速の時間変化を示した図である。
【図6】血液粘性測定装置の校正について説明するための図である。
【図7】血液粘性測定装置による粘性測定の手順を説明するためのフローチャートである。
【図8】変形例1の粘性測定装置に係るセンサ部の構造を示した断面図である。
【図9】変形例1の粘性測定装置の構成を説明するためのブロック図である。
【図10】変形例1における超音波のモード切替を説明するための図である。
【図11】変形例2の粘性測定装置に係るセンサ部の構造を示した断面図である。
【図12】変形例2の粘性測定装置の構成を説明するためのブロック図である。
【図13】変形例2における超音波のモード切替を説明するための図である。
【図14】血管内径の測定方法の変形例に係る原理を説明するための図である。
【図15】血管内径の測定方法の変形例における反射パルス波を示した図である。
【図16】血管内径の測定方法の変形例における実験データを示したグラフ図である。
【符号の説明】
【0129】
1 センサ部
2 回路部
3 演算部
4 出力部
10 送受信素子
11 送受信素子
12 送受信素子
13 基底部
14 皮膚
15 整合部
18 生体内
20 血管
【技術分野】
【0001】
本発明は、血液粘性測定装置に関し、例えば、人体の血液の粘性を非侵襲的に測定するものに関する。
【背景技術】
【0002】
血液を用いた健康状態の検査は広く行われているが、正確な検査のためには血液成分の数値だけでなく、血液の流れ方、即ち血液のレオロジー(流動性)が重要である。
そして、血液のレオロジーを表す指標の1つには血液の粘性があり、一般に「血液のサラサラ度、ドロドロ度」などと呼ばれている。
【0003】
血液の粘性は、人体から採血した血液の粘度をマイクロ流路を用いた測定装置や粘度計測器などで測定することが従来より行われている。
ところが、このように採血を伴う方法は、実施するのに資格が必要であり、血液の流れやすさを日常的にチェックするのは困難であるという問題があった。
そのため、近年では、本出願人による次の特許文献1に示すように、非侵襲で(即ち、生体を切開したり針を刺したりせずに)血液の流速を測定する装置が提案されている。
【0004】
【特許文献1】特開2003−204964公報
【0005】
この技術は、血液に超音波を送信し、その反射波の周波数の変化量から、血液の流速を非侵襲で測定するものである。血液はある方向に流れているので、これに超音波が反射すると、ドップラー効果により反射波の周波数が変化する。この周波数の変化量から血液の流速を求めることができるのである。
【0006】
また、特許文献1の技術では、異なる2方向に反射される反射波をそれぞれ受信し、これらの反射波の周波数の変化量からセンサと血管の成す角度(血液の流れている方向)を測定することができる。そして、測定した角度を考慮することにより流速をより正確に求めている。そして、測定した血液の流速により粘性を推し量ることができる。
【発明の開示】
【発明が解決しようとする課題】
【0007】
ところが、研究を進めるうちに、血液の流速は血液の粘性のみならず、血管の太さにも依存するということがわかった。
即ち、粘性の低い血液でも細い血管では流速が小さくなり、粘性の高い血液でも太い血管では流速が速くなる。
そのため、血液の粘性をより正確に評価するためには、流速だけでなく血管の太さをも測定し、考慮する必要があるという問題が新たに発見された。
【0008】
そこで、本発明の目的は、血液の流速と血管の太さを測定して血液の粘性を決定することである。
【課題を解決するための手段】
【0009】
本発明は、前記目的を達成するために、血管の内部を流れる血液の流速を計測する流速計測手段と、前記計測した流速に対応する前記血管の内径を計測する内径計測手段と、前記計測した流速と内径を用いて前記血液の粘性を決定する粘性決定手段と、を具備したことを特徴とする血液粘性測定装置を提供する(第1の構成)。
第1の構成において、前記計測した流速に対応する前記血管の血圧を取得する血圧取得手段を具備し、前記粘性決定手段は、前記取得した血圧を用いて粘性を決定するように構成することもできる(第2の構成)。
第2の構成において、前記粘性決定手段は、前記計測した流速、前記内径、及び前記取得した血圧のうち、それぞれの最大値を用いて粘性を決定するように構成することもできる(第3の構成)。
第2の構成、又は第3の構成において、前記血圧取得手段は、前記流速と前記内径の計測時と時間差をおいて計測した血圧を取得するように構成することもできる(第4の構成)。
第1の構成から第4の構成において、生体表面から前記血液に連続波を送信する連続波送信手段と、前記送信した連続波のうち、前記血液で反射された反射波を受信する連続波受信手段と、を具備し、前記流速計測手段は、前記受信した2方向の反射波の周波数変化量を用いて流速を算出するように構成することもできる(第5の構成)。
第1の構成から第5の構成において、生体表面から前記血管にパルス波を送信するパルス波送信手段と、前記送信したパルス波のうち、前記血管で反射された反射波を受信するパルス波受信手段と、を具備し、前記内径計測手段は、前記受信したパルス波を用いて前記血管の内径を算出するように構成することもできる(第6の構成)。
第6の構成において、生体表面から生体内に波動を送信する波動送信素子と、前記波動送信素子に連続波とパルス波を選択的に発生させる素子駆動手段と、を具備し、前記素子駆動手段で前記波動送信素子における連続波とパルス波の発生を切り替えることにより、前記波動送信素子は前記流速計測手段で使用する連続波と前記内径計測手段で使用するパルス波を送信するように構成することもできる(第7の構成)。
第2の構成から第7の構成において、定数の入力を受け付ける定数入力受付手段を具備し、前記粘性決定手段は、粘性をη、流速をV、内径をR、血圧をP、前記定数をkとして、粘性をη=k×R2×P÷Vなる式で算出するように構成することもできる(第8の構成)。
【発明の効果】
【0010】
本発明によると、血液の流速と血管の太さを測定して血液の粘性を決定することかできる。
【発明を実施するための最良の形態】
【0011】
(実施の形態の概要)
本実施の形態の血液粘性測定装置は、血液の流速と、血管の太さと、血圧を所定の計算式に代入して血液の粘性を算出する。
血液の流速は、血流に超音波の連続波を送信し、その反射連続波の周波数の変化量(ドップラーシフト)から求める。この測定方法は特許文献1で提案されているものを利用する。
血管の太さは、血管に超音波のパルス波を送信し、血管の内壁で反射された反射パルス波(エコー)から内径を求める。
一方、血圧は、一般の血圧計などにより測定した値を利用する。
【0012】
血液粘性測定装置は、以上のようにして取得した値のうち、最大流速、最大内径、最大血圧を後述の計算式に入力して血液の粘性を算出する。
ここで、各値の最大値を用いたのは、最大血圧時には、血液の流速も血管の内径も最大になるので、変動するこれらの値のうち対応するものを取得できるからである。
【0013】
本実施の形態の血液粘性測定装置では、血液流速測定用の超音波送受信素子と血管内径測定用の超音波送受信素子を同一センサに組み込むことができ、同時に同一部位の血液流速と血管内径を測定することができる。このため、血液粘性度の測定精度を向上させることができる。
また、本実施の形態の血液粘性測定装置は、非侵襲で血液粘性度を測定することができ、また小型化することができる。そのため、ユーザは、家庭などにおいて日常生活の中で血液の状態を日々確認することができ、手軽に健康管理を行うことかできる。
【0014】
(実施の形態の詳細)
図1は、血液粘性測定装置のセンサ部を示した図であり、図1(a)はセンサ部の断面を示しており、図1(b)はセンサ部の底面(人体に接する面)を示している。
また、図1(a)では、センサ部1が装着された皮膚14、生体内18、血管20も図示してある。
【0015】
センサ部1は、血液の流速と血管の太さ(内径)をセンシングするセンサであって、例えば、人体の手首、指先、腕などに装着される。
より具体的には、例えば、センサ部1をサック状に形成し、ユーザがこれに指先を挿入したり、あるいはセンサ部1をベルトに設置し、このベルトを手首や腕に装着するように構成することができる。
【0016】
更には、センサ部1や後述する計測システムを腕時計に組み込むことも可能である。この場合、腕時計は時間計測モードと血液粘性計測モードを切り替えることができるようになっており、ユーザは腕時計を装着したまま血液粘性計測モードにて粘性の計測を行うことができる。
【0017】
センサ部1は、基底部13、送信素子10aと受信素子10bから成る送受信素子10、送信素子11aと受信素子11bから成る送受信素子11、送信素子12aと受信素子12bから成る送受信素子12、及び整合部15などから構成されている。送信素子10a、11a、12a、は波動送信素子を構成しており、受信素子10b、11b、12bは波動受信素子を構成している。
基底部13は、樹脂などの個体により構成されており、人体に接する方向の面において送受信素子10、送受信素子11、送受信素子12を所定位置に保持する。
【0018】
送受信素子10、送受信素子11、及び送受信素子12を構成する各素子は何れも圧電素子によって構成されており、超音波の送受信に用いられる。
これらのうち、送受信素子10と送受信素子12は血液の流速の測定に用いられ、送受信素子11は血管の内径の測定に用いられる。
【0019】
より詳細には、送受信素子10において、送信素子10aは超音波の連続波(以下、単に連続波と記す)を生体内18に送信する。この連続波は、血管20を流れる血流により反射され、受信素子10bにて受信される。
反射される連続波の周波数は、血液の流速によるドップラー効果により変化しており、この周波数の変化量(ドップラーシフト)を用いて血液の流速を求めることができる。
【0020】
同様に、送受信素子12において、送信素子12aが送信する連続波は血管20を流れる血流により反射され受信素子12bで受信される。
詳細は後述するが、送受信素子10と送受信素子12は、基底部13において所定角度を持って固定されており、血管20に対して異なる方向から連続波を送信するようになっている。これによって、センサ部1と血管20の成す角度を計算することができ、より正確に血液の流速を計算することができる。
【0021】
一方、送受信素子11において、送信素子11aは、超音波によるパルス波(以下、パルス波)を生体内18に送信する。このパルス波は血管20の外壁と内壁により反射され、受信素子11bで受信される。このようにして、センサ部1は、血管20による反射パルス波を検出することができる。
【0022】
送受信素子10、11、12の超音波送受信側の面には整合部15が設けられている。
整合部15は樹脂などの超音波伝達媒体により構成されており、センサ部1と生体内18とのインピーダンスを調節する音響整合層を構成している。
より詳細には、整合部15は、送受信素子10〜送受信素子12のインピーダンスと生体内18のインピーダンスの中間程度のインピーダンスを持つ媒体により構成するのが望ましい。
【0023】
このように、超音波の伝達経路におけるインピーダンスを変化を緩和することにより、センサ部1と生体内18との間での超音波の反射などを低減することができ、超音波の伝達効率を改善することができる。
【0024】
次に、図2を用いて血管20を流れる血液の流速の測定原理について説明する。
図2(a)は、図1におけるセンサ部1と血管20の角度の関係を示しており、図2(b)は、更に、送受信素子10と送受信素子12との角度関係を含め、これらの角度関係を抽出した図である。
【0025】
図に示したように、送受信素子10、送受信素子11、送受信素子12は、血管20の同じ部位における血液の流速と血管20の内径を計測するように配設されている。
そして、送受信素子11がパルス波を送信する方向と血管20の成す角度をγとし、送受信素子10が連続波を送信する方向と血管20の成す方向をθとする。
また、送受信素子10、送受信素子12が生体内18の表面と成す角度をそれぞれα、βとする。
【0026】
以上のように角度を設定し、送受信素子10で検出された周波数の変化量をΔf1、送受信素子12で検出された周波数の変化量をΔf2とすると、これらの変化量は次の式(1)、(2)で与えられる。
【0027】
Δf1=2×v×cosθ×F÷c・・・(1)
Δf2=2×v×cos(θ+α+β)×F÷c・・・(2)
【0028】
以上の式(1)、(2)において、cは生体内18での音速であり約1530[m/s]である。また、Fは生体内18の内部に送信した超音波の周波数であり、vは血液の流速である。式(1)、(2)からθは次の式(3)で表される。
【0029】
tanθ=(Δf2÷Δf1−cos(θ+α+β))÷c・・・(3)
【0030】
このように一度θが求まると、これを(1)に適用して血液の流速vを求めることができる。
また、γは次の式(4)により求めることができる。このγは血管の内径を算出するのに用いられる。
【0031】
γ=θ+α・・・(4)
【0032】
以上のようにして、送受信素子10と送受信素子12で検出した周波数の変化量から、血管20の流速vと、血管20がセンサ部1と成す角度(生体内18での方向)であるθ、γを算出することができる。
【0033】
次に、図3を用いて血管の内径を測定する原理について説明する。
ここで、センサ部1と血管20の位置関係は図2(a)と同じであるとする。
図3(a)は、送信素子11aが送信するパルス波を示しており、図3(b)は、受信素子11bが受信する反射パルス波を示している。何れも、縦軸はパルスの大きさを電圧で示しており、横軸は時間を示している。また、図3(a)、(b)の時間軸は一致させてある。
【0034】
送信素子11aがパルス波22を生体内18の内部に送信すると、血管20で反射された反射パルス波23a〜23dが受信素子11bで受信される。
血管20の形状のうち、センサ部1側の部分の外壁と内壁、及びこの部分と対向する部分の内壁と外壁で反射されたパルス波がこの順序で受信される。また、血管20は管状の形状を有しているため、側面で反射された反射パルス波は生体内18に拡散されてしまう。
【0035】
そのため、反射パルス波23aは、血管20の外壁のうち皮膚14に近い部分で反射されたものであり、反射パルス波23bは、血管20の内壁のうち皮膚14に近い部分から反射されたものであり、反射パルス波23cは、血管20の内壁のうち皮膚14から遠い部分で反射されたものであり、反射パルス波23dは血管20のうち皮膚14から遠い部分で反射されたものであることがわかる。
【0036】
このように、反射パルス波23bと反射パルス波23cが血管20の内壁からのものである。反射パルス23bが受信されてからパルス波23cが受信されるまでの時間差をΔtとすると内径Rは次の式(5)で表される。
【0037】
R=c×Δt×sinγ÷2・・・(5)
【0038】
ここで、γは式(4)により求められるので、Δtを計測することにより式(5)により血管20の内径を算出することができる。
【0039】
次に、図4のブロック図を用いて血液粘性測定装置のシステム構成について説明する。
図4に示したように、本実施の形態の血液粘性測定装置は、センサ部1、回路部2、演算部3、出力部4から構成されている。
センサ部1については既に説明したので、ここでは、回路部2、演算部3、出力部4について説明する。
【0040】
回路部2は、センサ部1を駆動すると共に、センサ部1で検出された信号を演算部3に伝達する機能部であり、連続駆動回路31、受信回路32、受信回路33、パルス駆動回路34、受信回路35などから構成されている。
【0041】
連続駆動回路31は、送信素子10a、送信素子12aと接続しており、これらの素子を駆動して連続波を発生させる。連続駆動回路31により駆動される連続波の周波数は一般に10〜20[MHz]程度であるが、ここでは一例として15[MHz]とする。連続駆動回路31は、連続波送信手段を構成している。
【0042】
超音波は、周波数が高くなると分解能が高くなるが、生体内18に浸透する距離が短くなり、逆に周波数が低くなると生体内18に浸透する距離が長くなるが分解能が低下するという性質があるため、これらの性質を考慮して適当な周波数が選択される。
【0043】
受信回路32は、受信素子10bと接続しており、送信素子10aの出力した連続波の反射連続波を受信して演算部3に出力する。
受信回路33は、受信素子12bと接続しており、送信素子12aの出力した連続波の反射連続波を受信して演算部3に出力する。
受信回路32と受信回路33は、連続波受信手段を構成している。
【0044】
パルス駆動回路34は、送信素子11aに接続しており、これを駆動してパルス波を発生させる。パルス駆動回路34が発生させるパルスの間隔は1[msec]程度に設定されている。パルス駆動回路34はパルス送信手段を構成している。
受信回路35は、受信素子11bに接続しており、送信素子11aの出力したパルス波の反射パルス波を受信して演算部3に出力する。受信回路35はパルス受信手段を構成している。
【0045】
送信素子11aがパルスを発生してから、反射パルスが戻ってくるまでの時間間隔は一般に20〜30[μsec]程度であり、この間隔よりもパルスの発生間隔を十分に長くすることにより、反射パルス波が受信される前に次のパルスを発生するのを防止することができる。これにより、受信された反射パルス波が、何れの時点で送信したパルス波によるものか識別することができる。
【0046】
なお、図示しないが、受信素子10b〜12bと回路部2の間にはそれぞれフィルタが設置されており、対応する送信素子以外の送信素子による反射波が受信されるのを防止してある。
【0047】
演算部3は、周波数変化量検出部41、42、流速出力部43、内径算出部44、粘性計算部45などから構成されている。
周波数変化量検出部41は、受信回路32と接続しており、受信回路32から受信素子10bで検出された反射連続波の周波数を取得する。
【0048】
そして、周波数変化量検出部41は、送信素子10aが生体内18に送信した連続波の周波数と、受信回路32から取得した反射連続波の周波数を比較し、送受信素子10における周波数の変化量を検出する。
周波数変化量検出部41は、送信素子10aが送信する連続波の周波数を記憶しておいても良いし、あるいは、連続駆動回路31から取得するように構成しても良い。
【0049】
周波数変化量検出部42は、受信回路33と接続しており、受信回路33から受信素子12bで検出された反射連続波の周波数を取得する。
そして、周波数変化量検出部41と同様にして、送受信素子12における周波数の変化量を検出する。
【0050】
流速出力部43は、周波数変化量検出部41から送受信素子10における周波数の変化量を取得し、周波数変化量検出部42から送受信素子12における周波数の変化量を取得する。
そして、流速出力部43は、これらの値を式(3)、(4)に代入して血流のv(血液の流速)、θ、γを算出する。流速出力部43は流速計測手段を構成している。
【0051】
内径算出部44は、受信回路35に接続されており、受信回路35から反射パルス波を取得して血管20の内径を算出する。
内径算出部44は、受信回路35から出力されたデータからΔtを検出し、これを式(5)に代入して内径を算出する。また、内径計算で必要な角度であるγは流速出力部43より取得する。内径算出部44は内径計測手段を構成している。
【0052】
粘性計算部45は、流速出力部43より血液の流速を取得し、内径算出部44より血管20の内径を取得し、更に血圧データ47を外部より取得し、これらのデータを用いて血液の粘性を算出する。粘性計算部45は、粘性決定手段を構成している。
【0053】
血圧データ47は、一般の血圧計などを用いて測定した値をユーザが入力するようになっている。このため、演算部3に数値を入力するためのキーボードなどのユーザインターフェースを備えることができる。又はインターフェースを介して血圧計と接続しても良い。
なお、本実施の形態では、後述するように最高血圧を用いて粘性を算出するように構成されているため、血圧データ47として少なくとも最高血圧が入力されるようになっている。このように演算部3は血圧取得手段を備えている。
【0054】
ここで、粘性計算部45が血液の粘性を算出する原理について説明する。
図5(a)は、粘性計算部45が流速出力部43から取得した流速の時間変化を表した図である。なお、縦軸は流速を表しており、横軸は時間を表している。
この図に示したように、流速出力部43で検出される流速は心臓の心拍に伴って上下し拍動している。
【0055】
粘性計算部45は、流速出力部43から取得した流速データから流速の最大値Vmaxを取得する。Vmaxを取得するための流速の最大値は、心拍毎に検出された最大値のうちの何れでも良い。なお、流速データから心拍毎に最大流速を抽出し、これを平均してVmaxとしても良い。
【0056】
図5(b)は、粘性計算部45が内径算出部44から取得した内径の時間変換を表した図である。なお、縦軸は流速を表しており、横軸は時間を表している。更に、時間軸は図5(a)に一致させてある。血管20の内径も心臓の心拍に伴って上下しており、血流が最大となるときに内径も最大となるというように、血流の変化と内径の変化は対応している。
【0057】
粘性計算部45は、内径算出部44から取得した内径データから内径の最大値Rmaxを取得する。なお、Rmaxを取得するための内径の最大値は、図5(a)のVmaxに一致する時刻における値とする。
これにより、粘性計算部45は、血流の最大値Vmaxに対応する内径の最大値Rmaxを取得することができる。
【0058】
なお、Rmaxとしては、内径データから最大値を抽出し、これを平均したものを用いても良い。
粘性測定に要する時間は10秒程度であり、この間に血流の状態が大きく変わることはないため、血管の内径Rmaxは、Vmaxと同時刻のものとする必要はなく、他の内径の最大値をRmaxとすることも可能である。
【0059】
血流速度がVmax、内径がRmaxとなるときの血圧は最大血圧であると考えられるので、粘性計算部45は、血圧データ47による最大血圧を取得して、これをVmax、Rmax取得時の血圧Pmaxとする。
【0060】
なお、本実施の形態では、流速と内径の測定と、血圧の測定と、を別々に行うため、血圧測定による流速、内径の変化を考慮する必要はない。
血圧の測定は、腕を圧迫するなどして血流に変化を生じさせるため、流速、内径の測定を行った後に、血圧の測定を行うのが望ましい。
【0061】
粘性計算部45は、このようにしてVmax、Rmax、及びPmaxを取得すると、これを次の式(6)に代入して血液の粘性ηを算出する。ただし、kは定数である。
【0062】
η=k×(Rmax)2×Pmax÷Vmax・・・(6)
【0063】
なお、式(6)の粘性計算では、流速、内径、血圧の最大値を用いたが、これは、最大値を用いると値対応する流速、内径、血圧の値の取得が容易であるためである。即ち、流速が最大なるときに、内径、血圧も最大になると考えられるため、流速最大値における内径、血圧をそれぞれ最大内径、最大血圧とすることができる。
【0064】
式(6)は、これら最大値でなくても一般に成り立つ式であり、ある流速における内径と血圧がわかる場合は、これらを式(6)に代入して粘性を求めることができる。
【0065】
ところで、式(6)は、ハーゲン・ポアズイユの式から類推して本願発明者らが求めたものである。
ハーゲン・ポアズイユの式とは、ニュートン流体が一定半径Rを有する管内を流れる場合に、その流速を求める式であり、次の式(7)で与えられる。
【0066】
V=R2×(P1−P2)÷(4×η×l)・・・(7)
【0067】
ここで、P1は上流側のある点での流体の圧力、P2は下流側のある点での流体の圧力、lはこの2点間の距離、ηは粘性である。
ハーゲン・ポワズイユの式(7)によると、流体の粘性は、輸送管の断面積と流体の圧力に比例し、流速に反比例することから、粘性を求める式(6)を見いだした。
【0068】
式(6)で導入した定数kは、粘性ηの測定値を校正するのに用いることができる。
即ち、図6を用いて後述するように、ユーザはkを設定することによって、医療機関などで測定した粘性の値と、本願の血液粘性測定装置による測定値を一致させることができる。これについてはより詳細に後述する。
そして、粘性計算部45は、式(6)によって算出した粘性の値ηを出力部4に出力する。
【0069】
演算部3は、以上のようにして粘性ηを算出するために、例えば、CPU(Central Processing Unit)、ROM(Read Only Memory)、RAM(Random Access Memory)、EEPROM(Electrically Erasable and Programmable ROM)などのハードウェアを備えている。
【0070】
CPUは中央処理装置であって、ROM、RAM、EEPROMなどに記憶されているプログラムに従って、各種の演算処理、演算部3全体の制御、回路部2や出力部4とのデータの送受信の制御などを行う。
ROMは、演算部3を機能させるための基本的にパラメータやプログラムなどを記憶した読み出し専用の記憶媒体である。CPUは、これらのパラメータやプログラムを用いて、血液粘性測定装置の起動時にこれを初期状態に設定するなどする。
【0071】
RAMは随時読み出し書き込みが可能な記憶媒体である。RAMは、例えば、CPUが血液の粘性を算出する際に、受信回路32、受信回路33、内径算出部44から取得してデータを記憶するためのエリアを提供したり、また、これらのエリアに記憶されたデータを用いて粘性を算出する際のワーキングエリアを提供する。
【0072】
EEPROMは、電気的な操作によって、後からデータを書き換えたり消去したりすることが可能なROMである。
本実施の形態では、EEPROMには、演算部3を機能させるための基本的なプログラムであるOS(Operating System)や、血液の粘性を算出するための血液粘性算出プログラムなどが記憶されている他、式(6)で用いる定数kの値も記憶されている。
【0073】
CPUは、血液粘性プログラムを実行することにより、周波数変化量検出部41、周波数変化量検出部42、内径算出部44、流速出力部43、粘性計算部45などの各機能部がソフトウェア的に構成される。
【0074】
また、演算部3に、ハードディスクなどの大容量の記憶媒体を備え、ユーザの日々の粘性を蓄積するように構成することもできる。
更に、演算部3に、入出力インターフェースを備え、粘性データを外部のコンピュータなどに出力したり、あるいは、外部からデータやプログラムを読み込むように構成することもできる。
【0075】
また、フレキシブルディスク、光磁気ディスク、半導体メモリなどで構成された外部記憶媒体を駆動する記憶媒体駆動装置を演算部3に備え、粘性データをこれらの外部記憶媒体に書き込んだり、あるいは、外部記憶媒体に書き込まれたデータやプログラムを読み込んだりできるように構成することもできる。
【0076】
以上は、演算部3のハードウェア的な構成の一例であって、これは演算部3の構成を限定するものではなく、周波数変化量検出部41〜粘性計算部45を形成するものであれはどのようなものでも良い。
【0077】
また、センサ部1の出力はアナログデータであり、演算部3で処理するデータはデジタルデータであるので、何れかの段階でアナログデータをサンプリングしてデジタルデータに変換する必要があるが、これは、回路部2で行うように構成しても良いし、あるいは演算部3で行うように構成しても良い。
【0078】
次に出力部4について説明する。出力部4は、結果表示部49を備えており、粘性計算部45から出力された粘性ηを表示する。
表示装置は、例えば、液晶ディスプレイ、プラズマディスプレイ、CRTディスプレイなどで構成されており、ηの値を数値で表示する。また、ηの値をグラフやその他の図表、記号などを用いて表示することも可能である。
【0079】
次に、図6のグラフを用いて定数kの校正の一例を説明する。
図6の縦軸は、医療機関などに設置されている他の血液粘性測定装置による粘性の測定値の大きさを表しており、横軸は本願の血液粘性測定装置による粘性の測定値の大きさを表している。
【0080】
そして、グラフ上には異なる粘性を有する流体の各サンプルについて両測定器による測定値をプロットしてある。
このように、プロットした点は直線上にのっている。このため、定数kの値を適当に設定すれば、両測定器による測定値が一致するように校正することができる。
【0081】
そのため、例えば、ユーザは、行きつけの医療機関などに設置されている他の血液粘性測定装置で粘性を測定すると共に、本願の血液粘性測定装置で粘性を測定し、両者の値が同じになるように定数kを設定して記憶させれば、以後本願の血液粘性測定装置で粘性を測定することができる。
【0082】
血液の粘性を測定する方法はいくつかあり、測定方法や血液粘性測定装置により測定値が異なる場合がある。
そのため、このように測定値の校正機能を持たせることにより、特定の血液粘性測定装置に対応するように本願の血液粘性測定装置を調節することができ、例えば、自宅において、行きつけの病院と同じ条件で血液の粘性を測定することができるようになる。
なお、本願の血液粘性測定装置の出荷時には、設計で定めたデフォルト値が記憶されている。
【0083】
次に、本願の血液粘性測定装置による粘性測定の手順を図7のフローチャートを用いて説明する。
まず、演算部3がセンサ部1を駆動し、送受信素子10、送受信素子12による流速の測定と、送受信素子11による内径の測定を開始する(ステップ5)。
【0084】
次に、回路部2は、これらの測定値をセンサ部1から受信し、演算部3に出力する。演算部3は、回路部2よりこれらの測定値を受信し、RAMなどの記憶装置に記憶する(ステップ10)。
この、測定値を記憶装置に格納する処理は、粘性の測定に必要な測定値が蓄積される間(例えば、10秒間程度)継続され、終了する(ステップ15)。
【0085】
次に、演算部3は、ユーザからの血圧値の入力を受け付け、これを取得して記憶する(ステップ20)。
次に、演算部3は、記憶した測定値から、最大血圧値、最大流速、最大内径を特定し(ステップ25)、これらの測定値を用いて粘性を算出する(ステップ30)。算出した粘性は、出力部4にて出力される。
【0086】
以上、本実施の形態について説明したが、これにより次のような効果を得ることができる。
(1)非侵襲にて血液の粘性を測定することができる。
(2)血液の流速と血管の太さ(内径)を考慮して粘性を求めるため、より正確な粘性を測定することができる。
【0087】
(3)血圧、流速、内径の最大値を特定して粘性を測定するため、血圧、流速、内径の対応する値を用いて粘性を計算することができる。
(4)定数kの設定により、測定値を校正することができる。
(5)センサ部1、回路部2、演算部3、出力部4の何れも小型化が可能なため、ユーザが家庭などに設置して手軽に粘性を測定することができる。また、腕時計などに装着して、随時粘性を測定することができる。
【0088】
なお、本実施の形態では、流速、内径、圧力をパラメータとして粘性を算出したが、圧力を用いずに流速と内径を用いて大まかな粘性の値を求めるように校正することもできる。この場合は、例えば、式(6)においてPmaxをkに含めることにより粘性を算出することができる。
【0089】
この場合、粘性の測定値に血圧変動分の誤差は生じるものの、血圧は短期間に大きく変動することは少ないため、短期間に渡って粘性の推移を大まかに測定したい場合などに有効である。
【0090】
また、本実施の形態では、血液の流速や血管の内径を計測するのに超音波を用いたが、これは計測用の波動を超音波に限定するものではなく、例えば、レーザなど他の波動を用いて計測を行うことも可能である。
【0091】
(変形例1)
次に、本実施の形態の変形例1について説明する。
図8は、変形例1の粘性測定装置に係るセンサ部の構造を示した断面図である。
変形例1は、送受信素子11で連続波とパルス波を選択的に発生させることにより、送受信素子11が血液の流速を測定する機能と血管の内径を測定する機能を兼ね備えるものである。
なお、以降では、先に説明した実施の形態と対応する機能部には同じ符号を付し、実施の形態と同じ動作を行うものについてはその説明を簡略化、あるいは省略することにする。
【0092】
送受信素子10は、実施の形態と同様に超音波の連続波を生体内18に送出し、血管20を流れる血液の血流による周波数の変化を測定時間に渡って継続的に測定する。
送受信素子11は、測定が開始されると一定時間連続波を生体内18に送出し、その後パルス波を送出する。
【0093】
送受信素子11が一定時間送出した連続波と、送受信素子10による連続波により血流の測定に必要な血管20の角度θが式(3)により計算される。一旦θを求めた後は、送受信素子10での検出値を式(1)に適用することにより血液の流速を算出することができる。
【0094】
そして、送受信素子11が連続波に引き続き送出したパルス波により血管20の内径を測定することができる。
このように、血管20の角度θの算出に必要な測定値は、送受信素子11が連続波を送出している間に取得できてしまうため、その後は、送受信素子11の送出するパルス波と送受信素子10が送出する連続波によって粘性の測定を行うことができる。
【0095】
次に、図9のブロック図を用いて変形例1に係る血液粘性測定装置のシステム構成について説明する。
変形例1の血液粘性測定装置は、センサ部1、回路部2、演算部3、出力部4から構成されている。
【0096】
連続駆動回路31は、送信装置10aに接続すると共に、切替回路51を介して送信素子12aに接続している。
また、パルス駆動回路34は、切替回路51を介して送信素子12aに接続している。
【0097】
切替回路51は、送信素子12aを駆動する回路を選択する回路であり、切替回路51を切り替えることにより、送信素子12aを連続駆動回路31又はパルス駆動回路34で駆動することができる。
そして、送信素子12aは、連続駆動回路31によって駆動されているときは生体内18に連続波を送信し、パルス駆動回路34によって駆動されているときはパルス波を送信する。
このように、連続駆動回路31、パルス駆動回路34、及び切替回路51により、連続波とパルス波を選択的に発生される素子駆動手段が構成される。
【0098】
受信回路33は、切替回路52を介して受信素子12bに接続し、また、受信回路35も切替回路52を介して受信素子12bに接続している。
切替回路52は、受信素子12bで検出された反射波を受信する受信回路を選択する回路であり、切替回路52を切り替えることにより、受信回路33、又は受信回路35で反射波が受信される。
【0099】
回路部2は、切替回路51と切替回路52を同期して切り替えを行い、送信素子12aが連続駆動回路31により駆動されているときは、受信素子12bを受信回路33に接続し、送信素子12aがパルス駆動回路34により駆動されているときは、受信素子12bを受信回路35に接続する。
【0100】
このため、送信素子12aが連続波を送信している場合、受信素子12bで受信された反射連続波は受信回路33を介して周波数変化量検出部42に出力され、送信素子12aがパルス波を送信している場合、受信素子12bで受信された反射パルス波は受信回路35を介して内径算出部44に出力される。
このようにして、回路部2は送受信素子12を連続波モード及びパルス波モードに切り替えて、血液の流速の測定と、血管の内径の測定の双方に使用する。
【0101】
図10は、粘性測定時に送受信素子12から送信される超音波のモード切替を説明するための図である。
図10において、縦軸は送信波の出力の大きさを電圧で表しており、横軸は時間を示している。
【0102】
図10に示したように、変形例1の回路部2は、測定開始してから時間T1の間は送受信素子12を連続波モードで駆動し、その後時間T2の間はパルス波モードで駆動する。そして、再び連続波モードに切り替えて、これを時間T3の間継続する。
【0103】
変形例1では、一例として、T1、及びT3は1秒程度とし、T2は10秒程度とした。また、パルス波モードにおいてパルス波の間隔は0.1[msec]程度である。
なお、図示しないが、送受信素子10の方は、測定開始から測定終了まで連続波を送信する。
【0104】
変形例1の血液粘性測定装置は、測定開始後T1の間は、送受信素子10と送受信素子12からの信号を用いてθを算出する。
そして、変形例1の血液粘性測定装置は、時間T2の間は、送受信素子10からの信号により血液の流速を測定し、送受信素子12からの信号により血管20の内径を測定する。
【0105】
そして、変形例1の血液粘性測定装置は、時間T3の間に再度θの測定を行い、時間T1で測定θと一致するか確認する。
変形例1の演算部3は、θが一致する場合はこのθを用いて粘性を計算し、θが一致しない場合は、θの平均値を用いて粘性を計算するか又は再測定とする。
【0106】
以上に説明した変形例1では、センサ部1に装備する送受信素子を2つ(送受信素子10と送受信素子12)にすることができる。
このため、血液粘性測定装置の製造コストを低減することができる。
【0107】
(変形例2)
次に、本実施の形態の変形例2について説明する。
図11は、変形例2の粘性測定装置に係るセンサ部の構造を示した断面図である。
変形例2は、変形例1と同様に送信素子11aを連続波モードとパルス波モードで駆動するが、送信素子10aは装備せず、送信素子10aでの連続波の送信は行わない。
【0108】
送信素子11aは、例えば、0.1[msec]ごとに連続波とパルス波を交互に生体内18に送信する。
送信素子11aが連続波を送信している場合、変形例2の血液粘性測定装置は、血流による反射連続波を受信素子10b、11bで受信し、これら受信した反射連続波の周波数の変化量から血液の流速を求める。
【0109】
送信素子11aがパルス波を送信している場合、変形例2の血液粘性測定装置は、血管20による反射パルス波を受信素子11bで受信し、これを用いて血管20の内径を測定する。なお、受信素子11aで反射パルス波を受信し、これによって血管20の内径を測定するように構成することもできる。
【0110】
次に、図12のブロック図を用いて変形例2に係る血液粘性測定装置のシステム構成について説明する。
変形例2の血液粘性測定装置は、センサ部1、回路部2、演算部3、出力部4から構成されている。
【0111】
連続駆動回路31は、切替回路51を介して送信素子12aに接続している。
また、パルス駆動回路34も、切替回路51を介して送信素子12aに接続している。
【0112】
切替回路51は、送信素子12aを駆動する回路を選択する回路であり、切替回路51を切り替えることにより、送信素子12aを連続駆動回路31又はパルス駆動回路34で駆動することができる。
そして、送信素子12aは、連続駆動回路31によって駆動されているときは生体内18に連続波を送信し、パルス駆動回路34によって駆動されているときはパルス波を送信する。
【0113】
受信回路33は、切替回路52を介して受信素子12bに接続し、また、受信回路35も切替回路52を介して受信素子12bに接続している。
切替回路52は、受信素子12bで検出された反射波を受信する受信回路を選択する回路であり、切替回路52を切り替えることにより、受信回路33、又は受信回路35で反射波が受信される。
【0114】
回路部2は、切替回路51と切替回路52を同期して切り替え、送信素子12aが連続駆動回路31により駆動されているときは、受信素子12bを受信回路33に接続し、送信素子12aがパルス駆動回路34により駆動されているときは、受信素子12bを受信回路35に接続する。
【0115】
このため、送信素子12aが連続波を送信している場合、受信素子10bで受信された連続波は受信回路32を介して周波数変化量検出部41に出力され、一方、受信素子12bで受信された反射連続波は受信回路33を介して周波数変化量検出部42に出力される。これにより血液の流速が算出される。
【0116】
また、送信素子12aがパルス波を送信している場合、受信素子12bで反射パルス波が受信され、受信回路35を介して内径算出部44に出力される。これによって血管20の内径が算出される。
このようにして、回路部2は送受信素子12を連続波モード及びパルス波モードに切り替えて、血液の流速の測定と、血管の内径の測定の双方に使用する。
【0117】
図13は、粘性測定時に送受信素子12から送信される超音波のモード切替を説明するための図である。
図10において、縦軸は送信波の出力の大きさを電圧で表しており、横軸は時間を示している。
【0118】
図10に示したように、変形例2の回路部2は、測定開始してから時間T4ごとにパルス波モードと連続波モードを切り替え、血液の流速の測定と血管20の内径の測定を交互に行う。T4は例えば、0.1[msec]程度である。
【0119】
このように、変形例2では、血液の流速を測定している間は血管20の内径を測定することができず、逆に血管20の内径を測定している間は血液の流速を測定することはできない。即ち、血液の流速と血管20の内径を同時に測定することはできない。
【0120】
しかし、10秒程度の測定時間中に血液の流速や血管20の状態が大きく変化することは考えにくいため、このように、T4ごとに血液の流速と血管20の内径を交互に測定するようにしても正確な粘性を測定することができる。
また、センサ部1において変形例1の発振素子10aを省略することができ、更にコストの低減を図ることができる。
【0121】
(血管内径の測定方法の変形例)
以上に説明した実施の形態及び変形例1、2では、式(5)にて血管20の内径の算出を行ったが、ここで、他の方法により血管20を内径を計測する方法について説明する。
【0122】
ここでは、血管20の太さが太いほど反射パルス波の強度が大きくなることを利用して血管20の内径を見積もる。
図14は、図1においてセンサ部1を血管20の方向に見たところを示した断面図である。
送受信素子11が送信したパルス波は血管20に当たり反射するが、血管20の部分のうち、センサ部1に面する部分60の面積が広いほど反射パルス波の強度が大きくなる。
【0123】
一般に、血管20は管状形状を有しているため、反射パルス波の強度を血管20の太さに対応すると考えられる。また、測定部位を特定すれば、血管壁の厚さの個人差は小さいと考えられるため、反射パルス波の強度を血管20の内径に対応させることが可能である。
【0124】
図15(a)は、本変形例において、送信素子aが送出するパルス波を示しており、図15(b)は、受信素子11bが受信する反射パルス波を示している。
何れも縦軸は強度を電圧にて表しており、横軸は時間を表している。また、両者の時間軸は一致させてある。
図15(b)に示したΔVは、血管20の部分60による反射パルス波の強度を示しており、本変形例はこのΔVから血管の太さを求めるものである。
【0125】
多くのサンプルを用いて反射パルス波の強度と血管20の内径の関係を統計的に分析し、これをデータベース化しておけば、反射パルス波の強度から血管20の内径を推測することが可能となる。
なお、なお、血管20の内壁から反射された反射パルス波を用いて血管20の内径を推定することも可能である。
【0126】
図16は、水中に各太さのチューブを沈め、これによる反射パルス波の電圧を計測してプロットしたグラフである。縦軸に反射パルス波の出力電圧をとり、横軸にチューブ径をとっている。
図に示したように、チューブ径0.5[mm]のチューブに対しては、0.2[mVpp]程度の出力電圧が得られ、1.0[mm]のチューブに対しては、0.3[mVpp]程度の出力電圧が得られている。
【0127】
同様に、2.0[mm]、3.0[mm]とチューブ径が増すと、反射パルス波の出力電圧も増している。
そして、これらのデータは、略直線上に存在している。このため、反射パルス波の出力電圧からチューブ径を推定することが可能となる。
血管20に対しても血管径と反射パルス波の出力電圧について同様の関係が成り立つと考えられるため、反射パルス波の電圧から血管径を推定することが可能となる。
【図面の簡単な説明】
【0128】
【図1】血液粘性測定装置のセンサ部を示した図である。
【図2】血液の流速を測定する原理を説明するための図である。
【図3】血管の内径を測定する原理を説明するための図である。
【図4】血液粘性測定装置の構成を説明するためのブロック図である。
【図5】血液の流速の時間変化を示した図である。
【図6】血液粘性測定装置の校正について説明するための図である。
【図7】血液粘性測定装置による粘性測定の手順を説明するためのフローチャートである。
【図8】変形例1の粘性測定装置に係るセンサ部の構造を示した断面図である。
【図9】変形例1の粘性測定装置の構成を説明するためのブロック図である。
【図10】変形例1における超音波のモード切替を説明するための図である。
【図11】変形例2の粘性測定装置に係るセンサ部の構造を示した断面図である。
【図12】変形例2の粘性測定装置の構成を説明するためのブロック図である。
【図13】変形例2における超音波のモード切替を説明するための図である。
【図14】血管内径の測定方法の変形例に係る原理を説明するための図である。
【図15】血管内径の測定方法の変形例における反射パルス波を示した図である。
【図16】血管内径の測定方法の変形例における実験データを示したグラフ図である。
【符号の説明】
【0129】
1 センサ部
2 回路部
3 演算部
4 出力部
10 送受信素子
11 送受信素子
12 送受信素子
13 基底部
14 皮膚
15 整合部
18 生体内
20 血管
【特許請求の範囲】
【請求項1】
血管の内部を流れる血液の流速を計測する流速計測手段と、
前記計測した流速に対応する前記血管の内径を計測する内径計測手段と、
前記計測した流速と内径を用いて前記血液の粘性を決定する粘性決定手段と、
を具備したことを特徴とする血液粘性測定装置。
【請求項2】
前記計測した流速に対応する前記血管の血圧を取得する血圧取得手段を具備し、
前記粘性決定手段は、前記取得した血圧を用いて粘性を決定することを特徴とする請求項1に記載の血液粘性測定装置。
【請求項3】
前記粘性決定手段は、前記計測した流速、前記内径、及び前記取得した血圧のうち、それぞれの最大値を用いて粘性を決定することを特徴とする請求項2に記載の血液粘性測定装置。
【請求項4】
前記血圧取得手段は、前記流速と前記内径の計測時と時間差をおいて計測した血圧を取得することを特徴とする請求項2、又は請求項3に記載の血液粘性測定装置。
【請求項5】
生体表面から前記血液に連続波を送信する連続波送信手段と、
前記送信した連続波のうち、前記血液で反射された反射波を受信する連続波受信手段と、
を具備し、
前記流速計測手段は、前記受信した2方向の反射波の周波数変化量を用いて流速を算出することを特徴とする請求項1から請求項4までのうちの何れか1の請求項に記載の血液粘性測定装置。
【請求項6】
生体表面から前記血管にパルス波を送信するパルス波送信手段と、
前記送信したパルス波のうち、前記血管で反射された反射波を受信するパルス波受信手段と、
を具備し、
前記内径計測手段は、前記受信したパルス波を用いて前記血管の内径を算出することを特徴とする請求項1から請求項5までのうちの何れか1の請求項に記載の血液粘性測定装置。
【請求項7】
生体表面から生体内に波動を送信する波動送信素子と、
前記波動送信素子に連続波とパルス波を選択的に発生させる素子駆動手段と、
を具備し、
前記素子駆動手段で前記波動送信素子における連続波とパルス波の発生を切り替えることにより、前記波動送信素子は前記流速計測手段で使用する連続波と前記内径計測手段で使用するパルス波を送信することを特徴とする請求項6に記載の血液粘性測定装置。
【請求項8】
定数の入力を受け付ける定数入力受付手段を具備し、前記粘性決定手段は、粘性をη、流速をV、内径をR、血圧をP、前記定数をkとして、粘性をη=k×R2×P÷Vなる式で算出することを特徴とする請求項2から請求項7までのうちの何れか1の請求項に記載の血液粘性測定装置。
【請求項1】
血管の内部を流れる血液の流速を計測する流速計測手段と、
前記計測した流速に対応する前記血管の内径を計測する内径計測手段と、
前記計測した流速と内径を用いて前記血液の粘性を決定する粘性決定手段と、
を具備したことを特徴とする血液粘性測定装置。
【請求項2】
前記計測した流速に対応する前記血管の血圧を取得する血圧取得手段を具備し、
前記粘性決定手段は、前記取得した血圧を用いて粘性を決定することを特徴とする請求項1に記載の血液粘性測定装置。
【請求項3】
前記粘性決定手段は、前記計測した流速、前記内径、及び前記取得した血圧のうち、それぞれの最大値を用いて粘性を決定することを特徴とする請求項2に記載の血液粘性測定装置。
【請求項4】
前記血圧取得手段は、前記流速と前記内径の計測時と時間差をおいて計測した血圧を取得することを特徴とする請求項2、又は請求項3に記載の血液粘性測定装置。
【請求項5】
生体表面から前記血液に連続波を送信する連続波送信手段と、
前記送信した連続波のうち、前記血液で反射された反射波を受信する連続波受信手段と、
を具備し、
前記流速計測手段は、前記受信した2方向の反射波の周波数変化量を用いて流速を算出することを特徴とする請求項1から請求項4までのうちの何れか1の請求項に記載の血液粘性測定装置。
【請求項6】
生体表面から前記血管にパルス波を送信するパルス波送信手段と、
前記送信したパルス波のうち、前記血管で反射された反射波を受信するパルス波受信手段と、
を具備し、
前記内径計測手段は、前記受信したパルス波を用いて前記血管の内径を算出することを特徴とする請求項1から請求項5までのうちの何れか1の請求項に記載の血液粘性測定装置。
【請求項7】
生体表面から生体内に波動を送信する波動送信素子と、
前記波動送信素子に連続波とパルス波を選択的に発生させる素子駆動手段と、
を具備し、
前記素子駆動手段で前記波動送信素子における連続波とパルス波の発生を切り替えることにより、前記波動送信素子は前記流速計測手段で使用する連続波と前記内径計測手段で使用するパルス波を送信することを特徴とする請求項6に記載の血液粘性測定装置。
【請求項8】
定数の入力を受け付ける定数入力受付手段を具備し、前記粘性決定手段は、粘性をη、流速をV、内径をR、血圧をP、前記定数をkとして、粘性をη=k×R2×P÷Vなる式で算出することを特徴とする請求項2から請求項7までのうちの何れか1の請求項に記載の血液粘性測定装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2006−204722(P2006−204722A)
【公開日】平成18年8月10日(2006.8.10)
【国際特許分類】
【出願番号】特願2005−23391(P2005−23391)
【出願日】平成17年1月31日(2005.1.31)
【出願人】(000002325)セイコーインスツル株式会社 (3,629)
【Fターム(参考)】
【公開日】平成18年8月10日(2006.8.10)
【国際特許分類】
【出願日】平成17年1月31日(2005.1.31)
【出願人】(000002325)セイコーインスツル株式会社 (3,629)
【Fターム(参考)】
[ Back to top ]

