国際特許分類[C07C231/12]の内容
化学;冶金 (1,075,549) | 有機化学 (230,229) | 非環式化合物または炭素環式化合物 (64,036) | カルボン酸アミドの製造 (1,104) | カルボン酸アミド基の形成の関与しない反応による製造 (331)
国際特許分類[C07C231/12]に分類される特許
201 - 210 / 331
シクロアルカンカルボキサミド誘導体及びその製造方法
【課題】 選択的にカテプシンK阻害作用を有する新規なシクロアルカンカルボキサミド誘導体及びその製造法を提供する。
【解決手段】 下記の一般式(I)で示されるシクロアルカンカルボキサミド誘導体または薬学的に許容できる塩。
【化1】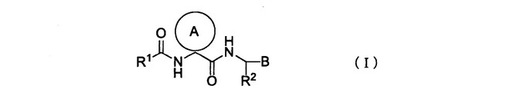
[式中、R1、R2は、(置換)アルキル基、(置換)アルケニル基、(置換)アルキニル基、(置換)芳香族炭化水素基、(置換)複素環基を表し、環Aは炭素数5〜7のアルキリデン基、Bはホルミル基、ヒドロキシメチル基を示す]
(もっと読む)
18F標識フルオロベンゼン環を有する放射性リガンドの合成法
【課題】様々な複雑の構造を有する放射性リガンドを合成する。
【解決手段】様々な官能基を持ちながら、ブロムあるいはヨードベンゼン環を有する誘導体を放射性リガンドの標識原料とし、フェニルスズ化合物を合成する。一方、一個以上の電子供与性基を有するヨードベンゼンを酸化し、トシル酸と反応させることにより、新規な電子供与性基を有するヒドロキシトシルヨードベンゼン化合物を得る。次に、この化合物を様々なフェニルスズ化合物と反応させることにより、標識前駆体であるジフェニルヨードニウム塩を合成する。最後に本ジフェニルヨードニウム塩を[18F]F-との反応により、様々な官能基を持ちながら[18F]フルオロベンゼン環を有する18F標識リガンドを合成する。
(もっと読む)
エンタカポンの製造方法
エンタカポンの新しい製造方法であって、3,4−ジヒドロキシ−5−ニトロベンズアルデヒドをN,N−ジエチル−2−シアノアセトアミドと、触媒の存在下、C4〜8のアルコール中で、減圧下、少なくとも70℃の温度で反応させる工程、混合物を30℃以下の温度まで冷却する工程、種晶中に少なくとも10重量%のZ体を含むN,N−ジエチル−2−シアノ−3−(3,4−ジヒドロキシ−5−ニトロフェニル)アクリルアミドを種晶として混合物に添加する工程、混合物を5℃以下の温度まで冷却する工程、結晶化した生成物を単離する工程、そして得られたN,N−ジエチル−2−シアノ−3−(3,4−ジヒドロキシ−5−ニトロフェニル)アクリルアミドのEおよびZ体の混合物をE体(エンタカポン)に変換する工程を含む製造方法。 (もっと読む)
化合物
本発明は、a5b1機能を阻害する化合物、それらの製造方法、それらを活性成分として含有する医薬組成物、薬剤としてのそれらの使用、およびヒトなどの温血動物での充実性腫瘍の処置のためのような、有意の血管新生または血管の成分を有する疾患の処置に用いるための薬剤の製造におけるそれらの使用に関する。本発明は、更に、a5b1を阻害する、そして更に、他のインテグリンに対して一つまたは複数の適当な選択性プロフィールを示す化合物に関する。 (もっと読む)
光学活性2−アミノブタンアミドもしくはその塩の製造方法
【課題】光学活性2−アミノブタンアミドもしくはその塩を高い収率および高い光学純度で製造することが可能な方法を提供すること。
【解決手段】有機溶媒下、下記式(1):
で示される(RS)−2−アミノブタンアミドを光学活性なカルボン酸で光学分割して、光学活性2−アミノブタンアミドもしくはその塩を製造するにあたり、該光学分割と同時に、あるいは、該光学分割の後に、芳香族アルデヒドを触媒としてエピマー化を行い、該芳香族アルデヒドの使用量が、(RS)−2−アミノブタンアミドに対して、モル比で、0.005以上、0.3以下である。
(もっと読む)
抗炎症剤として有用なシネフリン誘導体
本発明は、R1が、アシル基またはスルホニル基であり、R2が、脂環式、芳香族または複素環モノカルボン酸に由来するアシル基、イミダゾリルカルボニル基およびトリアゾリルカルボニル基からなる群より選択されるアシル基であり、R3が、水素またはアミノ保護基である、構造式を有する化合物、またはその溶媒和物、またはその塩に関し、抗炎症剤として有効なものである。  (もっと読む)
(もっと読む)
アミノアルカン酸アミドの製造法
本発明は、シアンアルカン酸エステルとa)アンモニアまたはアミンおよびb)水素とを触媒の存在で反応させることによってアミノアルカン酸アミドを製造する方法に関し、その際、成分b)との反応は、シアンアルカン酸エステルと成分a)との反応の開始と同時にかまたはこの反応の開始後遅くとも最大100分以内に開始させる。 (もっと読む)
2−クロロエトキシ−酢酸−N,N−ジメチルアミドの製法
本発明によれば、溶媒中、任意に触媒の存在下、式(II)の2-ヒドロキシエトキシ-酢酸-N,N-ジメチルアミドを塩化チオニルと反応させ、蒸留によって溶媒を除去することによって、式(I)の2-クロロエトキシ-酢酸-N,N-ジメチルアミドが製造される。
式(I)
【化1】
式(II)
【化2】
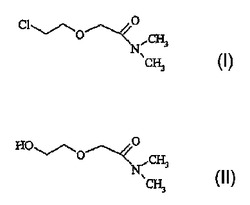 (もっと読む)
(もっと読む)
二座C,P−キラルホスフィン配位子
本発明は、式I(式中、R1およびR2は、互いに独立して、アルキル、アリール、シクロアルキルまたはヘテロアリールであり、前記アルキル、アリール、シクロアルキルまたはヘテロアリールは、アルキル、アルコキシ、ハロゲン、ヒドロキシ、アミノ、モノ−もしくはジアルキルアミノ、アリール、−SO2−R7、−SO3−、−CO−NR8R8’、カルボキシ、アルコキシカルボニル、トリアルキルシリル、ジアリールアルキルシリル、ジアルキルアリールシリルまたはトリアリールシリルにより置換されていてもよく;R3は、アルキル、シクロアルキル、アリールまたはヘテロアリールであり;R4’およびR4は、互いに独立して、水素、アルキルもしくは場合により置換されているアリールを表すか、またはR4’およびR4は、それらが結合するC原子と一緒になって、3〜8員炭素環を形成しており;点線は、存在しないか、または存在して二重結合を形成しており;R5およびR6は、互いに独立して、水素、アルキルもしくはアリールであるか、または一緒に結合して、3〜8員炭素環もしくは芳香族環を形成しており;R7は、アルキル、アリールまたはNR8R8’であり;R8およびR8’は、互いに独立して、水素、アルキルまたはアリールである)で示される新規なホスフィン配位子、そのような配位子の金属錯体、および不斉反応における触媒としてのそのような金属錯体の使用に関する。 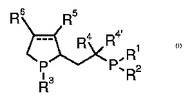 (もっと読む)
(もっと読む)
α‐ガラクトシルセラミドのアナログ及びその使用
式Iの化合物、[ここで、式中、R1が、ヒトCD1dへ結合した場合に、α−ガラクトシルセラミドのスフィンゴシン鎖の末端nC14H29が占める容積に比較してC’チャネルが占める容積の少なくとも30%を充填し、及びR2が、ヒトCD1dへ結合した場合に、α−ガラクトシルセラミドのアシル鎖の末端nC25H51が占める容積に比較してA’チャネルが占める容積の少なくとも30%を充填するように、R1が、ヒトCD1dのC’チャネルを占めるために適合する疎水性部分を示し、R2が、ヒトCD1dのA’チャネルを占めるために適合する疎水性部分を表し、R3が、水素又はOHを示し、Ra及びRbが、夫々、水素を示し、更に、R3が水素を示す場合には、Ra及びRbが共に一重結合を形成してよく、Xが、−CHA(CHOH)nY又は-P(=O)(O-)OCH2(CHOH)mYを示し、〔ここで、式中、Yが、CHB1B2を示し、nが、1〜4の整数を示し、mが、0又は1を示し、Aが、水素を示し、B1及びB2の一方が、H、OH又はフェニルを示し、そして他方が、水素を示すか、又はB1及びB2の一方が、ヒドロキシルを示し、そして他方が、フェニルを示す、さらに、nが、4を示す場合は、Aが、B1及びB2の一方と共に一重結合を形成し、そしてB1及びB2の他方が、H、OH又はOS O3Hを示す〕]及び、薬学的に許容可能なそれらの塩;式Iの化合物がウイルス、微生物感染、寄生虫、自己免疫疾患、癌、アレルギー又は喘息の治療において使用されることが示されることが記載される。
【化1】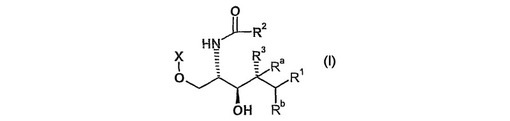
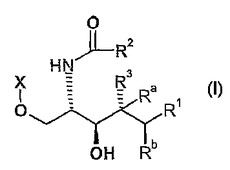 (もっと読む)
(もっと読む)
201 - 210 / 331
[ Back to top ]

