ペプチドの同定方法
【課題】ペプチドからより多くの情報量を取得し、データベース上のペプチドを特定することのできるペプチドの同定手法。
【解決手段】ペプチドのC末端からアミノ酸を逐次的に分解し、C末端からアミノ酸残基が欠損したC末端欠損ペプチドを得る。C末端欠損ペプチドの分子量と、ピログルタミル化ペプチドの分子量とをそれぞれ測定する。C末端欠損ペプチドの分子量と、ペプチドの分子量との差を算出することにより、C末端欠損ペプチドの逐次的分解による分子量の減少量を求める。減少量に対応する分子量を有するアミノ酸を選択することにより、ペプチドのC末端から所定の数のアミノ酸を同定する。データベースに記録された一連の既知アミノ酸配列の中から、同定された所定の数のアミノ酸から構成されるペプチドのC末端アミノ酸配列と一致するC末端アミノ酸配列を有する既知アミノ酸配列を抽出する。
【解決手段】ペプチドのC末端からアミノ酸を逐次的に分解し、C末端からアミノ酸残基が欠損したC末端欠損ペプチドを得る。C末端欠損ペプチドの分子量と、ピログルタミル化ペプチドの分子量とをそれぞれ測定する。C末端欠損ペプチドの分子量と、ペプチドの分子量との差を算出することにより、C末端欠損ペプチドの逐次的分解による分子量の減少量を求める。減少量に対応する分子量を有するアミノ酸を選択することにより、ペプチドのC末端から所定の数のアミノ酸を同定する。データベースに記録された一連の既知アミノ酸配列の中から、同定された所定の数のアミノ酸から構成されるペプチドのC末端アミノ酸配列と一致するC末端アミノ酸配列を有する既知アミノ酸配列を抽出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、解析対象とするペプチドのアミノ酸配列を同定するペプチドの同定方法に関する。
【背景技術】
【0002】
ペプチドのアミノ酸配列について質量分析を利用してデータベースサーチする方法に関しては従来(1)PMF法、(2)ペプチドタグ法、(3)MS/MS法が知られている。
【0003】
このうち(1)PMF法では、ペプチドを特異性の高い分解方法で断片化し、得られた断片を質量分析にかけ断片化法の特異性を考慮して、データベース中のペプチドに対して特異的断片化法に対応するペプチド断片群の質量を算出し、実験結果と一致するペプチドをサーチする方法である。この方法は非常に簡便であること、近年の質量分析装置の精度が非常に向上したことがあいまって多用されている方法である。しかしながら、もとのペプチドがある程度以上大きくないと十分な数のペプチド断片が得られず、その結果データベースのペプチド候補がたくさん上げられひとつに絞り込めないことが多々あるのが問題であった。
【0004】
(2)のペプチドタグ法はシークエンスタグ法ともよばれ、ペプチド断片の断片化前の質量とそのペプチド断片に対して不活性ガスを当てるなどしてフラグメンテーションを生じさせた結果得られるイオン種を観測し、そのスペクトルから数残基のアミノ酸配列情報や組成、さらには、順序は問わないものの2残基分の特定のアミノ酸の組み合わせ、などの情報を取得し、ペプチド断片を得る際に使用した酵素の特異性なども加味して、データベースサーチを行い、ペプチドを帰属する手法である。近年、質量分析装置の高機能化、ハイブリッド化が促進されMS/MS法の性能・感度が向上しつつあり、(3)に述べるMS/MS法が多用される傾向があり、ペプチドタグ法はあまり用いられない。ペプチドのカバー率をなるべく上げることにより検索結果の確からしさを向上させようとする風潮がその傾向を加速している。
【0005】
(3)のMS/MS法はペプチドを断片化して得られたなるべく多数のペプチド断片のイオン種に対して不活性ガスをあてるなどしてペプチド結合部位でフラグメンテーションしアミノ酸配列を反映したフラグメントイオン種を生成させてこれを質量分析器で検出し、データベース中のペプチド断片群に対してもっともマッチするペプチド断片を含むペプチドをサーチするものである。マッチするペプチド断片の個数がより多いペプチドがより確からしい同定候補と判定される。しかしながら、ペプチド結合の開裂の程度は配列に大きく依存し、すべてのペプチド結合を一様に開裂させるように衝突エネルギーを調整することは難しい。また衝突エネルギーによってはペプチド結合以外の部分での断片化も生じることがあり、解析作業を複雑なものにしている。
【0006】
データベースサーチする際に、スペクトルをマッチさせるのではなく、化学的にアミノ酸配列を決定してペプチドを同定する方法もある。N末端からの配列情報はエドマン分解が標準的手法として認知されているが、アミノ基がブロックされている際には使用できない。また比較的時間がかかることもスループットを上げる際に問題となっている。一方、C末端側からの配列決定方法として無水酢酸による化学反応を基本として一連の反応より得られる反応産物の質量スペクトルからC末端アミノ酸配列情報を取得する方法もある。代表的な例としてアルカン酸無水物によるC末端アミノ酸の逐次分解反応が申請者らより報告されている。例えば、アルカン酸無水物(たとえば無水酢酸)蒸気に微量のパーフルオロアルカン酸(たとえばトリフルオロ酢酸)蒸気を混入させC末端アミノ酸を逐次的に分解する方法が提案されている(非特許文献1参照)。この手法によれば、スペクトルの複雑性を除去するためにC末端逐次分解前にペプチド群ないしペプチドに対して行うアシル化反応(前処理工程)とC末端逐次分解後に反応産物に対して行う含窒素芳香環化合物または第三アミン化合物による加水分解処理(後処理工程)を行うことが有効であることも併せて記載されている。また別に、ゲル担体に保持されたペプチドに対してはピリジン水溶液による処理が後の逐次分解反応を触媒することも申請者らより報告されている(非特許文献2参照)。
【0007】
【非特許文献1】Miyazaki,K.et al.,Proteomics.4,11−19(2004)
【非特許文献2】Miyazaki,K.et al.,Proteomics.6,2026−2033(2006)
【特許文献1】国際公開第2005−078447号パンフレット
【発明の開示】
【発明が解決しようとする課題】
【0008】
ペプチドをデータベース上で同定する際、従来のPMF法、MS/MS法では同定しきれないペプチドが存在していた。これらの手法が持つ構造的な欠陥、すなわち、ペプチドが比較的小さい場合、得られる断片が少なくなり、ペプチドをデータベース上に特定するには情報量が少なすぎる場合がある、という欠陥があった。
【0009】
このように、解析対象とするペプチドからより多くの情報量を取得し、データベース上のペプチドを特定することのできる簡便なペプチドの同定手法が望まれていた。
【課題を解決するための手段】
【0010】
本発明によれば、解析対象とするペプチドのアミノ酸配列を同定するペプチドの同定方法であって、
ペプチドのC末端からアミノ酸を逐次的に分解するとともに、C末端欠損ペプチドを得るステップと、
C末端欠損ペプチドを得るステップと並行して、解析対象とするペプチドを脱水処理により所定の位置で切断し、N末端のアミノ酸残基が分子内脱水された脱水型ペプチドを得るステップと、
C末端欠損ペプチドの分子量と、脱水型ペプチドの分子量とをそれぞれ測定するステップと、
C末端欠損ペプチドの分子量と、ペプチドの分子量との差を算出することにより、C末端欠損ペプチドの逐次的分解による分子量の減少量を求めるステップと、
減少量に対応する分子量を有するアミノ酸を選択することにより、ペプチドのC末端部を構成する所定の数のアミノ酸を同定し、データベースに記録された一連のアミノ酸配列からペプチドのC末端部と一致するC末端部を有する一連のアミノ酸配列を抽出するステップと、
抽出された一連のアミノ酸配列の中から脱水型ペプチドの測定結果に基づいて一のアミノ酸配列を選択するステップと、
を含むことを特徴とするペプチドの同定方法
が提供される。
【発明の効果】
【0011】
本発明の方法によれば、データベースから一のアミノ酸配列を選択して、解析対象となるペプチドを精度よく同定することができる。
【発明を実施するための最良の形態】
【0012】
以下、本発明の実施の形態について、図面を用いて説明する。尚、すべての図面において、同様な構成要素には同様の符号を付し、適宜説明を省略する。
【0013】
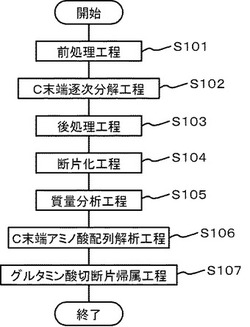
図1は、本実施の形態に係るペプチドの同定方法を示すフローチャートである。本実施の形態は、解析対象とするペプチドのアミノ酸配列を同定するペプチドの同定方法である。本実施の形態の基本は、ステップ102と、ステップ105と、ステップ106と、ステップ107から構成される。ステップ102では、ペプチドのC末端からアミノ酸を逐次的に分解し、C末端からアミノ酸残基が欠損したC末端欠損ペプチドを得る(C末端逐次分解工程、S102)。また、このC末端逐次分解反応と並行して、脱水処理によりグルタミン酸のアミノ基側が分子内脱水されたピログルタミル化ペプチドが得られる。ステップ105では、C末端欠損ペプチドの分子量と、ピログルタミル化ペプチドの分子量とをそれぞれ測定する(質量分析工程、S105)。ステップ106では、C末端欠損ペプチドの分子量と、ペプチドとの分子量との差を算出することにより、C末端欠損ペプチドの逐次的分解による分子量の減少量を求める。つづいて、減少量に対応する分子量を有するアミノ酸を選択することにより、ペプチドのC末端から所定の数のアミノ酸を同定する。そして、データベースに記録された一連の既知アミノ酸配列の中から、同定された所定の数のアミノ酸から構成されるペプチドのC末端アミノ酸配列と一致するC末端アミノ酸配列を有する既知アミノ酸配列を抽出する(C末端アミノ酸配列解析工程、S106)。ステップ107では、ステップ106で抽出された既知アミノ酸配列の中からピログルタミル化ペプチドの測定結果に基づいて一の既知アミノ酸配列を選択する(グルタミン酸切断片帰属工程、S107)。
【0014】
図1で示すように、ステップ102の前に、ステップ101を行ってもよい(前処理工程、S101)。ステップ101では、ペプチド中のセリン、トレオニン、チロシンのβ−ヒドロキル基をO−アシル化して保護する。また、リシンのε−アミノ基をN−アシル化して保護する。これにより、C末端逐次分解工程における切断等の副反応を抑制することができる。
【0015】
ステップ102では、ペプチドをアルカン酸無水物と接触させることにより、C末端欠損ペプチドとピログルタミル化ペプチドとを得ることできる。アルカン酸無水物として、無水酢酸または酢酸を用いると好ましい。こうすることにより、O−アシル化およびN―アシル化とC末端逐次分解反応とを同時に行うことができる。したがって、セリン、トレオニンのβ−ヒドロキシ基、チロシンのフェノール基、リシンのε−アミノ基の保護を行いつつ、C末端逐次分解反応を行うことができる。また、ステップ101の手順が不要となり、簡便な方法でC末端アミノ酸を安定的に分解することが可能となる。また、ピログルタミル化反応も良好に進行させることができる。
【0016】
図3は、グルタミン酸のアミノ基側のペプチド結合で切断を受けて生じるピログルタミン酸の構造を示す図である。無水酢酸等の酸触媒または加熱条件により、グルタミン酸のγ−カルボキシ基が活性化され反応産物としてピログルタミン酸が得られる。アミノ基側で切断を受けたグルタミン酸は、脱水しており、ピログルタミル化している。グルタミン酸が分子内で脱水をおこし環状構造となる。
【0017】
グルタミン酸の分子内脱水反応は、一般的に、高温下におくと発生する。また、酸触媒下におくことにより、反応速度を高めることができる。C末端逐次分解反応では、酢酸、TFA等の有機酸を用いている。したがって、これらの有機酸が酸触媒として働く。この反応メカニズムは明らかではないが、図3で示す以下のようなメカニズムが予想される。すなわち、グルタミン酸が分子内脱水して分子内ピログルタミル化を起こす。つづいて、この分子内ピログルタミン酸の主鎖に由来するペプチド結合に加水分解が生じ、結果としてピログルタミン酸をN末端にもつ脱水ペプチドが形成される、と考えられる。
【0018】
また、ステップ102の後に、ステップ103を行ってもよい(後処理工程、S103)。ステップ103では、O−アシル化を脱保護する。また、C末端逐次分解工程で形成された5−オキサゾロン環を加水分解する。こうすることにより、1個以上のアミノ酸残基が除去された後のペプチドのC末端に、確実にカルボキシ基を再生することができる。
【0019】
ステップ103とステップ105の間に、ステップ104を行う(断片化工程、S104)。ステップ104では、ペプチドを所定の位置で切断する。これにより、ピログルタミル化ペプチドが所定の位置で切断されたピログルタミル化ペプチド断片が得られる。また、ステップ104では、C末端欠損ペプチドが所定の位置で切断されたC末端欠損ペプチド断片が得ることもできる。さらに、ペプチドのN末端を含むペプチド断片も得ることができる。ペプチドが断片化されることにより、分子量の大きいペプチドを解析対象とした場合であっても、より高感度で質量分析を行うことができる。
【0020】
ステップ104では、プロテアーゼ処理することにより、ピログルタミル化ペプチドおよびC末端欠損ペプチド等のペプチドを所定の位置で切断することができる。プロテアーゼとしてトリプシンを用いると、アルギニンのカルボキシ側のペプチド結合を切断することができる。
【0021】
ペプチドをアルギニンのカルボキシ基側のペプチド結合で切断することにより、質量分析において、ピログルタミル化ペプチドを、より高感度で検出することができる。したがって、ピログルタミル化ペプチドをより一層確実に分析することができる。
【0022】
また、トリプシンを用いたペプチドの断片化は、塩基性アミノ酸残基のC末端側で選択的に生じるため、もとのペプチドとC末端アミノ酸が欠損したペプチドの切断位置を一致させることができる。このため、もとのペプチドに由来するC末端側の断片ペプチドは、C末端アミノ酸が欠損したペプチドに由来するC末端側の断片ペプチドのC末端側にさらに所定の数のアミノ酸残基が付加された配列となる。よって、これらの分子量を比較し、逐次分解による分子量の減少量を算出することにより、除去されたアミノ酸残基の種類を特定することが可能となる。
【0023】
ここで、塩基性アミノ酸残基のうち、リシン残基はジメチル化、アセチル化等の天然の修飾を受けうる。修飾されたリシン残基はトリプシン消化を受けないことから、修飾の有無によりトリプシン消化により生じるペプチド断片が異なる。そこで、ステップ101においてリシン残基のε−アミノ基の保護を行うとともに、この保護基がステップ103で脱保護されないようにしている。こうすることにより、リシン残基のトリプシン感受性を消失させておくことができる。このため、アルギニン残基のC末端側ペプチド結合での選択的な断片化が可能となる。
【0024】
よって、C末端側のアミノ酸が欠損した逐次分解生成物を、質量分析により一層好適な分子量範囲内の分子量を有するペプチド断片に分割することができる。したがって、C末端側ペプチド断片の分子量を調節する処理として、トリプシン処理を積極的に活用することができる。
【0025】
ステップ104の断片化工程の後、試料を脱塩処理してペプチド断片を回収し、乾燥した後、質量分析装置を利用して、ペプチド断片の混合物に由来するイオン種の分子量を測定する。ここで、脱塩処理を行うことにより、回収、乾燥されるペプチド断片は、各種の塩を形成するものではなく、本来のペプチド部分単体とされている。そして、C末端の選択的な逐次分解によって得られる一連の反応生成物と、分解前のペプチドとを断片化処理で得られるペプチド断片のうち、それぞれのC末端側ペプチド断片の分子量同士を比較して、これらの差異に基づき、除去されたアミノ酸をC末端側から特定する。
【0026】
質量分析工程(S105)に用いる質量分析装置として、たとえば、イオントラップ質量分析計、四重極型質量分析計、磁場型質量分析計、飛行時間(TOF)型質量分析計、フーリエ変換型質量分析計などを用いることができる。また、イオン化法として、エレクトロスプレーイオン化法(ESI法)、マトリックス支援レーザー脱離イオン化(MALDI)法、高速原子衝突イオン化(FAB)法などが挙げられる。
【0027】
このうち、たとえばMALDI−TOF−MSが好適に用いられる。MALDI−TOF−MSを用いることにより、イオン化過程において、ペプチド断片を構成するアミノ酸残基から一部の原子団が欠落することを抑制することができる。また、比較的高分子量のペプチド断片の測定を好適に行うことができる。また、測定対象のタンパク質を試料中からゲル電気泳動を用いて分離し、ゲル中で上述の処理を施した後、回収して測定に供する場合にも、対応する陰イオンと陽イオンの両方を測定可能である。これらのことから、MALDI−TOF−MSを用いることにより、さらに再現性の高い分析を行うことができる。
【0028】
以下、質量分析にMALDI−TOF−MSを用いる場合を例に、説明する。MALDI−TOF−MSのイオン化過程では、ペプチド断片にプロトン(H+)が付加された陽イオン種と、ペプチド断片からプロトンが離脱された陰イオン種とをそれぞれ測定することが可能となる。本実施形態では、測定モードを選択し、陽イオン種と陰イオン種とをそれぞれ個別に測定する。
【0029】
ここで、質量分析工程(S105)は、断片化工程(S104)の後に行われるので、断片化工程にトリプシンによるプロテアーゼ処理を採用するとC末端欠損ペプチドを構成するアミノ酸残基中にはアルギニン残基が含まれていない。一方、断片化工程(S104)で得られるピログルタミル化ペプチド断片にはプロトン受容能に富むグアニジノ基を持つアルギニン残基が含まれているため、これらに由来する陽イオン種の安定化が図られる。
【0030】
このため、質量分析において、陽イオン種を測定した結果と、陰イオン種を測定した結果とを比較すると、C末端欠損ペプチド断片とピログルタミル化ペプチド断片とは、その相対強度が異なる挙動を示す。この現象を利用すれば、MALDI−TOF−MS装置によって測定される複数種のピーク中より、一連のペプチド断片に起因するピークを識別し、特定することが可能となる。
【0031】
陽イオン種の質量分析スペクトル中では、C末端にアルギニン残基を有するペプチド断片群に起因するピーク強度が相対的に強くなる。一方、アルギニン残基の存在してないC末端側ペプチド断片は、プロトン供与能を示すカルボキシ基をそのC末端に有する。このため、MALDI−TOF−MS装置で測定される陽イオン種の質量分析スペクトル中において、ピログルタミル化ペプチド断片群に起因するピーク強度が相対的に強くなる。また、陰イオン種の質量分析スペクトル中において、C末端欠損ペプチド断片群に起因するピーク強度が相対的に強くなる。
【0032】
したがって、陰イオン種による質量分析によりC末端欠損ペプチド断片の分子量を測定することができる。また、陽イオン種による質量分析により、ピログルタミル化ペプチド断片の分子量を測定することができる。また、陽イオン種による質量分析により、ペプチドのN末端を含み、C末端がアルギニンで切断されたペプチド断片の分子量も測定することができる。また、陽イオン種による質量分析では、質量精度のより高いリフレクターモードを好適に使用することができる。これにより、ピログルタミル化ペプチド断片を精度のよく測定することができる。
【0033】
なお、ステップ105の質量分析に供するペプチド断片の長さは、たとえば20〜30アミノ酸残基以下とすることができる。こうすることにより、質量分析の際に、ペプチド断片のイオン化を確実に行うことができる。
【0034】
ステップ106では、陰イオン種による質量分析の結果を用いて、C末端欠損ペプチドの分子量と、ペプチドとの分子量との差を算出することにより、C末端欠損ペプチドの逐次的分解による分子量の減少量を求める。
【0035】
一連のC末端欠損ペプチドに対応する陰イオン種は、陰イオン種による分子量測定において相対的に大きな強度を与えるため、陰イオン種により測定された分子量に基づいて、C末端アミノ酸の逐次的分解に伴う分子量減少を簡便な方法で容易に把握することができる。このため、もとのペプチドからC末端1残基欠損ペプチド、C末端2残基欠損ペプチド、以下、順次C末端n残基欠損ペプチド(nは自然数)までの各C末端欠損ペプチドについて、アミノ酸残基1個の欠損により生じる分子量の減少量を算出し、この減少量をアミノ酸残基の分子量と比較すれば、C末端からのアミノ酸配列を決定することができる。
【0036】
そして、データベースに記録された一連の既知アミノ酸配列の中から、同定された所定の数のアミノ酸から構成されるペプチドのC末端アミノ酸配列と一致するC末端アミノ酸配列を有する一群の既知アミノ酸配列を抽出する。データベースには、タンパク質やペプチドのアミノ酸配列情報が格納されている。
【0037】
同定するC末端残基のアミノ酸は任意の個数でよいが、より多くのアミノ酸を同定すれば、データベースから抽出する一群の既知アミノ酸配列の数を少なくすることができ、ステップ107の帰属工程が容易になる。
【0038】
ステップ107では、陽イオン種による質量分析の結果を用いて、ピログルタミル化ペプチド断片の分子量を同定する。ピログルタミル化ペプチド断片のN末端はグルタミン酸で切断を受け、かつ、ピログルタミン酸に変換されている。ピログルタミン酸は、グルタミン酸が分子内で脱水されることにより生じるため、グルタミン酸より脱水した分、分子量が小さく観測される。すなわち、水の分子量(18Da)に相当する分、分子量が小さく観測される。
【0039】
また、陽イオン種による質量分析では、ペプチドのN末端を含み、C末端がアルギニンで切断されたペプチド断片も検出することができる。
【0040】
ピログルタミル化ペプチド断片の分子量、N末端がグルタミン酸であることおよびC末端がアルギニンであることの情報に基づき、ピログルタミル化ペプチドのアミノ酸配列の帰属を行う。具体的には、ステップ106で抽出された既知アミノ酸配列を参照し、ピログルタミル化ペプチド断片のアミノ酸配列を含むもっとも確からしい一の既知アミノ酸配列を選択する。
【0041】
ピログルタミル化ペプチド断片は、リシンのε−アミノ基がN−アシル化されている。したがって、既知アミノ酸配列のリシンもN−アシル化されたものとして分子量を算出する。また、既知アミノ酸配列のN末端のアミノ基もN−アシル化されたものとして分子量を算出する。
【0042】
一の既知アミノ酸配列を選択できれば、解析対象となるペプチドのアミノ酸の配列は、選択した既知アミノ酸配列に相当することになる。したがって、解析対象のペプチドのアミノ酸配列を同定することができる。一方、一の既知アミノ酸配列を選択できない場合は、ステップ106に戻り、同定するペプチドのC末端アミノ酸残基の個数を増やす。これにより、データベースから抽出する既知アミノ酸配列をさらに絞り込むことができる。
【0043】
以下、本実施の形態に係るペプチドの同定方法を利用したタンパク質の解析方法を図1に従って具体的に説明する。
【0044】
解析対象となるペプチドに対してC末端逐次分解反応を施し、該ペプチドのC末端部において複数残基アミノ酸が外れた一連の反応産物の作成を行う。図1に示すように、C末端逐次分解反応においては副反応を抑制するためにあらかじめアシル化処理を行い、アミノ基、水酸基をN−アシル、O−アシル化する前処理工程(S101)を設ける場合がある。C末端逐次分解工程(S102)後はスペクトルを良好にするために残存する5−オキサゾロン環やO−アシル化をうけたセリン、スレオニン、チロシンの水酸基を加水分解するためアルカリ処理を行う(後処理工程、S103)場合がある。これらの工程を経て得られた反応産物に対してアミノ酸に特異的な断片化法を施し(S104)、ペプチドを質量分析の可能な大きさに断片化し、質量分析を行う(S105)。この際、C末端部分のアミノ酸配列と内部のグルタミン酸で切断を受け、ピログルタミン酸となった断片の分子量の測定を行う。こうして得られた情報はデータベース内にあるペプチドの同定のために有効に利用される。具体的には、得られたC末端のアミノ酸配列情報により、ある程度ペプチドを絞り込む(S106)。たとえば、4残基のアミノ酸配列が確定すると、ペプチドの候補は(1/20)×(1/20)×(1/20)×(1/20)に絞り込まれる。つぎに絞り込まれたペプチドに対して、グルタミン酸がピログルタミン酸に変換されたと仮定して、観測結果とマッチするペプチド断片を生成しうるかどうかをサーベイし(S107)、もっとも観測事実を説明できるペプチドを第一候補として、データベースサーチを終了する。
【0045】
C末端逐次分解反応については、公知の技術(たとえば、特開2003−279581、特許文献1)を用いる。
【0046】
反応が進行する際に想定される解析対象のペプチドの様子を図2に示す。すなわち、解析対象となるターゲットペプチドに対して、たとえば無水酢酸処理等により前記C末端逐次分解反応を遂行する。これにより、得られる化学処理済みのペプチドは、C末端側からアミノ酸が連続的にはずれたものとなる。したがって、欠損数の異なるC末端欠損ペプチドの分子量の差分が配列情報となる。C末端逐次分解反応の際、たとえばアルカン酸無水物として無水酢酸、アルカン酸として酢酸を使用した場合、該ペプチドの反応産物は一般に、N末端のアミノ基およびリシン残基のアミノ基はすべてアシル化を受けて、N−アセチル化の状態となる。また、O−アセチル化を受けていたセリン、スレオニン、チロシンの水酸基はすべて前記後処理工程による加水分解をうけ、フリーの水酸基となっている。該ペプチドのC末端部分は数残基が外れた状態となり、残余している5−オキサゾロン環は前記後処理工程による加水分解をうけ通常のカルボキシ基が形成されている。
【0047】
この段階で該反応産物に対して断片化処理を施す。たとえばトリプシンが望ましく使用される。トリプシンが適用された場合、図2に示すとおり該ペプチドのC末端逐次分解反応産物はアルギニンのC末端側で切断される。トリプシンのもうひとつの切断アミノ酸であるリシンは該反応の結果定量的にアセチル化を受けているのでトリプシンによっては認識されず、切断を受けることはない。したがって、断片化後のペプチド断片群は次の2つのグループに大別される。すなわち、(1)該ペプチドの内部フラグメントでそのC末端部分がアルギニンであるペプチド断片。(2)該ペプチドのC末端部分でアルギニンを含まず、かつ、C末端はC末端逐次分解反応の結果一定ではなく、さまざまな数のアミノ酸が切断してなるミクスチャーの状態のペプチド断片群。(2)のペプチド断片群の個々のペプチド断片のN末端のアミノ酸はトリプシンによる切断片であるため特定のアミノ酸にそろっているが、どのアミノ酸であるかはわからない。なお、図2では、Rはアルギニンを示し、Pyrはピログルタミン酸を示している。
【0048】
前記断片化されたペプチド断片群(1)(2)のミクスチャーを一括して質量分析にかける。この場合、MALDI−TOF MSが好適に使用される。質量分析は、ポジティブイオンモード(陽イオン種)とネガティブイオンモード(陰イオン種)の両方で行う。ポジティブイオンモードで測定した場合、アルギニンの効果があるため(1)のペプチド断片群が非常に強く観測される。この際、少なからず、グルタミン酸のアミノ基側での開裂の結果生じたピログルタミン酸をN末端にもち、C末端にはアルギニンを持つペプチドが観察される。一方ネガティブイオンモードで測定した際は、(2)のペプチド断片群が比較的強く観察され、これらのイオン種はC末端逐次分解反応によりC末端側からいくつかのアミノ酸が欠落したペプチド断片群であるから、スペクトルはラダー状を呈し、ピーク間の質量差はすなわちC末端からのアミノ酸配列を反映したものとなる。このようにして、解析対象のペプチドのいくつかの内部フラグメントの分子量(グルタミン酸のアミノ基側で切断を受けたフラグメントはそのグルタミン酸はピログルタミン酸へ変換されている)とC末端のアミノ酸配列およびC末端ペプチド断片の分子量が同時に得られることになる。
【0049】
つまり、(1)のペプチド群はアルギニンが末端に必ず存在するのでポジティブモード測定時に強く観測される。一部はグルタミン酸で切断を受けて、かつ、グルタミン酸はピログルタミン酸(Pyr)に変換されている。これも、C末端部分はアルギニンなので非常に強く観測される。一方、(2)のC末端部アミノ酸が逐次分解されたペプチド群はアルギニンがないのでネガティブモードによる測定時、相対的に強調される。
【0050】
前記解析で得られたC末端アミノ酸配列とC末端ペプチド断片の分子量は解析対象のペプチドをデータベース上で絞り込む際に使用される。一般には配列の一残基が決定されると候補は1/20に減少するので、決定されたC末端アミノ酸配列数に応じてデータベース中のペプチドの数は指数関数的に絞り込まれる。さらにC末端ペプチド断片の分子量が特定されることからもデータベース中のペプチドの候補数は大幅に絞り込まれることになる。
【0051】
絞り込まれたペプチドをさらに絞り込むためにポジティブイオンモードで非常に強く観測されるペプチド断片が有効に利用される。これらのペプチド断片のC末端は前記の通りアルギニンであることが化学的に保証されている。また該ペプチド断片のN末端は通常通りトリプシンによりアルギニンのC末端側で切断を受けたものか、あるいは、前記のとおり、グルタミン酸で切断を受け、かつ、ピログルタミン酸に変換されている(グルタミン酸より脱水した分(18Da)分子量が小さく観測される)ものと推定されるので、前記C末端配列とC末端ペプチド断片の分子量により絞り込まれた候補からこのようなポジティブイオンモードで強く観測されるペプチド断片を生成しうるペプチドをサーベイすることにより、ペプチドの同定がより高精度になされる。
【0052】
図3にはグルタミン酸のアミノ基側で切断を受けて生じるピログルタミン酸の構造を図示した。分子内で脱水をおこし環状構造となるので、アミノ末端のアミノ酸がグルタミン酸とした場合の分子量より18Da小さくなる。トリプシンにより断片化処理を行うと図2に示すとおり、該脱水体ペプチド断片のC末端はアルギニンとなるので、ポジティブイオンモードで非常に強く観察される。また、この特徴を生かすため、測定感度は劣るものの測定精度のより高いリフレクターモードが好適に使用される。
【0053】
以上のように、本実施の形態に係る方法によれば、化学的C末端配列解析法とGlu−N開裂反応を組み合わせたペプチドのデータベースサーチ方法を提供することができる。
【0054】
本実施の形態に係る方法は、ペプチドの配列をデータベースサーチする際の化学的手法を組み合わせた高精度化に関する。より具体的には、ペプチドのC末端側からの逐次分解反応によって得られるペプチドのC末端配列とその際同時に副反応産物として生じるグルタミン酸のアミノ基側でのペプチド結合の開裂反応、およびその最終反応産物であるピログルタミン酸を検出することで解析対象のペプチドのデータベースサーチをより高精度に行うものである。
【0055】
本実施の形態に係る方法は、ペプチドのC末端アミノ酸の逐次的分解という信頼性の高い化学的手法の効果を最大限データベースサーチに利用することを特徴とする。すなわち、ペプチドのC末端アミノ酸逐次分解反応によるペプチドのC末端部が逐次的にアミノ酸単位で分解されて形成される反応産物を酵素的あるいは化学的に分解して得られる反応産物を質量分析にかけ、スペクトルの測定を行うが、このさいネガティブイオンモードで測定されるスペクトルにあってはC末端配列情報の取得を行うと同時に、ポジティブイオンモードで測定されるスペクトルにあってはC末端アミノ酸逐次分解反応の副反応産物であるグルタミン酸のアミノ基側での開裂、および、開裂の際形成されるピログルタミン酸の帰属を行うことでデータベースサーチをより精度の高いものとしている。
【0056】
つづいて、本実施の形態の効果について説明する。
【0057】
本実施の形態によれば、解析対象のペプチドに対して所定の化学的処理を施し、かつ、質量分析法を利用することにより、より多くの配列情報を取得してデータベースから一のアミノ酸配列を選択することができる。したがって、解析対象となるペプチドのアミノ酸配列を精度よく同定することができる。
【0058】
具体的には、本実施の形態によれば、解析対象とするペプチドからC末端欠損ペプチドとピログルタミル化ペプチドとを得ることにより、C末端欠損ペプチドの分子量の測定結果とピログルタミル化ペプチドの分子量の測定結果とに基づいてデータベースに記録された一連の既知アミノ酸配列の中から、効率よく簡便に一の既知アミノ酸配列を選択することができる。したがって、精度よくペプチドのアミノ酸配列を同定することができる。
【0059】
従来の技術では、C末端欠損ペプチドのみの質量分析結果に基づいて、アミノ酸配列の分析を行うものであった。そのためデータベースを利用したペプチドのアミノ酸配列の解析を行う場合、情報量が足りないという問題があった。しかしながら、本実施の形態によれば、C末端欠損ペプチドを生成するとともにグルタミン酸を切断し、ピログルタミル化されたペプチドを得ることにより、ピログルタミル化されたペプチドの質量分析によって得られる情報を利用することができる。したがって、アミノ酸配列のデータベースを利用して精度よくペプチドのアミノ酸配列を同定することができる。
【0060】
また、本実施の方法によれば、ペプチドの、特に有効ペプチド断片の生成個数が少数に限られることの多い低分子量のペプチドのデータベースサーチの精度が格段に向上する。
【0061】
以上、図面を参照して本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【0062】
たとえば、以下の各態様も、本発明の範囲内として有効である。
(1)解析対象とするペプチドをデータベース検索により同定する手法の一つであり、少なくとも次に示す化学反応とその反応に特徴的なペプチド結合の切断反応を応用して、データベース検索を遂行することを特徴とする、ペプチドの同定方法;すなわち、解析対象とするペプチドに対してC末端逐次分解反応を施して該ペプチドのC末端部において複数個のアミノ酸が遊離した一連の反応生成物を作成し、該反応生成物に対して特定のアミノ酸で断片化するプロテアーゼ処理ないし化学反応処理を施し、該断片化処理により得られたペプチド断片群に対して、質量分析を行い、ネガティブイオンモードによる質量分析においては該ペプチドのC末端アミノ酸配列情報およびC末端ペプチド断片の分子量情報を取得し、ポジティブイオンモードによる質量分析においては該ペプチドのグルタミン酸切断断片を副反応に伴う質量変化を考慮しつつデータベース中の配列データに対して帰属操作を行い、二つのイオンモードで得られる情報をあわせてデータベースサーチを行うことにより、解析対象であるペプチドの同定を行うデータベースサーチ方法。
(2)前記C末端逐次分解反応はアルカン酸無水物に対してアルカン酸またはパーフルオロアルカン酸を少量添加してなる溶液を乾燥ペプチドに滴下し、10℃〜60℃に設定される温度において1〜16時間に設定される時間反応させることを特徴とするペプチドのデータベースサーチ方法。
(3)前記C末端逐次分解反応は解析対象となるペプチドがゲル単体に保持されている際は、アルカン酸無水物にアルカン酸またはパーフルオロアルカン酸を少量添加してなる溶液を双極性非プロトン性溶媒に溶解してなる溶液によりゲル単体を無水的に膨潤せしめ、アルカン酸無水物によるC末端逐次分解反応をゲル担体中に保持されたペプチドにたいして10℃〜60℃に設定される温度において1〜16時間の反応させることを特徴とするペプチドのデータベースサーチ方法。
(4)前記C末端逐次分解反応はアルカン酸無水物に対してアルカン酸またはパーフルオロアルカン酸を少量添加してなる溶液から蒸発するガス状の試薬が閉鎖経路を通じて解析対象のペプチドに到達し、C末端逐次分解反応を10℃〜60℃に設定される温度において1〜16時間の任意の時間反応させることを特徴とするデータベースサーチ方法。
(5)前記C末端逐次分解反応において、アルカン酸無水物に対してアルカン酸を添加してなる溶液を用い、解析対象となるペプチドに対してC末端逐次分解反応に先行して、ペプチドに存在する可能性のあるアミノ基のN−アシル化、水酸基のO−アシル化を施すことにより、不要な副反応を極力排除する保護反応を前処理として行うことを特徴とするデータベースサーチ方法。
(6)前記C末端逐次分解反応において、ピリジン水溶液処理にてC末端逐次分解反応を短時間で達成する触媒処理を施すデータベースサーチ方法。
(7)前記C末端逐次分解反応において、C末端部に残存する5−オキサゾロン、水酸基に入っているO−アシル基を加水分解するために含窒素芳香環化合物または第3級アミン水溶液を50℃〜100℃、1時間〜8時間の範囲で選択される後処理工程を含むことを特徴とするデータベースサーチ方法。
(8)前記C末端逐次分解反応において使用するアルカン酸無水物は無水酢酸であることを特徴とするデータベースサーチ方法。
(9)前記C末端逐次分解反応において使用するアルカン酸は酢酸であることを特徴とするデータベースサーチ方法。
(10)前記C末端逐次分解反応の後、反応産物を断片化する際に使用する手法として、トリプシンによる断片化を行うことを特徴とするデータベースサーチ方法。
(11)前記化学反応産物の質量分析においてMALDI−TOF MSを使用し、同一反応産物に対してポジティブイオンモード、ネガティブイオンモード両方の測定を行い、ポジティブイオンモードにおいてはグルタミン酸のアミノ基側での切断および切断産物がピログルタミン酸に変換されることを予期して測定される各イオンのm/zをデータベースと照合する工程と、ネガティブイオンモードにおいては該ペプチドのC末端アミノ酸配列を抽出してデータベースと照合する工程とを併せ持つことを特徴とするデータベースサーチ方法。
(12)前記パーフルオロアルカン酸が、0.3〜2.5の範囲内の酸解離定数(pKa)を有し、炭素数2〜4のパーフルオロアルカン酸であることを特徴とするデータベースサーチ方法。
(13)前記パーフルオロアルカン酸がトリフルオロ酢酸であることを特徴とするデータベースサーチ方法。
(14)前記後処理工程に使用される第三級アミン化合物がジメチルアミノエタノールであることを特徴とするデータベースサーチ方法。
【実施例】
【0063】
以下に、実施例を挙げて、本発明をより詳細に説明するが、本発明の範囲は、かかる実施例により何ら限定されるものではない。
【0064】
本発明の有効性を検証する目的で、ゲル担体上に担持されている153アミノ酸からなるヘムタンパク質、ウマ由来のミオグロビンについて、そのタンパク質部分グロビン・ペプチド鎖のC末端逐次分解反応を行った。
【0065】
本実施例では、解析対象試料となるウマ・ミオグロビンを、ポリアクリルアミド・ゲルを利用して、SDS−PAGE法によりゲル電気泳動して、バンドとして、そのグロビン・ペプチド鎖を分離した後、本発明にかかる解析方法で生成される該ペプチドにかかる情報、すなわち、C末端アミノ酸配列情報、C末端ペプチド断片分子量およびピログルタミン酸を含む内部ペプチド断片の分子量情報の取得について述べる。
【0066】
(ゲル電気泳動法による単離)
市販されているウマ・ミオグロビン標品について、1μg/μLの濃度でグロビン・ペプチド鎖部分のみを含有するペプチド溶液を調製した。なお、該ウマ・ミオグロビンのグロビン・ペプチド鎖部分には、ヒト・ミオグロビンと異なり、システイン残基は存在しないが、仮に、ヒト・ミオグロビンなどのように、システイン残基を内在するペプチドに対しては、該システイン残基のスルファニル基(−SH)の酸化による、−S−S−結合の形成を回避するため、2−スルファニルエタノール(HS−C2H4−OH:2−メルカプトエタノール)、DTT(ジチオトレイトール:トレオ−1,4−ジスルファニル−2,3−ブタンジオール)などの還元性試薬を添加するなどして、予め酸化防止処理を施した。場合によっては、予め、システイン残基のスルファニル基(−SH)に対して、カルボキシメチル化などの保護を施した。
【0067】
このペプチド溶液を、ゲル濃度12.5質量%のポリアクリルアミド・ゲル上に電気泳動し、泳動処理後、クーマシー・染色により、目的とするグロビン・ペプチド鎖のバンドを特定した。本例では、かかる染色バンド部のゲルを切り出し、ゲル切片を以下の一連の操作に供した。
【0068】
(ゲルのピリジン溶液処理)
ゲル切片を、気密性を有するチューブに入れ、20体積%濃度のピリジン水溶液1mLを注入し、2時間攪拌した。こうすることにより引き続き行われる脱水処理の結果ゲル内にわずかに残存するピリジンの触媒効果によりC末端逐次分解反応を実用的な短時間のうちに終了した。これは、引き続き行われる脱水処理の結果ゲル内にわずかに残存するピリジンの触媒効果と考えられる。
【0069】
(ゲルの脱水処理)
ピリジン処理したゲル切片を、気密性を有するチューブ中に入れ、アセトニトリル1mLを注入し、15分間攪拌した。その後、前記アセトニトリルを棄て、新たに、アセトニトリル1mLを注入し、更に15分間攪拌した。このアセトニトリルを利用する、ゲル中に含浸する水の抽出処理を、合計3回行い、ゲルの脱水処理を行った。脱水処理によりゲル体積の収縮が生じた。
【0070】
(C末端逐次分解処理操作)
次にチューブ中で、脱水処理済みのゲル切片に、30体積%濃度の無水酢酸のホルムアミド溶液1mLを注入した。乾燥雰囲気下で、密栓したチューブを攪拌しつつ、該容器全体の温度を、50℃に加熱し、かかる温度に、3時間保持する。この加熱保持の間に、当初、体積収縮しているゲルは、溶媒ホルムアミドの浸潤に従って、再膨潤し、本来の体積に復した。この再膨潤したゲル中に担持されているグロビン・ペプチド鎖に対して、溶質の無水酢酸が、前記加熱温度で作用する結果、ペプチドのN末端アミノ基に選択的なアセチル化反応が進行した。加えて、ペプチド鎖内に含有される、リシン残基(−NH−CH(CH2CH2CH2CH2NH2)−CO−)のε位のアミノ基へのN−アセチル化、同時に、セリン残基(−NH−CH(CH2OH)−CO−)やトレオニン残基(−NH−CH(CH(CH3)OH)−CO−)に存在するヒドロキシ基に対するO−アセチル化、チロシン残基(−NH−CH(CH2−C6H4−OH)−CO−)のフェノール性ヒドロキシ基へのO−アセチル化がなされた。
【0071】
この再膨潤したゲル中に担持されているペプチド鎖C末端に対して、無水酢酸を前記加熱温度で作用させることで、ペプチド鎖のC末端アミノ酸の選択的分解反応が進行した。具体的には、ペプチドのC末端において、5−オキサゾロン環形成を介し、ペプチド鎖のC末端アミノ酸の逐次的分解反応が進行すると推定される。
【0072】
このC末端アミノ酸の逐次的な分解反応が進行し、ゲル中には、段階的にC末端アミノ酸が除去された、一連の反応産物と、初段の5−オキサゾロン構造への変換時点に留まっている、アセチル基による修飾・保護を施した元のペプチド鎖とが含まれた混合物が、ゲル担体に担持された状態で残される。かかるC末端アミノ酸の逐次的分解処理を終えた後、容器内に残留する、未反応の無水酢酸を含むホルムアミド溶液を除去し、次に説明される加水分解処理を行った。
【0073】
(加水分解処理)
反応産物が含まれる混合物が担持されている状態のゲル切片を入れた前記容器内に、DMAE((CH3)2N−CH2CH2OH)10体積%濃度の水溶液1mLを注入した。密栓した該容器を攪拌しつつ、15分間この状態を保持した。この操作を3回行い、最後にさらに1mLの該水溶液を注入した。容器全体の温度を、60℃に加熱し、かかる温度に、2時間保持した。加水分解処理の目的は、前記混合物中に存在する反応産物ペプチドのC末端が、カルボキシ基に変換されたもの以外に、5−オキサゾロン構造に留まったもの、あるいは、非対称型酸無水物への変換まで進行したものも含まれた混合物状態となっているため、これらに加水分解処理を施し、ペプチドのC末端をカルボキシ基となった状態へとそろえることである。加えて、塩基性窒素含有有機化合物が塩基触媒として機能することに伴い、アセチル基による修飾・保護を施したペプチド鎖上の、セリン残基(−NH−CH(CH2OH)−CO−)やトレオニン残基(−NH−CH(CH(CH3)OH)−CO−)に存在するヒドロキシ基に対するO−アセチル化保護は加水分解され、脱保護がなされた。また、チロシン残基(−NH−CH(CH2−C6H4−OH)−CO−)のフェノール性ヒドロキシ基へのO−アセチル化保護の加水分解も、同様に進んだ。但し、用いる有機塩基の塩基性は高くないため、N−アセチル化保護の脱保護は進まず、最終的に後処理工程後には、より高い選択性を持って、N末端のアミノ基に対するN−アセチル化、リシン残基(−NH−CH(CH2CH2CH2CH2NH2)−CO−)のε位のアミノ基へのN−アセチル化が残るものとなる。場合によっては、チロシン残基(−NH−CH(CH2−C6H4−OH)−CO−)のフェノール性ヒドロキシ基へのO−アセチル化が、極僅かに残るものとなった。
【0074】
かかる加水分解処理工程を終えた後、容器内に残留する水溶液を除去し、容器中にアセトニトリル1mLを注入し、15分間攪拌した。その後、前記アセトニトリルを棄て、新たにアセトニトリル1mLを注入し、更に15分間攪拌した。このアセトニトリルを利用する、ゲル中に含浸する水溶液の抽出処理を、合計3回行い、再膨潤ゲル中の脱水処理を行う。脱水処理に伴い、ゲル体積の収縮が生じた。
【0075】
(トリプシン消化によるペプチド断片化)
ウマ・ミオグロビンのグロビン・ペプチド鎖は、153アミノ酸からなる(配列番号1)ため、質量分析における、適正な分子量範囲を逸脱しており、トリプシン消化によるペプチド断片化処理を行った。
【0076】
具体的には、前記の加水分解処理を施し、脱水処理済みのゲル切片を入れた容器内に、トリプシン含有水溶液を加え、ゲル担体上に担持されている状態のままペプチド鎖の断片化を行った。前記トリプシン含有水溶液は、重炭酸アンモニウム緩衝液(pH8)中に、トリプシンを0.067μg/μLの濃度で含有しており、トリプシン消化は37℃で16時間酵素反応を行った。その際、脱水処理されていたゲルは、溶媒水の浸潤に従って速やかに再膨潤し本来の体積に復した。この再膨潤したゲル中に担持されているペプチド鎖、反応産物に対して、前記緩衝液とともに、ゲル中に浸入するトリプシンを前記加熱温度で作用させることで、トリプシンに特異的な酵素消化が進行した。
【0077】
なお、ペプチド鎖、反応産物は、前記加水分解処理工程における脱保護によっても、N末端のアミノ基に対するN−アセチル化、リシン残基(−NH−CH(CH2CH2CH2CH2NH2)−CO−)のε位のアミノ基へのN−アセチル化は保持された状態であり、トリプシン消化によっては、前記N−アセチル化リシン残基のC末側ペプチド結合の切断はなされず、アルギニン残基のC末側ペプチド結合切断が進行した。このウマ・ミオグロビンのグロビン・ペプチド鎖が有するアミノ酸配列は既に判明している。
【0078】
図4は、ウマ・ミオグロビンのシークエンスを示す図である。図4に示すようにアルギニン残基のC末側ペプチド結合切断に伴い、153アミノ酸からなる元のペプチド鎖は、1−31(配列番号2)、32−139(配列番号3)、140−153(配列番号4)の各部分アミノ酸配列を含む断片に、トリプシン消化を受けた。なお、図4には、C末端逐次分解反応操作に伴い、N−アセチル化保護が施されるリシン残基およびアミノ末端を持つ残基番号1のグリシンを下線で示し、さらには、トリプシン消化による、アルギニン残基のC末側ペプチド結合切断で生じる、N末側の1−31とC末側の140−153の各部分アミノ酸配列を大文字で示す。32−139の部分のアミノ酸配列を小文字で示す。
【0079】
ターゲットペプチドは、リシンのε位のアミノ基がN−アセチル化されているため、ウマ・ミオグロビンのリシンもアセチル化されたものとして質量を計算する。また、ターゲットペプチドのN末端もN−アセチル化されている。したがって、ウマ・ミオグロビンのグリシンもアセチル化されたものとして質量を計算する。
【0080】
トリプシン消化によって断片化されると、これらのペプチド断片は、ゲル担体からの溶出を生じ易くなり、容器内のトリプシン溶液中に溶出した。なお、かかるトリプシン消化処理工程では、前記140−153アミノ酸の部分アミノ酸配列を含むC末端断片とともに、上述するC末端アミノ酸の逐次的分解処理で生成される一連の反応産物に由来するC末端断片も、容器内のトリプシン溶液中に溶出した。すなわち、該トリプシン消化処理は、長いアミノ酸長のペプチド鎖から、そのC末端部分を、質量分析に適合する所望の分子量範囲のペプチド断片とするとともに、かかるペプチド断片を、ゲル中から高い収率で溶出、回収した。
【0081】
かかるトリプシン消化処理工程を終えた後、ゲル中から容器内のトリプシン溶液中に溶出する断片化されたペプチド断片を回収した。回収されたペプチド断片の混合物を含む溶液について、脱塩処理を施した後、真空乾燥処理を行った。
【0082】
(加水分解処理、トリプシン消化によるペプチド断片化済みの反応産物の特定)
以上の一連の処理を施して得られる、加水分解処理、ペプチド断片化済みの反応産物とグロビン・ペプチド鎖のC末端断片との混合物について、質量分析法により、含有される各ペプチド断片の分子量の測定を行った。
【0083】
MALDI−TOF−MS装置を利用し、各ペプチド断片の分子量を反映する主イオン種ピークの質量測定を行った。なお、かかるMALDI−TOF−MS装置を利用する測定では、イオン種の分別は、負帯電イオン種を検出器へ導く、所謂ネガティブイオンモードの測定と、正帯電イオン種を検出器へ導く、所謂ポジティブイオンモードの測定との双方を行った。すなわち、各ペプチド断片の分子量を反映する主イオン種として、ポジティブイオンモードの測定において、プロトン(H+)が付加された陽イオン種、ネガティブイオンモードの測定において、プロトン(H+)が離脱した陰イオン種の、対応する二種のスペクトルを得た。
【0084】
図5は、ウマ・ミオグロビンを逐次分解後トリプシン消化を行い、得られたペプチド断片群をネガティブイオンモード(リニアモード)で測定してC末端配列情報を観測した質量分析ペクトルである。図5に示すネガティブイオンモードの測定では、ポジティブイオンモードでの測定結果との比較から相対的な強度が増加するピークとして、140−153、140−152、140−151、140−150、140−149の5本のピークが観測され、配列情報としてC末端側から「GQFG」と4残基の配列が推定された。また、トリプシンによる断片化操作の結果得られたC末端フラグメントは1634.6の分子量をもつことが確認できた。これらの情報はデータベースサーチの際に利用された。すなわち、解析対象となるペプチドのC末端フラグメントは1634.6としてネガティブイオンモードで観測される分子量を持つこと、このペプチド断片のN末端のアミノ酸のアミノ基側にあったトリプシンにより切断を受けたアミノ酸はアルギニンであったはずであること、このペプチド断片あるいは解析対象のペプチドのC末端アミノ酸配列はアミノ基側から「GFQG」であること、などがデータベースサーチの際に利用された。なお、データベース検索の際にはリシン残基はアセチル化を受けているものとして検索を行った。この検索によりペプチドの候補群が1次候補群として絞り込まれた。
【0085】
表1に、測定されたピークの質量値、元のグロビン・ペプチド鎖のC末端断片に起因するピークの質量値、質量値の差異、ならびに、それから特定される各反応産物断片において除去されているアミノ酸、および、各反応産物の形態を示す。
【0086】
【表1】

【0087】
図6には図5の測定で使用した同じペプチド断片混合物をポジティブイオンモードで高精度が出るリフレクターモードを使用して測定した結果の質量分析スペクトルを示す。図6は、ウマ・ミオグロビンを逐次分解後トリプシン消化を行い、得られたペプチド断片群をポジティブイオンモードで測定して、ピログルタミン酸をN末端に持つペプチドを高精度(リフレクターモード)で測定して得られる。「T」はトリプシンの自己消化物断片を示す。
【0088】
3本のピークが逐次分解特異的なグルタミン酸のアミノ基側での切断とその結果形成されるピログルタミン酸をN末端に、またアルギニンをC末端側にもつペプチド断片として観測された。図6中の「T」はトリプシンの自己消化物を示す。トリプシンの自己消化物ペプチド断片の分子量は公知であるから解析作業からはあらかじめ除外された。残りの3本のピークは対応するペプチド断片が「N末端がピログルタミン酸でC末端がアルギニンである」ものと仮定して前記ペプチドの1次候補群の中からトリプシンによる断片化処理により生じうるかどうか絞り込んだ。3本のピークはまたグルタミン酸の切断を伴わずアルギニンのカルボキシ基側での切断のみで生じている可能性も考慮した。
【0089】
こうすることにより前記ペプチドの1次候補群の中からウマ・ミオグロビンがもっとも確からしいものとして2次的に絞り込まれた。
【0090】
図7には高分子量領域(2800−3300)での測定結果得られた質量分析スペクトルを示す。図7は、ウマ・ミオグロビンを逐次分解後トリプシン消化を行い、得られたペプチド断片群をネガティブイオンモード(図7(a))、ポジティブイオンモード(図7(b))で測定した結果のスペクトルを示す。高分子量領域(2800−3300)測定のためリニアイオンモードを使用した結果である。P1、P2、P3、P4はP0((pyrE)WQQVLNVWGKVEADIAGHGQEVLIR[6−31])の2つのトリプトファンが酸化して得られたピークで、それぞれ1酸化体、2酸化体、3酸化体、4酸化体を示す。この場合、ネガティブイオンモードでは観測されないピークがポジティブイオンモードで5本観察されており、それぞれP0、P1、P2、P3、P4と示したピークの観測されたm/zは2999.8(P0)、3015.2(P1)、3032.1(P2)、3048.1(P3)、3064.1(P4)であった。これらのピークも上述の通りグルタミン酸で断片化を受けてピログルタミン酸化しC末端側にはアルギニンをもつペプチド断片として帰属でき、データベース検索に有効に利用された。なお、pyrEはピログルタミン酸を示す。[]内は残基番号である。また、図7(b)中、2999.80は、観測値を示す。
【0091】
前記実施例のデータベースサーチについてより詳しく記述する。まず、図4の結果および表1の結果から観測対象となっているペプチドのC末端配列は「GFQG」となっていることが推定される。この条件でデータベース検索を行うと、各種生物由来のミオグロビン54個、Methanococcus jannaschii 由来のProtein−L−isoaspartate O−methyltransferase1この合計55個のペプチドが候補としてヒットした。なおデータベースはSwiss−Prot ver. 41を使用した。図4の結果からはC末端ペプチド断片の分子量が1634.6と観測されていることから、Protein−L−isoaspartate O−methyltransferaseは候補から外れることがわかった。なぜならProtein−L−isoaspartate O−methyltransferaseのC末端断片の配列は「GDEIIIKDCGPVAFVPLVGKEGFQG」であり、リシンがアセチル化を受けているものとしてその分子量は2671.36、その観測値は2670前後となるはずだからである。この値をもつピークは観察されなかった。したがって1次候補として各種生物由来のミオグロビン54個が選択された。
【0092】
次に図6の結果からは観察対象のペプチドは611.27、546.39、1489.65というポジティブイオンモードで強調されるペプチド断片が生成されることがわかった。1次候補のなかからこれらの事実を反映するペプチドの選別をおこなうと、次の6種の動物に絞られた。すなわち、ウマ、ヨーロッパカワウソ、タヌキ、ユーラシアビーバー、南米ナキウサギ、ウサギである。これらの候補のうち、図7に示したP0、P1、P2、P3、P4に該当するペプチド断片に該当する分子量をもつピークを算出できるのはウマのみであることがわかった。図7のピーク、P0は「pyrEWQQVLNVWGKVEADIAGHGQEVLIR」に該当した。N末端はピログルタミル化、リシンはすべてアセチル化を受けているとすると分子量は2997.6となる。内部にあるトリプトファン(W)は容易に1酸化(+16)、2酸化(+32)を受けることが広く知られている。該ペプチド断片にはトリプトファンが2つあるので3酸化、4酸化も観測されるはずである。事実、これら酸化ピークがP1、P2、P3、P4に対応した。
【0093】
以上のように、C末端逐次分解反応により得られる反応産物をトリプシンで断片化し、C末端欠損ペプチド断片、ピログルタミル化ペプチド断片等を得ることによりC末端アミノ酸配列、C末端断片ペプチドの分子量、グルタミン酸がピログルタミル化した切断片の帰属、などを行うことにより、データベース中のペプチド群の中から、特定のペプチドの同定が可能であることが示された。
【図面の簡単な説明】
【0094】
【図1】実施の形態に係るペプチドの同定方法のフローチャートを示す図である。
【図2】実施の形態に係るペプチドの同定方法を説明する図である。
【図3】実施の形態に係る脱水型ペプチドの構造の一部を示す図である。
【図4】ウマ・ミオグロビンのアミノ酸配列を示す図である。
【図5】実施例に係るペプチドの質量分析スペクトルを示す図である。
【図6】実施例に係るペプチドの質量分析スペクトルを示す図である。
【図7】実施例に係るペプチドの質量分析スペクトルを示す図である。
【技術分野】
【0001】
本発明は、解析対象とするペプチドのアミノ酸配列を同定するペプチドの同定方法に関する。
【背景技術】
【0002】
ペプチドのアミノ酸配列について質量分析を利用してデータベースサーチする方法に関しては従来(1)PMF法、(2)ペプチドタグ法、(3)MS/MS法が知られている。
【0003】
このうち(1)PMF法では、ペプチドを特異性の高い分解方法で断片化し、得られた断片を質量分析にかけ断片化法の特異性を考慮して、データベース中のペプチドに対して特異的断片化法に対応するペプチド断片群の質量を算出し、実験結果と一致するペプチドをサーチする方法である。この方法は非常に簡便であること、近年の質量分析装置の精度が非常に向上したことがあいまって多用されている方法である。しかしながら、もとのペプチドがある程度以上大きくないと十分な数のペプチド断片が得られず、その結果データベースのペプチド候補がたくさん上げられひとつに絞り込めないことが多々あるのが問題であった。
【0004】
(2)のペプチドタグ法はシークエンスタグ法ともよばれ、ペプチド断片の断片化前の質量とそのペプチド断片に対して不活性ガスを当てるなどしてフラグメンテーションを生じさせた結果得られるイオン種を観測し、そのスペクトルから数残基のアミノ酸配列情報や組成、さらには、順序は問わないものの2残基分の特定のアミノ酸の組み合わせ、などの情報を取得し、ペプチド断片を得る際に使用した酵素の特異性なども加味して、データベースサーチを行い、ペプチドを帰属する手法である。近年、質量分析装置の高機能化、ハイブリッド化が促進されMS/MS法の性能・感度が向上しつつあり、(3)に述べるMS/MS法が多用される傾向があり、ペプチドタグ法はあまり用いられない。ペプチドのカバー率をなるべく上げることにより検索結果の確からしさを向上させようとする風潮がその傾向を加速している。
【0005】
(3)のMS/MS法はペプチドを断片化して得られたなるべく多数のペプチド断片のイオン種に対して不活性ガスをあてるなどしてペプチド結合部位でフラグメンテーションしアミノ酸配列を反映したフラグメントイオン種を生成させてこれを質量分析器で検出し、データベース中のペプチド断片群に対してもっともマッチするペプチド断片を含むペプチドをサーチするものである。マッチするペプチド断片の個数がより多いペプチドがより確からしい同定候補と判定される。しかしながら、ペプチド結合の開裂の程度は配列に大きく依存し、すべてのペプチド結合を一様に開裂させるように衝突エネルギーを調整することは難しい。また衝突エネルギーによってはペプチド結合以外の部分での断片化も生じることがあり、解析作業を複雑なものにしている。
【0006】
データベースサーチする際に、スペクトルをマッチさせるのではなく、化学的にアミノ酸配列を決定してペプチドを同定する方法もある。N末端からの配列情報はエドマン分解が標準的手法として認知されているが、アミノ基がブロックされている際には使用できない。また比較的時間がかかることもスループットを上げる際に問題となっている。一方、C末端側からの配列決定方法として無水酢酸による化学反応を基本として一連の反応より得られる反応産物の質量スペクトルからC末端アミノ酸配列情報を取得する方法もある。代表的な例としてアルカン酸無水物によるC末端アミノ酸の逐次分解反応が申請者らより報告されている。例えば、アルカン酸無水物(たとえば無水酢酸)蒸気に微量のパーフルオロアルカン酸(たとえばトリフルオロ酢酸)蒸気を混入させC末端アミノ酸を逐次的に分解する方法が提案されている(非特許文献1参照)。この手法によれば、スペクトルの複雑性を除去するためにC末端逐次分解前にペプチド群ないしペプチドに対して行うアシル化反応(前処理工程)とC末端逐次分解後に反応産物に対して行う含窒素芳香環化合物または第三アミン化合物による加水分解処理(後処理工程)を行うことが有効であることも併せて記載されている。また別に、ゲル担体に保持されたペプチドに対してはピリジン水溶液による処理が後の逐次分解反応を触媒することも申請者らより報告されている(非特許文献2参照)。
【0007】
【非特許文献1】Miyazaki,K.et al.,Proteomics.4,11−19(2004)
【非特許文献2】Miyazaki,K.et al.,Proteomics.6,2026−2033(2006)
【特許文献1】国際公開第2005−078447号パンフレット
【発明の開示】
【発明が解決しようとする課題】
【0008】
ペプチドをデータベース上で同定する際、従来のPMF法、MS/MS法では同定しきれないペプチドが存在していた。これらの手法が持つ構造的な欠陥、すなわち、ペプチドが比較的小さい場合、得られる断片が少なくなり、ペプチドをデータベース上に特定するには情報量が少なすぎる場合がある、という欠陥があった。
【0009】
このように、解析対象とするペプチドからより多くの情報量を取得し、データベース上のペプチドを特定することのできる簡便なペプチドの同定手法が望まれていた。
【課題を解決するための手段】
【0010】
本発明によれば、解析対象とするペプチドのアミノ酸配列を同定するペプチドの同定方法であって、
ペプチドのC末端からアミノ酸を逐次的に分解するとともに、C末端欠損ペプチドを得るステップと、
C末端欠損ペプチドを得るステップと並行して、解析対象とするペプチドを脱水処理により所定の位置で切断し、N末端のアミノ酸残基が分子内脱水された脱水型ペプチドを得るステップと、
C末端欠損ペプチドの分子量と、脱水型ペプチドの分子量とをそれぞれ測定するステップと、
C末端欠損ペプチドの分子量と、ペプチドの分子量との差を算出することにより、C末端欠損ペプチドの逐次的分解による分子量の減少量を求めるステップと、
減少量に対応する分子量を有するアミノ酸を選択することにより、ペプチドのC末端部を構成する所定の数のアミノ酸を同定し、データベースに記録された一連のアミノ酸配列からペプチドのC末端部と一致するC末端部を有する一連のアミノ酸配列を抽出するステップと、
抽出された一連のアミノ酸配列の中から脱水型ペプチドの測定結果に基づいて一のアミノ酸配列を選択するステップと、
を含むことを特徴とするペプチドの同定方法
が提供される。
【発明の効果】
【0011】
本発明の方法によれば、データベースから一のアミノ酸配列を選択して、解析対象となるペプチドを精度よく同定することができる。
【発明を実施するための最良の形態】
【0012】
以下、本発明の実施の形態について、図面を用いて説明する。尚、すべての図面において、同様な構成要素には同様の符号を付し、適宜説明を省略する。
【0013】
図1は、本実施の形態に係るペプチドの同定方法を示すフローチャートである。本実施の形態は、解析対象とするペプチドのアミノ酸配列を同定するペプチドの同定方法である。本実施の形態の基本は、ステップ102と、ステップ105と、ステップ106と、ステップ107から構成される。ステップ102では、ペプチドのC末端からアミノ酸を逐次的に分解し、C末端からアミノ酸残基が欠損したC末端欠損ペプチドを得る(C末端逐次分解工程、S102)。また、このC末端逐次分解反応と並行して、脱水処理によりグルタミン酸のアミノ基側が分子内脱水されたピログルタミル化ペプチドが得られる。ステップ105では、C末端欠損ペプチドの分子量と、ピログルタミル化ペプチドの分子量とをそれぞれ測定する(質量分析工程、S105)。ステップ106では、C末端欠損ペプチドの分子量と、ペプチドとの分子量との差を算出することにより、C末端欠損ペプチドの逐次的分解による分子量の減少量を求める。つづいて、減少量に対応する分子量を有するアミノ酸を選択することにより、ペプチドのC末端から所定の数のアミノ酸を同定する。そして、データベースに記録された一連の既知アミノ酸配列の中から、同定された所定の数のアミノ酸から構成されるペプチドのC末端アミノ酸配列と一致するC末端アミノ酸配列を有する既知アミノ酸配列を抽出する(C末端アミノ酸配列解析工程、S106)。ステップ107では、ステップ106で抽出された既知アミノ酸配列の中からピログルタミル化ペプチドの測定結果に基づいて一の既知アミノ酸配列を選択する(グルタミン酸切断片帰属工程、S107)。
【0014】
図1で示すように、ステップ102の前に、ステップ101を行ってもよい(前処理工程、S101)。ステップ101では、ペプチド中のセリン、トレオニン、チロシンのβ−ヒドロキル基をO−アシル化して保護する。また、リシンのε−アミノ基をN−アシル化して保護する。これにより、C末端逐次分解工程における切断等の副反応を抑制することができる。
【0015】
ステップ102では、ペプチドをアルカン酸無水物と接触させることにより、C末端欠損ペプチドとピログルタミル化ペプチドとを得ることできる。アルカン酸無水物として、無水酢酸または酢酸を用いると好ましい。こうすることにより、O−アシル化およびN―アシル化とC末端逐次分解反応とを同時に行うことができる。したがって、セリン、トレオニンのβ−ヒドロキシ基、チロシンのフェノール基、リシンのε−アミノ基の保護を行いつつ、C末端逐次分解反応を行うことができる。また、ステップ101の手順が不要となり、簡便な方法でC末端アミノ酸を安定的に分解することが可能となる。また、ピログルタミル化反応も良好に進行させることができる。
【0016】
図3は、グルタミン酸のアミノ基側のペプチド結合で切断を受けて生じるピログルタミン酸の構造を示す図である。無水酢酸等の酸触媒または加熱条件により、グルタミン酸のγ−カルボキシ基が活性化され反応産物としてピログルタミン酸が得られる。アミノ基側で切断を受けたグルタミン酸は、脱水しており、ピログルタミル化している。グルタミン酸が分子内で脱水をおこし環状構造となる。
【0017】
グルタミン酸の分子内脱水反応は、一般的に、高温下におくと発生する。また、酸触媒下におくことにより、反応速度を高めることができる。C末端逐次分解反応では、酢酸、TFA等の有機酸を用いている。したがって、これらの有機酸が酸触媒として働く。この反応メカニズムは明らかではないが、図3で示す以下のようなメカニズムが予想される。すなわち、グルタミン酸が分子内脱水して分子内ピログルタミル化を起こす。つづいて、この分子内ピログルタミン酸の主鎖に由来するペプチド結合に加水分解が生じ、結果としてピログルタミン酸をN末端にもつ脱水ペプチドが形成される、と考えられる。
【0018】
また、ステップ102の後に、ステップ103を行ってもよい(後処理工程、S103)。ステップ103では、O−アシル化を脱保護する。また、C末端逐次分解工程で形成された5−オキサゾロン環を加水分解する。こうすることにより、1個以上のアミノ酸残基が除去された後のペプチドのC末端に、確実にカルボキシ基を再生することができる。
【0019】
ステップ103とステップ105の間に、ステップ104を行う(断片化工程、S104)。ステップ104では、ペプチドを所定の位置で切断する。これにより、ピログルタミル化ペプチドが所定の位置で切断されたピログルタミル化ペプチド断片が得られる。また、ステップ104では、C末端欠損ペプチドが所定の位置で切断されたC末端欠損ペプチド断片が得ることもできる。さらに、ペプチドのN末端を含むペプチド断片も得ることができる。ペプチドが断片化されることにより、分子量の大きいペプチドを解析対象とした場合であっても、より高感度で質量分析を行うことができる。
【0020】
ステップ104では、プロテアーゼ処理することにより、ピログルタミル化ペプチドおよびC末端欠損ペプチド等のペプチドを所定の位置で切断することができる。プロテアーゼとしてトリプシンを用いると、アルギニンのカルボキシ側のペプチド結合を切断することができる。
【0021】
ペプチドをアルギニンのカルボキシ基側のペプチド結合で切断することにより、質量分析において、ピログルタミル化ペプチドを、より高感度で検出することができる。したがって、ピログルタミル化ペプチドをより一層確実に分析することができる。
【0022】
また、トリプシンを用いたペプチドの断片化は、塩基性アミノ酸残基のC末端側で選択的に生じるため、もとのペプチドとC末端アミノ酸が欠損したペプチドの切断位置を一致させることができる。このため、もとのペプチドに由来するC末端側の断片ペプチドは、C末端アミノ酸が欠損したペプチドに由来するC末端側の断片ペプチドのC末端側にさらに所定の数のアミノ酸残基が付加された配列となる。よって、これらの分子量を比較し、逐次分解による分子量の減少量を算出することにより、除去されたアミノ酸残基の種類を特定することが可能となる。
【0023】
ここで、塩基性アミノ酸残基のうち、リシン残基はジメチル化、アセチル化等の天然の修飾を受けうる。修飾されたリシン残基はトリプシン消化を受けないことから、修飾の有無によりトリプシン消化により生じるペプチド断片が異なる。そこで、ステップ101においてリシン残基のε−アミノ基の保護を行うとともに、この保護基がステップ103で脱保護されないようにしている。こうすることにより、リシン残基のトリプシン感受性を消失させておくことができる。このため、アルギニン残基のC末端側ペプチド結合での選択的な断片化が可能となる。
【0024】
よって、C末端側のアミノ酸が欠損した逐次分解生成物を、質量分析により一層好適な分子量範囲内の分子量を有するペプチド断片に分割することができる。したがって、C末端側ペプチド断片の分子量を調節する処理として、トリプシン処理を積極的に活用することができる。
【0025】
ステップ104の断片化工程の後、試料を脱塩処理してペプチド断片を回収し、乾燥した後、質量分析装置を利用して、ペプチド断片の混合物に由来するイオン種の分子量を測定する。ここで、脱塩処理を行うことにより、回収、乾燥されるペプチド断片は、各種の塩を形成するものではなく、本来のペプチド部分単体とされている。そして、C末端の選択的な逐次分解によって得られる一連の反応生成物と、分解前のペプチドとを断片化処理で得られるペプチド断片のうち、それぞれのC末端側ペプチド断片の分子量同士を比較して、これらの差異に基づき、除去されたアミノ酸をC末端側から特定する。
【0026】
質量分析工程(S105)に用いる質量分析装置として、たとえば、イオントラップ質量分析計、四重極型質量分析計、磁場型質量分析計、飛行時間(TOF)型質量分析計、フーリエ変換型質量分析計などを用いることができる。また、イオン化法として、エレクトロスプレーイオン化法(ESI法)、マトリックス支援レーザー脱離イオン化(MALDI)法、高速原子衝突イオン化(FAB)法などが挙げられる。
【0027】
このうち、たとえばMALDI−TOF−MSが好適に用いられる。MALDI−TOF−MSを用いることにより、イオン化過程において、ペプチド断片を構成するアミノ酸残基から一部の原子団が欠落することを抑制することができる。また、比較的高分子量のペプチド断片の測定を好適に行うことができる。また、測定対象のタンパク質を試料中からゲル電気泳動を用いて分離し、ゲル中で上述の処理を施した後、回収して測定に供する場合にも、対応する陰イオンと陽イオンの両方を測定可能である。これらのことから、MALDI−TOF−MSを用いることにより、さらに再現性の高い分析を行うことができる。
【0028】
以下、質量分析にMALDI−TOF−MSを用いる場合を例に、説明する。MALDI−TOF−MSのイオン化過程では、ペプチド断片にプロトン(H+)が付加された陽イオン種と、ペプチド断片からプロトンが離脱された陰イオン種とをそれぞれ測定することが可能となる。本実施形態では、測定モードを選択し、陽イオン種と陰イオン種とをそれぞれ個別に測定する。
【0029】
ここで、質量分析工程(S105)は、断片化工程(S104)の後に行われるので、断片化工程にトリプシンによるプロテアーゼ処理を採用するとC末端欠損ペプチドを構成するアミノ酸残基中にはアルギニン残基が含まれていない。一方、断片化工程(S104)で得られるピログルタミル化ペプチド断片にはプロトン受容能に富むグアニジノ基を持つアルギニン残基が含まれているため、これらに由来する陽イオン種の安定化が図られる。
【0030】
このため、質量分析において、陽イオン種を測定した結果と、陰イオン種を測定した結果とを比較すると、C末端欠損ペプチド断片とピログルタミル化ペプチド断片とは、その相対強度が異なる挙動を示す。この現象を利用すれば、MALDI−TOF−MS装置によって測定される複数種のピーク中より、一連のペプチド断片に起因するピークを識別し、特定することが可能となる。
【0031】
陽イオン種の質量分析スペクトル中では、C末端にアルギニン残基を有するペプチド断片群に起因するピーク強度が相対的に強くなる。一方、アルギニン残基の存在してないC末端側ペプチド断片は、プロトン供与能を示すカルボキシ基をそのC末端に有する。このため、MALDI−TOF−MS装置で測定される陽イオン種の質量分析スペクトル中において、ピログルタミル化ペプチド断片群に起因するピーク強度が相対的に強くなる。また、陰イオン種の質量分析スペクトル中において、C末端欠損ペプチド断片群に起因するピーク強度が相対的に強くなる。
【0032】
したがって、陰イオン種による質量分析によりC末端欠損ペプチド断片の分子量を測定することができる。また、陽イオン種による質量分析により、ピログルタミル化ペプチド断片の分子量を測定することができる。また、陽イオン種による質量分析により、ペプチドのN末端を含み、C末端がアルギニンで切断されたペプチド断片の分子量も測定することができる。また、陽イオン種による質量分析では、質量精度のより高いリフレクターモードを好適に使用することができる。これにより、ピログルタミル化ペプチド断片を精度のよく測定することができる。
【0033】
なお、ステップ105の質量分析に供するペプチド断片の長さは、たとえば20〜30アミノ酸残基以下とすることができる。こうすることにより、質量分析の際に、ペプチド断片のイオン化を確実に行うことができる。
【0034】
ステップ106では、陰イオン種による質量分析の結果を用いて、C末端欠損ペプチドの分子量と、ペプチドとの分子量との差を算出することにより、C末端欠損ペプチドの逐次的分解による分子量の減少量を求める。
【0035】
一連のC末端欠損ペプチドに対応する陰イオン種は、陰イオン種による分子量測定において相対的に大きな強度を与えるため、陰イオン種により測定された分子量に基づいて、C末端アミノ酸の逐次的分解に伴う分子量減少を簡便な方法で容易に把握することができる。このため、もとのペプチドからC末端1残基欠損ペプチド、C末端2残基欠損ペプチド、以下、順次C末端n残基欠損ペプチド(nは自然数)までの各C末端欠損ペプチドについて、アミノ酸残基1個の欠損により生じる分子量の減少量を算出し、この減少量をアミノ酸残基の分子量と比較すれば、C末端からのアミノ酸配列を決定することができる。
【0036】
そして、データベースに記録された一連の既知アミノ酸配列の中から、同定された所定の数のアミノ酸から構成されるペプチドのC末端アミノ酸配列と一致するC末端アミノ酸配列を有する一群の既知アミノ酸配列を抽出する。データベースには、タンパク質やペプチドのアミノ酸配列情報が格納されている。
【0037】
同定するC末端残基のアミノ酸は任意の個数でよいが、より多くのアミノ酸を同定すれば、データベースから抽出する一群の既知アミノ酸配列の数を少なくすることができ、ステップ107の帰属工程が容易になる。
【0038】
ステップ107では、陽イオン種による質量分析の結果を用いて、ピログルタミル化ペプチド断片の分子量を同定する。ピログルタミル化ペプチド断片のN末端はグルタミン酸で切断を受け、かつ、ピログルタミン酸に変換されている。ピログルタミン酸は、グルタミン酸が分子内で脱水されることにより生じるため、グルタミン酸より脱水した分、分子量が小さく観測される。すなわち、水の分子量(18Da)に相当する分、分子量が小さく観測される。
【0039】
また、陽イオン種による質量分析では、ペプチドのN末端を含み、C末端がアルギニンで切断されたペプチド断片も検出することができる。
【0040】
ピログルタミル化ペプチド断片の分子量、N末端がグルタミン酸であることおよびC末端がアルギニンであることの情報に基づき、ピログルタミル化ペプチドのアミノ酸配列の帰属を行う。具体的には、ステップ106で抽出された既知アミノ酸配列を参照し、ピログルタミル化ペプチド断片のアミノ酸配列を含むもっとも確からしい一の既知アミノ酸配列を選択する。
【0041】
ピログルタミル化ペプチド断片は、リシンのε−アミノ基がN−アシル化されている。したがって、既知アミノ酸配列のリシンもN−アシル化されたものとして分子量を算出する。また、既知アミノ酸配列のN末端のアミノ基もN−アシル化されたものとして分子量を算出する。
【0042】
一の既知アミノ酸配列を選択できれば、解析対象となるペプチドのアミノ酸の配列は、選択した既知アミノ酸配列に相当することになる。したがって、解析対象のペプチドのアミノ酸配列を同定することができる。一方、一の既知アミノ酸配列を選択できない場合は、ステップ106に戻り、同定するペプチドのC末端アミノ酸残基の個数を増やす。これにより、データベースから抽出する既知アミノ酸配列をさらに絞り込むことができる。
【0043】
以下、本実施の形態に係るペプチドの同定方法を利用したタンパク質の解析方法を図1に従って具体的に説明する。
【0044】
解析対象となるペプチドに対してC末端逐次分解反応を施し、該ペプチドのC末端部において複数残基アミノ酸が外れた一連の反応産物の作成を行う。図1に示すように、C末端逐次分解反応においては副反応を抑制するためにあらかじめアシル化処理を行い、アミノ基、水酸基をN−アシル、O−アシル化する前処理工程(S101)を設ける場合がある。C末端逐次分解工程(S102)後はスペクトルを良好にするために残存する5−オキサゾロン環やO−アシル化をうけたセリン、スレオニン、チロシンの水酸基を加水分解するためアルカリ処理を行う(後処理工程、S103)場合がある。これらの工程を経て得られた反応産物に対してアミノ酸に特異的な断片化法を施し(S104)、ペプチドを質量分析の可能な大きさに断片化し、質量分析を行う(S105)。この際、C末端部分のアミノ酸配列と内部のグルタミン酸で切断を受け、ピログルタミン酸となった断片の分子量の測定を行う。こうして得られた情報はデータベース内にあるペプチドの同定のために有効に利用される。具体的には、得られたC末端のアミノ酸配列情報により、ある程度ペプチドを絞り込む(S106)。たとえば、4残基のアミノ酸配列が確定すると、ペプチドの候補は(1/20)×(1/20)×(1/20)×(1/20)に絞り込まれる。つぎに絞り込まれたペプチドに対して、グルタミン酸がピログルタミン酸に変換されたと仮定して、観測結果とマッチするペプチド断片を生成しうるかどうかをサーベイし(S107)、もっとも観測事実を説明できるペプチドを第一候補として、データベースサーチを終了する。
【0045】
C末端逐次分解反応については、公知の技術(たとえば、特開2003−279581、特許文献1)を用いる。
【0046】
反応が進行する際に想定される解析対象のペプチドの様子を図2に示す。すなわち、解析対象となるターゲットペプチドに対して、たとえば無水酢酸処理等により前記C末端逐次分解反応を遂行する。これにより、得られる化学処理済みのペプチドは、C末端側からアミノ酸が連続的にはずれたものとなる。したがって、欠損数の異なるC末端欠損ペプチドの分子量の差分が配列情報となる。C末端逐次分解反応の際、たとえばアルカン酸無水物として無水酢酸、アルカン酸として酢酸を使用した場合、該ペプチドの反応産物は一般に、N末端のアミノ基およびリシン残基のアミノ基はすべてアシル化を受けて、N−アセチル化の状態となる。また、O−アセチル化を受けていたセリン、スレオニン、チロシンの水酸基はすべて前記後処理工程による加水分解をうけ、フリーの水酸基となっている。該ペプチドのC末端部分は数残基が外れた状態となり、残余している5−オキサゾロン環は前記後処理工程による加水分解をうけ通常のカルボキシ基が形成されている。
【0047】
この段階で該反応産物に対して断片化処理を施す。たとえばトリプシンが望ましく使用される。トリプシンが適用された場合、図2に示すとおり該ペプチドのC末端逐次分解反応産物はアルギニンのC末端側で切断される。トリプシンのもうひとつの切断アミノ酸であるリシンは該反応の結果定量的にアセチル化を受けているのでトリプシンによっては認識されず、切断を受けることはない。したがって、断片化後のペプチド断片群は次の2つのグループに大別される。すなわち、(1)該ペプチドの内部フラグメントでそのC末端部分がアルギニンであるペプチド断片。(2)該ペプチドのC末端部分でアルギニンを含まず、かつ、C末端はC末端逐次分解反応の結果一定ではなく、さまざまな数のアミノ酸が切断してなるミクスチャーの状態のペプチド断片群。(2)のペプチド断片群の個々のペプチド断片のN末端のアミノ酸はトリプシンによる切断片であるため特定のアミノ酸にそろっているが、どのアミノ酸であるかはわからない。なお、図2では、Rはアルギニンを示し、Pyrはピログルタミン酸を示している。
【0048】
前記断片化されたペプチド断片群(1)(2)のミクスチャーを一括して質量分析にかける。この場合、MALDI−TOF MSが好適に使用される。質量分析は、ポジティブイオンモード(陽イオン種)とネガティブイオンモード(陰イオン種)の両方で行う。ポジティブイオンモードで測定した場合、アルギニンの効果があるため(1)のペプチド断片群が非常に強く観測される。この際、少なからず、グルタミン酸のアミノ基側での開裂の結果生じたピログルタミン酸をN末端にもち、C末端にはアルギニンを持つペプチドが観察される。一方ネガティブイオンモードで測定した際は、(2)のペプチド断片群が比較的強く観察され、これらのイオン種はC末端逐次分解反応によりC末端側からいくつかのアミノ酸が欠落したペプチド断片群であるから、スペクトルはラダー状を呈し、ピーク間の質量差はすなわちC末端からのアミノ酸配列を反映したものとなる。このようにして、解析対象のペプチドのいくつかの内部フラグメントの分子量(グルタミン酸のアミノ基側で切断を受けたフラグメントはそのグルタミン酸はピログルタミン酸へ変換されている)とC末端のアミノ酸配列およびC末端ペプチド断片の分子量が同時に得られることになる。
【0049】
つまり、(1)のペプチド群はアルギニンが末端に必ず存在するのでポジティブモード測定時に強く観測される。一部はグルタミン酸で切断を受けて、かつ、グルタミン酸はピログルタミン酸(Pyr)に変換されている。これも、C末端部分はアルギニンなので非常に強く観測される。一方、(2)のC末端部アミノ酸が逐次分解されたペプチド群はアルギニンがないのでネガティブモードによる測定時、相対的に強調される。
【0050】
前記解析で得られたC末端アミノ酸配列とC末端ペプチド断片の分子量は解析対象のペプチドをデータベース上で絞り込む際に使用される。一般には配列の一残基が決定されると候補は1/20に減少するので、決定されたC末端アミノ酸配列数に応じてデータベース中のペプチドの数は指数関数的に絞り込まれる。さらにC末端ペプチド断片の分子量が特定されることからもデータベース中のペプチドの候補数は大幅に絞り込まれることになる。
【0051】
絞り込まれたペプチドをさらに絞り込むためにポジティブイオンモードで非常に強く観測されるペプチド断片が有効に利用される。これらのペプチド断片のC末端は前記の通りアルギニンであることが化学的に保証されている。また該ペプチド断片のN末端は通常通りトリプシンによりアルギニンのC末端側で切断を受けたものか、あるいは、前記のとおり、グルタミン酸で切断を受け、かつ、ピログルタミン酸に変換されている(グルタミン酸より脱水した分(18Da)分子量が小さく観測される)ものと推定されるので、前記C末端配列とC末端ペプチド断片の分子量により絞り込まれた候補からこのようなポジティブイオンモードで強く観測されるペプチド断片を生成しうるペプチドをサーベイすることにより、ペプチドの同定がより高精度になされる。
【0052】
図3にはグルタミン酸のアミノ基側で切断を受けて生じるピログルタミン酸の構造を図示した。分子内で脱水をおこし環状構造となるので、アミノ末端のアミノ酸がグルタミン酸とした場合の分子量より18Da小さくなる。トリプシンにより断片化処理を行うと図2に示すとおり、該脱水体ペプチド断片のC末端はアルギニンとなるので、ポジティブイオンモードで非常に強く観察される。また、この特徴を生かすため、測定感度は劣るものの測定精度のより高いリフレクターモードが好適に使用される。
【0053】
以上のように、本実施の形態に係る方法によれば、化学的C末端配列解析法とGlu−N開裂反応を組み合わせたペプチドのデータベースサーチ方法を提供することができる。
【0054】
本実施の形態に係る方法は、ペプチドの配列をデータベースサーチする際の化学的手法を組み合わせた高精度化に関する。より具体的には、ペプチドのC末端側からの逐次分解反応によって得られるペプチドのC末端配列とその際同時に副反応産物として生じるグルタミン酸のアミノ基側でのペプチド結合の開裂反応、およびその最終反応産物であるピログルタミン酸を検出することで解析対象のペプチドのデータベースサーチをより高精度に行うものである。
【0055】
本実施の形態に係る方法は、ペプチドのC末端アミノ酸の逐次的分解という信頼性の高い化学的手法の効果を最大限データベースサーチに利用することを特徴とする。すなわち、ペプチドのC末端アミノ酸逐次分解反応によるペプチドのC末端部が逐次的にアミノ酸単位で分解されて形成される反応産物を酵素的あるいは化学的に分解して得られる反応産物を質量分析にかけ、スペクトルの測定を行うが、このさいネガティブイオンモードで測定されるスペクトルにあってはC末端配列情報の取得を行うと同時に、ポジティブイオンモードで測定されるスペクトルにあってはC末端アミノ酸逐次分解反応の副反応産物であるグルタミン酸のアミノ基側での開裂、および、開裂の際形成されるピログルタミン酸の帰属を行うことでデータベースサーチをより精度の高いものとしている。
【0056】
つづいて、本実施の形態の効果について説明する。
【0057】
本実施の形態によれば、解析対象のペプチドに対して所定の化学的処理を施し、かつ、質量分析法を利用することにより、より多くの配列情報を取得してデータベースから一のアミノ酸配列を選択することができる。したがって、解析対象となるペプチドのアミノ酸配列を精度よく同定することができる。
【0058】
具体的には、本実施の形態によれば、解析対象とするペプチドからC末端欠損ペプチドとピログルタミル化ペプチドとを得ることにより、C末端欠損ペプチドの分子量の測定結果とピログルタミル化ペプチドの分子量の測定結果とに基づいてデータベースに記録された一連の既知アミノ酸配列の中から、効率よく簡便に一の既知アミノ酸配列を選択することができる。したがって、精度よくペプチドのアミノ酸配列を同定することができる。
【0059】
従来の技術では、C末端欠損ペプチドのみの質量分析結果に基づいて、アミノ酸配列の分析を行うものであった。そのためデータベースを利用したペプチドのアミノ酸配列の解析を行う場合、情報量が足りないという問題があった。しかしながら、本実施の形態によれば、C末端欠損ペプチドを生成するとともにグルタミン酸を切断し、ピログルタミル化されたペプチドを得ることにより、ピログルタミル化されたペプチドの質量分析によって得られる情報を利用することができる。したがって、アミノ酸配列のデータベースを利用して精度よくペプチドのアミノ酸配列を同定することができる。
【0060】
また、本実施の方法によれば、ペプチドの、特に有効ペプチド断片の生成個数が少数に限られることの多い低分子量のペプチドのデータベースサーチの精度が格段に向上する。
【0061】
以上、図面を参照して本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【0062】
たとえば、以下の各態様も、本発明の範囲内として有効である。
(1)解析対象とするペプチドをデータベース検索により同定する手法の一つであり、少なくとも次に示す化学反応とその反応に特徴的なペプチド結合の切断反応を応用して、データベース検索を遂行することを特徴とする、ペプチドの同定方法;すなわち、解析対象とするペプチドに対してC末端逐次分解反応を施して該ペプチドのC末端部において複数個のアミノ酸が遊離した一連の反応生成物を作成し、該反応生成物に対して特定のアミノ酸で断片化するプロテアーゼ処理ないし化学反応処理を施し、該断片化処理により得られたペプチド断片群に対して、質量分析を行い、ネガティブイオンモードによる質量分析においては該ペプチドのC末端アミノ酸配列情報およびC末端ペプチド断片の分子量情報を取得し、ポジティブイオンモードによる質量分析においては該ペプチドのグルタミン酸切断断片を副反応に伴う質量変化を考慮しつつデータベース中の配列データに対して帰属操作を行い、二つのイオンモードで得られる情報をあわせてデータベースサーチを行うことにより、解析対象であるペプチドの同定を行うデータベースサーチ方法。
(2)前記C末端逐次分解反応はアルカン酸無水物に対してアルカン酸またはパーフルオロアルカン酸を少量添加してなる溶液を乾燥ペプチドに滴下し、10℃〜60℃に設定される温度において1〜16時間に設定される時間反応させることを特徴とするペプチドのデータベースサーチ方法。
(3)前記C末端逐次分解反応は解析対象となるペプチドがゲル単体に保持されている際は、アルカン酸無水物にアルカン酸またはパーフルオロアルカン酸を少量添加してなる溶液を双極性非プロトン性溶媒に溶解してなる溶液によりゲル単体を無水的に膨潤せしめ、アルカン酸無水物によるC末端逐次分解反応をゲル担体中に保持されたペプチドにたいして10℃〜60℃に設定される温度において1〜16時間の反応させることを特徴とするペプチドのデータベースサーチ方法。
(4)前記C末端逐次分解反応はアルカン酸無水物に対してアルカン酸またはパーフルオロアルカン酸を少量添加してなる溶液から蒸発するガス状の試薬が閉鎖経路を通じて解析対象のペプチドに到達し、C末端逐次分解反応を10℃〜60℃に設定される温度において1〜16時間の任意の時間反応させることを特徴とするデータベースサーチ方法。
(5)前記C末端逐次分解反応において、アルカン酸無水物に対してアルカン酸を添加してなる溶液を用い、解析対象となるペプチドに対してC末端逐次分解反応に先行して、ペプチドに存在する可能性のあるアミノ基のN−アシル化、水酸基のO−アシル化を施すことにより、不要な副反応を極力排除する保護反応を前処理として行うことを特徴とするデータベースサーチ方法。
(6)前記C末端逐次分解反応において、ピリジン水溶液処理にてC末端逐次分解反応を短時間で達成する触媒処理を施すデータベースサーチ方法。
(7)前記C末端逐次分解反応において、C末端部に残存する5−オキサゾロン、水酸基に入っているO−アシル基を加水分解するために含窒素芳香環化合物または第3級アミン水溶液を50℃〜100℃、1時間〜8時間の範囲で選択される後処理工程を含むことを特徴とするデータベースサーチ方法。
(8)前記C末端逐次分解反応において使用するアルカン酸無水物は無水酢酸であることを特徴とするデータベースサーチ方法。
(9)前記C末端逐次分解反応において使用するアルカン酸は酢酸であることを特徴とするデータベースサーチ方法。
(10)前記C末端逐次分解反応の後、反応産物を断片化する際に使用する手法として、トリプシンによる断片化を行うことを特徴とするデータベースサーチ方法。
(11)前記化学反応産物の質量分析においてMALDI−TOF MSを使用し、同一反応産物に対してポジティブイオンモード、ネガティブイオンモード両方の測定を行い、ポジティブイオンモードにおいてはグルタミン酸のアミノ基側での切断および切断産物がピログルタミン酸に変換されることを予期して測定される各イオンのm/zをデータベースと照合する工程と、ネガティブイオンモードにおいては該ペプチドのC末端アミノ酸配列を抽出してデータベースと照合する工程とを併せ持つことを特徴とするデータベースサーチ方法。
(12)前記パーフルオロアルカン酸が、0.3〜2.5の範囲内の酸解離定数(pKa)を有し、炭素数2〜4のパーフルオロアルカン酸であることを特徴とするデータベースサーチ方法。
(13)前記パーフルオロアルカン酸がトリフルオロ酢酸であることを特徴とするデータベースサーチ方法。
(14)前記後処理工程に使用される第三級アミン化合物がジメチルアミノエタノールであることを特徴とするデータベースサーチ方法。
【実施例】
【0063】
以下に、実施例を挙げて、本発明をより詳細に説明するが、本発明の範囲は、かかる実施例により何ら限定されるものではない。
【0064】
本発明の有効性を検証する目的で、ゲル担体上に担持されている153アミノ酸からなるヘムタンパク質、ウマ由来のミオグロビンについて、そのタンパク質部分グロビン・ペプチド鎖のC末端逐次分解反応を行った。
【0065】
本実施例では、解析対象試料となるウマ・ミオグロビンを、ポリアクリルアミド・ゲルを利用して、SDS−PAGE法によりゲル電気泳動して、バンドとして、そのグロビン・ペプチド鎖を分離した後、本発明にかかる解析方法で生成される該ペプチドにかかる情報、すなわち、C末端アミノ酸配列情報、C末端ペプチド断片分子量およびピログルタミン酸を含む内部ペプチド断片の分子量情報の取得について述べる。
【0066】
(ゲル電気泳動法による単離)
市販されているウマ・ミオグロビン標品について、1μg/μLの濃度でグロビン・ペプチド鎖部分のみを含有するペプチド溶液を調製した。なお、該ウマ・ミオグロビンのグロビン・ペプチド鎖部分には、ヒト・ミオグロビンと異なり、システイン残基は存在しないが、仮に、ヒト・ミオグロビンなどのように、システイン残基を内在するペプチドに対しては、該システイン残基のスルファニル基(−SH)の酸化による、−S−S−結合の形成を回避するため、2−スルファニルエタノール(HS−C2H4−OH:2−メルカプトエタノール)、DTT(ジチオトレイトール:トレオ−1,4−ジスルファニル−2,3−ブタンジオール)などの還元性試薬を添加するなどして、予め酸化防止処理を施した。場合によっては、予め、システイン残基のスルファニル基(−SH)に対して、カルボキシメチル化などの保護を施した。
【0067】
このペプチド溶液を、ゲル濃度12.5質量%のポリアクリルアミド・ゲル上に電気泳動し、泳動処理後、クーマシー・染色により、目的とするグロビン・ペプチド鎖のバンドを特定した。本例では、かかる染色バンド部のゲルを切り出し、ゲル切片を以下の一連の操作に供した。
【0068】
(ゲルのピリジン溶液処理)
ゲル切片を、気密性を有するチューブに入れ、20体積%濃度のピリジン水溶液1mLを注入し、2時間攪拌した。こうすることにより引き続き行われる脱水処理の結果ゲル内にわずかに残存するピリジンの触媒効果によりC末端逐次分解反応を実用的な短時間のうちに終了した。これは、引き続き行われる脱水処理の結果ゲル内にわずかに残存するピリジンの触媒効果と考えられる。
【0069】
(ゲルの脱水処理)
ピリジン処理したゲル切片を、気密性を有するチューブ中に入れ、アセトニトリル1mLを注入し、15分間攪拌した。その後、前記アセトニトリルを棄て、新たに、アセトニトリル1mLを注入し、更に15分間攪拌した。このアセトニトリルを利用する、ゲル中に含浸する水の抽出処理を、合計3回行い、ゲルの脱水処理を行った。脱水処理によりゲル体積の収縮が生じた。
【0070】
(C末端逐次分解処理操作)
次にチューブ中で、脱水処理済みのゲル切片に、30体積%濃度の無水酢酸のホルムアミド溶液1mLを注入した。乾燥雰囲気下で、密栓したチューブを攪拌しつつ、該容器全体の温度を、50℃に加熱し、かかる温度に、3時間保持する。この加熱保持の間に、当初、体積収縮しているゲルは、溶媒ホルムアミドの浸潤に従って、再膨潤し、本来の体積に復した。この再膨潤したゲル中に担持されているグロビン・ペプチド鎖に対して、溶質の無水酢酸が、前記加熱温度で作用する結果、ペプチドのN末端アミノ基に選択的なアセチル化反応が進行した。加えて、ペプチド鎖内に含有される、リシン残基(−NH−CH(CH2CH2CH2CH2NH2)−CO−)のε位のアミノ基へのN−アセチル化、同時に、セリン残基(−NH−CH(CH2OH)−CO−)やトレオニン残基(−NH−CH(CH(CH3)OH)−CO−)に存在するヒドロキシ基に対するO−アセチル化、チロシン残基(−NH−CH(CH2−C6H4−OH)−CO−)のフェノール性ヒドロキシ基へのO−アセチル化がなされた。
【0071】
この再膨潤したゲル中に担持されているペプチド鎖C末端に対して、無水酢酸を前記加熱温度で作用させることで、ペプチド鎖のC末端アミノ酸の選択的分解反応が進行した。具体的には、ペプチドのC末端において、5−オキサゾロン環形成を介し、ペプチド鎖のC末端アミノ酸の逐次的分解反応が進行すると推定される。
【0072】
このC末端アミノ酸の逐次的な分解反応が進行し、ゲル中には、段階的にC末端アミノ酸が除去された、一連の反応産物と、初段の5−オキサゾロン構造への変換時点に留まっている、アセチル基による修飾・保護を施した元のペプチド鎖とが含まれた混合物が、ゲル担体に担持された状態で残される。かかるC末端アミノ酸の逐次的分解処理を終えた後、容器内に残留する、未反応の無水酢酸を含むホルムアミド溶液を除去し、次に説明される加水分解処理を行った。
【0073】
(加水分解処理)
反応産物が含まれる混合物が担持されている状態のゲル切片を入れた前記容器内に、DMAE((CH3)2N−CH2CH2OH)10体積%濃度の水溶液1mLを注入した。密栓した該容器を攪拌しつつ、15分間この状態を保持した。この操作を3回行い、最後にさらに1mLの該水溶液を注入した。容器全体の温度を、60℃に加熱し、かかる温度に、2時間保持した。加水分解処理の目的は、前記混合物中に存在する反応産物ペプチドのC末端が、カルボキシ基に変換されたもの以外に、5−オキサゾロン構造に留まったもの、あるいは、非対称型酸無水物への変換まで進行したものも含まれた混合物状態となっているため、これらに加水分解処理を施し、ペプチドのC末端をカルボキシ基となった状態へとそろえることである。加えて、塩基性窒素含有有機化合物が塩基触媒として機能することに伴い、アセチル基による修飾・保護を施したペプチド鎖上の、セリン残基(−NH−CH(CH2OH)−CO−)やトレオニン残基(−NH−CH(CH(CH3)OH)−CO−)に存在するヒドロキシ基に対するO−アセチル化保護は加水分解され、脱保護がなされた。また、チロシン残基(−NH−CH(CH2−C6H4−OH)−CO−)のフェノール性ヒドロキシ基へのO−アセチル化保護の加水分解も、同様に進んだ。但し、用いる有機塩基の塩基性は高くないため、N−アセチル化保護の脱保護は進まず、最終的に後処理工程後には、より高い選択性を持って、N末端のアミノ基に対するN−アセチル化、リシン残基(−NH−CH(CH2CH2CH2CH2NH2)−CO−)のε位のアミノ基へのN−アセチル化が残るものとなる。場合によっては、チロシン残基(−NH−CH(CH2−C6H4−OH)−CO−)のフェノール性ヒドロキシ基へのO−アセチル化が、極僅かに残るものとなった。
【0074】
かかる加水分解処理工程を終えた後、容器内に残留する水溶液を除去し、容器中にアセトニトリル1mLを注入し、15分間攪拌した。その後、前記アセトニトリルを棄て、新たにアセトニトリル1mLを注入し、更に15分間攪拌した。このアセトニトリルを利用する、ゲル中に含浸する水溶液の抽出処理を、合計3回行い、再膨潤ゲル中の脱水処理を行う。脱水処理に伴い、ゲル体積の収縮が生じた。
【0075】
(トリプシン消化によるペプチド断片化)
ウマ・ミオグロビンのグロビン・ペプチド鎖は、153アミノ酸からなる(配列番号1)ため、質量分析における、適正な分子量範囲を逸脱しており、トリプシン消化によるペプチド断片化処理を行った。
【0076】
具体的には、前記の加水分解処理を施し、脱水処理済みのゲル切片を入れた容器内に、トリプシン含有水溶液を加え、ゲル担体上に担持されている状態のままペプチド鎖の断片化を行った。前記トリプシン含有水溶液は、重炭酸アンモニウム緩衝液(pH8)中に、トリプシンを0.067μg/μLの濃度で含有しており、トリプシン消化は37℃で16時間酵素反応を行った。その際、脱水処理されていたゲルは、溶媒水の浸潤に従って速やかに再膨潤し本来の体積に復した。この再膨潤したゲル中に担持されているペプチド鎖、反応産物に対して、前記緩衝液とともに、ゲル中に浸入するトリプシンを前記加熱温度で作用させることで、トリプシンに特異的な酵素消化が進行した。
【0077】
なお、ペプチド鎖、反応産物は、前記加水分解処理工程における脱保護によっても、N末端のアミノ基に対するN−アセチル化、リシン残基(−NH−CH(CH2CH2CH2CH2NH2)−CO−)のε位のアミノ基へのN−アセチル化は保持された状態であり、トリプシン消化によっては、前記N−アセチル化リシン残基のC末側ペプチド結合の切断はなされず、アルギニン残基のC末側ペプチド結合切断が進行した。このウマ・ミオグロビンのグロビン・ペプチド鎖が有するアミノ酸配列は既に判明している。
【0078】
図4は、ウマ・ミオグロビンのシークエンスを示す図である。図4に示すようにアルギニン残基のC末側ペプチド結合切断に伴い、153アミノ酸からなる元のペプチド鎖は、1−31(配列番号2)、32−139(配列番号3)、140−153(配列番号4)の各部分アミノ酸配列を含む断片に、トリプシン消化を受けた。なお、図4には、C末端逐次分解反応操作に伴い、N−アセチル化保護が施されるリシン残基およびアミノ末端を持つ残基番号1のグリシンを下線で示し、さらには、トリプシン消化による、アルギニン残基のC末側ペプチド結合切断で生じる、N末側の1−31とC末側の140−153の各部分アミノ酸配列を大文字で示す。32−139の部分のアミノ酸配列を小文字で示す。
【0079】
ターゲットペプチドは、リシンのε位のアミノ基がN−アセチル化されているため、ウマ・ミオグロビンのリシンもアセチル化されたものとして質量を計算する。また、ターゲットペプチドのN末端もN−アセチル化されている。したがって、ウマ・ミオグロビンのグリシンもアセチル化されたものとして質量を計算する。
【0080】
トリプシン消化によって断片化されると、これらのペプチド断片は、ゲル担体からの溶出を生じ易くなり、容器内のトリプシン溶液中に溶出した。なお、かかるトリプシン消化処理工程では、前記140−153アミノ酸の部分アミノ酸配列を含むC末端断片とともに、上述するC末端アミノ酸の逐次的分解処理で生成される一連の反応産物に由来するC末端断片も、容器内のトリプシン溶液中に溶出した。すなわち、該トリプシン消化処理は、長いアミノ酸長のペプチド鎖から、そのC末端部分を、質量分析に適合する所望の分子量範囲のペプチド断片とするとともに、かかるペプチド断片を、ゲル中から高い収率で溶出、回収した。
【0081】
かかるトリプシン消化処理工程を終えた後、ゲル中から容器内のトリプシン溶液中に溶出する断片化されたペプチド断片を回収した。回収されたペプチド断片の混合物を含む溶液について、脱塩処理を施した後、真空乾燥処理を行った。
【0082】
(加水分解処理、トリプシン消化によるペプチド断片化済みの反応産物の特定)
以上の一連の処理を施して得られる、加水分解処理、ペプチド断片化済みの反応産物とグロビン・ペプチド鎖のC末端断片との混合物について、質量分析法により、含有される各ペプチド断片の分子量の測定を行った。
【0083】
MALDI−TOF−MS装置を利用し、各ペプチド断片の分子量を反映する主イオン種ピークの質量測定を行った。なお、かかるMALDI−TOF−MS装置を利用する測定では、イオン種の分別は、負帯電イオン種を検出器へ導く、所謂ネガティブイオンモードの測定と、正帯電イオン種を検出器へ導く、所謂ポジティブイオンモードの測定との双方を行った。すなわち、各ペプチド断片の分子量を反映する主イオン種として、ポジティブイオンモードの測定において、プロトン(H+)が付加された陽イオン種、ネガティブイオンモードの測定において、プロトン(H+)が離脱した陰イオン種の、対応する二種のスペクトルを得た。
【0084】
図5は、ウマ・ミオグロビンを逐次分解後トリプシン消化を行い、得られたペプチド断片群をネガティブイオンモード(リニアモード)で測定してC末端配列情報を観測した質量分析ペクトルである。図5に示すネガティブイオンモードの測定では、ポジティブイオンモードでの測定結果との比較から相対的な強度が増加するピークとして、140−153、140−152、140−151、140−150、140−149の5本のピークが観測され、配列情報としてC末端側から「GQFG」と4残基の配列が推定された。また、トリプシンによる断片化操作の結果得られたC末端フラグメントは1634.6の分子量をもつことが確認できた。これらの情報はデータベースサーチの際に利用された。すなわち、解析対象となるペプチドのC末端フラグメントは1634.6としてネガティブイオンモードで観測される分子量を持つこと、このペプチド断片のN末端のアミノ酸のアミノ基側にあったトリプシンにより切断を受けたアミノ酸はアルギニンであったはずであること、このペプチド断片あるいは解析対象のペプチドのC末端アミノ酸配列はアミノ基側から「GFQG」であること、などがデータベースサーチの際に利用された。なお、データベース検索の際にはリシン残基はアセチル化を受けているものとして検索を行った。この検索によりペプチドの候補群が1次候補群として絞り込まれた。
【0085】
表1に、測定されたピークの質量値、元のグロビン・ペプチド鎖のC末端断片に起因するピークの質量値、質量値の差異、ならびに、それから特定される各反応産物断片において除去されているアミノ酸、および、各反応産物の形態を示す。
【0086】
【表1】

【0087】
図6には図5の測定で使用した同じペプチド断片混合物をポジティブイオンモードで高精度が出るリフレクターモードを使用して測定した結果の質量分析スペクトルを示す。図6は、ウマ・ミオグロビンを逐次分解後トリプシン消化を行い、得られたペプチド断片群をポジティブイオンモードで測定して、ピログルタミン酸をN末端に持つペプチドを高精度(リフレクターモード)で測定して得られる。「T」はトリプシンの自己消化物断片を示す。
【0088】
3本のピークが逐次分解特異的なグルタミン酸のアミノ基側での切断とその結果形成されるピログルタミン酸をN末端に、またアルギニンをC末端側にもつペプチド断片として観測された。図6中の「T」はトリプシンの自己消化物を示す。トリプシンの自己消化物ペプチド断片の分子量は公知であるから解析作業からはあらかじめ除外された。残りの3本のピークは対応するペプチド断片が「N末端がピログルタミン酸でC末端がアルギニンである」ものと仮定して前記ペプチドの1次候補群の中からトリプシンによる断片化処理により生じうるかどうか絞り込んだ。3本のピークはまたグルタミン酸の切断を伴わずアルギニンのカルボキシ基側での切断のみで生じている可能性も考慮した。
【0089】
こうすることにより前記ペプチドの1次候補群の中からウマ・ミオグロビンがもっとも確からしいものとして2次的に絞り込まれた。
【0090】
図7には高分子量領域(2800−3300)での測定結果得られた質量分析スペクトルを示す。図7は、ウマ・ミオグロビンを逐次分解後トリプシン消化を行い、得られたペプチド断片群をネガティブイオンモード(図7(a))、ポジティブイオンモード(図7(b))で測定した結果のスペクトルを示す。高分子量領域(2800−3300)測定のためリニアイオンモードを使用した結果である。P1、P2、P3、P4はP0((pyrE)WQQVLNVWGKVEADIAGHGQEVLIR[6−31])の2つのトリプトファンが酸化して得られたピークで、それぞれ1酸化体、2酸化体、3酸化体、4酸化体を示す。この場合、ネガティブイオンモードでは観測されないピークがポジティブイオンモードで5本観察されており、それぞれP0、P1、P2、P3、P4と示したピークの観測されたm/zは2999.8(P0)、3015.2(P1)、3032.1(P2)、3048.1(P3)、3064.1(P4)であった。これらのピークも上述の通りグルタミン酸で断片化を受けてピログルタミン酸化しC末端側にはアルギニンをもつペプチド断片として帰属でき、データベース検索に有効に利用された。なお、pyrEはピログルタミン酸を示す。[]内は残基番号である。また、図7(b)中、2999.80は、観測値を示す。
【0091】
前記実施例のデータベースサーチについてより詳しく記述する。まず、図4の結果および表1の結果から観測対象となっているペプチドのC末端配列は「GFQG」となっていることが推定される。この条件でデータベース検索を行うと、各種生物由来のミオグロビン54個、Methanococcus jannaschii 由来のProtein−L−isoaspartate O−methyltransferase1この合計55個のペプチドが候補としてヒットした。なおデータベースはSwiss−Prot ver. 41を使用した。図4の結果からはC末端ペプチド断片の分子量が1634.6と観測されていることから、Protein−L−isoaspartate O−methyltransferaseは候補から外れることがわかった。なぜならProtein−L−isoaspartate O−methyltransferaseのC末端断片の配列は「GDEIIIKDCGPVAFVPLVGKEGFQG」であり、リシンがアセチル化を受けているものとしてその分子量は2671.36、その観測値は2670前後となるはずだからである。この値をもつピークは観察されなかった。したがって1次候補として各種生物由来のミオグロビン54個が選択された。
【0092】
次に図6の結果からは観察対象のペプチドは611.27、546.39、1489.65というポジティブイオンモードで強調されるペプチド断片が生成されることがわかった。1次候補のなかからこれらの事実を反映するペプチドの選別をおこなうと、次の6種の動物に絞られた。すなわち、ウマ、ヨーロッパカワウソ、タヌキ、ユーラシアビーバー、南米ナキウサギ、ウサギである。これらの候補のうち、図7に示したP0、P1、P2、P3、P4に該当するペプチド断片に該当する分子量をもつピークを算出できるのはウマのみであることがわかった。図7のピーク、P0は「pyrEWQQVLNVWGKVEADIAGHGQEVLIR」に該当した。N末端はピログルタミル化、リシンはすべてアセチル化を受けているとすると分子量は2997.6となる。内部にあるトリプトファン(W)は容易に1酸化(+16)、2酸化(+32)を受けることが広く知られている。該ペプチド断片にはトリプトファンが2つあるので3酸化、4酸化も観測されるはずである。事実、これら酸化ピークがP1、P2、P3、P4に対応した。
【0093】
以上のように、C末端逐次分解反応により得られる反応産物をトリプシンで断片化し、C末端欠損ペプチド断片、ピログルタミル化ペプチド断片等を得ることによりC末端アミノ酸配列、C末端断片ペプチドの分子量、グルタミン酸がピログルタミル化した切断片の帰属、などを行うことにより、データベース中のペプチド群の中から、特定のペプチドの同定が可能であることが示された。
【図面の簡単な説明】
【0094】
【図1】実施の形態に係るペプチドの同定方法のフローチャートを示す図である。
【図2】実施の形態に係るペプチドの同定方法を説明する図である。
【図3】実施の形態に係る脱水型ペプチドの構造の一部を示す図である。
【図4】ウマ・ミオグロビンのアミノ酸配列を示す図である。
【図5】実施例に係るペプチドの質量分析スペクトルを示す図である。
【図6】実施例に係るペプチドの質量分析スペクトルを示す図である。
【図7】実施例に係るペプチドの質量分析スペクトルを示す図である。
【特許請求の範囲】
【請求項1】
解析対象とするペプチドのアミノ酸配列を同定するペプチドの同定方法であって、
前記ペプチドのC末端からアミノ酸を逐次的に分解し、前記C末端からアミノ酸残基が欠損したC末端欠損ペプチドを得るステップと、
前記C末端欠損ペプチドを得る前記ステップと並行して、前記ペプチドを脱水処理により所定の位置で切断し、N末端のアミノ酸残基が分子内脱水された脱水型ペプチドを得るステップと、
前記C末端欠損ペプチドの分子量と、前記脱水型ペプチドの分子量とをそれぞれ測定するステップと、
前記C末端欠損ペプチドの分子量と、前記ペプチドの分子量との差を算出することにより、前記C末端欠損ペプチドの逐次的分解による分子量の減少量を求めるステップと、
前記減少量に対応する分子量を有するアミノ酸を選択することにより、前記ペプチドの前記C末端から所定の数のアミノ酸を同定するステップと、
データベースに記録された一連の既知アミノ酸配列の中から、同定された所定の数のアミノ酸から構成される前記ペプチドのC末端アミノ酸配列と一致するC末端アミノ酸配列を有する前記既知アミノ酸配列を抽出するステップと、
抽出された前記既知アミノ酸配列の中から前記脱水型ペプチドの測定結果に基づいて一の既知アミノ酸配列を選択するステップと、
を含むことを特徴とするペプチドの同定方法。
【請求項2】
前記脱水型ペプチドを所定の位置で切断して脱水型ペプチド断片を得るステップをさらに含み、
前記脱水型ペプチドの分子量を測定する前記ステップは、前記脱水型ペプチド断片の分子量を測定することを特徴とする請求項1に記載のペプチドの同定方法。
【請求項3】
前記C末端欠損ペプチドを所定の位置で切断してC末端欠損ペプチド断片を得るステップをさらに含み、
前記C末端欠損ペプチドの分子量を測定する前記ステップは、前記C末端欠損ペプチド断片の分子量を測定することを特徴とする請求項1または2に記載のペプチドの同定方法。
【請求項4】
前記C末端欠損ペプチドの分子量を測定する前記ステップは、陰イオン種による質量分析測定を行うステップを含み、
前記脱水型ペプチドの分子量を測定する前記ステップは、陽イオン種による質量分析測定を行うステップを含むことを特徴とする請求項1乃至3いずれかに記載のペプチドの同定方法。
【請求項5】
前記脱水型ペプチドを得る前記ステップは、グルタミン酸のN末端の位置で切断し、N末端のアミノ酸残基がピログルタミル化した脱水型ペプチドを得ることを特徴とする請求項1乃至4いずれかに記載のペプチドの同定方法。
【請求項6】
前記脱水型ペプチドを得る前記ステップは、前記ペプチド中の特定のアミノ酸残基を保護し、前記脱水型ペプチド断片を得る前記ステップにおける前記切断に対する前記特定のアミノ酸残基の感受性を失わせるステップを含むことを特徴とする請求項2に記載のペプチドの同定方法。
【請求項7】
前記脱水型ペプチド断片を得る前記ステップは、プロテアーゼ処理することにより前記脱水型ペプチドを切断することを特徴とする請求項6に記載のペプチドの同定方法。
【請求項8】
前記プロテアーゼがトリプシンであって、
特定のアミノ酸残基の感受性を失わせる前記ステップは、前記ペプチドをN−アシル化するステップを含むことを特徴とする請求項7に記載のペプチドの同定方法。
【請求項9】
特定のアミノ酸残基の感受性を失わせる前記ステップは、前記ペプチドをO−アシル化するステップをさらに含み、
前記脱水型ペプチドを得るステップの後、前記脱水型ペプチド断片を得る前記ステップの前に、前記O−アシル化の脱保護を行うことを特徴とする請求項6乃至8いずれかに記載のペプチドの同定方法。
【請求項10】
前記ペプチドをアルカン酸無水物と接触させることにより、前記C末端欠損ペプチドと前記脱水型ペプチドとを得ることを特徴とする請求項1乃至9いずれかに記載のペプチドの同定方法。
【請求項11】
前記ペプチドを無水酢酸と接触させることにより、前記C末端欠損ペプチドと前記脱水型ペプチドとを得ることを特徴とする請求項1乃至10いずれかに記載のペプチドの同定方法。
【請求項1】
解析対象とするペプチドのアミノ酸配列を同定するペプチドの同定方法であって、
前記ペプチドのC末端からアミノ酸を逐次的に分解し、前記C末端からアミノ酸残基が欠損したC末端欠損ペプチドを得るステップと、
前記C末端欠損ペプチドを得る前記ステップと並行して、前記ペプチドを脱水処理により所定の位置で切断し、N末端のアミノ酸残基が分子内脱水された脱水型ペプチドを得るステップと、
前記C末端欠損ペプチドの分子量と、前記脱水型ペプチドの分子量とをそれぞれ測定するステップと、
前記C末端欠損ペプチドの分子量と、前記ペプチドの分子量との差を算出することにより、前記C末端欠損ペプチドの逐次的分解による分子量の減少量を求めるステップと、
前記減少量に対応する分子量を有するアミノ酸を選択することにより、前記ペプチドの前記C末端から所定の数のアミノ酸を同定するステップと、
データベースに記録された一連の既知アミノ酸配列の中から、同定された所定の数のアミノ酸から構成される前記ペプチドのC末端アミノ酸配列と一致するC末端アミノ酸配列を有する前記既知アミノ酸配列を抽出するステップと、
抽出された前記既知アミノ酸配列の中から前記脱水型ペプチドの測定結果に基づいて一の既知アミノ酸配列を選択するステップと、
を含むことを特徴とするペプチドの同定方法。
【請求項2】
前記脱水型ペプチドを所定の位置で切断して脱水型ペプチド断片を得るステップをさらに含み、
前記脱水型ペプチドの分子量を測定する前記ステップは、前記脱水型ペプチド断片の分子量を測定することを特徴とする請求項1に記載のペプチドの同定方法。
【請求項3】
前記C末端欠損ペプチドを所定の位置で切断してC末端欠損ペプチド断片を得るステップをさらに含み、
前記C末端欠損ペプチドの分子量を測定する前記ステップは、前記C末端欠損ペプチド断片の分子量を測定することを特徴とする請求項1または2に記載のペプチドの同定方法。
【請求項4】
前記C末端欠損ペプチドの分子量を測定する前記ステップは、陰イオン種による質量分析測定を行うステップを含み、
前記脱水型ペプチドの分子量を測定する前記ステップは、陽イオン種による質量分析測定を行うステップを含むことを特徴とする請求項1乃至3いずれかに記載のペプチドの同定方法。
【請求項5】
前記脱水型ペプチドを得る前記ステップは、グルタミン酸のN末端の位置で切断し、N末端のアミノ酸残基がピログルタミル化した脱水型ペプチドを得ることを特徴とする請求項1乃至4いずれかに記載のペプチドの同定方法。
【請求項6】
前記脱水型ペプチドを得る前記ステップは、前記ペプチド中の特定のアミノ酸残基を保護し、前記脱水型ペプチド断片を得る前記ステップにおける前記切断に対する前記特定のアミノ酸残基の感受性を失わせるステップを含むことを特徴とする請求項2に記載のペプチドの同定方法。
【請求項7】
前記脱水型ペプチド断片を得る前記ステップは、プロテアーゼ処理することにより前記脱水型ペプチドを切断することを特徴とする請求項6に記載のペプチドの同定方法。
【請求項8】
前記プロテアーゼがトリプシンであって、
特定のアミノ酸残基の感受性を失わせる前記ステップは、前記ペプチドをN−アシル化するステップを含むことを特徴とする請求項7に記載のペプチドの同定方法。
【請求項9】
特定のアミノ酸残基の感受性を失わせる前記ステップは、前記ペプチドをO−アシル化するステップをさらに含み、
前記脱水型ペプチドを得るステップの後、前記脱水型ペプチド断片を得る前記ステップの前に、前記O−アシル化の脱保護を行うことを特徴とする請求項6乃至8いずれかに記載のペプチドの同定方法。
【請求項10】
前記ペプチドをアルカン酸無水物と接触させることにより、前記C末端欠損ペプチドと前記脱水型ペプチドとを得ることを特徴とする請求項1乃至9いずれかに記載のペプチドの同定方法。
【請求項11】
前記ペプチドを無水酢酸と接触させることにより、前記C末端欠損ペプチドと前記脱水型ペプチドとを得ることを特徴とする請求項1乃至10いずれかに記載のペプチドの同定方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2009−92411(P2009−92411A)
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願番号】特願2007−260874(P2007−260874)
【出願日】平成19年10月4日(2007.10.4)
【出願人】(000004237)日本電気株式会社 (19,353)
【Fターム(参考)】
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願日】平成19年10月4日(2007.10.4)
【出願人】(000004237)日本電気株式会社 (19,353)
【Fターム(参考)】
[ Back to top ]

