亜硝酸性窒素の浄化方法
【課題】水性液中の硝酸性窒素や亜硝酸性窒素を高効率で低濃度化する方法を提供することであって、ラージスケールへの適用が可能であり、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が可能であり、装置コストを低減でき、環境負荷が十分に低減され、有害な副生成物の発生を抑制でき、安全性の高い、水性液中の硝酸性窒素や亜硝酸性窒素の浄化方法を提供する。
【解決手段】本発明は、亜硝酸性窒素の浄化方法に関する。本発明は、水性液中に含まれる亜硝酸性窒素を浄化する方法であって、光触媒およびアンモニウムイオンの存在下で光触媒反応を行う。
【解決手段】本発明は、亜硝酸性窒素の浄化方法に関する。本発明は、水性液中に含まれる亜硝酸性窒素を浄化する方法であって、光触媒およびアンモニウムイオンの存在下で光触媒反応を行う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、亜硝酸性窒素の浄化方法に関する。
【背景技術】
【0002】
貴金属製造・再生業などの各種産業において、高濃度の硝酸性窒素(NO3−)や亜硝酸性窒素(NO2−)を含む廃液が発生している。現状、このような廃液を処理する方法としては、希釈した上で下水道へ排出する方法が採られている。
【0003】
しかし、近年、高濃度の硝酸性窒素や亜硝酸性窒素を含む廃液の排出規制が厳しくなっており、このような廃液中の硝酸性窒素や亜硝酸性窒素を効率的に低濃度化する技術が早急に求められている。
【0004】
水性液中の硝酸性窒素や亜硝酸性窒素を低濃度化する従来の技術として、イオン交換、逆浸透、電気化学透析などを利用した物理化学的脱窒素方法、独立栄養細菌などを用いる生物学的脱窒素方法、電解還元などを利用した電気化学的脱窒素方法、水素ガスを用いた触媒法などが報告されている(例えば、特許文献1、特許文献2など参照)。しかし、これら従来の技術においては、例えば、低濃度化の効率が低いという問題、ラージスケールへの適用が難しいという問題、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が難しいという問題、装置コストが大きいという問題、環境負荷が十分に低減されていないという問題、有害な副生成物が発生するという問題などがある。
【0005】
さらに、水性液中の硝酸性窒素や亜硝酸性窒素を低濃度化する技術を、貴金属製造・再生業などの各種産業において排出された廃液中の硝酸性窒素や亜硝酸性窒素の浄化に適用する際には、上記問題の解決に加えて、高い安全性が求められる。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開平11−90463号公報
【特許文献2】特開2000−308900号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の課題は、水性液中の硝酸性窒素や亜硝酸性窒素を高効率で低濃度化する方法を提供することであって、ラージスケールへの適用が可能であり、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が可能であり、装置コストを低減でき、環境負荷が十分に低減され、有害な副生成物の発生を抑制でき、安全性の高い、水性液中の硝酸性窒素や亜硝酸性窒素の浄化方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明は、亜硝酸性窒素の浄化方法に関する。本発明は、水性液中に含まれる亜硝酸性窒素を浄化する方法であって、光触媒およびアンモニウムイオンの存在下で光触媒反応を行う。
【0009】
好ましい実施形態においては、上記光触媒が酸化物半導体型光触媒である。
【0010】
好ましい実施形態においては、上記光触媒反応中の上記水性液の温度が50℃以下である。
【0011】
好ましい実施形態においては、上記アンモニウムイオンがアンモニア由来である。
【0012】
好ましい実施形態においては、上記光触媒反応開始時の上記水性液のpHを6〜8に調整する。
【0013】
好ましい実施形態においては、上記pHの調整のためにアンモニアを用いる。
【0014】
好ましい実施形態においては、上記亜硝酸性窒素が、硝酸性窒素に対する光触媒反応によって得られる。
【0015】
好ましい実施形態においては、上記硝酸性窒素に対する光触媒反応が、酸化物半導体型光触媒および貴金属系助触媒の存在下で行われる。
【0016】
好ましい実施形態においては、上記水性液が廃液である。
【0017】
好ましい実施形態においては、上記廃液が貴金属製造・再生業において排出される廃液である。
【発明の効果】
【0018】
本発明の浄化方法によれば、水性液中の硝酸性窒素や亜硝酸性窒素を高効率で低濃度化することができる。本発明の浄化方法は、ラージスケールへの適用が可能であり、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が可能であり、装置コストを低減でき、環境負荷が十分に低減され、有害な副生成物の発生を抑制でき、安全性が高い。
【図面の簡単な説明】
【0019】
【図1】参考例1の結果を示すグラフ図である。
【図2】参考例2の結果を示すグラフ図である。
【図3】実施例1の結果を示すグラフ図である。
【図4】実施例3の結果を示すグラフ図である。
【図5】実施例4の結果を示すグラフ図である。
【図6】実施例5の結果を示すグラフ図である。
【図7】実施例6の結果を示すグラフ図である。
【図8】比較例1の結果を示すグラフ図である。
【図9】比較例2の結果を示すグラフ図である。
【発明を実施するための形態】
【0020】
本発明は、亜硝酸性窒素(NO2−)の浄化方法に関する。具体的には、本発明は、水性液中に含まれる亜硝酸性窒素を浄化する方法である。
【0021】
本発明は、水性液中に含まれる亜硝酸性窒素を浄化する方法であるが、水性液中に硝酸性窒素(NO3−)が含まれる場合にも適用できる。すなわち、後述するように、水性液中に硝酸性窒素(NO3−)が含まれる場合には、該硝酸性窒素を、任意の適切な反応を行うことによって、亜硝酸性窒素に変換すればよい。
【0022】
本発明の浄化方法の好ましい実施形態の一つは、下記一般式(2)に示すように、水性液中に含まれる亜硝酸性窒素を浄化する方法であって、光触媒およびアンモニウムイオンの存在下で光触媒反応を行い、窒素に転化する。さらに好ましくは、下記一般式(1)に示すように、上記亜硝酸性窒素が、硝酸性窒素に対する光触媒反応によって得られる。
NO3− →〔光触媒反応〕→ NO2− ・・・(1)
NO2− + NH4+ →〔光触媒反応〕→ N2 ・・・(2)
【0023】
本発明の浄化方法を適用できる水性液中の亜硝酸性窒素の濃度としては、低濃度(例えば、100μmol/L以下)から高濃度(例えば、10mol/L以上)に至るまで、任意の適切な濃度を採用し得る。
【0024】
本発明の浄化方法は、高濃度(例えば、10mol/L以上)の亜硝酸性窒素を含む水性液に適用できるので、貴金属製造・再生業などの各種産業において排出された廃液中の硝酸性窒素や亜硝酸性窒素の浄化に適用できる。
【0025】
本発明の浄化方法においては、光触媒およびアンモニウムイオン(NH4+)の存在下で光触媒反応を行う。
【0026】
上記光触媒としては、任意の適切な光触媒を採用し得る。このような光触媒としては、好ましくは、酸化物半導体型光触媒である。酸化物半導体型光触媒としては、例えば、BeO、MgO、CaO、SrO、BaO、CeO2、ThO2、UO3、U3O8、TiO2、ZrO2、V2O5、Y2O3、Y2O2S、Nb2O5、Ta2O5、MoO3、WO3、MnO2、Fe2O3、MgFe2O4、NiFe2O4、ZnFe2O4、ZnCo2O4、ZnO、CdO、Al2O3、MgAl2O4、ZnAl2O4、Tl2O3、In2O3、SiO2、SnO2、PbO2、UO2、Cr2O3、MgCr2O4、FeCrO4、CoCrO4、ZnCr2O4、WO2、MnO、Mn3O4、Mn2O3、FeO、NiO、CoO、Co3O4、PdO、CuO、Cu2O、Ag2O、CoAl2O4、NiAl2O4、Tl2O、GeO、PbO、TiO、Ti2O3、VO、MoO2、IrO2、RuO2、CdS、CdSe、CdTeなどが挙げられる。これらの酸化物半導体型光触媒の中でも、触媒活性の高さ、入手のし易さなどの点からは、TiO2が好ましい。
【0027】
上記光触媒は、1種のみを用いてもよいし、2種以上を併用してもよい。
【0028】
上記光触媒には、助触媒が併用されてもよい。このような助触媒としては、例えば、金、白金、パラジウム、銀、銅、ロジウムなど、任意の適切な貴金属系助触媒が挙げられる。助触媒の量としては、任意の適切な量を採用し得る。このような助触媒は、1種のみを用いてもよいし、2種以上を併用してもよい。
【0029】
水性液中の光触媒の量としては、光触媒反応が起こり得る量であれば、任意の適切な量を採用し得る。このような光触媒の量としては、水性液全量に対して、好ましくは0.02〜20重量%であり、より好ましくは0.2〜2.0重量%である。
【0030】
上記アンモニウムイオンとしては、任意の適切なアンモニウムイオン発生源から供給されるアンモニウムイオンを採用し得る。このようなアンモニウムイオン発生源としては、好ましくは、アンモニア(NH3)が挙げられる。
【0031】
アンモニウムイオン発生源としてアンモニアが採用される場合、該アンモニアは、例えば、別途入手したアンモニアであってもよいし、任意の適切な工業製品等の製造工程において排出されたアンモニアであってもよい。好ましい実施形態の一つとして、例えば、本発明の浄化方法が貴金属製造・再生業などの各種産業において排出された廃液中の硝酸性窒素や亜硝酸性窒素の浄化に適用される場合、該貴金属製造・再生業などにおける製造工程において排出されたアンモニアを、本発明の浄化方法におけるアンモニウムイオン発生源として用いる形態が挙げられる。
【0032】
水性液中のアンモニウムイオンの濃度としては、光触媒反応が起こり得る量であれば、任意の適切な量を採用し得る。このようなアンモニウムイオンの濃度としては、水性液全量に対して、好ましくは100μmol/L〜10mol/Lであり、より好ましくは1mmol/L〜5mol/Lである。
【0033】
上記光触媒反応の条件としては、任意の適切な条件を採用し得る。
【0034】
上記光触媒反応の条件として、例えば、照射光としては、太陽光などの自然光であってもよいし、蛍光灯、ブラックライト、キセノンランプ、水銀ランプ、ハロゲンランプ、LEDなどの人工光(紫外光など)であってもよい。
【0035】
上記光触媒反応の条件として、例えば、光触媒反応中の上記水性液の温度としては、任意の適切な温度を採用し得る。しかしながら、本発明の浄化方法においては、上記光触媒反応中の上記水性液の温度を常温付近で行うことが可能である。すなわち、本発明の浄化方法においては、上記光触媒反応中の上記水性液の温度が、好ましくは50℃以下であり、より好ましくは0〜45℃であり、さらに好ましくは2〜40℃以下であり、特に好ましくは5〜30℃である。本発明の浄化方法において、上記光触媒反応中の上記水性液の温度を常温付近で行うことが可能であれば、浄化に費やすエネルギーを低減できるだけでなく、該水性液が有毒な揮発性物質を含む廃液である場合には、該有毒な揮発性物質の揮散を抑制することが可能となり、また、水性液温度上昇による副反応の発生に起因する安全性低下の問題も回避可能となる。
【0036】
従来、亜硝酸性窒素とアンモニウムイオンとは、熱化学反応によって反応して窒素に転化できることは知られているが、その反応を進行させるためには、70℃以上の熱エネルギーを与えることが必要であり、たとえそのような高い熱エネルギーを与えても、十分な反応は起こらない(5時間後の転化率として20%程度)。また、亜硝酸性窒素とアンモニウムイオンとを、光化学反応によって反応させて窒素に転化しようとしても、窒素はほとんど発生しない(5時間後の転化率として10%程度)。
【0037】
本発明の浄化方法においては、光触媒を用いた光触媒反応を、亜硝酸性窒素とアンモニウムイオンとの反応に利用したところ、驚くべきことに、非常に高い転化率で窒素に転化できることが判り、しかも、その光触媒反応中の上記水性液の温度を常温付近で行っても、非常に高い転化率で窒素に転化できることが判った。
【0038】
本発明の浄化方法においては、上記光触媒反応開始時の上記水性液のpHを6〜8に調整することが好ましい。上記光触媒反応開始時の上記水性液のpHを6〜8に調整することによって、より高い転化率で上記光触媒反応を進行させることができる。
【0039】
上記光触媒反応開始時の上記水性液のpHを6〜8に調整する手段としては、任意の適切な手段を採用し得る。好ましい実施形態の一つとして、例えば、本発明の浄化方法が貴金属製造・再生業などの各種産業において排出された廃液中の硝酸性窒素や亜硝酸性窒素の浄化に適用される場合、該貴金属製造・再生業などにおける製造工程において排出されたアンモニアを、pH調整のために用いる形態が挙げられる。
【0040】
本発明の浄化方法において、上記亜硝酸性窒素は、水性液中に含まれる硝酸性窒素(NO3−)が任意の適切な反応によって亜硝酸性窒素に変換されたものであってもよい。このような反応としては、例えば、硝酸性窒素に対する光触媒反応が挙げられる。
【0041】
上記のような硝酸性窒素に対する光触媒反応の条件としては、任意の適切な光触媒反応の条件を採用し得る。好ましくは、光触媒として、酸化物半導体型光触媒および貴金属系助触媒を用いる。
【0042】
上記酸化物半導体型光触媒としては、前述したものと同様のものを選択し得る。このような酸化物半導体型光触媒は、1種のみを用いてもよいし、2種以上を併用してもよい。
【0043】
上記貴金属系助触媒としては、例えば、金、白金、パラジウム、銀、銅、ロジウムなどが挙げられる。このような貴金属系助触媒は、1種のみを用いてもよいし、2種以上を併用してもよい。
【0044】
本発明の浄化方法は、ラージスケールへの適用が可能であり、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が可能であり、装置コストを低減でき、環境負荷が十分に低減され、有害な副生成物の発生を抑制でき、安全性が高いので、好ましくは、水性液が廃液である場合に適用でき、より好ましくは、上記廃液が貴金属製造・再生業において排出される廃液である場合に適用できる。また、本発明の浄化方法で用いる光触媒は、再利用することも可能である。
【実施例】
【0045】
〔参考例1〕:硝酸性窒素から亜硝酸性窒素への転化(Pd−Ag/TiO2光触媒の使用)
パイレックス(登録商標)試験管に、触媒としてTiO2(Degussa社製、P25):47.5mgを入れ、さらに、NaNO3(関東化学株式会社製):500μmol(5cm3)を入れて懸濁させ、シュウ酸ナトリウム:2mmolを加え、助触媒として硫酸パラジウム(関東化学株式会社製)および硫酸銀(関東化学株式会社製)を全触媒重量に対してPdが1重量%、Agが4重量%となるように加え、系内をAr雰囲気(バブリング:20min)にし、25℃(298K)にて、400W高圧水銀灯の紫外光(>300nm)を照射した。
反応終了後、気相生成物である水素(H2)、N2、一酸化窒素(NO)はガスクロマトグラフ(G.C.(GC−8A:Shimadzu社製、ステンレスカラム:Molecular Sieve 5A、INJ:313K、COL:323K))で定量した。液相のNO2−、NO3−はイオンクロマトグラフ(CO−2060plus:日本分光社製)を用いて定量した。また、NH3および気相の一酸化二窒素(N2O)を定量する場合は、イオンクロマトグラフ(CO−2060plus、日本分光社製)およびG.C.(GC−8A:Shimadzu社製、ステンレスカラム:Pora Pack−Q、INJ:373K、COL:358K)で定量した。
結果を図1に示す。
本参考例1では、図1に示すように、窒素バランス(NB)を保ちつつ、24hで約95%のNO3−が還元された。還元生成物の多くはNO2−であった。
【0046】
〔参考例2〕:硝酸性窒素から亜硝酸性窒素への転化(Ag/TiO2光触媒の使用)
助触媒として硫酸銀(関東化学株式会社製)を全触媒重量に対してAgが4重量%となるように加えた以外は、参考例1と同様に行った。
結果を図2に示す。
本参考例2では、図2に示すように、窒素バランス(NB)を保ちつつ、12hでNO3−の初期量の約90%がNO2−に還元された。これはAgの助触媒効果によりNO3−が選択的にNO2−へ還元されたものといえる。
【0047】
〔実施例1〕
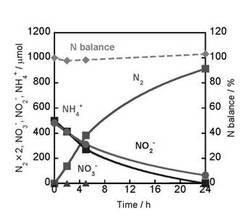
パイレックス(登録商標)試験管に、光触媒としてTiO2(Degussa社製、P25):50.0mgを入れ、さらに、NaNO2(関東化学株式会社製):500μmol(5cm3)および(NH4)2SO4(関東化学株式会社製):500μmol(5cm3)を入れて懸濁させ、系内をAr雰囲気(バブリング:20min)にし、25℃(298K)にて、400W高圧水銀灯の紫外光(>300nm)を照射した。光触媒反応開始時の水性液のpHは7であった。
反応終了後、気相生成物である水素(H2)、N2、一酸化窒素(NO)はガスクロマトグラフ(G.C.(GC−8A:Shimadzu社製、ステンレスカラム:Molecular Sieve 5A、INJ:313K、COL:323K))で定量した。液相のNO2−、NO3−はイオンクロマトグラフ(CO−2060plus:日本分光社製)を用いて定量した。また、NH3および気相の一酸化二窒素(N2O)を定量する場合は、イオンクロマトグラフ(CO−2060plus、日本分光社製)およびG.C.(GC−8A:Shimadzu社製、ステンレスカラム:Pora Pack−Q、INJ:373K、COL:358K)で定量した。
結果を図3に示す。
本実施例1では、図3に示すように、25℃(298K)にて、24h後においてNO2−とNH4+はほとんど消費され、N2が生成した。
【0048】
〔実施例2〕:助触媒の使用
光触媒として、TiO2、Pt/TiO2、Rh/TiO2、Cu/TiO2、Au/TiO2、Pd/TiO2、Ag/TiO2を用い(助触媒金属はTiO2の1重量%)、NaNO2の量を50μmolとし、紫外光(>300nm)を3時間照射した以外は、実施例1と同様に行った。
3時間照射後の結果を表1に示す。
【表1】

【0049】
〔実施例3〕:光触媒反応開始時の水性液のpH=4の場合
H2SO4(関東化学株式会社製)によって、光触媒反応開始時の水性液のpHを4に調整した以外は、実施例1と同様に行った。
結果を図4に示す。
本実施例3では、図4に示すように、N2の生成量がpH=7(実施例1)の場合に比べて少なくなった。
【0050】
〔実施例4〕:光触媒反応開始時の水性液のpH=10の場合
NaOH(関東化学株式会社製)水溶液によって、光触媒反応開始時の水性液のpHを10に調整した以外は、実施例1と同様に行った。
結果を図5に示す。
本実施例4では、図5に示すように、N2の生成量がpH=7(実施例1)の場合に比べて少なくなった。
【0051】
〔実施例5〕:高濃度の場合
NaNO2(関東化学株式会社製)および(NH4)2SO4(関東化学株式会社製)の濃度をいずれも5mmolとした以外は、実施例1と同様に行った。
結果を図6に示す。
本実施例5では、図6に示すように、基質の濃度が実施例1の10倍の高濃度の場合であっても、5時間で2000μmol近いN2が生成し、その他の副反応も観察されなかった。また、図6のグラフより、反応時間を延ばせば、NO2−とNH4+はほとんど消費されてN2が生成することが判る。
【0052】
〔実施例6〕:触媒の再利用
実施例1で使用した光触媒(TiO2)を回収し、この回収した光触媒を用いて、再度、実施例1と同様に行った。
結果を図7に示す。
本実施例6では、図7に示すように、反応速度は小さくはなったが、回収した触媒を再利用することが十分に可能であることが判る。
【0053】
〔比較例1〕
光触媒を用いずに遮光して、25℃、50℃、75℃において、熱化学反応を行った以外は、実施例1と同様に行った。反応時間は5時間であった。
結果を図8に示す。
本比較例1では、図8に示すように、25℃では反応は進行せず、50℃、75℃と温度を上げていくにしたがって、少しずつN2が発生した。しかし、75℃で発生したN2はわずかに約100μmol程度であり、また、廃液処理においてこのような温度は危険であり、エネルギー使用量も過大となる。
【0054】
〔比較例2〕
光触媒を用いずに、25℃において、光化学反応を行った以外は、実施例1と同様に行った。
結果を図9に示す。
本比較例2では、図9に示すように、5時間でNO2−とNH4+が約20μmolずつ反応し、N2が生成した。しかし、光触媒反応ほどN2は生成しなかった。
【産業上の利用可能性】
【0055】
本発明の浄化方法は、ラージスケールへの適用が可能であり、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が可能であり、装置コストを低減でき、環境負荷が十分に低減され、有害な副生成物の発生を抑制でき、安全性が高いので、好ましくは、水性液が廃液である場合に適用でき、より好ましくは、上記廃液が貴金属製造・再生業において排出される廃液である場合に適用できる。また、本発明の浄化方法で用いる光触媒は、再利用することも可能である。
【技術分野】
【0001】
本発明は、亜硝酸性窒素の浄化方法に関する。
【背景技術】
【0002】
貴金属製造・再生業などの各種産業において、高濃度の硝酸性窒素(NO3−)や亜硝酸性窒素(NO2−)を含む廃液が発生している。現状、このような廃液を処理する方法としては、希釈した上で下水道へ排出する方法が採られている。
【0003】
しかし、近年、高濃度の硝酸性窒素や亜硝酸性窒素を含む廃液の排出規制が厳しくなっており、このような廃液中の硝酸性窒素や亜硝酸性窒素を効率的に低濃度化する技術が早急に求められている。
【0004】
水性液中の硝酸性窒素や亜硝酸性窒素を低濃度化する従来の技術として、イオン交換、逆浸透、電気化学透析などを利用した物理化学的脱窒素方法、独立栄養細菌などを用いる生物学的脱窒素方法、電解還元などを利用した電気化学的脱窒素方法、水素ガスを用いた触媒法などが報告されている(例えば、特許文献1、特許文献2など参照)。しかし、これら従来の技術においては、例えば、低濃度化の効率が低いという問題、ラージスケールへの適用が難しいという問題、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が難しいという問題、装置コストが大きいという問題、環境負荷が十分に低減されていないという問題、有害な副生成物が発生するという問題などがある。
【0005】
さらに、水性液中の硝酸性窒素や亜硝酸性窒素を低濃度化する技術を、貴金属製造・再生業などの各種産業において排出された廃液中の硝酸性窒素や亜硝酸性窒素の浄化に適用する際には、上記問題の解決に加えて、高い安全性が求められる。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開平11−90463号公報
【特許文献2】特開2000−308900号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の課題は、水性液中の硝酸性窒素や亜硝酸性窒素を高効率で低濃度化する方法を提供することであって、ラージスケールへの適用が可能であり、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が可能であり、装置コストを低減でき、環境負荷が十分に低減され、有害な副生成物の発生を抑制でき、安全性の高い、水性液中の硝酸性窒素や亜硝酸性窒素の浄化方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明は、亜硝酸性窒素の浄化方法に関する。本発明は、水性液中に含まれる亜硝酸性窒素を浄化する方法であって、光触媒およびアンモニウムイオンの存在下で光触媒反応を行う。
【0009】
好ましい実施形態においては、上記光触媒が酸化物半導体型光触媒である。
【0010】
好ましい実施形態においては、上記光触媒反応中の上記水性液の温度が50℃以下である。
【0011】
好ましい実施形態においては、上記アンモニウムイオンがアンモニア由来である。
【0012】
好ましい実施形態においては、上記光触媒反応開始時の上記水性液のpHを6〜8に調整する。
【0013】
好ましい実施形態においては、上記pHの調整のためにアンモニアを用いる。
【0014】
好ましい実施形態においては、上記亜硝酸性窒素が、硝酸性窒素に対する光触媒反応によって得られる。
【0015】
好ましい実施形態においては、上記硝酸性窒素に対する光触媒反応が、酸化物半導体型光触媒および貴金属系助触媒の存在下で行われる。
【0016】
好ましい実施形態においては、上記水性液が廃液である。
【0017】
好ましい実施形態においては、上記廃液が貴金属製造・再生業において排出される廃液である。
【発明の効果】
【0018】
本発明の浄化方法によれば、水性液中の硝酸性窒素や亜硝酸性窒素を高効率で低濃度化することができる。本発明の浄化方法は、ラージスケールへの適用が可能であり、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が可能であり、装置コストを低減でき、環境負荷が十分に低減され、有害な副生成物の発生を抑制でき、安全性が高い。
【図面の簡単な説明】
【0019】
【図1】参考例1の結果を示すグラフ図である。
【図2】参考例2の結果を示すグラフ図である。
【図3】実施例1の結果を示すグラフ図である。
【図4】実施例3の結果を示すグラフ図である。
【図5】実施例4の結果を示すグラフ図である。
【図6】実施例5の結果を示すグラフ図である。
【図7】実施例6の結果を示すグラフ図である。
【図8】比較例1の結果を示すグラフ図である。
【図9】比較例2の結果を示すグラフ図である。
【発明を実施するための形態】
【0020】
本発明は、亜硝酸性窒素(NO2−)の浄化方法に関する。具体的には、本発明は、水性液中に含まれる亜硝酸性窒素を浄化する方法である。
【0021】
本発明は、水性液中に含まれる亜硝酸性窒素を浄化する方法であるが、水性液中に硝酸性窒素(NO3−)が含まれる場合にも適用できる。すなわち、後述するように、水性液中に硝酸性窒素(NO3−)が含まれる場合には、該硝酸性窒素を、任意の適切な反応を行うことによって、亜硝酸性窒素に変換すればよい。
【0022】
本発明の浄化方法の好ましい実施形態の一つは、下記一般式(2)に示すように、水性液中に含まれる亜硝酸性窒素を浄化する方法であって、光触媒およびアンモニウムイオンの存在下で光触媒反応を行い、窒素に転化する。さらに好ましくは、下記一般式(1)に示すように、上記亜硝酸性窒素が、硝酸性窒素に対する光触媒反応によって得られる。
NO3− →〔光触媒反応〕→ NO2− ・・・(1)
NO2− + NH4+ →〔光触媒反応〕→ N2 ・・・(2)
【0023】
本発明の浄化方法を適用できる水性液中の亜硝酸性窒素の濃度としては、低濃度(例えば、100μmol/L以下)から高濃度(例えば、10mol/L以上)に至るまで、任意の適切な濃度を採用し得る。
【0024】
本発明の浄化方法は、高濃度(例えば、10mol/L以上)の亜硝酸性窒素を含む水性液に適用できるので、貴金属製造・再生業などの各種産業において排出された廃液中の硝酸性窒素や亜硝酸性窒素の浄化に適用できる。
【0025】
本発明の浄化方法においては、光触媒およびアンモニウムイオン(NH4+)の存在下で光触媒反応を行う。
【0026】
上記光触媒としては、任意の適切な光触媒を採用し得る。このような光触媒としては、好ましくは、酸化物半導体型光触媒である。酸化物半導体型光触媒としては、例えば、BeO、MgO、CaO、SrO、BaO、CeO2、ThO2、UO3、U3O8、TiO2、ZrO2、V2O5、Y2O3、Y2O2S、Nb2O5、Ta2O5、MoO3、WO3、MnO2、Fe2O3、MgFe2O4、NiFe2O4、ZnFe2O4、ZnCo2O4、ZnO、CdO、Al2O3、MgAl2O4、ZnAl2O4、Tl2O3、In2O3、SiO2、SnO2、PbO2、UO2、Cr2O3、MgCr2O4、FeCrO4、CoCrO4、ZnCr2O4、WO2、MnO、Mn3O4、Mn2O3、FeO、NiO、CoO、Co3O4、PdO、CuO、Cu2O、Ag2O、CoAl2O4、NiAl2O4、Tl2O、GeO、PbO、TiO、Ti2O3、VO、MoO2、IrO2、RuO2、CdS、CdSe、CdTeなどが挙げられる。これらの酸化物半導体型光触媒の中でも、触媒活性の高さ、入手のし易さなどの点からは、TiO2が好ましい。
【0027】
上記光触媒は、1種のみを用いてもよいし、2種以上を併用してもよい。
【0028】
上記光触媒には、助触媒が併用されてもよい。このような助触媒としては、例えば、金、白金、パラジウム、銀、銅、ロジウムなど、任意の適切な貴金属系助触媒が挙げられる。助触媒の量としては、任意の適切な量を採用し得る。このような助触媒は、1種のみを用いてもよいし、2種以上を併用してもよい。
【0029】
水性液中の光触媒の量としては、光触媒反応が起こり得る量であれば、任意の適切な量を採用し得る。このような光触媒の量としては、水性液全量に対して、好ましくは0.02〜20重量%であり、より好ましくは0.2〜2.0重量%である。
【0030】
上記アンモニウムイオンとしては、任意の適切なアンモニウムイオン発生源から供給されるアンモニウムイオンを採用し得る。このようなアンモニウムイオン発生源としては、好ましくは、アンモニア(NH3)が挙げられる。
【0031】
アンモニウムイオン発生源としてアンモニアが採用される場合、該アンモニアは、例えば、別途入手したアンモニアであってもよいし、任意の適切な工業製品等の製造工程において排出されたアンモニアであってもよい。好ましい実施形態の一つとして、例えば、本発明の浄化方法が貴金属製造・再生業などの各種産業において排出された廃液中の硝酸性窒素や亜硝酸性窒素の浄化に適用される場合、該貴金属製造・再生業などにおける製造工程において排出されたアンモニアを、本発明の浄化方法におけるアンモニウムイオン発生源として用いる形態が挙げられる。
【0032】
水性液中のアンモニウムイオンの濃度としては、光触媒反応が起こり得る量であれば、任意の適切な量を採用し得る。このようなアンモニウムイオンの濃度としては、水性液全量に対して、好ましくは100μmol/L〜10mol/Lであり、より好ましくは1mmol/L〜5mol/Lである。
【0033】
上記光触媒反応の条件としては、任意の適切な条件を採用し得る。
【0034】
上記光触媒反応の条件として、例えば、照射光としては、太陽光などの自然光であってもよいし、蛍光灯、ブラックライト、キセノンランプ、水銀ランプ、ハロゲンランプ、LEDなどの人工光(紫外光など)であってもよい。
【0035】
上記光触媒反応の条件として、例えば、光触媒反応中の上記水性液の温度としては、任意の適切な温度を採用し得る。しかしながら、本発明の浄化方法においては、上記光触媒反応中の上記水性液の温度を常温付近で行うことが可能である。すなわち、本発明の浄化方法においては、上記光触媒反応中の上記水性液の温度が、好ましくは50℃以下であり、より好ましくは0〜45℃であり、さらに好ましくは2〜40℃以下であり、特に好ましくは5〜30℃である。本発明の浄化方法において、上記光触媒反応中の上記水性液の温度を常温付近で行うことが可能であれば、浄化に費やすエネルギーを低減できるだけでなく、該水性液が有毒な揮発性物質を含む廃液である場合には、該有毒な揮発性物質の揮散を抑制することが可能となり、また、水性液温度上昇による副反応の発生に起因する安全性低下の問題も回避可能となる。
【0036】
従来、亜硝酸性窒素とアンモニウムイオンとは、熱化学反応によって反応して窒素に転化できることは知られているが、その反応を進行させるためには、70℃以上の熱エネルギーを与えることが必要であり、たとえそのような高い熱エネルギーを与えても、十分な反応は起こらない(5時間後の転化率として20%程度)。また、亜硝酸性窒素とアンモニウムイオンとを、光化学反応によって反応させて窒素に転化しようとしても、窒素はほとんど発生しない(5時間後の転化率として10%程度)。
【0037】
本発明の浄化方法においては、光触媒を用いた光触媒反応を、亜硝酸性窒素とアンモニウムイオンとの反応に利用したところ、驚くべきことに、非常に高い転化率で窒素に転化できることが判り、しかも、その光触媒反応中の上記水性液の温度を常温付近で行っても、非常に高い転化率で窒素に転化できることが判った。
【0038】
本発明の浄化方法においては、上記光触媒反応開始時の上記水性液のpHを6〜8に調整することが好ましい。上記光触媒反応開始時の上記水性液のpHを6〜8に調整することによって、より高い転化率で上記光触媒反応を進行させることができる。
【0039】
上記光触媒反応開始時の上記水性液のpHを6〜8に調整する手段としては、任意の適切な手段を採用し得る。好ましい実施形態の一つとして、例えば、本発明の浄化方法が貴金属製造・再生業などの各種産業において排出された廃液中の硝酸性窒素や亜硝酸性窒素の浄化に適用される場合、該貴金属製造・再生業などにおける製造工程において排出されたアンモニアを、pH調整のために用いる形態が挙げられる。
【0040】
本発明の浄化方法において、上記亜硝酸性窒素は、水性液中に含まれる硝酸性窒素(NO3−)が任意の適切な反応によって亜硝酸性窒素に変換されたものであってもよい。このような反応としては、例えば、硝酸性窒素に対する光触媒反応が挙げられる。
【0041】
上記のような硝酸性窒素に対する光触媒反応の条件としては、任意の適切な光触媒反応の条件を採用し得る。好ましくは、光触媒として、酸化物半導体型光触媒および貴金属系助触媒を用いる。
【0042】
上記酸化物半導体型光触媒としては、前述したものと同様のものを選択し得る。このような酸化物半導体型光触媒は、1種のみを用いてもよいし、2種以上を併用してもよい。
【0043】
上記貴金属系助触媒としては、例えば、金、白金、パラジウム、銀、銅、ロジウムなどが挙げられる。このような貴金属系助触媒は、1種のみを用いてもよいし、2種以上を併用してもよい。
【0044】
本発明の浄化方法は、ラージスケールへの適用が可能であり、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が可能であり、装置コストを低減でき、環境負荷が十分に低減され、有害な副生成物の発生を抑制でき、安全性が高いので、好ましくは、水性液が廃液である場合に適用でき、より好ましくは、上記廃液が貴金属製造・再生業において排出される廃液である場合に適用できる。また、本発明の浄化方法で用いる光触媒は、再利用することも可能である。
【実施例】
【0045】
〔参考例1〕:硝酸性窒素から亜硝酸性窒素への転化(Pd−Ag/TiO2光触媒の使用)
パイレックス(登録商標)試験管に、触媒としてTiO2(Degussa社製、P25):47.5mgを入れ、さらに、NaNO3(関東化学株式会社製):500μmol(5cm3)を入れて懸濁させ、シュウ酸ナトリウム:2mmolを加え、助触媒として硫酸パラジウム(関東化学株式会社製)および硫酸銀(関東化学株式会社製)を全触媒重量に対してPdが1重量%、Agが4重量%となるように加え、系内をAr雰囲気(バブリング:20min)にし、25℃(298K)にて、400W高圧水銀灯の紫外光(>300nm)を照射した。
反応終了後、気相生成物である水素(H2)、N2、一酸化窒素(NO)はガスクロマトグラフ(G.C.(GC−8A:Shimadzu社製、ステンレスカラム:Molecular Sieve 5A、INJ:313K、COL:323K))で定量した。液相のNO2−、NO3−はイオンクロマトグラフ(CO−2060plus:日本分光社製)を用いて定量した。また、NH3および気相の一酸化二窒素(N2O)を定量する場合は、イオンクロマトグラフ(CO−2060plus、日本分光社製)およびG.C.(GC−8A:Shimadzu社製、ステンレスカラム:Pora Pack−Q、INJ:373K、COL:358K)で定量した。
結果を図1に示す。
本参考例1では、図1に示すように、窒素バランス(NB)を保ちつつ、24hで約95%のNO3−が還元された。還元生成物の多くはNO2−であった。
【0046】
〔参考例2〕:硝酸性窒素から亜硝酸性窒素への転化(Ag/TiO2光触媒の使用)
助触媒として硫酸銀(関東化学株式会社製)を全触媒重量に対してAgが4重量%となるように加えた以外は、参考例1と同様に行った。
結果を図2に示す。
本参考例2では、図2に示すように、窒素バランス(NB)を保ちつつ、12hでNO3−の初期量の約90%がNO2−に還元された。これはAgの助触媒効果によりNO3−が選択的にNO2−へ還元されたものといえる。
【0047】
〔実施例1〕
パイレックス(登録商標)試験管に、光触媒としてTiO2(Degussa社製、P25):50.0mgを入れ、さらに、NaNO2(関東化学株式会社製):500μmol(5cm3)および(NH4)2SO4(関東化学株式会社製):500μmol(5cm3)を入れて懸濁させ、系内をAr雰囲気(バブリング:20min)にし、25℃(298K)にて、400W高圧水銀灯の紫外光(>300nm)を照射した。光触媒反応開始時の水性液のpHは7であった。
反応終了後、気相生成物である水素(H2)、N2、一酸化窒素(NO)はガスクロマトグラフ(G.C.(GC−8A:Shimadzu社製、ステンレスカラム:Molecular Sieve 5A、INJ:313K、COL:323K))で定量した。液相のNO2−、NO3−はイオンクロマトグラフ(CO−2060plus:日本分光社製)を用いて定量した。また、NH3および気相の一酸化二窒素(N2O)を定量する場合は、イオンクロマトグラフ(CO−2060plus、日本分光社製)およびG.C.(GC−8A:Shimadzu社製、ステンレスカラム:Pora Pack−Q、INJ:373K、COL:358K)で定量した。
結果を図3に示す。
本実施例1では、図3に示すように、25℃(298K)にて、24h後においてNO2−とNH4+はほとんど消費され、N2が生成した。
【0048】
〔実施例2〕:助触媒の使用
光触媒として、TiO2、Pt/TiO2、Rh/TiO2、Cu/TiO2、Au/TiO2、Pd/TiO2、Ag/TiO2を用い(助触媒金属はTiO2の1重量%)、NaNO2の量を50μmolとし、紫外光(>300nm)を3時間照射した以外は、実施例1と同様に行った。
3時間照射後の結果を表1に示す。
【表1】

【0049】
〔実施例3〕:光触媒反応開始時の水性液のpH=4の場合
H2SO4(関東化学株式会社製)によって、光触媒反応開始時の水性液のpHを4に調整した以外は、実施例1と同様に行った。
結果を図4に示す。
本実施例3では、図4に示すように、N2の生成量がpH=7(実施例1)の場合に比べて少なくなった。
【0050】
〔実施例4〕:光触媒反応開始時の水性液のpH=10の場合
NaOH(関東化学株式会社製)水溶液によって、光触媒反応開始時の水性液のpHを10に調整した以外は、実施例1と同様に行った。
結果を図5に示す。
本実施例4では、図5に示すように、N2の生成量がpH=7(実施例1)の場合に比べて少なくなった。
【0051】
〔実施例5〕:高濃度の場合
NaNO2(関東化学株式会社製)および(NH4)2SO4(関東化学株式会社製)の濃度をいずれも5mmolとした以外は、実施例1と同様に行った。
結果を図6に示す。
本実施例5では、図6に示すように、基質の濃度が実施例1の10倍の高濃度の場合であっても、5時間で2000μmol近いN2が生成し、その他の副反応も観察されなかった。また、図6のグラフより、反応時間を延ばせば、NO2−とNH4+はほとんど消費されてN2が生成することが判る。
【0052】
〔実施例6〕:触媒の再利用
実施例1で使用した光触媒(TiO2)を回収し、この回収した光触媒を用いて、再度、実施例1と同様に行った。
結果を図7に示す。
本実施例6では、図7に示すように、反応速度は小さくはなったが、回収した触媒を再利用することが十分に可能であることが判る。
【0053】
〔比較例1〕
光触媒を用いずに遮光して、25℃、50℃、75℃において、熱化学反応を行った以外は、実施例1と同様に行った。反応時間は5時間であった。
結果を図8に示す。
本比較例1では、図8に示すように、25℃では反応は進行せず、50℃、75℃と温度を上げていくにしたがって、少しずつN2が発生した。しかし、75℃で発生したN2はわずかに約100μmol程度であり、また、廃液処理においてこのような温度は危険であり、エネルギー使用量も過大となる。
【0054】
〔比較例2〕
光触媒を用いずに、25℃において、光化学反応を行った以外は、実施例1と同様に行った。
結果を図9に示す。
本比較例2では、図9に示すように、5時間でNO2−とNH4+が約20μmolずつ反応し、N2が生成した。しかし、光触媒反応ほどN2は生成しなかった。
【産業上の利用可能性】
【0055】
本発明の浄化方法は、ラージスケールへの適用が可能であり、高濃度の硝酸性窒素や亜硝酸性窒素を含む水性液への適用が可能であり、装置コストを低減でき、環境負荷が十分に低減され、有害な副生成物の発生を抑制でき、安全性が高いので、好ましくは、水性液が廃液である場合に適用でき、より好ましくは、上記廃液が貴金属製造・再生業において排出される廃液である場合に適用できる。また、本発明の浄化方法で用いる光触媒は、再利用することも可能である。
【特許請求の範囲】
【請求項1】
水性液中に含まれる亜硝酸性窒素を浄化する方法であって、
光触媒およびアンモニウムイオンの存在下で光触媒反応を行う、
亜硝酸性窒素の浄化方法。
【請求項2】
前記光触媒が酸化物半導体型光触媒である、請求項1に記載の浄化方法。
【請求項3】
前記光触媒反応中の前記水性液の温度が50℃以下である、請求項1または2に記載の浄化方法。
【請求項4】
前記アンモニウムイオンがアンモニア由来である、請求項1から3までのいずれかに記載の浄化方法。
【請求項5】
前記光触媒反応開始時の前記水性液のpHを6〜8に調整する、請求項1から4までのいずれかに記載の浄化方法。
【請求項6】
前記pHの調整のためにアンモニアを用いる、請求項5に記載の浄化方法。
【請求項7】
前記亜硝酸性窒素が、硝酸性窒素に対する光触媒反応によって得られる、請求項1から6までのいずれかに記載の浄化方法。
【請求項8】
前記硝酸性窒素に対する光触媒反応が、酸化物半導体型光触媒および貴金属系助触媒の存在下で行われる、請求項7に記載の浄化方法。
【請求項9】
前記水性液が廃液である、請求項1から8までのいずれかに記載の浄化方法。
【請求項10】
前記廃液が貴金属製造・再生業において排出される廃液である、請求項9に記載の浄化方法。
【請求項1】
水性液中に含まれる亜硝酸性窒素を浄化する方法であって、
光触媒およびアンモニウムイオンの存在下で光触媒反応を行う、
亜硝酸性窒素の浄化方法。
【請求項2】
前記光触媒が酸化物半導体型光触媒である、請求項1に記載の浄化方法。
【請求項3】
前記光触媒反応中の前記水性液の温度が50℃以下である、請求項1または2に記載の浄化方法。
【請求項4】
前記アンモニウムイオンがアンモニア由来である、請求項1から3までのいずれかに記載の浄化方法。
【請求項5】
前記光触媒反応開始時の前記水性液のpHを6〜8に調整する、請求項1から4までのいずれかに記載の浄化方法。
【請求項6】
前記pHの調整のためにアンモニアを用いる、請求項5に記載の浄化方法。
【請求項7】
前記亜硝酸性窒素が、硝酸性窒素に対する光触媒反応によって得られる、請求項1から6までのいずれかに記載の浄化方法。
【請求項8】
前記硝酸性窒素に対する光触媒反応が、酸化物半導体型光触媒および貴金属系助触媒の存在下で行われる、請求項7に記載の浄化方法。
【請求項9】
前記水性液が廃液である、請求項1から8までのいずれかに記載の浄化方法。
【請求項10】
前記廃液が貴金属製造・再生業において排出される廃液である、請求項9に記載の浄化方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−187490(P2012−187490A)
【公開日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願番号】特願2011−52322(P2011−52322)
【出願日】平成23年3月10日(2011.3.10)
【出願人】(000125347)学校法人近畿大学 (389)
【Fターム(参考)】
【公開日】平成24年10月4日(2012.10.4)
【国際特許分類】
【出願日】平成23年3月10日(2011.3.10)
【出願人】(000125347)学校法人近畿大学 (389)
【Fターム(参考)】
[ Back to top ]

