宿主細胞タンパク由来のペプチドを含むHPVワクチン
本発明は宿主細胞タンパク由来のペプチドを含む、ヒトパピローマウィルス (HPV)ワクチンに関し、特に、子宮頸癌、頭頸部癌、皮膚癌のようなHPV感染に関連する癌に対するワクチンに関する。当該ペプチドは、例えばE6、E7のようなHPVタンパクによる分解の標的とされ、HPVに感染された細胞の表面に相対的に多量に存在する宿主細胞タンパクの断片を含む。これらのペプチドは、CTLにより認識され、免疫反応を発現させるので、好ましい腫瘍特異的なマーカーである。本発明は、また、新規なペプチド:ペプチド/HLA複合体のようなペプチド複合体と、腫瘍特異的なワクチンにおけるそれらの使用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は宿主細胞タンパク由来のペプチドを含むヒトパピローマウィルス(HPV)ワクチンに関し、特に、限定されるものではないが、子宮頸癌、頭頸部癌、皮膚癌のような、HPV感染に関連した癌に対するワクチンに関する。ペプチドは、E6やE7のような、HPVタンパクによる分解の標的となる、宿主細胞タンパクの断片を含む。さらに、本発明は、新規なペプチドの同定とその使用に関する。加えて、本発明は、新規なペプチド:ペプチド複合体とその使用に関する。
【背景技術】
【0002】
ヒトパピローマウィルス(HPV)は、足、手、声帯、口、および生殖器の組織の細胞の異常成長を引き起こす、非常に一般的なウィルスである。60型以上のHPVが同定されており、各型は体の特定の部位に感染する。多くの場合、HPVは1、2年以内に消滅し、実際、感染の間も、無症状であることがあり、すなわち、個人はそれらの感染に気付かない。しかしながら、少数の場合において、HPVは成長し、癌に変化する。
【0003】
HPVにより引き起こされる異常な細胞は2種類存在する。コンジローマ(いぼ)と異形成(前癌)である。いぼ状成長は感染した部分において発見される可能性があり、痒みと、炎症と、僅かな出血を引き起こす。これらの例においては、抗ウィルスのクリームが処方され、場合によっては、冷焼灼(細胞を破壊するために凍らせる)もしくは熱焼灼(電気的機器、もしくはレーザー処理によりいぼを焼く)によりその腫瘍が除かれたり、破壊されたりする。
【0004】
HPVの感染が癌に進行する場合、癌患者は手術、放射線治療、および化学療法の組合せにより治療される。しかしながら、放射線治療と化学療法は、悪性細胞とともに正常な細胞も破壊するという欠点を有しており、深刻な副作用を引き起こし得る。一方、手術は侵襲性であり、患者は二次感染の可能性が残される。多くの患者が再発し、病気について強く抗議しているという結果から、これらの副作用と危険は、好ましくなく、また、これらの治療がいつもうまくいく訳ではないことに関係している。
【0005】
それゆえに、より効果的な治療が必要であることは明らかであり、また、免疫システムの特異性の、ウィルスに感染された細胞に対しての利用可能性が示唆されている。この構想は、免疫療法と呼ばれる。
【0006】
具体的には、癌患者は、腫瘍細胞を認識することができるT細胞を有しているが、これらの細胞は、これらの細胞を破壊することができる、細胞傷害性Tリンパ球(CTL)に分裂、分化はしないことが示されている。
【0007】
細胞傷害性Tリンパ球は、ウィルスに感染された細胞のような、‘‘標的’’細胞を破壊するとともに、癌細胞の‘‘免疫監視’’にも関係している。CTLの多くはT細胞のCD8+サブセットに属しており、T-細胞レセプター(TCR)を有する。ペプチドが主要組織適合性遺伝子複合体(MHC)クラス1分子と結合して、細胞表面で発現されるとき、これらTCRはそれらを認識することができる。ヒトにおいて、MHC各クラスは1以上の遺伝子座により示される。これらはヒト白血球抗原(HLA)と呼称される。クラスIのHLA遺伝子座は、HLA-A, -B, -C, -E, -F, および-Gである。加えて、各HLAは、様々な対立遺伝子を有しており、表1はこれまでに同定されたそれら対立遺伝子を記載する。
【0008】
CTLが、TCRが特異的である抗原/MHC複合体に遭遇するとき、エフェクター/キラー細胞に分化した後、細胞周期に入り、数回の有糸分裂の期間を経る。分化は、細胞破壊タンパクであるパーフォリンとグランザイムを含む、多量の修飾されたリソソームを形成することを含む。CTLが標的細胞を破壊すると、それらのほとんどは死滅するが、ごく一部は抗原が再び現れたときに速やかに抗原に反応することを可能とする、メモリー細胞となる。
【0009】
腫瘍に反応する細胞傷害性Tリンパ球は、動物モデル(1)やヒト (2)において、腫瘍の緩解を調節することが示されており、そのため、ヒトの癌のための免疫療法として、腫瘍特異的であるCTLの使用が注目を集めている。
【0010】
この点に関し、モノクロナール抗体が幾つかの癌に対して、特に白血病に効果があることが示されており、モノクロナール抗体は癌細胞に結合した分子またはレセプターを標的としている。表2は、これら抗体のうちのいくつかとそれらの作用メカニズムを記載する。
【0011】
また、樹状細胞ワクチンが、腫瘍特異的なCTL反応を発現させるために用いられている。樹状細胞は、もっとも重要な抗原提示細胞であり、それらは抗原を取り込み、ペプチドに分解してT細胞に提示したりする。樹状細胞ワクチンを製造するために、樹状細胞が採取され、患者の腫瘍の種類に応じた抗原に生体外でさらされ、そして患者に再挿入される。今まで、これらのワクチンは、メラノーマ、前立腺癌、およびリンパ腫に対して幾つかの有望な結果を示した。
【0012】
これらのワクチンは、正常な細胞ではなく、癌細胞で発現している分子のみを標的とするのが理想である。しかしながら、そのような腫瘍特異的な抗原は発見するのが困難であり、結果として、現在使用されている免疫剤の多くは、最終的に置換されることを期待して、正常な細胞をも標的としている。放射線療法や化学的療法のように、この療法も深刻な副作用を引き起こすおそれがあり、また、自己免疫の可能性を生じさせるおそれもある。事実、テロメラーゼワクチンの場合において、このタンパクは骨髄幹細胞や、生殖器や、おそらくその他の組織にも存在している。さらに、いくつかの樹状細胞がさらされた抗原は、メラニン細胞で発見されるチロシナーゼ、または前立腺細胞で発見される前立腺酸性フォスファターゼ (PAP)を含む。
【0013】
従って、特に従来のウィルスや癌の治療の効果が現れなかった、病気が進行したステージの患者に対して、さらなるウィルスの療法が必要であることは明らかである。
【0014】
最近、あるタンパク質の高いレベルでの発現により、CTLが腫瘍細胞と正常な細胞を区別することが可能となることが、多くの研究により示されている(4、5)。
【0015】
腫瘍免疫療法において自己免疫を避ける方法の1つは、ウィルスと連関する、ヒトの悪性腫瘍の15%を標的とすることである。これらのもっとも強い連関は、子宮頸癌とヒトパピローマウィルス間のものであり、子宮頸癌細胞の99.7%がHPVのDNAを含んでいる (6)。生殖器の粘膜に感染し、子宮頸癌、頭頸部癌、皮膚癌のような、悪性腫瘍を生じさせる25以上のHPVが存在する。これらの‘‘高危険’’であるHPVは、少なくとも2つの腫瘍遺伝子産物、子宮頸部の上皮細胞において不死化および形質転換させるために機能するE6とE7により特徴付けられる。これらのタンパクの発現は癌細胞の形質転換された表現型を維持するために不可欠であると考えられており、そのため、これらの非自己ウィルス性タンパクはCTL調節免疫療法の興味深い標的である。
【0016】
HPV E6/E7に対するCTL活性型はワクチン接種により誘導することが可能であり (7)、そのようなCTLは前癌状態の子宮頸疾患 (8)や癌の患者(9)において可変的な出現率で検出される。しかしながら、それらが低い出現率でしか発現しない可能性が高いため、生体外でこれらCTLを生成することは困難である(10)。腫瘍特異的な標的としてこれらのタンパクを使用することの主な制限は、それらが癌細胞内で低いレベルで発現されることである (11)。さらに、E6およびE7タンパク自体は、小さく、また、CTLによる認識に適したエピトープをほとんど含んでいない (12)。
【発明の開示】
【課題を解決するための手段】
【0017】
本発明の目的は、CTLにより認識されるペプチドを同定した後、標的とすることによって、これらの課題を解決することにある。ペプチドはHPV形質転換細胞に特異的であり、また、自己免疫を生じさせる可能性は低い。これらのペプチドはHPV形質転換細胞中のみに、また、過剰に存在しており、通常、これらのペプチドが由来とするタンパクは、HPV形質転換細胞中において存在しないか、または非常に低いレベルで発現される。対照的に、正常な細胞ではこれらのタンパクは正常、あるいは高いレベルで発現している。
【0018】
本発明は、HPV E6およびE7腫瘍タンパクが、感染細胞の形質転換中に生じる、例えば網膜芽細胞腫タンパク (Rb)、特にC-MYCおよびHMCM7 (表3参照)のような、宿主細胞タンパクを標的とする分解を調節するために用いるメカニズムを基としている。
【0019】
HPV腫瘍タンパクが結合して、Rbのような宿主細胞タンパクの分解を促進することが周知となっている。そのため、通常ではタンパク分解されないため、正常細胞はRbタンパクの高い細胞内レベルを有しているのに対し、形質転換された子宮頸癌細胞の分析は完全な長さのRbタンパクのはっきりとした発現を示さない。
【0020】
Rbタンパクはユビキチン依存タンパク分解システムにより分解されることが示されており (13)、さらに最近では、プロテアゾームと呼ばれる細胞内顆粒がE6およびE7腫瘍タンパクの相互作用後の宿主細胞タンパクの分解 (18, 19)の調節をしていることが明らかとなった。
【0021】
我々は、例えばプロテアゾームによる、ユビキチン化したタンパク基質の分解は、CTLにより認識されるペプチドが産生される主なメカニズムである可能性がある、という事実を認識した (20、21)。例えば、ウィルスに感染された細胞において、細胞質で新たに合成されたウィルス性タンパクは、プロテアゾームによりペプチド断片に分解される。これらのペプチドは、抗原処理 (TAP)タンパクと結合したトランスポーターにより、小胞体(ER)に輸送される。ER内部では、ペプチドは、成熟MHC/ペプチド複合体を形成するMHCクラスI分子とベータ2マイクログロブリンに結合する。これが、CTLにより認識され得る、細胞表面に輸送される。図1は、この過程の図による表示である。
【0022】
したがって、本発明は、HPV形質転換細胞において、Rbタンパク (および他のタンパク、表3参照)が分解の標的とされ、また、そのペプチドがCTLにより認識され得るペプチドとして細胞の表面に存在しているという理論を基としている。HPV形質転換されていない、あるいは正常な細胞においては、これらのタンパクはほとんど分解されないため、これらのペプチドは、事実上、CTL認識に適用されない。よって、HPV形質転換細胞は、例えば、通常、細胞表面でペプチドHLA複合体として結合して存在している、高レベルのRb由来ペプチドを有するが、正常な細胞とは対照的に、完全な長さのタンパクの細胞内レベルは低い。
【0023】
免疫療法のための標的としての宿主細胞タンパクの使用は、新規ではない。しかしながら、従来のすべての例において、この方法は、正常な細胞と比較しての腫瘍におけるタンパクの過剰発現に依存していた。例えば、p53 (5)、ウィルムス転写因子 (WT1)、Her 2/Neu (16)、およびHtert (17)のような宿主細胞タンパクは、これらすべてが腫瘍細胞において過剰発現しているため、‘‘腫瘍特異的’’抗原と提唱されてきた。我々の知るところでは、 これは、通常、正常細胞と比較してHPV形質転換細胞内において低い、または検出できないレベルで発現する‘‘腫瘍特異的’’タンパク、より具体的にはそのペプチドを対象とするHPVまたは癌のワクチンとしては、初めてのものである。
【0024】
従来、高レベルな抗原発現は、CTLが腫瘍細胞と正常な細胞を区別することを可能とするために有効であると考えられていた。
【0025】
加えて、今まで、HPVワクチンはこのウィルスにより分解の標的とされる宿主タンパクではなく、HPVにより産生されるタンパクを包含していた。
【0026】
まとめとして、本発明は、必ずしもウィルスに感染された細胞における関連タンパクの相対的に高レベルな発現、または明らかな発現を利用するのではなく、細胞表面における相対的に高レベルなペプチドの存在を利用するものである。事実、腫瘍特異的タンパクの低レベルな発現、または発現しないことは、そのタンパクがウィルス性タンパクによる分解の標的となっており、そのため低い細胞内レベルで存在する一方、分解後は、細胞膜に存在し、CTL認識のためのペプチドとして利用できることを、典型的に示している。
【0027】
したがって、本発明の1つの態様として、単離され、精製され、合成され、または組み換えられた、少なくとも1つのペプチドであって、ヒトパピローマウィルス腫瘍タンパクにより分解された宿主細胞タンパクの断片であるとともに、哺乳動物に投与されるとCTL反応を発現させることができるペプチドを含むワクチンが提供される。
【0028】
ヒトパピローマウィルス腫瘍タンパクにより分解された細胞タンパクへのここでの言及は、HPV腫瘍タンパクにより選択的に分解の標的とされたタンパクへの言及を含み、また、HPV形質転換細胞において、選択的に分解の標的とされたタンパク、あるいは、すなわち直接的にまたは間接的に、主として、しかしこれに限定されるものではない、ユビキチン経路により分解されるという方法で、ヒトHPV腫瘍タンパクにより活性化されたタンパクを含む。
【0029】
本発明の好ましい実施形態において、哺乳動物はヒトである。
【0030】
腫瘍タンパクは、E6またはE7であることが好ましい。
【0031】
宿主細胞タンパクは、例えばE6やE7のようなウィルス性タンパクにより分解されるタンパクであってもよく、表3は、E6またはE7により分解の標的にされるとして現在知られているタンパクを示す。
【0032】
タンパクは、正常な細胞と比較して、HPV形質転換または腫瘍細胞の細胞表面において多量に存在していることを指す、HPV特異的あるいは腫瘍特異的であってもよい。
【0033】
さらに好ましくは、ペプチドは長さにおいて9から30のアミノ酸であることが好ましい。
【0034】
あるいは、ペプチドは長さにおいて9から11のアミノ酸であってもよい。
【0035】
CTL反応は、CTLがワクチンのペプチドを発現させているHPV形質転換細胞または腫瘍細胞を認識することができることを示す、HPV特異的、あるいは腫瘍特異的CTL反応であることが好ましい。
【0036】
さらに好ましくは、ワクチンは表4に示すペプチドの一つ以上を含む(SEQ ID NOS:1-163)。
【0037】
さらにより好ましくは、ワクチンは、上述したペプチドのいずれか1つと、上述したペプチドとともに、主要組織適合性遺伝子複合体分子、好ましくはクラスI分子、さら好ましくはヒト白血球抗原(HLA)、さらにより好ましくは表1から選択されるHLAを含む。
【0038】
本発明の異なる態様として、単離され、精製され、合成され、または組み換えられたペプチドであって、表4に記載されたものから選択されるペプチドを含むワクチンが提供される。
【0039】
本発明のさらに異なる態様として、表4から選択される、単離され、精製され、合成され、または組み換えられた少なくとも1つのペプチドと、さらに表1に記載されたHLAから選択された、単離され、精製され、合成され、または組み換えられた、少なくとも1つのペプチドとを含むワクチンが提供される。
【0040】
本発明のさらなる態様として、上述したペプチドまたはペプチド/HLA複合体のいずれかをコードする、単離され、精製され、合成され、または組み換えられた少なくとも1つの核酸分子を含むワクチンが提供される。
【0041】
この実施形態において、核酸分子は組み換えコンストラクトを含むベクターの形で存在するようにしてもよい。コンストラクトは、選択された宿主システムにおいて前記ワクチンの発現に適することが好ましい。宿主システムは、細胞、プラスミド、ウィルス、生命体、他の同様な媒体である。
【0042】
本発明のさらなる態様として、本発明のベクターにより形質転換された、あるいは核酸導入された宿主細胞が提供される。
【0043】
加えて、本発明は、上述した組み換えコンストラクトを含むベクターにより形質転換された、あるいは核酸導入された宿主細胞を培養することと、生じたコンストラクト産物を単離/精製することとを含む、ワクチンの製造方法を提供する。
【0044】
本発明のペプチドはまた、生体外で、任意の免疫療法に使用される、HPV特異的、あるいは腫瘍特異的な細胞傷害性Tリンパ球、またはそれらのT細胞レセプター、または前記レセプターをコードする遺伝子を産生、および単離するために使用されてもよい。例えばこれは、Tリンパ球を上述したペプチドのうち少なくともひとつを用いて培養することにより実行され得る。
【0045】
本発明のまたさらなる態様として、
(a)宿主細胞がHPVにより形質転換され、または核酸導入されたときにHPVタンパクによ
り分解され、最終的にウィルスに感染された細胞表面に存在する、宿主タンパクの断片である少なくとも1つのペプチドとともに、細胞傷害性Tリンパ球を含むサンプルを培養することと、
(b)それへの結合により、前記ペプチドを認識するCTLを選択することと、を含むHPV特異的あるいは腫瘍特異的細胞傷害性Tリンパ球の同定方法が提供される。
【0046】
本発明の好ましい方法として、前記ペプチドは表4に示したリストから選択されたペプチドである。本発明のさらに好ましい方法として、CTLはCD8+細胞である。
【0047】
CTLレセプターは、上述した方法を使用してさらに同定されてもよいことは、当業者にとって明らかである。
【0048】
本発明は、疾患、特に癌、より好ましくは子宮頸癌、頭頸部扁平上皮癌、非メラノーマ皮膚癌、メソチオローマ(mesothioloma)、前立腺癌に関連するHPVを治療するために使用され得る。
【0049】
さらに、本発明は、治療されるべき哺乳動物に上述したワクチンを投与することを含む、治療方法を提供する。好ましくは、哺乳動物はヒトである。
【0050】
本発明のさらなる態様によれば、表4に示されるリストから選択されるペプチド、または同じものをコードする核酸分子が提供される。
【0051】
本発明の好ましい実施形態において、前記ペプチドはワクチンとして使用され、好ましくは、疾患に関連するHPVを治療するためのHPVワクチンとして使用される。
【0052】
本発明のさらなる態様によれば、HLAペプチドと結合して存在する、表4に示されるペプチドのうち少なくともひとつを含む複合体が提供される。
【0053】
さらに好ましくは、HLAペプチドは表1に示されたペプチドのうちの1つであり、より具体的にはHLA-A結合タンパクであり、さらにより具体的にはHLA-A0201である。
【0054】
本発明のさらなる態様によれば、ヒトパピローマウィルス腫瘍タンパクにより分解された哺乳動物細胞タンパクの断片であり、HPV形質転換あるいはHPV導入細胞の表面においてHLAと結合して存在し、細胞傷害性Tリンパ球による当該ペプチドとHLAの複合体の認識により免疫反応の発現が起こる、HPVワクチン産生のためのHPV特異的ペプチドの使用が提供される。
【発明を実施するための最良の形態】
【0055】
以下の実施例を通して、および以下の図を参照して発明を説明する。
【0056】
実施例1
15のタンパクに由来する、候補である9または10のアミノ酸ペプチドが、分析のために選択された、ペプチドの全てのリストである表4を参照求む。HLA-A*0201と結合すると予想される102のペプチドが、公表されたアルゴリズムに従って選択された(33、34)(表4)。我々が使用した当該アルゴリズムは、以前、他の腫瘍特異的CTLエピトープを適切に予想するために使用された(17)。我々は、白人の間でもっとも共通なHLA対立遺伝子であり、実証実験を容易に行うための生体内外のモデルシステムが明らかとなっている、HLA-A*0201をco-presentingペプチドとして選択した。当初のリストの102のペプチドから、62が試験のために合成された。
【0057】
HLA-A*0201への結合について試験されたペプチド
CTLは、細胞表面の、HLAクラスI分子に結合したペプチドを認識する。したがって、ペプチドは、機能するためにHLAへ結合しなければならない。これは、結合により生じるHLA-A*0201発現の増加を測定する、細胞ベースアッセイ (cell based assay)を用いることにより、測定され得る。
【0058】
細胞ベースペプチド結合アッセイは、候補であるペプチドの多く (43/62)がHLA-A*0201に結合し得ることを示すために用いられた(表3、図3)。
【0059】
宿主タンパク由来ペプチドのHLA-A2結合
T2細胞のHLA-A*0201発現は、100μgの試料ペプチドを用いて一晩培養した後のフローサイトメトリーにより、測定された。各ペプチドは4回づつテストされた。HLA-A*0201発現における50%以上の割合の増加が、有意であるとみなされた。
【0060】
観察された結合のレベルは、強い、または緩やかのいずれかで分類されることができ、2つのよく知られたHLA-A*0201制限CTLエピトープ(インフルエンザM1およびEBV BMFL1)と同程度であった(図3)。
【0061】
HLA-A*0201発現の50%より大きい増加を示した43のペプチドは、免疫原性実験における試験のための候補として選択された。
【0062】
マウスにおける生体内免疫原性の試験
我々は、潜在的なヒトワクチンを試験するために、HLA-A*0201トランスジェニックマウスを用いた (36)。これらのマウスは、生体内反応の発達を測定するための補助薬とともに、ペプチドが接種され得る。これらの反応は、脾臓内においてペプチド特異的なT細胞を固定するためのIFN-Yの数を測定するELISPOTアッセイを用いて検出された。
【0063】
Rb (6)、Mupp1 (7)、BAK (3)、DLG (2)、AP (2)タンパク由来の20のペプチドが扱われた。すべてのペプチドは、結合の強さで選択された。HLA-A*0201バインダーとして知られるインフルエンザ由来のM158-66ペプチドが、ポジティブコントロールとして用いられた。顕著なT細胞反応は、ポジティブコントロールであるM158-66ペプチド (7/12 マウス)およびRb485-493 (Rb7)タンパク由来のペプチド(7/10 マウス)について観察された。結果は図4に示された。
【0064】
ヒトTリンパ球を使用する生体外免疫原性試験
候補となるペプチドは、癌細胞を認識して破壊することができるヒトTリンパ球を活性化することができなければならない。我々は、子宮頸癌の患者の抹消血中からペプチド特異的T細胞を検出した。これから、そのようなペプチドは‘‘自己’’タンパクに由来するにもかかわらず免疫原性を有することが可能であるという考えが証明された。
【0065】
ペプチド特異的T細胞の検出
本発明のペプチドに対して反応するT細胞は、子宮頸癌であるHLA-A2+の患者から優先的に検出される必要がある。4つの患者の血液サンプル (3つは子宮頸癌、1つは前悪性疾患、CIN3)が、Rb7ペプチドを認識するCD8+T細胞の存在について試験された。蛍光識別された多量体のHLA-A2/ペプチド複合体が、フローサイトメトリーによりペプチド特異的T細胞の数を測定するために使用された。このアッセイは、Rb7ペプチドに特異的なT細胞が、子宮頸癌の2人の患者の血液中で低い出現率で検出され得ることを示した。これらの出現率は、以前にHPV16 E7ペプチド特異的T細胞について得られたものと同様であった。これにより、さらなる実験のためのRb特異的T細胞を単離、および増加させることが可能であることが示唆された。
【0066】
上述した技術を使用することにより、Tリンパ球がMelan-Aのような、特定の‘‘自己’’腫瘍抗原を認識することは、健全なドナーにおいても容易に検出し得る。しかしながら、健全なドナーにおいて、Tリンパ球の‘‘自己’’抗原の認識を検出するのが難しいのは、一般的なケースである。8人の健全なドナーに由来する血液サンプル (全てHLA-A2+)が、適当な蛍光標識された多量体 (五量体)を使用して、Rb7ペプチドとMelan -Aペプチドを認識するCD8+細胞の存在について試験された。Tリンパ球のRb7ペプチドの認識は、8人の健全なドナーすべてにおいて可変的で、しかし一般に低い出現率で検出され得る(表6)。反対に、以前の報告を確認すると、Melan -Aに対するT-リンパ球の反応は、非常に高い出現率であった (50)。Rb7に特異的なTリンパ球のもっとも高い反応は、ドナー5で検出された (図5)。
【0067】
上述したアッセイは、ヒトT細胞のRb7の認識は、患者と健全なドナーのどちらでも検出され得ることを示している。ELISPOTアッセイは、健全なドナーから培養されたRb7ペプチド特異的CD8+Tリンパ球が、IFN-γを分泌させることができるか否かを判別するために用いられた。7人の健全なドナーについて試験され、うち3人のドナーで検出できる数のIFN-γ分泌リンパ球が示された(図5)。
【0068】
全般的なこれらの結果は、Rb7ペプチドのような、HPV処理により産生される宿主細胞タンパク断片は、CD8+Tリンパ球の免疫原性を示し、また、機能的(IFN-γ分泌)反応を発現させることが可能である。これにより、実験や臨床治療の使用のいずれかのために、多量のRb特異的T細胞を、単離、増加させることが可能であることが示唆された。
【0069】
【表1A】

【表1B】

【表1C】

【表1D】

【表1E】

【表1F】

【表1G】

【表1H】

【表1I】

【表1J】

【表1K】

【表1L】

【表1M】

【表1N】

【表1O】

【0070】
【表2】

【0071】
【表3】

【0072】
【表4A】

【表4B】

【表4C】

【表4D】

【0073】
【表5】

【0074】
【表6】

【0075】
引用文献
1. Mandelboim, O., E. Vadai, M. Fridkin, A. Katz-Hillel, M. Feldman, G. Berke, and L. Eisenbach. 1995. Regression of established murine carcinoma metastases following vaccination with tumour-associated antigen peptides. Nature Medicine. 1:1179.
2. Heslop, H. E., and C. M. Rooney. 1997. Adoptive cellular immunotherapy for EBV lymphoproliferative disease. Immunological Reviews 157:217.
3. Overwijk, W. W., D. S. Lee, D. R. Surman, K. R. Irvine, C. E. Touloukian, C. C. Chan, M. W. Carroll, B. Moss, S. A. Rosenberg, and N. P. Restifo. 1999. Vaccination with a recombinant vaccinia virus encoding a "self" antigen induces autoimmune vitiligo and tumor cell destruction in mice: requirement for CD4(+) T lymphocytes. Proceedings of the National Academy of Sciences of the United States of America 96:2982.
4. Gao, L., I. Bellantuono, A. Elsasser, S. B. Marley, M. Y. Gordon, J. M. Goldman, and H. J. Stauss. 2000. Selective elimination of leukemic CD34(+) progenitor cells by cytotoxic T lymphocytes specific for WT1. Blood 95:2198.
5. Theobald, M., J. Biggs, D. Dittmer, A. J. Levine, and L. A. Sherman. 1996. Targeting p53 as a general tumour antigen. Proceedings of the National Academy of Sciences of the United States of America 92:11993.
6. Walboomers, J. M., M. V. Jacobs, M. M. Manos, F. X. Bosch, J. A. Kummer, K. V. Shah, P. J. Snijders, J. Peto, C. J. Meijer, and N. Munoz. 1999. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. Journal of Pathology 189:12.
7. Borysiewicz, L. K., A. Fiander, M. Nimako, S. Man, G. W. G. Wilkinson, D. Westmoreland, A. S. Evans, M. Adams, S. N. Stacey, M. E. G. Boursnell, E. Rutherford, J. K. Hickling, and S. C. Inglis. 1996. A recombinant vaccinia virus encoding human papillomavirus type 16 and type 18, e6 and e7 proteins as immunotherapy for cervical cancer. Lancet 347:1523.
8. Nimako, M., A. N. Fiander, G. W. Wilkinson, L. K. Borysiewicz, and S. Man. 1997. Human papillomavirus-specific cytotoxic T lymphocytes in patients with cervical intraepithelial neoplasia grade III. Cancer Res 57:4855.
9. Evans, E. M., S. Man, A. S. Evans, and L. K. Borysiewicz. 1997. Infiltration of cervical cancer tissue with human papillomavirus- specific cytotoxic T-lymphocytes. Cancer Res 57:2943.
10. Youde, S. J., P. R. Dunbar, E. M. Evans, A. N. Fiander, L. K. Borysiewicz, V. Cerundolo, and S. Man. 2000. Use of fluorogenic histocompatibility leukocyte antigen-A*0201/HPV 16 E7 peptide complexes to isolate rare human cytotoxic T-lymphocyte- recognizing endogenous human papillomavirus antigens. Cancer Res 60:365.
11. Frazer, I. H., R. Thomas, J. Zhou, G. R. Leggatt, L. Dunn, N. McMillan, R. W. Tindle, L. Filgueira, P. Manders, P. Barnard, and M. Sharkey. 1999. Potential strategies utilised by papillomavirus to evade host immunity. Immunological Reviews 168:131.
12. Khammanivong, V., X. S. Liu, W. J. Liu, S. J. Rodda, G. R. Leggatt, R. W. Tindle, I. H. Frazer, and G. J. Fernando. 2003. Paucity of functional CTL epitopes in the E7 oncoprotein of cervical cancer associated human papillomavirus type 16. Immunol Cell Biol 81:1.
13. Scheffner, M., Munger K, Huibregtse JM, and H. PM. 1992. Targeted degradation of the retinoblastoma protein by human papillomavirus E7-E6 fusion proteins. European Molecular Biology Organisation Journal 11:2425.
14. Scheffner, M., B. A. Werness, J. M. Huigbretse, A. J. Levine, and P. M. Howley. 1990. The E6 oncoprotein encoded by human papillomavirus types 16 and 18 promotes the degradation of p53. Cell 63:1129.
15. Higashitsuji, H., K. Itoh, T. Nagao, S. Dawson, K. Nonoguchi, T. Kido, R. J. Mayer, S. Arii, and J. Fujita. 2000. Reduced stability of retinoblastoma protein by gankyrin, an oncogenic ankyrin-repeat protein overexpressed in hepatomas. Nature Medicine 6:96.
16. Rongcun, Y., F. Salazar-Onfray, J. Charo, K. Malmberg, K. Evrin, H. Maes, K. Kono, C. Hising, M. Petersson, O. Larsson, L. Lan, E. Appella, A. Sette, E. Celis, and R. Kiessling. 1999. Identification of New HER2/neu-Derived Peptide Epitopes That Can Elicit Specific CTL Against Autologous and Allogeneic Carcinomas and Melanomas 1. The Journal of Immunology,,: 163:1037-1044.
17. Vonderheide, R. H., W. C. Hahn, J. L. Schultze, and L. M. Nadler. 1999. The telomerase catalytic subunit is a widely expressed tumor-associated antigen recognized by cytotoxic T lymphocytes. Immunity 10:673.
18. Berezutskaya, E., and S. Bagchi. 1997. The human papillomavirus E7 oncoprotein functionally interacts with the S4 subunit of the 26 S proteasome J Biol Chem 272:30135.
19. Boyer, S. N., D. E. Wazer, and V. Band. 1996. E7 protein of human papilloma virus 16 induces degradation of retinoblastoma protein through the ubiquitin proteasome pathway. Cancer research 56:4620.
20. Michalek, M. T., E. P. Grant, C. Gramm, A. L. Goldberg, and K. L. Rock. 1993. A role for the ubiquitin-dependent proteolytic pathway in MHC class I- restricted antigen presentation. Nature 363:552.
21. Cerundolo, V., A. Benham, V. Braud, S. Mukherjee, K. Gould, B. Macino, J. Neefjes, and A. Townsend. 1997. The proteasome-specific inhibitor lactacystin blocks presentation of cytotoxic T lymphocyte epitopes in human and murine cells. Eur J Immunol 27:336.
22. Vierboom, M., S. Zwaveling, G. Bos, M. Ooms, G. Krietemeijer, C. Melief, and R. Offringa. 2000. High Steady-State Levels of p53 Are Not a Prerequisite for Tumor Eradication by Wild-Type p53-specific Cytotoxic T Lymphocytes. Cancer Research 60:5508-5513.
23. Vierboom, M. P., H. W. Nijman, R. Offringa, E. I. van der Voort, T. van Hall, L. van den Broek, G. J. Fleuren, P. Kenemans, W. M. Kast, and C. J. Melief. 1997. Tumor eradication by wild-type p53-specific cytotoxic T lymphocytes. Journal of Experimental Medicine 186:695.
24. Kao, W. H., S. L. Beaudenon, A. L. Talis, J. M. Huibregtse, and P. M. Howley. 2000. Human Papillomavirus Type 16 E6 Induces Self-Ubiquitination of the E6AP Ubiquitin-Protein Ligase. J. Virol. 74:6408.
25. Gross-Mesilaty, S., E. Reinstein, B. Bercovich, K. E. Tobias, A. L. Schwartz, C. Kahana, and A. Ciechanover. 1998. Basal and human papillomavirus E6 oncoprotein-induced degradation of Myc proteins by the ubiquitin pathway. Proceedings of the National Academy of Sciences of the United States of America 95:8058.
26. Nakagawa, S., and J. M. Huibregtse. 2000. Human scribble (Vartul) is targeted for ubiquitin-mediated degradation by the high-risk papillomavirus E6 proteins and the E6AP ubiquitin- protein ligase. Mol Cell Biol 20:8244.
27. Kuhne, C., and L. Banks. 1998. E3-ubiquitin ligase/E6-AP links multicopy maintenance protein 7 to the ubiquitination pathway by a novel motif, the L2G box. J Biol Chem 273:34302.
28. Glaunsinger, B. A., S. S. Lee, M. Thomas, L. Banks, and R. Javier. 2000. Interactions of the PDZ-protein MAGI-1 with adenovirus E4-ORF1 and high- risk papillomavirus E6 oncoproteins. Oncogene 19:5270.
29. Gao, Q., L. Singh, A. Kumar, S. Srinivasan, D. E. Wazer, and V. Band. 2001. Human papillomavirus type 16 E6-induced degradation of E6TP1 correlates with its ability to immortalize human mammary epithelial cells. J Virol 75:4459.
30. Pim, D., M. Thomas, R. Javier, D. Gardiol, and L. Banks. 2000. HPV E6 targeted degradation of the discs large protein: evidence for the involvement of a novel ubiquitin ligase Oncogene 19:719.
31. Thomas, M., and L. Banks. 1998. Inhibition of Bak-induced apoptosis by HPV-18 E6. Oncogene 17:2943.
32. Lee, S., B. Glaunsinger, F. Mantovani, L. Banks, and R. Javier. 2000. Multi-PDZ Domain Protein MUPP1 Is a Cellular Target for both Adenovirus E4-ORF1 and High-Risk Papillomavirus Type 18 E6 Oncoproteins. Journal of Virology 74:9680-9693.
33. Srivenugopal, K. S., and F. Ali-Osman. 2002. The DNA repair protein, O(6)-Methylguanine-DNA methyltransferase is a proteolytic target for the E6 human papillomavirus oncoprotein. Oncogene 21:5940.
34. Thomas, M., R. Laura, K. Hepner, E. Guccione, C. Sawyers, L. Lasky, and L. Banks. 2002. Oncogenic human papillomavirus E6 proteins target the MAGI-2 and MAGI-3 proteins for degradation. Oncogene 21:5088.
35. Lu, Z., X. Hu, Y. Li, L. Zheng, Y. Zhou, H. Jiang, T. Ning, Z. Basang, C. Zhang, and Y. Ke. 2004. Human papillomavirus 16 E6 oncoprotein interferences with insulin signaling pathway by binding to tuberin. J Biol Chem In press.
36. Parker, K. C., M. A. Bednarek, L. K. Hull, U. Utz, B. Cunningham, H. J. Zweerink, W. E. Biddison, and J. E. Coligan. 1992. Sequence motifs important for peptide binding to the human MHC class I molecule, HLA-A2. Journal of Immunology 149:3580.
37. Engelhard, V. H. 1994. Structure of peptides associated with MHC class I molecules. Current Opinion in Immunology 6:13.
38. Ellis, J. R., P. J. Keating, J. Baird, E. F. Hounsell, D. V. Renouf, M. Rowe, D. Hopkins, M. F. Duggan-Keen, J. S. Bartholomew, L. S. Young, and P. L. Stern. 1995. The association of an HPV16 oncogene variant with HLA-B7 has implications for vaccine design in cervical cancer. Nature Medicine 1:464.
39. Faulkner, L., L. K. Borysiewicz, and S. Man. 1998. The use of human leucocyte antigen class I transgenic mice to investigate human immune function. J Immunol Methods 221:1.
40. Dunbar, P., J. Chen, D. Chao, N. Rust, H. Teisserenc, G. Ogg, P. Romero, P. Weynants, and V. Cerundolo. 1999. Rapid cloning of tumour specific CTL suitable for adoptive immunotherapy of melanoma. Journal of Immunology 162:6959.
41. Rooney, C. M., C. A. Smith, C. Y. C. Ng, S. K. Loftin, J. W. Sixbey, Y. Gan, D. K. Srivastava, L. C. Bowman, R. A. Krance, M. K. Brenner, and H. E. Heslop. 1998. Infusion of cytotoxic T cells for the prevention and treatment of epstein-barr virus-induced lymphoma in allogeneic transplant recipients Blood 92:1549.
42. Stanislawski, T., R. H. Voss, C. Lotz, E. Sadovnikova, R. A. Willemsen, J. Kuball, T. Ruppert, R. L. Bolhuis, C. J. Melief, C. Huber, H. J. Stauss, and M. Theobald. 2001. Circumventing tolerance to a human MDM2-derived tumor antigen by TCR gene transfer. Nat Immunol 2:962.
43. Shah, K. V. 1998. Do human papillomavirus infections cause oral cancer? J Natl Cancer Inst 90:1585.
44. Shamanin, V., H. zur Hausen, D. Lavergne, C. M. Proby, I. M. Leigh, C. Neumann, H. Hamm, M. Goos, U.-F. Haustein, E. G. Jung, G. Plewig, H. Wolff, and E.-M. de Villiers. 1996. Human papillomavirus infections in nonmelanoma skin cancers from renal transplant recipients and nonimmunosuppressed patients. Journal of the National Cancer Institute 88:802.
45. Kiviat, N. B. 1999. Papillomaviruses in non-melanoma skin cancer: epidemiological aspects. Semin Cancer Biol 9:397.
46. Man, S., and A. Fiander. 2001. Immunology of human papillomavirus infection in lower genital tract neoplasia. Best Pract Res Clin Obstet Gynaecol 15:701.
47. Palefsky, J. M. 1997. Cutaneous and genital HPV-associated lesions in HIV-infected patients. Clin Dermatol 15:439.
48. De Luca, A., A. Baldi, V. Esposito, C. M. Howard, L. Bagella, P. Rizzo, M. Caputi, H. I. Pass, G. G. Giordano, F. Baldi, M. Carbone, and A. Giordano. 1997. The retinoblastoma gene family pRb/p105, p107, pRb2/p130 and simian virus-40 large T-antigen in human mesotheliomas Nature Medicine 3:913.
49. Li, B., and Q. P. Dou. 2000. Bax degradation by the ubiquitin/proteasome-dependent pathway: involvement in tumor survival and progression. Proc Natl Acad Sci U S A 97:3850.
50. Pittet, M. J., Valmori, D., Dunbar, P. R., Speiser, D. E., Linard, D., Lejeune, F., Fleischhauer, K., Cerundolo, V., Cerottini, J. C., and Romero, P. 1999. High Frequencies of Naive Melan-A/MART-1-specific CD8(+) T Cells in a Large Proportion of Human. Histocompatibility Leukocyte Antigen (HLA)-A2 Individuals. Journal of Experimental Medicine 190:705-716.
【図面の簡単な説明】
【0076】
【図1】図1は、ヒトパピローマウィルスにより形質転換された細胞における、宿主細胞タンパクのT細胞認識のメカニズムを示す。
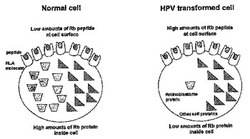
【図2】図2は、正常な細胞とHPV形質転換細胞の宿主細胞ペプチドの存在の違いを示す。
【図3】図3は、宿主タンパク由来ペプチドのHLA-A2を示す。具体的には、T2細胞のHLA-A*0201発現が、100μgの試料ペプチドを用いた一晩の培養後のフローサイトメトリーにより測定された。各ペプチドは、4回づつ繰り返した。50%以上のHLA-A*0201発現のA%の増加が重要であると考えられた。
【図4】図4は、ヒトRbタンパク由来のペプチドに対する生体内T細胞反応の産生を示す。具体的には、HLA-A2/Kbトランスジェニックマウスに、不完全なフロインドアジュバント中で乳化された100μgの試料ペプチドを接種した。各ペプチドについて、2から4匹のマウスが試験された。10から11日後、マウスは実験のために殺され、脾細胞がELISPOTアッセイに供された。これらは、接種されたペプチドに特異的なT細胞 (スポット)を産生するIFN-□の数が測定された。好ましい結果は、少なくともさらなる2回の繰り返し実験において確認された。M158-66、Rb1、Rb7、およびBAK18ペプチドについて試験した1つの実験からの典型的なデータを示す。
【図5】図5は、Rb7を認識するCD8+T細胞が健全なHLA-A2+ドナーにおいて検出され得ることを示す。具体的には、CD8+T細胞は、Rb7ペプチド (パネルC&D)またはメラン-A/Mart126-35ペプチド (パネルA&B)を用いて14日間培養された。0日目と14日目に、適当な蛍光標識されたペプチド:HLA-A2 5量体を用いて、ペプチド特異的なCD8+T細胞の数が測定された。これらは、フローサイトメーターを用いて分析され、死細胞およびCD14+細胞を除いた、ゲート細胞の%を表した。5人のドナー(表4)の結果を示した。
【図6】図6は、Rb7を認識するCD8+T細胞が健全なドナーにおいて検出され得ることを示す。具体的には、健全なHLA-A2+ドナーに由来する抹消血リンパ球が、CD8+T細胞に添加され、Rb7ペプチドと抗原存在細胞(APC)とともに14日間培養された。培養された細胞は回収され、Rb7ペプチドに反応してIFN-□を分泌することができるT細胞の数を測定するための酵素結合免疫スポット(ELISPOT)アッセイで試験された。7人のドナーのうち3人 (A、B、C)が顕著な反応を示す能力があった(T細胞+Rb7+PBMCのスポットの数>2 上記のT細胞+PBMCの標準偏差)。
【技術分野】
【0001】
本発明は宿主細胞タンパク由来のペプチドを含むヒトパピローマウィルス(HPV)ワクチンに関し、特に、限定されるものではないが、子宮頸癌、頭頸部癌、皮膚癌のような、HPV感染に関連した癌に対するワクチンに関する。ペプチドは、E6やE7のような、HPVタンパクによる分解の標的となる、宿主細胞タンパクの断片を含む。さらに、本発明は、新規なペプチドの同定とその使用に関する。加えて、本発明は、新規なペプチド:ペプチド複合体とその使用に関する。
【背景技術】
【0002】
ヒトパピローマウィルス(HPV)は、足、手、声帯、口、および生殖器の組織の細胞の異常成長を引き起こす、非常に一般的なウィルスである。60型以上のHPVが同定されており、各型は体の特定の部位に感染する。多くの場合、HPVは1、2年以内に消滅し、実際、感染の間も、無症状であることがあり、すなわち、個人はそれらの感染に気付かない。しかしながら、少数の場合において、HPVは成長し、癌に変化する。
【0003】
HPVにより引き起こされる異常な細胞は2種類存在する。コンジローマ(いぼ)と異形成(前癌)である。いぼ状成長は感染した部分において発見される可能性があり、痒みと、炎症と、僅かな出血を引き起こす。これらの例においては、抗ウィルスのクリームが処方され、場合によっては、冷焼灼(細胞を破壊するために凍らせる)もしくは熱焼灼(電気的機器、もしくはレーザー処理によりいぼを焼く)によりその腫瘍が除かれたり、破壊されたりする。
【0004】
HPVの感染が癌に進行する場合、癌患者は手術、放射線治療、および化学療法の組合せにより治療される。しかしながら、放射線治療と化学療法は、悪性細胞とともに正常な細胞も破壊するという欠点を有しており、深刻な副作用を引き起こし得る。一方、手術は侵襲性であり、患者は二次感染の可能性が残される。多くの患者が再発し、病気について強く抗議しているという結果から、これらの副作用と危険は、好ましくなく、また、これらの治療がいつもうまくいく訳ではないことに関係している。
【0005】
それゆえに、より効果的な治療が必要であることは明らかであり、また、免疫システムの特異性の、ウィルスに感染された細胞に対しての利用可能性が示唆されている。この構想は、免疫療法と呼ばれる。
【0006】
具体的には、癌患者は、腫瘍細胞を認識することができるT細胞を有しているが、これらの細胞は、これらの細胞を破壊することができる、細胞傷害性Tリンパ球(CTL)に分裂、分化はしないことが示されている。
【0007】
細胞傷害性Tリンパ球は、ウィルスに感染された細胞のような、‘‘標的’’細胞を破壊するとともに、癌細胞の‘‘免疫監視’’にも関係している。CTLの多くはT細胞のCD8+サブセットに属しており、T-細胞レセプター(TCR)を有する。ペプチドが主要組織適合性遺伝子複合体(MHC)クラス1分子と結合して、細胞表面で発現されるとき、これらTCRはそれらを認識することができる。ヒトにおいて、MHC各クラスは1以上の遺伝子座により示される。これらはヒト白血球抗原(HLA)と呼称される。クラスIのHLA遺伝子座は、HLA-A, -B, -C, -E, -F, および-Gである。加えて、各HLAは、様々な対立遺伝子を有しており、表1はこれまでに同定されたそれら対立遺伝子を記載する。
【0008】
CTLが、TCRが特異的である抗原/MHC複合体に遭遇するとき、エフェクター/キラー細胞に分化した後、細胞周期に入り、数回の有糸分裂の期間を経る。分化は、細胞破壊タンパクであるパーフォリンとグランザイムを含む、多量の修飾されたリソソームを形成することを含む。CTLが標的細胞を破壊すると、それらのほとんどは死滅するが、ごく一部は抗原が再び現れたときに速やかに抗原に反応することを可能とする、メモリー細胞となる。
【0009】
腫瘍に反応する細胞傷害性Tリンパ球は、動物モデル(1)やヒト (2)において、腫瘍の緩解を調節することが示されており、そのため、ヒトの癌のための免疫療法として、腫瘍特異的であるCTLの使用が注目を集めている。
【0010】
この点に関し、モノクロナール抗体が幾つかの癌に対して、特に白血病に効果があることが示されており、モノクロナール抗体は癌細胞に結合した分子またはレセプターを標的としている。表2は、これら抗体のうちのいくつかとそれらの作用メカニズムを記載する。
【0011】
また、樹状細胞ワクチンが、腫瘍特異的なCTL反応を発現させるために用いられている。樹状細胞は、もっとも重要な抗原提示細胞であり、それらは抗原を取り込み、ペプチドに分解してT細胞に提示したりする。樹状細胞ワクチンを製造するために、樹状細胞が採取され、患者の腫瘍の種類に応じた抗原に生体外でさらされ、そして患者に再挿入される。今まで、これらのワクチンは、メラノーマ、前立腺癌、およびリンパ腫に対して幾つかの有望な結果を示した。
【0012】
これらのワクチンは、正常な細胞ではなく、癌細胞で発現している分子のみを標的とするのが理想である。しかしながら、そのような腫瘍特異的な抗原は発見するのが困難であり、結果として、現在使用されている免疫剤の多くは、最終的に置換されることを期待して、正常な細胞をも標的としている。放射線療法や化学的療法のように、この療法も深刻な副作用を引き起こすおそれがあり、また、自己免疫の可能性を生じさせるおそれもある。事実、テロメラーゼワクチンの場合において、このタンパクは骨髄幹細胞や、生殖器や、おそらくその他の組織にも存在している。さらに、いくつかの樹状細胞がさらされた抗原は、メラニン細胞で発見されるチロシナーゼ、または前立腺細胞で発見される前立腺酸性フォスファターゼ (PAP)を含む。
【0013】
従って、特に従来のウィルスや癌の治療の効果が現れなかった、病気が進行したステージの患者に対して、さらなるウィルスの療法が必要であることは明らかである。
【0014】
最近、あるタンパク質の高いレベルでの発現により、CTLが腫瘍細胞と正常な細胞を区別することが可能となることが、多くの研究により示されている(4、5)。
【0015】
腫瘍免疫療法において自己免疫を避ける方法の1つは、ウィルスと連関する、ヒトの悪性腫瘍の15%を標的とすることである。これらのもっとも強い連関は、子宮頸癌とヒトパピローマウィルス間のものであり、子宮頸癌細胞の99.7%がHPVのDNAを含んでいる (6)。生殖器の粘膜に感染し、子宮頸癌、頭頸部癌、皮膚癌のような、悪性腫瘍を生じさせる25以上のHPVが存在する。これらの‘‘高危険’’であるHPVは、少なくとも2つの腫瘍遺伝子産物、子宮頸部の上皮細胞において不死化および形質転換させるために機能するE6とE7により特徴付けられる。これらのタンパクの発現は癌細胞の形質転換された表現型を維持するために不可欠であると考えられており、そのため、これらの非自己ウィルス性タンパクはCTL調節免疫療法の興味深い標的である。
【0016】
HPV E6/E7に対するCTL活性型はワクチン接種により誘導することが可能であり (7)、そのようなCTLは前癌状態の子宮頸疾患 (8)や癌の患者(9)において可変的な出現率で検出される。しかしながら、それらが低い出現率でしか発現しない可能性が高いため、生体外でこれらCTLを生成することは困難である(10)。腫瘍特異的な標的としてこれらのタンパクを使用することの主な制限は、それらが癌細胞内で低いレベルで発現されることである (11)。さらに、E6およびE7タンパク自体は、小さく、また、CTLによる認識に適したエピトープをほとんど含んでいない (12)。
【発明の開示】
【課題を解決するための手段】
【0017】
本発明の目的は、CTLにより認識されるペプチドを同定した後、標的とすることによって、これらの課題を解決することにある。ペプチドはHPV形質転換細胞に特異的であり、また、自己免疫を生じさせる可能性は低い。これらのペプチドはHPV形質転換細胞中のみに、また、過剰に存在しており、通常、これらのペプチドが由来とするタンパクは、HPV形質転換細胞中において存在しないか、または非常に低いレベルで発現される。対照的に、正常な細胞ではこれらのタンパクは正常、あるいは高いレベルで発現している。
【0018】
本発明は、HPV E6およびE7腫瘍タンパクが、感染細胞の形質転換中に生じる、例えば網膜芽細胞腫タンパク (Rb)、特にC-MYCおよびHMCM7 (表3参照)のような、宿主細胞タンパクを標的とする分解を調節するために用いるメカニズムを基としている。
【0019】
HPV腫瘍タンパクが結合して、Rbのような宿主細胞タンパクの分解を促進することが周知となっている。そのため、通常ではタンパク分解されないため、正常細胞はRbタンパクの高い細胞内レベルを有しているのに対し、形質転換された子宮頸癌細胞の分析は完全な長さのRbタンパクのはっきりとした発現を示さない。
【0020】
Rbタンパクはユビキチン依存タンパク分解システムにより分解されることが示されており (13)、さらに最近では、プロテアゾームと呼ばれる細胞内顆粒がE6およびE7腫瘍タンパクの相互作用後の宿主細胞タンパクの分解 (18, 19)の調節をしていることが明らかとなった。
【0021】
我々は、例えばプロテアゾームによる、ユビキチン化したタンパク基質の分解は、CTLにより認識されるペプチドが産生される主なメカニズムである可能性がある、という事実を認識した (20、21)。例えば、ウィルスに感染された細胞において、細胞質で新たに合成されたウィルス性タンパクは、プロテアゾームによりペプチド断片に分解される。これらのペプチドは、抗原処理 (TAP)タンパクと結合したトランスポーターにより、小胞体(ER)に輸送される。ER内部では、ペプチドは、成熟MHC/ペプチド複合体を形成するMHCクラスI分子とベータ2マイクログロブリンに結合する。これが、CTLにより認識され得る、細胞表面に輸送される。図1は、この過程の図による表示である。
【0022】
したがって、本発明は、HPV形質転換細胞において、Rbタンパク (および他のタンパク、表3参照)が分解の標的とされ、また、そのペプチドがCTLにより認識され得るペプチドとして細胞の表面に存在しているという理論を基としている。HPV形質転換されていない、あるいは正常な細胞においては、これらのタンパクはほとんど分解されないため、これらのペプチドは、事実上、CTL認識に適用されない。よって、HPV形質転換細胞は、例えば、通常、細胞表面でペプチドHLA複合体として結合して存在している、高レベルのRb由来ペプチドを有するが、正常な細胞とは対照的に、完全な長さのタンパクの細胞内レベルは低い。
【0023】
免疫療法のための標的としての宿主細胞タンパクの使用は、新規ではない。しかしながら、従来のすべての例において、この方法は、正常な細胞と比較しての腫瘍におけるタンパクの過剰発現に依存していた。例えば、p53 (5)、ウィルムス転写因子 (WT1)、Her 2/Neu (16)、およびHtert (17)のような宿主細胞タンパクは、これらすべてが腫瘍細胞において過剰発現しているため、‘‘腫瘍特異的’’抗原と提唱されてきた。我々の知るところでは、 これは、通常、正常細胞と比較してHPV形質転換細胞内において低い、または検出できないレベルで発現する‘‘腫瘍特異的’’タンパク、より具体的にはそのペプチドを対象とするHPVまたは癌のワクチンとしては、初めてのものである。
【0024】
従来、高レベルな抗原発現は、CTLが腫瘍細胞と正常な細胞を区別することを可能とするために有効であると考えられていた。
【0025】
加えて、今まで、HPVワクチンはこのウィルスにより分解の標的とされる宿主タンパクではなく、HPVにより産生されるタンパクを包含していた。
【0026】
まとめとして、本発明は、必ずしもウィルスに感染された細胞における関連タンパクの相対的に高レベルな発現、または明らかな発現を利用するのではなく、細胞表面における相対的に高レベルなペプチドの存在を利用するものである。事実、腫瘍特異的タンパクの低レベルな発現、または発現しないことは、そのタンパクがウィルス性タンパクによる分解の標的となっており、そのため低い細胞内レベルで存在する一方、分解後は、細胞膜に存在し、CTL認識のためのペプチドとして利用できることを、典型的に示している。
【0027】
したがって、本発明の1つの態様として、単離され、精製され、合成され、または組み換えられた、少なくとも1つのペプチドであって、ヒトパピローマウィルス腫瘍タンパクにより分解された宿主細胞タンパクの断片であるとともに、哺乳動物に投与されるとCTL反応を発現させることができるペプチドを含むワクチンが提供される。
【0028】
ヒトパピローマウィルス腫瘍タンパクにより分解された細胞タンパクへのここでの言及は、HPV腫瘍タンパクにより選択的に分解の標的とされたタンパクへの言及を含み、また、HPV形質転換細胞において、選択的に分解の標的とされたタンパク、あるいは、すなわち直接的にまたは間接的に、主として、しかしこれに限定されるものではない、ユビキチン経路により分解されるという方法で、ヒトHPV腫瘍タンパクにより活性化されたタンパクを含む。
【0029】
本発明の好ましい実施形態において、哺乳動物はヒトである。
【0030】
腫瘍タンパクは、E6またはE7であることが好ましい。
【0031】
宿主細胞タンパクは、例えばE6やE7のようなウィルス性タンパクにより分解されるタンパクであってもよく、表3は、E6またはE7により分解の標的にされるとして現在知られているタンパクを示す。
【0032】
タンパクは、正常な細胞と比較して、HPV形質転換または腫瘍細胞の細胞表面において多量に存在していることを指す、HPV特異的あるいは腫瘍特異的であってもよい。
【0033】
さらに好ましくは、ペプチドは長さにおいて9から30のアミノ酸であることが好ましい。
【0034】
あるいは、ペプチドは長さにおいて9から11のアミノ酸であってもよい。
【0035】
CTL反応は、CTLがワクチンのペプチドを発現させているHPV形質転換細胞または腫瘍細胞を認識することができることを示す、HPV特異的、あるいは腫瘍特異的CTL反応であることが好ましい。
【0036】
さらに好ましくは、ワクチンは表4に示すペプチドの一つ以上を含む(SEQ ID NOS:1-163)。
【0037】
さらにより好ましくは、ワクチンは、上述したペプチドのいずれか1つと、上述したペプチドとともに、主要組織適合性遺伝子複合体分子、好ましくはクラスI分子、さら好ましくはヒト白血球抗原(HLA)、さらにより好ましくは表1から選択されるHLAを含む。
【0038】
本発明の異なる態様として、単離され、精製され、合成され、または組み換えられたペプチドであって、表4に記載されたものから選択されるペプチドを含むワクチンが提供される。
【0039】
本発明のさらに異なる態様として、表4から選択される、単離され、精製され、合成され、または組み換えられた少なくとも1つのペプチドと、さらに表1に記載されたHLAから選択された、単離され、精製され、合成され、または組み換えられた、少なくとも1つのペプチドとを含むワクチンが提供される。
【0040】
本発明のさらなる態様として、上述したペプチドまたはペプチド/HLA複合体のいずれかをコードする、単離され、精製され、合成され、または組み換えられた少なくとも1つの核酸分子を含むワクチンが提供される。
【0041】
この実施形態において、核酸分子は組み換えコンストラクトを含むベクターの形で存在するようにしてもよい。コンストラクトは、選択された宿主システムにおいて前記ワクチンの発現に適することが好ましい。宿主システムは、細胞、プラスミド、ウィルス、生命体、他の同様な媒体である。
【0042】
本発明のさらなる態様として、本発明のベクターにより形質転換された、あるいは核酸導入された宿主細胞が提供される。
【0043】
加えて、本発明は、上述した組み換えコンストラクトを含むベクターにより形質転換された、あるいは核酸導入された宿主細胞を培養することと、生じたコンストラクト産物を単離/精製することとを含む、ワクチンの製造方法を提供する。
【0044】
本発明のペプチドはまた、生体外で、任意の免疫療法に使用される、HPV特異的、あるいは腫瘍特異的な細胞傷害性Tリンパ球、またはそれらのT細胞レセプター、または前記レセプターをコードする遺伝子を産生、および単離するために使用されてもよい。例えばこれは、Tリンパ球を上述したペプチドのうち少なくともひとつを用いて培養することにより実行され得る。
【0045】
本発明のまたさらなる態様として、
(a)宿主細胞がHPVにより形質転換され、または核酸導入されたときにHPVタンパクによ
り分解され、最終的にウィルスに感染された細胞表面に存在する、宿主タンパクの断片である少なくとも1つのペプチドとともに、細胞傷害性Tリンパ球を含むサンプルを培養することと、
(b)それへの結合により、前記ペプチドを認識するCTLを選択することと、を含むHPV特異的あるいは腫瘍特異的細胞傷害性Tリンパ球の同定方法が提供される。
【0046】
本発明の好ましい方法として、前記ペプチドは表4に示したリストから選択されたペプチドである。本発明のさらに好ましい方法として、CTLはCD8+細胞である。
【0047】
CTLレセプターは、上述した方法を使用してさらに同定されてもよいことは、当業者にとって明らかである。
【0048】
本発明は、疾患、特に癌、より好ましくは子宮頸癌、頭頸部扁平上皮癌、非メラノーマ皮膚癌、メソチオローマ(mesothioloma)、前立腺癌に関連するHPVを治療するために使用され得る。
【0049】
さらに、本発明は、治療されるべき哺乳動物に上述したワクチンを投与することを含む、治療方法を提供する。好ましくは、哺乳動物はヒトである。
【0050】
本発明のさらなる態様によれば、表4に示されるリストから選択されるペプチド、または同じものをコードする核酸分子が提供される。
【0051】
本発明の好ましい実施形態において、前記ペプチドはワクチンとして使用され、好ましくは、疾患に関連するHPVを治療するためのHPVワクチンとして使用される。
【0052】
本発明のさらなる態様によれば、HLAペプチドと結合して存在する、表4に示されるペプチドのうち少なくともひとつを含む複合体が提供される。
【0053】
さらに好ましくは、HLAペプチドは表1に示されたペプチドのうちの1つであり、より具体的にはHLA-A結合タンパクであり、さらにより具体的にはHLA-A0201である。
【0054】
本発明のさらなる態様によれば、ヒトパピローマウィルス腫瘍タンパクにより分解された哺乳動物細胞タンパクの断片であり、HPV形質転換あるいはHPV導入細胞の表面においてHLAと結合して存在し、細胞傷害性Tリンパ球による当該ペプチドとHLAの複合体の認識により免疫反応の発現が起こる、HPVワクチン産生のためのHPV特異的ペプチドの使用が提供される。
【発明を実施するための最良の形態】
【0055】
以下の実施例を通して、および以下の図を参照して発明を説明する。
【0056】
実施例1
15のタンパクに由来する、候補である9または10のアミノ酸ペプチドが、分析のために選択された、ペプチドの全てのリストである表4を参照求む。HLA-A*0201と結合すると予想される102のペプチドが、公表されたアルゴリズムに従って選択された(33、34)(表4)。我々が使用した当該アルゴリズムは、以前、他の腫瘍特異的CTLエピトープを適切に予想するために使用された(17)。我々は、白人の間でもっとも共通なHLA対立遺伝子であり、実証実験を容易に行うための生体内外のモデルシステムが明らかとなっている、HLA-A*0201をco-presentingペプチドとして選択した。当初のリストの102のペプチドから、62が試験のために合成された。
【0057】
HLA-A*0201への結合について試験されたペプチド
CTLは、細胞表面の、HLAクラスI分子に結合したペプチドを認識する。したがって、ペプチドは、機能するためにHLAへ結合しなければならない。これは、結合により生じるHLA-A*0201発現の増加を測定する、細胞ベースアッセイ (cell based assay)を用いることにより、測定され得る。
【0058】
細胞ベースペプチド結合アッセイは、候補であるペプチドの多く (43/62)がHLA-A*0201に結合し得ることを示すために用いられた(表3、図3)。
【0059】
宿主タンパク由来ペプチドのHLA-A2結合
T2細胞のHLA-A*0201発現は、100μgの試料ペプチドを用いて一晩培養した後のフローサイトメトリーにより、測定された。各ペプチドは4回づつテストされた。HLA-A*0201発現における50%以上の割合の増加が、有意であるとみなされた。
【0060】
観察された結合のレベルは、強い、または緩やかのいずれかで分類されることができ、2つのよく知られたHLA-A*0201制限CTLエピトープ(インフルエンザM1およびEBV BMFL1)と同程度であった(図3)。
【0061】
HLA-A*0201発現の50%より大きい増加を示した43のペプチドは、免疫原性実験における試験のための候補として選択された。
【0062】
マウスにおける生体内免疫原性の試験
我々は、潜在的なヒトワクチンを試験するために、HLA-A*0201トランスジェニックマウスを用いた (36)。これらのマウスは、生体内反応の発達を測定するための補助薬とともに、ペプチドが接種され得る。これらの反応は、脾臓内においてペプチド特異的なT細胞を固定するためのIFN-Yの数を測定するELISPOTアッセイを用いて検出された。
【0063】
Rb (6)、Mupp1 (7)、BAK (3)、DLG (2)、AP (2)タンパク由来の20のペプチドが扱われた。すべてのペプチドは、結合の強さで選択された。HLA-A*0201バインダーとして知られるインフルエンザ由来のM158-66ペプチドが、ポジティブコントロールとして用いられた。顕著なT細胞反応は、ポジティブコントロールであるM158-66ペプチド (7/12 マウス)およびRb485-493 (Rb7)タンパク由来のペプチド(7/10 マウス)について観察された。結果は図4に示された。
【0064】
ヒトTリンパ球を使用する生体外免疫原性試験
候補となるペプチドは、癌細胞を認識して破壊することができるヒトTリンパ球を活性化することができなければならない。我々は、子宮頸癌の患者の抹消血中からペプチド特異的T細胞を検出した。これから、そのようなペプチドは‘‘自己’’タンパクに由来するにもかかわらず免疫原性を有することが可能であるという考えが証明された。
【0065】
ペプチド特異的T細胞の検出
本発明のペプチドに対して反応するT細胞は、子宮頸癌であるHLA-A2+の患者から優先的に検出される必要がある。4つの患者の血液サンプル (3つは子宮頸癌、1つは前悪性疾患、CIN3)が、Rb7ペプチドを認識するCD8+T細胞の存在について試験された。蛍光識別された多量体のHLA-A2/ペプチド複合体が、フローサイトメトリーによりペプチド特異的T細胞の数を測定するために使用された。このアッセイは、Rb7ペプチドに特異的なT細胞が、子宮頸癌の2人の患者の血液中で低い出現率で検出され得ることを示した。これらの出現率は、以前にHPV16 E7ペプチド特異的T細胞について得られたものと同様であった。これにより、さらなる実験のためのRb特異的T細胞を単離、および増加させることが可能であることが示唆された。
【0066】
上述した技術を使用することにより、Tリンパ球がMelan-Aのような、特定の‘‘自己’’腫瘍抗原を認識することは、健全なドナーにおいても容易に検出し得る。しかしながら、健全なドナーにおいて、Tリンパ球の‘‘自己’’抗原の認識を検出するのが難しいのは、一般的なケースである。8人の健全なドナーに由来する血液サンプル (全てHLA-A2+)が、適当な蛍光標識された多量体 (五量体)を使用して、Rb7ペプチドとMelan -Aペプチドを認識するCD8+細胞の存在について試験された。Tリンパ球のRb7ペプチドの認識は、8人の健全なドナーすべてにおいて可変的で、しかし一般に低い出現率で検出され得る(表6)。反対に、以前の報告を確認すると、Melan -Aに対するT-リンパ球の反応は、非常に高い出現率であった (50)。Rb7に特異的なTリンパ球のもっとも高い反応は、ドナー5で検出された (図5)。
【0067】
上述したアッセイは、ヒトT細胞のRb7の認識は、患者と健全なドナーのどちらでも検出され得ることを示している。ELISPOTアッセイは、健全なドナーから培養されたRb7ペプチド特異的CD8+Tリンパ球が、IFN-γを分泌させることができるか否かを判別するために用いられた。7人の健全なドナーについて試験され、うち3人のドナーで検出できる数のIFN-γ分泌リンパ球が示された(図5)。
【0068】
全般的なこれらの結果は、Rb7ペプチドのような、HPV処理により産生される宿主細胞タンパク断片は、CD8+Tリンパ球の免疫原性を示し、また、機能的(IFN-γ分泌)反応を発現させることが可能である。これにより、実験や臨床治療の使用のいずれかのために、多量のRb特異的T細胞を、単離、増加させることが可能であることが示唆された。
【0069】
【表1A】

【表1B】

【表1C】

【表1D】

【表1E】

【表1F】

【表1G】

【表1H】

【表1I】

【表1J】

【表1K】

【表1L】

【表1M】

【表1N】

【表1O】

【0070】
【表2】

【0071】
【表3】

【0072】
【表4A】

【表4B】

【表4C】

【表4D】

【0073】
【表5】

【0074】
【表6】

【0075】
引用文献
1. Mandelboim, O., E. Vadai, M. Fridkin, A. Katz-Hillel, M. Feldman, G. Berke, and L. Eisenbach. 1995. Regression of established murine carcinoma metastases following vaccination with tumour-associated antigen peptides. Nature Medicine. 1:1179.
2. Heslop, H. E., and C. M. Rooney. 1997. Adoptive cellular immunotherapy for EBV lymphoproliferative disease. Immunological Reviews 157:217.
3. Overwijk, W. W., D. S. Lee, D. R. Surman, K. R. Irvine, C. E. Touloukian, C. C. Chan, M. W. Carroll, B. Moss, S. A. Rosenberg, and N. P. Restifo. 1999. Vaccination with a recombinant vaccinia virus encoding a "self" antigen induces autoimmune vitiligo and tumor cell destruction in mice: requirement for CD4(+) T lymphocytes. Proceedings of the National Academy of Sciences of the United States of America 96:2982.
4. Gao, L., I. Bellantuono, A. Elsasser, S. B. Marley, M. Y. Gordon, J. M. Goldman, and H. J. Stauss. 2000. Selective elimination of leukemic CD34(+) progenitor cells by cytotoxic T lymphocytes specific for WT1. Blood 95:2198.
5. Theobald, M., J. Biggs, D. Dittmer, A. J. Levine, and L. A. Sherman. 1996. Targeting p53 as a general tumour antigen. Proceedings of the National Academy of Sciences of the United States of America 92:11993.
6. Walboomers, J. M., M. V. Jacobs, M. M. Manos, F. X. Bosch, J. A. Kummer, K. V. Shah, P. J. Snijders, J. Peto, C. J. Meijer, and N. Munoz. 1999. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. Journal of Pathology 189:12.
7. Borysiewicz, L. K., A. Fiander, M. Nimako, S. Man, G. W. G. Wilkinson, D. Westmoreland, A. S. Evans, M. Adams, S. N. Stacey, M. E. G. Boursnell, E. Rutherford, J. K. Hickling, and S. C. Inglis. 1996. A recombinant vaccinia virus encoding human papillomavirus type 16 and type 18, e6 and e7 proteins as immunotherapy for cervical cancer. Lancet 347:1523.
8. Nimako, M., A. N. Fiander, G. W. Wilkinson, L. K. Borysiewicz, and S. Man. 1997. Human papillomavirus-specific cytotoxic T lymphocytes in patients with cervical intraepithelial neoplasia grade III. Cancer Res 57:4855.
9. Evans, E. M., S. Man, A. S. Evans, and L. K. Borysiewicz. 1997. Infiltration of cervical cancer tissue with human papillomavirus- specific cytotoxic T-lymphocytes. Cancer Res 57:2943.
10. Youde, S. J., P. R. Dunbar, E. M. Evans, A. N. Fiander, L. K. Borysiewicz, V. Cerundolo, and S. Man. 2000. Use of fluorogenic histocompatibility leukocyte antigen-A*0201/HPV 16 E7 peptide complexes to isolate rare human cytotoxic T-lymphocyte- recognizing endogenous human papillomavirus antigens. Cancer Res 60:365.
11. Frazer, I. H., R. Thomas, J. Zhou, G. R. Leggatt, L. Dunn, N. McMillan, R. W. Tindle, L. Filgueira, P. Manders, P. Barnard, and M. Sharkey. 1999. Potential strategies utilised by papillomavirus to evade host immunity. Immunological Reviews 168:131.
12. Khammanivong, V., X. S. Liu, W. J. Liu, S. J. Rodda, G. R. Leggatt, R. W. Tindle, I. H. Frazer, and G. J. Fernando. 2003. Paucity of functional CTL epitopes in the E7 oncoprotein of cervical cancer associated human papillomavirus type 16. Immunol Cell Biol 81:1.
13. Scheffner, M., Munger K, Huibregtse JM, and H. PM. 1992. Targeted degradation of the retinoblastoma protein by human papillomavirus E7-E6 fusion proteins. European Molecular Biology Organisation Journal 11:2425.
14. Scheffner, M., B. A. Werness, J. M. Huigbretse, A. J. Levine, and P. M. Howley. 1990. The E6 oncoprotein encoded by human papillomavirus types 16 and 18 promotes the degradation of p53. Cell 63:1129.
15. Higashitsuji, H., K. Itoh, T. Nagao, S. Dawson, K. Nonoguchi, T. Kido, R. J. Mayer, S. Arii, and J. Fujita. 2000. Reduced stability of retinoblastoma protein by gankyrin, an oncogenic ankyrin-repeat protein overexpressed in hepatomas. Nature Medicine 6:96.
16. Rongcun, Y., F. Salazar-Onfray, J. Charo, K. Malmberg, K. Evrin, H. Maes, K. Kono, C. Hising, M. Petersson, O. Larsson, L. Lan, E. Appella, A. Sette, E. Celis, and R. Kiessling. 1999. Identification of New HER2/neu-Derived Peptide Epitopes That Can Elicit Specific CTL Against Autologous and Allogeneic Carcinomas and Melanomas 1. The Journal of Immunology,,: 163:1037-1044.
17. Vonderheide, R. H., W. C. Hahn, J. L. Schultze, and L. M. Nadler. 1999. The telomerase catalytic subunit is a widely expressed tumor-associated antigen recognized by cytotoxic T lymphocytes. Immunity 10:673.
18. Berezutskaya, E., and S. Bagchi. 1997. The human papillomavirus E7 oncoprotein functionally interacts with the S4 subunit of the 26 S proteasome J Biol Chem 272:30135.
19. Boyer, S. N., D. E. Wazer, and V. Band. 1996. E7 protein of human papilloma virus 16 induces degradation of retinoblastoma protein through the ubiquitin proteasome pathway. Cancer research 56:4620.
20. Michalek, M. T., E. P. Grant, C. Gramm, A. L. Goldberg, and K. L. Rock. 1993. A role for the ubiquitin-dependent proteolytic pathway in MHC class I- restricted antigen presentation. Nature 363:552.
21. Cerundolo, V., A. Benham, V. Braud, S. Mukherjee, K. Gould, B. Macino, J. Neefjes, and A. Townsend. 1997. The proteasome-specific inhibitor lactacystin blocks presentation of cytotoxic T lymphocyte epitopes in human and murine cells. Eur J Immunol 27:336.
22. Vierboom, M., S. Zwaveling, G. Bos, M. Ooms, G. Krietemeijer, C. Melief, and R. Offringa. 2000. High Steady-State Levels of p53 Are Not a Prerequisite for Tumor Eradication by Wild-Type p53-specific Cytotoxic T Lymphocytes. Cancer Research 60:5508-5513.
23. Vierboom, M. P., H. W. Nijman, R. Offringa, E. I. van der Voort, T. van Hall, L. van den Broek, G. J. Fleuren, P. Kenemans, W. M. Kast, and C. J. Melief. 1997. Tumor eradication by wild-type p53-specific cytotoxic T lymphocytes. Journal of Experimental Medicine 186:695.
24. Kao, W. H., S. L. Beaudenon, A. L. Talis, J. M. Huibregtse, and P. M. Howley. 2000. Human Papillomavirus Type 16 E6 Induces Self-Ubiquitination of the E6AP Ubiquitin-Protein Ligase. J. Virol. 74:6408.
25. Gross-Mesilaty, S., E. Reinstein, B. Bercovich, K. E. Tobias, A. L. Schwartz, C. Kahana, and A. Ciechanover. 1998. Basal and human papillomavirus E6 oncoprotein-induced degradation of Myc proteins by the ubiquitin pathway. Proceedings of the National Academy of Sciences of the United States of America 95:8058.
26. Nakagawa, S., and J. M. Huibregtse. 2000. Human scribble (Vartul) is targeted for ubiquitin-mediated degradation by the high-risk papillomavirus E6 proteins and the E6AP ubiquitin- protein ligase. Mol Cell Biol 20:8244.
27. Kuhne, C., and L. Banks. 1998. E3-ubiquitin ligase/E6-AP links multicopy maintenance protein 7 to the ubiquitination pathway by a novel motif, the L2G box. J Biol Chem 273:34302.
28. Glaunsinger, B. A., S. S. Lee, M. Thomas, L. Banks, and R. Javier. 2000. Interactions of the PDZ-protein MAGI-1 with adenovirus E4-ORF1 and high- risk papillomavirus E6 oncoproteins. Oncogene 19:5270.
29. Gao, Q., L. Singh, A. Kumar, S. Srinivasan, D. E. Wazer, and V. Band. 2001. Human papillomavirus type 16 E6-induced degradation of E6TP1 correlates with its ability to immortalize human mammary epithelial cells. J Virol 75:4459.
30. Pim, D., M. Thomas, R. Javier, D. Gardiol, and L. Banks. 2000. HPV E6 targeted degradation of the discs large protein: evidence for the involvement of a novel ubiquitin ligase Oncogene 19:719.
31. Thomas, M., and L. Banks. 1998. Inhibition of Bak-induced apoptosis by HPV-18 E6. Oncogene 17:2943.
32. Lee, S., B. Glaunsinger, F. Mantovani, L. Banks, and R. Javier. 2000. Multi-PDZ Domain Protein MUPP1 Is a Cellular Target for both Adenovirus E4-ORF1 and High-Risk Papillomavirus Type 18 E6 Oncoproteins. Journal of Virology 74:9680-9693.
33. Srivenugopal, K. S., and F. Ali-Osman. 2002. The DNA repair protein, O(6)-Methylguanine-DNA methyltransferase is a proteolytic target for the E6 human papillomavirus oncoprotein. Oncogene 21:5940.
34. Thomas, M., R. Laura, K. Hepner, E. Guccione, C. Sawyers, L. Lasky, and L. Banks. 2002. Oncogenic human papillomavirus E6 proteins target the MAGI-2 and MAGI-3 proteins for degradation. Oncogene 21:5088.
35. Lu, Z., X. Hu, Y. Li, L. Zheng, Y. Zhou, H. Jiang, T. Ning, Z. Basang, C. Zhang, and Y. Ke. 2004. Human papillomavirus 16 E6 oncoprotein interferences with insulin signaling pathway by binding to tuberin. J Biol Chem In press.
36. Parker, K. C., M. A. Bednarek, L. K. Hull, U. Utz, B. Cunningham, H. J. Zweerink, W. E. Biddison, and J. E. Coligan. 1992. Sequence motifs important for peptide binding to the human MHC class I molecule, HLA-A2. Journal of Immunology 149:3580.
37. Engelhard, V. H. 1994. Structure of peptides associated with MHC class I molecules. Current Opinion in Immunology 6:13.
38. Ellis, J. R., P. J. Keating, J. Baird, E. F. Hounsell, D. V. Renouf, M. Rowe, D. Hopkins, M. F. Duggan-Keen, J. S. Bartholomew, L. S. Young, and P. L. Stern. 1995. The association of an HPV16 oncogene variant with HLA-B7 has implications for vaccine design in cervical cancer. Nature Medicine 1:464.
39. Faulkner, L., L. K. Borysiewicz, and S. Man. 1998. The use of human leucocyte antigen class I transgenic mice to investigate human immune function. J Immunol Methods 221:1.
40. Dunbar, P., J. Chen, D. Chao, N. Rust, H. Teisserenc, G. Ogg, P. Romero, P. Weynants, and V. Cerundolo. 1999. Rapid cloning of tumour specific CTL suitable for adoptive immunotherapy of melanoma. Journal of Immunology 162:6959.
41. Rooney, C. M., C. A. Smith, C. Y. C. Ng, S. K. Loftin, J. W. Sixbey, Y. Gan, D. K. Srivastava, L. C. Bowman, R. A. Krance, M. K. Brenner, and H. E. Heslop. 1998. Infusion of cytotoxic T cells for the prevention and treatment of epstein-barr virus-induced lymphoma in allogeneic transplant recipients Blood 92:1549.
42. Stanislawski, T., R. H. Voss, C. Lotz, E. Sadovnikova, R. A. Willemsen, J. Kuball, T. Ruppert, R. L. Bolhuis, C. J. Melief, C. Huber, H. J. Stauss, and M. Theobald. 2001. Circumventing tolerance to a human MDM2-derived tumor antigen by TCR gene transfer. Nat Immunol 2:962.
43. Shah, K. V. 1998. Do human papillomavirus infections cause oral cancer? J Natl Cancer Inst 90:1585.
44. Shamanin, V., H. zur Hausen, D. Lavergne, C. M. Proby, I. M. Leigh, C. Neumann, H. Hamm, M. Goos, U.-F. Haustein, E. G. Jung, G. Plewig, H. Wolff, and E.-M. de Villiers. 1996. Human papillomavirus infections in nonmelanoma skin cancers from renal transplant recipients and nonimmunosuppressed patients. Journal of the National Cancer Institute 88:802.
45. Kiviat, N. B. 1999. Papillomaviruses in non-melanoma skin cancer: epidemiological aspects. Semin Cancer Biol 9:397.
46. Man, S., and A. Fiander. 2001. Immunology of human papillomavirus infection in lower genital tract neoplasia. Best Pract Res Clin Obstet Gynaecol 15:701.
47. Palefsky, J. M. 1997. Cutaneous and genital HPV-associated lesions in HIV-infected patients. Clin Dermatol 15:439.
48. De Luca, A., A. Baldi, V. Esposito, C. M. Howard, L. Bagella, P. Rizzo, M. Caputi, H. I. Pass, G. G. Giordano, F. Baldi, M. Carbone, and A. Giordano. 1997. The retinoblastoma gene family pRb/p105, p107, pRb2/p130 and simian virus-40 large T-antigen in human mesotheliomas Nature Medicine 3:913.
49. Li, B., and Q. P. Dou. 2000. Bax degradation by the ubiquitin/proteasome-dependent pathway: involvement in tumor survival and progression. Proc Natl Acad Sci U S A 97:3850.
50. Pittet, M. J., Valmori, D., Dunbar, P. R., Speiser, D. E., Linard, D., Lejeune, F., Fleischhauer, K., Cerundolo, V., Cerottini, J. C., and Romero, P. 1999. High Frequencies of Naive Melan-A/MART-1-specific CD8(+) T Cells in a Large Proportion of Human. Histocompatibility Leukocyte Antigen (HLA)-A2 Individuals. Journal of Experimental Medicine 190:705-716.
【図面の簡単な説明】
【0076】
【図1】図1は、ヒトパピローマウィルスにより形質転換された細胞における、宿主細胞タンパクのT細胞認識のメカニズムを示す。
【図2】図2は、正常な細胞とHPV形質転換細胞の宿主細胞ペプチドの存在の違いを示す。
【図3】図3は、宿主タンパク由来ペプチドのHLA-A2を示す。具体的には、T2細胞のHLA-A*0201発現が、100μgの試料ペプチドを用いた一晩の培養後のフローサイトメトリーにより測定された。各ペプチドは、4回づつ繰り返した。50%以上のHLA-A*0201発現のA%の増加が重要であると考えられた。
【図4】図4は、ヒトRbタンパク由来のペプチドに対する生体内T細胞反応の産生を示す。具体的には、HLA-A2/Kbトランスジェニックマウスに、不完全なフロインドアジュバント中で乳化された100μgの試料ペプチドを接種した。各ペプチドについて、2から4匹のマウスが試験された。10から11日後、マウスは実験のために殺され、脾細胞がELISPOTアッセイに供された。これらは、接種されたペプチドに特異的なT細胞 (スポット)を産生するIFN-□の数が測定された。好ましい結果は、少なくともさらなる2回の繰り返し実験において確認された。M158-66、Rb1、Rb7、およびBAK18ペプチドについて試験した1つの実験からの典型的なデータを示す。
【図5】図5は、Rb7を認識するCD8+T細胞が健全なHLA-A2+ドナーにおいて検出され得ることを示す。具体的には、CD8+T細胞は、Rb7ペプチド (パネルC&D)またはメラン-A/Mart126-35ペプチド (パネルA&B)を用いて14日間培養された。0日目と14日目に、適当な蛍光標識されたペプチド:HLA-A2 5量体を用いて、ペプチド特異的なCD8+T細胞の数が測定された。これらは、フローサイトメーターを用いて分析され、死細胞およびCD14+細胞を除いた、ゲート細胞の%を表した。5人のドナー(表4)の結果を示した。
【図6】図6は、Rb7を認識するCD8+T細胞が健全なドナーにおいて検出され得ることを示す。具体的には、健全なHLA-A2+ドナーに由来する抹消血リンパ球が、CD8+T細胞に添加され、Rb7ペプチドと抗原存在細胞(APC)とともに14日間培養された。培養された細胞は回収され、Rb7ペプチドに反応してIFN-□を分泌することができるT細胞の数を測定するための酵素結合免疫スポット(ELISPOT)アッセイで試験された。7人のドナーのうち3人 (A、B、C)が顕著な反応を示す能力があった(T細胞+Rb7+PBMCのスポットの数>2 上記のT細胞+PBMCの標準偏差)。
【特許請求の範囲】
【請求項1】
単離され、精製され、合成され、または組み換えらた、少なくとも1つのペプチドであって、ヒトパピローマウィルス(HPV)腫瘍タンパクにより分解された宿主細胞タンパクの断片であり、哺乳動物に投与されるとき、細胞傷害性Tリンパ球(CTL)反応を発現させることができる前記ペプチドを含むワクチン。
【請求項2】
前記哺乳動物はヒトである、請求項1に記載のワクチン。
【請求項3】
前記腫瘍タンパクはE6またはE7である、請求項1または2に記載のワクチン。
【請求項4】
前記宿主細胞タンパクは、1つ以上の表3に示したタンパクを含む請求項1から3のいずれか1つに記載のワクチン。
【請求項5】
前記ペプチドは、正常な細胞と比較してHPV形質転換細胞や腫瘍細胞の細胞表面で多量に存在することを示す、HPV特異的、あるいは腫瘍特異的である請求項1から4のいずれか1つに記載のワクチン。
【請求項6】
前記ペプチドは、長さにおいて9から30のアミノ酸である請求項1から5のいずれか1つに記載のワクチン。
【請求項7】
前記ペプチドは、長さにおいて9から11のアミノ酸である請求項6に記載のワクチン。
【請求項8】
前記ワクチンは、1つ以上の表4に示したペプチド(SEQ ID NOS: 1-163)を含む請求項1から7のいずれか1つに記載のワクチン。
【請求項9】
CTL反応は、CTLが、前記ワクチンのペプチドを発現させているHPV形質転換細胞または腫瘍細胞を認識することができることを示す、HPV-特異的あるいは腫瘍特異的である請求項1から8のいずれか1つに記載のワクチン。
【請求項10】
主要組織適合性遺伝子複合体分子をさらに含む請求項1から9のいずれか1つに記載のワクチン。
【請求項11】
前記主要組織適合性遺伝子複合体分子は、クラスI分子である請求項10に記載のワクチン。
【請求項12】
前記主要組織適合性遺伝子複合体分子は、ヒト白血球抗原 (HLA)である請求項10から11に記載のワクチン。
【請求項13】
前記主要組織適合性遺伝子複合体分子は、表1に示したものの1つ以上を含む請求項10から12のいずれか1つに記載のワクチン。
【請求項14】
単離され、精製され、合成され、または組み換えられた、少なくとも1つのペプチドであって、表4に記載されたものから選択される前記ペプチドを含むワクチン。
【請求項15】
表4から選択される、単離され、精製され、合成され、または組み換えられた、少なくとも1つのペプチドと、さらに、表1に記載されたものから選択される、単離され、精製され、合成され、または組み換えられた、少なくとも1つのHLAとを含むワクチン。
【請求項16】
請求項1から9、または14のワクチンに応じたペプチド、あるいは請求項10から13、または15のワクチンに応じたペプチド/HLA複合体をコードする、単離され、精製され、合成され、または組み換えられた、少なくとも1つの核酸分子を含むワクチン。
【請求項17】
前記核酸分子は、ベクター内にあり、組み換えコンストラクトを含む請求項16に記載のワクチン。
【請求項18】
前記コンストラクトは、選択された宿主システム内における前記ペプチドまたは前記ペプチド/HLA複合体の発現に適応している請求項17に記載のワクチン。
【請求項19】
表4に記載されたものから選択されたペプチドをコードする核酸分子と、随意に、表1に記載されたものから選択されたHLAをコードする核酸分子とを含むベクター。
【請求項20】
請求項19に記載のベクターにより形質転換された、あるいは核酸導入された宿主細胞。
【請求項21】
発現できるように組み込まれた、表4に記載されたものから選択されるペプチドと、随意に、表1に記載されたものから選択されたHLAをコードする核酸分子を有する、細胞、プラスミド、ウィルス、生命体、または他の媒体。
【請求項22】
請求項19に記載のベクターにより形質転換された、あるいは核酸導入された宿主細胞を培養することと、生じたコンストラクト産物を単離/精製することを含む、ワクチンを製造する方法。
【請求項23】
(a)宿主細胞がHPVにより形質転換され、または核酸導入されたときにHPVタンパクにより分解され、最終的にウィルスに感染された細胞表面に存在する、宿主タンパクの断片である少なくとも1つのペプチドとともに、細胞傷害性Tリンパ球を含むサンプルを培養することと、
(b)それへの結合によって前記ペプチドを認識するCTLを選択するとともに、前記ペプチドに結合するレセプターの性質を決定することにより、CTLレセプターが同定されることと、を含むHPV特異的、あるいは腫瘍特異的なCTL、またはそのCTLレセプターの同定方法。
【請求項24】
前記ペプチドは、表4に記載されたものから選択される請求項23に記載の同定方法。
【請求項25】
前記CTLは、CD8+細胞である請求項23または24に記載の同定方法。
【請求項26】
請求項1から18のうちいずれか1つに記載の、HPVに関連する疾患を治療するためのワクチンの使用。
【請求項27】
前記疾患は、子宮頸癌、頭頸部扁平上皮癌、非メラノーマ皮膚癌、肝臓癌、メソチオローマ (mesothioloma)、あるいは前立腺癌のいずれか1つである請求項26に記載のワクチンの使用。
【請求項28】
治療されるべき哺乳動物に対して、請求項1から18のうちいずれか1つのワクチンを投与することを含む治療方法。
【請求項29】
前記哺乳動物はヒトである、請求項28に記載の治療方法。
【請求項30】
表4に示されたリストから選択されたペプチド、またはそれをコードする核酸分子。
【請求項31】
ワクチンとしての請求項30のペプチドの使用。
【請求項32】
HLA co-presentingペプチドと結合する、表4に示された少なくとも1つのペプチドを含む複合体。
【請求項33】
HLAペプチドは、表1に示されたものから選択される請求項32に記載の複合体。
【請求項34】
HLAペプチドは、HLA-A結合タンパクである請求項32または33に記載の複合体。
【請求項35】
HLAペプチドは、HLA-A0201である請求項32から34のうちいずれか1つに記載の複合体。
【請求項36】
HPVワクチンを製造するためのHPV特異的ペプチドの使用であって、
前記ペプチドはヒトパピローマウィルス腫瘍タンパクにより分解された哺乳動物細胞タンパクの断片であり、形質転換された、あるいは核酸導入されたHPV細胞の表面でHLAと結合して存在し、CTLによる当該ペプチドHLA複合体の認識により、免疫反応の発現が生じる、HPV特異的ペプチドの使用。
【請求項1】
単離され、精製され、合成され、または組み換えらた、少なくとも1つのペプチドであって、ヒトパピローマウィルス(HPV)腫瘍タンパクにより分解された宿主細胞タンパクの断片であり、哺乳動物に投与されるとき、細胞傷害性Tリンパ球(CTL)反応を発現させることができる前記ペプチドを含むワクチン。
【請求項2】
前記哺乳動物はヒトである、請求項1に記載のワクチン。
【請求項3】
前記腫瘍タンパクはE6またはE7である、請求項1または2に記載のワクチン。
【請求項4】
前記宿主細胞タンパクは、1つ以上の表3に示したタンパクを含む請求項1から3のいずれか1つに記載のワクチン。
【請求項5】
前記ペプチドは、正常な細胞と比較してHPV形質転換細胞や腫瘍細胞の細胞表面で多量に存在することを示す、HPV特異的、あるいは腫瘍特異的である請求項1から4のいずれか1つに記載のワクチン。
【請求項6】
前記ペプチドは、長さにおいて9から30のアミノ酸である請求項1から5のいずれか1つに記載のワクチン。
【請求項7】
前記ペプチドは、長さにおいて9から11のアミノ酸である請求項6に記載のワクチン。
【請求項8】
前記ワクチンは、1つ以上の表4に示したペプチド(SEQ ID NOS: 1-163)を含む請求項1から7のいずれか1つに記載のワクチン。
【請求項9】
CTL反応は、CTLが、前記ワクチンのペプチドを発現させているHPV形質転換細胞または腫瘍細胞を認識することができることを示す、HPV-特異的あるいは腫瘍特異的である請求項1から8のいずれか1つに記載のワクチン。
【請求項10】
主要組織適合性遺伝子複合体分子をさらに含む請求項1から9のいずれか1つに記載のワクチン。
【請求項11】
前記主要組織適合性遺伝子複合体分子は、クラスI分子である請求項10に記載のワクチン。
【請求項12】
前記主要組織適合性遺伝子複合体分子は、ヒト白血球抗原 (HLA)である請求項10から11に記載のワクチン。
【請求項13】
前記主要組織適合性遺伝子複合体分子は、表1に示したものの1つ以上を含む請求項10から12のいずれか1つに記載のワクチン。
【請求項14】
単離され、精製され、合成され、または組み換えられた、少なくとも1つのペプチドであって、表4に記載されたものから選択される前記ペプチドを含むワクチン。
【請求項15】
表4から選択される、単離され、精製され、合成され、または組み換えられた、少なくとも1つのペプチドと、さらに、表1に記載されたものから選択される、単離され、精製され、合成され、または組み換えられた、少なくとも1つのHLAとを含むワクチン。
【請求項16】
請求項1から9、または14のワクチンに応じたペプチド、あるいは請求項10から13、または15のワクチンに応じたペプチド/HLA複合体をコードする、単離され、精製され、合成され、または組み換えられた、少なくとも1つの核酸分子を含むワクチン。
【請求項17】
前記核酸分子は、ベクター内にあり、組み換えコンストラクトを含む請求項16に記載のワクチン。
【請求項18】
前記コンストラクトは、選択された宿主システム内における前記ペプチドまたは前記ペプチド/HLA複合体の発現に適応している請求項17に記載のワクチン。
【請求項19】
表4に記載されたものから選択されたペプチドをコードする核酸分子と、随意に、表1に記載されたものから選択されたHLAをコードする核酸分子とを含むベクター。
【請求項20】
請求項19に記載のベクターにより形質転換された、あるいは核酸導入された宿主細胞。
【請求項21】
発現できるように組み込まれた、表4に記載されたものから選択されるペプチドと、随意に、表1に記載されたものから選択されたHLAをコードする核酸分子を有する、細胞、プラスミド、ウィルス、生命体、または他の媒体。
【請求項22】
請求項19に記載のベクターにより形質転換された、あるいは核酸導入された宿主細胞を培養することと、生じたコンストラクト産物を単離/精製することを含む、ワクチンを製造する方法。
【請求項23】
(a)宿主細胞がHPVにより形質転換され、または核酸導入されたときにHPVタンパクにより分解され、最終的にウィルスに感染された細胞表面に存在する、宿主タンパクの断片である少なくとも1つのペプチドとともに、細胞傷害性Tリンパ球を含むサンプルを培養することと、
(b)それへの結合によって前記ペプチドを認識するCTLを選択するとともに、前記ペプチドに結合するレセプターの性質を決定することにより、CTLレセプターが同定されることと、を含むHPV特異的、あるいは腫瘍特異的なCTL、またはそのCTLレセプターの同定方法。
【請求項24】
前記ペプチドは、表4に記載されたものから選択される請求項23に記載の同定方法。
【請求項25】
前記CTLは、CD8+細胞である請求項23または24に記載の同定方法。
【請求項26】
請求項1から18のうちいずれか1つに記載の、HPVに関連する疾患を治療するためのワクチンの使用。
【請求項27】
前記疾患は、子宮頸癌、頭頸部扁平上皮癌、非メラノーマ皮膚癌、肝臓癌、メソチオローマ (mesothioloma)、あるいは前立腺癌のいずれか1つである請求項26に記載のワクチンの使用。
【請求項28】
治療されるべき哺乳動物に対して、請求項1から18のうちいずれか1つのワクチンを投与することを含む治療方法。
【請求項29】
前記哺乳動物はヒトである、請求項28に記載の治療方法。
【請求項30】
表4に示されたリストから選択されたペプチド、またはそれをコードする核酸分子。
【請求項31】
ワクチンとしての請求項30のペプチドの使用。
【請求項32】
HLA co-presentingペプチドと結合する、表4に示された少なくとも1つのペプチドを含む複合体。
【請求項33】
HLAペプチドは、表1に示されたものから選択される請求項32に記載の複合体。
【請求項34】
HLAペプチドは、HLA-A結合タンパクである請求項32または33に記載の複合体。
【請求項35】
HLAペプチドは、HLA-A0201である請求項32から34のうちいずれか1つに記載の複合体。
【請求項36】
HPVワクチンを製造するためのHPV特異的ペプチドの使用であって、
前記ペプチドはヒトパピローマウィルス腫瘍タンパクにより分解された哺乳動物細胞タンパクの断片であり、形質転換された、あるいは核酸導入されたHPV細胞の表面でHLAと結合して存在し、CTLによる当該ペプチドHLA複合体の認識により、免疫反応の発現が生じる、HPV特異的ペプチドの使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2008−508873(P2008−508873A)
【公表日】平成20年3月27日(2008.3.27)
【国際特許分類】
【出願番号】特願2007−524391(P2007−524391)
【出願日】平成17年7月27日(2005.7.27)
【国際出願番号】PCT/GB2005/002962
【国際公開番号】WO2006/013336
【国際公開日】平成18年2月9日(2006.2.9)
【出願人】(504043462)ユニバーシティ カレッジ カーディフ コンサルタンツ リミテッド (12)
【Fターム(参考)】
【公表日】平成20年3月27日(2008.3.27)
【国際特許分類】
【出願日】平成17年7月27日(2005.7.27)
【国際出願番号】PCT/GB2005/002962
【国際公開番号】WO2006/013336
【国際公開日】平成18年2月9日(2006.2.9)
【出願人】(504043462)ユニバーシティ カレッジ カーディフ コンサルタンツ リミテッド (12)
【Fターム(参考)】
[ Back to top ]

