質量分析用イオン化標識剤およびそれを用いた質量分析法
【課題】マトリックスに依存することなく、高感度かつ高精度のレーザーイオン化質量分析を可能にする質量分析用標識剤を提供すること。
【解決手段】レーザー照射によってイオン対に開裂するイオン開裂部分および他の物質と結合を形成しうる結合基を有する化合物(好ましくは中性分子)からなる質量分析用イオン化標識剤、および該標識剤を用いる質量分析法。
【解決手段】レーザー照射によってイオン対に開裂するイオン開裂部分および他の物質と結合を形成しうる結合基を有する化合物(好ましくは中性分子)からなる質量分析用イオン化標識剤、および該標識剤を用いる質量分析法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、各種試料を高感度かつ定量的に質量分析することを可能とする新規概念に基づく質量分析用イオン化標識剤およびそれを用いた質量分析法に関する。
【背景技術】
【0002】
質量分析法は、幅広く化学、生物学などの分子を扱う科学において必須の分子測定法である。その際だった特徴は、分子量の情報に基づく優れた分子定性能である。加えて、質量分析は破壊的測定法であるものの、一般に高感度分析が可能であるため、測定試料の要求量は極めて小さく、測定機器の普及に伴い、その重要性、汎用性は益々高まって行くものと考えられる。
【0003】
質量分析法は、大きく分けて1)イオン化法と2)分子ふるい部分に分けて考えることができる。イオン化法としては,エレクトロンインパクト(EI)、ケミカルイオン化(CI)、高速原子衝突イオン化(FAB)、エレクトロスプレーイオン化(ESI)、大気圧イオン化(API)、コールドスプレーイオン化(CSI)そしてマトリックス支援レーザー脱離イオン化(MALDI)などが開発されており、分子ふるい部である2重収束型質量分析法,四重極型質量分析法(Q-MS)、飛行時間型質量分析法(TOF-MS)などと組み合わせて広く利用されている。
【0004】
既存のイオン化法は、外部からの物理的なエネルギーを標的試料に加えることによって標的分子のイオン化を促す方法であり、一般的に多くの化合物を網羅的に測定可能とするものの幾つかの解決されるべき問題点を残している。例えば、1)塩などの夾雑物の影響により目的分子イオンが観察できない場合がある(夾雑物の存在に弱い)、2)イオン化し易さが分子により大きく異なり、観察し難い分子がある、3)微妙な試料状態、分析条件変化、分子構造の違いで試料分子のレスポンスファクターが変化し易いため、定量解析が一般に難しいなどを挙げることができる。
【0005】
特定の標的分子を解析し、その質量変化を定量的に見積もるためには、安定したイオン化を可能とするイオン化標識の導入が効果的であると考えられる。この様な背景の下、イオン化を促進するための標識試薬の開発がなされており、これまでに、オリゴ糖のネガティヴモード検出を目的とした2−アミノベンズアミド(非特許文献1)、特定のマトリックスとの組み合わせによりイオン化を促進する2−ニトロベンゼンスルフェニルクロリド(特許文献1)、グアニジウム基の導入のための糖鎖標識試薬(特許文献2)などのマトリックス支援レーザー脱離イオン化飛行時間型質量分析法(MALDI−TOF−MS)におけるイオン化を促進するための各種標識試薬が報告されている。
【0006】
MALDI−TOF−MSは、従来イオン化が困難であった高分子量の生体分子を安定かつ高感度にイオン化することを可能にし、ポストゲノムにおけるプロテオーム解析の必須アイテムになっている。しかし、MALDI−TOF−MSは高濃度のマトリックスを必要とするため、1)低分子量領域でマトリックスに由来するイオンピークがバックグランドとして発生して低分子化合物の分析が困難である、2)試料の層厚を増して、試料分布の不均一とレーザー光線のエネルギー伝播の不均一をもたらし、また、3)イオン化されたマトリックスを介する複雑なメカニズムでイオン化されるので、再現性に欠けるという問題があった。また、一般的にマトリックスと試料化合物との混合結晶を予め調製し、さらにレーザー光線の照準を混合結晶に合わせるなどのテクニックを要し、自動化が困難であるため、高速液体クロマトグラフィー(HPLC)、キャピラリー電気泳動(CE)等の分離精製機器とのオンライン分析が困難であった。
【0007】
この様な背景の下、レーザーイオン化において、試料の分子構造、分析条件、夾雑物、マトリックスなどによるレスポンスファクターの影響を受けにくく、さらにマトリックスに依存することなく安定したイオン化を可能にするイオン化標識剤を開発することができれば、生命科学をはじめとする各種分野において、再現性、定量性が高い質量分析を簡便に行うことを可能にする革新的なツールになるものと期待できるが、そのような標識剤は未だ開発されていない。
【特許文献1】特開2006-10672号公報
【特許文献2】特開2005-291958号公報
【非特許文献1】Analytical Chemistry, 第77巻, 2005年, p.6954-6959
【非特許文献2】Organic Letters, 第3巻, 第2号, 2001年, p.255-257
【非特許文献3】Journal of the American Chemical Society, 第122巻, 2000年, p.2687-2697
【非特許文献4】Bioorganic & Medicinal Chemistry Letters, 第6巻, 1996年, p.979-982
【非特許文献5】The Journal of Organic Chemistry, 第62巻, 1997年, p.2370-2380
【非特許文献6】Journal of Combinatorial Chemistry, 第5巻, 2003年, p.814-820
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明の目的は、分子構造、分析条件、夾雑物、マトリックスなどによりレスポンスファクターの影響を受けにくく、レスポンスファクターが安定したレーザーイオン化を可能にする質量分析用標識剤を提供することである。
【課題を解決するための手段】
【0009】
本発明者らは、レーザー光線によるイオン開裂が可能な部位を標識化によって試料化合物に付与すれば、マトリックスに依存しない安定したイオン化を実現できるのではないかとの着想に想到した。
【0010】
光エネルギーを吸収することにより開裂してイオン化する分子は、有機合成の分野において、光による穏和な条件下における選択的脱保護が可能な保護基として数多くの化合物が報告されており(例えば、非特許文献2および3)、支持固相担体の上でペプチド等の分子を連続的に合成する固相合成におけるリンカーとしても利用されている(例えば、非特許文献4および5)。近年、光開裂性リンカーを有する固相を利用したコンビナトリアル合成において、化合物が保持された樹脂を直接レーザー脱離イオン化(LDI)に付すことにより、標的分子の切り出しと同時に、マトリックスを用いることなくカルボキシレートを検出することが可能であることが報告されている(非特許文献6参照)。これら光開裂性分子を利用する技術は、有機合成における脱保護や固相からの切り離しに関するものであり、質量分析用標識剤への利用を示唆するものではなく、光開裂性分子をイオン化促進のために質量分析用標識剤(イオン化標識剤)に利用するという概念はこれまで存在していない。
【0011】
本発明者らは、質量分析用イオン化標識剤に光開裂性分子を利用する着想のもと、レーザー照射によって効率的にイオン開裂しうる結合を標識化により試料化合物に付与したところ、開裂によりイオン化された標識化試料化合物を高感度かつ定量的に質量分析できることを見出し、本発明を完成するに至った。
すなわち、本発明は以下のとおりである。
[1]レーザー照射によってイオン対に開裂するイオン開裂部分および他の物質と結合を形成しうる結合基を有する化合物からなることを特徴とする、質量分析用イオン化標識剤。
[2]化合物が中性分子である、上記[1]記載の質量分析用イオン化標識剤。
[3]結合基がアニオンに開裂する部分構造中に存在する、上記[1]または[2]記載の質量分析用イオン化標識剤。
[4]イオン開裂部分が、カルボカチオンと(チオ)フェノール性アニオンに開裂し得る(チオ)エーテル結合を含む、上記[1]〜[3]のいずれかに記載の質量分析用イオン化標識剤。
[5]カルボカチオンが共役系スペーサーを介するかまたは介さないで電子求引性基を少なくとも1つ有する、上記[4]記載の質量分析用イオン化標識剤。
[69カルボカチオンがベンジルカチオンである、上記[4]または[5]記載の質量分析用イオン化標識剤。
[7](チオ)フェノール構造に共役する不飽和結合を有する基を有する、上記[4]〜[6]のいずれかに記載の質量分析用イオン化標識剤。
[8]質量分析用イオン化標識剤を構成する化合物が、式(I)
【0012】
【化1】

【0013】
(式中、R1、R2およびR3は独立して、水素原子または任意の置換基を示し、Xは酸素原子または硫黄原子を示し、Wは単結合またはカルボニル基を示し、Yは単結合または任意の構造を有するスペーサーを示し、Zは他の物質と結合を形成しうる結合基を示し、環Aは独立して1以上の任意の置換基を有していてもよい。)で表される(チオ)エーテル化合物である、上記[4]記載の質量分析用イオン化標識剤。
[9]R1、R2およびR3の少なくとも一つが、共役系スペーサーを介するかまたは介さない電子求引性基、または該電子求引性基を少なくとも一つ有し、さらに任意の置換基を有していてもよいフェニル基である、上記[8]記載の質量分析用イオン化標識剤。
[10]電子求引性基が、ニトロ基、シアノ基、ハロゲン原子、カルボニル基、ホスホリル基、スルホニル基および電子欠乏型複素環基から選ばれる、上記[9]記載の質量分析用イオン化標識剤。
[11]Xが酸素原子である、上記[8]〜[10]のいずれかに記載の質量分析用イオン化標識剤。
[12]Zが、カルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基である、上記[8]〜[11]のいずれか一項に記載の質量分析用イオン化標識剤。
[13]環Aが環Aに共役する不飽和結合を有する基を有する、上記[8]〜[12]のいずれか一項に記載の質量分析用イオン化標識剤。
【0014】
[14]試料化合物に上記[1]〜[13]のいずれかに記載の質量分析用イオン化標識剤を作用させて標識する工程、得られた標識化試料化合物にレーザーを照射してイオン化する工程、およびイオン化された標識化試料化合物を質量分離部にて分離する工程を含むことを特徴とする質量分析法。
[15]飛行時間型質量分析法によってイオンを分離する、上記[14]記載の質量分析法。
[16]試料化合物の定量分析を行う、上記[14]または[15]記載の質量分析法。
[17]試料化合物の反応をモニターする、上記[14]または[15]記載の質量分析法。
[18]式(I’)
【0015】
【化2】

【0016】
(式中、R1’、R2’およびR3’は独立して、水素原子;アルキル基;アルコキシ基;ハロゲン原子、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基およびパーフルオロアルキル基から選ばれる電子求引性基;または該電子求引性基を少なくとも一つ有し、さらにアルキル基およびアルコキシ基から選ばれる1以上の置換基を有していてもよいフェニル基を示し、Xは酸素原子または硫黄原子を示し、Y’は単結合、フェニレン基または炭素数1〜17の飽和または不飽和の炭化水素鎖(該炭化水素鎖は、オキソ、アルキル基、アルケニル基、アルキニル基およびアリール基から選ばれる1以上の置換基を有していてもよく、構成炭素原子の1以上が、酸素原子、窒素原子および硫黄原子から選ばれるヘテロ原子またはフェニレン基で置き換わってもよい。)からなるスペーサーを示し、Z’はカルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基を示し、環A’は独立して、アルキル基、アルコキシ基、チオアルコキシ基、アルケニル基、アルキニル基、アリール基、ヘテロアリール基、カルボニル基、シアノ基、ハロゲン原子、ニトロ基、ホスホリル基およびスルホニル基から選ばれる1以上の置換基を有していてもよい。)で表される(チオ)エーテル化合物。
[19]Xが酸素原子である、上記[18]記載の化合物。
[20]上記[18]または[19]記載の化合物の、質量分析用イオン化標識剤としての使用。
【発明の効果】
【0017】
レーザー光によるイオン開裂を利用するという新規概念に基づく質量分析用のイオン化標識剤の開発に初めて成功した。本発明の質量分析用イオン化標識剤は以下に示す様々な利点を有し、質量分析の適用範囲を各段に広げる革命的なツールである。
(1)本発明の標識剤で標識された試料は、一定条件下で確実にイオン化することができるので、定量性の高いデータが得られる。
(2)本発明の標識剤で標識された試料はレーザーにより直接イオン化され、そのイオン化メカニズムがMALDI−MSに比べシンプルであるので、イオン化のレスポンスファクターが構造の多様性、塩などの夾雑物の存在、分析条件などに影響されにくく、分子量のみに依存する傾向がある。したがって、予めシグナル強度と分子量との相関の経験式を得ておけば、内部標準法などを併用することにより試料濃度を定量的に分析することが可能である。
(3)低濃度のサンプルで短時間の測定が可能であり、定量分析も可能であり、さらに夾雑物の影響も受けにくいので、試料化合物の反応の進行をモニターするのにも適している。さらに、複数の生成物が得られる反応や中間体を経由して段階的に進行する反応においても、それぞれの生成物などのシグナル強度を経験式から補正可能であるので、応用範囲が広い。
(4)MALDIと同程度の試料濃度(数pM)で測定可能であり、しかも、MALDIに比べ格段に安定したスペクトル再現性が得られる。
(5)比較的低分子量の化合物では、マトリックスの支援を要することなく質量分析することが可能になる。したがって、MALDIでは困難であった低分子量化合物の分析も可能となり、また、マトリックスとの混合結晶を調製する必要がないので、HPLC等とのハイフネーションが容易となる。さらに、レーザー照射により直接イオンが発生するためイオン化メカニズムがシンプルであり、全てのイオンは同じタイミングでドリフト空間に導入される。したがって、マトリックスとサンプルの混合結晶における不均一やレーザーエネルギー伝播の不均一などの問題はなく、再現性の良いスペクトルが得られる。
(6)本発明の標識剤で標識された試料化合物をマトリックスの支援下で質量分析する場合においても、既存のMALDI−MS法に対して、標的分子のイオン化しやすさを考慮したマトリックスの選択を行なう必要がないことから、例えば、結晶性、分散性などの観点から、従来よりも格段に幅広い範囲の化合物をマトリックスとして利用可能であるという利点がある。
(7)結合基を適宜選択することにより、特定の官能基を標的とした質量分析が可能となる。
(8)特別なテクニックを要することなく、通常の手法により簡便に分析できる。
(9)通常の有機合成手法により安価に調製することができる。
また、試料化合物分子の複数箇所を標識することにより多価イオンに誘導し、より高分子量の測定も可能になると考えられる。
【発明を実施するための最良の形態】
【0018】
以下、本発明について詳細に説明する。
1.置換基の説明
以下に、本発明で使用される置換基を詳述する。
本発明において「アルキル基」としては、炭素数1〜30の直鎖または分枝のアルキル基、例えばメチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec−ブチル、tert−ブチル、ペンチル、イソペンチル、ネオペンチル、ヘキシル、2−エチルブチル、ヘプチル、オクチル、ノニル、デシル、ウンデシル、ドデシル、トリデシル、ヘキサデシル、ペンタデシル、ヘキサデシル、ヘプタデシル、オクタデシル等が挙げられる。
【0019】
本発明において「パーフルオロアルキル基」としては、水素原子のすべてがフッ素原子で置換された炭素数1〜30の直鎖または分枝のアルキル基、例えばトリフルオロメチル、ペンタフルオロエチル、ヘプタフルオロプロピル、ヘプタフルオロイソプロピル、ノナフルオロブチル、ノナフルオロイソブチル、ノナフルオロ−sec−ブチル、ノナフルオロ−tert−ブチル、ウンデカフルオロペンチル、ウンデカフルオロイソペンチル、ウンデカフルオロネオペンチル、トリデカフルオロヘキシル、2−(ペンタフルオロエチル)オクタフルオロブチル、ペンタデカフルオロヘプチル、ヘプタデカフルオロオクチル、ノナデカフルオロノニル、ヘンイコサフルオロデシル、トリコサフルオロウンデシル、ペンタコサフルオロドデシル等が挙げられる。
【0020】
本発明において「アルコキシ基」としては、炭素数1〜30の直鎖または分枝のアルコキシ基、例えばメトキシ、エトキシ、プロポキシ、イソプロポキシ、ブトキシ、イソブトキシ、sec−ブトキシ、tert−ブトキシ、ペントキシ、イソペントキシ、ネオペントキシ、ヘキシルオキシ、ヘプチルオキシ、オクチルオキシ、ノニルオキシ、デシルオキシ、ウンデシルオキシ、ドデシルオキシ、トリデシルオキシ、ヘキサデシルオキシ、ペンタデシルオキシ、ヘキサデシルオキシ、ヘプタデシルオキシ、オクタデシルオキシ等が挙げられる。
【0021】
本発明において「チオアルコキシ基」としては、炭素数1〜30の直鎖または分枝のチオアルコキシ基、例えばチオメトキシ、チオエトキシ、チオプロポキシ、チオイソプロポキシ、チオブトキシ、チオイソブトキシ、sec−チオブトキシ、tert−チオブトキシ、チオペントキシ、チオイソペントキシ、チオネオペントキシ、チオヘキシルオキシ、チオヘプチルオキシ、チオオクチルオキシ、チオノニルオキシ、チオデシルオキシ、チオウンデシルオキシ、チオドデシルオキシ、チオトリデシルオキシ、チオヘキサデシルオキシ、チオペンタデシルオキシ、チオヘキサデシルオキシ、チオヘプタデシルオキシ、チオオクタデシルオキシ等が挙げられる。
【0022】
本発明において「ハロゲン原子」とは、フッ素原子、塩素原子、臭素原子またはヨウ素原子である。
【0023】
本発明において「アルケニル基」としては、炭素数2〜30の直鎖または分枝のアルケニル基、例えばビニル、1−プロペニル、2−プロペニル、イソプロペニル、1−ブテニル、2−ブテニル、3−ブテニル、1−イソブテニル、2−イソブテニル、1−sec−ブテニル、2−sec−ブテニル、1−ペンテニル、1−イソペンテニル、1−ヘキセニル、1−ヘプテニル、1−オクテニル、1−ノネニル、1−デセニル、1−ウンデセニル、1−ドデセニル、1−トリデセニル、1−ヘキサデセニル、1−ペンタデセニル、1−ヘキサデセニル、1−ヘプタデセニル、1−オクタデセニル等が挙げられる。
【0024】
本発明において「アルキニル基」としては、炭素数2〜30の直鎖または分枝のアルキニル基、例えばエチニル、1−プロピニル、2−プロピニル、1−ブチニル、2−ブチニル、3−ブチニル、2−sec−ブチニル、1−ペンチニル、1−イソペンチニル、1−ヘキシニル、1−ヘプチニル、1−オクチニル、1−ノニニル、1−デシニル、1−ウンデシニル、1−ドデシニル、1−トリデシニル、1−ヘキサデシニル、1−ペンタデシニル、1−ヘキサデシニル、1−ヘプタデシニル、1−オクタデシニル等が挙げられる。
【0025】
本発明において「モノアルキルアミノ基」とは、炭素数1〜30の直鎖または分枝のアルキル基を1つ有するアミノ基、例えばメチルアミノ、エチルアミノ、プロピルアミノ、イソプロピルアミノ、ブチルアミノ、イソブチルアミノ、sec−ブチルアミノ、tert−ブチルアミノ、ペンチルアミノ、イソペンチルアミノ、ネオペンチルアミノ、ヘキシルアミノ、2−エチルブチルアミノ、ヘプチルアミノ、オクチルアミノ、ノニルアミノ、デシルアミノ、ウンデシルアミノ、ドデシルアミノ、トリデシルアミノ、ヘキサデシルアミノ、ペンタデシルアミノ、ヘキサデシルアミノ、ヘプタデシルアミノ、オクタデシルアミノ等が挙げられる。
【0026】
本発明において「ジアルキルアミノ基」とは、炭素数1〜30の直鎖または分枝の同一または異なる2個のアルキル基を有するアミノ基、例えばジメチルアミノ、ジエチルアミノ、ジプロピルアミノ、ジイソプロピルアミノ、ジブチルアミノ、ジイソブチルアミノ、ジ−sec−ブチルアミノ、ジ−tert−ブチルアミノ、ジペンチルアミノ、ジイソペンチルアミノ、ジネオペンチルアミノ、ジヘキシルアミノ、ジ2−エチルブチルアミノ、ジヘプチルアミノ、ジオクチルアミノ、ジノニルアミノ、ジデシルアミノ、ジウンデシルアミノ、ジドデシルアミノ、ジトリデシルアミノ、ジヘキサデシルアミノ、ジペンタデシルアミノ、ジヘキサデシルアミノ、ジヘプタデシルアミノ、ジオクタデシルアミノ、N−メチル−N−エチルアミノ、N−メチル−N−プロピルアミノ、N−メチル−N−イソプロピルアミノ、N−メチル−N−ブチルアミノ、N−メチル−N−イソブチルアミノ、N−メチル−N−sec−ブチルアミノ、N−メチル−N−tert−ブチルアミノ、N−メチル−N−ペンチルアミノ、N−メチル−N−イソペンチルアミノ、N−メチル−N−ネオペンチルアミノ、N−メチル−N−ヘキシルアミノ、N−メチル−N−2−エチルブチルアミノ、N−メチル−N−ヘプチルアミノ、N−メチル−N−オクチルアミノ、N−メチル−N−ノニルアミノ、N−メチル−N−デシルアミノ、N−メチル−N−ウンデシルアミノ、N−メチル−N−ドデシルアミノ、N−メチル−N−トリデシルアミノ、N−メチル−N−ヘキサデシルアミノ、N−メチル−N−ペンタデシルアミノ、N−メチル−N−ヘキサデシルアミノ、N−メチル−N−ヘプタデシルアミノ、N−メチル−N−オクタデシルアミノ等が挙げられる。
【0027】
本発明において「アリール基」とは、炭素数6〜22個の芳香族炭化水素環から誘導される1価の基であり、例えば、フェニル基、ナフチル基、アントリル基、フェナントリル基などが挙げられる。
【0028】
本発明において「ヘテロアリール基」とは、炭素原子以外に酸素原子、硫黄原子及び窒素原子から選ばれるヘテロ原子を1〜7個含む5〜6員の芳香性を有する単環性複素環または縮合複素環から誘導される1価の基であり、例えば、チエニル基、フリル基、ピロリル基、イニダゾリル基、オキサゾリル基、チアゾリル基、ピラゾリル基、イソキサゾリル基、イソチアゾリル基、トリアゾリル基、テトラゾリル基、フラザニル基、ピリジル基、ピリミジニル基、ピリダジニル基、ピラジニル基、トリアジニル基、テトラジニル基、インドリル基、イソインドリル基、インドリジニル基、インダゾリル基、ベンゾフリル基、イソベンゾフリル基、ベンゾチエニル基、イソベンゾチエニル基、ベンズイミダゾリル基、キノリル基、イソキノリル基、1,8−ナフチリジニル基、キノキサリニル基、キナゾリニル基、シンノリニル基、フタラジニル基、フェナントリジニル基、アクリジニル基、ペリミジニル基、フェナントロリニル基、フェナジニル基などが挙げられる。
【0029】
本発明において「カルボニル基」とは、カルボニル基を含む基を意味し、例えば、アルキル−カルボニル基、アルコキシ−カルボニル基(アルコキシカルボニル基)、チオアルコキシ−カルボニル基、アリール−カルボニル基、アリール−オキシ−カルボニル基、ヘテロアリール−カルボニル基、ヘテロアリール−オキシ−カルボニル基、アルケニル−カルボニル基、アルキニル−カルボニル基、アミノ−カルボニル基(カルバモイル基)、モノアルキルアミノ−カルボニル基(モノアルキルカルバモイル基)、ジアルキルアミノ−カルボニル基(ジアルキルカルバモイル基)などが挙げられる。ここで、部分構造として用いられる「アルキル」、「アルコキシ」、「チオアルコキシ」、「アリール」、「ヘテロアリール」、「アルケニル」、「アルキニル」、「モノアルキルアミノ」および「ジアルキルアミノ」は、それぞれ上記で定義したものと同義である。
【0030】
本発明において「スルホニル基」とは、スルホニル基を含む基を意味し、例えば、アルキル−スルホニル基、アルコキシ−スルホニル基、アリール−スルホニル基、アリール−オキシ−スルホニル基、ヘテロアリール−スルホニル基、ヘテロアリール−オキシ−スルホニル基、アルケニル−スルホニル基、アルキニル−スルホニル基、アミノ−スルホニル基(スルファモイル基)、モノアルキルアミノ−スルホニル基(モノアルキルスルファモイル基)、ジアルキルアミノ−スルホニル基(ジアルキルスルファモイル基)などが挙げられる。ここで、部分構造として用いられる「アルキル」、「アルコキシ」、「アリール」、「ヘテロアリール」、「アルケニル」、「アルキニル」、「モノアルキルアミノ」および「ジアルキルアミノ」は、それぞれ上記で定義したものと同義である。
【0031】
本発明において「ホスホリル基」とは、ホスホリル基を含む基を意味し、例えば、ジアルキル−ホスホリル基、ジアリール−ホスホリル基、ジヘテロアリール−ホスホリル基、ジアルケニル−ホスホリル基、ジアルキニル−ホスホリル基などが挙げられる。ここで、部分構造として用いられる「アルキル」、「アリール」、「ヘテロアリール」、「アルケニル」および「アルキニル」は、それぞれ上記で定義したものと同義である。
【0032】
本発明において「ハロゲノスルホニル基」としては、クロロスルホニル基、ブロモスルホニル基などが挙げられる。
【0033】
本発明において「フェニレン基」としては、o−フェニレン基、m−フェニレン基およびp−フェニレン基が挙げられる。
【0034】
本発明において「電子欠乏型複素環基」とは、少なくとも1つの電気陰性な窒素原子を含む、(4n+2)個(nは自然数)の原子から構成される芳香族化合物で構成される基であり、例えば、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル、キナゾリニル、キノキサリニル、アクリジニルなどが挙げられる。
【0035】
2.質量分析用イオン化標識剤
「質量分析用イオン化標識剤」とは、質量分析の対象となる試料化合物と結合を形成して標識し、標識化された試料化合物の分子量を計測するためのイオン化、具体的にはレーザー光照射によるイオン化を促進するための化合物を意味する。
【0036】
本発明の質量分析用イオン化標識剤は、レーザー照射によりイオン対(カチオンとアニオン)に開裂し得る部分(イオン開裂部分)、さらに構造中に他の物質と結合を形成しうる結合基(以下、単に「結合基」と省略することがある。)を有する化合物(以下、「レーザー開裂性化合物」と呼ぶことがある。)から構成されることを特徴とする。
【0037】
【化3】

【0038】
本明細書中、レーザー開裂性化合物において、カチオンに開裂する部分を「カチオンパート」、アニオンに開裂する部分構造を「アニオンパート」と呼ぶものとする。
【0039】
本発明のレーザー開裂性化合物において、「レーザー照射によってイオン対に開裂するイオン開裂部分」としては、かかる作用を有する結合を含む部分構造を意味する。
レーザー照射によってイオン対に開裂する結合としては、カルボカチオンとカルボキシレートに開裂しうるエステル結合、カルボカチオンとオキサイドに開裂しうるエーテル結合、カルボカチオンとチオオキサイドに開裂しうるチオエーテル結合などが挙げられる。なかでも、質量分析において高い感度が得られることから、エステル結合、エーテル結合、チオエーテル結合が好ましく、カルボカチオンと(チオ)フェノール性アニオンに開裂し得る(チオ)エーテル結合がさらに好ましい。
【0040】
本発明のレーザー開裂性化合物は、好ましくは中性分子である。本発明において、「中性分子」とは、それ自身で構造中にイオン性の電荷を有さない分子、あるいは溶液中に溶解したときにイオンに解離しない分子を意味する。
本発明のレーザー開裂性化合物は中性分子でない場合においても使用可能であるが、分子中にイオン性の部分構造などが存在すると、レーザーイオン脱離過程に緩衝作用を及ぼし、シグナルの減弱または消失、あるいは開裂したシグナルと開裂していないシグナルなどの複数のシグナルを与え、効率的な質量分析や定量的な測定が困難になる場合がある。
【0041】
以下に、レーザー開裂性化合物を構成するアニオンパート、カチオンパートおよび結合基について詳述する。
2−1.アニオンパート
アニオンパートは、レーザー開裂性化合物が開裂してアニオンになる部分構造である。
【0042】
アニオンパートとしては、レーザー照射によってイオン対に開裂する結合がエステル結合の場合はカルボキシレートを含む構造、エーテル結合の場合はオキサイドを含む構造、チオエーテル結合の場合はチオオキサイドを含む構造、フェノール性(チオ)エーテル結合の場合は(チオ)フェノキサイドを含む構造などが挙げられ、(チオ)フェノキサイドを含む構造が好ましい。
【0043】
以下に、アニオンパートの好ましい態様である(チオ)フェノキサイドを含む部分構造(以下、「(チオ)フェノール性アニオンパート」と呼ぶことがある。)について詳述するが、アニオンパートがこれに限定されないことは言うまでもない。
【0044】
(チオ)フェノール性アニオンパートとは、芳香族炭化水素環または芳香族複素環の任意の位置に酸素原子または硫黄原子が直接結合した構造を意味する。すなわち、(チオ)フェノール性アニオンパートは、−X−(芳香族炭化水素環)または−X−(芳香族複素環)で表される構造を有する(Xは酸素原子または硫黄原子を示す)。
【0045】
芳香族炭化水素環の炭素数は、6〜22個が好ましい。具体例としては、ベンゼン、ナフタレン、アントラセン、フェナントレン、ピレン、ベンゾフェナントレン、クリセン、ペンタセン、ピセンなどが挙げられる。
【0046】
芳香族複素環は、炭素原子以外に酸素原子、硫黄原子及び窒素原子から選ばれるヘテロ原子を1〜7個含む5〜6員の芳香性を有する単環性複素環または縮合複素環が挙げられる。具体例としては、チオフェン、フラン、ピロール、イミダゾール、オキサゾール、チアゾール、ピラゾール、イソキサゾール、イソチアゾール、トリアゾール、テトラゾール、フラザン、ピリジン、ピリミジン、ピリダジン、ピラジン、トリアジン、テトラジン、インドール、イソインドール、インドリジン、インダゾール、ベンゾフラン、イソベンゾフラン、ベンゾチオフェン、イソベンゾチオフェン、ベンズイミダゾール、キノリン、イソキノリン、1,8−ナフチリジン、キノキサリン、キナゾリン、シンノリン、フタラジン、フェナントリジン、アクリジン、ペリミジン、フェナントロリン、フェナジン等が挙げられる。
【0047】
芳香族炭化水素環および芳香族複素環は、本発明が奏する効果を損なわない限度において、独立して1以上の任意の置換基を有していてもよい。係る置換基としては、例えばアルキル基、アルコキシ基、チオアルコキシ基、アルケニル基、アルキニル基、アリール基、ヘテロアリール基、カルボニル基、シアノ基、ハロゲン原子、ニトロ基、ホスホリル基、スルホニル基等が挙げられるが、特に(チオ)フェノール構造に共役する不飽和結合を有する基がレーザー照射によるイオン開裂を促進するため好ましい。
【0048】
「(チオ)フェノール構造に共役する不飽和結合を有する基」としては、アリール基、ヘテロアリール基、シアノ基、ニトロ基、ホスホリル基の他、下記式で表される置換基が挙げられる。
【0049】
【化4】

【0050】
(式中、R4、R5、R6およびR7は独立して、水素原子、アルキル基、アリール基、アルケニル基またはアルキニル基を示す。)
また、下記式で表されるような2価の基が(チオ)フェノール構造と縮合環を形成する態様であってもよい。
【0051】
【化5】

【0052】
(式中、Y1は−CH−、−NH−、酸素原子または硫黄原子を示し、n1は1〜3の整数を示す。)
また、「(チオ)フェノール構造に共役する不飽和結合を有する基」は、可能である限り、アルキル基、アルコキシ基、ハロゲン原子、アルコキシカルボニル基、ニトロ基、シアノ基、ハロゲン原子、カルボニル基、ホスホリル基、スルホニル基等の置換基をさらに有していてもよい。
【0053】
以下に、(チオ)フェノール性アニオンパートの具体例を示す。
【0054】
【化6】

【0055】
(式中の各記号は前記と同義である。)
2−2.カチオンパート
カチオンパートは、レーザー開裂性化合物が開裂してカチオンになる部分構造である。
【0056】
カチオンパートとしては、レーザー照射によってイオン対に開裂する結合がエステル結合、エーテル結合またはチオエーテル結合、あるいは(チオ)フェノール性エーテル結合の場合はカルボカチオンを含む構造などが挙げられる。
【0057】
以下に、カチオンパートの好ましい態様であるカルボカチオンを含む部分構造(以下、「カルボカチオンパート」と呼ぶことがある。)について詳述するが、カチオンパートがこれに限定されないことは言うまでもない。
カルボカチオンパートは、任意の置換基を1つ以上有していてもよいメチル基で表される。
【0058】
カルボカチオンパートが有していてもよい任意の置換基としては、アルキル基、アルコキシ基、ハロゲン原子、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基、パーフルオロアルキル基などから自由に選択することができるが、電子求引性基を少なくとも1つ有する態様がレーザー光によるイオン開裂を起こし易くするため好ましい。
当該電子求引性基はカルボカチオンパートに直接結合してもよいが、開裂後のカチオンパートを安定化することにより効率的な開裂を促進するという理由から、共役系スペーサーをカルボカチオンパートとの間に介する態様が好ましい。
【0059】
電子求引性基としては、ハロゲン原子、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基、パーフルオロアルキル基などが挙げられる。
電子求引性基の具体例を下記式に列挙する。
【0060】
【化7】

【0061】
(式中、R8、R9およびR10は独立して、水素原子、アルキル基、アリール基、アルケニル基またはアルキニル基を示し、Rfはパーフルオロアルキル基を示す。)
【0062】
共役系スペーサーとは、パイ電子を介して電子求引性をイオン開裂する結合に伝達し得る2価の基であり、例えば、
【0063】
【化8】

【0064】
など、またはこれらを2個以上組み合わせたものが挙げられる。これら共役系スペーサーは、置換可能な位置に、アルキル基、アルコキシ基、アリール基、ハロゲン原子、アルケニル基、アルキニル基、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基などの置換基をさらに有していてもよい。
【0065】
カルボカチオンパートはベンジル基が好ましく、該ベンジル基のベンゼン環状の任意の位置に少なくとも1つの電子求引性基を有する態様がさらに好ましい。
ベンジル基のベンゼン環が有する電子求引性基は、上記と同様のものが挙げられ、さらに、置換可能な位置に、アルキル基、アルコキシ基、アリール基、ハロゲン原子などの置換基を有していてもよい。
カルボカチオンパートの具体例を以下に列挙する。
【0066】
【化9】

【0067】
【化10】

【0068】
(式中、R11およびR12は独立して、アルキル基、アリール基、ハロゲン原子、アルケニル基、アルキニル基または上記で定義された電子求引性基を示し、R13はアルキル基、アリール基、アルケニル基、アルキニル基を示し、他の記号は前記と同義である。)
2−3.結合基
本発明のレーザー開裂性化合物には、他の物質と結合を形成するための結合基が存在することが必要である。
「他の物質」とは、結合基と結合を形成しうる官能基または構造を有する試料化合物を意味する。
結合基によって形成される結合とは共有結合に限定されず、水素結合、配位結合、キレート結合なども包含されるが、試料化合物の特定の官能基との反応により形成される共有結合が好ましい。
かかる結合基はレーザー開裂性化合物のいかなる部位に存在しても標識剤としての機能を損なうものではないが、定量的取扱を行うために、フラグメンテーションを生じにくい負イオンモードによりマススペクトルを得ることが好ましいという理由から、結合基がアニオンパートに存在する態様が好ましい。
【0069】
結合基は可能である限り、レーザー開裂性化合物のいかなる部位に存在してもよく、レーザー開裂性化合物に置換基が存在する場合には、該置換基上に存在していてもよい。
さらには、結合基がレーザー開裂性化合物に2以上存在する態様も許容される。
【0070】
結合基としては、カルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基、ジスルフィド基などが挙げられる。
【0071】
結合基の例示と、各々の結合基と結合する官能基または構造、および形成される結合を表1−1〜3に示す。
【0072】
【表1−1】

【0073】
【表1−2】

【0074】
【表1−3】

【0075】
結合基はレーザー開裂性化合物に直接結合していてもよいし、任意の構造を有するスペーサーを介して結合してもよい。スペーサーとしては、炭素原子、酸素原子、窒素原子、硫黄原子から選ばれる1〜100個の構成原子からなる直鎖または分岐鎖、2価の芳香族炭化水素環(フェニレン基、ナフチレン基など)、2価の芳香族複素環などが挙げられ、あるいはこれらを2個以上組み合わせた態様であってもよい。
また、該スペーサーは、アルキル基、アルコキシ基、ハロゲン原子、オキソ、チオキソ、アリール基、ヘテロアリール基、アルケニル基、アルキニル基などから選ばれる1以上の置換基を有していてもよい。
以下に、スペーサーの具体例を示す。
【0076】
【化11】

【0077】
(式中、n2、n3およびn4は独立して、1〜100の整数を示し、Raは水素原子またはアルキル基を示す。)
【0078】
2−4.レーザー開裂性化合物
本発明の質量分析用イオン化標識剤は、上記で定義された条件を満たすレーザー開裂性化合物であるかぎり如何なるものであってもよいが、好適には下記式(I)で表される(チオ)エーテル化合物である。
【0079】
【化12】

【0080】
(式中、R1、R2およびR3は独立して、水素原子または任意の置換基を示し、Xは酸素原子または硫黄原子を示し、Wは単結合またはカルボニル基を示し、Yは単結合または任意の構造を有するスペーサーを示し、Zは他の物質と結合を形成しうる結合基を示し、環Aは独立して1以上の任意の置換基を有していてもよい。)
【0081】
式(I)で表される(チオ)エーテル化合物において、R1、R2およびR3の少なくとも一つが、共役系スペーサーを介するかまたは介さない電子求引性基、または該電子求引性基を少なくとも一つに有し、さらに任意の置換基を有していてもよいフェニル基である態様が好ましい。
該電子求引性基としては、ニトロ基、シアノ基、ハロゲン原子、カルボニル基、ホスホリル基、スルホニル基または電子欠乏型複素環基が好ましい。
【0082】
Xとしては、酸素原子が好ましい。
Zとしては、カルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基が好ましい。
【0083】
Wとしては、カルボニル基が好ましい。
Wが単結合である場合は、環Aには、環Aに共役する不飽和結合を有する基が存在する態様が好ましい。「環Aに共役する不飽和結合を有する基」としては、上記で定義および例示された「(チオ)フェノール構造に共役する不飽和結合を有する基」と同様のものが挙げられる。
【0084】
なお、式(I)で表される(チオ)フェノール化合物のうち、下記式(I’)で表される化合物は新規化合物である。
【0085】
【化13】

【0086】
(式中、R1’、R2’およびR3’は独立して、水素原子;アルキル基;アルコキシ基;ハロゲン原子、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基およびパーフルオロアルキル基から選ばれる電子求引性基;または該電子求引性基を少なくとも一つ有し、さらにアルキル基およびアルコキシ基から選ばれる1以上の置換基を有していてもよいフェニル基を示し、Xは酸素原子または硫黄原子を示し、Y’は単結合、フェニレン基または炭素数1〜17の飽和または不飽和の炭化水素鎖(該炭化水素鎖は、オキソ、アルキル基、アルケニル基、アルキニル基およびアリール基から選ばれる1以上の置換基を有していてもよく、構成炭素原子の1以上が、酸素原子、窒素原子および硫黄原子から選ばれるヘテロ原子またはフェニレン基で置き換わってもよい。)からなるスペーサーを示し、Z’はカルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基を示し、環A’は独立して、アルキル基、アルコキシ基、チオアルコキシ基、アルケニル基、アルキニル基、アリール基、ヘテロアリール基、カルボニル基、シアノ基、ハロゲン原子、ニトロ基、ホスホリル基およびスルホニル基から選ばれる1以上の置換基を有していてもよい。)
【0087】
2−5.製法
本発明のレーザー開裂性化合物は、エステル結合、エーテル結合、チオエーテル結合などのレーザー照射によってイオン対に開裂する結合を含む化合物を製造するための自体公知の有機合成技術を用いて、容易に製造することができる。
(チオ)エーテル結合を有する式(I)で表される化合物を例にとって、以下に説明する。
【0088】
【化14】

【0089】
(式中、Lはハロゲン原子、メタンスルホニルオキシ基、p−トルエンスルホニルオキシ基などの脱離基を示し、Z1はZに変換可能な基を示す。他の記号は前記と同義である。)
Z1の「Zに変換可能な基」としては、自体公知の手法により1工程または複数工程を経てZに変換しうるものであればよく、例えば、Zがスクシンイミドオキシカルボニル基、アルコキシカルボニル基である場合はカルボキシル基、Zがマレイミジル基、イソ(チオ)シアネート基、クロロカルボニルアミノ基、アルコキシカルボニルアミノ基などの場合はアミノ基などが挙げられる。
【0090】
(チオ)フェノール(II)と化合物(III)とを塩基の存在下反応させることにより(チオ)エーテル化合物(I)を製造することができる(工程1)。
結合基Zは(チオ)エーテル結合形成の後に導入してもよい。その場合は、(チオ)フェノール(II’)と化合物(III)とを塩基の存在下反応させて(チオ)エーテル化合物(IV)をまず合成し(工程1’)、その後Z1をZに変換すればよい(工程2)。
なお、上記工程以外に、自体公知の手法を用いて、保護、脱保護、置換基変換、置換基導入、還元、酸化、エステル化、加水分解などの反応を必要に応じて追加して適宜行なっても良い。
【0091】
原料の(チオ)フェノール(II)、(チオ)フェノール(II’)および化合物(III)は、公知の方法によって合成することができ、また市販品を使用してもよい。(チオ)フェノール(II)は、(チオ)フェノール(II’)から工程2と同様な手法により合成してもよい。
【0092】
工程1および工程1’は、通常の(チオ)エーテル結合を合成する方法により行なうことができる。
化合物(III)は、(チオ)フェノール類に対して、1〜3当量程度用いられる。
【0093】
塩基としては、無機塩基(例えば、炭酸カリウム、炭酸ナトリウム、水酸化カリウム、水酸化ナトリウム、水素化ナトリウム等)または有機塩基(例えば、トリエチルアミン、ジイソプロピルエチルアミン、ピリジン、N−メチルモルホリン等)が挙げられる。
塩基の使用量は、(チオ)フェノール類に対して、1〜5当量程度である。
【0094】
反応は好ましくは溶媒中で行なわれる。溶媒としては反応を阻害しないかぎり制限されず、例えば、酢酸エステル類(例えば、酢酸エチル、酢酸イソプロピル、酢酸イソブチル、酢酸n−ブチルなど)、炭化水素類(例えば、ヘキサン、ヘプタン、トルエン、ベンゼン、キシレンなど)、ニトリル類(例えば、アセトニトリル、プロピオニトリルなど)、エーテル類(例えば、ジエチルエーテル、THF、ジオキサンなど)、アルコール類(例えば、エタノール、イソプロピルアルコール、n−ブタノールなど)、非プロトン性極性溶媒(N,N−ジメチルホルムアミド、ジメチルスルホキシドなど)などが挙げられ、これらは2種以上を併用してもよい。
【0095】
反応温度は、0℃〜80℃程度で行なわれ、通常1〜15時間程度で終了する。
【0096】
工程2は、Zに応じて、自体公知の手法で行えばよい。例えば、
(1)Zがスクシンイミドオキシカルボニル基である場合はZ1がカルボキシル基である(チオ)エーテル化合物(IV)とN−ヒドロキシスクシンイミドをジシクロヘキシルカルボジイミド(DCC)、N−(3−ジメチルアミノプロピル)−N’−エチルカルボジイミド(EDC)などの縮合剤を用いて縮合させる;
(2)Zがマレイミジル基である場合はZ1がアミノ基である(チオ)エーテル化合物(IV)と無水マレイン酸を反応させる;
(3)Zがイソシアネート基である場合はZ1がアミノ基である(チオ)エーテル化合物(IV)とトリホスゲンを反応させる;などにより行なうことができる。
【0097】
各工程で得られた粗製の生成物は、常法(再結晶、クロマトグラフィー等)により精製することができる。
【0098】
3.質量分析法
本発明の質量分析法は、試料化合物を本発明の質量分析用イオン化標識剤に作用させて標識する工程、得られた標識化試料化合物にレーザーを照射してイオン化する工程、およびイオン化された標識化試料化合物を質量分離部にて分離する工程を含むことを特徴とする。
【0099】
試料化合物は質量分析用イオン化標識剤と結合する官能基または構造を有するものであれば特に限定されず、医薬、農薬などの各種薬品;医薬品添加物、食品添加物、化粧料添加物などの各種添加物;合成物;天然物などの比較的分子量が低い化合物;および各種樹脂;タンパク質、核酸、糖類、糖タンパク、糖脂質鎖等の生体分子などの高分子が挙げられる。また、試料化合物は精製物でもよいし、混合物であってもよい。
【0100】
分析の前に、試料化合物に質量分析用イオン化標識剤を作用させて試料化合物の標識化を行なう。試料化合物に存在する官能基または構造に応じて、結合を形成しうる結合基を有する標識剤を適宜選択する。
試料化合物中に存在する官能基または構造が不明の場合には、結合基の異なる標識剤を数種類用いて予備試験を行うこともできる。
試料化合物が混合物である場合は、特定の官能基または構造を有するものを選択的に分析することもできる。
【0101】
試料化合物の標識化は、標識剤の結合基に適した慣用技術を用いて行なうことができる。
例えば、適当な溶媒中で試料化合物と質量分析用イオン化標識剤とを混合、攪拌する方法などが挙げられる。この際、塩基、酸、触媒などを適宜添加してもよい。
【0102】
得られる粗製の標識化試料化合物は、精製せずに質量分析に付することができ、あるいは必要に応じて、自体公知の分離精製手段、例えば、薄層クロマトグラフィー(TLC)、キャピラリーガスクロマトグラフィー(CGC)、高速液体クロマトグラフィー(HPLC)、キャピラリー電気泳動(CE)などにより精製した後、質量分析に付してもよい。また、これら分析機器と質量分析機を自体公知のハイフネーテッド技術を利用して接続することもできる。
【0103】
また、より簡便な方法として、試料化合物と質量分析用イオン化標識剤を質量分析機の試料導入部(プレート、プローブなど)に同時または順次導入して試料導入部で反応させ、次いで質量分析に付することもできる。
【0104】
標識化された試料化合物をイオン化する方法としては、レーザー光照射によるものであれば特に限定されず、レーザー脱離イオン化法(LDI)、マトリックス支援レーザー脱離イオン化法(MALDI)などが挙げられる。
レーザー源としては、窒素レーザー(337nm)、YAGレーザー(第3調波:355nm、第4調波:266nm)、炭酸ガスレーザー(2.94μm)などが挙げられ、標識剤のレーザー照射によってイオン対に開裂する結合を効率的に開裂しうるものを適宜選択すればよい。
【0105】
LDIは、試料分子がレーザー光を直接吸収してイオン化する方法である。
MALDIは、試料とマトリックスの混合結晶を調製し、それにレーザー光を照射する事でイオン化を行う方法である。MALDIでは、マトリックス分子がレーザー光を共鳴吸収してイオン化すると同時に急速加熱されて試料分子とともに気化する。続いてイオン化したマトリックス分子と試料分子との間でプロトンや電子などの授受が起こる事によってイオン化される。
【0106】
本発明においては、標識化された試料はマトリックスに依存することなく、レーザー照射により直接イオン化されうる。したがって、マトリックスを使用することによる様々な制限がないLDIが好ましく採用される。
また、MALDIを採用する場合においても、本発明により標識化された試料は、レーザー照射により直接イオン化するため、マトリックスとの複雑な化学的相互作用を避けることができる。即ち、レーザー照射後、既にイオン化している標識化試料とマトリックス間では、静電反発により複雑な電荷移動は生じ難く、マトリックスは、主にイオン化した試料を気相へ導くための脱離過程に作用するものと考えられる。従って、本発明により標識化された試料にMALDIを適用する場合においても、マトリックス使用による応答の乱れを生じさせる影響は少なく、より定量性の高いスペクトルを再現性よく得ることができる。さらに、標識化された試料化合物はレーザー光線によって直接イオン化されるので、マトリックス分子自体がイオン化される必要はない。したがって、従来のMALDIに比較して使用できるマトリックスの範囲は格段に広くなる。さらには、イオン化されにくいマトリックスを使用することにより、マトリックス分子由来のバックグランドを大幅に低減させることができる。
【0107】
イオン化された試料化合物は、質量分離部で分離され、検出される。
「質量分離部」とは、静電力によって飛行させたイオンに電場または磁場を作用させて、イオンの質量電荷比(m/z)に応じて生じる振幅、飛行時間、軌道の違いにより、イオンをm/zで分離する装置である。
【0108】
質量分離部のイオン分離法は特に限定されず、自体公知の方法が採用されうる。例えば、飛行時間型質量分析法(TOF−MS)、2重収束偏向磁場型質量分析法、4重極型質量分析法(Q−MS)、イオントラップ型質量分析法(IT―MS)などが挙げられる。好適には、TOF−MSが採用される。
【0109】
TOF−MSとは、真空中でのイオンの飛行時間が質量電荷比(m/z)によって異なる事を利用する分離法である。イオン源から検出器までイオンを直線的に飛行させるリニアモードとリフレクトロンという静電場ミラーを用いてイオンの向きを反転させるリフレクターモードがあり、試料化合物または分析の目的(定性分析、定量分析など)に応じて適切な方法を採用すればよい。
【0110】
リニアモードは、測定時間が短い点や、ドリフト空間内で分解したり、中性化したイオンも元のイオンと同一の速度で飛行して検出器に到達するため、高感度に測定できる。一方、イオンの初期運動エネルギーの広がりがピークの幅の広がりになるため、分解能が低下する。
【0111】
これに対して、リフレクターモードでは、大きな初期運動エネルギーをもつイオンほどリフレクトロンの奥まで進んでから反転するため、同じm/zのイオンはほぼ同時に検出器に到達し、高分解能が得られる。しかし、飛行途中で分解や中性化されたイオンは、もとのイオン種とは異なる軌道を描いて反転するか、直進するため、リニアモードと比較すると検出感度は低くなる。
また、リフレクターモードでは、飛行途中で分解したイオンを検出することにより、ポストソース分解を利用したMS/MS測定を行う事ができる。
【0112】
本発明の質量分析法には、レーザー脱離イオン化室と質量分析部を含む市販の装置を制限なく使用することができる。かかる装置としては、Voyager−DE(登録商標)Pro(アプライドバイオシステム社製)などが挙げられる。
【0113】
本発明の質量分析法においては、試料化合物にアニオンパートまたはカチオンパートが付加したイオンのm/z値が観測される。したがって、アニオンパートまたはカチオンパートに相当する部分の分子量を差し引くことによって、試料化合物の分子量を算出することができる。
【0114】
本発明の標識剤を用いた質量分析法で標識化された試料は、レーザー光よる開裂により確実にイオン化されているので、高感度かつ高精度に分析することができる。
また、試料化合物の分子の複数箇所が標識化された場合は、多価イオンが生成するため、m/zが小さくなり、分析機器の測定限界を超えた高分子量の試料も分析しうる。
【0115】
3−1.定量分析
本発明の質量分析法では、試料化合物はレーザーにより直接イオン化され、そのイオン化メカニズムがシンプルであるので、イオン化のレスポンスファクターが構造の多様性に影響されにくく、分子量のみに依存する傾向がある。したがって、分子量が判明している数種の化合物を用いて予めシグナル強度と分子量との相関の経験式を得ておけば、内部標準法などを併用することにより試料濃度を定量的に分析することが可能である。
【0116】
具体的には、分析対象となる化合物の分子量の近辺(±800程度、好ましく±200程度)の分子量が判明している数種(10〜20種、好ましくは5〜6種)の化合物を本発明の標識剤で標識する。次いで、これら標識化化合物の一定濃度(好ましくは10〜500μM)の溶液を調製し、その一定量を質量分析する。これらは、それぞれ個別に測定してもよいし、混合物として一括して測定してもよい。
次いで、得られたスペクトルの各標識化化合物のシグナル強度(典型的には、面積値。以下、同様。)と分子量をグラフにプロットする。これらの値の対数値(log)をプロットすると直線性のある相関が得られるので好ましい(図3参照)。
このグラフから、最小二乗法などにより解析して、相関性の経験式を得ることができる。その際、例外的に相関性から外れる化合物がある場合は除外してもよい。
【0117】
内部標準法によって定量する場合は、標識化した試料化合物を、一定濃度の内部標準化合物(該内部標準化合物は、本発明の標識剤で標識化されたものである必要がある。例えば、上記の経験式を作成するために使用した標識化化合物の一つを用いることができる。以下、同様。)と混合して質量分析する。
具体的には、標識化した試料化合物を、予め調製した一定濃度の内部標準化合物の溶液に溶解させる。得られた溶液の一定量を質量分析する。得られるスペクトルの試料化合物と内部標準化合物の各シグナルの強度比(試料化合物/内部標準化合物の面積比)を、それぞれの分子量に基づき上記で得られた経験式を用いて補正する。補正した強度比と内部標準化合物の濃度の積により、試料化合物の濃度を算出することができる。
試料化合物の標品が得られている場合には、検量線法によって定量分析することもできる。
【0118】
3−2.反応のモニタリング
本発明の質量分析法は、低濃度(10μM程度)のサンプルで短時間(5秒程度)の測定が可能であり、反応試薬や副生物などの夾雑物の影響も受けにくいので、必要に応じて上記の定量分析法と組み合わせることにより、反応の進行をモニターすることができる。比較的高濃度(10mM程度以上)を必要とし、測定に比較的長時間(2分程度)を要する1H−NMRでは解析困難な反応速度が早い反応を好適にモニターすることができる。
また、本発明の質量分析法による反応のモニタリングは、得られるスペクトルの原料化合物、生成物などのシグナル強度を、それぞれの分子量に基づき上記で得られる経験式を用いて補正することにより解析可能であるため、特別なシステムを構築する必要がない。したがって、反応の進行に伴いシフトする原料と生成物の最大吸光度を補正するために、適切なシステムを必要とする分光分析法によるモニタリングよりも簡便である。
【0119】
具体的には、まず、反応の原料化合物を本発明の標識剤により標識する。次いで、標識化された原料化合物の一定濃度の溶液を調製する。反応を定量的に解析する場合には、反応に関与しない内部標準化合物の一定濃度の溶液に標識化原料化合物を溶解させてもよい。
得られた標識化原料化合物の溶液に反応試薬(例えば、求核剤、求電子剤、酸化剤、還元剤、酸、塩基、酵素、触媒など)を添加して反応を開始する。次いで、所定時間ごとに反応液をサンプリングする。サンプリングした溶液に、クエンチ剤(水、酸、塩基、大過剰の他の反応試薬など)を加えて、反応を停止させるか、或いは溶媒を蒸発乾固させることにより反応を停止させてもよい。
【0120】
次いで、サンプリングした溶液を質量分析する。得られるスペクトルの原料化合物(または、クエンチ剤と原料化合物との反応生成物。以下、同様)、生成物、内部標準化合物などのシグナル強度を、それぞれの分子量に基づいて、上記3−1で得られた経験式を用いて補正する。原料化合物と生成物の補正したシグナル強度比あるいは内部標準法を用いて算出した生成物の定量値と反応時間との関係をグラフにプロットし、必要に応じて、自体公知の反応解析法、例えば、最小二乗法、アレニウスプロット法、ラインウェーバー・バークプロット法、ファントホッフプロット法等により、反応速度定数、ミカエリス定数、触媒中心活性、活性化エネルギー、活性化エンタルピー、活性化エントロピーなどを算出することができる。
本発明の質量分析法による反応のモニタリングでは、生成物が複数存在する場合や中間体を経由して段階的に進行する反応においても、それぞれの生成物または中間体などのシグナル強度を経験式から補正可能であるので応用範囲が広く、有用性が高い。
【実施例】
【0121】
以下、本発明について、実施例を挙げてさらに具体的に説明する。本発明はこれらにより何ら限定されるものではない。
【0122】
製造例1:化合物13の合成
【0123】
【化15】

【0124】
グルコース(1mmol)のピリジン(4mL)溶液に無水酢酸(2.8mL)加え、混合物を室温で12時間攪拌した。混合物を酢酸エチル(20mL)に加え、1M塩酸(20mL)で3回、食塩水(20mL)で1回洗浄した。次いで、有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。得られた残渣を酢酸(1mL)に溶解し、臭化水素酸酢酸溶液(5mL)を0℃で10分間で加えた。混合物を10%炭酸カリウム水溶液と酢酸エチル(10mL)に注いだ。追加の酢酸エチル(20mL)を加えた後、混合物を10%炭酸カリウム水溶液(20mL)で3回、食塩水(20mL)で1回洗浄した。次いで、有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。得られた残渣と2−プロピン−1−オール(3mmol)をCH2Cl2(5mL)に溶解し、トリフルオロメタンスルホン酸銀(2mmol)を室温下加え、懸濁液を15分間攪拌し、濾過した。濾液を10%炭酸カリウム水溶液(10mL)で2回、食塩水(10mL)で1回洗浄した。次いで、有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(n−ヘキサン:酢酸エチル=5:1〜1:1)で精製し、化合物13を白色固体として得た。(収率65%)
mp 119-121℃;
IR (KBr, cm -1): 2970, 1765, 1382, 1235, 1048, 902;
1H-NMR(400MHz, CDCl3, TMS, r.t.) δ: 2.01(3H, s), 2.03(3H, s), 2.06(3H, s), 2.09(3H, s), 2.49(1H, t, J=2.4Hz), 3.72-3.76(1H,m), 4.15(1H, d, J=9.6Hz), 4.28(1H, d, J=12.4Hz), 4.38(2H, d, J=2.4Hz), 4.79(1H, d, J=8.8Hz), 5.02(1H, t, J=8.8Hz), 5.11(1H, t, J=9.6Hz), 5.25(1H, t, J=9.2Hz);
13C-NMR(500MHz, CDCl3, TMS, r.t.) δ: 20.5, 20.6, 55.9, 61.7, 68.3, 70.9, 71.9, 72.7, 75.5, 78.1, 98.1, 169.4, 170.2, 170.6;
HRMS m/z Calcd. for C37H56N2O5 386.1213, Found 386.1175.
【0125】
製造例2:化合物14の合成
【0126】
【化16】

【0127】
製造例1と同様にして、マルトース1水和物から化合物14を得た。
mp 69-70℃;
IR (KBr, cm -1): 2964, 1765, 1684, 1370, 1239, 1039, 899;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ: 2.01-2.05(15H, m), 2.10(3H, s), 2.15(3H, s), 2.56(1H, s), 3.75(1H, d, J=10.2Hz), 3.95-4.06(3H, m), 4.25(2H, t, J=12.2Hz), 4.36(2H, s), 4.50(1H, d, J=10.2Hz), 4.80-4.87(3H, m), 5.05(1H, t, J=12.2Hz), 5.29(1H, t, J=8.8Hz), 5.35(1H, t, J=8.8Hz), 5.41(1H, t, J=4.0Hz);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ: 20.3, 20.3, 20.4, 20.5, 20.6, 55.6, 61.3, 62.4, 67.8, 68.3, 69.1, 69.8, 71.5, 72.0,72.5, 75.1, 75.4, 77.9, 95.3, 97.4, 169.1, 169.3, 169.6, 169.9, 170.1, 170.1, 170.2;
HRMS m/z Calcd. for C29H38O18 674.2058, Found 674.2051.
【0128】
製造例3:化合物15の合成
【0129】
【化17】

【0130】
製造例1と同様にして、マルトトリオースから化合物15を得た。
mp 93-95℃;
IR (KBr, cm -1): 2966, 1765, 1765, 1647, 1434, 1238, 1037, 899;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ: 2.00-2.06(21H, m), 2.10(3H, s), 2.16(3H, s), 2.18(3H, s), 2.49(1H, s), 3.77(1H, d, J=12.2Hz), 3.94-4.36(10H, m), 4.78(2H, t, J=12.2Hz), 4.72-4.87(4H, m), 5.07(1H, t, J=10.2Hz), 5.27-5.41(5H, m);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ: 13.9, 20.3, 20.4, 20.5, 20.6, 20.6, 20.7, 55.6, 60.1, 61.2, 62.2, 62.6, 67.7, 68.3, 68.7, 69.1, 69.8, 70.2, 71.5, 71.6, 72, 72.4, 73.6, 75.0, 75.4, 77.2, 77.9, 95.4, 95.5, 97.4, 169.1, 169.4, 169.5, 169.8, 170.1, 170.2, 170.3, 170.3;
FAB HRMS m/z Calcd. for C41H54O26 962.2903, Found 962.2910.
【0131】
実施例1
【0132】
【化18】

【0133】
(1)4−(4−メトキシ−3,5−ジメチルフェニル)−4−オキソ酪酸の合成
ジクロロエタン(2mL)に塩化アルミニウム(2mmol)を加え、氷水で冷却した後、無水コハク酸(1mmol)と2,6−ジメチルアニソール(1.25mmol)を加え、室温で3時間撹拌した。反応液を氷水(30mL)に注ぎ、酢酸エチルで2回抽出した後、油層を1規定塩酸で1回洗浄した。その後、油層を10%炭酸カリウム水溶液で3回抽出し、その抽出液を塩酸で酸性にして酢酸エチルで3回抽出した。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去して、白色結晶の標記化合物を定量的に得た。
IR (KBr, cm -1): 1710, 1678, 1594, 1151, 1012, 936;
1H-NMR(400MHz, CDCl3, TMS, r.t.) δ: 2.32(6H, s), 2.79(2H, t, J=6.8Hz), 3.26(2H, t, J=6.8Hz), 3.75(3H, s), 7.66(2H, s);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ: 15.8, 27.7, 32.5, 59.5, 128.5, 130.6, 131.5, 160.8, 178.2, 196.5;
HRMS m/z Calcd. for C13H16O3 236.1049, Found 236.1049.
【0134】
(2)化合物1の合成
4−(4−メトキシ−3,5−ジメチルフェニル)−4−オキソ酪酸(1mmol)をジメチルホルムアミド(2mL)に溶解させ、ヨウ化メチル(1.5mmol)と炭酸カリウム(2mmol)加え、室温で3時間撹拌した。反応液を30mLの蒸留水に加え、酢酸エチルで2回抽出した後、1規定塩酸で3回洗浄した。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去して、淡黄色油状物質の化合物1を定量的に得た。
IR (KBr, cm -1): 1738, 1680, 1598, 1148, 1011;
1H-NMR(400MHz, CDCl3, TMS, r.t.) δ: 2.32(6H, s), 2.75(2H, t, J=6.8Hz), 3.27(2H, t, J=6.8Hz), 3.70(3H, s), 3.76(3H, s), 7.67(2H, s);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ: 15.9, 27.8, 33.0, 51.5, 59.4, 128.8, 130.9, 132.0, 161.1, 173.2, 197.1;
HRMS m/z Calcd. for C14H18O4 250.1205, Found 250.1183.
【0135】
(3)化合物2の合成
化合物1(1mmol)をジクロロメタン(5mL)に溶解させ2口フラスコに移し、窒素ガスを充填した後、これをエタノールバスにて−78℃に冷却した。ここに三臭化ホウ素(2mmol)をシリンジで加え、−5℃で12時間撹拌した。この反応液を氷水(50mL)に注ぎ、酢酸エチルで3回抽出し、抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去した。残査をカラムクロマトグラフィーで精製(ノルマルヘキサン:酢酸エチル=4:1)して、淡黄色結晶の化合物2を65%の収率で得た。
mp 109-111℃;
IR (KBr, cm -1): 1721.15, 1359.47, 1201.07, 1153.83, 992.26, 851.00;
1H-NMR(400MHz, CDCl3, TMS, r.t.) δ: 2.28(6H, s), 2.75(2H, t, J=6.8Hz), 3.26(2H, t, J=6.8Hz), 3.71(3H, s), 5.24(1H, s,), 7.66(2H, s);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ: 15.9, 28.1, 32.8, 51.8, 123.3, 128.6, 129.1, 157.3, 173.9, 197.2;
HRMS m/z Calcd. for C13H16O4 236.1049, Found 236.1030.
【0136】
(4)化合物3aの合成
化合物2(1mmol)をジメチルホルムアミド(2mL)に溶解させ、p−ニトロベンジルブロミド(1.1mmol)と炭酸カリウム(2mmol)加え、室温で3時間撹拌した。反応液を30mLの蒸留水に加え酢酸エチルで2回抽出した。1規定塩酸で3回洗浄した。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去した。残査をカラムクロマトグラフィーで精製(ノルマルヘキサン:酢酸エチル=4:1)して、淡黄色結晶の化合物3aをほぼ定量的に得た。
mp 125-128℃;
IR (KBr, cm -1); 1748, 1678, 1595, 1523, 1342, 1325, 1150, 981;
1H-NMR(400MHz, CDCl3, TMS, r.t.)δ;2.33(6H, s), 2.76(2H, t, J=6.6Hz), 3.28(2H, t, J=6.6Hz), 3.70(3H, s), 4.96(2H, s), 7.65(2H, d, J=8.0Hz), 7.70(2H, s), 8.27(2H, d, J=8.0Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.)δ;16.57, 28.11, 33.29, 51.78, 72.39, 123.71, 127.59, 129.18, 131.13, 132.73, 144.32, 147.56, 159.41, 173.25, 197.15.
HRMS m/z Calcd. for C20H21NO6 371.1369, Found 371.1369.
【0137】
実施例2
実施例1と同様にして化合物3bを得た。
【0138】
【化19】

【0139】
明黄色固体; mp 127-129℃;
IR (KBr, cm -1): 1755, 1725, 1680, 1214, 1151, 1071, 844;
1H-NMR(300MHz, CDCl3, TMS, r.t.)δ;2.35(6H, s), 2.75(2H, t, J=6.6Hz), 3.27(2H, t, J=6.6Hz), 3.70(3H,s), 3.85(3H, s), 4.56(2H, s), 7.67(2H, s).
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.3, 28.0, 33.1, 51.6, 52.1, 68.7, 129.1, 131.0, 133.0, 159.3, 168.9, 173.3, 197.2;
HRMS m/z Calcd. for C16H20O6 308.1260, Found 308.1253.
【0140】
実施例3
実施例1と同様にして化合物3cを得た。
【0141】
【化20】

【0142】
白色固体; mp 53-55℃;
IR (KBr, cm -1): 3032, 1726, 1678, 1597, 1359, 1223, 1151, 972, 843;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 2.33(6H, s), 2.76(2H, t, J=6.8Hz), 3.28(2H, t, J=6.8Hz), 3.71(3H, s), 4.85(2H, s), 7.36-7.47(5H, m), 7.69(2H,s);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 28.1, 33.2, 51.7, 74.1, 127.8, 128.2, 128.5, 129.1, 131.5, 137.0, 160.1, 173.4, 197.4;
HRMS m/z Calcd. for C20H22O4 326.1518, Found 326.1504
【0143】
実施例4
実施例1と同様にして化合物3dを得た。
【0144】
【化21】

【0145】
黄色固体; mp 127-130℃;
IR (KBr, cm -1): 2937, 1737, 1678, 1582, 1525, 1441, 1324, 1276, 1223, 1154, 875, 796;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 2.33(6H, s), 2.77(2H, t, J=6.8Hz), 3.30(2H, t, J=6.8Hz), 3.72(3H, s), 4.00(3H, s), 4.06(3H, s), 5.28(2H, s), 7.66(1H, s), 7.72(2H, s), 7.80(1H, s);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 28.1, 33.3, 51.8, 56.4, 56.5, 70.3, 108, 109.0, 129.2, 129.8, 131.3, 132.8, 138.6, 147.8, 154.1, 159.6, 173.4, 197.3;
HRMS m/z Calcd. for C22H25NO8 431.1580, Found 431.1581.
【0146】
実施例5
実施例1と同様にして化合物3eを得た。
【0147】
【化22】

【0148】
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 2.32(6H, s), 2.76(2H, t, J=6.8Hz), 3.28(2H, t, J=6.8Hz), 3.71(3H, s), 3.93(6H, s), 4.91(2H, s), 7.65(1H, d, J=7.8Hz), 7.70(2H, s), 7.80(2H, d, J=7.8Hz);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 28.0, 33.2, 51.8, 52.6, 52.7, 72.5, 127.3, 129.2, 129.3, 129.4, 131.2, 131.3, 132.5, 132.7, 140.8, 159.6, 167.6, 167.9, 173.4, 197.4;
HRMS m/z Calcd. for C24H26O8 442.1628, Found 442.1629.
【0149】
実施例6:4−[3,5−ジメチル−4−(4−ニトロベンジルオキシ)フェニル]−4−オキソ酪酸の合成
【0150】
【化23】

【0151】
化合物3a(1mmol)を少量のテトラヒドロフランに溶解させ、5%水酸化ナトリウム水溶液を50mL加え、室温で1時間撹拌した。反応液を塩酸で酸性にし、酢酸エチルで3回抽出を行った。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去すると、淡黄色結晶の標記化合物をほぼ定量的に得た。
1H-NMR(300MHz, CDCl3, TMS, r.t.)δ;2.33(6H, s), 2.82(2H, t, J=6.9Hz), 3.29(2H, t, J=6.9Hz), 4.96(2H, s), 7.66(2H, d, J=9.0Hz), 7.71(2H, s), 8.29(2H, d, J=8.7Hz).
【0152】
実施例7:化合物5の合成
【0153】
【化24】

【0154】
4−[3,5−ジメチル−4−(4−ニトロベンジルオキシ)フェニル]−4−オキソ酪酸(1mmol)にジクロロメタン(2mL)を加え、N−ヒドロキシスクシンイミド(1.5mmol)と縮合剤EDC(2mmol)を加え、室温で3時間撹拌した。反応液を1回につき10mLの蒸留水で3回洗浄し、無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去して、黄色結晶の化合物5をほぼ定量的に得た。
mp 194-197℃;
IR (KBr, cm -1): 3450, 1737, 1679, 1525, 1347, 1206, 1155, 1063, 983, 854;
1H-NMR(300MHz, CDCl3, TMS, r.t.)δ;2.33(6H, s), 2.85(4H, s), 3.08(2H, t, J=6.9Hz), 3.40(2H, t, J=6.9Hz), 4.96(2H, s), 7.66(2H, d, J=9.0Hz), 7.71(2H, s), 8.28(2H, d, J=9.0Hz).
13C-NMR (400MHz, CDCl3, TMS, r.t.)δ (ppm); 16.5, 25.44, 25.6, 32.9, 72.4, 123.8, 127.7, 129.3, 131.4, 132.3, 144.4, 147.7, 159.8, 168.4, 169, 196;
HRMS m/z Calcd. for C23H22N2O8 454.1376, Found 454.1367.
【0155】
実施例8:化合物4(4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−N−(n−プロピル)−酪酸アミド)の合成
【0156】
【化25】

【0157】
化合物5(1mmol)のCH2Cl2(3mL)溶液にn−プロピルアミン(1.2mmol)を加えた。 反応溶液を室温で3時間攪拌した。次いで、混合物を水に注ぎ、CH2Cl2(5mL)で3回抽出した。次いで、有機層を硫酸マグネシウムで乾燥し、ろ過し、減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(n−ヘキサン:酢酸エチル=5:1〜1:1)で精製し、化合物4を白色固体として得た。
白色固体; mp 170-172℃;
IR (KBr, cm -1): 2961, 1678, 1641, 1527, 1343, 1322, 1150, 982, 854;
1H-NMR (300MHz, CDCl3, TMS, r.t.) δ (ppm); 0.93(3H, t, J=7.2Hz), 1.50-1.58(2H, m), 2.32(6H, s), 2.63(2H, t, J=6.6Hz), 3.23(2H, t, J=6.6Hz), 3.34(2H, t, J=6.6Hz), 4.96(2H, s), 5.99(1H, s), 7.66(2H, d, J=8.4Hz), 7.71(2H, s), 8.28(2H, d, J=8.4Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 11.3, 16.5, 22.8, 30.4, 34.0, 41.3, 72.4, 123.8, 127.7, 129.3, 1321.2, 132.9, 144.4, 147.7, 159.6, 172.0, 198.5;
HRMS m/z Calcd. for C22H26N2O5 398.1842, Found 398.1837.
【0158】
実施例9:化合物4a(N−ベンジル−4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−酪酸アミド)の合成
【0159】
【化26】

【0160】
化合物5をジクロロメタンに溶解させ、ベンジルアミンを2当量加え1時間撹拌した後、蒸留水を加え酢酸エチルで3回抽出し、抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去した。残査をカラムクロマトグラフィーで精製(ノルマルヘキサン:酢酸エチル=4:1)して、黄色結晶の化合物4aをほぼ定量的に得た。
1H-NMR(300MHz, CDCl3, TMS, r.t.)δ;2.32(6H, s), 2.67(2H, d, J=6.5Hz), 3.36(2H, d, J=6.5Hz), 4.46(2H, d, J=6.0Hz), 4.96(2H, s), 6.06(1H, bs), 7.26-7.31(5H, m), 7.66(2H, d, J=9.0Hz), 7.71(2H, s), 8.28(2H, d, J=9.0 Hz).
【0161】
実施例10:化合物7(N−(2−アミノエチル)−4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−酪酸アミド)の合成
実施例8と同様にして、化合物7を合成した。
【0162】
【化27】

【0163】
白色固体; mp 123-125℃;
IR (KBr, cm -1): 3363, 2898, 1665, 1514, 1346, 1296, 1151, 1007.65, 850;
1H-NMR (300MHz, CDCl3, TMS, r.t.) δ (ppm); 2.32(6H, s), 2.63(2H, t, J=6.6Hz), 2.84(2H, t, J=6.3Hz), 3.31-3.36(4H, m), 4.96(2H, s), 6.19(1H, s), 7.66(2H, d, J=9.0Hz), 7.71(2H, s), 8.29(2H, d, J=9.0Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 30.3, 33.9, 41.3, 42.0, 72.4, 123.8, 127.7, 129.3, 131.2, 132.8, 144.4, 147.6, 159.5, 172.4, 198.5;
HRMS m/z Calcd. for C21H25N3O5 399.1794, Found 399.1774.
【0164】
実施例11:化合物8(N−(tert−ブチル)−4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−酪酸アミド)の合成
実施例8と同様にして、化合物8を合成した。
【0165】
【化28】

【0166】
白色固体; mp 124-125℃;
IR (KBr, cm -1): 2969, 1678, 1642, 1530, 1344, 1152, 983, 853;
1H-NMR (300MHz, CDCl3, TMS, r.t.) δ (ppm); 1.35(9H, s), 2.32(6H, s), 2.54(2H, t, J=6.6Hz), 3.30(2H, t, J=6.6Hz), 4.95(2H, s), 5.61(1H, s), 7.66(2H, d, J=9.0Hz), 7.69(2H, s), 8.28(2H, d, J=9.0Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.6, 28.9, 31.3, 34.1, 51.4, 72.7, 124.4, 128.3, 130.0, 131.8, 133.6, 145.2, 148.4, 160.3, 172.2, 199.5;
HRMS m/z Calcd. for C23H28N2O5 412.1998 Found 412.1996.
【0167】
実施例12:化合物9(N−シクロヘキシル−4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−酪酸アミド)の合成
実施例8と同様にして、化合物9を合成した。
【0168】
【化29】

【0169】
白色固体; mp 207-210℃;
IR (KBr, cm -1): 2933, 2854, 1640, 1527, 1343, 1302, 1152, 987, 855;
1H-NMR (300MHz, CDCl3, TMS, r.t.) δ (ppm); 1.11-1.23(3H, m), 1.29-1.38(3H, m), 1.68-1.73(2H, m), 1.88-1.92(2H, m), 2.32(6H, s), 2.58(2H, t, J=6.6Hz), 3.31(2H, t, J=6.6Hz), 3.74-3.76(1H, m), 4.95(2H, s), 5.61(1H, s), 7.65(2H, d, J=8.4Hz), 7.74(2H, s), 8.28(2H, d, J=8.4Hz);
13C-NMR(500MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 24.8, 25.5, 30.7, 33.1, 34.1, 48.3, 72.4, 123.8, 127.7, 129.3, 131.2, 133.0, 144.4, 147.7, 159.6, 171.1, 198.5;
HRMS m/z Calcd. for C25H30N2O5 438.2155, Found 438.2148.
【0170】
実施例13:化合物10(4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−N−(β−フェニルエチル)−酪酸アミド)の合成
実施例8と同様にして、化合物10を合成した。
【0171】
【化30】

【0172】
白色固体; mp 176-178℃;
IR (KBr, cm -1): 2942, 1678, 1632, 1527, 1342, 1233, 1211, 1149, 981, 855;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 2.33(6H, s), 2.57(2H, t, J=6.8Hz), 2.82(2H, t, J=6.8Hz), 3.30(2H, t, J=6.8Hz), 3.53(2H, q, J=6.4Hz), 4.96(2H, s), 5.74(1H, s), 7.20-7.32(5H, m), 7.66(2H, d, J=8.8Hz), 7.70(2H, s), 8.28(2H, d, J=8.8Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 30.3, 33.9, 35.7, 40.68, 72.4, 123.8, 126.4, 127.6, 128.7, 129.3, 131.2, 132.8, 138.9, 144.4, 147.6, 159.5, 172.0, 198.3;
HRMS m/z Calcd. for C27H28N2O5 460.1998 Found 460.1996.
【0173】
実施例14:化合物11(4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−N−ドデシル−4−オキソ−酪酸アミド)の合成
実施例8と同様にして、化合物11を合成した。
【0174】
【化31】

【0175】
白色固体; mp 147-149℃;
IR (KBr, cm -1): 3088, 2918, 2850, 1642, 1528, 1343, 1234, 1150, 983, 855,
1H-NMR (300MHz, CDCl3, TMS, r.t.) δ (ppm); 0.88(3H, t, J=6.6Hz), 1.25(15H, s), 1.50(3H, t, J=7.2Hz), 2.48(6H, s), 2.60(2H, t, J=6.6Hz), 3.24(2H, q, J=6.6Hz), 3.33(2H, t, J=6.6Hz), 4.95(2H, s), 5.77(1H, t, J=9.0Hz), 7.65(2H, d, J=8.7Hz), 7.74(2H, s), 8.82(2H, d, J=8.7Hz).
13C-NMR(500MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 24.8, 25.5, 30.7, 33.1, 34.1, 48.3, 72.4, 123.8, 127.7, 129.3, 131.2, 133.0, 144.4, 147.7, 159.6, 171.1, 198.5;
HRMS m/z Calcd. for C31H44N2O5 524.3250 Found 524.3234.
【0176】
実施例15:化合物12(4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−N−オクタデシル−4−オキソ−酪酸アミド)の合成
実施例8と同様にして、化合物12を合成した。
【0177】
【化32】

【0178】
白色固体; mp 147-149℃;
IR (KBr, cm -1): 3088, 2918, 2850, 1642, 1528, 1343, 1212, 1150, 983, 855;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 0.88(6H, t, J=6.6Hz), 1.25(22H, s), 1.44-1.49(4H, m), 2.32(6H, s), 2.60(2H, t, J=6.6Hz), 3.24(2H, q, J=6.6Hz), 3.32(2H, t, J=6.6Hz), 4.95(2H, s), 5.74(1H, s), 7.65(2H, d, J=9.0Hz), 7.71(2H, s), 8.28(2H, d, J=9.0Hz);
13C-NMR(500MHz, CDCl3, TMS, r.t.) δ (ppm); 14.1, 16.5, 22.7, 26.9, 29.3, 29.6, 29.7, 30.5, 31.9, 34.1, 39.7, 72.4, 123.8, 127.7, 129.4, 131.2, 132.9, 144.4, 147.7, 159.6, 172.0, 198.5;
HRMS m/z Calcd. for C37H56N2O5 608.4189 Found 608.4177.
【0179】
実施例16:化合物6(N−[2−(2−アジド−エトキシ)−エチル]−4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−酪酸アミド)の合成
【0180】
【化33】

【0181】
化合物5(1mmol)のCH2Cl2(3mL)溶液に2−(2−アミノエトキシ)エタノール(2mmol)を加え、反応溶液を室温で3時間攪拌した。ついで、反応混合物を水に注ぎ、CH2Cl2(5mL)で3回抽出した。次いで、有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。残渣をピリジン(5mL)に溶解し、メタンスルホニルクロリド(1.2mmol)を加え、反応混合物を室温で12時間攪拌した。混合物に酢酸エチル(20mL)を加え、1M塩酸(20mL)で3回、食塩水(20mL)で1回洗浄した。有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。得られた残渣をDMF(5mL)に溶解し、ナトリウムアジド(3mmol)を加え、懸濁液を〔室温で12時間攪拌した。混合物に酢酸エチル(20mL)を加え、1M塩酸(20mL)で3回、食塩水(20mL)で1回洗浄した。有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(n−ヘキサン:酢酸エチル=1:1〜1:2)で精製し、化合物6を黄色味を帯びた固体として得た。(収率70%)
黄色固体; mp 112-115℃;
IR (KBr, cm -1): 2103, 1755, 1641, 1343, 1233, 1052;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 2.33(6H, s), 2.63(2H, t, J=6.8Hz), 3.32(2H, t, J=6.8Hz), 3.40(2H, t, J=4.8Hz), 3.50(2H, t, J=4.8Hz), 3.58(2H, t, J=4.8Hz), 3.69(2H, t, J=4.8Hz), 4.96(2H, s), 7.66(2H, d, J=8.4Hz), 7.71(2H, s), 8.28(2H, d, J=8.8Hz);
13C-NMR (500MHz, CDCl3, TMS, r.t.) δ (ppm); 16.6, 30.2, 33.8, 39.2, 50.6, 69.9, 70.14, 72.4, 123.8, 127.7, 129.3, 131.2, 132.9, 144.5, 147.6, 159.5, 172.2, 198.2;
HRMS m/z Calcd. for C23H27N5O6 469.1961, Found 469.1959.
【0182】
実施例17:化合物16の合成
【0183】
【化34】

【0184】
化合物13(1mmol)と化合物6(1mmol)のアセトニトリル溶液(5mL)に硫酸銅(I)(0.5mmol)とアスコルビン酸ナトリウム(2mmol)を加え、混合物を室温で12時間攪拌した。次いで、混合物を水に注ぎ、酢酸エチル(10mL)で3回抽出した。有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:メタノール=50:1〜10:1)で精製し、化合物16を白色固体として得た。(収率96%)
明黄色固体; mp 45-48℃;
IR (KBr, cm -1): 2956, 1755, 1676, 1347, 1228, 1153, 1040;
1H-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 1.98-2.20(14H, m), 2.32(6H, s), 2.63(2H, t, J=6.8Hz), 3.32(2H, t, J=6.8Hz), 3.75-3.85(3H, m), 3.74-3.80(1H, m), 3.80-3.92(2H, m), 4.08-4.18(1H, m), 4.22-4.32(1H, m), 4.46(2H, s), 4.65-4.90(2H, m), 4.96(2H, s), 4.99-5.04(1H, m), 5.12(1H, t, J=9.2Hz), 5.22(1H, t, J=9.2Hz), 6.37(1H, t, J=5.6Hz), 7.66(2H, d, J=8.8Hz), 7.71(2H, s), 7.75(1H, s), 8.28(2H, d, 8.8Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.4, 20.5, 20.6, 20.6, 30.0, 33.7, 39.1, 50.1, 61.8, 63.1, 68.3, 68.9, 69.8, 71.3, 71.8, 72.3, 72.6, 100.0, 123.7, 123.8, 127.6, 129.2, 131.1, 132.8, 144.1, 144.4, 147.6, 159.5, 169.3, 169.4, 170.1, 170.6, 172.3, 198.2;
FAB HRMS m/z Calcd. for C40H49N5O16 855.3174, Found 855.3164.
【0185】
実施例18:化合物17の合成
【0186】
【化35】

【0187】
実施例15と同様にして化合物17を得た。(収率95%)
白色固体; mp 94-96℃;
IR (KBr, cm -1): 2958, 1755, 1675, 1529, 1369, 1348, 1234.90, 1153, 1043;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 1.98-2.04(17H, m), 2.10(3H, s), 2.15(3H, s), 2.32(6H, s), 2.62(2H, t, J=6.8Hz), 3.32(2H, t, J=6.8Hz), 3.43(1H, q, J=5.6Hz), 3.53-3.54(2H, m), 3.69-3.75(1H, m), 3.86(2H, t, J=4,8Hz), 3.95-4.07(3H, m), 4.18-4.32(2H, m), 4.49-4.63(3H, m), 4.72(1H, d, J=8.2Hz), 4.81-4.93(3H, m), 4.96(2H, s), 5.06(1H, t, J=10.2Hz), 5.26(1H, t, J=8.8Hz), 5.33-5.42(2H, m), 6.31(1H, t, J=5.6Hz), 7.66(2H, d, J=8.2Hz), 7.71(2H, s), 7.73(1H, s), 8.28(2H, d, J=8.8Hz);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 20.5, 20.5, 20.6, 20.8, 30.1, 33.7, 39.1, 50.1, 61.5, 62.6, 63.1, 68.0, 68.4, 68.9, 69.3, 69.8, 70.0, 72.1, 72.3, 72.4, 72.7, 75.2, 95.5, 99.6, 123.8, 123.9, 127.64, 129.3, 131.2, 132.9, 144.1, 144.4, 147.6, 159.5, 169.3, 169.7, 169.8, 170.1, 170.4, 170.5, 172.3, 198.2;
HRMS m/z Calcd. for C52H65N5O241143.4020, Found 1143.4116.
【0188】
実施例19:化合物18の合成
【0189】
【化36】

【0190】
実施例15と同様にして化合物18を得た。(収率95%)
白色固体; mp 98-100℃;
IR (KBr, cm -1): 2961, 1755, 1675, 1530, 1370, 1348, 1235, 1152, 1037;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 1.96-2.10(27H, m), 2.15(3H, s), 2.18(3H, s), 2.32(6H, s), 2.62(2H, d, J=6.8Hz), 3.32(2H, t, J=6.8Hz), 3.43(1H, q, J=5.4Hz), 3.53-3.54(2H, m), 3.74-3.77(1H, m), 3.86(2H, t, J=4.8Hz), 3.92-4.07(4H, m), 4.17-4.33(3H, m), 4.46-4.57(4H, m), 4.70-4.75(2H, m), 4.81-4.92(3H, m), 4.96(2H, s), 5.07(1H, t, J=10.2Hz), 5.24-5.29(2H, m), 5.34-5.42(3H, m), 6.28(1H, t, J=5.6Hz), 7.66(2H, d, 8.8Hz), 7.70(2H, s), 7.73(1H, s), 8.28(2H, d, 8.8Hz);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.4, 20.4, 20.5, 20.6, 20.7, 20.7, 20.8, 30.0, 33.6, 39.1, 50.0, 61.3, 62.2, 62.7, 63.1, 67.8, 68.4, 68.8, 68.9, 69.2, 69.7, 70.0., 70.3, 71.6, 72.0, 72.2, 72.3, 72.4, 73.7, 75.0, 95.5, 95.6, 99.5, 123.7, 123.9, 127.6, 129.2, 131.1, 132.8, 144.0, 144.4, 147.5, 159.4, 169.3, 169.5, 169.7, 169.7, 169.9, 170.2, 170.4, 170.4, 170.4, 170.5, 172.2, 198.2,
HRMS m/z Calcd. for C64H81N5O32 1431.4865, Found 1431.4855.
実施例20:化合物19の合成
【0191】
【化37】

【0192】
フェノキシ酢酸に過剰の塩酸メタノールを加え、室温で6時間撹拌した。反応液をそのまま減圧留去すると、淡黄色の液状物質(フェノキシ酢酸メチル)をほぼ定量的に得た。ジクロロエタン(5mL)に塩化アルミニウム(4mmol)を加え、氷水で冷却した後、無水コハク酸(1mmol)とフェノキシ酢酸メチル(1mmol)を加え、室温で3時間撹拌した。反応液を氷水(30mL)に注ぎ、酢酸エチルで2回抽出した後、有機層を1規定塩酸で1回洗浄した。その後、有機層を10%炭酸カリウム水溶液で3回抽出し、その抽出液を塩酸で酸性にして酢酸エチルで3回抽出した。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去して、白色結晶の化合物19をほぼ定量的に得た。1H-NMR(300MHz, CDCl3, TMS, r.t.)δ;2.79(2H, t, J=6.6Hz), 3.27(2H, t, J=6.6Hz), 3.82(3H, s), 4.71(2H, s), 6.95(2H, d, J=9.0Hz), 7.97(2H, d, J=9.0Hz).
実施例21:化合物20の合成
【0193】
【化38】

【0194】
化合物19(1mmol)をジメチルホルムアミド(2mL)に溶解させ、ヨウ化メチル(1.5mmol)と炭酸カリウム(2mmol)加え、室温で3時間撹拌した。反応液を30mLの蒸留水に加え酢酸エチルで2回抽出した後、1規定塩酸で3回洗浄した。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去して、淡黄色結晶の化合物20をほぼ定量的に得た。
1H-NMR(400MHz, CDCl3, TMS, r.t.)δ;2.74(2H, d, J=6.8Hz), 3.26(2H, d, J=6.8Hz), 3.69(3H, s), 3.80(3H, s), 4.70(2H, s), 6.94(2H, d, J=8.8Hz), 7.96(2H, d, J=8.8Hz).
上記方法と同様にして、下記表2−1〜3に示される化合物を合成した。
【0195】
【表2−1】

【0196】
【表2−2】

【0197】
【表2−3】

【0198】
試験例1:定量性の検討(検量線)
化合物4aの1mMのアセトニトリル溶液を1mL量り、全量を10mLとし100μM溶液を調製した。100μM溶液を5mL量り全量を10mLとし50μM溶液を調整した。50μM溶液を5mL量り、全量を10mLとし25μM溶液を調製した。100μM溶液を1mL量り、全量を10mLとし10μM溶液を調製した。同様の操作を繰り返し1、2、2.5、4、5、6および8μM溶液それぞれ調製した。これらの11種類の化合物4aの溶液をそれぞれ1mL量り取り、10μMの化合物3aの溶液を内部標準として各1mL混合させ、11種類の試料溶液を調製した。これらの試料溶液を質量分析用プレートに0.5μLスポットさせた後、蒸発乾固させアプライドバイオシステムズのVoyager−DE(登録商標)PROにて質量分析を行った。測定により得られたシグナル強度より、化合物3aに対する化合物4aの面積比を算出した。測定は各スポットについて8回行い、得られた面積値の最大値と最小値を除き、6つの相加平均を測定値として算出し、検量線を作成した。結果を図1に示す。
広い濃度領域では完全な直線関係ではないものの広い濃度領域に渡って累乗近似曲線により良好な応答を観察することができた(相関係数r=0.999)。一般的に狭い濃度領域では近似的に直線として取り扱うことも可能である。観察された非直線性は一般的なTOF−MSにおける機械的な性質によるものであると考えられ、改良された装置を用いることにより改善され得る。
【0199】
試験例2:アミン類の簡便検出法
化合物5を10μmol正確に量り、10mLのアセトニトリルを加え1mM溶液を調製した。この溶液を100倍希釈することにより10μMの溶液とした。ベンジルアミンは0.1mmolを正確に量り、10mLのアセトニトリルに溶解し10mM溶液とした。この、10mMベンジルアミンアセトニトリル溶液を1mLはかり、全量を10mLとし1mM溶液を調製した。1mM溶液を1mL量り、全量を10mLとし、100μM溶液を調製した。ベンジルアミンアセトニトリル100μM溶液を1mL量り、全量を10mLとし、10μM溶液を調製した。
質量分析用プレート上に10μMのベンジルアミン溶液を0.5μLスポット後、乾燥させてから調製した10μMの化合物5溶液を0.5μL重ねてスポットし、蒸発乾固させアプライドバイオシステムズのVoyager−DE(登録商標) PROにて質量分析を行った。得られたMSスペクトルを図2に示す。
標識化されたベンジルアミン(アミド誘導体)のイオンピークを明確に観測することができた。
【0200】
試験例3:LDI−MSスペクトル測定
以下の条件でネガティブモード、線形動作モード(ディレイド・エクストラクションタイプ)、最適化されたレーザーレートタイプで、実施例化合物のLDI−MSスペクトルを測定した。
使用機器:アプライドバイオシステムズ社製、Voyager DE Pro
加速電圧: 20,000V,
格子電圧: 95%,
格子ワイヤ電圧0: 0.05%,
遅延時間:130 nsec.
全ての測定には、ステンレススチールプレート(PLETE1、45ウェル)を使用した。典型的には、標識された化合物の10μM溶液を調製し、0.2μLの試料を各サークルにアプライし、周辺温度で乾燥させた。溶媒としてはアセトニトリル又はジクロロメタンを使用した。予め混合した溶液(1:1混合物)をシグナルレスポンスファクターの比較のために使用した。以下に示す数値は10スペクトルの平均を表す。
【0201】
表3に化合物2、3a〜3eの測定結果を示す。内部標準としては化合物4を用いた。相対強度は化合物3aを1.0とした時の相対値を示す。測定は10μMの予め混合した溶液を用いた。
【0202】
【表3】

【0203】
化合物3aでネガティブチャージされたフェノレートイオンIに相当するm/z=235.10のシグナルが観測され、満足がいく結果が得られた。興味深いことに、カチオンパートの多様性がLDI−MSの感度に強い影響を与えることが分った。フェノール誘導体である化合物2(R1=H)は、比較的低いO−H結合エネルギーにも係わらず、化合物3aの6%のシグナル強度しか示さなかった。電子吸引性のメトキシカルボニル基は感度を向上させた。ニトロ基やメトキシカルボニル基などの電子吸引性置換基を有するベンジル基がシグナルの相対強度を増強させることが明らかとなった。化合物3aの検出限界は、20fmol/spot辺りであった。これら化合物の特徴的な光照射開裂エーテル結合であるニトロベンジルフェノールエーテルは適当な酸性または塩基性条件並びに実験室の照明下では化学的に安定であった。
【0204】
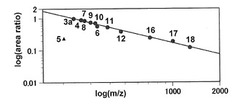
図3に化合物3a、4〜12および16〜18について、縦軸に相対強度[log(面積比)]、横軸にlog(m/z)をプロットしたグラフを示す。LDI−MSは各化合物の10μM溶液の0.2μLを用いて行った。相対強度は化合物3aを1.0とした時の相対値を示す。
興味深いことにこれら標識された化合物の照射により生成したイオンのレスポンスファクターは、それらの構造の多様性に係わらず、その分子量のみに高い相関性を示した。但し例外として、活性エステルである化合物5は、レーザーパルス照射により分解し、環化イオンIIIに相当するm/z=203の比較的弱いシグナルを示した。
図3におけるシグナル面積比と分子量の相関性に関して最小二乗法により、応答経験式y = 725.04 * (x−1.208)(yは、シグナル面積値、xはm/z値を示す。)が得られた。
このように、本発明の標識剤を用いたLDI−MSにおいてイオンの初期速度がレスポンスファクターを主に制御していることが示唆された。図3より得られる経験式は、未知化合物の相対濃度を見積もることを可能にしうる。
【0205】
【化39】

【0206】
以上の結果より、本発明の標識剤で標識された化合物のLDI−MSのシグナル強度はその構造には依存せず、分子量にのみに依存する傾向があることが明らかとなり、種々の構造骨格を有する化合物同士を定量的に測定するのに適していることが明らかとなった。
【0207】
試験例4:反応のモニタリング(1)
化合物5(50μM)とβ−フェネチルアミン(50μM)のアセトニトリル(2mL)溶液を調製した。経時的に反応液をサンプリングし、過剰のn−プロピルアミンを加え、反応をクエンチし、試験例3と同様の条件でLDI−MSスペクトルを測定した。
各サンプルからは、化合物10(m/z=324)と化合物4(m/z=262)に相当するシグナルのみが測定された。図3のグラフより得られる応答経験式よりそれらシグナルの面積比を補正した後、反応時間と生成物濃度の関係を示すグラフを得た(図4)。反応の進行に伴い生成するヒドロキシスクシンイミドは定量的質量分析を妨げなかった。生成物と原料濃度の時間プロフィールに基づいて、二次速度定数(k2=292M−1s−1)が得られた。一般的な中性塩(有機または無機)の存在は、本発明の標識剤を用いたLDI−MSの定量的分析に顕著な影響を与えないことが示唆された。
以上の結果より、本発明の標識剤で標識された化合物の反応は、LDI−MSを用いて定量的にモニタリングするのに適していることが分った。
【0208】
試験例5:反応のモニタリング(2)
化合物16、17および18(100μM)のメタノール溶液(100μL)のそれぞれに、100mMのn−プロピルアミンのメタノール溶液(400μL)と内部標準として1mMの化合物11のメタノール溶液(10μL)を加えた。15分毎にステンレススチールプレートに反応溶液の0.2μLをアプライし、試験例3と同様な条件でLDI−MSスペクトルを測定して、反応をモニターした。
化合物17についての5時間後のLDI−MSスペクトルを図5に示す。部分的に脱アセチル化された各生成物のシグナルが観察された。
図3より得られる応答経験式により補正した後、反応において脱アセチル化された各生成物のシグナル面積の合計は、生成物の官能性や極性の顕著な多様性に係わらず、内部標準の化合物11(図5にシグナルを示していない)と一致した。完全に脱アセチル化された生成物は15時間後、92%(相対強度0.237)で観測された。
【0209】
図6に、完全に脱アセチル化された化合物16’、17’および18’の相対強度と分子量の相関性を示すグラフを、化合物3a、4〜12および16〜18と共に示す。化合物16’、17’および18’は化合物3aを1.0とした相対値で示した。化合物16’、17’および18’の相対強度と分子量の相関性は、化合物3a、4、6〜12および16〜18の相関性と一致した。
以上の結果により、本発明の標識剤は、多段階反応のモニタリングにも利用できることが明らかとなった。
本発明の標識剤を利用した反応のモニタリングは、1H−NMRを利用した場合に比較して、(1)低濃度で感度よく測定できる、(2)短時間で測定できるなどの利点がある。
また、光学分光法でも低濃度反応のモニタリングが可能であるが、反応の進行に従って極大吸光度がシフトして、不動点を形成するような測定系をデザインする必要がある。一方、本発明の方法ではシグナル強度は分子量のみに依存するので、試料を標識することを除いて、特別なデザインを必要とせず、幅広い系に適用することが容易である。
【0210】
試験例6:反応のモニタリング(3)
誘導体16’の50mM溶液10μLにβ−グルコシダーゼ(スウィートアーモンド由来)溶液20μL(1U)、100mMリン酸緩衝液(pH 5.8)970μLを加え、40℃に加温した。経時的にマイクロピペットにより0.5μLのサンプリングを行い、質量分析用プレートに試料溶液をスポットし、放置することにより溶媒を蒸発乾固させ測定試料とした。試験例3と同様の条件にて質量分析を行った。反応スキームを以下に示す。
【0211】
【化40】

【0212】
それぞれの試料スポットから3つのマススペクトルを取得し、シグナル面積比の平均値を測定データとして利用した。各時間の化合物16’(m/z=551)の加水分解生成物19(m/z=389)に対するシグナル面積比に対して、図3から得られる応答経験式に基づき算出された質量差に基づく応答ファクター1.52を乗じることにより、加水分解生成物19の量(nmol)を算出した。加水分解生成物の量を経時変化を図7に示す。
【0213】
測定した濃度領域において加水分解生成物の増大は良好な直線関係となっていることが判明した。このように、本発明の方法により酵素反応の初速度を容易に決定することが可能である。尚、本分析系では比較的高濃度(約100mM)のリン酸バッファーが共存していたが、シグナルの定量性が損なわれることがないことを示している。
【産業上の利用可能性】
【0214】
本発明の質量分析用イオン化標識剤を利用することにより、従来のMALDIでは困難であった様々な測定が飛躍的に容易又は可能になるものと期待され、効率的な測定キット、アッセイキットなど多方面への応用が可能である。
【図面の簡単な説明】
【0215】
【図1】本発明のイオン化標識剤で標識されたベンジルアミンの定量性(検量線)を示すグラフである(試験例1)。
【図2】本発明のイオン化標識剤で標識されたベンジルアミンのMSスペクトルである(試験例2)。
【図3】本発明のイオン化標識剤で標識された化合物について、縦軸に相対強度log(面積比)、横軸にlog(m/z)をプロットしたグラフである。(試験例3)
【図4】化合物5とβ−フェネチルアミンとの2次反応をモニタリングしたグラフである。(試験例4)
【図5】化合物17とn−プロピルアミンの反応液の5時間後のLDI−MSスペクトルである。(試験例5)
【図6】本発明のイオン化標識剤で標識された化合物について、縦軸に相対強度log(面積比)、横軸にlog(m/z)をプロットしたグラフである。(試験例5)
【図7】本発明のイオン化標識剤で標識された化合物の酵素(β−グリコシダーゼ)反応について、生成物と時間との関係を示すグラフである。(試験例6)
【技術分野】
【0001】
本発明は、各種試料を高感度かつ定量的に質量分析することを可能とする新規概念に基づく質量分析用イオン化標識剤およびそれを用いた質量分析法に関する。
【背景技術】
【0002】
質量分析法は、幅広く化学、生物学などの分子を扱う科学において必須の分子測定法である。その際だった特徴は、分子量の情報に基づく優れた分子定性能である。加えて、質量分析は破壊的測定法であるものの、一般に高感度分析が可能であるため、測定試料の要求量は極めて小さく、測定機器の普及に伴い、その重要性、汎用性は益々高まって行くものと考えられる。
【0003】
質量分析法は、大きく分けて1)イオン化法と2)分子ふるい部分に分けて考えることができる。イオン化法としては,エレクトロンインパクト(EI)、ケミカルイオン化(CI)、高速原子衝突イオン化(FAB)、エレクトロスプレーイオン化(ESI)、大気圧イオン化(API)、コールドスプレーイオン化(CSI)そしてマトリックス支援レーザー脱離イオン化(MALDI)などが開発されており、分子ふるい部である2重収束型質量分析法,四重極型質量分析法(Q-MS)、飛行時間型質量分析法(TOF-MS)などと組み合わせて広く利用されている。
【0004】
既存のイオン化法は、外部からの物理的なエネルギーを標的試料に加えることによって標的分子のイオン化を促す方法であり、一般的に多くの化合物を網羅的に測定可能とするものの幾つかの解決されるべき問題点を残している。例えば、1)塩などの夾雑物の影響により目的分子イオンが観察できない場合がある(夾雑物の存在に弱い)、2)イオン化し易さが分子により大きく異なり、観察し難い分子がある、3)微妙な試料状態、分析条件変化、分子構造の違いで試料分子のレスポンスファクターが変化し易いため、定量解析が一般に難しいなどを挙げることができる。
【0005】
特定の標的分子を解析し、その質量変化を定量的に見積もるためには、安定したイオン化を可能とするイオン化標識の導入が効果的であると考えられる。この様な背景の下、イオン化を促進するための標識試薬の開発がなされており、これまでに、オリゴ糖のネガティヴモード検出を目的とした2−アミノベンズアミド(非特許文献1)、特定のマトリックスとの組み合わせによりイオン化を促進する2−ニトロベンゼンスルフェニルクロリド(特許文献1)、グアニジウム基の導入のための糖鎖標識試薬(特許文献2)などのマトリックス支援レーザー脱離イオン化飛行時間型質量分析法(MALDI−TOF−MS)におけるイオン化を促進するための各種標識試薬が報告されている。
【0006】
MALDI−TOF−MSは、従来イオン化が困難であった高分子量の生体分子を安定かつ高感度にイオン化することを可能にし、ポストゲノムにおけるプロテオーム解析の必須アイテムになっている。しかし、MALDI−TOF−MSは高濃度のマトリックスを必要とするため、1)低分子量領域でマトリックスに由来するイオンピークがバックグランドとして発生して低分子化合物の分析が困難である、2)試料の層厚を増して、試料分布の不均一とレーザー光線のエネルギー伝播の不均一をもたらし、また、3)イオン化されたマトリックスを介する複雑なメカニズムでイオン化されるので、再現性に欠けるという問題があった。また、一般的にマトリックスと試料化合物との混合結晶を予め調製し、さらにレーザー光線の照準を混合結晶に合わせるなどのテクニックを要し、自動化が困難であるため、高速液体クロマトグラフィー(HPLC)、キャピラリー電気泳動(CE)等の分離精製機器とのオンライン分析が困難であった。
【0007】
この様な背景の下、レーザーイオン化において、試料の分子構造、分析条件、夾雑物、マトリックスなどによるレスポンスファクターの影響を受けにくく、さらにマトリックスに依存することなく安定したイオン化を可能にするイオン化標識剤を開発することができれば、生命科学をはじめとする各種分野において、再現性、定量性が高い質量分析を簡便に行うことを可能にする革新的なツールになるものと期待できるが、そのような標識剤は未だ開発されていない。
【特許文献1】特開2006-10672号公報
【特許文献2】特開2005-291958号公報
【非特許文献1】Analytical Chemistry, 第77巻, 2005年, p.6954-6959
【非特許文献2】Organic Letters, 第3巻, 第2号, 2001年, p.255-257
【非特許文献3】Journal of the American Chemical Society, 第122巻, 2000年, p.2687-2697
【非特許文献4】Bioorganic & Medicinal Chemistry Letters, 第6巻, 1996年, p.979-982
【非特許文献5】The Journal of Organic Chemistry, 第62巻, 1997年, p.2370-2380
【非特許文献6】Journal of Combinatorial Chemistry, 第5巻, 2003年, p.814-820
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明の目的は、分子構造、分析条件、夾雑物、マトリックスなどによりレスポンスファクターの影響を受けにくく、レスポンスファクターが安定したレーザーイオン化を可能にする質量分析用標識剤を提供することである。
【課題を解決するための手段】
【0009】
本発明者らは、レーザー光線によるイオン開裂が可能な部位を標識化によって試料化合物に付与すれば、マトリックスに依存しない安定したイオン化を実現できるのではないかとの着想に想到した。
【0010】
光エネルギーを吸収することにより開裂してイオン化する分子は、有機合成の分野において、光による穏和な条件下における選択的脱保護が可能な保護基として数多くの化合物が報告されており(例えば、非特許文献2および3)、支持固相担体の上でペプチド等の分子を連続的に合成する固相合成におけるリンカーとしても利用されている(例えば、非特許文献4および5)。近年、光開裂性リンカーを有する固相を利用したコンビナトリアル合成において、化合物が保持された樹脂を直接レーザー脱離イオン化(LDI)に付すことにより、標的分子の切り出しと同時に、マトリックスを用いることなくカルボキシレートを検出することが可能であることが報告されている(非特許文献6参照)。これら光開裂性分子を利用する技術は、有機合成における脱保護や固相からの切り離しに関するものであり、質量分析用標識剤への利用を示唆するものではなく、光開裂性分子をイオン化促進のために質量分析用標識剤(イオン化標識剤)に利用するという概念はこれまで存在していない。
【0011】
本発明者らは、質量分析用イオン化標識剤に光開裂性分子を利用する着想のもと、レーザー照射によって効率的にイオン開裂しうる結合を標識化により試料化合物に付与したところ、開裂によりイオン化された標識化試料化合物を高感度かつ定量的に質量分析できることを見出し、本発明を完成するに至った。
すなわち、本発明は以下のとおりである。
[1]レーザー照射によってイオン対に開裂するイオン開裂部分および他の物質と結合を形成しうる結合基を有する化合物からなることを特徴とする、質量分析用イオン化標識剤。
[2]化合物が中性分子である、上記[1]記載の質量分析用イオン化標識剤。
[3]結合基がアニオンに開裂する部分構造中に存在する、上記[1]または[2]記載の質量分析用イオン化標識剤。
[4]イオン開裂部分が、カルボカチオンと(チオ)フェノール性アニオンに開裂し得る(チオ)エーテル結合を含む、上記[1]〜[3]のいずれかに記載の質量分析用イオン化標識剤。
[5]カルボカチオンが共役系スペーサーを介するかまたは介さないで電子求引性基を少なくとも1つ有する、上記[4]記載の質量分析用イオン化標識剤。
[69カルボカチオンがベンジルカチオンである、上記[4]または[5]記載の質量分析用イオン化標識剤。
[7](チオ)フェノール構造に共役する不飽和結合を有する基を有する、上記[4]〜[6]のいずれかに記載の質量分析用イオン化標識剤。
[8]質量分析用イオン化標識剤を構成する化合物が、式(I)
【0012】
【化1】

【0013】
(式中、R1、R2およびR3は独立して、水素原子または任意の置換基を示し、Xは酸素原子または硫黄原子を示し、Wは単結合またはカルボニル基を示し、Yは単結合または任意の構造を有するスペーサーを示し、Zは他の物質と結合を形成しうる結合基を示し、環Aは独立して1以上の任意の置換基を有していてもよい。)で表される(チオ)エーテル化合物である、上記[4]記載の質量分析用イオン化標識剤。
[9]R1、R2およびR3の少なくとも一つが、共役系スペーサーを介するかまたは介さない電子求引性基、または該電子求引性基を少なくとも一つ有し、さらに任意の置換基を有していてもよいフェニル基である、上記[8]記載の質量分析用イオン化標識剤。
[10]電子求引性基が、ニトロ基、シアノ基、ハロゲン原子、カルボニル基、ホスホリル基、スルホニル基および電子欠乏型複素環基から選ばれる、上記[9]記載の質量分析用イオン化標識剤。
[11]Xが酸素原子である、上記[8]〜[10]のいずれかに記載の質量分析用イオン化標識剤。
[12]Zが、カルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基である、上記[8]〜[11]のいずれか一項に記載の質量分析用イオン化標識剤。
[13]環Aが環Aに共役する不飽和結合を有する基を有する、上記[8]〜[12]のいずれか一項に記載の質量分析用イオン化標識剤。
【0014】
[14]試料化合物に上記[1]〜[13]のいずれかに記載の質量分析用イオン化標識剤を作用させて標識する工程、得られた標識化試料化合物にレーザーを照射してイオン化する工程、およびイオン化された標識化試料化合物を質量分離部にて分離する工程を含むことを特徴とする質量分析法。
[15]飛行時間型質量分析法によってイオンを分離する、上記[14]記載の質量分析法。
[16]試料化合物の定量分析を行う、上記[14]または[15]記載の質量分析法。
[17]試料化合物の反応をモニターする、上記[14]または[15]記載の質量分析法。
[18]式(I’)
【0015】
【化2】

【0016】
(式中、R1’、R2’およびR3’は独立して、水素原子;アルキル基;アルコキシ基;ハロゲン原子、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基およびパーフルオロアルキル基から選ばれる電子求引性基;または該電子求引性基を少なくとも一つ有し、さらにアルキル基およびアルコキシ基から選ばれる1以上の置換基を有していてもよいフェニル基を示し、Xは酸素原子または硫黄原子を示し、Y’は単結合、フェニレン基または炭素数1〜17の飽和または不飽和の炭化水素鎖(該炭化水素鎖は、オキソ、アルキル基、アルケニル基、アルキニル基およびアリール基から選ばれる1以上の置換基を有していてもよく、構成炭素原子の1以上が、酸素原子、窒素原子および硫黄原子から選ばれるヘテロ原子またはフェニレン基で置き換わってもよい。)からなるスペーサーを示し、Z’はカルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基を示し、環A’は独立して、アルキル基、アルコキシ基、チオアルコキシ基、アルケニル基、アルキニル基、アリール基、ヘテロアリール基、カルボニル基、シアノ基、ハロゲン原子、ニトロ基、ホスホリル基およびスルホニル基から選ばれる1以上の置換基を有していてもよい。)で表される(チオ)エーテル化合物。
[19]Xが酸素原子である、上記[18]記載の化合物。
[20]上記[18]または[19]記載の化合物の、質量分析用イオン化標識剤としての使用。
【発明の効果】
【0017】
レーザー光によるイオン開裂を利用するという新規概念に基づく質量分析用のイオン化標識剤の開発に初めて成功した。本発明の質量分析用イオン化標識剤は以下に示す様々な利点を有し、質量分析の適用範囲を各段に広げる革命的なツールである。
(1)本発明の標識剤で標識された試料は、一定条件下で確実にイオン化することができるので、定量性の高いデータが得られる。
(2)本発明の標識剤で標識された試料はレーザーにより直接イオン化され、そのイオン化メカニズムがMALDI−MSに比べシンプルであるので、イオン化のレスポンスファクターが構造の多様性、塩などの夾雑物の存在、分析条件などに影響されにくく、分子量のみに依存する傾向がある。したがって、予めシグナル強度と分子量との相関の経験式を得ておけば、内部標準法などを併用することにより試料濃度を定量的に分析することが可能である。
(3)低濃度のサンプルで短時間の測定が可能であり、定量分析も可能であり、さらに夾雑物の影響も受けにくいので、試料化合物の反応の進行をモニターするのにも適している。さらに、複数の生成物が得られる反応や中間体を経由して段階的に進行する反応においても、それぞれの生成物などのシグナル強度を経験式から補正可能であるので、応用範囲が広い。
(4)MALDIと同程度の試料濃度(数pM)で測定可能であり、しかも、MALDIに比べ格段に安定したスペクトル再現性が得られる。
(5)比較的低分子量の化合物では、マトリックスの支援を要することなく質量分析することが可能になる。したがって、MALDIでは困難であった低分子量化合物の分析も可能となり、また、マトリックスとの混合結晶を調製する必要がないので、HPLC等とのハイフネーションが容易となる。さらに、レーザー照射により直接イオンが発生するためイオン化メカニズムがシンプルであり、全てのイオンは同じタイミングでドリフト空間に導入される。したがって、マトリックスとサンプルの混合結晶における不均一やレーザーエネルギー伝播の不均一などの問題はなく、再現性の良いスペクトルが得られる。
(6)本発明の標識剤で標識された試料化合物をマトリックスの支援下で質量分析する場合においても、既存のMALDI−MS法に対して、標的分子のイオン化しやすさを考慮したマトリックスの選択を行なう必要がないことから、例えば、結晶性、分散性などの観点から、従来よりも格段に幅広い範囲の化合物をマトリックスとして利用可能であるという利点がある。
(7)結合基を適宜選択することにより、特定の官能基を標的とした質量分析が可能となる。
(8)特別なテクニックを要することなく、通常の手法により簡便に分析できる。
(9)通常の有機合成手法により安価に調製することができる。
また、試料化合物分子の複数箇所を標識することにより多価イオンに誘導し、より高分子量の測定も可能になると考えられる。
【発明を実施するための最良の形態】
【0018】
以下、本発明について詳細に説明する。
1.置換基の説明
以下に、本発明で使用される置換基を詳述する。
本発明において「アルキル基」としては、炭素数1〜30の直鎖または分枝のアルキル基、例えばメチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec−ブチル、tert−ブチル、ペンチル、イソペンチル、ネオペンチル、ヘキシル、2−エチルブチル、ヘプチル、オクチル、ノニル、デシル、ウンデシル、ドデシル、トリデシル、ヘキサデシル、ペンタデシル、ヘキサデシル、ヘプタデシル、オクタデシル等が挙げられる。
【0019】
本発明において「パーフルオロアルキル基」としては、水素原子のすべてがフッ素原子で置換された炭素数1〜30の直鎖または分枝のアルキル基、例えばトリフルオロメチル、ペンタフルオロエチル、ヘプタフルオロプロピル、ヘプタフルオロイソプロピル、ノナフルオロブチル、ノナフルオロイソブチル、ノナフルオロ−sec−ブチル、ノナフルオロ−tert−ブチル、ウンデカフルオロペンチル、ウンデカフルオロイソペンチル、ウンデカフルオロネオペンチル、トリデカフルオロヘキシル、2−(ペンタフルオロエチル)オクタフルオロブチル、ペンタデカフルオロヘプチル、ヘプタデカフルオロオクチル、ノナデカフルオロノニル、ヘンイコサフルオロデシル、トリコサフルオロウンデシル、ペンタコサフルオロドデシル等が挙げられる。
【0020】
本発明において「アルコキシ基」としては、炭素数1〜30の直鎖または分枝のアルコキシ基、例えばメトキシ、エトキシ、プロポキシ、イソプロポキシ、ブトキシ、イソブトキシ、sec−ブトキシ、tert−ブトキシ、ペントキシ、イソペントキシ、ネオペントキシ、ヘキシルオキシ、ヘプチルオキシ、オクチルオキシ、ノニルオキシ、デシルオキシ、ウンデシルオキシ、ドデシルオキシ、トリデシルオキシ、ヘキサデシルオキシ、ペンタデシルオキシ、ヘキサデシルオキシ、ヘプタデシルオキシ、オクタデシルオキシ等が挙げられる。
【0021】
本発明において「チオアルコキシ基」としては、炭素数1〜30の直鎖または分枝のチオアルコキシ基、例えばチオメトキシ、チオエトキシ、チオプロポキシ、チオイソプロポキシ、チオブトキシ、チオイソブトキシ、sec−チオブトキシ、tert−チオブトキシ、チオペントキシ、チオイソペントキシ、チオネオペントキシ、チオヘキシルオキシ、チオヘプチルオキシ、チオオクチルオキシ、チオノニルオキシ、チオデシルオキシ、チオウンデシルオキシ、チオドデシルオキシ、チオトリデシルオキシ、チオヘキサデシルオキシ、チオペンタデシルオキシ、チオヘキサデシルオキシ、チオヘプタデシルオキシ、チオオクタデシルオキシ等が挙げられる。
【0022】
本発明において「ハロゲン原子」とは、フッ素原子、塩素原子、臭素原子またはヨウ素原子である。
【0023】
本発明において「アルケニル基」としては、炭素数2〜30の直鎖または分枝のアルケニル基、例えばビニル、1−プロペニル、2−プロペニル、イソプロペニル、1−ブテニル、2−ブテニル、3−ブテニル、1−イソブテニル、2−イソブテニル、1−sec−ブテニル、2−sec−ブテニル、1−ペンテニル、1−イソペンテニル、1−ヘキセニル、1−ヘプテニル、1−オクテニル、1−ノネニル、1−デセニル、1−ウンデセニル、1−ドデセニル、1−トリデセニル、1−ヘキサデセニル、1−ペンタデセニル、1−ヘキサデセニル、1−ヘプタデセニル、1−オクタデセニル等が挙げられる。
【0024】
本発明において「アルキニル基」としては、炭素数2〜30の直鎖または分枝のアルキニル基、例えばエチニル、1−プロピニル、2−プロピニル、1−ブチニル、2−ブチニル、3−ブチニル、2−sec−ブチニル、1−ペンチニル、1−イソペンチニル、1−ヘキシニル、1−ヘプチニル、1−オクチニル、1−ノニニル、1−デシニル、1−ウンデシニル、1−ドデシニル、1−トリデシニル、1−ヘキサデシニル、1−ペンタデシニル、1−ヘキサデシニル、1−ヘプタデシニル、1−オクタデシニル等が挙げられる。
【0025】
本発明において「モノアルキルアミノ基」とは、炭素数1〜30の直鎖または分枝のアルキル基を1つ有するアミノ基、例えばメチルアミノ、エチルアミノ、プロピルアミノ、イソプロピルアミノ、ブチルアミノ、イソブチルアミノ、sec−ブチルアミノ、tert−ブチルアミノ、ペンチルアミノ、イソペンチルアミノ、ネオペンチルアミノ、ヘキシルアミノ、2−エチルブチルアミノ、ヘプチルアミノ、オクチルアミノ、ノニルアミノ、デシルアミノ、ウンデシルアミノ、ドデシルアミノ、トリデシルアミノ、ヘキサデシルアミノ、ペンタデシルアミノ、ヘキサデシルアミノ、ヘプタデシルアミノ、オクタデシルアミノ等が挙げられる。
【0026】
本発明において「ジアルキルアミノ基」とは、炭素数1〜30の直鎖または分枝の同一または異なる2個のアルキル基を有するアミノ基、例えばジメチルアミノ、ジエチルアミノ、ジプロピルアミノ、ジイソプロピルアミノ、ジブチルアミノ、ジイソブチルアミノ、ジ−sec−ブチルアミノ、ジ−tert−ブチルアミノ、ジペンチルアミノ、ジイソペンチルアミノ、ジネオペンチルアミノ、ジヘキシルアミノ、ジ2−エチルブチルアミノ、ジヘプチルアミノ、ジオクチルアミノ、ジノニルアミノ、ジデシルアミノ、ジウンデシルアミノ、ジドデシルアミノ、ジトリデシルアミノ、ジヘキサデシルアミノ、ジペンタデシルアミノ、ジヘキサデシルアミノ、ジヘプタデシルアミノ、ジオクタデシルアミノ、N−メチル−N−エチルアミノ、N−メチル−N−プロピルアミノ、N−メチル−N−イソプロピルアミノ、N−メチル−N−ブチルアミノ、N−メチル−N−イソブチルアミノ、N−メチル−N−sec−ブチルアミノ、N−メチル−N−tert−ブチルアミノ、N−メチル−N−ペンチルアミノ、N−メチル−N−イソペンチルアミノ、N−メチル−N−ネオペンチルアミノ、N−メチル−N−ヘキシルアミノ、N−メチル−N−2−エチルブチルアミノ、N−メチル−N−ヘプチルアミノ、N−メチル−N−オクチルアミノ、N−メチル−N−ノニルアミノ、N−メチル−N−デシルアミノ、N−メチル−N−ウンデシルアミノ、N−メチル−N−ドデシルアミノ、N−メチル−N−トリデシルアミノ、N−メチル−N−ヘキサデシルアミノ、N−メチル−N−ペンタデシルアミノ、N−メチル−N−ヘキサデシルアミノ、N−メチル−N−ヘプタデシルアミノ、N−メチル−N−オクタデシルアミノ等が挙げられる。
【0027】
本発明において「アリール基」とは、炭素数6〜22個の芳香族炭化水素環から誘導される1価の基であり、例えば、フェニル基、ナフチル基、アントリル基、フェナントリル基などが挙げられる。
【0028】
本発明において「ヘテロアリール基」とは、炭素原子以外に酸素原子、硫黄原子及び窒素原子から選ばれるヘテロ原子を1〜7個含む5〜6員の芳香性を有する単環性複素環または縮合複素環から誘導される1価の基であり、例えば、チエニル基、フリル基、ピロリル基、イニダゾリル基、オキサゾリル基、チアゾリル基、ピラゾリル基、イソキサゾリル基、イソチアゾリル基、トリアゾリル基、テトラゾリル基、フラザニル基、ピリジル基、ピリミジニル基、ピリダジニル基、ピラジニル基、トリアジニル基、テトラジニル基、インドリル基、イソインドリル基、インドリジニル基、インダゾリル基、ベンゾフリル基、イソベンゾフリル基、ベンゾチエニル基、イソベンゾチエニル基、ベンズイミダゾリル基、キノリル基、イソキノリル基、1,8−ナフチリジニル基、キノキサリニル基、キナゾリニル基、シンノリニル基、フタラジニル基、フェナントリジニル基、アクリジニル基、ペリミジニル基、フェナントロリニル基、フェナジニル基などが挙げられる。
【0029】
本発明において「カルボニル基」とは、カルボニル基を含む基を意味し、例えば、アルキル−カルボニル基、アルコキシ−カルボニル基(アルコキシカルボニル基)、チオアルコキシ−カルボニル基、アリール−カルボニル基、アリール−オキシ−カルボニル基、ヘテロアリール−カルボニル基、ヘテロアリール−オキシ−カルボニル基、アルケニル−カルボニル基、アルキニル−カルボニル基、アミノ−カルボニル基(カルバモイル基)、モノアルキルアミノ−カルボニル基(モノアルキルカルバモイル基)、ジアルキルアミノ−カルボニル基(ジアルキルカルバモイル基)などが挙げられる。ここで、部分構造として用いられる「アルキル」、「アルコキシ」、「チオアルコキシ」、「アリール」、「ヘテロアリール」、「アルケニル」、「アルキニル」、「モノアルキルアミノ」および「ジアルキルアミノ」は、それぞれ上記で定義したものと同義である。
【0030】
本発明において「スルホニル基」とは、スルホニル基を含む基を意味し、例えば、アルキル−スルホニル基、アルコキシ−スルホニル基、アリール−スルホニル基、アリール−オキシ−スルホニル基、ヘテロアリール−スルホニル基、ヘテロアリール−オキシ−スルホニル基、アルケニル−スルホニル基、アルキニル−スルホニル基、アミノ−スルホニル基(スルファモイル基)、モノアルキルアミノ−スルホニル基(モノアルキルスルファモイル基)、ジアルキルアミノ−スルホニル基(ジアルキルスルファモイル基)などが挙げられる。ここで、部分構造として用いられる「アルキル」、「アルコキシ」、「アリール」、「ヘテロアリール」、「アルケニル」、「アルキニル」、「モノアルキルアミノ」および「ジアルキルアミノ」は、それぞれ上記で定義したものと同義である。
【0031】
本発明において「ホスホリル基」とは、ホスホリル基を含む基を意味し、例えば、ジアルキル−ホスホリル基、ジアリール−ホスホリル基、ジヘテロアリール−ホスホリル基、ジアルケニル−ホスホリル基、ジアルキニル−ホスホリル基などが挙げられる。ここで、部分構造として用いられる「アルキル」、「アリール」、「ヘテロアリール」、「アルケニル」および「アルキニル」は、それぞれ上記で定義したものと同義である。
【0032】
本発明において「ハロゲノスルホニル基」としては、クロロスルホニル基、ブロモスルホニル基などが挙げられる。
【0033】
本発明において「フェニレン基」としては、o−フェニレン基、m−フェニレン基およびp−フェニレン基が挙げられる。
【0034】
本発明において「電子欠乏型複素環基」とは、少なくとも1つの電気陰性な窒素原子を含む、(4n+2)個(nは自然数)の原子から構成される芳香族化合物で構成される基であり、例えば、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル、キナゾリニル、キノキサリニル、アクリジニルなどが挙げられる。
【0035】
2.質量分析用イオン化標識剤
「質量分析用イオン化標識剤」とは、質量分析の対象となる試料化合物と結合を形成して標識し、標識化された試料化合物の分子量を計測するためのイオン化、具体的にはレーザー光照射によるイオン化を促進するための化合物を意味する。
【0036】
本発明の質量分析用イオン化標識剤は、レーザー照射によりイオン対(カチオンとアニオン)に開裂し得る部分(イオン開裂部分)、さらに構造中に他の物質と結合を形成しうる結合基(以下、単に「結合基」と省略することがある。)を有する化合物(以下、「レーザー開裂性化合物」と呼ぶことがある。)から構成されることを特徴とする。
【0037】
【化3】

【0038】
本明細書中、レーザー開裂性化合物において、カチオンに開裂する部分を「カチオンパート」、アニオンに開裂する部分構造を「アニオンパート」と呼ぶものとする。
【0039】
本発明のレーザー開裂性化合物において、「レーザー照射によってイオン対に開裂するイオン開裂部分」としては、かかる作用を有する結合を含む部分構造を意味する。
レーザー照射によってイオン対に開裂する結合としては、カルボカチオンとカルボキシレートに開裂しうるエステル結合、カルボカチオンとオキサイドに開裂しうるエーテル結合、カルボカチオンとチオオキサイドに開裂しうるチオエーテル結合などが挙げられる。なかでも、質量分析において高い感度が得られることから、エステル結合、エーテル結合、チオエーテル結合が好ましく、カルボカチオンと(チオ)フェノール性アニオンに開裂し得る(チオ)エーテル結合がさらに好ましい。
【0040】
本発明のレーザー開裂性化合物は、好ましくは中性分子である。本発明において、「中性分子」とは、それ自身で構造中にイオン性の電荷を有さない分子、あるいは溶液中に溶解したときにイオンに解離しない分子を意味する。
本発明のレーザー開裂性化合物は中性分子でない場合においても使用可能であるが、分子中にイオン性の部分構造などが存在すると、レーザーイオン脱離過程に緩衝作用を及ぼし、シグナルの減弱または消失、あるいは開裂したシグナルと開裂していないシグナルなどの複数のシグナルを与え、効率的な質量分析や定量的な測定が困難になる場合がある。
【0041】
以下に、レーザー開裂性化合物を構成するアニオンパート、カチオンパートおよび結合基について詳述する。
2−1.アニオンパート
アニオンパートは、レーザー開裂性化合物が開裂してアニオンになる部分構造である。
【0042】
アニオンパートとしては、レーザー照射によってイオン対に開裂する結合がエステル結合の場合はカルボキシレートを含む構造、エーテル結合の場合はオキサイドを含む構造、チオエーテル結合の場合はチオオキサイドを含む構造、フェノール性(チオ)エーテル結合の場合は(チオ)フェノキサイドを含む構造などが挙げられ、(チオ)フェノキサイドを含む構造が好ましい。
【0043】
以下に、アニオンパートの好ましい態様である(チオ)フェノキサイドを含む部分構造(以下、「(チオ)フェノール性アニオンパート」と呼ぶことがある。)について詳述するが、アニオンパートがこれに限定されないことは言うまでもない。
【0044】
(チオ)フェノール性アニオンパートとは、芳香族炭化水素環または芳香族複素環の任意の位置に酸素原子または硫黄原子が直接結合した構造を意味する。すなわち、(チオ)フェノール性アニオンパートは、−X−(芳香族炭化水素環)または−X−(芳香族複素環)で表される構造を有する(Xは酸素原子または硫黄原子を示す)。
【0045】
芳香族炭化水素環の炭素数は、6〜22個が好ましい。具体例としては、ベンゼン、ナフタレン、アントラセン、フェナントレン、ピレン、ベンゾフェナントレン、クリセン、ペンタセン、ピセンなどが挙げられる。
【0046】
芳香族複素環は、炭素原子以外に酸素原子、硫黄原子及び窒素原子から選ばれるヘテロ原子を1〜7個含む5〜6員の芳香性を有する単環性複素環または縮合複素環が挙げられる。具体例としては、チオフェン、フラン、ピロール、イミダゾール、オキサゾール、チアゾール、ピラゾール、イソキサゾール、イソチアゾール、トリアゾール、テトラゾール、フラザン、ピリジン、ピリミジン、ピリダジン、ピラジン、トリアジン、テトラジン、インドール、イソインドール、インドリジン、インダゾール、ベンゾフラン、イソベンゾフラン、ベンゾチオフェン、イソベンゾチオフェン、ベンズイミダゾール、キノリン、イソキノリン、1,8−ナフチリジン、キノキサリン、キナゾリン、シンノリン、フタラジン、フェナントリジン、アクリジン、ペリミジン、フェナントロリン、フェナジン等が挙げられる。
【0047】
芳香族炭化水素環および芳香族複素環は、本発明が奏する効果を損なわない限度において、独立して1以上の任意の置換基を有していてもよい。係る置換基としては、例えばアルキル基、アルコキシ基、チオアルコキシ基、アルケニル基、アルキニル基、アリール基、ヘテロアリール基、カルボニル基、シアノ基、ハロゲン原子、ニトロ基、ホスホリル基、スルホニル基等が挙げられるが、特に(チオ)フェノール構造に共役する不飽和結合を有する基がレーザー照射によるイオン開裂を促進するため好ましい。
【0048】
「(チオ)フェノール構造に共役する不飽和結合を有する基」としては、アリール基、ヘテロアリール基、シアノ基、ニトロ基、ホスホリル基の他、下記式で表される置換基が挙げられる。
【0049】
【化4】

【0050】
(式中、R4、R5、R6およびR7は独立して、水素原子、アルキル基、アリール基、アルケニル基またはアルキニル基を示す。)
また、下記式で表されるような2価の基が(チオ)フェノール構造と縮合環を形成する態様であってもよい。
【0051】
【化5】

【0052】
(式中、Y1は−CH−、−NH−、酸素原子または硫黄原子を示し、n1は1〜3の整数を示す。)
また、「(チオ)フェノール構造に共役する不飽和結合を有する基」は、可能である限り、アルキル基、アルコキシ基、ハロゲン原子、アルコキシカルボニル基、ニトロ基、シアノ基、ハロゲン原子、カルボニル基、ホスホリル基、スルホニル基等の置換基をさらに有していてもよい。
【0053】
以下に、(チオ)フェノール性アニオンパートの具体例を示す。
【0054】
【化6】

【0055】
(式中の各記号は前記と同義である。)
2−2.カチオンパート
カチオンパートは、レーザー開裂性化合物が開裂してカチオンになる部分構造である。
【0056】
カチオンパートとしては、レーザー照射によってイオン対に開裂する結合がエステル結合、エーテル結合またはチオエーテル結合、あるいは(チオ)フェノール性エーテル結合の場合はカルボカチオンを含む構造などが挙げられる。
【0057】
以下に、カチオンパートの好ましい態様であるカルボカチオンを含む部分構造(以下、「カルボカチオンパート」と呼ぶことがある。)について詳述するが、カチオンパートがこれに限定されないことは言うまでもない。
カルボカチオンパートは、任意の置換基を1つ以上有していてもよいメチル基で表される。
【0058】
カルボカチオンパートが有していてもよい任意の置換基としては、アルキル基、アルコキシ基、ハロゲン原子、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基、パーフルオロアルキル基などから自由に選択することができるが、電子求引性基を少なくとも1つ有する態様がレーザー光によるイオン開裂を起こし易くするため好ましい。
当該電子求引性基はカルボカチオンパートに直接結合してもよいが、開裂後のカチオンパートを安定化することにより効率的な開裂を促進するという理由から、共役系スペーサーをカルボカチオンパートとの間に介する態様が好ましい。
【0059】
電子求引性基としては、ハロゲン原子、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基、パーフルオロアルキル基などが挙げられる。
電子求引性基の具体例を下記式に列挙する。
【0060】
【化7】

【0061】
(式中、R8、R9およびR10は独立して、水素原子、アルキル基、アリール基、アルケニル基またはアルキニル基を示し、Rfはパーフルオロアルキル基を示す。)
【0062】
共役系スペーサーとは、パイ電子を介して電子求引性をイオン開裂する結合に伝達し得る2価の基であり、例えば、
【0063】
【化8】

【0064】
など、またはこれらを2個以上組み合わせたものが挙げられる。これら共役系スペーサーは、置換可能な位置に、アルキル基、アルコキシ基、アリール基、ハロゲン原子、アルケニル基、アルキニル基、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基などの置換基をさらに有していてもよい。
【0065】
カルボカチオンパートはベンジル基が好ましく、該ベンジル基のベンゼン環状の任意の位置に少なくとも1つの電子求引性基を有する態様がさらに好ましい。
ベンジル基のベンゼン環が有する電子求引性基は、上記と同様のものが挙げられ、さらに、置換可能な位置に、アルキル基、アルコキシ基、アリール基、ハロゲン原子などの置換基を有していてもよい。
カルボカチオンパートの具体例を以下に列挙する。
【0066】
【化9】

【0067】
【化10】

【0068】
(式中、R11およびR12は独立して、アルキル基、アリール基、ハロゲン原子、アルケニル基、アルキニル基または上記で定義された電子求引性基を示し、R13はアルキル基、アリール基、アルケニル基、アルキニル基を示し、他の記号は前記と同義である。)
2−3.結合基
本発明のレーザー開裂性化合物には、他の物質と結合を形成するための結合基が存在することが必要である。
「他の物質」とは、結合基と結合を形成しうる官能基または構造を有する試料化合物を意味する。
結合基によって形成される結合とは共有結合に限定されず、水素結合、配位結合、キレート結合なども包含されるが、試料化合物の特定の官能基との反応により形成される共有結合が好ましい。
かかる結合基はレーザー開裂性化合物のいかなる部位に存在しても標識剤としての機能を損なうものではないが、定量的取扱を行うために、フラグメンテーションを生じにくい負イオンモードによりマススペクトルを得ることが好ましいという理由から、結合基がアニオンパートに存在する態様が好ましい。
【0069】
結合基は可能である限り、レーザー開裂性化合物のいかなる部位に存在してもよく、レーザー開裂性化合物に置換基が存在する場合には、該置換基上に存在していてもよい。
さらには、結合基がレーザー開裂性化合物に2以上存在する態様も許容される。
【0070】
結合基としては、カルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基、ジスルフィド基などが挙げられる。
【0071】
結合基の例示と、各々の結合基と結合する官能基または構造、および形成される結合を表1−1〜3に示す。
【0072】
【表1−1】

【0073】
【表1−2】

【0074】
【表1−3】

【0075】
結合基はレーザー開裂性化合物に直接結合していてもよいし、任意の構造を有するスペーサーを介して結合してもよい。スペーサーとしては、炭素原子、酸素原子、窒素原子、硫黄原子から選ばれる1〜100個の構成原子からなる直鎖または分岐鎖、2価の芳香族炭化水素環(フェニレン基、ナフチレン基など)、2価の芳香族複素環などが挙げられ、あるいはこれらを2個以上組み合わせた態様であってもよい。
また、該スペーサーは、アルキル基、アルコキシ基、ハロゲン原子、オキソ、チオキソ、アリール基、ヘテロアリール基、アルケニル基、アルキニル基などから選ばれる1以上の置換基を有していてもよい。
以下に、スペーサーの具体例を示す。
【0076】
【化11】

【0077】
(式中、n2、n3およびn4は独立して、1〜100の整数を示し、Raは水素原子またはアルキル基を示す。)
【0078】
2−4.レーザー開裂性化合物
本発明の質量分析用イオン化標識剤は、上記で定義された条件を満たすレーザー開裂性化合物であるかぎり如何なるものであってもよいが、好適には下記式(I)で表される(チオ)エーテル化合物である。
【0079】
【化12】

【0080】
(式中、R1、R2およびR3は独立して、水素原子または任意の置換基を示し、Xは酸素原子または硫黄原子を示し、Wは単結合またはカルボニル基を示し、Yは単結合または任意の構造を有するスペーサーを示し、Zは他の物質と結合を形成しうる結合基を示し、環Aは独立して1以上の任意の置換基を有していてもよい。)
【0081】
式(I)で表される(チオ)エーテル化合物において、R1、R2およびR3の少なくとも一つが、共役系スペーサーを介するかまたは介さない電子求引性基、または該電子求引性基を少なくとも一つに有し、さらに任意の置換基を有していてもよいフェニル基である態様が好ましい。
該電子求引性基としては、ニトロ基、シアノ基、ハロゲン原子、カルボニル基、ホスホリル基、スルホニル基または電子欠乏型複素環基が好ましい。
【0082】
Xとしては、酸素原子が好ましい。
Zとしては、カルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基が好ましい。
【0083】
Wとしては、カルボニル基が好ましい。
Wが単結合である場合は、環Aには、環Aに共役する不飽和結合を有する基が存在する態様が好ましい。「環Aに共役する不飽和結合を有する基」としては、上記で定義および例示された「(チオ)フェノール構造に共役する不飽和結合を有する基」と同様のものが挙げられる。
【0084】
なお、式(I)で表される(チオ)フェノール化合物のうち、下記式(I’)で表される化合物は新規化合物である。
【0085】
【化13】

【0086】
(式中、R1’、R2’およびR3’は独立して、水素原子;アルキル基;アルコキシ基;ハロゲン原子、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基およびパーフルオロアルキル基から選ばれる電子求引性基;または該電子求引性基を少なくとも一つ有し、さらにアルキル基およびアルコキシ基から選ばれる1以上の置換基を有していてもよいフェニル基を示し、Xは酸素原子または硫黄原子を示し、Y’は単結合、フェニレン基または炭素数1〜17の飽和または不飽和の炭化水素鎖(該炭化水素鎖は、オキソ、アルキル基、アルケニル基、アルキニル基およびアリール基から選ばれる1以上の置換基を有していてもよく、構成炭素原子の1以上が、酸素原子、窒素原子および硫黄原子から選ばれるヘテロ原子またはフェニレン基で置き換わってもよい。)からなるスペーサーを示し、Z’はカルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基を示し、環A’は独立して、アルキル基、アルコキシ基、チオアルコキシ基、アルケニル基、アルキニル基、アリール基、ヘテロアリール基、カルボニル基、シアノ基、ハロゲン原子、ニトロ基、ホスホリル基およびスルホニル基から選ばれる1以上の置換基を有していてもよい。)
【0087】
2−5.製法
本発明のレーザー開裂性化合物は、エステル結合、エーテル結合、チオエーテル結合などのレーザー照射によってイオン対に開裂する結合を含む化合物を製造するための自体公知の有機合成技術を用いて、容易に製造することができる。
(チオ)エーテル結合を有する式(I)で表される化合物を例にとって、以下に説明する。
【0088】
【化14】

【0089】
(式中、Lはハロゲン原子、メタンスルホニルオキシ基、p−トルエンスルホニルオキシ基などの脱離基を示し、Z1はZに変換可能な基を示す。他の記号は前記と同義である。)
Z1の「Zに変換可能な基」としては、自体公知の手法により1工程または複数工程を経てZに変換しうるものであればよく、例えば、Zがスクシンイミドオキシカルボニル基、アルコキシカルボニル基である場合はカルボキシル基、Zがマレイミジル基、イソ(チオ)シアネート基、クロロカルボニルアミノ基、アルコキシカルボニルアミノ基などの場合はアミノ基などが挙げられる。
【0090】
(チオ)フェノール(II)と化合物(III)とを塩基の存在下反応させることにより(チオ)エーテル化合物(I)を製造することができる(工程1)。
結合基Zは(チオ)エーテル結合形成の後に導入してもよい。その場合は、(チオ)フェノール(II’)と化合物(III)とを塩基の存在下反応させて(チオ)エーテル化合物(IV)をまず合成し(工程1’)、その後Z1をZに変換すればよい(工程2)。
なお、上記工程以外に、自体公知の手法を用いて、保護、脱保護、置換基変換、置換基導入、還元、酸化、エステル化、加水分解などの反応を必要に応じて追加して適宜行なっても良い。
【0091】
原料の(チオ)フェノール(II)、(チオ)フェノール(II’)および化合物(III)は、公知の方法によって合成することができ、また市販品を使用してもよい。(チオ)フェノール(II)は、(チオ)フェノール(II’)から工程2と同様な手法により合成してもよい。
【0092】
工程1および工程1’は、通常の(チオ)エーテル結合を合成する方法により行なうことができる。
化合物(III)は、(チオ)フェノール類に対して、1〜3当量程度用いられる。
【0093】
塩基としては、無機塩基(例えば、炭酸カリウム、炭酸ナトリウム、水酸化カリウム、水酸化ナトリウム、水素化ナトリウム等)または有機塩基(例えば、トリエチルアミン、ジイソプロピルエチルアミン、ピリジン、N−メチルモルホリン等)が挙げられる。
塩基の使用量は、(チオ)フェノール類に対して、1〜5当量程度である。
【0094】
反応は好ましくは溶媒中で行なわれる。溶媒としては反応を阻害しないかぎり制限されず、例えば、酢酸エステル類(例えば、酢酸エチル、酢酸イソプロピル、酢酸イソブチル、酢酸n−ブチルなど)、炭化水素類(例えば、ヘキサン、ヘプタン、トルエン、ベンゼン、キシレンなど)、ニトリル類(例えば、アセトニトリル、プロピオニトリルなど)、エーテル類(例えば、ジエチルエーテル、THF、ジオキサンなど)、アルコール類(例えば、エタノール、イソプロピルアルコール、n−ブタノールなど)、非プロトン性極性溶媒(N,N−ジメチルホルムアミド、ジメチルスルホキシドなど)などが挙げられ、これらは2種以上を併用してもよい。
【0095】
反応温度は、0℃〜80℃程度で行なわれ、通常1〜15時間程度で終了する。
【0096】
工程2は、Zに応じて、自体公知の手法で行えばよい。例えば、
(1)Zがスクシンイミドオキシカルボニル基である場合はZ1がカルボキシル基である(チオ)エーテル化合物(IV)とN−ヒドロキシスクシンイミドをジシクロヘキシルカルボジイミド(DCC)、N−(3−ジメチルアミノプロピル)−N’−エチルカルボジイミド(EDC)などの縮合剤を用いて縮合させる;
(2)Zがマレイミジル基である場合はZ1がアミノ基である(チオ)エーテル化合物(IV)と無水マレイン酸を反応させる;
(3)Zがイソシアネート基である場合はZ1がアミノ基である(チオ)エーテル化合物(IV)とトリホスゲンを反応させる;などにより行なうことができる。
【0097】
各工程で得られた粗製の生成物は、常法(再結晶、クロマトグラフィー等)により精製することができる。
【0098】
3.質量分析法
本発明の質量分析法は、試料化合物を本発明の質量分析用イオン化標識剤に作用させて標識する工程、得られた標識化試料化合物にレーザーを照射してイオン化する工程、およびイオン化された標識化試料化合物を質量分離部にて分離する工程を含むことを特徴とする。
【0099】
試料化合物は質量分析用イオン化標識剤と結合する官能基または構造を有するものであれば特に限定されず、医薬、農薬などの各種薬品;医薬品添加物、食品添加物、化粧料添加物などの各種添加物;合成物;天然物などの比較的分子量が低い化合物;および各種樹脂;タンパク質、核酸、糖類、糖タンパク、糖脂質鎖等の生体分子などの高分子が挙げられる。また、試料化合物は精製物でもよいし、混合物であってもよい。
【0100】
分析の前に、試料化合物に質量分析用イオン化標識剤を作用させて試料化合物の標識化を行なう。試料化合物に存在する官能基または構造に応じて、結合を形成しうる結合基を有する標識剤を適宜選択する。
試料化合物中に存在する官能基または構造が不明の場合には、結合基の異なる標識剤を数種類用いて予備試験を行うこともできる。
試料化合物が混合物である場合は、特定の官能基または構造を有するものを選択的に分析することもできる。
【0101】
試料化合物の標識化は、標識剤の結合基に適した慣用技術を用いて行なうことができる。
例えば、適当な溶媒中で試料化合物と質量分析用イオン化標識剤とを混合、攪拌する方法などが挙げられる。この際、塩基、酸、触媒などを適宜添加してもよい。
【0102】
得られる粗製の標識化試料化合物は、精製せずに質量分析に付することができ、あるいは必要に応じて、自体公知の分離精製手段、例えば、薄層クロマトグラフィー(TLC)、キャピラリーガスクロマトグラフィー(CGC)、高速液体クロマトグラフィー(HPLC)、キャピラリー電気泳動(CE)などにより精製した後、質量分析に付してもよい。また、これら分析機器と質量分析機を自体公知のハイフネーテッド技術を利用して接続することもできる。
【0103】
また、より簡便な方法として、試料化合物と質量分析用イオン化標識剤を質量分析機の試料導入部(プレート、プローブなど)に同時または順次導入して試料導入部で反応させ、次いで質量分析に付することもできる。
【0104】
標識化された試料化合物をイオン化する方法としては、レーザー光照射によるものであれば特に限定されず、レーザー脱離イオン化法(LDI)、マトリックス支援レーザー脱離イオン化法(MALDI)などが挙げられる。
レーザー源としては、窒素レーザー(337nm)、YAGレーザー(第3調波:355nm、第4調波:266nm)、炭酸ガスレーザー(2.94μm)などが挙げられ、標識剤のレーザー照射によってイオン対に開裂する結合を効率的に開裂しうるものを適宜選択すればよい。
【0105】
LDIは、試料分子がレーザー光を直接吸収してイオン化する方法である。
MALDIは、試料とマトリックスの混合結晶を調製し、それにレーザー光を照射する事でイオン化を行う方法である。MALDIでは、マトリックス分子がレーザー光を共鳴吸収してイオン化すると同時に急速加熱されて試料分子とともに気化する。続いてイオン化したマトリックス分子と試料分子との間でプロトンや電子などの授受が起こる事によってイオン化される。
【0106】
本発明においては、標識化された試料はマトリックスに依存することなく、レーザー照射により直接イオン化されうる。したがって、マトリックスを使用することによる様々な制限がないLDIが好ましく採用される。
また、MALDIを採用する場合においても、本発明により標識化された試料は、レーザー照射により直接イオン化するため、マトリックスとの複雑な化学的相互作用を避けることができる。即ち、レーザー照射後、既にイオン化している標識化試料とマトリックス間では、静電反発により複雑な電荷移動は生じ難く、マトリックスは、主にイオン化した試料を気相へ導くための脱離過程に作用するものと考えられる。従って、本発明により標識化された試料にMALDIを適用する場合においても、マトリックス使用による応答の乱れを生じさせる影響は少なく、より定量性の高いスペクトルを再現性よく得ることができる。さらに、標識化された試料化合物はレーザー光線によって直接イオン化されるので、マトリックス分子自体がイオン化される必要はない。したがって、従来のMALDIに比較して使用できるマトリックスの範囲は格段に広くなる。さらには、イオン化されにくいマトリックスを使用することにより、マトリックス分子由来のバックグランドを大幅に低減させることができる。
【0107】
イオン化された試料化合物は、質量分離部で分離され、検出される。
「質量分離部」とは、静電力によって飛行させたイオンに電場または磁場を作用させて、イオンの質量電荷比(m/z)に応じて生じる振幅、飛行時間、軌道の違いにより、イオンをm/zで分離する装置である。
【0108】
質量分離部のイオン分離法は特に限定されず、自体公知の方法が採用されうる。例えば、飛行時間型質量分析法(TOF−MS)、2重収束偏向磁場型質量分析法、4重極型質量分析法(Q−MS)、イオントラップ型質量分析法(IT―MS)などが挙げられる。好適には、TOF−MSが採用される。
【0109】
TOF−MSとは、真空中でのイオンの飛行時間が質量電荷比(m/z)によって異なる事を利用する分離法である。イオン源から検出器までイオンを直線的に飛行させるリニアモードとリフレクトロンという静電場ミラーを用いてイオンの向きを反転させるリフレクターモードがあり、試料化合物または分析の目的(定性分析、定量分析など)に応じて適切な方法を採用すればよい。
【0110】
リニアモードは、測定時間が短い点や、ドリフト空間内で分解したり、中性化したイオンも元のイオンと同一の速度で飛行して検出器に到達するため、高感度に測定できる。一方、イオンの初期運動エネルギーの広がりがピークの幅の広がりになるため、分解能が低下する。
【0111】
これに対して、リフレクターモードでは、大きな初期運動エネルギーをもつイオンほどリフレクトロンの奥まで進んでから反転するため、同じm/zのイオンはほぼ同時に検出器に到達し、高分解能が得られる。しかし、飛行途中で分解や中性化されたイオンは、もとのイオン種とは異なる軌道を描いて反転するか、直進するため、リニアモードと比較すると検出感度は低くなる。
また、リフレクターモードでは、飛行途中で分解したイオンを検出することにより、ポストソース分解を利用したMS/MS測定を行う事ができる。
【0112】
本発明の質量分析法には、レーザー脱離イオン化室と質量分析部を含む市販の装置を制限なく使用することができる。かかる装置としては、Voyager−DE(登録商標)Pro(アプライドバイオシステム社製)などが挙げられる。
【0113】
本発明の質量分析法においては、試料化合物にアニオンパートまたはカチオンパートが付加したイオンのm/z値が観測される。したがって、アニオンパートまたはカチオンパートに相当する部分の分子量を差し引くことによって、試料化合物の分子量を算出することができる。
【0114】
本発明の標識剤を用いた質量分析法で標識化された試料は、レーザー光よる開裂により確実にイオン化されているので、高感度かつ高精度に分析することができる。
また、試料化合物の分子の複数箇所が標識化された場合は、多価イオンが生成するため、m/zが小さくなり、分析機器の測定限界を超えた高分子量の試料も分析しうる。
【0115】
3−1.定量分析
本発明の質量分析法では、試料化合物はレーザーにより直接イオン化され、そのイオン化メカニズムがシンプルであるので、イオン化のレスポンスファクターが構造の多様性に影響されにくく、分子量のみに依存する傾向がある。したがって、分子量が判明している数種の化合物を用いて予めシグナル強度と分子量との相関の経験式を得ておけば、内部標準法などを併用することにより試料濃度を定量的に分析することが可能である。
【0116】
具体的には、分析対象となる化合物の分子量の近辺(±800程度、好ましく±200程度)の分子量が判明している数種(10〜20種、好ましくは5〜6種)の化合物を本発明の標識剤で標識する。次いで、これら標識化化合物の一定濃度(好ましくは10〜500μM)の溶液を調製し、その一定量を質量分析する。これらは、それぞれ個別に測定してもよいし、混合物として一括して測定してもよい。
次いで、得られたスペクトルの各標識化化合物のシグナル強度(典型的には、面積値。以下、同様。)と分子量をグラフにプロットする。これらの値の対数値(log)をプロットすると直線性のある相関が得られるので好ましい(図3参照)。
このグラフから、最小二乗法などにより解析して、相関性の経験式を得ることができる。その際、例外的に相関性から外れる化合物がある場合は除外してもよい。
【0117】
内部標準法によって定量する場合は、標識化した試料化合物を、一定濃度の内部標準化合物(該内部標準化合物は、本発明の標識剤で標識化されたものである必要がある。例えば、上記の経験式を作成するために使用した標識化化合物の一つを用いることができる。以下、同様。)と混合して質量分析する。
具体的には、標識化した試料化合物を、予め調製した一定濃度の内部標準化合物の溶液に溶解させる。得られた溶液の一定量を質量分析する。得られるスペクトルの試料化合物と内部標準化合物の各シグナルの強度比(試料化合物/内部標準化合物の面積比)を、それぞれの分子量に基づき上記で得られた経験式を用いて補正する。補正した強度比と内部標準化合物の濃度の積により、試料化合物の濃度を算出することができる。
試料化合物の標品が得られている場合には、検量線法によって定量分析することもできる。
【0118】
3−2.反応のモニタリング
本発明の質量分析法は、低濃度(10μM程度)のサンプルで短時間(5秒程度)の測定が可能であり、反応試薬や副生物などの夾雑物の影響も受けにくいので、必要に応じて上記の定量分析法と組み合わせることにより、反応の進行をモニターすることができる。比較的高濃度(10mM程度以上)を必要とし、測定に比較的長時間(2分程度)を要する1H−NMRでは解析困難な反応速度が早い反応を好適にモニターすることができる。
また、本発明の質量分析法による反応のモニタリングは、得られるスペクトルの原料化合物、生成物などのシグナル強度を、それぞれの分子量に基づき上記で得られる経験式を用いて補正することにより解析可能であるため、特別なシステムを構築する必要がない。したがって、反応の進行に伴いシフトする原料と生成物の最大吸光度を補正するために、適切なシステムを必要とする分光分析法によるモニタリングよりも簡便である。
【0119】
具体的には、まず、反応の原料化合物を本発明の標識剤により標識する。次いで、標識化された原料化合物の一定濃度の溶液を調製する。反応を定量的に解析する場合には、反応に関与しない内部標準化合物の一定濃度の溶液に標識化原料化合物を溶解させてもよい。
得られた標識化原料化合物の溶液に反応試薬(例えば、求核剤、求電子剤、酸化剤、還元剤、酸、塩基、酵素、触媒など)を添加して反応を開始する。次いで、所定時間ごとに反応液をサンプリングする。サンプリングした溶液に、クエンチ剤(水、酸、塩基、大過剰の他の反応試薬など)を加えて、反応を停止させるか、或いは溶媒を蒸発乾固させることにより反応を停止させてもよい。
【0120】
次いで、サンプリングした溶液を質量分析する。得られるスペクトルの原料化合物(または、クエンチ剤と原料化合物との反応生成物。以下、同様)、生成物、内部標準化合物などのシグナル強度を、それぞれの分子量に基づいて、上記3−1で得られた経験式を用いて補正する。原料化合物と生成物の補正したシグナル強度比あるいは内部標準法を用いて算出した生成物の定量値と反応時間との関係をグラフにプロットし、必要に応じて、自体公知の反応解析法、例えば、最小二乗法、アレニウスプロット法、ラインウェーバー・バークプロット法、ファントホッフプロット法等により、反応速度定数、ミカエリス定数、触媒中心活性、活性化エネルギー、活性化エンタルピー、活性化エントロピーなどを算出することができる。
本発明の質量分析法による反応のモニタリングでは、生成物が複数存在する場合や中間体を経由して段階的に進行する反応においても、それぞれの生成物または中間体などのシグナル強度を経験式から補正可能であるので応用範囲が広く、有用性が高い。
【実施例】
【0121】
以下、本発明について、実施例を挙げてさらに具体的に説明する。本発明はこれらにより何ら限定されるものではない。
【0122】
製造例1:化合物13の合成
【0123】
【化15】

【0124】
グルコース(1mmol)のピリジン(4mL)溶液に無水酢酸(2.8mL)加え、混合物を室温で12時間攪拌した。混合物を酢酸エチル(20mL)に加え、1M塩酸(20mL)で3回、食塩水(20mL)で1回洗浄した。次いで、有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。得られた残渣を酢酸(1mL)に溶解し、臭化水素酸酢酸溶液(5mL)を0℃で10分間で加えた。混合物を10%炭酸カリウム水溶液と酢酸エチル(10mL)に注いだ。追加の酢酸エチル(20mL)を加えた後、混合物を10%炭酸カリウム水溶液(20mL)で3回、食塩水(20mL)で1回洗浄した。次いで、有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。得られた残渣と2−プロピン−1−オール(3mmol)をCH2Cl2(5mL)に溶解し、トリフルオロメタンスルホン酸銀(2mmol)を室温下加え、懸濁液を15分間攪拌し、濾過した。濾液を10%炭酸カリウム水溶液(10mL)で2回、食塩水(10mL)で1回洗浄した。次いで、有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(n−ヘキサン:酢酸エチル=5:1〜1:1)で精製し、化合物13を白色固体として得た。(収率65%)
mp 119-121℃;
IR (KBr, cm -1): 2970, 1765, 1382, 1235, 1048, 902;
1H-NMR(400MHz, CDCl3, TMS, r.t.) δ: 2.01(3H, s), 2.03(3H, s), 2.06(3H, s), 2.09(3H, s), 2.49(1H, t, J=2.4Hz), 3.72-3.76(1H,m), 4.15(1H, d, J=9.6Hz), 4.28(1H, d, J=12.4Hz), 4.38(2H, d, J=2.4Hz), 4.79(1H, d, J=8.8Hz), 5.02(1H, t, J=8.8Hz), 5.11(1H, t, J=9.6Hz), 5.25(1H, t, J=9.2Hz);
13C-NMR(500MHz, CDCl3, TMS, r.t.) δ: 20.5, 20.6, 55.9, 61.7, 68.3, 70.9, 71.9, 72.7, 75.5, 78.1, 98.1, 169.4, 170.2, 170.6;
HRMS m/z Calcd. for C37H56N2O5 386.1213, Found 386.1175.
【0125】
製造例2:化合物14の合成
【0126】
【化16】

【0127】
製造例1と同様にして、マルトース1水和物から化合物14を得た。
mp 69-70℃;
IR (KBr, cm -1): 2964, 1765, 1684, 1370, 1239, 1039, 899;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ: 2.01-2.05(15H, m), 2.10(3H, s), 2.15(3H, s), 2.56(1H, s), 3.75(1H, d, J=10.2Hz), 3.95-4.06(3H, m), 4.25(2H, t, J=12.2Hz), 4.36(2H, s), 4.50(1H, d, J=10.2Hz), 4.80-4.87(3H, m), 5.05(1H, t, J=12.2Hz), 5.29(1H, t, J=8.8Hz), 5.35(1H, t, J=8.8Hz), 5.41(1H, t, J=4.0Hz);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ: 20.3, 20.3, 20.4, 20.5, 20.6, 55.6, 61.3, 62.4, 67.8, 68.3, 69.1, 69.8, 71.5, 72.0,72.5, 75.1, 75.4, 77.9, 95.3, 97.4, 169.1, 169.3, 169.6, 169.9, 170.1, 170.1, 170.2;
HRMS m/z Calcd. for C29H38O18 674.2058, Found 674.2051.
【0128】
製造例3:化合物15の合成
【0129】
【化17】

【0130】
製造例1と同様にして、マルトトリオースから化合物15を得た。
mp 93-95℃;
IR (KBr, cm -1): 2966, 1765, 1765, 1647, 1434, 1238, 1037, 899;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ: 2.00-2.06(21H, m), 2.10(3H, s), 2.16(3H, s), 2.18(3H, s), 2.49(1H, s), 3.77(1H, d, J=12.2Hz), 3.94-4.36(10H, m), 4.78(2H, t, J=12.2Hz), 4.72-4.87(4H, m), 5.07(1H, t, J=10.2Hz), 5.27-5.41(5H, m);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ: 13.9, 20.3, 20.4, 20.5, 20.6, 20.6, 20.7, 55.6, 60.1, 61.2, 62.2, 62.6, 67.7, 68.3, 68.7, 69.1, 69.8, 70.2, 71.5, 71.6, 72, 72.4, 73.6, 75.0, 75.4, 77.2, 77.9, 95.4, 95.5, 97.4, 169.1, 169.4, 169.5, 169.8, 170.1, 170.2, 170.3, 170.3;
FAB HRMS m/z Calcd. for C41H54O26 962.2903, Found 962.2910.
【0131】
実施例1
【0132】
【化18】

【0133】
(1)4−(4−メトキシ−3,5−ジメチルフェニル)−4−オキソ酪酸の合成
ジクロロエタン(2mL)に塩化アルミニウム(2mmol)を加え、氷水で冷却した後、無水コハク酸(1mmol)と2,6−ジメチルアニソール(1.25mmol)を加え、室温で3時間撹拌した。反応液を氷水(30mL)に注ぎ、酢酸エチルで2回抽出した後、油層を1規定塩酸で1回洗浄した。その後、油層を10%炭酸カリウム水溶液で3回抽出し、その抽出液を塩酸で酸性にして酢酸エチルで3回抽出した。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去して、白色結晶の標記化合物を定量的に得た。
IR (KBr, cm -1): 1710, 1678, 1594, 1151, 1012, 936;
1H-NMR(400MHz, CDCl3, TMS, r.t.) δ: 2.32(6H, s), 2.79(2H, t, J=6.8Hz), 3.26(2H, t, J=6.8Hz), 3.75(3H, s), 7.66(2H, s);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ: 15.8, 27.7, 32.5, 59.5, 128.5, 130.6, 131.5, 160.8, 178.2, 196.5;
HRMS m/z Calcd. for C13H16O3 236.1049, Found 236.1049.
【0134】
(2)化合物1の合成
4−(4−メトキシ−3,5−ジメチルフェニル)−4−オキソ酪酸(1mmol)をジメチルホルムアミド(2mL)に溶解させ、ヨウ化メチル(1.5mmol)と炭酸カリウム(2mmol)加え、室温で3時間撹拌した。反応液を30mLの蒸留水に加え、酢酸エチルで2回抽出した後、1規定塩酸で3回洗浄した。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去して、淡黄色油状物質の化合物1を定量的に得た。
IR (KBr, cm -1): 1738, 1680, 1598, 1148, 1011;
1H-NMR(400MHz, CDCl3, TMS, r.t.) δ: 2.32(6H, s), 2.75(2H, t, J=6.8Hz), 3.27(2H, t, J=6.8Hz), 3.70(3H, s), 3.76(3H, s), 7.67(2H, s);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ: 15.9, 27.8, 33.0, 51.5, 59.4, 128.8, 130.9, 132.0, 161.1, 173.2, 197.1;
HRMS m/z Calcd. for C14H18O4 250.1205, Found 250.1183.
【0135】
(3)化合物2の合成
化合物1(1mmol)をジクロロメタン(5mL)に溶解させ2口フラスコに移し、窒素ガスを充填した後、これをエタノールバスにて−78℃に冷却した。ここに三臭化ホウ素(2mmol)をシリンジで加え、−5℃で12時間撹拌した。この反応液を氷水(50mL)に注ぎ、酢酸エチルで3回抽出し、抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去した。残査をカラムクロマトグラフィーで精製(ノルマルヘキサン:酢酸エチル=4:1)して、淡黄色結晶の化合物2を65%の収率で得た。
mp 109-111℃;
IR (KBr, cm -1): 1721.15, 1359.47, 1201.07, 1153.83, 992.26, 851.00;
1H-NMR(400MHz, CDCl3, TMS, r.t.) δ: 2.28(6H, s), 2.75(2H, t, J=6.8Hz), 3.26(2H, t, J=6.8Hz), 3.71(3H, s), 5.24(1H, s,), 7.66(2H, s);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ: 15.9, 28.1, 32.8, 51.8, 123.3, 128.6, 129.1, 157.3, 173.9, 197.2;
HRMS m/z Calcd. for C13H16O4 236.1049, Found 236.1030.
【0136】
(4)化合物3aの合成
化合物2(1mmol)をジメチルホルムアミド(2mL)に溶解させ、p−ニトロベンジルブロミド(1.1mmol)と炭酸カリウム(2mmol)加え、室温で3時間撹拌した。反応液を30mLの蒸留水に加え酢酸エチルで2回抽出した。1規定塩酸で3回洗浄した。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去した。残査をカラムクロマトグラフィーで精製(ノルマルヘキサン:酢酸エチル=4:1)して、淡黄色結晶の化合物3aをほぼ定量的に得た。
mp 125-128℃;
IR (KBr, cm -1); 1748, 1678, 1595, 1523, 1342, 1325, 1150, 981;
1H-NMR(400MHz, CDCl3, TMS, r.t.)δ;2.33(6H, s), 2.76(2H, t, J=6.6Hz), 3.28(2H, t, J=6.6Hz), 3.70(3H, s), 4.96(2H, s), 7.65(2H, d, J=8.0Hz), 7.70(2H, s), 8.27(2H, d, J=8.0Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.)δ;16.57, 28.11, 33.29, 51.78, 72.39, 123.71, 127.59, 129.18, 131.13, 132.73, 144.32, 147.56, 159.41, 173.25, 197.15.
HRMS m/z Calcd. for C20H21NO6 371.1369, Found 371.1369.
【0137】
実施例2
実施例1と同様にして化合物3bを得た。
【0138】
【化19】

【0139】
明黄色固体; mp 127-129℃;
IR (KBr, cm -1): 1755, 1725, 1680, 1214, 1151, 1071, 844;
1H-NMR(300MHz, CDCl3, TMS, r.t.)δ;2.35(6H, s), 2.75(2H, t, J=6.6Hz), 3.27(2H, t, J=6.6Hz), 3.70(3H,s), 3.85(3H, s), 4.56(2H, s), 7.67(2H, s).
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.3, 28.0, 33.1, 51.6, 52.1, 68.7, 129.1, 131.0, 133.0, 159.3, 168.9, 173.3, 197.2;
HRMS m/z Calcd. for C16H20O6 308.1260, Found 308.1253.
【0140】
実施例3
実施例1と同様にして化合物3cを得た。
【0141】
【化20】

【0142】
白色固体; mp 53-55℃;
IR (KBr, cm -1): 3032, 1726, 1678, 1597, 1359, 1223, 1151, 972, 843;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 2.33(6H, s), 2.76(2H, t, J=6.8Hz), 3.28(2H, t, J=6.8Hz), 3.71(3H, s), 4.85(2H, s), 7.36-7.47(5H, m), 7.69(2H,s);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 28.1, 33.2, 51.7, 74.1, 127.8, 128.2, 128.5, 129.1, 131.5, 137.0, 160.1, 173.4, 197.4;
HRMS m/z Calcd. for C20H22O4 326.1518, Found 326.1504
【0143】
実施例4
実施例1と同様にして化合物3dを得た。
【0144】
【化21】

【0145】
黄色固体; mp 127-130℃;
IR (KBr, cm -1): 2937, 1737, 1678, 1582, 1525, 1441, 1324, 1276, 1223, 1154, 875, 796;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 2.33(6H, s), 2.77(2H, t, J=6.8Hz), 3.30(2H, t, J=6.8Hz), 3.72(3H, s), 4.00(3H, s), 4.06(3H, s), 5.28(2H, s), 7.66(1H, s), 7.72(2H, s), 7.80(1H, s);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 28.1, 33.3, 51.8, 56.4, 56.5, 70.3, 108, 109.0, 129.2, 129.8, 131.3, 132.8, 138.6, 147.8, 154.1, 159.6, 173.4, 197.3;
HRMS m/z Calcd. for C22H25NO8 431.1580, Found 431.1581.
【0146】
実施例5
実施例1と同様にして化合物3eを得た。
【0147】
【化22】

【0148】
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 2.32(6H, s), 2.76(2H, t, J=6.8Hz), 3.28(2H, t, J=6.8Hz), 3.71(3H, s), 3.93(6H, s), 4.91(2H, s), 7.65(1H, d, J=7.8Hz), 7.70(2H, s), 7.80(2H, d, J=7.8Hz);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 28.0, 33.2, 51.8, 52.6, 52.7, 72.5, 127.3, 129.2, 129.3, 129.4, 131.2, 131.3, 132.5, 132.7, 140.8, 159.6, 167.6, 167.9, 173.4, 197.4;
HRMS m/z Calcd. for C24H26O8 442.1628, Found 442.1629.
【0149】
実施例6:4−[3,5−ジメチル−4−(4−ニトロベンジルオキシ)フェニル]−4−オキソ酪酸の合成
【0150】
【化23】

【0151】
化合物3a(1mmol)を少量のテトラヒドロフランに溶解させ、5%水酸化ナトリウム水溶液を50mL加え、室温で1時間撹拌した。反応液を塩酸で酸性にし、酢酸エチルで3回抽出を行った。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去すると、淡黄色結晶の標記化合物をほぼ定量的に得た。
1H-NMR(300MHz, CDCl3, TMS, r.t.)δ;2.33(6H, s), 2.82(2H, t, J=6.9Hz), 3.29(2H, t, J=6.9Hz), 4.96(2H, s), 7.66(2H, d, J=9.0Hz), 7.71(2H, s), 8.29(2H, d, J=8.7Hz).
【0152】
実施例7:化合物5の合成
【0153】
【化24】

【0154】
4−[3,5−ジメチル−4−(4−ニトロベンジルオキシ)フェニル]−4−オキソ酪酸(1mmol)にジクロロメタン(2mL)を加え、N−ヒドロキシスクシンイミド(1.5mmol)と縮合剤EDC(2mmol)を加え、室温で3時間撹拌した。反応液を1回につき10mLの蒸留水で3回洗浄し、無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去して、黄色結晶の化合物5をほぼ定量的に得た。
mp 194-197℃;
IR (KBr, cm -1): 3450, 1737, 1679, 1525, 1347, 1206, 1155, 1063, 983, 854;
1H-NMR(300MHz, CDCl3, TMS, r.t.)δ;2.33(6H, s), 2.85(4H, s), 3.08(2H, t, J=6.9Hz), 3.40(2H, t, J=6.9Hz), 4.96(2H, s), 7.66(2H, d, J=9.0Hz), 7.71(2H, s), 8.28(2H, d, J=9.0Hz).
13C-NMR (400MHz, CDCl3, TMS, r.t.)δ (ppm); 16.5, 25.44, 25.6, 32.9, 72.4, 123.8, 127.7, 129.3, 131.4, 132.3, 144.4, 147.7, 159.8, 168.4, 169, 196;
HRMS m/z Calcd. for C23H22N2O8 454.1376, Found 454.1367.
【0155】
実施例8:化合物4(4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−N−(n−プロピル)−酪酸アミド)の合成
【0156】
【化25】

【0157】
化合物5(1mmol)のCH2Cl2(3mL)溶液にn−プロピルアミン(1.2mmol)を加えた。 反応溶液を室温で3時間攪拌した。次いで、混合物を水に注ぎ、CH2Cl2(5mL)で3回抽出した。次いで、有機層を硫酸マグネシウムで乾燥し、ろ過し、減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(n−ヘキサン:酢酸エチル=5:1〜1:1)で精製し、化合物4を白色固体として得た。
白色固体; mp 170-172℃;
IR (KBr, cm -1): 2961, 1678, 1641, 1527, 1343, 1322, 1150, 982, 854;
1H-NMR (300MHz, CDCl3, TMS, r.t.) δ (ppm); 0.93(3H, t, J=7.2Hz), 1.50-1.58(2H, m), 2.32(6H, s), 2.63(2H, t, J=6.6Hz), 3.23(2H, t, J=6.6Hz), 3.34(2H, t, J=6.6Hz), 4.96(2H, s), 5.99(1H, s), 7.66(2H, d, J=8.4Hz), 7.71(2H, s), 8.28(2H, d, J=8.4Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 11.3, 16.5, 22.8, 30.4, 34.0, 41.3, 72.4, 123.8, 127.7, 129.3, 1321.2, 132.9, 144.4, 147.7, 159.6, 172.0, 198.5;
HRMS m/z Calcd. for C22H26N2O5 398.1842, Found 398.1837.
【0158】
実施例9:化合物4a(N−ベンジル−4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−酪酸アミド)の合成
【0159】
【化26】

【0160】
化合物5をジクロロメタンに溶解させ、ベンジルアミンを2当量加え1時間撹拌した後、蒸留水を加え酢酸エチルで3回抽出し、抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去した。残査をカラムクロマトグラフィーで精製(ノルマルヘキサン:酢酸エチル=4:1)して、黄色結晶の化合物4aをほぼ定量的に得た。
1H-NMR(300MHz, CDCl3, TMS, r.t.)δ;2.32(6H, s), 2.67(2H, d, J=6.5Hz), 3.36(2H, d, J=6.5Hz), 4.46(2H, d, J=6.0Hz), 4.96(2H, s), 6.06(1H, bs), 7.26-7.31(5H, m), 7.66(2H, d, J=9.0Hz), 7.71(2H, s), 8.28(2H, d, J=9.0 Hz).
【0161】
実施例10:化合物7(N−(2−アミノエチル)−4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−酪酸アミド)の合成
実施例8と同様にして、化合物7を合成した。
【0162】
【化27】

【0163】
白色固体; mp 123-125℃;
IR (KBr, cm -1): 3363, 2898, 1665, 1514, 1346, 1296, 1151, 1007.65, 850;
1H-NMR (300MHz, CDCl3, TMS, r.t.) δ (ppm); 2.32(6H, s), 2.63(2H, t, J=6.6Hz), 2.84(2H, t, J=6.3Hz), 3.31-3.36(4H, m), 4.96(2H, s), 6.19(1H, s), 7.66(2H, d, J=9.0Hz), 7.71(2H, s), 8.29(2H, d, J=9.0Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 30.3, 33.9, 41.3, 42.0, 72.4, 123.8, 127.7, 129.3, 131.2, 132.8, 144.4, 147.6, 159.5, 172.4, 198.5;
HRMS m/z Calcd. for C21H25N3O5 399.1794, Found 399.1774.
【0164】
実施例11:化合物8(N−(tert−ブチル)−4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−酪酸アミド)の合成
実施例8と同様にして、化合物8を合成した。
【0165】
【化28】

【0166】
白色固体; mp 124-125℃;
IR (KBr, cm -1): 2969, 1678, 1642, 1530, 1344, 1152, 983, 853;
1H-NMR (300MHz, CDCl3, TMS, r.t.) δ (ppm); 1.35(9H, s), 2.32(6H, s), 2.54(2H, t, J=6.6Hz), 3.30(2H, t, J=6.6Hz), 4.95(2H, s), 5.61(1H, s), 7.66(2H, d, J=9.0Hz), 7.69(2H, s), 8.28(2H, d, J=9.0Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.6, 28.9, 31.3, 34.1, 51.4, 72.7, 124.4, 128.3, 130.0, 131.8, 133.6, 145.2, 148.4, 160.3, 172.2, 199.5;
HRMS m/z Calcd. for C23H28N2O5 412.1998 Found 412.1996.
【0167】
実施例12:化合物9(N−シクロヘキシル−4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−酪酸アミド)の合成
実施例8と同様にして、化合物9を合成した。
【0168】
【化29】

【0169】
白色固体; mp 207-210℃;
IR (KBr, cm -1): 2933, 2854, 1640, 1527, 1343, 1302, 1152, 987, 855;
1H-NMR (300MHz, CDCl3, TMS, r.t.) δ (ppm); 1.11-1.23(3H, m), 1.29-1.38(3H, m), 1.68-1.73(2H, m), 1.88-1.92(2H, m), 2.32(6H, s), 2.58(2H, t, J=6.6Hz), 3.31(2H, t, J=6.6Hz), 3.74-3.76(1H, m), 4.95(2H, s), 5.61(1H, s), 7.65(2H, d, J=8.4Hz), 7.74(2H, s), 8.28(2H, d, J=8.4Hz);
13C-NMR(500MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 24.8, 25.5, 30.7, 33.1, 34.1, 48.3, 72.4, 123.8, 127.7, 129.3, 131.2, 133.0, 144.4, 147.7, 159.6, 171.1, 198.5;
HRMS m/z Calcd. for C25H30N2O5 438.2155, Found 438.2148.
【0170】
実施例13:化合物10(4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−N−(β−フェニルエチル)−酪酸アミド)の合成
実施例8と同様にして、化合物10を合成した。
【0171】
【化30】

【0172】
白色固体; mp 176-178℃;
IR (KBr, cm -1): 2942, 1678, 1632, 1527, 1342, 1233, 1211, 1149, 981, 855;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 2.33(6H, s), 2.57(2H, t, J=6.8Hz), 2.82(2H, t, J=6.8Hz), 3.30(2H, t, J=6.8Hz), 3.53(2H, q, J=6.4Hz), 4.96(2H, s), 5.74(1H, s), 7.20-7.32(5H, m), 7.66(2H, d, J=8.8Hz), 7.70(2H, s), 8.28(2H, d, J=8.8Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 30.3, 33.9, 35.7, 40.68, 72.4, 123.8, 126.4, 127.6, 128.7, 129.3, 131.2, 132.8, 138.9, 144.4, 147.6, 159.5, 172.0, 198.3;
HRMS m/z Calcd. for C27H28N2O5 460.1998 Found 460.1996.
【0173】
実施例14:化合物11(4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−N−ドデシル−4−オキソ−酪酸アミド)の合成
実施例8と同様にして、化合物11を合成した。
【0174】
【化31】

【0175】
白色固体; mp 147-149℃;
IR (KBr, cm -1): 3088, 2918, 2850, 1642, 1528, 1343, 1234, 1150, 983, 855,
1H-NMR (300MHz, CDCl3, TMS, r.t.) δ (ppm); 0.88(3H, t, J=6.6Hz), 1.25(15H, s), 1.50(3H, t, J=7.2Hz), 2.48(6H, s), 2.60(2H, t, J=6.6Hz), 3.24(2H, q, J=6.6Hz), 3.33(2H, t, J=6.6Hz), 4.95(2H, s), 5.77(1H, t, J=9.0Hz), 7.65(2H, d, J=8.7Hz), 7.74(2H, s), 8.82(2H, d, J=8.7Hz).
13C-NMR(500MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 24.8, 25.5, 30.7, 33.1, 34.1, 48.3, 72.4, 123.8, 127.7, 129.3, 131.2, 133.0, 144.4, 147.7, 159.6, 171.1, 198.5;
HRMS m/z Calcd. for C31H44N2O5 524.3250 Found 524.3234.
【0176】
実施例15:化合物12(4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−N−オクタデシル−4−オキソ−酪酸アミド)の合成
実施例8と同様にして、化合物12を合成した。
【0177】
【化32】

【0178】
白色固体; mp 147-149℃;
IR (KBr, cm -1): 3088, 2918, 2850, 1642, 1528, 1343, 1212, 1150, 983, 855;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 0.88(6H, t, J=6.6Hz), 1.25(22H, s), 1.44-1.49(4H, m), 2.32(6H, s), 2.60(2H, t, J=6.6Hz), 3.24(2H, q, J=6.6Hz), 3.32(2H, t, J=6.6Hz), 4.95(2H, s), 5.74(1H, s), 7.65(2H, d, J=9.0Hz), 7.71(2H, s), 8.28(2H, d, J=9.0Hz);
13C-NMR(500MHz, CDCl3, TMS, r.t.) δ (ppm); 14.1, 16.5, 22.7, 26.9, 29.3, 29.6, 29.7, 30.5, 31.9, 34.1, 39.7, 72.4, 123.8, 127.7, 129.4, 131.2, 132.9, 144.4, 147.7, 159.6, 172.0, 198.5;
HRMS m/z Calcd. for C37H56N2O5 608.4189 Found 608.4177.
【0179】
実施例16:化合物6(N−[2−(2−アジド−エトキシ)−エチル]−4−[3,5−ジメチル−4−(4−ニトロ−ベンジルオキシ)−フェニル]−4−オキソ−酪酸アミド)の合成
【0180】
【化33】

【0181】
化合物5(1mmol)のCH2Cl2(3mL)溶液に2−(2−アミノエトキシ)エタノール(2mmol)を加え、反応溶液を室温で3時間攪拌した。ついで、反応混合物を水に注ぎ、CH2Cl2(5mL)で3回抽出した。次いで、有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。残渣をピリジン(5mL)に溶解し、メタンスルホニルクロリド(1.2mmol)を加え、反応混合物を室温で12時間攪拌した。混合物に酢酸エチル(20mL)を加え、1M塩酸(20mL)で3回、食塩水(20mL)で1回洗浄した。有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。得られた残渣をDMF(5mL)に溶解し、ナトリウムアジド(3mmol)を加え、懸濁液を〔室温で12時間攪拌した。混合物に酢酸エチル(20mL)を加え、1M塩酸(20mL)で3回、食塩水(20mL)で1回洗浄した。有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(n−ヘキサン:酢酸エチル=1:1〜1:2)で精製し、化合物6を黄色味を帯びた固体として得た。(収率70%)
黄色固体; mp 112-115℃;
IR (KBr, cm -1): 2103, 1755, 1641, 1343, 1233, 1052;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 2.33(6H, s), 2.63(2H, t, J=6.8Hz), 3.32(2H, t, J=6.8Hz), 3.40(2H, t, J=4.8Hz), 3.50(2H, t, J=4.8Hz), 3.58(2H, t, J=4.8Hz), 3.69(2H, t, J=4.8Hz), 4.96(2H, s), 7.66(2H, d, J=8.4Hz), 7.71(2H, s), 8.28(2H, d, J=8.8Hz);
13C-NMR (500MHz, CDCl3, TMS, r.t.) δ (ppm); 16.6, 30.2, 33.8, 39.2, 50.6, 69.9, 70.14, 72.4, 123.8, 127.7, 129.3, 131.2, 132.9, 144.5, 147.6, 159.5, 172.2, 198.2;
HRMS m/z Calcd. for C23H27N5O6 469.1961, Found 469.1959.
【0182】
実施例17:化合物16の合成
【0183】
【化34】

【0184】
化合物13(1mmol)と化合物6(1mmol)のアセトニトリル溶液(5mL)に硫酸銅(I)(0.5mmol)とアスコルビン酸ナトリウム(2mmol)を加え、混合物を室温で12時間攪拌した。次いで、混合物を水に注ぎ、酢酸エチル(10mL)で3回抽出した。有機層を硫酸マグネシウムで乾燥し、濾過し、減圧下留去した。残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:メタノール=50:1〜10:1)で精製し、化合物16を白色固体として得た。(収率96%)
明黄色固体; mp 45-48℃;
IR (KBr, cm -1): 2956, 1755, 1676, 1347, 1228, 1153, 1040;
1H-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 1.98-2.20(14H, m), 2.32(6H, s), 2.63(2H, t, J=6.8Hz), 3.32(2H, t, J=6.8Hz), 3.75-3.85(3H, m), 3.74-3.80(1H, m), 3.80-3.92(2H, m), 4.08-4.18(1H, m), 4.22-4.32(1H, m), 4.46(2H, s), 4.65-4.90(2H, m), 4.96(2H, s), 4.99-5.04(1H, m), 5.12(1H, t, J=9.2Hz), 5.22(1H, t, J=9.2Hz), 6.37(1H, t, J=5.6Hz), 7.66(2H, d, J=8.8Hz), 7.71(2H, s), 7.75(1H, s), 8.28(2H, d, 8.8Hz);
13C-NMR(400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.4, 20.5, 20.6, 20.6, 30.0, 33.7, 39.1, 50.1, 61.8, 63.1, 68.3, 68.9, 69.8, 71.3, 71.8, 72.3, 72.6, 100.0, 123.7, 123.8, 127.6, 129.2, 131.1, 132.8, 144.1, 144.4, 147.6, 159.5, 169.3, 169.4, 170.1, 170.6, 172.3, 198.2;
FAB HRMS m/z Calcd. for C40H49N5O16 855.3174, Found 855.3164.
【0185】
実施例18:化合物17の合成
【0186】
【化35】

【0187】
実施例15と同様にして化合物17を得た。(収率95%)
白色固体; mp 94-96℃;
IR (KBr, cm -1): 2958, 1755, 1675, 1529, 1369, 1348, 1234.90, 1153, 1043;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 1.98-2.04(17H, m), 2.10(3H, s), 2.15(3H, s), 2.32(6H, s), 2.62(2H, t, J=6.8Hz), 3.32(2H, t, J=6.8Hz), 3.43(1H, q, J=5.6Hz), 3.53-3.54(2H, m), 3.69-3.75(1H, m), 3.86(2H, t, J=4,8Hz), 3.95-4.07(3H, m), 4.18-4.32(2H, m), 4.49-4.63(3H, m), 4.72(1H, d, J=8.2Hz), 4.81-4.93(3H, m), 4.96(2H, s), 5.06(1H, t, J=10.2Hz), 5.26(1H, t, J=8.8Hz), 5.33-5.42(2H, m), 6.31(1H, t, J=5.6Hz), 7.66(2H, d, J=8.2Hz), 7.71(2H, s), 7.73(1H, s), 8.28(2H, d, J=8.8Hz);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.5, 20.5, 20.5, 20.6, 20.8, 30.1, 33.7, 39.1, 50.1, 61.5, 62.6, 63.1, 68.0, 68.4, 68.9, 69.3, 69.8, 70.0, 72.1, 72.3, 72.4, 72.7, 75.2, 95.5, 99.6, 123.8, 123.9, 127.64, 129.3, 131.2, 132.9, 144.1, 144.4, 147.6, 159.5, 169.3, 169.7, 169.8, 170.1, 170.4, 170.5, 172.3, 198.2;
HRMS m/z Calcd. for C52H65N5O241143.4020, Found 1143.4116.
【0188】
実施例19:化合物18の合成
【0189】
【化36】

【0190】
実施例15と同様にして化合物18を得た。(収率95%)
白色固体; mp 98-100℃;
IR (KBr, cm -1): 2961, 1755, 1675, 1530, 1370, 1348, 1235, 1152, 1037;
1H-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 1.96-2.10(27H, m), 2.15(3H, s), 2.18(3H, s), 2.32(6H, s), 2.62(2H, d, J=6.8Hz), 3.32(2H, t, J=6.8Hz), 3.43(1H, q, J=5.4Hz), 3.53-3.54(2H, m), 3.74-3.77(1H, m), 3.86(2H, t, J=4.8Hz), 3.92-4.07(4H, m), 4.17-4.33(3H, m), 4.46-4.57(4H, m), 4.70-4.75(2H, m), 4.81-4.92(3H, m), 4.96(2H, s), 5.07(1H, t, J=10.2Hz), 5.24-5.29(2H, m), 5.34-5.42(3H, m), 6.28(1H, t, J=5.6Hz), 7.66(2H, d, 8.8Hz), 7.70(2H, s), 7.73(1H, s), 8.28(2H, d, 8.8Hz);
13C-NMR (400MHz, CDCl3, TMS, r.t.) δ (ppm); 16.4, 20.4, 20.5, 20.6, 20.7, 20.7, 20.8, 30.0, 33.6, 39.1, 50.0, 61.3, 62.2, 62.7, 63.1, 67.8, 68.4, 68.8, 68.9, 69.2, 69.7, 70.0., 70.3, 71.6, 72.0, 72.2, 72.3, 72.4, 73.7, 75.0, 95.5, 95.6, 99.5, 123.7, 123.9, 127.6, 129.2, 131.1, 132.8, 144.0, 144.4, 147.5, 159.4, 169.3, 169.5, 169.7, 169.7, 169.9, 170.2, 170.4, 170.4, 170.4, 170.5, 172.2, 198.2,
HRMS m/z Calcd. for C64H81N5O32 1431.4865, Found 1431.4855.
実施例20:化合物19の合成
【0191】
【化37】

【0192】
フェノキシ酢酸に過剰の塩酸メタノールを加え、室温で6時間撹拌した。反応液をそのまま減圧留去すると、淡黄色の液状物質(フェノキシ酢酸メチル)をほぼ定量的に得た。ジクロロエタン(5mL)に塩化アルミニウム(4mmol)を加え、氷水で冷却した後、無水コハク酸(1mmol)とフェノキシ酢酸メチル(1mmol)を加え、室温で3時間撹拌した。反応液を氷水(30mL)に注ぎ、酢酸エチルで2回抽出した後、有機層を1規定塩酸で1回洗浄した。その後、有機層を10%炭酸カリウム水溶液で3回抽出し、その抽出液を塩酸で酸性にして酢酸エチルで3回抽出した。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去して、白色結晶の化合物19をほぼ定量的に得た。1H-NMR(300MHz, CDCl3, TMS, r.t.)δ;2.79(2H, t, J=6.6Hz), 3.27(2H, t, J=6.6Hz), 3.82(3H, s), 4.71(2H, s), 6.95(2H, d, J=9.0Hz), 7.97(2H, d, J=9.0Hz).
実施例21:化合物20の合成
【0193】
【化38】

【0194】
化合物19(1mmol)をジメチルホルムアミド(2mL)に溶解させ、ヨウ化メチル(1.5mmol)と炭酸カリウム(2mmol)加え、室温で3時間撹拌した。反応液を30mLの蒸留水に加え酢酸エチルで2回抽出した後、1規定塩酸で3回洗浄した。抽出液を無水硫酸マグネシウムにて乾燥させた後、溶媒を減圧留去して、淡黄色結晶の化合物20をほぼ定量的に得た。
1H-NMR(400MHz, CDCl3, TMS, r.t.)δ;2.74(2H, d, J=6.8Hz), 3.26(2H, d, J=6.8Hz), 3.69(3H, s), 3.80(3H, s), 4.70(2H, s), 6.94(2H, d, J=8.8Hz), 7.96(2H, d, J=8.8Hz).
上記方法と同様にして、下記表2−1〜3に示される化合物を合成した。
【0195】
【表2−1】

【0196】
【表2−2】

【0197】
【表2−3】

【0198】
試験例1:定量性の検討(検量線)
化合物4aの1mMのアセトニトリル溶液を1mL量り、全量を10mLとし100μM溶液を調製した。100μM溶液を5mL量り全量を10mLとし50μM溶液を調整した。50μM溶液を5mL量り、全量を10mLとし25μM溶液を調製した。100μM溶液を1mL量り、全量を10mLとし10μM溶液を調製した。同様の操作を繰り返し1、2、2.5、4、5、6および8μM溶液それぞれ調製した。これらの11種類の化合物4aの溶液をそれぞれ1mL量り取り、10μMの化合物3aの溶液を内部標準として各1mL混合させ、11種類の試料溶液を調製した。これらの試料溶液を質量分析用プレートに0.5μLスポットさせた後、蒸発乾固させアプライドバイオシステムズのVoyager−DE(登録商標)PROにて質量分析を行った。測定により得られたシグナル強度より、化合物3aに対する化合物4aの面積比を算出した。測定は各スポットについて8回行い、得られた面積値の最大値と最小値を除き、6つの相加平均を測定値として算出し、検量線を作成した。結果を図1に示す。
広い濃度領域では完全な直線関係ではないものの広い濃度領域に渡って累乗近似曲線により良好な応答を観察することができた(相関係数r=0.999)。一般的に狭い濃度領域では近似的に直線として取り扱うことも可能である。観察された非直線性は一般的なTOF−MSにおける機械的な性質によるものであると考えられ、改良された装置を用いることにより改善され得る。
【0199】
試験例2:アミン類の簡便検出法
化合物5を10μmol正確に量り、10mLのアセトニトリルを加え1mM溶液を調製した。この溶液を100倍希釈することにより10μMの溶液とした。ベンジルアミンは0.1mmolを正確に量り、10mLのアセトニトリルに溶解し10mM溶液とした。この、10mMベンジルアミンアセトニトリル溶液を1mLはかり、全量を10mLとし1mM溶液を調製した。1mM溶液を1mL量り、全量を10mLとし、100μM溶液を調製した。ベンジルアミンアセトニトリル100μM溶液を1mL量り、全量を10mLとし、10μM溶液を調製した。
質量分析用プレート上に10μMのベンジルアミン溶液を0.5μLスポット後、乾燥させてから調製した10μMの化合物5溶液を0.5μL重ねてスポットし、蒸発乾固させアプライドバイオシステムズのVoyager−DE(登録商標) PROにて質量分析を行った。得られたMSスペクトルを図2に示す。
標識化されたベンジルアミン(アミド誘導体)のイオンピークを明確に観測することができた。
【0200】
試験例3:LDI−MSスペクトル測定
以下の条件でネガティブモード、線形動作モード(ディレイド・エクストラクションタイプ)、最適化されたレーザーレートタイプで、実施例化合物のLDI−MSスペクトルを測定した。
使用機器:アプライドバイオシステムズ社製、Voyager DE Pro
加速電圧: 20,000V,
格子電圧: 95%,
格子ワイヤ電圧0: 0.05%,
遅延時間:130 nsec.
全ての測定には、ステンレススチールプレート(PLETE1、45ウェル)を使用した。典型的には、標識された化合物の10μM溶液を調製し、0.2μLの試料を各サークルにアプライし、周辺温度で乾燥させた。溶媒としてはアセトニトリル又はジクロロメタンを使用した。予め混合した溶液(1:1混合物)をシグナルレスポンスファクターの比較のために使用した。以下に示す数値は10スペクトルの平均を表す。
【0201】
表3に化合物2、3a〜3eの測定結果を示す。内部標準としては化合物4を用いた。相対強度は化合物3aを1.0とした時の相対値を示す。測定は10μMの予め混合した溶液を用いた。
【0202】
【表3】

【0203】
化合物3aでネガティブチャージされたフェノレートイオンIに相当するm/z=235.10のシグナルが観測され、満足がいく結果が得られた。興味深いことに、カチオンパートの多様性がLDI−MSの感度に強い影響を与えることが分った。フェノール誘導体である化合物2(R1=H)は、比較的低いO−H結合エネルギーにも係わらず、化合物3aの6%のシグナル強度しか示さなかった。電子吸引性のメトキシカルボニル基は感度を向上させた。ニトロ基やメトキシカルボニル基などの電子吸引性置換基を有するベンジル基がシグナルの相対強度を増強させることが明らかとなった。化合物3aの検出限界は、20fmol/spot辺りであった。これら化合物の特徴的な光照射開裂エーテル結合であるニトロベンジルフェノールエーテルは適当な酸性または塩基性条件並びに実験室の照明下では化学的に安定であった。
【0204】
図3に化合物3a、4〜12および16〜18について、縦軸に相対強度[log(面積比)]、横軸にlog(m/z)をプロットしたグラフを示す。LDI−MSは各化合物の10μM溶液の0.2μLを用いて行った。相対強度は化合物3aを1.0とした時の相対値を示す。
興味深いことにこれら標識された化合物の照射により生成したイオンのレスポンスファクターは、それらの構造の多様性に係わらず、その分子量のみに高い相関性を示した。但し例外として、活性エステルである化合物5は、レーザーパルス照射により分解し、環化イオンIIIに相当するm/z=203の比較的弱いシグナルを示した。
図3におけるシグナル面積比と分子量の相関性に関して最小二乗法により、応答経験式y = 725.04 * (x−1.208)(yは、シグナル面積値、xはm/z値を示す。)が得られた。
このように、本発明の標識剤を用いたLDI−MSにおいてイオンの初期速度がレスポンスファクターを主に制御していることが示唆された。図3より得られる経験式は、未知化合物の相対濃度を見積もることを可能にしうる。
【0205】
【化39】

【0206】
以上の結果より、本発明の標識剤で標識された化合物のLDI−MSのシグナル強度はその構造には依存せず、分子量にのみに依存する傾向があることが明らかとなり、種々の構造骨格を有する化合物同士を定量的に測定するのに適していることが明らかとなった。
【0207】
試験例4:反応のモニタリング(1)
化合物5(50μM)とβ−フェネチルアミン(50μM)のアセトニトリル(2mL)溶液を調製した。経時的に反応液をサンプリングし、過剰のn−プロピルアミンを加え、反応をクエンチし、試験例3と同様の条件でLDI−MSスペクトルを測定した。
各サンプルからは、化合物10(m/z=324)と化合物4(m/z=262)に相当するシグナルのみが測定された。図3のグラフより得られる応答経験式よりそれらシグナルの面積比を補正した後、反応時間と生成物濃度の関係を示すグラフを得た(図4)。反応の進行に伴い生成するヒドロキシスクシンイミドは定量的質量分析を妨げなかった。生成物と原料濃度の時間プロフィールに基づいて、二次速度定数(k2=292M−1s−1)が得られた。一般的な中性塩(有機または無機)の存在は、本発明の標識剤を用いたLDI−MSの定量的分析に顕著な影響を与えないことが示唆された。
以上の結果より、本発明の標識剤で標識された化合物の反応は、LDI−MSを用いて定量的にモニタリングするのに適していることが分った。
【0208】
試験例5:反応のモニタリング(2)
化合物16、17および18(100μM)のメタノール溶液(100μL)のそれぞれに、100mMのn−プロピルアミンのメタノール溶液(400μL)と内部標準として1mMの化合物11のメタノール溶液(10μL)を加えた。15分毎にステンレススチールプレートに反応溶液の0.2μLをアプライし、試験例3と同様な条件でLDI−MSスペクトルを測定して、反応をモニターした。
化合物17についての5時間後のLDI−MSスペクトルを図5に示す。部分的に脱アセチル化された各生成物のシグナルが観察された。
図3より得られる応答経験式により補正した後、反応において脱アセチル化された各生成物のシグナル面積の合計は、生成物の官能性や極性の顕著な多様性に係わらず、内部標準の化合物11(図5にシグナルを示していない)と一致した。完全に脱アセチル化された生成物は15時間後、92%(相対強度0.237)で観測された。
【0209】
図6に、完全に脱アセチル化された化合物16’、17’および18’の相対強度と分子量の相関性を示すグラフを、化合物3a、4〜12および16〜18と共に示す。化合物16’、17’および18’は化合物3aを1.0とした相対値で示した。化合物16’、17’および18’の相対強度と分子量の相関性は、化合物3a、4、6〜12および16〜18の相関性と一致した。
以上の結果により、本発明の標識剤は、多段階反応のモニタリングにも利用できることが明らかとなった。
本発明の標識剤を利用した反応のモニタリングは、1H−NMRを利用した場合に比較して、(1)低濃度で感度よく測定できる、(2)短時間で測定できるなどの利点がある。
また、光学分光法でも低濃度反応のモニタリングが可能であるが、反応の進行に従って極大吸光度がシフトして、不動点を形成するような測定系をデザインする必要がある。一方、本発明の方法ではシグナル強度は分子量のみに依存するので、試料を標識することを除いて、特別なデザインを必要とせず、幅広い系に適用することが容易である。
【0210】
試験例6:反応のモニタリング(3)
誘導体16’の50mM溶液10μLにβ−グルコシダーゼ(スウィートアーモンド由来)溶液20μL(1U)、100mMリン酸緩衝液(pH 5.8)970μLを加え、40℃に加温した。経時的にマイクロピペットにより0.5μLのサンプリングを行い、質量分析用プレートに試料溶液をスポットし、放置することにより溶媒を蒸発乾固させ測定試料とした。試験例3と同様の条件にて質量分析を行った。反応スキームを以下に示す。
【0211】
【化40】

【0212】
それぞれの試料スポットから3つのマススペクトルを取得し、シグナル面積比の平均値を測定データとして利用した。各時間の化合物16’(m/z=551)の加水分解生成物19(m/z=389)に対するシグナル面積比に対して、図3から得られる応答経験式に基づき算出された質量差に基づく応答ファクター1.52を乗じることにより、加水分解生成物19の量(nmol)を算出した。加水分解生成物の量を経時変化を図7に示す。
【0213】
測定した濃度領域において加水分解生成物の増大は良好な直線関係となっていることが判明した。このように、本発明の方法により酵素反応の初速度を容易に決定することが可能である。尚、本分析系では比較的高濃度(約100mM)のリン酸バッファーが共存していたが、シグナルの定量性が損なわれることがないことを示している。
【産業上の利用可能性】
【0214】
本発明の質量分析用イオン化標識剤を利用することにより、従来のMALDIでは困難であった様々な測定が飛躍的に容易又は可能になるものと期待され、効率的な測定キット、アッセイキットなど多方面への応用が可能である。
【図面の簡単な説明】
【0215】
【図1】本発明のイオン化標識剤で標識されたベンジルアミンの定量性(検量線)を示すグラフである(試験例1)。
【図2】本発明のイオン化標識剤で標識されたベンジルアミンのMSスペクトルである(試験例2)。
【図3】本発明のイオン化標識剤で標識された化合物について、縦軸に相対強度log(面積比)、横軸にlog(m/z)をプロットしたグラフである。(試験例3)
【図4】化合物5とβ−フェネチルアミンとの2次反応をモニタリングしたグラフである。(試験例4)
【図5】化合物17とn−プロピルアミンの反応液の5時間後のLDI−MSスペクトルである。(試験例5)
【図6】本発明のイオン化標識剤で標識された化合物について、縦軸に相対強度log(面積比)、横軸にlog(m/z)をプロットしたグラフである。(試験例5)
【図7】本発明のイオン化標識剤で標識された化合物の酵素(β−グリコシダーゼ)反応について、生成物と時間との関係を示すグラフである。(試験例6)
【特許請求の範囲】
【請求項1】
レーザー照射によってイオン対に開裂するイオン開裂部分および他の物質と結合を形成しうる結合基を有する化合物からなることを特徴とする、質量分析用イオン化標識剤。
【請求項2】
化合物が中性分子である、請求項1記載の質量分析用イオン化標識剤。
【請求項3】
結合基がアニオンに開裂する部分構造中に存在する、請求項1または2記載の質量分析用イオン化標識剤。
【請求項4】
イオン開裂部分が、カルボカチオンと(チオ)フェノール性アニオンに開裂し得る(チオ)エーテル結合を含む、請求項1〜3のいずれか一項に記載の質量分析用イオン化標識剤。
【請求項5】
カルボカチオンが共役系スペーサーを介するかまたは介さないで電子求引性基を少なくとも1つ有する、請求項4記載の質量分析用イオン化標識剤。
【請求項6】
カルボカチオンがベンジルカチオンである、請求項4または5記載の質量分析用イオン化標識剤。
【請求項7】
(チオ)フェノール構造に共役する不飽和結合を有する基を有する、請求項4〜6のいずれか一項に記載の質量分析用イオン化標識剤。
【請求項8】
質量分析用イオン化標識剤を構成する化合物が、式(I)
【化1】

(式中、R1、R2およびR3は独立して、水素原子または任意の置換基を示し、Xは酸素原子または硫黄原子を示し、Wは単結合またはカルボニル基を示し、Yは単結合または任意の構造を有するスペーサーを示し、Zは他の物質と結合を形成しうる結合基を示し、環Aは独立して1以上の任意の置換基を有していてもよい。)で表される(チオ)エーテル化合物である、請求項4記載の質量分析用イオン化標識剤。
【請求項9】
R1、R2およびR3の少なくとも一つが、共役系スペーサーを介するかまたは介さない電子求引性基、または該電子求引性基を少なくとも一つ有し、さらに任意の置換基を有していてもよいフェニル基である、請求項8記載の質量分析用イオン化標識剤。
【請求項10】
電子求引性基が、ニトロ基、シアノ基、ハロゲン原子、カルボニル基、ホスホリル基、スルホニル基および電子欠乏型複素環基から選ばれる、請求項9記載の質量分析用イオン化標識剤。
【請求項11】
Xが酸素原子である、請求項8〜10のいずれか一項に記載の質量分析用イオン化標識剤。
【請求項12】
Zが、カルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基である、請求項8〜11のいずれか一項に記載の質量分析用イオン化標識剤。
【請求項13】
環Aが環Aに共役する不飽和結合を有する基を有する、請求項8〜12のいずれか一項に記載の質量分析用イオン化標識剤。
【請求項14】
試料化合物に請求項1〜13のいずれか一項に記載の質量分析用イオン化標識剤を作用させて標識する工程、得られた標識化試料化合物にレーザーを照射してイオン化する工程、およびイオン化された標識化試料化合物を質量分離部にて分離する工程を含むことを特徴とする質量分析法。
【請求項15】
飛行時間型質量分析法によってイオンを分離する、請求項14記載の質量分析法。
【請求項16】
試料化合物の定量分析を行う、請求項14または15記載の質量分析法。
【請求項17】
試料化合物の反応をモニターする、請求項14または15記載の質量分析法。
【請求項18】
式(I’)
【化2】

(式中、R1’、R2’およびR3’は独立して、水素原子;アルキル基;アルコキシ基;ハロゲン原子、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基およびパーフルオロアルキル基から選ばれる電子求引性基;または該電子求引性基を少なくとも一つ有し、さらにアルキル基およびアルコキシ基から選ばれる1以上の置換基を有していてもよいフェニル基を示し、Xは酸素原子または硫黄原子を示し、Y’は単結合、フェニレン基または炭素数1〜17の飽和または不飽和の炭化水素鎖(該炭化水素鎖は、オキソ、アルキル基、アルケニル基、アルキニル基およびアリール基から選ばれる1以上の置換基を有していてもよく、構成炭素原子の1以上が、酸素原子、窒素原子および硫黄原子から選ばれるヘテロ原子またはフェニレン基で置き換わってもよい。)からなるスペーサーを示し、Z’はカルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基を示し、環A’は独立して、アルキル基、アルコキシ基、チオアルコキシ基、アルケニル基、アルキニル基、アリール基、ヘテロアリール基、カルボニル基、シアノ基、ハロゲン原子、ニトロ基、ホスホリル基およびスルホニル基から選ばれる1以上の置換基を有していてもよい。)で表される(チオ)エーテル化合物。
【請求項19】
Xが酸素原子である、請求項18記載の化合物。
【請求項20】
請求項18または19記載の化合物の、質量分析用イオン化標識剤としての使用。
【請求項1】
レーザー照射によってイオン対に開裂するイオン開裂部分および他の物質と結合を形成しうる結合基を有する化合物からなることを特徴とする、質量分析用イオン化標識剤。
【請求項2】
化合物が中性分子である、請求項1記載の質量分析用イオン化標識剤。
【請求項3】
結合基がアニオンに開裂する部分構造中に存在する、請求項1または2記載の質量分析用イオン化標識剤。
【請求項4】
イオン開裂部分が、カルボカチオンと(チオ)フェノール性アニオンに開裂し得る(チオ)エーテル結合を含む、請求項1〜3のいずれか一項に記載の質量分析用イオン化標識剤。
【請求項5】
カルボカチオンが共役系スペーサーを介するかまたは介さないで電子求引性基を少なくとも1つ有する、請求項4記載の質量分析用イオン化標識剤。
【請求項6】
カルボカチオンがベンジルカチオンである、請求項4または5記載の質量分析用イオン化標識剤。
【請求項7】
(チオ)フェノール構造に共役する不飽和結合を有する基を有する、請求項4〜6のいずれか一項に記載の質量分析用イオン化標識剤。
【請求項8】
質量分析用イオン化標識剤を構成する化合物が、式(I)
【化1】

(式中、R1、R2およびR3は独立して、水素原子または任意の置換基を示し、Xは酸素原子または硫黄原子を示し、Wは単結合またはカルボニル基を示し、Yは単結合または任意の構造を有するスペーサーを示し、Zは他の物質と結合を形成しうる結合基を示し、環Aは独立して1以上の任意の置換基を有していてもよい。)で表される(チオ)エーテル化合物である、請求項4記載の質量分析用イオン化標識剤。
【請求項9】
R1、R2およびR3の少なくとも一つが、共役系スペーサーを介するかまたは介さない電子求引性基、または該電子求引性基を少なくとも一つ有し、さらに任意の置換基を有していてもよいフェニル基である、請求項8記載の質量分析用イオン化標識剤。
【請求項10】
電子求引性基が、ニトロ基、シアノ基、ハロゲン原子、カルボニル基、ホスホリル基、スルホニル基および電子欠乏型複素環基から選ばれる、請求項9記載の質量分析用イオン化標識剤。
【請求項11】
Xが酸素原子である、請求項8〜10のいずれか一項に記載の質量分析用イオン化標識剤。
【請求項12】
Zが、カルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基である、請求項8〜11のいずれか一項に記載の質量分析用イオン化標識剤。
【請求項13】
環Aが環Aに共役する不飽和結合を有する基を有する、請求項8〜12のいずれか一項に記載の質量分析用イオン化標識剤。
【請求項14】
試料化合物に請求項1〜13のいずれか一項に記載の質量分析用イオン化標識剤を作用させて標識する工程、得られた標識化試料化合物にレーザーを照射してイオン化する工程、およびイオン化された標識化試料化合物を質量分離部にて分離する工程を含むことを特徴とする質量分析法。
【請求項15】
飛行時間型質量分析法によってイオンを分離する、請求項14記載の質量分析法。
【請求項16】
試料化合物の定量分析を行う、請求項14または15記載の質量分析法。
【請求項17】
試料化合物の反応をモニターする、請求項14または15記載の質量分析法。
【請求項18】
式(I’)
【化2】

(式中、R1’、R2’およびR3’は独立して、水素原子;アルキル基;アルコキシ基;ハロゲン原子、カルボニル基、シアノ基、ニトロ基、ホスホリル基、スルホニル基およびパーフルオロアルキル基から選ばれる電子求引性基;または該電子求引性基を少なくとも一つ有し、さらにアルキル基およびアルコキシ基から選ばれる1以上の置換基を有していてもよいフェニル基を示し、Xは酸素原子または硫黄原子を示し、Y’は単結合、フェニレン基または炭素数1〜17の飽和または不飽和の炭化水素鎖(該炭化水素鎖は、オキソ、アルキル基、アルケニル基、アルキニル基およびアリール基から選ばれる1以上の置換基を有していてもよく、構成炭素原子の1以上が、酸素原子、窒素原子および硫黄原子から選ばれるヘテロ原子またはフェニレン基で置き換わってもよい。)からなるスペーサーを示し、Z’はカルボキシル基、スクシンイミドオキシカルボニル基、アミノ基、マレイミジル基、ホルミル基、アルコキシカルボニル基、水酸基、ヒドラジノ基、ハロゲン原子、ハロゲノスルホニル基、ボロン酸基、アジド基、アルケニル基、アルキニル基、チオール基およびジスルフィド基から選ばれる結合基を示し、環A’は独立して、アルキル基、アルコキシ基、チオアルコキシ基、アルケニル基、アルキニル基、アリール基、ヘテロアリール基、カルボニル基、シアノ基、ハロゲン原子、ニトロ基、ホスホリル基およびスルホニル基から選ばれる1以上の置換基を有していてもよい。)で表される(チオ)エーテル化合物。
【請求項19】
Xが酸素原子である、請求項18記載の化合物。
【請求項20】
請求項18または19記載の化合物の、質量分析用イオン化標識剤としての使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2008−64739(P2008−64739A)
【公開日】平成20年3月21日(2008.3.21)
【国際特許分類】
【出願番号】特願2007−163180(P2007−163180)
【出願日】平成19年6月20日(2007.6.20)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成18年3月6日 日本薬学会第126年会組織委員会発行の「日本薬学会第126年会要旨集 1・4」に発表
【出願人】(504205521)国立大学法人 長崎大学 (226)
【Fターム(参考)】
【公開日】平成20年3月21日(2008.3.21)
【国際特許分類】
【出願日】平成19年6月20日(2007.6.20)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成18年3月6日 日本薬学会第126年会組織委員会発行の「日本薬学会第126年会要旨集 1・4」に発表
【出願人】(504205521)国立大学法人 長崎大学 (226)
【Fターム(参考)】
[ Back to top ]

