アリルハイドロカーボン受容体キメラタンパク質、それをコードする遺伝子、発現ベクター、形質転換細胞、および被験物質の毒性検出方法
【課題】化学物質毒性の高感度検出に有用なAhRキメラタンパク質を提供すること。
【解決手段】bHLHドメインおよびPASドメインを含む、ラット由来のアリルハイドロカーボン受容体(AhR)のN末端領域、および転写活性化ドメインを含む、マウス由来のAhRのC末端領域をN末端から順に含むAhRキメラタンパク質。
【解決手段】bHLHドメインおよびPASドメインを含む、ラット由来のアリルハイドロカーボン受容体(AhR)のN末端領域、および転写活性化ドメインを含む、マウス由来のAhRのC末端領域をN末端から順に含むAhRキメラタンパク質。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、化学物質毒性の高感度検出に有用なアリルハイドロカーボン受容体キメラタンパク質、それをコードする遺伝子、当該遺伝子を含む発現ベクター、当該発現ベクターを含む形質転換細胞、および当該形質転換細胞を用いて被験物質の毒性を検出する方法に関する。
【背景技術】
【0002】
今日、多様な化学物質が産業活動や日常生活の中で使用され、様々な過程において、意図的あるいは非意図的に環境中に排出され、重大な環境問題のひとつとなっている。このように環境中に排出される化学物質のなかでも、ダイオキシン類(DXNs)やポリ塩化ビフェニル類(PCBs)、あるいは芳香族炭化水素類(PAHs)は、ごく微量で人や野生生物に対して多様な毒性を示すことから、これらの化学物質を環境中から迅速かつ高感度に検出する手法の開発が求められている。
【0003】
これまでの研究から、DXNs、PCBs、PAHsの毒性の多くは、共通の受容体型の転写制御因子、すなわちアリルハイドロカーボン受容体(AhR; arylhydrocarbon receptor)を介して発現することが明らかにされている。AhRは、DXNs、PCBs、PAHsに高い親和性を持つ受容体であり、細胞内に取り込まれたこれらの化学物質と結合して活性化される。基質との結合により活性化されたAhRは、細胞の核内に移動して、生体異物応答配列(XRE; xenobiotic responsive elements)などの特異的な結合配列に結合し、標的となる遺伝子の転写誘導を引き起こすことにより、DXNs、PCBs、PAHsの毒性発現に機能するといわれている。図7にアリルハイドロカーボン受容体(AhR)による遺伝子の転写活性化メカニズムを模式的に示す。図7は、ダイオキシン類が、細胞内のAhRに結合して複合体を形成し、遺伝子の特定の配列(すなわち、生体異物応答配列XRE; 5’- GCGTG -3’)に結合することにより、下流遺伝子(たとえば、薬物代謝酵素CYP1A1)の発現を活性化することを示す。図7において、HSPは熱ショックタンパク質(heat shock protein)を示し、Arntは、アリルハイドロカーボン受容体核内トランスロケーター(aryl hydrocarbon receptor nuclear translocator)を示す。
【0004】
上述のAhRを介した転写活性化メカニズムに基いて、基質との結合で活性化されたAhRと、その特異的な結合配列との結合を指標として、環境中のDXNs、PCBs、PAHsを検出する手法が開発されている。このような手法には、たとえば、ラットAhR遺伝子を導入した神経芽細胞腫細胞を用いて、AhRがリガンドを結合したことにより発現が誘導される細胞内マーカー遺伝子(チロシン水酸化酵素遺伝子など)の発現変化を測定することで、環境中のDXNs、PCBs、PAHsを検出するアッセイがある(特許文献1および2)。しかしながら、環境中のDXNs、PCBs、PAHsは、ごく微量で人や野生生物に対して多様な毒性を示すことから、毒性を示す化学物質を検出する手法の更なる高感度化が求められている。
【特許文献1】特開2005-328714号公報
【特許文献2】特開2006-325551号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、化学物質毒性の高感度検出に有用なAhRキメラタンパク質を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明の第一の側面によると、bHLHドメインおよびPASドメインを含む、ラット由来のアリルハイドロカーボン受容体(AhR)のN末端領域、および転写活性化ドメインを含む、マウス由来のAhRのC末端領域をN末端から順に含む、AhRキメラタンパク質が提供される。
【0007】
本発明の第二の側面によると、上記AhRキメラタンパク質をコードするAhR融合遺伝子が提供される。
【0008】
本発明の第三の側面によると、上記AhR融合遺伝子を含む発現ベクターが提供される。
【0009】
本発明の第四の側面によると、上記発現ベクターが哺乳類細胞に導入された形質転換細胞、並びに上記発現ベクターが哺乳類細胞に導入され、かつリガンドを結合したAhRが結合可能なAhR結合配列と、リガンド結合AhRの前記AhR結合配列への結合により発現が誘導されるレポーター遺伝子とを含む第二の発現ベクター(レポーターベクター)が更に導入された形質転換細胞が提供される。
【0010】
本発明の第五の側面によると、上記形質転換細胞を被験物質に暴露する工程と、AhRの活性化により発現が誘導される細胞内マーカー遺伝子または前記レポーター遺伝子の発現レベルを、前記形質転換細胞において測定する工程と、前記工程で測定された細胞内マーカー遺伝子またはレポーター遺伝子の発現レベルを、被験物質に暴露されていない前記形質転換細胞における細胞内マーカー遺伝子またはレポーター遺伝子の発現レベルと比較する工程とを含む、被験物質の毒性を検出する方法が提供される。
【発明の効果】
【0011】
本発明のAhRキメラタンパク質を導入した形質転換細胞を用いて、被験物質の毒性を高感度に検出することが可能である。
【発明を実施するための最良の形態】
【0012】
本発明者らは、マウスとラットのAhRを遺伝子工学的に融合したAhRキメラタンパク質が、ダイオキシン類、ポリ塩化ビフェニル類、芳香族炭化水素類に対して高応答性を有することを見出し、本発明を完成させるに至った。
【0013】
1.アリルハイドロカーボン受容体(AhR)キメラタンパク質
AhRタンパク質に関しては、該タンパク質の機能が、独立した複数のドメインによって制御されることが知られている。すなわち、AhRのN末端側には、Arnt(アリルハイドロカーボン受容体核内トランスロケーター;aryl hydrocarbon receptor nuclear translocator)とのヘテロダイマー形成やDNAへの結合に関わる「bHLHドメイン (basic helix-loop-helix domain)」と、基質との結合やタンパク質-タンパク質の相互作用に関わる「PASドメイン」が存在し、C末端側には標的遺伝子の発現応答性に関わる「転写活性化ドメイン」が存在することが知られている。
【0014】
一つの態様において本発明のアリルハイドロカーボン受容体(AhR)キメラタンパク質は、
bHLHドメインおよびPASドメインを含む、ラット由来のAhRのN末端領域、および
転写活性化ドメインを含む、マウス由来のAhRのC末端領域
をN末端から順に含む。
【0015】
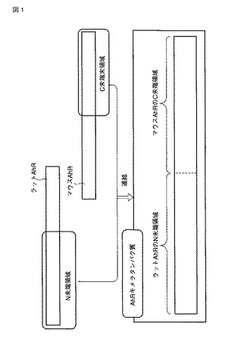
本発明のAhRキメラタンパク質を模式的に図1に示す。図1に示すように、本発明のAhRキメラタンパク質は、ラット由来のAhRのN末端領域とマウス由来のAhRのC末端領域が連結されたキメラタンパク質である。
【0016】
具体的な態様において、本発明のAhRキメラタンパク質は、
ラット由来のAhRの第13番〜第85番のアミノ酸配列(配列番号2)を含むbHLHドメイン、
ラット由来のAhRの第117番〜第384番のアミノ酸配列(配列番号4)を含むPASドメイン、および
マウス由来のAhRの第593番〜第805番のアミノ酸配列(配列番号6)を含む転写活性化ドメイン
をN末端から順に含む。配列番号2により示されるアミノ酸配列は、bHLHドメインとして機能し得る最小単位を意味し、配列番号4により示されるアミノ酸配列は、PSAドメインとして機能し得る最小単位を意味し、配列番号6により示されるアミノ酸配列は、転写活性化ドメインとして機能し得る最小単位を意味する。なお、配列番号2、4および6に示されるアミノ酸配列は、それぞれ配列番号1、3および5に示されるヌクレオチド配列にコードされる。これらの機能ドメインは、AhRタンパク質としての機能を損なわない限り、連結のためのリンカー配列(たとえば5〜20個のアミノ酸配列)により連結されていてもよい。
【0017】
たとえば、AhRキメラタンパク質の好ましい様態のひとつとして、ラットAhRの第1番〜第384番のアミノ酸配列(配列番号8)を少なくとも含む領域と、マウスAhRの第593番〜第805番のアミノ酸配列(配列番号6)を少なくとも含む領域を、N末端から順に含むキメラタンパク質が挙げられる。配列番号8により示されるアミノ酸配列は、bHLHドメインおよびPASドメインとして機能し得る最小単位を意味し、配列番号6により示されるアミノ酸配列は、転写活性化ドメインとして機能し得る最小単位を意味する。なお、配列番号8および6に示されるアミノ酸配列は、それぞれ配列番号7および5に示されるヌクレオチド配列にコードされる。これらの機能ドメインは、AhRタンパク質としての機能を損なわない限り、連結のためのリンカー配列(たとえば5〜20個のアミノ酸配列)により連結されていてもよい。
【0018】
本発明のAhRキメラタンパク質の一例として、ラット由来のAhRの第1番〜第422番のアミノ酸配列(配列番号10)、およびマウス由来のAhRの第419番〜第805番のアミノ酸配列(配列番号12)をN末端から順に含むAhRキメラタンパク質が挙げられる。後述の実施例では、配列番号10のアミノ酸配列(422アミノ酸)と配列番号12のアミノ酸配列(387アミノ酸)が、リンカー配列なしで直接連結された809アミノ酸のAhRキメラタンパク質(配列番号14)が作成されているが、AhRタンパク質としての機能を損なわない限り、連結のためのリンカー配列(たとえば5〜20個のアミノ酸配列)を含んでいてもよい。
【0019】
本発明のAhRキメラタンパク質は、遺伝子工学的手法に従ってこれをコードする融合遺伝子を調製し、それを発現させることにより作成することができる(後述の融合遺伝子の作成方法および実施例参照)。
【0020】
2.AhRキメラタンパク質をコードする遺伝子
AhRキメラタンパク質をコードする融合遺伝子は、上述のAhRキメラタンパク質をコードするものである。AhRキメラタンパク質をコードする融合遺伝子の一例として、ラット由来のアリルハイドロカーボン受容体(AhR)の第1番〜第422番のアミノ酸配列(配列番号10)、およびマウス由来のAhRの第419番〜第805番のアミノ酸配列(配列番号12)をN末端から順に含むAhRキメラタンパク質をコードする遺伝子が挙げられる。また、一例として、配列番号13に記載のヌクレオチド配列からなる、AhRキメラタンパク質をコードする遺伝子が挙げられる。
【0021】
融合遺伝子は、たとえば、以下に記載のとおり作成することができる(後述の実施例1および2参照)。
【0022】
(a)AhRタンパク質をコードする遺伝子のクローニング
ラットのSD系統とマウスのC57BL6系統のAhRをコードする遺伝子の塩基配列はいずれも公知である。したがって、ラットAhR遺伝子およびマウスAhR遺伝子のクローニングは、たとえばポリメラーゼ連鎖反応(PCR)などの遺伝子増幅法やファージー・ライブラリーのスクリーニングなどにより、クローニングできる。PCRでクローニングをおこなう場合、C57BL6系統のマウス、ならびにSD系統のラットから抽出したRNAを逆転写してcDNAを合成し、これを鋳型としたPCRによってAhR遺伝子を増幅後、任意のベクターにクローニングすることができる。
【0023】
(b)AhRキメラタンパク質をコードする遺伝子の作製
(a)に述べた方法でクローニングした遺伝子を用いて、たとえば、ラットSD系統のAhRの第1番〜第422番のアミノ酸配列に由来するペプチドと、マウスC57BL6系統のAhRの第419番〜第805番のアミノ酸配列に由来するペプチドを連結し、AhRキメラタンパク質をコードする遺伝子を作製することができる。具体的には、(a)に述べた方法でクローニングしたラットSD系統のAhR遺伝子とマウスC57BL6系統のAhR遺伝子を制限酵素BamHIの認識部位で、ラットSD系統のAhRが5’側となるように連結すればよい。あるいは、ラットSD系統のAhRの第1番〜第422番のアミノ酸をコードする塩基配列、ならびにマウスC57BL6系統のAhRの第419番〜第805番のアミノ酸をコードする塩基配列をPCRによって増幅し、これを連結してもよい。あるいは、ラットSD系統のAhRの第1番〜第422番のアミノ酸をコードする塩基配列と、マウスC57BL6系統のAhRの第419番〜第805番のアミノ酸をコードする塩基配列を連結した遺伝子を人工的に合成してもよい。
【0024】
3.AhRキメラタンパク質をコードする遺伝子を含む発現ベクター
本発明の発現ベクターは、上述のAhRキメラタンパク質をコードする融合遺伝子を含む。好ましい態様において、本発明の発現ベクターは、上述のAhRキメラタンパク質をコードする融合遺伝子と、当該融合遺伝子の宿主細胞内での発現を可能とするプロモーターと、該宿主細胞で機能する転写終結シグナルとからなる発現カセットを有する。本発明の発現ベクターの一例を模式的に図2に示す。図2において発現ベクターは、SV40初期プロモーター(配列番号15)、SD系統ラット由来のAhRタンパク質の第1番〜第422番アミノ酸をコードする塩基配列(配列番号9)、C57BL6系統マウス由来のAhRタンパク質の第419番〜第805番アミノ酸をコードする塩基配列(配列番号11)、およびSV40ポリアデニル化部位を含む。
【0025】
AhRキメラタンパク質を細胞内で発現させるための発現ベクターは、たとえば、以下に記載のとおり作成することができる(後述の実施例2参照)。
【0026】
このような発現ベクターの作成は、上述のとおり作製したAhRキメラタンパク質をコードする遺伝子を、任意のプロモーターの下流に機能的に連結すればよい。「機能的に連結する」とは、連結された領域が、その領域の機能を発揮するように連結されていることを意味する。具体的には、AhRキメラタンパク質をコードする遺伝子がプロモーター活性により発現されるように連結されていることを意味する。プロモーターは、AhRキメラタンパク質を発現させる宿主細胞の種類にあわせて選択する。たとえば、AhRキメラタンパク質を発現させるときは、哺乳類細胞で機能するプロモーターを選択する。このようなプロモーターとしては、たとえばSV40の初期プロモーター(配列番号15)や後期プロモーター、ヘルペスウイルスのチミジンキナーゼプロモーター、サイトメガロウイルスのプロモーターなどが挙げられる。さらにベクター上には、大腸菌内でベクターの複製に必要な複製起点、あるいはベクターを細胞に導入した際に、ベクター導入細胞の選抜を容易にするための薬剤耐性遺伝子、たとえばアンピシリン耐性遺伝子、カナマイシン耐性遺伝子などが組み込まれていることが望ましい。
【0027】
4.発現ベクターを含む形質転換細胞
本発明の形質転換細胞は、上述のAhRキメラタンパク質発現ベクターを哺乳類細胞に導入したものである。
【0028】
(1)宿主細胞
本発明の発現ベクターを導入するための宿主細胞は、何れの哺乳類細胞であることもできる。哺乳類細胞の種類は、発現ベクターに含まれるプロモーターが機能する細胞であればよく、たとえば初代培養細胞であっても、不死化した培養細胞であってもよい。宿主細胞は、発現されるAhRキメラタンパク質が、宿主細胞内の既存のAhRタンパク質により希釈されないように、AhRタンパク質が発現していないか、または低いレベルで発現している細胞が好ましい。
【0029】
哺乳類細胞は、たとえば、ヒト細胞、マウス細胞またはラット細胞である。特に、宿主細胞は、神経由来の細胞、とりわけ中枢神経系に由来する細胞であることが望ましい。神経由来細胞は、たとえば、ヒト神経由来細胞、マウス神経由来細胞またはラット神経由来細胞である。具体的には、神経芽細胞腫、とりわけマウスの神経芽細胞腫であるNeuro2aなどを使用することができる。
【0030】
(2)好ましい態様
好ましい態様において、本発明の形質転換細胞は、上述の本発明のAhRキメラタンパク質発現ベクターに加えて、リガンドを結合したAhRが結合可能なAhR結合配列と、リガンド結合AhRの前記AhR結合配列への結合により発現が誘導されるレポーター遺伝子とを含む第二の発現ベクター(以下、レポーターベクターともいう)が更に導入されている。この好ましい態様の形質転換細胞を模式的に図4に示す。
【0031】
レポーターベクターについては、その一例を模式的に図3に示す。図3においてレポーターベクターは、チロシン水酸化酵素(TH)遺伝子のAhR結合配列(配列番号16)、TH遺伝子のコア・プロモーター(配列番号17)、ホタル・ルシフェラーゼ遺伝子、およびSV40ポリアデニル化配列を含む。
【0032】
レポーターベクターにおいて「リガンドを結合したAhRが結合可能なAhR結合配列(単にAhR結合配列ともいう)」を含む塩基配列は、たとえば、チロシン水酸化酵素(TH)遺伝子の上流領域に由来する塩基配列(配列番号16)、シトクロムP450 1A1(CYP1A1)遺伝子の上流領域に由来する塩基配列(配列番号18、配列番号19)、グルタチオンS転移酵素Ya(GST-Ya)遺伝子の上流領域に由来する塩基配列(配列番号20)、またはグルクロン酸転移酵素1A6(UGT1A6)遺伝子の上流領域に由来する塩基配列(配列番号21)を使用することができる。AhR結合配列は、リガンドを結合したAhRの結合効率を高めるために、複数のAhR結合配列(たとえば2〜10個のAhR結合配列)が直列的に連結した繰返し配列を使用してもよい(後述の実施例3参照)。
【0033】
レポーターベクターにおいて「レポーター遺伝子」は、レポーター遺伝子アッセイで使用されることが既知の任意のレポーター遺伝子を使用することができる。レポーター遺伝子は、その産物の活性が簡単に測定でき、測定バックグラウンドの低いものが好ましく、たとえばこのような遺伝子として、遺伝子産物を発光で検出できるルシフェラーゼ遺伝子、蛍光で検出できる緑色蛍光タンパク質遺伝子、発色で検出できるβ−ガラクトシダーゼ遺伝子、放射線活性で検出できるクロラムフェニコール・アセチルトランスフェラーゼ遺伝子などが挙げられる。
【0034】
レポーター遺伝子は、リガンド結合AhR(活性化AhR)のAhR結合配列への結合により発現が誘導される。レポーター遺伝子は、活性化AhRのAhR結合配列への結合により発現が誘導されるように、一般的にはAhR結合配列の下流に配置される。
【0035】
なお、上述のAhRキメラタンパク質発現ベクター、第二の発現ベクター(レポーターベクター)は、その他、種々のエレメントを含むことができる。たとえば、適切な微生物内で機能する複製起点および薬剤耐性遺伝子などを組み込むことができる。また、ベクターを細胞の染色体上に組み込んで安定に保持させるために、ベクター内に哺乳類用の薬剤耐性遺伝子を組み込んでおくことができる。このような哺乳類用の薬剤耐性遺伝子には、たとえばゼオシン耐性遺伝子およびハイグロマイシン耐性遺伝子などがあげられる。また、マルチクローニングサイトなどの適切な制限酵素部位を有することもできる。
【0036】
AhRキメラタンパク質発現ベクター、第二の発現ベクター(レポーターベクター)は、環状のプラスミドDNA、ウイルスベクターDNA、直鎖のDNA断片など任意の形態であり得る。
【0037】
(3)調製方法
AhRキメラタンパク質を産生する形質転換細胞は、たとえば、以下に記載のとおり、上述のAhRキメラタンパク質発現ベクターを哺乳類細胞に導入することにより作成することができる(後述の実施例4および5参照)。
【0038】
AhRキメラタンパク質発現ベクターの細胞への導入は一過的な導入であっても、安定な導入であってもよい。AhRキメラタンパク質発現ベクターを一過的に導入する例では、哺乳類細胞を培養容器に播き、10%牛胎児血清を含むMEMダルベッコ・ハムF12等比混合(DF1:1)培地などの培地中において、5%CO2条件下で37℃において数時間から1晩程度インキュベートする。このように培養した細胞に上記AhRキメラタンパク質発現ベクターを導入する。細胞へのAhRキメラタンパク質発現ベクターの導入法としては、たとえばリポフェクタミン法、エレクトロポレーション法、DEAE-デキストラン法、リン酸カルシウム法などの当業者に既知のいずれの方法を使用して行うこともできる。たとえば、リポフェクタミン2000(インビトロジェン社製)を使用することもでき、市販のマニュアルに従って、導入するベクターの量、リポフェクタミン2000の量、および細胞数などをあらかじめ決定しておくことが好ましい。細胞に導入するベクターは、適当な制限酵素で消化して直鎖状にしてから導入してもよい。
【0039】
また、AhRキメラタンパク質発現ベクターに加えてレポーターベクターを細胞に導入する場合、レポーターベクターも同様の処理により細胞に導入することができる。この場合、AhRキメラタンパク質発現ベクターとレポーターベクターの両方を含む溶液を用いて1回の導入処理で行ってもよいし、AhRキメラタンパク質発現ベクターとレポーターベクターを別々の導入処理で細胞に導入してもよい。
【0040】
5.形質転換細胞を用いて被験物質の毒性を検出する方法
本発明の形質転換細胞を用いて被験物質の毒性を検出する方法には、以下の3つの態様が含まれる。
【0041】
第一の態様では、AhRキメラタンパク質発現ベクターに加えてレポーターベクターを導入した形質転換細胞(図4参照)を用いて、導入されたレポーター遺伝子の発現レベルの変化に基いて被験物質の毒性を検出する。
【0042】
第二の態様では、AhRキメラタンパク質発現ベクターを導入した形質転換細胞を用いて、細胞内マーカー遺伝子の発現レベルの変化に基いて被験物質の毒性を検出する。
【0043】
第三の態様では、AhRキメラタンパク質発現ベクターを導入した神経芽細胞腫細胞を用いて、この神経芽細胞腫細胞の形態変化に基いて被験物質の毒性を検出する。
【0044】
本発明の「被験物質の毒性を検出する方法」を用いて、被験物質が、ダイオキシン毒性、ポリ塩化ビフェニル毒性、または芳香族炭化水素毒性を有するか否かを検出することができる。なお、第一および第二の態様の詳細については、ぞれぞれ後述の実施例4および5を参照することもできる。
【0045】
(1)第一の態様
第一の態様では、AhRキメラタンパク質発現ベクターおよびレポーターベクターを導入した哺乳類細胞(図4参照)を使用する。この細胞を、被検物質を未曝露の条件下と曝露条件下で培養する。被検物質存在下での培養時間は、使用する哺乳類細胞に応じて適切な時間を予備実験によりあらかじめ決定するのが望ましいが、通常は2時間〜3日程度が好ましい。
【0046】
被験物質の毒性検出は、被験物質に暴露条件下で培養した細胞と未暴露条件下で培養した細胞におけるレポーター遺伝子の発現レベルの比較によりおこなう。遺伝子の発現レベルは、当該技術分野で公知の手法に従って測定することができる。ここで発現レベルの測定は、レポーター遺伝子の発現量(mRNA量)を測定してもよいし、レポータータンパク質(レポーター遺伝子産物)の発現量を測定してもよい。
【0047】
被験物質に未暴露の条件下に比較して、被験物質暴露した条件下において、細胞から抽出したレポーター遺伝子、あるいはレポータータンパク質の発現量が増加していた場合、被験物質が毒性を有すると判断する。
【0048】
被験物質の毒性の有無をレポーター遺伝子の発現量で判断する場合には、被験物質に暴露した細胞からRNAを抽出して遺伝子の発現量を測定すればよい。遺伝子の発現量の測定には、公知の方法を用いればよく、このような方法としては逆転写PCR法やノザンハイブリダイゼーション法などが挙げられる。
【0049】
被験物質の毒性の有無をレポータータンパク質の発現量で判断する場合には、被験物質に暴露した細胞からタンパク質を抽出して遺伝子の発現量を測定すればよい。遺伝子の発現量の測定には、公知の方法を用いればよく、このような方法としてはウエスタンブロッティングやELISA、あるいはレポータータンパク質が酵素の場合には酵素活性を測定する方法などがある。
【0050】
(2)第二の態様
第二の態様では、AhRキメラタンパク質発現ベクターのみを導入した哺乳類細胞を使用する。第二の態様では、レポーター遺伝子が細胞に導入されておらず、細胞内マーカー遺伝子の発現レベル(遺伝子またはタンパク質の発現量)を測定する。このように第二の態様は、測定対象が、レポーター遺伝子ではなく細胞内マーカー遺伝子である点で第一の態様とは異なるため、以下、第一の態様と異なる点のみ説明する。
【0051】
細胞内マーカー遺伝子は、リガンドが結合したAhRの作用によりその発現が増大することが知られている細胞内遺伝子であり、たとえば、チロシン水酸化酵素(TH)遺伝子、シトクロムP450 1A1(CYP1A1)遺伝子、シトクロムP450 1A2(CYP1A2)遺伝子、グルタチオンS転移酵素(GST)遺伝子、グルクロン酸転移酵素1A6(UGT1A6)遺伝子などが挙げられる。
【0052】
第一の態様と同様、被験物質の毒性検出は、被験物質に暴露条件下で培養した細胞と未暴露条件下で培養した細胞における細胞内マーカー遺伝子の発現量、あるいはマーカータンパク質(マーカー遺伝子産物)の発現量の比較によりおこなう。
【0053】
(3)第三の態様
第三の態様では、AhRキメラタンパク質発現ベクターのみを導入した神経芽細胞腫細胞を使用する。
【0054】
第三の態様で使用される神経芽細胞腫細胞は、アリルハイドロカーボン受容体(AhR)の基質を添加すると、未添加のときと比べて細胞の形態が変化する細胞である。たとえば、AhRの基質を未添加の状態で突起の伸長がみられるが、AhRの基質を添加すると、伸長する突起の頻度が減少する細胞(特開2005-328714号公報参照)、またはAhRの基質を未添加の状態では突起の伸長がみられず、AhRの基質を添加すると突起の伸長がみられる細胞(特開2006-325551号公報参照)が挙げられる。これら細胞としては、神経芽細胞腫細胞にAhRキメラタンパク質発現ベクターを導入し、AhRの基質を添加したときに突起の伸長に変化が観察される細胞を選択して使用してもよい。
【0055】
このような神経芽細胞腫細胞を被験物質に暴露し、細胞に所定の形態変化が観察されるか否かを観察することにより、被験物質の毒性を検出することができる。
【実施例】
【0056】
[実施例1] AhR遺伝子のクローニング
(1)ラットAhR遺伝子
SD系統のラットの脳から全RNAを抽出して、これを鋳型にオリゴ(dT)プライマーをもちいて逆転写した。この逆転写したサンプルから、Pyrobest DNAポリメラーゼ(タカラバイオ)を用いたPCR(変性:94℃ 1分、アニーリング:55℃ 1分、伸長:72℃ 4分を1サイクルとして25サイクルの反応)により、SD系統ラットのAhR遺伝子コーディング領域を増幅した。プライマーにはSD系統のAhR遺伝子に特異的な下記プライマーを使用した。プライマーの5’末端には、PCR産物のベクターへの組み込みを容易にするための制限酵素HindIII(フォワードプライマー)、XhoI(リバースプライマー)の認識配列を付加した。
【0057】
フォワードプライマー:5’- CCCAAGCTTACCATGAGCAGCGGCGCCAACATCA -3’(配列番号22)
リバースプライマー:5’- CCGCTCGAGAGGAATCCGCTGGGTGTGATATCAG -3’(配列番号23)。
【0058】
増幅したラットSD系統のAhR遺伝子を発現させるためのベクター(増幅したラットSD系統のAhR遺伝子をpcDNA4/V5-His Bベクター(インビトロジェン)に組み込んだ組換えベクター)は、以下のとおり調製した。すなわち、増幅したラットSD系統のAhR遺伝子を、制限酵素HindIIIとXhoIで消化後、0.8% アガロースで電気泳動をおこない、対応するバンドを切り出して、QIA quick Gel Extraction Kit(キアゲン)で精製し、同様にHindIII と XhoIで消化したpcDNA4/V5-His Bベクターに組み込んだ。このように調製されたベクターでは設計上、AhR遺伝子は、AhR遺伝子のC末端にHisタグとV5エピトープが付加された融合タンパク質として発現する。そこで、AhRが融合タンパク質として発現しないようにするため、上述の調製されたベクターを鋳型として、下記プライマーにより、AhRのコーディング領域のみを増幅して、PGV-P2ベクター(TOYO B-Net)のHindIIIとXbaIサイトに挿入した。このとき、AhRの増幅に使用したプライマーの5’末端には、PCR産物のベクターへの組み込みを容易にするための制限酵素HindIII(フォワードプライマー)、XbaI(リバースプライマー)の認識配列を付加した。
【0059】
フォワードプライマー:5’- CCCAAGCTTACCATGAGCAGCGGCGCCAACATCA -3’(配列番号22)
リバースプライマー:5’- CGGTCTAGAGCTACAGGAATCCGCTGGGTGT -3’(配列番号24)。
【0060】
なお、本実施例では、ラットAhR遺伝子をクローニングするために2回の増幅を行っているが、ラットAhR遺伝子のクローニングは、上記配列番号22および24のプライマーを用いて、細胞から抽出したRNAを鋳型に、直接AhRのコーディング領域を増幅して、PGV-P2ベクターに組み込むことによっても可能である。
【0061】
増幅したラットSD系統由来のAhR遺伝子のコーディング領域は、制限酵素HindIIIとXbaIで消化後、0.8% アガロースで電気泳動をおこない、対応するバンドを切り出して、QIA quick Gel Extraction Kitで精製し、同様にHindIIIとXbaIで消化したPGV-P2ベクターに組み込み、SD系統ラットのAhR遺伝子発現ベクター;PGV-rAhRとした。
【0062】
(2)マウスAhR遺伝子
C57/BL6系統のマウスの肝臓から全RNAを抽出し、これを鋳型として上記と同様の反応条件でPCRをおこない、C57/BL6系統マウスのAhR遺伝子コーディング領域を増幅した。プライマーにはC57/BL6系統のマウスAhR遺伝子に特異的な下記プライマーをもちいた。プライマーの5’末端は、PCR産物のベクターへの組み込みを用意にするために制限酵素HindIII(フォワードプライマー)、XbaI(リバースプライマー)の認識配列を付加した。
【0063】
フォワードプライマー:5’- CCCAAGCTTATGAGCAGCGGCGCCAACATCACC -3’(配列番号25)
リバースプライマー:5’- CCCTCTAGATCAACTCTGCACCTTGCTTAGGAA -3’(配列番号26)
C57/BL6系統のマウスAhR遺伝子は、制限酵素HindIIIとXbaIで消化後、0.8% アガロースで電気泳動をおこない、対応するバンドを切り出して、QIA quick Gel Extraction Kitで精製し、同様にHindIIIとXbaIで消化したPGV-P2ベクターに組み込み、C57/BL6系統マウスのAhR遺伝子発現ベクター;PGV-mAhRとした。
【0064】
上記のAhR発現用ベクターPGV-rAhRおよびPGV-mAhRはいずれも大腸菌TOP10(インビトロジェン)に導入して増幅と維持をおこなった。
【0065】
[実施例2] AhRキメラタンパク質をコードする遺伝子の作製、ならびにAhRキメラタンパク質発現ベクターの構築
PGV-mAhRを制限酵素BamHIで消化後、0.8% アガロースによる電気泳動をおこない、C57BL6系統マウスのAhR遺伝子の3’末端側を含むDNA断片を切り出し、QIA quick Gel Extraction Kit で精製し、「インサートのDNA断片」を調製した。
【0066】
PGV-rAhRを制限酵素BamHIで消化後、アルカリホスファターゼ処理により、DNA末端のリン酸基を除去した。処理後のPGV-rAhRは、0.8% アガロースによる電気泳動後、PGV-P2ベクターとSD系統ラットのAhRの5’末端側を含むDNA断片のバンドを切り出し、QIA quick Gel Extraction Kitで精製し、「ベクターのDNA断片」を調製した。
【0067】
SD系統ラットの5’末端側を含む「ベクターのDNA断片」と、C57BL6系統マウスの3’末端側を含む「インサートのDNA断片」を、T4 DNA ligaseを用いて連結し、AhRキメラタンパク質をコードする遺伝子を組み込んだ発現ベクター;PGV-rmAhRを作製した。PGV-rmAhRの発現カセット部分を図2に示した。PGV-rmAhRは、大腸菌TOP10に導入して、ベクターの増幅と維持をおこなった。
【0068】
[実施例3] TH遺伝子のAhR結合配列を組み込んだレポーターベクターの調製
TH転写制御領域内のAhR結合配列(配列番号16)は、下記プライマー・セットを用いて増幅した。
【0069】
フォワードプライマー: 5’- AGCGGTACCCTGTCTTCATGTCGTGTCTAGG -3’(配列番号27)
リバースプライマー: 5’- AGCGCTAGCTGCATCCACTGTCGCAGGCACC -3’(配列番号28)
プライマーの5’末端には、いずれも、PCR増幅断片のベクターの組み込みを容易にすることを目的に、制限酵素KpnI(フォワードプライマー)、NheI(リバースプライマー)の認識配列を付加した。増幅後のDNA断片はT4 DNA ligaseでタンデムに連結した。このDNA断片を、制限酵素KpnIとNheIで部分消化した後、アガロース電気泳動をおこない、配列番号16のDNAが3つタンデムに連結された断片をQIA quick Gel Extraction Kit(キアゲン社製)で精製し、「TH遺伝子のAhR結合配列」としてベクターに組み込んだ。ベクターは、ホタル・ルシフェラーゼ遺伝子を予め含むPGV-P2ベクターをベースに、同ベクター上のSV40プロモーターを、下記プライマーにより増幅したTH遺伝子のコア・プロモーター(配列番号17)に組み換えたpTHP100/Lucを調製して使用した。
【0070】
フォワードプライマー: 5’- CGGCTCGAGGTGGGGGACCCAGAGGGGCTTTGAC-3’(配列番号29)
リバースプライマー: 5’- GCAAAGCTTAAGCTGGTGGTCCCGAGTTCTGTCT -3’(配列番号30)。
【0071】
このベクター;pTHP100/LucのKpnIとNheIサイトに、上述の「TH遺伝子のAhR結合配列」を挿入し、最終的なレポーターベクターであるpTHE60x3/Lucを調製した。pTHE60x3/Lucの発現カセット部分を図3に示した。
【0072】
[実施例4] AhRキメラタンパク質をもちいたレポーター遺伝子アッセイによるダイオキシン異性体の検出
AhRキメラタンパク質を用いたレポーター遺伝子アッセイによるダイオキシン異性体の検出は、実施例3に記述のレポーターベクター;pTHE60x3/Lucを使用し、レポーター遺伝子アッセイでおこなった。本アッセイには、ダイオキシン異性体のひとつである2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)を使用した。
【0073】
ベクターの細胞への導入は、リポフェクタミン2000(インビトロジェン)を使用し、操作はInvitrogen社のマニュアルに従った。Opti-MEM培地50μlに懸濁した計0.8μgのベクター(0.4 μgのレポーターベクター、0.2 μgのAhRキメラタンパク質発現ベクターpPGV-rmAhR、および0.2 μgのpcDNA4/V5-His/lacZ)と、同様にOpti-MEM培地50μlに懸濁した2μlのリポフェクタミン2000を混合して20分間室温に静置し、核酸/リポフェクタミン2000の複合体を形成させた。これをDF1:1培地(10% 牛胎児血清を含む)500μl中で予め一晩培養したマウスの神経芽細胞腫Neuro2a(前日に0.8 x 105細胞で播種)に添加して、ベクターを細胞内に導入した。ベクター導入効率の向上と、導入ベクター由来のタンパク質発現を目的に、細胞はトランスフェクション後、さらに24時間培養した。また、AhRキメラタンパク質と検出感度を比較するため、上記と同様の方法で、PGV-rAhR(ラットAhR発現ベクター)を導入した細胞、ならびにPGV-mAhR(マウスAhR発現ベクター)を導入した細胞も調製した。
【0074】
TCDDは、関東化学より購入したジメチルスルフォキシド溶解品を使用した。トランスフェクションから24時間後、細胞の培地を取り除いてから、新たにTCDD暴露条件の細胞にそれぞれ0、1、100、10000 pg/mlのTCDDを含む培地を加えて、さらに24時間培養した。24時間後に培地を取り除き、細胞をリン酸緩衝液で2回洗浄した後、タンパク質抽出用の溶液(TOYO B-NET社製)をウェルあたり100μlずつ加えて、室温で15分間穏やかに攪拌してから、-80℃で溶液を凍結させた。凍結した溶液は室温で解凍後、チューブに回収し、ルシフェラーゼ活性とβ-ガラクトシダーゼ活性を測定した。結果を図5に示す。レポーターであるルシフェラーゼの活性は、β-ガラクトシダーゼ ng 当たりの1秒間の相対発光強度(RLU /sec / ng β-galactosidase)に換算して表した。
【0075】
図5に示すように、PGV-rAhR(ラットAhR)およびPGV-mAhR(マウスAhR)を導入した細胞では、0 pg/ml TCDD暴露条件下と1 pg/ml TCDD暴露条件下で、レポーター遺伝子の発現量に統計学的に有意な差は見られなかった。これに対して、AhRキメラタンパク質の発現ベクター;PGV-rmAhRを導入した細胞では、TCDD未暴露条件下に比べ、1 pg/ml TCDD暴露条件下において、レポーター遺伝子の発現量が統計学的に有意に増加しており、TCDD検出感度の向上が確認された。またPGV-rmAhRを導入した細胞では、中・高濃度(100 pg/mlと10000 pg/ml)のTCDD暴露条件下においても、レポーター遺伝子の応答性の向上(発現変化量の増加)が観察された。
【0076】
このようにAhRキメラタンパク質を用いた本発明の検出方法では、1 pg/mlの濃度のTCDDを検出することが可能であり、ラットAhRやマウスAhRを用いた場合より検出感度が増大した。また、検出感度の増大により、従来必要とされていた被験物質を含むサンプルの濃縮処理が、短時間で済み簡便になるという効果も奏される。
【0077】
[実施例5] AhRキメラタンパク質をもちいた逆転写PCRによるダイオキシン異性体の検出
AhRキメラタンパク質を用いた逆転写PCRによるダイオキシン異性体の検出は、ダイオキシン異性体のひとつである2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)を使用し、細胞内マーカー遺伝子にはチロシン水酸化酵素(TH)遺伝子およびシトクロムP450 1A1(CYP1A1)遺伝子をもちいた。
【0078】
AhRキメラタンパク質発現ベクターの細胞への導入は、リポフェクタミン2000(Invitrogen社)を使用し、操作はInvitrogen社のマニュアルに従った。Opti-MEM培地50μlに懸濁した計0.8μgのAhRキメラタンパク質発現ベクター; PGV-rmAhRと、同様にOpti-MEM培地50μlに懸濁した2μlのリポフェクタミン2000を混合して20分間室温に静置し、核酸/リポフェクタミン2000の複合体を形成させた。これをDF1:1培地(10% 牛胎児血清を含む)500μl中で予め一晩培養したマウスの神経芽細胞腫Neuro2a(前日に0.8 x 105細胞で播種)に添加して、ベクターを細胞内に導入した。ベクター導入効率の向上と、導入ベクター由来のタンパク質発現を目的に、細胞はトランスフェクション後、さらに24時間培養した。また、AhRキメラタンパク質と検出感度を比較するため、上記と同様の方法で、PGV-rAhR(ラットAhR発現ベクター)を導入した細胞、ならびにPGV-mAhR(マウスAhR発現ベクター)を導入した細胞も調製した。
【0079】
TCDDは、関東化学より購入したジメチルスルフォキシド溶解品を使用した。トランスフェクションから24時間後、細胞の培地を取り除いてから、新たにTCDD暴露条件の細胞にそれぞれ0、1、100、10000 pg/mlのTCDDを含む培地を加えて、さらに24時間培養した。24時間後に培地を取り除き、RNeasy Kit(キアゲン)を使用して、Total RNAを抽出した。抽出したRNAは、SuperScript First Strand System(インビトロジェン)で逆転写してcDNAに変換し、これを鋳型として、以下に示すTH遺伝子、ならびにCYP1A1遺伝子に特異的なプライマーを用いてPCR反応をおこなった。
【0080】
フォワードプライマー(TH遺伝子増幅用): 5’- CCCACAGCACCACAAGAGATA -3’(配列番号31)
リバースプライマー(TH遺伝子増幅用): 5’- AAGTAGGAGGCACAATGTC -3’(配列番号32)
フォワードプライマー(CYP1A1遺伝子増幅用): 5’- CCACGGTGTACTGGTTCACT -3’(配列番号33)
リバースプライマー(CYP1A1遺伝子増幅用): 5’- GGCATAGTTCCTGAGCTTGT -3’(配列番号34)。
【0081】
PCR反応後の溶液は、アガロースゲルで電気泳動した後、エチジウムブロマイドで染色して、PCR反応で増幅したTH遺伝子、ならびにCYP1A1遺伝子を可視化した。結果を図6に示す。図6に示したように、PGV-rmAhRを導入した細胞では、PGV-rAhRおよびPGV-mAhRを導入した細胞に比べて、TCDD暴露条件下でTH、CYP1A1両遺伝子の発現が高レベルに誘導されており、低濃度(1 pg/ml )のTCDDを検出することができた。
【図面の簡単な説明】
【0082】
【図1】本発明のAhRキメラタンパク質を模式的に示す図。
【図2】AhRキメラタンパク質を発現するベクターPGV-rmAhRの発現カセット部分を模式的に示す図。
【図3】レポーターベクターpTHE60x3/Lucの発現カセット部分を模式的に示す図。
【図4】AhRキメラタンパク質をコードする遺伝子を導入した本発明の形質転換細胞の一例を模式的に示す図。
【図5】AhRキメラタンパク質を発現する形質転換細胞を用いたレポーター遺伝子アッセイの結果を示すグラフ。
【図6】AhRキメラタンパク質を発現する形質転換細胞における、TCDDの添加に対する細胞内マーカー遺伝子の発現量の変化を示す電気泳動写真。
【図7】ダイオキシン類がアリルハイドロカーボン受容体(AhR)を介して遺伝子の転写を活性化するメカニズムを模式的に示す図。
【技術分野】
【0001】
本発明は、化学物質毒性の高感度検出に有用なアリルハイドロカーボン受容体キメラタンパク質、それをコードする遺伝子、当該遺伝子を含む発現ベクター、当該発現ベクターを含む形質転換細胞、および当該形質転換細胞を用いて被験物質の毒性を検出する方法に関する。
【背景技術】
【0002】
今日、多様な化学物質が産業活動や日常生活の中で使用され、様々な過程において、意図的あるいは非意図的に環境中に排出され、重大な環境問題のひとつとなっている。このように環境中に排出される化学物質のなかでも、ダイオキシン類(DXNs)やポリ塩化ビフェニル類(PCBs)、あるいは芳香族炭化水素類(PAHs)は、ごく微量で人や野生生物に対して多様な毒性を示すことから、これらの化学物質を環境中から迅速かつ高感度に検出する手法の開発が求められている。
【0003】
これまでの研究から、DXNs、PCBs、PAHsの毒性の多くは、共通の受容体型の転写制御因子、すなわちアリルハイドロカーボン受容体(AhR; arylhydrocarbon receptor)を介して発現することが明らかにされている。AhRは、DXNs、PCBs、PAHsに高い親和性を持つ受容体であり、細胞内に取り込まれたこれらの化学物質と結合して活性化される。基質との結合により活性化されたAhRは、細胞の核内に移動して、生体異物応答配列(XRE; xenobiotic responsive elements)などの特異的な結合配列に結合し、標的となる遺伝子の転写誘導を引き起こすことにより、DXNs、PCBs、PAHsの毒性発現に機能するといわれている。図7にアリルハイドロカーボン受容体(AhR)による遺伝子の転写活性化メカニズムを模式的に示す。図7は、ダイオキシン類が、細胞内のAhRに結合して複合体を形成し、遺伝子の特定の配列(すなわち、生体異物応答配列XRE; 5’- GCGTG -3’)に結合することにより、下流遺伝子(たとえば、薬物代謝酵素CYP1A1)の発現を活性化することを示す。図7において、HSPは熱ショックタンパク質(heat shock protein)を示し、Arntは、アリルハイドロカーボン受容体核内トランスロケーター(aryl hydrocarbon receptor nuclear translocator)を示す。
【0004】
上述のAhRを介した転写活性化メカニズムに基いて、基質との結合で活性化されたAhRと、その特異的な結合配列との結合を指標として、環境中のDXNs、PCBs、PAHsを検出する手法が開発されている。このような手法には、たとえば、ラットAhR遺伝子を導入した神経芽細胞腫細胞を用いて、AhRがリガンドを結合したことにより発現が誘導される細胞内マーカー遺伝子(チロシン水酸化酵素遺伝子など)の発現変化を測定することで、環境中のDXNs、PCBs、PAHsを検出するアッセイがある(特許文献1および2)。しかしながら、環境中のDXNs、PCBs、PAHsは、ごく微量で人や野生生物に対して多様な毒性を示すことから、毒性を示す化学物質を検出する手法の更なる高感度化が求められている。
【特許文献1】特開2005-328714号公報
【特許文献2】特開2006-325551号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、化学物質毒性の高感度検出に有用なAhRキメラタンパク質を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明の第一の側面によると、bHLHドメインおよびPASドメインを含む、ラット由来のアリルハイドロカーボン受容体(AhR)のN末端領域、および転写活性化ドメインを含む、マウス由来のAhRのC末端領域をN末端から順に含む、AhRキメラタンパク質が提供される。
【0007】
本発明の第二の側面によると、上記AhRキメラタンパク質をコードするAhR融合遺伝子が提供される。
【0008】
本発明の第三の側面によると、上記AhR融合遺伝子を含む発現ベクターが提供される。
【0009】
本発明の第四の側面によると、上記発現ベクターが哺乳類細胞に導入された形質転換細胞、並びに上記発現ベクターが哺乳類細胞に導入され、かつリガンドを結合したAhRが結合可能なAhR結合配列と、リガンド結合AhRの前記AhR結合配列への結合により発現が誘導されるレポーター遺伝子とを含む第二の発現ベクター(レポーターベクター)が更に導入された形質転換細胞が提供される。
【0010】
本発明の第五の側面によると、上記形質転換細胞を被験物質に暴露する工程と、AhRの活性化により発現が誘導される細胞内マーカー遺伝子または前記レポーター遺伝子の発現レベルを、前記形質転換細胞において測定する工程と、前記工程で測定された細胞内マーカー遺伝子またはレポーター遺伝子の発現レベルを、被験物質に暴露されていない前記形質転換細胞における細胞内マーカー遺伝子またはレポーター遺伝子の発現レベルと比較する工程とを含む、被験物質の毒性を検出する方法が提供される。
【発明の効果】
【0011】
本発明のAhRキメラタンパク質を導入した形質転換細胞を用いて、被験物質の毒性を高感度に検出することが可能である。
【発明を実施するための最良の形態】
【0012】
本発明者らは、マウスとラットのAhRを遺伝子工学的に融合したAhRキメラタンパク質が、ダイオキシン類、ポリ塩化ビフェニル類、芳香族炭化水素類に対して高応答性を有することを見出し、本発明を完成させるに至った。
【0013】
1.アリルハイドロカーボン受容体(AhR)キメラタンパク質
AhRタンパク質に関しては、該タンパク質の機能が、独立した複数のドメインによって制御されることが知られている。すなわち、AhRのN末端側には、Arnt(アリルハイドロカーボン受容体核内トランスロケーター;aryl hydrocarbon receptor nuclear translocator)とのヘテロダイマー形成やDNAへの結合に関わる「bHLHドメイン (basic helix-loop-helix domain)」と、基質との結合やタンパク質-タンパク質の相互作用に関わる「PASドメイン」が存在し、C末端側には標的遺伝子の発現応答性に関わる「転写活性化ドメイン」が存在することが知られている。
【0014】
一つの態様において本発明のアリルハイドロカーボン受容体(AhR)キメラタンパク質は、
bHLHドメインおよびPASドメインを含む、ラット由来のAhRのN末端領域、および
転写活性化ドメインを含む、マウス由来のAhRのC末端領域
をN末端から順に含む。
【0015】
本発明のAhRキメラタンパク質を模式的に図1に示す。図1に示すように、本発明のAhRキメラタンパク質は、ラット由来のAhRのN末端領域とマウス由来のAhRのC末端領域が連結されたキメラタンパク質である。
【0016】
具体的な態様において、本発明のAhRキメラタンパク質は、
ラット由来のAhRの第13番〜第85番のアミノ酸配列(配列番号2)を含むbHLHドメイン、
ラット由来のAhRの第117番〜第384番のアミノ酸配列(配列番号4)を含むPASドメイン、および
マウス由来のAhRの第593番〜第805番のアミノ酸配列(配列番号6)を含む転写活性化ドメイン
をN末端から順に含む。配列番号2により示されるアミノ酸配列は、bHLHドメインとして機能し得る最小単位を意味し、配列番号4により示されるアミノ酸配列は、PSAドメインとして機能し得る最小単位を意味し、配列番号6により示されるアミノ酸配列は、転写活性化ドメインとして機能し得る最小単位を意味する。なお、配列番号2、4および6に示されるアミノ酸配列は、それぞれ配列番号1、3および5に示されるヌクレオチド配列にコードされる。これらの機能ドメインは、AhRタンパク質としての機能を損なわない限り、連結のためのリンカー配列(たとえば5〜20個のアミノ酸配列)により連結されていてもよい。
【0017】
たとえば、AhRキメラタンパク質の好ましい様態のひとつとして、ラットAhRの第1番〜第384番のアミノ酸配列(配列番号8)を少なくとも含む領域と、マウスAhRの第593番〜第805番のアミノ酸配列(配列番号6)を少なくとも含む領域を、N末端から順に含むキメラタンパク質が挙げられる。配列番号8により示されるアミノ酸配列は、bHLHドメインおよびPASドメインとして機能し得る最小単位を意味し、配列番号6により示されるアミノ酸配列は、転写活性化ドメインとして機能し得る最小単位を意味する。なお、配列番号8および6に示されるアミノ酸配列は、それぞれ配列番号7および5に示されるヌクレオチド配列にコードされる。これらの機能ドメインは、AhRタンパク質としての機能を損なわない限り、連結のためのリンカー配列(たとえば5〜20個のアミノ酸配列)により連結されていてもよい。
【0018】
本発明のAhRキメラタンパク質の一例として、ラット由来のAhRの第1番〜第422番のアミノ酸配列(配列番号10)、およびマウス由来のAhRの第419番〜第805番のアミノ酸配列(配列番号12)をN末端から順に含むAhRキメラタンパク質が挙げられる。後述の実施例では、配列番号10のアミノ酸配列(422アミノ酸)と配列番号12のアミノ酸配列(387アミノ酸)が、リンカー配列なしで直接連結された809アミノ酸のAhRキメラタンパク質(配列番号14)が作成されているが、AhRタンパク質としての機能を損なわない限り、連結のためのリンカー配列(たとえば5〜20個のアミノ酸配列)を含んでいてもよい。
【0019】
本発明のAhRキメラタンパク質は、遺伝子工学的手法に従ってこれをコードする融合遺伝子を調製し、それを発現させることにより作成することができる(後述の融合遺伝子の作成方法および実施例参照)。
【0020】
2.AhRキメラタンパク質をコードする遺伝子
AhRキメラタンパク質をコードする融合遺伝子は、上述のAhRキメラタンパク質をコードするものである。AhRキメラタンパク質をコードする融合遺伝子の一例として、ラット由来のアリルハイドロカーボン受容体(AhR)の第1番〜第422番のアミノ酸配列(配列番号10)、およびマウス由来のAhRの第419番〜第805番のアミノ酸配列(配列番号12)をN末端から順に含むAhRキメラタンパク質をコードする遺伝子が挙げられる。また、一例として、配列番号13に記載のヌクレオチド配列からなる、AhRキメラタンパク質をコードする遺伝子が挙げられる。
【0021】
融合遺伝子は、たとえば、以下に記載のとおり作成することができる(後述の実施例1および2参照)。
【0022】
(a)AhRタンパク質をコードする遺伝子のクローニング
ラットのSD系統とマウスのC57BL6系統のAhRをコードする遺伝子の塩基配列はいずれも公知である。したがって、ラットAhR遺伝子およびマウスAhR遺伝子のクローニングは、たとえばポリメラーゼ連鎖反応(PCR)などの遺伝子増幅法やファージー・ライブラリーのスクリーニングなどにより、クローニングできる。PCRでクローニングをおこなう場合、C57BL6系統のマウス、ならびにSD系統のラットから抽出したRNAを逆転写してcDNAを合成し、これを鋳型としたPCRによってAhR遺伝子を増幅後、任意のベクターにクローニングすることができる。
【0023】
(b)AhRキメラタンパク質をコードする遺伝子の作製
(a)に述べた方法でクローニングした遺伝子を用いて、たとえば、ラットSD系統のAhRの第1番〜第422番のアミノ酸配列に由来するペプチドと、マウスC57BL6系統のAhRの第419番〜第805番のアミノ酸配列に由来するペプチドを連結し、AhRキメラタンパク質をコードする遺伝子を作製することができる。具体的には、(a)に述べた方法でクローニングしたラットSD系統のAhR遺伝子とマウスC57BL6系統のAhR遺伝子を制限酵素BamHIの認識部位で、ラットSD系統のAhRが5’側となるように連結すればよい。あるいは、ラットSD系統のAhRの第1番〜第422番のアミノ酸をコードする塩基配列、ならびにマウスC57BL6系統のAhRの第419番〜第805番のアミノ酸をコードする塩基配列をPCRによって増幅し、これを連結してもよい。あるいは、ラットSD系統のAhRの第1番〜第422番のアミノ酸をコードする塩基配列と、マウスC57BL6系統のAhRの第419番〜第805番のアミノ酸をコードする塩基配列を連結した遺伝子を人工的に合成してもよい。
【0024】
3.AhRキメラタンパク質をコードする遺伝子を含む発現ベクター
本発明の発現ベクターは、上述のAhRキメラタンパク質をコードする融合遺伝子を含む。好ましい態様において、本発明の発現ベクターは、上述のAhRキメラタンパク質をコードする融合遺伝子と、当該融合遺伝子の宿主細胞内での発現を可能とするプロモーターと、該宿主細胞で機能する転写終結シグナルとからなる発現カセットを有する。本発明の発現ベクターの一例を模式的に図2に示す。図2において発現ベクターは、SV40初期プロモーター(配列番号15)、SD系統ラット由来のAhRタンパク質の第1番〜第422番アミノ酸をコードする塩基配列(配列番号9)、C57BL6系統マウス由来のAhRタンパク質の第419番〜第805番アミノ酸をコードする塩基配列(配列番号11)、およびSV40ポリアデニル化部位を含む。
【0025】
AhRキメラタンパク質を細胞内で発現させるための発現ベクターは、たとえば、以下に記載のとおり作成することができる(後述の実施例2参照)。
【0026】
このような発現ベクターの作成は、上述のとおり作製したAhRキメラタンパク質をコードする遺伝子を、任意のプロモーターの下流に機能的に連結すればよい。「機能的に連結する」とは、連結された領域が、その領域の機能を発揮するように連結されていることを意味する。具体的には、AhRキメラタンパク質をコードする遺伝子がプロモーター活性により発現されるように連結されていることを意味する。プロモーターは、AhRキメラタンパク質を発現させる宿主細胞の種類にあわせて選択する。たとえば、AhRキメラタンパク質を発現させるときは、哺乳類細胞で機能するプロモーターを選択する。このようなプロモーターとしては、たとえばSV40の初期プロモーター(配列番号15)や後期プロモーター、ヘルペスウイルスのチミジンキナーゼプロモーター、サイトメガロウイルスのプロモーターなどが挙げられる。さらにベクター上には、大腸菌内でベクターの複製に必要な複製起点、あるいはベクターを細胞に導入した際に、ベクター導入細胞の選抜を容易にするための薬剤耐性遺伝子、たとえばアンピシリン耐性遺伝子、カナマイシン耐性遺伝子などが組み込まれていることが望ましい。
【0027】
4.発現ベクターを含む形質転換細胞
本発明の形質転換細胞は、上述のAhRキメラタンパク質発現ベクターを哺乳類細胞に導入したものである。
【0028】
(1)宿主細胞
本発明の発現ベクターを導入するための宿主細胞は、何れの哺乳類細胞であることもできる。哺乳類細胞の種類は、発現ベクターに含まれるプロモーターが機能する細胞であればよく、たとえば初代培養細胞であっても、不死化した培養細胞であってもよい。宿主細胞は、発現されるAhRキメラタンパク質が、宿主細胞内の既存のAhRタンパク質により希釈されないように、AhRタンパク質が発現していないか、または低いレベルで発現している細胞が好ましい。
【0029】
哺乳類細胞は、たとえば、ヒト細胞、マウス細胞またはラット細胞である。特に、宿主細胞は、神経由来の細胞、とりわけ中枢神経系に由来する細胞であることが望ましい。神経由来細胞は、たとえば、ヒト神経由来細胞、マウス神経由来細胞またはラット神経由来細胞である。具体的には、神経芽細胞腫、とりわけマウスの神経芽細胞腫であるNeuro2aなどを使用することができる。
【0030】
(2)好ましい態様
好ましい態様において、本発明の形質転換細胞は、上述の本発明のAhRキメラタンパク質発現ベクターに加えて、リガンドを結合したAhRが結合可能なAhR結合配列と、リガンド結合AhRの前記AhR結合配列への結合により発現が誘導されるレポーター遺伝子とを含む第二の発現ベクター(以下、レポーターベクターともいう)が更に導入されている。この好ましい態様の形質転換細胞を模式的に図4に示す。
【0031】
レポーターベクターについては、その一例を模式的に図3に示す。図3においてレポーターベクターは、チロシン水酸化酵素(TH)遺伝子のAhR結合配列(配列番号16)、TH遺伝子のコア・プロモーター(配列番号17)、ホタル・ルシフェラーゼ遺伝子、およびSV40ポリアデニル化配列を含む。
【0032】
レポーターベクターにおいて「リガンドを結合したAhRが結合可能なAhR結合配列(単にAhR結合配列ともいう)」を含む塩基配列は、たとえば、チロシン水酸化酵素(TH)遺伝子の上流領域に由来する塩基配列(配列番号16)、シトクロムP450 1A1(CYP1A1)遺伝子の上流領域に由来する塩基配列(配列番号18、配列番号19)、グルタチオンS転移酵素Ya(GST-Ya)遺伝子の上流領域に由来する塩基配列(配列番号20)、またはグルクロン酸転移酵素1A6(UGT1A6)遺伝子の上流領域に由来する塩基配列(配列番号21)を使用することができる。AhR結合配列は、リガンドを結合したAhRの結合効率を高めるために、複数のAhR結合配列(たとえば2〜10個のAhR結合配列)が直列的に連結した繰返し配列を使用してもよい(後述の実施例3参照)。
【0033】
レポーターベクターにおいて「レポーター遺伝子」は、レポーター遺伝子アッセイで使用されることが既知の任意のレポーター遺伝子を使用することができる。レポーター遺伝子は、その産物の活性が簡単に測定でき、測定バックグラウンドの低いものが好ましく、たとえばこのような遺伝子として、遺伝子産物を発光で検出できるルシフェラーゼ遺伝子、蛍光で検出できる緑色蛍光タンパク質遺伝子、発色で検出できるβ−ガラクトシダーゼ遺伝子、放射線活性で検出できるクロラムフェニコール・アセチルトランスフェラーゼ遺伝子などが挙げられる。
【0034】
レポーター遺伝子は、リガンド結合AhR(活性化AhR)のAhR結合配列への結合により発現が誘導される。レポーター遺伝子は、活性化AhRのAhR結合配列への結合により発現が誘導されるように、一般的にはAhR結合配列の下流に配置される。
【0035】
なお、上述のAhRキメラタンパク質発現ベクター、第二の発現ベクター(レポーターベクター)は、その他、種々のエレメントを含むことができる。たとえば、適切な微生物内で機能する複製起点および薬剤耐性遺伝子などを組み込むことができる。また、ベクターを細胞の染色体上に組み込んで安定に保持させるために、ベクター内に哺乳類用の薬剤耐性遺伝子を組み込んでおくことができる。このような哺乳類用の薬剤耐性遺伝子には、たとえばゼオシン耐性遺伝子およびハイグロマイシン耐性遺伝子などがあげられる。また、マルチクローニングサイトなどの適切な制限酵素部位を有することもできる。
【0036】
AhRキメラタンパク質発現ベクター、第二の発現ベクター(レポーターベクター)は、環状のプラスミドDNA、ウイルスベクターDNA、直鎖のDNA断片など任意の形態であり得る。
【0037】
(3)調製方法
AhRキメラタンパク質を産生する形質転換細胞は、たとえば、以下に記載のとおり、上述のAhRキメラタンパク質発現ベクターを哺乳類細胞に導入することにより作成することができる(後述の実施例4および5参照)。
【0038】
AhRキメラタンパク質発現ベクターの細胞への導入は一過的な導入であっても、安定な導入であってもよい。AhRキメラタンパク質発現ベクターを一過的に導入する例では、哺乳類細胞を培養容器に播き、10%牛胎児血清を含むMEMダルベッコ・ハムF12等比混合(DF1:1)培地などの培地中において、5%CO2条件下で37℃において数時間から1晩程度インキュベートする。このように培養した細胞に上記AhRキメラタンパク質発現ベクターを導入する。細胞へのAhRキメラタンパク質発現ベクターの導入法としては、たとえばリポフェクタミン法、エレクトロポレーション法、DEAE-デキストラン法、リン酸カルシウム法などの当業者に既知のいずれの方法を使用して行うこともできる。たとえば、リポフェクタミン2000(インビトロジェン社製)を使用することもでき、市販のマニュアルに従って、導入するベクターの量、リポフェクタミン2000の量、および細胞数などをあらかじめ決定しておくことが好ましい。細胞に導入するベクターは、適当な制限酵素で消化して直鎖状にしてから導入してもよい。
【0039】
また、AhRキメラタンパク質発現ベクターに加えてレポーターベクターを細胞に導入する場合、レポーターベクターも同様の処理により細胞に導入することができる。この場合、AhRキメラタンパク質発現ベクターとレポーターベクターの両方を含む溶液を用いて1回の導入処理で行ってもよいし、AhRキメラタンパク質発現ベクターとレポーターベクターを別々の導入処理で細胞に導入してもよい。
【0040】
5.形質転換細胞を用いて被験物質の毒性を検出する方法
本発明の形質転換細胞を用いて被験物質の毒性を検出する方法には、以下の3つの態様が含まれる。
【0041】
第一の態様では、AhRキメラタンパク質発現ベクターに加えてレポーターベクターを導入した形質転換細胞(図4参照)を用いて、導入されたレポーター遺伝子の発現レベルの変化に基いて被験物質の毒性を検出する。
【0042】
第二の態様では、AhRキメラタンパク質発現ベクターを導入した形質転換細胞を用いて、細胞内マーカー遺伝子の発現レベルの変化に基いて被験物質の毒性を検出する。
【0043】
第三の態様では、AhRキメラタンパク質発現ベクターを導入した神経芽細胞腫細胞を用いて、この神経芽細胞腫細胞の形態変化に基いて被験物質の毒性を検出する。
【0044】
本発明の「被験物質の毒性を検出する方法」を用いて、被験物質が、ダイオキシン毒性、ポリ塩化ビフェニル毒性、または芳香族炭化水素毒性を有するか否かを検出することができる。なお、第一および第二の態様の詳細については、ぞれぞれ後述の実施例4および5を参照することもできる。
【0045】
(1)第一の態様
第一の態様では、AhRキメラタンパク質発現ベクターおよびレポーターベクターを導入した哺乳類細胞(図4参照)を使用する。この細胞を、被検物質を未曝露の条件下と曝露条件下で培養する。被検物質存在下での培養時間は、使用する哺乳類細胞に応じて適切な時間を予備実験によりあらかじめ決定するのが望ましいが、通常は2時間〜3日程度が好ましい。
【0046】
被験物質の毒性検出は、被験物質に暴露条件下で培養した細胞と未暴露条件下で培養した細胞におけるレポーター遺伝子の発現レベルの比較によりおこなう。遺伝子の発現レベルは、当該技術分野で公知の手法に従って測定することができる。ここで発現レベルの測定は、レポーター遺伝子の発現量(mRNA量)を測定してもよいし、レポータータンパク質(レポーター遺伝子産物)の発現量を測定してもよい。
【0047】
被験物質に未暴露の条件下に比較して、被験物質暴露した条件下において、細胞から抽出したレポーター遺伝子、あるいはレポータータンパク質の発現量が増加していた場合、被験物質が毒性を有すると判断する。
【0048】
被験物質の毒性の有無をレポーター遺伝子の発現量で判断する場合には、被験物質に暴露した細胞からRNAを抽出して遺伝子の発現量を測定すればよい。遺伝子の発現量の測定には、公知の方法を用いればよく、このような方法としては逆転写PCR法やノザンハイブリダイゼーション法などが挙げられる。
【0049】
被験物質の毒性の有無をレポータータンパク質の発現量で判断する場合には、被験物質に暴露した細胞からタンパク質を抽出して遺伝子の発現量を測定すればよい。遺伝子の発現量の測定には、公知の方法を用いればよく、このような方法としてはウエスタンブロッティングやELISA、あるいはレポータータンパク質が酵素の場合には酵素活性を測定する方法などがある。
【0050】
(2)第二の態様
第二の態様では、AhRキメラタンパク質発現ベクターのみを導入した哺乳類細胞を使用する。第二の態様では、レポーター遺伝子が細胞に導入されておらず、細胞内マーカー遺伝子の発現レベル(遺伝子またはタンパク質の発現量)を測定する。このように第二の態様は、測定対象が、レポーター遺伝子ではなく細胞内マーカー遺伝子である点で第一の態様とは異なるため、以下、第一の態様と異なる点のみ説明する。
【0051】
細胞内マーカー遺伝子は、リガンドが結合したAhRの作用によりその発現が増大することが知られている細胞内遺伝子であり、たとえば、チロシン水酸化酵素(TH)遺伝子、シトクロムP450 1A1(CYP1A1)遺伝子、シトクロムP450 1A2(CYP1A2)遺伝子、グルタチオンS転移酵素(GST)遺伝子、グルクロン酸転移酵素1A6(UGT1A6)遺伝子などが挙げられる。
【0052】
第一の態様と同様、被験物質の毒性検出は、被験物質に暴露条件下で培養した細胞と未暴露条件下で培養した細胞における細胞内マーカー遺伝子の発現量、あるいはマーカータンパク質(マーカー遺伝子産物)の発現量の比較によりおこなう。
【0053】
(3)第三の態様
第三の態様では、AhRキメラタンパク質発現ベクターのみを導入した神経芽細胞腫細胞を使用する。
【0054】
第三の態様で使用される神経芽細胞腫細胞は、アリルハイドロカーボン受容体(AhR)の基質を添加すると、未添加のときと比べて細胞の形態が変化する細胞である。たとえば、AhRの基質を未添加の状態で突起の伸長がみられるが、AhRの基質を添加すると、伸長する突起の頻度が減少する細胞(特開2005-328714号公報参照)、またはAhRの基質を未添加の状態では突起の伸長がみられず、AhRの基質を添加すると突起の伸長がみられる細胞(特開2006-325551号公報参照)が挙げられる。これら細胞としては、神経芽細胞腫細胞にAhRキメラタンパク質発現ベクターを導入し、AhRの基質を添加したときに突起の伸長に変化が観察される細胞を選択して使用してもよい。
【0055】
このような神経芽細胞腫細胞を被験物質に暴露し、細胞に所定の形態変化が観察されるか否かを観察することにより、被験物質の毒性を検出することができる。
【実施例】
【0056】
[実施例1] AhR遺伝子のクローニング
(1)ラットAhR遺伝子
SD系統のラットの脳から全RNAを抽出して、これを鋳型にオリゴ(dT)プライマーをもちいて逆転写した。この逆転写したサンプルから、Pyrobest DNAポリメラーゼ(タカラバイオ)を用いたPCR(変性:94℃ 1分、アニーリング:55℃ 1分、伸長:72℃ 4分を1サイクルとして25サイクルの反応)により、SD系統ラットのAhR遺伝子コーディング領域を増幅した。プライマーにはSD系統のAhR遺伝子に特異的な下記プライマーを使用した。プライマーの5’末端には、PCR産物のベクターへの組み込みを容易にするための制限酵素HindIII(フォワードプライマー)、XhoI(リバースプライマー)の認識配列を付加した。
【0057】
フォワードプライマー:5’- CCCAAGCTTACCATGAGCAGCGGCGCCAACATCA -3’(配列番号22)
リバースプライマー:5’- CCGCTCGAGAGGAATCCGCTGGGTGTGATATCAG -3’(配列番号23)。
【0058】
増幅したラットSD系統のAhR遺伝子を発現させるためのベクター(増幅したラットSD系統のAhR遺伝子をpcDNA4/V5-His Bベクター(インビトロジェン)に組み込んだ組換えベクター)は、以下のとおり調製した。すなわち、増幅したラットSD系統のAhR遺伝子を、制限酵素HindIIIとXhoIで消化後、0.8% アガロースで電気泳動をおこない、対応するバンドを切り出して、QIA quick Gel Extraction Kit(キアゲン)で精製し、同様にHindIII と XhoIで消化したpcDNA4/V5-His Bベクターに組み込んだ。このように調製されたベクターでは設計上、AhR遺伝子は、AhR遺伝子のC末端にHisタグとV5エピトープが付加された融合タンパク質として発現する。そこで、AhRが融合タンパク質として発現しないようにするため、上述の調製されたベクターを鋳型として、下記プライマーにより、AhRのコーディング領域のみを増幅して、PGV-P2ベクター(TOYO B-Net)のHindIIIとXbaIサイトに挿入した。このとき、AhRの増幅に使用したプライマーの5’末端には、PCR産物のベクターへの組み込みを容易にするための制限酵素HindIII(フォワードプライマー)、XbaI(リバースプライマー)の認識配列を付加した。
【0059】
フォワードプライマー:5’- CCCAAGCTTACCATGAGCAGCGGCGCCAACATCA -3’(配列番号22)
リバースプライマー:5’- CGGTCTAGAGCTACAGGAATCCGCTGGGTGT -3’(配列番号24)。
【0060】
なお、本実施例では、ラットAhR遺伝子をクローニングするために2回の増幅を行っているが、ラットAhR遺伝子のクローニングは、上記配列番号22および24のプライマーを用いて、細胞から抽出したRNAを鋳型に、直接AhRのコーディング領域を増幅して、PGV-P2ベクターに組み込むことによっても可能である。
【0061】
増幅したラットSD系統由来のAhR遺伝子のコーディング領域は、制限酵素HindIIIとXbaIで消化後、0.8% アガロースで電気泳動をおこない、対応するバンドを切り出して、QIA quick Gel Extraction Kitで精製し、同様にHindIIIとXbaIで消化したPGV-P2ベクターに組み込み、SD系統ラットのAhR遺伝子発現ベクター;PGV-rAhRとした。
【0062】
(2)マウスAhR遺伝子
C57/BL6系統のマウスの肝臓から全RNAを抽出し、これを鋳型として上記と同様の反応条件でPCRをおこない、C57/BL6系統マウスのAhR遺伝子コーディング領域を増幅した。プライマーにはC57/BL6系統のマウスAhR遺伝子に特異的な下記プライマーをもちいた。プライマーの5’末端は、PCR産物のベクターへの組み込みを用意にするために制限酵素HindIII(フォワードプライマー)、XbaI(リバースプライマー)の認識配列を付加した。
【0063】
フォワードプライマー:5’- CCCAAGCTTATGAGCAGCGGCGCCAACATCACC -3’(配列番号25)
リバースプライマー:5’- CCCTCTAGATCAACTCTGCACCTTGCTTAGGAA -3’(配列番号26)
C57/BL6系統のマウスAhR遺伝子は、制限酵素HindIIIとXbaIで消化後、0.8% アガロースで電気泳動をおこない、対応するバンドを切り出して、QIA quick Gel Extraction Kitで精製し、同様にHindIIIとXbaIで消化したPGV-P2ベクターに組み込み、C57/BL6系統マウスのAhR遺伝子発現ベクター;PGV-mAhRとした。
【0064】
上記のAhR発現用ベクターPGV-rAhRおよびPGV-mAhRはいずれも大腸菌TOP10(インビトロジェン)に導入して増幅と維持をおこなった。
【0065】
[実施例2] AhRキメラタンパク質をコードする遺伝子の作製、ならびにAhRキメラタンパク質発現ベクターの構築
PGV-mAhRを制限酵素BamHIで消化後、0.8% アガロースによる電気泳動をおこない、C57BL6系統マウスのAhR遺伝子の3’末端側を含むDNA断片を切り出し、QIA quick Gel Extraction Kit で精製し、「インサートのDNA断片」を調製した。
【0066】
PGV-rAhRを制限酵素BamHIで消化後、アルカリホスファターゼ処理により、DNA末端のリン酸基を除去した。処理後のPGV-rAhRは、0.8% アガロースによる電気泳動後、PGV-P2ベクターとSD系統ラットのAhRの5’末端側を含むDNA断片のバンドを切り出し、QIA quick Gel Extraction Kitで精製し、「ベクターのDNA断片」を調製した。
【0067】
SD系統ラットの5’末端側を含む「ベクターのDNA断片」と、C57BL6系統マウスの3’末端側を含む「インサートのDNA断片」を、T4 DNA ligaseを用いて連結し、AhRキメラタンパク質をコードする遺伝子を組み込んだ発現ベクター;PGV-rmAhRを作製した。PGV-rmAhRの発現カセット部分を図2に示した。PGV-rmAhRは、大腸菌TOP10に導入して、ベクターの増幅と維持をおこなった。
【0068】
[実施例3] TH遺伝子のAhR結合配列を組み込んだレポーターベクターの調製
TH転写制御領域内のAhR結合配列(配列番号16)は、下記プライマー・セットを用いて増幅した。
【0069】
フォワードプライマー: 5’- AGCGGTACCCTGTCTTCATGTCGTGTCTAGG -3’(配列番号27)
リバースプライマー: 5’- AGCGCTAGCTGCATCCACTGTCGCAGGCACC -3’(配列番号28)
プライマーの5’末端には、いずれも、PCR増幅断片のベクターの組み込みを容易にすることを目的に、制限酵素KpnI(フォワードプライマー)、NheI(リバースプライマー)の認識配列を付加した。増幅後のDNA断片はT4 DNA ligaseでタンデムに連結した。このDNA断片を、制限酵素KpnIとNheIで部分消化した後、アガロース電気泳動をおこない、配列番号16のDNAが3つタンデムに連結された断片をQIA quick Gel Extraction Kit(キアゲン社製)で精製し、「TH遺伝子のAhR結合配列」としてベクターに組み込んだ。ベクターは、ホタル・ルシフェラーゼ遺伝子を予め含むPGV-P2ベクターをベースに、同ベクター上のSV40プロモーターを、下記プライマーにより増幅したTH遺伝子のコア・プロモーター(配列番号17)に組み換えたpTHP100/Lucを調製して使用した。
【0070】
フォワードプライマー: 5’- CGGCTCGAGGTGGGGGACCCAGAGGGGCTTTGAC-3’(配列番号29)
リバースプライマー: 5’- GCAAAGCTTAAGCTGGTGGTCCCGAGTTCTGTCT -3’(配列番号30)。
【0071】
このベクター;pTHP100/LucのKpnIとNheIサイトに、上述の「TH遺伝子のAhR結合配列」を挿入し、最終的なレポーターベクターであるpTHE60x3/Lucを調製した。pTHE60x3/Lucの発現カセット部分を図3に示した。
【0072】
[実施例4] AhRキメラタンパク質をもちいたレポーター遺伝子アッセイによるダイオキシン異性体の検出
AhRキメラタンパク質を用いたレポーター遺伝子アッセイによるダイオキシン異性体の検出は、実施例3に記述のレポーターベクター;pTHE60x3/Lucを使用し、レポーター遺伝子アッセイでおこなった。本アッセイには、ダイオキシン異性体のひとつである2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)を使用した。
【0073】
ベクターの細胞への導入は、リポフェクタミン2000(インビトロジェン)を使用し、操作はInvitrogen社のマニュアルに従った。Opti-MEM培地50μlに懸濁した計0.8μgのベクター(0.4 μgのレポーターベクター、0.2 μgのAhRキメラタンパク質発現ベクターpPGV-rmAhR、および0.2 μgのpcDNA4/V5-His/lacZ)と、同様にOpti-MEM培地50μlに懸濁した2μlのリポフェクタミン2000を混合して20分間室温に静置し、核酸/リポフェクタミン2000の複合体を形成させた。これをDF1:1培地(10% 牛胎児血清を含む)500μl中で予め一晩培養したマウスの神経芽細胞腫Neuro2a(前日に0.8 x 105細胞で播種)に添加して、ベクターを細胞内に導入した。ベクター導入効率の向上と、導入ベクター由来のタンパク質発現を目的に、細胞はトランスフェクション後、さらに24時間培養した。また、AhRキメラタンパク質と検出感度を比較するため、上記と同様の方法で、PGV-rAhR(ラットAhR発現ベクター)を導入した細胞、ならびにPGV-mAhR(マウスAhR発現ベクター)を導入した細胞も調製した。
【0074】
TCDDは、関東化学より購入したジメチルスルフォキシド溶解品を使用した。トランスフェクションから24時間後、細胞の培地を取り除いてから、新たにTCDD暴露条件の細胞にそれぞれ0、1、100、10000 pg/mlのTCDDを含む培地を加えて、さらに24時間培養した。24時間後に培地を取り除き、細胞をリン酸緩衝液で2回洗浄した後、タンパク質抽出用の溶液(TOYO B-NET社製)をウェルあたり100μlずつ加えて、室温で15分間穏やかに攪拌してから、-80℃で溶液を凍結させた。凍結した溶液は室温で解凍後、チューブに回収し、ルシフェラーゼ活性とβ-ガラクトシダーゼ活性を測定した。結果を図5に示す。レポーターであるルシフェラーゼの活性は、β-ガラクトシダーゼ ng 当たりの1秒間の相対発光強度(RLU /sec / ng β-galactosidase)に換算して表した。
【0075】
図5に示すように、PGV-rAhR(ラットAhR)およびPGV-mAhR(マウスAhR)を導入した細胞では、0 pg/ml TCDD暴露条件下と1 pg/ml TCDD暴露条件下で、レポーター遺伝子の発現量に統計学的に有意な差は見られなかった。これに対して、AhRキメラタンパク質の発現ベクター;PGV-rmAhRを導入した細胞では、TCDD未暴露条件下に比べ、1 pg/ml TCDD暴露条件下において、レポーター遺伝子の発現量が統計学的に有意に増加しており、TCDD検出感度の向上が確認された。またPGV-rmAhRを導入した細胞では、中・高濃度(100 pg/mlと10000 pg/ml)のTCDD暴露条件下においても、レポーター遺伝子の応答性の向上(発現変化量の増加)が観察された。
【0076】
このようにAhRキメラタンパク質を用いた本発明の検出方法では、1 pg/mlの濃度のTCDDを検出することが可能であり、ラットAhRやマウスAhRを用いた場合より検出感度が増大した。また、検出感度の増大により、従来必要とされていた被験物質を含むサンプルの濃縮処理が、短時間で済み簡便になるという効果も奏される。
【0077】
[実施例5] AhRキメラタンパク質をもちいた逆転写PCRによるダイオキシン異性体の検出
AhRキメラタンパク質を用いた逆転写PCRによるダイオキシン異性体の検出は、ダイオキシン異性体のひとつである2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)を使用し、細胞内マーカー遺伝子にはチロシン水酸化酵素(TH)遺伝子およびシトクロムP450 1A1(CYP1A1)遺伝子をもちいた。
【0078】
AhRキメラタンパク質発現ベクターの細胞への導入は、リポフェクタミン2000(Invitrogen社)を使用し、操作はInvitrogen社のマニュアルに従った。Opti-MEM培地50μlに懸濁した計0.8μgのAhRキメラタンパク質発現ベクター; PGV-rmAhRと、同様にOpti-MEM培地50μlに懸濁した2μlのリポフェクタミン2000を混合して20分間室温に静置し、核酸/リポフェクタミン2000の複合体を形成させた。これをDF1:1培地(10% 牛胎児血清を含む)500μl中で予め一晩培養したマウスの神経芽細胞腫Neuro2a(前日に0.8 x 105細胞で播種)に添加して、ベクターを細胞内に導入した。ベクター導入効率の向上と、導入ベクター由来のタンパク質発現を目的に、細胞はトランスフェクション後、さらに24時間培養した。また、AhRキメラタンパク質と検出感度を比較するため、上記と同様の方法で、PGV-rAhR(ラットAhR発現ベクター)を導入した細胞、ならびにPGV-mAhR(マウスAhR発現ベクター)を導入した細胞も調製した。
【0079】
TCDDは、関東化学より購入したジメチルスルフォキシド溶解品を使用した。トランスフェクションから24時間後、細胞の培地を取り除いてから、新たにTCDD暴露条件の細胞にそれぞれ0、1、100、10000 pg/mlのTCDDを含む培地を加えて、さらに24時間培養した。24時間後に培地を取り除き、RNeasy Kit(キアゲン)を使用して、Total RNAを抽出した。抽出したRNAは、SuperScript First Strand System(インビトロジェン)で逆転写してcDNAに変換し、これを鋳型として、以下に示すTH遺伝子、ならびにCYP1A1遺伝子に特異的なプライマーを用いてPCR反応をおこなった。
【0080】
フォワードプライマー(TH遺伝子増幅用): 5’- CCCACAGCACCACAAGAGATA -3’(配列番号31)
リバースプライマー(TH遺伝子増幅用): 5’- AAGTAGGAGGCACAATGTC -3’(配列番号32)
フォワードプライマー(CYP1A1遺伝子増幅用): 5’- CCACGGTGTACTGGTTCACT -3’(配列番号33)
リバースプライマー(CYP1A1遺伝子増幅用): 5’- GGCATAGTTCCTGAGCTTGT -3’(配列番号34)。
【0081】
PCR反応後の溶液は、アガロースゲルで電気泳動した後、エチジウムブロマイドで染色して、PCR反応で増幅したTH遺伝子、ならびにCYP1A1遺伝子を可視化した。結果を図6に示す。図6に示したように、PGV-rmAhRを導入した細胞では、PGV-rAhRおよびPGV-mAhRを導入した細胞に比べて、TCDD暴露条件下でTH、CYP1A1両遺伝子の発現が高レベルに誘導されており、低濃度(1 pg/ml )のTCDDを検出することができた。
【図面の簡単な説明】
【0082】
【図1】本発明のAhRキメラタンパク質を模式的に示す図。
【図2】AhRキメラタンパク質を発現するベクターPGV-rmAhRの発現カセット部分を模式的に示す図。
【図3】レポーターベクターpTHE60x3/Lucの発現カセット部分を模式的に示す図。
【図4】AhRキメラタンパク質をコードする遺伝子を導入した本発明の形質転換細胞の一例を模式的に示す図。
【図5】AhRキメラタンパク質を発現する形質転換細胞を用いたレポーター遺伝子アッセイの結果を示すグラフ。
【図6】AhRキメラタンパク質を発現する形質転換細胞における、TCDDの添加に対する細胞内マーカー遺伝子の発現量の変化を示す電気泳動写真。
【図7】ダイオキシン類がアリルハイドロカーボン受容体(AhR)を介して遺伝子の転写を活性化するメカニズムを模式的に示す図。
【特許請求の範囲】
【請求項1】
bHLHドメインおよびPASドメインを含む、ラット由来のアリルハイドロカーボン受容体(AhR)のN末端領域、および
転写活性化ドメインを含む、マウス由来のAhRのC末端領域
をN末端から順に含むAhRキメラタンパク質。
【請求項2】
ラット由来のAhRの第13番〜第85番のアミノ酸配列(配列番号2)を含むbHLHドメイン、
ラット由来のAhRの第117番〜第384番のアミノ酸配列(配列番号4)を含むPASドメイン、および
マウス由来のAhRの第593番〜第805番のアミノ酸配列(配列番号6)を含む転写活性化ドメイン
をN末端から順に含むAhRキメラタンパク質。
【請求項3】
ラット由来のアリルハイドロカーボン受容体(AhR)の第1番〜第422番のアミノ酸配列(配列番号10)、および
マウス由来のAhRの第419番〜第805番のアミノ酸配列(配列番号12)
をN末端から順に含むAhRキメラタンパク質。
【請求項4】
請求項3に記載のAhRキメラタンパク質をコードするAhR融合遺伝子。
【請求項5】
配列番号13に記載のヌクレオチド配列からなる、AhRキメラタンパク質をコードするAhR融合遺伝子。
【請求項6】
請求項4または5に記載のAhR融合遺伝子を含む発現ベクター。
【請求項7】
請求項6に記載の発現ベクターが哺乳類細胞に導入された、形質転換細胞。
【請求項8】
前記哺乳類細胞が神経由来細胞である、請求項7に記載の形質転換細胞。
【請求項9】
前記神経由来細胞が神経芽細胞腫細胞である、請求項8に記載の形質転換細胞。
【請求項10】
請求項7に記載の形質転換細胞であって、リガンドを結合したAhRが結合可能なAhR結合配列と、リガンド結合AhRの前記AhR結合配列への結合により発現が誘導されるレポーター遺伝子とを含む第二の発現ベクター(レポーターベクター)が更に導入された、形質転換細胞。
【請求項11】
請求項10に記載の形質転換細胞を被験物質に暴露する工程と、
前記形質転換細胞における前記レポーター遺伝子の発現レベルを測定する工程と、
前記工程で測定されたレポーター遺伝子の発現レベルを、被験物質に暴露されていない前記形質転換細胞におけるレポーター遺伝子の発現レベルと比較する工程と
を含む、被験物質の毒性を検出する方法。
【請求項12】
請求項7〜9の何れか1項に記載の形質転換細胞を被験物質に暴露する工程と、
AhRの活性化により発現が誘導される細胞内マーカー遺伝子の発現レベルを、前記形質転換細胞において測定する工程と、
前記工程で測定された細胞内マーカー遺伝子の発現レベルを、被験物質に暴露されていない前記形質転換細胞における前記細胞内マーカー遺伝子の発現レベルと比較する工程と
を含む、被験物質の毒性を検出する方法。
【請求項13】
前記細胞内マーカー遺伝子が、チロシン水酸化酵素(TH)遺伝子、シトクロムP450 1A1(CYP1A1)遺伝子、シトクロムP450 1A2(CYP1A2)遺伝子、グルタチオンS転移酵素Ya(GST-Ya)遺伝子、およびグルクロン酸転移酵素1A6(UGT1A6)遺伝子からなる群より選択される、請求項12に記載の方法。
【請求項14】
請求項9に記載の形質転換細胞を被験物質に暴露する工程と、
前記形質転換細胞の形態変化を観察する工程と
を含む、被験物質の毒性を検出する方法。
【請求項1】
bHLHドメインおよびPASドメインを含む、ラット由来のアリルハイドロカーボン受容体(AhR)のN末端領域、および
転写活性化ドメインを含む、マウス由来のAhRのC末端領域
をN末端から順に含むAhRキメラタンパク質。
【請求項2】
ラット由来のAhRの第13番〜第85番のアミノ酸配列(配列番号2)を含むbHLHドメイン、
ラット由来のAhRの第117番〜第384番のアミノ酸配列(配列番号4)を含むPASドメイン、および
マウス由来のAhRの第593番〜第805番のアミノ酸配列(配列番号6)を含む転写活性化ドメイン
をN末端から順に含むAhRキメラタンパク質。
【請求項3】
ラット由来のアリルハイドロカーボン受容体(AhR)の第1番〜第422番のアミノ酸配列(配列番号10)、および
マウス由来のAhRの第419番〜第805番のアミノ酸配列(配列番号12)
をN末端から順に含むAhRキメラタンパク質。
【請求項4】
請求項3に記載のAhRキメラタンパク質をコードするAhR融合遺伝子。
【請求項5】
配列番号13に記載のヌクレオチド配列からなる、AhRキメラタンパク質をコードするAhR融合遺伝子。
【請求項6】
請求項4または5に記載のAhR融合遺伝子を含む発現ベクター。
【請求項7】
請求項6に記載の発現ベクターが哺乳類細胞に導入された、形質転換細胞。
【請求項8】
前記哺乳類細胞が神経由来細胞である、請求項7に記載の形質転換細胞。
【請求項9】
前記神経由来細胞が神経芽細胞腫細胞である、請求項8に記載の形質転換細胞。
【請求項10】
請求項7に記載の形質転換細胞であって、リガンドを結合したAhRが結合可能なAhR結合配列と、リガンド結合AhRの前記AhR結合配列への結合により発現が誘導されるレポーター遺伝子とを含む第二の発現ベクター(レポーターベクター)が更に導入された、形質転換細胞。
【請求項11】
請求項10に記載の形質転換細胞を被験物質に暴露する工程と、
前記形質転換細胞における前記レポーター遺伝子の発現レベルを測定する工程と、
前記工程で測定されたレポーター遺伝子の発現レベルを、被験物質に暴露されていない前記形質転換細胞におけるレポーター遺伝子の発現レベルと比較する工程と
を含む、被験物質の毒性を検出する方法。
【請求項12】
請求項7〜9の何れか1項に記載の形質転換細胞を被験物質に暴露する工程と、
AhRの活性化により発現が誘導される細胞内マーカー遺伝子の発現レベルを、前記形質転換細胞において測定する工程と、
前記工程で測定された細胞内マーカー遺伝子の発現レベルを、被験物質に暴露されていない前記形質転換細胞における前記細胞内マーカー遺伝子の発現レベルと比較する工程と
を含む、被験物質の毒性を検出する方法。
【請求項13】
前記細胞内マーカー遺伝子が、チロシン水酸化酵素(TH)遺伝子、シトクロムP450 1A1(CYP1A1)遺伝子、シトクロムP450 1A2(CYP1A2)遺伝子、グルタチオンS転移酵素Ya(GST-Ya)遺伝子、およびグルクロン酸転移酵素1A6(UGT1A6)遺伝子からなる群より選択される、請求項12に記載の方法。
【請求項14】
請求項9に記載の形質転換細胞を被験物質に暴露する工程と、
前記形質転換細胞の形態変化を観察する工程と
を含む、被験物質の毒性を検出する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2008−228627(P2008−228627A)
【公開日】平成20年10月2日(2008.10.2)
【国際特許分類】
【出願番号】特願2007−71088(P2007−71088)
【出願日】平成19年3月19日(2007.3.19)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
【公開日】平成20年10月2日(2008.10.2)
【国際特許分類】
【出願日】平成19年3月19日(2007.3.19)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
[ Back to top ]

