テトラピロール誘導体のための新規の経口製剤
光線力学治療(PDT)及び抗菌光線力学治療(APDT)の間、経口投与のための経口製剤及び光増感剤の製造方法が提供される。経口製剤化された光増感剤は、亢進された溶解性及び透過性を示し、その結果、治療部位における光増感剤のバイオアベイラビリティが改善される。経口投与される光増感剤は、粘膜付着及び胃腸粘膜を通過する吸収のために適切に製造される。ここで提供される経口製剤は、経口ルートによる光増感剤のためのキャリアとして脂質及び公知のタンパク質を用いる。前選択された光増感剤をカプセル化するためのキャリアは、従来のリポソーム、PEG化されたリポソーム、ナノエマルション、ナノ結晶、ナノ粒子、脂肪エマルション、脂質製剤、ハイドロゾル、SMEDDS、アルファフェトプロテイン(AFP)、並びにウシ血清アルブミン(BSA)、脂肪エマルション、加熱溶融押出物、及びナノ粒子を含む。本発明における疎水性光増感剤のケースでの経口製剤は、適切な界面活性剤/可溶化剤を用いて安定化されており、その結果、胃における並びに十二指腸及び小腸で吸収されるまでの薬物の凝集を抑えることができる。経口製剤は、液剤、カプセル、錠剤、粉末、ペースト、又はゲルの形態で投与され得る。製造された薬剤は、PDTを行う前に単回又は複数回で経口投与され得る。一実施態様において、経口製剤における光増感剤としてテモポルフィン(m−THPC)が用いられる。多くの疎水性光増感剤のようにテモポルフィンは、経口投与に特に適している。テモポルフィン又は同様の光増感剤を代謝することができる、哺乳類の身体における酵素システムは知られていないからである。テモポルフィンは変化することなく血液システムに到達し得、消化管における製剤の吸収後も十分に活性を示す。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は一般的に、製剤に関する。具体的には、それは、光線力学治療(PDT)において、抗菌光線力学治療(APDT)において、及びさらに光診断の目的で用いられる、テトラピロール化合物及びそれらの誘導体の経口製剤に関する。この製剤は、経口投与されるだろう。
【背景技術】
【0002】
光増感剤は、光増感剤の吸収スペクトルに一致する特定の波長の照射により光活性化され得る化合物である。光増感剤は、光線力学治療(PDT)において用いられる。それは、癌治療の初期段階で用いられる新しい方法であり、今では他の医学的問題の治療においても有効であることが見出されている。PDT療法は、増殖型及び非増殖型を含む異なる種類の癌、良性前立腺過形成(BPH)、他の炎症性疾患の治療、化粧用途等に用いられる。一般的に、光増感剤は、患者に全身投与及び局所投与され、その両方は各々メリット及びデメリットを有する。
【0003】
一般的に、光増感剤は現在、局所投与又は静脈内投与により送達される。特に、静脈内投与による送達は、多くの光増感剤が水に不溶性の疎水性又は両親媒性物質であるため、治療に対して問題を引き起こす。しばしば光増感剤は、例えば光増感剤であるテモポルフィンのように、アルコール溶液(エタノール、プロピレングリコール)中で投与される。しかしながら、アルコールが含まれると投与の間痛みが引き起こされ得、可溶化剤としてのアルコールについては一般的に一定の群の患者には投与できない。そのため、疎水性光増感剤を水溶性にするという方法で、疎水性光増感剤を製剤化する努力が行われてきた。これらのアプローチは、リポソーム、ナノ粒子、量子ドット、又は無機性マテリアルをベースとしたキャリアシステムといった多くの異なるキャリアシステムを含む。この点において、特に興味深いのは、脂質、タンパク質、又は生体適合性ポリマーといった高度に生体適合性を有するマテリアルをベースとしたキャリアシステムである。本技術分野において、多数のこのようなキャリアシステムが知られている(特許文献1〜3、非特許文献1〜10)。しかしながら、これらの水溶性キャリアシステムは、静脈内投与のために開発された。それらを経口投与する可能性については評価されてこなかった。
【0004】
経口投与は、薬剤投与に対して最も簡便なルートのひとつであり、特に患者コンプライアンスに有用である。薬剤の経口投与に対して直面する大きな障壁は、生物学的バリアを含み、それにより水に難溶性の薬物分子の経口投与が困難となる。一般に、薬物のサイズ、バイオアベイラビリティ、溶解性及び安定性は、薬物が、腸粘膜及び腸上皮のような生物学的バリアを通過するのを困難にする。これらの生物学的バリアを克服するために、薬剤の開発及び製造ユニットは、より効果的なデリバリーシステムを用いた製剤化の新しい方法を見出してきた。より新しいドラッグデリバリーシステムは、脾臓及び肝臓といった非標的部位に薬物が集積するのを回避するように設計され、その結果、循環システムにおける薬物の半減期が劇的に長くなった。これは、いくつかのケースでは困難であり、また例えば癌性組織を含む肝臓である場合には望ましいことではない。
【0005】
経口ドラッグデリバリーシステムの開発は、より効率的に及びより少ない副作用で患者に薬剤を送達させる必要性により発展してきた。経口ルートは、薬剤投与の最も便利なルートであることが見出されてきた。ヒトへの使用における経口及び他の治療システムは、制御された持続的な薬物放出のためのコンセプトとして認められてきた。それは、望まない薬理的効果を最小限にする一方で、所望の治療効果を維持するために必要とされる薬物の1日投与量及び投与回数を最小限にし得る。経口薬物デリバリーシステムは具体的には、身体組織への長期接触の間の生物適合性マテリアル、薬物デリバリーモジュールを開発する生物工学的方法、及び持続的な制御された薬物投与のコンディション下での薬物動態学の解明のための臨床薬理学的試験を提供するために、材料科学におけるイノベーションを必要としてきた。
【0006】
経口薬物デリバリーシステム/方法は、血漿及び標的臓器において治療上最適な薬物濃度を維持し;及びその結果、頻回な単回投与の必要性を取り除く可能性を提供する。薬剤及びサプリメントとして用いられる多くの薬学的活性剤は、適切なキャリアシステムを用いて、安定化されており、分解又は酸化活性から保護されている必要がある。このような剤の有効性は、体液中のそれらの溶解性を向上させることにより、又はドラッグデリバリーシステムを用いて標的臓器に到達する前に望ましくない特性(例えば、毒性、臭気、味、及び他の性質)をマスクすることにより、改善され得る。
【0007】
不安定な、不溶性の、及び味の悪い活性剤の経口投与は、薬物を安定化させ、沈殿を回避し、及び早期の分解を防ぐことのできるデリバリーシステムを必要とするだろう。それはまた、溶解性を向上させ得るシステムを必要とする。悪い味をマスクし、毒性及び副作用を低減させるシステムである。製剤ユニットは、ナノカプセル、マイクロスフェア、リポソーム、及びPEG化のようなキャリアシステムを用いることによりこれらの特性を成し遂げるように、異なる手段を用いる。これらのキャリアシステムは、生物適合性ポリマー、脂質、又はさらには天然/合成タンパク質から作られる。天然の安定的なタンパク質/脂質は、免疫原性特性がより少ないことから用いられ、加えて特定の標的化のために用いられ得る。
【0008】
ドラッグデリバリーシステムは、低い溶解性及び浸透性を有し並びに消化管における酵素作用への高い感受性を有する、高分子量の薬物を投与するために広く用いられてきた。高分子の例は、ペプチド、タンパク質、ヌクレオチド、糖等を含む。先行技術において、我々は、経口投与のためのドラッグデリバリーシステムを用いた多くのこのような例を見る。
【0009】
Williamsらの特許文献4は、種々の疾患の治療において用いられるピリジル基置換ポルフィリン化合物及びそれらの有効量を開示している。彼らはまた、他の確立された方法に従った経口ルートを含む薬物の投与方法について議論している。彼らの発明の経口投与のための組成物は、錠剤、トローチ、水性若しくは油性懸濁液、顆粒、粉末、エマルション、カプセル、シロップ、又はエリキシルを含む。経口製剤の製造方法については議論されていない。
【0010】
Prasadらの特許文献5は、PDT療法において用いられる疎水性光増感剤をカプセル化するためのナノ粒子剤をベースとする、あるセラミックを開示している。薬物/色素を封入しているこのようなナノ粒子は、経口的に、非経口的に、又は局所的に投与され得る。そこで用いられる特定の光増感剤は、2−デビニル−2−(1−ヘキシルオキシエチル)ピロフェオホルビドである。
【0011】
Robinsonの特許文献6は、バクテリオクロリン及びバクテリオプルプリンの使用、並びのそれらの製造方法を開示している。彼の開示において、彼は、不活性希釈剤を用いた又は吸収可能な食用キャリアによるこの活性剤の経口投与を開示しており、又はそれはハード若しくはソフトシェルゼラチンカプセルに封入され得、錠剤に圧縮され、あるいは食物に直接的に取り込まれ得る。この特許文献は基本的には、対称及び不斉メソジアクリレートポルフィリンからのバクテリオクロリン及びバクテリオプルプリンの合成のための新しいルート及びPDT療法におけるそれらの使用を記述している。
【0012】
Sungらの特許文献7は、HMG−CoA還元酵素阻害薬、エリスロポエチン等のような治療上の活性剤を封入した生分解性ナノ粒子からなる経口製剤を開示している。それは経口的に送達され、効果的な傍細胞透過性を示す。この特許文献は、光増感剤について議論していないが、消化管において容易に吸収され得ない高分子量を有し、また封入されたタンパク質性薬物におけるプロテアーゼ活性を抑制するための、親水性タンパク質に対するキャリアとしてのナノ粒子に関連する。
【0013】
Harelの特許文献8は、薬物、タンパク質、ビタミン、プロバイオティクス体等のような生物活性剤の経口投与のためのマイクロ粒子の使用を開示している。封入マテリアルは、油、ポリサッカライド、タンパク質、合成ポリマー、又はこれらの組み合わせより作られ得る。
【0014】
Yoav D.Livneyらの特許文献9において、発明者らは、栄養物、治療上の化合物及び化粧上の化合物、並びに食物及び飲料を介したそれらの投与を含む、疎水性化合物の封入方法を記載している。特に、封入に対してミルクタンパク質であるカゼインを用いている。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】国際公開WO2006/133271号パンフレット
【特許文献2】国際公開WO1997/010811号パンフレット
【特許文献3】国際公開WO2003/097096号パンフレット
【特許文献4】米国特許第7,423,369号明細書
【特許文献5】米国特許第7,364,754号明細書
【特許文献6】米国特許第6,376,483号明細書
【特許文献7】米国特許公開公報2007/0237827号明細書
【特許文献8】米国特許公開公報2008/044481号明細書
【特許文献9】国際公開WO2007/122613号パンフレット
【非特許文献】
【0016】
【非特許文献1】F.L.Primo,P.P.Macaroff,Z.G.M.Lacava,R.B.Azevedo,P.C.Morais,A.C.Tedesco,Binding and photophysical studies of biocompatible magnetic fluid in biological medium and development of magnetic nanoemulsion:A new candidate for cancer treatment.J.Magnetism Magn.Mater.,2007,310,2838−2840
【非特許文献2】A.J.Gomes,C.N.Lunardi,A.C.Tedesco,Characterization of biodegradable poly(D,L−lactide−co−glycolide)nanoparticles loaded with bacteriochlorophyll−a for photodynamic therapy,Photomed. Laser Surg.,2007,25,428−435
【非特許文献3】E.Ricci−Junior,J.M.Marchetti,Preparation,characterization,photocytotoxicity assay of PLGA nanoparticles containing zinc(II)phthalocyanine for photodynamic therapy use,J.Microencapsul.,2006,23,523−538
【非特許文献4】E.Ricci−Junior,J.M.Marchetti,Zinc(II)phthalocyanine loaded PLGA nanoparticles for photodynamic therapy use,Int.J.Pharm.,2006,310,187−195
【非特許文献5】V.Saxena,M.Sadoqi,J.Shao,Polymeric nanoparticulate delivery system for indocyanine green:Biodistribution in healthy mice,Int.J.Pharm.,2006,308,200−204
【非特許文献6】A.Vargas,B.Pegaz,E.Debefve,Y.Konan−Kouakou,N.Lange,J.−P.Ballini,H.van den Bergh,R.Gurny,F.Delie,Improved photodynamic activity of porphyrin loaded into nanoparticles:an in vivo evaluation using chick embryos,Int.J.Pharm.,2004,286,131−145
【非特許文献7】Y.N.Konan,M.Berton,R.Gurny,E.All,mann,Enhanced photodynamic activity of meso−tetra(4−hydroxyphenyl)porphyrin by incorporation into sub−200 nm nanoparticles,Eur.J.Pharm.Sci.,2003,18,241−249
【非特許文献8】Y.N.Konan,R.Cerny,J.Favet,M.Berton,R.Gurny,E.All,mann,Preparation and characterization of sterile sub−200 nm meso−tetra(4−hydroxyphenyl)porphyrin loaded nanoparticles for photodynamic therapy,Eur.J.Pharm.Biopharm.,2003,55,115−124
【非特許文献9】A.Vargas,M.Eid,M.Fanchaouy,R.Gurny,F.Delie,In vivo photodynamic activity of photosensitizer−loaded nanoparticles: Formulation properties,administration parameters and biological issues involved in PDT outcome,Eur.J.Pharm.Biopharm.,2008,69,43−53
【非特許文献10】B.Pegaz,E.Debefve,F.Borle,J.−P.Ballini,H.Van den Bergh,Y.N.Kouakou−Konan,Encapsulation of porphyrins and chlorins in biodegradable nanoparticles:The effect of dye lipophilicity on the extravasation and the photothrombic activity.A comparative study,J.Photochem.Photobiol.B:Biology,2005,80,19−27
【発明の概要】
【課題を解決するための手段】
【0017】
一般的に、先行技術における光増感剤は、治療部位及び薬物の特性に依存して、全身的又は局所的に投与される。溶解性、分子サイズ、及び安定性は、投与のモードを決定するために用いられる一定のファクターである。本発明は、針刺しに起因する痛み、又は局所適用に起因する皮膚の染色等といった合併症を伴うことなく、経口ルートにより患者に容易に投与され得る経口製剤を提供する。本発明は、消化管により容易に吸収され得る製剤を提供することを目的とする。
【0018】
本発明の目的は、経口投与のための光増感剤の適切な製剤を提供することであり、それは、標的臓器又は身体領域に、光線力学治療及び抗菌光線力学治療に必要とされる治療上の用量の薬物を送達することができる。
【0019】
本発明の目的はまた、消化管において安定的である光増感剤を封入するキャリアシステムを用いた適切な経口製剤を提供することである。
【0020】
本発明の他の目的は、標的部位への十分な蓄積を保証するように薬物のバイオアベイラビリティを向上させる適切な経口製剤を提供することである。
【0021】
本発明のさらなる他の目的は、錠剤;カプセル;液体カプセル(liquid fill);粉末;ペースト;シロップ等の形態で投与され得る光増感剤の経口製剤を提供することである。
【0022】
本発明の他の目的はまた、脂質、従来のリポソーム、PEG化リポソーム、熱力学的に安定的なナノエマルション、アルファフェトプロテイン(AFP)、BSA(ウシ血清アルブミン)、ヒドロゾル、自己マイクロ乳化ドラッグデリバリーシステム(SMEDDS)、脂肪エマルションシステム、ナノ粒子、及び他の公知の適切なキャリアを含むキャリアシステムを用いて経口製剤を提供することである。
【0023】
本発明のさらなる目的は、消化管粘膜(薬物がその後吸収される)に容易に付着し得る経口製剤を提供することである。
【0024】
簡潔にいうと、本発明は、光線力学治療(PDT)及び抗菌光線力学治療(APDT)の間の経口投与のための光増感剤の製造方法を開示する。経口製剤化された光増感剤は、亢進された溶解性及び透過性を示し、その結果、治療部位において光増感剤のバイオアベイラビリティが改善される。経口投与された光増感剤は、粘膜付着及び胃腸粘膜を経由する吸収のために適切に製造される。経口製剤の本発明は、経口ルートによる光増感剤のためのキャリアとして脂質及び公知のタンパク質を用いる。光増感剤を封入することで知られるキャリアは、従来のリポソーム、PEG化されたリポソーム、ナノエマルション、ナノ結晶、ナノ粒子、脂肪エマルション、脂質製剤、ハイドロゾル、SMEDDS、アルファフェトプロテイン(AFP)、並びにウシ血清アルブミン(BSA)、脂肪エマルション及びナノ粒子を含む。本発明における疎水性光増感剤のケースでの経口製剤は、適切な界面活性剤/可溶化剤を用いて安定化されており、その結果、胃における並びに十二指腸及び小腸で吸収されるまでの薬物の凝集を抑えることができる。この製剤は、液剤、カプセル、錠剤、粉末、ペースト、又はゲルの形態で経口投与され得る。したがって、製造された薬剤は、PDTを行う前に単回又は複数回で経口投与され得る。本発明の実施態様のひとつは、経口製剤における光増感剤としてテモポルフィン(m−THPC)を用いることである。この化合物は特に、経口投与に適している。テモポルフィンを代謝することができる、哺乳類の身体における酵素システムは知られていないからである。そのため、テモポルフィンは変化することなく血液システムに到達し得、消化管における製剤の吸収後も十分に活性を示す。
【0025】
本発明の上述及び他の目的における特徴及び利益は、添付の図面と併せて以下の明細書の記載から明らかになるだろう。
【図面の簡単な説明】
【0026】
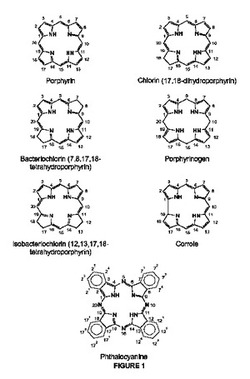
【図1】光線力学治療において有用である分子のテトラピロール骨格の例を示す図である。
【図2】FOSLIPOSの経口投与後にHT29腫瘍を有する雌のNMRInu/nuマウスで測定された蛍光を示すグラフの図である。
【図3】光増感剤BLC6066の構造を示す図である。
【発明を実施するための形態】
【0027】
経口ルートによる投与は、最も一般的かつ好適な方法であり、それにより薬物は全身的作用をもたらす。一般に、経口投与される薬剤は通常、薬物が錠剤又はカプセルに封入されている。錠剤は、薬物それ自体とは異なるさまざまな他の物質を含み、薬物はこれらの他の物質と混合可能である必要がある。それは、製剤化のための正しい不活性成分及び賦形剤を選択するように、活性剤の化学的及び物理的特性について良く理解する必要があることを意味する。他の経口製剤の形態は、液剤(溶液、懸濁液、及びエマルション)、半固形剤(ペースト)、及び固形剤(錠剤、カプセル(ソフト及びハード)、粉末、顆粒、プレミックス等を含む。
【0028】
前製造工程は、どの他の成分が調製に用いられるべきかを選択するための、薬物の物理的、化学的、及び力学的特性の評価を含む。活性剤の粒子サイズ、多型性、pH、及び溶解性といったファクターを考慮に入れる。これらのすべては、バイオアベイラビリティ及びひいては薬物の活性に影響し得るからである。薬物は、存在する薬物の量が各々の用量ユニット(例えば、各々の錠剤/カプセル)に一致することを保証する方法により、不活性添加剤と組み合わされなければならない。用量ユニットは、均一な特徴(許容可能な味、錠剤の堅さ、又はカプセルの崩壊)を有するべきである。
【0029】
経口投与される光増感剤は、溶解後、生体膜を通過して全身循環への吸収を経験する。薬物の経口バイオアベイラビリティをもたらす主要なプロセスは、溶解、透過性、消化管粘膜における酵素代謝、及び肝抽出である。
【0030】
光増感剤のための経口製剤の本発明において、本明細書で用いられる“光増感剤”の用語は、適切な波長を用いて光活性化され得る感光性の化合物を含む。それは、ポルフィリンのテトラピロール化合物及びそれらの誘導体化合物、クロリン(例えば、テモポルフィン、m−テトラヒドロキシフェニルクロリン(mTHPC)といった合成クロリンと同様にクロロフィル誘導体)、バクテリオクロリン、コロール、及びフタロシアニンを含む。又、それは、すべての場合において、互変異性体並びにそのメタレート(metallates)及び塩を含む。本発明は、図1に示される構造を有するテトラピロール大員環を含む。
【0031】
好ましくは、飽和炭素原子がピロール環のひとつの非結合炭素原子に位置するジヒドロポルフィリンといった還元されたポルフィリンを有する光増感剤である。このシリーズの親化合物は、クロリンと称され、非置換のポルフィリン環の用語で規定される、17,18−ジヒドロポルフィリンである。
【0032】
飽和炭素原子がピロール環の2つの対角線上の反対側の非結合炭素原子に位置するテトラヒドロポルフィリンは、バクテリオクロリンである:このように還元された隣接するピロール環を有するテトラヒドロポルフィリンは、イソバクテリオクロリンと称される。
【0033】
本発明のテトラピロール化合物は、限定されることなく、錠剤、カプセル、液体カプセル、粉末、液体、ゲル、又はペーストの形態のうちのひとつに製剤化される。本発明の製造方法は、前選択された光増感剤に化学的に混合可能なものの中から所定の不活性成分を用いる。
【0034】
経口投与に適する投薬形態は、例えば限定されることなく、薬学的に許容可能なエマルション、溶液、懸濁液、シロップ、及びエリキシルを含む。上記のように、光増感剤に加えて、投薬形態は、水又は他の溶媒、可溶化剤、及び乳化剤といった本技術分野で通常用いられる不活性希釈剤を含み得る。不活性希釈剤のほかに、湿潤剤、乳化剤及び懸濁剤、結晶化抑制剤、保存料、pH緩衝剤、甘味料、香味剤及び臭気マスキング剤といった補助剤を含み得る。
【0035】
薬学的に許容可能であるとは、合理的なベネフィット/リスク比に相応した、過度の毒性、アレルギー反応、又は合併症を引き起こすことの無い、ヒト又は動物の組織における使用に適する不活性マテリアル、組成物、及び投薬形態を意味する。
【0036】
本開示において有用である薬学的に許容可能なキャリア又はデリバリーシステムは、ドラッグデリバリーシステムの本技術分野において知られている新しいシステムと同様に従来のシステムも含む。
【0037】
一般に、本発明の投薬形態は、光増感剤;及び薬学的に許容可能な賦形剤/キャリアを含み、さらに、フィラー、バインダー、崩壊剤、潤滑剤、流動促進剤、湿潤剤、緩衝剤、吸収促進剤、及び投薬形態に依存する他のものを含む。
【0038】
(錠剤の形態)
一般に、テトラピロール化合物及びその誘導体の錠剤の形態は、所定の割合の光増感剤(活性剤)、所定の割合の界面活性剤、フィラー、崩壊剤、潤滑剤、流動促進剤、バインダー、吸収促進剤、溶液遅延剤、湿潤剤、吸収剤;緩衝剤、並びに凝集を回避するように容易な崩壊及び腸領域での錠剤の溶解を保証する少ない割合の化合物を有するだろう。界面活性剤の使用は、疎水性光増感剤を安定化させ凝集を回避する一助となる。
【0039】
崩壊時間は、早急な効果及び持続放出のために修正され得る。特定のコーティングは、より高いアルカリ性のpH若しくは特定の酵素作用の結果十二指腸でのみ崩壊するように、胃酸に耐性を有する錠剤を作ることができ、又は錠剤から腸への制限された拡散をもたらすことができる。錠剤はまた、味を隠すために糖で被覆され得る。いくつかの錠剤は、中に孔を有する不浸透性膜により取り巻かれた、浸透圧的に能動的なコアによりデザインされる。これよって、薬物は、錠剤が消化管を通って動く際に、一定の速度で錠剤から溶出することができる。
【0040】
実施態様のひとつにおいて、mTHPCは、体内に入ってin vivoで酵素活性及び他の生物学的活性に耐性を示すと、代謝体を形成しない好ましい光増感剤として用いられる(Hony Cai et al,Biomedical Chromatography 13:pg.354−359(1999)、及びBiomedical Chromatography 13:pg.184−186(1999)を参照)。Martijn Triesscheijnらによる“The Pharmacokinetic behaviour of the photosensitizer m−THPC in mice and men”(Cancer Chemother Pharmacol 60:Pg.113−122(2007))において、mTHPCの薬物動態及びその薬物動態学的反応は、in vivoにおいてリポタンパク質と結合するとき関連する。試験により、リポタンパク質もコレステロール代謝も血漿中のmTHPCの薬物動態に影響を与えないことが報告された。
【0041】
本発明において、錠剤コアの例は、限定されることなく、トウモロコシでんぷん、アルファでんぷん、グリコール酸ナトリウムでんぷん、ポビドン、ジベヘン酸グリセロール、ステアリン酸マグネシウム、ラクトース一水和物、粉末セルロース、アルファトウモロコシでんぷん、コロイド状無水シリカ、微晶質セルロース、ヒドロキシプロピルセルロース、インジゴカルミンアルミニウムレーキ、クロスポビドン、シリカ、コロイド状無水/コロイド状二酸化ケイ素等を含む。
【0042】
適切なフィルムコーティングマテリアル/組成物は、限定されることなく、ヒプロメロース、グリセロールトリアセテート、タルク、二酸化チタン(E171)、酸化鉄イエロー(E172)、酸化鉄レッド(E172)、エチルセルロース、ポリビニルアルコール−一部加水分解された二酸化チタン、レシチン、キサンタンガムを含む。
【0043】
(カプセルの形態)
実施態様にひとつにおいて、カプセル、ゼラチン被覆は、光増感剤製剤を封入するために用いられる。カプセルは、吸収を遅らせるために、摂取後、数時間未変化のままでいるようにデザインされ得る。それらはまた、同じ用量で早められた及び遅くされた吸収を作り出すように、早く及び遅く放出する粒子の混合物を含む。2つの主要なタイプのカプセルは、堅い殻のカプセル(乾燥した粉末化された成分に用いられる)及び柔らかい殻のカプセル(油に、及び油に溶解又は懸濁される活性成分に用いられる)である。これらのクラスのカプセルの両方は、ゼラチンと、カラギーナン並びにスターチ及びセルロースの変形形態のような植物ベースのゲル化物質と、の両方から作られる。
【0044】
本発明において用いられるカプセルシェルのマテリアルは、限定されることなく、ヒプロメロース、エチルセルロース、ラクトース一水和物、ステアリン酸マグネシウム、ヒプロメロース、ヒドロキシプロピルメチルセルロースアセテートサクシネート、スクロース、糖球状顆粒、タルカム、二酸化チタン、トリエチルシトレート、ポビドン、シリカ、コロイド状無水/コロイド状二酸化シリコン、ポリソルベート20等を含む。
【0045】
さらに、カプセルシェルのマテリアルは、例えば、二酸化チタン、酸化鉄イエロー、酸化鉄レッド、ゼラチン、ラウリル硫酸ナトリウム、インジゴカルミン、酸化鉄イエロー、及び食用白色インクといった薬学的に許容可能な着色剤を含み得る。さらに、カプセルシェルのマテリアルは、限定されることなく、シェラック、レシチン(大豆)、シメチコン、酸化鉄レッド、及びヒドロキシプロピルセルロースを含む薬学的に許容可能な印刷用インクを含み得る。
【0046】
(液体カプセル(Liquid fill capsules)(ソフト及びハードカプセル))
さらに他の実施態様において、液体カプセルが用いられる;それらは吸収を促進することにより疎水性光増感剤のバイオアベイラビリティを向上させるからである。液体カプセル(Liquid filling)は具体的には、簡易化された製造プロセスに起因した強力な活性化合物及び細胞毒性化合物を含む製品において、並びに他の形式で低い溶解性又は乏しいバイオアベイラビリティを示す製品において、適切である。可溶化剤は、限定されることなく、ポリエチレングリコール/マクロゴール(Lutrol(登録商標)(BASF AG))を含む。
【0047】
(液体の形態−Foslipos製剤)
本発明の“Foslipos”という用語は、サッカライドを添加されておらず、凍結乾燥されない、リポソーム小胞を形成することにより疎水性光増感剤を封入する脂質製剤を意味する。脂質は、疎水性薬物を可溶化することができ、そのため、脂質ベースのドラッグデリバリーシステムは消化管における薬物吸収及び溶解速度を改善させることが証明されてきた。
【0048】
本発明において用いられるリポソーム小胞は、リン脂質からなり、好ましくは合成リン脂質は、ジパルミトイルホスファチジルコリン(DPPC)、ジミリストイルホスファチジルコリン(DMPC)、ジステアロイルホスファチジルコリン(DSPC)といったホスファチジルコリン;及びジパルミトイルグリセロール(DPPG)、ジステアロイルホスファチジルグリセロール(DSPG)、及びジミリストイルホスファチジルグリセロール(DMPG)といったホスファチジルグリセロールである。
【0049】
Fosliposは、輸送コンパートメントとしての脂質二重層に焦点をあてている。この方法において、光増感剤は膜の内側に存在し、光増感剤は効率的に作用部位に標的化される。しかし、リポソーム粒子の中の内腔部位は、治療において有利な効果を有し得る薬物を含む、他の物質を封入できるように空にしておく。凍結乾燥は、薬物について商業上の関心を引くようにする、長期の安定的な活性を有するシェルの寿命をもたらすにもかかわらず、本発明における光増感剤の液体リポソーム製剤は、従来のリポソーム製剤と異なり凍結乾燥されない。
【0050】
(PEG化されたリポソーム製剤−液体の形態)
疎水性光増感剤、典型的な2又は3以上の合成リン脂質及び少なくともひとつのPEG化リン脂質は、アルコール溶液に溶解される。溶液をその後、ロータリーエバポレーターを用いて真空下で乾燥させる。混合物をその後100ナノメートルの最終孔径を用いたホモジナイザーフィルターシステムに通過させる。再水和中、水はモノサッカライドで補われる。ろ液を収集し、バイアルに充填し、任意に凍結乾燥させる。
【0051】
PEG化されたリポソーム製剤は、合成リン脂質を用いて調製される。本発明において用いられるリン脂質は好ましくは、DPPC(ジパルミトイルホスファチジルコリン)、DPPG(ジパルミトイルホスファチジルグリセロール)、及びDSPE(PEG化ジステアロイルホスファチジルエタノールアミン)を含み、これらのすべては合成して作られる。
【0052】
本発明の他の実施態様において、経口製剤が液体の形態において製造され得、光増感剤及びLipofundinの混合物が経口ルートで投与され得る。
【0053】
(熱力学的に安定的なナノ及び自己乳化マイクロエマルションドラッグデリバリーシステム(SMEDDS))
他の実施態様において、ナノ及びマイクロエマルションの経口製剤が、光増感剤の経口投与に対して用いられる。エマルションは液体システムであり、それにおいて、ひとつめの液体がふたつめの非混和性液体中に分散している(乳化剤有り又は無し)(通常は液滴中)。SMEDDS(マイクロエマルションシステム)は、延長された品質保持期間を短くする疎水性薬物の熱力学的に安定なキャリアシステムである。マイクロエマルション製剤の本製剤は、非毒性、非刺激性、及び薬学的に許容可能な成分を用いて調製される。
【0054】
SMEDDS(自己乳化マイクロエマルションドラッグデリバリーシステム)は、油の等方性混合物、界面活性剤、共活性剤、及び消化管で遭遇されるであろう穏やかな撹拌又は消化運動のコンディション下で水性溶媒又は消化管液にさらされるときに迅速に水中油型マイクロエマルションを形成する薬物として規定される。SMEDDSの用語は、水及び有機性成分(疎水性(脂溶性)有機性成分を含む)を含む透明又は実質的に透明のコロイド性分散として従来受け入れられた意味において用いられる。SMEDDSは、1又は2以上の下記の特性を有すると見なされる。それらは、それらの成分が接触するようにされたときに自発的に又は実質的に自発的に形成され、それは実質的なエネルギー供給無し(例えば、加熱、高度なせん断装置の使用、又は他の実質的な撹拌の使用無し)で行われる。それらは、熱力学的な安定性を示す。それらは、単層である。それらは実質的に透明である(すなわち、それらは光学顕微鏡の手段で観察すると透明又は乳白色である)。それらはそのままの状態では光学的に等方である。SMEDDSは分散相又は微粒子(液滴)相を含み、その粒子サイズは200nm未満であり、それゆえそれらは光学的等方性を示す。
【0055】
製薬及び化粧品産業界は、ハードゼラチンカプセル、錠剤、及びプラスターの形態でのパッケージングを促進するために、水相を含まない組成物に対するさらに増大する要求を表明している。ハードゼラチンカプセルの製造に対して現在知られている組成物(具体的には上述の文献に記載されているもの)は、ニーズに合致することができない。これらの混合物に含まれる水の存在は、ハードゼラチンカプセルを用いる技術に相容れない。
【0056】
本発明はこの問題を解決した。それは、具体的には薬学的又は化粧品での使用のための、経口投与可能な組成物に関し、それは、脂溶性の相、少なくともひとつの界面活性剤及び少なくともひとつの共活性剤を含む。それは、混合され及び生理液の存在において、そのままで溶解を促進し有効成分のバイオアベイラビリティを向上させるマイクロエマルションを形成する。
【0057】
(一般的な製剤の調製)
マイクロエマルションを形成することのできるこの経口投与可能な組成物は、少なくとも、
有効成分、
脂肪酸エステル及びグリセリドの混合物からなる脂溶性の相、
界面活性剤(SA)、
共活性剤(CoSA)、
溶媒、
親水性相、
を含み、該脂溶性の相は、16未満の親水性−脂溶性バランス(HLB)を有する炭素数8〜18のポリグリコライズドグリセリドの混合物からなり、この脂溶性の相は、組成物の全重量中1〜75%含まれ;界面活性剤(SA)は、炭素数8〜10の飽和ポリグリコライズドグリセリド及びポリグリセロールのオレイン酸エステルを含む群より選択され、この界面活性剤もまた16未満のHLBを有し;共活性剤(CoSA)は、プロピレングリコールのラウリン酸エステル、ポリグリセロールのオレイン酸エステル、及びエチルジグリコールを含む群より選択され;SA/CoSA比は、0.3〜8の間であり;最終のマイクロエマルションの親水性相は、消化環境の生理液による摂取後に供給される。
【0058】
本発明のひとつの他の実施態様において、自己マイクロ乳化ドラッグデリバリーシステム(SMEDDS)製剤としてのマイクロエマルションは、活性剤、好ましくはテモポルフィン(mTHPC)としての可変量の光増感剤を含み得る。一方、用いられる添加剤は、以下の例に限定されることなく、マクロゴールグリセロールヒドロキシステアレート40、ポリエトキシル化ひまし油、Cremophor(登録商標)EL(BASF社により販売)、ポリエチレングリコール300、ポリエチレングリコール400、d−アルファ−トコフェリル−ポリエチレングリコール−1000−スクシネート:TPGS(登録商標)(Estman社により販売)、カプリロカプロイルマクロゴールグリセリド(ポリオキシグリセリド):Labrasol(登録商標)、プロピレングリコールモノカプリレート/プロピレングリコールカプリレート:Capryol(登録商標)90、ジエチレングリコールモノエチルエーテル:Transcutol、オレオイルマクロゴールグリセリド(ポリオキシグリセリド)/リノレオイルマクロゴールグリセリド(ポリオキシグリセリド):Labrafil(登録商標)、ラウロイルマクロゴールグリセリド(ポリオキシグリセリド)/ステアロイルマクロゴールグリセリド(ポリオキシグリセリド):Gelucire(登録商標)、グリセリルモノ−リノレート:Maisine(登録商標)、プロピレングリコールジカプリロカプレート/中鎖トリグリセリド:Labrafac(登録商標)、プロピレングリコールモノラウレート/プロピレングリコールラウレート:Lauroglycol(登録商標)、グリセリルモノ−オレート:Peceol(登録商標)、ポリグリセリルオレート:Plurol Oleicque(登録商標)(すべてGattefosse SAS社(サン=プリースト、フランス)により販売);モノ−、ジグリセリド:Capmul(登録商標)MCM、プロピレングリコール中の混合されたカプリル酸/カプリン酸のジエステル:Captex(登録商標)200、カプリル酸/カプリン酸のトリグリセリド:Captex(登録商標)355、ポリグリセロールオレート:Caprol(登録商標)MPGO、デカグリセロール中のオレイン酸エステル:Caprol(登録商標)PGE−860、エトキシ化ココナッツグリセロールエステル:Acconon(登録商標)CO−7、エトキシ化カプリル酸/カプリン酸グリセロールエステル:Acconon(登録商標)CC−6(すべてABITEC社により販売)、並びに他の再結晶化阻害剤、バイオアベイラビリティ促進剤、界面活性剤、乳化剤、エタノール及び水(いくつかの異なるレジメンで混合される)を含む。これらの製剤は最終的には、ソフトゼラチンカプセルに充填されて投与される。十二指腸及び小腸において、腸液との接触後のSMEDDS製剤は、体内における後の吸収のために粘膜に容易に吸収されるのに適する約200nmのサイズの単相ミセルを形成するだろう。
【0059】
(ナノサスペンション)
不溶性薬物を高度に可溶化させる前述の方法の代替手段は、粒子サイズを小さくすることであり、それにより表面積が増大し、その結果溶解率が増大する。しかしながら、マイクロ化のみでは、これらの種類の薬物の所望のバイオアベイラビリティを得るには十分ではない。粒子サイズがサブマイクロメーターのサイズ範囲となれば、ナノ化は薬物のより高いバイオアベイラビリティを提供することが示されてきた(Mullerら、1998、2001)。薬物溶解率及び化合物の飽和溶解度が増大するからである。文献において薬物粒子サイズをナノメーター範囲に小さくする異なる方法が記載されており、例えば、沈殿(Trottaら、2001)、ジェットミル、パールミル(Liversidge及びConzentino、1995)、及び高圧ホモジネーション(Muller&Keck、2004)である。
【0060】
水性懸濁液を乾燥粉末に変えるために、凍結乾燥及び噴霧乾燥手段を用いることができる。噴霧乾燥はたいていプロセスにおいて高温を必要とし、それは熱に不安定な薬物には適切ではない。このようなケースにおいて、凍結乾燥が最も適切な手段である。凍結乾燥のプロセスにおいて、マンニトール、トレハロース、又はスクロースといった低温保護剤を溶液に加え、システムの再構築後の粒子凝集を回避する。
【0061】
(O/Wエマルション製剤)
本発明の他の実施態様において、経口投与される製剤の成分は、油及び脂肪化合物とmTHPCとの混合物である。異なる濃度の大豆油、中鎖トリグリセリド、グリセロール、卵レシチン、α−トコフェロール、オレイン酸ナトリウム、及び水を含むこのようなエマルションは、栄養輸液におけるカロリー源として臨床的に用いられる。
【0062】
(加熱溶融押出法製剤)
本発明の他の実施態様において、経口投与される製剤の成分は、適切な添加剤にブレンドされた生体適合性ポリマーとmTHPCとの混合物である。これらの混合物は、均一に溶融され、シングル又はツインスクリュー押出機により押し出され、APIの固体分散体を形成するだろう。これらの固体分散体は、湿潤性及びバイオアベイラビリティのより高いグレードに起因するAPIのより高い溶解率を示し、その結果、消化管における薬物放出を向上させる。適切なポリマーは、“塩基性ブチル化メタクリレートコポリマー(aPMMA)”、コポビドン(COP)、ポリエチレングリコール−ポリビニルアルコールコポリマー(PEG−PVA)、オイドラギット−改良剤及び他のポリマー、並びに本発明の技術分野における当業者に公知の添加剤の群から非排他的に選択され得る。
【0063】
(ナノ結晶製剤)
本発明の他の実施態様において、活性薬物化合物は、ナノ結晶製剤において経口投与され得る。極めて細かく粉砕された薬物(例えば、テモポルフィン)は、大きな表面積を有するように、界面活性剤により安定化され、最終的には噴霧乾燥され得、それにより消化管における安定的に吸収が促進される。
【0064】
(粉末化製剤−リポソームでカプセル化された光増感剤)
本発明の一実施態様において、光増感剤は経口投与のためのリポソームにカプセル化される。リポソーム小胞は、経口投与される疎水性光増感剤の溶解性を向上させ得る。
【0065】
リポソームは、下記の一般的な過程に従って調製された。
【0066】
疎水性光増感剤及び典型的には2又は3以上の合成リン脂質をアルコール溶液に溶解させる。溶液をその後ロータリーエバポレーターを用いて真空下で乾燥させる。混合物をその後100ナノメートルの最終孔サイズを用いるホモジナイザーフィルターシステムに通す。補水液をモノサッカライドで補う。ろ液を収集し、バイアルに充填し、任意に凍結乾燥させる。
【0067】
ホスファチジルコリンといった合成リン脂質は、ジパルミトイルホスファチジルコリン(DPPC)、ジミリストイルホスファチジルコリン(DMPC)、ジステアロイルホスファチジルコリン(DSPC)といった1又は2以上の合成コリンであり得る。示唆されるグリセロールは、ジパルミトイルホスファチジルグリセロール(DPPG)及びジミリストイルホスファチジルグリセロール(DMPG)を含む。必要とされる比率においてここで用いられる所定のリン脂質は、リポソーム製剤を安定化させ、及びそれを消化管分解作用から保護し得る。
【0068】
このように光増感剤を封入する製剤化されたリポソームは、乾燥粉末の形態であり、それは錠剤に変換され得、経口投与のためのハードカプセルに封入され得る。
【0069】
(ドラッグキャリアシステムとしてのナノ粒子)
経口製剤はまた、光増感剤が吸収され、光増感剤が含まれ、又は光増感剤が共有結合しているナノ粒子を含む。好ましい製剤において、ナノ粒子は、本技術分野において知られたような、ヒト血清アルブミン(HSA)又はポリ(ラクチド−co−グリコライド)(PLGA)といった生分解性マテリアルから形成される。
【0070】
(キャリアシステムとしてのアルファフェトプロテイン(AFP))
アルファフェトプロテイン(AFP)は、光増感剤を腫瘍細胞に標的化するように、この製剤におけるoncoshuttleとして用いられる。AFPは、ほとんどの癌がAFP受容体(AFPR)を発現しそれゆえ特異的な標的であるため、oncoshuttleとして用いられる。AFPは、約600のアミノ酸を含有するポリペプチド鎖及び大きな異種の炭水化物分子からなる大きな糖タンパク質である。AFP分子は、15のジスルフィド結合を含む。ジスルフィド結合が三次構造を決定する一方で、炭水化物は分子に特定の結合特性をもたらす。
【0071】
製剤の調製は、3つの部分に分けられ得る。
1)AFPタンパク質の除荷(unloading)
2)薬物物質のタンパク質への結合
3)タンパク質−薬物−複合体の分離及び保存
【0072】
タンパク質が結合リン脂質物質(例えば脂肪酸)によりのみ得られる場合、これらの物質は薬物分子の後の結合を許容するようにタンパク質から遊離される必要がある。
【0073】
(工程1)除荷(unloading)は、有機溶媒により行われ得、それはタンパク質の構造を壊さないが、リン脂質物質を分解するだろう。したがって、第一級及び第二級アルコール又はポリアルコールの水溶液が用いられ得る。除荷(unloading)後、AFPは限外ろ過により精製される必要がある。
【0074】
(工程2)負荷(loading)工程は、薬物物質を溶解させることができインキュベーション時間後に除去される必要のある溶媒を要する。除去は、凍結乾燥又はエバポレーションにより行われる。
【0075】
(工程3)非結合薬物物質は、限外ろ過により除去される必要があり、溶液は安定化される必要がある。
【0076】
(キャリアシステムとしてのウシ血清アルブミン(BSA))
ウシ血清アルブミン(BSA)といった天然のタンパク質は、経口投与のための光増感剤をカプセル化するために本発明において用いられる。AFPのアミノ酸配列は、ウシ血清アルブミンに著しく高い相同性を有する。アルブミン様タンパク質の特性は、2つのアルファヘリカルグロビン様サブドメインにより形成された構造的に相同する3つのドメインの存在である。したがって、BSAはまた、PDTにおいて効果的なキャリアとして用いられ得る。BSAは17のジスルフィド結合を有する大きな球状タンパク質である。BSA製剤の調製過程は、以下の通りである。
【0077】
製剤の調製は、3つの部分に分けられ得る。
1)BSAタンパク質の除荷(unloading)
2)薬物物質のタンパク質への結合
3)タンパク質−薬物−複合体の分離及び保存
【0078】
タンパク質が結合リン脂質物質(例えば脂肪酸及び他の脂質)によりのみ得られる場合、これらの物質は薬物分子の後の結合を許容するようにタンパク質から遊離される必要がある。
【0079】
(工程1)除荷(unloading)は、有機溶媒により行われ得、それはタンパク質の構造を壊さないが、リン脂質物質を分解するだろう。したがって、第一級及び第二級アルコール又はポリアルコールの水溶液が用いられ得る。除荷(unloading)後、BSAは限外ろ過により精製される必要がある。
【0080】
(工程2)負荷(loading)工程は、薬物物質を溶解させることができインキュベーション時間後に除去される必要のある溶媒を要する。除去は、凍結乾燥又はエバポレーションにより行われる。
【0081】
(工程3)非結合薬物物質は、限外ろ過により除去される必要があり、溶液は安定化される必要がある。
【0082】
本製造方法は上述のキャリアシステム及び製剤に限定されないが、それは、ミクロスフェア、ポリマー、ミセル、ハイドロゾル、アパソーム(apasomes)、ニオソーム、及びiPills等の新しい技術デバイスのような経口製剤に適する他のキャリアとともに用いられ得る。
【0083】
開示される経口製剤の光増感剤は、異なるタイプの、頭部及び頸部腫瘍、前立腺腫瘍、皮膚癌及び他の癌(それはさらに増殖性及び非増殖性疾患を含む)といった腫瘍性コンディション、並びにBPH、異形成、バレット食道、加齢黄斑変性、血管疾患、炎症性疾患、及び細菌及びウイルス感染といった他の疾患のコンディションを治療するために経口投与される。それはさらに、皮膚再生、にきび治療、恐怖(scare)及びしわの除去、毛髪除去、肥満低減及びセルライト治療といったPDTの化粧品適用のために用いられ得る。それはまた、ウイルス、細菌、菌類、寄生原生動物、及びプリオンといった微生物感染の治療のための抗菌光線力学療法において用いられる。さらに、PDTの適用は、歯科領域の問題及びその他を含む。本発明の製剤は、上述の例のみに限定されないが、光線力学療法(PDT)を用いて治療され得る他のヒト及び動物の疾患に拡張され得る。
【0084】
一般に、本発明の光増感剤の経口製剤を用いるPDT治療方法は、経口ルートによる光増感剤の単回投与、その後の照射を含む。さらなる実施態様はまた、光増感剤の複数回の経口投与の使用、その後の単回の照射レジメン又は複数回の光照射レジメンを含む。複数回の経口投与は、疾患のコンディション及び部位に依存して、毎日、毎週、又は必要に応じて行われ得る。組織内の最適投与量は、照射前の蛍光測定により保証され得る。このような最適化された治療レジメンは、光の感受性を最小化し、同時に壊死を制限し標的組織の順次の殺傷を引き起こす間薬物の有用性を最大化する。このような最適化された複数治療レジメンはまた、体内の免疫活動を誘導する一助となり、長期間標的化された細胞に対して免疫反応を引き起こす。疾患のコンディションに依存して、上述の治療レジメンは短い間隔の後必要に応じて繰り返されてもよい。
【0085】
さらにそれは、低用量で経口投与することにより診断目的で用いられ得る。本明細書において“低”という用語は、一般的に投与される効果的な治療上の用量よりも通常低い、効果的な用量を意味する。“診断”という用語は、活性剤又は疾患があること若しくは無いことを試験するのに有用であるマテリアル、及び/又は組織イメージングを亢進させる剤を意味する。本明細書において“効果的な”という用語は、所望の効果を作り出すのに有用である診断剤又は治療剤の経口投与(量)を意味する。
【0086】
他の可能性のある実施態様において、本発明の経口投与のためのテトラピロール誘導体製剤は、光/照射の適用無しに、非PDT治療剤として、又は抗癌化学療法剤として用いられる。光エネルギー無しでの薬物の作用は、光無しでの毒性に関連する。ここでの薬物は、直接的に細胞に作用する細胞毒性剤として機能する。本発明のテトラピロール経口製剤は、単回又は好ましくは複数回患者に投与される。ここで、細胞毒性作用は、使用している薬物濃度に直接的に依存し、それゆえ、医師により注意深く管理される必要がある。この適用は、癌細胞、細菌、菌類、寄生生物、及び感染性プリオンの不活性化に有用であるだろう。
【0087】
(光無しでの毒性の決定)
HIG82、HT29、及びJ774A1のような異なる細胞株における2,3−ジヒドロ−2,3−ジヒドロキシ−15,20−ジヘキシル−5,10−ビス(4−カルボキシフェニル)ポルフィリン(BLC6066)の光無しでの毒性作用(図3参照)は、約24時間、2〜10μMの範囲のBLC6066の異なる漸増濃度で培養細胞をインキュベートすることにより決定された。10μMの濃度のBLC6066でインキュベートされた細胞は、ヒト細胞において明確な毒性を示し、さらに細菌の細胞に対しても光無しでの強い毒性を示した。
【0088】
本発明は、下記の実施例によりさらに記述されるが、それにより限定されるものではない。
【実施例】
【0089】
(FOSLIPOS−リポソームベースの、経口投与のための疎水性光増感剤の経口製剤)
Foslipos(DPPC及びDPPGを含有する、mTHPCの脂質ベースの製剤)
薬物用量:300μg mTHPC
試験は、成体雌無胸腺NMRI nu/nuマウス(Harlan Winkelmann GmbH、ドイツ)を用いて行った。22−24gの体重の6−8週齢のマウスの左後部大腿部にHT29ヒト結腸直腸癌細胞の懸濁液(5%グルコース中8×107細胞/mLの0.1mL)を皮下注射して移植した。実験は10日後に行われ、そのとき、腫瘍は約5−8mmの表面直径及び高さ2−3mmの厚さに到達していた。
【0090】
Foslipos(300μg mTHPCの薬物用量)を強制経口投与した。投与直後に皮膚の蛍光をファイバースペクトロメーター(Jeti GmbH Jena)により測定した。励起波長は415nmであり、発光波長は652nmであった。皮膚の蛍光を、投与後異なる時間ポイント(0時間,1時間,2時間,4時間,6時間,8時間,25時間,31時間及び49時間)で計測した。Foslipos投与後24時間から高い蛍光値が測定され得た(図2参照)。
【0091】
(HPLC分析)
動物をFoslipos経口投与後50時間で屠殺した(各時間ポイントで3匹のマウス)。動物の屠殺直後に、血漿、肝臓、脾臓、結腸、腫瘍、皮膚、及び骨格筋を解剖し、重量を測定し、−70℃で保存した。すべての組織サンプルは、外科用メスでカットすることにより小片に分け、重量を測定し、凍結乾燥させた(Christ Freeze drying system Alpha 1−4 LSC)。残りの粉末化された組織の重量を測定し、約10−20mgを2.0mLの反応チューブに移し、1.5mLのメタノール:ジメチルスルフォキシド(DMSO)(3:5、v:v)を加えた。サンプルを2,400rpmで作動するボルテックスミキサー(MELB1719、Merck Europub)を用いて5秒間混合し、その後、少なくとも12時間持続的な振盪下60℃でインキュベートした。すべてのサンプルを5分間、16,000gで遠心分離した(Microfuge、Heraeus、ドイツ)。各々の上清の1mLをHPLC分析用のHPLCバイアルに移した。
【0092】
サンプルのHPLC分析により、他の組織の測定値と比べると、腫瘍細胞においてFosliposがより高度に集積したことが示された。
【0093】
添付の図面を参照して本発明の好ましい実施態様が記述されてきたが、本発明は特定の実施態様に限定されず、本技術分野における当業者により種々の変形及び修正が添付の特許請求の範囲に規定される通りの本発明の範囲及び精神から逸脱することなく達成され得ることが理解されるべきである。
【0094】
(関連する出願)
本出願は、米国仮特許出願61/173,487(出願日2009年4月28日)、及び米国特許出願12/768,244(出願日2010年4月27日)に基づく35USC§119(e)に基づく優先権主張の利益を有する。これら両方の出願の発明の名称は“テトラピロール誘導体に対する新規の経口製剤”であり、発明者は、スザンナグラフェらである。これらの出願は、本明細書に参照により取り込まれる。
【技術分野】
【0001】
本発明は一般的に、製剤に関する。具体的には、それは、光線力学治療(PDT)において、抗菌光線力学治療(APDT)において、及びさらに光診断の目的で用いられる、テトラピロール化合物及びそれらの誘導体の経口製剤に関する。この製剤は、経口投与されるだろう。
【背景技術】
【0002】
光増感剤は、光増感剤の吸収スペクトルに一致する特定の波長の照射により光活性化され得る化合物である。光増感剤は、光線力学治療(PDT)において用いられる。それは、癌治療の初期段階で用いられる新しい方法であり、今では他の医学的問題の治療においても有効であることが見出されている。PDT療法は、増殖型及び非増殖型を含む異なる種類の癌、良性前立腺過形成(BPH)、他の炎症性疾患の治療、化粧用途等に用いられる。一般的に、光増感剤は、患者に全身投与及び局所投与され、その両方は各々メリット及びデメリットを有する。
【0003】
一般的に、光増感剤は現在、局所投与又は静脈内投与により送達される。特に、静脈内投与による送達は、多くの光増感剤が水に不溶性の疎水性又は両親媒性物質であるため、治療に対して問題を引き起こす。しばしば光増感剤は、例えば光増感剤であるテモポルフィンのように、アルコール溶液(エタノール、プロピレングリコール)中で投与される。しかしながら、アルコールが含まれると投与の間痛みが引き起こされ得、可溶化剤としてのアルコールについては一般的に一定の群の患者には投与できない。そのため、疎水性光増感剤を水溶性にするという方法で、疎水性光増感剤を製剤化する努力が行われてきた。これらのアプローチは、リポソーム、ナノ粒子、量子ドット、又は無機性マテリアルをベースとしたキャリアシステムといった多くの異なるキャリアシステムを含む。この点において、特に興味深いのは、脂質、タンパク質、又は生体適合性ポリマーといった高度に生体適合性を有するマテリアルをベースとしたキャリアシステムである。本技術分野において、多数のこのようなキャリアシステムが知られている(特許文献1〜3、非特許文献1〜10)。しかしながら、これらの水溶性キャリアシステムは、静脈内投与のために開発された。それらを経口投与する可能性については評価されてこなかった。
【0004】
経口投与は、薬剤投与に対して最も簡便なルートのひとつであり、特に患者コンプライアンスに有用である。薬剤の経口投与に対して直面する大きな障壁は、生物学的バリアを含み、それにより水に難溶性の薬物分子の経口投与が困難となる。一般に、薬物のサイズ、バイオアベイラビリティ、溶解性及び安定性は、薬物が、腸粘膜及び腸上皮のような生物学的バリアを通過するのを困難にする。これらの生物学的バリアを克服するために、薬剤の開発及び製造ユニットは、より効果的なデリバリーシステムを用いた製剤化の新しい方法を見出してきた。より新しいドラッグデリバリーシステムは、脾臓及び肝臓といった非標的部位に薬物が集積するのを回避するように設計され、その結果、循環システムにおける薬物の半減期が劇的に長くなった。これは、いくつかのケースでは困難であり、また例えば癌性組織を含む肝臓である場合には望ましいことではない。
【0005】
経口ドラッグデリバリーシステムの開発は、より効率的に及びより少ない副作用で患者に薬剤を送達させる必要性により発展してきた。経口ルートは、薬剤投与の最も便利なルートであることが見出されてきた。ヒトへの使用における経口及び他の治療システムは、制御された持続的な薬物放出のためのコンセプトとして認められてきた。それは、望まない薬理的効果を最小限にする一方で、所望の治療効果を維持するために必要とされる薬物の1日投与量及び投与回数を最小限にし得る。経口薬物デリバリーシステムは具体的には、身体組織への長期接触の間の生物適合性マテリアル、薬物デリバリーモジュールを開発する生物工学的方法、及び持続的な制御された薬物投与のコンディション下での薬物動態学の解明のための臨床薬理学的試験を提供するために、材料科学におけるイノベーションを必要としてきた。
【0006】
経口薬物デリバリーシステム/方法は、血漿及び標的臓器において治療上最適な薬物濃度を維持し;及びその結果、頻回な単回投与の必要性を取り除く可能性を提供する。薬剤及びサプリメントとして用いられる多くの薬学的活性剤は、適切なキャリアシステムを用いて、安定化されており、分解又は酸化活性から保護されている必要がある。このような剤の有効性は、体液中のそれらの溶解性を向上させることにより、又はドラッグデリバリーシステムを用いて標的臓器に到達する前に望ましくない特性(例えば、毒性、臭気、味、及び他の性質)をマスクすることにより、改善され得る。
【0007】
不安定な、不溶性の、及び味の悪い活性剤の経口投与は、薬物を安定化させ、沈殿を回避し、及び早期の分解を防ぐことのできるデリバリーシステムを必要とするだろう。それはまた、溶解性を向上させ得るシステムを必要とする。悪い味をマスクし、毒性及び副作用を低減させるシステムである。製剤ユニットは、ナノカプセル、マイクロスフェア、リポソーム、及びPEG化のようなキャリアシステムを用いることによりこれらの特性を成し遂げるように、異なる手段を用いる。これらのキャリアシステムは、生物適合性ポリマー、脂質、又はさらには天然/合成タンパク質から作られる。天然の安定的なタンパク質/脂質は、免疫原性特性がより少ないことから用いられ、加えて特定の標的化のために用いられ得る。
【0008】
ドラッグデリバリーシステムは、低い溶解性及び浸透性を有し並びに消化管における酵素作用への高い感受性を有する、高分子量の薬物を投与するために広く用いられてきた。高分子の例は、ペプチド、タンパク質、ヌクレオチド、糖等を含む。先行技術において、我々は、経口投与のためのドラッグデリバリーシステムを用いた多くのこのような例を見る。
【0009】
Williamsらの特許文献4は、種々の疾患の治療において用いられるピリジル基置換ポルフィリン化合物及びそれらの有効量を開示している。彼らはまた、他の確立された方法に従った経口ルートを含む薬物の投与方法について議論している。彼らの発明の経口投与のための組成物は、錠剤、トローチ、水性若しくは油性懸濁液、顆粒、粉末、エマルション、カプセル、シロップ、又はエリキシルを含む。経口製剤の製造方法については議論されていない。
【0010】
Prasadらの特許文献5は、PDT療法において用いられる疎水性光増感剤をカプセル化するためのナノ粒子剤をベースとする、あるセラミックを開示している。薬物/色素を封入しているこのようなナノ粒子は、経口的に、非経口的に、又は局所的に投与され得る。そこで用いられる特定の光増感剤は、2−デビニル−2−(1−ヘキシルオキシエチル)ピロフェオホルビドである。
【0011】
Robinsonの特許文献6は、バクテリオクロリン及びバクテリオプルプリンの使用、並びのそれらの製造方法を開示している。彼の開示において、彼は、不活性希釈剤を用いた又は吸収可能な食用キャリアによるこの活性剤の経口投与を開示しており、又はそれはハード若しくはソフトシェルゼラチンカプセルに封入され得、錠剤に圧縮され、あるいは食物に直接的に取り込まれ得る。この特許文献は基本的には、対称及び不斉メソジアクリレートポルフィリンからのバクテリオクロリン及びバクテリオプルプリンの合成のための新しいルート及びPDT療法におけるそれらの使用を記述している。
【0012】
Sungらの特許文献7は、HMG−CoA還元酵素阻害薬、エリスロポエチン等のような治療上の活性剤を封入した生分解性ナノ粒子からなる経口製剤を開示している。それは経口的に送達され、効果的な傍細胞透過性を示す。この特許文献は、光増感剤について議論していないが、消化管において容易に吸収され得ない高分子量を有し、また封入されたタンパク質性薬物におけるプロテアーゼ活性を抑制するための、親水性タンパク質に対するキャリアとしてのナノ粒子に関連する。
【0013】
Harelの特許文献8は、薬物、タンパク質、ビタミン、プロバイオティクス体等のような生物活性剤の経口投与のためのマイクロ粒子の使用を開示している。封入マテリアルは、油、ポリサッカライド、タンパク質、合成ポリマー、又はこれらの組み合わせより作られ得る。
【0014】
Yoav D.Livneyらの特許文献9において、発明者らは、栄養物、治療上の化合物及び化粧上の化合物、並びに食物及び飲料を介したそれらの投与を含む、疎水性化合物の封入方法を記載している。特に、封入に対してミルクタンパク質であるカゼインを用いている。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】国際公開WO2006/133271号パンフレット
【特許文献2】国際公開WO1997/010811号パンフレット
【特許文献3】国際公開WO2003/097096号パンフレット
【特許文献4】米国特許第7,423,369号明細書
【特許文献5】米国特許第7,364,754号明細書
【特許文献6】米国特許第6,376,483号明細書
【特許文献7】米国特許公開公報2007/0237827号明細書
【特許文献8】米国特許公開公報2008/044481号明細書
【特許文献9】国際公開WO2007/122613号パンフレット
【非特許文献】
【0016】
【非特許文献1】F.L.Primo,P.P.Macaroff,Z.G.M.Lacava,R.B.Azevedo,P.C.Morais,A.C.Tedesco,Binding and photophysical studies of biocompatible magnetic fluid in biological medium and development of magnetic nanoemulsion:A new candidate for cancer treatment.J.Magnetism Magn.Mater.,2007,310,2838−2840
【非特許文献2】A.J.Gomes,C.N.Lunardi,A.C.Tedesco,Characterization of biodegradable poly(D,L−lactide−co−glycolide)nanoparticles loaded with bacteriochlorophyll−a for photodynamic therapy,Photomed. Laser Surg.,2007,25,428−435
【非特許文献3】E.Ricci−Junior,J.M.Marchetti,Preparation,characterization,photocytotoxicity assay of PLGA nanoparticles containing zinc(II)phthalocyanine for photodynamic therapy use,J.Microencapsul.,2006,23,523−538
【非特許文献4】E.Ricci−Junior,J.M.Marchetti,Zinc(II)phthalocyanine loaded PLGA nanoparticles for photodynamic therapy use,Int.J.Pharm.,2006,310,187−195
【非特許文献5】V.Saxena,M.Sadoqi,J.Shao,Polymeric nanoparticulate delivery system for indocyanine green:Biodistribution in healthy mice,Int.J.Pharm.,2006,308,200−204
【非特許文献6】A.Vargas,B.Pegaz,E.Debefve,Y.Konan−Kouakou,N.Lange,J.−P.Ballini,H.van den Bergh,R.Gurny,F.Delie,Improved photodynamic activity of porphyrin loaded into nanoparticles:an in vivo evaluation using chick embryos,Int.J.Pharm.,2004,286,131−145
【非特許文献7】Y.N.Konan,M.Berton,R.Gurny,E.All,mann,Enhanced photodynamic activity of meso−tetra(4−hydroxyphenyl)porphyrin by incorporation into sub−200 nm nanoparticles,Eur.J.Pharm.Sci.,2003,18,241−249
【非特許文献8】Y.N.Konan,R.Cerny,J.Favet,M.Berton,R.Gurny,E.All,mann,Preparation and characterization of sterile sub−200 nm meso−tetra(4−hydroxyphenyl)porphyrin loaded nanoparticles for photodynamic therapy,Eur.J.Pharm.Biopharm.,2003,55,115−124
【非特許文献9】A.Vargas,M.Eid,M.Fanchaouy,R.Gurny,F.Delie,In vivo photodynamic activity of photosensitizer−loaded nanoparticles: Formulation properties,administration parameters and biological issues involved in PDT outcome,Eur.J.Pharm.Biopharm.,2008,69,43−53
【非特許文献10】B.Pegaz,E.Debefve,F.Borle,J.−P.Ballini,H.Van den Bergh,Y.N.Kouakou−Konan,Encapsulation of porphyrins and chlorins in biodegradable nanoparticles:The effect of dye lipophilicity on the extravasation and the photothrombic activity.A comparative study,J.Photochem.Photobiol.B:Biology,2005,80,19−27
【発明の概要】
【課題を解決するための手段】
【0017】
一般的に、先行技術における光増感剤は、治療部位及び薬物の特性に依存して、全身的又は局所的に投与される。溶解性、分子サイズ、及び安定性は、投与のモードを決定するために用いられる一定のファクターである。本発明は、針刺しに起因する痛み、又は局所適用に起因する皮膚の染色等といった合併症を伴うことなく、経口ルートにより患者に容易に投与され得る経口製剤を提供する。本発明は、消化管により容易に吸収され得る製剤を提供することを目的とする。
【0018】
本発明の目的は、経口投与のための光増感剤の適切な製剤を提供することであり、それは、標的臓器又は身体領域に、光線力学治療及び抗菌光線力学治療に必要とされる治療上の用量の薬物を送達することができる。
【0019】
本発明の目的はまた、消化管において安定的である光増感剤を封入するキャリアシステムを用いた適切な経口製剤を提供することである。
【0020】
本発明の他の目的は、標的部位への十分な蓄積を保証するように薬物のバイオアベイラビリティを向上させる適切な経口製剤を提供することである。
【0021】
本発明のさらなる他の目的は、錠剤;カプセル;液体カプセル(liquid fill);粉末;ペースト;シロップ等の形態で投与され得る光増感剤の経口製剤を提供することである。
【0022】
本発明の他の目的はまた、脂質、従来のリポソーム、PEG化リポソーム、熱力学的に安定的なナノエマルション、アルファフェトプロテイン(AFP)、BSA(ウシ血清アルブミン)、ヒドロゾル、自己マイクロ乳化ドラッグデリバリーシステム(SMEDDS)、脂肪エマルションシステム、ナノ粒子、及び他の公知の適切なキャリアを含むキャリアシステムを用いて経口製剤を提供することである。
【0023】
本発明のさらなる目的は、消化管粘膜(薬物がその後吸収される)に容易に付着し得る経口製剤を提供することである。
【0024】
簡潔にいうと、本発明は、光線力学治療(PDT)及び抗菌光線力学治療(APDT)の間の経口投与のための光増感剤の製造方法を開示する。経口製剤化された光増感剤は、亢進された溶解性及び透過性を示し、その結果、治療部位において光増感剤のバイオアベイラビリティが改善される。経口投与された光増感剤は、粘膜付着及び胃腸粘膜を経由する吸収のために適切に製造される。経口製剤の本発明は、経口ルートによる光増感剤のためのキャリアとして脂質及び公知のタンパク質を用いる。光増感剤を封入することで知られるキャリアは、従来のリポソーム、PEG化されたリポソーム、ナノエマルション、ナノ結晶、ナノ粒子、脂肪エマルション、脂質製剤、ハイドロゾル、SMEDDS、アルファフェトプロテイン(AFP)、並びにウシ血清アルブミン(BSA)、脂肪エマルション及びナノ粒子を含む。本発明における疎水性光増感剤のケースでの経口製剤は、適切な界面活性剤/可溶化剤を用いて安定化されており、その結果、胃における並びに十二指腸及び小腸で吸収されるまでの薬物の凝集を抑えることができる。この製剤は、液剤、カプセル、錠剤、粉末、ペースト、又はゲルの形態で経口投与され得る。したがって、製造された薬剤は、PDTを行う前に単回又は複数回で経口投与され得る。本発明の実施態様のひとつは、経口製剤における光増感剤としてテモポルフィン(m−THPC)を用いることである。この化合物は特に、経口投与に適している。テモポルフィンを代謝することができる、哺乳類の身体における酵素システムは知られていないからである。そのため、テモポルフィンは変化することなく血液システムに到達し得、消化管における製剤の吸収後も十分に活性を示す。
【0025】
本発明の上述及び他の目的における特徴及び利益は、添付の図面と併せて以下の明細書の記載から明らかになるだろう。
【図面の簡単な説明】
【0026】
【図1】光線力学治療において有用である分子のテトラピロール骨格の例を示す図である。
【図2】FOSLIPOSの経口投与後にHT29腫瘍を有する雌のNMRInu/nuマウスで測定された蛍光を示すグラフの図である。
【図3】光増感剤BLC6066の構造を示す図である。
【発明を実施するための形態】
【0027】
経口ルートによる投与は、最も一般的かつ好適な方法であり、それにより薬物は全身的作用をもたらす。一般に、経口投与される薬剤は通常、薬物が錠剤又はカプセルに封入されている。錠剤は、薬物それ自体とは異なるさまざまな他の物質を含み、薬物はこれらの他の物質と混合可能である必要がある。それは、製剤化のための正しい不活性成分及び賦形剤を選択するように、活性剤の化学的及び物理的特性について良く理解する必要があることを意味する。他の経口製剤の形態は、液剤(溶液、懸濁液、及びエマルション)、半固形剤(ペースト)、及び固形剤(錠剤、カプセル(ソフト及びハード)、粉末、顆粒、プレミックス等を含む。
【0028】
前製造工程は、どの他の成分が調製に用いられるべきかを選択するための、薬物の物理的、化学的、及び力学的特性の評価を含む。活性剤の粒子サイズ、多型性、pH、及び溶解性といったファクターを考慮に入れる。これらのすべては、バイオアベイラビリティ及びひいては薬物の活性に影響し得るからである。薬物は、存在する薬物の量が各々の用量ユニット(例えば、各々の錠剤/カプセル)に一致することを保証する方法により、不活性添加剤と組み合わされなければならない。用量ユニットは、均一な特徴(許容可能な味、錠剤の堅さ、又はカプセルの崩壊)を有するべきである。
【0029】
経口投与される光増感剤は、溶解後、生体膜を通過して全身循環への吸収を経験する。薬物の経口バイオアベイラビリティをもたらす主要なプロセスは、溶解、透過性、消化管粘膜における酵素代謝、及び肝抽出である。
【0030】
光増感剤のための経口製剤の本発明において、本明細書で用いられる“光増感剤”の用語は、適切な波長を用いて光活性化され得る感光性の化合物を含む。それは、ポルフィリンのテトラピロール化合物及びそれらの誘導体化合物、クロリン(例えば、テモポルフィン、m−テトラヒドロキシフェニルクロリン(mTHPC)といった合成クロリンと同様にクロロフィル誘導体)、バクテリオクロリン、コロール、及びフタロシアニンを含む。又、それは、すべての場合において、互変異性体並びにそのメタレート(metallates)及び塩を含む。本発明は、図1に示される構造を有するテトラピロール大員環を含む。
【0031】
好ましくは、飽和炭素原子がピロール環のひとつの非結合炭素原子に位置するジヒドロポルフィリンといった還元されたポルフィリンを有する光増感剤である。このシリーズの親化合物は、クロリンと称され、非置換のポルフィリン環の用語で規定される、17,18−ジヒドロポルフィリンである。
【0032】
飽和炭素原子がピロール環の2つの対角線上の反対側の非結合炭素原子に位置するテトラヒドロポルフィリンは、バクテリオクロリンである:このように還元された隣接するピロール環を有するテトラヒドロポルフィリンは、イソバクテリオクロリンと称される。
【0033】
本発明のテトラピロール化合物は、限定されることなく、錠剤、カプセル、液体カプセル、粉末、液体、ゲル、又はペーストの形態のうちのひとつに製剤化される。本発明の製造方法は、前選択された光増感剤に化学的に混合可能なものの中から所定の不活性成分を用いる。
【0034】
経口投与に適する投薬形態は、例えば限定されることなく、薬学的に許容可能なエマルション、溶液、懸濁液、シロップ、及びエリキシルを含む。上記のように、光増感剤に加えて、投薬形態は、水又は他の溶媒、可溶化剤、及び乳化剤といった本技術分野で通常用いられる不活性希釈剤を含み得る。不活性希釈剤のほかに、湿潤剤、乳化剤及び懸濁剤、結晶化抑制剤、保存料、pH緩衝剤、甘味料、香味剤及び臭気マスキング剤といった補助剤を含み得る。
【0035】
薬学的に許容可能であるとは、合理的なベネフィット/リスク比に相応した、過度の毒性、アレルギー反応、又は合併症を引き起こすことの無い、ヒト又は動物の組織における使用に適する不活性マテリアル、組成物、及び投薬形態を意味する。
【0036】
本開示において有用である薬学的に許容可能なキャリア又はデリバリーシステムは、ドラッグデリバリーシステムの本技術分野において知られている新しいシステムと同様に従来のシステムも含む。
【0037】
一般に、本発明の投薬形態は、光増感剤;及び薬学的に許容可能な賦形剤/キャリアを含み、さらに、フィラー、バインダー、崩壊剤、潤滑剤、流動促進剤、湿潤剤、緩衝剤、吸収促進剤、及び投薬形態に依存する他のものを含む。
【0038】
(錠剤の形態)
一般に、テトラピロール化合物及びその誘導体の錠剤の形態は、所定の割合の光増感剤(活性剤)、所定の割合の界面活性剤、フィラー、崩壊剤、潤滑剤、流動促進剤、バインダー、吸収促進剤、溶液遅延剤、湿潤剤、吸収剤;緩衝剤、並びに凝集を回避するように容易な崩壊及び腸領域での錠剤の溶解を保証する少ない割合の化合物を有するだろう。界面活性剤の使用は、疎水性光増感剤を安定化させ凝集を回避する一助となる。
【0039】
崩壊時間は、早急な効果及び持続放出のために修正され得る。特定のコーティングは、より高いアルカリ性のpH若しくは特定の酵素作用の結果十二指腸でのみ崩壊するように、胃酸に耐性を有する錠剤を作ることができ、又は錠剤から腸への制限された拡散をもたらすことができる。錠剤はまた、味を隠すために糖で被覆され得る。いくつかの錠剤は、中に孔を有する不浸透性膜により取り巻かれた、浸透圧的に能動的なコアによりデザインされる。これよって、薬物は、錠剤が消化管を通って動く際に、一定の速度で錠剤から溶出することができる。
【0040】
実施態様のひとつにおいて、mTHPCは、体内に入ってin vivoで酵素活性及び他の生物学的活性に耐性を示すと、代謝体を形成しない好ましい光増感剤として用いられる(Hony Cai et al,Biomedical Chromatography 13:pg.354−359(1999)、及びBiomedical Chromatography 13:pg.184−186(1999)を参照)。Martijn Triesscheijnらによる“The Pharmacokinetic behaviour of the photosensitizer m−THPC in mice and men”(Cancer Chemother Pharmacol 60:Pg.113−122(2007))において、mTHPCの薬物動態及びその薬物動態学的反応は、in vivoにおいてリポタンパク質と結合するとき関連する。試験により、リポタンパク質もコレステロール代謝も血漿中のmTHPCの薬物動態に影響を与えないことが報告された。
【0041】
本発明において、錠剤コアの例は、限定されることなく、トウモロコシでんぷん、アルファでんぷん、グリコール酸ナトリウムでんぷん、ポビドン、ジベヘン酸グリセロール、ステアリン酸マグネシウム、ラクトース一水和物、粉末セルロース、アルファトウモロコシでんぷん、コロイド状無水シリカ、微晶質セルロース、ヒドロキシプロピルセルロース、インジゴカルミンアルミニウムレーキ、クロスポビドン、シリカ、コロイド状無水/コロイド状二酸化ケイ素等を含む。
【0042】
適切なフィルムコーティングマテリアル/組成物は、限定されることなく、ヒプロメロース、グリセロールトリアセテート、タルク、二酸化チタン(E171)、酸化鉄イエロー(E172)、酸化鉄レッド(E172)、エチルセルロース、ポリビニルアルコール−一部加水分解された二酸化チタン、レシチン、キサンタンガムを含む。
【0043】
(カプセルの形態)
実施態様にひとつにおいて、カプセル、ゼラチン被覆は、光増感剤製剤を封入するために用いられる。カプセルは、吸収を遅らせるために、摂取後、数時間未変化のままでいるようにデザインされ得る。それらはまた、同じ用量で早められた及び遅くされた吸収を作り出すように、早く及び遅く放出する粒子の混合物を含む。2つの主要なタイプのカプセルは、堅い殻のカプセル(乾燥した粉末化された成分に用いられる)及び柔らかい殻のカプセル(油に、及び油に溶解又は懸濁される活性成分に用いられる)である。これらのクラスのカプセルの両方は、ゼラチンと、カラギーナン並びにスターチ及びセルロースの変形形態のような植物ベースのゲル化物質と、の両方から作られる。
【0044】
本発明において用いられるカプセルシェルのマテリアルは、限定されることなく、ヒプロメロース、エチルセルロース、ラクトース一水和物、ステアリン酸マグネシウム、ヒプロメロース、ヒドロキシプロピルメチルセルロースアセテートサクシネート、スクロース、糖球状顆粒、タルカム、二酸化チタン、トリエチルシトレート、ポビドン、シリカ、コロイド状無水/コロイド状二酸化シリコン、ポリソルベート20等を含む。
【0045】
さらに、カプセルシェルのマテリアルは、例えば、二酸化チタン、酸化鉄イエロー、酸化鉄レッド、ゼラチン、ラウリル硫酸ナトリウム、インジゴカルミン、酸化鉄イエロー、及び食用白色インクといった薬学的に許容可能な着色剤を含み得る。さらに、カプセルシェルのマテリアルは、限定されることなく、シェラック、レシチン(大豆)、シメチコン、酸化鉄レッド、及びヒドロキシプロピルセルロースを含む薬学的に許容可能な印刷用インクを含み得る。
【0046】
(液体カプセル(Liquid fill capsules)(ソフト及びハードカプセル))
さらに他の実施態様において、液体カプセルが用いられる;それらは吸収を促進することにより疎水性光増感剤のバイオアベイラビリティを向上させるからである。液体カプセル(Liquid filling)は具体的には、簡易化された製造プロセスに起因した強力な活性化合物及び細胞毒性化合物を含む製品において、並びに他の形式で低い溶解性又は乏しいバイオアベイラビリティを示す製品において、適切である。可溶化剤は、限定されることなく、ポリエチレングリコール/マクロゴール(Lutrol(登録商標)(BASF AG))を含む。
【0047】
(液体の形態−Foslipos製剤)
本発明の“Foslipos”という用語は、サッカライドを添加されておらず、凍結乾燥されない、リポソーム小胞を形成することにより疎水性光増感剤を封入する脂質製剤を意味する。脂質は、疎水性薬物を可溶化することができ、そのため、脂質ベースのドラッグデリバリーシステムは消化管における薬物吸収及び溶解速度を改善させることが証明されてきた。
【0048】
本発明において用いられるリポソーム小胞は、リン脂質からなり、好ましくは合成リン脂質は、ジパルミトイルホスファチジルコリン(DPPC)、ジミリストイルホスファチジルコリン(DMPC)、ジステアロイルホスファチジルコリン(DSPC)といったホスファチジルコリン;及びジパルミトイルグリセロール(DPPG)、ジステアロイルホスファチジルグリセロール(DSPG)、及びジミリストイルホスファチジルグリセロール(DMPG)といったホスファチジルグリセロールである。
【0049】
Fosliposは、輸送コンパートメントとしての脂質二重層に焦点をあてている。この方法において、光増感剤は膜の内側に存在し、光増感剤は効率的に作用部位に標的化される。しかし、リポソーム粒子の中の内腔部位は、治療において有利な効果を有し得る薬物を含む、他の物質を封入できるように空にしておく。凍結乾燥は、薬物について商業上の関心を引くようにする、長期の安定的な活性を有するシェルの寿命をもたらすにもかかわらず、本発明における光増感剤の液体リポソーム製剤は、従来のリポソーム製剤と異なり凍結乾燥されない。
【0050】
(PEG化されたリポソーム製剤−液体の形態)
疎水性光増感剤、典型的な2又は3以上の合成リン脂質及び少なくともひとつのPEG化リン脂質は、アルコール溶液に溶解される。溶液をその後、ロータリーエバポレーターを用いて真空下で乾燥させる。混合物をその後100ナノメートルの最終孔径を用いたホモジナイザーフィルターシステムに通過させる。再水和中、水はモノサッカライドで補われる。ろ液を収集し、バイアルに充填し、任意に凍結乾燥させる。
【0051】
PEG化されたリポソーム製剤は、合成リン脂質を用いて調製される。本発明において用いられるリン脂質は好ましくは、DPPC(ジパルミトイルホスファチジルコリン)、DPPG(ジパルミトイルホスファチジルグリセロール)、及びDSPE(PEG化ジステアロイルホスファチジルエタノールアミン)を含み、これらのすべては合成して作られる。
【0052】
本発明の他の実施態様において、経口製剤が液体の形態において製造され得、光増感剤及びLipofundinの混合物が経口ルートで投与され得る。
【0053】
(熱力学的に安定的なナノ及び自己乳化マイクロエマルションドラッグデリバリーシステム(SMEDDS))
他の実施態様において、ナノ及びマイクロエマルションの経口製剤が、光増感剤の経口投与に対して用いられる。エマルションは液体システムであり、それにおいて、ひとつめの液体がふたつめの非混和性液体中に分散している(乳化剤有り又は無し)(通常は液滴中)。SMEDDS(マイクロエマルションシステム)は、延長された品質保持期間を短くする疎水性薬物の熱力学的に安定なキャリアシステムである。マイクロエマルション製剤の本製剤は、非毒性、非刺激性、及び薬学的に許容可能な成分を用いて調製される。
【0054】
SMEDDS(自己乳化マイクロエマルションドラッグデリバリーシステム)は、油の等方性混合物、界面活性剤、共活性剤、及び消化管で遭遇されるであろう穏やかな撹拌又は消化運動のコンディション下で水性溶媒又は消化管液にさらされるときに迅速に水中油型マイクロエマルションを形成する薬物として規定される。SMEDDSの用語は、水及び有機性成分(疎水性(脂溶性)有機性成分を含む)を含む透明又は実質的に透明のコロイド性分散として従来受け入れられた意味において用いられる。SMEDDSは、1又は2以上の下記の特性を有すると見なされる。それらは、それらの成分が接触するようにされたときに自発的に又は実質的に自発的に形成され、それは実質的なエネルギー供給無し(例えば、加熱、高度なせん断装置の使用、又は他の実質的な撹拌の使用無し)で行われる。それらは、熱力学的な安定性を示す。それらは、単層である。それらは実質的に透明である(すなわち、それらは光学顕微鏡の手段で観察すると透明又は乳白色である)。それらはそのままの状態では光学的に等方である。SMEDDSは分散相又は微粒子(液滴)相を含み、その粒子サイズは200nm未満であり、それゆえそれらは光学的等方性を示す。
【0055】
製薬及び化粧品産業界は、ハードゼラチンカプセル、錠剤、及びプラスターの形態でのパッケージングを促進するために、水相を含まない組成物に対するさらに増大する要求を表明している。ハードゼラチンカプセルの製造に対して現在知られている組成物(具体的には上述の文献に記載されているもの)は、ニーズに合致することができない。これらの混合物に含まれる水の存在は、ハードゼラチンカプセルを用いる技術に相容れない。
【0056】
本発明はこの問題を解決した。それは、具体的には薬学的又は化粧品での使用のための、経口投与可能な組成物に関し、それは、脂溶性の相、少なくともひとつの界面活性剤及び少なくともひとつの共活性剤を含む。それは、混合され及び生理液の存在において、そのままで溶解を促進し有効成分のバイオアベイラビリティを向上させるマイクロエマルションを形成する。
【0057】
(一般的な製剤の調製)
マイクロエマルションを形成することのできるこの経口投与可能な組成物は、少なくとも、
有効成分、
脂肪酸エステル及びグリセリドの混合物からなる脂溶性の相、
界面活性剤(SA)、
共活性剤(CoSA)、
溶媒、
親水性相、
を含み、該脂溶性の相は、16未満の親水性−脂溶性バランス(HLB)を有する炭素数8〜18のポリグリコライズドグリセリドの混合物からなり、この脂溶性の相は、組成物の全重量中1〜75%含まれ;界面活性剤(SA)は、炭素数8〜10の飽和ポリグリコライズドグリセリド及びポリグリセロールのオレイン酸エステルを含む群より選択され、この界面活性剤もまた16未満のHLBを有し;共活性剤(CoSA)は、プロピレングリコールのラウリン酸エステル、ポリグリセロールのオレイン酸エステル、及びエチルジグリコールを含む群より選択され;SA/CoSA比は、0.3〜8の間であり;最終のマイクロエマルションの親水性相は、消化環境の生理液による摂取後に供給される。
【0058】
本発明のひとつの他の実施態様において、自己マイクロ乳化ドラッグデリバリーシステム(SMEDDS)製剤としてのマイクロエマルションは、活性剤、好ましくはテモポルフィン(mTHPC)としての可変量の光増感剤を含み得る。一方、用いられる添加剤は、以下の例に限定されることなく、マクロゴールグリセロールヒドロキシステアレート40、ポリエトキシル化ひまし油、Cremophor(登録商標)EL(BASF社により販売)、ポリエチレングリコール300、ポリエチレングリコール400、d−アルファ−トコフェリル−ポリエチレングリコール−1000−スクシネート:TPGS(登録商標)(Estman社により販売)、カプリロカプロイルマクロゴールグリセリド(ポリオキシグリセリド):Labrasol(登録商標)、プロピレングリコールモノカプリレート/プロピレングリコールカプリレート:Capryol(登録商標)90、ジエチレングリコールモノエチルエーテル:Transcutol、オレオイルマクロゴールグリセリド(ポリオキシグリセリド)/リノレオイルマクロゴールグリセリド(ポリオキシグリセリド):Labrafil(登録商標)、ラウロイルマクロゴールグリセリド(ポリオキシグリセリド)/ステアロイルマクロゴールグリセリド(ポリオキシグリセリド):Gelucire(登録商標)、グリセリルモノ−リノレート:Maisine(登録商標)、プロピレングリコールジカプリロカプレート/中鎖トリグリセリド:Labrafac(登録商標)、プロピレングリコールモノラウレート/プロピレングリコールラウレート:Lauroglycol(登録商標)、グリセリルモノ−オレート:Peceol(登録商標)、ポリグリセリルオレート:Plurol Oleicque(登録商標)(すべてGattefosse SAS社(サン=プリースト、フランス)により販売);モノ−、ジグリセリド:Capmul(登録商標)MCM、プロピレングリコール中の混合されたカプリル酸/カプリン酸のジエステル:Captex(登録商標)200、カプリル酸/カプリン酸のトリグリセリド:Captex(登録商標)355、ポリグリセロールオレート:Caprol(登録商標)MPGO、デカグリセロール中のオレイン酸エステル:Caprol(登録商標)PGE−860、エトキシ化ココナッツグリセロールエステル:Acconon(登録商標)CO−7、エトキシ化カプリル酸/カプリン酸グリセロールエステル:Acconon(登録商標)CC−6(すべてABITEC社により販売)、並びに他の再結晶化阻害剤、バイオアベイラビリティ促進剤、界面活性剤、乳化剤、エタノール及び水(いくつかの異なるレジメンで混合される)を含む。これらの製剤は最終的には、ソフトゼラチンカプセルに充填されて投与される。十二指腸及び小腸において、腸液との接触後のSMEDDS製剤は、体内における後の吸収のために粘膜に容易に吸収されるのに適する約200nmのサイズの単相ミセルを形成するだろう。
【0059】
(ナノサスペンション)
不溶性薬物を高度に可溶化させる前述の方法の代替手段は、粒子サイズを小さくすることであり、それにより表面積が増大し、その結果溶解率が増大する。しかしながら、マイクロ化のみでは、これらの種類の薬物の所望のバイオアベイラビリティを得るには十分ではない。粒子サイズがサブマイクロメーターのサイズ範囲となれば、ナノ化は薬物のより高いバイオアベイラビリティを提供することが示されてきた(Mullerら、1998、2001)。薬物溶解率及び化合物の飽和溶解度が増大するからである。文献において薬物粒子サイズをナノメーター範囲に小さくする異なる方法が記載されており、例えば、沈殿(Trottaら、2001)、ジェットミル、パールミル(Liversidge及びConzentino、1995)、及び高圧ホモジネーション(Muller&Keck、2004)である。
【0060】
水性懸濁液を乾燥粉末に変えるために、凍結乾燥及び噴霧乾燥手段を用いることができる。噴霧乾燥はたいていプロセスにおいて高温を必要とし、それは熱に不安定な薬物には適切ではない。このようなケースにおいて、凍結乾燥が最も適切な手段である。凍結乾燥のプロセスにおいて、マンニトール、トレハロース、又はスクロースといった低温保護剤を溶液に加え、システムの再構築後の粒子凝集を回避する。
【0061】
(O/Wエマルション製剤)
本発明の他の実施態様において、経口投与される製剤の成分は、油及び脂肪化合物とmTHPCとの混合物である。異なる濃度の大豆油、中鎖トリグリセリド、グリセロール、卵レシチン、α−トコフェロール、オレイン酸ナトリウム、及び水を含むこのようなエマルションは、栄養輸液におけるカロリー源として臨床的に用いられる。
【0062】
(加熱溶融押出法製剤)
本発明の他の実施態様において、経口投与される製剤の成分は、適切な添加剤にブレンドされた生体適合性ポリマーとmTHPCとの混合物である。これらの混合物は、均一に溶融され、シングル又はツインスクリュー押出機により押し出され、APIの固体分散体を形成するだろう。これらの固体分散体は、湿潤性及びバイオアベイラビリティのより高いグレードに起因するAPIのより高い溶解率を示し、その結果、消化管における薬物放出を向上させる。適切なポリマーは、“塩基性ブチル化メタクリレートコポリマー(aPMMA)”、コポビドン(COP)、ポリエチレングリコール−ポリビニルアルコールコポリマー(PEG−PVA)、オイドラギット−改良剤及び他のポリマー、並びに本発明の技術分野における当業者に公知の添加剤の群から非排他的に選択され得る。
【0063】
(ナノ結晶製剤)
本発明の他の実施態様において、活性薬物化合物は、ナノ結晶製剤において経口投与され得る。極めて細かく粉砕された薬物(例えば、テモポルフィン)は、大きな表面積を有するように、界面活性剤により安定化され、最終的には噴霧乾燥され得、それにより消化管における安定的に吸収が促進される。
【0064】
(粉末化製剤−リポソームでカプセル化された光増感剤)
本発明の一実施態様において、光増感剤は経口投与のためのリポソームにカプセル化される。リポソーム小胞は、経口投与される疎水性光増感剤の溶解性を向上させ得る。
【0065】
リポソームは、下記の一般的な過程に従って調製された。
【0066】
疎水性光増感剤及び典型的には2又は3以上の合成リン脂質をアルコール溶液に溶解させる。溶液をその後ロータリーエバポレーターを用いて真空下で乾燥させる。混合物をその後100ナノメートルの最終孔サイズを用いるホモジナイザーフィルターシステムに通す。補水液をモノサッカライドで補う。ろ液を収集し、バイアルに充填し、任意に凍結乾燥させる。
【0067】
ホスファチジルコリンといった合成リン脂質は、ジパルミトイルホスファチジルコリン(DPPC)、ジミリストイルホスファチジルコリン(DMPC)、ジステアロイルホスファチジルコリン(DSPC)といった1又は2以上の合成コリンであり得る。示唆されるグリセロールは、ジパルミトイルホスファチジルグリセロール(DPPG)及びジミリストイルホスファチジルグリセロール(DMPG)を含む。必要とされる比率においてここで用いられる所定のリン脂質は、リポソーム製剤を安定化させ、及びそれを消化管分解作用から保護し得る。
【0068】
このように光増感剤を封入する製剤化されたリポソームは、乾燥粉末の形態であり、それは錠剤に変換され得、経口投与のためのハードカプセルに封入され得る。
【0069】
(ドラッグキャリアシステムとしてのナノ粒子)
経口製剤はまた、光増感剤が吸収され、光増感剤が含まれ、又は光増感剤が共有結合しているナノ粒子を含む。好ましい製剤において、ナノ粒子は、本技術分野において知られたような、ヒト血清アルブミン(HSA)又はポリ(ラクチド−co−グリコライド)(PLGA)といった生分解性マテリアルから形成される。
【0070】
(キャリアシステムとしてのアルファフェトプロテイン(AFP))
アルファフェトプロテイン(AFP)は、光増感剤を腫瘍細胞に標的化するように、この製剤におけるoncoshuttleとして用いられる。AFPは、ほとんどの癌がAFP受容体(AFPR)を発現しそれゆえ特異的な標的であるため、oncoshuttleとして用いられる。AFPは、約600のアミノ酸を含有するポリペプチド鎖及び大きな異種の炭水化物分子からなる大きな糖タンパク質である。AFP分子は、15のジスルフィド結合を含む。ジスルフィド結合が三次構造を決定する一方で、炭水化物は分子に特定の結合特性をもたらす。
【0071】
製剤の調製は、3つの部分に分けられ得る。
1)AFPタンパク質の除荷(unloading)
2)薬物物質のタンパク質への結合
3)タンパク質−薬物−複合体の分離及び保存
【0072】
タンパク質が結合リン脂質物質(例えば脂肪酸)によりのみ得られる場合、これらの物質は薬物分子の後の結合を許容するようにタンパク質から遊離される必要がある。
【0073】
(工程1)除荷(unloading)は、有機溶媒により行われ得、それはタンパク質の構造を壊さないが、リン脂質物質を分解するだろう。したがって、第一級及び第二級アルコール又はポリアルコールの水溶液が用いられ得る。除荷(unloading)後、AFPは限外ろ過により精製される必要がある。
【0074】
(工程2)負荷(loading)工程は、薬物物質を溶解させることができインキュベーション時間後に除去される必要のある溶媒を要する。除去は、凍結乾燥又はエバポレーションにより行われる。
【0075】
(工程3)非結合薬物物質は、限外ろ過により除去される必要があり、溶液は安定化される必要がある。
【0076】
(キャリアシステムとしてのウシ血清アルブミン(BSA))
ウシ血清アルブミン(BSA)といった天然のタンパク質は、経口投与のための光増感剤をカプセル化するために本発明において用いられる。AFPのアミノ酸配列は、ウシ血清アルブミンに著しく高い相同性を有する。アルブミン様タンパク質の特性は、2つのアルファヘリカルグロビン様サブドメインにより形成された構造的に相同する3つのドメインの存在である。したがって、BSAはまた、PDTにおいて効果的なキャリアとして用いられ得る。BSAは17のジスルフィド結合を有する大きな球状タンパク質である。BSA製剤の調製過程は、以下の通りである。
【0077】
製剤の調製は、3つの部分に分けられ得る。
1)BSAタンパク質の除荷(unloading)
2)薬物物質のタンパク質への結合
3)タンパク質−薬物−複合体の分離及び保存
【0078】
タンパク質が結合リン脂質物質(例えば脂肪酸及び他の脂質)によりのみ得られる場合、これらの物質は薬物分子の後の結合を許容するようにタンパク質から遊離される必要がある。
【0079】
(工程1)除荷(unloading)は、有機溶媒により行われ得、それはタンパク質の構造を壊さないが、リン脂質物質を分解するだろう。したがって、第一級及び第二級アルコール又はポリアルコールの水溶液が用いられ得る。除荷(unloading)後、BSAは限外ろ過により精製される必要がある。
【0080】
(工程2)負荷(loading)工程は、薬物物質を溶解させることができインキュベーション時間後に除去される必要のある溶媒を要する。除去は、凍結乾燥又はエバポレーションにより行われる。
【0081】
(工程3)非結合薬物物質は、限外ろ過により除去される必要があり、溶液は安定化される必要がある。
【0082】
本製造方法は上述のキャリアシステム及び製剤に限定されないが、それは、ミクロスフェア、ポリマー、ミセル、ハイドロゾル、アパソーム(apasomes)、ニオソーム、及びiPills等の新しい技術デバイスのような経口製剤に適する他のキャリアとともに用いられ得る。
【0083】
開示される経口製剤の光増感剤は、異なるタイプの、頭部及び頸部腫瘍、前立腺腫瘍、皮膚癌及び他の癌(それはさらに増殖性及び非増殖性疾患を含む)といった腫瘍性コンディション、並びにBPH、異形成、バレット食道、加齢黄斑変性、血管疾患、炎症性疾患、及び細菌及びウイルス感染といった他の疾患のコンディションを治療するために経口投与される。それはさらに、皮膚再生、にきび治療、恐怖(scare)及びしわの除去、毛髪除去、肥満低減及びセルライト治療といったPDTの化粧品適用のために用いられ得る。それはまた、ウイルス、細菌、菌類、寄生原生動物、及びプリオンといった微生物感染の治療のための抗菌光線力学療法において用いられる。さらに、PDTの適用は、歯科領域の問題及びその他を含む。本発明の製剤は、上述の例のみに限定されないが、光線力学療法(PDT)を用いて治療され得る他のヒト及び動物の疾患に拡張され得る。
【0084】
一般に、本発明の光増感剤の経口製剤を用いるPDT治療方法は、経口ルートによる光増感剤の単回投与、その後の照射を含む。さらなる実施態様はまた、光増感剤の複数回の経口投与の使用、その後の単回の照射レジメン又は複数回の光照射レジメンを含む。複数回の経口投与は、疾患のコンディション及び部位に依存して、毎日、毎週、又は必要に応じて行われ得る。組織内の最適投与量は、照射前の蛍光測定により保証され得る。このような最適化された治療レジメンは、光の感受性を最小化し、同時に壊死を制限し標的組織の順次の殺傷を引き起こす間薬物の有用性を最大化する。このような最適化された複数治療レジメンはまた、体内の免疫活動を誘導する一助となり、長期間標的化された細胞に対して免疫反応を引き起こす。疾患のコンディションに依存して、上述の治療レジメンは短い間隔の後必要に応じて繰り返されてもよい。
【0085】
さらにそれは、低用量で経口投与することにより診断目的で用いられ得る。本明細書において“低”という用語は、一般的に投与される効果的な治療上の用量よりも通常低い、効果的な用量を意味する。“診断”という用語は、活性剤又は疾患があること若しくは無いことを試験するのに有用であるマテリアル、及び/又は組織イメージングを亢進させる剤を意味する。本明細書において“効果的な”という用語は、所望の効果を作り出すのに有用である診断剤又は治療剤の経口投与(量)を意味する。
【0086】
他の可能性のある実施態様において、本発明の経口投与のためのテトラピロール誘導体製剤は、光/照射の適用無しに、非PDT治療剤として、又は抗癌化学療法剤として用いられる。光エネルギー無しでの薬物の作用は、光無しでの毒性に関連する。ここでの薬物は、直接的に細胞に作用する細胞毒性剤として機能する。本発明のテトラピロール経口製剤は、単回又は好ましくは複数回患者に投与される。ここで、細胞毒性作用は、使用している薬物濃度に直接的に依存し、それゆえ、医師により注意深く管理される必要がある。この適用は、癌細胞、細菌、菌類、寄生生物、及び感染性プリオンの不活性化に有用であるだろう。
【0087】
(光無しでの毒性の決定)
HIG82、HT29、及びJ774A1のような異なる細胞株における2,3−ジヒドロ−2,3−ジヒドロキシ−15,20−ジヘキシル−5,10−ビス(4−カルボキシフェニル)ポルフィリン(BLC6066)の光無しでの毒性作用(図3参照)は、約24時間、2〜10μMの範囲のBLC6066の異なる漸増濃度で培養細胞をインキュベートすることにより決定された。10μMの濃度のBLC6066でインキュベートされた細胞は、ヒト細胞において明確な毒性を示し、さらに細菌の細胞に対しても光無しでの強い毒性を示した。
【0088】
本発明は、下記の実施例によりさらに記述されるが、それにより限定されるものではない。
【実施例】
【0089】
(FOSLIPOS−リポソームベースの、経口投与のための疎水性光増感剤の経口製剤)
Foslipos(DPPC及びDPPGを含有する、mTHPCの脂質ベースの製剤)
薬物用量:300μg mTHPC
試験は、成体雌無胸腺NMRI nu/nuマウス(Harlan Winkelmann GmbH、ドイツ)を用いて行った。22−24gの体重の6−8週齢のマウスの左後部大腿部にHT29ヒト結腸直腸癌細胞の懸濁液(5%グルコース中8×107細胞/mLの0.1mL)を皮下注射して移植した。実験は10日後に行われ、そのとき、腫瘍は約5−8mmの表面直径及び高さ2−3mmの厚さに到達していた。
【0090】
Foslipos(300μg mTHPCの薬物用量)を強制経口投与した。投与直後に皮膚の蛍光をファイバースペクトロメーター(Jeti GmbH Jena)により測定した。励起波長は415nmであり、発光波長は652nmであった。皮膚の蛍光を、投与後異なる時間ポイント(0時間,1時間,2時間,4時間,6時間,8時間,25時間,31時間及び49時間)で計測した。Foslipos投与後24時間から高い蛍光値が測定され得た(図2参照)。
【0091】
(HPLC分析)
動物をFoslipos経口投与後50時間で屠殺した(各時間ポイントで3匹のマウス)。動物の屠殺直後に、血漿、肝臓、脾臓、結腸、腫瘍、皮膚、及び骨格筋を解剖し、重量を測定し、−70℃で保存した。すべての組織サンプルは、外科用メスでカットすることにより小片に分け、重量を測定し、凍結乾燥させた(Christ Freeze drying system Alpha 1−4 LSC)。残りの粉末化された組織の重量を測定し、約10−20mgを2.0mLの反応チューブに移し、1.5mLのメタノール:ジメチルスルフォキシド(DMSO)(3:5、v:v)を加えた。サンプルを2,400rpmで作動するボルテックスミキサー(MELB1719、Merck Europub)を用いて5秒間混合し、その後、少なくとも12時間持続的な振盪下60℃でインキュベートした。すべてのサンプルを5分間、16,000gで遠心分離した(Microfuge、Heraeus、ドイツ)。各々の上清の1mLをHPLC分析用のHPLCバイアルに移した。
【0092】
サンプルのHPLC分析により、他の組織の測定値と比べると、腫瘍細胞においてFosliposがより高度に集積したことが示された。
【0093】
添付の図面を参照して本発明の好ましい実施態様が記述されてきたが、本発明は特定の実施態様に限定されず、本技術分野における当業者により種々の変形及び修正が添付の特許請求の範囲に規定される通りの本発明の範囲及び精神から逸脱することなく達成され得ることが理解されるべきである。
【0094】
(関連する出願)
本出願は、米国仮特許出願61/173,487(出願日2009年4月28日)、及び米国特許出願12/768,244(出願日2010年4月27日)に基づく35USC§119(e)に基づく優先権主張の利益を有する。これら両方の出願の発明の名称は“テトラピロール誘導体に対する新規の経口製剤”であり、発明者は、スザンナグラフェらである。これらの出願は、本明細書に参照により取り込まれる。
【特許請求の範囲】
【請求項1】
疎水性光増感剤のための経口製剤。
【請求項2】
酸又は酵素を含む胃消化マテリアルにより顕著に分解されず、肝臓又は腎臓に集積しない、光増感剤と、
必要に応じた不活性成分と、
を含有する光線薬物の経口製剤であって、
前記経口製剤は、過形成性疾患治療及び抗菌治療において有用である、
ことを特徴とする経口製剤。
【請求項3】
前記光増感剤は、アントラキノン誘導体又は脂肪族アミン以外の構造を有し得る、
ことを特徴とする請求項1又は2に記載の経口製剤。
【請求項4】
前記光増感剤は、テトラピロール及びその誘導体又はフェナジン色素及びその誘導体である、
ことを特徴とする請求項1又は2に記載の経口製剤。
【請求項5】
消化管において代謝されない生分解性ナノ粒子若しくはナノ粒子に、それ自体、吸収され、含まれ、又は共有結合された光増感剤、及び適切な添加剤をさらに含む、請求項1又は2に記載の経口製剤。
【請求項6】
光増感剤、及び自己マイクロ乳化ドラッグデリバリーシステム(SMEDDS)を形成する適切なガレヌス製剤添加剤をさらに含む、請求項1又は2に記載の経口製剤。
【請求項7】
光増感剤、及び適切な薬学上許容可能な界面活性剤を含み、
光増感剤及び添加剤は、安定的なナノ結晶を形成するように本技術分野の当業者により周知の方法で調製される、
ことを特徴とする請求項1又は2に記載の経口製剤。
【請求項8】
光増感剤を経口投与し、標的組織における集積時間を許容し、その後に標的組織における前記光増感剤を活性化するように適切なエネルギーを適用することにより、腫瘍、異形成又は他の医学的若しくは美容上のコンディションを治療する方法。
【請求項9】
同時に壊死を制限する間、光感受性を最小化し薬物の有用性を最大化し、及び免疫システムサポートといった有益な身体サポート反応を最大化する間、腫瘍異形成又は他の望ましくない組織さらには脂肪といった標的組織の順次の殺傷を引き起こす、最適化された治療レジメンよる治療方法。
【請求項10】
好ましくは全身的に少ない用量を適用し、適切な間隔で活性化し、前記活性化の後に、標的組織に身体の他部分から再供給される薬物由来の利益を得るべきである1又は2以上の活性化が起こり、適切な時間(例えば1週間)の後、前述の順番が繰り返され、このサイクルが複数回繰り返される治療方法。
【請求項11】
前記経口製剤は、Foscanといった長時間安定型光増感剤又は抗菌光増感剤を含む、
ことを特徴とする請求項8乃至10のいずれか1項に記載の方法。
【請求項1】
疎水性光増感剤のための経口製剤。
【請求項2】
酸又は酵素を含む胃消化マテリアルにより顕著に分解されず、肝臓又は腎臓に集積しない、光増感剤と、
必要に応じた不活性成分と、
を含有する光線薬物の経口製剤であって、
前記経口製剤は、過形成性疾患治療及び抗菌治療において有用である、
ことを特徴とする経口製剤。
【請求項3】
前記光増感剤は、アントラキノン誘導体又は脂肪族アミン以外の構造を有し得る、
ことを特徴とする請求項1又は2に記載の経口製剤。
【請求項4】
前記光増感剤は、テトラピロール及びその誘導体又はフェナジン色素及びその誘導体である、
ことを特徴とする請求項1又は2に記載の経口製剤。
【請求項5】
消化管において代謝されない生分解性ナノ粒子若しくはナノ粒子に、それ自体、吸収され、含まれ、又は共有結合された光増感剤、及び適切な添加剤をさらに含む、請求項1又は2に記載の経口製剤。
【請求項6】
光増感剤、及び自己マイクロ乳化ドラッグデリバリーシステム(SMEDDS)を形成する適切なガレヌス製剤添加剤をさらに含む、請求項1又は2に記載の経口製剤。
【請求項7】
光増感剤、及び適切な薬学上許容可能な界面活性剤を含み、
光増感剤及び添加剤は、安定的なナノ結晶を形成するように本技術分野の当業者により周知の方法で調製される、
ことを特徴とする請求項1又は2に記載の経口製剤。
【請求項8】
光増感剤を経口投与し、標的組織における集積時間を許容し、その後に標的組織における前記光増感剤を活性化するように適切なエネルギーを適用することにより、腫瘍、異形成又は他の医学的若しくは美容上のコンディションを治療する方法。
【請求項9】
同時に壊死を制限する間、光感受性を最小化し薬物の有用性を最大化し、及び免疫システムサポートといった有益な身体サポート反応を最大化する間、腫瘍異形成又は他の望ましくない組織さらには脂肪といった標的組織の順次の殺傷を引き起こす、最適化された治療レジメンよる治療方法。
【請求項10】
好ましくは全身的に少ない用量を適用し、適切な間隔で活性化し、前記活性化の後に、標的組織に身体の他部分から再供給される薬物由来の利益を得るべきである1又は2以上の活性化が起こり、適切な時間(例えば1週間)の後、前述の順番が繰り返され、このサイクルが複数回繰り返される治療方法。
【請求項11】
前記経口製剤は、Foscanといった長時間安定型光増感剤又は抗菌光増感剤を含む、
ことを特徴とする請求項8乃至10のいずれか1項に記載の方法。
【図1】


【図3】


【図2】




【図3】


【図2】


【公表番号】特表2012−525409(P2012−525409A)
【公表日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願番号】特願2012−508644(P2012−508644)
【出願日】平成22年4月28日(2010.4.28)
【国際出願番号】PCT/US2010/032766
【国際公開番号】WO2010/129337
【国際公開日】平成22年11月11日(2010.11.11)
【出願人】(505283315)セラムオプテック ゲーエムベーハー (2)
【出願人】(511261167)バイオリテック リサーチ ゲーエムベーハー (1)
【Fターム(参考)】
【公表日】平成24年10月22日(2012.10.22)
【国際特許分類】
【出願日】平成22年4月28日(2010.4.28)
【国際出願番号】PCT/US2010/032766
【国際公開番号】WO2010/129337
【国際公開日】平成22年11月11日(2010.11.11)
【出願人】(505283315)セラムオプテック ゲーエムベーハー (2)
【出願人】(511261167)バイオリテック リサーチ ゲーエムベーハー (1)
【Fターム(参考)】
[ Back to top ]

