分析物の酵素触媒酸化により放出される過酸化水素の検出
試験試料中の分析物を酵素触媒酸化により過酸化水素を検出するための診断試験キットが提供される。この試験キットは、クロマトグラフ媒体を含む横流装置を含み、このクロマトグラフ媒体は、色原体が陰イオン性化合物とともに実質的に非拡散的に不動化される検出ゾーンを定める。この色原体は、酸化されると検出可能な色の変化を生じることができるロイコ塩基又はその誘導体である。
【発明の詳細な説明】
【背景技術】
【0001】
過酸化水素は、グルコース、コレステロール、尿酸、トリグリセリド、クレアチニンキナーゼ、クレアチニン等のような種々の化学的又は生物学的物質(分析物)の酵素触媒反応で生成される。所定の試験試料内の分析物の含量は、生成される過酸化水素の量から求めることができる。例えば、糖尿病は、尿中におけるグルコースの存在を検出することにより診断されることが多い。例を挙げると、グルコースが好気的酸化によりグルコン酸及び過酸化水素になるのを触媒するグルコース酸化酵素に尿試験試料を接触させることができる。典型的には、過酸化水素が存在すると色が変化する指標(例えば、ロイコ染料)を用いる。生じる色の変化は、存在するH2O2の量のほか、試験する流体の分析物含有量を示す。しかし、不都合なことには、このような試験を行う機構の多くは、過度に複雑で高価であり、負担が大きい。
従って、現在、分析物を酵素触媒酸化することにより発生する過酸化水素を検出するための改良方法が必要とされている。
【先行技術文献】
【特許文献】
【0002】
【特許文献1】米国特許第4,089,747号公報
【特許文献2】米国特許出願公開第2002/0119136号公報
【特許文献3】米国特許第5,075,077号公報
【特許文献4】米国特許第5,670,381号公報
【特許文献5】米国特許第5,252,459号公報
【特許文献6】米国特許出願公開番号第2003/0124739号公報
【特許文献7】米国特許出願公開番号第2003/0119202号公報
【非特許文献】
【0003】
【非特許文献1】F.Costによる「デジタル印刷のポケットガイド」、ニューヨーク州アルバニーのDelmar Publishers、ISBN 0−8273−7592−1の144及び145頁
【発明の概要】
【課題を解決するための手段】
【0004】
本発明の実施形態の1つによれば、分析物を酵素触媒酸化することにより放出される過酸化水素を検出するための診断試験キットが開示される。試験キットは、クロマトグラフ媒体を含む横流装置を含む。クロマトグラフ媒体は、陰イオン性化合物とともに色原体が実質的に非拡散的に不動化される検出ゾーンを定める。色原体は、酸化されると検出可能な色の変化を生じることができるロイコ塩基又はその誘導体である。
【0005】
本発明の別の実施形態によれば、分析物が酵素触媒酸化されることにより放出される過酸化水素を検出するための方法が開示される。方法は、陰イオン性化合物とともに被酸化性色原体が実質的に非拡散的に不動化される検出ゾーンを定めるクロマトグラフ媒体を含む横流装置を用意する段階を含む。被酸化性色原体は、ロイコ塩基又はその誘導体である。過酸化水素は、電子供与体と反応して中間化合物を形成する。中間化合物は、クロマトグラフ媒体を通って流れて検出ゾーンに接触することができ、それによって、中間化合物が色原体を酸化する。酸化した色原体の色は、酸化可能な色原体の色とは異なる。酸化した色原体の色を検出する。
【0006】
本発明の他の特徴及び側面は、以下で更に詳細に論じる。
本発明の完全で実施可能要件を満たす開示事項は、その最良の態様を含めて、当業者に向けたものであるが、これは、添付の図を参照して本明細書の残り部分において詳細に述べる。
本明細書及び図面に参照記号を繰り返して用いる場合には、本発明の同じ又は類似する特徴又は要素を表すことを意図する。
【図面の簡単な説明】
【0007】
【図1】本発明に用いることができる横流装置の実施形態の1つの斜視図である。
【発明を実施するための形態】
【0008】
定義
本明細書で用いる場合、「試験試料」という用語は、一般に、分析物を含むことが疑われるあらゆる材料をいう。試験試料は、血液、間質液、唾液、眼内レンズ液、脳脊髄液、汗、尿、乳汁、腹水、粘液、鼻汁、痰、滑液、腹膜液、膣液、月経、羊水、精液等を含む生理的流体のようなあらゆる生物学的供給源由来のものとすることができる。生理的流体のほか、環境又は食品アッセイを行うために水、食品等のような他の液体試料を用いることもできる。また、試験試料として分析物を含むことが疑われる固体材料を用いることもできる。試験試料は、生物学的供給源から得たまま直接用いることもでき、試料の特性を修正するために予備処理を行った後に用いることもできる。例えば、このような予備処理には、血液から血漿を調製すること、粘稠な流体を希釈すること等を含むことができる。また、予備処理の方法には、濾過、沈殿、希釈、蒸留、混合、濃縮、干渉成分の不活化、試薬付加、溶解等を含むこともできる。更に、固体試験試料を改質して液体媒体を形成するか、分析物を放出させることが有利になる場合がある。
【0009】
詳細な説明
本発明の種々の実施形態を以下に詳細に説明し、その1つ又はそれ以上の例を以下に記載することにする。各例は、本発明の説明のために挙げたものであり、本発明を限定するものではない。実際に、本発明には、本発明の範囲又は精神から逸脱することなく種々の変更形態及び変形形態を作ることができることは当業者には明らかであると考える。例えば、実施形態の1つの一部として図示又は記載した特徴を別の実施形態に用いて、更に別の実施形態を生成することができる。従って、本発明は、添付の請求項及びその均等物の範囲に含まれるものとしてこのような変更形態及び変形形態を含むことを意図するものである。
【0010】
一般に、本発明は、グルコース、ガラクトース、モノアミン、Lアミノ酸、アルコール、キサンチン、コレステロール、ラクテート、尿酸、トリグリセリド、クレアチニンキナーゼ、クレアチニン、又はサルコシンのような分析物を酵素触媒酸化することにより放出される過酸化水素の存在を検出するように構成された診断試験キットに関する。酸化反応を触媒するのに種々の酵素の何れを用いることもでき、これには、例えば、ガラクトース酸化酵素、グルコース酸化酵素、コレステロール酸化酵素、アミン酸化酵素、種々のアミノ酸酸化酵素、ポリフェノール酸化酵素、キサンチン酸化酵素、及びウリカーゼ等のような酸化酵素や、アルコール脱水素酵素、乳酸脱水素酵素、リンゴ酸脱水素酵素、グリセルアルデヒド−3−リン酸脱水素酵素、グリセロール脱水素酵素、及びグルコース−6−リン酸脱水素酵素等のような脱水素酵素、並びに、リポタンパク質リパーゼ及びホスホリパーゼ等のようなリパーゼや、コレステロールエステラーゼ及びコリンエステラーゼ等のようなエステラーゼが含まれる。例えば、グルコースは、グルコース酸化酵素を存在させて酸化し、グルコン酸及び過酸化水素を生じることができる。酵素は、単独で用いることもでき、生物学的分子又は特定の結合対の一員に対する接合体として用いることもできる。
【0011】
酵素触媒反応が起こる様式とは関係なく、過酸化水素は、分析物が酸化されることにより放出される。放出される過酸化水素の量は、一般に、試験試料中の分析物の量にほぼ比例する。従って、分析物の存在及び濃度は、放出過酸化水素を直接又は間接的に求めることにより求めることができる。更に詳細には、本発明の診断キットは、過酸化水素又は別の酸化剤が存在すると検出可能に色変化することができる色原体を用いる。理論に縛られることは望まないが、色原体の酸化により、吸収極大が、スペクトルの赤色端に向かって変位するか(「深色変位」)、スペクトルの青色端に向かって変位するか(「浅色変位」)の何れかが引き起こされると考えられる。吸収変位により、視覚的又は器具を通して検出可能な色の違いを生じ、試験試料内に過酸化水素が存在することを示す。例えば、試験試料と接触する前には、色原体は、無色とすることもでき、特定の色を有することもできる。しかし、試験試料と接触して分析物が酵素触媒酸化されることにより放出される過酸化水素と反応した後には、色原体は、最初の色と異なる色を示す。このように、色の変化は、試験試料中の分析物(例えば、コレステロール、グルコース等)の存在と容易に相関させることができる。
【0012】
本発明の色原体は、酸化されると検出可能な色の変化を示すことができるロイコ塩基又はその誘導体である。例えば、本発明に用いるのには、アリルメタンロイコ塩基(例えば、ジアリルメタン及びトリアリルメタン)が特に適切な酸化可能色原体である。例えば、トリアリルメタンロイコ塩基は、次の一般構造を有する。
【化1】

式中、R、R’、及びR”は、フェニル、ナフチル、アントラセニル等のような置換及び非置換アリール基から独立に選択される。アリール基は、アミノ、ヒドロキシル、カルボニル、カルボキシル、スルホン酸、アルキル、及び/又は他の公知の官能基のような官能基で置換することができる。このようなトリアリルメタンロイコ塩基の例には、ロイコマラカイトグリーン、パラロザリニンベース、クリスタルバイオレットラクトン、クリスタルバイオレットロイコ、クリスタルバイオレット、CIベーシックバイオレット1、CIベーシックバイオレット2、CIベーシックブルー、CIビクトリアブルー、N−ベンゾイルロイコメチレン等が含まれる。同様に、適切なジアリルメタンロイコ塩基には、4,4’−ビス(ジメチルアミノ)ベンズヒドロール(「ミヒラーヒドロール」としても知られる)、ミヒラーヒドロールロイコベンゾトリアゾール、ミヒラーヒドロールロイコモルホリン、ミヒラーヒドロールロイコベンゼンスルホンアミド等を含むことができる。アリルメタンロイコ塩基に加えて、過酸化水素又は他の酸化剤が存在するときに検出可能な色変化を示すことができる他の色原体は、Bruschiに付与された米国特許第4,089,747号に記載されており、これは、本明細書において引用によりそのまま組み入れられる。
【0013】
特定の実施形態の1つでは、色原体は、ロイコマラカイトグリーン(又はその類似物)であり、これは、一般に無色で、次の構造を有する。
【化2】

【0014】
過酸化水素で酸化されると、ロイコマラカイトグリーンは、マラカイトグリーンカルビノール(溶媒グリーン1)を形成し、これは、次の構造を有する。
【化3】

【0015】
また、ロイコマラカイトグリーンのカルビノール型も無色である。しかし、酸性条件では、ロイコマラカイトグリーンカルビノール型の1つ又はそれ以上の遊離アミノ基がプロトン化されてマラカイトグリーン(アニリングリーン、ベーシックグリーン4、ダイアモンドグリーンB、又はビクトリアグリーンBとしても知られる)を形成することができ、それは、色が緑色で次の構造を有する。
【化4】

【0016】
分析物が酵素触媒酸化されることにより放出される過酸化水素は、上に記載するように、色原体の色変化を直接誘発することができる。しかし、過酸化水素は、特定の色原体に対して比較的低酸化電位を有するため、過酸化物が低濃度(例えば、試験試料の5重量%未満)で放出されるときには、色変化を(例えば可視的に)検出することが困難であることがある。この点に関して、任意的に電子供与体を用い、過酸化水素と反応して色原体に対して過酸化水素より高酸化電位を有する中間化合物を生成することができる。この目的には、種々の公知の電子供与体を用いることができる。実施形態の1つでは、例えば、水溶液中の過剰量のヨウ化物イオン(I-)は、過酸化水素と反応して過酸化水素より酸化電位が遥かに大きいトリヨウ化物イオン(I3-)を形成することができる。イオン性ヨウ化物の例示的な供給源には、ヨウ化水素(HI)及び、アルカリ金属ヨウ化物塩(例えば、ヨウ化カリウム(Kl)、ヨウ化ナトリウム(NaI)、ヨウ化リチウム)、ヨウ化アンモニウム(NH4I)、ヨウ化カルシウム(CaI2)等)のような水溶性ヨウ化物塩が含まれる。他の適切な電子供与体には、チオシアン酸ナトリウム、チオシアン酸カリウム、チオシアン酸アンモニウム、及び他のチオシアン酸塩のようなチオシアン酸イオンの供給源を含むことができる。電子供与体として鉄(II)のような金属を用いることもできる。例えば、フェントン試薬は、鉄(II)及び過酸化水素の反応により形成される溶液である。即ち、鉄(II)は、過酸化水素により酸化されて鉄(III)になり、ヒドロキシルラジカル及びヒドロキシルアニオンを形成する。鉄(III)は、次に、同じ過酸化水素が過酸化物ラジカル及び陽子になることにより還元されて鉄(II)に戻る。得られる試薬は、色原体に対して強い酸化電位を有する。更に別の適切な電子供与体は、Johansenに付与された米国特許出願公開第2002/0119136号に記載されており、これは、本明細書において引用によりそのまま組み入れられる。
【0017】
電子供与体は、強酸化電位の中間化合物を生成することができるが、それにも関わらず、このような化合物の濃度は、場合によっては、色原体に望ましい色変化を生成するのには低すぎることがある。例えば、高濃度のトリヨウ化物イオンは、ヒトの眼に見える色(例えば金茶)になることができる。しかし、濃度が減少すると、色の明瞭さは減少する。従って、中間化合物(例えばトリヨウ化物イオン)に複合化して更に強い色を形成する顕色剤を用いることができる。このような顕色剤の特定の例の1つは、天然デンプン、及びデキストリン化、加水分解、アルキル化、ヒドロキシアルキル化、アセチル化又は断片化デンプンのような修飾誘導体の両方を含むデンプンである。デンプンは、一般に、2つの構造的に区別される多糖類、即ち、両方ともα−D−グルコピラノース単位から成るα−アミロース及びアミロペクチンから形成される。デンプンは、トウモロコシデンプン、小麦デンプン、馬鈴薯デンプン、タピオカデンプン、サゴデンプン、コメデンプン、モチトウモロコシデンプン又は高アミローストウモロコシデンプンのようなあらゆる起源のもの又はその誘導体とすることができる。上に記載するようなヨウ化物供給源とともに用いると、デンプンのα−アミロース部分が取り込まれるかそれに結合し、水溶性であり強い青色を有する線状トリヨウ化物イオン複合体を形成することができる。
【0018】
電子供与体及び/又は顕色剤が望ましく色変化するのを容易にする範囲は、部分的にはその濃度によって決まる。即ち、これらの化合物の1つ又はそれ以上の濃度が大きすぎると、色原体を圧倒して酸化反応を抑制することがある。一方、濃度が低すぎると、酸化電位が望ましい範囲まで高くならないことがある。この点に関して、電子供与体(例えば、ヨウ化物供給源)は、約0.01〜約2000ミリモル(「mM」)、実施形態のいくつかでは約0.1〜約1000mM、実施形態のいくつかでは約1〜約100mM/リットル試験試料の量で用いることができる。同様に、顕色剤(例えばデンプン)は、試験試料の重量に基づき、約0.001〜約10重量%、実施形態のいくつかでは約0.01〜約5重量%、実施形態のいくつかでは約0.1〜約2重量%の量で用いることができる。
【0019】
本発明により望ましい色変化を達成するために、色原体は、媒体のマトリクスを通して実質的に拡散しないように(即ち非拡散的に不動化する)反応媒体に付加される。これにより、使用者は、色原体が酸化されるときに起こる色変化を容易に検出することができるようになる。例えば、色原体を含む溶液は、最初に検出ゾーン内の反応媒体に付加することができる。色原体溶液は、クロマトグラフ媒体を形成するのに用いられる材料に応じて水性及び/又は非水性溶媒を含むものとすることができる。適切な非水性溶媒には、グリコール(例えば、プロピレングリコール、ブチレングリコール、トリエチレングリコール、へキシレングリコール、ポリエチレングリコール、エトキシジグリコール、及びジプロピレングリコール);アルコール(例えば、メタノール、エタノール、n−プロパノール、及びイソプロパノール);トリグリセリド;酢酸エチル;アセトン;トリアセチン;アセトニトリル、テトラヒドラフラン;キシレン;ホルムアルデヒド(例えば、ジメチルホルムアミド);その他を含むことができる。溶液中の溶媒及び色原体の量は、一般に、感受性の望ましいレベルに基づいて種々とすることができる。例えば、実施形態のいくつかでは、色原体は、約0.1〜約100ミリグラム/ミリリットル溶媒、実施形態のいくつかでは約0.5〜約60ミリグラム/ミリリットル溶媒、実施形態のいくつかでは約1〜約40ミリグラム/ミリリットル溶媒の濃度で存在することができる。
【0020】
それに関係なく、溶液は、乾燥して溶媒を除去し、媒体上に残りの色原体を残すことができる。色原体は、一般に、流体の試験試料と接触するまで検出ゾーン内に留まることになる。しかし、色原体は水溶性であるため、これは、特に不動化されなければ通常溶解して試験試料とともに流れる。従って、本発明によれば、色原体は、陰イオン性化合物、即ち、1つ又はそれ以上の陰イオンを含むか溶液中で1つ又はそれ以上のイオンを形成することができる化合物とともに検出ゾーン内に実質的に非拡散的に不動化される。このような陰イオン性化合物は、種々の方法で色原体を容易に不動化することができる。例えば、陰イオン性化合物は、色原体の荷電を促進し、クロマトグラフ媒体の表面に存在する1つ又はそれ以上の官能基とイオン結合を形成することもできる。また、特定の陰イオン性化合物(例えば酸)は、ロイコ塩基又はその誘導体(例えばプロトン化ロイコ塩基)と反応するとき実質的に水不溶性の沈殿物を形成することができる。当然、陰イオン性化合物は、種々の他の利益ももたらすことができる。例えば、少量の色原体は、空気中又は他の酸化環境に過剰に長時間放置されると酸化反応を受ける可能性がある。これにより、「偽陽性」を示すことになる色の変化が起こることがあり、最低でも、分析物の存在を半定量的又は定量的に求める能力に有害な影響を及ぼす可能性がある。陰イオン性化合物は、色原体が不注意に酸化しないように保護し、従って「偽陽性」を減少させることができる。
【0021】
陰イオン性化合物の選択は、色原体の性質及びその濃度を含む各種の因子に左右される。本発明に用いるのに適切な陰イオン性化合物は、例えば、塩酸、硝酸、硫酸、リン酸、ポリリン酸、ホウ酸、ボロン酸等のような無機酸と、アクリル酸、メタクリル酸、マロン酸、コハク酸、サリチル酸、スルホサリチル酸、アジピン酸、マレイン酸、リンゴ酸、オレイン酸、没食子酸、酒石酸、クエン酸、ギ酸、酢酸、グリコール酸、シュウ酸、プロピオン酸、フタル酸、イソフタル酸、グルタル酸、グルコン酸、乳酸、アスパラギン酸、グルタミニン酸、イタコン酸、トリフルオロ酢酸、バルビツール酸、桂皮酸、安息香酸、4−ヒドロキシ安息香酸、アミノ安息香酸等のようなカルボン酸;メタンスルホン酸、ベンゼンスルホン酸、トルエンスルホン酸、トリフルオロメタンスルホン酸、スチレンスルホン酸、ナフタレンジスルホン酸、ヒドロキシベンゼンスルホン酸等のようなスルホン酸;ポリ(アクリル)又はポリ(メタクリル)酸及びそのコポリマー(例えば、マレイン−アクリル、スルホン−アクリル、及びスチレン−アクリルコポリマー)、カラジーン(carageenic)酸、カルボキシメチルセルロース、アルギン酸等のようなポリマー酸;その他を含む有機酸と、を含むことができる。前述の酸の無水物(例えば無水マレイン酸)及び塩も用いることができる。塩は、ナトリウム塩、カリウム塩、カルシウム塩、セシウム塩、亜鉛塩、銅塩、鉄塩、アルミニウム塩、ジルコニウム塩、ランタン塩、イットリウム塩、マグネシウム塩、ストロンチウム塩、セリウム塩)のような金属塩の形とすることもでき、酸をアミン(例えば、アンモニア、トリエチルアミン、トリブチルアミン、ピペラジン、2−メチルピペラジン、ポリアリルアミン)と反応させることにより調製された塩の形とすることもできる。
【0022】
色原体が不動化される程度は、陰イオン性化合物の濃度によって決まる可能性がある。例えば、色原体溶液中の陰イオン性化合物の濃度は、約0.1〜約20ミリモル/リットル(「mM」)、実施形態のいくつかでは約1mM〜約10mM、実施形態のいくつかでは約2mM〜約8mMとすることができる。
【0023】
本発明によれば、試薬(例えば、酵素、過酸化物、電子供与体、顕色剤等)間の望ましい反応時間は、反応が起こる媒体を選択的に制御することにより達成することができる。即ち、反応媒体は、性質がクロマトグラフ的であるため、過酸化水素及び/又は他の試薬が一貫した制御可能な方式で側方に流れることができる。媒体を通って側方に流れる間に、過酸化水素は、分析のための個別の検出ゾーン内に含まれる色原体を酸化する。流体流れが制御されるという性質のため、あらゆる未反応試薬は、検出ゾーン内の色原体を観察するのに有害な影響を及ぼすことができないように、反応媒体の端部まで進行する。
【0024】
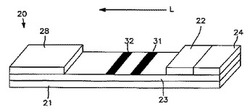
この点に関して、図1は、本発明により分析物の存在を検出するための横流装置20の特定の実施形態の1つを示す。図示するように、横流装置20は、任意的に硬質支持材料21で支持されるクロマトグラフ媒体23を含む。クロマトグラフ媒体23は、試験試料が通過することができる種々の材料の何れで作ることもできる。例えば、クロマトグラフ媒体23は、多糖類(例えば、紙のようなセルロース材料及び酢酸セルロース及びニトロセルロースのようなセルロース誘導体);ポリエーテルスルホン;ポリエチレン;ナイロン;ポリフッ化ビニリデン(PVDF);ポリエステル;ポリプロピレン;シリカ;不活性化アルミナ、珪藻土、MgSO4、又は、塩化ビニル、塩化ビニル−プロピレンコポリマー、及び塩化ビニル−酢酸ビニルコポリマーのような多孔性ポリマーマトリクスに均質に分散された他の無機の微粉化材料のような無機材料;天然由来布(例えば綿)及び合成布(例えばナイロン又はレーヨン)の両方の布;シリカゲル、アガロース、デキストラン、及びゼラチンのような多孔性ゲル;ポリアクリルアミドのようなポリマーフィルム;その他、のような合成又は天然由来材料で形成された多孔性膜とすることができる。特定の実施形態の1つでは、クロマトグラフ媒体23は、ニトロセルロース及び/又はポリエーテルスルホン材料で形成される。「ニトロセルロース」という用語は、ニトロセルロース単独とすることもでき、1〜7の炭素原子を有する脂肪族カルボン酸のような硝酸及び他の酸の混合エステルとすることもできるセルロースの硝酸エステルをいうことは当然理解される。
【0025】
クロマトグラフ媒体23の大きさ及び形状は、当業者には容易に理解されるように、一般に種々異なるものとすることができる。例えば、多孔性膜ストリップの長さは、約10〜約100ミリメートル、実施形態のいくつかでは約20〜約80ミリメートル、実施形態のいくつかでは約40〜約60ミリメートルとすることができる。また、膜ストリップの幅は、約0.5〜約20ミリメートル、実施形態のいくつかでは約1〜約15ミリメートル、実施形態のいくつかでは約2〜約10ミリメートルの範囲とすることができる。同様に、膜ストリップの厚さは、一般に、透過に基づく検出を可能にするのに十分に小さい。例えば、膜ストリップの厚さは、約500マイクロメートル未満、実施形態のいくつかでは約250マイクロメートル未満、実施形態のいくつかでは約150マイクロメートル未満とすることができる。
【0026】
上に述べたように、支持部21は、クロマトグラフ媒体23を支持する。例えば、支持部21は、図1に示すようにクロマトグラフ媒体23に直接隣接して位置決めすることもでき、クロマトグラフ媒体23と支持部21との間に1つ又はそれ以上の介在層を位置決めすることもできる。それと関係なく、支持部21は、一般に、クロマトグラフ媒体23を支持することができるあらゆる材料で形成することができる。支持部21は、透明又は光学的拡散性(例えば拡散透光性)材料のような光に透過性の材料で形成することができる。また、一般に、支持部21は、媒体23を通って流れる流体が支持部21を通って漏れないように液体不透過性であることが望ましい。支持部に適切な材料の例には、限定ではないが、ガラス;ポリスチレン、ポリプロピレン、ポリエステル(例えばMylar(登録商標)フィルム)、ポリブタジエン、ポリ塩化ビニル、ポリアミド、ポリカーボネート、エポキシド、メタクリレート、及びポリメラミンのようなポリマー材料;その他が含まれる。クロマトグラフ媒体23に十分な構造的裏打ちを設けるために、支持部21は、一般に、特定の最小厚さを有するように選択される。同様に、支持部21の厚さは、典型的には、その光学的特性に有害な影響を及ぼすほど厚くない。従って、例えば、支持部21の厚さは、約100〜約5,000マイクロメートル、実施形態のいくつかでは約150〜約2,000マイクロメートル、実施形態のいくつかでは約250〜約1,000マイクロメートルの範囲とすることができる。例えば、適切な膜ストリップの1つは、厚さが約125マイクロメートルであり、マサチューセッツ州ベッドフォードのMillipore Corp.から「SHF180UB25」という名称で入手することができる。
【0027】
当技術分野では公知のように、クロマトグラフ媒体23は、支持部21上に流し込み、得られるラミネートを望ましい大きさ及び形状にダイカットすることができる。或いは、クロマトグラフ媒体23は、単純に、例えば接着剤で支持部21にラミネートすることができる。実施形態のいくつかでは、ニトロセルロース又はナイロン多孔性膜がMylar(登録商標)フィルムに接着される。感圧接着剤のような接着剤を用いて多孔性膜をMylar(登録商標)フィルムに結合する。この種類のラミネート構造は、マサチューセッツ州ベッドフォードのMillipore Corp.から市販されていると考えられている。適切なラミネート装置構造の更に別の例は、Durley,IIIらに付与された米国特許第5,075,077号に記載されており、これは、本明細書において引用によりそのまま組み入れられる。
【0028】
また、装置20は、媒体23に隣接して配置される吸収性材料28も含むことができる。吸収性材料28は、毛管作用及び媒体23を通る流体の流れを促進するのに役立つ。また、吸収性材料28は、クロマトグラフ媒体23全体を通して移行する流体を受け取り、従って、検出領域からあらゆる未反応化合物を引き離す。本発明に用いることができる適切な吸収性材料のいくつかには、限定する意味ではないが、ニトロセルロース、セルロース材料、多孔性ポリエチレンパッド、ガラス繊維濾紙等が含まれる。吸収性材料は、装置に組み入れる前に湿潤していても乾燥していてもよい。予備的な湿潤は、ある流体に対しては毛管流を促進するが、典型的には必要とされない。また、当技術分野では公知のように、吸収性材料は、界面活性剤で処理して吸い上げ工程を補助することができる。
【0029】
アッセイを開始するために、使用者は、試験試料をクロマトグラフ媒体23の一部に直接付加することができ、これによって、試験試料は、該クロマトグラフ媒体23を通って図1に矢印「L」で示す方向に進行することができる。或いは、試験試料は、最初に、クロマトグラフ媒体23と流体的に連通する試料付加ゾーン24に付加することもできる。試料付加ゾーン24は、媒体23上に形成することができる。或いは、図1に示すように、試料付加ゾーン24は、パッドのような別個の材料で形成することもできる。このような試料パッドを形成するのに用いることができる適切な材料のいくつかには、限定ではないが、ニトロセルロース、セルロース、多孔性ポリエチレンパッド、及びガラス繊維濾紙が含まれる。望むならば、試料付加ゾーン24は、拡散的又は非拡散的の何れかで取り付けられた1つ又はそれ以上の前処理試薬を含むこともできる。
【0030】
上に記載した方法で分析物を検出するのを容易にするために、酵素、電子供与体、顕色剤等のような種々の試薬が用いられる。実施形態のいくつかでは、装置20に付加する前に1つ又はそれ以上の試薬を試験試料と混合することができる。例えば、試験試料は、酵素とともに特定の期間培養することができる。酵素触媒反応の培養時間は、問題とする酵素活性によって決まり、それは、部分的に、温度、pH、基質濃度、阻害剤(競合的(酵素に結合)、不競合的(酵素−基質複合体に結合)、又は非競合的(酵素及び/又は酵素−基質複合体に結合))の存在等によってきまることは当業者には容易に理解される。これらの因子は、培養時間を増大又は減少させるために望む通りに選択的に制御することができる。例えば、培養時間は、約1分より長くすることができ、実施形態のいくつかでは約5〜約50分、実施形態のいくつかでは約10〜約25分とすることができる。同様に、pHは、酵素活性を促進するために選択的に制御することができる。例えば、試験試料内に高レベルの基本物質(例えばアミン)が存在すれば、pHは、ある酵素活性を最適にするには高すぎ、例えば8より高いpHになる可能性がある。詳細には、酵素は、pHレベル約3〜約8、実施形態のいくつかでは約4〜約7で最適活性を有することができる。従って、望むならば、緩衝液又は他のpH変更化合物を用いて、望ましいpHを維持することができる。望ましいpHを維持するのに用いることができる生物学的適合性がある緩衝液のいくつかには、ホウ酸緩衝液、リン酸緩衝生理食塩水(PBS)、2−(N−モルホリノ)エタンスルホン酸(「MES」)、トリスヒドロキシメチルアミノメタン(「Tris」)、クエン酸緩衝液等が含まれる。
【0031】
培養後、試験試料内に存在するあらゆる酵素は、典型的には分析物を酸化して過酸化水素を放出することになる。次に、過酸化物を含む試験試料をアッセイ装置20に付加することができる。或いは、試験試料を付加する前に、酵素及び/又は他の試薬を装置20に拡散的に不動化することができる。このような事前付加により、次の使用者が試薬を取り扱い、試験試料又は希釈剤と混合する必要が無くなることを含む種々の利益が得られる。これは、使用者が一般に訓練された実験技術者又は医療従事者でない場合にケアを行うという点で特に有用である。(各)試薬は、試料付加ゾーン24、その上流、又は下流に配置することができる。このように、試験試料は、付加するときに分析物と混合することができる。試験試料を付加する点より下流に配置される場合には、試験試料は、付加するときに試薬と混合して溶解又は再懸濁することができる。
【0032】
図示する実施形態では、例えば、試料付加ゾーン24と流体的に連絡する試薬ゾーン22が用いられる。図1に示すように、試薬ゾーン22は、別個の材料又はパッドで形成される。このような試薬パッドは、ガラス繊維のような試験試料がそれを通過することができるあらゆる材料で形成することができる。或いは、試薬ゾーン22は、単純に、媒体23上に形成することができる。それに関係なく、試薬ゾーン22には、酵素、電子供与体、顕色剤等のような試薬を含む1つ又はそれ以上の溶液を付加し、乾燥することができる。従って、試験試料は、試薬ゾーン22の下流に位置する上に記載した被酸化性色原体を不動化した検出ゾーン31に到達する前に、試薬ゾーン22に接触して過酸化水素又は他の中間化合物を生成することができる。
【0033】
本発明の横流装置の利点の1つは、分析物検出を容易にするための1つ又はそれ以上の付加的なゾーンを容易に組み入れることができる能力である。例えば、図1を再び参照すると、横流装置20には、検出の正確さを向上させるために、対照ゾーン32も用いることができる。対照ゾーン32は、使用者に、試験が適切に行われているという信号を与える。更に詳細には、十分な量の試験試料と接触するとクロマトグラフ媒体23を通って流れる対照試薬を用いることができる。すると、これらの対照試薬は、視覚的に又は器具を用いての何れかで対照ゾーン32内に観察することができる。対照試薬は、一般に、ルミネセンス化合物(例えば、蛍光、りん光等);放射性化合物;可視化合物(例えば、着色染料又は金のような金属物質);信号生成物質を含むリポソーム又は他の小胞;酵素及び/又は基質等のような検出可能物質を含む。他の適切な検出可能物質は、Jouらに付与された米国特許第5,670,381号及びTarchaらに付与された第5,252,459号に記載されており、これらは、本明細書において引用によりそのまま組み入れられる。
【0034】
望むならば、検出可能物質は、粒子(時に「ビーズ」又は「マイクロビーズ」という)上に配置することができる。とりわけ、粒子は、検出可能物質がクロマトグラフ媒体を通って進行する能力を高める。例えば、核、マイコプラズマ、プラスミド、プラスチド、哺乳類細胞(例えば、赤血球ゴースト)、単細胞微生物(例えば細菌)、多糖類(例えばアガロース)等のような天然由来の粒子を用いることができる。更に、合成粒子を用いることもできる。例えば、実施形態の1つでは、蛍光又は着色染料でラベルされたラテックス微小粒子を用いる。本発明には合成粒子のいずれを用いることもできるが、粒子は、典型的には、ポリスチレン、ブタジエンスチレン、スチレンアクリル−ビニルターポリマー、ポリメチルメタクリレート、ポリエチルメタクリレート、スチレン−無水マレイン酸コポリマー、ポリ酢酸ビニル、ポリビニルピリジン、ポリジビニルベンゼン、ポリブチレンテレフタレート、アクリロニトリル、塩化ビニル−アクリレート等、又はそのアルデヒド、カルボキシル、アミノ、ヒドロキシル、又はヒドラジド誘導体で形成される。用いる場合には、粒子の形状は、一般に種々異なるものとすることができる。例えば、特定の実施形態の1つでは、粒子は、球状の形状である。しかし、本発明では、プレート、ロッド、ディスク、バー、管、不規則な形状等のような他の形状も意図されることは当然理解される。また、粒子の大きさも種々とすることができる。例えば、粒子の平均の大きさ(例えば直径)は、約0.1ナノメートル〜約1,000ミクロン、実施形態のいくつかでは約0.1ナノメートル〜約100ミクロン、実施形態のいくつかでは約1ナノメートル〜約10ミクロンの範囲とすることができる。適切な粒子の市販の例には、Molecular Probes,Inc.により商品名「FluoSphere」(Red 580/605)及び「TransfluoSphere」(543/620)で販売される蛍光カルボキシル化マイクロスフィアのほか、これもMolecular Probes,Inc.から販売される「Texas Red」及び5−及び6−カルボキシテトラメチルローダミンが含まれる。また、適切な着色ラテックス微小粒子の市販の例には、Bang’s Laboratory,Inc.から販売されるカルボキシル化ラテックスビーズが含まれる。
【0035】
対照ゾーン32の位置は、行う試験の性質に基づき、種々変えることができる。図示する実施形態では、例えば、対照ゾーン32は、クロマトグラフ媒体23により定められ、検出ゾーン31の下流に位置決めされる。このような実施形態では、対照ゾーン32は、非拡散的に不動化され、対照試薬と化学的及び/又は物理的結合を形成する材料を含むことができる。例えば、対照試薬がラテックス粒子を含む場合には、対照ゾーン32は、粒子に結合する多価電解質を含むことができる。種々の多価電解質結合システムは、例えば、Songらに付与された米国特許出願公開番号第2003/0124739号に記載されており、これは、本明細書において引用によりそのまま組み入れられる。しかし、別の実施形態では、対照ゾーン32は、単純に、対照試薬がクロマトグラフ媒体23を通って移動した後に流れつく吸収性材料28の領域により定めることができる。
【0036】
選択した特定の制御技術に関係なく、十分な量の試験試料を装置20に付加すると、対照ゾーン32内で、分析物が存在するかどうかの信号が形成されることになる。このような対照ゾーンにより得られる利点には、注意深い測定又は計算を必要とすることなく、十分な量の試験試料が加えられたことを使用者に知らせることが含まれる。これにより、反応時間、試験試料容量等を外部から制御することを必要とせずに横流装置20を用いることができるようになる。
【0037】
試料付加ゾーン24、試薬ゾーン22、検出ゾーン31、対照ゾーン32、及び横流装置20に用いられるあらゆる他のゾーンは、一般に、あらゆる数の個別検出領域を設け、使用者が試験試料内の酵素の濃度をうまく求めることができるようにする。各領域は、同じ又は異なる材料を含むことができる。例えば、ゾーンは、2つ又はそれ以上の個別領域(例えば、線、ドット等)を含むことができる。領域は、試験試料が装置20を通って流れる方向に実質的に垂直な方向の線の形で配置することができる。同様に、実施形態のいくつかでは、領域は、装置20を通って試験試料が流れる方向に実質的に平行な方向の線の形で配置することができる。
【0038】
図1の装置20を用いて試験試料内のグルコースの存在を検出するための方法の特定の実施形態の1つをこれから更に詳細に記載することにする。最初に、グルコースを含む試験試料を試料付加ゾーン24に付加し、「L」方向に試薬ゾーン22まで進行させる。試薬ゾーン22で、グルコースがグルコース酸化酵素と混合して触媒反応を開始し、過酸化水素を生成する。すると、過酸化水素は、試薬ゾーン22に含まれるヨウ化物イオンと反応して高酸化電位の中間化合物を生成する。任意的に、試薬ゾーン22に顕色剤(例えばデンプン)を用いて得られる色変化を増強することができる。試薬ゾーン22に存在する間又は混合物が装置20を通って流れるときに望ましい反応が起こる可能性がある。これに関係なく、酸化的中間化合物を含む試験試料は、最終的に、検出ゾーン31まで流れ、そこで、陰イオン性化合物が存在するときには色原体と反応する。
【0039】
この反応後、色原体は色を変化させる。色原体が色を変化させる程度は、視覚的又は器具を用いて求めることができる。実施形態の1つでは、色強度は、光学式読取装置で測定する。光学式読取装置の実際の構成及び構造は、当業者には容易に理解されるように、一般に種々とすることができる。典型的には、光学式読取装置は、電磁放射を放出することができる照射源と、信号(例えば透過又は反射光)を記録することができる検出器と、を含む。照射源は、可視又は近可視領域の光(例えば赤外又は紫外光)のような電磁放射を生成することができる当技術分野で公知のあらゆる装置とすることができる。例えば、本発明で用いることができる適切な照射源には、限定する意味ではないが、発光ダイオード(LED)、閃光ランプ、冷陰極蛍光ランプ、エレクトロルミネセントランプ等が含まれる。照明は、多重化することもでき及び/又はコリメートすることもできる。場合によっては、照明は、パルス化してあらゆる背景干渉を減少させることができる。更に、照明は、連続とすることもでき、又は連続波(CW)とパルス化照明を組み合わせ、複数の照明ビームを多重化させ(例えば、パルス化ビームとCWビームを多重化させ)て、CW供給源により生成される信号と、パルス化供給源により生成される信号との間を区別することができるようにすることもできる。例えば、実施形態のいくつかでは、LED(例えば、砒化アルミニウムガリウム赤色ダイオード、リン化ガリウム緑色ダイオード、砒化リン化ガリウム緑色ダイオード、又は窒化インジウムガリウム紫/青/紫外線(UV)ダイオード)が、パルス化照明源として用いられる。本発明に用いるのに適する適切なUV LED励起ダイオードの市販の例の1つは、型番NSHU55OE(Nichia Corporation)であり、これは、750〜1000マイクロワットの光パワーを順方向電流10ミリアンペア(3.5〜3.9ボルト)で半値全幅10度、ピーク波長370〜375ナノメートル、スペクトル半値幅12ナノメートルのビームにして放出する。
【0040】
場合によっては、照明源は、色原体に拡散照明を与えるものとすることができる。例えば、複数の点光源(例えばLED)列を単純に用いて比較的拡散性の照明を与えることができる。比較的安価な方式で拡散照明を与えることができる別の特に望ましい照明源は、エレクトロルミネセント(EL)装置である。EL装置は、一般に、その少なくとも1つが透明で光を逃がすことができる電極間に挟まれたルミネセント材料(例えばりん光体粒子)を用いるキャパシタ構造である。電極間に電圧を付加すると、ルミネセント材料内に発光を引き起こす変動電場が生じる。
【0041】
検出器は、一般に、信号を検知することができる当技術分野で公知のあらゆる装置とすることができる。例えば、検出器は、空間識別するように構成された電子撮像検出器とすることができる。このような電子撮像センサの例のいくつかには、高速線状電荷結合装置(CCD)、電化注入装置(CID)、相補的金属酸化物半導体(CMOS)装置等が含まれる。このような画像検出装置は、一般に、2次元アレイの電子光センサとされるが、単一の線の検出器ピクセル又は光センサ、例えば画像を走査するのに用いるようなものを含む線状撮像検出装置(例えば、線状CCD検出装置)を用いることもできる。各アレイは、「アドレス」と呼ばれることもある既知の一意的位置の組を含む。画像検出器の各アドレスは、領域(例えば、典型的には箱又は長方形として形作られた領域)を覆うセンサにより占有される。この領域は、一般に、「ピクセル」又はピクセル領域と呼ばれる。例えば、検出器ピクセルは、CCD、CID、又はCMOSセンサ、又は光を検出又は測定するあらゆる他の装置又はセンサとすることができる。検出器ピクセルの大きさは、大幅に変動させることができ、場合によっては直径又は長さは、0.2マイクロメートル程の小ささとすることができる。
【0042】
他の実施形態では、検出器は、空間識別能力に欠ける光センサとすることができる。例えば、このような光センサの例には、光電子倍増装置、アバランシェフォトダイオード又はシリコンフォトダイオードのようなフォトダイオード、その他を含むことができる。シリコンフォトダイオードは、安価で感受性があり、高速作業が可能で(立ち上がり時間が短い/処理能力が高い)、殆どの他の半導体技術及びモノリシック回路に容易に組み込むことができるという点で時に有利である。また、シリコンフォトダイオードは、物理的に小さく、そのため、種々の種類の検出システムに容易に組み込むことができる。シリコンフォトダイオードを用いる場合には、放出信号の波長の範囲は、感受性の範囲内とすることができ、これは、400〜1100ナノメートルである。
【0043】
光学式読取装置は、一般に、例えば、ルミネセンス(例えば、蛍光、りん光等)、吸収(例えば、蛍光又は非蛍光)、回折等を含むあらゆる公知の検出技術を用いることができる。本発明の特定の実施形態の1つでは、光学式読取装置は、吸収の関数として色強度を測定する。実施形態の1つでは、吸収読み取り値は、バージニア州のシャンティイ―のDynex Technologiesから入手されるマイクロプレート読み取り装置(型番MRX)を用いて測定する。別の実施形態では、吸収読み取り値は、F.Costによる「デジタル印刷のポケットガイド」、ニューヨーク州アルバニーのDelmar Publishers、ISBN 0−8273−7592−1の144及び145頁で論じられる「CIELAB」として知られる従来の試験を用いて読み取る。この方法は、反対色知覚説に基づき、知覚した色の3つの特徴に対応する3つの変数、L*、a*、及びb*を定める。3つの変数は、次の意味を有する。
L*=明度(又は光度)で、0〜100の範囲であり、0=暗、100=明である。
a*=赤/緑軸で、ほぼ−100〜100の範囲であり、正の値は赤色を帯びており、負の値は緑色を帯びている。
b*=黄/青軸で、ほぼ−100〜100の範囲であり、正の値は黄色を帯びており負の値は青色を帯びている。
【0044】
CIELAB色空間は、幾分視覚的に均質であるため、ヒトが知覚できる2つの色の間の差を表す単一の数を計算することができる。この差は、ΔEと呼ばれ、2つの色間で3つの差(ΔL*、Δa*、Δb*)の平方の合計の平方根をとることにより計算される。CIELAB色空間では、各ΔE単位は、2つの色間の「辛うじて認知可能」な差にほぼ等しい。従って、CIELABは、カラー管理及び色変化表現のための基準色空間として用いることができる客観的な装置独立表色システムの良好な尺度である。従って、この試験を用いて、色強度(L*、a*、b*)は、例えば、日本国大阪のMinolta Co.Ltd.の手持ち型分光光度計(型番CM2600d)を用いて測定することができる。この機器は、CIE第15号ISO 7724/1、ASTME1164及びJIS Z8722−1982(拡散照明/8度目視システムに一致するD/8ジオメトリを用いる。試料片表面の垂線に8度の角度で試料片表面に反射されるD65光は、試料片−測定光学システムにより受け取られる。更に別の適切な光学式読取装置は、Kaylorらに付与された米国特許出願公開番号第2003/0119202号に記載される反射分光光度計であり、この特許出願は、本明細書において引用によりそのまま組み入れられる。同様に、本発明には、透過モード検出システムを用いることもできる。
【0045】
望むならば、検出ゾーン31での色強度を測定し、試験試料に存在する分析物のレベルを定量的又は半定量的に求めることができる。検出ゾーン31での色強度は、典型的には、過酸化水素及び分析物濃度に正比例する。また、検出ゾーン31で生成される検出信号の強度「Is」は、複数の既知の分析物濃度に対して生成した予め決定した検出曲線に比較することもできる。未知の試験試料中の分析物の分量を求めるために、信号は、単純に、検出曲線に従って分析物濃度に変換することができる。これと関係なく、分析物及びあらゆる未反応試薬は、次に、吸収性材料28に到達するまで検出ゾーン31を過ぎて進行する。場合によっては、試薬は、空中である期間にわたって酸化され、着色化合物を形成することになる。しかし、このような着色化合物は、検出領域31に配置されるため、一般に、検出の正確さを損なわない。
【0046】
本発明は、試験試料中の特定の分析物(例えばグルコース)の存在を正確に検出するための比較的簡単で小型であり、費用効率のよい装置を提供する。試験結果は、可視的とすることができるため、試験を行う人に、素早く、高度に信頼可能で一貫する試験結果が導かれる試験条件下で容易に観察される。また、試験は迅速であり、比較的短い期間で検出することができる。例えば、色原体は、約30分未満、実施形態のいくつかでは約10分未満、実施形態のいくつかでは約5分未満、実施形態のいくつかでは約3分未満、実施形態のいくつかでは約1分未満、実施形態のいくつかでは約30秒未満で検出可能に色が変化することができる。このように、色原体は、分析物の存在又は不在を「実時間」で示すことができる。
本発明は、次の実施例を参照すると更に良好に理解することができる。
【実施例1】
【0047】
ロイコマラカイトグリーン(「LMG」)のHCl酸性化水(20ミリグラム/ミリリットル)溶液を作った。得られる溶液は、恐らくは材料が僅かに大気酸化されたことによる極めて薄い緑色であった。ガラス毛管を用いて少量の溶液をニトロセルロース膜/ハーフスティック(half−stick)横流型アッセイに配置した。装置は、次に、新しく作ったヨウ化カリウム及び過酸化水素の濃縮溶液に入れた。KI/過酸化物溶液は、直ちに黄色に変わり(I2の生成による)、溶液が膜に吸い上げられると、膜のロイコマラカイトグリーンが急速に鮮やかなエメラルドグリーン色に変わった。しかし、新しく形成された緑色材料は、水溶液とともに膜の上方に移動した。
【実施例2】
【0048】
高度に置換された中等度分子量のカルボキシメチルセルロース(「CMC」)の希釈水溶液を作った。溶液をマラカイトグリーンの酸性溶液に加えても、沈殿物は見られなかった。理論に縛られることは意図しないが、沈殿物ができないのは、ポリマーに他のカルボキシル基が存在し、染料/CMC沈殿物が可溶性のままであるためである可能性がある。次に、例1に記載するように、染料溶液を試験ストリップに加えた。染料の捕捉は見られなかった。
【実施例3】
【0049】
オレイン酸ナトリウムの希釈水溶液を作った。溶液をマラカイトグリーンの酸性溶液に加えても、沈殿物は見られなかった。
【実施例4】
【0050】
5−スルホサリチル酸二水和物(5−SSA)の希釈水溶液を作った。溶液をマラカイトグリーンの酸性溶液に加えると、沈殿物が観察された。「密接なイオン対」を更に試験するために、少量(ほぼ20マイクロリットル)のロイコマラカイトグリーンの酸性溶液(20ミリグラム/ミリリットル)を濃縮5−SSA溶液に加えた。得られる溶液は、例1に記載するように、ガラス毛管を介してニトロセルロース横流型ストリップに付加した。付加スポットは、急速に鮮やかな緑色になり、膜の定位置に留まった。
【実施例5】
【0051】
試験は、ロイコマラカイトグリーンの代わりにロイコクリスタルバイオレットを用いたことを除き実施例4に記載した通りに行った。試験すると、付加スポットは、極めて薄い赤みを帯びた色から紫に変化し、膜のその場所に留まった。
【実施例6】
【0052】
過酸化物に対する感受性のほか、必要なKI濃度を実際に示す実験を行った。詳細にノベルと、3モルの5−スルホサリチル酸及び0.5ミリモルロイコマラカイトグリーンの溶液の1マイクロリットルの液滴をニトロセルロース膜(Millipore部品番号CFSP 203000)に付加して乾燥させた。96穴プレートの4つのウェルを190マイクロリットルの1.0モルヨウ化カリウムで満たした。各ウェルに0.0重量%(対照)、0.003重量%、0.03重量%、及び0.3重量%の範囲の過酸化水素溶液を10マイクロリットル加えた。次に、ハーフスティック膜をそれぞれのウェルに配置した。対照ストリップは、僅かに緑色のスポットを生成するが、これは、大気条件で空気中でヨウ化カリウムが酸化されるためであると考えられている。残りの試験ストリップの各々に生じる色は、酸化カリウムが存在することにより過酸化物が活性化されたことを示すものであった。
【実施例7】
【0053】
例6に記載するように、ロイコマラカイトグリーンの酸性溶液(0.5ミリモルロイコマラカイトグリーン(「LMG」)及び2.0モル硫酸を用いる)をニトロセルロース膜に付加した。スポットは完全には乾燥していなかったが、得られる材料は、定位置に保持されていた。
【実施例8】
【0054】
飽和硫酸ナトリウム及び0.5ミリモルロイコマラカイトグリーン(「LMG」)から溶液を作り、例6に記載するようにニトロセルロース膜に付加した。溶液は、180マイクロリットルの0.1モルヨウ化カリウム及び20マイクロリットルの3重量%過酸化物を用いて生成した。染料は定位置に留まるが、容易には膜を濡らさなかった。
【実施例9】
【0055】
ニトロセルロース膜に濃縮HCl(37重量%)に溶解し、9:1比に希釈したロイコマラカイトグリーン(「LMG」)溶液20mg/mLでスポットをつけた。その後、この溶液8.2マイクロリットルを水で1ミリリットルまで希釈し、毛管で膜に付加した。スポットは膜に固定されたままであるが、膜を濡らすのは幾分困難であった。あらゆる濡れの問題は、溶液を比率9:1まで更に希釈することにより解決した。
【実施例10】
【0056】
10mg/mLロイコマラカイトグリーン(「LMG」)溶液を濃縮HCl(37重量%)に溶解し、9:1比に希釈した。この溶液8.2マイクロリットルを水で1ミリリットルまで希釈し、毛管でニトロセルロース膜に付加した。過酸化物/KIの組み合わせに暴露されるとき、いくつかの試料中の溶媒は、膜を容易には通過しなかった。
【実施例11】
【0057】
10mg/mLロイコマラカイトグリーン(「LMG」)溶液を濃縮HCl(1重量%)に溶解し、9:1比に希釈した。この溶液16.4マイクロリットルを水で1ミリリットルまで希釈し、滅菌濾過した。次に、溶液をBioMec噴霧器でニトロセルロース膜に付加し、膜を横切る連続線を形成した。溶液は、1マイクロリットル/センチメートル及び2マイクロリットル/センチメートルの比率で膜に噴霧した。両方の縞模様の膜で、LMGの移動は示されなかった。希釈試験を行い、過酸化物濃度に対するこのアッセイの感受性を求めた。全ての試験は、0.1モルヨウ化カリウム、及び膜に噴霧したLMGの量に応じて総量150又は50マイクロリットルを用いて行った。試験では、過酸化水素の存在は、極めて少量(例えばピコモル)で求めた。
【0058】
本発明は、その特定の実施形態に関して詳細に記載したが、当業者は、前述の事項を理解すれば、これらの実施形態の変更形態、変形形態、及び均等物を容易に気づくことができることは理解されると考える。従って、本発明の範囲は、添付の請求項及びそのあらゆる均等物の範囲であると判断される。
【符号の説明】
【0059】
20 横流装置
21 硬質支持材料
22 試薬ゾーン
23 クロマトグラフ媒体
24 試料付加ゾーン
28 吸収性材料
31 検出ゾーン
32 対照ゾーン
【背景技術】
【0001】
過酸化水素は、グルコース、コレステロール、尿酸、トリグリセリド、クレアチニンキナーゼ、クレアチニン等のような種々の化学的又は生物学的物質(分析物)の酵素触媒反応で生成される。所定の試験試料内の分析物の含量は、生成される過酸化水素の量から求めることができる。例えば、糖尿病は、尿中におけるグルコースの存在を検出することにより診断されることが多い。例を挙げると、グルコースが好気的酸化によりグルコン酸及び過酸化水素になるのを触媒するグルコース酸化酵素に尿試験試料を接触させることができる。典型的には、過酸化水素が存在すると色が変化する指標(例えば、ロイコ染料)を用いる。生じる色の変化は、存在するH2O2の量のほか、試験する流体の分析物含有量を示す。しかし、不都合なことには、このような試験を行う機構の多くは、過度に複雑で高価であり、負担が大きい。
従って、現在、分析物を酵素触媒酸化することにより発生する過酸化水素を検出するための改良方法が必要とされている。
【先行技術文献】
【特許文献】
【0002】
【特許文献1】米国特許第4,089,747号公報
【特許文献2】米国特許出願公開第2002/0119136号公報
【特許文献3】米国特許第5,075,077号公報
【特許文献4】米国特許第5,670,381号公報
【特許文献5】米国特許第5,252,459号公報
【特許文献6】米国特許出願公開番号第2003/0124739号公報
【特許文献7】米国特許出願公開番号第2003/0119202号公報
【非特許文献】
【0003】
【非特許文献1】F.Costによる「デジタル印刷のポケットガイド」、ニューヨーク州アルバニーのDelmar Publishers、ISBN 0−8273−7592−1の144及び145頁
【発明の概要】
【課題を解決するための手段】
【0004】
本発明の実施形態の1つによれば、分析物を酵素触媒酸化することにより放出される過酸化水素を検出するための診断試験キットが開示される。試験キットは、クロマトグラフ媒体を含む横流装置を含む。クロマトグラフ媒体は、陰イオン性化合物とともに色原体が実質的に非拡散的に不動化される検出ゾーンを定める。色原体は、酸化されると検出可能な色の変化を生じることができるロイコ塩基又はその誘導体である。
【0005】
本発明の別の実施形態によれば、分析物が酵素触媒酸化されることにより放出される過酸化水素を検出するための方法が開示される。方法は、陰イオン性化合物とともに被酸化性色原体が実質的に非拡散的に不動化される検出ゾーンを定めるクロマトグラフ媒体を含む横流装置を用意する段階を含む。被酸化性色原体は、ロイコ塩基又はその誘導体である。過酸化水素は、電子供与体と反応して中間化合物を形成する。中間化合物は、クロマトグラフ媒体を通って流れて検出ゾーンに接触することができ、それによって、中間化合物が色原体を酸化する。酸化した色原体の色は、酸化可能な色原体の色とは異なる。酸化した色原体の色を検出する。
【0006】
本発明の他の特徴及び側面は、以下で更に詳細に論じる。
本発明の完全で実施可能要件を満たす開示事項は、その最良の態様を含めて、当業者に向けたものであるが、これは、添付の図を参照して本明細書の残り部分において詳細に述べる。
本明細書及び図面に参照記号を繰り返して用いる場合には、本発明の同じ又は類似する特徴又は要素を表すことを意図する。
【図面の簡単な説明】
【0007】
【図1】本発明に用いることができる横流装置の実施形態の1つの斜視図である。
【発明を実施するための形態】
【0008】
定義
本明細書で用いる場合、「試験試料」という用語は、一般に、分析物を含むことが疑われるあらゆる材料をいう。試験試料は、血液、間質液、唾液、眼内レンズ液、脳脊髄液、汗、尿、乳汁、腹水、粘液、鼻汁、痰、滑液、腹膜液、膣液、月経、羊水、精液等を含む生理的流体のようなあらゆる生物学的供給源由来のものとすることができる。生理的流体のほか、環境又は食品アッセイを行うために水、食品等のような他の液体試料を用いることもできる。また、試験試料として分析物を含むことが疑われる固体材料を用いることもできる。試験試料は、生物学的供給源から得たまま直接用いることもでき、試料の特性を修正するために予備処理を行った後に用いることもできる。例えば、このような予備処理には、血液から血漿を調製すること、粘稠な流体を希釈すること等を含むことができる。また、予備処理の方法には、濾過、沈殿、希釈、蒸留、混合、濃縮、干渉成分の不活化、試薬付加、溶解等を含むこともできる。更に、固体試験試料を改質して液体媒体を形成するか、分析物を放出させることが有利になる場合がある。
【0009】
詳細な説明
本発明の種々の実施形態を以下に詳細に説明し、その1つ又はそれ以上の例を以下に記載することにする。各例は、本発明の説明のために挙げたものであり、本発明を限定するものではない。実際に、本発明には、本発明の範囲又は精神から逸脱することなく種々の変更形態及び変形形態を作ることができることは当業者には明らかであると考える。例えば、実施形態の1つの一部として図示又は記載した特徴を別の実施形態に用いて、更に別の実施形態を生成することができる。従って、本発明は、添付の請求項及びその均等物の範囲に含まれるものとしてこのような変更形態及び変形形態を含むことを意図するものである。
【0010】
一般に、本発明は、グルコース、ガラクトース、モノアミン、Lアミノ酸、アルコール、キサンチン、コレステロール、ラクテート、尿酸、トリグリセリド、クレアチニンキナーゼ、クレアチニン、又はサルコシンのような分析物を酵素触媒酸化することにより放出される過酸化水素の存在を検出するように構成された診断試験キットに関する。酸化反応を触媒するのに種々の酵素の何れを用いることもでき、これには、例えば、ガラクトース酸化酵素、グルコース酸化酵素、コレステロール酸化酵素、アミン酸化酵素、種々のアミノ酸酸化酵素、ポリフェノール酸化酵素、キサンチン酸化酵素、及びウリカーゼ等のような酸化酵素や、アルコール脱水素酵素、乳酸脱水素酵素、リンゴ酸脱水素酵素、グリセルアルデヒド−3−リン酸脱水素酵素、グリセロール脱水素酵素、及びグルコース−6−リン酸脱水素酵素等のような脱水素酵素、並びに、リポタンパク質リパーゼ及びホスホリパーゼ等のようなリパーゼや、コレステロールエステラーゼ及びコリンエステラーゼ等のようなエステラーゼが含まれる。例えば、グルコースは、グルコース酸化酵素を存在させて酸化し、グルコン酸及び過酸化水素を生じることができる。酵素は、単独で用いることもでき、生物学的分子又は特定の結合対の一員に対する接合体として用いることもできる。
【0011】
酵素触媒反応が起こる様式とは関係なく、過酸化水素は、分析物が酸化されることにより放出される。放出される過酸化水素の量は、一般に、試験試料中の分析物の量にほぼ比例する。従って、分析物の存在及び濃度は、放出過酸化水素を直接又は間接的に求めることにより求めることができる。更に詳細には、本発明の診断キットは、過酸化水素又は別の酸化剤が存在すると検出可能に色変化することができる色原体を用いる。理論に縛られることは望まないが、色原体の酸化により、吸収極大が、スペクトルの赤色端に向かって変位するか(「深色変位」)、スペクトルの青色端に向かって変位するか(「浅色変位」)の何れかが引き起こされると考えられる。吸収変位により、視覚的又は器具を通して検出可能な色の違いを生じ、試験試料内に過酸化水素が存在することを示す。例えば、試験試料と接触する前には、色原体は、無色とすることもでき、特定の色を有することもできる。しかし、試験試料と接触して分析物が酵素触媒酸化されることにより放出される過酸化水素と反応した後には、色原体は、最初の色と異なる色を示す。このように、色の変化は、試験試料中の分析物(例えば、コレステロール、グルコース等)の存在と容易に相関させることができる。
【0012】
本発明の色原体は、酸化されると検出可能な色の変化を示すことができるロイコ塩基又はその誘導体である。例えば、本発明に用いるのには、アリルメタンロイコ塩基(例えば、ジアリルメタン及びトリアリルメタン)が特に適切な酸化可能色原体である。例えば、トリアリルメタンロイコ塩基は、次の一般構造を有する。
【化1】

式中、R、R’、及びR”は、フェニル、ナフチル、アントラセニル等のような置換及び非置換アリール基から独立に選択される。アリール基は、アミノ、ヒドロキシル、カルボニル、カルボキシル、スルホン酸、アルキル、及び/又は他の公知の官能基のような官能基で置換することができる。このようなトリアリルメタンロイコ塩基の例には、ロイコマラカイトグリーン、パラロザリニンベース、クリスタルバイオレットラクトン、クリスタルバイオレットロイコ、クリスタルバイオレット、CIベーシックバイオレット1、CIベーシックバイオレット2、CIベーシックブルー、CIビクトリアブルー、N−ベンゾイルロイコメチレン等が含まれる。同様に、適切なジアリルメタンロイコ塩基には、4,4’−ビス(ジメチルアミノ)ベンズヒドロール(「ミヒラーヒドロール」としても知られる)、ミヒラーヒドロールロイコベンゾトリアゾール、ミヒラーヒドロールロイコモルホリン、ミヒラーヒドロールロイコベンゼンスルホンアミド等を含むことができる。アリルメタンロイコ塩基に加えて、過酸化水素又は他の酸化剤が存在するときに検出可能な色変化を示すことができる他の色原体は、Bruschiに付与された米国特許第4,089,747号に記載されており、これは、本明細書において引用によりそのまま組み入れられる。
【0013】
特定の実施形態の1つでは、色原体は、ロイコマラカイトグリーン(又はその類似物)であり、これは、一般に無色で、次の構造を有する。
【化2】

【0014】
過酸化水素で酸化されると、ロイコマラカイトグリーンは、マラカイトグリーンカルビノール(溶媒グリーン1)を形成し、これは、次の構造を有する。
【化3】

【0015】
また、ロイコマラカイトグリーンのカルビノール型も無色である。しかし、酸性条件では、ロイコマラカイトグリーンカルビノール型の1つ又はそれ以上の遊離アミノ基がプロトン化されてマラカイトグリーン(アニリングリーン、ベーシックグリーン4、ダイアモンドグリーンB、又はビクトリアグリーンBとしても知られる)を形成することができ、それは、色が緑色で次の構造を有する。
【化4】

【0016】
分析物が酵素触媒酸化されることにより放出される過酸化水素は、上に記載するように、色原体の色変化を直接誘発することができる。しかし、過酸化水素は、特定の色原体に対して比較的低酸化電位を有するため、過酸化物が低濃度(例えば、試験試料の5重量%未満)で放出されるときには、色変化を(例えば可視的に)検出することが困難であることがある。この点に関して、任意的に電子供与体を用い、過酸化水素と反応して色原体に対して過酸化水素より高酸化電位を有する中間化合物を生成することができる。この目的には、種々の公知の電子供与体を用いることができる。実施形態の1つでは、例えば、水溶液中の過剰量のヨウ化物イオン(I-)は、過酸化水素と反応して過酸化水素より酸化電位が遥かに大きいトリヨウ化物イオン(I3-)を形成することができる。イオン性ヨウ化物の例示的な供給源には、ヨウ化水素(HI)及び、アルカリ金属ヨウ化物塩(例えば、ヨウ化カリウム(Kl)、ヨウ化ナトリウム(NaI)、ヨウ化リチウム)、ヨウ化アンモニウム(NH4I)、ヨウ化カルシウム(CaI2)等)のような水溶性ヨウ化物塩が含まれる。他の適切な電子供与体には、チオシアン酸ナトリウム、チオシアン酸カリウム、チオシアン酸アンモニウム、及び他のチオシアン酸塩のようなチオシアン酸イオンの供給源を含むことができる。電子供与体として鉄(II)のような金属を用いることもできる。例えば、フェントン試薬は、鉄(II)及び過酸化水素の反応により形成される溶液である。即ち、鉄(II)は、過酸化水素により酸化されて鉄(III)になり、ヒドロキシルラジカル及びヒドロキシルアニオンを形成する。鉄(III)は、次に、同じ過酸化水素が過酸化物ラジカル及び陽子になることにより還元されて鉄(II)に戻る。得られる試薬は、色原体に対して強い酸化電位を有する。更に別の適切な電子供与体は、Johansenに付与された米国特許出願公開第2002/0119136号に記載されており、これは、本明細書において引用によりそのまま組み入れられる。
【0017】
電子供与体は、強酸化電位の中間化合物を生成することができるが、それにも関わらず、このような化合物の濃度は、場合によっては、色原体に望ましい色変化を生成するのには低すぎることがある。例えば、高濃度のトリヨウ化物イオンは、ヒトの眼に見える色(例えば金茶)になることができる。しかし、濃度が減少すると、色の明瞭さは減少する。従って、中間化合物(例えばトリヨウ化物イオン)に複合化して更に強い色を形成する顕色剤を用いることができる。このような顕色剤の特定の例の1つは、天然デンプン、及びデキストリン化、加水分解、アルキル化、ヒドロキシアルキル化、アセチル化又は断片化デンプンのような修飾誘導体の両方を含むデンプンである。デンプンは、一般に、2つの構造的に区別される多糖類、即ち、両方ともα−D−グルコピラノース単位から成るα−アミロース及びアミロペクチンから形成される。デンプンは、トウモロコシデンプン、小麦デンプン、馬鈴薯デンプン、タピオカデンプン、サゴデンプン、コメデンプン、モチトウモロコシデンプン又は高アミローストウモロコシデンプンのようなあらゆる起源のもの又はその誘導体とすることができる。上に記載するようなヨウ化物供給源とともに用いると、デンプンのα−アミロース部分が取り込まれるかそれに結合し、水溶性であり強い青色を有する線状トリヨウ化物イオン複合体を形成することができる。
【0018】
電子供与体及び/又は顕色剤が望ましく色変化するのを容易にする範囲は、部分的にはその濃度によって決まる。即ち、これらの化合物の1つ又はそれ以上の濃度が大きすぎると、色原体を圧倒して酸化反応を抑制することがある。一方、濃度が低すぎると、酸化電位が望ましい範囲まで高くならないことがある。この点に関して、電子供与体(例えば、ヨウ化物供給源)は、約0.01〜約2000ミリモル(「mM」)、実施形態のいくつかでは約0.1〜約1000mM、実施形態のいくつかでは約1〜約100mM/リットル試験試料の量で用いることができる。同様に、顕色剤(例えばデンプン)は、試験試料の重量に基づき、約0.001〜約10重量%、実施形態のいくつかでは約0.01〜約5重量%、実施形態のいくつかでは約0.1〜約2重量%の量で用いることができる。
【0019】
本発明により望ましい色変化を達成するために、色原体は、媒体のマトリクスを通して実質的に拡散しないように(即ち非拡散的に不動化する)反応媒体に付加される。これにより、使用者は、色原体が酸化されるときに起こる色変化を容易に検出することができるようになる。例えば、色原体を含む溶液は、最初に検出ゾーン内の反応媒体に付加することができる。色原体溶液は、クロマトグラフ媒体を形成するのに用いられる材料に応じて水性及び/又は非水性溶媒を含むものとすることができる。適切な非水性溶媒には、グリコール(例えば、プロピレングリコール、ブチレングリコール、トリエチレングリコール、へキシレングリコール、ポリエチレングリコール、エトキシジグリコール、及びジプロピレングリコール);アルコール(例えば、メタノール、エタノール、n−プロパノール、及びイソプロパノール);トリグリセリド;酢酸エチル;アセトン;トリアセチン;アセトニトリル、テトラヒドラフラン;キシレン;ホルムアルデヒド(例えば、ジメチルホルムアミド);その他を含むことができる。溶液中の溶媒及び色原体の量は、一般に、感受性の望ましいレベルに基づいて種々とすることができる。例えば、実施形態のいくつかでは、色原体は、約0.1〜約100ミリグラム/ミリリットル溶媒、実施形態のいくつかでは約0.5〜約60ミリグラム/ミリリットル溶媒、実施形態のいくつかでは約1〜約40ミリグラム/ミリリットル溶媒の濃度で存在することができる。
【0020】
それに関係なく、溶液は、乾燥して溶媒を除去し、媒体上に残りの色原体を残すことができる。色原体は、一般に、流体の試験試料と接触するまで検出ゾーン内に留まることになる。しかし、色原体は水溶性であるため、これは、特に不動化されなければ通常溶解して試験試料とともに流れる。従って、本発明によれば、色原体は、陰イオン性化合物、即ち、1つ又はそれ以上の陰イオンを含むか溶液中で1つ又はそれ以上のイオンを形成することができる化合物とともに検出ゾーン内に実質的に非拡散的に不動化される。このような陰イオン性化合物は、種々の方法で色原体を容易に不動化することができる。例えば、陰イオン性化合物は、色原体の荷電を促進し、クロマトグラフ媒体の表面に存在する1つ又はそれ以上の官能基とイオン結合を形成することもできる。また、特定の陰イオン性化合物(例えば酸)は、ロイコ塩基又はその誘導体(例えばプロトン化ロイコ塩基)と反応するとき実質的に水不溶性の沈殿物を形成することができる。当然、陰イオン性化合物は、種々の他の利益ももたらすことができる。例えば、少量の色原体は、空気中又は他の酸化環境に過剰に長時間放置されると酸化反応を受ける可能性がある。これにより、「偽陽性」を示すことになる色の変化が起こることがあり、最低でも、分析物の存在を半定量的又は定量的に求める能力に有害な影響を及ぼす可能性がある。陰イオン性化合物は、色原体が不注意に酸化しないように保護し、従って「偽陽性」を減少させることができる。
【0021】
陰イオン性化合物の選択は、色原体の性質及びその濃度を含む各種の因子に左右される。本発明に用いるのに適切な陰イオン性化合物は、例えば、塩酸、硝酸、硫酸、リン酸、ポリリン酸、ホウ酸、ボロン酸等のような無機酸と、アクリル酸、メタクリル酸、マロン酸、コハク酸、サリチル酸、スルホサリチル酸、アジピン酸、マレイン酸、リンゴ酸、オレイン酸、没食子酸、酒石酸、クエン酸、ギ酸、酢酸、グリコール酸、シュウ酸、プロピオン酸、フタル酸、イソフタル酸、グルタル酸、グルコン酸、乳酸、アスパラギン酸、グルタミニン酸、イタコン酸、トリフルオロ酢酸、バルビツール酸、桂皮酸、安息香酸、4−ヒドロキシ安息香酸、アミノ安息香酸等のようなカルボン酸;メタンスルホン酸、ベンゼンスルホン酸、トルエンスルホン酸、トリフルオロメタンスルホン酸、スチレンスルホン酸、ナフタレンジスルホン酸、ヒドロキシベンゼンスルホン酸等のようなスルホン酸;ポリ(アクリル)又はポリ(メタクリル)酸及びそのコポリマー(例えば、マレイン−アクリル、スルホン−アクリル、及びスチレン−アクリルコポリマー)、カラジーン(carageenic)酸、カルボキシメチルセルロース、アルギン酸等のようなポリマー酸;その他を含む有機酸と、を含むことができる。前述の酸の無水物(例えば無水マレイン酸)及び塩も用いることができる。塩は、ナトリウム塩、カリウム塩、カルシウム塩、セシウム塩、亜鉛塩、銅塩、鉄塩、アルミニウム塩、ジルコニウム塩、ランタン塩、イットリウム塩、マグネシウム塩、ストロンチウム塩、セリウム塩)のような金属塩の形とすることもでき、酸をアミン(例えば、アンモニア、トリエチルアミン、トリブチルアミン、ピペラジン、2−メチルピペラジン、ポリアリルアミン)と反応させることにより調製された塩の形とすることもできる。
【0022】
色原体が不動化される程度は、陰イオン性化合物の濃度によって決まる可能性がある。例えば、色原体溶液中の陰イオン性化合物の濃度は、約0.1〜約20ミリモル/リットル(「mM」)、実施形態のいくつかでは約1mM〜約10mM、実施形態のいくつかでは約2mM〜約8mMとすることができる。
【0023】
本発明によれば、試薬(例えば、酵素、過酸化物、電子供与体、顕色剤等)間の望ましい反応時間は、反応が起こる媒体を選択的に制御することにより達成することができる。即ち、反応媒体は、性質がクロマトグラフ的であるため、過酸化水素及び/又は他の試薬が一貫した制御可能な方式で側方に流れることができる。媒体を通って側方に流れる間に、過酸化水素は、分析のための個別の検出ゾーン内に含まれる色原体を酸化する。流体流れが制御されるという性質のため、あらゆる未反応試薬は、検出ゾーン内の色原体を観察するのに有害な影響を及ぼすことができないように、反応媒体の端部まで進行する。
【0024】
この点に関して、図1は、本発明により分析物の存在を検出するための横流装置20の特定の実施形態の1つを示す。図示するように、横流装置20は、任意的に硬質支持材料21で支持されるクロマトグラフ媒体23を含む。クロマトグラフ媒体23は、試験試料が通過することができる種々の材料の何れで作ることもできる。例えば、クロマトグラフ媒体23は、多糖類(例えば、紙のようなセルロース材料及び酢酸セルロース及びニトロセルロースのようなセルロース誘導体);ポリエーテルスルホン;ポリエチレン;ナイロン;ポリフッ化ビニリデン(PVDF);ポリエステル;ポリプロピレン;シリカ;不活性化アルミナ、珪藻土、MgSO4、又は、塩化ビニル、塩化ビニル−プロピレンコポリマー、及び塩化ビニル−酢酸ビニルコポリマーのような多孔性ポリマーマトリクスに均質に分散された他の無機の微粉化材料のような無機材料;天然由来布(例えば綿)及び合成布(例えばナイロン又はレーヨン)の両方の布;シリカゲル、アガロース、デキストラン、及びゼラチンのような多孔性ゲル;ポリアクリルアミドのようなポリマーフィルム;その他、のような合成又は天然由来材料で形成された多孔性膜とすることができる。特定の実施形態の1つでは、クロマトグラフ媒体23は、ニトロセルロース及び/又はポリエーテルスルホン材料で形成される。「ニトロセルロース」という用語は、ニトロセルロース単独とすることもでき、1〜7の炭素原子を有する脂肪族カルボン酸のような硝酸及び他の酸の混合エステルとすることもできるセルロースの硝酸エステルをいうことは当然理解される。
【0025】
クロマトグラフ媒体23の大きさ及び形状は、当業者には容易に理解されるように、一般に種々異なるものとすることができる。例えば、多孔性膜ストリップの長さは、約10〜約100ミリメートル、実施形態のいくつかでは約20〜約80ミリメートル、実施形態のいくつかでは約40〜約60ミリメートルとすることができる。また、膜ストリップの幅は、約0.5〜約20ミリメートル、実施形態のいくつかでは約1〜約15ミリメートル、実施形態のいくつかでは約2〜約10ミリメートルの範囲とすることができる。同様に、膜ストリップの厚さは、一般に、透過に基づく検出を可能にするのに十分に小さい。例えば、膜ストリップの厚さは、約500マイクロメートル未満、実施形態のいくつかでは約250マイクロメートル未満、実施形態のいくつかでは約150マイクロメートル未満とすることができる。
【0026】
上に述べたように、支持部21は、クロマトグラフ媒体23を支持する。例えば、支持部21は、図1に示すようにクロマトグラフ媒体23に直接隣接して位置決めすることもでき、クロマトグラフ媒体23と支持部21との間に1つ又はそれ以上の介在層を位置決めすることもできる。それと関係なく、支持部21は、一般に、クロマトグラフ媒体23を支持することができるあらゆる材料で形成することができる。支持部21は、透明又は光学的拡散性(例えば拡散透光性)材料のような光に透過性の材料で形成することができる。また、一般に、支持部21は、媒体23を通って流れる流体が支持部21を通って漏れないように液体不透過性であることが望ましい。支持部に適切な材料の例には、限定ではないが、ガラス;ポリスチレン、ポリプロピレン、ポリエステル(例えばMylar(登録商標)フィルム)、ポリブタジエン、ポリ塩化ビニル、ポリアミド、ポリカーボネート、エポキシド、メタクリレート、及びポリメラミンのようなポリマー材料;その他が含まれる。クロマトグラフ媒体23に十分な構造的裏打ちを設けるために、支持部21は、一般に、特定の最小厚さを有するように選択される。同様に、支持部21の厚さは、典型的には、その光学的特性に有害な影響を及ぼすほど厚くない。従って、例えば、支持部21の厚さは、約100〜約5,000マイクロメートル、実施形態のいくつかでは約150〜約2,000マイクロメートル、実施形態のいくつかでは約250〜約1,000マイクロメートルの範囲とすることができる。例えば、適切な膜ストリップの1つは、厚さが約125マイクロメートルであり、マサチューセッツ州ベッドフォードのMillipore Corp.から「SHF180UB25」という名称で入手することができる。
【0027】
当技術分野では公知のように、クロマトグラフ媒体23は、支持部21上に流し込み、得られるラミネートを望ましい大きさ及び形状にダイカットすることができる。或いは、クロマトグラフ媒体23は、単純に、例えば接着剤で支持部21にラミネートすることができる。実施形態のいくつかでは、ニトロセルロース又はナイロン多孔性膜がMylar(登録商標)フィルムに接着される。感圧接着剤のような接着剤を用いて多孔性膜をMylar(登録商標)フィルムに結合する。この種類のラミネート構造は、マサチューセッツ州ベッドフォードのMillipore Corp.から市販されていると考えられている。適切なラミネート装置構造の更に別の例は、Durley,IIIらに付与された米国特許第5,075,077号に記載されており、これは、本明細書において引用によりそのまま組み入れられる。
【0028】
また、装置20は、媒体23に隣接して配置される吸収性材料28も含むことができる。吸収性材料28は、毛管作用及び媒体23を通る流体の流れを促進するのに役立つ。また、吸収性材料28は、クロマトグラフ媒体23全体を通して移行する流体を受け取り、従って、検出領域からあらゆる未反応化合物を引き離す。本発明に用いることができる適切な吸収性材料のいくつかには、限定する意味ではないが、ニトロセルロース、セルロース材料、多孔性ポリエチレンパッド、ガラス繊維濾紙等が含まれる。吸収性材料は、装置に組み入れる前に湿潤していても乾燥していてもよい。予備的な湿潤は、ある流体に対しては毛管流を促進するが、典型的には必要とされない。また、当技術分野では公知のように、吸収性材料は、界面活性剤で処理して吸い上げ工程を補助することができる。
【0029】
アッセイを開始するために、使用者は、試験試料をクロマトグラフ媒体23の一部に直接付加することができ、これによって、試験試料は、該クロマトグラフ媒体23を通って図1に矢印「L」で示す方向に進行することができる。或いは、試験試料は、最初に、クロマトグラフ媒体23と流体的に連通する試料付加ゾーン24に付加することもできる。試料付加ゾーン24は、媒体23上に形成することができる。或いは、図1に示すように、試料付加ゾーン24は、パッドのような別個の材料で形成することもできる。このような試料パッドを形成するのに用いることができる適切な材料のいくつかには、限定ではないが、ニトロセルロース、セルロース、多孔性ポリエチレンパッド、及びガラス繊維濾紙が含まれる。望むならば、試料付加ゾーン24は、拡散的又は非拡散的の何れかで取り付けられた1つ又はそれ以上の前処理試薬を含むこともできる。
【0030】
上に記載した方法で分析物を検出するのを容易にするために、酵素、電子供与体、顕色剤等のような種々の試薬が用いられる。実施形態のいくつかでは、装置20に付加する前に1つ又はそれ以上の試薬を試験試料と混合することができる。例えば、試験試料は、酵素とともに特定の期間培養することができる。酵素触媒反応の培養時間は、問題とする酵素活性によって決まり、それは、部分的に、温度、pH、基質濃度、阻害剤(競合的(酵素に結合)、不競合的(酵素−基質複合体に結合)、又は非競合的(酵素及び/又は酵素−基質複合体に結合))の存在等によってきまることは当業者には容易に理解される。これらの因子は、培養時間を増大又は減少させるために望む通りに選択的に制御することができる。例えば、培養時間は、約1分より長くすることができ、実施形態のいくつかでは約5〜約50分、実施形態のいくつかでは約10〜約25分とすることができる。同様に、pHは、酵素活性を促進するために選択的に制御することができる。例えば、試験試料内に高レベルの基本物質(例えばアミン)が存在すれば、pHは、ある酵素活性を最適にするには高すぎ、例えば8より高いpHになる可能性がある。詳細には、酵素は、pHレベル約3〜約8、実施形態のいくつかでは約4〜約7で最適活性を有することができる。従って、望むならば、緩衝液又は他のpH変更化合物を用いて、望ましいpHを維持することができる。望ましいpHを維持するのに用いることができる生物学的適合性がある緩衝液のいくつかには、ホウ酸緩衝液、リン酸緩衝生理食塩水(PBS)、2−(N−モルホリノ)エタンスルホン酸(「MES」)、トリスヒドロキシメチルアミノメタン(「Tris」)、クエン酸緩衝液等が含まれる。
【0031】
培養後、試験試料内に存在するあらゆる酵素は、典型的には分析物を酸化して過酸化水素を放出することになる。次に、過酸化物を含む試験試料をアッセイ装置20に付加することができる。或いは、試験試料を付加する前に、酵素及び/又は他の試薬を装置20に拡散的に不動化することができる。このような事前付加により、次の使用者が試薬を取り扱い、試験試料又は希釈剤と混合する必要が無くなることを含む種々の利益が得られる。これは、使用者が一般に訓練された実験技術者又は医療従事者でない場合にケアを行うという点で特に有用である。(各)試薬は、試料付加ゾーン24、その上流、又は下流に配置することができる。このように、試験試料は、付加するときに分析物と混合することができる。試験試料を付加する点より下流に配置される場合には、試験試料は、付加するときに試薬と混合して溶解又は再懸濁することができる。
【0032】
図示する実施形態では、例えば、試料付加ゾーン24と流体的に連絡する試薬ゾーン22が用いられる。図1に示すように、試薬ゾーン22は、別個の材料又はパッドで形成される。このような試薬パッドは、ガラス繊維のような試験試料がそれを通過することができるあらゆる材料で形成することができる。或いは、試薬ゾーン22は、単純に、媒体23上に形成することができる。それに関係なく、試薬ゾーン22には、酵素、電子供与体、顕色剤等のような試薬を含む1つ又はそれ以上の溶液を付加し、乾燥することができる。従って、試験試料は、試薬ゾーン22の下流に位置する上に記載した被酸化性色原体を不動化した検出ゾーン31に到達する前に、試薬ゾーン22に接触して過酸化水素又は他の中間化合物を生成することができる。
【0033】
本発明の横流装置の利点の1つは、分析物検出を容易にするための1つ又はそれ以上の付加的なゾーンを容易に組み入れることができる能力である。例えば、図1を再び参照すると、横流装置20には、検出の正確さを向上させるために、対照ゾーン32も用いることができる。対照ゾーン32は、使用者に、試験が適切に行われているという信号を与える。更に詳細には、十分な量の試験試料と接触するとクロマトグラフ媒体23を通って流れる対照試薬を用いることができる。すると、これらの対照試薬は、視覚的に又は器具を用いての何れかで対照ゾーン32内に観察することができる。対照試薬は、一般に、ルミネセンス化合物(例えば、蛍光、りん光等);放射性化合物;可視化合物(例えば、着色染料又は金のような金属物質);信号生成物質を含むリポソーム又は他の小胞;酵素及び/又は基質等のような検出可能物質を含む。他の適切な検出可能物質は、Jouらに付与された米国特許第5,670,381号及びTarchaらに付与された第5,252,459号に記載されており、これらは、本明細書において引用によりそのまま組み入れられる。
【0034】
望むならば、検出可能物質は、粒子(時に「ビーズ」又は「マイクロビーズ」という)上に配置することができる。とりわけ、粒子は、検出可能物質がクロマトグラフ媒体を通って進行する能力を高める。例えば、核、マイコプラズマ、プラスミド、プラスチド、哺乳類細胞(例えば、赤血球ゴースト)、単細胞微生物(例えば細菌)、多糖類(例えばアガロース)等のような天然由来の粒子を用いることができる。更に、合成粒子を用いることもできる。例えば、実施形態の1つでは、蛍光又は着色染料でラベルされたラテックス微小粒子を用いる。本発明には合成粒子のいずれを用いることもできるが、粒子は、典型的には、ポリスチレン、ブタジエンスチレン、スチレンアクリル−ビニルターポリマー、ポリメチルメタクリレート、ポリエチルメタクリレート、スチレン−無水マレイン酸コポリマー、ポリ酢酸ビニル、ポリビニルピリジン、ポリジビニルベンゼン、ポリブチレンテレフタレート、アクリロニトリル、塩化ビニル−アクリレート等、又はそのアルデヒド、カルボキシル、アミノ、ヒドロキシル、又はヒドラジド誘導体で形成される。用いる場合には、粒子の形状は、一般に種々異なるものとすることができる。例えば、特定の実施形態の1つでは、粒子は、球状の形状である。しかし、本発明では、プレート、ロッド、ディスク、バー、管、不規則な形状等のような他の形状も意図されることは当然理解される。また、粒子の大きさも種々とすることができる。例えば、粒子の平均の大きさ(例えば直径)は、約0.1ナノメートル〜約1,000ミクロン、実施形態のいくつかでは約0.1ナノメートル〜約100ミクロン、実施形態のいくつかでは約1ナノメートル〜約10ミクロンの範囲とすることができる。適切な粒子の市販の例には、Molecular Probes,Inc.により商品名「FluoSphere」(Red 580/605)及び「TransfluoSphere」(543/620)で販売される蛍光カルボキシル化マイクロスフィアのほか、これもMolecular Probes,Inc.から販売される「Texas Red」及び5−及び6−カルボキシテトラメチルローダミンが含まれる。また、適切な着色ラテックス微小粒子の市販の例には、Bang’s Laboratory,Inc.から販売されるカルボキシル化ラテックスビーズが含まれる。
【0035】
対照ゾーン32の位置は、行う試験の性質に基づき、種々変えることができる。図示する実施形態では、例えば、対照ゾーン32は、クロマトグラフ媒体23により定められ、検出ゾーン31の下流に位置決めされる。このような実施形態では、対照ゾーン32は、非拡散的に不動化され、対照試薬と化学的及び/又は物理的結合を形成する材料を含むことができる。例えば、対照試薬がラテックス粒子を含む場合には、対照ゾーン32は、粒子に結合する多価電解質を含むことができる。種々の多価電解質結合システムは、例えば、Songらに付与された米国特許出願公開番号第2003/0124739号に記載されており、これは、本明細書において引用によりそのまま組み入れられる。しかし、別の実施形態では、対照ゾーン32は、単純に、対照試薬がクロマトグラフ媒体23を通って移動した後に流れつく吸収性材料28の領域により定めることができる。
【0036】
選択した特定の制御技術に関係なく、十分な量の試験試料を装置20に付加すると、対照ゾーン32内で、分析物が存在するかどうかの信号が形成されることになる。このような対照ゾーンにより得られる利点には、注意深い測定又は計算を必要とすることなく、十分な量の試験試料が加えられたことを使用者に知らせることが含まれる。これにより、反応時間、試験試料容量等を外部から制御することを必要とせずに横流装置20を用いることができるようになる。
【0037】
試料付加ゾーン24、試薬ゾーン22、検出ゾーン31、対照ゾーン32、及び横流装置20に用いられるあらゆる他のゾーンは、一般に、あらゆる数の個別検出領域を設け、使用者が試験試料内の酵素の濃度をうまく求めることができるようにする。各領域は、同じ又は異なる材料を含むことができる。例えば、ゾーンは、2つ又はそれ以上の個別領域(例えば、線、ドット等)を含むことができる。領域は、試験試料が装置20を通って流れる方向に実質的に垂直な方向の線の形で配置することができる。同様に、実施形態のいくつかでは、領域は、装置20を通って試験試料が流れる方向に実質的に平行な方向の線の形で配置することができる。
【0038】
図1の装置20を用いて試験試料内のグルコースの存在を検出するための方法の特定の実施形態の1つをこれから更に詳細に記載することにする。最初に、グルコースを含む試験試料を試料付加ゾーン24に付加し、「L」方向に試薬ゾーン22まで進行させる。試薬ゾーン22で、グルコースがグルコース酸化酵素と混合して触媒反応を開始し、過酸化水素を生成する。すると、過酸化水素は、試薬ゾーン22に含まれるヨウ化物イオンと反応して高酸化電位の中間化合物を生成する。任意的に、試薬ゾーン22に顕色剤(例えばデンプン)を用いて得られる色変化を増強することができる。試薬ゾーン22に存在する間又は混合物が装置20を通って流れるときに望ましい反応が起こる可能性がある。これに関係なく、酸化的中間化合物を含む試験試料は、最終的に、検出ゾーン31まで流れ、そこで、陰イオン性化合物が存在するときには色原体と反応する。
【0039】
この反応後、色原体は色を変化させる。色原体が色を変化させる程度は、視覚的又は器具を用いて求めることができる。実施形態の1つでは、色強度は、光学式読取装置で測定する。光学式読取装置の実際の構成及び構造は、当業者には容易に理解されるように、一般に種々とすることができる。典型的には、光学式読取装置は、電磁放射を放出することができる照射源と、信号(例えば透過又は反射光)を記録することができる検出器と、を含む。照射源は、可視又は近可視領域の光(例えば赤外又は紫外光)のような電磁放射を生成することができる当技術分野で公知のあらゆる装置とすることができる。例えば、本発明で用いることができる適切な照射源には、限定する意味ではないが、発光ダイオード(LED)、閃光ランプ、冷陰極蛍光ランプ、エレクトロルミネセントランプ等が含まれる。照明は、多重化することもでき及び/又はコリメートすることもできる。場合によっては、照明は、パルス化してあらゆる背景干渉を減少させることができる。更に、照明は、連続とすることもでき、又は連続波(CW)とパルス化照明を組み合わせ、複数の照明ビームを多重化させ(例えば、パルス化ビームとCWビームを多重化させ)て、CW供給源により生成される信号と、パルス化供給源により生成される信号との間を区別することができるようにすることもできる。例えば、実施形態のいくつかでは、LED(例えば、砒化アルミニウムガリウム赤色ダイオード、リン化ガリウム緑色ダイオード、砒化リン化ガリウム緑色ダイオード、又は窒化インジウムガリウム紫/青/紫外線(UV)ダイオード)が、パルス化照明源として用いられる。本発明に用いるのに適する適切なUV LED励起ダイオードの市販の例の1つは、型番NSHU55OE(Nichia Corporation)であり、これは、750〜1000マイクロワットの光パワーを順方向電流10ミリアンペア(3.5〜3.9ボルト)で半値全幅10度、ピーク波長370〜375ナノメートル、スペクトル半値幅12ナノメートルのビームにして放出する。
【0040】
場合によっては、照明源は、色原体に拡散照明を与えるものとすることができる。例えば、複数の点光源(例えばLED)列を単純に用いて比較的拡散性の照明を与えることができる。比較的安価な方式で拡散照明を与えることができる別の特に望ましい照明源は、エレクトロルミネセント(EL)装置である。EL装置は、一般に、その少なくとも1つが透明で光を逃がすことができる電極間に挟まれたルミネセント材料(例えばりん光体粒子)を用いるキャパシタ構造である。電極間に電圧を付加すると、ルミネセント材料内に発光を引き起こす変動電場が生じる。
【0041】
検出器は、一般に、信号を検知することができる当技術分野で公知のあらゆる装置とすることができる。例えば、検出器は、空間識別するように構成された電子撮像検出器とすることができる。このような電子撮像センサの例のいくつかには、高速線状電荷結合装置(CCD)、電化注入装置(CID)、相補的金属酸化物半導体(CMOS)装置等が含まれる。このような画像検出装置は、一般に、2次元アレイの電子光センサとされるが、単一の線の検出器ピクセル又は光センサ、例えば画像を走査するのに用いるようなものを含む線状撮像検出装置(例えば、線状CCD検出装置)を用いることもできる。各アレイは、「アドレス」と呼ばれることもある既知の一意的位置の組を含む。画像検出器の各アドレスは、領域(例えば、典型的には箱又は長方形として形作られた領域)を覆うセンサにより占有される。この領域は、一般に、「ピクセル」又はピクセル領域と呼ばれる。例えば、検出器ピクセルは、CCD、CID、又はCMOSセンサ、又は光を検出又は測定するあらゆる他の装置又はセンサとすることができる。検出器ピクセルの大きさは、大幅に変動させることができ、場合によっては直径又は長さは、0.2マイクロメートル程の小ささとすることができる。
【0042】
他の実施形態では、検出器は、空間識別能力に欠ける光センサとすることができる。例えば、このような光センサの例には、光電子倍増装置、アバランシェフォトダイオード又はシリコンフォトダイオードのようなフォトダイオード、その他を含むことができる。シリコンフォトダイオードは、安価で感受性があり、高速作業が可能で(立ち上がり時間が短い/処理能力が高い)、殆どの他の半導体技術及びモノリシック回路に容易に組み込むことができるという点で時に有利である。また、シリコンフォトダイオードは、物理的に小さく、そのため、種々の種類の検出システムに容易に組み込むことができる。シリコンフォトダイオードを用いる場合には、放出信号の波長の範囲は、感受性の範囲内とすることができ、これは、400〜1100ナノメートルである。
【0043】
光学式読取装置は、一般に、例えば、ルミネセンス(例えば、蛍光、りん光等)、吸収(例えば、蛍光又は非蛍光)、回折等を含むあらゆる公知の検出技術を用いることができる。本発明の特定の実施形態の1つでは、光学式読取装置は、吸収の関数として色強度を測定する。実施形態の1つでは、吸収読み取り値は、バージニア州のシャンティイ―のDynex Technologiesから入手されるマイクロプレート読み取り装置(型番MRX)を用いて測定する。別の実施形態では、吸収読み取り値は、F.Costによる「デジタル印刷のポケットガイド」、ニューヨーク州アルバニーのDelmar Publishers、ISBN 0−8273−7592−1の144及び145頁で論じられる「CIELAB」として知られる従来の試験を用いて読み取る。この方法は、反対色知覚説に基づき、知覚した色の3つの特徴に対応する3つの変数、L*、a*、及びb*を定める。3つの変数は、次の意味を有する。
L*=明度(又は光度)で、0〜100の範囲であり、0=暗、100=明である。
a*=赤/緑軸で、ほぼ−100〜100の範囲であり、正の値は赤色を帯びており、負の値は緑色を帯びている。
b*=黄/青軸で、ほぼ−100〜100の範囲であり、正の値は黄色を帯びており負の値は青色を帯びている。
【0044】
CIELAB色空間は、幾分視覚的に均質であるため、ヒトが知覚できる2つの色の間の差を表す単一の数を計算することができる。この差は、ΔEと呼ばれ、2つの色間で3つの差(ΔL*、Δa*、Δb*)の平方の合計の平方根をとることにより計算される。CIELAB色空間では、各ΔE単位は、2つの色間の「辛うじて認知可能」な差にほぼ等しい。従って、CIELABは、カラー管理及び色変化表現のための基準色空間として用いることができる客観的な装置独立表色システムの良好な尺度である。従って、この試験を用いて、色強度(L*、a*、b*)は、例えば、日本国大阪のMinolta Co.Ltd.の手持ち型分光光度計(型番CM2600d)を用いて測定することができる。この機器は、CIE第15号ISO 7724/1、ASTME1164及びJIS Z8722−1982(拡散照明/8度目視システムに一致するD/8ジオメトリを用いる。試料片表面の垂線に8度の角度で試料片表面に反射されるD65光は、試料片−測定光学システムにより受け取られる。更に別の適切な光学式読取装置は、Kaylorらに付与された米国特許出願公開番号第2003/0119202号に記載される反射分光光度計であり、この特許出願は、本明細書において引用によりそのまま組み入れられる。同様に、本発明には、透過モード検出システムを用いることもできる。
【0045】
望むならば、検出ゾーン31での色強度を測定し、試験試料に存在する分析物のレベルを定量的又は半定量的に求めることができる。検出ゾーン31での色強度は、典型的には、過酸化水素及び分析物濃度に正比例する。また、検出ゾーン31で生成される検出信号の強度「Is」は、複数の既知の分析物濃度に対して生成した予め決定した検出曲線に比較することもできる。未知の試験試料中の分析物の分量を求めるために、信号は、単純に、検出曲線に従って分析物濃度に変換することができる。これと関係なく、分析物及びあらゆる未反応試薬は、次に、吸収性材料28に到達するまで検出ゾーン31を過ぎて進行する。場合によっては、試薬は、空中である期間にわたって酸化され、着色化合物を形成することになる。しかし、このような着色化合物は、検出領域31に配置されるため、一般に、検出の正確さを損なわない。
【0046】
本発明は、試験試料中の特定の分析物(例えばグルコース)の存在を正確に検出するための比較的簡単で小型であり、費用効率のよい装置を提供する。試験結果は、可視的とすることができるため、試験を行う人に、素早く、高度に信頼可能で一貫する試験結果が導かれる試験条件下で容易に観察される。また、試験は迅速であり、比較的短い期間で検出することができる。例えば、色原体は、約30分未満、実施形態のいくつかでは約10分未満、実施形態のいくつかでは約5分未満、実施形態のいくつかでは約3分未満、実施形態のいくつかでは約1分未満、実施形態のいくつかでは約30秒未満で検出可能に色が変化することができる。このように、色原体は、分析物の存在又は不在を「実時間」で示すことができる。
本発明は、次の実施例を参照すると更に良好に理解することができる。
【実施例1】
【0047】
ロイコマラカイトグリーン(「LMG」)のHCl酸性化水(20ミリグラム/ミリリットル)溶液を作った。得られる溶液は、恐らくは材料が僅かに大気酸化されたことによる極めて薄い緑色であった。ガラス毛管を用いて少量の溶液をニトロセルロース膜/ハーフスティック(half−stick)横流型アッセイに配置した。装置は、次に、新しく作ったヨウ化カリウム及び過酸化水素の濃縮溶液に入れた。KI/過酸化物溶液は、直ちに黄色に変わり(I2の生成による)、溶液が膜に吸い上げられると、膜のロイコマラカイトグリーンが急速に鮮やかなエメラルドグリーン色に変わった。しかし、新しく形成された緑色材料は、水溶液とともに膜の上方に移動した。
【実施例2】
【0048】
高度に置換された中等度分子量のカルボキシメチルセルロース(「CMC」)の希釈水溶液を作った。溶液をマラカイトグリーンの酸性溶液に加えても、沈殿物は見られなかった。理論に縛られることは意図しないが、沈殿物ができないのは、ポリマーに他のカルボキシル基が存在し、染料/CMC沈殿物が可溶性のままであるためである可能性がある。次に、例1に記載するように、染料溶液を試験ストリップに加えた。染料の捕捉は見られなかった。
【実施例3】
【0049】
オレイン酸ナトリウムの希釈水溶液を作った。溶液をマラカイトグリーンの酸性溶液に加えても、沈殿物は見られなかった。
【実施例4】
【0050】
5−スルホサリチル酸二水和物(5−SSA)の希釈水溶液を作った。溶液をマラカイトグリーンの酸性溶液に加えると、沈殿物が観察された。「密接なイオン対」を更に試験するために、少量(ほぼ20マイクロリットル)のロイコマラカイトグリーンの酸性溶液(20ミリグラム/ミリリットル)を濃縮5−SSA溶液に加えた。得られる溶液は、例1に記載するように、ガラス毛管を介してニトロセルロース横流型ストリップに付加した。付加スポットは、急速に鮮やかな緑色になり、膜の定位置に留まった。
【実施例5】
【0051】
試験は、ロイコマラカイトグリーンの代わりにロイコクリスタルバイオレットを用いたことを除き実施例4に記載した通りに行った。試験すると、付加スポットは、極めて薄い赤みを帯びた色から紫に変化し、膜のその場所に留まった。
【実施例6】
【0052】
過酸化物に対する感受性のほか、必要なKI濃度を実際に示す実験を行った。詳細にノベルと、3モルの5−スルホサリチル酸及び0.5ミリモルロイコマラカイトグリーンの溶液の1マイクロリットルの液滴をニトロセルロース膜(Millipore部品番号CFSP 203000)に付加して乾燥させた。96穴プレートの4つのウェルを190マイクロリットルの1.0モルヨウ化カリウムで満たした。各ウェルに0.0重量%(対照)、0.003重量%、0.03重量%、及び0.3重量%の範囲の過酸化水素溶液を10マイクロリットル加えた。次に、ハーフスティック膜をそれぞれのウェルに配置した。対照ストリップは、僅かに緑色のスポットを生成するが、これは、大気条件で空気中でヨウ化カリウムが酸化されるためであると考えられている。残りの試験ストリップの各々に生じる色は、酸化カリウムが存在することにより過酸化物が活性化されたことを示すものであった。
【実施例7】
【0053】
例6に記載するように、ロイコマラカイトグリーンの酸性溶液(0.5ミリモルロイコマラカイトグリーン(「LMG」)及び2.0モル硫酸を用いる)をニトロセルロース膜に付加した。スポットは完全には乾燥していなかったが、得られる材料は、定位置に保持されていた。
【実施例8】
【0054】
飽和硫酸ナトリウム及び0.5ミリモルロイコマラカイトグリーン(「LMG」)から溶液を作り、例6に記載するようにニトロセルロース膜に付加した。溶液は、180マイクロリットルの0.1モルヨウ化カリウム及び20マイクロリットルの3重量%過酸化物を用いて生成した。染料は定位置に留まるが、容易には膜を濡らさなかった。
【実施例9】
【0055】
ニトロセルロース膜に濃縮HCl(37重量%)に溶解し、9:1比に希釈したロイコマラカイトグリーン(「LMG」)溶液20mg/mLでスポットをつけた。その後、この溶液8.2マイクロリットルを水で1ミリリットルまで希釈し、毛管で膜に付加した。スポットは膜に固定されたままであるが、膜を濡らすのは幾分困難であった。あらゆる濡れの問題は、溶液を比率9:1まで更に希釈することにより解決した。
【実施例10】
【0056】
10mg/mLロイコマラカイトグリーン(「LMG」)溶液を濃縮HCl(37重量%)に溶解し、9:1比に希釈した。この溶液8.2マイクロリットルを水で1ミリリットルまで希釈し、毛管でニトロセルロース膜に付加した。過酸化物/KIの組み合わせに暴露されるとき、いくつかの試料中の溶媒は、膜を容易には通過しなかった。
【実施例11】
【0057】
10mg/mLロイコマラカイトグリーン(「LMG」)溶液を濃縮HCl(1重量%)に溶解し、9:1比に希釈した。この溶液16.4マイクロリットルを水で1ミリリットルまで希釈し、滅菌濾過した。次に、溶液をBioMec噴霧器でニトロセルロース膜に付加し、膜を横切る連続線を形成した。溶液は、1マイクロリットル/センチメートル及び2マイクロリットル/センチメートルの比率で膜に噴霧した。両方の縞模様の膜で、LMGの移動は示されなかった。希釈試験を行い、過酸化物濃度に対するこのアッセイの感受性を求めた。全ての試験は、0.1モルヨウ化カリウム、及び膜に噴霧したLMGの量に応じて総量150又は50マイクロリットルを用いて行った。試験では、過酸化水素の存在は、極めて少量(例えばピコモル)で求めた。
【0058】
本発明は、その特定の実施形態に関して詳細に記載したが、当業者は、前述の事項を理解すれば、これらの実施形態の変更形態、変形形態、及び均等物を容易に気づくことができることは理解されると考える。従って、本発明の範囲は、添付の請求項及びそのあらゆる均等物の範囲であると判断される。
【符号の説明】
【0059】
20 横流装置
21 硬質支持材料
22 試薬ゾーン
23 クロマトグラフ媒体
24 試料付加ゾーン
28 吸収性材料
31 検出ゾーン
32 対照ゾーン
【特許請求の範囲】
【請求項1】
分析物を酵素触媒酸化することにより放出される過酸化水素を検出するための診断試験キットであって、前記試験キットが、クロマトグラフ媒体を含む横流装置を含み、前記クロマトグラフ媒体は、色原体が陰イオン性化合物とともに実質的に非拡散的に不動化される検出ゾーンを定め、前記色原体が、酸化されると検出可能な色の変化を生じることができるロイコ塩基又はその誘導体であることを特徴とする診断試験キット。
【請求項2】
前記色原体が、トリアリールメタンであることを特徴とする請求項1に記載の診断試験キット。
【請求項3】
前記色原体が、ロイコマラカイトグリーン、パラロザニリンベース、クリスタルバイオレットラクトン、クリスタルバイオレットロイコ、クリスタルバイオレット、CIベーシックバイオレット1、CIベーシックバイオレット2、CIベーシックブルー、CIビクトリアブルー、N−ベンゾイルロイコメチレン、及びその誘導体から成る群から選択されることを特徴とする請求項2に記載の診断試験キット。
【請求項4】
前記色原体が、ロイコマラカイトグリーン又はその誘導体であることを特徴とする請求項2に記載の診断試験キット。
【請求項5】
前記色原体が、ジアリルメタンであることを特徴とする請求項1に記載の診断試験キット。
【請求項6】
前記過酸化水素と反応し、前記色原体を酸化するように構成された中間化合物を形成することができる電子供与体を更に含むことを特徴とする請求項1〜請求項5の何れか1項に記載の前記診断試験キット。
【請求項7】
前記電子供与体が、ヨウ化物イオン供給源であることを特徴とする請求項6に記載の診断試験キット。
【請求項8】
前記ヨウ化物イオンの供給源が、アルカリ金属ヨウ化物塩であることを特徴とする請求項7に記載の診断試験キット。
【請求項9】
前記電子供与体が、金属であることを特徴とする請求項6に記載の診断試験キット。
【請求項10】
前記電子供与体と複合化することができる顕色剤を更に含むことを特徴とする請求項6に記載の診断試験キット。
【請求項11】
前記顕色剤が、デンプンであることを特徴とする請求項10に記載の診断試験キット。
【請求項12】
前記色原体が、酸化されると沈殿することを特徴とする請求項1〜請求項11の何れか1項に記載の診断試験キット。
【請求項13】
前記陰イオン性化合物が、酸、酸無水物、酸の塩、又はその組み合わせであることを特徴とする請求項1〜請求項12の何れか1項に記載の診断試験キット。
【請求項14】
前記陰イオン性化合物が、無機酸であることを特徴とする請求項13に記載の診断試験キット。
【請求項15】
前記クロマトグラフ媒体を通って流れた後に前記試験試料を受け取る吸収性材料を更に含むことを特徴とする請求項1〜請求項14の何れか1項に記載の診断試験キット。
【請求項16】
前記クロマトグラフ媒体が、多孔性膜であることを特徴とする請求項1〜請求項15の何れか1項に記載の診断試験キット。
【請求項17】
前記横流アッセイ装置が、1つ又はそれ以上の試薬が配置される試薬ゾーンを更に含み、前記試薬が、酵素、電子供与体、顕色剤、及びその組み合わせから成る群から選択されることを特徴とする請求項1〜請求項16の何れか1項に記載の診断試験キット。
【請求項18】
請求項1〜請求項17の何れか1項に記載の診断試験キットを用いて、分析物を酵素触媒酸化することにより放出された過酸化水素を検出するための方法であって、前記方法が、
前記過酸化水素を電子供与体と反応させて中間化合物を形成する段階と、
前記中間化合物が、前記クロマトグラフ媒体を通って流れて前記検出ゾーンに接触し、それによって、前記中間化合物が前記色原体を酸化して色の変化を引き起こし、前記酸化色原体が前記被酸化性色原体の色と異なる色を有する段階と、
前記酸化色原体の色を検出する段階と、
を含むことを特徴とする方法。
【請求項19】
前記酸化色原体の色が、視覚的に検出されることを特徴とする請求項18に記載の方法。
【請求項20】
前記酸化色原体の色の強度が、定量的又は半定量的に測定されることを特徴とする請求項18に記載の方法。
【請求項1】
分析物を酵素触媒酸化することにより放出される過酸化水素を検出するための診断試験キットであって、前記試験キットが、クロマトグラフ媒体を含む横流装置を含み、前記クロマトグラフ媒体は、色原体が陰イオン性化合物とともに実質的に非拡散的に不動化される検出ゾーンを定め、前記色原体が、酸化されると検出可能な色の変化を生じることができるロイコ塩基又はその誘導体であることを特徴とする診断試験キット。
【請求項2】
前記色原体が、トリアリールメタンであることを特徴とする請求項1に記載の診断試験キット。
【請求項3】
前記色原体が、ロイコマラカイトグリーン、パラロザニリンベース、クリスタルバイオレットラクトン、クリスタルバイオレットロイコ、クリスタルバイオレット、CIベーシックバイオレット1、CIベーシックバイオレット2、CIベーシックブルー、CIビクトリアブルー、N−ベンゾイルロイコメチレン、及びその誘導体から成る群から選択されることを特徴とする請求項2に記載の診断試験キット。
【請求項4】
前記色原体が、ロイコマラカイトグリーン又はその誘導体であることを特徴とする請求項2に記載の診断試験キット。
【請求項5】
前記色原体が、ジアリルメタンであることを特徴とする請求項1に記載の診断試験キット。
【請求項6】
前記過酸化水素と反応し、前記色原体を酸化するように構成された中間化合物を形成することができる電子供与体を更に含むことを特徴とする請求項1〜請求項5の何れか1項に記載の前記診断試験キット。
【請求項7】
前記電子供与体が、ヨウ化物イオン供給源であることを特徴とする請求項6に記載の診断試験キット。
【請求項8】
前記ヨウ化物イオンの供給源が、アルカリ金属ヨウ化物塩であることを特徴とする請求項7に記載の診断試験キット。
【請求項9】
前記電子供与体が、金属であることを特徴とする請求項6に記載の診断試験キット。
【請求項10】
前記電子供与体と複合化することができる顕色剤を更に含むことを特徴とする請求項6に記載の診断試験キット。
【請求項11】
前記顕色剤が、デンプンであることを特徴とする請求項10に記載の診断試験キット。
【請求項12】
前記色原体が、酸化されると沈殿することを特徴とする請求項1〜請求項11の何れか1項に記載の診断試験キット。
【請求項13】
前記陰イオン性化合物が、酸、酸無水物、酸の塩、又はその組み合わせであることを特徴とする請求項1〜請求項12の何れか1項に記載の診断試験キット。
【請求項14】
前記陰イオン性化合物が、無機酸であることを特徴とする請求項13に記載の診断試験キット。
【請求項15】
前記クロマトグラフ媒体を通って流れた後に前記試験試料を受け取る吸収性材料を更に含むことを特徴とする請求項1〜請求項14の何れか1項に記載の診断試験キット。
【請求項16】
前記クロマトグラフ媒体が、多孔性膜であることを特徴とする請求項1〜請求項15の何れか1項に記載の診断試験キット。
【請求項17】
前記横流アッセイ装置が、1つ又はそれ以上の試薬が配置される試薬ゾーンを更に含み、前記試薬が、酵素、電子供与体、顕色剤、及びその組み合わせから成る群から選択されることを特徴とする請求項1〜請求項16の何れか1項に記載の診断試験キット。
【請求項18】
請求項1〜請求項17の何れか1項に記載の診断試験キットを用いて、分析物を酵素触媒酸化することにより放出された過酸化水素を検出するための方法であって、前記方法が、
前記過酸化水素を電子供与体と反応させて中間化合物を形成する段階と、
前記中間化合物が、前記クロマトグラフ媒体を通って流れて前記検出ゾーンに接触し、それによって、前記中間化合物が前記色原体を酸化して色の変化を引き起こし、前記酸化色原体が前記被酸化性色原体の色と異なる色を有する段階と、
前記酸化色原体の色を検出する段階と、
を含むことを特徴とする方法。
【請求項19】
前記酸化色原体の色が、視覚的に検出されることを特徴とする請求項18に記載の方法。
【請求項20】
前記酸化色原体の色の強度が、定量的又は半定量的に測定されることを特徴とする請求項18に記載の方法。
【図1】




【公表番号】特表2010−502942(P2010−502942A)
【公表日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願番号】特願2009−526212(P2009−526212)
【出願日】平成19年7月18日(2007.7.18)
【国際出願番号】PCT/IB2007/052861
【国際公開番号】WO2008/026102
【国際公開日】平成20年3月6日(2008.3.6)
【出願人】(504460441)キンバリー クラーク ワールドワイド インコーポレイテッド (396)
【Fターム(参考)】
【公表日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願日】平成19年7月18日(2007.7.18)
【国際出願番号】PCT/IB2007/052861
【国際公開番号】WO2008/026102
【国際公開日】平成20年3月6日(2008.3.6)
【出願人】(504460441)キンバリー クラーク ワールドワイド インコーポレイテッド (396)
【Fターム(参考)】
[ Back to top ]

