界面活性剤により処理された固定化リン脂質代謝酵素およびこれを用いる機能性リン脂質の製造方法
【課題】リン脂質代謝酵素表層提示酵母を機能性リン脂質の合成反応に適用するために、有機溶媒に対する細胞の親和性を付与し、表層のリパーゼと基質とを効率的に接触させる手段を提供すること。
【解決手段】本発明は、界面活性剤により処理された固定化リン脂質代謝酵素を提供する。この界面活性剤処理された固定化リン脂質代謝酵素は、固定化リン脂質代謝酵素を、界面活性剤と接触させる工程;および、該固定化リン脂質代謝酵素を蒸留水で洗浄する工程によって得られる。この酵素は、機能性リン脂質を効率よく合成するために利用可能であり、現状の機能性リン脂質の製造工程を簡略化できる。したがって、リン脂質の製造の大幅なコストダウンを図ることができる。
【解決手段】本発明は、界面活性剤により処理された固定化リン脂質代謝酵素を提供する。この界面活性剤処理された固定化リン脂質代謝酵素は、固定化リン脂質代謝酵素を、界面活性剤と接触させる工程;および、該固定化リン脂質代謝酵素を蒸留水で洗浄する工程によって得られる。この酵素は、機能性リン脂質を効率よく合成するために利用可能であり、現状の機能性リン脂質の製造工程を簡略化できる。したがって、リン脂質の製造の大幅なコストダウンを図ることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、界面活性剤により処理された固定化リン脂質代謝酵素およびこれを用いる機能性リン脂質の製造方法に関する。より詳細には、固定化リン脂質代謝酵素は、リン脂質代謝酵素を細胞表層に提示する細胞(特に酵母)あるいは担体に固定化されたリン脂質代謝酵素であり得る。
【背景技術】
【0002】
リン脂質は重要な生体成分の1つであり、自然界に広く存在することが確認されている。リン脂質は、その分子内に、2本の長鎖脂肪酸からなる疎水性部位とリン酸エステルからなる親水性(極性)部位とを有する。脂肪酸としては、鎖長や不飽和結合数の異なるラウリン酸、オレイン酸、ドコサヘキサエン酸などが挙げられ、そして極性基としては、コリン基、エタノールアミン基、イノシトール基、セリン基などが挙げられる。各部位の構造が異なるリン脂質は、それぞれ特有の生理活性や機能を有し、食品、化粧品、工業製品、医薬品などの種々の分野への応用が期待できる。そのため、目的の分子構造を有するリン脂質を効率的に生産するための技術開発が極めて重要な課題となる。
【0003】
現在、リン脂質の工業生産用原料としては、主に大豆が使用されている。具体的には、大豆油の精製工程より発生する副産物(油滓)を利用し、低純度リン脂質が大量生産されている。しかしながら、大豆や卵黄などの天然由来のリン脂質から、目的の構造を有する機能性リン脂質を生産することは、抽出や精製工程が複雑である上に回収量が少ないことから、工業生産には適していない。
【0004】
従来、図1に示すリン脂質の各部位に作用する酵素群(リン脂質代謝酵素)を用いて、安価なリン脂質原料を目的の構造へと改変する研究が行われてきた(非特許文献1〜3)。例えば、リン脂質の疎水性部位を他の脂肪酸に置換する反応をエステル交換反応、および極性部位を置換する反応をリン酸基転移反応とそれぞれ呼び、これらの反応は、リン脂質代謝酵素、リン脂質原料、および置換する脂肪酸(あるいは極性基)を特定の有機溶媒に溶解させて行われる。
【0005】
通常、リン脂質代謝酵素は、微生物の培養液に含まれる酵素を精製・濃縮・固定化・回収することによって得られる。しかし、複雑なプロセスを経るため、設備コスト、ランニングコストが非常に高くなるという欠点を有する。
【特許文献1】特開2004−49014号公報
【非特許文献1】I. Svenssonら,Journal of the American Oil Chemists' Society,1992年,69巻,986-991頁
【非特許文献2】C.W. Parkら,Biotechnology Letter,2000年,22巻,147−150頁
【非特許文献3】M. Hosokawaら,Journal of agricultural and food chemistry,2000年,48巻,4550-4554頁
【非特許文献4】T. Matsumotoら,Applied and Environmental Microbiology,2002年,68巻,4517-4522頁
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明者らは、以前の研究で、目的酵素であるリパーゼを酵母の細胞表層に生産・固定(提示)させるためのベクター系を開発している(特許文献1および非特許文献4)。そこで、本発明は、リン脂質代謝酵素を細胞表層に提示する酵母を全細胞触媒として用いた機能性リン脂質生産系の開発を目的とした。
【0007】
一般に酵母などの微生物は水に対する親和性が高く、エステル合成に頻繁に用いるヘキサンなどの疎水性有機溶媒中で分散させることは困難であると考えられる。そのため、細胞表層に局在する酵素と溶媒中の基質との接触を妨げ、生産性の低下を引き起こす。したがって、リン脂質代謝酵素表層提示酵母を機能性リン脂質の合成反応に適用するためには、有機溶媒に対する細胞の親和性を付与し、表層のリパーゼと基質とを効率的に接触させる必要がある。
【課題を解決するための手段】
【0008】
本発明は、有機溶媒に可溶な界面活性剤でリン脂質代謝酵素表層提示酵母細胞の表層を処理し、高い反応性を有する酵母を機能性リン脂質の合成に利用できることを確認することによって完成された。また、イオン交換樹脂を担体として用いる固定化されたリン脂質代謝酵素に対しても、同様の処理が適用可能であることも明らかにした。
【0009】
本発明は、界面活性剤により処理された固定化リン脂質代謝酵素を提供する。
【0010】
本発明はまた、固定化リン脂質代謝酵素を、界面活性剤と接触させる工程;および
次いで、該固定化リン脂質代謝酵素を蒸留水で洗浄する工程;
を含む、界面活性剤により処理された固定化リン脂質代謝酵素の製造方法を提供する。
【0011】
1つの実施態様では、上記リン脂質代謝酵素は、細胞表層に提示されている。
【0012】
好適な実施態様では、上記細胞は、酵母細胞である。
【0013】
別の実施態様では、上記リン脂質代謝酵素は、単離または抽出された精製または粗精製酵素である。
【0014】
さらなる実施態様では、上記界面活性剤は、非イオン性界面活性剤である。
【0015】
好適な実施態様では、上記非イオン性界面活性剤は、Tween系界面活性剤である。
【0016】
さらに別の実施態様では、上記リン脂質代謝酵素は、リパーゼである。
【0017】
本発明はさらに、上記のいずれかの固定化リン脂質代謝酵素を、リン脂質および基質と接触させる工程;および
得られた機能性リン脂質を回収する工程
を含む、機能性リン脂質の製造方法を提供する。
【0018】
1つの実施態様では、上記リン脂質代謝酵素はリパーゼであり、そして上記基質は脂肪酸である。
【発明の効果】
【0019】
本発明によれば、簡単な工程によって、高い反応性を有するリン脂質代謝酵素が提供される。そのため、この酵素を機能性リン脂質の合成に利用でき、さらに現状の機能性リン脂質の製造工程を簡略化できる。したがって、リン脂質の製造の大幅なコストダウンを図ることができる。
【発明を実施するための最良の形態】
【0020】
本発明において、リン脂質代謝酵素とは、リン脂質の各部位に作用する酵素群をいう。例えば、図1に示すように、脂肪酸エステル部分に作用する酵素(例えば、リパーゼ、ホスホリパーゼA1(PLA1)、ホスホリパーゼA2(PLA2))、リン酸エステル部分に作用する酵素(例えば、ホスホリパーゼD(PLD))などが挙げられる。固定化されるリン脂質代謝酵素は、目的のリン脂質の合成反応に応じて適宜選択され、特に限定されない。また、これらのリン脂質代謝酵素の起源は限定されず、例えば、微生物由来のものが好適に用いられる。微生物は、天然に存在する野生型あるいは形質転換体のいずれであってもよい。
【0021】
本発明において、固定化リン脂質代謝酵素とは、任意の担体に固定化されたリン脂質代謝酵素をいう。樹脂などの一般的な担体に固定化された固定化酵素であってもよく、あるいは細胞の表層に提示された酵素であってもよい。後述するように、リン脂質代謝酵素を細胞表層に固定化した(すなわち、リン脂質代謝酵素を細胞表層に提示する)細胞が、さらに任意の担体に固定化されていてもよい。
【0022】
担体に固定化されるリン脂質代謝酵素は、一般的には、天然物または組換え体から単離または抽出された精製酵素または粗精製酵素が用いられる。精製酵素または粗精製酵素が固定化される担体としては、通常、酵素の固定化に用いられる担体が挙げられる。例えば、種々のイオン交換樹脂などの有機高分子化合物、セラミックなどの無機多孔質などが挙げられる。固定化には、例えば、担体結合法、架橋法および包括法などの当業者が通常用いる方法が適用できる。担体結合法には、イオン交換性の樹脂に吸着させる化学的吸着法あるいは物理的吸着法が含まれる。
【0023】
本発明において、細胞表層にリン脂質代謝酵素を提示させる細胞は、細菌、真菌、植物細胞など、細胞壁を有する細胞であれば、特に限定されない。好適には、酵母が使用される。
【0024】
細胞表層にリン脂質代謝酵素を提示する一般的な方法について説明する。細胞表層にリン脂質代謝酵素を提示する方法としては、(a)細胞表層局在タンパク質のGPIアンカーを介してリン脂質代謝酵素を細胞表層に提示する方法、および(b)細胞表層局在タンパク質の糖鎖結合タンパク質ドメインを介してリン脂質代謝酵素を細胞表層に提示する方法がある。
【0025】
用いられ得る細胞表層局在タンパク質としては、酵母の性凝集タンパク質であるα−またはa−アグルチニン、FLOタンパク質(例えば、FLO1、FLO2、FLO4、FLO5、FLO9、FLO10、およびFLO11)、アルカリホスファターゼなどが挙げられる。
【0026】
(a)GPIアンカーを利用する方法
GPIアンカーにより細胞表層に局在するタンパク質をコードする遺伝子は、N末端側から順に、分泌シグナル配列、細胞表層局在タンパク質(糖鎖結合タンパク質ドメイン)、およびGPIアンカー付着認識シグナル配列をそれぞれコードする遺伝子を有している。細胞内でこの遺伝子から発現された細胞表層局在タンパク質(糖鎖結合タンパク質)は、分泌シグナルにより細胞膜外へ導かれ、その際、GPIアンカー付着認識シグナル配列は、選択的に切断されたC末端部分を介して細胞膜のGPIアンカーと結合して細胞膜に固定される。その後、PI−PLCにより、GPIアンカーの根元部が切断され、細胞壁に組み込まれて細胞表層に固定され、細胞表層に提示される。
【0027】
ここで、GPIアンカーとは、グリコシルホスファチジルイノシトール(GPI)と呼ばれるエタノールアミンリン酸−6マンノースα1−2マンノースα1−6マンノースα1−4グルコサミンα1−6イノシトールリン脂質を基本構造とする糖脂質をいい、PI−PLCとは、ホスファチジルイノシトール依存性ホスホリパーゼCをいう。
【0028】
GPIアンカー付着認識シグナル配列とは、GPIアンカーが細胞表層局在タンパク質と結合する際に認識される配列であり、通常、細胞表層局在タンパク質のC末端あるいはその近傍に位置する。GPIアンカー付着シグナル配列としては、例えば酵母のα−アグルチニンのC末端部分の配列が好適に用いられる。上記α−アグルチニンのC末端から320アミノ酸の配列のC末端側には、GPIアンカー付着認識シグナル配列が含まれるので、上記方法に使用する遺伝子としては、このC末端から320アミノ酸の配列をコードするDNA配列が特に有用である。
【0029】
したがって、例えば、分泌シグナル配列をコードするDNA−細胞表層局在タンパク質をコードする構造遺伝子−GPIアンカー付着認識シグナルをコードするDNA配列を有する配列において、この細胞表層局在タンパク質をコードする構造遺伝子の全部または一部の配列を、目的とするリン脂質代謝酵素の構造遺伝子の配列に置換することにより、GPIアンカーを介して目的のリン脂質代謝酵素を細胞表層に提示する組換えDNAが得られる。細胞表層局在タンパク質がα−アグルチニンである場合、上記α−アグルチニンのC末端から320アミノ酸の配列をコードする配列を残すように、目的のリン脂質代謝酵素遺伝子を導入することが好ましい。このようにして細胞表層に提示されたリン脂質代謝酵素は、そのC末端側が表層に固定されている。
【0030】
(b)糖鎖結合タンパク質ドメインを利用する方法
細胞表層局在タンパク質が糖鎖結合タンパク質である場合、その糖鎖結合タンパク質ドメインは、複数の糖鎖を有し、この糖鎖が細胞壁中の糖鎖と相互作用または絡み合うことによって、細胞表層に留まることが可能である。例えば、レクチン、レクチン様タンパク質などの糖鎖結合部位などが挙げられる。代表的には、GPIアンカータンパク質の凝集機能ドメインが挙げられる。GPIアンカータンパク質の凝集機能ドメインとは、GPIアンカリングドメインよりもN末端側にあり、複数の糖鎖を有し、凝集に関与していると考えられているドメインをいう。
【0031】
この細胞表層局在タンパク質(凝集機能ドメイン)と目的のリン脂質代謝酵素とを結合することにより、細胞表層に酵素が提示される。例えば、細胞表層局在タンパク質(凝集機能ドメイン)の(1)N末端側にリン脂質代謝酵素を結合させる、(2)C末端側にリン脂質代謝酵素を結合させる、および(3)N末端側およびC末端側の両方に、同一または異なるリン脂質代謝酵素を結合させることができる。このようにして細胞表層に提示されたリン脂質代謝酵素は、そのN末端側またはC末端側が表層に固定される。
【0032】
上記組換えDNAに用いられる分泌シグナル配列は、細胞表層局在タンパク質の分泌シグナル配列を用いてもよいし、発現したリン脂質代謝酵素を細胞外へ導くことができる他の分泌シグナル配列を用いてもよい。例えば、グルコアミラーゼの分泌シグナル配列、酵母のα−またはa−アグルチニンの分泌シグナル配列、リパーゼの分泌シグナル配列が好適に用いられる。酵素活性に影響を及ぼさなければ、細胞表層提示後に分泌シグナル配列およびプロ配列の一部または全部がN末端に残ってもよい。
【0033】
本発明に使用される細胞は、目的とするリン脂質代謝酵素を細胞表層に提示するようにDNAを導入して、形質転換された細胞である。導入されるDNAは、少なくとも、分泌シグナル配列、糖鎖結合タンパク質ドメイン、および目的とするリン脂質代謝酵素をコードする配列を含む。さらに、もう1つの同じまたは別のリン脂質代謝酵素をコードする配列を含んでいてもよい。
【0034】
上記の各種配列を含むDNAの合成および結合は、当業者が通常用い得る技術で行われ得る。
【0035】
上記DNAはプラスミドの形態であることが望ましい。DNAの取得の簡易化の点からは、大腸菌とのシャトルベクターであることが好ましい。このDNAの出発材料は、例えば、酵母の2μmプラスミドの複製起点(Ori)とColE1の複製起点とを有しており、また、酵母選択マーカー(例えば、薬剤耐性遺伝子、TRP、LEU2など)および大腸菌の選択マーカー(薬剤耐性遺伝子など)を有することがさらに好ましい。また、酵素の構造遺伝子を発現させるために、この遺伝子の発現を調節するオペレーター、プロモーター、ターミネーター、エンハンサーなどのいわゆる調節配列をも含んでいることが望ましい。例えば、GAPDH(グリセルアルデヒド3’−リン酸デヒドロゲナーゼ)プロモーターおよびGAPDHターミネーターが挙げられる。このような出発材料のプラスミドの例としては、GAPDH(グリセルアルデヒド3’−リン酸デヒドロゲナーゼ)プロモーター配列およびGAPDHターミネーター配列を含むプラスミドpYGA2270またはpYE22m、あるいはUPR−ICL(イソクエン酸リアーゼ上流領域)配列とTerm−ICL(イソクエン酸リアーゼのターミネーター領域)配列とを含むプラスミドpWI3などが挙げられる。
【0036】
好適には、プラスミドpYGA2270またはpYE22mのGAPDHプロモーター配列とGAPDHターミネーター配列との間、あるいはプラスミドpWI3のUPR−ICLの配列とTerm−ICLの配列との間に、所望のリン脂質代謝酵素をコードするDNAを挿入すれば、酵母に導入するために使用されるプラスミドが製造される。本発明においては、好適には、マルチコピー型のプラスミドpWIFSまたはpWIFLが用いられ、例えば、pWIFS−ProROL(非特許文献4参照)、pWIFS−PLA1、またはpWIFL−ProROLが製造される。
【0037】
宿主の酵母としては、どのような酵母を用いてもよいが、凝集性の酵母が、反応後の分離が簡単である点で、あるいは簡単に固定できるため連続反応を行い得る点で好ましい。あるいは、糖鎖結合タンパク質ドメインとして、凝集機能ドメインを使用する場合は、どのような酵母にも強い凝集性を付与することができる。
【0038】
本発明の方法で用いられる細胞は、上記DNAを細胞に導入することにより得られる。DNAの導入とは、細胞の中にDNAを導入し、発現させることを意味する。DNAの導入の方法には、形質転換、形質導入、トランスフェクション、コトランスフェクション、エレクトロポレーションなどの方法があり、具体的には、酢酸リチウムを用いる方法、プロトプラスト法などがある。
【0039】
導入されるDNAは、前述のようなプラスミドの形態であってもよく、あるいは宿主の遺伝子に挿入して、または宿主の遺伝子と相同組換えを起こして染色体に取り込まれてもよい。
【0040】
DNAが導入された細胞は、選択マーカー(例えば、TRP)で選択され、発現されたリン脂質代謝酵素の活性を測定することにより選択される。リン脂質代謝酵素が細胞表層に固定されていることは、このリン脂質代謝酵素に対する抗タンパク質抗体とFITC標識抗IgG抗体とを用いる免疫抗体法によって確認できる。
【0041】
上記のようにして得られたリン脂質代謝酵素を細胞表層に提示する組換え細胞は、この細胞を維持し得る培地を含む懸濁液中で低温保存または凍結保存され得るか、あるいは低温乾燥または凍結乾燥して保存され得る。
【0042】
本発明で用いられるリン脂質代謝酵素表層提示細胞は、担体に固定化されていてもよい。本発明に用い得る担体の材質としては、例えば、ポリビニルアルコール、ポリウレタンフォーム、ポリスチレンフォーム、ポリアクリルアミド、ポリビニルフォルマール樹脂多孔質体、シリコンフォーム、セルロース多孔質体などの発泡体あるいは樹脂が好ましい。増殖および活性が低下した細胞あるいは死滅した細胞の脱落などを考慮すると、多孔質の担体が好ましい。多孔質体の開口部の大きさは細胞によっても異なるが、細胞が十分に入り込めて、増殖できる大きさが適当である。50μm〜1000μmが好適であるが、これに限定されない。
【0043】
また、担体の形状は問わない。担体の強度、培養効率などを考慮すると、球状あるいは立方体状であり、大きさは、球状の場合、直径が2mm〜50mm、立方体状の場合、2mm〜50mm角が好ましい。
【0044】
本明細書において、酵母の固定化とは、酵母が遊離の状態ではない状態を意味し、例えば、酵母が担体に結合あるいは付着または担体内部に取り込まれた状態などをいう。酵母の固定化には、例えば、担体結合法、架橋法および包括法などの当業者が通常用いる方法が適用できる。なかでも、凝集性の酵母の固定化には、担体結合法が最適である。担体結合法には、イオン交換性の樹脂に吸着させる化学的吸着法あるいは物理的吸着法が含まれる。
【0045】
本発明において、上記固定化リン脂質代謝酵素は、界面活性剤により処理されている。ここで、界面活性剤によるリン脂質代謝酵素の処理とは、リン脂質代謝酵素を界面活性剤と接触させることをいい、この処理により、リン脂質代謝酵素は界面活性剤で被覆される。例えば、界面活性剤処理されたリン脂質代謝酵素は、固定化リン脂質代謝酵素を、界面活性剤の水溶液中に入れて振とう処理し、次いで蒸留水で洗浄することによって得られる。
【0046】
本発明において用いられる界面活性剤は、特に限定されないが、生化学領域で一般的に用いられるものが好ましい。イオン性界面活性剤(陰イオン性界面活性剤、陽イオン性界面活性剤、および両性界面活性剤)ならびに非イオン性界面活性剤のいずれであってもよい。
【0047】
本発明においては、非イオン性界面活性剤が特に好適に用いられる。非イオン性界面活性剤としては、このような非イオン性界面活性剤としては、例えば、脂肪酸系(非イオン)(例えば、スクロース脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド)、高級アルコール系(非イオン)(例えば、ポリオキシエチレンアルキルエーテル)、およびアルキルフェノール系(例えば、ポリオキシエチレンアルキルフェニルエーテル)が挙げられる。より具体的には、Tween系界面活性剤、Triton系界面活性剤、Brij系界面活性剤が挙げられる。本発明においては、好ましくはTween20、Tween40、Tween60、およびTween80、より好ましくはTween20が用いられる。
【0048】
本発明においては、イオン性界面活性剤の中で、陰イオン性界面活性剤が好適に御地いられる。陰イオン性界面活性剤としては、アルキル硫酸ナトリウム(例えば、ドデシル硫酸ナトリウム(SDS))、アルキルベンゼンスルホン酸塩、コール酸ナトリウムなどが挙げられる。
【0049】
固定化リン脂質代謝酵素の処理工程において、固定化リン脂質代謝酵素を、上記界面活性剤と水溶液中で接触させる。界面活性剤の水溶液の濃度は、用いる界面活性剤に応じて異なる。非イオン性界面活性剤を用いる場合は、通常は0.05%(w/v)〜5%(w/v)、好ましくは0.1%(w/v)〜3%(w/v)、より好ましくは、0.5%(w/v)〜2%(w/v)である。接触させる時間は、濃度に応じて異なるが、通常は1〜48時間、好ましくは6〜36時間、より好ましくは12〜24時間であり得る。接触させる際の温度は、酵素が失活しない温度であり得、通常20〜37℃の範囲内である。酵素と界面活性剤との接触後、酵素を水で洗浄することが好ましい。
【0050】
上記のような界面活性剤により処理されたリン脂質代謝酵素を用いて、機能性リン脂質を製造する方法が提供される。本発明において、機能性リン脂質とは、目的の構造を有するように改変されたリン脂質をいい、その構造は特定されない。例えば、リン脂質の疎水性部位を他の脂肪酸に置換するエステル交換、あるいはリン脂質の極性部位を置換するリン酸基転移によって得られる改変されたリン脂質が挙げられる。
【0051】
本発明の方法に用いられるリン脂質は、その起源は特に限定されず、天然物由来(例えば、抽出物、濃縮物)であってもよく、または化学的に合成されたものでもよい。このようなリン脂質としては、ホスファチジルエタノールアミン(PE)、ホスファチジルコリン(PC)、ホスファチジルセリン(PS)、ホスファチジルイノシトール(PI)、ホスファチジルグリセロール(PG)などが挙げられ、これらの混合物であってもよい。
【0052】
これらのリン脂質の構成脂肪酸は、同一または異種の炭素数8〜24の飽和または不飽和脂肪酸である。このような脂肪酸としては、カプリル酸、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、ベヘン酸、アラキジン酸、パルミトオレイン酸、オレイン酸、リノール酸、α−およびγ−リノレイン酸、エルシン酸、アラキドン酸、エイコサペンタエン酸、ドコサヘキサエン酸、テトラコサテトラエン酸などが挙げられる。
【0053】
エステル交換反応に用いられる脂肪酸は、目的に応じて適宜選択される。好ましくは、炭素数8〜24の同一の飽和または不飽和脂肪酸である。このような脂肪酸は、上述のとおりである。
【0054】
リン酸基転移反応に用いられるエステルは、一塩基酸のエステルであってもよく、二塩基酸以上の酸のエステルであってもよい。二塩基酸以上の酸のエステルの場合は、中性エステルであることが好ましい。カルボン酸エステルとしては、例えば、酢酸エステル、プロピオン酸エステル、コハク酸エステル、マレイン酸エステル、安息香酸エステルなどが挙げられる。
【0055】
本発明の機能性リン脂質の製造方法において用いられる反応液は、細胞表層や担体に固定化されかつ界面活性剤処理されたリン脂質代謝酵素が酵素活性を示すことができるものであれば、特に限定されず、緩衝液や有機溶媒であってもよい。上記のようにリン脂質代謝酵素がリパーゼの場合は、エステルおよびアルコール以外の有機溶媒を用いることが好ましい。このような有機溶媒としては、ペンタン、ヘキサン、シクロヘキサン、ヘプタン、オクタン、ノナン、デカン、ベンゼン、トルエン、ジエチルエーテル、アセトン、アセトニトリル、クロロホルム、ジクロロエタン、テトラヒドロフランなどが挙げられる。
【0056】
本発明の方法においては、例えば、上記固定化リン脂質代謝酵素と、上記基質(例えば、リン脂質および脂肪酸)を含む上記反応液とを混合することによって、酵素と基質とを接触させて、目的のリン脂質を得ることができる。この場合の反応条件は、固定化された酵素が酵素活性を示すことができるものであれば、特に限定されず、基質濃度、反応温度、反応時間などは、当業者であれば適宜決定し得る。反応終了後、目的の生成物は、この生成物に応じた手段(例えば、抽出、カラムクロマトグラフィーなど)により、回収・精製され得る。
【0057】
このようにして得られた機能性リン脂質は、そのままリン脂質として食品や医薬品の原料などに利用可能である。
【実施例】
【0058】
(調製例1:リパーゼ細胞表層提示酵母の調製)
酵母菌株として、Saccharomyces cerevisiae MT8-1(MATa, ade, his3, leu2, trp1, ura3)(Tajimaら、Yeast,1985年,1巻,67-77頁)を用いた。以前の研究(非特許文献4)で構築されたプラスミドpWIFS−ProROLを、酢酸リチウム法により酵母株に導入した。このプラスミドは、酵母の細胞表層に糸状菌Rhizopus oryzae由来リパーゼ(ROL)を生産・固定させる遺伝子を有するベクターである。
【0059】
形質転換された酵母を5mLのSD(Synthetic Dropout)培地[0.67%(w/v)DIFCOTM Yeast nitrogen base w/o amino acid、2%(w/v)D−グルコース、100mg/LのL−ロイシン、ならびにそれぞれ20mg/Lのアデニン、ウラシル、およびL−ヒスチジン]で1日培養し(30℃、150opm)、波長600nmにおける初期菌体濃度OD(Optical density)が0.03となるようにSDC培地[SD培地に2%(w/v)のカザミノ酸を加えた培地]へ植菌した。菌体は、30℃で7日間培養した。培養後の菌体は蒸留水を用いて洗浄し、凍結乾燥した。この菌体をリパーゼ細胞表層提示酵母(以下、ROL表層提示酵母と略す)として用いた。
【0060】
(実施例1:界面活性剤で処理したリパーゼ細胞表層提示酵母の調製)
上記調製例1で得られた粉末状態のROL表層提示酵母を10mg−dry cell/mLとなるように蒸留水に懸濁し、1%(w/v)の各種界面活性剤を加えた。界面活性剤としては、非イオン性界面活性剤のポリオキシエチレンソルビタンモノラウレートであるTween20、Tween40、Tween60、およびTween80、ならびに陰イオン性界面活性剤であるドデシル硫酸ナトリウム(SDS)を用いた。この懸濁液を、30℃にて150opmで16時間振とう処理し、酵母表層をこれらの界面活性剤によって被覆した。処理後の懸濁液を8000rpmで5分間遠心分離し、沈殿した酵母を蒸留水で洗浄する操作を2回繰り返した後、減圧下で乾燥させた。こうして得られた白色の粉末を、界面活性剤処理リパーゼ表層提示酵母(以下、界面活性剤処理ROL表層提示酵母)とした。
【0061】
(参考例1:ROL表層提示酵母の菌体量がエステル交換反応に及ぼす影響の検討)
リン脂質の原料として、和光純薬工業株式会社より購入した卵黄由来ホスファチジルコリン(以下、PCと略す)を用いた。エステル交換反応は、50mgのPCおよび100mgのラウリン酸(LAと略す)をヘキサン5mLに溶解し、上記調製例1で得られた種々の量のROL表層提示酵母を添加して反応を開始した。反応温度は30℃であり、そして振とう条件は150opmであった。各反応時間におけるエステル交換率を測定するために、約300μLのヘキサン層を採取した。
【0062】
次いで、採取したヘキサンを揮発させ、残った脂質成分を少量(約10μL)のクロロホルムに溶解した。このクロロホルムを薄層クロマトグラフィー(展開溶媒:クロロホルム/メタノール/水,65/35/4,v/v/v)で展開し、リン脂質、リゾリン脂質、脂肪酸などを分離した。分離したリン脂質のみを含むシリカゲルを採取し、メタノール/トルエン溶液(4/1,v/v)3mLに加えてリン脂質を抽出した。この抽出液に塩化アセチル200μLを添加し、50℃で1時間撹拌することにより、リン脂質に含まれる脂肪酸をメチル化した。脂肪酸メチルの組成をガスクロマトグラフィーで分析してリン脂質脂肪酸組成を決定し、エステル交換率を算出した。結果を図2に示す。
【0063】
ROL表層提示酵母は、有機溶媒を用いない加水分解反応やエステル合成反応では高い活性を示すことが知られている(非特許文献4)。しかしながら、図2に示すように、処理を行っていないROL表層提示酵母を用いたPCのエステル交換反応において、菌体量を増やしてもエステル交換率はほとんど向上せず、どの菌体量においても10%以下の値を示した。これは、疎水性有機溶媒であるヘキサンに対する酵母の分散性が問題であると考えられる。
【0064】
(実施例2:Tween20処理リパーゼ表層提示酵母を用いるリン脂質のエステル交換反応)
50mgのPCおよび100mgのLAをヘキサン5mLに溶解し、上記実施例1で得られたTween20処理ROL表層提示酵母50mgを添加して反応を開始した。反応温度は30℃、振とう条件は150opmであった。なお、コントロールとして上記調製例1で得られたROL表層提示酵母について、同様に反応を行った。各反応時間におけるエステル交換率を測定するために、約300μLのヘキサン層を採取した。
【0065】
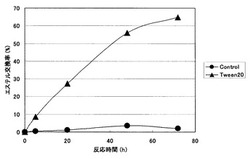
次いで、採取したヘキサンを揮発させ、残った脂質成分を少量(約10μL)のクロロホルムに溶解した。このクロロホルムを薄層クロマトグラフィー(展開溶媒:クロロホルム/メタノール/水,65/35/4,v/v/v)で展開し、リン脂質、リゾリン脂質、脂肪酸などを分離した。分離したリン脂質のみを含むシリカゲル画分を採取し、メタノール/トルエン溶液(4/1,v/v)3mLに加えてリン脂質を抽出した。この抽出液に塩化アセチル200μLを添加し、50℃で1時間撹拌することにより、リン脂質に含まれる脂肪酸をメチル化した。脂肪酸メチルの組成をガスクロマトグラフィーで分析してリン脂質脂肪酸組成を決定し、エステル交換率を算出した。結果を図3に示す。
【0066】
図3に示すように、Tween20処理を行った場合、エステル交換活性の飛躍的な向上が確認された。したがって、リパーゼ表層提示酵母における細胞表層のTween20処理が、リン脂質の分子構造の改変に極めて有効であることが分かった。
【0067】
(実施例3:界面活性剤の種類の検討)
上記実施例1で得られた種々の界面活性剤で処理されたROL表層提示酵母について、エステル交換率を上記実施例2と同様に操作して測定した。反応時間は48時間であった。結果を表1に示す。
【0068】
【表1】

【0069】
表1に示すように、全ての非イオン性界面活性剤(各種Tween)処理ROL表層提示酵母では、エステル交換活性が向上した。その中でも、Tween20が最も効果的であった。
【0070】
(実施例4:リパーゼ表層提示酵母の細胞表面疎水性)
界面活性剤処理によりエステル交換活性が増大する原因を追究する目的で、酵母細胞表面の疎水性を以下のようにして測定した。
【0071】
まず、ROL表層提示酵母および種々の界面活性剤処理ROL表層提示酵母を、生理食塩水[0.49%(wt)NaCl,0.49%(wt)KCl)]に懸濁し、波長600nmにおける菌体濃度(OD600)を測定した。このときの値をC1とした。酵母懸濁液3mLに対して、1mLのヘキサンを添加し、10秒間ボルテックスで混合し、そして10分間静置した。水相(下層)の菌体濃度(OD600)を測定し、この値をC2とした。
【0072】
細胞表面の疎水性(Hydropathy index:HI)を求める式は、
(C1−C2)/C2=HI ・・・(1)
と定義される。また(1)式は、
log(C1−C2)=logC2+logHI ・・・(2)
と変換することができる。この(2)式より、logC2=0のときlogHI=log(C1−C2)となるため、log(C1−C2)をY(縦)軸、logC2をX(横)軸にプロットして近似直線を求めると、Y切片の値がlogHIを示す。このlogHIの値を、細胞表面の疎水性を表す指標として用いた。例えば、細胞が強い疎水性を有する場合、大部分の細胞は上層(ヘキサン層)へ移行する。この場合、Y切片はより高い値を示すので、高いlogHI値は強い疎水性を示す。結果を表2に示す。
【0073】
【表2】

【0074】
表2に示すように、非イオン性界面活性剤で処理することによって、疎水性の指標であるlogHIは増加することが分かった。特に、Tween20を用いたときのlogHIの増加が顕著であった。これは、表1に示すエステル交換活性の増大と深い関連性があると考えられた。以上の結果より、非イオン性界面活性剤を用いた処理による酵母細胞表面の疎水性の変化が、リン脂質のエステル交換活性に大きく関与している可能性が示唆された。
【0075】
(調製例2:固定化リパーゼの調製)
R. oryzae由来リパーゼ粉末(製品名:Lipase F−AP15、天野エンザイム株式会社)250mgを100mMリン酸緩衝液(pH7)5mLに溶解させた。Tween20による処理を行うときには、1%(w/v)のTween20をバッファーに加えた。陰イオン交換樹脂であるDIAION HPA−25(三菱化学株式会社)1gを上記の溶液に添加し、20℃にて150opmで振とうすることにより、リパーゼを固定化した。リパーゼが固定化した樹脂を蒸留水で2回洗浄し、減圧下で乾燥後、固定化リパーゼを得た。
【0076】
(実施例5:Tween20処理固定化リパーゼのエステル交換活性に及ぼす影響の検討)
酵母細胞に対して効果のあったTween20処理が、一般的によく用いられている固定化リパーゼに対しても有効であるかを検証した。
【0077】
上記調製例2で得られた固定化リパーゼについて、上記実施例1と同様に操作してTween20処理固定化リパーゼを得た。次いで、Tween20処理固定化リパーゼ50mgを用いたこと以外は、上記実施例2と同様に操作して、PCのエステル交換反応を行った。反応時間は48時間であった。結果を表3に示す。
【0078】
【表3】

【0079】
表3に示すように、Tween20処理固定化リパーゼは、エステル交換率が顕著に増加した。したがって、界面活性剤処理は、酵母のような細胞だけでなく、分泌酵素を固定化した場合にも有効であることが示唆された。
【産業上の利用可能性】
【0080】
本発明によれば、簡単な工程によって、高い反応性を有するリン脂質代謝酵素が提供され、この酵素を機能性リン脂質の合成に利用でき、さらに現状の機能性リン脂質の製造工程を簡略化できる。したがって、リン脂質の製造の大幅なコストダウンを図ることができる。そのため、機能性リン脂質を、食品や医薬品の原料などとしてより安価に提供できる。
【図面の簡単な説明】
【0081】
【図1】リン脂質の基本構造および酵素の作用部位を示す模式図である。
【図2】エステル交換反応系に添加したROL表層提示酵母量とエステル交換率との関係を示すグラフである。
【図3】Tween20処理ROL表層提示酵母によるエステル交換反応の経時変化を示すグラフである。
【技術分野】
【0001】
本発明は、界面活性剤により処理された固定化リン脂質代謝酵素およびこれを用いる機能性リン脂質の製造方法に関する。より詳細には、固定化リン脂質代謝酵素は、リン脂質代謝酵素を細胞表層に提示する細胞(特に酵母)あるいは担体に固定化されたリン脂質代謝酵素であり得る。
【背景技術】
【0002】
リン脂質は重要な生体成分の1つであり、自然界に広く存在することが確認されている。リン脂質は、その分子内に、2本の長鎖脂肪酸からなる疎水性部位とリン酸エステルからなる親水性(極性)部位とを有する。脂肪酸としては、鎖長や不飽和結合数の異なるラウリン酸、オレイン酸、ドコサヘキサエン酸などが挙げられ、そして極性基としては、コリン基、エタノールアミン基、イノシトール基、セリン基などが挙げられる。各部位の構造が異なるリン脂質は、それぞれ特有の生理活性や機能を有し、食品、化粧品、工業製品、医薬品などの種々の分野への応用が期待できる。そのため、目的の分子構造を有するリン脂質を効率的に生産するための技術開発が極めて重要な課題となる。
【0003】
現在、リン脂質の工業生産用原料としては、主に大豆が使用されている。具体的には、大豆油の精製工程より発生する副産物(油滓)を利用し、低純度リン脂質が大量生産されている。しかしながら、大豆や卵黄などの天然由来のリン脂質から、目的の構造を有する機能性リン脂質を生産することは、抽出や精製工程が複雑である上に回収量が少ないことから、工業生産には適していない。
【0004】
従来、図1に示すリン脂質の各部位に作用する酵素群(リン脂質代謝酵素)を用いて、安価なリン脂質原料を目的の構造へと改変する研究が行われてきた(非特許文献1〜3)。例えば、リン脂質の疎水性部位を他の脂肪酸に置換する反応をエステル交換反応、および極性部位を置換する反応をリン酸基転移反応とそれぞれ呼び、これらの反応は、リン脂質代謝酵素、リン脂質原料、および置換する脂肪酸(あるいは極性基)を特定の有機溶媒に溶解させて行われる。
【0005】
通常、リン脂質代謝酵素は、微生物の培養液に含まれる酵素を精製・濃縮・固定化・回収することによって得られる。しかし、複雑なプロセスを経るため、設備コスト、ランニングコストが非常に高くなるという欠点を有する。
【特許文献1】特開2004−49014号公報
【非特許文献1】I. Svenssonら,Journal of the American Oil Chemists' Society,1992年,69巻,986-991頁
【非特許文献2】C.W. Parkら,Biotechnology Letter,2000年,22巻,147−150頁
【非特許文献3】M. Hosokawaら,Journal of agricultural and food chemistry,2000年,48巻,4550-4554頁
【非特許文献4】T. Matsumotoら,Applied and Environmental Microbiology,2002年,68巻,4517-4522頁
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明者らは、以前の研究で、目的酵素であるリパーゼを酵母の細胞表層に生産・固定(提示)させるためのベクター系を開発している(特許文献1および非特許文献4)。そこで、本発明は、リン脂質代謝酵素を細胞表層に提示する酵母を全細胞触媒として用いた機能性リン脂質生産系の開発を目的とした。
【0007】
一般に酵母などの微生物は水に対する親和性が高く、エステル合成に頻繁に用いるヘキサンなどの疎水性有機溶媒中で分散させることは困難であると考えられる。そのため、細胞表層に局在する酵素と溶媒中の基質との接触を妨げ、生産性の低下を引き起こす。したがって、リン脂質代謝酵素表層提示酵母を機能性リン脂質の合成反応に適用するためには、有機溶媒に対する細胞の親和性を付与し、表層のリパーゼと基質とを効率的に接触させる必要がある。
【課題を解決するための手段】
【0008】
本発明は、有機溶媒に可溶な界面活性剤でリン脂質代謝酵素表層提示酵母細胞の表層を処理し、高い反応性を有する酵母を機能性リン脂質の合成に利用できることを確認することによって完成された。また、イオン交換樹脂を担体として用いる固定化されたリン脂質代謝酵素に対しても、同様の処理が適用可能であることも明らかにした。
【0009】
本発明は、界面活性剤により処理された固定化リン脂質代謝酵素を提供する。
【0010】
本発明はまた、固定化リン脂質代謝酵素を、界面活性剤と接触させる工程;および
次いで、該固定化リン脂質代謝酵素を蒸留水で洗浄する工程;
を含む、界面活性剤により処理された固定化リン脂質代謝酵素の製造方法を提供する。
【0011】
1つの実施態様では、上記リン脂質代謝酵素は、細胞表層に提示されている。
【0012】
好適な実施態様では、上記細胞は、酵母細胞である。
【0013】
別の実施態様では、上記リン脂質代謝酵素は、単離または抽出された精製または粗精製酵素である。
【0014】
さらなる実施態様では、上記界面活性剤は、非イオン性界面活性剤である。
【0015】
好適な実施態様では、上記非イオン性界面活性剤は、Tween系界面活性剤である。
【0016】
さらに別の実施態様では、上記リン脂質代謝酵素は、リパーゼである。
【0017】
本発明はさらに、上記のいずれかの固定化リン脂質代謝酵素を、リン脂質および基質と接触させる工程;および
得られた機能性リン脂質を回収する工程
を含む、機能性リン脂質の製造方法を提供する。
【0018】
1つの実施態様では、上記リン脂質代謝酵素はリパーゼであり、そして上記基質は脂肪酸である。
【発明の効果】
【0019】
本発明によれば、簡単な工程によって、高い反応性を有するリン脂質代謝酵素が提供される。そのため、この酵素を機能性リン脂質の合成に利用でき、さらに現状の機能性リン脂質の製造工程を簡略化できる。したがって、リン脂質の製造の大幅なコストダウンを図ることができる。
【発明を実施するための最良の形態】
【0020】
本発明において、リン脂質代謝酵素とは、リン脂質の各部位に作用する酵素群をいう。例えば、図1に示すように、脂肪酸エステル部分に作用する酵素(例えば、リパーゼ、ホスホリパーゼA1(PLA1)、ホスホリパーゼA2(PLA2))、リン酸エステル部分に作用する酵素(例えば、ホスホリパーゼD(PLD))などが挙げられる。固定化されるリン脂質代謝酵素は、目的のリン脂質の合成反応に応じて適宜選択され、特に限定されない。また、これらのリン脂質代謝酵素の起源は限定されず、例えば、微生物由来のものが好適に用いられる。微生物は、天然に存在する野生型あるいは形質転換体のいずれであってもよい。
【0021】
本発明において、固定化リン脂質代謝酵素とは、任意の担体に固定化されたリン脂質代謝酵素をいう。樹脂などの一般的な担体に固定化された固定化酵素であってもよく、あるいは細胞の表層に提示された酵素であってもよい。後述するように、リン脂質代謝酵素を細胞表層に固定化した(すなわち、リン脂質代謝酵素を細胞表層に提示する)細胞が、さらに任意の担体に固定化されていてもよい。
【0022】
担体に固定化されるリン脂質代謝酵素は、一般的には、天然物または組換え体から単離または抽出された精製酵素または粗精製酵素が用いられる。精製酵素または粗精製酵素が固定化される担体としては、通常、酵素の固定化に用いられる担体が挙げられる。例えば、種々のイオン交換樹脂などの有機高分子化合物、セラミックなどの無機多孔質などが挙げられる。固定化には、例えば、担体結合法、架橋法および包括法などの当業者が通常用いる方法が適用できる。担体結合法には、イオン交換性の樹脂に吸着させる化学的吸着法あるいは物理的吸着法が含まれる。
【0023】
本発明において、細胞表層にリン脂質代謝酵素を提示させる細胞は、細菌、真菌、植物細胞など、細胞壁を有する細胞であれば、特に限定されない。好適には、酵母が使用される。
【0024】
細胞表層にリン脂質代謝酵素を提示する一般的な方法について説明する。細胞表層にリン脂質代謝酵素を提示する方法としては、(a)細胞表層局在タンパク質のGPIアンカーを介してリン脂質代謝酵素を細胞表層に提示する方法、および(b)細胞表層局在タンパク質の糖鎖結合タンパク質ドメインを介してリン脂質代謝酵素を細胞表層に提示する方法がある。
【0025】
用いられ得る細胞表層局在タンパク質としては、酵母の性凝集タンパク質であるα−またはa−アグルチニン、FLOタンパク質(例えば、FLO1、FLO2、FLO4、FLO5、FLO9、FLO10、およびFLO11)、アルカリホスファターゼなどが挙げられる。
【0026】
(a)GPIアンカーを利用する方法
GPIアンカーにより細胞表層に局在するタンパク質をコードする遺伝子は、N末端側から順に、分泌シグナル配列、細胞表層局在タンパク質(糖鎖結合タンパク質ドメイン)、およびGPIアンカー付着認識シグナル配列をそれぞれコードする遺伝子を有している。細胞内でこの遺伝子から発現された細胞表層局在タンパク質(糖鎖結合タンパク質)は、分泌シグナルにより細胞膜外へ導かれ、その際、GPIアンカー付着認識シグナル配列は、選択的に切断されたC末端部分を介して細胞膜のGPIアンカーと結合して細胞膜に固定される。その後、PI−PLCにより、GPIアンカーの根元部が切断され、細胞壁に組み込まれて細胞表層に固定され、細胞表層に提示される。
【0027】
ここで、GPIアンカーとは、グリコシルホスファチジルイノシトール(GPI)と呼ばれるエタノールアミンリン酸−6マンノースα1−2マンノースα1−6マンノースα1−4グルコサミンα1−6イノシトールリン脂質を基本構造とする糖脂質をいい、PI−PLCとは、ホスファチジルイノシトール依存性ホスホリパーゼCをいう。
【0028】
GPIアンカー付着認識シグナル配列とは、GPIアンカーが細胞表層局在タンパク質と結合する際に認識される配列であり、通常、細胞表層局在タンパク質のC末端あるいはその近傍に位置する。GPIアンカー付着シグナル配列としては、例えば酵母のα−アグルチニンのC末端部分の配列が好適に用いられる。上記α−アグルチニンのC末端から320アミノ酸の配列のC末端側には、GPIアンカー付着認識シグナル配列が含まれるので、上記方法に使用する遺伝子としては、このC末端から320アミノ酸の配列をコードするDNA配列が特に有用である。
【0029】
したがって、例えば、分泌シグナル配列をコードするDNA−細胞表層局在タンパク質をコードする構造遺伝子−GPIアンカー付着認識シグナルをコードするDNA配列を有する配列において、この細胞表層局在タンパク質をコードする構造遺伝子の全部または一部の配列を、目的とするリン脂質代謝酵素の構造遺伝子の配列に置換することにより、GPIアンカーを介して目的のリン脂質代謝酵素を細胞表層に提示する組換えDNAが得られる。細胞表層局在タンパク質がα−アグルチニンである場合、上記α−アグルチニンのC末端から320アミノ酸の配列をコードする配列を残すように、目的のリン脂質代謝酵素遺伝子を導入することが好ましい。このようにして細胞表層に提示されたリン脂質代謝酵素は、そのC末端側が表層に固定されている。
【0030】
(b)糖鎖結合タンパク質ドメインを利用する方法
細胞表層局在タンパク質が糖鎖結合タンパク質である場合、その糖鎖結合タンパク質ドメインは、複数の糖鎖を有し、この糖鎖が細胞壁中の糖鎖と相互作用または絡み合うことによって、細胞表層に留まることが可能である。例えば、レクチン、レクチン様タンパク質などの糖鎖結合部位などが挙げられる。代表的には、GPIアンカータンパク質の凝集機能ドメインが挙げられる。GPIアンカータンパク質の凝集機能ドメインとは、GPIアンカリングドメインよりもN末端側にあり、複数の糖鎖を有し、凝集に関与していると考えられているドメインをいう。
【0031】
この細胞表層局在タンパク質(凝集機能ドメイン)と目的のリン脂質代謝酵素とを結合することにより、細胞表層に酵素が提示される。例えば、細胞表層局在タンパク質(凝集機能ドメイン)の(1)N末端側にリン脂質代謝酵素を結合させる、(2)C末端側にリン脂質代謝酵素を結合させる、および(3)N末端側およびC末端側の両方に、同一または異なるリン脂質代謝酵素を結合させることができる。このようにして細胞表層に提示されたリン脂質代謝酵素は、そのN末端側またはC末端側が表層に固定される。
【0032】
上記組換えDNAに用いられる分泌シグナル配列は、細胞表層局在タンパク質の分泌シグナル配列を用いてもよいし、発現したリン脂質代謝酵素を細胞外へ導くことができる他の分泌シグナル配列を用いてもよい。例えば、グルコアミラーゼの分泌シグナル配列、酵母のα−またはa−アグルチニンの分泌シグナル配列、リパーゼの分泌シグナル配列が好適に用いられる。酵素活性に影響を及ぼさなければ、細胞表層提示後に分泌シグナル配列およびプロ配列の一部または全部がN末端に残ってもよい。
【0033】
本発明に使用される細胞は、目的とするリン脂質代謝酵素を細胞表層に提示するようにDNAを導入して、形質転換された細胞である。導入されるDNAは、少なくとも、分泌シグナル配列、糖鎖結合タンパク質ドメイン、および目的とするリン脂質代謝酵素をコードする配列を含む。さらに、もう1つの同じまたは別のリン脂質代謝酵素をコードする配列を含んでいてもよい。
【0034】
上記の各種配列を含むDNAの合成および結合は、当業者が通常用い得る技術で行われ得る。
【0035】
上記DNAはプラスミドの形態であることが望ましい。DNAの取得の簡易化の点からは、大腸菌とのシャトルベクターであることが好ましい。このDNAの出発材料は、例えば、酵母の2μmプラスミドの複製起点(Ori)とColE1の複製起点とを有しており、また、酵母選択マーカー(例えば、薬剤耐性遺伝子、TRP、LEU2など)および大腸菌の選択マーカー(薬剤耐性遺伝子など)を有することがさらに好ましい。また、酵素の構造遺伝子を発現させるために、この遺伝子の発現を調節するオペレーター、プロモーター、ターミネーター、エンハンサーなどのいわゆる調節配列をも含んでいることが望ましい。例えば、GAPDH(グリセルアルデヒド3’−リン酸デヒドロゲナーゼ)プロモーターおよびGAPDHターミネーターが挙げられる。このような出発材料のプラスミドの例としては、GAPDH(グリセルアルデヒド3’−リン酸デヒドロゲナーゼ)プロモーター配列およびGAPDHターミネーター配列を含むプラスミドpYGA2270またはpYE22m、あるいはUPR−ICL(イソクエン酸リアーゼ上流領域)配列とTerm−ICL(イソクエン酸リアーゼのターミネーター領域)配列とを含むプラスミドpWI3などが挙げられる。
【0036】
好適には、プラスミドpYGA2270またはpYE22mのGAPDHプロモーター配列とGAPDHターミネーター配列との間、あるいはプラスミドpWI3のUPR−ICLの配列とTerm−ICLの配列との間に、所望のリン脂質代謝酵素をコードするDNAを挿入すれば、酵母に導入するために使用されるプラスミドが製造される。本発明においては、好適には、マルチコピー型のプラスミドpWIFSまたはpWIFLが用いられ、例えば、pWIFS−ProROL(非特許文献4参照)、pWIFS−PLA1、またはpWIFL−ProROLが製造される。
【0037】
宿主の酵母としては、どのような酵母を用いてもよいが、凝集性の酵母が、反応後の分離が簡単である点で、あるいは簡単に固定できるため連続反応を行い得る点で好ましい。あるいは、糖鎖結合タンパク質ドメインとして、凝集機能ドメインを使用する場合は、どのような酵母にも強い凝集性を付与することができる。
【0038】
本発明の方法で用いられる細胞は、上記DNAを細胞に導入することにより得られる。DNAの導入とは、細胞の中にDNAを導入し、発現させることを意味する。DNAの導入の方法には、形質転換、形質導入、トランスフェクション、コトランスフェクション、エレクトロポレーションなどの方法があり、具体的には、酢酸リチウムを用いる方法、プロトプラスト法などがある。
【0039】
導入されるDNAは、前述のようなプラスミドの形態であってもよく、あるいは宿主の遺伝子に挿入して、または宿主の遺伝子と相同組換えを起こして染色体に取り込まれてもよい。
【0040】
DNAが導入された細胞は、選択マーカー(例えば、TRP)で選択され、発現されたリン脂質代謝酵素の活性を測定することにより選択される。リン脂質代謝酵素が細胞表層に固定されていることは、このリン脂質代謝酵素に対する抗タンパク質抗体とFITC標識抗IgG抗体とを用いる免疫抗体法によって確認できる。
【0041】
上記のようにして得られたリン脂質代謝酵素を細胞表層に提示する組換え細胞は、この細胞を維持し得る培地を含む懸濁液中で低温保存または凍結保存され得るか、あるいは低温乾燥または凍結乾燥して保存され得る。
【0042】
本発明で用いられるリン脂質代謝酵素表層提示細胞は、担体に固定化されていてもよい。本発明に用い得る担体の材質としては、例えば、ポリビニルアルコール、ポリウレタンフォーム、ポリスチレンフォーム、ポリアクリルアミド、ポリビニルフォルマール樹脂多孔質体、シリコンフォーム、セルロース多孔質体などの発泡体あるいは樹脂が好ましい。増殖および活性が低下した細胞あるいは死滅した細胞の脱落などを考慮すると、多孔質の担体が好ましい。多孔質体の開口部の大きさは細胞によっても異なるが、細胞が十分に入り込めて、増殖できる大きさが適当である。50μm〜1000μmが好適であるが、これに限定されない。
【0043】
また、担体の形状は問わない。担体の強度、培養効率などを考慮すると、球状あるいは立方体状であり、大きさは、球状の場合、直径が2mm〜50mm、立方体状の場合、2mm〜50mm角が好ましい。
【0044】
本明細書において、酵母の固定化とは、酵母が遊離の状態ではない状態を意味し、例えば、酵母が担体に結合あるいは付着または担体内部に取り込まれた状態などをいう。酵母の固定化には、例えば、担体結合法、架橋法および包括法などの当業者が通常用いる方法が適用できる。なかでも、凝集性の酵母の固定化には、担体結合法が最適である。担体結合法には、イオン交換性の樹脂に吸着させる化学的吸着法あるいは物理的吸着法が含まれる。
【0045】
本発明において、上記固定化リン脂質代謝酵素は、界面活性剤により処理されている。ここで、界面活性剤によるリン脂質代謝酵素の処理とは、リン脂質代謝酵素を界面活性剤と接触させることをいい、この処理により、リン脂質代謝酵素は界面活性剤で被覆される。例えば、界面活性剤処理されたリン脂質代謝酵素は、固定化リン脂質代謝酵素を、界面活性剤の水溶液中に入れて振とう処理し、次いで蒸留水で洗浄することによって得られる。
【0046】
本発明において用いられる界面活性剤は、特に限定されないが、生化学領域で一般的に用いられるものが好ましい。イオン性界面活性剤(陰イオン性界面活性剤、陽イオン性界面活性剤、および両性界面活性剤)ならびに非イオン性界面活性剤のいずれであってもよい。
【0047】
本発明においては、非イオン性界面活性剤が特に好適に用いられる。非イオン性界面活性剤としては、このような非イオン性界面活性剤としては、例えば、脂肪酸系(非イオン)(例えば、スクロース脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド)、高級アルコール系(非イオン)(例えば、ポリオキシエチレンアルキルエーテル)、およびアルキルフェノール系(例えば、ポリオキシエチレンアルキルフェニルエーテル)が挙げられる。より具体的には、Tween系界面活性剤、Triton系界面活性剤、Brij系界面活性剤が挙げられる。本発明においては、好ましくはTween20、Tween40、Tween60、およびTween80、より好ましくはTween20が用いられる。
【0048】
本発明においては、イオン性界面活性剤の中で、陰イオン性界面活性剤が好適に御地いられる。陰イオン性界面活性剤としては、アルキル硫酸ナトリウム(例えば、ドデシル硫酸ナトリウム(SDS))、アルキルベンゼンスルホン酸塩、コール酸ナトリウムなどが挙げられる。
【0049】
固定化リン脂質代謝酵素の処理工程において、固定化リン脂質代謝酵素を、上記界面活性剤と水溶液中で接触させる。界面活性剤の水溶液の濃度は、用いる界面活性剤に応じて異なる。非イオン性界面活性剤を用いる場合は、通常は0.05%(w/v)〜5%(w/v)、好ましくは0.1%(w/v)〜3%(w/v)、より好ましくは、0.5%(w/v)〜2%(w/v)である。接触させる時間は、濃度に応じて異なるが、通常は1〜48時間、好ましくは6〜36時間、より好ましくは12〜24時間であり得る。接触させる際の温度は、酵素が失活しない温度であり得、通常20〜37℃の範囲内である。酵素と界面活性剤との接触後、酵素を水で洗浄することが好ましい。
【0050】
上記のような界面活性剤により処理されたリン脂質代謝酵素を用いて、機能性リン脂質を製造する方法が提供される。本発明において、機能性リン脂質とは、目的の構造を有するように改変されたリン脂質をいい、その構造は特定されない。例えば、リン脂質の疎水性部位を他の脂肪酸に置換するエステル交換、あるいはリン脂質の極性部位を置換するリン酸基転移によって得られる改変されたリン脂質が挙げられる。
【0051】
本発明の方法に用いられるリン脂質は、その起源は特に限定されず、天然物由来(例えば、抽出物、濃縮物)であってもよく、または化学的に合成されたものでもよい。このようなリン脂質としては、ホスファチジルエタノールアミン(PE)、ホスファチジルコリン(PC)、ホスファチジルセリン(PS)、ホスファチジルイノシトール(PI)、ホスファチジルグリセロール(PG)などが挙げられ、これらの混合物であってもよい。
【0052】
これらのリン脂質の構成脂肪酸は、同一または異種の炭素数8〜24の飽和または不飽和脂肪酸である。このような脂肪酸としては、カプリル酸、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、ベヘン酸、アラキジン酸、パルミトオレイン酸、オレイン酸、リノール酸、α−およびγ−リノレイン酸、エルシン酸、アラキドン酸、エイコサペンタエン酸、ドコサヘキサエン酸、テトラコサテトラエン酸などが挙げられる。
【0053】
エステル交換反応に用いられる脂肪酸は、目的に応じて適宜選択される。好ましくは、炭素数8〜24の同一の飽和または不飽和脂肪酸である。このような脂肪酸は、上述のとおりである。
【0054】
リン酸基転移反応に用いられるエステルは、一塩基酸のエステルであってもよく、二塩基酸以上の酸のエステルであってもよい。二塩基酸以上の酸のエステルの場合は、中性エステルであることが好ましい。カルボン酸エステルとしては、例えば、酢酸エステル、プロピオン酸エステル、コハク酸エステル、マレイン酸エステル、安息香酸エステルなどが挙げられる。
【0055】
本発明の機能性リン脂質の製造方法において用いられる反応液は、細胞表層や担体に固定化されかつ界面活性剤処理されたリン脂質代謝酵素が酵素活性を示すことができるものであれば、特に限定されず、緩衝液や有機溶媒であってもよい。上記のようにリン脂質代謝酵素がリパーゼの場合は、エステルおよびアルコール以外の有機溶媒を用いることが好ましい。このような有機溶媒としては、ペンタン、ヘキサン、シクロヘキサン、ヘプタン、オクタン、ノナン、デカン、ベンゼン、トルエン、ジエチルエーテル、アセトン、アセトニトリル、クロロホルム、ジクロロエタン、テトラヒドロフランなどが挙げられる。
【0056】
本発明の方法においては、例えば、上記固定化リン脂質代謝酵素と、上記基質(例えば、リン脂質および脂肪酸)を含む上記反応液とを混合することによって、酵素と基質とを接触させて、目的のリン脂質を得ることができる。この場合の反応条件は、固定化された酵素が酵素活性を示すことができるものであれば、特に限定されず、基質濃度、反応温度、反応時間などは、当業者であれば適宜決定し得る。反応終了後、目的の生成物は、この生成物に応じた手段(例えば、抽出、カラムクロマトグラフィーなど)により、回収・精製され得る。
【0057】
このようにして得られた機能性リン脂質は、そのままリン脂質として食品や医薬品の原料などに利用可能である。
【実施例】
【0058】
(調製例1:リパーゼ細胞表層提示酵母の調製)
酵母菌株として、Saccharomyces cerevisiae MT8-1(MATa, ade, his3, leu2, trp1, ura3)(Tajimaら、Yeast,1985年,1巻,67-77頁)を用いた。以前の研究(非特許文献4)で構築されたプラスミドpWIFS−ProROLを、酢酸リチウム法により酵母株に導入した。このプラスミドは、酵母の細胞表層に糸状菌Rhizopus oryzae由来リパーゼ(ROL)を生産・固定させる遺伝子を有するベクターである。
【0059】
形質転換された酵母を5mLのSD(Synthetic Dropout)培地[0.67%(w/v)DIFCOTM Yeast nitrogen base w/o amino acid、2%(w/v)D−グルコース、100mg/LのL−ロイシン、ならびにそれぞれ20mg/Lのアデニン、ウラシル、およびL−ヒスチジン]で1日培養し(30℃、150opm)、波長600nmにおける初期菌体濃度OD(Optical density)が0.03となるようにSDC培地[SD培地に2%(w/v)のカザミノ酸を加えた培地]へ植菌した。菌体は、30℃で7日間培養した。培養後の菌体は蒸留水を用いて洗浄し、凍結乾燥した。この菌体をリパーゼ細胞表層提示酵母(以下、ROL表層提示酵母と略す)として用いた。
【0060】
(実施例1:界面活性剤で処理したリパーゼ細胞表層提示酵母の調製)
上記調製例1で得られた粉末状態のROL表層提示酵母を10mg−dry cell/mLとなるように蒸留水に懸濁し、1%(w/v)の各種界面活性剤を加えた。界面活性剤としては、非イオン性界面活性剤のポリオキシエチレンソルビタンモノラウレートであるTween20、Tween40、Tween60、およびTween80、ならびに陰イオン性界面活性剤であるドデシル硫酸ナトリウム(SDS)を用いた。この懸濁液を、30℃にて150opmで16時間振とう処理し、酵母表層をこれらの界面活性剤によって被覆した。処理後の懸濁液を8000rpmで5分間遠心分離し、沈殿した酵母を蒸留水で洗浄する操作を2回繰り返した後、減圧下で乾燥させた。こうして得られた白色の粉末を、界面活性剤処理リパーゼ表層提示酵母(以下、界面活性剤処理ROL表層提示酵母)とした。
【0061】
(参考例1:ROL表層提示酵母の菌体量がエステル交換反応に及ぼす影響の検討)
リン脂質の原料として、和光純薬工業株式会社より購入した卵黄由来ホスファチジルコリン(以下、PCと略す)を用いた。エステル交換反応は、50mgのPCおよび100mgのラウリン酸(LAと略す)をヘキサン5mLに溶解し、上記調製例1で得られた種々の量のROL表層提示酵母を添加して反応を開始した。反応温度は30℃であり、そして振とう条件は150opmであった。各反応時間におけるエステル交換率を測定するために、約300μLのヘキサン層を採取した。
【0062】
次いで、採取したヘキサンを揮発させ、残った脂質成分を少量(約10μL)のクロロホルムに溶解した。このクロロホルムを薄層クロマトグラフィー(展開溶媒:クロロホルム/メタノール/水,65/35/4,v/v/v)で展開し、リン脂質、リゾリン脂質、脂肪酸などを分離した。分離したリン脂質のみを含むシリカゲルを採取し、メタノール/トルエン溶液(4/1,v/v)3mLに加えてリン脂質を抽出した。この抽出液に塩化アセチル200μLを添加し、50℃で1時間撹拌することにより、リン脂質に含まれる脂肪酸をメチル化した。脂肪酸メチルの組成をガスクロマトグラフィーで分析してリン脂質脂肪酸組成を決定し、エステル交換率を算出した。結果を図2に示す。
【0063】
ROL表層提示酵母は、有機溶媒を用いない加水分解反応やエステル合成反応では高い活性を示すことが知られている(非特許文献4)。しかしながら、図2に示すように、処理を行っていないROL表層提示酵母を用いたPCのエステル交換反応において、菌体量を増やしてもエステル交換率はほとんど向上せず、どの菌体量においても10%以下の値を示した。これは、疎水性有機溶媒であるヘキサンに対する酵母の分散性が問題であると考えられる。
【0064】
(実施例2:Tween20処理リパーゼ表層提示酵母を用いるリン脂質のエステル交換反応)
50mgのPCおよび100mgのLAをヘキサン5mLに溶解し、上記実施例1で得られたTween20処理ROL表層提示酵母50mgを添加して反応を開始した。反応温度は30℃、振とう条件は150opmであった。なお、コントロールとして上記調製例1で得られたROL表層提示酵母について、同様に反応を行った。各反応時間におけるエステル交換率を測定するために、約300μLのヘキサン層を採取した。
【0065】
次いで、採取したヘキサンを揮発させ、残った脂質成分を少量(約10μL)のクロロホルムに溶解した。このクロロホルムを薄層クロマトグラフィー(展開溶媒:クロロホルム/メタノール/水,65/35/4,v/v/v)で展開し、リン脂質、リゾリン脂質、脂肪酸などを分離した。分離したリン脂質のみを含むシリカゲル画分を採取し、メタノール/トルエン溶液(4/1,v/v)3mLに加えてリン脂質を抽出した。この抽出液に塩化アセチル200μLを添加し、50℃で1時間撹拌することにより、リン脂質に含まれる脂肪酸をメチル化した。脂肪酸メチルの組成をガスクロマトグラフィーで分析してリン脂質脂肪酸組成を決定し、エステル交換率を算出した。結果を図3に示す。
【0066】
図3に示すように、Tween20処理を行った場合、エステル交換活性の飛躍的な向上が確認された。したがって、リパーゼ表層提示酵母における細胞表層のTween20処理が、リン脂質の分子構造の改変に極めて有効であることが分かった。
【0067】
(実施例3:界面活性剤の種類の検討)
上記実施例1で得られた種々の界面活性剤で処理されたROL表層提示酵母について、エステル交換率を上記実施例2と同様に操作して測定した。反応時間は48時間であった。結果を表1に示す。
【0068】
【表1】

【0069】
表1に示すように、全ての非イオン性界面活性剤(各種Tween)処理ROL表層提示酵母では、エステル交換活性が向上した。その中でも、Tween20が最も効果的であった。
【0070】
(実施例4:リパーゼ表層提示酵母の細胞表面疎水性)
界面活性剤処理によりエステル交換活性が増大する原因を追究する目的で、酵母細胞表面の疎水性を以下のようにして測定した。
【0071】
まず、ROL表層提示酵母および種々の界面活性剤処理ROL表層提示酵母を、生理食塩水[0.49%(wt)NaCl,0.49%(wt)KCl)]に懸濁し、波長600nmにおける菌体濃度(OD600)を測定した。このときの値をC1とした。酵母懸濁液3mLに対して、1mLのヘキサンを添加し、10秒間ボルテックスで混合し、そして10分間静置した。水相(下層)の菌体濃度(OD600)を測定し、この値をC2とした。
【0072】
細胞表面の疎水性(Hydropathy index:HI)を求める式は、
(C1−C2)/C2=HI ・・・(1)
と定義される。また(1)式は、
log(C1−C2)=logC2+logHI ・・・(2)
と変換することができる。この(2)式より、logC2=0のときlogHI=log(C1−C2)となるため、log(C1−C2)をY(縦)軸、logC2をX(横)軸にプロットして近似直線を求めると、Y切片の値がlogHIを示す。このlogHIの値を、細胞表面の疎水性を表す指標として用いた。例えば、細胞が強い疎水性を有する場合、大部分の細胞は上層(ヘキサン層)へ移行する。この場合、Y切片はより高い値を示すので、高いlogHI値は強い疎水性を示す。結果を表2に示す。
【0073】
【表2】

【0074】
表2に示すように、非イオン性界面活性剤で処理することによって、疎水性の指標であるlogHIは増加することが分かった。特に、Tween20を用いたときのlogHIの増加が顕著であった。これは、表1に示すエステル交換活性の増大と深い関連性があると考えられた。以上の結果より、非イオン性界面活性剤を用いた処理による酵母細胞表面の疎水性の変化が、リン脂質のエステル交換活性に大きく関与している可能性が示唆された。
【0075】
(調製例2:固定化リパーゼの調製)
R. oryzae由来リパーゼ粉末(製品名:Lipase F−AP15、天野エンザイム株式会社)250mgを100mMリン酸緩衝液(pH7)5mLに溶解させた。Tween20による処理を行うときには、1%(w/v)のTween20をバッファーに加えた。陰イオン交換樹脂であるDIAION HPA−25(三菱化学株式会社)1gを上記の溶液に添加し、20℃にて150opmで振とうすることにより、リパーゼを固定化した。リパーゼが固定化した樹脂を蒸留水で2回洗浄し、減圧下で乾燥後、固定化リパーゼを得た。
【0076】
(実施例5:Tween20処理固定化リパーゼのエステル交換活性に及ぼす影響の検討)
酵母細胞に対して効果のあったTween20処理が、一般的によく用いられている固定化リパーゼに対しても有効であるかを検証した。
【0077】
上記調製例2で得られた固定化リパーゼについて、上記実施例1と同様に操作してTween20処理固定化リパーゼを得た。次いで、Tween20処理固定化リパーゼ50mgを用いたこと以外は、上記実施例2と同様に操作して、PCのエステル交換反応を行った。反応時間は48時間であった。結果を表3に示す。
【0078】
【表3】

【0079】
表3に示すように、Tween20処理固定化リパーゼは、エステル交換率が顕著に増加した。したがって、界面活性剤処理は、酵母のような細胞だけでなく、分泌酵素を固定化した場合にも有効であることが示唆された。
【産業上の利用可能性】
【0080】
本発明によれば、簡単な工程によって、高い反応性を有するリン脂質代謝酵素が提供され、この酵素を機能性リン脂質の合成に利用でき、さらに現状の機能性リン脂質の製造工程を簡略化できる。したがって、リン脂質の製造の大幅なコストダウンを図ることができる。そのため、機能性リン脂質を、食品や医薬品の原料などとしてより安価に提供できる。
【図面の簡単な説明】
【0081】
【図1】リン脂質の基本構造および酵素の作用部位を示す模式図である。
【図2】エステル交換反応系に添加したROL表層提示酵母量とエステル交換率との関係を示すグラフである。
【図3】Tween20処理ROL表層提示酵母によるエステル交換反応の経時変化を示すグラフである。
【特許請求の範囲】
【請求項1】
界面活性剤により処理された固定化リン脂質代謝酵素。
【請求項2】
前記リン脂質代謝酵素が、細胞表層に提示されている、請求項1に記載の酵素。
【請求項3】
前記細胞が、酵母細胞である、請求項2に記載の酵素。
【請求項4】
前記リン脂質代謝酵素が、単離または抽出された精製または粗精製酵素である、請求項1に記載の酵素。
【請求項5】
前記界面活性剤が、非イオン性界面活性剤である、請求項1から4のいずれかの項に記載の酵素。
【請求項6】
前記非イオン性界面活性剤が、Tween系界面活性剤である、請求項5に記載の酵素。
【請求項7】
前記リン脂質代謝酵素が、リパーゼである、請求項1から6のいずれかの項に記載の酵素。
【請求項8】
固定化リン脂質代謝酵素を、界面活性剤と接触させる工程;および
次いで、該固定化リン脂質代謝酵素を蒸留水で洗浄する工程;
を含む、界面活性剤により処理された固定化リン脂質代謝酵素の製造方法。
【請求項9】
前記リン脂質代謝酵素が、細胞表層に提示されている、請求項8に記載の方法。
【請求項10】
前記細胞が、酵母細胞である、請求項9に記載の方法。
【請求項11】
前記リン脂質代謝酵素が、単離または抽出された精製または粗精製酵素である、請求項8に記載の方法。
【請求項12】
前記界面活性剤が、非イオン性界面活性剤である、請求項8から11のいずれかの項に記載の方法。
【請求項13】
前記非イオン性界面活性剤が、Tween系界面活性剤である、請求項12に記載の方法。
【請求項14】
前記リン脂質代謝酵素が、リパーゼである、請求項8から13のいずれかの項に記載の方法。
【請求項15】
請求項1から7のいずれかの項に記載の固定化リン脂質代謝酵素を、リン脂質および基質と接触させる工程;および
得られた機能性リン脂質を回収する工程
を含む、機能性リン脂質の製造方法。
【請求項16】
前記リン脂質代謝酵素がリパーゼであり、そして前記基質が脂肪酸である、請求項15に記載の方法。
【請求項1】
界面活性剤により処理された固定化リン脂質代謝酵素。
【請求項2】
前記リン脂質代謝酵素が、細胞表層に提示されている、請求項1に記載の酵素。
【請求項3】
前記細胞が、酵母細胞である、請求項2に記載の酵素。
【請求項4】
前記リン脂質代謝酵素が、単離または抽出された精製または粗精製酵素である、請求項1に記載の酵素。
【請求項5】
前記界面活性剤が、非イオン性界面活性剤である、請求項1から4のいずれかの項に記載の酵素。
【請求項6】
前記非イオン性界面活性剤が、Tween系界面活性剤である、請求項5に記載の酵素。
【請求項7】
前記リン脂質代謝酵素が、リパーゼである、請求項1から6のいずれかの項に記載の酵素。
【請求項8】
固定化リン脂質代謝酵素を、界面活性剤と接触させる工程;および
次いで、該固定化リン脂質代謝酵素を蒸留水で洗浄する工程;
を含む、界面活性剤により処理された固定化リン脂質代謝酵素の製造方法。
【請求項9】
前記リン脂質代謝酵素が、細胞表層に提示されている、請求項8に記載の方法。
【請求項10】
前記細胞が、酵母細胞である、請求項9に記載の方法。
【請求項11】
前記リン脂質代謝酵素が、単離または抽出された精製または粗精製酵素である、請求項8に記載の方法。
【請求項12】
前記界面活性剤が、非イオン性界面活性剤である、請求項8から11のいずれかの項に記載の方法。
【請求項13】
前記非イオン性界面活性剤が、Tween系界面活性剤である、請求項12に記載の方法。
【請求項14】
前記リン脂質代謝酵素が、リパーゼである、請求項8から13のいずれかの項に記載の方法。
【請求項15】
請求項1から7のいずれかの項に記載の固定化リン脂質代謝酵素を、リン脂質および基質と接触させる工程;および
得られた機能性リン脂質を回収する工程
を含む、機能性リン脂質の製造方法。
【請求項16】
前記リン脂質代謝酵素がリパーゼであり、そして前記基質が脂肪酸である、請求項15に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2008−178305(P2008−178305A)
【公開日】平成20年8月7日(2008.8.7)
【国際特許分類】
【出願番号】特願2007−12580(P2007−12580)
【出願日】平成19年1月23日(2007.1.23)
【出願人】(502059825)Bio−energy株式会社 (16)
【Fターム(参考)】
【公開日】平成20年8月7日(2008.8.7)
【国際特許分類】
【出願日】平成19年1月23日(2007.1.23)
【出願人】(502059825)Bio−energy株式会社 (16)
【Fターム(参考)】
[ Back to top ]

