蛍光物質検出装置とそれを含む検体分析装置
【課題】様々な生化学反応カートリッジに対してそれぞれ適切な条件で高精度の検出が行える蛍光物質検出装置を提供する。
【解決手段】 透光性を有するDNAチップ12の表面上の反射板33に裏面側から励起光を照射し、反射板33による反射光を光電子増倍管37によって受光し、光強度を測定する。この光強度測定値を、予め記憶していた光強度基準値と比較する。その比較結果に応じて、レーザ光発生器34の出力強度を調整する。それから、DNAチップ12のDNAプローブ32に向けて励起光を照射し、励起された蛍光物質からの蛍光を光電子増倍管37によって受光する。その蛍光検出パターンに基づいて検体の分析を行う。
【解決手段】 透光性を有するDNAチップ12の表面上の反射板33に裏面側から励起光を照射し、反射板33による反射光を光電子増倍管37によって受光し、光強度を測定する。この光強度測定値を、予め記憶していた光強度基準値と比較する。その比較結果に応じて、レーザ光発生器34の出力強度を調整する。それから、DNAチップ12のDNAプローブ32に向けて励起光を照射し、励起された蛍光物質からの蛍光を光電子増倍管37によって受光する。その蛍光検出パターンに基づいて検体の分析を行う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、検体中の細胞、微生物、染色体、核酸等のサンプルを抗原抗体反応や核酸ハイブリダイゼーション反応等の生化学反応を利用して検出するために、蛍光物質を検出する装置と、それを含む検体分析装置と、蛍光物質検出方法および検体分析方法に関する。
【背景技術】
【0002】
血液等の検体を分析する検体分析装置には、抗原抗体反応を利用した免疫学的な方法や、核酸ハイブリダイゼーションを利用した方法がある。免疫学的な方法の一例では、被検出物質と特異的に結合する抗体または抗原等のタンパク質をプローブとして用い、微粒子、ビーズ、またはガラス板等の固相表面に固定して、検体中の被検出物質との抗原抗体反応を行わせる。核酸ハイブリダイゼーションを利用した方法の一例では、一本鎖の核酸をプローブとして用い、微粒子、ビーズ、ガラス板等の固相表面に固定して、検体中の被検出物質と核酸ハイブリダイゼーションを行わせる。これらの方法は、酵素、蛍光物質、または発光性物質等の、検知感度の高い標識物質を担持した特異的な相互作用を有する標識化物質である標識化抗体、標識化抗原、または標識化核酸等を用いる。そして、抗原抗体化合物またはハイブリダイズされた二本鎖の核酸を検出して、被検出物質(ターゲット)の有無の検出やその定量を行う。
【0003】
これらの技術を発展させたものとして、例えば特許文献1には、互いに異なる塩基配列を有する多数のDNA(デオキシリボ核酸)プローブを、基板上にアレイ状に並べた、いわゆるDNAアレイが開示されている。
【0004】
また、非特許文献1には、多種類のタンパク質をメンブレンフィルタ上に並べ、DNAアレイと同様な構成のタンパク質アレイを作製する方法が開示されている。このように、DNAアレイやタンパク質アレイ等を用いることによって、極めて多数の項目の検査を一度に行うことが可能になってきている。
【0005】
また、様々な検体分析における、検体による汚染の軽減、反応の効率化、装置の小型化、作業の簡便化等の目的で、内部で生化学反応を行わせる使い捨て可能な生化学反応カートリッジが提案されている。例えば、特許文献2においては、DNAアレイを含む生化学反応カートリッジ内に複数のチャンバを配設する構成が開示されている。この生化学反応カートリッジによると、圧力差を利用して溶液を各チャンバへ移動させることにより検体中のDNAの抽出、増幅、またはハイブリダイゼーション等の反応を内部で行わせることが可能である。
【0006】
そして、このような生化学反応カートリッジ内に外部から溶液を注入する方法としては、外部の電動シリンジポンプや真空ポンプを利用する方法がある。また、生化学反応カートリッジ内部で溶液を移動する方法としては、圧力差以外にも、重力や毛細管現象や電気泳動を利用する方法が知られている。さらに、生化学反応カートリッジの内部に配設できる小型のマイクロポンプとして、特許文献2にはダイアフラムポンプ、特許文献3には発熱素子を利用したポンプ、特許文献4には圧電素子を利用したポンプがそれぞれ開示されている。
【0007】
生化学反応カートリッジとして、またはその一部として用いられるDNAチップに、情報記憶用のICを設け、このICに記憶された同定情報を利用してDNAの同定を行う構成がある。具体的には、特許文献5に、DNAチップの塩基配列情報や検体の情報を情報記憶用ICに書き込むことが開示されている。
【0008】
また、DNAチップ上のサンプルのハイブリダイゼーション状態を検知するために、サンプルに付着した蛍光物質(蛍光標識)を読み取る方法がある。具体的には、特許文献6に、蛍光物質を読み取ってターゲットの検出を行うために、蛍光を発生させるようにDNAチップに照射する励起光を適宜に較正する方法が開示されている。
【特許文献1】米国特許第5,445,934号明細書
【特許文献2】特表平11−509094号公報
【特許文献3】特許第2832117号明細書
【特許文献4】特開2000−274375号公報
【特許文献5】特開2001−147231号公報
【特許文献6】特表2002−538427号公報
【非特許文献1】アンジェリカ ロイキング(Angelika Lueking)他5名、「プロテイン マイクロアレイズ フォー ジーン エクスプレッション アンド アンチボディ スクリーニング(Protein Microarrays for Gene Expression and Antibody Screening)」、アナリティカル バイオケミストリー(Analytical Biochemistry) Vol.270(1)、アカデミック プレス(Academic Press)、1999年5月15日、p.103〜111
【発明の開示】
【発明が解決しようとする課題】
【0009】
生化学反応を生じさせるために様々な溶液を内蔵し、検体が供給される生化学反応カートリッジは、二次感染や汚染の防止と、使い勝手の観点から、使い捨てにすることが好ましい。しかし、マイクロポンプを内蔵した生化学反応カートリッジは高価であるという問題がある。
【0010】
したがって、ポンプを内蔵せずに外部のポンプの作用で溶液を移動し、検体注入後は溶液を外部に流出させずに一連の生化学反応を進められる構造の、使い捨ての生化学反応カートリッジが一般に利用されている。
【0011】
個々のDNAチップは、ハイブリダイゼーションという単独の生化学反応のみを行うためのものである。しかし、DNAチップを内蔵する生化学反応カートリッジは、各種の生化学反応を連続的に行い、最後に検出工程を行う場合がある。生化学反応カートリッジによっては、例えば、内蔵するDNAチップの基板の材質、厚さ、透光率等が異なる場合がある。このようにDNAチップの基板の材質、厚さ、透光率等が異なる生化学反応カートリッジに対して常に同一の条件で励起光を照射して蛍光の検出を行っても、誤差が大きくて高精度の検出が行えない可能性がある。
【0012】
また、蛍光物質は一般的に励起光によって劣化が生じやすく、長時間または高い強度の励起光が照射されると蛍光物質の劣化が生じ検出精度が低下する場合がある。
【0013】
そこで本発明の目的は、様々な生化学反応カートリッジに対してそれぞれ適切な条件で高精度の検出が行える蛍光物質検出装置と、それを含む検体分析装置と、蛍光物質検出方法および検体分析方法を提供することにある。
【課題を解決するための手段】
【0014】
本発明の特徴は、透光性を有する基板の表面上の蛍光物質を検出する蛍光物質検出装置であって、基板の裏面に向けて照射される励起光を発生させる励起光発生手段と、透光性を有する基板を透過することで減衰した励起光を受光する第1の受光手段と、励起光により励起された蛍光物質が発する蛍光を受光する第2の受光手段と、第1の受光手段が受光した減衰した励起光の光強度測定値に応じて励起光の出力強度を調整する調整手段とを備えるところにある。
【0015】
また、本発明のもう1つの特徴は、透光性を有する基板の表面上の蛍光物質を検出する蛍光物質検出方法において、基板の裏面に向けて励起光を照射する工程と、基板を透過することにより減衰した励起光を、受光手段によって受光する工程と、受光手段が受光した減衰した励起光の光強度測定値と、予め設定されている光強度基準値とを比較して、その比較結果に応じて、励起光の出力強度を調整する工程と、出力強度が調整された励起光を基板の裏面に照射する工程と、励起光が照射された位置に存在する蛍光物質が発する蛍光を、受光手段が検出する工程とを含むところにある。
【発明の効果】
【0016】
本発明によると、様々な基板を用いても、適切な光強度の励起光を用いることによって精度良く蛍光物質の検出が行える。
【発明を実施するための最良の形態】
【0017】
以下、本発明の実施の形態について図面を参照して説明する。
【0018】
なお、以下の実施形態においては、生化学反応カートリッジを用いる形態について詳細に説明する。しかし、本発明においてはこれに限らず、いわゆるDNAチップの検出装置としても用いることが可能である。その場合、使用する光学系によっては反射手段を設けない形態もありえる。
【0019】
[第1の実施形態]
図1には、本発明の第1の実施形態における検体分析装置が概略的に示されている。この検体分析装置の処理装置は、本実施形態において反応場となる生化学反応カートリッジ1が載置されるテーブル13を有している。テーブル13上には、電磁石14と、ペルチェ素子15,16と、第1の通信部26が配置され、これらは、処理装置全体を制御する制御部17に接続されている。電磁石14は、生化学反応カートリッジ1内に電磁力を作用させるものである。ペルチェ素子15,16は、生化学反応カートリッジ1の温度を制御するものである。第1の通信部26は、処理装置のデータを、後述する生化学反応カートリッジ1内のICチップ25に記憶させるために、ICチップ25に対して電力の送信や信号の送受信を行うものである。
【0020】
テーブル13の両側には、電動シリンジポンプ18,19と、これらのポンプ18,19によって空気を排出または吸引するための出入口であり、それぞれ10個ずつのポンプノズル20,21を有するポンプブロック22,23とが配置されている。電動シリンジポンプ18,19とポンプノズル20,21の間には、図示しない複数の電動切換バルブが配置されている。図示しない電動切換バルブとポンプ18,19は制御部17に接続されている。
【0021】
制御部17は検査者が入力を行う入力部24に接続されている。この制御部17は、ポンプノズル20,21を1個ずつ独立して開閉して電動シリンジポンプ18,19に対する接続および遮断を制御したり、全てのポンプノズル20,21を同時に開閉するなどの制御を行うことができる。また、制御部17は、電磁石14およびペルチェ素子15,16を適宜に作動させることによって、生化学反応カートリッジ1内での生化学反応を実行させる。
【0022】
テーブル13およびポンプブロック22,23の外部に、検出用エリア28が設けられている。この検出用エリア28は、生化学反応カートリッジ1のDNAチップ12のハイブリダイゼーション状態を検知するため、すなわち蛍光物質を検出するために設けられている。
【0023】
検出用エリア28には、XYステージ29と、蛍光検出ユニット30と、第2の通信部31が設けられており、これらも制御部17に接続されている。XYステージ29は、生化学反応カートリッジ1のX方向への移動(主走査)と、Y方向への移動(副走査)を行うためのものである。副走査は、1回の主走査が行われる度に、その主走査のスキャン幅分だけ、主走査方向に交差する方向(本実施形態では直交する方向)に行われる。蛍光検出ユニット30の詳細な構成については後述するが、主に光学機器で構成され、蛍光体を励起させて発生させた蛍光の強度を測定可能なものである。また、蛍光検出ユニット30は、励起光の強度を適宜に調整することもできる。第2の通信部31は、生化学反応カートリッジ1内のICチップ25に対して、電力の送信や信号の送受信を行うものである。
【0024】
さらに、制御部17の指令によって生化学反応カートリッジ1をテーブル13上から検出用エリア28へ搬送するカートリッジ搬送部27が設けられ、制御部17に接続されている。
【0025】
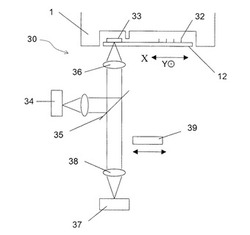
次に、本発明の主な特徴の1つである蛍光検出ユニット30の構成について、図2を参照して説明する。蛍光検出ユニット30は、主に、レーザ光発生器34と、スプリッタ35と、対物レンズ36と、光電子増倍管37と、レンズ38と、フィルタ39を有している。
【0026】
レーザ光発生器34は、レーザ光(励起光)を照射して、生化学反応カートリッジ1のDNAチップ12に位置する検体中の蛍光物質を励起して蛍光を発生させるためのレーザ光源であり、出力強度を調整可能である。スプリッタ35は、レーザ光発生器34からのレーザ光をDNAチップ12へ向けて90度屈曲させるとともに、DNAチップ12からの反射光や蛍光を透過させる。対物レンズ36は、DNAチップ12に対向し、制御部17および上下機構(図示せず)によって位置調整されてレーザ光をDNAチップ12に集光させる。レンズ38は、スプリッタ35を透過したDNAチップ12からの反射光や蛍光を光電子増倍管37に集光させる。光電子増倍管37は、レンズ38により集光された光が入射され、その入射光を検出するものである。フィルタ39は、制御部17および移動機構(図示せず)によって、DNAチップ12から光電子増倍管37へ至る光路上と光路外との間を移動可能である。このフィルタ39は、光路内に位置するときに、DNAチップ12からの蛍光を透過させるが、DNAチップ12からの反射光を遮断するものである。
【0027】
このような構成であるため、レーザ光発生器34からスプリッタ35を介して対物レンズ36に入射した平行光(レーザ光)が、対物レンズ36によってDNAチップ12上に合焦する。そして、レーザ光によって励起された蛍光物質から発せられる蛍光や、DNAチップ12に設けられた後述する反射板33からの反射光が、対物レンズ36によって平行光にされた後、スプリッタ35を透過する。スプリッタを透過した平行光は、フィルタ39が光路外にある場合にはそのままの状態で、フィルタ39が光路上に位置する場合には蛍光のみが透過して、レンズ38を介して光電子増倍管37に入射する。光電子増倍管37は、入射した光を検出してその光強度を測定する。
【0028】
次に、この処理装置における反応場となる生化学反応カートリッジ1について詳細に説明する。
【0029】
生化学反応カートリッジ1の本体(筐体)はポリメタクリル酸メチル(PMMA)、アクリルニトリル−ブタジエン−スチレン(ABS)共重合体、ポリスチレン、ポリカーボネート、ポリエステル、ポリ塩化ビニル等の透明または半透明の合成樹脂から構成されている。
【0030】
図3に示すように、生化学反応カートリッジ1の上部には、注射器等を用いて血液等の検体を注入するための検体入口2aが設けられ、ゴムキャップ2により封止されている。また、生化学反応カートリッジ1の側面には、内部の溶液を移動させるためにノズルを挿入して加圧または減圧を行うための複数のノズル入口3a〜3jが設けられ、ゴムキャップ3により封止されている。カートリッジ1の両面とも同様の構成になっている。
【0031】
生化学反応カートリッジ1にはICチップ25が設けられている。ICチップ25は、不揮発性の記憶部と、外部からの電力の受信と信号の送受信のための通信部を有している。ICチップ25の記憶部には、生化学反応カートリッジ1を識別するための識別情報(ID)が書き込まれている。さらに、この記憶部に、生化学反応カートリッジ1の種別や、処理工程の手順や、生化学反応の結果を分析するための分析用情報なども書き込まれることが好ましい。
【0032】
通常、処理装置またはそれに付属する装置には、生化学反応カートリッジ1の種別ごとの処理工程の手順が記憶されている。前記したようにICチップ25に生化学反応カートリッジ1の種別が書き込まれている場合には、その種別を読み取ってそれに適合する処理工程の手順を選択し、その手順に則って処理を行う。しかし、生化学反応カートリッジ1の種別が、処理装置またはそれに付属する装置に記憶されていない種別であった場合には、ICチップ25に書き込まれている処理工程の手順を読み込んで、その手順に則って処理を行う。処理工程の手順として書き込まれるデータの中には、生化学反応を起こすために加えられる温度条件等も含まれていてもよい。
【0033】
図4は生化学反応カートリッジ1の平面断面図を示している。前記したように片側の側面には10個のノズル入口3a〜3jが設けられ、反対側の側面にも10個のノズル入口3k〜3tが設けられている。各ノズル入口3a〜3tのほとんどは、それぞれの空気が流れる空気流路4a〜4tを介して、溶液を貯蔵する場所または反応を起こす場所であるチャンバ5a〜5tに連通している。つまり、ノズル入口3a〜3jは流路4a〜4jを介してチャンバ5a〜5jに連通している。反対側のノズル入口3k,3l,3m,3o,3r,3tは、それぞれ流路4k,4l,4m,4o,4r,4tを介してチャンバ5k,5l,5m,5o,5r,5tに連通している。ただし、本実施形態では、ノズル入口3n,3p,3q,3sはチャンバに連通しておらず予備になっており、使用されない。
【0034】
検体入口2aはチャンバ7に連通し、チャンバ7は流路6a,6b,6c,6kを介してチャンバ5a,5b,5c,5kに連通しているとともに、流路10を介してチャンバ8に連通している。チャンバ8は流路6g,6oを介してチャンバ5g,5oに連通しているとともに、流路11を介してチャンバ9に連通している。チャンバ9は流路6h,6i,6j,6r,6tを介してチャンバ5h,5i,5j,5r,5tに連通している。また、流路10は流路6d,6e,6f,6l,6mを介してチャンバ5d,5e,5f,5l,5mに連通している。
【0035】
チャンバ9の底面には角孔が開けられ、この角孔に、図2,5に示すDNAチップ12が、プローブ面を上にしてに貼り付けられている。DNAチップ12は、1平方インチ(約645mm2)程度の大きさを持つガラス板の固相表面に、数十〜数十万種類の異なるDNAプローブ32が高密度に並べられたものである。本実施形態では、このDNAチップ12を用いて、検体中のDNAとハイブリダイゼーション反応を行わせることによって、一度に数多くの遺伝子を検査できる。これらのDNAプローブ32はマトリックス状に規則正しく並べられており、それぞれのDNAプローブ32のアドレス(何行・何列と示される位置)を、情報として容易に取り出すことができる。なお、検査の対象となる遺伝子としては、感染症ウィルス、細菌、疾患関連遺伝子、各個人の遺伝子多型等がある。また、DNAチップ12には、DNAプローブ32がマトリックス状に配置された領域と並置して、反射板33が設けられている。この反射板33は、DNAチップ12の裏面からの励起光(図2に示すレーザ光)を反射するものである。
【0036】
ここで、本実施形態において検体の処理を行うための、各チャンバ5a〜5tのセッティングの一例を示す。チャンバ5aには、細胞壁を破壊するEDTA(エチレンジアミン四酢酸)を含む第1の溶血剤が、チャンバ5bには、界面活性剤等のタンパク質変性剤を含む第2の溶血剤がそれぞれ収容されている。チャンバ5cには、DNAが吸着するシリカコーティングされた磁性体粒子が収容されている。チャンバ5l、チャンバ5mには、DNAの抽出の際にDNAの精製を行うために用いられる第1、第2の抽出洗浄剤がそれぞれ収容されている。
【0037】
チャンバ5dには、DNAを磁性体粒子から溶出する低濃度塩のバッファからなる溶出液が収容されている。チャンバ5gには、PCR(ポリメラーゼ連鎖反応)に必要な薬剤、すなわち、プライマ、ポリメラーゼ、dNTP溶液、バッファ、蛍光剤を含むCy3−dUTP(アマシャム バイオサイエンス株式会社製の蛍光標識)等の混合液が収容されている。チャンバ5h,5jには、ハイブリダイゼーションしなかった蛍光物質(蛍光標識)付きの検体DNAと蛍光物質(蛍光標識)とを洗浄するための界面活性剤を含む洗浄剤が収容されている。チャンバ5iには、DNAチップ12を含むチャンバ9内を乾燥させるためのアルコールが収容されている。
【0038】
なお、チャンバ5eは血液のDNA以外の塵埃を溜めるためのチャンバである。チャンバ5fは、チャンバ5l,5mからの第1、第2の抽出洗浄剤の廃液を溜めるためのチャンバである。チャンバ5rは第1、第2の洗浄剤の廃液を溜めるためのチャンバである。チャンバ5k,5o,5tは、溶液がノズル入口に流れ込まないようにするために設けられたブランクのチャンバである。
【0039】
本実施形態では、この生化学反応カートリッジ1に血液等の液体状の検体を注入して、前記した処理装置(図1参照)にセットする。そして、生化学反応カートリッジ1の内部で、DNA等の抽出および増幅を行わせ、増幅された検体DNAと生化学反応カートリッジ1の内部にあるDNAチップ12のDNAプローブ32との間で、ハイブリダイゼーションを行わせる。一方、ハイブリダイゼーションしなかった蛍光物質(蛍光標識)付きの検体DNAと蛍光物質(蛍光標識)の洗浄を行うことができる。
【0040】
このような処理装置および生化学反応カートリッジ1を用いて、本実施形態において検体の生化学反応を生化学反応カートリッジ1内にて生じさせる方法について具体的に説明する。
【0041】
まず、検査者が、検体である血液を収容した注射器の針(図示せず)を、生化学反応カートリッジ1の検体入口2aを塞いでいるゴムキャップ2を貫通させて、注射器内の血液を検体入口2aからチャンバ7に注入する。その後に、検査者は生化学反応カートリッジ1をテーブル13上に置く。そして、検査者が、図示しないレバーを操作することにより、ポンプブロック22,23を図1の矢印の方向に移動させる。すると、ポンプノズル20,21が、生化学反応カートリッジ1の両側部のノズル入口3a〜3tに、ゴムキャップ3を貫通して挿入される。
【0042】
検査者が、入力部24から実験開始の命令を入力すると処理が始まる。図6は生化学反応およびその後処理の手順を説明するフローチャートである。
【0043】
まず、ステップS1で、制御部17が、ポンプノズル20,21を制御してノズル入口3a,3kのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5a内の第1の溶血剤を、血液の入ったチャンバ7に流し込む。このように、ノズル入口3aにポンプノズル20を挿入して空気を噴出して加圧し、ノズル入口3kにポンプノズル21を挿入して空気を吸引して減圧することによって、チャンバ5a内の第1の溶血剤が血液の入ったチャンバ7内に流れ込む。この様子が、チャンバ5a,7,5kを通る断面図である図7に示されている。
【0044】
本実施形態では、空気の供給および吸引のタイミングをずらすことによって、各チャンバへの加圧および減圧を制御してカートリッジ1内を溶液を円滑に流すことができる。さらに、電動シリンジポンプ19による空気の吸引を、ポンプ18からの空気の開始時からリニアに増加させるなどの細かな制御を行って、溶液をより円滑に流すことも可能である。例えば、溶血剤の粘性や流路の抵抗にもよるが、ステップS1において、電動シリンジポンプ19からの空気の吸引を、電動シリンジポンプ18からの空気の噴出を開始してから10〜200ミリ秒後に開始するように制御する。それによると、流れる溶液の先頭で溶液が飛び出すことがなく、溶液が円滑に流れる。これは、以下の各工程における溶液の移動についても同様である。
【0045】
また、電動シリンジポンプ18,19を用いて空気の供給を容易に制御しつつ、ノズル入口3a,3oのみを開にして、電動シリンジポンプ18,19によって空気の噴出および吸引を交互に繰り返す。こうして、チャンバ7の溶液を流路10に流し、その後に戻す動作を繰り返して攪拌を行う。あるいは、電動シリンジポンプ19から空気を連続して噴出することによって、気泡を発生させながら攪拌を行う。
【0046】
このようにして、第1の溶血剤の流動および撹拌の工程(ステップS1)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第1の溶血剤の流動および撹拌の工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0047】
次に、ステップS2において、ノズル入口3b,3kのみを開にして、ステップS1と同様の原理でチャンバ5b内の第2の溶血剤をチャンバ7に流し込む。そして、ステップS1と同様の攪拌を行う。
【0048】
このようにして第2の溶血剤の流動および撹拌の工程(ステップS2)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第2の溶血剤の流動および撹拌の工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0049】
さらに、ステップS3において、ノズル入口3c,3kのみを開にして、ステップS1,S2と同様の原理でチャンバ5c内の磁性体粒子をチャンバ7に流し込む。そして、ステップS1と同様の攪拌を行う。このステップS3によって、ステップS1,S2において細胞が溶解して得られたDNAが磁性体粒子に付着する。
【0050】
このようにして磁性体粒子の流動および撹拌の工程(ステップS3)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、磁性体粒子の流動および撹拌の工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0051】
そして、ステップS4で電磁石14をオンにし、ノズル入口3e,3kのみを開にし、電動シリンジポンプ19から空気を噴出し、電動シリンジポンプ18から空気を吸引して、チャンバ7内の溶液をチャンバ5eに移動させる。この移動の際に、磁性体粒子およびDNAを、流路10の電磁石14の上方位置で捕捉する。なお、電動シリンジポンプ18,19による空気の吸引および噴出を交互に繰り返して、溶液をチャンバ7と5eの間を2回往復させることにより、DNAの捕捉効率を向上させている。さらに往復回数を増やせば、捕捉効率を一層高めることができる。ただし、処理時間が余分に掛かることになる。
【0052】
このように、ステップS1〜S4にて、幅1〜2mm程度で高さ0.2〜1mm程度の小さい流路10上で、流動状態のDNAを、磁性体粒子を利用して極めて効率良く捕捉する。なお、仮に、捕捉ターゲット物質がDNAではなく、RNAまたはタンパク質の場合にも同様に効率の良い捕捉が行える。
【0053】
このようにして磁性体粒子およびDNAの捕捉工程(ステップS4)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、磁性体粒子およびDNAの捕捉工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0054】
次に、ステップS5において電磁石14をオフにし、ノズル入口3f,3lのみを開とする。そして、電動シリンジポンプ19から空気を噴出し、電動シリンジポンプ18から空気を吸引して、チャンバ5l内の第1の抽出洗浄液をチャンバ5fに移動させる。この際に、ステップS4で捕捉された磁性体粒子およびDNAが、抽出洗浄液と共に移動して洗浄が行われる。さらに、電磁石14をオンにして、ステップS4と同様の原理で磁性体粒子およびDNAと抽出洗浄液とをチャンバ5l内とチャンバ5fの間を2回往復させる。それによって、洗浄された磁性体粒子およびDNAを流路10の電磁石14の上方位置に回収し、第1の抽出洗浄液をチャンバ5lに戻す。
【0055】
このように、第1の抽出洗浄液により洗浄した後に磁性体粒子およびDNAを捕捉する工程(ステップS5)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第1の抽出洗浄液により洗浄した後に磁性体粒子およびDNAを捕捉する工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0056】
ステップS6において、ノズル入口3f,3mのみを開いてステップS5と同様の工程を行う。すなわち、チャンバ5m内の第2の抽出洗浄液と、磁性体粒子およびDNAとを移動させて、磁性体粒子およびDNAをさらに洗浄してから電磁石14の上方位置に回収し、第2の抽出洗浄液をチャンバ5mに戻す。
【0057】
このように、第2の抽出洗浄液により洗浄した後に磁性体粒子およびDNAを捕捉する工程(ステップS6)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第2の抽出洗浄液により洗浄した後に磁性体粒子およびDNAを捕捉する工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0058】
続いて、ステップS7において電磁石14をオンにしたまま、ノズル入口3d,3oのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5d内の溶出液をチャンバ8に移動させる。この溶出液の作用によって、磁性体粒子とDNAが分離し、DNAのみが溶出液とともにチャンバ8に移動し、磁性体粒子は流路10内に残る。
【0059】
このようにして、溶出液を流して磁性体粒子とDNAを分離させる工程(ステップS7)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、溶出液を流して磁性体粒子とDNAを分離させる工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0060】
このステップS7において、DNAの抽出および精製が行われる。本実施形態では、抽出洗浄液を収容するチャンバ5l,5mと、洗浄後の廃液を溜めるためのチャンバ5fが用意されているので、カートリッジ1内でDNAの抽出および精製を行うことが可能である。
【0061】
次に、ステップS8において、ノズル入口3g,3oのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5g内のPCR用薬剤(例えば、プライマ、ポリメラーゼ、dNTP溶液、バッファ、蛍光標識等の混合液)をチャンバ8に流し込む。さらに、ノズル入口3g,3tのみを開にし、電動シリンジポンプ18,19による空気の噴出および吸引を交互に繰り返し、チャンバ8の溶液を流路11に流して、その後に戻す動作を繰り返して攪拌を行う。そして、ペルチェ素子15を制御して、チャンバ8内の溶液を96℃の温度に10分保持した後に、96℃・10秒、55℃・10秒、72℃・1分のサイクルを30回繰り返してPCRを行い、溶出されたDNAを増幅する。
【0062】
このようにして、溶出されたDNAの増幅工程(ステップS8)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、溶出されたDNAの増幅工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0063】
ステップS9でノズル入口3g,3tのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引して、チャンバ8内の溶液をチャンバ9に移動させる。さらに、ペルチェ素子16を制御して、チャンバ9内の溶液を45℃で2時間保持し、ハイブリダイゼーションを行わせる。この時、電動シリンジポンプ18,19による空気の噴出および吸引を交互に繰り返して、チャンバ9内の溶液を流路6tに移動し、その後に戻す動作を繰り返して攪拌を行いながら、ハイブリダイゼーションを進める。
【0064】
このようにして、ハイブリダイゼーション工程(ステップS9)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、ハイブリダイゼーション工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0065】
次にステップS10において、同じく45℃に保持したまま、今度はノズル入口3h、3rのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ9内の溶液をチャンバ5rに移動させるとともに、チャンバ5h内の第1の洗浄液を、チャンバ9を通してチャンバ5rに流し込む。このように、ノズル入口3hにポンプノズル20を挿入し空気を噴出して加圧し、ノズル入口3rにポンプノズル21を挿入し空気を吸引して減圧することによって、チャンバ5h内の第1の洗浄液が、チャンバ9を通してチャンバ5r内に流れ込む。この様子が、チャンバ5h,9,5rを通る断面図である図8に示されている。電動シリンジポンプ18,19の吸引および噴出を交互に繰り返して、この溶液をチャンバ5h,9,5rの間を2回往復させ、最後にチャンバ5hに戻す。このようにして、ハイブリダイゼーションしなかった蛍光標識付きの検体DNAと蛍光標識とが洗浄される。
【0066】
このようにして、第1の洗浄液による洗浄工程(ステップS10)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第1の洗浄工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0067】
さらに、ステップS11において、同じく45℃に保持したまま、ノズル入口3j、3rのみを開いて、ステップS10と同様の工程を行う。すなわち、チャンバ5j内の第2の洗浄液をチャンバ9を通してチャンバ5rに流し込んでDNAの洗浄をさらに行い、最後に溶液をチャンバ5jに戻す。
【0068】
このようにして、第2の洗浄液による洗浄工程(ステップS11)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第2の洗浄液による洗浄工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0069】
本実施形態では、第1、第2の洗浄液を収容するチャンバ5h,5jと、洗浄後の廃液を溜めるためのチャンバ5rが用意されているので、前記の通り生化学反応カートリッジ1内でDNAチップ12の洗浄を行うことが可能である。
【0070】
ステップS12で、ノズル入口3i,3rのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引して、チャンバ5i内のアルコールを、チャンバ9を通してチャンバ5rに移動させる。その後に、ノズル入口3i,3tのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引してチャンバ9内を乾燥させる。
【0071】
このようにして、アルコールの流動および乾燥の工程(ステップS12)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、アルコールの流動および乾燥の工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0072】
以上述べたステップS1〜S12によって、検体の生化学反応(例えばDNAのハイブリダイゼーション)を生化学反応カートリッジ1内で行わせることができる。
【0073】
なお、本実施形態では、ノズル入口3a〜3tがカートリッジ1の2つの面、つまり両側部に集中して設けられている。そのため、電動シリンジポンプ18,19、電動切換バルブ、ポンプノズルを内蔵したポンプブロック22,23等の形状や配置を単純化することができる。さらに、必要なチャンバや流路を確保しながら、ポンプブロック22,23により生化学反応カートリッジ1を同時に挟み込むという単純な動作だけで、ポンプノズル20,21を挿入することができる。それによって、ポンプブロック22,23の構成も簡単にすることができる。また、ノズル入口3a〜3tを全て同じ高さに直線的に並ぶように配置することによって、ノズル入口3a〜3tに接続される流路4a〜4tの高さは全て同じになり、流路4a〜4tの作製が容易になる。
【0074】
また、図1に示す処理装置において、n個の生化学反応カートリッジ1を同時に使用できるようにポンプブロック22,23をn倍に長くした構成にすることができる。その場合、n個の生化学反応カートリッジ1を直列に並べて、n個の生化学反応カートリッジ1のそれぞれに対して必要な工程を同時に行うことができる。したがって、構成は極めて簡単でありながら多数の生化学反応カートリッジにおいて同時に生化学反応を行わせることが可能である。
【0075】
以上説明した処理工程(ステップS1〜S12)の後に、ステップS13において、検査者が図示しないレバーを操作して、ポンプブロック22,23を生化学反応カートリッジ1から離れる方向に移動させる。それによって、ポンプノズル20,21が生化学反応カートリッジ1のノズル入口3a〜3tから外れる。そして、ステップS14において、カートリッジ搬送部27(図1参照)を用いて、生化学反応カートリッジ1をテーブル13から検出用エリア28に搬送する。この検出用エリア28において、生化学反応カートリッジ1の生化学反応の測定および解析を行う。
【0076】
ステップS15において、DNAチップ12に捕捉された、ハイブリダイゼーションされたDNAを蛍光検出ユニット30によって検出する。検出結果は、第2の通信部31から、ICチップ25の通信部(図示せず)に向けて送信され、ICチップ25の記憶部(図示せず)に記憶される。こうして、ステップS1〜S12の各工程の(時間経過を含む)推移および各種条件と、その各工程を経たDNAチップ12の検出結果とが、生化学反応カートリッジ1のICチップ25に記憶される。なお、この蛍光検出工程(ステップS15)の詳細については後述する。
【0077】
それから、ステップS16において、制御部17が、蛍光検出したパターンを分析する。なお、生化学反応カートリッジ1が、予め処理装置に記憶されていない種別である場合には、検出パターンの分析にあたって、ICチップ25に書き込まれている分析用情報を読み込み、その分析用情報に基づいて分析を行う。
【0078】
ここで、本実施形態における蛍光検出と分析の原理について説明する。例えば、生化学反応カートリッジ1およびDNAチップ12が感染症検出用のものである場合には、DNAプローブ32の設定の仕方によって、いくつかの感染症が一度に検出できる。DNAプローブ32が5×5のマトリックス状に配置されたDNAチップ12を例にとって考えると、感染症A〜Eがそれぞれ単独で検出されたときのパターンが図9(a)〜(e)に示す5通りとなるように設定できる。なお、図9(a)〜(e)において、黒丸は、ターゲットがDNAプローブ32とハイブリダイゼーションして捕捉されており、ターゲットに付着した蛍光物質(蛍光標識)が蛍光を発している状態を示す。一方、白丸は、ターゲットがDNAプローブ32とハイブリダイゼーションせず捕捉されずに、蛍光標識が存在しない状態を示している。
【0079】
図9(a)〜(e)に示す例では、同一列に含まれるDNAプローブ32は全て、同じ感染症に感染したときに存在するDNAとハイブリダイゼーションするように設定されている。そして、各列毎に異なる感染症のDNAに対応するように設定されている。従って、図9(a)のパターンの検出結果が得られた場合には、感染症Aへの感染が認められ、同様に、図9(b)〜(e)のパターンの検出結果が得られた場合には、それぞれ感染症B〜Eへの感染が認められる。このような検出パターンに基づく感染判断方法は、制御部17に予め記憶されている分析用情報に含まれている。
【0080】
このように、蛍光物質が付着したDNAプローブ32の配列パターンに基づいて、目的とする検体分析を精度良く行うためには、ステップS15において、蛍光検出を精度良く行うことが重要である。特に、様々な種類の生化学反応カートリッジ1およびDNAチップ12に対応して、その都度正確な検出を行うことが必要である。
【0081】
そこで、本実施形態の蛍光検出工程を、図10に示すフローチャートを参照して詳細に説明する。
【0082】
まず、ステップS101において、フィルタ39を、DNAチップ12から光電子増倍管37に至る光路から外す。そして、XYステージ29(図1参照)を動作させて、レーザ光発生器34からのレーザ光(励起光)がDNAチップの反射板33に入射するように生化学反応カートリッジ1を動かす。そこで、ステップS102において、レーザ光発生器34から反射板33に励起光を照射し、ステップS103において、光電子増倍管37により反射板33からの反射光の光強度測定を開始する。その状態で、ステップS104において、対物レンズ36を上下に移動させながら光電子増倍管37による光強度測定値が最大になる位置を探す。そして、光強度測定値が最大になる位置に対物レンズ36を固定する。それから、ステップS105において、最大となった光強度測定値を、予め記憶されている光強度基準値と比較してその割合を算出する。なお、光強度基準値は、予め基準の基板と基準の励起光とを用いて実験的に得られた反射光の強度である。
【0083】
それから、ステップS106において、ステップS105で求められた割合に基づいて、レーザ光発生器34の出力強度を調整する。すなわち、光強度測定値が光強度基準値よりも大きい場合には出力強度を弱くし、光強度測定値が光強度基準値よりも小さい場合には出力強度を強くして、光強度測定値が光強度基準値にできるだけ一致するようにする。なお、図示しない調整手段がレーザ光発生器34の出力強度を調整してもよいが、レーザ光発生器34自体または制御部17が出力強度を調整する調整手段として作用してもよい。
【0084】
以上のステップS101〜S106によって準備作業を行ったら、ステップS107において、フィルタ39を、DNAチップ12から光電子増倍管37に至る光路上に移動する。そして、ステップS108において、XYステージ29を動作させて、レーザ光発生器34からのレーザ光(励起光)がDNAチップ12のDNAプローブ32群の検出開始位置に入射するように生化学反応カートリッジ1を動かす。そこで、ステップS109において、XYステージ29をX方向に主走査させながら、レーザ光発生器34からDNAチップ12の1ライン分の領域に励起光を照射する。励起光が照射された位置にあるDNAプローブ32に蛍光物質が存在していれば、すなわち蛍光物質(蛍光標識)が付着したDNAがハイブリダイゼーションしていれば、蛍光物質が蛍光を発生する。この蛍光は、フィルタ39を透過して光電子増倍管37によって検出される。こうして、1ライン分の蛍光の光強度を測定する。この測定結果によって、感染症Aへの感染の有無を知ることができる。なお、反射光など蛍光以外の光はフィルタ39によって遮断され、光電子増倍管37に入射しないため、検出ノイズが生じにくい。
【0085】
また、本実施形態では、ステップS105において励起光の出力強度を調整しているため、予め記憶されている分析用情報に基づいて蛍光の光強度の測定を行っても検出誤差が小さい。
【0086】
ただし、ステップS105において、光強度測定値と光強度基準値とを一致させることが困難である場合には、光強度基準値に換算するための補正式を求めておく。そして、ステップS110において、予め記憶されている分析用情報とこの補正式とを利用して、精度良く蛍光検出を行うことができる。例えば、ステップS105において調整しても光強度測定値が光強度基準値よりも大きくなる場合には、その差の1/2だけ測定値から減じる補正を行う。逆に、ステップS105において調整しても光強度測定値が光強度基準値よりも小さくなる場合には、その差の1/2だけ測定値に加える補正を行う。
【0087】
このようにして1ラインの蛍光検出が完了したら、ステップS111においてXYステージ29を動作させて、1ライン分だけ生化学反応カートリッジ1をY方向に副走査させる。
【0088】
ステップS112において、マトリックス状のDNAプローブ32の最終ラインの蛍光検出が完了したことが確認されるまで、主走査および蛍光検出(ステップS109〜S110)と、副走査(ステップS111)を交互に繰り返す。ステップS112においてマトリックス状のDNAプローブ32の最終ラインの蛍光検出が完了したことが確認されると、ステップS113においてXYステージ29を動作させて、生化学反応カートリッジ1を初期位置へ移動させる。
【0089】
以上説明したように、本実施形態では、DNAチップ12の基板の材質や厚さや屈折率が異なるなど、様々な種類の生化学反応カートリッジ1を用いて蛍光物質の検出を行う上で、実際の光強度測定値が光強度基準値と一致するように調整することができる。
【0090】
図2に示すような構成では、励起光を反射する反射板33がDNAチップ12の基板の表側に配置されており、励起光はその基板の裏側から照射されるため、基板によって光の減衰がある。そこで本実施形態では、予め、ステップS102〜S105の工程において基板での減衰率を把握し、それに基づいて、一定の強度で蛍光が励起されるように、ステップS106において励起光の出力強度を調整する。さらに、ステップS110では、調整された励起光により得られた蛍光強度にさらに補正を施して、最終的な検出結果を得る。
【0091】
こうして、内蔵するDNAチップ12の基板が異なる生化学反応カートリッジ1を測定する際にも、ほぼ同一の蛍光物質励起条件および蛍光検出条件の下で測定を行うことができる。従って、測定結果が安定していて、予め求められている分析用情報(例えば良否判定データ)との比較が簡単にできる。また、予め求められている分析用情報(例えば良否判定データ)を使用して分析を行うことが容易にできるため、処理速度が速くなり、データ換算等の間違いが発生する要因が減り、迅速に正確な結果が得られるという効果がある。その結果、常に精度良く検体の分析が行える。
【0092】
[第2の実施形態]
次に、本発明の第2の実施形態を詳細に説明する。
【0093】
図示していないが、本実施形態の反射体は、DNAチップ12ではなく、生化学反応カートリッジ1を取り付ける処理装置本体に設けられている。そして、反射体は、蛍光検出を行うためにレーザ光発生器34からDNAチップ12へ励起光を照射する際の妨げにならない格納位置と、基板表面に接触し、レーザ光発生器34から照射された励起光が入射する反射位置との間を移動可能である。従って、ステップS102〜S106においては、反射体を反射位置に配置した状態で、レーザ光発生器34から励起光を照射してその反射光の強度を測定して出力強度を調整する一連の工程を行う。その後、ステップS109〜S112において主走査および副走査を行って蛍光物質を検出する前に、反射体を反射位置から格納位置に移動させる。
【0094】
本実施形態によると、微小なDNAチップ12に反射板を設ける必要がないため、製造工程が簡単になる。なお、この反射体以外の構成ついては第1の実施形態と同様であるので説明を省略する。そして、説明を繰り返さないが、本実施形態では、第1の実施形態(図6,10)と同様の工程を行うことによって、第1の実施形態と同様な効果を得ることができる。
【0095】
[第3の実施形態]
次に、本発明の第3の実施形態を詳細に説明する。
【0096】
本実施形態では、図11に示すように、DNAチップ12の被検出領域において、DNAプローブ32がマトリックス状に並ぶ領域の側方に、そのマトリックスの領域の長さ以上の長さを有する反射板40が配置されている。この構成は、特に、実際に蛍光検出する1ライン分の主走査を行う前に、すなわち、副走査を1回行った後に、定期的に励起光を反射板40に照射してその反射光の強度を測定し、出力強度を調整する場合に適している。
【0097】
この場合の具体的な構成を図12に示している。すなわち、第1の実施形態と同様なレーザ光発生器34、スプリッタ35、対物レンズ36、レンズ38、および光電子増倍管37に加えて、受光素子(フォトダイオード)42と、ダイクロイック・ミラー41と、レンズ43を有している。フォトダイオード42は、DNAチップ12からの反射光の光強度を検出するためのものである。ダイクロイック・ミラー41は、DNAチップ12からの反射光を90度曲げてフォトダイオード42に向けて反射する一方、反射光とは波長の異なる蛍光をそのまま透過させる。レンズ43は、ダイクロイック・ミラー41によって90度曲げられて反射された反射光をフォトダイオード42に集光する。
【0098】
仮に、第1の実施形態と同様に、フィルタ39をDNAチップ12から光電子増倍管37に至る光路上と、光路外との間で移動させる構成にすると、非常に頻繁にフィルタ39の移動を行わねばならず、処理が煩雑で時間がかかる。そこで本実施形態ではフィルタ39は用いず、前記した通り、蛍光検出用の光電子増倍管37の他に、反射光を受光して励起光の出力強度調整用のデータを求めるための受光手段(フォトダイオード)42が別途設けられた構成にしている。そのために、ダイクロイック・ミラー41もさらに追加されている。
【0099】
次に、本実施形態における蛍光検出工程を、図13に示すフローチャートを参照して説明する。
【0100】
まず、第1の実施形態と同様にステップS1〜S14(図6参照)にて、生化学反応カートリッジ1内での生化学反応を行わせる。その後、ステップS121において、XYステージ29を動作させて、レーザ光発生器34からのレーザ光(励起光)が、反射板40の、DNAチップ12のDNAプローブ32群の検出開始位置に隣接する位置に入射するように生化学反応カートリッジ1を動かす。
【0101】
そこで、ステップS122において、レーザ光発生器34から反射板40に励起光を照射し、ステップS123において、ダイクロイック・ミラー41によって90度曲げられた、反射板40からの反射光の強度を、フォトダイオード42によって測定開始する。その状態で、ステップS124において、対物レンズ36を上下に移動させながらフォトダイオード42による光強度測定値が最大になる位置を探す。そして、光強度測定値が最大になる位置に対物レンズ36を固定する。それから、ステップS125において、最大となった光強度測定値を、予め記憶されている光強度基準値と比較してその割合を算出する。それから、ステップS126において、ステップS125で求められた割合に基づいて、レーザ光発生器34の出力強度を調整する。すなわち、光強度測定値が光強度基準値よりも大きい場合には出力強度を弱くし、光強度測定値が光強度基準値よりも小さい場合には出力強度を強くして、光強度測定値が光強度基準値にできるだけ一致するようにする。
【0102】
続いて、ステップS127において、XYステージ29をX方向に主走査させながら、レーザ光発生器34からDNAチップ12の1ライン分の領域にレーザ光(励起光)を照射する。励起光が照射された位置にあるDNAプローブ32に蛍光物質が存在していれば、すなわち蛍光物質(蛍光標識)が付着したDNAがハイブリダイゼーションしていれば、蛍光物質が蛍光を発生する。この蛍光は、ダイクロイック・ミラー40を透過して光電子増倍管37によって検出される。こうして、1ラインの蛍光の光強度を測定し、測定が完了したら励起光が反射板40に入射する位置に生化学反応カートリッジ1を移動させる。
【0103】
ステップS125において、光強度測定値と光強度基準値とを一致させることが困難である場合には、光強度基準値に換算するための補正式を求めておく。そして、ステップS128において、予め記憶されている分析用情報とこの補正式とを利用して、蛍光の光強度を精度良く求めることができる。例えば、ステップS105において調整しても光強度測定値が光強度基準値よりも大きくなる場合には、その差の1/2だけ測定値から減じる補正を行う。逆に、ステップS125において調整しても光強度測定値が光強度基準値よりも小さくなる場合には、その差の1/2だけ測定値に加える補正を行う。
【0104】
このようにして1ラインの蛍光検出が完了したら、ステップS129においてXYステージ29を動作させて、1ライン分だけ生化学反応カートリッジ1をY方向に副走査させる。
【0105】
ステップS130において、マトリックス状のDNAプローブ32の最終ラインの蛍光検出が完了したことが確認されるまで、主走査および蛍光検出(ステップS109〜S110)と、副走査(ステップS111)とを交互に繰り返す。ただし、本実施形態では、主走査および蛍光検出(ステップS109〜S110)を行う前に、必ず、励起光の出力強度調整のための処理(ステップS122〜S126)を行う。それによって、1つのDNAチップ12の分析を行っている最中に何らかの処理条件の変化が発生した場合にも、その都度対応して、高精度の蛍光検出を行うことができる。
【0106】
そして、ステップS130においてマトリックス状のDNAプローブ32の最終ラインの蛍光検出が完了したことが確認されると、ステップS131においてXYステージ29を動作させて、生化学反応カートリッジ1を初期位置へ移動させる。
【0107】
本実施形態では、前記したように、1ライン毎の実際の蛍光検出動作に際して、必ず、励起光の出力強度調整を行う。それによって、1つのDNAチップ12の分析を行っている最中に何らかの処理条件の変化が発生した場合にも、その都度対応して、精度のよい蛍光検出を行うことができる。また、説明を繰り返さないが、本実施形態でも、第1の実施形態と同様な効果を得ることができる。
【0108】
また、レーザ光発生器34の電源投入直後は、励起光が安定しない状況が生じる。その場合でも、本実施形態によると、毎回の主走査に先だって、反射板40による反射光の光強度を測定し、それに基づいて励起光の出力強度を調整するため、レーザ光発生器34の電源投入直後から、待機時間をおく必要なく、励起光が安定した状態と同程度の高精度の蛍光検出が可能である。これによって、レーザ光発生器34の電源をオンにし続けておかず、短時間であっても励起光が不必要な時に電源をオフにしても、作業効率が低下することはなく、省電力化に寄与するという効果もある。
【図面の簡単な説明】
【0109】
【図1】本発明の第1の実施形態の検体分析装置の構成を示すブロック図である。
【図2】図1に示す検体分析装置の蛍光物質検出装置を示す概略側面図である。
【図3】本発明の生化学反応カートリッジの斜視図である。
【図4】図3に示す生化学反応カートリッジの平面断面図である。
【図5】図3に示す生化学反応カートリッジのDNAチップの平面図である。
【図6】図1に示す検体分析装置における処理工程を示すフローチャートである。
【図7】図3,4に示す生化学反応カートリッジのチャンバの一部を通る縦断面図である。
【図8】図3,4に示す生化学反応カートリッジの他のチャンバを通る縦断面図である。
【図9】DNAチップの蛍光物質検出パターンの例を示す模式図である。
【図10】図6に示す処理工程の蛍光物質検出工程を示すフローチャートである。
【図11】本発明の第2の実施形態のDNAチップの平面図である。
【図12】本発明の第2の実施形態の蛍光物質検出装置を示す概略側面図である。
【図13】本発明の第2の実施形態の蛍光物質検出工程を示すフローチャートである。
【符号の説明】
【0110】
1 生化学反応カートリッジ
12 DNAチップ
17 制御部
25 ICチップ
30 蛍光検出ユニット
33 反射板
34 レーザ光発生器
37 光電子増倍管
40 反射板
42 フォトダイオード
【技術分野】
【0001】
本発明は、検体中の細胞、微生物、染色体、核酸等のサンプルを抗原抗体反応や核酸ハイブリダイゼーション反応等の生化学反応を利用して検出するために、蛍光物質を検出する装置と、それを含む検体分析装置と、蛍光物質検出方法および検体分析方法に関する。
【背景技術】
【0002】
血液等の検体を分析する検体分析装置には、抗原抗体反応を利用した免疫学的な方法や、核酸ハイブリダイゼーションを利用した方法がある。免疫学的な方法の一例では、被検出物質と特異的に結合する抗体または抗原等のタンパク質をプローブとして用い、微粒子、ビーズ、またはガラス板等の固相表面に固定して、検体中の被検出物質との抗原抗体反応を行わせる。核酸ハイブリダイゼーションを利用した方法の一例では、一本鎖の核酸をプローブとして用い、微粒子、ビーズ、ガラス板等の固相表面に固定して、検体中の被検出物質と核酸ハイブリダイゼーションを行わせる。これらの方法は、酵素、蛍光物質、または発光性物質等の、検知感度の高い標識物質を担持した特異的な相互作用を有する標識化物質である標識化抗体、標識化抗原、または標識化核酸等を用いる。そして、抗原抗体化合物またはハイブリダイズされた二本鎖の核酸を検出して、被検出物質(ターゲット)の有無の検出やその定量を行う。
【0003】
これらの技術を発展させたものとして、例えば特許文献1には、互いに異なる塩基配列を有する多数のDNA(デオキシリボ核酸)プローブを、基板上にアレイ状に並べた、いわゆるDNAアレイが開示されている。
【0004】
また、非特許文献1には、多種類のタンパク質をメンブレンフィルタ上に並べ、DNAアレイと同様な構成のタンパク質アレイを作製する方法が開示されている。このように、DNAアレイやタンパク質アレイ等を用いることによって、極めて多数の項目の検査を一度に行うことが可能になってきている。
【0005】
また、様々な検体分析における、検体による汚染の軽減、反応の効率化、装置の小型化、作業の簡便化等の目的で、内部で生化学反応を行わせる使い捨て可能な生化学反応カートリッジが提案されている。例えば、特許文献2においては、DNAアレイを含む生化学反応カートリッジ内に複数のチャンバを配設する構成が開示されている。この生化学反応カートリッジによると、圧力差を利用して溶液を各チャンバへ移動させることにより検体中のDNAの抽出、増幅、またはハイブリダイゼーション等の反応を内部で行わせることが可能である。
【0006】
そして、このような生化学反応カートリッジ内に外部から溶液を注入する方法としては、外部の電動シリンジポンプや真空ポンプを利用する方法がある。また、生化学反応カートリッジ内部で溶液を移動する方法としては、圧力差以外にも、重力や毛細管現象や電気泳動を利用する方法が知られている。さらに、生化学反応カートリッジの内部に配設できる小型のマイクロポンプとして、特許文献2にはダイアフラムポンプ、特許文献3には発熱素子を利用したポンプ、特許文献4には圧電素子を利用したポンプがそれぞれ開示されている。
【0007】
生化学反応カートリッジとして、またはその一部として用いられるDNAチップに、情報記憶用のICを設け、このICに記憶された同定情報を利用してDNAの同定を行う構成がある。具体的には、特許文献5に、DNAチップの塩基配列情報や検体の情報を情報記憶用ICに書き込むことが開示されている。
【0008】
また、DNAチップ上のサンプルのハイブリダイゼーション状態を検知するために、サンプルに付着した蛍光物質(蛍光標識)を読み取る方法がある。具体的には、特許文献6に、蛍光物質を読み取ってターゲットの検出を行うために、蛍光を発生させるようにDNAチップに照射する励起光を適宜に較正する方法が開示されている。
【特許文献1】米国特許第5,445,934号明細書
【特許文献2】特表平11−509094号公報
【特許文献3】特許第2832117号明細書
【特許文献4】特開2000−274375号公報
【特許文献5】特開2001−147231号公報
【特許文献6】特表2002−538427号公報
【非特許文献1】アンジェリカ ロイキング(Angelika Lueking)他5名、「プロテイン マイクロアレイズ フォー ジーン エクスプレッション アンド アンチボディ スクリーニング(Protein Microarrays for Gene Expression and Antibody Screening)」、アナリティカル バイオケミストリー(Analytical Biochemistry) Vol.270(1)、アカデミック プレス(Academic Press)、1999年5月15日、p.103〜111
【発明の開示】
【発明が解決しようとする課題】
【0009】
生化学反応を生じさせるために様々な溶液を内蔵し、検体が供給される生化学反応カートリッジは、二次感染や汚染の防止と、使い勝手の観点から、使い捨てにすることが好ましい。しかし、マイクロポンプを内蔵した生化学反応カートリッジは高価であるという問題がある。
【0010】
したがって、ポンプを内蔵せずに外部のポンプの作用で溶液を移動し、検体注入後は溶液を外部に流出させずに一連の生化学反応を進められる構造の、使い捨ての生化学反応カートリッジが一般に利用されている。
【0011】
個々のDNAチップは、ハイブリダイゼーションという単独の生化学反応のみを行うためのものである。しかし、DNAチップを内蔵する生化学反応カートリッジは、各種の生化学反応を連続的に行い、最後に検出工程を行う場合がある。生化学反応カートリッジによっては、例えば、内蔵するDNAチップの基板の材質、厚さ、透光率等が異なる場合がある。このようにDNAチップの基板の材質、厚さ、透光率等が異なる生化学反応カートリッジに対して常に同一の条件で励起光を照射して蛍光の検出を行っても、誤差が大きくて高精度の検出が行えない可能性がある。
【0012】
また、蛍光物質は一般的に励起光によって劣化が生じやすく、長時間または高い強度の励起光が照射されると蛍光物質の劣化が生じ検出精度が低下する場合がある。
【0013】
そこで本発明の目的は、様々な生化学反応カートリッジに対してそれぞれ適切な条件で高精度の検出が行える蛍光物質検出装置と、それを含む検体分析装置と、蛍光物質検出方法および検体分析方法を提供することにある。
【課題を解決するための手段】
【0014】
本発明の特徴は、透光性を有する基板の表面上の蛍光物質を検出する蛍光物質検出装置であって、基板の裏面に向けて照射される励起光を発生させる励起光発生手段と、透光性を有する基板を透過することで減衰した励起光を受光する第1の受光手段と、励起光により励起された蛍光物質が発する蛍光を受光する第2の受光手段と、第1の受光手段が受光した減衰した励起光の光強度測定値に応じて励起光の出力強度を調整する調整手段とを備えるところにある。
【0015】
また、本発明のもう1つの特徴は、透光性を有する基板の表面上の蛍光物質を検出する蛍光物質検出方法において、基板の裏面に向けて励起光を照射する工程と、基板を透過することにより減衰した励起光を、受光手段によって受光する工程と、受光手段が受光した減衰した励起光の光強度測定値と、予め設定されている光強度基準値とを比較して、その比較結果に応じて、励起光の出力強度を調整する工程と、出力強度が調整された励起光を基板の裏面に照射する工程と、励起光が照射された位置に存在する蛍光物質が発する蛍光を、受光手段が検出する工程とを含むところにある。
【発明の効果】
【0016】
本発明によると、様々な基板を用いても、適切な光強度の励起光を用いることによって精度良く蛍光物質の検出が行える。
【発明を実施するための最良の形態】
【0017】
以下、本発明の実施の形態について図面を参照して説明する。
【0018】
なお、以下の実施形態においては、生化学反応カートリッジを用いる形態について詳細に説明する。しかし、本発明においてはこれに限らず、いわゆるDNAチップの検出装置としても用いることが可能である。その場合、使用する光学系によっては反射手段を設けない形態もありえる。
【0019】
[第1の実施形態]
図1には、本発明の第1の実施形態における検体分析装置が概略的に示されている。この検体分析装置の処理装置は、本実施形態において反応場となる生化学反応カートリッジ1が載置されるテーブル13を有している。テーブル13上には、電磁石14と、ペルチェ素子15,16と、第1の通信部26が配置され、これらは、処理装置全体を制御する制御部17に接続されている。電磁石14は、生化学反応カートリッジ1内に電磁力を作用させるものである。ペルチェ素子15,16は、生化学反応カートリッジ1の温度を制御するものである。第1の通信部26は、処理装置のデータを、後述する生化学反応カートリッジ1内のICチップ25に記憶させるために、ICチップ25に対して電力の送信や信号の送受信を行うものである。
【0020】
テーブル13の両側には、電動シリンジポンプ18,19と、これらのポンプ18,19によって空気を排出または吸引するための出入口であり、それぞれ10個ずつのポンプノズル20,21を有するポンプブロック22,23とが配置されている。電動シリンジポンプ18,19とポンプノズル20,21の間には、図示しない複数の電動切換バルブが配置されている。図示しない電動切換バルブとポンプ18,19は制御部17に接続されている。
【0021】
制御部17は検査者が入力を行う入力部24に接続されている。この制御部17は、ポンプノズル20,21を1個ずつ独立して開閉して電動シリンジポンプ18,19に対する接続および遮断を制御したり、全てのポンプノズル20,21を同時に開閉するなどの制御を行うことができる。また、制御部17は、電磁石14およびペルチェ素子15,16を適宜に作動させることによって、生化学反応カートリッジ1内での生化学反応を実行させる。
【0022】
テーブル13およびポンプブロック22,23の外部に、検出用エリア28が設けられている。この検出用エリア28は、生化学反応カートリッジ1のDNAチップ12のハイブリダイゼーション状態を検知するため、すなわち蛍光物質を検出するために設けられている。
【0023】
検出用エリア28には、XYステージ29と、蛍光検出ユニット30と、第2の通信部31が設けられており、これらも制御部17に接続されている。XYステージ29は、生化学反応カートリッジ1のX方向への移動(主走査)と、Y方向への移動(副走査)を行うためのものである。副走査は、1回の主走査が行われる度に、その主走査のスキャン幅分だけ、主走査方向に交差する方向(本実施形態では直交する方向)に行われる。蛍光検出ユニット30の詳細な構成については後述するが、主に光学機器で構成され、蛍光体を励起させて発生させた蛍光の強度を測定可能なものである。また、蛍光検出ユニット30は、励起光の強度を適宜に調整することもできる。第2の通信部31は、生化学反応カートリッジ1内のICチップ25に対して、電力の送信や信号の送受信を行うものである。
【0024】
さらに、制御部17の指令によって生化学反応カートリッジ1をテーブル13上から検出用エリア28へ搬送するカートリッジ搬送部27が設けられ、制御部17に接続されている。
【0025】
次に、本発明の主な特徴の1つである蛍光検出ユニット30の構成について、図2を参照して説明する。蛍光検出ユニット30は、主に、レーザ光発生器34と、スプリッタ35と、対物レンズ36と、光電子増倍管37と、レンズ38と、フィルタ39を有している。
【0026】
レーザ光発生器34は、レーザ光(励起光)を照射して、生化学反応カートリッジ1のDNAチップ12に位置する検体中の蛍光物質を励起して蛍光を発生させるためのレーザ光源であり、出力強度を調整可能である。スプリッタ35は、レーザ光発生器34からのレーザ光をDNAチップ12へ向けて90度屈曲させるとともに、DNAチップ12からの反射光や蛍光を透過させる。対物レンズ36は、DNAチップ12に対向し、制御部17および上下機構(図示せず)によって位置調整されてレーザ光をDNAチップ12に集光させる。レンズ38は、スプリッタ35を透過したDNAチップ12からの反射光や蛍光を光電子増倍管37に集光させる。光電子増倍管37は、レンズ38により集光された光が入射され、その入射光を検出するものである。フィルタ39は、制御部17および移動機構(図示せず)によって、DNAチップ12から光電子増倍管37へ至る光路上と光路外との間を移動可能である。このフィルタ39は、光路内に位置するときに、DNAチップ12からの蛍光を透過させるが、DNAチップ12からの反射光を遮断するものである。
【0027】
このような構成であるため、レーザ光発生器34からスプリッタ35を介して対物レンズ36に入射した平行光(レーザ光)が、対物レンズ36によってDNAチップ12上に合焦する。そして、レーザ光によって励起された蛍光物質から発せられる蛍光や、DNAチップ12に設けられた後述する反射板33からの反射光が、対物レンズ36によって平行光にされた後、スプリッタ35を透過する。スプリッタを透過した平行光は、フィルタ39が光路外にある場合にはそのままの状態で、フィルタ39が光路上に位置する場合には蛍光のみが透過して、レンズ38を介して光電子増倍管37に入射する。光電子増倍管37は、入射した光を検出してその光強度を測定する。
【0028】
次に、この処理装置における反応場となる生化学反応カートリッジ1について詳細に説明する。
【0029】
生化学反応カートリッジ1の本体(筐体)はポリメタクリル酸メチル(PMMA)、アクリルニトリル−ブタジエン−スチレン(ABS)共重合体、ポリスチレン、ポリカーボネート、ポリエステル、ポリ塩化ビニル等の透明または半透明の合成樹脂から構成されている。
【0030】
図3に示すように、生化学反応カートリッジ1の上部には、注射器等を用いて血液等の検体を注入するための検体入口2aが設けられ、ゴムキャップ2により封止されている。また、生化学反応カートリッジ1の側面には、内部の溶液を移動させるためにノズルを挿入して加圧または減圧を行うための複数のノズル入口3a〜3jが設けられ、ゴムキャップ3により封止されている。カートリッジ1の両面とも同様の構成になっている。
【0031】
生化学反応カートリッジ1にはICチップ25が設けられている。ICチップ25は、不揮発性の記憶部と、外部からの電力の受信と信号の送受信のための通信部を有している。ICチップ25の記憶部には、生化学反応カートリッジ1を識別するための識別情報(ID)が書き込まれている。さらに、この記憶部に、生化学反応カートリッジ1の種別や、処理工程の手順や、生化学反応の結果を分析するための分析用情報なども書き込まれることが好ましい。
【0032】
通常、処理装置またはそれに付属する装置には、生化学反応カートリッジ1の種別ごとの処理工程の手順が記憶されている。前記したようにICチップ25に生化学反応カートリッジ1の種別が書き込まれている場合には、その種別を読み取ってそれに適合する処理工程の手順を選択し、その手順に則って処理を行う。しかし、生化学反応カートリッジ1の種別が、処理装置またはそれに付属する装置に記憶されていない種別であった場合には、ICチップ25に書き込まれている処理工程の手順を読み込んで、その手順に則って処理を行う。処理工程の手順として書き込まれるデータの中には、生化学反応を起こすために加えられる温度条件等も含まれていてもよい。
【0033】
図4は生化学反応カートリッジ1の平面断面図を示している。前記したように片側の側面には10個のノズル入口3a〜3jが設けられ、反対側の側面にも10個のノズル入口3k〜3tが設けられている。各ノズル入口3a〜3tのほとんどは、それぞれの空気が流れる空気流路4a〜4tを介して、溶液を貯蔵する場所または反応を起こす場所であるチャンバ5a〜5tに連通している。つまり、ノズル入口3a〜3jは流路4a〜4jを介してチャンバ5a〜5jに連通している。反対側のノズル入口3k,3l,3m,3o,3r,3tは、それぞれ流路4k,4l,4m,4o,4r,4tを介してチャンバ5k,5l,5m,5o,5r,5tに連通している。ただし、本実施形態では、ノズル入口3n,3p,3q,3sはチャンバに連通しておらず予備になっており、使用されない。
【0034】
検体入口2aはチャンバ7に連通し、チャンバ7は流路6a,6b,6c,6kを介してチャンバ5a,5b,5c,5kに連通しているとともに、流路10を介してチャンバ8に連通している。チャンバ8は流路6g,6oを介してチャンバ5g,5oに連通しているとともに、流路11を介してチャンバ9に連通している。チャンバ9は流路6h,6i,6j,6r,6tを介してチャンバ5h,5i,5j,5r,5tに連通している。また、流路10は流路6d,6e,6f,6l,6mを介してチャンバ5d,5e,5f,5l,5mに連通している。
【0035】
チャンバ9の底面には角孔が開けられ、この角孔に、図2,5に示すDNAチップ12が、プローブ面を上にしてに貼り付けられている。DNAチップ12は、1平方インチ(約645mm2)程度の大きさを持つガラス板の固相表面に、数十〜数十万種類の異なるDNAプローブ32が高密度に並べられたものである。本実施形態では、このDNAチップ12を用いて、検体中のDNAとハイブリダイゼーション反応を行わせることによって、一度に数多くの遺伝子を検査できる。これらのDNAプローブ32はマトリックス状に規則正しく並べられており、それぞれのDNAプローブ32のアドレス(何行・何列と示される位置)を、情報として容易に取り出すことができる。なお、検査の対象となる遺伝子としては、感染症ウィルス、細菌、疾患関連遺伝子、各個人の遺伝子多型等がある。また、DNAチップ12には、DNAプローブ32がマトリックス状に配置された領域と並置して、反射板33が設けられている。この反射板33は、DNAチップ12の裏面からの励起光(図2に示すレーザ光)を反射するものである。
【0036】
ここで、本実施形態において検体の処理を行うための、各チャンバ5a〜5tのセッティングの一例を示す。チャンバ5aには、細胞壁を破壊するEDTA(エチレンジアミン四酢酸)を含む第1の溶血剤が、チャンバ5bには、界面活性剤等のタンパク質変性剤を含む第2の溶血剤がそれぞれ収容されている。チャンバ5cには、DNAが吸着するシリカコーティングされた磁性体粒子が収容されている。チャンバ5l、チャンバ5mには、DNAの抽出の際にDNAの精製を行うために用いられる第1、第2の抽出洗浄剤がそれぞれ収容されている。
【0037】
チャンバ5dには、DNAを磁性体粒子から溶出する低濃度塩のバッファからなる溶出液が収容されている。チャンバ5gには、PCR(ポリメラーゼ連鎖反応)に必要な薬剤、すなわち、プライマ、ポリメラーゼ、dNTP溶液、バッファ、蛍光剤を含むCy3−dUTP(アマシャム バイオサイエンス株式会社製の蛍光標識)等の混合液が収容されている。チャンバ5h,5jには、ハイブリダイゼーションしなかった蛍光物質(蛍光標識)付きの検体DNAと蛍光物質(蛍光標識)とを洗浄するための界面活性剤を含む洗浄剤が収容されている。チャンバ5iには、DNAチップ12を含むチャンバ9内を乾燥させるためのアルコールが収容されている。
【0038】
なお、チャンバ5eは血液のDNA以外の塵埃を溜めるためのチャンバである。チャンバ5fは、チャンバ5l,5mからの第1、第2の抽出洗浄剤の廃液を溜めるためのチャンバである。チャンバ5rは第1、第2の洗浄剤の廃液を溜めるためのチャンバである。チャンバ5k,5o,5tは、溶液がノズル入口に流れ込まないようにするために設けられたブランクのチャンバである。
【0039】
本実施形態では、この生化学反応カートリッジ1に血液等の液体状の検体を注入して、前記した処理装置(図1参照)にセットする。そして、生化学反応カートリッジ1の内部で、DNA等の抽出および増幅を行わせ、増幅された検体DNAと生化学反応カートリッジ1の内部にあるDNAチップ12のDNAプローブ32との間で、ハイブリダイゼーションを行わせる。一方、ハイブリダイゼーションしなかった蛍光物質(蛍光標識)付きの検体DNAと蛍光物質(蛍光標識)の洗浄を行うことができる。
【0040】
このような処理装置および生化学反応カートリッジ1を用いて、本実施形態において検体の生化学反応を生化学反応カートリッジ1内にて生じさせる方法について具体的に説明する。
【0041】
まず、検査者が、検体である血液を収容した注射器の針(図示せず)を、生化学反応カートリッジ1の検体入口2aを塞いでいるゴムキャップ2を貫通させて、注射器内の血液を検体入口2aからチャンバ7に注入する。その後に、検査者は生化学反応カートリッジ1をテーブル13上に置く。そして、検査者が、図示しないレバーを操作することにより、ポンプブロック22,23を図1の矢印の方向に移動させる。すると、ポンプノズル20,21が、生化学反応カートリッジ1の両側部のノズル入口3a〜3tに、ゴムキャップ3を貫通して挿入される。
【0042】
検査者が、入力部24から実験開始の命令を入力すると処理が始まる。図6は生化学反応およびその後処理の手順を説明するフローチャートである。
【0043】
まず、ステップS1で、制御部17が、ポンプノズル20,21を制御してノズル入口3a,3kのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5a内の第1の溶血剤を、血液の入ったチャンバ7に流し込む。このように、ノズル入口3aにポンプノズル20を挿入して空気を噴出して加圧し、ノズル入口3kにポンプノズル21を挿入して空気を吸引して減圧することによって、チャンバ5a内の第1の溶血剤が血液の入ったチャンバ7内に流れ込む。この様子が、チャンバ5a,7,5kを通る断面図である図7に示されている。
【0044】
本実施形態では、空気の供給および吸引のタイミングをずらすことによって、各チャンバへの加圧および減圧を制御してカートリッジ1内を溶液を円滑に流すことができる。さらに、電動シリンジポンプ19による空気の吸引を、ポンプ18からの空気の開始時からリニアに増加させるなどの細かな制御を行って、溶液をより円滑に流すことも可能である。例えば、溶血剤の粘性や流路の抵抗にもよるが、ステップS1において、電動シリンジポンプ19からの空気の吸引を、電動シリンジポンプ18からの空気の噴出を開始してから10〜200ミリ秒後に開始するように制御する。それによると、流れる溶液の先頭で溶液が飛び出すことがなく、溶液が円滑に流れる。これは、以下の各工程における溶液の移動についても同様である。
【0045】
また、電動シリンジポンプ18,19を用いて空気の供給を容易に制御しつつ、ノズル入口3a,3oのみを開にして、電動シリンジポンプ18,19によって空気の噴出および吸引を交互に繰り返す。こうして、チャンバ7の溶液を流路10に流し、その後に戻す動作を繰り返して攪拌を行う。あるいは、電動シリンジポンプ19から空気を連続して噴出することによって、気泡を発生させながら攪拌を行う。
【0046】
このようにして、第1の溶血剤の流動および撹拌の工程(ステップS1)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第1の溶血剤の流動および撹拌の工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0047】
次に、ステップS2において、ノズル入口3b,3kのみを開にして、ステップS1と同様の原理でチャンバ5b内の第2の溶血剤をチャンバ7に流し込む。そして、ステップS1と同様の攪拌を行う。
【0048】
このようにして第2の溶血剤の流動および撹拌の工程(ステップS2)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第2の溶血剤の流動および撹拌の工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0049】
さらに、ステップS3において、ノズル入口3c,3kのみを開にして、ステップS1,S2と同様の原理でチャンバ5c内の磁性体粒子をチャンバ7に流し込む。そして、ステップS1と同様の攪拌を行う。このステップS3によって、ステップS1,S2において細胞が溶解して得られたDNAが磁性体粒子に付着する。
【0050】
このようにして磁性体粒子の流動および撹拌の工程(ステップS3)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、磁性体粒子の流動および撹拌の工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0051】
そして、ステップS4で電磁石14をオンにし、ノズル入口3e,3kのみを開にし、電動シリンジポンプ19から空気を噴出し、電動シリンジポンプ18から空気を吸引して、チャンバ7内の溶液をチャンバ5eに移動させる。この移動の際に、磁性体粒子およびDNAを、流路10の電磁石14の上方位置で捕捉する。なお、電動シリンジポンプ18,19による空気の吸引および噴出を交互に繰り返して、溶液をチャンバ7と5eの間を2回往復させることにより、DNAの捕捉効率を向上させている。さらに往復回数を増やせば、捕捉効率を一層高めることができる。ただし、処理時間が余分に掛かることになる。
【0052】
このように、ステップS1〜S4にて、幅1〜2mm程度で高さ0.2〜1mm程度の小さい流路10上で、流動状態のDNAを、磁性体粒子を利用して極めて効率良く捕捉する。なお、仮に、捕捉ターゲット物質がDNAではなく、RNAまたはタンパク質の場合にも同様に効率の良い捕捉が行える。
【0053】
このようにして磁性体粒子およびDNAの捕捉工程(ステップS4)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、磁性体粒子およびDNAの捕捉工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0054】
次に、ステップS5において電磁石14をオフにし、ノズル入口3f,3lのみを開とする。そして、電動シリンジポンプ19から空気を噴出し、電動シリンジポンプ18から空気を吸引して、チャンバ5l内の第1の抽出洗浄液をチャンバ5fに移動させる。この際に、ステップS4で捕捉された磁性体粒子およびDNAが、抽出洗浄液と共に移動して洗浄が行われる。さらに、電磁石14をオンにして、ステップS4と同様の原理で磁性体粒子およびDNAと抽出洗浄液とをチャンバ5l内とチャンバ5fの間を2回往復させる。それによって、洗浄された磁性体粒子およびDNAを流路10の電磁石14の上方位置に回収し、第1の抽出洗浄液をチャンバ5lに戻す。
【0055】
このように、第1の抽出洗浄液により洗浄した後に磁性体粒子およびDNAを捕捉する工程(ステップS5)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第1の抽出洗浄液により洗浄した後に磁性体粒子およびDNAを捕捉する工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0056】
ステップS6において、ノズル入口3f,3mのみを開いてステップS5と同様の工程を行う。すなわち、チャンバ5m内の第2の抽出洗浄液と、磁性体粒子およびDNAとを移動させて、磁性体粒子およびDNAをさらに洗浄してから電磁石14の上方位置に回収し、第2の抽出洗浄液をチャンバ5mに戻す。
【0057】
このように、第2の抽出洗浄液により洗浄した後に磁性体粒子およびDNAを捕捉する工程(ステップS6)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第2の抽出洗浄液により洗浄した後に磁性体粒子およびDNAを捕捉する工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0058】
続いて、ステップS7において電磁石14をオンにしたまま、ノズル入口3d,3oのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5d内の溶出液をチャンバ8に移動させる。この溶出液の作用によって、磁性体粒子とDNAが分離し、DNAのみが溶出液とともにチャンバ8に移動し、磁性体粒子は流路10内に残る。
【0059】
このようにして、溶出液を流して磁性体粒子とDNAを分離させる工程(ステップS7)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、溶出液を流して磁性体粒子とDNAを分離させる工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0060】
このステップS7において、DNAの抽出および精製が行われる。本実施形態では、抽出洗浄液を収容するチャンバ5l,5mと、洗浄後の廃液を溜めるためのチャンバ5fが用意されているので、カートリッジ1内でDNAの抽出および精製を行うことが可能である。
【0061】
次に、ステップS8において、ノズル入口3g,3oのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ5g内のPCR用薬剤(例えば、プライマ、ポリメラーゼ、dNTP溶液、バッファ、蛍光標識等の混合液)をチャンバ8に流し込む。さらに、ノズル入口3g,3tのみを開にし、電動シリンジポンプ18,19による空気の噴出および吸引を交互に繰り返し、チャンバ8の溶液を流路11に流して、その後に戻す動作を繰り返して攪拌を行う。そして、ペルチェ素子15を制御して、チャンバ8内の溶液を96℃の温度に10分保持した後に、96℃・10秒、55℃・10秒、72℃・1分のサイクルを30回繰り返してPCRを行い、溶出されたDNAを増幅する。
【0062】
このようにして、溶出されたDNAの増幅工程(ステップS8)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、溶出されたDNAの増幅工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0063】
ステップS9でノズル入口3g,3tのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引して、チャンバ8内の溶液をチャンバ9に移動させる。さらに、ペルチェ素子16を制御して、チャンバ9内の溶液を45℃で2時間保持し、ハイブリダイゼーションを行わせる。この時、電動シリンジポンプ18,19による空気の噴出および吸引を交互に繰り返して、チャンバ9内の溶液を流路6tに移動し、その後に戻す動作を繰り返して攪拌を行いながら、ハイブリダイゼーションを進める。
【0064】
このようにして、ハイブリダイゼーション工程(ステップS9)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、ハイブリダイゼーション工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0065】
次にステップS10において、同じく45℃に保持したまま、今度はノズル入口3h、3rのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引する。それによって、チャンバ9内の溶液をチャンバ5rに移動させるとともに、チャンバ5h内の第1の洗浄液を、チャンバ9を通してチャンバ5rに流し込む。このように、ノズル入口3hにポンプノズル20を挿入し空気を噴出して加圧し、ノズル入口3rにポンプノズル21を挿入し空気を吸引して減圧することによって、チャンバ5h内の第1の洗浄液が、チャンバ9を通してチャンバ5r内に流れ込む。この様子が、チャンバ5h,9,5rを通る断面図である図8に示されている。電動シリンジポンプ18,19の吸引および噴出を交互に繰り返して、この溶液をチャンバ5h,9,5rの間を2回往復させ、最後にチャンバ5hに戻す。このようにして、ハイブリダイゼーションしなかった蛍光標識付きの検体DNAと蛍光標識とが洗浄される。
【0066】
このようにして、第1の洗浄液による洗浄工程(ステップS10)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第1の洗浄工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0067】
さらに、ステップS11において、同じく45℃に保持したまま、ノズル入口3j、3rのみを開いて、ステップS10と同様の工程を行う。すなわち、チャンバ5j内の第2の洗浄液をチャンバ9を通してチャンバ5rに流し込んでDNAの洗浄をさらに行い、最後に溶液をチャンバ5jに戻す。
【0068】
このようにして、第2の洗浄液による洗浄工程(ステップS11)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、第2の洗浄液による洗浄工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0069】
本実施形態では、第1、第2の洗浄液を収容するチャンバ5h,5jと、洗浄後の廃液を溜めるためのチャンバ5rが用意されているので、前記の通り生化学反応カートリッジ1内でDNAチップ12の洗浄を行うことが可能である。
【0070】
ステップS12で、ノズル入口3i,3rのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引して、チャンバ5i内のアルコールを、チャンバ9を通してチャンバ5rに移動させる。その後に、ノズル入口3i,3tのみを開にし、電動シリンジポンプ18から空気を噴出し、電動シリンジポンプ19から空気を吸引してチャンバ9内を乾燥させる。
【0071】
このようにして、アルコールの流動および乾燥の工程(ステップS12)を行ったら、第1の通信部26から、ICチップ25の通信部(図示せず)に向けて信号を送信する。この信号は、アルコールの流動および乾燥の工程の完了と、その工程の各種条件と、終了時刻とを表すものであり、ICチップ25の記憶部(図示せず)に記憶される。
【0072】
以上述べたステップS1〜S12によって、検体の生化学反応(例えばDNAのハイブリダイゼーション)を生化学反応カートリッジ1内で行わせることができる。
【0073】
なお、本実施形態では、ノズル入口3a〜3tがカートリッジ1の2つの面、つまり両側部に集中して設けられている。そのため、電動シリンジポンプ18,19、電動切換バルブ、ポンプノズルを内蔵したポンプブロック22,23等の形状や配置を単純化することができる。さらに、必要なチャンバや流路を確保しながら、ポンプブロック22,23により生化学反応カートリッジ1を同時に挟み込むという単純な動作だけで、ポンプノズル20,21を挿入することができる。それによって、ポンプブロック22,23の構成も簡単にすることができる。また、ノズル入口3a〜3tを全て同じ高さに直線的に並ぶように配置することによって、ノズル入口3a〜3tに接続される流路4a〜4tの高さは全て同じになり、流路4a〜4tの作製が容易になる。
【0074】
また、図1に示す処理装置において、n個の生化学反応カートリッジ1を同時に使用できるようにポンプブロック22,23をn倍に長くした構成にすることができる。その場合、n個の生化学反応カートリッジ1を直列に並べて、n個の生化学反応カートリッジ1のそれぞれに対して必要な工程を同時に行うことができる。したがって、構成は極めて簡単でありながら多数の生化学反応カートリッジにおいて同時に生化学反応を行わせることが可能である。
【0075】
以上説明した処理工程(ステップS1〜S12)の後に、ステップS13において、検査者が図示しないレバーを操作して、ポンプブロック22,23を生化学反応カートリッジ1から離れる方向に移動させる。それによって、ポンプノズル20,21が生化学反応カートリッジ1のノズル入口3a〜3tから外れる。そして、ステップS14において、カートリッジ搬送部27(図1参照)を用いて、生化学反応カートリッジ1をテーブル13から検出用エリア28に搬送する。この検出用エリア28において、生化学反応カートリッジ1の生化学反応の測定および解析を行う。
【0076】
ステップS15において、DNAチップ12に捕捉された、ハイブリダイゼーションされたDNAを蛍光検出ユニット30によって検出する。検出結果は、第2の通信部31から、ICチップ25の通信部(図示せず)に向けて送信され、ICチップ25の記憶部(図示せず)に記憶される。こうして、ステップS1〜S12の各工程の(時間経過を含む)推移および各種条件と、その各工程を経たDNAチップ12の検出結果とが、生化学反応カートリッジ1のICチップ25に記憶される。なお、この蛍光検出工程(ステップS15)の詳細については後述する。
【0077】
それから、ステップS16において、制御部17が、蛍光検出したパターンを分析する。なお、生化学反応カートリッジ1が、予め処理装置に記憶されていない種別である場合には、検出パターンの分析にあたって、ICチップ25に書き込まれている分析用情報を読み込み、その分析用情報に基づいて分析を行う。
【0078】
ここで、本実施形態における蛍光検出と分析の原理について説明する。例えば、生化学反応カートリッジ1およびDNAチップ12が感染症検出用のものである場合には、DNAプローブ32の設定の仕方によって、いくつかの感染症が一度に検出できる。DNAプローブ32が5×5のマトリックス状に配置されたDNAチップ12を例にとって考えると、感染症A〜Eがそれぞれ単独で検出されたときのパターンが図9(a)〜(e)に示す5通りとなるように設定できる。なお、図9(a)〜(e)において、黒丸は、ターゲットがDNAプローブ32とハイブリダイゼーションして捕捉されており、ターゲットに付着した蛍光物質(蛍光標識)が蛍光を発している状態を示す。一方、白丸は、ターゲットがDNAプローブ32とハイブリダイゼーションせず捕捉されずに、蛍光標識が存在しない状態を示している。
【0079】
図9(a)〜(e)に示す例では、同一列に含まれるDNAプローブ32は全て、同じ感染症に感染したときに存在するDNAとハイブリダイゼーションするように設定されている。そして、各列毎に異なる感染症のDNAに対応するように設定されている。従って、図9(a)のパターンの検出結果が得られた場合には、感染症Aへの感染が認められ、同様に、図9(b)〜(e)のパターンの検出結果が得られた場合には、それぞれ感染症B〜Eへの感染が認められる。このような検出パターンに基づく感染判断方法は、制御部17に予め記憶されている分析用情報に含まれている。
【0080】
このように、蛍光物質が付着したDNAプローブ32の配列パターンに基づいて、目的とする検体分析を精度良く行うためには、ステップS15において、蛍光検出を精度良く行うことが重要である。特に、様々な種類の生化学反応カートリッジ1およびDNAチップ12に対応して、その都度正確な検出を行うことが必要である。
【0081】
そこで、本実施形態の蛍光検出工程を、図10に示すフローチャートを参照して詳細に説明する。
【0082】
まず、ステップS101において、フィルタ39を、DNAチップ12から光電子増倍管37に至る光路から外す。そして、XYステージ29(図1参照)を動作させて、レーザ光発生器34からのレーザ光(励起光)がDNAチップの反射板33に入射するように生化学反応カートリッジ1を動かす。そこで、ステップS102において、レーザ光発生器34から反射板33に励起光を照射し、ステップS103において、光電子増倍管37により反射板33からの反射光の光強度測定を開始する。その状態で、ステップS104において、対物レンズ36を上下に移動させながら光電子増倍管37による光強度測定値が最大になる位置を探す。そして、光強度測定値が最大になる位置に対物レンズ36を固定する。それから、ステップS105において、最大となった光強度測定値を、予め記憶されている光強度基準値と比較してその割合を算出する。なお、光強度基準値は、予め基準の基板と基準の励起光とを用いて実験的に得られた反射光の強度である。
【0083】
それから、ステップS106において、ステップS105で求められた割合に基づいて、レーザ光発生器34の出力強度を調整する。すなわち、光強度測定値が光強度基準値よりも大きい場合には出力強度を弱くし、光強度測定値が光強度基準値よりも小さい場合には出力強度を強くして、光強度測定値が光強度基準値にできるだけ一致するようにする。なお、図示しない調整手段がレーザ光発生器34の出力強度を調整してもよいが、レーザ光発生器34自体または制御部17が出力強度を調整する調整手段として作用してもよい。
【0084】
以上のステップS101〜S106によって準備作業を行ったら、ステップS107において、フィルタ39を、DNAチップ12から光電子増倍管37に至る光路上に移動する。そして、ステップS108において、XYステージ29を動作させて、レーザ光発生器34からのレーザ光(励起光)がDNAチップ12のDNAプローブ32群の検出開始位置に入射するように生化学反応カートリッジ1を動かす。そこで、ステップS109において、XYステージ29をX方向に主走査させながら、レーザ光発生器34からDNAチップ12の1ライン分の領域に励起光を照射する。励起光が照射された位置にあるDNAプローブ32に蛍光物質が存在していれば、すなわち蛍光物質(蛍光標識)が付着したDNAがハイブリダイゼーションしていれば、蛍光物質が蛍光を発生する。この蛍光は、フィルタ39を透過して光電子増倍管37によって検出される。こうして、1ライン分の蛍光の光強度を測定する。この測定結果によって、感染症Aへの感染の有無を知ることができる。なお、反射光など蛍光以外の光はフィルタ39によって遮断され、光電子増倍管37に入射しないため、検出ノイズが生じにくい。
【0085】
また、本実施形態では、ステップS105において励起光の出力強度を調整しているため、予め記憶されている分析用情報に基づいて蛍光の光強度の測定を行っても検出誤差が小さい。
【0086】
ただし、ステップS105において、光強度測定値と光強度基準値とを一致させることが困難である場合には、光強度基準値に換算するための補正式を求めておく。そして、ステップS110において、予め記憶されている分析用情報とこの補正式とを利用して、精度良く蛍光検出を行うことができる。例えば、ステップS105において調整しても光強度測定値が光強度基準値よりも大きくなる場合には、その差の1/2だけ測定値から減じる補正を行う。逆に、ステップS105において調整しても光強度測定値が光強度基準値よりも小さくなる場合には、その差の1/2だけ測定値に加える補正を行う。
【0087】
このようにして1ラインの蛍光検出が完了したら、ステップS111においてXYステージ29を動作させて、1ライン分だけ生化学反応カートリッジ1をY方向に副走査させる。
【0088】
ステップS112において、マトリックス状のDNAプローブ32の最終ラインの蛍光検出が完了したことが確認されるまで、主走査および蛍光検出(ステップS109〜S110)と、副走査(ステップS111)を交互に繰り返す。ステップS112においてマトリックス状のDNAプローブ32の最終ラインの蛍光検出が完了したことが確認されると、ステップS113においてXYステージ29を動作させて、生化学反応カートリッジ1を初期位置へ移動させる。
【0089】
以上説明したように、本実施形態では、DNAチップ12の基板の材質や厚さや屈折率が異なるなど、様々な種類の生化学反応カートリッジ1を用いて蛍光物質の検出を行う上で、実際の光強度測定値が光強度基準値と一致するように調整することができる。
【0090】
図2に示すような構成では、励起光を反射する反射板33がDNAチップ12の基板の表側に配置されており、励起光はその基板の裏側から照射されるため、基板によって光の減衰がある。そこで本実施形態では、予め、ステップS102〜S105の工程において基板での減衰率を把握し、それに基づいて、一定の強度で蛍光が励起されるように、ステップS106において励起光の出力強度を調整する。さらに、ステップS110では、調整された励起光により得られた蛍光強度にさらに補正を施して、最終的な検出結果を得る。
【0091】
こうして、内蔵するDNAチップ12の基板が異なる生化学反応カートリッジ1を測定する際にも、ほぼ同一の蛍光物質励起条件および蛍光検出条件の下で測定を行うことができる。従って、測定結果が安定していて、予め求められている分析用情報(例えば良否判定データ)との比較が簡単にできる。また、予め求められている分析用情報(例えば良否判定データ)を使用して分析を行うことが容易にできるため、処理速度が速くなり、データ換算等の間違いが発生する要因が減り、迅速に正確な結果が得られるという効果がある。その結果、常に精度良く検体の分析が行える。
【0092】
[第2の実施形態]
次に、本発明の第2の実施形態を詳細に説明する。
【0093】
図示していないが、本実施形態の反射体は、DNAチップ12ではなく、生化学反応カートリッジ1を取り付ける処理装置本体に設けられている。そして、反射体は、蛍光検出を行うためにレーザ光発生器34からDNAチップ12へ励起光を照射する際の妨げにならない格納位置と、基板表面に接触し、レーザ光発生器34から照射された励起光が入射する反射位置との間を移動可能である。従って、ステップS102〜S106においては、反射体を反射位置に配置した状態で、レーザ光発生器34から励起光を照射してその反射光の強度を測定して出力強度を調整する一連の工程を行う。その後、ステップS109〜S112において主走査および副走査を行って蛍光物質を検出する前に、反射体を反射位置から格納位置に移動させる。
【0094】
本実施形態によると、微小なDNAチップ12に反射板を設ける必要がないため、製造工程が簡単になる。なお、この反射体以外の構成ついては第1の実施形態と同様であるので説明を省略する。そして、説明を繰り返さないが、本実施形態では、第1の実施形態(図6,10)と同様の工程を行うことによって、第1の実施形態と同様な効果を得ることができる。
【0095】
[第3の実施形態]
次に、本発明の第3の実施形態を詳細に説明する。
【0096】
本実施形態では、図11に示すように、DNAチップ12の被検出領域において、DNAプローブ32がマトリックス状に並ぶ領域の側方に、そのマトリックスの領域の長さ以上の長さを有する反射板40が配置されている。この構成は、特に、実際に蛍光検出する1ライン分の主走査を行う前に、すなわち、副走査を1回行った後に、定期的に励起光を反射板40に照射してその反射光の強度を測定し、出力強度を調整する場合に適している。
【0097】
この場合の具体的な構成を図12に示している。すなわち、第1の実施形態と同様なレーザ光発生器34、スプリッタ35、対物レンズ36、レンズ38、および光電子増倍管37に加えて、受光素子(フォトダイオード)42と、ダイクロイック・ミラー41と、レンズ43を有している。フォトダイオード42は、DNAチップ12からの反射光の光強度を検出するためのものである。ダイクロイック・ミラー41は、DNAチップ12からの反射光を90度曲げてフォトダイオード42に向けて反射する一方、反射光とは波長の異なる蛍光をそのまま透過させる。レンズ43は、ダイクロイック・ミラー41によって90度曲げられて反射された反射光をフォトダイオード42に集光する。
【0098】
仮に、第1の実施形態と同様に、フィルタ39をDNAチップ12から光電子増倍管37に至る光路上と、光路外との間で移動させる構成にすると、非常に頻繁にフィルタ39の移動を行わねばならず、処理が煩雑で時間がかかる。そこで本実施形態ではフィルタ39は用いず、前記した通り、蛍光検出用の光電子増倍管37の他に、反射光を受光して励起光の出力強度調整用のデータを求めるための受光手段(フォトダイオード)42が別途設けられた構成にしている。そのために、ダイクロイック・ミラー41もさらに追加されている。
【0099】
次に、本実施形態における蛍光検出工程を、図13に示すフローチャートを参照して説明する。
【0100】
まず、第1の実施形態と同様にステップS1〜S14(図6参照)にて、生化学反応カートリッジ1内での生化学反応を行わせる。その後、ステップS121において、XYステージ29を動作させて、レーザ光発生器34からのレーザ光(励起光)が、反射板40の、DNAチップ12のDNAプローブ32群の検出開始位置に隣接する位置に入射するように生化学反応カートリッジ1を動かす。
【0101】
そこで、ステップS122において、レーザ光発生器34から反射板40に励起光を照射し、ステップS123において、ダイクロイック・ミラー41によって90度曲げられた、反射板40からの反射光の強度を、フォトダイオード42によって測定開始する。その状態で、ステップS124において、対物レンズ36を上下に移動させながらフォトダイオード42による光強度測定値が最大になる位置を探す。そして、光強度測定値が最大になる位置に対物レンズ36を固定する。それから、ステップS125において、最大となった光強度測定値を、予め記憶されている光強度基準値と比較してその割合を算出する。それから、ステップS126において、ステップS125で求められた割合に基づいて、レーザ光発生器34の出力強度を調整する。すなわち、光強度測定値が光強度基準値よりも大きい場合には出力強度を弱くし、光強度測定値が光強度基準値よりも小さい場合には出力強度を強くして、光強度測定値が光強度基準値にできるだけ一致するようにする。
【0102】
続いて、ステップS127において、XYステージ29をX方向に主走査させながら、レーザ光発生器34からDNAチップ12の1ライン分の領域にレーザ光(励起光)を照射する。励起光が照射された位置にあるDNAプローブ32に蛍光物質が存在していれば、すなわち蛍光物質(蛍光標識)が付着したDNAがハイブリダイゼーションしていれば、蛍光物質が蛍光を発生する。この蛍光は、ダイクロイック・ミラー40を透過して光電子増倍管37によって検出される。こうして、1ラインの蛍光の光強度を測定し、測定が完了したら励起光が反射板40に入射する位置に生化学反応カートリッジ1を移動させる。
【0103】
ステップS125において、光強度測定値と光強度基準値とを一致させることが困難である場合には、光強度基準値に換算するための補正式を求めておく。そして、ステップS128において、予め記憶されている分析用情報とこの補正式とを利用して、蛍光の光強度を精度良く求めることができる。例えば、ステップS105において調整しても光強度測定値が光強度基準値よりも大きくなる場合には、その差の1/2だけ測定値から減じる補正を行う。逆に、ステップS125において調整しても光強度測定値が光強度基準値よりも小さくなる場合には、その差の1/2だけ測定値に加える補正を行う。
【0104】
このようにして1ラインの蛍光検出が完了したら、ステップS129においてXYステージ29を動作させて、1ライン分だけ生化学反応カートリッジ1をY方向に副走査させる。
【0105】
ステップS130において、マトリックス状のDNAプローブ32の最終ラインの蛍光検出が完了したことが確認されるまで、主走査および蛍光検出(ステップS109〜S110)と、副走査(ステップS111)とを交互に繰り返す。ただし、本実施形態では、主走査および蛍光検出(ステップS109〜S110)を行う前に、必ず、励起光の出力強度調整のための処理(ステップS122〜S126)を行う。それによって、1つのDNAチップ12の分析を行っている最中に何らかの処理条件の変化が発生した場合にも、その都度対応して、高精度の蛍光検出を行うことができる。
【0106】
そして、ステップS130においてマトリックス状のDNAプローブ32の最終ラインの蛍光検出が完了したことが確認されると、ステップS131においてXYステージ29を動作させて、生化学反応カートリッジ1を初期位置へ移動させる。
【0107】
本実施形態では、前記したように、1ライン毎の実際の蛍光検出動作に際して、必ず、励起光の出力強度調整を行う。それによって、1つのDNAチップ12の分析を行っている最中に何らかの処理条件の変化が発生した場合にも、その都度対応して、精度のよい蛍光検出を行うことができる。また、説明を繰り返さないが、本実施形態でも、第1の実施形態と同様な効果を得ることができる。
【0108】
また、レーザ光発生器34の電源投入直後は、励起光が安定しない状況が生じる。その場合でも、本実施形態によると、毎回の主走査に先だって、反射板40による反射光の光強度を測定し、それに基づいて励起光の出力強度を調整するため、レーザ光発生器34の電源投入直後から、待機時間をおく必要なく、励起光が安定した状態と同程度の高精度の蛍光検出が可能である。これによって、レーザ光発生器34の電源をオンにし続けておかず、短時間であっても励起光が不必要な時に電源をオフにしても、作業効率が低下することはなく、省電力化に寄与するという効果もある。
【図面の簡単な説明】
【0109】
【図1】本発明の第1の実施形態の検体分析装置の構成を示すブロック図である。
【図2】図1に示す検体分析装置の蛍光物質検出装置を示す概略側面図である。
【図3】本発明の生化学反応カートリッジの斜視図である。
【図4】図3に示す生化学反応カートリッジの平面断面図である。
【図5】図3に示す生化学反応カートリッジのDNAチップの平面図である。
【図6】図1に示す検体分析装置における処理工程を示すフローチャートである。
【図7】図3,4に示す生化学反応カートリッジのチャンバの一部を通る縦断面図である。
【図8】図3,4に示す生化学反応カートリッジの他のチャンバを通る縦断面図である。
【図9】DNAチップの蛍光物質検出パターンの例を示す模式図である。
【図10】図6に示す処理工程の蛍光物質検出工程を示すフローチャートである。
【図11】本発明の第2の実施形態のDNAチップの平面図である。
【図12】本発明の第2の実施形態の蛍光物質検出装置を示す概略側面図である。
【図13】本発明の第2の実施形態の蛍光物質検出工程を示すフローチャートである。
【符号の説明】
【0110】
1 生化学反応カートリッジ
12 DNAチップ
17 制御部
25 ICチップ
30 蛍光検出ユニット
33 反射板
34 レーザ光発生器
37 光電子増倍管
40 反射板
42 フォトダイオード
【特許請求の範囲】
【請求項1】
透光性を有する基板の表面上の蛍光物質を検出する蛍光物質検出装置であって、
前記基板の裏面に向けて照射される励起光を発生させる励起光発生手段と、
前記透光性を有する基板を透過することで減衰した前記励起光を受光する第1の受光手段と、前記励起光により励起された前記蛍光物質が発する蛍光を受光する第2の受光手段と、
前記第1の受光手段が受光した前記減衰した励起光の光強度測定値に応じて前記励起光の出力強度を調整する調整手段と、
を備えることを特徴とする蛍光物質検出装置。
【請求項2】
前記基板の表面側に反射手段が設けられており、
該反射手段は、前記透過した励起光が前記基板の裏面側に向かって反射するように配置されている請求項1に記載の蛍光物質検出装置。
【請求項3】
前記第1および第2の受光手段が単一の前記受光手段である、請求項2に記載の蛍光物質検出装置。
【請求項4】
前記励起光が前記基板の少なくとも一部を横切るように、前記基板を前記励起光発生手段に対して相対的に一定方向に走査する主走査と、前記基板を、前記主走査の方向に交差する方向に、前記励起光発生手段に対して相対的に移動させる副走査とを交互に複数回繰り返すことによって、前記基板の被検出領域全体に対して前記励起光を照射可能であり、
前記被検出領域には、前記蛍光物質の存在する可能性のある領域と、前記反射手段とが並置されており、
複数回行われる前記主走査の各々に先だって、前記励起光発生手段が前記反射手段に前記励起光を照射し、前記受光手段が前記反射光を受光して、該反射光の光強度測定値に基づいて前記励起光の出力強度を調整する、請求項2〜3のいずれか1項に記載の蛍光物質検出装置。
【請求項5】
前記反射手段は前記基板の表面に前記基板と一体的に設けられている、請求項2〜4のいずれか1項に記載の蛍光物質検出装置。
【請求項6】
前記反射手段は前記基板の表面に隣接する位置に配置されている、請求項2〜4のいずれか1項に記載の蛍光物質検出装置。
【請求項7】
前記基板の被検出領域には、蛍光物質が付着しているDNAを捕捉可能な複数のDNAプローブが設けられている、請求項1〜6のいずれか1項に記載の蛍光物質検出装置。
【請求項8】
請求項1〜7のいずれか1項に記載の蛍光物質検出装置と、
前記蛍光物質検出装置による前記蛍光物質の検出結果に基づいて、前記蛍光物質検出装置に供給される検体の生化学反応の有無および/または生化学反応状態を知ることによって、前記検体を分析する制御部と
を含む、検体分析装置。
【請求項9】
前記制御部は前記蛍光物質検出装置の動作を制御可能である、請求項8に記載の検体分析装置。
【請求項10】
前記検体が供給される前記基板を含む生化学反応カートリッジがセットされ、前記検体の生化学反応を行わせるための処理装置をさらに含む、請求項9に記載の検体分析装置。
【請求項11】
請求項1〜10のいずれか1項に記載の装置に使用するための基板であって、
透光性を有する基板と、該基板表面に結合した標的物質を捕捉するためのプローブと、前記基板表面に設けられた反射手段と、を有するプローブ結合基板。
【請求項12】
透光性を有する基板の表面上の蛍光物質を検出する蛍光物質検出方法において、
前記基板の裏面に向けて励起光を照射する工程と、
前記基板を透過することにより減衰した前記励起光を、受光手段によって受光する工程と、
前記受光手段が受光した前記減衰した励起光の光強度測定値と、予め設定されている光強度基準値とを比較して、その比較結果に応じて、前記励起光の出力強度を調整する工程と、
出力強度が調整された前記励起光を前記基板の裏面に照射する工程と、
前記励起光が照射された位置に存在する前記蛍光物質が発する蛍光を、前記受光手段が検出する工程と
を含むことを特徴とする蛍光物質検出方法。
【請求項13】
透光性を有する基板の表面上の蛍光物質を検出する蛍光物質検出方法において、
表面に反射手段を有する基板の裏面に向けて励起光を照射する工程と、
前記励起光が前記反射手段により反射された反射光を、受光手段によって受光する工程と、
前記受光手段が受光した反射光の光強度測定値と、予め設定されている光強度基準値とを比較して、その比較結果に応じて、前記励起光の出力強度を調整する工程と、
出力強度が調整された前記励起光を前記基板の裏面に照射する工程と、
前記励起光が照射された位置に存在する前記蛍光物質が発する蛍光を、前記受光手段が検出する工程と
を含むことを特徴とする蛍光物質検出方法。
【請求項14】
単一の前記受光手段によって、前記反射光と前記蛍光を受光する、請求項13に記載の蛍光物質検出方法。
【請求項15】
前記受光手段のうちの反射光受光手段によって前記反射光を受光し、前記受光手段のうちの蛍光受光手段によって前記蛍光を受光する、請求項13に記載の蛍光物質検出方法。
【請求項16】
前記励起光が前記基板の少なくとも一部を横切るように、前記基板を前記励起光発生手段に対して相対的に一定方向に走査する主走査と、前記基板を、前記主走査の方向に交差する方向に、前記励起光発生手段に対して相対的に移動させる副走査とを交互に複数回繰り返すことによって、前記基板の被検出領域全体に対して前記励起光を照射し、
複数回行われる前記主走査の各々に先だって、前記励起光発生手段が前記反射手段に前記励起光を照射し、前記受光手段が前記反射光を受光して、該反射光の光強度測定値に基づいて前記励起光の出力強度を調整する、請求項13〜15のいずれか1項に記載の蛍光物質検出方法。
【請求項17】
請求項12〜16のいずれか1項に記載の蛍光物質検出方法の各工程と、前記蛍光の検出結果に基づいて、検体の生化学反応の有無および/または生化学反応状態を知ることによって前記検体を分析する工程とを含む、検体分析方法。
【請求項1】
透光性を有する基板の表面上の蛍光物質を検出する蛍光物質検出装置であって、
前記基板の裏面に向けて照射される励起光を発生させる励起光発生手段と、
前記透光性を有する基板を透過することで減衰した前記励起光を受光する第1の受光手段と、前記励起光により励起された前記蛍光物質が発する蛍光を受光する第2の受光手段と、
前記第1の受光手段が受光した前記減衰した励起光の光強度測定値に応じて前記励起光の出力強度を調整する調整手段と、
を備えることを特徴とする蛍光物質検出装置。
【請求項2】
前記基板の表面側に反射手段が設けられており、
該反射手段は、前記透過した励起光が前記基板の裏面側に向かって反射するように配置されている請求項1に記載の蛍光物質検出装置。
【請求項3】
前記第1および第2の受光手段が単一の前記受光手段である、請求項2に記載の蛍光物質検出装置。
【請求項4】
前記励起光が前記基板の少なくとも一部を横切るように、前記基板を前記励起光発生手段に対して相対的に一定方向に走査する主走査と、前記基板を、前記主走査の方向に交差する方向に、前記励起光発生手段に対して相対的に移動させる副走査とを交互に複数回繰り返すことによって、前記基板の被検出領域全体に対して前記励起光を照射可能であり、
前記被検出領域には、前記蛍光物質の存在する可能性のある領域と、前記反射手段とが並置されており、
複数回行われる前記主走査の各々に先だって、前記励起光発生手段が前記反射手段に前記励起光を照射し、前記受光手段が前記反射光を受光して、該反射光の光強度測定値に基づいて前記励起光の出力強度を調整する、請求項2〜3のいずれか1項に記載の蛍光物質検出装置。
【請求項5】
前記反射手段は前記基板の表面に前記基板と一体的に設けられている、請求項2〜4のいずれか1項に記載の蛍光物質検出装置。
【請求項6】
前記反射手段は前記基板の表面に隣接する位置に配置されている、請求項2〜4のいずれか1項に記載の蛍光物質検出装置。
【請求項7】
前記基板の被検出領域には、蛍光物質が付着しているDNAを捕捉可能な複数のDNAプローブが設けられている、請求項1〜6のいずれか1項に記載の蛍光物質検出装置。
【請求項8】
請求項1〜7のいずれか1項に記載の蛍光物質検出装置と、
前記蛍光物質検出装置による前記蛍光物質の検出結果に基づいて、前記蛍光物質検出装置に供給される検体の生化学反応の有無および/または生化学反応状態を知ることによって、前記検体を分析する制御部と
を含む、検体分析装置。
【請求項9】
前記制御部は前記蛍光物質検出装置の動作を制御可能である、請求項8に記載の検体分析装置。
【請求項10】
前記検体が供給される前記基板を含む生化学反応カートリッジがセットされ、前記検体の生化学反応を行わせるための処理装置をさらに含む、請求項9に記載の検体分析装置。
【請求項11】
請求項1〜10のいずれか1項に記載の装置に使用するための基板であって、
透光性を有する基板と、該基板表面に結合した標的物質を捕捉するためのプローブと、前記基板表面に設けられた反射手段と、を有するプローブ結合基板。
【請求項12】
透光性を有する基板の表面上の蛍光物質を検出する蛍光物質検出方法において、
前記基板の裏面に向けて励起光を照射する工程と、
前記基板を透過することにより減衰した前記励起光を、受光手段によって受光する工程と、
前記受光手段が受光した前記減衰した励起光の光強度測定値と、予め設定されている光強度基準値とを比較して、その比較結果に応じて、前記励起光の出力強度を調整する工程と、
出力強度が調整された前記励起光を前記基板の裏面に照射する工程と、
前記励起光が照射された位置に存在する前記蛍光物質が発する蛍光を、前記受光手段が検出する工程と
を含むことを特徴とする蛍光物質検出方法。
【請求項13】
透光性を有する基板の表面上の蛍光物質を検出する蛍光物質検出方法において、
表面に反射手段を有する基板の裏面に向けて励起光を照射する工程と、
前記励起光が前記反射手段により反射された反射光を、受光手段によって受光する工程と、
前記受光手段が受光した反射光の光強度測定値と、予め設定されている光強度基準値とを比較して、その比較結果に応じて、前記励起光の出力強度を調整する工程と、
出力強度が調整された前記励起光を前記基板の裏面に照射する工程と、
前記励起光が照射された位置に存在する前記蛍光物質が発する蛍光を、前記受光手段が検出する工程と
を含むことを特徴とする蛍光物質検出方法。
【請求項14】
単一の前記受光手段によって、前記反射光と前記蛍光を受光する、請求項13に記載の蛍光物質検出方法。
【請求項15】
前記受光手段のうちの反射光受光手段によって前記反射光を受光し、前記受光手段のうちの蛍光受光手段によって前記蛍光を受光する、請求項13に記載の蛍光物質検出方法。
【請求項16】
前記励起光が前記基板の少なくとも一部を横切るように、前記基板を前記励起光発生手段に対して相対的に一定方向に走査する主走査と、前記基板を、前記主走査の方向に交差する方向に、前記励起光発生手段に対して相対的に移動させる副走査とを交互に複数回繰り返すことによって、前記基板の被検出領域全体に対して前記励起光を照射し、
複数回行われる前記主走査の各々に先だって、前記励起光発生手段が前記反射手段に前記励起光を照射し、前記受光手段が前記反射光を受光して、該反射光の光強度測定値に基づいて前記励起光の出力強度を調整する、請求項13〜15のいずれか1項に記載の蛍光物質検出方法。
【請求項17】
請求項12〜16のいずれか1項に記載の蛍光物質検出方法の各工程と、前記蛍光の検出結果に基づいて、検体の生化学反応の有無および/または生化学反応状態を知ることによって前記検体を分析する工程とを含む、検体分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2007−47110(P2007−47110A)
【公開日】平成19年2月22日(2007.2.22)
【国際特許分類】
【出願番号】特願2005−234215(P2005−234215)
【出願日】平成17年8月12日(2005.8.12)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成19年2月22日(2007.2.22)
【国際特許分類】
【出願日】平成17年8月12日(2005.8.12)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

