国際特許分類[C12N9/64]の内容
化学;冶金 (1,075,549) | 生化学;ビール;酒精;ぶどう酒;酢;微生物学;酵素学;突然変異または遺伝子工学 (115,607) | 微生物または酵素;その組成物 (68,222) | 酵素,例.リガーゼ;酵素の調製,活性化,阻害,分離または精製方法 (6,067) | 加水分解酵素 (2,152) | ペプチド結合に作用するもの,例.トロンボプラスチン,ロイシンアミノペプチダーゼ (618) | プロティナーゼ (494) | 動物の組織から抽出されたもの,例.レンニン (112)
国際特許分類[C12N9/64]に分類される特許
31 - 40 / 112
線維症および肝疾患の治療
本発明は線維症または肝疾患の治療または予防のためのACE2に関する。 (もっと読む)
前立腺癌および結腸癌の診断および治療に有用な腫瘍抗原
【課題】新規の前立腺特異性のアンドロゲンで調節された細胞表面セリンプロテアーゼである20P1F12/TMPRSS2に由来するかまたはこれを基にした、前立腺癌および結腸癌の診断および治療のための組成物を提供する。
【解決手段】20P1F12/TMPRSS2遺伝子の全コード配列を含む完全長のcDNA。組成物中の検出マーカーまたは毒物または治療用組成物で標識された抗体を含む、20P1F12/TMPRSS2タンパク質およびそのポリペプチド断片に結合する抗体。20P1F12/TMPRSS2に特異的に反応するモノクローナル抗体。
(もっと読む)
インシュリン分解酵素結晶
本発明は、インシュリン分解酵素(IDE)のアポ結晶および共結晶ならびに薬物開発におけるその使用を提供する。 (もっと読む)
組換えエラスターゼタンパク質ならびにその製造方法および使用
本発明は、生物学的に活性な組換えエラスターゼタンパク質の製造、精製、製剤化、および使用のための方法に関する。前記エラスターゼタンパク質を含む医薬組成物と同様に、治療的に有用なエラスターゼを作製する組換え法が説明される。新規の組換えエラスターゼタンパク質およびタンパク質調製物もまた開示される。本発明のエラスターゼタンパク質を含有する医薬組成物を用いて生体導管疾患を治療および予防する方法が説明される。 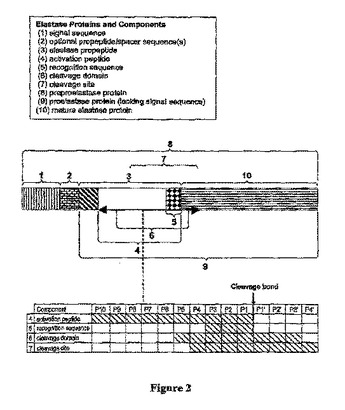 (もっと読む)
(もっと読む)
Mch4およびMch5、アポトーシス性プロテアーゼ、コードする核酸、および使用方法
【課題】新しいアポトーシス遺伝子およびそれらの遺伝子産物を同定すること。
【解決手段】本発明は、Mch4をコードする単離された遺伝子またはMch5をコードする単離された遺伝子、ならびにその機能的フラグメントを提供する。Mch4またはMch5、あるいはその機能的フラグメントをコードする単離された核酸配列もまた提供される。遺伝子または核酸配列は、Mch4またはMch5ヌクレオチド配列のコード鎖または非コード鎖に対応する1本鎖または2本鎖核酸であり得る。FADD様ドメインMch4A、Mch4B、Mch5A、およびMch5Bのような機能的フラグメントをコードする遺伝子および核酸もまた提供される。単離されたMch4またはMch5ポリペプチド、あるいはFADD様ドメインMch4A、Mch4B、Mch5A、およびMch5Bを含むその機能的フラグメントもまた提供される。
(もっと読む)
アミロイドタンパク質に関係する疾患を治療するための組織カリクレイン
本発明はアルツハイマー病またはその症候群、および健忘性軽度認知障害またはその症候群を治療する方法に関する。本発明の方法は、治療上有効な量の組織カリクレイン、その変異体または活性断片を投与するステップを含む。本発明はさらに、アミロイドの消化または切断のための、およびアミロイドの消化または切断から利益を得る症状の治療のための、組織カリクレインまたはその変異体もしくは活性断片の使用に関する。本発明はさらに、治療上有効な量の組織カリクレイン、その変異体または活性断片を含む、経口または鼻腔内投与用に製剤された医薬組成物に関する。 (もっと読む)
改変型カリクレイン及びこれを用いる機能型カリクレインの製造方法
【課題】効率よく且つ大量に機能型カリクレインを製造する方法を提供すること。
【解決手段】本発明は、制御配列からなるアミノ酸配列が欠失したカリクレインアミノ酸配列を含む、改変型カリクレインポリペプチドを利用した機能型カリクレインの製造方法を提供する。上記改変型カリクレインポリペプチドをコードする発現ベクターが導入された形質転換体を培養することにより、培養上清中に機能型カリクレインが分泌される。本発明の方法を用いれば、エンドプロテアーゼによる汚染のリスクを有さない高活性の機能型カリクレインを、効率よく且つ大量に製造することが可能となる。
(もっと読む)
カリクレイン7モジュレーター
本発明は、セリンプロテアーゼ カリクレイン7の結晶構造および創薬における該結晶構造の使用に関する。本発明はまた、カリクレイン7のこの活性部位に特異的に結合する化合物に関する。 (もっと読む)
精製されたマルチメラ−ゼ
【課題】生理学的な様式でフォンビルブラント因子(vWF)をタンパク質加水分解によりプロセシングすることができ、場合によりvWFを分解することができる酵素活性、およびそのような酵素活性を含む調製物を提供する。
【解決手段】間接的または直接的なタンパク質加水分解活性を有し、シングレット構造を有するフォンビルブラント因子(vWF)をサテライト構造を有するvWFに変換し、セリンプロテアーゼ阻害剤 ジイソプロピルフルオロホスフェ−ト(DFP)またはカルペインプロテアーゼ阻害剤 Z-Leu-Leu-Tyr-CHN2の存在下で活性である精製されたマルチメラ−ゼ、および該マルチメラーゼを含有する調製物。
(もっと読む)
ヒトフューリンのための予備的な精製方法
組換え切断型ヒトフューリンをCHO細胞中で発現させ、限外ろ過及び透析ろ過によって約50倍に濃縮した。濃縮物を、Capto−MMC(商標)を用いたカラムクロマトグラフィーによって精製し、30〜50倍の精製倍率、少なくとも60%の収率を得た。Capto−MMC(商標)クロマトグラフィー後に得られた少なくとも20%純粋な調製物は、既にプロVWFのオンカラム成熟が可能な精製度であった。次いで、追加のArginine Sepharoseクロマトグラフィー精製を実施した。切断型ヒトフューリンの精製のためのこの2つのカラムプロセスによって、比活性約290,000Uフューリン/mgタンパク質及び収率約50%でほぼ純粋なフューリン調製物が得られた。 (もっと読む)
31 - 40 / 112
[ Back to top ]



