β−アミロイドアナログ−T細胞エピトープワクチン
【課題】アルツハイマー病(AD)およびその他のアミロイド沈着を特徴とする疾患の治療法を提供する。
【解決手段】自己のアミロイド前駆体タンパク質(APP)またはβアミロイド(Aβ)のアナログ、またはそのアナログが結合したポリヒドロキシポリマー骨格を含むコンジュゲート、または同アナログをエンコードする核酸、または同アナログをエンコードして発現する核酸断片を有する非病原性微生物またはウイルス、を自家ワクチンとして含む医薬組成物。
【解決手段】自己のアミロイド前駆体タンパク質(APP)またはβアミロイド(Aβ)のアナログ、またはそのアナログが結合したポリヒドロキシポリマー骨格を含むコンジュゲート、または同アナログをエンコードする核酸、または同アナログをエンコードして発現する核酸断片を有する非病原性微生物またはウイルス、を自家ワクチンとして含む医薬組成物。
【発明の詳細な説明】
【技術分野】
【0001】
技術分野
本発明は、アルツハイマー病(AD)、およびアミロイド沈着を特徴とする、例えば中枢神経系(CNS)におけるアミロイド沈着を特徴とする他の疾患の治療ならびに予防における改
良に関する。より特異的には、本発明は、アミロイド沈着に関与する病理を有する疾患に苦しんでいるか、または苦しむ危険性がある患者において、関連タンパク質(APPもしくはAβ)またはその成分に対する抗体の産生を可能にすることによる、(望まれていない)アミロイド沈着をダウンレギュレーションする方法に関する。本発明はまた、この方法において有用なポリペプチドの製造方法とともに、そのように修飾されたポリペプチドを提供する。本発明により包含されるものとしてはまた、修飾されたポリペプチドをエンコードする核酸断片とともに、これらの核酸断片が組込まれたベクターおよび宿主細胞ならびにそれにより形質転換された細胞ラインである。最後に、本発明は、新しいタイプのコンジュゲートペプチド免疫原を規定する。
【背景技術】
【0002】
背景技術
アミロイドーシスは、不溶性タンパク質フィブリルの細胞外沈着で、組織損傷および疾患を導く(Pepys, 1996;Tanら、1995;Kelly、1996)。フィブリルは、通常、溶解性のタ
ンパク質およびペプチドが異常な方法により自己会合するときに形成される(Kelly、1997)。
【0003】
アミロイドは、全身性アミロイドーシス、AD、成人発症型糖尿病、パーキンソン病、ハンチントン病、前頭側頭型痴呆、およびプリオンに関する伝染性海綿状脳症(ヒトにおけるクールーおよびクロイツフェルト−ヤコブ病、ならびにそれぞれヒツジおよびウシにおけるスクラピーおよびBSE)を含む重篤な疾患に関連し、例えばアルツハイマー病におけ
るアミロイドプラーク形成は、ヒトの疾患の悪化に密接に関連しているようである。β−アミロイドタンパク質のような沈着において見出されるタンパク質の過剰発現、またはその修飾された形態の発現の動物モデルは、種々の疾患の症状、例えばアルツハイマー様症状を誘導することが示されている。アミロイド沈着に対する特異的療法はなく、これらの疾患は、通常、致命的である。
【0004】
アミロイドフィブリルのサブユニットは、野生型、変異型またはトランケーテッド(truncated)タンパク質であり、同様のフィブリルをオリゴペプチドおよび変性タンパク質か
らインビトロで形成することができる(Bradburyら、1960;Filshieら、1964;Burkeおよ
びRougvie、1972)。フィブリルのポリペプチド成分の性質が、アミロイドーシスの特徴を明らかにしている。アミロイドタンパク質のサイズ、天然の構造および機能における大きな相違にもかかわらず、全てのアミロイドフィブリルは、長さが未定であり、分岐せず、直径70〜120Åであり、コンゴーレッドで特徴的な染色を示す(Pepys、1996)。これらは、ポリペプチド鎖がβシートに構成されている、クロスβ構造(PaulingおよびCorey、1951)に特有である。アミロイドタンパク質は大きく異なった前駆体構造を有するが、これらは全て、おそらくは同様の経路に沿って、β−シートへリックスプロトフィラメントの基礎単位である、誤って折りたたまれた形状への構造転換を受けることができる。
【0005】
アミロイドーシスに導く、この特有の繊維形状はβ−フィブリロース(β-fibrilloses)
(Glenner、1980a、b)と呼ばれ、ADのフィブリルタンパク質は、その二次構造が知られる以前に、β−タンパク質と名付けられた(GlennerおよびWong、1984)。特徴的なクロス−
β回折パターンは、フィブリルの外観および着色特性とともに、現在では、アミロイドの
診断上の顕著な特徴として受け入れられており、非常に異なるタンパク質前駆体から形成されるが、フィブリルが構造上類似の程度を共有し、それらの前駆体タンパク質の性質に関わらず構造上のスーパーファミリーを構成することを示唆する(Sunde M、Serpell LC、Bartlam M、Fraser PE、Pepys MB、Blake CCFJ Mol Biol 1997 Oct 31;273(3):729〜739)。
【0006】
中枢神経系におけるアミロイド沈着が、疾患の進行において中心的役割を有することを示唆する、最も広くいきわたった、よく知られた疾患の一つは、ADである。
【0007】
AD
アルツハイマー病(AD)は、回復不能の進行性の脳障害で、徐々に発生し、記憶喪失、行動性および人格の変化、ならびに精神的能力の減退に帰着する。これらの喪失は、脳細胞の死およびこれらの間の接続の崩壊に関する。この疾患の経過は個人によって変動し、減退の速度も同様である。AD患者は平均で、診断後8〜10年間生存するが、疾患は20年まで
続くことができる。
【0008】
ADは、初期の、軽度の健忘性から精神的機能の重度の喪失まで、段階的に進行する。この喪失は痴呆として知られる。ADの人のほとんどにおいて、症状は60の年齢後にまず現れるが、より早期の発症は珍しくない。最も早期の症状はしばしば、記銘力の喪失、判断の誤り、および人格の変化を含む。しばしば、ADの初期段階の人々は、考えることがはっきりしなくなり、親しい人々や一般の物体の名前を忘れる。疾患の後期では、単純な作業であってもどのように行うかを忘れる。ついに、ADの人々は、全ての推理能力を喪失し、彼らの日々の世話について他の人々に依存するようになる。結局、疾患は、患者を寝たきりにし、他の疾患および感染が進行しがちになるほど衰弱させる。最も一般的には、ADの人々は肺炎で死亡する。
【0009】
ADが発生する危険性は年齢とともに増加するが、ADおよび痴呆の症状は、通常の老化の部分ではない。ADおよび他の痴呆性の障害は、脳に影響する疾患に原因がある。通常の老化では、脳の神経細胞が大量に喪失することはない。これに対して、ADは3つの鍵となる
過程を破壊する:神経細胞伝達、代謝および修復である。この破壊は、結局、多くの神経細胞が機能を停止し、他の神経細胞との接続を喪失し、死ぬことの原因となる。
【0010】
まず、ADは、記憶を制御する脳の部分、特に海馬および関係する構造にあるニューロンを破壊する。海馬にある神経細胞が正確に機能しなくなると、短期間の記憶が衰弱し、しばしば、簡単で熟知した作業を行う個人の能力が減退し始める。ADは、大脳皮質、特に言語および推理をつかさどる領域をも攻撃する。ついに、脳の多くのほかの領域が含まれ、これらの全ての脳の領域が萎縮(収縮)し、AD患者は、寝たきりで、失禁性で、完全に無力になり、外界に対して応答しなくなる(出典:National Institute on Aging Progress Report on Alzheimer's Disease、1999)。
【0011】
ADの影響
ADは、65歳以上の人々の間で最も一般的な痴呆の原因である。これは、個人、家族、健康管理システムおよび全体としての社会に対するその莫大な影響から、主要な健康問題を提示する。科学者は、400万人以下の人々がこの疾患に苦しみ、65歳を超えると5歳ごとに有病率は倍になると見積もっている。毎年、約36万の新しい症例(発病)が発生するとも見積もられ、この数字は集団の年齢に伴い増加する(Brookmeyerら、1998)。
【0012】
ADは、社会に重大な経済的負荷を課す。最近の米国での研究は、一人のAD患者を介護する年間の費用が軽度のAD患者で18,408ドル、中程度のAD患者で30,096ドル、そして重度のAD患者で36,132ドルであると見積もっている。米国におけるAD患者の介護の年間の国の費
用は、500億ドルをわずかに上回ると見積もられている(Leonら、1998)。
【0013】
およそ400万人の米国人は85歳以上であり、最も産業化された国では、この年齢の群は
、人口のうちで最も速く成長している部分の一つである。米国では、この群は2030年までに850万に近い数になると見積もられている;この数はさらに多くなり得るとさえ示唆す
る、人口の動向を研究する専門家もいる。より多くの人々がより長く生きるようになると、ADを含む老化の疾患に冒される人数は増加し続ける。例えば、85歳以上の全ての人の半分近くが痴呆の何らかの形態を有することを示す研究もある(National Institute on Aging Progress Report on Alzheimer's Disease、1999)。
【0014】
ADの主な特徴
脳における2つの異常な構造がADの顕著な特徴である:アミロイドプラークと神経原線
維もつれ(NFT)である。プラークは、脳のニューロンの外側および周囲のタンパク質なら
びに細胞性物質の、濃密でほとんど不溶性の沈着である。もつれは、ニューロンの内側に形成された不溶性のねじれた線維である。2種類のADが存在する:ある遺伝のパターンに
従う家族性AD (FAD)と、遺伝の明らかなパターンが見られない孤発性ADである。発症の年齢が異なるので、ADはさらに、早期発症(65歳より若い人に発生する)または晩期発症(65歳以上の人に発生する)と表される。早期発症ADは珍しく(症例の約10%)、一般に30〜60歳の人に影響する。早期発症ADのある形態は遺伝性で、家族に遺伝する。早期発症ADは、しばしば、より一般的な晩期発症ADよりも早く進行する。
【0015】
現在までに知られている全てのFADは早期に発症し、FADの症例の50%までもが3つの異
なる染色体上に位置する3つの遺伝子の欠損により引き起こされることが、現在知られて
いる。これらは、第21染色体上のAPP遺伝子の変異;第14染色体上のプレセニリン1と呼ばれる遺伝子の変異;および第1染色体上のプレセニリン2と呼ばれる遺伝子の変異である。しかしながら、これらの変異のいずれかが、より一般的な、孤発性または非家族性の形態の晩期発症ADにおいて主な役割を果たしていることの証明はまだない(National Institute on Aging Progress Report on Alzheimer's Disease、1999)。
【0016】
アミロイドプラーク
ADでは、アミロイドプラークは、まず記憶および他の認識の機能に用いられる領域において発生する。これは、ニューロンの部分と小神経膠細胞および星状神経膠細胞のような非神経細胞とともに混ざり合った、βアミロイド(以下、Aβと表す)−アミロイド前駆
体タンパク質(APP、このアミノ酸配列をSEQ ID NO: 2に示す)と呼ばれるより大きいタ
ンパク質のタンパク質断片−の、ほとんど不溶性の沈着からなる。アミロイドプラーク自体がADの主な原因を構成するのか、またはそれらがADの過程での副産物であるのかは知られていない。確かに、APP遺伝子の変異により引き起こされたADの遺伝性の形態において
示されたように、APPタンパク質における変化はADの原因となり、Aβプラーク形成は、ヒトの疾患の進行に緊密に関連しているようである(Lippa C. F.ら、1998)。
【0017】
APP
APPは、細胞膜に結合している多くのタンパク質の一つである。それが作られた後、APPは、神経細胞の膜に埋め込まれるようになり、部分的に細胞の内部にあり、部分的に外部にある。トランスジェニックマウスを用いた最近の研究は、APPがニューロンの成長およ
び生存において重要な役割を果たしていると考えられることを示す。例えば、APPのある
形態および量は、短期および長期の両方の損傷に対してニューロンを保護し、自己修復できるように、損傷を受けたニューロンを改善し、脳損傷後にニューロンの部分が成長するのを助けるであろう。
【0018】
APPは細胞膜に埋め込まれているが、プロテアーゼがAPPの特定の位置に作用し、タンパ
ク質断片に切断する。あるプロテアーゼはAPPを切断してAβを形成するのを助け、他のプロテアーゼはアミロイド断片の中間でAPPを切断するので、Aβは形成されない。形成されたAβは2つの異なる長さであり、比較的溶解性でゆっくりと凝集する、より短い40(または41)アミノ酸のAβと、迅速に不溶性の凝集塊を形成する、わずかに長い42アミノ酸の
「粘着性の」Aβである。Aβが形成される間、これが神経細胞の中または周辺をどのように動いているのかは、はっきり知られていない。この過程の最後の段階において、「粘着性の」Aβは、細胞外で長いフィラメントに凝集し、すでに死んだかまたは死んでいくニ
ューロンの断片、ならびに小神経膠細胞および星状神経膠細胞とともに、脳組織においてADの特徴であるプラークを形成する。
【0019】
APPにおける変異が、APP前駆体からAβを切り取るようであり、したがって全Aβがより多くなるか、または「粘着性の」形態が比較的多く形成されることを引き起こすとの証拠がいくつか存在する。プレセニリン遺伝子における変異が、少なくとも2つの方法:Aβの産生を変更すること、またはより直接的に細胞死を引き起こすこと、においてニューロンの分解に寄与しているとも考えられる。他の研究者は、変異したプレセニリン1および2は、アポトーシスの速度を促進するのに関与することを示唆する。
【0020】
疾患が進行するにつれて、より多くのプラークが形成され、脳のより多くを占めることが予想される。研究により、Aβは、動的平衡のように、同時に集合し、ばらばらになっ
ているであろうことが示唆される。これは、プラークが形成された後でもそれを分解することが可能であるかもしれないとの希望を高める。(National Institute on Aging Progress Report on Alzheimer's Disease、1999)。
【0021】
Aβは、ニューロンに毒性であると考えられている。組織培養研究において、研究者は
、正常なヒトAPPを過剰発現するニューロンに比較して、変異した形態のヒトAPPを過剰発現するようにした海馬ニューロン細胞の死が増加したことを観察した(Luoら、1999)。
さらに、Aβタンパク質の過剰発現または修飾された形態の発現は、動物モデルにおい
て、アルツハイマー様の症状を誘発することが示されている(Hsiao K.ら、1998)。
【0022】
増加したAβの発生、プラークへのその集合、および結果としての神経毒性がADに導く
とすれば、プラークへのAβの集合が遅くなるか、ブロックされる条件を調査することは
、治療上の興味の対象である。
【0023】
プレセニリン
プレセニリン-1 (S-180)における変異は、早期発症家族性AD (FAD)の全ての症例の約50%に達する。ADを起こす約30の変異が同定されている。ADの発症は、変異によって変動する。プレセニリン-2における変異は、FADの症例のより少ない部分を占めるが、重要な因
子である。プレセニリンが、孤発性の非家族性ADに関与するかは知られていない。プレセニリンの機能は知られていないが、Aβ-42(ペプチド、SEQ ID NO: 2の残基673〜714のより長い、より粘着性の形態)を与えるAPPのプロセシングに関与していると考えられる。
なぜなら、プレセニリン変異があるAD患者はこのペプチドのレベルが増加したからである。プレセニリンがNFTの発生を引き起こす役割をも有するかは、不明である。プレセニリ
ンは、ニューロンの分解およびニューロンの死に、より直接的な役割を有するかもしれないことを示唆する者もいる。プレセニリン-1は第14染色体に位置し、プレセニリン-2は第1染色体に結合している。もし、これらの遺伝子のたった1つの変異バージョンを有していると、その人が早期発症ADを発生することはほぼ確実である。
【0024】
プレセニリン-1が、APPのプロセシングに関与する、仮説のγ-セクレターゼと同一であるかについては、不明な点がある(Naruseら、1998)。
【0025】
アポリポタンパク質E
アポリポタンパク質Eは、通常、コレステロールと結合するが、ADの脳のプラークやも
つれにおいても見出される。対立遺伝子1〜3はADに関与していないようであるが、APOE-
ε4対立遺伝子の存在と晩期ADの発生との間には、重要な相関関係がある(Strittmatterら、1993)。しかしながら、これは危険因子であって、プレセニリンおよびAPP変異の場合のような直接の原因ではなく、これは家族性ADに限定されない。
【0026】
ApoEε4タンパク質がADの発生の可能性を増加させる方法は、明確には知られていない
が、可能性のある理論としては、それがAβの形成を促進してADの発症の年齢を引き下げ
ることに寄与するか、または特定のAPOE対立遺伝子の存在もしくは非存在が、ニューロンが損傷に応答する方法に影響することである(Buttiniら、1999)。
【0027】
Apo A1も、アミロイド産生性である(amyloigenic)ことが示されている。無損傷apo A1
自体は、コンゴーレッド陽性であるアミロイド様フィブリルをインビトロで形成することができる(Am J Pathol 147 (2):238〜244 (Aug 1995)、Wisniewski T、Golabek AA、Kida E、Wisniewski KE、Frangione B)。
他の対立遺伝子に比べて、知力喪失の症状の減少におけるAPOE-ε4対立遺伝子の肯定的な効果があることを示唆する、矛盾した結果がいくつかあるようである(Stern, Brandt、1997、Annals of Neurology 41)。
【0028】
神経原線維もつれ
ADの2つ目の顕著な特徴は、神経細胞の内部で見出されるねじれた糸の異常な集積から
なる。もつれの主要な成分は、タウ(τ)と呼ばれるタンパク質の一つの形態である。中枢神経系においては、タウタンパク質は、細胞の内部支持構造の構成成分の一つである微小管または骨格に結合し、安定化するのを助ける能力について最もよく知られている。しかしながら、ADにおいては、タウは化学的変化を受け、この変化したタウはもはや微小管を安定化することができず、微小管を崩壊させる原因となる。この輸送系の崩壊は、まず神経細胞間の伝達の機能不全となり、後にニューロンの死を導くであろう。
【0029】
ADにおいては、化学的変化を受けたタウは、2本の糸のタウが互いの周りに巻きついた
、二重らせんフィラメントによじれる。これらのフィラメントは神経原線維もつれにおいて見出される主要な物質である。最近のある研究では、研究者は、健康な脳の海馬の特定の部分のニューロンの6%未満、軽度のADで死亡した人のこれらのニューロンの43%より
多く、および重度のADで死亡した人のこれらのニューロンの71%において、神経原線維変化を見出した。ニューロンの喪失が研究されたとき、同様の進行が見られた。このタイプの証拠は、もつれの形成およびニューロンの喪失は、ADの過程においてともに進行するとの考えを支持する(National Institute on Aging Progress Report on Alzheimer's Disease、1999)。
【0030】
タウオパシー(tauopathies)およびもつれ
AD以外のいくつかの神経変性疾患は、ニューロンおよび神経膠においてタウが凝集して不溶性のフィラメントになり、機能不全ならびに死に導くことが特徴である。非常に最近、AD以外の遺伝性痴呆の多様性がある家族を研究していた研究者のいくつかのグループが、第17染色体上のタウ遺伝子における最初の変異を発見した(Clarkら、1998;Huttonら、1998;Poorkajら、1998;Spillantiniら、1998)。これらの家族では、タウ遺伝子におけ
る変異が、ニューロン細胞死および痴呆を引き起こす。ADとある特徴を共有しているがいくつかの重要な点において異なるこれらの障害は、まとめて「第17染色体に関連する前頭側頭型痴呆およびパーキンソニズム(fronto temporal dementia and parkinsonism linked to chromosome 17)」(FTDP-17)と呼ばれる。これらは、パーキンソン病、筋萎縮性側索硬化症(ALS)のある形態、大脳皮質基底核変性症、進行性核上性麻痺およびピック病など
の疾患であり、全てがタウタンパク質の異常な凝集を特徴とする。
【0031】
他のAD様神経病
ADと、プリオン病(クールー、クロイツフェルト−ヤコブ病およびウシの海綿状脳炎など)、パーキンソン病、ハンチントン病ならびに前頭側頭型痴呆を含む他の神経病との間には、重要な類似がある。全てが脳における異常タンパク質の沈着を含む。ADおよびプリオン病は、痴呆と死を引き起こし、両者は不溶性のアミロイドフィブリルの形成に関連するが、膜タンパク質からは互いに異なる。
【0032】
ADに次ぐ第二の最も一般的な神経変性障害であるパーキンソン病を研究する科学者らは、疾患に関係する最初の遺伝子を発見した。この遺伝子は、AD患者の脳のアミロイドプラークにおいても興味深く見出される、シヌクレインと呼ばれるタンパク質をコードする(Lavedan C、1998、Genome Res. 8(9): 871 80)。研究者らは、痴呆の原因となる別の進行
性神経変性障害であるハンチントン病における遺伝子欠損が、ハンチントンタンパク質がADのAβフィブリルおよびプリオン病のタンパク質フィブリルに非常によく似た不溶性の
フィブリルを形成することの原因となることをも見出した(Scherzinger Eら、1999、PNAS
U.S.A. 96(8):4604〜9)。
【0033】
科学者らは、変異した場合に、ADにおいてみられるのに類似した深刻な行動障害および進行性痴呆を引き起こす珍しい遺伝性の疾患である、家族性ブリティッシュ痴呆(familial British dementia (FBD))の原因となる、新規な遺伝子をも発見している。FBDプラークにおいて見出されるアミロイドフィブリルの生化学的分析では、ABriと名付けられた特有のペプチドが見出された(Vidalら、1999)。この遺伝子における特定の点での変異は、通
常より長いBriタンパク質の産生に帰着する。Briタンパク質の変異末端から切り取ったABiペプチドは、アミロイドフィブリルとして沈着する。これらのプラークは、FBDを特徴付けるニューロンの機能不全および痴呆に導くと考えられている。
【0034】
Aβでの免疫化
免疫系は、生物中の外来タンパク質およびタンパク様の粒子の除去に、通常、貢献するが、上記の疾患に関連する沈着は主に自己タンパク質からなり、したがってこれらの疾患の制御において免疫系に役割を与えることは、あまり明白ではない。さらに、沈着は、通常、免疫系から分離された区画(CNS)に位置し、これら両方の事実はワクチンまたは免疫
療法的アプローチは成功しないであろうことを示唆する。
【0035】
にもかかわらず、科学者らは最近、異種のヒトAβと免疫系を刺激することが知られて
いる物質とからなるワクチンでマウスを免疫化することを試みている(Schenkら、1999お
よびWO 99/27944)。このワクチンは、マウスのDNAにヒトAPPの変異遺伝子を挿入した、ADの部分トランスジェニックマウスモデルにおいて試験された。マウスは修飾されたAPPタ
ンパク質を産生し、成長するにつれてアミロイドプラークを発生した。このマウスモデルは修飾されたトランスジェニックヒトAPPに対するワクチンがプラーク形成に影響を有す
るかを試験するのに用いられた。最初の実験では、トランスジェニックマウスの1つの群
は、6週齢から始まり11ヶ月で終わる毎月のワクチン注射を受けた。トランスジェニック
マウスの第2の群は、注射を受けずコントロール群となった。13ヶ月齢までに、コントロ
ール群のマウスはその脳の2〜6%を覆うプラークを有した。これに比べて、免疫されたマウスは実質的にプラークがなかった。
【0036】
第2の実験では、研究者らは、いくらかのプラークがすでに発生している11ヶ月で注射
を始めた。7ヶ月の期間の間に、コントロールのトランスジェニックマウスはその脳の中
でプラークの量が17倍に増加したが、ワクチンを受けたものは、18ヶ月齢のコントロールトランスジェニックマウスに比べて99%の減少であった。あるマウスでは、予め存在して
いたプラーク沈着のいくらかが、処置により除去されたようであった。また、免疫化の結果として、炎症や異常な神経細胞のプロセスのようなプラークに関連する他の損傷が減少したことも見出された。
【0037】
上記のことは、したがってマウスにおける予備的研究であり、研究者らは、例えばワクチン化されたマウスがほかの点においても健康を維持するのか、これらのワクチン化されたものの記憶は正常に保たれるのかを見出す必要がある。さらに、マウスモデルはADの完全な代表ではない(動物は神経原線維もつれを発生せず、そのニューロンが大量に死ぬことがない)ので、ヒトがマウスと類似または異なる反応を示すかを決定するのに、付加的な研究が必要である。考慮が必要な他の問題としては、この方法がアミロイド沈着を「治療」するであろうが、痴呆の発達を止めることができないことである。
【0038】
技術的な論点は、主要な難題をも表す。例えば、この技術を用いてヒトがその自己のタンパク質に対する抗体を産生することを可能にするワクチンを作成することは、可能ではないようである。ヒトにおけるいずれの試験をも考慮することができる前に、安全性および効率について非常に多くの問題を解決しなければならない。
【0039】
Schenkらによる研究は、よって、ADにおいて形成されたプラークのような中枢神経系でのタンパク様の沈着中の自己タンパク質に対する強い免疫応答を発生させることが可能であれば、沈着の形成を防止し、すでに形成されたプラークをおそらく除去することの両方が可能であることを示す。
【0040】
最近、上記で論じたAβワクチンを用いた臨床試験が、副作用により停止された:ワク
チン化された多くの患者が、CNSにおいて、Aβに対する制御されない自己免疫によると考えられる慢性脳炎を発生した。
【発明の概要】
【発明が解決しようとする課題】
【0041】
発明の目的
本発明の目的は、ADのようなアミロイドの沈着を特徴とする症状に対する新規の治療を提供することである。更なる目的は、ADおよびアミロイド沈着を含む他の病理学的障害への新規の治療を得るために、アミロイドに対する自家ワクチンを開発することである。
【課題を解決するための手段】
【0042】
発明の要旨
非免疫原性APPおよびAβに対する強い免疫応答を発生させるための自家ワクチン療法技術の使用が、本明細書に記載される。また、アミロイド沈着に関連するこのような疾患の症状の予防、可能な治療または緩和のためのこのようなワクチンの製造も記載される。
【0043】
したがって、本発明の最も広く最も全般的な観点において、本発明は、アナログが
a) SEQ ID NO: 2の残基672〜714のサブシークエンスの少なくとも1つのコピーからなるポリアミノ酸であり、外来Tヘルパーエピトープ(THエピトープ)が、アミノ酸の付加およ
び/または挿入および/または欠失および/または置換により組み込まれ、該サブシークエンスが、SEQ ID NO: 2のアミノ酸残基673〜714からなるアミノ酸配列の残基1〜42、残
基1〜40、残基1〜39、残基1〜35、残基1〜34、残基1〜28、残基1〜12、残基1〜5、残基13〜28、残基13〜35、残基17〜28、残基25〜35、残基35〜40、残基36〜42および残基35〜42からなる群より選択されるか;および/または
b) 外来THエピトープおよび破壊されたアミロイド前駆体タンパク質(APP)またはβアミロイド(Aβ)配列を含むポリアミノ酸であることにより、該アナログが、T細胞応答を開始するMHCクラスII分子に生産的に結合する、SEQ ID NO: 2のいずれの配列をも含まないか
;および/または
c) 外来THエピトープおよびAPPまたはAβ由来アミノ酸を含み、該アナログのC末端に位置する1つの単独メチオニン残基を含むポリアミノ酸であり、APPまたはAβおよび外来TH
エピトープの中の他のメチオニン残基が置換されているかもしくは欠失されており、好ましくはロイシンもしくはイソロイシンにより置換されているか;および/または
d) a)で定義したポリアミノ酸および/またはb)で定義したポリアミノ酸および/またはc)で定義したポリアミノ酸が別個に結合しているポリヒドロキシポリマー骨格を含むコンジュゲートであるか;および/または
e) 1)外来THエピトープならびに2) a)で定義したサブシークエンス、b)で定義した破壊
されたAPPもしくはAβ配列、およびC末端に位置する単一のメチオニン残基を含み、APPまたはAβおよび外来THエピトープの中の他のメチオニン残基が置換されているかもしくは
欠失されており、好ましくはロイシンもしくはイソロイシンにより置換されているAPPま
たはAβ由来アミノ酸配列からなる群より選択されるポリアミノ酸が別個に結合している
ポリヒドロキシポリマー骨格を含むコンジュゲートである、
アナログによる動物の免疫化が、動物の自己のAPPまたはAβに対する抗体産生を誘導するように、APPおよび/またはAβの少なくとも1つのB細胞エピトープと少なくとも1つの外
来THエピトープとを同じ分子に組み込む、APPまたはAβの少なくとも1つのアナログの免
疫原的有効量を動物の免疫系に提示することを含む、ヒトを含む動物におけるAPPまたはAβのインビボダウンレギュレーション方法に関する。
【0044】
本譲渡人は、以前、APPおよびAβのようなアミロイド産生ポリペプチド(amyloidogenic
polypeptide)に対する安全なワクチン化方法に関する国際特許出願をファイルしており
、WO 01/62284参照。この出願は、本出願の出願日に公開されておらず、さらに、上記のAPPおよびAβの有用なアナログに関する詳細を含まない。
【0045】
本発明は、APPおよびAβのアナログとともに、これらの部分集合をエンコードする核酸断片にも関する。アナログまたは核酸断片を含む免疫原性組成物も、本発明の部分である。
【図面の簡単な説明】
【0046】
【図1】Aβタンパク質Aβ-43 (またはC-100)に対する抗体応答を発生させることを目的とした、アミロイド前駆体タンパク質に由来する自家ワクチン(Autovac)変異体の概略図。APPを図の一番上に図示し、残りの概略の構築物は、モデルエピトープP2およびP30が置換されるか、または種々のトランケーション(truncation)中に挿入されることを示す。図において、黒の縞模様はAPPシグナル配列を示し、二方向の斜交線模様はAPPの細胞外部分を示し、濃い鉛直の平行線はAPPの膜貫通ドメインを示し、明るい鉛直の平行線はAPPの細胞内ドメインを示し、粗い斜交線模様はP30エピトープを示し、細かい斜交線模様はP2エピトープを表す。実線の箱はAβ-42/43を示し、実線の箱および点線の箱は一緒にC-100を示す。「Abeta」はAβを意味する。
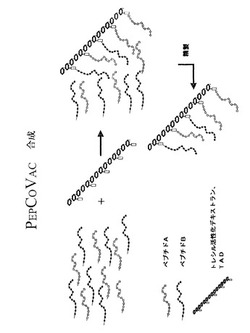
【図2】一般的に適用可能な免疫原性コンジュゲートの合成の実施形態の概略図。ペプチドA(あらゆる抗原性の配列、例えば本明細書に記載のAβ配列)およびペプチドB(外来Tヘルパーエピトープを含むアミノ酸配列)を合成して混合する。その後、これらを適切な活性ポリヒドロキシポリマーと接触させて、ペプチドAおよびBを、ペプチド混合物中のこれら2つの物質の間の最初の比に相当する定量で、活性化基を介して結合する。詳細は実施例4を参照。
【発明を実施するための形態】
【0047】
詳細な発明の開示
定義
以下において、本明細書および請求項において用いるいくつかの語について、本発明の境界を明確にするために、定義して詳細に説明する。
【0048】
本明細書において交換可能に用いられる「アミロイド」および「アミロイドタンパク質
」の語は、長さが不確定の、分岐していないタンパク様フィブリルのクラスを意味する。アミロイドフィブリルは、コンゴーレッドで特徴的な染色を示し、ポリペプチド鎖がβシートに組織されているクロスβ構造を共有する。アミロイドは、非常に異なる前駆体構造を有するが、全てが、βシートヘリックスプロトフィラメントの基礎単位である、間違って折りたたまれた形態に構造変化を受けることができる、アミロイド産生タンパク質に通常由来する。通常、アミロイドフィブリルの径は、約70〜約120Åの間で変動する。
【0049】
「アミロイド産生タンパク質」の語は、そのまま沈着の部分となること、または沈着の形成を導く生合成経路の部分となることのいずれかにより、アミロイド沈着の形成に関与するポリペプチドを意味することを意図する。よって、アミロイド産生タンパク質の例はAPPおよびAβであるが、これらの代謝に含まれるタンパク質もアミロイド産生タンパク質である。
【0050】
本明細書において「アミロイドポリペプチド」は、ヒトまたはその他の哺乳動物に由来する、上記のアミロイド産生タンパク質(または無傷のアミロイド産生タンパク質と実質的な量のB細胞エピトープを共有する、これらのトランケート(truncate))のアミノ酸配
列を含むポリペプチドを意味することを意図する−よって、アミロイド産生ポリペプチドは、例えばアミロイド産生ポリペプチドの前駆体の実質的な部分を含むことができる(A
βの場合、一つの可能なアミロイドポリペプチドはAPP由来である)。例えば酵母または
他の非哺乳類の真核発現系の使用により、種々のグリコシル化パターンを有する形態とともに、原核生物系において製造されたアミロイド産生ポリペプチドの非グリコシル化形態もこの語の境界内である。しかしながら、「アミロイド産生ポリペプチド」の語を用いる場合、問題のポリペプチドは、治療される動物に提示されるときに、通常、非免疫原性であることを意図することが記載される。言い換えると、アミロイド産生ポリペプチドは、自己タンパク質であるか、または問題の動物のアミロイド産生性に対して免疫応答を通常起こさないこのような自己タンパク質のアナログである。
【0051】
「アナログ」は、その分子構造の中に1つまたはいくつかの変化を組み込んだAPPまたはAβ由来の分子である。このような変化は、例えばAPPまたはAβポリアミノ酸の適切な融
合パートナーとの融合の形態(すなわちCおよび/またはN末端へのアミノ酸残基の付加を
排他的に含む一次構造の変化)にあるか、および/またはポリペプチドのアミノ酸配列に
おける挿入および/または欠失および/または置換であることが可能である。この語により、派生APPまたはAβ由来分子も含まれ、APPまたはAβの修飾についての以下の議論を参照。アナログは、アミロイドの通常の前駆体タンパク質に対する抗体を誘導することがほとんど、またはまったくできないように構築されたものである場合があり、それによりアミロイドタンパク質の前駆体であるポリペプチドの(生理学的に正常な)非凝集形態との望まれない干渉を回避する。
【0052】
ヒトAPPまたはAβの外来アナログ(例えばイヌまたはブタアナログ)の、ヒトにおけるワクチンとしての使用が、APPまたはAβに対して所望の免疫性を産生することが推測できることが記載される。免疫化のためのこのような外来アナログの使用も、本発明の部分であると考えられる。
【0053】
「ポリペプチド」の語は、本明細書で、2〜10アミノ酸残基の短いペプチド、11〜100アミノ酸残基のオリゴペプチド、100を超えるアミノ酸残基のポリペプチドを共に意味する
ことを意図する。さらに、この語はタンパク質、すなわち少なくとも1つのポリペプチド
を含む機能性生体分子を含むことをも意図する;少なくとも2つのポリペプチドを含む場
合、これらは複合体を形成するか、共有結合するか、または非共有結合することができる。タンパク質中のポリペプチドは、グリコシル化されるか、および/または脂質化されるか(lipidated)、および/または補欠分子団を含むことができる。「ポリアミノ酸」の語
は、「ポリペプチド」の語と同等である。
【0054】
「Tリンパ球」および「T細胞」の語を、各種の細胞媒介免疫応答とともにヒトの免疫応答においてヘルパー活性の原因である、胸腺起源のリンパ球に対して同義的に用いるつもりである。同様に、「Bリンパ球」および「B細胞」の語を、抗体産生リンパ球に対して同義的に用いるつもりである。
【0055】
「サブシークエンス」の語は、天然に存在するアミロイドのアミノ酸配列または核酸配列からそれぞれ直接由来した、少なくとも3つのアミノ酸、または適切な場合には、少な
くとも3つのヌクレオチドのあらゆる連続的な範囲を意味する。
【0056】
「動物」の語は、本明細書において一般に、ホモ・サピエンス(Homo sapiens)、カニス・ドメスティカス(Canis domesticus)などのような動物種(好ましくは哺乳動物) で、単
一の動物だけではないことを意味することを意図する。しかしながら、本発明の方法により免疫化された個体が全て、同じ免疫原で動物を免疫化することを許容する、実質的に同じAPPまたはAβを有することが重要であるので、この語はこのような動物種の個体群をも意味する。本明細書における動物が免疫系を有する生物であることは、当業者には明白であろう。該動物は、哺乳動物のような脊椎動物が好ましい。
【0057】
本明細書中の「APPまたはAβのインビボダウンレギュレーション」の語により、関連するタイプの沈着したアミロイドタンパク質(またはアミロイドそのもの)の生物における全量の減少を意味する。ダウンレギュレーションは、いくつかの機構により得ることができる:それらのうち、間違った凝集を防ぐための、抗体結合によるアミロイドでの単純な干渉が最も単純である。しかしながら、清掃細胞(マクロファージや他の食細胞など)によるアミロイドの除去となる抗体の結合、およびアミロイド形成に導く他のアミロイド産生ポリペプチドに干渉する抗体も、本発明の範囲内である。更なる可能性としては、抗体がCNSの外部でAβに結合し、それにより、単純な質量作用原理により効果的にAβをCNSから除去することである。
【0058】
「免疫系に・・・提示する」の表現は、動物の免疫系が、制御された方法で免疫原性攻撃に供されることを意味することを意図する。以下の開示から明らかなように、このような免疫系の攻撃は、多くの方法によりもたらすことができ、それらのうちで最も重要なものは、「ファーマクシン(pharmaccine)」(すなわち進行中の疾患を治療または改善する
のに投与されるワクチン)を含むポリペプチドによるワクチン化、または核酸「ファーマクシン」ワクチン化である。達成する重要な結果は、動物における免疫適格細胞が免疫原的に効果的な方法で、抗原と対峙することであって、この結果を達成する精密なモードは、本発明の根底にある発明の概念にはほとんど重要ではない。
【0059】
「免疫原的有効量」の語は、当該技術における通常の意味を有し、すなわち免疫原と免疫学的な特徴を共有する病原性の剤に著しく関与する免疫応答を誘導し得る免疫原の量である。
【0060】
本明細書において、APPまたはAβが「修飾された」との表現を用いる場合、APPまたはAβについてポリペプチドの化学的修飾が行われたことを意味する。このような修飾は、例えば配列中のあるアミノ酸残基の派生(例えばアルキル化)を含み得るが、以下の開示から認識されるように、好ましい修飾はアミノ酸配列の一次構造の変化を含む。
【0061】
「APPまたはAβに対する自己寛容」を論じる場合、ポリペプチドはワクチン化される個体群で自己タンパク質であるので、個体群における正常な個体はポリペプチドに対して免疫応答しないことが理解される;しかし、動物個体群で、まばらに存在する個体が、例え
ば自己免疫異常の部分として、天然のポリペプチドに対して抗体を産生できるかもしれないことは除外することはできない。いずれの割合においても、動物は、通常、そのAPPま
たはAβに対してのみ自己寛容であるだろうが、他の動物種または異なる表現型を有する
個体群に由来するアナログも該動物により寛容化されることを除外することはできない。
【0062】
「外来T細胞エピトープ」(または「外来Tリンパ球エピトープ」)は、MHC分子に結合
でき、動物種においてT細胞を刺激するペプチドである。本発明において好ましい外来T細胞エピトープは、「乱交雑(promiscuous)」エピトープ、すなわち、動物種または個体群
において、特定のクラスのMHC分子の実質的なフラクションと結合するエピトープである
。ごく限られた数のこのような乱交雑T細胞エピトープのみが知られており、それらを以
下に詳述する。乱交雑T細胞エピトープは、「ユニバーサル」T細胞エピトープとも表される。本発明に従って使用される免疫原を、できるだけ大きな動物個体群のフラクションで有効にするため、1) 同じアナログにいくつかの外来T細胞エピトープを挿入するか、または2) 各アナログが挿入された異なる乱交雑エピトープを有する、いくつかのアナログを
作ることが必要であろうことが記載される。また、外来T細胞エピトープの観念は、潜在
性T細胞エピトープ、すなわち自己タンパク質に由来し、かつ該自己タンパク質の部分で
はない単離の形態で存在する場合に、免疫原性の挙動を奏するのみであるエピトープの使用を包含することが記載される。
【0063】
「外来Tヘルパーリンパ球エピトープ」(外来THエピトープ)は、MHCクラスII分子を結合し、MHCクラスII分子に結合した抗原提示細胞(APC)の表面に存在することができる外来T細胞エピトープである。
【0064】
(生体)分子の“機能性部分”は、本明細書において、分子によって奏される少なくとも1つの生化学的または生理学的な効果の原因となる分子の部分を意味することを意図す
る。多くの酵素および他のエフェクター分子が、該分子によって奏される効果の原因となる活性部位を有することは、当該技術で周知である。分子の他の部分は、安定化または溶解性を増強する目的に役立つであろう、従って、この目的が、本発明のある実施形態に関して適切でないならば除外することができる。例えば、APPまたはAβにおける修飾成分として、あるサイトカインを用いることが可能であり(以下の詳細な議論を参照)、そのような場合、APPまたはAβへの結合は必要な安定性を提供すると考えられるので、安定性の問題は関係がない。
【0065】
「アジュバント」の語は、ワクチン技術の分野での一般的な意味を有し、すなわち、1)ワクチンの免疫原に対する特異的な免疫応答をそれ自体で有することができないが、2)
にもかかわらず、免疫原に対する免疫応答を増強できる物質または物質の組成物である。または、言い換えると、アジュバントのみでのワクチン化は、免疫原に対する免疫応答を提供せず、免疫原でのワクチン化は免疫原に対する免疫応答を発生させるか、または発生させないが、免疫原とアジュバントとを組合わせたワクチン化は、免疫原単独で誘導されるより強い、免疫原に対する免疫応答を誘導する。
【0066】
分子の「標的化」は、本明細書において、動物に導入される分子が、特定の組織で優先的に現れるか、または特定の細胞もしくは細胞のタイプと優先的に会合する状況を示すことを意図する。その効果は、標的化を促進する組成物中への分子の処方、または標的化を促進する分子の群に導入することを含む多くの方法で達成することができる。これらの問題を以下に詳細に述べる。
【0067】
「免疫系の刺激」は、ある物質または物質の組成物が、一般の非特異的な免疫刺激効果を発揮することを意味する。いくつかのアジュバントと推定上のアジュバント(例えばあるサイトカイン)は、免疫系を刺激する能力を共有する。免疫刺激剤を用いる成果は、免
疫原での同時または続いて起こる免疫化が、免疫原の分離された使用と比較して有意でより効果的な免疫応答を誘導することを意味する免疫系の増加された「機敏さ(alertness
)」である。
【0068】
「生産的な結合」は、MHC分子に結合したペプチドを提示する細胞にたずさわるT細胞を刺激することができるように、ペプチドがMHC分子(クラスIまたはII)へ結合することを意味する。例えば、APC表面においてMHCクラスII分子に結合したペプチドは、このAPCが、
提示されたペプチド−MHCクラスII複合体に結合するTH細胞を刺激する場合に、生産的に
結合するという。
【0069】
アミロイドダウンレギュレーションの好ましい実施形態
本発明の方法において免疫原として用いられるアナログは、APPまたはAβのアミノ酸配列中に少なくとも1つの変化が存在する、修飾されたAPPまたはAβ分子が好ましい。なぜ
なら、自己寛容の全て重要な破壊は、この方法で大きく促進されるからである−これは、例えば、野生型Aβによる免疫化をAβ変異型分子による免疫化と比較した本明細書の実施例2に示す結果から明らかである。自己タンパク質を認識する潜在的な自己反応性Bリンパ球が正常な個体に生理学的に存在することは、示されている(Dalum Iら、1996、J. Immunol. 157:4796〜4804)。しかしながら、これらのBリンパ球が適切な自己タンパク質に反
応し得る抗体を実際に産生するように誘導されるためには、サイトカイン産生Tヘルパー
リンパ球(TH細胞またはTHリンパ球)の補助が必要である。抗原提示細胞(APC)により提示
された場合に、Tリンパ球は、自己タンパク質に由来するT細胞エピトープを一般的に認識しないので、この補助は、通常、提供されない。しかしながら、自己タンパク質中に「外来性」の要素を与えることによって(すなわち免疫学的に重要な修飾を導入することによ
り)、外来要素を認識するT細胞が、APC上の外来エピトープ(最初は単核細胞のようなもの)を認識することより活性化される。
【0070】
修飾された自己タンパク質上の自己エピトープを認識し得るポリクローナルBリンパ球
(APCでもある)も、抗原を取り込み、その後、その外来T細胞エピトープを提示し、活性化されたTリンパ球は、その後、これらの自己反応性ポリクローナルBリンパ球にサイトカインの補助を提供する。これらのポリクローナルBリンパ球により産生される抗体は、天
然のポリペプチド上に存在するものをも含む、修飾されたポリペプチド上の異なるエピトープと反応し得るので、非修飾自己タンパク質と交差反応性である抗体が誘導される。
【0071】
結論として、Tリンパ球は、実際は挿入されたエピトープのみが宿主にとって外来であ
るのに、ポリクローナルBリンパ球の個体群が外来抗原の全てを認識するかのようにふる
まうように誘導されることができる。このようにして、非修飾自己抗原と交差反応することができる抗体が誘導される。
【0072】
自己寛容の破壊を得るためにペプチド自己抗原を修飾するいくつかの方法が、当該技術において公知である。にもかかわらず、本発明のアナログは、
−抗原提示細胞(APC)への修飾された分子の標的化をもたらす、少なくとも1つの第一成分を導入するか、および/または
−免疫系を刺激する、少なくとも1つの第二成分を導入するか、および/または
−免疫系へのアナログの提示を最適化する、少なくとも1つの第三成分を導入する
を含むことが好ましい。
【0073】
しかしながら、これらの全ての修飾は、APPまたはAβ中の本来のBリンパ球エピトープ
の実質的なフラクションを維持している間に行われるべきである。なぜなら、天然分子のBリンパ球による認識は、それにより促進されるからである。
【0074】
ある好ましい実施形態においては、側鎖(外来T細胞エピトープまたは上記の第一、第
二および第三成分の形態における)が、共有結合的に、または非共有結合的に導入される。これは、一次元アミノ酸配列を変化させることなく、または鎖中の個別のアミノ酸の間のペプチド結合に少なくとも変化を導入することなく、APPまたはAβに由来するアミノ酸残基の範囲を派生することを意味する。
【0075】
これに代わる、好ましい実施形態は、アミノ酸の置換および/または欠失および/または挿入および/または付加(組換え手段により、またはペプチド合成によりもたらされるであろう;アミノ酸のより長い範囲を含む修飾は、融合ポリペプチドを発生させることができる)を利用する。この実施形態の、ある特に好ましいバージョンは、いくつかのアミノ酸配列を、それぞれ外来免疫優性T細胞エピトープを含むいくつかの対応するアミノ酸
配列で置換し、同時に、アナログ中の自己タンパク質の全体の三次構造を維持する、自己タンパク質のアナログで免疫化することによる自己タンパク質のダウンレギュレーション方法を開示する、WO 95/05849に記載の技術である。しかしながら、本発明の目的に対し
ては、修飾(挿入、付加、欠失または置換)が外来T細胞エピトープを発生させ、同時に
、APPまたはAβ中のB細胞エピトープの実質的な数を維持することで充分である。しかし
ながら、誘導された免疫応答の最大の効率を得るためには、APPまたはAβの全体の三次構造が、修飾された分子中で保存されることが好ましい。
【0076】
APPもしくはAβまたはこれらの断片が変異されていることが好ましい場合がある。Aβ
−43の位置35のメチオニンが、好ましくはロイシンもしくはイソロイシンで置換された置換変異体か、または単純に欠失されていることが特に好ましい。特に好ましいアナログは、C末端に位置する単一のメチオニンを含み、これは、それがアミロイド産生ポリペプチ
ドまたは外来THエピトープ中に天然に発生するからか、またはそれが挿入または付加されたからのいずれかである。よって、外来THエピトープを含むアナログの部分が、C末端に
位置する可能性があるメチオニンを除いては、メチオニンを有さないことも好ましい。
【0077】
1つのメチオニンを除いて全てを除去する主要な理由は、その後、臭化シアンにより開
裂することができ、単独のアナログを放出する、多量体のアナログを組換え的に調製することが可能になることである。この方法により、組換えの産生が促進されることが利点である。
【0078】
実際、本発明において用いられるAPPまたはAβのアナログの全てが、アナログ中のC末
端アミノ酸としての位置にあり、アミロイド産生ポリペプチドもしくは外来THエピトープのいずれかの中にある他のメチオニンは欠失されているか、または他のアミノ酸に置換されている、単一のメチオニンを単に含むという特徴を共有する。
【0079】
さらに興味深いある変異は、Aβ-43中の位置19にあるフェニルアラニンの欠失または置換であり、この変異は、このフェニルアラニン残基のプロリンへの置換であることが特に好ましい。
【0080】
アナログ中で用いられる別の興味深いポリアミノ酸は、Aβ-43タンパク質のトランケーテッド(truncated)部分である。これらは、本発明による免疫原性アナログ中に用いるこ
ともできる。特に好ましいものは、トランケートAβ(1〜42)、Aβ(1〜40)、Aβ(1〜39)、Aβ(1〜35)、Aβ(1〜34)、Aβ(1〜34)、Aβ(1〜28)、Aβ(1〜12)、Aβ(1〜5)、Aβ(13〜28)、Aβ(13〜35)、Aβ(17〜28)、Aβ(25〜35)、Aβ(35〜40)、(36〜42)、およびAβ(35〜42) (カッコ内の数字は、適切な断片を構成するAβ-43のアミノ酸範囲を表す−Aβ(35〜40)は、例えばSEQ ID NO: 2のアミノ酸706〜711に一致する)である。Aβ-43のトランケー
テッド部分をもつこれらの全ての変異は、本明細書に記載のAβ断片、特に実施例1に示す変異9、10、11、12および13を用いて作製することができる。
【0081】
次に示す式は、本発明により一般的に保護される分子的構築物を示す:
(MOD1)s1(アミロイドe1)n1(MOD2)s2(アミロイドe2)n2・・・・(MODx)sx(アミロイドex)nx
(I)
(ここで、アミロイドe1〜アミロイドexは、APPまたはAβのサブシークエンスを含むx個
のB細胞エピトープであり、これらは独立して同一または異なっており、外来の側鎖を有
していても有していなくてもよい;xは≧3の整数であり、n1〜nxはx個の≧0である整数(
少なくとも1つが≧1である)であり、MOD1〜MODxは、保存されたB細胞エピトープの間に導入されたx個の修飾であり、s1〜sxはx個の≧0である整数(アミロイドexサブシークエンスに側鎖が導入されない場合は、少なくとも1つが≧1である) )。
よって、構築物の免疫原性に一般的な機能的抑制があるならば、本発明は、APPまたはAβの本来の配列の順列の全ての種類、およびその中の修飾の全ての種類を許容する。よって、例えばインビボにおいて副作用を示す配列の部分の脱落、または通常細胞内であるので、望まれない免疫学的反応を生じることができる部分の脱落により得られる、修飾されたAPPまたはAβは本発明に含まれる。
【0082】
上で概説した構築物のある好ましいバージョンは、適用可能である場合、アミロイドタンパク質のサブシークエンスを含むB細胞エピトープが、アミロイドが由来する前駆体ポ
リペプチドにおいて、細胞外に露出しないものである。このようなエピトープの選択をすることにより、前駆体を産生する細胞に反応し得る抗体が発生しないことが確実になり、これにより、発生した免疫応答が、望まれないアミロイド沈着に対する免疫応答に限定されるようになる。この場合、それらが産生された細胞に対するいかなる結合をも有さない場合にのみ細胞外の相に露出しているAPPまたはAβのエピトープに対する免疫を誘導することが可能であろう。
【0083】
B細胞エピトープの実質的なフラクション、または本明細書に記載のような修飾に供さ
れるタンパク質の全体の三次構造の保存は、多くの方法により達成することができる。一つ目は、問題のポリペプチドに対するポリクローナル抗血清(例えばウサギにおいて作製された抗血清)を単純に作製し、その後、この抗血清を、産生される修飾されたタンパク質に対する試験試薬として(例えば競合的ELISAにおいて)用いることである。このような
抗血清との限定された(しかしまだ意味のある、特異的な)反応性を示すアナログが本来のB細胞エピトープの実質的なフラクションを保持しているとみなされるが、APPまたはA
βが反応するのと同程度に抗血清と反応する、修飾されたバージョン(アナログ)は、APP
またはAβと同じ全体の三次構造を有するとみなされなければならない。
【0084】
代わりに、APPまたはAβ上の別個のエピトープと反応し得るモノクローナル抗体の選択を作製し、試験パネルとして用いることができる。このアプローチは、1) APPまたはAβ
のエピトープマッピング、および2) 作製されたアナログにおいて保持されるエピトープ
のマッピングを許容する利点を有する。
【0085】
もちろん、第三のアプローチは、APPもしくはAβ、またはこれらの生物学的に活性なトランケート(上記参照)の三次構造を決定し、これを、作製されたアナログの、決定された三次構造と比較することであろう。三次構造は、X線回折の検討およびNMR分光法により決定することができる。三次構造に関する更なる情報は、与えられた分子の三次構造についての有用な情報を得るために、純粋な形態のポリペプチドが要求されるだけであることに利点を有する(X線回折はポリペプチドの結晶を用いることが要求され、NMRはポリペプチドの同位体変形が要求される)円偏光二色性分光分析の検討によりある程度は得ることができる。しかしながら、円偏光二色性分析は二次構造の要素の情報を通じて、正しい三次構造の間接的な証拠を提供することができるのみであるので、決定的なデータを得るには、結局、X線回折および/またはNMRが必要である。
【0086】
本発明のある好ましい実施形態は、APPまたはAβのBリンパ球エピトープの多数の提示
(すなわち、少なくとも1つのB細胞エピトープが2つの位置に存在する式I)を用いる。この効果は、種々の方法、例えば(ポリペプチド由来のAPPまたはAβ)m (ここで、mは≧2の
整数である)の構造を含む融合ポリペプチドを単に作製し、次いでAPPまたはAβ配列の少
なくとも1つに、本明細書に記載の修飾を導入することにより達成することができる。導
入された修飾がBリンパ球エピトープの少なくとも1つの重複および/またはハプテンの導入を含むことが好ましい。選択されたエピトープの多数の提示を含むこれらの実施形態は、APPまたはAβの単なる重要でない部分がワクチン剤における構成成分として有用である場合に、特に好ましい。
【0087】
上述したように、外来T細胞エピトープの導入は、少なくとも一つのアミノ酸の挿入、
付加、欠失または置換の導入により達成することができる。もちろん、通常の状況は、アミノ酸配列における1つ以上の変化の導入(例えば完全なT細胞エピトープの挿入またはそれによる置換)であるが、到達する重要な目的は、抗原提示細胞(APC)により加工された
場合に、アナログが、APCの表面上にMCHクラスII分子の意味において提示されている、このような外来免疫優性T細胞エピトープを生じさせることである。したがって、もし、適
切な位置にあるAPPまたはAβのアミノ酸配列が、外来THエピトープにおいても見出すことができるいくつかのアミノ酸残基を含む場合、外来THエピトープの導入は、アミノ酸の挿入、付加、欠失および置換によって外来エピトープの残りのアミノ酸を提供することにより達成することができる。言い換えると、本発明の目的を満たすために、挿入または置換による完全なTHエピトープの導入は必要ではない。
【0088】
挿入、欠失、置換または付加のアミノ酸の数は、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20および25のような少なくとも2の挿入、置換、付加または欠失であることが好ましい。挿入、置換、付加または欠失のアミノ酸の数が、最大で100
、最大で90、最大で80、最大で70のように150を超えないことがさらに好ましい。置換、
挿入、欠失または付加の数は、60を超えないことが特に好ましく、特に、この数は50または40さえも超えるべきではない。最も好ましくは、30を超えない数である。アミノ酸付加については、得られる構築物が融合ポリペプチドの形態にある場合、これらはしばしば、150よりかなり高いことが記載される。
【0089】
本発明の好ましい実施形態は、少なくとも1つの外来免疫優性T細胞エピトープを導入することによる修飾を含む。T細胞エピトープの免疫優性の問題は、問題の動物種に依存す
ることが理解されるであろう。本明細書において用いられるように、「免疫優性」の語は、ワクチン化された個体/個体群においてかなりの免疫応答を起こすエピトープを単にい
うが、ある個体/個体群において免疫優性であるT細胞エピトープは、同じ種の他の個体においても免疫優性である必要がなく、それが後者の個体においてはMHC-II分子に結合することが可能であってもそうであることは公知の事実である。よって、本発明の目的については、免疫優性T細胞エピトープは、抗原中に存在する場合に、T細胞の援助を提供するのに効果的なT細胞エピトープである。典型的に、免疫優性T細胞エピトープは、それらが発現するポリペプチドに関わらず、本質的にいつもMHCクラスII分子に結合して提示される
、固有の特徴を有する。
【0090】
他の重要な点は、T細胞エピトープのMHC制限の問題である。一般的に、天然に発生するT細胞エピトープはMHC制限され、すなわちT細胞エピトープを構成する、あるペプチドはMHCクラスII分子の部分集合に効果的に結合するのみである。これは、多くの場合、ある特定のT細胞エピトープの使用が、個体群のフラクションにおいてのみ効果的であるワクチ
ン成分となる効果を有し、そのフラクションのサイズに依存して、同じ分子においてより多くのT細胞エピトープを含むか、または代わりに構成成分が導入されたT細胞エピトープ
の性質によって互いに区別されるAPPまたはAβの変形である多成分ワクチンを作製することが必要になることが可能である。
【0091】
もし、用いるT細胞のMHC制限が全くわからない場合(例えばワクチン化された動物がほとんど明確でないMHC組成物を有する状況において)、特定のワクチン組成物により包含
される個体群のフラクションは、次の式
【0092】
【数1】

【0093】
(ここで、piは、ワクチン組成物に存在するi番目の外来T細胞エピトープに対する、応答
者の個体群中の頻度であり、nはワクチン組成物中の外来T細胞エピトープの総数である)により見積もられる。よって、それぞれ0.8、0.7および0.6の個体群における応答頻度を
有する、3つの外来T細胞エピトープを含むワクチン組成物は
1 − 0.2 × 0.3 × 0.4 = 0.976
を与えることになり、すなわち、個体群の97.6%が、ワクチンに対するMHC-II媒介応答を統計学的に有するであろう。
【0094】
上記式は、用いるペプチドの多少正確なMHC制限パターンがわかっている状況において
は当てはまらない。もし、例えばあるペプチドがHLA-DR対立遺伝子であるDR1、DR3、DR5
およびDR7によりエンコードされるヒトMHC-II分子にのみ結合するのであれば、このペプ
チドを、HLA-DR対立遺伝子によりエンコードされる残りのMHC-II分子に結合する他のペプチドとともに用いることが、問題の個体群における100%の適用範囲を達成する。同様に
、もし第二のペプチドがDR3およびDR5にのみ結合するならば、このペプチドの添加は、適用範囲を全く増加させない。もしワクチン中のT細胞エピトープの純粋にMHC制限上への個体群の応答の計算に基礎をおく場合、特定のワクチン組成物により包含される個体群の最小のフラクションは次の式:
【0095】
【数2】

【0096】
(ここで、φjは、ワクチン中のT細胞エピトープのいずれか一つに結合し、3つの公知のHLA遺伝子座(DP、DRおよびDQ)のj番目に属する、MHC分子をエンコードする対立遺伝子のハプロタイプの個体群中の頻度の合計である;実際問題として、まずどのMHC分子がワクチ
ン中の各T細胞エピトープを認識するのかを決定し、その後それらをタイプ(DP、DRおよびDQ)により列挙し、次いで列挙された異なる対立遺伝子のハプロタイプのそれぞれの頻度
を各タイプについて合計し、それによりφ1、φ2およびφ3を得る)により決定すること
ができる。
【0097】
式IIのpiの値が、対応する理論値πi:
【0098】
【数3】

【0099】
(ここで、νjは、ワクチン中のi番目のT細胞エピトープに結合し、3つの公知のHLA遺伝
子座(DP、DRおよびDQ)のj番目に属する、MHC分子をエンコードする対立遺伝子のハプロタイプの個体群中の頻度の合計である)を超えることが起こり得る。これは、1 − Πiの個体群中では、応答者の頻度のf残存-i = (pi − Πi) / (1 − Πi)であることを意味する。よって、式IIIは、式V:
【0100】
【数4】

【0101】
(ここで、1 − f残存-iの表現は、負である場合、ゼロに設定される)を得るように調節することができる。式Vは、全てのエピトープがハプロタイプの同じ組に対してハプロタ
イプの位置づけをされていることが必要であることが記載される。
【0102】
よって、アナログに導入されることとなるT細胞エピトープを選択する場合、エピトー
プについての入手可能である全ての知識を含むことが重要である:1) 個体群中の応答者
の各エピトープに対する頻度、2) MHC制限データ、および3) 適切なハプロタイプの個体
群中における頻度である。
【0103】
動物種または動物個体群の多くの割合において活性である、天然に発生する「乱交雑」T細胞エピトープがいくつか存在し、これらはワクチンに導入されることが好適であり、
それにより同じワクチン中における非常に多数の異なるアナログの必要性が減少される。
【0104】
本発明の乱交雑エピトープは、破傷風トキソイド(例えばP2およびP30エピトープ)、ジ
フテリアトキソイド、インフルエンザウイルスヘマグルチニン(HA)、およびピー・ファルシパルム(P. falciparum) CS抗原からのエピトープのような天然に発生するヒトT細胞エ
ピトープであることができる。
【0105】
長年にわたって、他の乱交雑T細胞エピトープがいくつか同定されている。特に、異な
るHLA-DR対立遺伝子によりエンコードされるHLA-DR分子の多くの割合に結合することができるペプチドが同定され、これらは全て、本発明において用いるアナログに導入される可能性があるT細胞エピトープである。本明細書にその全てが参照として組み込まれる、次
の参考文献において議論されるエピトープも参照:WO 98/23635 (Frazer IHら、The University of Queenslandに譲渡);Southwood Sら、1998、J. Immunol. 160:3363〜3373;Sinigaglia Fら、1988、Nature 336:778〜780;Chicz RMら、1993、J. Exp. Med 178:27〜47;Hammer Jら、1993、Cell 74:197〜203;およびFalk Kら、1994、Immunogenetics 39:230〜242。後の参考文献もまたHLA-DQおよび-DPリガンドに関する。これらの5つの参考文献に列挙されたエピトープは全て、本発明において用いることとなる天然のエピトープの候補として適切である。なぜなら、これらと共通モチーフを共有するエピトープだからである。
【0106】
代わりに、エピトープは、MHCクラスII分子の多くの割合に結合することができるいず
れの人工T細胞エピトープであってもよい。この関連において、WO 95/07707および対応する論文Alexander Jら、1994、Immunity 1:751〜761(どちらの開示も本明細書に参照として組み込まれる)に記載のpan DRエピトープペプチド("PADRE")は、本発明により用いら
れることとなるエピトープの候補として興味深い。これらの論文に開示の最も効果的なPADREペプチドは、投与されたときに安定性を向上するためにCおよびN末端にD-アミノ酸を有することが記載される。しかしながら、本発明は、続いてAPCのリソソーム区画内で酵
素的に分解され、MHC-II分子に関する、続いて起こる提示を許容するアナログの部分としての適切なエピトープの組み込みをまず目的とし、よって本発明において用いるエピトープではD-アミノ酸を組み込むことは得策ではない。
【0107】
特に好ましいPANDREペプチドは、アミノ酸配列AKFVAAWTLKAAA (SEQ ID NO: 17)または
その免疫学的に有効なサブシークエンスを有するものである。同じMHC制限の欠損を有す
るこのエピトープおよび他のエピトープは、本発明の方法に用いるアナログ中に存在するべき、好ましいT細胞エピトープである。このような超乱交雑(super-promiscuous)エピトープは、ただ1つの単独のアナログがワクチン化された動物の免疫系に提示される、本発
明の最も単純な実施形態について許容する。
【0108】
上述したように、APPまたはAβの修飾は、APCまたはBリンパ球に対して修飾されたアミロイド産生ポリペプチドを標的化する第一成分の導入をも含む。例えば、第一成分は、B
リンパ球特異的表面抗原またはAPC特異的表面抗原に対する特異的結合パートナーである
ことができる。多くのこのような特異的表面抗原が当該技術において公知である。例えば、該成分は、Bリンパ球またはAPC上にそれに対する受容体がある炭水化物(例えばマンナ
ンまたはマンノース)であることができる。代わりに、第二成分はハプテンであることが
できる。APCまたはリンパ球上の表面分子を特異的に認識する抗体フラグメントは、第一
成分として用いることができる(表面分子は、例えばFCγRIのようなマクロファージおよび単核細胞のFCγ受容体、または代わりに、CD40もしくはCTLA-4のようなその他のいかなる特異的表面マーカーであってよい)。これらの全ての例示した標的化分子は、アジュバントの部分としても用いることができることが記載される、下記を参照。
【0109】
増大された免疫応答を達成するために、ある細胞タイプに対するアナログの標的化の代替物または補足物として、免疫系を刺激する上記の第二成分を含むことにより免疫系の応答性のレベルを増加させることが可能である。このような第二成分の典型的な例は、サイトカインおよびヒートショックタンパク質または分子状シャペロン、ならびにそれらの効果的な部分である。
【0110】
本発明に用いられる好適なサイトカインは、ワクチン組成物中でアジュバントとしても通常機能するもの、すなわち、例えばインターフェロンγ(IFN-γ)、インターロイキン1 (IL-1)、インターロイキン2 (IL-2)、インターロイキン4 (IL-4)、インターロイキン6 (IL-6)、インターロイキン12 (IL-12)、インターロイキン13 (IL-13)、インターロイキン15
(IL-15)、および顆粒球マクロファージコロニー刺激因子(GM-CSF)である;代わりに、サイトカイン分子の機能性部分は、第二成分として充分であろう。このようなサイトカインのアジュバント物質としての使用に関しては、以下の議論を参照。
【0111】
本発明によると、第二成分として用いられる好適なヒートショックタンパク質または分子状シャペロンは、HSP70、HSP90、HSC70、GRP94 (gp96としても知られる、Wearsch PAら、1998、Biochemistry 37:5709〜19参照)、およびCRT (カルレティキュリン)であることができる。
【0112】
代わりに、第二成分は、リステリオライシン(LLO)、リピドAおよび熱不安定エンテロトキシンのようなトキシンであることができる。また、MDP (ムラミルジペプチド)、CFA (
完全フロイントアジュバント)、ならびにトレハロースジエステルTDMおよびTDEのような
いくつかのマイコバクテリア由来物も興味深い可能性である。
【0113】
免疫系に対するアナログの提示を増大させる第三成分の導入の可能性も、本発明の重要な実施形態である。当該技術は、この原理のいくつかの例を示している。例えば、ボレリア・ブルグドルフェリ(Borrelia burgdorferi)タンパク質OspA中のパルミトイル脂質化アンカーは、自己アジュバント化ポリペプチドを与えるように用いることができることが知られている(例えばWO 96/40718参照)−脂質化タンパク質は、ポリペプチドの脂質化アン
カー部分とそこから突起している分子の残りの部分とから構成される核とともにミセル様構造を形成し、抗原決定基の多数の提示となるようである。よって、この使用および異なる脂質化アンカー(例えばミリスチル基、ミリスチル基、ファルネシル基、ゲラニル−ゲ
ラニル基、GPI−アンカー、およびN-アシルジグリセリド基)を用いる、関連するアプローチは、本発明の好ましい実施形態であり、それは、特に組換え的に産生されたタンパク質におけるこのような脂質化アンカーの提供は、全く率直であり、アナログへの融合パートナーとして、例えば天然に発生するシグナル配列の使用を単に必要とするだけであるからである。他の可能性は、相補因子C3のC3d断片またはC3自体の使用である(Dempseyら、1996、Science 271、348〜350およびLou & Kohler、1998、Nature Biotechnology 16、458〜462参照)。
【0114】
免疫系に対するAPPまたはAβの重要なエピトープ領域の多コピー(例えば少なくとも2)
の好ましい提示となる、本発明の別の実施形態は、特定分子、すなわち上記の変形dまた
はeへのアナログの共有結合である。例えばポリマーを用いることができ、例えばデキス
トランのような炭水化物(例えばLees Aら、1994、Vaccine 12:1160〜1166;Lees Aら、1990、J Immunol. 145:3594〜3600参照)であるが、マンノースおよびマンナンも有用な代替物である。例えばイー・コリ(E. coli)およびその他のバクテリアからの必要不可欠な
膜タンパク質も有用な結合パートナーである。キーホールリンペットヘモシアニン(KLH)
、破傷風トキソイド、ジフテリアトキソイドおよびウシ血清アルブミン(BSA)のような伝
統的な担体分子も、好ましい有用な結合パートナーである。
【0115】
炭水化物のような、ポリヒドロキシポリマーへのAPPまたはAβの由来物の共有結合の好ましい実施形態は、ポリヒドロキシポリマーに別個に結合する少なくとも1つのAPPまたはAβ由来ペプチドおよび少なくとも1つの外来Tヘルパーエピトープの使用を含む(すなわち、外来TヘルパーエピトープおよびAPPまたはAβ由来アミノ酸配列は互いに融合するので
はなく、むしろポリヒドロキシポリマーに結合し、次いでそれが担体の骨格としての役割を果たす)。再び、このような実施形態は、APPまたはAβ由来ペプチドの領域を有する適
切なB細胞エピトープが、短いペプチドの範囲により構成される場合に、最も好ましい−
これは、このアプローチが、得られる免疫原性の剤における選択されたエピトープの多数の提示を達成する非常に簡便な方法の一つだからである。しかしながら、本明細書においてすでに述べたアナログをポリヒドロキシポリマー骨格に単純に結合させる、すなわちAPPまたはAβ由来物が外来THエピトープとは別個に骨格に結合していないことも可能である。
【0116】
外来TヘルパーエピトープおよびAPPまたはAβ由来(ポリ)ペプチドの結合は、ペプチダ
ーゼにより切断可能なアミド結合によることが好ましい。このストラテジーは、APCがコ
ンジュゲートを取り上げると、同時にコンジュゲートを加工処理することができ、続いてMHCクラスIIの関係において外来T細胞エピトープを提示する効果を有する。
【0117】
ペプチド(興味の対象であるAPPまたはAβ由来ペプチドとともに外来エピトープの両方)の結合を達成する一つの方法は、トレシル(トリフルオロエチルスルホニル)基またはマレイミド、p-ニトロフェニルクロロホルメート(OH基の活性化およびペプチドとポリヒドロ
キシポリマーとの間のペプチド結合の形成のため)、およびトシル(p-トルエンスルホニル)のようなその他の適切な活性化基を用いて、適切なポリヒドロキシポリマーを活性化す
ることである。例えば、WO 00/05316およびUS 5,874,469(両者とも本明細書に参照として組み込まれる)に記載のようにして、活性化された多糖類を製造して、これらをAPPまたはAβ由来ペプチドまたはポリアミノ酸、ならびに通常の固相もしくは液相ペプチド合成技
術により作製されたT細胞エピトープに結合させることが可能である。得られた生成物は
、APPまたはAβおよび外来T細胞エピトープに由来のポリアミノ酸を、そのN末端またはその他の利用可能な窒素部分により結合して有する、ポリヒドロキシポリマー骨格(例えば
デキストラン骨格)からなる。所望により、N末端にある一つを除いて全ての利用可能なアミノ基を保護するようにAPPまたはAβペプチドを合成し、続いて、得られた保護されたペプチドをトレシル化されたデキストラン部分に結合し、最後に、得られたコンジュゲートを脱保護することが可能である。このアプローチの特定の例は、以下の実施例に述べる。
【0118】
WO 00/05316およびUS 5,874,469に教示のような水溶性多糖類分子を使用する代わりに
、架橋された多糖類分子を用いることが同等に可能であり、それによりポリペプチドおよび多糖類の間の粒状のコンジュゲートを得る−これは、2つの目的、すなわちコンジュゲ
ートを注射した場合の局所的沈着効果を得ること、およびAPCに対してひきつける力があ
る標的である粒子を得ることが達成されるので、免疫系に対するポリペプチドの向上された提示に導くと考えられている。このような粒状の系を用いるアプローチも、実施例において説明する。
【0119】
APPまたはAβに修飾を導入するのに選択された領域については、a) 知られた、予想さ
れるB細胞エピトープの保存、b) 三次構造の保存、c) 「産生細胞」上にB細胞エピトープが存在することの回避などを考慮することが根底にある。いずれにしても、上述したように、異なる位置におけるT細胞エピトープの導入に全て供されたアナログの一組を検査す
ることは、全く簡単である。
【0120】
本発明の最も好ましい実施形態がヒトAβのダウンレギュレーションを含むので、上記
のAPPまたはAβポリペプチドはヒトAβポリペプチドであることが好ましい。この実施形
態においては、APPまたはAβポリペプチドは、SEQ ID NO: 2における少なくとも1つのア
ミノ酸配列が、同じもしくは異なる長さであって、外来THエピトープを含む少なくとも1
つのアミノ酸配列で置換されることにより修飾されていることが特に好ましい。修飾されたアミロイド産生APPおよびAβの好ましい例を、P2およびP30エピトープを例として用い
て、図1に概略を示す。このような構築物の背景原理は、実施例において詳細に論ずる。
【0121】
より特異的には、SEQ ID NO: 2中に導入されるTHを含む(または完成する)アミノ酸配列は、SEQ ID NO: 2中のいずれのアミノ酸において導入してもよい。すなわち、導入はSEQ ID NO: 2中の1〜770のいずれのアミノ酸の後でもよいが、好ましくはSEQ ID NO: 2の671
、672、673、674、675、676、677、678、679、680、681、682、683、684、685、686、687、688、689、690、691、692、693、694、695、696、697、698、699、700、701、702、703、704、705、706、707、708、709、710、711、712、713および714のいずれかのアミノ酸
の後である。これは、1〜671のいずれかもしくは全てのアミノ酸、または715〜770のいずれかもしくは全てのアミノ酸の欠失と組合わせてもよい。さらに、置換の技術を用いる場合、SEQ ID NO: 2中の671、672、673、674、675、676、677、678、679、680、681、682、683、684、685、686、687、688、689、690、691、692、693、694、695、696、697、698、699、700、701、702、703、704、705、706、707、708、709、710、711、712、713および714のいずれか1つのアミノ酸が、導入と組合わせて置換されていてもよい。
【0122】
本発明の他の実施形態は、T細胞応答を開始するMHCクラスII分子に生産的に結合する、SEQ ID NO: 2のいずれのサブシークエンスをも含まないアナログの提示である。
【0123】
免疫系が例えば抗Aβ免疫応答を誘導することを保証する抗原の設計についてのこのよ
うなストラテジーの背景にある原理は、次のようである:自己タンパク質に対する体の免疫寛容性を破壊するのに充分に強いアジュバント中に処方された、Aβのような豊富な自
己由来タンパク質で免疫化する場合、あるワクチン化された個体においては、誘導された免疫応答が、単純に免疫化を停止するだけでは停止されない危険性がある。これは、このような個体において誘導された免疫応答が、自己タンパク質の天然THエピトープにより推進されているようであり、このことがワクチン化された個体自身のタンパク質が、それ自身で免疫化剤として機能し得る悪影響を有するからである:よって、自己免疫状態が確立されている。
【0124】
外来THエピトープの使用を含む好ましい方法は、抗−自己免疫応答が外来THエピトープにより推進されるので、発明者の知る限りでは、この効果を生み出すことは観察されておらず、好ましい技術に頼った、誘導された免疫応答が免疫化の停止後に実際に衰弱することは、本発明者らにより繰り返して示されている。しかしながら、免疫応答がそれに対して免疫化する適切な自己タンパク質の自己THエピトープによっても推進されることは、いくつかの個体において理論上では起こり得る−これは、比較的豊富にある、Aβのような
自己タンパク質を考慮する場合に特に適切であるが、他の治療上適切な自己タンパク質は局所的に存在するだけであるか、または体内において、「自己免疫効果」が不可能であるほど非常にわずかな量である。これを回避するある非常に単純な方法は、THエピトープとして役に立つことができるであろうペプチド配列の免疫原を含むことを全く回避することである(および、約9アミノ酸より短いペプチドはTHエピトープとして役に立つことがで
きないので、より短い断片の使用は、ある単純で実行可能なアプローチである)。したがって、本発明のこの実施形態は、さもなければTHエピトープとして機能するであろう標的タンパク質の配列中の保存性の置換を単に含む配列を含む、「自己刺激THエピトープ」として役に立つことができる、標的APPまたはAβのペプチド配列を含まない免疫原を確実にすることを供給する。
【0125】
APPまたはAβのアナログの免疫系提示の好ましい実施形態は、MHCクラスII分子に生産
的に結合しない少なくとも1つのAPPまたはAβ由来ペプチド、および少なくとも1つの外来Tヘルパーエピトープを含むキメラペプチドの使用を含む。さらに、APPまたはAβ由来ペ
プチドがB細胞エピトープを有することが好ましい。免疫原性アナログが、1つ以上のB細
胞エピトープを含むアミノ酸配列が連続配列または挿入を含む配列のいずれかとして表されるものであり、該挿入が外来Tヘルパーエピトープを含むことが特に好ましい。
【0126】
再び、このような実施形態は、APPまたはAβの領域を有する適切なB細胞エピトープが
、MHCクラスII分子に生産的に結合することができる手段がない、短いペプチド範囲から
なる場合に最も好ましい。アミロイド産生ポリペプチドの選択されたB細胞エピトープま
たは複数のエピトープは、したがってSEQ ID NO: 2の最大で9の連続したアミノ酸を含む
べきである。アミロイド産生ポリペプチドのアミノ酸配列からの、最大で8、7、6、5、4
または3の連続したアミノ酸を有するもののような、より短いペプチドが好ましい。
【0127】
アナログがSEQ ID NO: 2の少なくとも1つのサブシークエンスを含むので、そのような1つのサブシークエンスがそれぞれ独立して、9の連続したアミノ酸、8の連続したアミノ酸、7の連続したアミノ酸、6の連続したアミノ酸、5の連続したアミノ酸、4の連続したアミノ酸、および3の連続したアミノ酸からなる群より選択される、APPまたはAβからのアミ
ノ酸範囲からなることが好ましい。
【0128】
連続したアミノ酸が、SEQ ID NO: 2の残基672、673、674、675、676、677、678、679、680、681、682、683、684、685、686、687、688、689、690、691、692、693、694、695、
696、697、698、699、700、701、702、703、704、705、706、707、708、709、710、711、712、713および714からなる群より選択されるアミノ酸残基から始まることが特に好まし
い。
【0129】
タンパク質/ペプチドワクチン化;アナログの処方および投与
動物へのアナログの投与により動物の免疫系にアナログを提示する場合、ポリペプチドの処方は、当該技術において通常承認される原理に従う。
【0130】
有効成分としてペプチド配列を含むワクチンの製造は、全て本明細書に参照として組み込まれる米国特許4,608,251;4,601,903;4,599,231;4,599,230;4,596,792;および4,578,770に例示のように、当該技術において一般的によく理解されている。典型的には、このようなワクチンは、液体の溶液または懸濁物のいずれかとして、注射可能なように製造される;注射の前の液体における溶液または液体における懸濁物に適した固体形態も製造することができる。製造物は、乳化されていてもよい。
【0131】
免疫原性有効成分は、医薬上許容され、有効成分に影響を及ぼさない添加剤としばしば混合される。適切な添加剤は、例えば水、食塩水、デキストロース、グリセロール、エタノールなど、またはこれらの組合わせである。加えて、所望により、ワクチンは、湿潤剤もしくは乳化剤、pH緩衝剤、またはワクチンの効果を増大させるアジュバントのような補助物質を少量含むことができる;以下の、アジュバントの詳細な議論を参照。
【0132】
ワクチンは、非経口で、例えば皮下、皮内または筋肉内のいずれかの注射により、通常、投与される。投与の他の形態に適した付加的な製剤は、坐剤や、ある場合においては、経口、バッカル、舌下、腹膜内、膣内、肛門、硬膜外、脊髄、および頭蓋内の製剤を含む。坐剤については、伝統的な結合剤および担体は、例えばポリアルキレングリコールまたはトリグリセリドを含むことができる;このような坐剤は、有効成分を0.5%〜10%、好ま
しくは1〜2%の範囲で含む混合物からつくられる。経口製剤は、例えば医薬グレードのマ
ンニトール、ラクトース、スターチ、ステアリン酸マグネシウム、サッカリンナトリウム、セルロース、炭酸マグネシウムなどの通常用いられる添加剤を含む。これらの組成物は、溶液、懸濁液、錠剤、丸剤、カプセル、持続放出性製剤または粉剤の形態をとり、10〜95%、好ましくは25〜70%の有効成分を含む。経口製剤について、コレラトキシンは、興味深い製剤パートナーである(および抱合パートナーとしても可能性がある)。
【0133】
ポリペプチドは、中性または塩の形態でワクチンに処方することができる。医薬上許容される塩は、酸付加塩(ペプチドの遊離のアミノ基とともに形成される)、および例えば塩酸もしくはリン酸のような無機酸、または酢酸、シュウ酸、酒石酸、マンデル酸などの有機酸とともに形成されるものを含む。遊離のカルボキシル基と形成される塩は、例えば水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、水酸化カルシウム、または水酸化第二鉄のような無機塩基、およびイソプロピルアミン、トリメチルアミン、2−エチル
アミノ エタノール、ヒスチジン、プロカインなどの有機塩基に由来するものであってもよい。
【0134】
ワクチンは、投与量製剤に影響を及ぼさない方法で、治療上有効な免疫原性である量で投与される。投与される量は、例えば免疫応答をする個体の免疫系の受容力、および所望の防御の程度を含み、治療される被験者に依存する。適切な投与量範囲は、ワクチン接種あたり数百μgのオーダーの有効成分であり、好ましい範囲が、約0.5μg〜1,000μgの範
囲のような約0.1μg〜2,000μg (1〜10 mgの範囲のより高い量が予期されるが)、好まし
くは1μg〜500μmの範囲、特に約10μg〜100μgの範囲である。
最初の投与およびブースター注射の好適なレジメント(regiments)も変動するが、最初
の投与に続いて接種または他の投与を行うことにより代表される。
【0135】
適用の仕方は広く変動する。ワクチンの投与の通常の方法のいずれも適用可能である。これらは、固体の生理学的に許容されるベース上の、または生理学的に許容される分散液中の経口適用、注射による非経口などを含む。ワクチンの投与量は、投与経路に依存し、ワクチン化されるヒトの年齢および抗原の製剤により変動する。
【0136】
ワクチンのポリペプチドのいくつかは、ワクチン中において充分に免疫原性であるが、他のいくつかについては、ワクチンがさらにアジュバント物質を含む場合、免疫応答が増強される。
【0137】
ワクチンについてアジュバント効果を達成する種々の方法が知られている。一般的な原理および方法は、“The Theory and Practical Application of Adjuvants"、1995、Duncan E.S. Stewart-Tull(編)、John Wiley & Sons Ltd、ISBN 0-471-95170-6、および“Vaccines: New Generationn Immunological Adjuvants"、1995、Gregoriadis Gら(編)、Plenum Press、New York、ISBN 0-306-45283-9に詳述され、両者とも本明細書に参照として組み込まれる。
【0138】
自己抗原への自己寛容の破壊の促進を示し得るアジュバントを用いることが、特に好ましい;実際、非修飾アミロイド産生ポリペプチドを自己ワクチン中の有効成分として用いる場合に、これは必須である。適切なアジュバントの制限されない例は、免疫標的化アジュバント;トキシン、サイトカインおよびマイコバクテリア派生物のような免疫変調アジュバント;油処方成分;ポリマー;ミセル形成アジュバント;サポニン;免疫刺激複合マトリクス(immunostimulating complex matrix) (ISCOMマトリックス);粒子;DDA;アル
ミニウムアジュバント;DNAアジュバント;γ−イヌリン;およびカプセル化アジュバン
トからなる群より選択される。一般的に、アナログ中の第一、第二および第三成分として有用な化合物および剤に関する上記の開示は、必要な変更を加えて、本発明のワクチンのアジュバントにおけるそれらの使用に当てはまることが記載される。
【0139】
アジュバントの適用は、緩衝食塩水中の0.05〜0.1%溶液として通常用いられる水酸化アルミニウムまたはリン酸アルミニウム(ミョウバン)のような剤、0.25%溶液として用い
られる糖の合成ポリマー(例えばCarbopol(登録商標))との混合物の使用を含み、それぞれ70〜101℃の範囲の温度において30秒〜2分間の熱処理によるワクチン中のタンパク質の凝集、および架橋剤による凝集も可能である。アルブミンへのペプシン処理抗体(Fab断片)を用いた再活性化による凝集、シー・パルバム(C. parvum)のような細菌細胞もしくはエンドトキシンもしくはグラム陰性細菌のリポ多糖類成分との混合物、マンニドモノ−オレエート (Aracel A)のような生理学的に許容される油賦形剤中の乳化物、またはブロック
代替物として用いられるパーフルオロカーボン(Fluosol-DA)の20%溶液とのエマルジョン
も用いることができる。スクアレンのような油およびIFAとの混合物も好ましい。
【0140】
本発明によると、DDA(ジメチルジオクタデシルアンモニウム ブロミド)は、DNAおよびγ−イヌリンのままでのアジュバントだけでなくフロイントの完全アジュバントおよび不完全アジュバントとして興味深い候補であり、またQuilAおよびQS21のようなキラヤサポ
ニンはRIBIのままで興味深い。更なる可能性は、モノホスホリルリピドA (MPL)、前記のC3およびC3d、ならびにムラミルジペプチド(MDP)である。
【0141】
リポソーム製剤も、アジュバント効果を与えることが知られており、よって本発明によると、リポソームアジュバントは好ましい。
【0142】
また、免疫刺激複合体マトリックスタイプ (ISCOM(登録商標)マトリックス)アジュバントも、このタイプのアジュバントがAPCによりMHCクラスII発現をアップレギュレーショ
ンすることができるので特に、本発明による好ましい選択である。ISCOM(登録商標)マ
トリックスは、キラヤ・サポナリア(Quillaja saponaria)からの(任意に分別された)サポニン(トリテルペノイド)、コレステロール、およびリン脂質からなる。免疫原性タンパク質と混合した場合、得られる粒子製剤は、サポニンが60〜70%、コレステロールおよびリ
ン脂質が10〜15%、ならびにタンパク質が10〜15%を構成する、ISCOM粒子として知られる
ものである。組成物および免疫刺激複合体に関する詳細は、例えばアジュバントに関する上記の教科書に見出されるが、Morein Bら、1995、Clin. Immunother. 3:461〜475、な
らびにBarr IGおよびMitchell GF、1996、Immunol. and Cell Biol. 74:8〜25(両者とも本明細書に参照として組み込まれる)も、完全免疫刺激複合体の製造についての有用な教
示を与える。
【0143】
アジュバント効果を達成する、その他の非常に興味深い(よって、好ましい)可能性は、Gosselinら、1992(本明細書に参照として組みこまれる)に記載の技術を用いることである。簡単に、本発明の抗原のような適切な抗原の提示は、抗原を単核/マクロファージ上
のFcγ受容体に対する抗体(または抗原結合抗体フラグメント)に結合させることにより増大される。特に、抗原と抗−FcγRIとの間の抱合は、ワクチン化の目的のための免疫原性を増大させることが示されている。
【0144】
他の可能性は、アミロイド産生ポリペプチドの修飾されたバージョン中の第一及び第二成分の候補として上述した標的化および免疫調節物質(とりわけサイトカイン)の使用を含む。この関連において、ポリI:Cのようなサイトカインの合成インデューサーも可能性
がある。
【0145】
好適なマイコバクテリア由来物は、ムラミルジペプチド、完全フロイントアジュバント、RIBI、ならびにTDMおよびTDEのようなトレハロースのジエステルからなる群より選択される。
【0146】
好適な免疫標的化アジュバントは、CD40リガンドおよびCD40抗体またはそれらの特異的結合断片(上記の議論参照)、マンノース、Fab断片、ならびにCTLA-4からなる群より選択
される。
【0147】
好適なポリマーアジュバントは、デキストラン、PEG、スターチ、マンナンおよびマン
ノースのような炭水化物;プラスチックポリマー;ならびにラテックスビーズのようなラテックスからなる群より選択される。
【0148】
興味深いその他の免疫応答の調節の手段は、「バーチャルリンパ節」(VLN) (ImmunoTherapy, Inc.、360 Lexington Avenue、New York、NY 10017-6501により開発された専売医
用装置)中に、免疫原(任意にアジュバントおよび医薬上許容される担体および賦形剤とともに)を含むことである。VLN(薄い管状の装置)は、リンパ節の構造および機能を模倣している。皮膚の下へのVLNの挿入は、サイトカインおよびケモカインの急な高まりを伴う無
菌の炎症の部位を創生する。T細胞およびB細胞とともにAPCも危険信号に迅速に応答し、
炎症を起こした部位に戻り、VLNの多孔性マトリックスの内側に蓄積する。抗原に免疫応
答を装備するのに要求される必要な抗原投与量は、VLNを用いる場合に減少されることと
、VLNを用いたワクチン化により与えられた免疫防御は、アジュバントとしてRibiを用い
た通常の免疫化に勝ることとが示されている。この技術は、とりわけGelber Cら、1998、"Elicitation of Robust Cellular and Humoral Immune Responses to Small Amounts of
Immunogens Using a Novel Medical Device Designated the Virtual Lymph Node":"From the Laboratory to the Clinic, Book of Abstracts、October 12th〜15th 1998, Seascape Resort、Aptos、California"に簡単に記載されている。
【0149】
ワクチンの微粒子製剤は、タンパク質抗原の免疫原性を増加させることが多くの件で示され、したがって本発明の他の好ましい実施形態である。微粒子は、抗原と、ポリマー、脂質、炭水化物もしくは粒子を形成するのに好適な他の分子との共製剤として作られるか、または微粒子は抗原自体のみからなる均質の粒子であることができる。
【0150】
ポリマーベースの微粒子の例としては、ポリマーと抗原とが固体粒子に濃縮されたPLGAおよびPVPベースの粒子(Gupta, R.K. ら、1998)である。脂質ベースの粒子は、ミセルの
中に抗原を取り込んだ脂質のミセル(いわゆるリポソーム)として作ることができる(Pietrobon, P.J. 1995)。炭水化物ベースの粒子は、スターチまたはキトサンのような適切な分解し得る炭水化物から典型的に作られる。炭水化物と抗原とを混合し、ポリマー粒子について用いられた方法(Kas, H.S.ら、1997)と同様の方法で粒子に濃縮する。
【0151】
抗原のみからなる粒子は、種々の噴霧および凍結乾燥技術により作ることができる。本発明の目的に特に好適なものは、制御されたサイズの非常に均一な粒子を作るのに用いられる超臨界流体技術である(York, P. 1999およびShekunov, B.ら、1999)。
【0152】
ワクチンは、1年に1、2、3、4、5または6回のような年に1〜6回、個体に必要に応じて
投与されるべきであることが予期される。本発明による好ましい自己ワクチンの使用により誘導される記憶免疫性は永続せず、したがって免疫系はアミロイド産生ポリペプチドまたは修飾されたアミロイド産生ポリペプチドで定期的に攻撃されることが必要であることがすでに示されている。
【0153】
遺伝的変異のために、異なる個体が同じポリペプチドに対して変動した強度の免疫応答で反応するであろう。したがって、本発明のワクチンは、免疫応答を増加させるためにいくつかの異なるポリペプチドを含んでいてもよく、これは外来T細胞エピトープ導入の選
択に関する、上記の議論を参照。ワクチンは2以上のポリペプチドを含んでいてよく、全
てのポリペプチドは、上記のとおりである。
この結果、ワクチンは、3〜10の異なるポリペプチドのような3〜20の異なる、修飾または非修飾のポリペプチドを含むことができる。
【0154】
核酸ワクチン化
ペプチドベースワクチンの伝統的な投与の代替として、核酸ワクチン化(「核酸免疫化
」、「遺伝的免疫化」および「遺伝子免疫化」としても知られる)の技術は、多くの魅力
的な特徴を提供する。
【0155】
第一に、伝統的なワクチンのアプローチに比較して、核酸ワクチン化は、免疫原性剤の大規模な製造(例えば修飾されたアミロイド産生ポリペプチドを製造する微生物の工業的規模の発酵の形態)を消費する資源を必要としない。さらに、免疫原を精製およびリフォールディングする装置の必要がない。最後に、核酸ワクチン化は、導入された核酸の発現産物を製造するために、ワクチン化された個体の生化学的器官に頼っているので、発現産物の最適な翻訳後プロセシングが起こることが期待される;これは、上述したように、本来のB細胞エピトープのかなりのフラクションが修飾された分子中に保存されるべきであ
り、B細胞エピトープは、いずれの(生体)分子(例えば炭水化物、脂質、タンパク質など)
の部分からも原則として構成することができるので、自己ワクチン化の場合に特に重要である。したがって、免疫原の本来のグリコシル化およびリピド化は、全体としての免疫原性に非常に重要であり、これは免疫原を産生する宿主を有することにより最も確実にされる。
【0156】
よって、本発明の変形a〜cの好ましい実施形態は、アナログをエンコードする核酸を動物の細胞に導入することにより免疫系にアナログを提示し、それにより核酸が導入された
細胞によるインビボ発現を得ることを含む。
【0157】
本実施形態においては、導入された核酸は、裸のDNA、荷電または非荷電の脂質ととも
に処方されたDNA、リポソーム中に処方されたDNA、ウイルスベクターに包含されたDNA、
トランスフェクション促進タンパク質またはポリペプチドとともに処方されたDNA、標的
化タンパク質またはポリペプチドとともに処方されたDNA、カルシウム沈殿剤とともに処
方されたDNA、不活性担体分子に結合したDNA、ポリマー、例えばPLGA (WO 98/31398に記
載のマイクロカプセル化技術を参照)中またはキチンもしくはキトサン中に被包されたDNA、およびアジュバントとともに処方されたDNAの形態にあり得るDNAが好ましい。この関係において、伝統的なワクチン処方でのアジュバントの使用に適する実用上全ての考慮すべき事柄が、DNAワクチンの処方に当てはまることが注目される。よって、ポリペプチドベ
ースのワクチンの関係においてアジュバントの使用に関する、本明細書における全ての開示は、必要な変更を加えて、核酸ワクチン化技術におけるその使用に当てはまる。
【0158】
上記で説明したポリペプチドベースのワクチンの投与経路および投与スキームに関し、これらは本発明の核酸ワクチンにも適用可能であり、ポリペプチドについての投与経路および投与スキームに適する上記の全ての議論は、必要な変更を加えて、核酸にも当てはまる。核酸ワクチンは、静脈内および動脈内に適切に投与され得ることをこれに追加するべきである。さらに、核酸ワクチンは、いわゆる遺伝子銃により投与され得ることは当該技術において公知であり、よってこのことおよびこれと同等の投与形態は、本発明の部分であるとみなされる。最後に、核酸の投与におけるVLNの使用は、良好な結果を生じること
が報告されており、よってこの特定の投与形態は特に好ましい。
【0159】
さらに、免疫化剤として用いられる核酸は、例えば有用なアジュバントとして論じたサイトカインのような、上記の免疫調節物質の形態にある第一、第二および/または第三成分をエンコードする領域を含むことができる。この実施形態の好ましいバージョンは、アナログのコーディング領域および免疫調節剤のコーディング領域を、異なるリーディングフレームで、または少なくとも異なるプロモーターの制御下で有することを包含する。これにより、アナログまたはエピトープが免疫調節剤の融合パートナーとして産生されるのを回避する。代わりに、2つの別個なヌクレオチド断片を用いることができるが、これは
、同じ分子中に含まれた両方のコーディング領域を有する場合、共発現が確実になる利点があるので、あまり好適ではない。
【0160】
したがって、本発明は
−本発明の核酸断片またはベクター(以下のベクターの議論を参照)、ならびに
−上記の医薬上および免疫学上許容される賦形剤および/または担体および/またはアジュバント
を含む、APPまたはAβに対する抗体産生を誘導する組成物に関する。
【0161】
通常の環境において、変形をエンコードする核酸は、発現がウイルスプロモーターの調節下にあるベクターの形態で導入される。本発明によるベクターのより詳細な議論については、以下の議論を参照。また、核酸ワクチンの処方および使用に関する詳細な議論は入手可能であり、Donnelly JJら、1997、Annu. Rev. Immunol. 15:617〜648およびDonnelly JJら、1997、Life Sciences 60:163〜172を参照。これらの両者の参考文献は、本明細書に参照として組み込まれる。
【0162】
生ワクチン
免疫系に対して、変形a〜cに定義されるようなアナログを提示する第三の代案は、生ワクチン技術の使用である。生ワクチンでは、免疫系への提示は、アナログをエンコードする核酸断片またはこのような核酸断片を組み込んだベクターで形質転換された非病原性微
生物を、動物に投与することによりもたらされる。非病原性微生物は、いずれの適切な弱毒化細菌株(継代培養によるか、または組換えDNA技術による病原性発現産物の除去により弱毒化)、たとえばマイコバクテリウム・ボビス ビーシージー(Mycobacterium bovis BCG.)、非病原性のストレプトコッカス種(Streptococcus spp.)、イー・コリ、サルモネラ
種(Salmonella spp.)、ビブリオ・コレラ(Vibrio cholerae)、シゲラ(Shigella)であってもよい。最新の生ワクチンの製造に関する概説は、例えばSaliou P、1995、Rev. Prat. 45:1492〜1496およびWalker PD、1992、Vaccine 10:977〜990に見出され、両者は本明細書中に参照として組み込まれる。このような生ワクチン中で用いられる核酸断片およびベクターについての詳細は、以下の議論を参照。
【0163】
細菌の生ワクチンの代替物として、ワクシニア株またはいずれの他の適切なポックスウイルスのような非ビルレントウイルスワクチンベクター中に、以下で論じられる本発明の核酸断片を組み込むことができる。
【0164】
通常、非病原性微生物またはウイルスは、動物に一度のみ投与されるが、防御免疫を維持するために、寿命の間に1回以上微生物を投与することが必要な場合がある。ポリペプ
チドワクチン化について上記で説明したような免疫化スキームが、生またはウイルスワクチンを用いる場合に、有用であろうことが考えられる。
【0165】
代わりに、生またはウイルスワクチン化を、その前またはその後のポリペプチドおよび/または核酸ワクチン化と組合わせてもよい。例えば、生またはウイルスワクチンによる一次免疫化をもたらし、続いてポリペプチドまたは核酸アプローチを用いてブースター免疫化を行うことが可能である。
【0166】
微生物またはウイルスは、例えば有用なアジュバントとして論じたサイトカインのような、上記の免疫調節物質の形態にある第一、第二および/または第三成分をエンコードする領域を含む核酸で形質転換されることができる。この実施形態の好ましいバージョンは、アナログのコーディング領域および免疫調節剤のコーディング領域を、異なるリーディングフレームで、または少なくとも異なるプロモーターの制御下で有することを包含する。これにより、アナログまたはエピトープが免疫調節剤の融合パートナーとして産生されるのを回避する。代わりに、2つの別個なヌクレオチド断片を形質転換の剤として用いる
ことができる。もちろん、第一および/または第二および/または第三成分を同じリーディングフレームに有することは、発現産物として本発明のアナログを提供することができ、このような実施形態は、本発明において特に好ましい。
【0167】
疾患の治療における本発明の方法の使用
上記の議論から認識されるように、本発明の方法の提供は、アミロイド沈着と特徴とする疾患の制御を許容する。この関係において、ADが本発明の方法の鍵となる標的であるだけでなく、Aβを含むアミロイド沈着を特徴とする他の疾患も可能な標的である。よって
、アミロイド活性のダウンレギュレーションのための本発明の方法の重要な実施形態は、アミロイド沈着を特徴とするADまたは他の疾患を治療および/または予防および/または改善することを含み、該方法は、アミロイドの量が有意に減少される程度まで、本発明の方法に従ってAPPまたはAβをダウンレギュレーションすることを含む。
【0168】
アミロイドの減少が、アミロイド形成とアミロイド分解/除去との間のバランスの逆転
になること、すなわちアミロイド分解/除去の速度がアミロイド形成の速度を超えるよう
になることが特に好ましい。それを必要とする個体の免疫化の数および免疫学的影響を注意深く制御することにより、過剰な副作用を有することなくアミロイド沈着の総計での減少となる、時間に関してのバランスを得ることが可能になる。
【0169】
代わりに、個体において本発明の方法が現存するアミロイド沈着を除去または減少できない場合、本発明の方法は、新しいアミロイドの形成における診療上有意な減少を得て、それにより、疾患の状態が衰弱させられない時間をかなり延長するのに用いることができる。アミロイドの血清濃度(沈着物質と平衡にあると考えられている)を測定することによるか、または陽電子放射断層撮影(PET)スキャンを用いることにより、アミロイド沈着の
速度をモニターすることができるはずであり、Small GWら、1996、Ann N Y Acad Sci 802:70〜78参照。
【0170】
本発明の手段および方法が、類似の方法において治療または改善に用いられるその他の疾患および症状は、上記の「発明の背景」において述べたか、または以下の「これらに関連する他のアミロイドの疾患およびタンパク質」の題がついた項目において列挙される。
【0171】
本発明のペプチド、ポリペプチドおよび組成物
上記からも明らかなように、本発明は、病理に関するアミロイド沈着の量を減少させるために、APPまたはAβ抗原に対して個体を免疫化するという概念に基づく。このような免疫化を得る好ましい方法は、本明細書で記載のアナログを用いることであり、それにより当該技術において以前に記載されていない分子を提供する。
【0172】
本明細書において論じるアナログは、それ自体で発明であり、したがって本発明の重要な部分は、上述したようなアナログに関係する。よって、修飾されたAPPまたはAβに関係する本明細書におけるいずれの開示も、本発明のアミロイド産生アナログを説明する目的に関し、このような開示のいずれも、必要な変更を加えて、これらのアナログの記載に当てはまる。
【0173】
好ましい、修飾されたAPPまたはAβ分子は、APPもしくはAβ、または少なくとも10アミノ酸の長さのそれらのサブシークエンスと少なくとも70%の配列相同性を有するポリペプ
チドとなる修飾を含むことが記載される。より高い配列相同性、例えば少なくとも75%、
または少なくとも80、85、90もしくは95%が好ましい。タンパク質および核酸の配列相同
性は、(Nref − Ndif)・100/Nref (ここで、Ndifは、整列したときに、2つの配列中の非
相同残基の総数であり、Nrefは、1つの配列中の残基数である。)のように算出できる。よって、DNA配列AGTCAGTCは、配列AATCAATCと75%の配列相同性を有する(Ndif=2およびNref=8)。
【0174】
本発明は、本発明の方法を実行するのに有用な組成物にも関する。よって、本発明は、さらに医薬上および免疫学上許容される希釈剤および/または賦形剤および/または担体および/または添加剤ならびに任意にアジュバントを含む、上記のアナログを免疫原的有効量含む免疫原性組成物に関する。言い換えると、本発明のこの部分は、本質的に上述したように、アナログの処方に関する。アジュバント、担体および添加剤の選択は、本発明のAPPまたはAβのダウンレギュレーション方法における、使用のための修飾または非修飾アミロイド産生ポリペプチドの処方について言及するときに論じたことに従う。
【0175】
ポリペプチドは、当該技術において公知の方法により製造される。より長いポリペプチドは、アナログをエンコードする核酸配列の適切なベクターへの導入、該ベクターによる適切な宿主細胞の形質転換、宿主細胞による核酸配列の発現、宿主細胞またはその培養上清からの発現産物の回収、ならびにその後の精製および任意の更なる修飾、例えばリフォールディングまたは派生(derivatization)を含む組換え遺伝子の手段により、通常、製造される。
【0176】
より短いペプチドは、固相または液相ペプチド合成の公知の技術により製造するのが好ましい。しかしながら、この技術における最近の進歩は、この手段による全長ポリペプチ
ドおよびタンパク質の製造を可能にし、したがって合成手段により長い構築物を製造することも本発明の範囲内である。
【0177】
本発明の核酸断片およびベクター
ポリアミノ酸アナログが組換え遺伝子技術だけでなく化学合成または半合成により製造できることが、上記の開示から認められるであろう;後者の2つの選択は、修飾がタンパ
ク質担体(KLH、ジフテリアトキソイド、破傷風トキソイド、およびBSAのような)と、炭水化物ポリマーのような非タンパク性分子との結合にある場合、ならびに修飾がAPPまた
はAβ由来ペプチド鎖への側鎖もしくは側面の群の付加を含む場合にももちろん、特に適
切である。
【0178】
組換え遺伝子技術の目的のために、およびもちろん核酸免疫化の目的のために、アナログをエンコードする核酸断片は重要な化学産物である。よって、本発明の重要な部分は、本発明のアナログ、すなわち融合パートナーが付加もしくは挿入されている天然の配列を含むAPPまたはAβ由来ポリペプチド、または好ましくは挿入および/または付加により、好ましくは置換および/または欠失により外来T細胞エピトープが導入されたAPPまたはA
β由来ポリペプチドをエンコードする核酸断片に関する。本発明の核酸断片は、DNAまた
はRNA断片のいずれかである。
【0179】
本発明の核酸断片は、通常、適切なベクターに挿入され、本発明の核酸断片を有するクローニングまたは発現ベクターとなる;このような新規ベクターもまた本発明の部分である。本発明のこれらのベクターの構築に関する詳細は、形質転換細胞および微生物の関係において以下で論じる。ベクターは、適用の目的およびタイプに応じて、プラスミド、ファージ、コスミド、ミニ染色体またはウイルスの形態にあり得るだけでなく、特定の細胞において一過的に発現するだけの裸のDNAも重要なベクターである。本発明の好ましいク
ローニングおよび発現ベクターは自律複製が可能であり、それにより、後に続くクローニングのための高レベル発現または高レベル複製を目的とする高いコピー数を可能にする。
【0180】
本発明のベクターの全体的な概要は、5'→3'方向に実施可能な連鎖で次の特徴を含む:本発明の核酸断片の発現を推進するプロモーター、必要に応じて、ポリペプチド断片の(細胞外の相へ、もしくは適用可能である場合にはペリプラズマへの)分泌または膜への組み込みを可能にするリーダーペプチドをエンコードする核酸配列、本発明の核酸断片、および必要に応じてターミネーターをエンコードする核酸配列である。生産株または細胞ラインにおいて発現ベクターとともに機能する場合、好ましい形質転換細胞の遺伝的安定性を目的として、宿主細胞に導入されたときのベクターは、宿主細胞ゲノムに組み込まれる。これに対して、動物においてインビボ発現をもたらすために用いるベクターとともに作用する場合(すなわち、DNAワクチン化においてベクターを用いる場合)、ベクターが宿主細胞ゲノムに組み込まれることができないことが、安全性の理由から好ましい;典型的に、裸のDNAまたは非組み込みウイルスベクターが用いられ、その選択は当業者に公知である。
【0181】
本発明のベクターを用いて宿主細胞を形質転換し、本発明のアナログを産生する。本発明の部分でもある、このような形質転換細胞は、本発明の核酸断片またはベクターを増殖させるのに用いるか、または本発明のアナログの組換え産生に用いる培養細胞または細胞ラインであり得る。代わりに、形質転換細胞は、アナログの分泌、または細菌の膜もしくは細胞壁への組み込みをもたらすように核酸断片(単一または多コピー)が挿入された、適切な生ワクチン株であり得る。
【0182】
本発明の好ましい形質転換細胞は、細菌(エシェリヒア[たとえばイー・コリ]、バチル
ス(Bacillus) [例えばバチルス・サチリス(Bacillus subtilis)]、サルモネラ、またはマイコバクテリア[好ましくは非病原性の、例えばエム・ボビス ビーシージー]種)、酵母(
サッカロミセス・セレビシエ(Saccharomyces cerevisiae)など)、ならびに原虫のような
微生物である。代わりに、形質転換細胞は真菌、昆虫細胞、植物細胞、または哺乳動物細胞のような多細胞生物に由来する。最も好ましくは、ヒト由来であるが、これは以下の細胞ラインおよびベクターの議論を参照。最近の結果は、出願人の実験室において、市場で入手可能なドロソフィラ・メラノガスター(Drosophila melanogaster)細胞ライン(Invitrogenから入手可能なスナイダー2 (S2)細胞ラインおよびベクター系)の、ポリペプチドの
組換え産生における使用に大きな見込みを示し、したがってこの発現系は特に好ましい。
【0183】
クローニングおよび/または最適化された発現の目的のために、形質転換細胞が本発明の核酸断片を複製することができることが好ましい。核酸断片を発現する細胞は、本発明の好ましい有用な実施形態である;これらは、本発明のアナログの小規模または大規模の製造のために、または非病原性細菌の場合には、生ワクチン中のワクチン構成成分として用いることができる。
【0184】
形質転換細胞により本発明のアナログを製造する場合に、少しも必須ではないが、発現産物が培地中に運び出されるか、または形質転換細胞の表面上にあるかのいずれかが便利である。
【0185】
効果的な産生細胞が同定された場合、それを基礎として、本発明のベクターを有し、修飾されたアミロイド産生ポリペプチドをエンコードする核酸断片を発現する安定な細胞ラインを樹立することが好ましい。好ましくは、この安定な細胞ラインは、本発明のアナログを分泌するか、有し、それによりその精製を促進する。
【0186】
一般に、宿主細胞に影響を与えない種に由来するレプリコンおよび調節配列を含むプラスミドベクターは、宿主と関連して用いる。ベクターは、通常、複製部位とともに、形質転換細胞において表現型の選択を提供し得るマーキング配列を有する。例えば、イー・コリは、イー・コリ種に由来するプラスミド、pBR322を用いて典型的に形質転換される(例
えばBolivarら、1977参照)。pBR322プラスミドは、アンピシリンおよびテトラサイクリン耐性遺伝子を含み、したがって形質転換細胞を同定するのに簡単な手段を提供する。pBR
プラスミド、または他の微生物のプラスミドもしくはファージは、発現のために原核細胞微生物により使用され得るプロモーターをも含まなければならないか、含むように修飾されなければならない。
【0187】
これらのプロモーターは、B-ラクタマーゼ(ペニシリナーゼ)およびラクトースプロモーター系(Changら、1978;Itakuraら、1977;Goeddelら、1979)およびトリプトファン(trp)プロモーター系(Goeddelら、1979;EP-A-0 036 776)を含む組換えDNA構築において、最も一般的に用いられる。これらは最も一般的に用いられるが、他の微生物のプロモーターが発見および使用され、これらの核酸配列に関する詳細が発表され、当業者がそれらをプラスミドベクターと機能的に連結することを可能にする(Siebwenlistら、1980)。原核生物
からのある遺伝子は、人為的な手段による他のプロモーターの付加を必要とすることなく、それ自身のプロモーター配列からイー・コリにおいて効率的に発現することができる。
【0188】
原核生物に加えて、酵母培養のような真核微生物も用いることができ、ここでプロモーターは発現を推進することが可能であるべきである。サッカロミセス・セレビシエ、または通常のパン酵母は、真核微生物中で最も一般的に用いられるが、いくつかのその他の株も、通常、入手可能である。サッカロミセス中での発現には、たとえばプラスミドYRp7が一般的に用いられる(Stinchcombら、1979;Kingsmanら、1979;Tschemperら、1980)。こ
のプラスミドは、トリプトファン中で成長する能力が欠失した酵母の変異株、例えばATCC
No. 44076またはPEP4-1 (Jones、1977)に対して選択マーカーを提供するtrpl遺伝子を予め含む。酵母宿主細胞ゲノムの特徴としてのtrpl障害の存在は、よってトリプトファンの
非存在下での成長により形質転換を検出する、効果的な環境を提供する。
【0189】
酵母ベクター中の適切なプロモーター配列は、3−ホスホグリセレートキナーゼ(Hitzmanら、1980)、またはエノラーゼ、グリセルアルデヒド−3−ホスフェートデヒドロゲナー
ゼ、ヘキソキナーゼ、ピルベートデカルボキシラーゼ、ホスホフラクトキナーゼ、グルコース−6−ホスフェートイソメラーゼ、3−ホスホグリセレートムターゼ、ピルベートキナーゼ、トリオースホスフェートイソメラーゼ、ホスホグルコースイソメラーゼ、およびグルコキナーゼのような他の糖分解酵素(Hessら、1968;Hollandら、1978)のプロモーター
を含む。適切な発現プラスミドの構築において、これらの遺伝子に関連する終結配列は、発現ベクターの発現が所望される配列の3'に連結され、mRNAのポリアデニル化および停止を提供する。
【0190】
成長条件により制御される転写の付加的な利点を有するその他のプロモーターは、アルコールデヒドロゲナーゼ2、イソシトクロムC、酸性ホスファターゼ、窒素代謝に関する分解酵素、および上記のグリセルアルデヒド−3−ホスフェートデヒドロゲナーゼ、ならび
にマルトースおよびガラクトース利用に責任がある酵素のプロモーター領域である。酵母に影響を与えないプロモーター、複製起点および終結配列を含むいずれのプラスミドベクターも適切である。
【0191】
微生物に加えて、多細胞生物由来の細胞の培養も宿主として用いることができる。原則として、そのような細胞培養は、脊椎動物または非脊椎動物培養からのいずれであっても機能し得る。しかしながら、脊椎動物細胞における興味は最大であり、培養(組織培養)での脊椎動物の増殖は、近年、ルーチンの手順となっている(Tissue Culture、1973)。このような有用な宿主細胞ラインの例は、VEROおよびHeLa細胞、チャイニーズハムスター卵巣
(CHO)細胞ラインおよびW138、BHK、COS-7 293、スポドプテラ・フルギペルダ(Spodoptera frugiperda) (SF)細胞(とりわけProtein Sciences、1000 Research Parkway、Meriden
、CT 06450、U.S.A.およびInvitrogenからの完全発現系として市場で入手可能)、ならび
にMDCK細胞ラインである。本発明においては、Invitrogen、PO Box 2312、9704 CH Groningen、The Netherlands から入手可能なS2が特に好ましい細胞ラインである。
【0192】
このような細胞の発現ベクターは、(必要であれば)複製起点、いずれかの必要なリボソーム結合部位とともに、発現される遺伝子の上流に位置するプロモーター、RNAスプライ
ス部位、ポリアデニル化部位、および転写終結配列を通常含む。
【0193】
哺乳動物細胞における使用には、発現ベクター上の制御機能がウイルス材料からしばしば提供される。例えば、一般的に用いられるプロモーターは、ポリオーマ、アデノウイルス2、最も頻繁にはシミアンウイルス40 (SV40) に由来する。SV40ウイルスの初期および
後期プロモーターは、SV40ウイルスの複製起点をも含む断片としてウイルスから簡単にどちらも得られるので、特に有用である(Fiersら、1978)。ウイルスの複製起点中に位置す
るHindIII部位からBglI部位に広がる約250 bpの配列を含むのであれば、より小さいまた
はより大きいSV40断片を用いることもできる。さらに、所望する遺伝子配列と通常関連するプロモーターまたは調節配列を用いることが、このような調節配列が宿主細胞系に影響を及ぼさないのであれば、可能であり、しばしば所望される。
【0194】
複製起点は、SV40またはその他のウイルス(例えばポリオーマ、アデノ、VSV、BPV)に由来するような外来の起点を含むベクターの構築により提供されるか、または宿主細胞の染色体複製機構により提供されるかのいずれかであってよい。ベクターが宿主細胞の染色体に組み込まれる場合、後者がしばしば充分である。
【0195】
有用なアナログの同定
天然に発生するAPPまたはAβの全ての可能な変形または修飾が、天然の形態と交差反応性である動物において抗体を誘発する能力を有するわけではないことは、当業者には明白である。しかしながら、本明細書において論じる免疫学的反応性についての最小の要求を満たす、修飾されたアミロイド産生分子の効率的な標準スクリーンを設定することは困難ではない。よって、
−ペプチド合成または遺伝子工学技術により、アミノ酸配列が動物種のAPPまたはAβのアミノ酸配列中に挿入、欠失、または置換された、本発明の、相互に別個のアナログの組を作成することにより、動物種にとって外来であるT細胞エピトープを含むアミノ酸配列の
組を生じさせるか、または相互に別個のアナログの組をエンコードする核酸断片の組を作成し、
−非修飾APPまたはAβに対して、動物種による抗体産生を誘導する能力について、アナログまたは核酸断片の該組のメンバーを試験し、そして
−種における非修飾APPまたはAβに対する抗体産生を大きく誘導するアナログの組のメンバーを同定して、任意に単離するか、または動物種における非修飾APPまたはAβに対する抗体産生を大きく誘導する核酸断片の組のメンバーによりエンコードされるポリペプチド発現産物を同定して、任意に単離する
ことを含む、非修飾アミロイド産生ポリペプチドが(非免疫原性)自己タンパク質である動物種において、非修飾アミロイド産生ポリペプチドに対する抗体を誘導し得る、修飾されたアミロイド産生ポリペプチドの同定方法を用いることが可能である。
【0196】
この関係において、「相互に別個の修飾されたアミロイド産生ポリペプチドの組」は、例えば上記の基準(例えば円偏光二色性分光分析、NMRスペクトル、および/またはX線回
折パターンとの組合わせ)に基づいて選択された、非同一のアナログの集団である。該組
は、わずかなメンバーのみで構成されていてもよいが、該組は数百のメンバーを含むことができると考えられる。
組のメンバーの試験は、結局インビボで行うことができるが、本発明の目的を提供する修飾された分子の数を狭める、いくつかのインビトロ試験を適用することができる。
【0197】
外来T細胞エピトープを導入する目的がT細胞の助けによりB細胞応答を補助することで
あるので、必要条件は、T細胞増殖がアナログにより誘導されることである。T細胞増殖は、インビトロでの標準化された増殖アッセイにより試験することができる。簡単に、T細
胞が豊富なサンプルを患者から得て、その後培養に維持する。培養されたT細胞を、修飾
された分子で予め処理した患者のAPCに接触させ、そのT細胞エピトープを提示するように加工処理する。T細胞の増殖をモニターし、適切なコントロール(例えば、処理していない天然のアミロイド産生ポリペプチドで処理したAPCと接触させた培養中のT細胞)と比較す
る。代わりに、増殖は、外来T細胞のその認識に応答してT細胞により放出された適切なサイトカインの濃度を測定することにより、測定できる。
【0198】
組のいずれかのタイプの少なくとも1つのアナログが、APPまたはAβに対する抗体産生
を誘導し得ることの可能性を高めると、動物種においてAPPまたはAβと反応し得る抗体産生を大きく誘導する、組のメンバーと、医薬上および免疫学上許容される担体および/または賦形剤および/または希釈剤および/または添加剤と、任意に少なくとも1つの医薬
上および免疫学上許容されるアジュバントとを組合わせて混合することを含む、非修飾のAPCまたはAβが自己タンパク質である場合に、動物種における非修飾のAPCまたはAβに対する抗体を誘導し得る少なくとも1つのアナログを含む、免疫原性組成物を製造すること
が可能である。
【0199】
ポリペプチドの組の上記の試験は、まず、本発明の、相互に別個のいくつかの核酸配列またはベクターを作成し、これらを適切な発現ベクターに挿入し、該ベクターで適切な宿主細胞を形質転換し、本発明の核酸配列の発現をもたらすことにより、適切に行われる。
これらの工程に続いて、発現産物の単離を行うことができる。核酸配列および/またはベクターが、PCRのような分子増幅技術の実施を含む方法によるか、または核酸合成により
作成されることが好ましい。
【0200】
特異的アミロイド産生標的
アルツハイマーに最もしばしば関連するタンパク質である、APP、ApoE4およびタウに加えて、それがADの脳のプラークまたはもつれに直接存在することによるか、ADの進行の危険性の増加との、その明確な遺伝子的関連のいずれかにより、ADと何らかの関連がある、その他のタンパク質が多く列挙される。全てではないとしてもそれらの抗原のほとんどが、上記のAβ、APP、プレセニリンおよびApoE4とともに、本発明のある実施形態において
、推定の標的タンパク質である。これらの推定の標的は、WO 01/62284において、すでに
詳細に議論されている。よって、これらの推定の標的については、ここでは短く言及するのみであり、より詳細な背景の議論は、本明細書に参照として組み込まれるWO 01/62284
に見出すことができる:
α1-アンチキモトリプシン(ACT);α2-マクログロブリン;ABAD (Aβ-ペプチド結合アル
コールデヒドロゲナーゼ);APLP1および−2 (アミロイド前駆体様タンパク質1および−2);AMY117;Bax;Bcl-2;ブレオマイシンヒドロラーゼ;BRI/ABRI;クロモグラニンA;ク
ラステリン/apoJ;CRF (副腎皮質ホルモン放出因子)結合タンパク質;EDTF (内皮由来傷
害性因子);ヘパラン硫酸プロテオグリカン;ヒトコラプシン応答媒介タンパク質−2 (collapsin response mediator protein-2);ハンチントン(ハンチントン病タンパク質);ICAM-I;IL-6;リソソーム関連抗原CD68;P21 ras;PLC-δ1 (ホスホリパーゼC アイソエンザイムδ1);血清アミロイドP成分(SAP);シナプトフィシン;シヌクレイン(α−シヌク
レインまたはNACP);およびTGF-b1 (トランスフォーミング成長因子b1)。
【0201】
ここに記載のAPPまたはAβのダウンレギュレーションの手段および方法は、これらの他のアミロイド産生ポリペプチドのいずれにも対する療法、例えば能動特異的免疫療法と組合わせることができる。
【0202】
アルツハイマー病とは別に、脳のアミロイドアンギオパチーも、本明細書に開示の技術の適切な標的である疾患である。
APPまたはAβに対する免疫方法のほとんどが、天然のAPPまたはAβと交差反応性の抗体を生じさせる免疫化に限定されるべきであることが考えられる。にもかかわらず、アミロイド産生ポリペプチドからのMHCクラスIエピトープを提示する細胞に対するCTL応答の形
態で細胞免疫を誘導することが興味の対象である場合もある−これは、APPまたはAβを産生する細胞の数の減少が深刻な副作用を構成しない場合に、好都合であり得る。CTL応答
が所望される場合、出願人のWO 00/20027の教示を用いることが好ましい。これらの2つの文書の開示は、本明細書に参照として組み込まれる。
【0203】
免疫原担体
賦形剤として働く非免疫原性ポリマー分子、例えば多価の活性化されたポリ−ヒドロキシポリマーに共有結合したB細胞エピトープを提示するか、もしくは含むTヘルパーエピトープまたはAPPもしくはAβを含む分子は、上述のように、免疫学的に適切な部分のみを含むワクチン分子として機能して、それを得ることが可能であり、そして上記で開示の変形dおよびeにおける興味深い実施形態である。乱交雑の、またはいわゆるユニバーサルTヘ
ルパーエピトープは、例えばワクチンへの標的がAPPまたはAβのような自己抗原である場合に用いることができる。さらに、免疫応答を増大させる要素は、賦形剤と共結合することができ、それによりアジュバントとして働くことができる。このような要素は、マンノース、タフトシン、ムラミルジペプチド、CpGモチーフなどであり得る。この場合、ワク
チン産物の、その後のアジュバント処方は不要であり、産物は純水または食塩水中に投与することができるであろう。
【0204】
細胞傷害性T細胞(CTL)エピトープとTヘルパーエピトープとが結合することにより、CTLエピトープが由来する抗原に特異的なCTLを発生することも可能になる。APC、例えばマクロファージの、細胞質ゾルへの生成物の取り込みを促進する要素、例えばマンノースは、CTL−およびT細胞エピトープとともに賦形剤に共結合して、CTL応答を増大させることも
できる。
【0205】
最終生成物中のB細胞エピトープとTヘルパーエピトープ(P2およびP30)との比は、合成
工程におけるこれらのペプチドの濃度を変動させることにより変動することができる。上述したように、免疫原性分子には、例えばマンノース、タフトシン、CpGモチーフまたは
他の免疫刺激物質(本明細書中に記載)を、必要により例えば該物質のアミノ化誘導体を用いて、合成工程中においてカーボネートバッファーにこれらを添加することにより、タグとして付けることができる。
【0206】
不溶性の活性化されたポリヒドロキシポリマーを、APPまたはAβ B細胞エピトープを含むペプチドとTヘルパーエピトープとを結合させるのに用いる場合、上述したように、固
体相合成として行うことができ、最終生成物は洗浄およびろ過により回収して精製することができる。トレシル活性化されたポリヒドロキシポリマーに結合させる要素(ペプチド
、タグなど)は、低いpH、例えばpH4〜5においてポリヒドロキシポリマーに添加すること
ができ、受動拡散により「ゲル」中に均一に分布することが許容される。その後、pHをpH9〜10に向上させて、ペプチド上の第一級アミノ基とタグの、ポリヒドロキシポリマーの
トレシル基への反応を開始することができる。ペプチドと例えば免疫刺激要素とを結合させた後、ゲルを、免疫化に適切なサイズの粒子を形成するように細かくする。
【0207】
このような免疫原は、したがって
a) 少なくとも1つの第一のアミノ酸配列が少なくとも1つのB細胞および/または少なくとも1つのCTLエピトープを含む、APPまたはAβ由来の少なくとも1つの第一のアミノ酸配
列、ならびに
b) 外来Tヘルパー細胞エピトープを含む少なくとも1つの第二のアミノ酸配列
を含み、
少なくとも第一および少なくとも第二のアミノ酸配列のそれぞれは、医薬上許容される、活性化されたポリヒドロキシポリマー担体に結合している。
【0208】
アミノ酸配列がポリヒドロキシポリマーに結合するためには、アミノ酸配列との必要な連結を形成することができる適切な反応性基で、ポリヒドロキシポリマーを「活性化する」ことが通常必要である。
【0209】
「ポリヒドロキシポリマー」の語は、WO 00/05316中と同じ意味を有する、すなわちポ
リヒドロキシポリマーが、この出願中に特異的に述べられているのと全く同じ特徴を有することができることを意図する。よって、ポリヒドロキシポリマーは、水に溶解性または不溶性であり得る(よって、免疫原の製造中において異なる合成工程を必要とする)。ポリヒドロキシポリマーは、天然に発生するポリヒドロキシ化合物および合成ポリヒドロキシ化合物から選択することができる。
【0210】
特定の、好ましいポリヒドロキシポリマーは、アセタン(acetan)、アミロペクチン、ガム寒天(gum agar-agar)、アガロース、アルジネート、アラビアゴム、カレゲナン(carregeenan)、セルロース、シクロデキストリン、デキストラン、フルセララン(furcellaran)
、ガラクトマンナン、ゼラチン、ガッティ(ghatti)、グルカン、グリコーゲン、グアー、カラヤ(karaya)、コンジャク/A (konjac/A)、ローカストビーンガム、マンナン、ペクチ
ン、オオバコ、プルラン、スターチ、タマリン、トラガカント、ザンサン、キシラン、お
よびキシログルカンから選択される多糖類である。デキストランが特に好ましい。
【0211】
しかしながら、ポリヒドロキシポリマーは、高度に分岐したポリ(エチレンイミン) (PEI)、テトラチエニレン ビニレン(tetrathienylene vinylene)、Kevlar (長鎖ポリパラフェニルテレフタルアミド)、ポリ(ウレタン)、ポリ(シロキサン)、ポリジメチルシロキサ
ン、シリコン、ポリ(メチルメタクリレート) (PMMA)、ポリ(ビニルアルコール)、ポリ(ビニルピロリドン)、ポリ(2-ヒドロキシエチルメタクリレート)、ポリ(N-ビニルピロリドン)、ポリ(ビニルアルコール)、ポリ(アクリル酸)、ポリテトラフルオロエチレン(PTFE)、
ポリアクリルアミド、ポリ(エチレン−酢酸ビニル) (Poly(ethylene-co-vinyl acetate))、ポリ(エチレングリコール)および誘導体、ポリ(メタクリル酸)、ポリラクチド(PLA)、
ポリグリコリド(PGA)、ポリ(ラクチド−グリコリド) (Poly(lactide-co-glycolides)) (PLGA)、ポリ無水物、ならびにポリオルトエステルから選択することもできる。
【0212】
問題の(すなわち活性化前)ポリヒドロキシポリマーの(重量)平均分子量は、典型的に、少なくとも2,000のような少なくとも1,000、好ましくは2,500〜2,000,000の範囲、より好ましくは3,000〜1,000,000の範囲、特に5,000〜500,000の範囲である。実施例において、平均分子量が10,000〜200,000の範囲であるポリヒドロキシポリマーが特に有利であるこ
とが示されている。
【0213】
ポリヒドロキシポリマーは、室温において、少なくとも10 mg/ml、好ましくは、少なくとも50 mg/mlのような少なくとも25 mg/ml、特に、少なくとも150 mg/mlのような少なく
とも100 mg/mlの範囲で水溶性であることが好ましい。デキストランは、本明細書に記載
のように活性化されても、水溶性に関しての要件を満足することが知られている。
【0214】
最も興味深いポリヒドロキシポリマーのいくつかについて、活性化されていないポリヒドロキシポリマー(すなわち活性前の天然のポリヒドロキシポリマー)のC(炭素原子)とOH
基(ヒドロキシ基)との間の比は、1.5〜2.3のような1.3〜2.5、好ましくは1.6〜2.1、特に1.85〜2.05の範囲内である。いずれの特定の理論に拘束されることなく、活性化されていないポリヒドロキシポリマーのC/OH比のようなものは、親水性の非常に有利なレベルを示すと考えられる。ポリビニルアルコールおよび多糖類は、この要件を満足するポリヒドロキシポリマーの例である。活性化の比がやや低いが、上記の比は、活性化されたポリヒドロキシポリマーについてほぼ同様であると考えられる。
【0215】
「ポリヒドロキシポリマー担体」の語は、アミノ酸配列を有する免疫原の部分を意味することを意図する。一般的な規則として、ポリヒドロキシポリマー担体は、ペプチダーゼによりアミノ酸配列が切断され得る外側の境界を有し、例えば抗原提示細胞ではそれは免疫原を加工処理する。よって、ポリヒドロキシポリマー担体は、活性化基を有するポリヒドロキシポリマーであることが可能であり、そこで活性化基とアミノ酸配列との間の結合がAPCにおいてペプチダーゼにより切断されるか、またはポリヒドロキシポリマー担体は
、活性化基および例えば単一のL-アミノ酸もしくはいくつかのD-アミノ酸のようなリンカーを有するポリヒドロキシポリマーであることが可能であり、そこでリンカーの最後の部分がアミノ酸配列に結合し、APCにおいてペプチダーゼに切断される。
【0216】
上述したように、ポリヒドロキシポリマーは、担体にペプチドをつなぎとめることを促進する官能基(活性化基)を有する。当該技術において広い範囲の適用可能な官能基が知られており、例えばトレシル(トリフルオロエチルスルホニル)、マレイミド、p-ニトロフェニルクロロホルメート、シアノゲンブロミド、トシル(p-トルエンスルホニル)、トリフリル(トリフルオロメタンスルホニル)、ペンタフルオロベンゼンスルホニルおよびビニルスルホン基である。本発明に含む官能基の好ましい例は、トレシル、マレイミド、トシル、トリフリル、ペンタフルオロベンゼンスルホニル、p-ニトロフェニルクロロホルメートお
よびビニルスルホン基であり、これらのうちトレシル、マレイミドおよびトシル基が特に適切である。
【0217】
トレシル活性化されたポリヒドロキシポリマーは、トレシルクロライドを用いて、WO 00/05316の実施例1のデキストランの活性化について記載のようにするか、またはGregoriusら、J. Immunol. Meth. 181 (1995) 65〜73に記載のようにして製造することができる。
【0218】
マレイミド活性化されたポリヒドロキシポリマーは、p-マレイミドフェニルイソシアネートを用いて、WO 00/05316の実施例3のデキストランの活性化について記載のようにして製造することができる。代わりに、トレシル活性化されたポリヒドロキシポリマー(トレ
シル活性化デキストラン(TAD)のような)を、過剰の例えば1,3-ジアミノプロパンのようなジアミン化合物(通常、H2N-CnH2n-NH2、ここでnは1〜20、好ましくは1〜8)で派生させ、
その後、TADに導入されたアミノ基をスクシンイミジル4-(N-マレイミドメチル)シクロヘ
キサン-1-カルボキシレート(SMCC)、スルホ-スクシンイミジル4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレート(スルホ-SMCC)、スクシンイミジル4-(p-マレイミドフ
ェニル)ブチレート(SMPB)、スルホ-スクシンイミジル4-(p-マレイミドフェニル)ブチレート(スルホ-SMPB)、N-γ-マレイミドブチリルオキシ-スクシンイミドエステル(GMBS)また
はN-γ-マレイミドブチリルオキシ-スルホスクシンイミド エステルのような試薬と反応させることにより、デキストランのようなポリヒドロキシポリマーにマレイミド基を導入することができる。活性化についての異なる試薬および経路により、マレイミド官能基と、活性化が行われる親のヒドロキシ基の残りの部分との間の結合に関して、形式的にわずかに異なるマレイミド活性化された産物となるが、全ておよびそれぞれが「マレイミド活性化されたポリヒドロキシポリマー」と考えられる。
【0219】
トシル活性化されたポリヒドロキシポリマーは、トシルクロライドを用いて、WO 00/05316の実施例2のデキストランの活性化について記載のようにして製造することができる。トリフリルおよびペンタフルオロベンゼンスルホニル活性化ポリヒドロキシポリマーは、トシルまたはトレシル活性化アナログとして、例えば対応する酸塩化物を用いることにより製造される。
【0220】
シアノゲンブロミド活性化されたポリヒドロキシポリマーは、従来の方法を用いてポリヒドロキシポリマーをシアノゲンブロミドと反応させることにより製造することができる。得られる官能基は、通常、ポリヒドロキシポリマーの2つのヒドロキシ基とのシアネー
トエステルである。
【0221】
活性化の程度は、遊離のヒドロキシ基と活性化基(すなわち機能化されたヒドロキシ基)との間の比で表すことができる。ポリヒドロキシポリマーの遊離のヒドロキシ基と活性化基との間の比は、ポリヒドロキシポリマーの親水性および反応性の間の有利なバランスを得るために、250:1〜4:1の間であるべきであると考えられる。好ましくは、比が100:1〜6:1の間、より好ましくは60:1〜8:1の間、特に40:1〜10:1の間である。
【0222】
本発明による一般的に適用可能な免疫原の製造方法において用いる、特に興味深い活性化されたポリヒドロキシポリマーは、トレシル、トシルおよびマレイミド活性化された多糖、特にトレシル活性化されたデキストラン(TAD)、トシル活性化されたデキストラン(TosAD)、およびマレイミド活性化されたデキストラン(MAD)である。
【0223】
ポリヒドロキシポリマー担体とそこに結合するアミノ酸配列との間の結合は、例えばAPCにおける抗原の加工処理において活性なペプチダーゼのようなペプチダーゼにより切断
可能であることが好ましい。したがって、少なくとも第一および少なくとも第二のアミノ酸配列がアミド結合またはペプチド結合を介して活性化されたポリヒドロキシポリマー担
体に結合することが好ましい。少なくとも第一および少なくとも第二のアミノ酸配列のそれぞれが、窒素原子部分にそれぞれのアミノ結合を提供することが特に好ましい。
【0224】
ポリヒドロキシポリマー担体は、アミノ酸残基を実質的に有さず、活性化基がペプチダーゼ切断可能結合の部分を提供することを必要とするが、上述したように、担体が少なくとも1つのL-アミノ酸を含むスペーサーを単純に含んでいてもよい。にもかかわらず、少
なくとも第一および少なくとも第二のアミノ酸配列は、アミノ酸配列のN末端における窒
素原子を介して活性化されたバージョンのポリヒドロキシポリマーに、通常、結合する。
【0225】
上述の、本発明の一般的に適用可能な免疫原は、本質的に、ポリペプチドワクチンについて本明細書において記載したような免疫化方法において用いることができる。すなわち、本明細書において論じたアミロイド産生ポリペプチドのダウンレギュレーションのためのポリペプチドワクチンの投与量、投与形態および処方に関する全ての開示は、必要な変更を加えて、一般的に適用可能な免疫原に適用する。
【0226】
一般的に適用可能な、安全なワクチン化技術
上述したように、本発明のある好ましい実施形態は、アミロイド産生ポリペプチドに対する免疫応答を推進するであろう自己由来THエピトープを提供することができないアミロイド産生ポリペプチドの変形の使用を包含する。
【0227】
しかしながら、抗−自己ワクチンを設計するため、および抗−自己免疫をもたらすためのこのストラテジーは、それ自体で発明な、一般的に適用可能な技術であると本発明者らは考える。ダウンレギュレーションしようとする自己抗原が体内で充分に豊富であるので免疫応答の自己刺激が起こることが可能になる場合に、特に適することを証明するべきである。したがって、本実施形態の上記の全ての開示は、APCまたはAβに対する抗−自己免疫応答の供給に関する範囲の限りでは、必要な変更を加えて、他の自己ポリペプチドに対する免疫化に適用し、特にそれらに対して充分な量で存在して、制御されない自己免疫状態の形態において免疫応答を維持するものに適用する。なぜなら、適切な自己ポリペプチドの自己THエピトープは、免疫応答を推進しているからである。
【実施例】
【0228】
実施例1
ADに対する免疫化のための自己ワクチン化アプローチ
Aβタンパク質ノックアウトマウスがいずれの異常または悪い副作用を示さないという
事実は、Aβの除去もしくは量の減少が安全であることを示唆する、Zheng H. (1996)。
【0229】
トランスジェニック動物がトランスジェニックヒトAβタンパク質に対して免疫化され
た、発表された実験は、自己寛容を破壊することができれば、自己反応性抗体によりAβ
のダウンレギュレーションを得ることができることを示唆する。これらの実験は、このようなAβのダウンレギュレーションがプラークの形成を防止し、すでに形成されたAβプラークを脳から除去することの両方を行うであろうことをさらに示唆する、Schenkら(1999)参照。しかし、伝統的に、自己タンパク質に対する抗体を産生することは可能ではない。
【0230】
したがって、発表されたデータは真の自己タンパク質に対する真の自己寛容を破壊する手段を提供しない。免疫応答が、それが必要であると考えられる場合に、細胞膜結合Aβ
前駆体タンパク質(APP)に対してではなく、Aβ沈着にのみ、または主にそれに対して向けられていることをどのように確実にするかについての情報を提供するデータをも提供しない。現存する技術を用いて発生させた免疫応答は、制御されない方法で自己タンパク質に対する免疫応答をおそらく発生するであろうから、Aβタンパク質の部分に対する不要な
過剰の自己反応性が発生するであろう。よって、現存する免疫化ストラテジーを用いることは、自己タンパク質に対する強い免疫応答を発生することができないようであり、さら
にCNS中の多数の細胞上に存在する膜結合APPに対する強い交差反応性の可能性のために、安全ではない。
【0231】
本発明は、CNSまたは体内のその他の区画中においてプラークを形成し、深刻な疾患の
原因となる可能性がある真の自己タンパク質に対する、強い制御された免疫応答を効率的に発生させる手段を提供する。安全で効果的なヒトAβタンパク質の治療ワクチンは、AD
の治療のために、この技術を用いて開発される。
【0232】
これに鑑みて、次世紀の健康管理システムを損なうと予想される疾患であるADが治癒され、記載されたようなワクチンが、この疾患の症状の治療および進行に効果的な治療上のアプローチを少なくとも構成することができることを予測することが可能である。この技術は、ADおよび他の神経疾患におけるアミロイド沈着をブロックする、全く新しい免疫学的アプローチを表す。
【0233】
以下の表では、35の企画された構築物を示す。表中に示された全ての位置は、APPの開
始のメチオニン(SEQ ID NO: 2中の最初のアミノ酸)に関するものであり、開始および終了のアミノ酸の両方を含み、例えば672〜714断片は、アミノ酸672および714の両方を含む。P2およびP30についての開始および終了の位置は、エピトープが示された位置でAPP断片の部分を置換する(両方の位置が置換に含まれる)ことを示す−ほとんどの構築物においては、導入されたエピトープは、エピトープの長さの断片を置換する。表中のアステリスクは次の意味を有する:
*) P2およびP30のただ1つの位置は、示された位置においてエピトープがAPP誘導体に挿入されたことを示す(エピトープは、与えられた位置のC末端側に近接したアミノ酸から開始する)。
**) 構築物34は、それぞれP30およびP2により分離された3つの同一のAPP断片を含む。
***) 構築物35は、P30およびP2エピトープを変化させることにより分離された9つの同一
のAPP断片を含む。
【0234】
【表1】

【0235】
それに対して応答を発生するのが最も興味深いAPPの部分は、ADの脳におけるアミロイ
ドプラークの主要な構成物である、43アミノ酸のAβコアペプチド(Aβ-43、SEQ ID NO: 2の残基672〜714に相当)である。このAPP断片は、上で列挙した全ての構築の部分である。
【0236】
変形1および2は、モデルエピトープであるP2およびP30が位置する、Aβ-43の上流のAPP部分を含む。変形1および3〜8の全ては、神経毒性であることが示されているC-100断片を含む−C-100断片は、SEQ ID NO: 2のアミノ酸残基714〜770に相当する。変形3〜5におい
て、エピトープはC-100断片の部分を置換しているが、変形6〜8ではC-100に挿入されている。
【0237】
変形9〜35は、コアAβ-43タンパク質のみを含む。変形9〜13では、P2およびP30がAβ-43のいずれかの末端に融合されている;14〜21では、P2およびP30がAβ-43の部分を置換している;22〜33においては、P2およびP30がAβ-43中に挿入されている;34は、それぞれP30およびP2により間隔が置かれた3つの同一のAβ-43断片を含む;35は、交互のP2およびP30エピトープにより間隔が置かれた9つのAβ-43の繰返しを含む。
【0238】
上記で論じたAβ-43タンパク質のトランケーテッド部分も、本発明の免疫原性アナログに用いることができる。特に好ましくは、トランケートAβ(1〜42)、Aβ(1〜40)、Aβ(1
〜39)、Aβ(1〜35)、Aβ(1〜34)、Aβ(1〜34)、Aβ(1〜28)、Aβ(1〜12)、Aβ(1〜5)、A
β(13〜28)、Aβ(13〜35)、Aβ(17〜28)、Aβ(25〜35)、Aβ(35〜40)、Aβ(36〜42)およ
びAβ(35〜42)である(カッコ内の番号は、適切な断片を構築するAβ-43のアミノ酸範囲を示す−Aβ(35〜40)は、例えばSEQ ID NO: 2のアミノ酸706-711と同一である)。Aβ-43の
トランケーテッド部分を有するこれらの全ての変形は、本明細書に記載のAβ断片、特に
変形9、10、11、12および13を用いて作成することができる。
【0239】
Aβ-43またはその断片は、変異していることが好ましい場合がある。特に好ましくは、Aβ-43の位置35のメチオニンが、好ましくはロイシンもしくはイソロイシンで置換されているか、または単純に欠失されている置換変形である。特に好ましいアナログは、アミロイド産生ポリペプチドもしくは外来THエピトープ中に天然に発生したか、または挿入されたかもしくは付加されたかのいずれかの理由により、C末端に位置する単一のメチオニン
を含む。よって、外来THエピトープを含むアナログの部分が、C末端に位置する可能性が
あるメチオニンを除いて、メチオニンを有さないことも好ましい。
【0240】
実際に、本発明により用いられるAPPまたはAβの全てのアナログが、アナログ中のC末
端アミノ酸として位置する単一のメチオニンを単に含み、そしてアミロイド産生ポリペプチドもしくは外来THエピトープのいずれにある他のメチオニンが欠失しているか、または他のアミノ酸に置換されているかという特徴を共有することが、一般的に好ましい。
【0241】
さらに興味深いある変異は、Aβ-43の位置19でのフェニルアラニンの欠失または置換であり、該変異がこのフェニルアラニン残基のプロリンへの置換であることが特に好ましい。
【0242】
次の表は、Aβ-43のトランケートまたは変異とともに働く特に好ましい構築物の群を示す:
【0243】
【表2】

【0244】
この表において、分子中で用いたAβセグメントは、Aβ(1-42/43)分子のアミノ酸1 (aa
1)に対するアミノ酸番号で示し、すなわち1〜28は、Aβ(1-42/43)の断片1〜28を分子中
において用いることを意味する。2つ以上の異なるセグメントを用いる場合、両方を表中
に示し、すなわち1〜12 (a) + 13〜28 (b)は、Aβ(1-42/43)の断片1〜12および断片13〜28の両方を分子中において用いることを意味する。
【0245】
また、同じセグメントが構築物において1以上のコピーで存在する場合、表中に示し、
すなわち1〜12 (×3)は、Aβ(1-42/43)の断片1〜12が構築物中において3コピーで存在す
ることを示す。
【0246】
さらに、分子中のAβセグメントの位置は、分子の最初のアミノ酸に対するアミノ酸の
位置により示し、すなわち22〜49は、問題のAβ断片が、分子のアミノ酸22からアミノ酸49に、両方の位置を含んで位置することを示す。P2およびP30エピトープの位置は、同等に示される。分子中で2つ以上のAβ断片を用いる場合、その位置を全て示し、すなわち1〜12 (a) + 49〜64 (b)は、断片(a)が分子中のアミノ酸1〜12に位置し、断片(b)がアミノ酸49〜64に位置することを示す。
【0247】
さらに、同じ断片の1つ以上のコピーが分子中に存在する場合、全てのコピーの位置を
示し、すなわち1〜12、34〜45、61〜72は、Aβ断片の3つのコピーが分子中に、それぞれ
位置1〜12、34〜45および61〜72に位置することを示す。
【0248】
最後に、各分子の全長の表示は、Aβ断片ならびにP2およびP30エピトープの両方を含む。
【0249】
変形42は、Aβ断片を示す欄に示すように、位置19 (pheからpro)および35 (metからlys)における2つのアミノ酸置換を含む。
【0250】
外来T細胞エピトープの導入のための特定の点の詳細については、図1および上記の表を参照。
【0251】
さらに、あるタイプの構築物が特に好ましい。本発明の目的の一つが、Aβの除去が望
まれる場合にAPPを産生する細胞の破壊を回避することであるので、APP中に存在する場合に細胞外の相に露出しない自己ワクチン構築物を製造することが可能であると考えられる。したがって、このような構築物は、SEQ ID NO: 2のアミノ酸700〜714により定義されるアミノ酸断片に由来する少なくとも1つのB細胞エピトープを含むことが必要であろう。このような短いポリペプチド断片は弱い免疫原性のみであることが予想されるので、このような自己ワクチン構築物はB細胞エピトープのいくつかのコピーからなることが好ましく
、すなわち本発明の詳細な開示における式Iに示す構造を有する構築物の形態であり、上
記を参照。式Iのこのバージョンにおいて、アミロイドe1〜アミロイドexの語は、SEQ ID NO: 2のアミノ酸700〜714に由来するアミノ酸配列を含む、x個のB細胞エピトープである
。好ましい代案は、多糖類担体分子への、アミド結合を介したアミロイド産生(ポリ)ペプチドおよび選択された外来Tヘルパーエピトープの結合の、上記で説明した可能性である
−これにより、SEQ ID NO: 2のアミノ酸700〜714により構築される「弱い」エピトープの多数の提示が可能になり、B細胞およびT細胞エピトープの間の最適な比を選択することも可能になる。
【0252】
実施例2
Aβおよび本発明の修飾タンパク質を用いたトランスジェニックマウスの免疫化
hAB43+-34をエンコードするDNAの構築。hAB43+-34遺伝子をいくつかの工程で構築した
。まず、プライマーME#800 (SEQ ID NO: 9)を鋳型として用いて、プライマーME#801 (SEQ
ID NO: 10)およびME#802 (SEQ ID NO: 11)とともにPCR断片をつくった。ME#800は、イー・コリ最適コドンとともにヒトAβ-43断片をエンコードする。ME#801および802は、断片
に適切な制限部位を付加する。
【0253】
PCR断片を精製し、NcoIおよびHindIIIで消化し、再び精製して、NcoI-HindIIIで消化して精製したpET28b+イー・コリ発現ベクターにクローン化した。野生型ヒトAβ-43をエン
コードする、得られたプラスミドをpAB1と名付けた。
【0254】
次の工程では、Tヘルパーエピトープ、P2を分子のC末端に付加する。プライマーME#806
(SEQ ID NO: 12)は、P2エピトープをエンコードする配列を含み、よってPCR反応によりP2およびAβ-43の融合体を発生する。
【0255】
クローニングは、pAB1を鋳型として用いて、プライマーME#178 (SEQ ID NO: 8)およびME#806とともにPCR断片を作成することにより行った。断片を精製し、NcoIおよびHindIII
で消化し、再び精製して、NcoI-HindIIIで消化して精製したpET28b+ベクターにクローン
化した。得られたプラスミドをpAB2と呼ぶ。
【0256】
類似の方法において、他のTヘルパーエピトープ、P30がN末端に付加されたAβ-43をエ
ンコードする配列を有する、他のプラスミドを作成した。これは、pAB1を鋳型として用いて、プライマーME#105 (SEQ ID NO: 7)およびME#807 (SEQ ID NO: 13)とともにPCR断片を作成することにより行った。
断片を精製し、NcoIおよびHindIIIで消化し、再び精製して、NcoI-HindIIIで消化して
精製したpET28b+ベクターにクローン化した。得られたプラスミドをpAB3と呼ぶ。
【0257】
第三の工程において、プライマーME#809 (SEQ ID NO: 14)により、プラスミドpAB2のP2エピトープのC末端に第二のAβ-43リピートを付加する。ME#809は、Aβ-43リピートの直
後に、BamHI部位を同時に創る。PCR断片を、pAB2を鋳型として用いてプライマーME#178およびME#809とともに作成した。断片をNcoIおよびHindIIIで消化し、精製して、NcoI-HindIIIで消化して精製したpET28b+ベクターにクローン化した。得られたプラスミドをpAB4と名付ける。
【0258】
最後に、pAB3からの、P30エピトープ−Aβ-43リピート配列をpAB4プラスミドにクロー
ン化した。これは、pAB3を鋳型として用いて、プライマーME#811 (SEQ ID NO: 16)およびME#105とともにPCR断片を作成することにより行った。該断片を精製し、 pAB3を鋳型として用いる、その後のME#810 (SEQ ID NO: 15) とのPCRにおいてプライマーとして用いた。得られた断片を精製し、BamHIおよびHindIIIで消化し、BamHI-HindIIIで消化して精製し
たpAB4プラスミドにクローン化した。得られたプラスミド、pAB5は、hAB43+-34分子をエ
ンコードする。
【0259】
全てのPCRおよびクローニング手順は、Sambrook, J.、Fritsch, E.F.およびManiatis, T. 1989 "Molecular cloning: a laboratory manual"、第2版、Cold Spring Harbor Laboratory、N.Yに実質的に記載のようにして行った。
全てのクローニング手順において、イー・コリK-12細胞、Top-10 F'株(Stratagene、USA)を用いた。pET28b+ベクターは、Novagen、USAから購入した。すぺてのプライマーは、DNA Technology、Denmarkにおいて合成した。
【0260】
hAB43+-34の発現と精製。pAB5によりエンコードされるhAB43+-34タンパク質を、pET28b+システム(Novagen)の供給業者により記載されたようにしてBL21-Gold (Novagen)イー・
コリ細胞において発現した。
【0261】
発現したhAB43+-34タンパク質を、封入体を洗浄し、その後、6 M尿素存在下にBioCad精製ワークステーション(PerSeptive Biosystems、USA)を用いて、カチオン交換クロマトグラフィーを行うことにより、85%を超える純度に精製した。その後、減少した量の尿素を
含む溶液に対して段階的に透析を行うことにより、尿素を除去した。最終バッファーは、10 mM Tris、pH 8.5であった。
【0262】
免疫化研究。ヒトAPP(アルツハイマーの前駆体タンパク質)へのマウストランスジェニ
ックを、研究に用いた。TgRND8+と呼ばれるこれらのマウスは、マウスの脳においてAβ-40およびAβ-42の高い濃度となるAPPの変異形態を発現する(Janus, C.ら)。
【0263】
マウス(群あたり8〜10匹のマウス)を、Aβ-42 (SEQ ID NO: 2、残基673〜714、標準Fmocストラテジーにより合成)またはhAB43+-34変形(実施例1の表中の構築物34、組換え的に
製造)のいずれかで、2週間間隔で4回免疫した。投与量は、Aβについて100 mgまたはhAB43+-34について50 mgのいずれかであった。43日目(3回の注射後)および52日目(4回の注射
後)にマウスの血を採取し、血清を、直接Aβ-42 ELISA を用いて抗-Aβ-42特異的力価の
レベルを測定するのに用いた。
以下の表は、平均の相対的抗-Aβ-42力価を示す。
【0264】
【表3】

【0265】
明らかに、hAB43+-34 Aβ変形で免疫して得られた抗体力価は、変化していない野生型Aβ-42を抗原として用いて得られた力価より、3および4免疫化後で、それぞれ約4倍および7.5倍高い。免疫化に用いた変形の量が、免疫に用いた野生型配列の量の50%のみであった場合に、この事実は、さらに正しい相関関係におかれる。
【0266】
実施例3
架橋剤として活性化されたポリヒドロキシポリマーを用いた、Aβペプチドコポリマーワ
クチンの合成。
導入。伝統的なコンジュゲートワクチンは、担体タンパク質に共有的に結合した(ポリ)ペプチドからなる。ペプチドはB細胞エピトープを含み、担体タンパク質はTヘルパーエピトープを提供する。しかしながら、担体タンパク質のほとんどは、全配列のわずかな部分しか適切なTヘルパーエピトープを含まないので、通常、Tヘルパーエピトープの起源として適切ではない。このようなエピトープは、例えば12〜15アミノ酸のペプチドとして定義され、合成され得る。これらのペプチドが、例えば多価活性化されたポリヒドロキシポリマーを介してB細胞エピトープを含むペプチドに共有的に結合する場合、適切な部分のみ
を含むワクチン分子を得ることができる。B細胞およびT細胞エピトープの間の最適化された比を含むワクチンコンジュゲートを提供することも、さらに可能である。
【0267】
活性化されたポリヒドロキシポリマーの合成。デキストラン、スターチ、アガロースなどのポリヒドロキシポリマーは、N-メチルピロリジノン(NMP)中に溶解した均質合成(デキストラン)か、または例えばアセトン中における不均質合成(スターチ、アガロース、架橋デキストラン)のいずれかにより、2,2,2-トリフルオロエタンスルホニル クロライド(トレシルクロライド)とともに活性化することができる。
【0268】
乾燥N-メチルピロリジノン(NMP) 225 mlを、乾燥条件下に、攪拌のための磁石を備えた500 ml丸底フラスコ中の凍結乾燥した水溶性デキストラン(4.5 g、83 mmol、臨床グレー
ド、Mw(平均) 78000)に添加する。フラスコを磁石で攪拌しながら60℃の油浴中におく。
温度を20分間かけて92℃に上昇させる。デキストランが溶解したら、フラスコを油浴中から直ちに出し、浴中の温度を40℃に下げる。フラスコをさらに磁石で攪拌しながら再び油浴中におき、トレシルクロライド(2.764 ml、25 mmol)を滴下する。15分後、乾燥ピリジ
ン(無水、2.020 ml、25 mmol)を滴下する。フラスコを油浴から出し、室温で1時間攪拌する。生成物(トレシル活性化デキストラン、TAD)を、冷エタノール(99.9%) 1200 ml中で沈殿させる。
【0269】
上清を移し、2000 rpm での遠心分離により、沈殿物を50 mlのポリプロピレンチューブに回収する。沈殿物を0.5%酢酸50 mlに溶解し、0.5%酢酸5000 mlに対して2回透析して、
凍結乾燥する。TADは、凍結乾燥粉末として-20℃で保存できる。
【0270】
アガロースや架橋デキストランのような不溶性ポリヒドロキシポリマーは、例えばアセトン中にポリヒドロキシポリマーの懸濁液をつくり、固相合成としての合成を行うことによりトレシル活性化することができる。活性化ポリヒドロキシポリマーは、ろ過により回収することができる。適切な方法は、例えばNilsson KおよびMosbach K (1987)、Methods
in Enzymology 135、p. 67、ならびにHermansson GTら(1992)、"Immobilized Affinity Ligand Techniques"、Academic Press, Inc.、p. 87に報告されている。
【0271】
Aβペプチドコポリマーワクチンの合成。TAD (10 mg)をH2O 100μlに溶解し、Aβ-42 (SEQ ID NO: 2、残基673〜714) 5 mg、P2 (SEQ ID NO: 4) 2.5 mgおよびP30 (SEQ ID NO: 6) 2.5 mgを含むpH 9.6のカーボネートバッファー1000μlを添加する。Aβ-42 ならびにP2およびP30ペプチドは全て、保護されたリシン基を含む:これらは、1-(4,4-ジメチル-2,6-ジシクロヘキシ-1-イリデン)エチル (Dde)保護リシン基の形態にある。ペプチドを標準Fmocストラテジーにより製造するが、ここで、従来のFmoc-Lys(Boc)-OHをFmoc-Lys(Dde)-OH (Novabiochemより入手、カタログ番号04-12-1121)で置換し、すなわちリシンのε-ア
ミノ基がBoc の代わりにDdeで保護される。
【0272】
pHの値を測定し、1 M HClを用いて9.6に合わせる。室温にて2.5時間後、80%溶液からのヒドラジンを最終ヒドラジン濃度8%まで添加し、溶液をさらに室温にて30分間インキュベ
ートし、その後、直ちに凍結乾燥する。凍結乾燥した生成物をH2Oに溶解し、最終の凍結
乾燥の前に、H2Oに対して延長して透析する。
【0273】
最終生成物中のB細胞エピトープ(Aβ)およびT細胞エピトープ(P2およびP30)の間の比は、合成工程において異なる濃度のこれらのペプチドを用いることにより、変動させることができる。さらに、最終産物は、合成工程においてカーボネートバッファーにアミノ化マンノースを添加することにより、例えばマンノース(APCへのコンジュゲートを標的とするように)でタグを付加することができる。
【0274】
不溶性の活性化されたポリヒドロキシポリマーを、B細胞エピトープを含むペプチドお
よびT細胞エピトープを結合するのに用いる場合、ポリマーへの結合は、固相合成として
行うことができ、最終産物は洗浄およびろ過により回収して精製する。
【0275】
一般的な説明において言及したように、ペプチドベースのワクチンを製造する今回記載のアプローチは、全く合成のペプチドワクチンを製造するのが便利である場合、および問題のポリペプチド抗原が単一のペプチドにおいて充分な免疫原性を提供する場合に、いずれの他のポリペプチド抗原にも適用することができる。
【0276】
実施例4
合成ペプチドコポリマーワクチン
TAD (10 mg)をH2O 100μlに溶解し、ペプチドA (興味のあるいずれの免疫原性ペプチド) 1〜5 mg、P2 (ジフテリアトキソイドP2エピトープ) 1〜5 mg およびP30 (ジフテリアトキソイドP30エピトープ) 1〜5 mgを含むpH 9.6のカーボネートバッファー1000μlを添加
する。pHの値を測定し、0.1 M HClを用いて9.6に合わせる。室温にて2.5時間後、溶液を
その後直ちに凍結乾燥する。凍結乾燥した生成物をH2Oに溶解し、最終の凍結乾燥の前に
、H2Oに対して延長して透析するか、またはゲルろ過カラム上で脱塩する。ペプチドが配
列中にリシンを有する場合、リシン側鎖中のε-アミンを、合成中にFmoc-Lys(Dde)-OH 誘導体を用いてDdeにより保護するべきである (GregoriusおよびTheisen 2001、提出済み)
。結合後、80%溶液からのヒドラジンを最終ヒドラジン濃度1〜20%まで添加し、溶液を室
温にてさらに30分間インキュベートし、その後、直ちに凍結乾燥し、最終の凍結乾燥の前に、H2Oに対して延長して透析するか、またはゲルろ過カラム上で脱塩する。原理を図2の概略図に示す。
【0277】
このような免疫原は、「ペプチドA」としてのボレリア・ブルゴドルフェリのタンパク
質OspCの短いC末端断片、およびペプチドBとしてのジフテリアトキソイドエピトープ(P2
またはP30)とともに、本発明者らにより用いられている。この抗原による免疫化研究の結果は、OspC断片およびワクチン化したマウスのMHCハプロタイプに適合する外来ジフテリ
アエピトープを含む、本発明の抗原だけが、これらのマウスにおいてOspCに反応性の抗体を誘導することが可能であったことを明らかにした。これに対して、OspCペプチドのみを含む分子は、抗体産生を誘導することができず、また、一方がOspCを含み、他方がエピトープを含む、2の免疫原の混合物についても同様であった。よって、本質的でないとして
も、OspCのような短いペプチドハプテンに対する抗体産生を誘導するために、同じポリヒドロキシポリマー担体への包含がより優れていると結論付ける。
【0278】
参考文献のリスト
Brookmeyer, R.;Gray, S.;Kawas, C. (1998). Projections of Alzheimer's Disease
in the United States and the Public Health Impact of Delaying Disease Onset. American Journal of Public Health、88(9)、1337〜1342。
Buttini, M.;Orth, M.;Bellosta, S.;Akeefe, H.;Pitas, R.E.;Wyss Coray, T.;Mucke, L.;Mahley, R.W. (1999). Expression of Human Apolipoprotein E3 or E4 in t
he Brains of Apoe-/- Mice: Isoform Specific Effects on Neurodegeneration. Journal of Neuroscience、19、4867〜4880。
【0279】
Clark, L.N.;Poorkaj, P.;Wszolek, Z.;Geschwind, D.H.;Nasreddine, Z.S.;Miller, B.;Li, D.;Payami, H.;Awert, F.;Markopoulou, K.;Andreadis, A.;D'Souza, I.;Lee, V.M.;Reed, L.;Trojanowski, J.Q.;Zhukareva, V.;Bird, T.;Schellenberg, G.;Wilhelmsen, K.C. (1998). Pathogenic Implications of Mutations in the Tau Gene in Pallido Ponto Nigral Degeneration and Related Neurodegenerative Disorders Linked to Chromosome 17. Proceedings of the National Academy of Sciences U.S.A.、95(22)、13103〜13107。
Gupta, R. K.ら(1998)、Dev Biol Stand. 92:63〜78。
【0280】
Hsiao K.ら(1998) Transgenic mice expressing Alzheimer amyloid precursor proteins"、Exp. Gerontol. 33 (7〜8)、883〜889
Hutton, M.;Lendon, C.L.;Rizzu, P.;Baker, M.;Froelich, S.;Houlden, H.;Pickering Brown, S.;Chakraverty, S.;Isaacs, A.;Grover, A.;Hackett, J.;Adamson,
J.;Lincoln, S.;Dickson, D.;Davies, P.;Petersen, R.C.;Stevens, M.;de Graaff, E.;Wauters, E.;van Baren, J.;Hillebrand, M.;Joosse, M.;Kwon, J.M.;Nowotny, P.;Che, L.K.;Norton, J.;Morris, J.C.;Reed, L.E.;Trojanowski, J.;Basun,
H.;Lannfelt, L.;Neystat, M.;Fahn, S.;Dark, F.;Tannenberg, T.;Dodd, P.;Hayward, N.;Kwok, J.B.J.;Schofield, P.R.;Andreadis, A.;Snowden, J.;Craufurd, D.;Neary, D.;Owen, F.;Oostra, B.A.;Hardy, J.;Goate, A.;van Swieten, J.;Mann, D.;Lynch, T.;Heutink, P. (1998). Association of Missense and 5' Splice Site Mutations in Tau with the Inherited Dementia FTDP 17. Nature、393、702〜705。
【0281】
Janus, C.ら(2000)、Nature 408:979〜982。
Kas, H.S. (1997) J Microencapsul 14:689〜711
Leon, J.;Cheng, C.K.;Neumann, P.J. (1998). Alzheimer's Disease Care: Costs and Potential Savings. Health Affairs、17(6)、206〜216。
Lippa C. F.ら(1998) Ab-42 deposition precedes other changes in PS-1 Alzheimer's disease. Lancet 352、1117〜1118
Luo, J. J.;Wallace, W.;Riccioni, T.;Ingram, D.K.;Roth, G.S.;Kusiak, J.W. (1999). Death of PC12 Cells and Hippocampal Neurons Induced by Adenoviral Mediated FAD Human Amyloid Precursor Protein Gene Expression. Journal of Neuroscience Research、55(5)、629〜642。
【0282】
Naruse, S.;Thinakaran, G.;Luo, J. J.;Kusiak, J.W.;Tomita, T.;Iwatsubo, T.;Qian, X.;Ginty, D.D.;Price, D.L.;Borchelt, D.R.;Wong, P.C.;Sisodia, S.S. (1998). Effects of PS1 Deficiency on Membrane Protein Trafficking in Neurons. Neuron、21(5)、1213〜1231。
National Institute on Aging Progress Report on Alzheimer's Disease、1999、NIH Publication No. 99-4664。
Pietrobon, P.J. (1995)、Pharm Biotechnol. 6:347〜61Poorkaj, P.;Bird, T.D.;Wijsman, E.;Nemens, E.;Garruto, R.M.;Anderson, L.;Andreadis, A.;Wiederhold, W.C.;Raskind, M.;Schellenberg, G.D. (1998). Tau Is a Candidate Gene for Chromosome 17 Frontotemporal Dementia. Annals of Neurology、43、815〜825。
Schenk, D.;Barbour, R.;Dunn, W.;Gordon, G.;Grajeda, H.;Guido, T.;Hu, K.
;Huang, J.;Johnson Wood, K.;Khan, K.;Kholodenko, D.;Lee, M.;Liao, Z.;Lieberburg, I.;Motter, R.;Mutter, L.;Soriano, F.;Shopp, G.;Vasquez, N.;Vandevert, C.;Walker, S.;Wogulis, M.;Yednock, T.;Games, D.;Seubert, P. (1999). Imm
unization with A beta Attenuates Alzheimer's Disease Like Pathology in the PDAPP
Mouse. Nature、400(6740)、173〜177。
【0283】
Shekunov, B.ら(1999)、J. Crystal Growth 198/199:1345〜1351。
Spillantini, M.G.;Murrell, J.R.;Goedert, M.;Farlow, M.R.;Klug, A.;Ghetti,
B. (1998). Mutation in the Tau Gene in Familial Multiple System Tauopathy with Presenile Dementia. Proceedings of the National Academy of Sciences U.S.A., 95(13)、7737〜7741。
Strittmatter, W.J.;Saunders, A.M.;Schmechel, D.;Pericak Vance, M.;Enghild,
J.;Salvesen, G.S.;Roses, A.D. (1993). Apolipoprotein E: High Avidity Binding to Aβ and Increased Frequency of Type 4 Allele in Late Onset Familial Alzheimer
Disease. Proceedings of the National Academy of Sciences U.S.A.、90、1977〜1981。
Vidal, R.;Frangione, B.;Rostagno, A.;Mead, S.;Revesz, T.;Plant, G.;Ghiso, J. (1999). A Stop Codon Mutation in the BRI Gene Associated with Familial British Dementia. Nature、399:776〜781。
Zheng H. (1996) "Mice deficient for the amyloid precursor protein gene. Ann. N
Y Acad. Sci.、777、421〜426。
York, P. (1999)、PSTT 11:430〜440
【技術分野】
【0001】
技術分野
本発明は、アルツハイマー病(AD)、およびアミロイド沈着を特徴とする、例えば中枢神経系(CNS)におけるアミロイド沈着を特徴とする他の疾患の治療ならびに予防における改
良に関する。より特異的には、本発明は、アミロイド沈着に関与する病理を有する疾患に苦しんでいるか、または苦しむ危険性がある患者において、関連タンパク質(APPもしくはAβ)またはその成分に対する抗体の産生を可能にすることによる、(望まれていない)アミロイド沈着をダウンレギュレーションする方法に関する。本発明はまた、この方法において有用なポリペプチドの製造方法とともに、そのように修飾されたポリペプチドを提供する。本発明により包含されるものとしてはまた、修飾されたポリペプチドをエンコードする核酸断片とともに、これらの核酸断片が組込まれたベクターおよび宿主細胞ならびにそれにより形質転換された細胞ラインである。最後に、本発明は、新しいタイプのコンジュゲートペプチド免疫原を規定する。
【背景技術】
【0002】
背景技術
アミロイドーシスは、不溶性タンパク質フィブリルの細胞外沈着で、組織損傷および疾患を導く(Pepys, 1996;Tanら、1995;Kelly、1996)。フィブリルは、通常、溶解性のタ
ンパク質およびペプチドが異常な方法により自己会合するときに形成される(Kelly、1997)。
【0003】
アミロイドは、全身性アミロイドーシス、AD、成人発症型糖尿病、パーキンソン病、ハンチントン病、前頭側頭型痴呆、およびプリオンに関する伝染性海綿状脳症(ヒトにおけるクールーおよびクロイツフェルト−ヤコブ病、ならびにそれぞれヒツジおよびウシにおけるスクラピーおよびBSE)を含む重篤な疾患に関連し、例えばアルツハイマー病におけ
るアミロイドプラーク形成は、ヒトの疾患の悪化に密接に関連しているようである。β−アミロイドタンパク質のような沈着において見出されるタンパク質の過剰発現、またはその修飾された形態の発現の動物モデルは、種々の疾患の症状、例えばアルツハイマー様症状を誘導することが示されている。アミロイド沈着に対する特異的療法はなく、これらの疾患は、通常、致命的である。
【0004】
アミロイドフィブリルのサブユニットは、野生型、変異型またはトランケーテッド(truncated)タンパク質であり、同様のフィブリルをオリゴペプチドおよび変性タンパク質か
らインビトロで形成することができる(Bradburyら、1960;Filshieら、1964;Burkeおよ
びRougvie、1972)。フィブリルのポリペプチド成分の性質が、アミロイドーシスの特徴を明らかにしている。アミロイドタンパク質のサイズ、天然の構造および機能における大きな相違にもかかわらず、全てのアミロイドフィブリルは、長さが未定であり、分岐せず、直径70〜120Åであり、コンゴーレッドで特徴的な染色を示す(Pepys、1996)。これらは、ポリペプチド鎖がβシートに構成されている、クロスβ構造(PaulingおよびCorey、1951)に特有である。アミロイドタンパク質は大きく異なった前駆体構造を有するが、これらは全て、おそらくは同様の経路に沿って、β−シートへリックスプロトフィラメントの基礎単位である、誤って折りたたまれた形状への構造転換を受けることができる。
【0005】
アミロイドーシスに導く、この特有の繊維形状はβ−フィブリロース(β-fibrilloses)
(Glenner、1980a、b)と呼ばれ、ADのフィブリルタンパク質は、その二次構造が知られる以前に、β−タンパク質と名付けられた(GlennerおよびWong、1984)。特徴的なクロス−
β回折パターンは、フィブリルの外観および着色特性とともに、現在では、アミロイドの
診断上の顕著な特徴として受け入れられており、非常に異なるタンパク質前駆体から形成されるが、フィブリルが構造上類似の程度を共有し、それらの前駆体タンパク質の性質に関わらず構造上のスーパーファミリーを構成することを示唆する(Sunde M、Serpell LC、Bartlam M、Fraser PE、Pepys MB、Blake CCFJ Mol Biol 1997 Oct 31;273(3):729〜739)。
【0006】
中枢神経系におけるアミロイド沈着が、疾患の進行において中心的役割を有することを示唆する、最も広くいきわたった、よく知られた疾患の一つは、ADである。
【0007】
AD
アルツハイマー病(AD)は、回復不能の進行性の脳障害で、徐々に発生し、記憶喪失、行動性および人格の変化、ならびに精神的能力の減退に帰着する。これらの喪失は、脳細胞の死およびこれらの間の接続の崩壊に関する。この疾患の経過は個人によって変動し、減退の速度も同様である。AD患者は平均で、診断後8〜10年間生存するが、疾患は20年まで
続くことができる。
【0008】
ADは、初期の、軽度の健忘性から精神的機能の重度の喪失まで、段階的に進行する。この喪失は痴呆として知られる。ADの人のほとんどにおいて、症状は60の年齢後にまず現れるが、より早期の発症は珍しくない。最も早期の症状はしばしば、記銘力の喪失、判断の誤り、および人格の変化を含む。しばしば、ADの初期段階の人々は、考えることがはっきりしなくなり、親しい人々や一般の物体の名前を忘れる。疾患の後期では、単純な作業であってもどのように行うかを忘れる。ついに、ADの人々は、全ての推理能力を喪失し、彼らの日々の世話について他の人々に依存するようになる。結局、疾患は、患者を寝たきりにし、他の疾患および感染が進行しがちになるほど衰弱させる。最も一般的には、ADの人々は肺炎で死亡する。
【0009】
ADが発生する危険性は年齢とともに増加するが、ADおよび痴呆の症状は、通常の老化の部分ではない。ADおよび他の痴呆性の障害は、脳に影響する疾患に原因がある。通常の老化では、脳の神経細胞が大量に喪失することはない。これに対して、ADは3つの鍵となる
過程を破壊する:神経細胞伝達、代謝および修復である。この破壊は、結局、多くの神経細胞が機能を停止し、他の神経細胞との接続を喪失し、死ぬことの原因となる。
【0010】
まず、ADは、記憶を制御する脳の部分、特に海馬および関係する構造にあるニューロンを破壊する。海馬にある神経細胞が正確に機能しなくなると、短期間の記憶が衰弱し、しばしば、簡単で熟知した作業を行う個人の能力が減退し始める。ADは、大脳皮質、特に言語および推理をつかさどる領域をも攻撃する。ついに、脳の多くのほかの領域が含まれ、これらの全ての脳の領域が萎縮(収縮)し、AD患者は、寝たきりで、失禁性で、完全に無力になり、外界に対して応答しなくなる(出典:National Institute on Aging Progress Report on Alzheimer's Disease、1999)。
【0011】
ADの影響
ADは、65歳以上の人々の間で最も一般的な痴呆の原因である。これは、個人、家族、健康管理システムおよび全体としての社会に対するその莫大な影響から、主要な健康問題を提示する。科学者は、400万人以下の人々がこの疾患に苦しみ、65歳を超えると5歳ごとに有病率は倍になると見積もっている。毎年、約36万の新しい症例(発病)が発生するとも見積もられ、この数字は集団の年齢に伴い増加する(Brookmeyerら、1998)。
【0012】
ADは、社会に重大な経済的負荷を課す。最近の米国での研究は、一人のAD患者を介護する年間の費用が軽度のAD患者で18,408ドル、中程度のAD患者で30,096ドル、そして重度のAD患者で36,132ドルであると見積もっている。米国におけるAD患者の介護の年間の国の費
用は、500億ドルをわずかに上回ると見積もられている(Leonら、1998)。
【0013】
およそ400万人の米国人は85歳以上であり、最も産業化された国では、この年齢の群は
、人口のうちで最も速く成長している部分の一つである。米国では、この群は2030年までに850万に近い数になると見積もられている;この数はさらに多くなり得るとさえ示唆す
る、人口の動向を研究する専門家もいる。より多くの人々がより長く生きるようになると、ADを含む老化の疾患に冒される人数は増加し続ける。例えば、85歳以上の全ての人の半分近くが痴呆の何らかの形態を有することを示す研究もある(National Institute on Aging Progress Report on Alzheimer's Disease、1999)。
【0014】
ADの主な特徴
脳における2つの異常な構造がADの顕著な特徴である:アミロイドプラークと神経原線
維もつれ(NFT)である。プラークは、脳のニューロンの外側および周囲のタンパク質なら
びに細胞性物質の、濃密でほとんど不溶性の沈着である。もつれは、ニューロンの内側に形成された不溶性のねじれた線維である。2種類のADが存在する:ある遺伝のパターンに
従う家族性AD (FAD)と、遺伝の明らかなパターンが見られない孤発性ADである。発症の年齢が異なるので、ADはさらに、早期発症(65歳より若い人に発生する)または晩期発症(65歳以上の人に発生する)と表される。早期発症ADは珍しく(症例の約10%)、一般に30〜60歳の人に影響する。早期発症ADのある形態は遺伝性で、家族に遺伝する。早期発症ADは、しばしば、より一般的な晩期発症ADよりも早く進行する。
【0015】
現在までに知られている全てのFADは早期に発症し、FADの症例の50%までもが3つの異
なる染色体上に位置する3つの遺伝子の欠損により引き起こされることが、現在知られて
いる。これらは、第21染色体上のAPP遺伝子の変異;第14染色体上のプレセニリン1と呼ばれる遺伝子の変異;および第1染色体上のプレセニリン2と呼ばれる遺伝子の変異である。しかしながら、これらの変異のいずれかが、より一般的な、孤発性または非家族性の形態の晩期発症ADにおいて主な役割を果たしていることの証明はまだない(National Institute on Aging Progress Report on Alzheimer's Disease、1999)。
【0016】
アミロイドプラーク
ADでは、アミロイドプラークは、まず記憶および他の認識の機能に用いられる領域において発生する。これは、ニューロンの部分と小神経膠細胞および星状神経膠細胞のような非神経細胞とともに混ざり合った、βアミロイド(以下、Aβと表す)−アミロイド前駆
体タンパク質(APP、このアミノ酸配列をSEQ ID NO: 2に示す)と呼ばれるより大きいタ
ンパク質のタンパク質断片−の、ほとんど不溶性の沈着からなる。アミロイドプラーク自体がADの主な原因を構成するのか、またはそれらがADの過程での副産物であるのかは知られていない。確かに、APP遺伝子の変異により引き起こされたADの遺伝性の形態において
示されたように、APPタンパク質における変化はADの原因となり、Aβプラーク形成は、ヒトの疾患の進行に緊密に関連しているようである(Lippa C. F.ら、1998)。
【0017】
APP
APPは、細胞膜に結合している多くのタンパク質の一つである。それが作られた後、APPは、神経細胞の膜に埋め込まれるようになり、部分的に細胞の内部にあり、部分的に外部にある。トランスジェニックマウスを用いた最近の研究は、APPがニューロンの成長およ
び生存において重要な役割を果たしていると考えられることを示す。例えば、APPのある
形態および量は、短期および長期の両方の損傷に対してニューロンを保護し、自己修復できるように、損傷を受けたニューロンを改善し、脳損傷後にニューロンの部分が成長するのを助けるであろう。
【0018】
APPは細胞膜に埋め込まれているが、プロテアーゼがAPPの特定の位置に作用し、タンパ
ク質断片に切断する。あるプロテアーゼはAPPを切断してAβを形成するのを助け、他のプロテアーゼはアミロイド断片の中間でAPPを切断するので、Aβは形成されない。形成されたAβは2つの異なる長さであり、比較的溶解性でゆっくりと凝集する、より短い40(または41)アミノ酸のAβと、迅速に不溶性の凝集塊を形成する、わずかに長い42アミノ酸の
「粘着性の」Aβである。Aβが形成される間、これが神経細胞の中または周辺をどのように動いているのかは、はっきり知られていない。この過程の最後の段階において、「粘着性の」Aβは、細胞外で長いフィラメントに凝集し、すでに死んだかまたは死んでいくニ
ューロンの断片、ならびに小神経膠細胞および星状神経膠細胞とともに、脳組織においてADの特徴であるプラークを形成する。
【0019】
APPにおける変異が、APP前駆体からAβを切り取るようであり、したがって全Aβがより多くなるか、または「粘着性の」形態が比較的多く形成されることを引き起こすとの証拠がいくつか存在する。プレセニリン遺伝子における変異が、少なくとも2つの方法:Aβの産生を変更すること、またはより直接的に細胞死を引き起こすこと、においてニューロンの分解に寄与しているとも考えられる。他の研究者は、変異したプレセニリン1および2は、アポトーシスの速度を促進するのに関与することを示唆する。
【0020】
疾患が進行するにつれて、より多くのプラークが形成され、脳のより多くを占めることが予想される。研究により、Aβは、動的平衡のように、同時に集合し、ばらばらになっ
ているであろうことが示唆される。これは、プラークが形成された後でもそれを分解することが可能であるかもしれないとの希望を高める。(National Institute on Aging Progress Report on Alzheimer's Disease、1999)。
【0021】
Aβは、ニューロンに毒性であると考えられている。組織培養研究において、研究者は
、正常なヒトAPPを過剰発現するニューロンに比較して、変異した形態のヒトAPPを過剰発現するようにした海馬ニューロン細胞の死が増加したことを観察した(Luoら、1999)。
さらに、Aβタンパク質の過剰発現または修飾された形態の発現は、動物モデルにおい
て、アルツハイマー様の症状を誘発することが示されている(Hsiao K.ら、1998)。
【0022】
増加したAβの発生、プラークへのその集合、および結果としての神経毒性がADに導く
とすれば、プラークへのAβの集合が遅くなるか、ブロックされる条件を調査することは
、治療上の興味の対象である。
【0023】
プレセニリン
プレセニリン-1 (S-180)における変異は、早期発症家族性AD (FAD)の全ての症例の約50%に達する。ADを起こす約30の変異が同定されている。ADの発症は、変異によって変動する。プレセニリン-2における変異は、FADの症例のより少ない部分を占めるが、重要な因
子である。プレセニリンが、孤発性の非家族性ADに関与するかは知られていない。プレセニリンの機能は知られていないが、Aβ-42(ペプチド、SEQ ID NO: 2の残基673〜714のより長い、より粘着性の形態)を与えるAPPのプロセシングに関与していると考えられる。
なぜなら、プレセニリン変異があるAD患者はこのペプチドのレベルが増加したからである。プレセニリンがNFTの発生を引き起こす役割をも有するかは、不明である。プレセニリ
ンは、ニューロンの分解およびニューロンの死に、より直接的な役割を有するかもしれないことを示唆する者もいる。プレセニリン-1は第14染色体に位置し、プレセニリン-2は第1染色体に結合している。もし、これらの遺伝子のたった1つの変異バージョンを有していると、その人が早期発症ADを発生することはほぼ確実である。
【0024】
プレセニリン-1が、APPのプロセシングに関与する、仮説のγ-セクレターゼと同一であるかについては、不明な点がある(Naruseら、1998)。
【0025】
アポリポタンパク質E
アポリポタンパク質Eは、通常、コレステロールと結合するが、ADの脳のプラークやも
つれにおいても見出される。対立遺伝子1〜3はADに関与していないようであるが、APOE-
ε4対立遺伝子の存在と晩期ADの発生との間には、重要な相関関係がある(Strittmatterら、1993)。しかしながら、これは危険因子であって、プレセニリンおよびAPP変異の場合のような直接の原因ではなく、これは家族性ADに限定されない。
【0026】
ApoEε4タンパク質がADの発生の可能性を増加させる方法は、明確には知られていない
が、可能性のある理論としては、それがAβの形成を促進してADの発症の年齢を引き下げ
ることに寄与するか、または特定のAPOE対立遺伝子の存在もしくは非存在が、ニューロンが損傷に応答する方法に影響することである(Buttiniら、1999)。
【0027】
Apo A1も、アミロイド産生性である(amyloigenic)ことが示されている。無損傷apo A1
自体は、コンゴーレッド陽性であるアミロイド様フィブリルをインビトロで形成することができる(Am J Pathol 147 (2):238〜244 (Aug 1995)、Wisniewski T、Golabek AA、Kida E、Wisniewski KE、Frangione B)。
他の対立遺伝子に比べて、知力喪失の症状の減少におけるAPOE-ε4対立遺伝子の肯定的な効果があることを示唆する、矛盾した結果がいくつかあるようである(Stern, Brandt、1997、Annals of Neurology 41)。
【0028】
神経原線維もつれ
ADの2つ目の顕著な特徴は、神経細胞の内部で見出されるねじれた糸の異常な集積から
なる。もつれの主要な成分は、タウ(τ)と呼ばれるタンパク質の一つの形態である。中枢神経系においては、タウタンパク質は、細胞の内部支持構造の構成成分の一つである微小管または骨格に結合し、安定化するのを助ける能力について最もよく知られている。しかしながら、ADにおいては、タウは化学的変化を受け、この変化したタウはもはや微小管を安定化することができず、微小管を崩壊させる原因となる。この輸送系の崩壊は、まず神経細胞間の伝達の機能不全となり、後にニューロンの死を導くであろう。
【0029】
ADにおいては、化学的変化を受けたタウは、2本の糸のタウが互いの周りに巻きついた
、二重らせんフィラメントによじれる。これらのフィラメントは神経原線維もつれにおいて見出される主要な物質である。最近のある研究では、研究者は、健康な脳の海馬の特定の部分のニューロンの6%未満、軽度のADで死亡した人のこれらのニューロンの43%より
多く、および重度のADで死亡した人のこれらのニューロンの71%において、神経原線維変化を見出した。ニューロンの喪失が研究されたとき、同様の進行が見られた。このタイプの証拠は、もつれの形成およびニューロンの喪失は、ADの過程においてともに進行するとの考えを支持する(National Institute on Aging Progress Report on Alzheimer's Disease、1999)。
【0030】
タウオパシー(tauopathies)およびもつれ
AD以外のいくつかの神経変性疾患は、ニューロンおよび神経膠においてタウが凝集して不溶性のフィラメントになり、機能不全ならびに死に導くことが特徴である。非常に最近、AD以外の遺伝性痴呆の多様性がある家族を研究していた研究者のいくつかのグループが、第17染色体上のタウ遺伝子における最初の変異を発見した(Clarkら、1998;Huttonら、1998;Poorkajら、1998;Spillantiniら、1998)。これらの家族では、タウ遺伝子におけ
る変異が、ニューロン細胞死および痴呆を引き起こす。ADとある特徴を共有しているがいくつかの重要な点において異なるこれらの障害は、まとめて「第17染色体に関連する前頭側頭型痴呆およびパーキンソニズム(fronto temporal dementia and parkinsonism linked to chromosome 17)」(FTDP-17)と呼ばれる。これらは、パーキンソン病、筋萎縮性側索硬化症(ALS)のある形態、大脳皮質基底核変性症、進行性核上性麻痺およびピック病など
の疾患であり、全てがタウタンパク質の異常な凝集を特徴とする。
【0031】
他のAD様神経病
ADと、プリオン病(クールー、クロイツフェルト−ヤコブ病およびウシの海綿状脳炎など)、パーキンソン病、ハンチントン病ならびに前頭側頭型痴呆を含む他の神経病との間には、重要な類似がある。全てが脳における異常タンパク質の沈着を含む。ADおよびプリオン病は、痴呆と死を引き起こし、両者は不溶性のアミロイドフィブリルの形成に関連するが、膜タンパク質からは互いに異なる。
【0032】
ADに次ぐ第二の最も一般的な神経変性障害であるパーキンソン病を研究する科学者らは、疾患に関係する最初の遺伝子を発見した。この遺伝子は、AD患者の脳のアミロイドプラークにおいても興味深く見出される、シヌクレインと呼ばれるタンパク質をコードする(Lavedan C、1998、Genome Res. 8(9): 871 80)。研究者らは、痴呆の原因となる別の進行
性神経変性障害であるハンチントン病における遺伝子欠損が、ハンチントンタンパク質がADのAβフィブリルおよびプリオン病のタンパク質フィブリルに非常によく似た不溶性の
フィブリルを形成することの原因となることをも見出した(Scherzinger Eら、1999、PNAS
U.S.A. 96(8):4604〜9)。
【0033】
科学者らは、変異した場合に、ADにおいてみられるのに類似した深刻な行動障害および進行性痴呆を引き起こす珍しい遺伝性の疾患である、家族性ブリティッシュ痴呆(familial British dementia (FBD))の原因となる、新規な遺伝子をも発見している。FBDプラークにおいて見出されるアミロイドフィブリルの生化学的分析では、ABriと名付けられた特有のペプチドが見出された(Vidalら、1999)。この遺伝子における特定の点での変異は、通
常より長いBriタンパク質の産生に帰着する。Briタンパク質の変異末端から切り取ったABiペプチドは、アミロイドフィブリルとして沈着する。これらのプラークは、FBDを特徴付けるニューロンの機能不全および痴呆に導くと考えられている。
【0034】
Aβでの免疫化
免疫系は、生物中の外来タンパク質およびタンパク様の粒子の除去に、通常、貢献するが、上記の疾患に関連する沈着は主に自己タンパク質からなり、したがってこれらの疾患の制御において免疫系に役割を与えることは、あまり明白ではない。さらに、沈着は、通常、免疫系から分離された区画(CNS)に位置し、これら両方の事実はワクチンまたは免疫
療法的アプローチは成功しないであろうことを示唆する。
【0035】
にもかかわらず、科学者らは最近、異種のヒトAβと免疫系を刺激することが知られて
いる物質とからなるワクチンでマウスを免疫化することを試みている(Schenkら、1999お
よびWO 99/27944)。このワクチンは、マウスのDNAにヒトAPPの変異遺伝子を挿入した、ADの部分トランスジェニックマウスモデルにおいて試験された。マウスは修飾されたAPPタ
ンパク質を産生し、成長するにつれてアミロイドプラークを発生した。このマウスモデルは修飾されたトランスジェニックヒトAPPに対するワクチンがプラーク形成に影響を有す
るかを試験するのに用いられた。最初の実験では、トランスジェニックマウスの1つの群
は、6週齢から始まり11ヶ月で終わる毎月のワクチン注射を受けた。トランスジェニック
マウスの第2の群は、注射を受けずコントロール群となった。13ヶ月齢までに、コントロ
ール群のマウスはその脳の2〜6%を覆うプラークを有した。これに比べて、免疫されたマウスは実質的にプラークがなかった。
【0036】
第2の実験では、研究者らは、いくらかのプラークがすでに発生している11ヶ月で注射
を始めた。7ヶ月の期間の間に、コントロールのトランスジェニックマウスはその脳の中
でプラークの量が17倍に増加したが、ワクチンを受けたものは、18ヶ月齢のコントロールトランスジェニックマウスに比べて99%の減少であった。あるマウスでは、予め存在して
いたプラーク沈着のいくらかが、処置により除去されたようであった。また、免疫化の結果として、炎症や異常な神経細胞のプロセスのようなプラークに関連する他の損傷が減少したことも見出された。
【0037】
上記のことは、したがってマウスにおける予備的研究であり、研究者らは、例えばワクチン化されたマウスがほかの点においても健康を維持するのか、これらのワクチン化されたものの記憶は正常に保たれるのかを見出す必要がある。さらに、マウスモデルはADの完全な代表ではない(動物は神経原線維もつれを発生せず、そのニューロンが大量に死ぬことがない)ので、ヒトがマウスと類似または異なる反応を示すかを決定するのに、付加的な研究が必要である。考慮が必要な他の問題としては、この方法がアミロイド沈着を「治療」するであろうが、痴呆の発達を止めることができないことである。
【0038】
技術的な論点は、主要な難題をも表す。例えば、この技術を用いてヒトがその自己のタンパク質に対する抗体を産生することを可能にするワクチンを作成することは、可能ではないようである。ヒトにおけるいずれの試験をも考慮することができる前に、安全性および効率について非常に多くの問題を解決しなければならない。
【0039】
Schenkらによる研究は、よって、ADにおいて形成されたプラークのような中枢神経系でのタンパク様の沈着中の自己タンパク質に対する強い免疫応答を発生させることが可能であれば、沈着の形成を防止し、すでに形成されたプラークをおそらく除去することの両方が可能であることを示す。
【0040】
最近、上記で論じたAβワクチンを用いた臨床試験が、副作用により停止された:ワク
チン化された多くの患者が、CNSにおいて、Aβに対する制御されない自己免疫によると考えられる慢性脳炎を発生した。
【発明の概要】
【発明が解決しようとする課題】
【0041】
発明の目的
本発明の目的は、ADのようなアミロイドの沈着を特徴とする症状に対する新規の治療を提供することである。更なる目的は、ADおよびアミロイド沈着を含む他の病理学的障害への新規の治療を得るために、アミロイドに対する自家ワクチンを開発することである。
【課題を解決するための手段】
【0042】
発明の要旨
非免疫原性APPおよびAβに対する強い免疫応答を発生させるための自家ワクチン療法技術の使用が、本明細書に記載される。また、アミロイド沈着に関連するこのような疾患の症状の予防、可能な治療または緩和のためのこのようなワクチンの製造も記載される。
【0043】
したがって、本発明の最も広く最も全般的な観点において、本発明は、アナログが
a) SEQ ID NO: 2の残基672〜714のサブシークエンスの少なくとも1つのコピーからなるポリアミノ酸であり、外来Tヘルパーエピトープ(THエピトープ)が、アミノ酸の付加およ
び/または挿入および/または欠失および/または置換により組み込まれ、該サブシークエンスが、SEQ ID NO: 2のアミノ酸残基673〜714からなるアミノ酸配列の残基1〜42、残
基1〜40、残基1〜39、残基1〜35、残基1〜34、残基1〜28、残基1〜12、残基1〜5、残基13〜28、残基13〜35、残基17〜28、残基25〜35、残基35〜40、残基36〜42および残基35〜42からなる群より選択されるか;および/または
b) 外来THエピトープおよび破壊されたアミロイド前駆体タンパク質(APP)またはβアミロイド(Aβ)配列を含むポリアミノ酸であることにより、該アナログが、T細胞応答を開始するMHCクラスII分子に生産的に結合する、SEQ ID NO: 2のいずれの配列をも含まないか
;および/または
c) 外来THエピトープおよびAPPまたはAβ由来アミノ酸を含み、該アナログのC末端に位置する1つの単独メチオニン残基を含むポリアミノ酸であり、APPまたはAβおよび外来TH
エピトープの中の他のメチオニン残基が置換されているかもしくは欠失されており、好ましくはロイシンもしくはイソロイシンにより置換されているか;および/または
d) a)で定義したポリアミノ酸および/またはb)で定義したポリアミノ酸および/またはc)で定義したポリアミノ酸が別個に結合しているポリヒドロキシポリマー骨格を含むコンジュゲートであるか;および/または
e) 1)外来THエピトープならびに2) a)で定義したサブシークエンス、b)で定義した破壊
されたAPPもしくはAβ配列、およびC末端に位置する単一のメチオニン残基を含み、APPまたはAβおよび外来THエピトープの中の他のメチオニン残基が置換されているかもしくは
欠失されており、好ましくはロイシンもしくはイソロイシンにより置換されているAPPま
たはAβ由来アミノ酸配列からなる群より選択されるポリアミノ酸が別個に結合している
ポリヒドロキシポリマー骨格を含むコンジュゲートである、
アナログによる動物の免疫化が、動物の自己のAPPまたはAβに対する抗体産生を誘導するように、APPおよび/またはAβの少なくとも1つのB細胞エピトープと少なくとも1つの外
来THエピトープとを同じ分子に組み込む、APPまたはAβの少なくとも1つのアナログの免
疫原的有効量を動物の免疫系に提示することを含む、ヒトを含む動物におけるAPPまたはAβのインビボダウンレギュレーション方法に関する。
【0044】
本譲渡人は、以前、APPおよびAβのようなアミロイド産生ポリペプチド(amyloidogenic
polypeptide)に対する安全なワクチン化方法に関する国際特許出願をファイルしており
、WO 01/62284参照。この出願は、本出願の出願日に公開されておらず、さらに、上記のAPPおよびAβの有用なアナログに関する詳細を含まない。
【0045】
本発明は、APPおよびAβのアナログとともに、これらの部分集合をエンコードする核酸断片にも関する。アナログまたは核酸断片を含む免疫原性組成物も、本発明の部分である。
【図面の簡単な説明】
【0046】
【図1】Aβタンパク質Aβ-43 (またはC-100)に対する抗体応答を発生させることを目的とした、アミロイド前駆体タンパク質に由来する自家ワクチン(Autovac)変異体の概略図。APPを図の一番上に図示し、残りの概略の構築物は、モデルエピトープP2およびP30が置換されるか、または種々のトランケーション(truncation)中に挿入されることを示す。図において、黒の縞模様はAPPシグナル配列を示し、二方向の斜交線模様はAPPの細胞外部分を示し、濃い鉛直の平行線はAPPの膜貫通ドメインを示し、明るい鉛直の平行線はAPPの細胞内ドメインを示し、粗い斜交線模様はP30エピトープを示し、細かい斜交線模様はP2エピトープを表す。実線の箱はAβ-42/43を示し、実線の箱および点線の箱は一緒にC-100を示す。「Abeta」はAβを意味する。
【図2】一般的に適用可能な免疫原性コンジュゲートの合成の実施形態の概略図。ペプチドA(あらゆる抗原性の配列、例えば本明細書に記載のAβ配列)およびペプチドB(外来Tヘルパーエピトープを含むアミノ酸配列)を合成して混合する。その後、これらを適切な活性ポリヒドロキシポリマーと接触させて、ペプチドAおよびBを、ペプチド混合物中のこれら2つの物質の間の最初の比に相当する定量で、活性化基を介して結合する。詳細は実施例4を参照。
【発明を実施するための形態】
【0047】
詳細な発明の開示
定義
以下において、本明細書および請求項において用いるいくつかの語について、本発明の境界を明確にするために、定義して詳細に説明する。
【0048】
本明細書において交換可能に用いられる「アミロイド」および「アミロイドタンパク質
」の語は、長さが不確定の、分岐していないタンパク様フィブリルのクラスを意味する。アミロイドフィブリルは、コンゴーレッドで特徴的な染色を示し、ポリペプチド鎖がβシートに組織されているクロスβ構造を共有する。アミロイドは、非常に異なる前駆体構造を有するが、全てが、βシートヘリックスプロトフィラメントの基礎単位である、間違って折りたたまれた形態に構造変化を受けることができる、アミロイド産生タンパク質に通常由来する。通常、アミロイドフィブリルの径は、約70〜約120Åの間で変動する。
【0049】
「アミロイド産生タンパク質」の語は、そのまま沈着の部分となること、または沈着の形成を導く生合成経路の部分となることのいずれかにより、アミロイド沈着の形成に関与するポリペプチドを意味することを意図する。よって、アミロイド産生タンパク質の例はAPPおよびAβであるが、これらの代謝に含まれるタンパク質もアミロイド産生タンパク質である。
【0050】
本明細書において「アミロイドポリペプチド」は、ヒトまたはその他の哺乳動物に由来する、上記のアミロイド産生タンパク質(または無傷のアミロイド産生タンパク質と実質的な量のB細胞エピトープを共有する、これらのトランケート(truncate))のアミノ酸配
列を含むポリペプチドを意味することを意図する−よって、アミロイド産生ポリペプチドは、例えばアミロイド産生ポリペプチドの前駆体の実質的な部分を含むことができる(A
βの場合、一つの可能なアミロイドポリペプチドはAPP由来である)。例えば酵母または
他の非哺乳類の真核発現系の使用により、種々のグリコシル化パターンを有する形態とともに、原核生物系において製造されたアミロイド産生ポリペプチドの非グリコシル化形態もこの語の境界内である。しかしながら、「アミロイド産生ポリペプチド」の語を用いる場合、問題のポリペプチドは、治療される動物に提示されるときに、通常、非免疫原性であることを意図することが記載される。言い換えると、アミロイド産生ポリペプチドは、自己タンパク質であるか、または問題の動物のアミロイド産生性に対して免疫応答を通常起こさないこのような自己タンパク質のアナログである。
【0051】
「アナログ」は、その分子構造の中に1つまたはいくつかの変化を組み込んだAPPまたはAβ由来の分子である。このような変化は、例えばAPPまたはAβポリアミノ酸の適切な融
合パートナーとの融合の形態(すなわちCおよび/またはN末端へのアミノ酸残基の付加を
排他的に含む一次構造の変化)にあるか、および/またはポリペプチドのアミノ酸配列に
おける挿入および/または欠失および/または置換であることが可能である。この語により、派生APPまたはAβ由来分子も含まれ、APPまたはAβの修飾についての以下の議論を参照。アナログは、アミロイドの通常の前駆体タンパク質に対する抗体を誘導することがほとんど、またはまったくできないように構築されたものである場合があり、それによりアミロイドタンパク質の前駆体であるポリペプチドの(生理学的に正常な)非凝集形態との望まれない干渉を回避する。
【0052】
ヒトAPPまたはAβの外来アナログ(例えばイヌまたはブタアナログ)の、ヒトにおけるワクチンとしての使用が、APPまたはAβに対して所望の免疫性を産生することが推測できることが記載される。免疫化のためのこのような外来アナログの使用も、本発明の部分であると考えられる。
【0053】
「ポリペプチド」の語は、本明細書で、2〜10アミノ酸残基の短いペプチド、11〜100アミノ酸残基のオリゴペプチド、100を超えるアミノ酸残基のポリペプチドを共に意味する
ことを意図する。さらに、この語はタンパク質、すなわち少なくとも1つのポリペプチド
を含む機能性生体分子を含むことをも意図する;少なくとも2つのポリペプチドを含む場
合、これらは複合体を形成するか、共有結合するか、または非共有結合することができる。タンパク質中のポリペプチドは、グリコシル化されるか、および/または脂質化されるか(lipidated)、および/または補欠分子団を含むことができる。「ポリアミノ酸」の語
は、「ポリペプチド」の語と同等である。
【0054】
「Tリンパ球」および「T細胞」の語を、各種の細胞媒介免疫応答とともにヒトの免疫応答においてヘルパー活性の原因である、胸腺起源のリンパ球に対して同義的に用いるつもりである。同様に、「Bリンパ球」および「B細胞」の語を、抗体産生リンパ球に対して同義的に用いるつもりである。
【0055】
「サブシークエンス」の語は、天然に存在するアミロイドのアミノ酸配列または核酸配列からそれぞれ直接由来した、少なくとも3つのアミノ酸、または適切な場合には、少な
くとも3つのヌクレオチドのあらゆる連続的な範囲を意味する。
【0056】
「動物」の語は、本明細書において一般に、ホモ・サピエンス(Homo sapiens)、カニス・ドメスティカス(Canis domesticus)などのような動物種(好ましくは哺乳動物) で、単
一の動物だけではないことを意味することを意図する。しかしながら、本発明の方法により免疫化された個体が全て、同じ免疫原で動物を免疫化することを許容する、実質的に同じAPPまたはAβを有することが重要であるので、この語はこのような動物種の個体群をも意味する。本明細書における動物が免疫系を有する生物であることは、当業者には明白であろう。該動物は、哺乳動物のような脊椎動物が好ましい。
【0057】
本明細書中の「APPまたはAβのインビボダウンレギュレーション」の語により、関連するタイプの沈着したアミロイドタンパク質(またはアミロイドそのもの)の生物における全量の減少を意味する。ダウンレギュレーションは、いくつかの機構により得ることができる:それらのうち、間違った凝集を防ぐための、抗体結合によるアミロイドでの単純な干渉が最も単純である。しかしながら、清掃細胞(マクロファージや他の食細胞など)によるアミロイドの除去となる抗体の結合、およびアミロイド形成に導く他のアミロイド産生ポリペプチドに干渉する抗体も、本発明の範囲内である。更なる可能性としては、抗体がCNSの外部でAβに結合し、それにより、単純な質量作用原理により効果的にAβをCNSから除去することである。
【0058】
「免疫系に・・・提示する」の表現は、動物の免疫系が、制御された方法で免疫原性攻撃に供されることを意味することを意図する。以下の開示から明らかなように、このような免疫系の攻撃は、多くの方法によりもたらすことができ、それらのうちで最も重要なものは、「ファーマクシン(pharmaccine)」(すなわち進行中の疾患を治療または改善する
のに投与されるワクチン)を含むポリペプチドによるワクチン化、または核酸「ファーマクシン」ワクチン化である。達成する重要な結果は、動物における免疫適格細胞が免疫原的に効果的な方法で、抗原と対峙することであって、この結果を達成する精密なモードは、本発明の根底にある発明の概念にはほとんど重要ではない。
【0059】
「免疫原的有効量」の語は、当該技術における通常の意味を有し、すなわち免疫原と免疫学的な特徴を共有する病原性の剤に著しく関与する免疫応答を誘導し得る免疫原の量である。
【0060】
本明細書において、APPまたはAβが「修飾された」との表現を用いる場合、APPまたはAβについてポリペプチドの化学的修飾が行われたことを意味する。このような修飾は、例えば配列中のあるアミノ酸残基の派生(例えばアルキル化)を含み得るが、以下の開示から認識されるように、好ましい修飾はアミノ酸配列の一次構造の変化を含む。
【0061】
「APPまたはAβに対する自己寛容」を論じる場合、ポリペプチドはワクチン化される個体群で自己タンパク質であるので、個体群における正常な個体はポリペプチドに対して免疫応答しないことが理解される;しかし、動物個体群で、まばらに存在する個体が、例え
ば自己免疫異常の部分として、天然のポリペプチドに対して抗体を産生できるかもしれないことは除外することはできない。いずれの割合においても、動物は、通常、そのAPPま
たはAβに対してのみ自己寛容であるだろうが、他の動物種または異なる表現型を有する
個体群に由来するアナログも該動物により寛容化されることを除外することはできない。
【0062】
「外来T細胞エピトープ」(または「外来Tリンパ球エピトープ」)は、MHC分子に結合
でき、動物種においてT細胞を刺激するペプチドである。本発明において好ましい外来T細胞エピトープは、「乱交雑(promiscuous)」エピトープ、すなわち、動物種または個体群
において、特定のクラスのMHC分子の実質的なフラクションと結合するエピトープである
。ごく限られた数のこのような乱交雑T細胞エピトープのみが知られており、それらを以
下に詳述する。乱交雑T細胞エピトープは、「ユニバーサル」T細胞エピトープとも表される。本発明に従って使用される免疫原を、できるだけ大きな動物個体群のフラクションで有効にするため、1) 同じアナログにいくつかの外来T細胞エピトープを挿入するか、または2) 各アナログが挿入された異なる乱交雑エピトープを有する、いくつかのアナログを
作ることが必要であろうことが記載される。また、外来T細胞エピトープの観念は、潜在
性T細胞エピトープ、すなわち自己タンパク質に由来し、かつ該自己タンパク質の部分で
はない単離の形態で存在する場合に、免疫原性の挙動を奏するのみであるエピトープの使用を包含することが記載される。
【0063】
「外来Tヘルパーリンパ球エピトープ」(外来THエピトープ)は、MHCクラスII分子を結合し、MHCクラスII分子に結合した抗原提示細胞(APC)の表面に存在することができる外来T細胞エピトープである。
【0064】
(生体)分子の“機能性部分”は、本明細書において、分子によって奏される少なくとも1つの生化学的または生理学的な効果の原因となる分子の部分を意味することを意図す
る。多くの酵素および他のエフェクター分子が、該分子によって奏される効果の原因となる活性部位を有することは、当該技術で周知である。分子の他の部分は、安定化または溶解性を増強する目的に役立つであろう、従って、この目的が、本発明のある実施形態に関して適切でないならば除外することができる。例えば、APPまたはAβにおける修飾成分として、あるサイトカインを用いることが可能であり(以下の詳細な議論を参照)、そのような場合、APPまたはAβへの結合は必要な安定性を提供すると考えられるので、安定性の問題は関係がない。
【0065】
「アジュバント」の語は、ワクチン技術の分野での一般的な意味を有し、すなわち、1)ワクチンの免疫原に対する特異的な免疫応答をそれ自体で有することができないが、2)
にもかかわらず、免疫原に対する免疫応答を増強できる物質または物質の組成物である。または、言い換えると、アジュバントのみでのワクチン化は、免疫原に対する免疫応答を提供せず、免疫原でのワクチン化は免疫原に対する免疫応答を発生させるか、または発生させないが、免疫原とアジュバントとを組合わせたワクチン化は、免疫原単独で誘導されるより強い、免疫原に対する免疫応答を誘導する。
【0066】
分子の「標的化」は、本明細書において、動物に導入される分子が、特定の組織で優先的に現れるか、または特定の細胞もしくは細胞のタイプと優先的に会合する状況を示すことを意図する。その効果は、標的化を促進する組成物中への分子の処方、または標的化を促進する分子の群に導入することを含む多くの方法で達成することができる。これらの問題を以下に詳細に述べる。
【0067】
「免疫系の刺激」は、ある物質または物質の組成物が、一般の非特異的な免疫刺激効果を発揮することを意味する。いくつかのアジュバントと推定上のアジュバント(例えばあるサイトカイン)は、免疫系を刺激する能力を共有する。免疫刺激剤を用いる成果は、免
疫原での同時または続いて起こる免疫化が、免疫原の分離された使用と比較して有意でより効果的な免疫応答を誘導することを意味する免疫系の増加された「機敏さ(alertness
)」である。
【0068】
「生産的な結合」は、MHC分子に結合したペプチドを提示する細胞にたずさわるT細胞を刺激することができるように、ペプチドがMHC分子(クラスIまたはII)へ結合することを意味する。例えば、APC表面においてMHCクラスII分子に結合したペプチドは、このAPCが、
提示されたペプチド−MHCクラスII複合体に結合するTH細胞を刺激する場合に、生産的に
結合するという。
【0069】
アミロイドダウンレギュレーションの好ましい実施形態
本発明の方法において免疫原として用いられるアナログは、APPまたはAβのアミノ酸配列中に少なくとも1つの変化が存在する、修飾されたAPPまたはAβ分子が好ましい。なぜ
なら、自己寛容の全て重要な破壊は、この方法で大きく促進されるからである−これは、例えば、野生型Aβによる免疫化をAβ変異型分子による免疫化と比較した本明細書の実施例2に示す結果から明らかである。自己タンパク質を認識する潜在的な自己反応性Bリンパ球が正常な個体に生理学的に存在することは、示されている(Dalum Iら、1996、J. Immunol. 157:4796〜4804)。しかしながら、これらのBリンパ球が適切な自己タンパク質に反
応し得る抗体を実際に産生するように誘導されるためには、サイトカイン産生Tヘルパー
リンパ球(TH細胞またはTHリンパ球)の補助が必要である。抗原提示細胞(APC)により提示
された場合に、Tリンパ球は、自己タンパク質に由来するT細胞エピトープを一般的に認識しないので、この補助は、通常、提供されない。しかしながら、自己タンパク質中に「外来性」の要素を与えることによって(すなわち免疫学的に重要な修飾を導入することによ
り)、外来要素を認識するT細胞が、APC上の外来エピトープ(最初は単核細胞のようなもの)を認識することより活性化される。
【0070】
修飾された自己タンパク質上の自己エピトープを認識し得るポリクローナルBリンパ球
(APCでもある)も、抗原を取り込み、その後、その外来T細胞エピトープを提示し、活性化されたTリンパ球は、その後、これらの自己反応性ポリクローナルBリンパ球にサイトカインの補助を提供する。これらのポリクローナルBリンパ球により産生される抗体は、天
然のポリペプチド上に存在するものをも含む、修飾されたポリペプチド上の異なるエピトープと反応し得るので、非修飾自己タンパク質と交差反応性である抗体が誘導される。
【0071】
結論として、Tリンパ球は、実際は挿入されたエピトープのみが宿主にとって外来であ
るのに、ポリクローナルBリンパ球の個体群が外来抗原の全てを認識するかのようにふる
まうように誘導されることができる。このようにして、非修飾自己抗原と交差反応することができる抗体が誘導される。
【0072】
自己寛容の破壊を得るためにペプチド自己抗原を修飾するいくつかの方法が、当該技術において公知である。にもかかわらず、本発明のアナログは、
−抗原提示細胞(APC)への修飾された分子の標的化をもたらす、少なくとも1つの第一成分を導入するか、および/または
−免疫系を刺激する、少なくとも1つの第二成分を導入するか、および/または
−免疫系へのアナログの提示を最適化する、少なくとも1つの第三成分を導入する
を含むことが好ましい。
【0073】
しかしながら、これらの全ての修飾は、APPまたはAβ中の本来のBリンパ球エピトープ
の実質的なフラクションを維持している間に行われるべきである。なぜなら、天然分子のBリンパ球による認識は、それにより促進されるからである。
【0074】
ある好ましい実施形態においては、側鎖(外来T細胞エピトープまたは上記の第一、第
二および第三成分の形態における)が、共有結合的に、または非共有結合的に導入される。これは、一次元アミノ酸配列を変化させることなく、または鎖中の個別のアミノ酸の間のペプチド結合に少なくとも変化を導入することなく、APPまたはAβに由来するアミノ酸残基の範囲を派生することを意味する。
【0075】
これに代わる、好ましい実施形態は、アミノ酸の置換および/または欠失および/または挿入および/または付加(組換え手段により、またはペプチド合成によりもたらされるであろう;アミノ酸のより長い範囲を含む修飾は、融合ポリペプチドを発生させることができる)を利用する。この実施形態の、ある特に好ましいバージョンは、いくつかのアミノ酸配列を、それぞれ外来免疫優性T細胞エピトープを含むいくつかの対応するアミノ酸
配列で置換し、同時に、アナログ中の自己タンパク質の全体の三次構造を維持する、自己タンパク質のアナログで免疫化することによる自己タンパク質のダウンレギュレーション方法を開示する、WO 95/05849に記載の技術である。しかしながら、本発明の目的に対し
ては、修飾(挿入、付加、欠失または置換)が外来T細胞エピトープを発生させ、同時に
、APPまたはAβ中のB細胞エピトープの実質的な数を維持することで充分である。しかし
ながら、誘導された免疫応答の最大の効率を得るためには、APPまたはAβの全体の三次構造が、修飾された分子中で保存されることが好ましい。
【0076】
APPもしくはAβまたはこれらの断片が変異されていることが好ましい場合がある。Aβ
−43の位置35のメチオニンが、好ましくはロイシンもしくはイソロイシンで置換された置換変異体か、または単純に欠失されていることが特に好ましい。特に好ましいアナログは、C末端に位置する単一のメチオニンを含み、これは、それがアミロイド産生ポリペプチ
ドまたは外来THエピトープ中に天然に発生するからか、またはそれが挿入または付加されたからのいずれかである。よって、外来THエピトープを含むアナログの部分が、C末端に
位置する可能性があるメチオニンを除いては、メチオニンを有さないことも好ましい。
【0077】
1つのメチオニンを除いて全てを除去する主要な理由は、その後、臭化シアンにより開
裂することができ、単独のアナログを放出する、多量体のアナログを組換え的に調製することが可能になることである。この方法により、組換えの産生が促進されることが利点である。
【0078】
実際、本発明において用いられるAPPまたはAβのアナログの全てが、アナログ中のC末
端アミノ酸としての位置にあり、アミロイド産生ポリペプチドもしくは外来THエピトープのいずれかの中にある他のメチオニンは欠失されているか、または他のアミノ酸に置換されている、単一のメチオニンを単に含むという特徴を共有する。
【0079】
さらに興味深いある変異は、Aβ-43中の位置19にあるフェニルアラニンの欠失または置換であり、この変異は、このフェニルアラニン残基のプロリンへの置換であることが特に好ましい。
【0080】
アナログ中で用いられる別の興味深いポリアミノ酸は、Aβ-43タンパク質のトランケーテッド(truncated)部分である。これらは、本発明による免疫原性アナログ中に用いるこ
ともできる。特に好ましいものは、トランケートAβ(1〜42)、Aβ(1〜40)、Aβ(1〜39)、Aβ(1〜35)、Aβ(1〜34)、Aβ(1〜34)、Aβ(1〜28)、Aβ(1〜12)、Aβ(1〜5)、Aβ(13〜28)、Aβ(13〜35)、Aβ(17〜28)、Aβ(25〜35)、Aβ(35〜40)、(36〜42)、およびAβ(35〜42) (カッコ内の数字は、適切な断片を構成するAβ-43のアミノ酸範囲を表す−Aβ(35〜40)は、例えばSEQ ID NO: 2のアミノ酸706〜711に一致する)である。Aβ-43のトランケー
テッド部分をもつこれらの全ての変異は、本明細書に記載のAβ断片、特に実施例1に示す変異9、10、11、12および13を用いて作製することができる。
【0081】
次に示す式は、本発明により一般的に保護される分子的構築物を示す:
(MOD1)s1(アミロイドe1)n1(MOD2)s2(アミロイドe2)n2・・・・(MODx)sx(アミロイドex)nx
(I)
(ここで、アミロイドe1〜アミロイドexは、APPまたはAβのサブシークエンスを含むx個
のB細胞エピトープであり、これらは独立して同一または異なっており、外来の側鎖を有
していても有していなくてもよい;xは≧3の整数であり、n1〜nxはx個の≧0である整数(
少なくとも1つが≧1である)であり、MOD1〜MODxは、保存されたB細胞エピトープの間に導入されたx個の修飾であり、s1〜sxはx個の≧0である整数(アミロイドexサブシークエンスに側鎖が導入されない場合は、少なくとも1つが≧1である) )。
よって、構築物の免疫原性に一般的な機能的抑制があるならば、本発明は、APPまたはAβの本来の配列の順列の全ての種類、およびその中の修飾の全ての種類を許容する。よって、例えばインビボにおいて副作用を示す配列の部分の脱落、または通常細胞内であるので、望まれない免疫学的反応を生じることができる部分の脱落により得られる、修飾されたAPPまたはAβは本発明に含まれる。
【0082】
上で概説した構築物のある好ましいバージョンは、適用可能である場合、アミロイドタンパク質のサブシークエンスを含むB細胞エピトープが、アミロイドが由来する前駆体ポ
リペプチドにおいて、細胞外に露出しないものである。このようなエピトープの選択をすることにより、前駆体を産生する細胞に反応し得る抗体が発生しないことが確実になり、これにより、発生した免疫応答が、望まれないアミロイド沈着に対する免疫応答に限定されるようになる。この場合、それらが産生された細胞に対するいかなる結合をも有さない場合にのみ細胞外の相に露出しているAPPまたはAβのエピトープに対する免疫を誘導することが可能であろう。
【0083】
B細胞エピトープの実質的なフラクション、または本明細書に記載のような修飾に供さ
れるタンパク質の全体の三次構造の保存は、多くの方法により達成することができる。一つ目は、問題のポリペプチドに対するポリクローナル抗血清(例えばウサギにおいて作製された抗血清)を単純に作製し、その後、この抗血清を、産生される修飾されたタンパク質に対する試験試薬として(例えば競合的ELISAにおいて)用いることである。このような
抗血清との限定された(しかしまだ意味のある、特異的な)反応性を示すアナログが本来のB細胞エピトープの実質的なフラクションを保持しているとみなされるが、APPまたはA
βが反応するのと同程度に抗血清と反応する、修飾されたバージョン(アナログ)は、APP
またはAβと同じ全体の三次構造を有するとみなされなければならない。
【0084】
代わりに、APPまたはAβ上の別個のエピトープと反応し得るモノクローナル抗体の選択を作製し、試験パネルとして用いることができる。このアプローチは、1) APPまたはAβ
のエピトープマッピング、および2) 作製されたアナログにおいて保持されるエピトープ
のマッピングを許容する利点を有する。
【0085】
もちろん、第三のアプローチは、APPもしくはAβ、またはこれらの生物学的に活性なトランケート(上記参照)の三次構造を決定し、これを、作製されたアナログの、決定された三次構造と比較することであろう。三次構造は、X線回折の検討およびNMR分光法により決定することができる。三次構造に関する更なる情報は、与えられた分子の三次構造についての有用な情報を得るために、純粋な形態のポリペプチドが要求されるだけであることに利点を有する(X線回折はポリペプチドの結晶を用いることが要求され、NMRはポリペプチドの同位体変形が要求される)円偏光二色性分光分析の検討によりある程度は得ることができる。しかしながら、円偏光二色性分析は二次構造の要素の情報を通じて、正しい三次構造の間接的な証拠を提供することができるのみであるので、決定的なデータを得るには、結局、X線回折および/またはNMRが必要である。
【0086】
本発明のある好ましい実施形態は、APPまたはAβのBリンパ球エピトープの多数の提示
(すなわち、少なくとも1つのB細胞エピトープが2つの位置に存在する式I)を用いる。この効果は、種々の方法、例えば(ポリペプチド由来のAPPまたはAβ)m (ここで、mは≧2の
整数である)の構造を含む融合ポリペプチドを単に作製し、次いでAPPまたはAβ配列の少
なくとも1つに、本明細書に記載の修飾を導入することにより達成することができる。導
入された修飾がBリンパ球エピトープの少なくとも1つの重複および/またはハプテンの導入を含むことが好ましい。選択されたエピトープの多数の提示を含むこれらの実施形態は、APPまたはAβの単なる重要でない部分がワクチン剤における構成成分として有用である場合に、特に好ましい。
【0087】
上述したように、外来T細胞エピトープの導入は、少なくとも一つのアミノ酸の挿入、
付加、欠失または置換の導入により達成することができる。もちろん、通常の状況は、アミノ酸配列における1つ以上の変化の導入(例えば完全なT細胞エピトープの挿入またはそれによる置換)であるが、到達する重要な目的は、抗原提示細胞(APC)により加工された
場合に、アナログが、APCの表面上にMCHクラスII分子の意味において提示されている、このような外来免疫優性T細胞エピトープを生じさせることである。したがって、もし、適
切な位置にあるAPPまたはAβのアミノ酸配列が、外来THエピトープにおいても見出すことができるいくつかのアミノ酸残基を含む場合、外来THエピトープの導入は、アミノ酸の挿入、付加、欠失および置換によって外来エピトープの残りのアミノ酸を提供することにより達成することができる。言い換えると、本発明の目的を満たすために、挿入または置換による完全なTHエピトープの導入は必要ではない。
【0088】
挿入、欠失、置換または付加のアミノ酸の数は、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20および25のような少なくとも2の挿入、置換、付加または欠失であることが好ましい。挿入、置換、付加または欠失のアミノ酸の数が、最大で100
、最大で90、最大で80、最大で70のように150を超えないことがさらに好ましい。置換、
挿入、欠失または付加の数は、60を超えないことが特に好ましく、特に、この数は50または40さえも超えるべきではない。最も好ましくは、30を超えない数である。アミノ酸付加については、得られる構築物が融合ポリペプチドの形態にある場合、これらはしばしば、150よりかなり高いことが記載される。
【0089】
本発明の好ましい実施形態は、少なくとも1つの外来免疫優性T細胞エピトープを導入することによる修飾を含む。T細胞エピトープの免疫優性の問題は、問題の動物種に依存す
ることが理解されるであろう。本明細書において用いられるように、「免疫優性」の語は、ワクチン化された個体/個体群においてかなりの免疫応答を起こすエピトープを単にい
うが、ある個体/個体群において免疫優性であるT細胞エピトープは、同じ種の他の個体においても免疫優性である必要がなく、それが後者の個体においてはMHC-II分子に結合することが可能であってもそうであることは公知の事実である。よって、本発明の目的については、免疫優性T細胞エピトープは、抗原中に存在する場合に、T細胞の援助を提供するのに効果的なT細胞エピトープである。典型的に、免疫優性T細胞エピトープは、それらが発現するポリペプチドに関わらず、本質的にいつもMHCクラスII分子に結合して提示される
、固有の特徴を有する。
【0090】
他の重要な点は、T細胞エピトープのMHC制限の問題である。一般的に、天然に発生するT細胞エピトープはMHC制限され、すなわちT細胞エピトープを構成する、あるペプチドはMHCクラスII分子の部分集合に効果的に結合するのみである。これは、多くの場合、ある特定のT細胞エピトープの使用が、個体群のフラクションにおいてのみ効果的であるワクチ
ン成分となる効果を有し、そのフラクションのサイズに依存して、同じ分子においてより多くのT細胞エピトープを含むか、または代わりに構成成分が導入されたT細胞エピトープ
の性質によって互いに区別されるAPPまたはAβの変形である多成分ワクチンを作製することが必要になることが可能である。
【0091】
もし、用いるT細胞のMHC制限が全くわからない場合(例えばワクチン化された動物がほとんど明確でないMHC組成物を有する状況において)、特定のワクチン組成物により包含
される個体群のフラクションは、次の式
【0092】
【数1】

【0093】
(ここで、piは、ワクチン組成物に存在するi番目の外来T細胞エピトープに対する、応答
者の個体群中の頻度であり、nはワクチン組成物中の外来T細胞エピトープの総数である)により見積もられる。よって、それぞれ0.8、0.7および0.6の個体群における応答頻度を
有する、3つの外来T細胞エピトープを含むワクチン組成物は
1 − 0.2 × 0.3 × 0.4 = 0.976
を与えることになり、すなわち、個体群の97.6%が、ワクチンに対するMHC-II媒介応答を統計学的に有するであろう。
【0094】
上記式は、用いるペプチドの多少正確なMHC制限パターンがわかっている状況において
は当てはまらない。もし、例えばあるペプチドがHLA-DR対立遺伝子であるDR1、DR3、DR5
およびDR7によりエンコードされるヒトMHC-II分子にのみ結合するのであれば、このペプ
チドを、HLA-DR対立遺伝子によりエンコードされる残りのMHC-II分子に結合する他のペプチドとともに用いることが、問題の個体群における100%の適用範囲を達成する。同様に
、もし第二のペプチドがDR3およびDR5にのみ結合するならば、このペプチドの添加は、適用範囲を全く増加させない。もしワクチン中のT細胞エピトープの純粋にMHC制限上への個体群の応答の計算に基礎をおく場合、特定のワクチン組成物により包含される個体群の最小のフラクションは次の式:
【0095】
【数2】

【0096】
(ここで、φjは、ワクチン中のT細胞エピトープのいずれか一つに結合し、3つの公知のHLA遺伝子座(DP、DRおよびDQ)のj番目に属する、MHC分子をエンコードする対立遺伝子のハプロタイプの個体群中の頻度の合計である;実際問題として、まずどのMHC分子がワクチ
ン中の各T細胞エピトープを認識するのかを決定し、その後それらをタイプ(DP、DRおよびDQ)により列挙し、次いで列挙された異なる対立遺伝子のハプロタイプのそれぞれの頻度
を各タイプについて合計し、それによりφ1、φ2およびφ3を得る)により決定すること
ができる。
【0097】
式IIのpiの値が、対応する理論値πi:
【0098】
【数3】

【0099】
(ここで、νjは、ワクチン中のi番目のT細胞エピトープに結合し、3つの公知のHLA遺伝
子座(DP、DRおよびDQ)のj番目に属する、MHC分子をエンコードする対立遺伝子のハプロタイプの個体群中の頻度の合計である)を超えることが起こり得る。これは、1 − Πiの個体群中では、応答者の頻度のf残存-i = (pi − Πi) / (1 − Πi)であることを意味する。よって、式IIIは、式V:
【0100】
【数4】

【0101】
(ここで、1 − f残存-iの表現は、負である場合、ゼロに設定される)を得るように調節することができる。式Vは、全てのエピトープがハプロタイプの同じ組に対してハプロタ
イプの位置づけをされていることが必要であることが記載される。
【0102】
よって、アナログに導入されることとなるT細胞エピトープを選択する場合、エピトー
プについての入手可能である全ての知識を含むことが重要である:1) 個体群中の応答者
の各エピトープに対する頻度、2) MHC制限データ、および3) 適切なハプロタイプの個体
群中における頻度である。
【0103】
動物種または動物個体群の多くの割合において活性である、天然に発生する「乱交雑」T細胞エピトープがいくつか存在し、これらはワクチンに導入されることが好適であり、
それにより同じワクチン中における非常に多数の異なるアナログの必要性が減少される。
【0104】
本発明の乱交雑エピトープは、破傷風トキソイド(例えばP2およびP30エピトープ)、ジ
フテリアトキソイド、インフルエンザウイルスヘマグルチニン(HA)、およびピー・ファルシパルム(P. falciparum) CS抗原からのエピトープのような天然に発生するヒトT細胞エ
ピトープであることができる。
【0105】
長年にわたって、他の乱交雑T細胞エピトープがいくつか同定されている。特に、異な
るHLA-DR対立遺伝子によりエンコードされるHLA-DR分子の多くの割合に結合することができるペプチドが同定され、これらは全て、本発明において用いるアナログに導入される可能性があるT細胞エピトープである。本明細書にその全てが参照として組み込まれる、次
の参考文献において議論されるエピトープも参照:WO 98/23635 (Frazer IHら、The University of Queenslandに譲渡);Southwood Sら、1998、J. Immunol. 160:3363〜3373;Sinigaglia Fら、1988、Nature 336:778〜780;Chicz RMら、1993、J. Exp. Med 178:27〜47;Hammer Jら、1993、Cell 74:197〜203;およびFalk Kら、1994、Immunogenetics 39:230〜242。後の参考文献もまたHLA-DQおよび-DPリガンドに関する。これらの5つの参考文献に列挙されたエピトープは全て、本発明において用いることとなる天然のエピトープの候補として適切である。なぜなら、これらと共通モチーフを共有するエピトープだからである。
【0106】
代わりに、エピトープは、MHCクラスII分子の多くの割合に結合することができるいず
れの人工T細胞エピトープであってもよい。この関連において、WO 95/07707および対応する論文Alexander Jら、1994、Immunity 1:751〜761(どちらの開示も本明細書に参照として組み込まれる)に記載のpan DRエピトープペプチド("PADRE")は、本発明により用いら
れることとなるエピトープの候補として興味深い。これらの論文に開示の最も効果的なPADREペプチドは、投与されたときに安定性を向上するためにCおよびN末端にD-アミノ酸を有することが記載される。しかしながら、本発明は、続いてAPCのリソソーム区画内で酵
素的に分解され、MHC-II分子に関する、続いて起こる提示を許容するアナログの部分としての適切なエピトープの組み込みをまず目的とし、よって本発明において用いるエピトープではD-アミノ酸を組み込むことは得策ではない。
【0107】
特に好ましいPANDREペプチドは、アミノ酸配列AKFVAAWTLKAAA (SEQ ID NO: 17)または
その免疫学的に有効なサブシークエンスを有するものである。同じMHC制限の欠損を有す
るこのエピトープおよび他のエピトープは、本発明の方法に用いるアナログ中に存在するべき、好ましいT細胞エピトープである。このような超乱交雑(super-promiscuous)エピトープは、ただ1つの単独のアナログがワクチン化された動物の免疫系に提示される、本発
明の最も単純な実施形態について許容する。
【0108】
上述したように、APPまたはAβの修飾は、APCまたはBリンパ球に対して修飾されたアミロイド産生ポリペプチドを標的化する第一成分の導入をも含む。例えば、第一成分は、B
リンパ球特異的表面抗原またはAPC特異的表面抗原に対する特異的結合パートナーである
ことができる。多くのこのような特異的表面抗原が当該技術において公知である。例えば、該成分は、Bリンパ球またはAPC上にそれに対する受容体がある炭水化物(例えばマンナ
ンまたはマンノース)であることができる。代わりに、第二成分はハプテンであることが
できる。APCまたはリンパ球上の表面分子を特異的に認識する抗体フラグメントは、第一
成分として用いることができる(表面分子は、例えばFCγRIのようなマクロファージおよび単核細胞のFCγ受容体、または代わりに、CD40もしくはCTLA-4のようなその他のいかなる特異的表面マーカーであってよい)。これらの全ての例示した標的化分子は、アジュバントの部分としても用いることができることが記載される、下記を参照。
【0109】
増大された免疫応答を達成するために、ある細胞タイプに対するアナログの標的化の代替物または補足物として、免疫系を刺激する上記の第二成分を含むことにより免疫系の応答性のレベルを増加させることが可能である。このような第二成分の典型的な例は、サイトカインおよびヒートショックタンパク質または分子状シャペロン、ならびにそれらの効果的な部分である。
【0110】
本発明に用いられる好適なサイトカインは、ワクチン組成物中でアジュバントとしても通常機能するもの、すなわち、例えばインターフェロンγ(IFN-γ)、インターロイキン1 (IL-1)、インターロイキン2 (IL-2)、インターロイキン4 (IL-4)、インターロイキン6 (IL-6)、インターロイキン12 (IL-12)、インターロイキン13 (IL-13)、インターロイキン15
(IL-15)、および顆粒球マクロファージコロニー刺激因子(GM-CSF)である;代わりに、サイトカイン分子の機能性部分は、第二成分として充分であろう。このようなサイトカインのアジュバント物質としての使用に関しては、以下の議論を参照。
【0111】
本発明によると、第二成分として用いられる好適なヒートショックタンパク質または分子状シャペロンは、HSP70、HSP90、HSC70、GRP94 (gp96としても知られる、Wearsch PAら、1998、Biochemistry 37:5709〜19参照)、およびCRT (カルレティキュリン)であることができる。
【0112】
代わりに、第二成分は、リステリオライシン(LLO)、リピドAおよび熱不安定エンテロトキシンのようなトキシンであることができる。また、MDP (ムラミルジペプチド)、CFA (
完全フロイントアジュバント)、ならびにトレハロースジエステルTDMおよびTDEのような
いくつかのマイコバクテリア由来物も興味深い可能性である。
【0113】
免疫系に対するアナログの提示を増大させる第三成分の導入の可能性も、本発明の重要な実施形態である。当該技術は、この原理のいくつかの例を示している。例えば、ボレリア・ブルグドルフェリ(Borrelia burgdorferi)タンパク質OspA中のパルミトイル脂質化アンカーは、自己アジュバント化ポリペプチドを与えるように用いることができることが知られている(例えばWO 96/40718参照)−脂質化タンパク質は、ポリペプチドの脂質化アン
カー部分とそこから突起している分子の残りの部分とから構成される核とともにミセル様構造を形成し、抗原決定基の多数の提示となるようである。よって、この使用および異なる脂質化アンカー(例えばミリスチル基、ミリスチル基、ファルネシル基、ゲラニル−ゲ
ラニル基、GPI−アンカー、およびN-アシルジグリセリド基)を用いる、関連するアプローチは、本発明の好ましい実施形態であり、それは、特に組換え的に産生されたタンパク質におけるこのような脂質化アンカーの提供は、全く率直であり、アナログへの融合パートナーとして、例えば天然に発生するシグナル配列の使用を単に必要とするだけであるからである。他の可能性は、相補因子C3のC3d断片またはC3自体の使用である(Dempseyら、1996、Science 271、348〜350およびLou & Kohler、1998、Nature Biotechnology 16、458〜462参照)。
【0114】
免疫系に対するAPPまたはAβの重要なエピトープ領域の多コピー(例えば少なくとも2)
の好ましい提示となる、本発明の別の実施形態は、特定分子、すなわち上記の変形dまた
はeへのアナログの共有結合である。例えばポリマーを用いることができ、例えばデキス
トランのような炭水化物(例えばLees Aら、1994、Vaccine 12:1160〜1166;Lees Aら、1990、J Immunol. 145:3594〜3600参照)であるが、マンノースおよびマンナンも有用な代替物である。例えばイー・コリ(E. coli)およびその他のバクテリアからの必要不可欠な
膜タンパク質も有用な結合パートナーである。キーホールリンペットヘモシアニン(KLH)
、破傷風トキソイド、ジフテリアトキソイドおよびウシ血清アルブミン(BSA)のような伝
統的な担体分子も、好ましい有用な結合パートナーである。
【0115】
炭水化物のような、ポリヒドロキシポリマーへのAPPまたはAβの由来物の共有結合の好ましい実施形態は、ポリヒドロキシポリマーに別個に結合する少なくとも1つのAPPまたはAβ由来ペプチドおよび少なくとも1つの外来Tヘルパーエピトープの使用を含む(すなわち、外来TヘルパーエピトープおよびAPPまたはAβ由来アミノ酸配列は互いに融合するので
はなく、むしろポリヒドロキシポリマーに結合し、次いでそれが担体の骨格としての役割を果たす)。再び、このような実施形態は、APPまたはAβ由来ペプチドの領域を有する適
切なB細胞エピトープが、短いペプチドの範囲により構成される場合に、最も好ましい−
これは、このアプローチが、得られる免疫原性の剤における選択されたエピトープの多数の提示を達成する非常に簡便な方法の一つだからである。しかしながら、本明細書においてすでに述べたアナログをポリヒドロキシポリマー骨格に単純に結合させる、すなわちAPPまたはAβ由来物が外来THエピトープとは別個に骨格に結合していないことも可能である。
【0116】
外来TヘルパーエピトープおよびAPPまたはAβ由来(ポリ)ペプチドの結合は、ペプチダ
ーゼにより切断可能なアミド結合によることが好ましい。このストラテジーは、APCがコ
ンジュゲートを取り上げると、同時にコンジュゲートを加工処理することができ、続いてMHCクラスIIの関係において外来T細胞エピトープを提示する効果を有する。
【0117】
ペプチド(興味の対象であるAPPまたはAβ由来ペプチドとともに外来エピトープの両方)の結合を達成する一つの方法は、トレシル(トリフルオロエチルスルホニル)基またはマレイミド、p-ニトロフェニルクロロホルメート(OH基の活性化およびペプチドとポリヒドロ
キシポリマーとの間のペプチド結合の形成のため)、およびトシル(p-トルエンスルホニル)のようなその他の適切な活性化基を用いて、適切なポリヒドロキシポリマーを活性化す
ることである。例えば、WO 00/05316およびUS 5,874,469(両者とも本明細書に参照として組み込まれる)に記載のようにして、活性化された多糖類を製造して、これらをAPPまたはAβ由来ペプチドまたはポリアミノ酸、ならびに通常の固相もしくは液相ペプチド合成技
術により作製されたT細胞エピトープに結合させることが可能である。得られた生成物は
、APPまたはAβおよび外来T細胞エピトープに由来のポリアミノ酸を、そのN末端またはその他の利用可能な窒素部分により結合して有する、ポリヒドロキシポリマー骨格(例えば
デキストラン骨格)からなる。所望により、N末端にある一つを除いて全ての利用可能なアミノ基を保護するようにAPPまたはAβペプチドを合成し、続いて、得られた保護されたペプチドをトレシル化されたデキストラン部分に結合し、最後に、得られたコンジュゲートを脱保護することが可能である。このアプローチの特定の例は、以下の実施例に述べる。
【0118】
WO 00/05316およびUS 5,874,469に教示のような水溶性多糖類分子を使用する代わりに
、架橋された多糖類分子を用いることが同等に可能であり、それによりポリペプチドおよび多糖類の間の粒状のコンジュゲートを得る−これは、2つの目的、すなわちコンジュゲ
ートを注射した場合の局所的沈着効果を得ること、およびAPCに対してひきつける力があ
る標的である粒子を得ることが達成されるので、免疫系に対するポリペプチドの向上された提示に導くと考えられている。このような粒状の系を用いるアプローチも、実施例において説明する。
【0119】
APPまたはAβに修飾を導入するのに選択された領域については、a) 知られた、予想さ
れるB細胞エピトープの保存、b) 三次構造の保存、c) 「産生細胞」上にB細胞エピトープが存在することの回避などを考慮することが根底にある。いずれにしても、上述したように、異なる位置におけるT細胞エピトープの導入に全て供されたアナログの一組を検査す
ることは、全く簡単である。
【0120】
本発明の最も好ましい実施形態がヒトAβのダウンレギュレーションを含むので、上記
のAPPまたはAβポリペプチドはヒトAβポリペプチドであることが好ましい。この実施形
態においては、APPまたはAβポリペプチドは、SEQ ID NO: 2における少なくとも1つのア
ミノ酸配列が、同じもしくは異なる長さであって、外来THエピトープを含む少なくとも1
つのアミノ酸配列で置換されることにより修飾されていることが特に好ましい。修飾されたアミロイド産生APPおよびAβの好ましい例を、P2およびP30エピトープを例として用い
て、図1に概略を示す。このような構築物の背景原理は、実施例において詳細に論ずる。
【0121】
より特異的には、SEQ ID NO: 2中に導入されるTHを含む(または完成する)アミノ酸配列は、SEQ ID NO: 2中のいずれのアミノ酸において導入してもよい。すなわち、導入はSEQ ID NO: 2中の1〜770のいずれのアミノ酸の後でもよいが、好ましくはSEQ ID NO: 2の671
、672、673、674、675、676、677、678、679、680、681、682、683、684、685、686、687、688、689、690、691、692、693、694、695、696、697、698、699、700、701、702、703、704、705、706、707、708、709、710、711、712、713および714のいずれかのアミノ酸
の後である。これは、1〜671のいずれかもしくは全てのアミノ酸、または715〜770のいずれかもしくは全てのアミノ酸の欠失と組合わせてもよい。さらに、置換の技術を用いる場合、SEQ ID NO: 2中の671、672、673、674、675、676、677、678、679、680、681、682、683、684、685、686、687、688、689、690、691、692、693、694、695、696、697、698、699、700、701、702、703、704、705、706、707、708、709、710、711、712、713および714のいずれか1つのアミノ酸が、導入と組合わせて置換されていてもよい。
【0122】
本発明の他の実施形態は、T細胞応答を開始するMHCクラスII分子に生産的に結合する、SEQ ID NO: 2のいずれのサブシークエンスをも含まないアナログの提示である。
【0123】
免疫系が例えば抗Aβ免疫応答を誘導することを保証する抗原の設計についてのこのよ
うなストラテジーの背景にある原理は、次のようである:自己タンパク質に対する体の免疫寛容性を破壊するのに充分に強いアジュバント中に処方された、Aβのような豊富な自
己由来タンパク質で免疫化する場合、あるワクチン化された個体においては、誘導された免疫応答が、単純に免疫化を停止するだけでは停止されない危険性がある。これは、このような個体において誘導された免疫応答が、自己タンパク質の天然THエピトープにより推進されているようであり、このことがワクチン化された個体自身のタンパク質が、それ自身で免疫化剤として機能し得る悪影響を有するからである:よって、自己免疫状態が確立されている。
【0124】
外来THエピトープの使用を含む好ましい方法は、抗−自己免疫応答が外来THエピトープにより推進されるので、発明者の知る限りでは、この効果を生み出すことは観察されておらず、好ましい技術に頼った、誘導された免疫応答が免疫化の停止後に実際に衰弱することは、本発明者らにより繰り返して示されている。しかしながら、免疫応答がそれに対して免疫化する適切な自己タンパク質の自己THエピトープによっても推進されることは、いくつかの個体において理論上では起こり得る−これは、比較的豊富にある、Aβのような
自己タンパク質を考慮する場合に特に適切であるが、他の治療上適切な自己タンパク質は局所的に存在するだけであるか、または体内において、「自己免疫効果」が不可能であるほど非常にわずかな量である。これを回避するある非常に単純な方法は、THエピトープとして役に立つことができるであろうペプチド配列の免疫原を含むことを全く回避することである(および、約9アミノ酸より短いペプチドはTHエピトープとして役に立つことがで
きないので、より短い断片の使用は、ある単純で実行可能なアプローチである)。したがって、本発明のこの実施形態は、さもなければTHエピトープとして機能するであろう標的タンパク質の配列中の保存性の置換を単に含む配列を含む、「自己刺激THエピトープ」として役に立つことができる、標的APPまたはAβのペプチド配列を含まない免疫原を確実にすることを供給する。
【0125】
APPまたはAβのアナログの免疫系提示の好ましい実施形態は、MHCクラスII分子に生産
的に結合しない少なくとも1つのAPPまたはAβ由来ペプチド、および少なくとも1つの外来Tヘルパーエピトープを含むキメラペプチドの使用を含む。さらに、APPまたはAβ由来ペ
プチドがB細胞エピトープを有することが好ましい。免疫原性アナログが、1つ以上のB細
胞エピトープを含むアミノ酸配列が連続配列または挿入を含む配列のいずれかとして表されるものであり、該挿入が外来Tヘルパーエピトープを含むことが特に好ましい。
【0126】
再び、このような実施形態は、APPまたはAβの領域を有する適切なB細胞エピトープが
、MHCクラスII分子に生産的に結合することができる手段がない、短いペプチド範囲から
なる場合に最も好ましい。アミロイド産生ポリペプチドの選択されたB細胞エピトープま
たは複数のエピトープは、したがってSEQ ID NO: 2の最大で9の連続したアミノ酸を含む
べきである。アミロイド産生ポリペプチドのアミノ酸配列からの、最大で8、7、6、5、4
または3の連続したアミノ酸を有するもののような、より短いペプチドが好ましい。
【0127】
アナログがSEQ ID NO: 2の少なくとも1つのサブシークエンスを含むので、そのような1つのサブシークエンスがそれぞれ独立して、9の連続したアミノ酸、8の連続したアミノ酸、7の連続したアミノ酸、6の連続したアミノ酸、5の連続したアミノ酸、4の連続したアミノ酸、および3の連続したアミノ酸からなる群より選択される、APPまたはAβからのアミ
ノ酸範囲からなることが好ましい。
【0128】
連続したアミノ酸が、SEQ ID NO: 2の残基672、673、674、675、676、677、678、679、680、681、682、683、684、685、686、687、688、689、690、691、692、693、694、695、
696、697、698、699、700、701、702、703、704、705、706、707、708、709、710、711、712、713および714からなる群より選択されるアミノ酸残基から始まることが特に好まし
い。
【0129】
タンパク質/ペプチドワクチン化;アナログの処方および投与
動物へのアナログの投与により動物の免疫系にアナログを提示する場合、ポリペプチドの処方は、当該技術において通常承認される原理に従う。
【0130】
有効成分としてペプチド配列を含むワクチンの製造は、全て本明細書に参照として組み込まれる米国特許4,608,251;4,601,903;4,599,231;4,599,230;4,596,792;および4,578,770に例示のように、当該技術において一般的によく理解されている。典型的には、このようなワクチンは、液体の溶液または懸濁物のいずれかとして、注射可能なように製造される;注射の前の液体における溶液または液体における懸濁物に適した固体形態も製造することができる。製造物は、乳化されていてもよい。
【0131】
免疫原性有効成分は、医薬上許容され、有効成分に影響を及ぼさない添加剤としばしば混合される。適切な添加剤は、例えば水、食塩水、デキストロース、グリセロール、エタノールなど、またはこれらの組合わせである。加えて、所望により、ワクチンは、湿潤剤もしくは乳化剤、pH緩衝剤、またはワクチンの効果を増大させるアジュバントのような補助物質を少量含むことができる;以下の、アジュバントの詳細な議論を参照。
【0132】
ワクチンは、非経口で、例えば皮下、皮内または筋肉内のいずれかの注射により、通常、投与される。投与の他の形態に適した付加的な製剤は、坐剤や、ある場合においては、経口、バッカル、舌下、腹膜内、膣内、肛門、硬膜外、脊髄、および頭蓋内の製剤を含む。坐剤については、伝統的な結合剤および担体は、例えばポリアルキレングリコールまたはトリグリセリドを含むことができる;このような坐剤は、有効成分を0.5%〜10%、好ま
しくは1〜2%の範囲で含む混合物からつくられる。経口製剤は、例えば医薬グレードのマ
ンニトール、ラクトース、スターチ、ステアリン酸マグネシウム、サッカリンナトリウム、セルロース、炭酸マグネシウムなどの通常用いられる添加剤を含む。これらの組成物は、溶液、懸濁液、錠剤、丸剤、カプセル、持続放出性製剤または粉剤の形態をとり、10〜95%、好ましくは25〜70%の有効成分を含む。経口製剤について、コレラトキシンは、興味深い製剤パートナーである(および抱合パートナーとしても可能性がある)。
【0133】
ポリペプチドは、中性または塩の形態でワクチンに処方することができる。医薬上許容される塩は、酸付加塩(ペプチドの遊離のアミノ基とともに形成される)、および例えば塩酸もしくはリン酸のような無機酸、または酢酸、シュウ酸、酒石酸、マンデル酸などの有機酸とともに形成されるものを含む。遊離のカルボキシル基と形成される塩は、例えば水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、水酸化カルシウム、または水酸化第二鉄のような無機塩基、およびイソプロピルアミン、トリメチルアミン、2−エチル
アミノ エタノール、ヒスチジン、プロカインなどの有機塩基に由来するものであってもよい。
【0134】
ワクチンは、投与量製剤に影響を及ぼさない方法で、治療上有効な免疫原性である量で投与される。投与される量は、例えば免疫応答をする個体の免疫系の受容力、および所望の防御の程度を含み、治療される被験者に依存する。適切な投与量範囲は、ワクチン接種あたり数百μgのオーダーの有効成分であり、好ましい範囲が、約0.5μg〜1,000μgの範
囲のような約0.1μg〜2,000μg (1〜10 mgの範囲のより高い量が予期されるが)、好まし
くは1μg〜500μmの範囲、特に約10μg〜100μgの範囲である。
最初の投与およびブースター注射の好適なレジメント(regiments)も変動するが、最初
の投与に続いて接種または他の投与を行うことにより代表される。
【0135】
適用の仕方は広く変動する。ワクチンの投与の通常の方法のいずれも適用可能である。これらは、固体の生理学的に許容されるベース上の、または生理学的に許容される分散液中の経口適用、注射による非経口などを含む。ワクチンの投与量は、投与経路に依存し、ワクチン化されるヒトの年齢および抗原の製剤により変動する。
【0136】
ワクチンのポリペプチドのいくつかは、ワクチン中において充分に免疫原性であるが、他のいくつかについては、ワクチンがさらにアジュバント物質を含む場合、免疫応答が増強される。
【0137】
ワクチンについてアジュバント効果を達成する種々の方法が知られている。一般的な原理および方法は、“The Theory and Practical Application of Adjuvants"、1995、Duncan E.S. Stewart-Tull(編)、John Wiley & Sons Ltd、ISBN 0-471-95170-6、および“Vaccines: New Generationn Immunological Adjuvants"、1995、Gregoriadis Gら(編)、Plenum Press、New York、ISBN 0-306-45283-9に詳述され、両者とも本明細書に参照として組み込まれる。
【0138】
自己抗原への自己寛容の破壊の促進を示し得るアジュバントを用いることが、特に好ましい;実際、非修飾アミロイド産生ポリペプチドを自己ワクチン中の有効成分として用いる場合に、これは必須である。適切なアジュバントの制限されない例は、免疫標的化アジュバント;トキシン、サイトカインおよびマイコバクテリア派生物のような免疫変調アジュバント;油処方成分;ポリマー;ミセル形成アジュバント;サポニン;免疫刺激複合マトリクス(immunostimulating complex matrix) (ISCOMマトリックス);粒子;DDA;アル
ミニウムアジュバント;DNAアジュバント;γ−イヌリン;およびカプセル化アジュバン
トからなる群より選択される。一般的に、アナログ中の第一、第二および第三成分として有用な化合物および剤に関する上記の開示は、必要な変更を加えて、本発明のワクチンのアジュバントにおけるそれらの使用に当てはまることが記載される。
【0139】
アジュバントの適用は、緩衝食塩水中の0.05〜0.1%溶液として通常用いられる水酸化アルミニウムまたはリン酸アルミニウム(ミョウバン)のような剤、0.25%溶液として用い
られる糖の合成ポリマー(例えばCarbopol(登録商標))との混合物の使用を含み、それぞれ70〜101℃の範囲の温度において30秒〜2分間の熱処理によるワクチン中のタンパク質の凝集、および架橋剤による凝集も可能である。アルブミンへのペプシン処理抗体(Fab断片)を用いた再活性化による凝集、シー・パルバム(C. parvum)のような細菌細胞もしくはエンドトキシンもしくはグラム陰性細菌のリポ多糖類成分との混合物、マンニドモノ−オレエート (Aracel A)のような生理学的に許容される油賦形剤中の乳化物、またはブロック
代替物として用いられるパーフルオロカーボン(Fluosol-DA)の20%溶液とのエマルジョン
も用いることができる。スクアレンのような油およびIFAとの混合物も好ましい。
【0140】
本発明によると、DDA(ジメチルジオクタデシルアンモニウム ブロミド)は、DNAおよびγ−イヌリンのままでのアジュバントだけでなくフロイントの完全アジュバントおよび不完全アジュバントとして興味深い候補であり、またQuilAおよびQS21のようなキラヤサポ
ニンはRIBIのままで興味深い。更なる可能性は、モノホスホリルリピドA (MPL)、前記のC3およびC3d、ならびにムラミルジペプチド(MDP)である。
【0141】
リポソーム製剤も、アジュバント効果を与えることが知られており、よって本発明によると、リポソームアジュバントは好ましい。
【0142】
また、免疫刺激複合体マトリックスタイプ (ISCOM(登録商標)マトリックス)アジュバントも、このタイプのアジュバントがAPCによりMHCクラスII発現をアップレギュレーショ
ンすることができるので特に、本発明による好ましい選択である。ISCOM(登録商標)マ
トリックスは、キラヤ・サポナリア(Quillaja saponaria)からの(任意に分別された)サポニン(トリテルペノイド)、コレステロール、およびリン脂質からなる。免疫原性タンパク質と混合した場合、得られる粒子製剤は、サポニンが60〜70%、コレステロールおよびリ
ン脂質が10〜15%、ならびにタンパク質が10〜15%を構成する、ISCOM粒子として知られる
ものである。組成物および免疫刺激複合体に関する詳細は、例えばアジュバントに関する上記の教科書に見出されるが、Morein Bら、1995、Clin. Immunother. 3:461〜475、な
らびにBarr IGおよびMitchell GF、1996、Immunol. and Cell Biol. 74:8〜25(両者とも本明細書に参照として組み込まれる)も、完全免疫刺激複合体の製造についての有用な教
示を与える。
【0143】
アジュバント効果を達成する、その他の非常に興味深い(よって、好ましい)可能性は、Gosselinら、1992(本明細書に参照として組みこまれる)に記載の技術を用いることである。簡単に、本発明の抗原のような適切な抗原の提示は、抗原を単核/マクロファージ上
のFcγ受容体に対する抗体(または抗原結合抗体フラグメント)に結合させることにより増大される。特に、抗原と抗−FcγRIとの間の抱合は、ワクチン化の目的のための免疫原性を増大させることが示されている。
【0144】
他の可能性は、アミロイド産生ポリペプチドの修飾されたバージョン中の第一及び第二成分の候補として上述した標的化および免疫調節物質(とりわけサイトカイン)の使用を含む。この関連において、ポリI:Cのようなサイトカインの合成インデューサーも可能性
がある。
【0145】
好適なマイコバクテリア由来物は、ムラミルジペプチド、完全フロイントアジュバント、RIBI、ならびにTDMおよびTDEのようなトレハロースのジエステルからなる群より選択される。
【0146】
好適な免疫標的化アジュバントは、CD40リガンドおよびCD40抗体またはそれらの特異的結合断片(上記の議論参照)、マンノース、Fab断片、ならびにCTLA-4からなる群より選択
される。
【0147】
好適なポリマーアジュバントは、デキストラン、PEG、スターチ、マンナンおよびマン
ノースのような炭水化物;プラスチックポリマー;ならびにラテックスビーズのようなラテックスからなる群より選択される。
【0148】
興味深いその他の免疫応答の調節の手段は、「バーチャルリンパ節」(VLN) (ImmunoTherapy, Inc.、360 Lexington Avenue、New York、NY 10017-6501により開発された専売医
用装置)中に、免疫原(任意にアジュバントおよび医薬上許容される担体および賦形剤とともに)を含むことである。VLN(薄い管状の装置)は、リンパ節の構造および機能を模倣している。皮膚の下へのVLNの挿入は、サイトカインおよびケモカインの急な高まりを伴う無
菌の炎症の部位を創生する。T細胞およびB細胞とともにAPCも危険信号に迅速に応答し、
炎症を起こした部位に戻り、VLNの多孔性マトリックスの内側に蓄積する。抗原に免疫応
答を装備するのに要求される必要な抗原投与量は、VLNを用いる場合に減少されることと
、VLNを用いたワクチン化により与えられた免疫防御は、アジュバントとしてRibiを用い
た通常の免疫化に勝ることとが示されている。この技術は、とりわけGelber Cら、1998、"Elicitation of Robust Cellular and Humoral Immune Responses to Small Amounts of
Immunogens Using a Novel Medical Device Designated the Virtual Lymph Node":"From the Laboratory to the Clinic, Book of Abstracts、October 12th〜15th 1998, Seascape Resort、Aptos、California"に簡単に記載されている。
【0149】
ワクチンの微粒子製剤は、タンパク質抗原の免疫原性を増加させることが多くの件で示され、したがって本発明の他の好ましい実施形態である。微粒子は、抗原と、ポリマー、脂質、炭水化物もしくは粒子を形成するのに好適な他の分子との共製剤として作られるか、または微粒子は抗原自体のみからなる均質の粒子であることができる。
【0150】
ポリマーベースの微粒子の例としては、ポリマーと抗原とが固体粒子に濃縮されたPLGAおよびPVPベースの粒子(Gupta, R.K. ら、1998)である。脂質ベースの粒子は、ミセルの
中に抗原を取り込んだ脂質のミセル(いわゆるリポソーム)として作ることができる(Pietrobon, P.J. 1995)。炭水化物ベースの粒子は、スターチまたはキトサンのような適切な分解し得る炭水化物から典型的に作られる。炭水化物と抗原とを混合し、ポリマー粒子について用いられた方法(Kas, H.S.ら、1997)と同様の方法で粒子に濃縮する。
【0151】
抗原のみからなる粒子は、種々の噴霧および凍結乾燥技術により作ることができる。本発明の目的に特に好適なものは、制御されたサイズの非常に均一な粒子を作るのに用いられる超臨界流体技術である(York, P. 1999およびShekunov, B.ら、1999)。
【0152】
ワクチンは、1年に1、2、3、4、5または6回のような年に1〜6回、個体に必要に応じて
投与されるべきであることが予期される。本発明による好ましい自己ワクチンの使用により誘導される記憶免疫性は永続せず、したがって免疫系はアミロイド産生ポリペプチドまたは修飾されたアミロイド産生ポリペプチドで定期的に攻撃されることが必要であることがすでに示されている。
【0153】
遺伝的変異のために、異なる個体が同じポリペプチドに対して変動した強度の免疫応答で反応するであろう。したがって、本発明のワクチンは、免疫応答を増加させるためにいくつかの異なるポリペプチドを含んでいてもよく、これは外来T細胞エピトープ導入の選
択に関する、上記の議論を参照。ワクチンは2以上のポリペプチドを含んでいてよく、全
てのポリペプチドは、上記のとおりである。
この結果、ワクチンは、3〜10の異なるポリペプチドのような3〜20の異なる、修飾または非修飾のポリペプチドを含むことができる。
【0154】
核酸ワクチン化
ペプチドベースワクチンの伝統的な投与の代替として、核酸ワクチン化(「核酸免疫化
」、「遺伝的免疫化」および「遺伝子免疫化」としても知られる)の技術は、多くの魅力
的な特徴を提供する。
【0155】
第一に、伝統的なワクチンのアプローチに比較して、核酸ワクチン化は、免疫原性剤の大規模な製造(例えば修飾されたアミロイド産生ポリペプチドを製造する微生物の工業的規模の発酵の形態)を消費する資源を必要としない。さらに、免疫原を精製およびリフォールディングする装置の必要がない。最後に、核酸ワクチン化は、導入された核酸の発現産物を製造するために、ワクチン化された個体の生化学的器官に頼っているので、発現産物の最適な翻訳後プロセシングが起こることが期待される;これは、上述したように、本来のB細胞エピトープのかなりのフラクションが修飾された分子中に保存されるべきであ
り、B細胞エピトープは、いずれの(生体)分子(例えば炭水化物、脂質、タンパク質など)
の部分からも原則として構成することができるので、自己ワクチン化の場合に特に重要である。したがって、免疫原の本来のグリコシル化およびリピド化は、全体としての免疫原性に非常に重要であり、これは免疫原を産生する宿主を有することにより最も確実にされる。
【0156】
よって、本発明の変形a〜cの好ましい実施形態は、アナログをエンコードする核酸を動物の細胞に導入することにより免疫系にアナログを提示し、それにより核酸が導入された
細胞によるインビボ発現を得ることを含む。
【0157】
本実施形態においては、導入された核酸は、裸のDNA、荷電または非荷電の脂質ととも
に処方されたDNA、リポソーム中に処方されたDNA、ウイルスベクターに包含されたDNA、
トランスフェクション促進タンパク質またはポリペプチドとともに処方されたDNA、標的
化タンパク質またはポリペプチドとともに処方されたDNA、カルシウム沈殿剤とともに処
方されたDNA、不活性担体分子に結合したDNA、ポリマー、例えばPLGA (WO 98/31398に記
載のマイクロカプセル化技術を参照)中またはキチンもしくはキトサン中に被包されたDNA、およびアジュバントとともに処方されたDNAの形態にあり得るDNAが好ましい。この関係において、伝統的なワクチン処方でのアジュバントの使用に適する実用上全ての考慮すべき事柄が、DNAワクチンの処方に当てはまることが注目される。よって、ポリペプチドベ
ースのワクチンの関係においてアジュバントの使用に関する、本明細書における全ての開示は、必要な変更を加えて、核酸ワクチン化技術におけるその使用に当てはまる。
【0158】
上記で説明したポリペプチドベースのワクチンの投与経路および投与スキームに関し、これらは本発明の核酸ワクチンにも適用可能であり、ポリペプチドについての投与経路および投与スキームに適する上記の全ての議論は、必要な変更を加えて、核酸にも当てはまる。核酸ワクチンは、静脈内および動脈内に適切に投与され得ることをこれに追加するべきである。さらに、核酸ワクチンは、いわゆる遺伝子銃により投与され得ることは当該技術において公知であり、よってこのことおよびこれと同等の投与形態は、本発明の部分であるとみなされる。最後に、核酸の投与におけるVLNの使用は、良好な結果を生じること
が報告されており、よってこの特定の投与形態は特に好ましい。
【0159】
さらに、免疫化剤として用いられる核酸は、例えば有用なアジュバントとして論じたサイトカインのような、上記の免疫調節物質の形態にある第一、第二および/または第三成分をエンコードする領域を含むことができる。この実施形態の好ましいバージョンは、アナログのコーディング領域および免疫調節剤のコーディング領域を、異なるリーディングフレームで、または少なくとも異なるプロモーターの制御下で有することを包含する。これにより、アナログまたはエピトープが免疫調節剤の融合パートナーとして産生されるのを回避する。代わりに、2つの別個なヌクレオチド断片を用いることができるが、これは
、同じ分子中に含まれた両方のコーディング領域を有する場合、共発現が確実になる利点があるので、あまり好適ではない。
【0160】
したがって、本発明は
−本発明の核酸断片またはベクター(以下のベクターの議論を参照)、ならびに
−上記の医薬上および免疫学上許容される賦形剤および/または担体および/またはアジュバント
を含む、APPまたはAβに対する抗体産生を誘導する組成物に関する。
【0161】
通常の環境において、変形をエンコードする核酸は、発現がウイルスプロモーターの調節下にあるベクターの形態で導入される。本発明によるベクターのより詳細な議論については、以下の議論を参照。また、核酸ワクチンの処方および使用に関する詳細な議論は入手可能であり、Donnelly JJら、1997、Annu. Rev. Immunol. 15:617〜648およびDonnelly JJら、1997、Life Sciences 60:163〜172を参照。これらの両者の参考文献は、本明細書に参照として組み込まれる。
【0162】
生ワクチン
免疫系に対して、変形a〜cに定義されるようなアナログを提示する第三の代案は、生ワクチン技術の使用である。生ワクチンでは、免疫系への提示は、アナログをエンコードする核酸断片またはこのような核酸断片を組み込んだベクターで形質転換された非病原性微
生物を、動物に投与することによりもたらされる。非病原性微生物は、いずれの適切な弱毒化細菌株(継代培養によるか、または組換えDNA技術による病原性発現産物の除去により弱毒化)、たとえばマイコバクテリウム・ボビス ビーシージー(Mycobacterium bovis BCG.)、非病原性のストレプトコッカス種(Streptococcus spp.)、イー・コリ、サルモネラ
種(Salmonella spp.)、ビブリオ・コレラ(Vibrio cholerae)、シゲラ(Shigella)であってもよい。最新の生ワクチンの製造に関する概説は、例えばSaliou P、1995、Rev. Prat. 45:1492〜1496およびWalker PD、1992、Vaccine 10:977〜990に見出され、両者は本明細書中に参照として組み込まれる。このような生ワクチン中で用いられる核酸断片およびベクターについての詳細は、以下の議論を参照。
【0163】
細菌の生ワクチンの代替物として、ワクシニア株またはいずれの他の適切なポックスウイルスのような非ビルレントウイルスワクチンベクター中に、以下で論じられる本発明の核酸断片を組み込むことができる。
【0164】
通常、非病原性微生物またはウイルスは、動物に一度のみ投与されるが、防御免疫を維持するために、寿命の間に1回以上微生物を投与することが必要な場合がある。ポリペプ
チドワクチン化について上記で説明したような免疫化スキームが、生またはウイルスワクチンを用いる場合に、有用であろうことが考えられる。
【0165】
代わりに、生またはウイルスワクチン化を、その前またはその後のポリペプチドおよび/または核酸ワクチン化と組合わせてもよい。例えば、生またはウイルスワクチンによる一次免疫化をもたらし、続いてポリペプチドまたは核酸アプローチを用いてブースター免疫化を行うことが可能である。
【0166】
微生物またはウイルスは、例えば有用なアジュバントとして論じたサイトカインのような、上記の免疫調節物質の形態にある第一、第二および/または第三成分をエンコードする領域を含む核酸で形質転換されることができる。この実施形態の好ましいバージョンは、アナログのコーディング領域および免疫調節剤のコーディング領域を、異なるリーディングフレームで、または少なくとも異なるプロモーターの制御下で有することを包含する。これにより、アナログまたはエピトープが免疫調節剤の融合パートナーとして産生されるのを回避する。代わりに、2つの別個なヌクレオチド断片を形質転換の剤として用いる
ことができる。もちろん、第一および/または第二および/または第三成分を同じリーディングフレームに有することは、発現産物として本発明のアナログを提供することができ、このような実施形態は、本発明において特に好ましい。
【0167】
疾患の治療における本発明の方法の使用
上記の議論から認識されるように、本発明の方法の提供は、アミロイド沈着と特徴とする疾患の制御を許容する。この関係において、ADが本発明の方法の鍵となる標的であるだけでなく、Aβを含むアミロイド沈着を特徴とする他の疾患も可能な標的である。よって
、アミロイド活性のダウンレギュレーションのための本発明の方法の重要な実施形態は、アミロイド沈着を特徴とするADまたは他の疾患を治療および/または予防および/または改善することを含み、該方法は、アミロイドの量が有意に減少される程度まで、本発明の方法に従ってAPPまたはAβをダウンレギュレーションすることを含む。
【0168】
アミロイドの減少が、アミロイド形成とアミロイド分解/除去との間のバランスの逆転
になること、すなわちアミロイド分解/除去の速度がアミロイド形成の速度を超えるよう
になることが特に好ましい。それを必要とする個体の免疫化の数および免疫学的影響を注意深く制御することにより、過剰な副作用を有することなくアミロイド沈着の総計での減少となる、時間に関してのバランスを得ることが可能になる。
【0169】
代わりに、個体において本発明の方法が現存するアミロイド沈着を除去または減少できない場合、本発明の方法は、新しいアミロイドの形成における診療上有意な減少を得て、それにより、疾患の状態が衰弱させられない時間をかなり延長するのに用いることができる。アミロイドの血清濃度(沈着物質と平衡にあると考えられている)を測定することによるか、または陽電子放射断層撮影(PET)スキャンを用いることにより、アミロイド沈着の
速度をモニターすることができるはずであり、Small GWら、1996、Ann N Y Acad Sci 802:70〜78参照。
【0170】
本発明の手段および方法が、類似の方法において治療または改善に用いられるその他の疾患および症状は、上記の「発明の背景」において述べたか、または以下の「これらに関連する他のアミロイドの疾患およびタンパク質」の題がついた項目において列挙される。
【0171】
本発明のペプチド、ポリペプチドおよび組成物
上記からも明らかなように、本発明は、病理に関するアミロイド沈着の量を減少させるために、APPまたはAβ抗原に対して個体を免疫化するという概念に基づく。このような免疫化を得る好ましい方法は、本明細書で記載のアナログを用いることであり、それにより当該技術において以前に記載されていない分子を提供する。
【0172】
本明細書において論じるアナログは、それ自体で発明であり、したがって本発明の重要な部分は、上述したようなアナログに関係する。よって、修飾されたAPPまたはAβに関係する本明細書におけるいずれの開示も、本発明のアミロイド産生アナログを説明する目的に関し、このような開示のいずれも、必要な変更を加えて、これらのアナログの記載に当てはまる。
【0173】
好ましい、修飾されたAPPまたはAβ分子は、APPもしくはAβ、または少なくとも10アミノ酸の長さのそれらのサブシークエンスと少なくとも70%の配列相同性を有するポリペプ
チドとなる修飾を含むことが記載される。より高い配列相同性、例えば少なくとも75%、
または少なくとも80、85、90もしくは95%が好ましい。タンパク質および核酸の配列相同
性は、(Nref − Ndif)・100/Nref (ここで、Ndifは、整列したときに、2つの配列中の非
相同残基の総数であり、Nrefは、1つの配列中の残基数である。)のように算出できる。よって、DNA配列AGTCAGTCは、配列AATCAATCと75%の配列相同性を有する(Ndif=2およびNref=8)。
【0174】
本発明は、本発明の方法を実行するのに有用な組成物にも関する。よって、本発明は、さらに医薬上および免疫学上許容される希釈剤および/または賦形剤および/または担体および/または添加剤ならびに任意にアジュバントを含む、上記のアナログを免疫原的有効量含む免疫原性組成物に関する。言い換えると、本発明のこの部分は、本質的に上述したように、アナログの処方に関する。アジュバント、担体および添加剤の選択は、本発明のAPPまたはAβのダウンレギュレーション方法における、使用のための修飾または非修飾アミロイド産生ポリペプチドの処方について言及するときに論じたことに従う。
【0175】
ポリペプチドは、当該技術において公知の方法により製造される。より長いポリペプチドは、アナログをエンコードする核酸配列の適切なベクターへの導入、該ベクターによる適切な宿主細胞の形質転換、宿主細胞による核酸配列の発現、宿主細胞またはその培養上清からの発現産物の回収、ならびにその後の精製および任意の更なる修飾、例えばリフォールディングまたは派生(derivatization)を含む組換え遺伝子の手段により、通常、製造される。
【0176】
より短いペプチドは、固相または液相ペプチド合成の公知の技術により製造するのが好ましい。しかしながら、この技術における最近の進歩は、この手段による全長ポリペプチ
ドおよびタンパク質の製造を可能にし、したがって合成手段により長い構築物を製造することも本発明の範囲内である。
【0177】
本発明の核酸断片およびベクター
ポリアミノ酸アナログが組換え遺伝子技術だけでなく化学合成または半合成により製造できることが、上記の開示から認められるであろう;後者の2つの選択は、修飾がタンパ
ク質担体(KLH、ジフテリアトキソイド、破傷風トキソイド、およびBSAのような)と、炭水化物ポリマーのような非タンパク性分子との結合にある場合、ならびに修飾がAPPまた
はAβ由来ペプチド鎖への側鎖もしくは側面の群の付加を含む場合にももちろん、特に適
切である。
【0178】
組換え遺伝子技術の目的のために、およびもちろん核酸免疫化の目的のために、アナログをエンコードする核酸断片は重要な化学産物である。よって、本発明の重要な部分は、本発明のアナログ、すなわち融合パートナーが付加もしくは挿入されている天然の配列を含むAPPまたはAβ由来ポリペプチド、または好ましくは挿入および/または付加により、好ましくは置換および/または欠失により外来T細胞エピトープが導入されたAPPまたはA
β由来ポリペプチドをエンコードする核酸断片に関する。本発明の核酸断片は、DNAまた
はRNA断片のいずれかである。
【0179】
本発明の核酸断片は、通常、適切なベクターに挿入され、本発明の核酸断片を有するクローニングまたは発現ベクターとなる;このような新規ベクターもまた本発明の部分である。本発明のこれらのベクターの構築に関する詳細は、形質転換細胞および微生物の関係において以下で論じる。ベクターは、適用の目的およびタイプに応じて、プラスミド、ファージ、コスミド、ミニ染色体またはウイルスの形態にあり得るだけでなく、特定の細胞において一過的に発現するだけの裸のDNAも重要なベクターである。本発明の好ましいク
ローニングおよび発現ベクターは自律複製が可能であり、それにより、後に続くクローニングのための高レベル発現または高レベル複製を目的とする高いコピー数を可能にする。
【0180】
本発明のベクターの全体的な概要は、5'→3'方向に実施可能な連鎖で次の特徴を含む:本発明の核酸断片の発現を推進するプロモーター、必要に応じて、ポリペプチド断片の(細胞外の相へ、もしくは適用可能である場合にはペリプラズマへの)分泌または膜への組み込みを可能にするリーダーペプチドをエンコードする核酸配列、本発明の核酸断片、および必要に応じてターミネーターをエンコードする核酸配列である。生産株または細胞ラインにおいて発現ベクターとともに機能する場合、好ましい形質転換細胞の遺伝的安定性を目的として、宿主細胞に導入されたときのベクターは、宿主細胞ゲノムに組み込まれる。これに対して、動物においてインビボ発現をもたらすために用いるベクターとともに作用する場合(すなわち、DNAワクチン化においてベクターを用いる場合)、ベクターが宿主細胞ゲノムに組み込まれることができないことが、安全性の理由から好ましい;典型的に、裸のDNAまたは非組み込みウイルスベクターが用いられ、その選択は当業者に公知である。
【0181】
本発明のベクターを用いて宿主細胞を形質転換し、本発明のアナログを産生する。本発明の部分でもある、このような形質転換細胞は、本発明の核酸断片またはベクターを増殖させるのに用いるか、または本発明のアナログの組換え産生に用いる培養細胞または細胞ラインであり得る。代わりに、形質転換細胞は、アナログの分泌、または細菌の膜もしくは細胞壁への組み込みをもたらすように核酸断片(単一または多コピー)が挿入された、適切な生ワクチン株であり得る。
【0182】
本発明の好ましい形質転換細胞は、細菌(エシェリヒア[たとえばイー・コリ]、バチル
ス(Bacillus) [例えばバチルス・サチリス(Bacillus subtilis)]、サルモネラ、またはマイコバクテリア[好ましくは非病原性の、例えばエム・ボビス ビーシージー]種)、酵母(
サッカロミセス・セレビシエ(Saccharomyces cerevisiae)など)、ならびに原虫のような
微生物である。代わりに、形質転換細胞は真菌、昆虫細胞、植物細胞、または哺乳動物細胞のような多細胞生物に由来する。最も好ましくは、ヒト由来であるが、これは以下の細胞ラインおよびベクターの議論を参照。最近の結果は、出願人の実験室において、市場で入手可能なドロソフィラ・メラノガスター(Drosophila melanogaster)細胞ライン(Invitrogenから入手可能なスナイダー2 (S2)細胞ラインおよびベクター系)の、ポリペプチドの
組換え産生における使用に大きな見込みを示し、したがってこの発現系は特に好ましい。
【0183】
クローニングおよび/または最適化された発現の目的のために、形質転換細胞が本発明の核酸断片を複製することができることが好ましい。核酸断片を発現する細胞は、本発明の好ましい有用な実施形態である;これらは、本発明のアナログの小規模または大規模の製造のために、または非病原性細菌の場合には、生ワクチン中のワクチン構成成分として用いることができる。
【0184】
形質転換細胞により本発明のアナログを製造する場合に、少しも必須ではないが、発現産物が培地中に運び出されるか、または形質転換細胞の表面上にあるかのいずれかが便利である。
【0185】
効果的な産生細胞が同定された場合、それを基礎として、本発明のベクターを有し、修飾されたアミロイド産生ポリペプチドをエンコードする核酸断片を発現する安定な細胞ラインを樹立することが好ましい。好ましくは、この安定な細胞ラインは、本発明のアナログを分泌するか、有し、それによりその精製を促進する。
【0186】
一般に、宿主細胞に影響を与えない種に由来するレプリコンおよび調節配列を含むプラスミドベクターは、宿主と関連して用いる。ベクターは、通常、複製部位とともに、形質転換細胞において表現型の選択を提供し得るマーキング配列を有する。例えば、イー・コリは、イー・コリ種に由来するプラスミド、pBR322を用いて典型的に形質転換される(例
えばBolivarら、1977参照)。pBR322プラスミドは、アンピシリンおよびテトラサイクリン耐性遺伝子を含み、したがって形質転換細胞を同定するのに簡単な手段を提供する。pBR
プラスミド、または他の微生物のプラスミドもしくはファージは、発現のために原核細胞微生物により使用され得るプロモーターをも含まなければならないか、含むように修飾されなければならない。
【0187】
これらのプロモーターは、B-ラクタマーゼ(ペニシリナーゼ)およびラクトースプロモーター系(Changら、1978;Itakuraら、1977;Goeddelら、1979)およびトリプトファン(trp)プロモーター系(Goeddelら、1979;EP-A-0 036 776)を含む組換えDNA構築において、最も一般的に用いられる。これらは最も一般的に用いられるが、他の微生物のプロモーターが発見および使用され、これらの核酸配列に関する詳細が発表され、当業者がそれらをプラスミドベクターと機能的に連結することを可能にする(Siebwenlistら、1980)。原核生物
からのある遺伝子は、人為的な手段による他のプロモーターの付加を必要とすることなく、それ自身のプロモーター配列からイー・コリにおいて効率的に発現することができる。
【0188】
原核生物に加えて、酵母培養のような真核微生物も用いることができ、ここでプロモーターは発現を推進することが可能であるべきである。サッカロミセス・セレビシエ、または通常のパン酵母は、真核微生物中で最も一般的に用いられるが、いくつかのその他の株も、通常、入手可能である。サッカロミセス中での発現には、たとえばプラスミドYRp7が一般的に用いられる(Stinchcombら、1979;Kingsmanら、1979;Tschemperら、1980)。こ
のプラスミドは、トリプトファン中で成長する能力が欠失した酵母の変異株、例えばATCC
No. 44076またはPEP4-1 (Jones、1977)に対して選択マーカーを提供するtrpl遺伝子を予め含む。酵母宿主細胞ゲノムの特徴としてのtrpl障害の存在は、よってトリプトファンの
非存在下での成長により形質転換を検出する、効果的な環境を提供する。
【0189】
酵母ベクター中の適切なプロモーター配列は、3−ホスホグリセレートキナーゼ(Hitzmanら、1980)、またはエノラーゼ、グリセルアルデヒド−3−ホスフェートデヒドロゲナー
ゼ、ヘキソキナーゼ、ピルベートデカルボキシラーゼ、ホスホフラクトキナーゼ、グルコース−6−ホスフェートイソメラーゼ、3−ホスホグリセレートムターゼ、ピルベートキナーゼ、トリオースホスフェートイソメラーゼ、ホスホグルコースイソメラーゼ、およびグルコキナーゼのような他の糖分解酵素(Hessら、1968;Hollandら、1978)のプロモーター
を含む。適切な発現プラスミドの構築において、これらの遺伝子に関連する終結配列は、発現ベクターの発現が所望される配列の3'に連結され、mRNAのポリアデニル化および停止を提供する。
【0190】
成長条件により制御される転写の付加的な利点を有するその他のプロモーターは、アルコールデヒドロゲナーゼ2、イソシトクロムC、酸性ホスファターゼ、窒素代謝に関する分解酵素、および上記のグリセルアルデヒド−3−ホスフェートデヒドロゲナーゼ、ならび
にマルトースおよびガラクトース利用に責任がある酵素のプロモーター領域である。酵母に影響を与えないプロモーター、複製起点および終結配列を含むいずれのプラスミドベクターも適切である。
【0191】
微生物に加えて、多細胞生物由来の細胞の培養も宿主として用いることができる。原則として、そのような細胞培養は、脊椎動物または非脊椎動物培養からのいずれであっても機能し得る。しかしながら、脊椎動物細胞における興味は最大であり、培養(組織培養)での脊椎動物の増殖は、近年、ルーチンの手順となっている(Tissue Culture、1973)。このような有用な宿主細胞ラインの例は、VEROおよびHeLa細胞、チャイニーズハムスター卵巣
(CHO)細胞ラインおよびW138、BHK、COS-7 293、スポドプテラ・フルギペルダ(Spodoptera frugiperda) (SF)細胞(とりわけProtein Sciences、1000 Research Parkway、Meriden
、CT 06450、U.S.A.およびInvitrogenからの完全発現系として市場で入手可能)、ならび
にMDCK細胞ラインである。本発明においては、Invitrogen、PO Box 2312、9704 CH Groningen、The Netherlands から入手可能なS2が特に好ましい細胞ラインである。
【0192】
このような細胞の発現ベクターは、(必要であれば)複製起点、いずれかの必要なリボソーム結合部位とともに、発現される遺伝子の上流に位置するプロモーター、RNAスプライ
ス部位、ポリアデニル化部位、および転写終結配列を通常含む。
【0193】
哺乳動物細胞における使用には、発現ベクター上の制御機能がウイルス材料からしばしば提供される。例えば、一般的に用いられるプロモーターは、ポリオーマ、アデノウイルス2、最も頻繁にはシミアンウイルス40 (SV40) に由来する。SV40ウイルスの初期および
後期プロモーターは、SV40ウイルスの複製起点をも含む断片としてウイルスから簡単にどちらも得られるので、特に有用である(Fiersら、1978)。ウイルスの複製起点中に位置す
るHindIII部位からBglI部位に広がる約250 bpの配列を含むのであれば、より小さいまた
はより大きいSV40断片を用いることもできる。さらに、所望する遺伝子配列と通常関連するプロモーターまたは調節配列を用いることが、このような調節配列が宿主細胞系に影響を及ぼさないのであれば、可能であり、しばしば所望される。
【0194】
複製起点は、SV40またはその他のウイルス(例えばポリオーマ、アデノ、VSV、BPV)に由来するような外来の起点を含むベクターの構築により提供されるか、または宿主細胞の染色体複製機構により提供されるかのいずれかであってよい。ベクターが宿主細胞の染色体に組み込まれる場合、後者がしばしば充分である。
【0195】
有用なアナログの同定
天然に発生するAPPまたはAβの全ての可能な変形または修飾が、天然の形態と交差反応性である動物において抗体を誘発する能力を有するわけではないことは、当業者には明白である。しかしながら、本明細書において論じる免疫学的反応性についての最小の要求を満たす、修飾されたアミロイド産生分子の効率的な標準スクリーンを設定することは困難ではない。よって、
−ペプチド合成または遺伝子工学技術により、アミノ酸配列が動物種のAPPまたはAβのアミノ酸配列中に挿入、欠失、または置換された、本発明の、相互に別個のアナログの組を作成することにより、動物種にとって外来であるT細胞エピトープを含むアミノ酸配列の
組を生じさせるか、または相互に別個のアナログの組をエンコードする核酸断片の組を作成し、
−非修飾APPまたはAβに対して、動物種による抗体産生を誘導する能力について、アナログまたは核酸断片の該組のメンバーを試験し、そして
−種における非修飾APPまたはAβに対する抗体産生を大きく誘導するアナログの組のメンバーを同定して、任意に単離するか、または動物種における非修飾APPまたはAβに対する抗体産生を大きく誘導する核酸断片の組のメンバーによりエンコードされるポリペプチド発現産物を同定して、任意に単離する
ことを含む、非修飾アミロイド産生ポリペプチドが(非免疫原性)自己タンパク質である動物種において、非修飾アミロイド産生ポリペプチドに対する抗体を誘導し得る、修飾されたアミロイド産生ポリペプチドの同定方法を用いることが可能である。
【0196】
この関係において、「相互に別個の修飾されたアミロイド産生ポリペプチドの組」は、例えば上記の基準(例えば円偏光二色性分光分析、NMRスペクトル、および/またはX線回
折パターンとの組合わせ)に基づいて選択された、非同一のアナログの集団である。該組
は、わずかなメンバーのみで構成されていてもよいが、該組は数百のメンバーを含むことができると考えられる。
組のメンバーの試験は、結局インビボで行うことができるが、本発明の目的を提供する修飾された分子の数を狭める、いくつかのインビトロ試験を適用することができる。
【0197】
外来T細胞エピトープを導入する目的がT細胞の助けによりB細胞応答を補助することで
あるので、必要条件は、T細胞増殖がアナログにより誘導されることである。T細胞増殖は、インビトロでの標準化された増殖アッセイにより試験することができる。簡単に、T細
胞が豊富なサンプルを患者から得て、その後培養に維持する。培養されたT細胞を、修飾
された分子で予め処理した患者のAPCに接触させ、そのT細胞エピトープを提示するように加工処理する。T細胞の増殖をモニターし、適切なコントロール(例えば、処理していない天然のアミロイド産生ポリペプチドで処理したAPCと接触させた培養中のT細胞)と比較す
る。代わりに、増殖は、外来T細胞のその認識に応答してT細胞により放出された適切なサイトカインの濃度を測定することにより、測定できる。
【0198】
組のいずれかのタイプの少なくとも1つのアナログが、APPまたはAβに対する抗体産生
を誘導し得ることの可能性を高めると、動物種においてAPPまたはAβと反応し得る抗体産生を大きく誘導する、組のメンバーと、医薬上および免疫学上許容される担体および/または賦形剤および/または希釈剤および/または添加剤と、任意に少なくとも1つの医薬
上および免疫学上許容されるアジュバントとを組合わせて混合することを含む、非修飾のAPCまたはAβが自己タンパク質である場合に、動物種における非修飾のAPCまたはAβに対する抗体を誘導し得る少なくとも1つのアナログを含む、免疫原性組成物を製造すること
が可能である。
【0199】
ポリペプチドの組の上記の試験は、まず、本発明の、相互に別個のいくつかの核酸配列またはベクターを作成し、これらを適切な発現ベクターに挿入し、該ベクターで適切な宿主細胞を形質転換し、本発明の核酸配列の発現をもたらすことにより、適切に行われる。
これらの工程に続いて、発現産物の単離を行うことができる。核酸配列および/またはベクターが、PCRのような分子増幅技術の実施を含む方法によるか、または核酸合成により
作成されることが好ましい。
【0200】
特異的アミロイド産生標的
アルツハイマーに最もしばしば関連するタンパク質である、APP、ApoE4およびタウに加えて、それがADの脳のプラークまたはもつれに直接存在することによるか、ADの進行の危険性の増加との、その明確な遺伝子的関連のいずれかにより、ADと何らかの関連がある、その他のタンパク質が多く列挙される。全てではないとしてもそれらの抗原のほとんどが、上記のAβ、APP、プレセニリンおよびApoE4とともに、本発明のある実施形態において
、推定の標的タンパク質である。これらの推定の標的は、WO 01/62284において、すでに
詳細に議論されている。よって、これらの推定の標的については、ここでは短く言及するのみであり、より詳細な背景の議論は、本明細書に参照として組み込まれるWO 01/62284
に見出すことができる:
α1-アンチキモトリプシン(ACT);α2-マクログロブリン;ABAD (Aβ-ペプチド結合アル
コールデヒドロゲナーゼ);APLP1および−2 (アミロイド前駆体様タンパク質1および−2);AMY117;Bax;Bcl-2;ブレオマイシンヒドロラーゼ;BRI/ABRI;クロモグラニンA;ク
ラステリン/apoJ;CRF (副腎皮質ホルモン放出因子)結合タンパク質;EDTF (内皮由来傷
害性因子);ヘパラン硫酸プロテオグリカン;ヒトコラプシン応答媒介タンパク質−2 (collapsin response mediator protein-2);ハンチントン(ハンチントン病タンパク質);ICAM-I;IL-6;リソソーム関連抗原CD68;P21 ras;PLC-δ1 (ホスホリパーゼC アイソエンザイムδ1);血清アミロイドP成分(SAP);シナプトフィシン;シヌクレイン(α−シヌク
レインまたはNACP);およびTGF-b1 (トランスフォーミング成長因子b1)。
【0201】
ここに記載のAPPまたはAβのダウンレギュレーションの手段および方法は、これらの他のアミロイド産生ポリペプチドのいずれにも対する療法、例えば能動特異的免疫療法と組合わせることができる。
【0202】
アルツハイマー病とは別に、脳のアミロイドアンギオパチーも、本明細書に開示の技術の適切な標的である疾患である。
APPまたはAβに対する免疫方法のほとんどが、天然のAPPまたはAβと交差反応性の抗体を生じさせる免疫化に限定されるべきであることが考えられる。にもかかわらず、アミロイド産生ポリペプチドからのMHCクラスIエピトープを提示する細胞に対するCTL応答の形
態で細胞免疫を誘導することが興味の対象である場合もある−これは、APPまたはAβを産生する細胞の数の減少が深刻な副作用を構成しない場合に、好都合であり得る。CTL応答
が所望される場合、出願人のWO 00/20027の教示を用いることが好ましい。これらの2つの文書の開示は、本明細書に参照として組み込まれる。
【0203】
免疫原担体
賦形剤として働く非免疫原性ポリマー分子、例えば多価の活性化されたポリ−ヒドロキシポリマーに共有結合したB細胞エピトープを提示するか、もしくは含むTヘルパーエピトープまたはAPPもしくはAβを含む分子は、上述のように、免疫学的に適切な部分のみを含むワクチン分子として機能して、それを得ることが可能であり、そして上記で開示の変形dおよびeにおける興味深い実施形態である。乱交雑の、またはいわゆるユニバーサルTヘ
ルパーエピトープは、例えばワクチンへの標的がAPPまたはAβのような自己抗原である場合に用いることができる。さらに、免疫応答を増大させる要素は、賦形剤と共結合することができ、それによりアジュバントとして働くことができる。このような要素は、マンノース、タフトシン、ムラミルジペプチド、CpGモチーフなどであり得る。この場合、ワク
チン産物の、その後のアジュバント処方は不要であり、産物は純水または食塩水中に投与することができるであろう。
【0204】
細胞傷害性T細胞(CTL)エピトープとTヘルパーエピトープとが結合することにより、CTLエピトープが由来する抗原に特異的なCTLを発生することも可能になる。APC、例えばマクロファージの、細胞質ゾルへの生成物の取り込みを促進する要素、例えばマンノースは、CTL−およびT細胞エピトープとともに賦形剤に共結合して、CTL応答を増大させることも
できる。
【0205】
最終生成物中のB細胞エピトープとTヘルパーエピトープ(P2およびP30)との比は、合成
工程におけるこれらのペプチドの濃度を変動させることにより変動することができる。上述したように、免疫原性分子には、例えばマンノース、タフトシン、CpGモチーフまたは
他の免疫刺激物質(本明細書中に記載)を、必要により例えば該物質のアミノ化誘導体を用いて、合成工程中においてカーボネートバッファーにこれらを添加することにより、タグとして付けることができる。
【0206】
不溶性の活性化されたポリヒドロキシポリマーを、APPまたはAβ B細胞エピトープを含むペプチドとTヘルパーエピトープとを結合させるのに用いる場合、上述したように、固
体相合成として行うことができ、最終生成物は洗浄およびろ過により回収して精製することができる。トレシル活性化されたポリヒドロキシポリマーに結合させる要素(ペプチド
、タグなど)は、低いpH、例えばpH4〜5においてポリヒドロキシポリマーに添加すること
ができ、受動拡散により「ゲル」中に均一に分布することが許容される。その後、pHをpH9〜10に向上させて、ペプチド上の第一級アミノ基とタグの、ポリヒドロキシポリマーの
トレシル基への反応を開始することができる。ペプチドと例えば免疫刺激要素とを結合させた後、ゲルを、免疫化に適切なサイズの粒子を形成するように細かくする。
【0207】
このような免疫原は、したがって
a) 少なくとも1つの第一のアミノ酸配列が少なくとも1つのB細胞および/または少なくとも1つのCTLエピトープを含む、APPまたはAβ由来の少なくとも1つの第一のアミノ酸配
列、ならびに
b) 外来Tヘルパー細胞エピトープを含む少なくとも1つの第二のアミノ酸配列
を含み、
少なくとも第一および少なくとも第二のアミノ酸配列のそれぞれは、医薬上許容される、活性化されたポリヒドロキシポリマー担体に結合している。
【0208】
アミノ酸配列がポリヒドロキシポリマーに結合するためには、アミノ酸配列との必要な連結を形成することができる適切な反応性基で、ポリヒドロキシポリマーを「活性化する」ことが通常必要である。
【0209】
「ポリヒドロキシポリマー」の語は、WO 00/05316中と同じ意味を有する、すなわちポ
リヒドロキシポリマーが、この出願中に特異的に述べられているのと全く同じ特徴を有することができることを意図する。よって、ポリヒドロキシポリマーは、水に溶解性または不溶性であり得る(よって、免疫原の製造中において異なる合成工程を必要とする)。ポリヒドロキシポリマーは、天然に発生するポリヒドロキシ化合物および合成ポリヒドロキシ化合物から選択することができる。
【0210】
特定の、好ましいポリヒドロキシポリマーは、アセタン(acetan)、アミロペクチン、ガム寒天(gum agar-agar)、アガロース、アルジネート、アラビアゴム、カレゲナン(carregeenan)、セルロース、シクロデキストリン、デキストラン、フルセララン(furcellaran)
、ガラクトマンナン、ゼラチン、ガッティ(ghatti)、グルカン、グリコーゲン、グアー、カラヤ(karaya)、コンジャク/A (konjac/A)、ローカストビーンガム、マンナン、ペクチ
ン、オオバコ、プルラン、スターチ、タマリン、トラガカント、ザンサン、キシラン、お
よびキシログルカンから選択される多糖類である。デキストランが特に好ましい。
【0211】
しかしながら、ポリヒドロキシポリマーは、高度に分岐したポリ(エチレンイミン) (PEI)、テトラチエニレン ビニレン(tetrathienylene vinylene)、Kevlar (長鎖ポリパラフェニルテレフタルアミド)、ポリ(ウレタン)、ポリ(シロキサン)、ポリジメチルシロキサ
ン、シリコン、ポリ(メチルメタクリレート) (PMMA)、ポリ(ビニルアルコール)、ポリ(ビニルピロリドン)、ポリ(2-ヒドロキシエチルメタクリレート)、ポリ(N-ビニルピロリドン)、ポリ(ビニルアルコール)、ポリ(アクリル酸)、ポリテトラフルオロエチレン(PTFE)、
ポリアクリルアミド、ポリ(エチレン−酢酸ビニル) (Poly(ethylene-co-vinyl acetate))、ポリ(エチレングリコール)および誘導体、ポリ(メタクリル酸)、ポリラクチド(PLA)、
ポリグリコリド(PGA)、ポリ(ラクチド−グリコリド) (Poly(lactide-co-glycolides)) (PLGA)、ポリ無水物、ならびにポリオルトエステルから選択することもできる。
【0212】
問題の(すなわち活性化前)ポリヒドロキシポリマーの(重量)平均分子量は、典型的に、少なくとも2,000のような少なくとも1,000、好ましくは2,500〜2,000,000の範囲、より好ましくは3,000〜1,000,000の範囲、特に5,000〜500,000の範囲である。実施例において、平均分子量が10,000〜200,000の範囲であるポリヒドロキシポリマーが特に有利であるこ
とが示されている。
【0213】
ポリヒドロキシポリマーは、室温において、少なくとも10 mg/ml、好ましくは、少なくとも50 mg/mlのような少なくとも25 mg/ml、特に、少なくとも150 mg/mlのような少なく
とも100 mg/mlの範囲で水溶性であることが好ましい。デキストランは、本明細書に記載
のように活性化されても、水溶性に関しての要件を満足することが知られている。
【0214】
最も興味深いポリヒドロキシポリマーのいくつかについて、活性化されていないポリヒドロキシポリマー(すなわち活性前の天然のポリヒドロキシポリマー)のC(炭素原子)とOH
基(ヒドロキシ基)との間の比は、1.5〜2.3のような1.3〜2.5、好ましくは1.6〜2.1、特に1.85〜2.05の範囲内である。いずれの特定の理論に拘束されることなく、活性化されていないポリヒドロキシポリマーのC/OH比のようなものは、親水性の非常に有利なレベルを示すと考えられる。ポリビニルアルコールおよび多糖類は、この要件を満足するポリヒドロキシポリマーの例である。活性化の比がやや低いが、上記の比は、活性化されたポリヒドロキシポリマーについてほぼ同様であると考えられる。
【0215】
「ポリヒドロキシポリマー担体」の語は、アミノ酸配列を有する免疫原の部分を意味することを意図する。一般的な規則として、ポリヒドロキシポリマー担体は、ペプチダーゼによりアミノ酸配列が切断され得る外側の境界を有し、例えば抗原提示細胞ではそれは免疫原を加工処理する。よって、ポリヒドロキシポリマー担体は、活性化基を有するポリヒドロキシポリマーであることが可能であり、そこで活性化基とアミノ酸配列との間の結合がAPCにおいてペプチダーゼにより切断されるか、またはポリヒドロキシポリマー担体は
、活性化基および例えば単一のL-アミノ酸もしくはいくつかのD-アミノ酸のようなリンカーを有するポリヒドロキシポリマーであることが可能であり、そこでリンカーの最後の部分がアミノ酸配列に結合し、APCにおいてペプチダーゼに切断される。
【0216】
上述したように、ポリヒドロキシポリマーは、担体にペプチドをつなぎとめることを促進する官能基(活性化基)を有する。当該技術において広い範囲の適用可能な官能基が知られており、例えばトレシル(トリフルオロエチルスルホニル)、マレイミド、p-ニトロフェニルクロロホルメート、シアノゲンブロミド、トシル(p-トルエンスルホニル)、トリフリル(トリフルオロメタンスルホニル)、ペンタフルオロベンゼンスルホニルおよびビニルスルホン基である。本発明に含む官能基の好ましい例は、トレシル、マレイミド、トシル、トリフリル、ペンタフルオロベンゼンスルホニル、p-ニトロフェニルクロロホルメートお
よびビニルスルホン基であり、これらのうちトレシル、マレイミドおよびトシル基が特に適切である。
【0217】
トレシル活性化されたポリヒドロキシポリマーは、トレシルクロライドを用いて、WO 00/05316の実施例1のデキストランの活性化について記載のようにするか、またはGregoriusら、J. Immunol. Meth. 181 (1995) 65〜73に記載のようにして製造することができる。
【0218】
マレイミド活性化されたポリヒドロキシポリマーは、p-マレイミドフェニルイソシアネートを用いて、WO 00/05316の実施例3のデキストランの活性化について記載のようにして製造することができる。代わりに、トレシル活性化されたポリヒドロキシポリマー(トレ
シル活性化デキストラン(TAD)のような)を、過剰の例えば1,3-ジアミノプロパンのようなジアミン化合物(通常、H2N-CnH2n-NH2、ここでnは1〜20、好ましくは1〜8)で派生させ、
その後、TADに導入されたアミノ基をスクシンイミジル4-(N-マレイミドメチル)シクロヘ
キサン-1-カルボキシレート(SMCC)、スルホ-スクシンイミジル4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレート(スルホ-SMCC)、スクシンイミジル4-(p-マレイミドフ
ェニル)ブチレート(SMPB)、スルホ-スクシンイミジル4-(p-マレイミドフェニル)ブチレート(スルホ-SMPB)、N-γ-マレイミドブチリルオキシ-スクシンイミドエステル(GMBS)また
はN-γ-マレイミドブチリルオキシ-スルホスクシンイミド エステルのような試薬と反応させることにより、デキストランのようなポリヒドロキシポリマーにマレイミド基を導入することができる。活性化についての異なる試薬および経路により、マレイミド官能基と、活性化が行われる親のヒドロキシ基の残りの部分との間の結合に関して、形式的にわずかに異なるマレイミド活性化された産物となるが、全ておよびそれぞれが「マレイミド活性化されたポリヒドロキシポリマー」と考えられる。
【0219】
トシル活性化されたポリヒドロキシポリマーは、トシルクロライドを用いて、WO 00/05316の実施例2のデキストランの活性化について記載のようにして製造することができる。トリフリルおよびペンタフルオロベンゼンスルホニル活性化ポリヒドロキシポリマーは、トシルまたはトレシル活性化アナログとして、例えば対応する酸塩化物を用いることにより製造される。
【0220】
シアノゲンブロミド活性化されたポリヒドロキシポリマーは、従来の方法を用いてポリヒドロキシポリマーをシアノゲンブロミドと反応させることにより製造することができる。得られる官能基は、通常、ポリヒドロキシポリマーの2つのヒドロキシ基とのシアネー
トエステルである。
【0221】
活性化の程度は、遊離のヒドロキシ基と活性化基(すなわち機能化されたヒドロキシ基)との間の比で表すことができる。ポリヒドロキシポリマーの遊離のヒドロキシ基と活性化基との間の比は、ポリヒドロキシポリマーの親水性および反応性の間の有利なバランスを得るために、250:1〜4:1の間であるべきであると考えられる。好ましくは、比が100:1〜6:1の間、より好ましくは60:1〜8:1の間、特に40:1〜10:1の間である。
【0222】
本発明による一般的に適用可能な免疫原の製造方法において用いる、特に興味深い活性化されたポリヒドロキシポリマーは、トレシル、トシルおよびマレイミド活性化された多糖、特にトレシル活性化されたデキストラン(TAD)、トシル活性化されたデキストラン(TosAD)、およびマレイミド活性化されたデキストラン(MAD)である。
【0223】
ポリヒドロキシポリマー担体とそこに結合するアミノ酸配列との間の結合は、例えばAPCにおける抗原の加工処理において活性なペプチダーゼのようなペプチダーゼにより切断
可能であることが好ましい。したがって、少なくとも第一および少なくとも第二のアミノ酸配列がアミド結合またはペプチド結合を介して活性化されたポリヒドロキシポリマー担
体に結合することが好ましい。少なくとも第一および少なくとも第二のアミノ酸配列のそれぞれが、窒素原子部分にそれぞれのアミノ結合を提供することが特に好ましい。
【0224】
ポリヒドロキシポリマー担体は、アミノ酸残基を実質的に有さず、活性化基がペプチダーゼ切断可能結合の部分を提供することを必要とするが、上述したように、担体が少なくとも1つのL-アミノ酸を含むスペーサーを単純に含んでいてもよい。にもかかわらず、少
なくとも第一および少なくとも第二のアミノ酸配列は、アミノ酸配列のN末端における窒
素原子を介して活性化されたバージョンのポリヒドロキシポリマーに、通常、結合する。
【0225】
上述の、本発明の一般的に適用可能な免疫原は、本質的に、ポリペプチドワクチンについて本明細書において記載したような免疫化方法において用いることができる。すなわち、本明細書において論じたアミロイド産生ポリペプチドのダウンレギュレーションのためのポリペプチドワクチンの投与量、投与形態および処方に関する全ての開示は、必要な変更を加えて、一般的に適用可能な免疫原に適用する。
【0226】
一般的に適用可能な、安全なワクチン化技術
上述したように、本発明のある好ましい実施形態は、アミロイド産生ポリペプチドに対する免疫応答を推進するであろう自己由来THエピトープを提供することができないアミロイド産生ポリペプチドの変形の使用を包含する。
【0227】
しかしながら、抗−自己ワクチンを設計するため、および抗−自己免疫をもたらすためのこのストラテジーは、それ自体で発明な、一般的に適用可能な技術であると本発明者らは考える。ダウンレギュレーションしようとする自己抗原が体内で充分に豊富であるので免疫応答の自己刺激が起こることが可能になる場合に、特に適することを証明するべきである。したがって、本実施形態の上記の全ての開示は、APCまたはAβに対する抗−自己免疫応答の供給に関する範囲の限りでは、必要な変更を加えて、他の自己ポリペプチドに対する免疫化に適用し、特にそれらに対して充分な量で存在して、制御されない自己免疫状態の形態において免疫応答を維持するものに適用する。なぜなら、適切な自己ポリペプチドの自己THエピトープは、免疫応答を推進しているからである。
【実施例】
【0228】
実施例1
ADに対する免疫化のための自己ワクチン化アプローチ
Aβタンパク質ノックアウトマウスがいずれの異常または悪い副作用を示さないという
事実は、Aβの除去もしくは量の減少が安全であることを示唆する、Zheng H. (1996)。
【0229】
トランスジェニック動物がトランスジェニックヒトAβタンパク質に対して免疫化され
た、発表された実験は、自己寛容を破壊することができれば、自己反応性抗体によりAβ
のダウンレギュレーションを得ることができることを示唆する。これらの実験は、このようなAβのダウンレギュレーションがプラークの形成を防止し、すでに形成されたAβプラークを脳から除去することの両方を行うであろうことをさらに示唆する、Schenkら(1999)参照。しかし、伝統的に、自己タンパク質に対する抗体を産生することは可能ではない。
【0230】
したがって、発表されたデータは真の自己タンパク質に対する真の自己寛容を破壊する手段を提供しない。免疫応答が、それが必要であると考えられる場合に、細胞膜結合Aβ
前駆体タンパク質(APP)に対してではなく、Aβ沈着にのみ、または主にそれに対して向けられていることをどのように確実にするかについての情報を提供するデータをも提供しない。現存する技術を用いて発生させた免疫応答は、制御されない方法で自己タンパク質に対する免疫応答をおそらく発生するであろうから、Aβタンパク質の部分に対する不要な
過剰の自己反応性が発生するであろう。よって、現存する免疫化ストラテジーを用いることは、自己タンパク質に対する強い免疫応答を発生することができないようであり、さら
にCNS中の多数の細胞上に存在する膜結合APPに対する強い交差反応性の可能性のために、安全ではない。
【0231】
本発明は、CNSまたは体内のその他の区画中においてプラークを形成し、深刻な疾患の
原因となる可能性がある真の自己タンパク質に対する、強い制御された免疫応答を効率的に発生させる手段を提供する。安全で効果的なヒトAβタンパク質の治療ワクチンは、AD
の治療のために、この技術を用いて開発される。
【0232】
これに鑑みて、次世紀の健康管理システムを損なうと予想される疾患であるADが治癒され、記載されたようなワクチンが、この疾患の症状の治療および進行に効果的な治療上のアプローチを少なくとも構成することができることを予測することが可能である。この技術は、ADおよび他の神経疾患におけるアミロイド沈着をブロックする、全く新しい免疫学的アプローチを表す。
【0233】
以下の表では、35の企画された構築物を示す。表中に示された全ての位置は、APPの開
始のメチオニン(SEQ ID NO: 2中の最初のアミノ酸)に関するものであり、開始および終了のアミノ酸の両方を含み、例えば672〜714断片は、アミノ酸672および714の両方を含む。P2およびP30についての開始および終了の位置は、エピトープが示された位置でAPP断片の部分を置換する(両方の位置が置換に含まれる)ことを示す−ほとんどの構築物においては、導入されたエピトープは、エピトープの長さの断片を置換する。表中のアステリスクは次の意味を有する:
*) P2およびP30のただ1つの位置は、示された位置においてエピトープがAPP誘導体に挿入されたことを示す(エピトープは、与えられた位置のC末端側に近接したアミノ酸から開始する)。
**) 構築物34は、それぞれP30およびP2により分離された3つの同一のAPP断片を含む。
***) 構築物35は、P30およびP2エピトープを変化させることにより分離された9つの同一
のAPP断片を含む。
【0234】
【表1】

【0235】
それに対して応答を発生するのが最も興味深いAPPの部分は、ADの脳におけるアミロイ
ドプラークの主要な構成物である、43アミノ酸のAβコアペプチド(Aβ-43、SEQ ID NO: 2の残基672〜714に相当)である。このAPP断片は、上で列挙した全ての構築の部分である。
【0236】
変形1および2は、モデルエピトープであるP2およびP30が位置する、Aβ-43の上流のAPP部分を含む。変形1および3〜8の全ては、神経毒性であることが示されているC-100断片を含む−C-100断片は、SEQ ID NO: 2のアミノ酸残基714〜770に相当する。変形3〜5におい
て、エピトープはC-100断片の部分を置換しているが、変形6〜8ではC-100に挿入されている。
【0237】
変形9〜35は、コアAβ-43タンパク質のみを含む。変形9〜13では、P2およびP30がAβ-43のいずれかの末端に融合されている;14〜21では、P2およびP30がAβ-43の部分を置換している;22〜33においては、P2およびP30がAβ-43中に挿入されている;34は、それぞれP30およびP2により間隔が置かれた3つの同一のAβ-43断片を含む;35は、交互のP2およびP30エピトープにより間隔が置かれた9つのAβ-43の繰返しを含む。
【0238】
上記で論じたAβ-43タンパク質のトランケーテッド部分も、本発明の免疫原性アナログに用いることができる。特に好ましくは、トランケートAβ(1〜42)、Aβ(1〜40)、Aβ(1
〜39)、Aβ(1〜35)、Aβ(1〜34)、Aβ(1〜34)、Aβ(1〜28)、Aβ(1〜12)、Aβ(1〜5)、A
β(13〜28)、Aβ(13〜35)、Aβ(17〜28)、Aβ(25〜35)、Aβ(35〜40)、Aβ(36〜42)およ
びAβ(35〜42)である(カッコ内の番号は、適切な断片を構築するAβ-43のアミノ酸範囲を示す−Aβ(35〜40)は、例えばSEQ ID NO: 2のアミノ酸706-711と同一である)。Aβ-43の
トランケーテッド部分を有するこれらの全ての変形は、本明細書に記載のAβ断片、特に
変形9、10、11、12および13を用いて作成することができる。
【0239】
Aβ-43またはその断片は、変異していることが好ましい場合がある。特に好ましくは、Aβ-43の位置35のメチオニンが、好ましくはロイシンもしくはイソロイシンで置換されているか、または単純に欠失されている置換変形である。特に好ましいアナログは、アミロイド産生ポリペプチドもしくは外来THエピトープ中に天然に発生したか、または挿入されたかもしくは付加されたかのいずれかの理由により、C末端に位置する単一のメチオニン
を含む。よって、外来THエピトープを含むアナログの部分が、C末端に位置する可能性が
あるメチオニンを除いて、メチオニンを有さないことも好ましい。
【0240】
実際に、本発明により用いられるAPPまたはAβの全てのアナログが、アナログ中のC末
端アミノ酸として位置する単一のメチオニンを単に含み、そしてアミロイド産生ポリペプチドもしくは外来THエピトープのいずれにある他のメチオニンが欠失しているか、または他のアミノ酸に置換されているかという特徴を共有することが、一般的に好ましい。
【0241】
さらに興味深いある変異は、Aβ-43の位置19でのフェニルアラニンの欠失または置換であり、該変異がこのフェニルアラニン残基のプロリンへの置換であることが特に好ましい。
【0242】
次の表は、Aβ-43のトランケートまたは変異とともに働く特に好ましい構築物の群を示す:
【0243】
【表2】

【0244】
この表において、分子中で用いたAβセグメントは、Aβ(1-42/43)分子のアミノ酸1 (aa
1)に対するアミノ酸番号で示し、すなわち1〜28は、Aβ(1-42/43)の断片1〜28を分子中
において用いることを意味する。2つ以上の異なるセグメントを用いる場合、両方を表中
に示し、すなわち1〜12 (a) + 13〜28 (b)は、Aβ(1-42/43)の断片1〜12および断片13〜28の両方を分子中において用いることを意味する。
【0245】
また、同じセグメントが構築物において1以上のコピーで存在する場合、表中に示し、
すなわち1〜12 (×3)は、Aβ(1-42/43)の断片1〜12が構築物中において3コピーで存在す
ることを示す。
【0246】
さらに、分子中のAβセグメントの位置は、分子の最初のアミノ酸に対するアミノ酸の
位置により示し、すなわち22〜49は、問題のAβ断片が、分子のアミノ酸22からアミノ酸49に、両方の位置を含んで位置することを示す。P2およびP30エピトープの位置は、同等に示される。分子中で2つ以上のAβ断片を用いる場合、その位置を全て示し、すなわち1〜12 (a) + 49〜64 (b)は、断片(a)が分子中のアミノ酸1〜12に位置し、断片(b)がアミノ酸49〜64に位置することを示す。
【0247】
さらに、同じ断片の1つ以上のコピーが分子中に存在する場合、全てのコピーの位置を
示し、すなわち1〜12、34〜45、61〜72は、Aβ断片の3つのコピーが分子中に、それぞれ
位置1〜12、34〜45および61〜72に位置することを示す。
【0248】
最後に、各分子の全長の表示は、Aβ断片ならびにP2およびP30エピトープの両方を含む。
【0249】
変形42は、Aβ断片を示す欄に示すように、位置19 (pheからpro)および35 (metからlys)における2つのアミノ酸置換を含む。
【0250】
外来T細胞エピトープの導入のための特定の点の詳細については、図1および上記の表を参照。
【0251】
さらに、あるタイプの構築物が特に好ましい。本発明の目的の一つが、Aβの除去が望
まれる場合にAPPを産生する細胞の破壊を回避することであるので、APP中に存在する場合に細胞外の相に露出しない自己ワクチン構築物を製造することが可能であると考えられる。したがって、このような構築物は、SEQ ID NO: 2のアミノ酸700〜714により定義されるアミノ酸断片に由来する少なくとも1つのB細胞エピトープを含むことが必要であろう。このような短いポリペプチド断片は弱い免疫原性のみであることが予想されるので、このような自己ワクチン構築物はB細胞エピトープのいくつかのコピーからなることが好ましく
、すなわち本発明の詳細な開示における式Iに示す構造を有する構築物の形態であり、上
記を参照。式Iのこのバージョンにおいて、アミロイドe1〜アミロイドexの語は、SEQ ID NO: 2のアミノ酸700〜714に由来するアミノ酸配列を含む、x個のB細胞エピトープである
。好ましい代案は、多糖類担体分子への、アミド結合を介したアミロイド産生(ポリ)ペプチドおよび選択された外来Tヘルパーエピトープの結合の、上記で説明した可能性である
−これにより、SEQ ID NO: 2のアミノ酸700〜714により構築される「弱い」エピトープの多数の提示が可能になり、B細胞およびT細胞エピトープの間の最適な比を選択することも可能になる。
【0252】
実施例2
Aβおよび本発明の修飾タンパク質を用いたトランスジェニックマウスの免疫化
hAB43+-34をエンコードするDNAの構築。hAB43+-34遺伝子をいくつかの工程で構築した
。まず、プライマーME#800 (SEQ ID NO: 9)を鋳型として用いて、プライマーME#801 (SEQ
ID NO: 10)およびME#802 (SEQ ID NO: 11)とともにPCR断片をつくった。ME#800は、イー・コリ最適コドンとともにヒトAβ-43断片をエンコードする。ME#801および802は、断片
に適切な制限部位を付加する。
【0253】
PCR断片を精製し、NcoIおよびHindIIIで消化し、再び精製して、NcoI-HindIIIで消化して精製したpET28b+イー・コリ発現ベクターにクローン化した。野生型ヒトAβ-43をエン
コードする、得られたプラスミドをpAB1と名付けた。
【0254】
次の工程では、Tヘルパーエピトープ、P2を分子のC末端に付加する。プライマーME#806
(SEQ ID NO: 12)は、P2エピトープをエンコードする配列を含み、よってPCR反応によりP2およびAβ-43の融合体を発生する。
【0255】
クローニングは、pAB1を鋳型として用いて、プライマーME#178 (SEQ ID NO: 8)およびME#806とともにPCR断片を作成することにより行った。断片を精製し、NcoIおよびHindIII
で消化し、再び精製して、NcoI-HindIIIで消化して精製したpET28b+ベクターにクローン
化した。得られたプラスミドをpAB2と呼ぶ。
【0256】
類似の方法において、他のTヘルパーエピトープ、P30がN末端に付加されたAβ-43をエ
ンコードする配列を有する、他のプラスミドを作成した。これは、pAB1を鋳型として用いて、プライマーME#105 (SEQ ID NO: 7)およびME#807 (SEQ ID NO: 13)とともにPCR断片を作成することにより行った。
断片を精製し、NcoIおよびHindIIIで消化し、再び精製して、NcoI-HindIIIで消化して
精製したpET28b+ベクターにクローン化した。得られたプラスミドをpAB3と呼ぶ。
【0257】
第三の工程において、プライマーME#809 (SEQ ID NO: 14)により、プラスミドpAB2のP2エピトープのC末端に第二のAβ-43リピートを付加する。ME#809は、Aβ-43リピートの直
後に、BamHI部位を同時に創る。PCR断片を、pAB2を鋳型として用いてプライマーME#178およびME#809とともに作成した。断片をNcoIおよびHindIIIで消化し、精製して、NcoI-HindIIIで消化して精製したpET28b+ベクターにクローン化した。得られたプラスミドをpAB4と名付ける。
【0258】
最後に、pAB3からの、P30エピトープ−Aβ-43リピート配列をpAB4プラスミドにクロー
ン化した。これは、pAB3を鋳型として用いて、プライマーME#811 (SEQ ID NO: 16)およびME#105とともにPCR断片を作成することにより行った。該断片を精製し、 pAB3を鋳型として用いる、その後のME#810 (SEQ ID NO: 15) とのPCRにおいてプライマーとして用いた。得られた断片を精製し、BamHIおよびHindIIIで消化し、BamHI-HindIIIで消化して精製し
たpAB4プラスミドにクローン化した。得られたプラスミド、pAB5は、hAB43+-34分子をエ
ンコードする。
【0259】
全てのPCRおよびクローニング手順は、Sambrook, J.、Fritsch, E.F.およびManiatis, T. 1989 "Molecular cloning: a laboratory manual"、第2版、Cold Spring Harbor Laboratory、N.Yに実質的に記載のようにして行った。
全てのクローニング手順において、イー・コリK-12細胞、Top-10 F'株(Stratagene、USA)を用いた。pET28b+ベクターは、Novagen、USAから購入した。すぺてのプライマーは、DNA Technology、Denmarkにおいて合成した。
【0260】
hAB43+-34の発現と精製。pAB5によりエンコードされるhAB43+-34タンパク質を、pET28b+システム(Novagen)の供給業者により記載されたようにしてBL21-Gold (Novagen)イー・
コリ細胞において発現した。
【0261】
発現したhAB43+-34タンパク質を、封入体を洗浄し、その後、6 M尿素存在下にBioCad精製ワークステーション(PerSeptive Biosystems、USA)を用いて、カチオン交換クロマトグラフィーを行うことにより、85%を超える純度に精製した。その後、減少した量の尿素を
含む溶液に対して段階的に透析を行うことにより、尿素を除去した。最終バッファーは、10 mM Tris、pH 8.5であった。
【0262】
免疫化研究。ヒトAPP(アルツハイマーの前駆体タンパク質)へのマウストランスジェニ
ックを、研究に用いた。TgRND8+と呼ばれるこれらのマウスは、マウスの脳においてAβ-40およびAβ-42の高い濃度となるAPPの変異形態を発現する(Janus, C.ら)。
【0263】
マウス(群あたり8〜10匹のマウス)を、Aβ-42 (SEQ ID NO: 2、残基673〜714、標準Fmocストラテジーにより合成)またはhAB43+-34変形(実施例1の表中の構築物34、組換え的に
製造)のいずれかで、2週間間隔で4回免疫した。投与量は、Aβについて100 mgまたはhAB43+-34について50 mgのいずれかであった。43日目(3回の注射後)および52日目(4回の注射
後)にマウスの血を採取し、血清を、直接Aβ-42 ELISA を用いて抗-Aβ-42特異的力価の
レベルを測定するのに用いた。
以下の表は、平均の相対的抗-Aβ-42力価を示す。
【0264】
【表3】

【0265】
明らかに、hAB43+-34 Aβ変形で免疫して得られた抗体力価は、変化していない野生型Aβ-42を抗原として用いて得られた力価より、3および4免疫化後で、それぞれ約4倍および7.5倍高い。免疫化に用いた変形の量が、免疫に用いた野生型配列の量の50%のみであった場合に、この事実は、さらに正しい相関関係におかれる。
【0266】
実施例3
架橋剤として活性化されたポリヒドロキシポリマーを用いた、Aβペプチドコポリマーワ
クチンの合成。
導入。伝統的なコンジュゲートワクチンは、担体タンパク質に共有的に結合した(ポリ)ペプチドからなる。ペプチドはB細胞エピトープを含み、担体タンパク質はTヘルパーエピトープを提供する。しかしながら、担体タンパク質のほとんどは、全配列のわずかな部分しか適切なTヘルパーエピトープを含まないので、通常、Tヘルパーエピトープの起源として適切ではない。このようなエピトープは、例えば12〜15アミノ酸のペプチドとして定義され、合成され得る。これらのペプチドが、例えば多価活性化されたポリヒドロキシポリマーを介してB細胞エピトープを含むペプチドに共有的に結合する場合、適切な部分のみ
を含むワクチン分子を得ることができる。B細胞およびT細胞エピトープの間の最適化された比を含むワクチンコンジュゲートを提供することも、さらに可能である。
【0267】
活性化されたポリヒドロキシポリマーの合成。デキストラン、スターチ、アガロースなどのポリヒドロキシポリマーは、N-メチルピロリジノン(NMP)中に溶解した均質合成(デキストラン)か、または例えばアセトン中における不均質合成(スターチ、アガロース、架橋デキストラン)のいずれかにより、2,2,2-トリフルオロエタンスルホニル クロライド(トレシルクロライド)とともに活性化することができる。
【0268】
乾燥N-メチルピロリジノン(NMP) 225 mlを、乾燥条件下に、攪拌のための磁石を備えた500 ml丸底フラスコ中の凍結乾燥した水溶性デキストラン(4.5 g、83 mmol、臨床グレー
ド、Mw(平均) 78000)に添加する。フラスコを磁石で攪拌しながら60℃の油浴中におく。
温度を20分間かけて92℃に上昇させる。デキストランが溶解したら、フラスコを油浴中から直ちに出し、浴中の温度を40℃に下げる。フラスコをさらに磁石で攪拌しながら再び油浴中におき、トレシルクロライド(2.764 ml、25 mmol)を滴下する。15分後、乾燥ピリジ
ン(無水、2.020 ml、25 mmol)を滴下する。フラスコを油浴から出し、室温で1時間攪拌する。生成物(トレシル活性化デキストラン、TAD)を、冷エタノール(99.9%) 1200 ml中で沈殿させる。
【0269】
上清を移し、2000 rpm での遠心分離により、沈殿物を50 mlのポリプロピレンチューブに回収する。沈殿物を0.5%酢酸50 mlに溶解し、0.5%酢酸5000 mlに対して2回透析して、
凍結乾燥する。TADは、凍結乾燥粉末として-20℃で保存できる。
【0270】
アガロースや架橋デキストランのような不溶性ポリヒドロキシポリマーは、例えばアセトン中にポリヒドロキシポリマーの懸濁液をつくり、固相合成としての合成を行うことによりトレシル活性化することができる。活性化ポリヒドロキシポリマーは、ろ過により回収することができる。適切な方法は、例えばNilsson KおよびMosbach K (1987)、Methods
in Enzymology 135、p. 67、ならびにHermansson GTら(1992)、"Immobilized Affinity Ligand Techniques"、Academic Press, Inc.、p. 87に報告されている。
【0271】
Aβペプチドコポリマーワクチンの合成。TAD (10 mg)をH2O 100μlに溶解し、Aβ-42 (SEQ ID NO: 2、残基673〜714) 5 mg、P2 (SEQ ID NO: 4) 2.5 mgおよびP30 (SEQ ID NO: 6) 2.5 mgを含むpH 9.6のカーボネートバッファー1000μlを添加する。Aβ-42 ならびにP2およびP30ペプチドは全て、保護されたリシン基を含む:これらは、1-(4,4-ジメチル-2,6-ジシクロヘキシ-1-イリデン)エチル (Dde)保護リシン基の形態にある。ペプチドを標準Fmocストラテジーにより製造するが、ここで、従来のFmoc-Lys(Boc)-OHをFmoc-Lys(Dde)-OH (Novabiochemより入手、カタログ番号04-12-1121)で置換し、すなわちリシンのε-ア
ミノ基がBoc の代わりにDdeで保護される。
【0272】
pHの値を測定し、1 M HClを用いて9.6に合わせる。室温にて2.5時間後、80%溶液からのヒドラジンを最終ヒドラジン濃度8%まで添加し、溶液をさらに室温にて30分間インキュベ
ートし、その後、直ちに凍結乾燥する。凍結乾燥した生成物をH2Oに溶解し、最終の凍結
乾燥の前に、H2Oに対して延長して透析する。
【0273】
最終生成物中のB細胞エピトープ(Aβ)およびT細胞エピトープ(P2およびP30)の間の比は、合成工程において異なる濃度のこれらのペプチドを用いることにより、変動させることができる。さらに、最終産物は、合成工程においてカーボネートバッファーにアミノ化マンノースを添加することにより、例えばマンノース(APCへのコンジュゲートを標的とするように)でタグを付加することができる。
【0274】
不溶性の活性化されたポリヒドロキシポリマーを、B細胞エピトープを含むペプチドお
よびT細胞エピトープを結合するのに用いる場合、ポリマーへの結合は、固相合成として
行うことができ、最終産物は洗浄およびろ過により回収して精製する。
【0275】
一般的な説明において言及したように、ペプチドベースのワクチンを製造する今回記載のアプローチは、全く合成のペプチドワクチンを製造するのが便利である場合、および問題のポリペプチド抗原が単一のペプチドにおいて充分な免疫原性を提供する場合に、いずれの他のポリペプチド抗原にも適用することができる。
【0276】
実施例4
合成ペプチドコポリマーワクチン
TAD (10 mg)をH2O 100μlに溶解し、ペプチドA (興味のあるいずれの免疫原性ペプチド) 1〜5 mg、P2 (ジフテリアトキソイドP2エピトープ) 1〜5 mg およびP30 (ジフテリアトキソイドP30エピトープ) 1〜5 mgを含むpH 9.6のカーボネートバッファー1000μlを添加
する。pHの値を測定し、0.1 M HClを用いて9.6に合わせる。室温にて2.5時間後、溶液を
その後直ちに凍結乾燥する。凍結乾燥した生成物をH2Oに溶解し、最終の凍結乾燥の前に
、H2Oに対して延長して透析するか、またはゲルろ過カラム上で脱塩する。ペプチドが配
列中にリシンを有する場合、リシン側鎖中のε-アミンを、合成中にFmoc-Lys(Dde)-OH 誘導体を用いてDdeにより保護するべきである (GregoriusおよびTheisen 2001、提出済み)
。結合後、80%溶液からのヒドラジンを最終ヒドラジン濃度1〜20%まで添加し、溶液を室
温にてさらに30分間インキュベートし、その後、直ちに凍結乾燥し、最終の凍結乾燥の前に、H2Oに対して延長して透析するか、またはゲルろ過カラム上で脱塩する。原理を図2の概略図に示す。
【0277】
このような免疫原は、「ペプチドA」としてのボレリア・ブルゴドルフェリのタンパク
質OspCの短いC末端断片、およびペプチドBとしてのジフテリアトキソイドエピトープ(P2
またはP30)とともに、本発明者らにより用いられている。この抗原による免疫化研究の結果は、OspC断片およびワクチン化したマウスのMHCハプロタイプに適合する外来ジフテリ
アエピトープを含む、本発明の抗原だけが、これらのマウスにおいてOspCに反応性の抗体を誘導することが可能であったことを明らかにした。これに対して、OspCペプチドのみを含む分子は、抗体産生を誘導することができず、また、一方がOspCを含み、他方がエピトープを含む、2の免疫原の混合物についても同様であった。よって、本質的でないとして
も、OspCのような短いペプチドハプテンに対する抗体産生を誘導するために、同じポリヒドロキシポリマー担体への包含がより優れていると結論付ける。
【0278】
参考文献のリスト
Brookmeyer, R.;Gray, S.;Kawas, C. (1998). Projections of Alzheimer's Disease
in the United States and the Public Health Impact of Delaying Disease Onset. American Journal of Public Health、88(9)、1337〜1342。
Buttini, M.;Orth, M.;Bellosta, S.;Akeefe, H.;Pitas, R.E.;Wyss Coray, T.;Mucke, L.;Mahley, R.W. (1999). Expression of Human Apolipoprotein E3 or E4 in t
he Brains of Apoe-/- Mice: Isoform Specific Effects on Neurodegeneration. Journal of Neuroscience、19、4867〜4880。
【0279】
Clark, L.N.;Poorkaj, P.;Wszolek, Z.;Geschwind, D.H.;Nasreddine, Z.S.;Miller, B.;Li, D.;Payami, H.;Awert, F.;Markopoulou, K.;Andreadis, A.;D'Souza, I.;Lee, V.M.;Reed, L.;Trojanowski, J.Q.;Zhukareva, V.;Bird, T.;Schellenberg, G.;Wilhelmsen, K.C. (1998). Pathogenic Implications of Mutations in the Tau Gene in Pallido Ponto Nigral Degeneration and Related Neurodegenerative Disorders Linked to Chromosome 17. Proceedings of the National Academy of Sciences U.S.A.、95(22)、13103〜13107。
Gupta, R. K.ら(1998)、Dev Biol Stand. 92:63〜78。
【0280】
Hsiao K.ら(1998) Transgenic mice expressing Alzheimer amyloid precursor proteins"、Exp. Gerontol. 33 (7〜8)、883〜889
Hutton, M.;Lendon, C.L.;Rizzu, P.;Baker, M.;Froelich, S.;Houlden, H.;Pickering Brown, S.;Chakraverty, S.;Isaacs, A.;Grover, A.;Hackett, J.;Adamson,
J.;Lincoln, S.;Dickson, D.;Davies, P.;Petersen, R.C.;Stevens, M.;de Graaff, E.;Wauters, E.;van Baren, J.;Hillebrand, M.;Joosse, M.;Kwon, J.M.;Nowotny, P.;Che, L.K.;Norton, J.;Morris, J.C.;Reed, L.E.;Trojanowski, J.;Basun,
H.;Lannfelt, L.;Neystat, M.;Fahn, S.;Dark, F.;Tannenberg, T.;Dodd, P.;Hayward, N.;Kwok, J.B.J.;Schofield, P.R.;Andreadis, A.;Snowden, J.;Craufurd, D.;Neary, D.;Owen, F.;Oostra, B.A.;Hardy, J.;Goate, A.;van Swieten, J.;Mann, D.;Lynch, T.;Heutink, P. (1998). Association of Missense and 5' Splice Site Mutations in Tau with the Inherited Dementia FTDP 17. Nature、393、702〜705。
【0281】
Janus, C.ら(2000)、Nature 408:979〜982。
Kas, H.S. (1997) J Microencapsul 14:689〜711
Leon, J.;Cheng, C.K.;Neumann, P.J. (1998). Alzheimer's Disease Care: Costs and Potential Savings. Health Affairs、17(6)、206〜216。
Lippa C. F.ら(1998) Ab-42 deposition precedes other changes in PS-1 Alzheimer's disease. Lancet 352、1117〜1118
Luo, J. J.;Wallace, W.;Riccioni, T.;Ingram, D.K.;Roth, G.S.;Kusiak, J.W. (1999). Death of PC12 Cells and Hippocampal Neurons Induced by Adenoviral Mediated FAD Human Amyloid Precursor Protein Gene Expression. Journal of Neuroscience Research、55(5)、629〜642。
【0282】
Naruse, S.;Thinakaran, G.;Luo, J. J.;Kusiak, J.W.;Tomita, T.;Iwatsubo, T.;Qian, X.;Ginty, D.D.;Price, D.L.;Borchelt, D.R.;Wong, P.C.;Sisodia, S.S. (1998). Effects of PS1 Deficiency on Membrane Protein Trafficking in Neurons. Neuron、21(5)、1213〜1231。
National Institute on Aging Progress Report on Alzheimer's Disease、1999、NIH Publication No. 99-4664。
Pietrobon, P.J. (1995)、Pharm Biotechnol. 6:347〜61Poorkaj, P.;Bird, T.D.;Wijsman, E.;Nemens, E.;Garruto, R.M.;Anderson, L.;Andreadis, A.;Wiederhold, W.C.;Raskind, M.;Schellenberg, G.D. (1998). Tau Is a Candidate Gene for Chromosome 17 Frontotemporal Dementia. Annals of Neurology、43、815〜825。
Schenk, D.;Barbour, R.;Dunn, W.;Gordon, G.;Grajeda, H.;Guido, T.;Hu, K.
;Huang, J.;Johnson Wood, K.;Khan, K.;Kholodenko, D.;Lee, M.;Liao, Z.;Lieberburg, I.;Motter, R.;Mutter, L.;Soriano, F.;Shopp, G.;Vasquez, N.;Vandevert, C.;Walker, S.;Wogulis, M.;Yednock, T.;Games, D.;Seubert, P. (1999). Imm
unization with A beta Attenuates Alzheimer's Disease Like Pathology in the PDAPP
Mouse. Nature、400(6740)、173〜177。
【0283】
Shekunov, B.ら(1999)、J. Crystal Growth 198/199:1345〜1351。
Spillantini, M.G.;Murrell, J.R.;Goedert, M.;Farlow, M.R.;Klug, A.;Ghetti,
B. (1998). Mutation in the Tau Gene in Familial Multiple System Tauopathy with Presenile Dementia. Proceedings of the National Academy of Sciences U.S.A., 95(13)、7737〜7741。
Strittmatter, W.J.;Saunders, A.M.;Schmechel, D.;Pericak Vance, M.;Enghild,
J.;Salvesen, G.S.;Roses, A.D. (1993). Apolipoprotein E: High Avidity Binding to Aβ and Increased Frequency of Type 4 Allele in Late Onset Familial Alzheimer
Disease. Proceedings of the National Academy of Sciences U.S.A.、90、1977〜1981。
Vidal, R.;Frangione, B.;Rostagno, A.;Mead, S.;Revesz, T.;Plant, G.;Ghiso, J. (1999). A Stop Codon Mutation in the BRI Gene Associated with Familial British Dementia. Nature、399:776〜781。
Zheng H. (1996) "Mice deficient for the amyloid precursor protein gene. Ann. N
Y Acad. Sci.、777、421〜426。
York, P. (1999)、PSTT 11:430〜440
【特許請求の範囲】
【請求項1】
a) SEQ ID NO: 2の残基672〜714のサブシークエンスの少なくとも1つのコピーからなるポリアミノ酸であって、少なくとも1つの外来Tヘルパーエピトープ(THエピトープ)が、アミノ酸の付加および/または挿入および/または欠失および/または置換により組み込まれ、該サブシークエンスが、SEQ ID NO: 2のアミノ酸残基673〜714からなるアミノ酸配列の残基1〜40、残基1〜39、残基1〜35、残基1〜34、残基1〜28、残基1〜12、残基1〜5、残基13〜28、残基13〜35、残基17〜28、残基25〜35、残基35〜40、残基36〜42および残基35〜42からなる群より選択され、SEQ ID NO: 2のアミノ酸残基673〜714の位置19のフェニルアラニンが任意に置換されていてもよいポリアミノ酸であるか;または
b) a)で定義したポリアミノ酸が別個に結合しているポリヒドロキシポリマー骨格を含むコンジュゲートであるか;または
c) a)で定義したポリアミノ酸をエンコードする核酸であるか;または
d) a)で定義したポリアミノ酸をエンコードして発現する核酸断片を有する非病原性微生物またはウイルスである
免疫原を含有する、ヒトを含む動物におけるアルツハイマー病またはアミロイド沈着を特徴とする他の疾患の治療、予防または改善のための医薬組成物。
【請求項2】
ポリアミノ酸またはコンジュゲートが、
−Bリンパ球または抗原提示細胞(APC)上にそれに対する受容体がある炭水化物、およびAPCまたはリンパ球上の表面分子を特異的に認識する抗体フラグメントから選択される、APCもしくはBリンパ球へのポリアミノ酸の標的化をもたらす少なくとも1つの第一成分、および/または
−サイトカイン、ヒートショックタンパク質および分子状シャペロンから選択される、免疫系を刺激する少なくとも1つの第二成分、および/または
−脂質化アンカー、相補因子C3のC3d断片およびC3から選択される、免疫系へのポリアミノ酸の提示を最適化する少なくとも1つの第三成分
を含む請求項1に記載の医薬組成物。
【請求項3】
第一および/または第二および/または第三成分が、APPもしくはAβ配列における適切な化学基への共有もしくは非共有結合により側鎖として結合している請求項2に記載の医薬組成物。
【請求項4】
ポリアミノ酸またはコンジュゲートが融合ポリペプチドを含む請求項1〜3のいずれか1項に記載の医薬組成物。
【請求項5】
ポリアミノ酸またはコンジュゲートが、APPもしくはAβの少なくとも1つのB細胞エピトープの重複、および/またはハプテンの導入を含む請求項1〜4のいずれか1項に記載の医薬組成物。
【請求項6】
外来T細胞エピトープが動物において免疫優性である請求項1〜5のいずれか1項に記載の医薬組成物。
【請求項7】
外来T細胞エピトープが、乱交雑である請求項1〜6のいずれか1項に記載の医薬組成物。
【請求項8】
天然T細胞エピトープが、破傷風トキソイドエピトープ、ジフテリアトキソイドエピトープ、インフルエンザウイルスヘマグルチニンエピトープ、およびピー・ファルシパルムCSエピトープから選択される請求項7に記載の医薬組成物。
【請求項9】
ポリアミノ酸またはコンジュゲートが、Aβの前駆体ポリペプチドの細胞結合形態に存在する場合に細胞外の相に露出しないB細胞エピトープを含む請求項1〜8のいずれか1項に記載の医薬組成物。
【請求項10】
ポリアミノ酸またはコンジュゲートが、Aβの前駆体ポリペプチドの細胞結合形態に存在する場合に細胞外の相に露出する少なくとも1つのB細胞エピトープを有さない請求項1〜9のいずれか1項に記載の医薬組成物。
【請求項11】
変形a)の免疫原が、
-破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基1-28、その後に破傷風トキソイドP30エピトープのアミノ酸残基、
- Aβのアミノ酸残基1-12、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後に破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基13-28、
- Aβのアミノ酸残基1-12、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後にAβのアミノ酸残基1-12、その後に破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基1-12、
- Aβのアミノ酸残基13-28、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後にAβのアミノ酸残基13-28、その後に破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基13-28、
- Aβのアミノ酸残基1-12、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後にAβのアミノ酸残基13-35、その後に破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基36-42、
- Aβのアミノ酸残基1-28、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後にAβのアミノ酸残基1-28、その後に破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基1-28、および
- 位置19のフェニルアラニンがプロリンで置換され、位置35のメチオニンがリジンで置換されたAβのアミノ酸残基1-43、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後に破傷風トキソイドP2エピトープのアミノ酸残基
からなる群より選択されるポリアミノ酸を含むか、または該ポリアミノ酸からなる、請求項1〜10のいずれか1項に記載の医薬組成物。
【請求項12】
少なくとも2コピーのポリアミノ酸またはコンジュゲートが、抗原決定基の多コピーを
提示することができる担体分子に共有的もしくは非共有的に結合する請求項1〜11のいずれか1項に記載の医薬組成物。
【請求項13】
変形b)で、ポリアミノ酸が、アミド結合によりポリヒドロキシポリマーに結合している請求項1〜12のいずれか1項に記載の医薬組成物。
【請求項14】
変形b)で、ポリヒドロキシポリマーが多糖類である請求項1〜13のいずれか1項に記載の医薬組成物。
【請求項15】
ポリアミノ酸またはコンジュゲートが、自己抗原への自己寛容を破壊するのを促進するアジュバントとともに処方される請求項1〜14のいずれか1項に記載の医薬組成物。
【請求項16】
治療、予防または改善が、ポリアミノ酸またはコンジュゲートの有効量を、非経口経路;腹膜経路;経口経路;バッカル経路;舌下経路;硬膜外経路;脊髄経路;肛門経路;頭蓋内経路から選択される経路を経て動物に投与することを伴う請求項1〜15のいずれか1項に記載の医薬組成物。
【請求項17】
有効量が、0.5μg〜2,000μgのポリアミノ酸またはコンジュゲートである請求項16に記載の医薬組成物。
【請求項18】
変形c)で、治療、予防または改善が、ポリアミノ酸またはコンジュゲートをエンコードする核酸を動物細胞に導入し、それにより導入された核酸の該細胞によるインビボ発現を得ることを伴う請求項1〜11のいずれか1項に記載の医薬組成物。
【請求項19】
導入された核酸が、裸のDNA、荷電または非荷電の脂質とともに処方されたDNA、リポソーム中に処方されたDNA、ウイルスベクターに包含されたDNA、トランスフェクション促進タンパク質またはポリペプチドとともに処方されたDNA、標的化タンパク質またはポリペプチドとともに処方されたDNA、カルシウム沈殿剤とともに処方されたDNA、不活性担体分子に結合したDNA、キチンまたはキトサン中に被包されたDNA、およびアジュバントとともに処方されたDNAから選択される請求項18に記載の医薬組成物。
【請求項20】
治療、予防または改善が、1年あたり少なくとも1、少なくとも2、少なくとも3、少なくとも4、少なくとも6、または少なくとも12の投与/導入を含む請求項16〜19のいずれか1項に記載の医薬組成物。
【請求項21】
治療、予防または改善が、アミロイドの全量が減少するか、もしくはアミロイド形成の速度が臨床上有意義に減少する程度に、APPまたはAβがダウンレギュレーションされることを含む請求項1〜20のいずれか1項に記載の医薬組成物。
【請求項22】
ポリアミノ酸またはコンジュゲートを用いた動物の免疫化が、動物の自己APPもしくはAβに対する抗体の産生を誘導する結果となる修飾が導入されており、該ポリアミノ酸またはコンジュゲートが請求項1〜14のいずれか1項に定義される、動物のAPPもしくはAβに由来するポリアミノ酸またはコンジュゲート。
【請求項23】
医薬上および免疫学上許容される担体および/または賦形剤ならびに任意にアジュバントをさらに含む、請求項22に記載のポリアミノ酸またはコンジュゲートの免疫原的有効量を含む免疫原性組成物。
【請求項24】
請求項22に記載のポリアミノ酸をエンコードする核酸断片。
【請求項25】
請求項24に記載の核酸断片を有するベクター。
【請求項26】
プラスミド、ファージ、コスミド、ミニ染色体、およびウイルスからなる群より選択される請求項25に記載のベクター。
【請求項27】
請求項24に記載の核酸断片の発現を推進するプロモーター、必要に応じて、ポリペプチド断片の分泌もしくは膜への組み込みを可能にするリーダーペプチドをエンコードする核酸配列、請求項24に記載の核酸断片、および必要に応じてターミネーターを、5'→3'方向に実施可能な連鎖で含む請求項25または26に記載のベクター。
【請求項28】
宿主細胞に導入された場合に、宿主細胞のゲノムに組み込まれることが可能であるか、または不可能である請求項25〜27のいずれか1項に記載のベクター。
【請求項29】
プロモーターが、真核細胞および/または原核細胞における発現を推進する請求項27または28に記載のベクター。
【請求項30】
請求項25〜29のいずれか1項に記載のベクターを有する形質転換細胞。
【請求項31】
細菌、酵母、原虫から選択される微生物、または真菌、昆虫細胞、植物細胞および哺乳動物細胞から選択される多細胞生物に由来する細胞である請求項30に記載の形質転換細胞。
【請求項32】
請求項24に記載の核酸断片を発現する請求項30または31に記載の形質転換細胞。
【請求項33】
変形d)で、治療、予防または改善が、ポリアミノ酸をエンコードして発現する核酸断片を有する非病原性微生物またはウイルスを投与することを伴う請求項1〜11のいずれか1項に記載の医薬組成物。
【請求項34】
−請求項24に記載の核酸断片もしくは請求項25〜29のいずれか1項に記載のベクター、ならびに
−医薬上および免疫学上許容される担体および/または賦形剤および/またはアジュバント
を含むアミロイドに対する抗体産生を誘導する組成物。
【請求項35】
請求項25〜29のいずれか1項に記載のベクターを有し、請求項24に記載の核酸断片を発現し、その表面に請求項22に記載のポリアミノ酸を任意に分泌するかまたは有する安定な細胞ライン。
【請求項1】
a) SEQ ID NO: 2の残基672〜714のサブシークエンスの少なくとも1つのコピーからなるポリアミノ酸であって、少なくとも1つの外来Tヘルパーエピトープ(THエピトープ)が、アミノ酸の付加および/または挿入および/または欠失および/または置換により組み込まれ、該サブシークエンスが、SEQ ID NO: 2のアミノ酸残基673〜714からなるアミノ酸配列の残基1〜40、残基1〜39、残基1〜35、残基1〜34、残基1〜28、残基1〜12、残基1〜5、残基13〜28、残基13〜35、残基17〜28、残基25〜35、残基35〜40、残基36〜42および残基35〜42からなる群より選択され、SEQ ID NO: 2のアミノ酸残基673〜714の位置19のフェニルアラニンが任意に置換されていてもよいポリアミノ酸であるか;または
b) a)で定義したポリアミノ酸が別個に結合しているポリヒドロキシポリマー骨格を含むコンジュゲートであるか;または
c) a)で定義したポリアミノ酸をエンコードする核酸であるか;または
d) a)で定義したポリアミノ酸をエンコードして発現する核酸断片を有する非病原性微生物またはウイルスである
免疫原を含有する、ヒトを含む動物におけるアルツハイマー病またはアミロイド沈着を特徴とする他の疾患の治療、予防または改善のための医薬組成物。
【請求項2】
ポリアミノ酸またはコンジュゲートが、
−Bリンパ球または抗原提示細胞(APC)上にそれに対する受容体がある炭水化物、およびAPCまたはリンパ球上の表面分子を特異的に認識する抗体フラグメントから選択される、APCもしくはBリンパ球へのポリアミノ酸の標的化をもたらす少なくとも1つの第一成分、および/または
−サイトカイン、ヒートショックタンパク質および分子状シャペロンから選択される、免疫系を刺激する少なくとも1つの第二成分、および/または
−脂質化アンカー、相補因子C3のC3d断片およびC3から選択される、免疫系へのポリアミノ酸の提示を最適化する少なくとも1つの第三成分
を含む請求項1に記載の医薬組成物。
【請求項3】
第一および/または第二および/または第三成分が、APPもしくはAβ配列における適切な化学基への共有もしくは非共有結合により側鎖として結合している請求項2に記載の医薬組成物。
【請求項4】
ポリアミノ酸またはコンジュゲートが融合ポリペプチドを含む請求項1〜3のいずれか1項に記載の医薬組成物。
【請求項5】
ポリアミノ酸またはコンジュゲートが、APPもしくはAβの少なくとも1つのB細胞エピトープの重複、および/またはハプテンの導入を含む請求項1〜4のいずれか1項に記載の医薬組成物。
【請求項6】
外来T細胞エピトープが動物において免疫優性である請求項1〜5のいずれか1項に記載の医薬組成物。
【請求項7】
外来T細胞エピトープが、乱交雑である請求項1〜6のいずれか1項に記載の医薬組成物。
【請求項8】
天然T細胞エピトープが、破傷風トキソイドエピトープ、ジフテリアトキソイドエピトープ、インフルエンザウイルスヘマグルチニンエピトープ、およびピー・ファルシパルムCSエピトープから選択される請求項7に記載の医薬組成物。
【請求項9】
ポリアミノ酸またはコンジュゲートが、Aβの前駆体ポリペプチドの細胞結合形態に存在する場合に細胞外の相に露出しないB細胞エピトープを含む請求項1〜8のいずれか1項に記載の医薬組成物。
【請求項10】
ポリアミノ酸またはコンジュゲートが、Aβの前駆体ポリペプチドの細胞結合形態に存在する場合に細胞外の相に露出する少なくとも1つのB細胞エピトープを有さない請求項1〜9のいずれか1項に記載の医薬組成物。
【請求項11】
変形a)の免疫原が、
-破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基1-28、その後に破傷風トキソイドP30エピトープのアミノ酸残基、
- Aβのアミノ酸残基1-12、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後に破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基13-28、
- Aβのアミノ酸残基1-12、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後にAβのアミノ酸残基1-12、その後に破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基1-12、
- Aβのアミノ酸残基13-28、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後にAβのアミノ酸残基13-28、その後に破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基13-28、
- Aβのアミノ酸残基1-12、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後にAβのアミノ酸残基13-35、その後に破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基36-42、
- Aβのアミノ酸残基1-28、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後にAβのアミノ酸残基1-28、その後に破傷風トキソイドP2エピトープのアミノ酸残基、その後にAβのアミノ酸残基1-28、および
- 位置19のフェニルアラニンがプロリンで置換され、位置35のメチオニンがリジンで置換されたAβのアミノ酸残基1-43、その後に破傷風トキソイドP30エピトープのアミノ酸残基、その後に破傷風トキソイドP2エピトープのアミノ酸残基
からなる群より選択されるポリアミノ酸を含むか、または該ポリアミノ酸からなる、請求項1〜10のいずれか1項に記載の医薬組成物。
【請求項12】
少なくとも2コピーのポリアミノ酸またはコンジュゲートが、抗原決定基の多コピーを
提示することができる担体分子に共有的もしくは非共有的に結合する請求項1〜11のいずれか1項に記載の医薬組成物。
【請求項13】
変形b)で、ポリアミノ酸が、アミド結合によりポリヒドロキシポリマーに結合している請求項1〜12のいずれか1項に記載の医薬組成物。
【請求項14】
変形b)で、ポリヒドロキシポリマーが多糖類である請求項1〜13のいずれか1項に記載の医薬組成物。
【請求項15】
ポリアミノ酸またはコンジュゲートが、自己抗原への自己寛容を破壊するのを促進するアジュバントとともに処方される請求項1〜14のいずれか1項に記載の医薬組成物。
【請求項16】
治療、予防または改善が、ポリアミノ酸またはコンジュゲートの有効量を、非経口経路;腹膜経路;経口経路;バッカル経路;舌下経路;硬膜外経路;脊髄経路;肛門経路;頭蓋内経路から選択される経路を経て動物に投与することを伴う請求項1〜15のいずれか1項に記載の医薬組成物。
【請求項17】
有効量が、0.5μg〜2,000μgのポリアミノ酸またはコンジュゲートである請求項16に記載の医薬組成物。
【請求項18】
変形c)で、治療、予防または改善が、ポリアミノ酸またはコンジュゲートをエンコードする核酸を動物細胞に導入し、それにより導入された核酸の該細胞によるインビボ発現を得ることを伴う請求項1〜11のいずれか1項に記載の医薬組成物。
【請求項19】
導入された核酸が、裸のDNA、荷電または非荷電の脂質とともに処方されたDNA、リポソーム中に処方されたDNA、ウイルスベクターに包含されたDNA、トランスフェクション促進タンパク質またはポリペプチドとともに処方されたDNA、標的化タンパク質またはポリペプチドとともに処方されたDNA、カルシウム沈殿剤とともに処方されたDNA、不活性担体分子に結合したDNA、キチンまたはキトサン中に被包されたDNA、およびアジュバントとともに処方されたDNAから選択される請求項18に記載の医薬組成物。
【請求項20】
治療、予防または改善が、1年あたり少なくとも1、少なくとも2、少なくとも3、少なくとも4、少なくとも6、または少なくとも12の投与/導入を含む請求項16〜19のいずれか1項に記載の医薬組成物。
【請求項21】
治療、予防または改善が、アミロイドの全量が減少するか、もしくはアミロイド形成の速度が臨床上有意義に減少する程度に、APPまたはAβがダウンレギュレーションされることを含む請求項1〜20のいずれか1項に記載の医薬組成物。
【請求項22】
ポリアミノ酸またはコンジュゲートを用いた動物の免疫化が、動物の自己APPもしくはAβに対する抗体の産生を誘導する結果となる修飾が導入されており、該ポリアミノ酸またはコンジュゲートが請求項1〜14のいずれか1項に定義される、動物のAPPもしくはAβに由来するポリアミノ酸またはコンジュゲート。
【請求項23】
医薬上および免疫学上許容される担体および/または賦形剤ならびに任意にアジュバントをさらに含む、請求項22に記載のポリアミノ酸またはコンジュゲートの免疫原的有効量を含む免疫原性組成物。
【請求項24】
請求項22に記載のポリアミノ酸をエンコードする核酸断片。
【請求項25】
請求項24に記載の核酸断片を有するベクター。
【請求項26】
プラスミド、ファージ、コスミド、ミニ染色体、およびウイルスからなる群より選択される請求項25に記載のベクター。
【請求項27】
請求項24に記載の核酸断片の発現を推進するプロモーター、必要に応じて、ポリペプチド断片の分泌もしくは膜への組み込みを可能にするリーダーペプチドをエンコードする核酸配列、請求項24に記載の核酸断片、および必要に応じてターミネーターを、5'→3'方向に実施可能な連鎖で含む請求項25または26に記載のベクター。
【請求項28】
宿主細胞に導入された場合に、宿主細胞のゲノムに組み込まれることが可能であるか、または不可能である請求項25〜27のいずれか1項に記載のベクター。
【請求項29】
プロモーターが、真核細胞および/または原核細胞における発現を推進する請求項27または28に記載のベクター。
【請求項30】
請求項25〜29のいずれか1項に記載のベクターを有する形質転換細胞。
【請求項31】
細菌、酵母、原虫から選択される微生物、または真菌、昆虫細胞、植物細胞および哺乳動物細胞から選択される多細胞生物に由来する細胞である請求項30に記載の形質転換細胞。
【請求項32】
請求項24に記載の核酸断片を発現する請求項30または31に記載の形質転換細胞。
【請求項33】
変形d)で、治療、予防または改善が、ポリアミノ酸をエンコードして発現する核酸断片を有する非病原性微生物またはウイルスを投与することを伴う請求項1〜11のいずれか1項に記載の医薬組成物。
【請求項34】
−請求項24に記載の核酸断片もしくは請求項25〜29のいずれか1項に記載のベクター、ならびに
−医薬上および免疫学上許容される担体および/または賦形剤および/またはアジュバント
を含むアミロイドに対する抗体産生を誘導する組成物。
【請求項35】
請求項25〜29のいずれか1項に記載のベクターを有し、請求項24に記載の核酸断片を発現し、その表面に請求項22に記載のポリアミノ酸を任意に分泌するかまたは有する安定な細胞ライン。
【図1】


【図2】




【図2】


【公開番号】特開2009−280582(P2009−280582A)
【公開日】平成21年12月3日(2009.12.3)
【国際特許分類】
【出願番号】特願2009−141187(P2009−141187)
【出願日】平成21年6月12日(2009.6.12)
【分割の表示】特願2003−520770(P2003−520770)の分割
【原出願日】平成14年8月20日(2002.8.20)
【出願人】(508344590)
【氏名又は名称原語表記】H.LUNDBECK A/S
【住所又は居所原語表記】Ottiliavej 9,DK−2500 Valby,DENMARK
【Fターム(参考)】
【公開日】平成21年12月3日(2009.12.3)
【国際特許分類】
【出願日】平成21年6月12日(2009.6.12)
【分割の表示】特願2003−520770(P2003−520770)の分割
【原出願日】平成14年8月20日(2002.8.20)
【出願人】(508344590)

【氏名又は名称原語表記】H.LUNDBECK A/S
【住所又は居所原語表記】Ottiliavej 9,DK−2500 Valby,DENMARK
【Fターム(参考)】
[ Back to top ]

