癌及びグルコース代謝障害の治療に用いる合成親油性イノシトールグリカン
本発明は、親油性イノシトールグリカン化合物、並びにその塩、溶媒和物、及び生理的機能性誘導体を合成するための物質及び方法に関し、加えて癌及びグルコース代謝障害(糖尿病、肥満、メタボリック症候群等)の治療のためのこれらの使用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、親油性イノシトールグリカン化合物を合成するための物質及び方法、並びに該化合物を癌及びグルコース代謝障害(糖尿病、肥満、メタボリック症候群等)の治療に使用する方法に関する。
【背景技術】
【0002】
米国では癌は2番目に多い死亡原因となっている。2000年には、世界中の様々な原因による5600万人近くの死亡例のうち12パーセントが悪性腫瘍に関連していた。2020年までに世界の癌罹患率は50%増加し、1500万に達する可能性がある。癌の発見及び治療は進歩しているが、ワクチンや他の広く効果的な予防/治療方法は未だ得られていない。
【0003】
女性では乳癌が最も多く、これに肺癌と結腸・直腸癌が続く。現在は早期診断と積極的治療(外科処置、放射線療法、化学療法、ホルモン療法等の様々な治療のうち1種以上)の組み合わせにより癌に対応している。
【0004】
男性の場合は前立腺癌が最も多く、50歳を超える男性における発現率は30%と推定される。ヒト前立腺癌は骨へと転移する傾向がある。通常、外科処置及び/又は放射線療法に基づいて治療を行うが、これらの方法は効果が無い場合も多い。従って、当分野では幅広いヒト癌を治療するための新たな抗癌剤や治療法が強く求められている。
【0005】
世界の全年齢層の糖尿病有病率は2000年には2.8%と推定され、2030年には4.4%に達すると予期されている。糖尿病患者の総数は2000年の1億7100万人から、2030年には3億6600万人に増加すると予想されている。II型糖尿病の約90%が過剰体重に起因しているので、II型糖尿病有病率の増加は肥満の急増と密接に関連している。更に、世界で約1億9700万人が耐糖能障害を有し、その最も一般的な原因は肥満とそれに関連するメタボリック症候群である。この数は2025年までに約4億2000万人に増加すると予想されている。
【0006】
メタボリック症候群は、心臓病、卒中、及び閉塞性動脈硬化症を誘発し得る多くの心臓病危険因子を内包する中心性肥満である。国民健康調査によると、アメリカ人は5人に1人以上がメタボリック症候群に該当する。メタボリック症候群や糖尿病の根本的原因は主に運動不足と過剰体重であるため、生活様式の改善(健康食、運動増進、体重減少等)によって、メタボリック症候群に関連する合併症の低減又は予防、並びに糖尿病の制御が可能となる。
【0007】
しかしながら、糖尿病及びメタボリック症候群を患う多くの人にとって生活様式改善は困難であり、従来の治療法に従うことになる。最近の抗糖尿病薬(経口血糖降下薬、インスリン等)では完全には疾患を制御することができず、したがって完全には糖尿病性合併症を予防できない。従って、糖尿病及びメタボリック症候群の新たな治療法が必要とされている。
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、一つには、癌、糖尿病、肥満、及びメタボリック症候群の治療に用いられる新種の化合物に関する。特に本発明では、親油性イノシトールグリカン化合物からなる抗癌剤を提供し、これを単独で又は他の抗癌剤又は癌治療法と組み合わせて使用する。また、本発明は親油性イノシトールグリカン化合物からなる抗糖尿病剤を提供し、これを単独で又は他の抗糖尿病剤又は抗糖尿病療法と組み合わせて使用する。更に、メタボリック症候群の治療に用いられる親油性イノシトールグリカン化合物を提供し、これを単独で又は肥満抑制やメタボリック症候群治療に用いられる他の薬剤又は治療法と組み合わせて使用する。
【課題を解決するための手段】
【0009】
上記親油性イノシトールグリカン(IG)化合物は、式I:
A−O1−B(I)
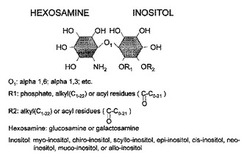
[式中、Aはグルコサミン及びガラクトサミンからなる群から選ばれるヘキソサミンであり;O1はアルファ1,6結合、アルファ1,3結合、又はアルファ1,2結合であり;Bはイノシトール、myo−イノシトール、chiro−イノシトール、scyllo−イノシトール、epi−イノシトール、cis−イノシトール、neo−イノシトール、muco−イノシトール、及びallo−イノシトールからなる群から選ばれる]で表される1以上の化合物から選択できる。B部分は互いに独立して任意にホスフェート、チオホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)で一置換又は二置換されていてよい。ある実施形態では、本発明の親油性イノシトールグリカン化合物は、1種以上の式II:
【化1】

[式中、O1はアルファ1,6結合及びアルファ1,3結合を表し;R1はホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)であり;R2はアルキル基(C1−22)又はアシル残基(O=C−C0−21)である]で表される化合物、並びにその機能性類似体及び異性体を包含する。本発明の治療的及び/又は機能的に活性な化合物として、式I及び式IIで表されるもの、並びにその異性体、塩、エステル、及び水和物等が含まれる。
【0010】
本発明のある実施形態では、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、他の薬剤又は治療法と併用する。他の態様においては、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、1種以上のアルキル−アシル−ホスファチジン酸(AAPA)化合物と併用することができる。アルキル−アシル−ホスファチジン酸(AAPA)は、IG−1のグリコシルホスファチジルイノシトール(GPI)前駆体を、GPI特異的ホスホリパーゼD(GPI−PLD)で加水分解することによって得られると考えられる物質である。好ましい実施形態では、AAPA化合物は、式III:
1−アルキル(C1−22)−2−アシル(O=C−C0−21)−sn−グリセロール−ホスフェート(III)
で表される化合物から選ばれる。AAPA化合物は、その塩、溶媒和物、及び生理的機能性誘導体も包含する。アルキル−アシル−ホスファチジン酸(AAPA)化合物の例としては、AAPA1(1−O−アルキル(18:0)−2−O−アシル−(18:0)−sn−グリセロール−ホスフェート)、AAPA2(1−O−アルキル(18:0)−2−O−アシル−(20:4)−sn−グリセロール−ホスフェート)、及びAAPA3(1−O−アルキル(18:0)−2−O−アシル−(22:4)−sn−グリセロール−ホスフェート)が挙げられるが、これらに限定されない。好ましい実施形態では、併用は相乗効果を示す。
【0011】
本発明の態様では、1種以上の親油性イノシトールグリカン化合物及び/又は1種以上のアルキル−アシル−ホスファチジン酸(AAPA)化合物を含む組成物を患者に投与することを含む。本発明の実施形態では、癌細胞の処置において相乗的な治療効果を示す、1種以上の親油性イノシトールグリカン化合物と1種以上のAAPA化合物との組み合わせを投与する方法を含む。「相乗的」とは、各薬剤を単剤療法で用いた場合の治療効果を足した合計よりも、優れた治療効果が得られることを示す。
【0012】
本発明の他の態様では、式I、II、及びIIIで表される化合物の合成方法を提供する。
【0013】
他の態様では、本発明は、有効量の親油性イノシトールグリカン化合物(或いはその機能性類似体又は異性体)を細胞に暴露して細胞増殖を抑制する方法を提供する。この細胞増殖は癌に関連するものであってよい。好ましい実施形態では、該細胞は対象の生体内に存在する。他の態様では、癌細胞の異常増殖を遅くする又は改善するために、本発明の化合物を1種以上使用してよい。
【0014】
本発明の他の態様では、治療有効量の本発明の化合物を、処置を必要とする対象に投与することによって、細胞増殖異常を治療、抑制、及び/又は改善する。この細胞増殖異常は良性腫瘍又は悪性腫瘍であってよい。特に細胞増殖異常は、癌腫(carcinoma)、肉腫(sarcoma)、リンパ腫、又は白血病であってよい。この方法の一実施形態においては、細胞増殖異常は癌であり、癌としては肺癌、骨癌、膵臓癌、皮膚癌、頭部又は頸部の癌、皮膚又は眼内の黒色腫、子宮癌、卵巣癌、直腸癌、肛門部癌、胃癌、結腸癌、乳癌、子宮癌、卵管癌、子宮内膜癌、頸部癌、膣癌、外陰癌、ホジキン病、食道癌、小腸癌、内分泌系癌、甲状腺癌、副甲状腺癌、副腎癌、軟組織肉腫、尿道癌、陰茎癌、前立腺癌、慢性又は急性の白血病、リンパ球性リンパ腫、膀胱癌、腎臓又は尿管の癌、腎細胞癌、腎盂癌、中枢神経系(CNS)の腫瘍、CNS原発リンパ腫、脊髄軸腫瘍、脳幹グリオーマ、下垂体アデノーマ、並びにこれら1種以上の組み合わせが挙げられるが、これらに限定されない。
【0015】
また、本発明の方法は、小細胞肺癌、非小細胞肺癌、食道癌、腎臓癌、膵臓癌、悪性黒色腫、膀胱癌、乳癌、結腸癌、肝臓癌、肺癌、肉腫、胃癌、胆管癌、中皮腫、又は前立腺癌からなる群から選ばれる癌の患者を治療することを包含する。この方法の他の実施形態においては、細胞増殖異常が良性増殖性疾患であり、該疾患としては乾癬、前立腺肥大症、及び再狭窄が挙げられるが、これらに限定されない。本発明の方法及び組成物を用いた治療に適する癌の例としては、前立腺癌、乳癌、膵臓癌、皮膚癌、結腸癌、前立腺癌、及び神経芽細胞腫が挙げられる。
【0016】
本発明の他の態様によれば、少なくとも1つの式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を細胞に暴露して、細胞増殖を抑制する方法が提供される。ある実施形態では、該細胞増殖は癌に関連する。この細胞は対象(好ましくは哺乳動物)の生体内に存在してよい。癌は例えば膵臓癌、乳癌、結腸癌、皮膚癌、又は前立腺癌であってよい。ある実施形態では、抗増殖特性を有する更なる第2の化合物を、同時又は連続的に細胞に暴露する。抗増殖特性を有する化合物の例としては、抗腫瘍薬、癌化学療法剤、及び抗増殖剤(レスベラトロール、ブチレート等)が挙げられるが、これらに限定されない。
【0017】
本発明は、更に式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を含有する治療用組成物を提供する。該組成物は、癌又は血管形成異常疾患を患う対象、或いはこれら疾患の疑いがある対象に投与できるように構成されている。好ましい実施形態では、親油性イノシトールグリカンを医薬組成物として調製する。この組成物は更に第2の抗増殖化合物を含有してよい。
【0018】
抗癌剤は癌細胞のアポトーシスを誘導する能力を有するのが望ましい。最小限の副作用で正常細胞に作用することなく癌細胞のアポトーシスを誘導する能力は、新規抗癌剤の開発において主要な目標である。本発明の開発過程で行った実験では、親油性イノシトールグリカンは細胞増殖を抑制し、癌細胞(ヒト膵臓癌細胞、ヒト肝臓癌細胞、ヒト胃癌細胞、ヒト結腸癌細胞、ヒト乳癌細胞等)の迅速死を誘導することが示された。一方で親油性イノシトールグリカンは正常細胞には作用しない。
【0019】
他の実施形態では、本発明は、治療有効量又は予防有効量の式I又は式IIの化合物を、薬学的に許容される添加剤、担体、又は賦形剤と共に、処置を要する患者に投与して、該患者の癌を治療又は予防する方法を包含する。
【0020】
他の態様では、本発明は、治療有効量又は予防有効量の式I又は式IIの化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、少なくとも1つの付加的な治療薬と共に、処置を要する患者に投与して、該患者の癌を治療又は予防する方法を包含する。好ましい実施形態では、治療有効量又は予防有効量の式I又は式IIの化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、1種以上の式(III)のAAPA化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)と併用する。この併用により相乗効果が得られる。他の実施形態では、この併用に、更に少なくとも1つの付加的治療薬を組み合わせて用いる。
【0021】
本発明の方法は、特に、1種以上の親油性イノシトールグリカン化合物と1種以上のAAPA化合物との組み合わせを癌患者に投与して、該患者を治療する方法を包含する。ある実施形態においては、投与する量は「有効量」であると考えてよい。当然ながら、「有効量」は、患者に1)親油性イノシトールグリカン化合物と2)AAPA化合物の両方を投与した際に、治療的有用性が得られるような量を意味する。勿論、患者には親油性イノシトールグリカンとAAPAを共に治療効果が得られると考えられる量だけ投与する。
【0022】
他の態様では、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)をグルコース代謝障害の治療に用いることができる。グルコース代謝障害としては、肥満、糖尿病、メタボリック症候群、インスリン抵抗症、耐糖能障害、高インスリン血症、X症候群、高コレステロール血症、高リポタンパク血症、高トリグリセリド血症、粥状動脈硬化症、及び糖尿病性腎症が挙げられるが、これらに限定されない。例えば、親油性イノシトールグリカン化合物はII型糖尿病の治療に有用である。II型糖尿病は、末梢組織のインスリン抵抗、膵臓ベータ細胞からのグルコース刺激によるインスリン分泌の障害、及び肝臓内グルコース新生の増加に関連する疾患である。実施例では、高脂肪食を与えたマウス及びSTZ糖尿病マウスにおける、親油性イノシトールグリカン化合物による脂肪細胞内の脂質生成の増加と血漿グルコース濃度の低下について示されている。更に、グルコース恒常性を制御するために親油性イノシトールグリカン化合物を使用することもできる。実施例に示すとおり、高脂肪食を与えたob/ob肥満マウス及びC57B/6マウスに親油性イノシトールグリカン化合物を与えて28日間処置を行った結果、1日摂食量、体重、並びにインスリン、トリグリセリド、遊離脂肪酸、及びレプチンの空腹時血漿濃度が大幅に低下した。
【図面の簡単な説明】
【0023】
【図1】本発明の親油性イノシトールグリカン化合物の一般式を示す図である。
【図2】本発明のアルキル−アシル−ホスファチジン酸化合物の一般式を示す図である。
【図3】図3Aは、無血清培地で1時間培養したPanc−1細胞中でIG−1(2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール)の乳酸産生阻害を示す棒グラフである。図3Bは、無血清培地で1時間培養したPanc−1細胞(ヒト膵臓癌細胞)中でIG−1がATP量に影響しない様子を示す棒グラフである。
【図4A】Panc−1細胞(ヒト膵臓癌細胞)に対するIG−1、レスベラトロール、及びブチレートの効果の比較、並びに1時間後にIG−1がPanc−1細胞の迅速死を誘起した様子を示す棒グラフである。
【図4B】Panc−1細胞(ヒト膵臓癌細胞)に対するIG−1、レスベラトロール、及びブチレートの効果の比較、並びに24時間後にIG−1がPanc−1細胞の迅速死を誘導した様子を示す棒グラフである。
【図4C】Panc−1細胞(ヒト膵臓癌細胞)に対するIG−1、レスベラトロール、及びブチレートの効果の比較、並びに3日後にIG−1がPanc−1細胞の迅速死を誘導した様子を示す棒グラフである。
【図5】PC3細胞(ヒト前立腺癌細胞)に対するIG−2(2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール−1−ホスフェート)、レスベラトロール、及びブチレートの効果の比較、並びに24時間後にIG−2がPC3細胞の迅速死を誘導した様子を示す棒グラフである。
【図6】3日間の処置後のヒト膵臓癌細胞(Panc−1)の死に対するIG−13(2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−1−パルミトイル−D−myo−イノシトール)、IG−14(2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−2−パルミトイル−D−myo−イノシトール)、IG−15(2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−1−パルミトイル−D−myo−イノシトール)、レスベラトロール、及びブチレートの効果を比較した棒グラフである。
【図7】エールリッヒ腹水癌細胞担癌ddYマウスにIG1及びアルキル−アシル−ホスファチジン酸(AAPA2)を7日間毎日投与した後のカプラン・マイヤー生存曲線である。
【図8】IG−1による1時間以内のヒト臍帯静脈内皮細胞迅速死に対するAAPA2の阻害効果を示す図である。
【図9】図9AはIG1を用いてインキュベートした3T3−L1脂肪細胞中のグリコーゲン合成の活性化を示す図である。図9BはIG1を用いてインキュベートした3T3−L1脂肪細胞中の脂質生成の活性化を示す図である。
【図10】IG−1及びIG−2の濃度に対する、ラットから単離した脂肪細胞中の脂質生成活性の関係を百分率で示した図である。
【図11】40μMのIG−1、IG−2、IG−13、IG−14、及びIG15を用いてインキュベートしたラット脂肪細胞の脂質生成活性化を示す図である。
【図12】図12AはIG15を用いてインキュベートした3T3−L1脂肪細胞中のグリコーゲン合成の活性化を示す図である。図12BはIG15を用いてインキュベートした3T3−L1脂肪細胞中の脂質生成の活性化を示す図である。
【図13】高脂肪食を与えたC57B/6マウスにIG1を静脈内投与した後、血漿グルコース濃度が経時的に低下する様子を示す図である。
【図14】ストレプトゾトシン(STZ)糖尿病マウスにIG1を静脈内投与した後、血漿グルコース濃度が経時的に低下する様子を示す図である。
【図15】高脂肪食を与えたC57B/6マウスにIG1を7日間腹腔内投与した後、耐糖能が経時的に改善される様子を示す図である。
【図16】STZ糖尿病マウスにIG1を7日間腹腔内投与した後、空腹時血漿グルコース濃度が経時的に改善される様子を示す図である。
【発明を実施するための形態】
【0024】
本発明の理解をより容易にするために、まず用語を定義する。
【0025】
本発明において、「癌の疑いがある対象(subject suspected of having cancer)」は、1種以上の癌の兆候(顕著なしこりや腫瘤等)を示す対象、又は癌の検査中(例えば定期検診中)の対象を表す。癌の疑いがある対象は1種以上の危険因子を有する場合がある。通常、癌の疑いがある対象は癌の検査を受けていない。しかしながら、「癌の疑いがある対象」は、予備的診断を受けて、例えばCTスキャンで腫瘤を示したが、確認検査(生検及び/又は組織検査等)を受けていない、或いは癌の病期が明らかでない個人を包含する。この語は、更にかつて癌を患った人(例えば寛解期の人)を包含する。「癌の疑いがある対象」は、時には癌と診断されることがあり、また癌ではないと判断される場合もある。
【0026】
本発明において、「癌と診断された対象(subject diagnosed with a cancer)」は、検査により癌性細胞を有すると判明した対象を表す。癌の診断にはいかなる適切な方法も用いてよく、その例としては生検、X線、血液検査、及び本発明の診断法が挙げられるが、これらに限定されない。「予備的診断」は、目視検査(例えば、CTスキャンやしこりの有無の確認)及び抗原検査の1つのみによるものである。
【0027】
本発明において、「対象(subject)」は免疫反応が誘発された生体を包含する。好ましい対象は哺乳動物である。対象の例としては、人間、猿、犬、猫、マウス、ラット、雌牛、馬、豚、山羊、及び羊が挙げられるが、これらに限定されない。
【0028】
本発明において、「親油性イノシトールグリカン」とは、式I:A−O1−B(I)で表される化合物、並びにその塩、溶媒和物、機能性類似体、及び生理的機能性誘導体を包含する。式I中、Aはグルコサミン及びガラクトサミンからなる群から選ばれるヘキソサミンであり;O1はアルファ1,6結合、アルファ1,3結合、又はアルファ1,2結合であり;Bはイノシトール、myo−イノシトール、chiro−イノシトール、scyllo−イノシトール、epi−イノシトール、cis−イノシトール、neo−イノシトール、muco−イノシトール、及びallo−イノシトールからなる群から選ばれる。B部分は互いに独立して任意にホスフェート、チオホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)で一置換又は二置換されていてよい。ある実施形態では、本発明の親油性イノシトールグリカン化合物は、1種以上の式IIで表される化合物、並びにその機能性類似体、塩、溶媒和物、及び生理的機能性誘導体を包含する。
【0029】
【化2】

式II中、O1はアルファ1,6結合及びアルファ1,3結合を表し;R1はホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)であり;R2はアルキル基(C1−22)又はアシル残基(O=C−C0−21)である。以下、本発明の親油性イノシトールグリカン化合物の典型例を表1に示す。
【0030】
【表1】

【0031】
本発明において、「アルキル」は脂肪族炭化水素基を表し、直鎖状であっても分岐鎖状であってもよい。鎖中に約1〜22個の炭素原子を含む。好ましいアルキル基は鎖中に1〜約14個の炭素原子を含む。「分岐鎖」は1つ以上の低級アルキル基(メチル、エチル、プロピル等)がアルキル直鎖に結合したものを意味する。「低級アルキル」は1〜約6個の炭素原子を含む直鎖又は分岐鎖を意味する。アルキルには1以上の「アルキル置換基」が置換していてよい。アルキル置換基は同じであっても異なっていてもよく、例としてはハロゲン、シクロアルキル、ヒドロキシ、アルコキシ、アミノ、カルバモイル、アシルアミノ、アロイルアミノ、カルボキシ、アルコキシカルボニル、アラルキルオキシカルボニル、又はヘテロアラルキルオキシカルボニル等が挙げられる。典型的なアルキル基としては、メチル、トリフルオロメチル、シクロプロピルメチル、シクロペンチルメチル、エチル、n−プロピル、イソプロピル、n−ブチル、1−ブチル、n−ペンチル、3−ペンチル、メトキシエチル、カルボキシメチル、メトキシカルボニルエチル、ベンジルオキシカルボニルメチル、及びピリジルメチルオキシカルボニルメチル等が挙げられる。
【0032】
本発明において、「アシル」はH−CO−基又はアルキル−CO−基を表す。好ましいアシル基としては、パルミトイル、低級アルキル、ホルミル、アセチル、プロパノイル、2−メチルプロパノイル、及びブタノイルが挙げられる。
【0033】
本発明において、「任意に(optionally)」とは、それに続けて述べる事象が生じてもよく、また生じる必要はないということを表し、その記載は当該事象が生じる場合及び生じない場合を共に包含する。
【0034】
本発明において、「生理的機能性誘導体」とは、本発明の化合物の薬学的に許容される誘導体を表し、例えば、哺乳動物に投与すると(直接的又は間接的に)本発明の化合物又はその活性代謝産物を供給できるエステル又はアミドが挙げられる。このような誘導体は、必要以上に実験を行わなくても、「Burger's Medicinal Chemistry and Drug Discovery」、第5版、第1巻「Principles and Practice」の教示を参照すれば当業者には明確である。該文献はこの参照により開示に含まれる。
【0035】
本発明において、「溶媒和物」は、様々な化学量論の溶媒と溶質(本発明では、式(I)又は式(II)の化合物、或いはその塩又は生理的機能性誘導体)の複合体を表す。本発明の目的に用いる溶媒は、溶質の生物学的活性を阻害しないと考えられる。適当な溶媒の例としては、水、メタノール、エタノール、及び酢酸が挙げられるが、これらに限定されない。好ましくは薬学的に許容される溶媒を用いる。適当な薬学的に許容される溶媒の例としては、水、エタノール、及び酢酸が挙げられる。最も好ましい溶媒は水である。
【0036】
式(I)又は式(II)の化合物は、複数の形態に結晶化できる性質を有してよい。このような性質は結晶多形と呼ばれ、全ての形態の結晶多形が式(I)、式(II)、式(III)、及び式(IV)の範囲に含まれる。通常、結晶多形は、温度、圧力、又はその両方の変化に応答して惹起され、また様々な結晶化プロセスの結果として生じることもある。結晶多形は当分野で知られる様々な物理的特性(X線回折像、溶解度、融点等)によって識別できる。
【0037】
本発明において、「置換(substituted)」は、単一又は複数の命名された置換基による置換を表し、特に明記しない限り多置換であってもよい。
【0038】
本発明において、「グルコース代謝障害」とは、グルコースの取り込み又は放出、更にはインスリンの発現、産生、分泌、又は使用に関連する疾患を表す。グルコース代謝障害は、肥満、糖尿病、メタボリック症候群、インスリン抵抗症、耐糖能障害、高インスリン血症、X症候群、高コレステロール血症、高リポタンパク血症、高トリグリセリド血症、粥状動脈硬化症、及び糖尿病性腎症からなる群から選択できるが、これらに限定されない。
【0039】
「類似体」とは、親化合物に似た構造を持ち、親化合物と同じ化学的性質又は薬理活性を有する化合物を表す。類似体としては、ホモログ(即ち、1個以上の炭素原子が親化合物と異なる類似体)、位置異性体、1個以上の原子を異なるものに変更した化合物(例えば、炭素原子を酸素原子、硫黄原子、又は窒素原子で置換したもの)、並びに1以上の官能基が異なる化合物(例えば、1以上の適当な置換基の有無が親化合物と異なる類似体)が挙げられるが、これらに限定されない。
【0040】
本発明において、「薬学的に許容される塩」は、標的対象(例えば、哺乳動物、及び/又は生体内若しくは生体外の細胞、組織、若しくは器官)において生理学的に許容される。本発明の化合物の塩(例えば酸又は塩基との反応で得られる)を表す。本発明の化合物の「塩」は、無機又は有機の酸や塩基から調製してよい。酸の例としては、塩酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、p−トルエンスルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、エタンスルホン酸、ギ酸、安息香酸、マロン酸、スルホン酸、2−ナフタレンスルホン酸、ベンゼンスルホン酸等が挙げられるが、これらに限定されない。本来それ自体は薬学的に許容されない他の酸(シュウ酸等)も、本発明の化合物又はその薬学的に許容される酸付加塩を得るための中間体として有用な塩の調製のために使用してよい。
【0041】
塩の例としては、酢酸塩、アジピン酸塩、アルギン酸塩、アスパラギン酸塩、安息香酸塩、ベンゼンスルホン酸塩、重硫酸塩、酪酸塩、クエン酸塩、樟脳酸塩、カンファースルホン酸塩、シクロペンタンプロピオン酸塩、二グルコン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、フマル酸塩、フルコヘプタン酸塩、グリセロリン酸塩、ヘミ硫酸塩、ヘプタン酸塩、ヘキサン酸塩、塩化物、臭化物、ヨウ化物、2−ヒドロキシエタンスルホン酸塩、乳酸塩、マレイン酸塩、メタンスルホン酸塩、2−ナフタレンスルホン酸塩、ニコチン酸塩、シュウ酸塩、パモ酸塩、ペクチン酸塩、過硫酸塩、フェニルプロピオン酸塩、ピクリン酸塩、ピバル酸塩、プロピオン酸塩、コハク酸塩、酒石酸塩、チオシアン酸塩、トシル酸塩、ウンデカン酸塩等が挙げられるが、これらに限定されない。本発明の化合物の塩を治療に用いる場合、薬学的に許容されるように設計する。しかしながら、薬学的に許容されない酸と塩基の塩を使用してもよく、例えば薬学的に許容される化合物の調製又は精製に用いてよい。
【0042】
本発明において、「有効量」は、例えば研究者又は臨床医が求める、組織、器官、動物、又は人間の生物学的又は医学的な反応を誘発するような、薬物又は薬剤の量を意味する。例えば、有益又は望ましい結果をもたらすに十分な量を表す。更に、「治療有効量」は、そのような量を投与していない対象と比較して、疾病、障害、又は副作用の治療、治癒、予防、又は改善が向上するような、或いは疾患又は障害の進行速度を低下させるような、量を意味する。また、この語は、正常な生理的機能を増強するのに有効な量も包含する。有効量を1回又は複数回投与することができる。
【0043】
本発明において、「予防的有効量」は、癌等の病気や疾患、或いは癌の再発や転移を予防するのに十分な、本発明の化合物又は他の活性成分の量を表す。予防的有効量は、初期疾患又は疾患の再発や拡大を予防するのに十分な量を表す場合もある。この語は、好ましくは、予防効果全体を改善するような、或いは他の予防薬や治療薬の予防効果又は相乗効果を強化するような、毒性を示さない量を包含する。
【0044】
本発明において、「投与」は、薬物、プロドラッグ、又は他の薬剤、或いは治療法(放射線療法等)を、生体内、試験管内、又は生体外で、生理的な系(対象、細胞、組織、器官等)に与える行為を表す。例えば人体に投与する場合は、目(眼内)、口(経口)、皮膚(経皮)、鼻(経鼻)、肺(吸入)、口腔粘膜(口腔内)、耳、注射(静脈内、皮下、腫瘍内、腹腔内等)等の経路から投与してよい。
【0045】
「併用」は、複数の化学物質又は治療法を、生体内、試験管内、又は生体外で、生理系(対象、細胞、組織、器官等)に投与することを表す。化学物質や治療法を「併用」する際には、各々を同時に投与してもよく、いかなる時間的順序や物理的組み合わせで投与してもよい。各々の効果が相加的又は相乗的に発揮されるように薬剤を選択して投与してよい。
【0046】
親油性イノシトールグリカンの合成
親油性IG類:脂肪酸でアシル化されたイノシトール残基を有するグリコシルホスファチジルイノシトール(GPI)アンカーが動物から発見されている。このアンカーは、イノシトールがアシル化された遊離GPIと同様に、アシル化IG類(ホスフェート残基を持たないイノシトールグリカン)の前駆体として利用できる。GPI−PLCはアシル化イノシトール環を有するGPI類を開裂できないが、GPI−PLDはそれができる。更に、グリコシルホスファチジルイノシトール特異的ホスホリパーゼD(GPI−PLD)は、遊離GPI類を、GPI−PLC(ホスホリパーゼC)によって生成するIPG類に類似の生物学的活性を有するIGへと変換できる。例えば、これらは試験管内でPKA(プロテインキナーゼA)を阻害できる。しかしながら、IG又はGPIの構造(例えばアシル化イノシトール環の有無等)は、本発明以前には知られていなかった。
【0047】
【化3】

【0048】
13のような典型的なアシル化IG化合物、及びアシル化IPG化合物14を合成し、図面及び実施例に示すような生物学的活性を評価した。
【0049】
標的化合物13及び14の逆合成解析
典型的IG化合物13及び14は、完全に保護された化合物63及び68から得られる。糖化学分野では、ベンジルエーテルをアルコールの保護基として用いる。アミンの保護基としてはアジドを用いる。リン酸エステル68は63から順次得られる。
【0050】
スキーム1.化合物13及び14の逆合成解析
【化4】

【0051】
パルミチン酸エステル63の合成については既に報告されているが、本発明は、パルミトイル基を導入するために保護基の操作を含む異なるアプローチを開示する。解析により、ジオール64のアキシャルヒドロキシ基の選択的パルミトイル化を計画した。ジオール64も公知の化合物である。化合物64は、フッ化グリコシル65bとイノシトール残基ドナーである環状炭酸エステル66から合成した(カップリング反応の収率40%、ジオール脱保護の収率87%)。この炭酸エステルは容易に入手できるD−キシロース69から11工程で調製するが、クロマトグラフ精製は4回で済み、全収率は16%で、全ての反応をグラム量までスケールアップできた。
【0052】
スキーム2.イノシトール残基ドナー66の合成
【化5】

【0053】
既に報告されている公知のジオール64の合成方法は、多くの欠点を有する。
【0054】
スキーム3.ジオール64の最短合成
【化6】

【0055】
例えば、マーティン・ロマス(Martin-Lomas)合成では、第1中間体であるイノシトールとL−カンファーの光学活性ケタール(スキームには図示せず)の精製に手間がかかる(ディートリッヒ(Dietrich, H.)、エスピノーサ(Espinosa, J. F.)、キアラ(Chiara, J. L.)、ヒメネス・バルベロ(Jimenez-Barbero, J.)、レオン(Leon, Y.)、バレラ・ニエト(Varela-Nieto, I.)、マト(Mato, J. M.)、カノ(Cano, F. H.)、フォーセス・フォーセス(Foces-Foces, C.)、マルティン・ロマス(Martin-Lomas, M.)、ケミストリー・ア・ヨーロピアン・ジャーナル(Chem. Eur. J.)、1999、320〜336)。報告された他の合成法は更に不利である。目的のイノシトールドナーはいくつかの保護基の操作を必要とする工程を経て調製されるものである(コタズ(Cottaz, S.)、ブリマコブ(Brimacombe, J. S.)、ファーガソン(Ferguson, M. A. J.)、カーボハイドレート・リサーチ(Carbohydr. Res.)、1995、271、85〜91)。
【0056】
環状炭酸エステル66及びトリクロロアセチルイミデート65aを用いることとした。イノシトールドナー66を数種のフッ化グリコシルとカップリングしたところ、カップリング生成物(α及びβアノマー)のみが総収率50〜60%で得られた。また、6−S−ベンジル−6−チオ−6−デオキシ置換基を有するトリクロロアセトイミデートドナー65cを蛍光性IPG類似体の合成に用いて、カップリング生成物を得た。即ち、我々はトリクロロアセトイミデートドナーと環状炭酸エステルアクセプターのカップリングを拡張し、ドナー65aの反応性を確認した。
【0057】
更に他の方法では、ジエン72から容易に得られるアクセプター67を、カップリングドナー65aと反応させてジオール64を調製する。カップリング生成物73の二重結合をジヒドロキシル化できた。cis−アルケンは不斉ジヒドロキシル化反応の基質として理想的ではないと考えられる。しかし、アルケンにキラル置換基が存在すると、ある程度のジアステレオ選択性が得られると考えた。この方法は反応工程が少ないという利点がある。
【0058】
スキーム4.ジオール64の代替調製法
【化7】

【0059】
このように計画したイノシトールグリカン13及び14の合成が成功するか否かは、ジオール64のアキシャルヒドロキシル基の選択的パルミトイル化次第である。
【0060】
隣接ジオールの選択的モノアシル化方法
モノ−O−アシル化ジオール74の調製方法をスキーム5に要約して示す。上記3つの方法とは異なり、非対称ジオールのアキシャルヒドロキシ基のエステル化に方法D及びEを用いた。実際に方法Dを用いて、パルミトイル化GPI−アンカーの合成に用いるアシル化イノシトール構成要素を調製した。この合成では、エカトリアルヒドロキシル基の保護(アルキル化、75に類似の中間体を生成)、残存アルコールのエステル化、並びに脱保護を行った。方法Eでは、アルキル化により75を調製せず、中間体O−スタンニレン76を直接アシル化する。しかしながら、アキシャルヒドロキシル基のエステル化は、少数の例でしか観測されず、イノシトールの場合は起こらなかった。
【0061】
スキーム5.隣接ジオールの選択的モノアシル化
【化8】

【0062】
方法Eは、6員環が縮合したオルトエステル(77等)の加水分解が高い位置選択性を示すという観測結果に基づくものである。更に、この方法は非環式ジオールの位置選択的モノアシル化に適用できると考えられる。従って、64のパルミトイル化には環状オルトエステル法を選択したが、当業者はモノ−O−アシル化ジオールの調製に他の方法を選ぶこともできる。
【0063】
イノシトールグリカン13及びイノシトールホスフェートグリカン14の合成
トリクロロアセトイミデートドナー65aと環状炭酸エステル66のカップリングを行った。カップリング反応でTMSOTfを用いてアクセプターをシリル化できることが知られているため、促進剤としてTfOHを選択した。また、TfOHをより弱いドナー(即ち、より電子吸引性が高い基を有するドナー)と共に用いると、カップリング反応で高いα選択性が得られるという前例があった。
【0064】
スキーム6.トリクロロアセトイミデートドナー65aとアクセプター66のカップリング
【化9】

【0065】
2:1の適度なα:βアノマー比の二糖78を計62%の収率で得た。65cを用いた場合と比べて収率は高かった。しかしながら、フッ化物65bに替えてトリクロロアセトイミデートを用いても、カップリング生成物の収率は向上しなかった。65cを用いた場合はおそらく硫黄原子が副反応を引き起こしたと判断した。興味深いことに、79のような構造と考えられる化合物が反応混合物から単離された。なお、二糖78の各アノマーの分離は非常に困難であることが分かった。しかしながら、環状炭酸エステルの加水分解(スキーム7)によって得られる、対応するジオール64α(以下、本明細書において64と表す)と64βは分離しやすい。加水分解はアノマーを分離しなくても行うことができる。貴重な64のエステル化を試す前に、モデル化合物17をトリメチルオルトパルミテート80と反応させた。ジオール17は、ほぼ定量的な収率で81と82の6:1混合物へと変換された(スキーム8の方法A)。環状オルトエステル中間体の加水分解における(+)−カンファースルホン酸単独での効果(MeCN−DCM混合物中)についても詳細に調べた(方法B)。
【0066】
スキーム7.環状炭酸エステル78α及び78βの加水分解
【化10】

【0067】
スキーム8.モデルジオール17のパルミトイル化
【化11】

【0068】
このような条件下で、パルミチン酸エステルの位置異性体を収率93%、異性体比は3.6:1で得た。また、副生成物(カンファースルホン酸メチルと判明)から主要な異性体(81)を分離する際に問題が生じることが分かった。他の触媒としてp−トルエンスルホン酸ピリジニウムを使用したところ(方法C)、81と82が計94%の収率で得られた。パルミチン酸エステルのアキシャル:エカトリアル比は、8.2:1と最も高かった。
【0069】
PPTS触媒によるジオール64のパルミトイル化を試したところ、出発物質の変換は非常に遅かった。(+)−CSAによって反応を加速させることができる。他の実験ではカンファースルホン酸のみを触媒として用いた。この反応では、63と83の混合物が92%の収率で得られた。生成物の比は3.6:1で得られた。上述のモデルジオール17を出発物質として用いた場合と同じ比が得られたことから、グルコサミン残基は位置選択性に影響しなかったと考えられる。様々なアゾール誘導体の酸性塩による加水分解を行って、位置選択性を調べることができる。これは、酸/アゾール複合体がホスホロアミダイトとアルコールの縮合の効率に及ぼす効果の研究に類似している。
【0070】
スキーム9.ジオール64のパルミトイル化
【化12】

【0071】
化合物81をモデル物質として用いて、ホスホロアミダイト法を用いたO,O−ジベンジル−N,N−ジイソプロピルアミノホスホロアミダイトによるホスホリル化反応(及びそれに続く亜リン酸エステルのリン酸エステルへの酸化)を行った。この反応の成否は反応溶媒に強く依存する。オリゴ糖の合成では、亜リン酸エステル形成を促進するために通常はテトラゾールのアセトニトリル溶液を用いる。しかしながら、市販又は自作のテトラゾールアセトニトリル溶液を用いて81のホスホリル化を行ったところ、アルコールはある程度しか亜リン酸エステルへ変換されなかった。反応混合物から完全にアセトニトリルを除去すると、完全に変換された。市販のテトラゾールMeCN溶液には水が残留している。本研究では、テトラゾール溶液調製用のアセトニトリルを活性化Al2O3カラムを通して乾燥した。
【0072】
スキーム10.モデル81のリン酸エステル化
【化13】

【0073】
アルコール63を同様の条件下で反応させた。予想外に、所望のリン酸エステル68の収率は良くなかった(65%)。形成されたリン酸エステルとアジドとの分子内環化が進行した可能性がある。亜リン酸エステル形成後にたまたま反応混合物を23℃で5時間放置したところ、実際に45%の収率で環化生成物(ジアステレオマーの1つ)が単離された(68の収率は24%)。これは環化速度が非常に遅いことを意味し、68の収率が低いことの説明となる。活性化された84がイノシトール環のOH基と反応するのとほぼ同じ速度で、63のアジド基がホスホロアミデート84と反応した可能性がある。
【0074】
スキーム11.63のリン酸エステル化の生成物
【化14】

【0075】
最終的に63のベンジル基を全体的に除去するのは困難であることが分かった。ベンゼン環の水素化が観測されたり、多量のN−メチル化生成物が検出されたりといった失敗(データは図示せず)を何度か繰り返した後、適当な条件を発見した。高い水素圧力(70バール)下、クロロホルムメタノール中で、Pd/C触媒下で化合物63を13へと完全に変換した。脱ベンジル化を十分に行うためには溶媒比及び溶媒/基質比と同様に非常に重要であることが分かった。幸運なことに、新たに発見した条件下で化合物68は完全に脱保護され、純粋な14を得た。
【0076】
スキーム12.イノシトールグリカン13及び14の合成の最終工程
【化15】

【0077】
63の合成:ジヒドロキシル化法
スキーム4に示す計画に従って、アリルアルコール67とトリクロロアセトイミデート65aのカップリングを検討した。トリクロロアセトイミデート法を用いたアノマー結合形成の選択性を制御する方法としては、(隣接基の関与の他に)少なくとも2つの方法が考えられる。
【0078】
スキーム13:67のグリコシル化
【化16】

【0079】
通常、Et2O溶媒中でTMSOTfを触媒として用いてカップリング反応を行うと、α−アノマーの選択的形成が観測される。実際にエントリー番号1の結果はこれに一致している。
【0080】
特にα−トリクロロアセトイミデートには他の立体制御法を用いる。アルコールとの反応は非極性溶媒中でBF3・Et2O触媒を用いて行い、この反応はSN2的経路で進行し、高いβ選択性を示す。本発明より前には、α−グリコシド結合を選択的に形成する目的でβ−トリクロロアセトイミデートを用いた例は無かった。このような変更を試みた結果をエントリー番号2に示す。この反応条件はβ異性体の形成に適していることが分かった。興味深いことに、生成した73βの量(モル)は、反応に用いたβ−イミデートの量(27.7モル%)よりも僅かに多い。α−イミデートの多くは73βに変換され、このイミデート異性体から過剰のβ生成物が得られたと考えられる。同時に、生成した73の量は、反応に用いたβ−イミデートの量よりもかなり少ない(17対72.3モル%)。更にかなりの量のフッ化物87が生成した。この反応のメカニズムについては殆ど解っていないが、フッ化物イオン源はBF3・Et2O中のHF不純物ではないと考えた。これら結果を総合すると、β−65aをBF3・Et2O触媒によるSN2型グリコシル化に用いるのは好ましくないことが分かる。
【0081】
TMSOTfに替えてTfOHを用いた場合の結果をエントリー番号3〜5に示す。この場合は僅かに収率が向上した。低温では73の収率が低下した(エントリー番号5)ことから、加熱により収率が向上する可能性がある。
【0082】
グリコシル化の収率を最適化した後、化合物73のジヒドロキシル化を試みた(スキーム14)。当初用いた触媒条件下ではジヒドロキシル化は進行しなかった(エントリー番号1〜3)。OsO4とアミンの複合体(アミン=ピリジン又は(DHQ)2PHAL)をアルケン73に添加すると反応が容易に進行することが分かった。しかしながら、形成されたオスミウム酸エステルの加水分解は、不斉ジヒドロキシル化に通常用いられる条件下(K2CO3、tBuOH/H2O)では非常に遅かった。出発物質のtBuOHへの溶解度が限られているため反応性が低くなったと考えられる。約30mgのスケールで反応を試みた際に(エントリー番号2)、このことが明らかとなった。他の実験では反応混合物に共溶媒としてTHFを加えた(エントリー番号3)。効果は同様であった。形成されたオスミウム酸エステルを加水分解する際の良好な条件を得るために、1当量のOsO4及び小過剰のアミン配位子を用いてジヒドロキシル化反応を化学量論的に検討した。NaHSO3/Py/H2O混合物は、親油性ジオールのオスミウム酸エステル(ピリジンと複合体を形成)の加水分解に有効である。実際は、(DHQ)2PHAL及びピリジンと複合体を形成したオスミウム酸エステルの加水分解には有効であったが、ジオールジアステレオマーの収率は変動が大きかった(エントリー番号4及び5)。アジドが部分的に還元されたと考えられる。亜硫酸水素ナトリウム自体は非常に有効であった(エントリー番号6)。より強い塩基性条件(LiOH/MeOH/THF、myo−イノシトールに添加)で加水分解を行うと、反応は非常に速かったものの、ジオールの収率はあまり良くなかった(エントリー番号7)。立体障害のあるアルケンの触媒的ジヒドロキシル化を加速する目的では、キヌクリジン((DHQ)2PHALの親化合物)よりもDABCOが好ましい場合がある。エントリー番号8は、塩基による加水分解においてDABCOを添加すると反応が加速したことを示す。
【0083】
スキーム14.アルケン73のジヒドロキシル化
【化17】

【0084】
細部をもう一点検討した。反応混合物のpH低下に比例してジヒドロキシル化が遅くなると予想されたため、実験番号3では過剰量のK2CO3を使用した。対して実験番号9ではK2CO3を3当量のみ使用した。この条件下でのジヒドロキシル化が最も有効であった。炭酸カリウムを3当量のみ添加した場合に反応結果が変化するか否かを確認するために、事例番号3に似た条件での対照実験を行った。約20時間後、約60%の変換が観測された。この時点で1当量のNaOHを加えた。TLCにより更なる反応の進行が観測されたが、アミン、四酸化オスミウム、及びNaOHを追加しても出発物質が完全に変換されることはなかった。従って、この触媒的ジヒドロキシル化には、適切な溶媒の組み合わせと反応溶媒のイオン強度が重要であると考えられる。
【0085】
生成したジオールを互いに分離するのは困難であった。従って、純粋な64のエステル化と同じ条件下で、64と88の混合物をパルミトイル化した。4種のパルミチン酸エステルの分離には非常に手間がかかることが分かった。ある程度純粋な63(カンファースルホン酸メチルエステルが混入している場合がある)と89を1本のフラッシュクロマトグラフィーカラムで分離することができたが、2種の少量異性体83及び90の分離には更なる精製が必要であった。63と83をそれぞれ別に合成したため、生成物中のこれら化合物は容易に同定できた。化合物89及び90は、1H−NMRスペクトル中の特徴的なイノシトール環水素原子の信号に基づいて互いに区別した。化合物89では、エカトリアル水素原子H−2(スキーム15に太字で示す)と同じ炭素に結合したヒドロキシル基がエステル化されている。その結果、H−2の信号は高磁場(δ=5.72)側にシフトする。対称的に、90ではH−2の信号は4.24ppmに見られる。
【0086】
スキーム15.単一化合物からの4−パルミトイル化IG前駆体の合成
【化18】

【0087】
スキーム16.イノシトールグリカン13の異性体の合成
【化19】

【0088】
全てのパルミチン酸エステルを分離したことで、73のジヒドロキシル化のジアステレオ選択性をはっきりと決定することが可能となった。89及び90に対する63及び83の比率は1に非常に近かった。73のキラル中心がジアステレオ選択性を誘導することはなかった。
【0089】
63と同じ条件下でパルミチン酸エステル83、89、及び90を脱ベンジル化することに成功し、化合物63の異性体を得た(スキーム16)。
【0090】
典型的親油性イノシトールグリカン化合物の合成を達成した。パルミチン酸エステル残基の存在によって、63及び68の脱ベンジル化には高圧や適当な溶媒及び基質濃度といった特別な条件が必要とされた。
【0091】
環状オルトエステル(スキーム5の77等)の位置選択的開裂にPPTSは用いなかった。17を出発物質として用いた場合にはPPTS触媒により最も高い選択性が得られたが、この触媒は二糖64の反応には効果的ではなかった。
【0092】
IG前駆体63を得るための新規経路を開発した。2つの重要工程であるグリコシル化及びジヒドロキシル化を最適化した。ここで、所望のジオール64を得るのに適したジヒドロキシル化は本質的にはジアステレオ選択的ではないが、共通前駆体72からの64の収率は上述した目的物質志向の合成と比較してやや高い(23%対17%)。とはいえジアステレオ選択性の改善の余地はある。例えば、他のキラルアミン(特にDHQ−IND又はDHQD−IND)を用いてジヒドロキシル化するのが望ましい。cis−アルケンにこのようなアミンを用いると、他の配位子と比較して最も高いeeが得られることが分かっている。DABCO自体は73のジヒドロキシル化に非常に有効であった。このアミンによりある程度のエナンチオ選択性が得られた(約25%)。
【0093】
スキーム17.ジオール64調製の代替法の開発
【化20】

【0094】
スキーム18.脱ヒドロキシル化用に選択したキラル配位子
【化21】

【0095】
chiro−イノシトールを含むイノシトールグリカンの前駆体として、アルケン73を使用できる。本発明で開示する化学技術は、単一又は複数のマンノースで置換されたグルコサミンを含むパルミトイル化オリゴ糖の合成に使用できる。例えば、開示の方法を用いてβ−(1→46結合)グリコシド結合構造を有するパルミトイル化二糖(即ち13のβ異性体等)を合成できる。
【0096】
医薬組成物
本発明の式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、実質的に如何なる方法でも投与でき、また同時又は連続的に投与できる。他の実施形態では、親油性イノシトールグリカン化合物を、経皮貼布剤を用いて経皮投与できる。
【0097】
式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、癌に関連する細胞増殖を治療又は予防する、或いはその進行を遅くする目的で、治療的に投与できる。また、癌に関連する細胞増殖から保護する、或いは他の疾患に関連する細胞増殖の発現を避ける又は未然に防ぐ目的で、予防的に投与できる。例えば、癌と診断された患者又は癌発症の危険性がある患者における癌の進行を抑制又は停止するために、親油性イノシトールグリカン組成物を予防的に投与することができる。
【0098】
式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、様々な経路又は方法により対象に投与できる。適当な投与方法としては、経口吸入投与、経鼻吸入投与、経皮投与、経口投与、直腸投与、経粘膜投与、腸内投与、並びに非経口投与(筋内注射、皮下注射、静脈内注射等)が挙げられるが、これらに限定されない。式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、同じ又は異なる方法で投与できる。例えば、親油性イノシトールグリカン化合物と薬学的に許容される塩又は水和物を経口投与することができる。また、経皮貼布やエアロゾル製剤を用いて経鼻吸入によって投与することができ、ナノカプセル又はマイクロカプセル製剤として投与することもできる。親油性イノシトールグリカン化合物をクモ膜下投与又は脳室内投与することもできる。
【0099】
式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を様々に組み合わせて投与できる。例えば、IG1とその類似体の組み合わせ、IG2とその類似体の組み合わせ、IG1とIG2の組み合わせ、それらの様々な類似体の組み合わせを投与してよい。加えて、この化合物を他の治療薬と組み合わせて投与することもできる。勿論、本発明の組成物と併用可能な治療薬は、治療する症状に応じて選択される。例えば、本発明の化合物を、癌や関連する他の症状や副作用に用いられる他の薬剤との混合物の形態で投与することができる。
【0100】
式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、各化合物単独で製剤することができ、同種の化合物(例えば2種の異なる類似体又は異性体)の混合物として製剤することもできる。また、異なる親油性イノシトールグリカン化合物(例えばIG1、IG2、IG13、IG14、及びIG15のうち1種以上)の混合物として製剤することもできる。通常、このような組成物は、薬学的に許容される塩又は水和物として調製した親油性イノシトールグリカン化合物を含有する。
【0101】
本発明で用いる医薬組成物は、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)の効果を更に促進する生理学的に許容される担体、添加剤、希釈剤、又は賦形剤のうち1以上を用いて、従来法により調製できる。製剤の形態は投与経路に応じて選択する。
【0102】
このような製剤は、埋め込み(implantation)又は皮膚下送達(皮下、筋内等)、筋内注射、又は経皮投与できる。例えば、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、適当なポリマー材料又は疎水性材料(使用可能な油中の乳剤等)或いはイオン交換樹脂と共に製剤化してよい。
【0103】
化合物の経皮投与に適した製剤については、米国特許第5,725,876号、同第5,716,635号、同第5,633,008号、同第5,603,947号、同第5,411,739号、同第5,364,630号、同第5,230,896号、同第5,004,610号、同第4,943,435号、同第4,908,213号、及び同第4,839,174号に記載されており、これら特許はこの参照により開示に含まれる。薬学的に許容される塩又は水和物は、親油性イノシトールグリカン化合物として容易に吸収され、細胞膜及び血液脳関門を通過する。このような製剤はいずれも通常の方法により経皮投与に適した形態とすることができる。
【0104】
注射する場合は、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、生理学的に適切な水溶液の形態(ハンクス液、リンゲル液、又は生理食塩水緩衝液等)で用いてよい。経粘膜投与する場合は、透過すべき障壁に適した浸透剤を製剤に用いる。このような浸透剤は当該分野で広く公知である。
【0105】
経口投与する場合は、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、当該分野で広く知られている薬学的に許容される担体と組み合わせて製剤してよい。このような担体を用いることで、本発明の化合物を患者の経口摂取に適した錠剤、丸薬、ガム、糖衣錠、カプセル、液体、ゲル、シロップ、スラリー、懸濁液等の製剤に使用できる。或いは、化合物をキャンディー、クッキー、又は他の食品の形態に製剤化することもできる。経口用薬剤は、本発明の化合物を固体賦形剤と混合し、得られた混合物を任意にすり潰し、必要に応じて他の適当な助剤を加え、粒状混合物を錠剤や糖衣錠核部に加工して調製できる。適当な賦形剤としては、増量剤(乳糖、スクロース、マンニトール、ソルビトールのような糖類等)、セルロース類(トウモロコシデンプン、小麦デンプン、米デンプン、ジャガイモデンプン、ゼラチン、トラガカントゴム、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム等)、及びポリビニルピロリドン(PVP)が挙げられるが、これらに限定されない。必要に応じて、架橋ポリビニルピロリドン、寒天、アルギン酸、これらの塩(アルギン酸ナトリウム等)のような崩壊剤を加えてもよい。
【0106】
濃縮糖溶液を使用してよく、該溶液は任意にアラビアゴム、タルク、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、又は二酸化チタン、ラッカー溶液、及び適当な有機溶媒又は混合溶媒を含有してよい。活性化合物を識別するため、又は異なる組み合わせの活性化合物服用物を特徴付けるために、錠剤や被覆物に染料又は顔料を加えてもよい。
【0107】
経口使用可能な医薬組成物として、ゼラチンからなる押し込み型カプセルや、ゼラチン及び可塑剤(グリセロール、ソルビトール等)からなるソフト封入カプセルが挙げられる。押し込み型カプセルは本発明の化合物を含む混合物を含有してよく、更に充てん剤(乳糖等)、結合剤(デンプン等)、滑沢剤(タルク、ステアリン酸マグネシウム等)、又は安定化剤を含有してよい。ソフトカプセル内では、本発明の化合物が適当な液体(脂肪油、液体パラフィン、液体ポリエチレングリコール類等)中に溶解又は懸濁していてよい。ソフトカプセル製剤には安定化剤を加えてもよい。経口投与用製剤はいずれも投与に適した用量で製剤するべきである。
【0108】
口腔投与する場合は、公知の方法で調製した経口スプレー、錠剤、ガム、又はトローチ剤の形態の組成物を使用できる。治療用化合物(或いは薬学的に許容される塩又は水和物)の経口投与又は口腔投与に適したキャンディー型の製剤については米国特許第6,083,962号に記載されており、該文献はこの参照により開示に含まれる。治療用化合物の経口投与又は口腔投与に適した他の製剤については、米国特許第5,939,100号、同第5,799,633号、同第5,662,920号、同第5,603,947号、同第5,549,906号、同第D358,683号、同第5,326,563号、同第5,293,883号、同第5,147,654号、同第5,035,252号、同第4,967,773号、同第4,907,606号、同第4,848,376号、及び同第4,776,353号に記載されており、これらはこの参照により開示に含まれる。これら製剤はいずれも通常の方法により親油性イノシトールグリカン化合物(或いは薬学的に許容される塩又は水和物)の投与に適した形態とすることができる。
【0109】
吸入又は注入(inhalation又はinsufflation)用の組成物としては、薬学的に許容される水性溶媒、有機溶媒、又はそれらの混合物を用いた溶液及び懸濁液、並びに粉末が挙げられる。組成物を呼吸器経路(経口又は経鼻)で投与し、局所的又は全身的に作用させるのが好ましい。吸入により経口又は経鼻投与する場合は、本発明の化合物をエアロゾルスプレーの形態で簡便に送達する。エアロゾルスプレーは、加圧パック又は噴霧器を用いて適当な噴射剤(二酸化炭素や他のガス等)と共に使用してよい。加圧エアロゾルの場合、一回服用量測定バルブを用いて用量単位を制御できる。本発明の化合物と適当な粉末基材(乳糖、デンプン等)の混合粉末を含有する、ゼラチン等からなるカプセルやカートリッジを調製し、吸入器(inhaler又はinsufflator)に用いてもよい。経鼻吸入に適した製剤は当該分野で広く知られている。例えば、式(I)又は式(II)の親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)、水溶性希釈剤(有機酸等)、及び増粘剤(天然ポリマー、合成ポリマー、乳剤の油相を有する油状物質等)を含有する経鼻エアロゾルスプレーを使用してよい。気化器を用いて、本発明の式(I)又は式(II)の親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を大量に含む蒸気を送達して投与してもよい。この気化器は電池で駆動でき、細胞(肺細胞等)の増殖を抑制する効果を示す親油性イノシトールグリカン化合物を一定量だけ送達できるように設計できる。薬学的に許容される無菌溶媒中の本発明の化合物を、不活性ガスを用いて噴霧してもよい。霧状になった溶液を噴霧器から直接吸ってよく、また噴霧器をフェイスマスク、テント、又は間欠的陽圧呼吸器に取り付けてもよい。
【0110】
注射により投与する場合は、本発明の化合物を界面活性剤(又は湿潤剤若しくは界面活性剤)と共に製剤化してよく、或いは乳剤(油中水型乳剤又は水中油型乳剤)の形態で使用してもよい。適当な界面活性剤としては、ポリオキシエチレンソルビタン類(Tween(商標)20、40、60、80、85等)や他のソルビタン類(Span20、40、60、80、85等)のような非イオン性界面活性剤が挙げられるが、これらに限定されない。界面活性剤を用いた組成物は、0.05〜5%、好ましくは0.1〜2.5%の界面活性剤を含有してよい。勿論、必要に応じてマンニトールや他の薬学的に許容される賦形剤といった他の成分を添加してもよい。
【0111】
市販の脂肪乳剤を用いて適切な乳剤を調製することができる。市販の脂肪乳剤としては、イントラリピド(Intralipid)、リポシン(Liposyn)、インフォニュトロール(Infonutrol)、リポファンジン(Lipofundin)、リピフィサン(Lipiphysan)等がある。活性成分を予混合乳剤組成物に溶解してよく、油(大豆油、紅花油、綿実油、胡麻油、トウモロコシ油、扁桃油等)に溶解してもよく、或いは水及びリン脂質(卵リン脂質、大豆リン脂質、大豆レシチン等)を混合して調製した乳剤に溶解してもよい。勿論、乳剤の粘張力を調整するために、グリセロールやグルコース等の他の成分を添加してもよい。通常、適当な乳剤は20%以下、例えば5〜20%の油を含む。脂肪乳剤は0.1〜1.0μm(特に0.1〜0.5μm)の脂肪滴を含有するのが好ましく、5.5〜8.0のpHを有するのが好ましい。
【0112】
式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、大量投与注射、持続注入等の非経口注射投与用の製剤に用いてもよい。注射用の製剤は、例えばアンプルや複数回投与用容器中に単位用量に分け、任意に保存料を加えたものであってよい。このような組成物は油性又は水性の賦形剤を用いた懸濁液、溶液、又は乳剤であってよく、また懸濁剤、安定化剤、分散剤等の製剤材料を含有してよい。
【0113】
非経口投与用の医薬組成物においては、本発明の化合物を水溶性の形態で使用し、これを水溶液に用いてよい。また、本発明の化合物の油性注射懸濁液を調製してもよい。適当な親油性の溶媒又は賦形剤としては、脂肪油(胡麻油等)、合成脂肪酸エステル(オレイン酸エチル、トリグリセリド類等)、リポソーム等が挙げられる。水性注射懸濁液は、カルボキシメチルセルロースナトリウム、ソルビトール、デキストランといった、懸濁液の粘度を増加させる物質を含有してよい。また、懸濁液は適当な安定化剤又は本発明の化合物の溶解性を増加させ高濃度溶液の調製を可能とする薬剤を任意に含有してよい。
【0114】
必要に応じて、経口投与用の用量単位製剤をマイクロカプセル化してよい。例えば粒子材料をポリマーやワックス等で被覆又は包埋することによって、放出を延長又は持続する製剤を調製することができる。
【0115】
或いは、使用前の式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を粉末の状態とし、適当な賦形剤(発熱物質を含まない滅菌水等)と共に製剤化してもよい。
【0116】
式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、坐剤や停留かん腸剤等の直腸投与用組成物として製剤してもよい。このような組成物は、例えばココアバター、他のグリセリド類等の従来の坐剤基材を含有する。
【0117】
医薬組成物は適当な固体相又はゲル相の担体又は賦形剤を含有してもよい。このような担体又は賦形剤の例としては、炭酸カルシウム、リン酸カルシウム、種々の糖類、デンプン類、セルロース誘導体、ゼラチン、ポリマー(ポリエチレングリコール等)等が挙げられるが、これらに限定されない。
【0118】
有効用量
本発明で好適に用いられる医薬組成物は、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、有効量、即ち目的(例えば細胞増殖又は癌の治療、予防、又は抑制)を達成するに十分な量だけ含有する。本発明の化合物の治療有効量は多くの要因に依存すると考えられ、このような要因としては、動物の年齢及び体重、治療を要する正確な症状及び重篤性、製剤の特性、投与経路等が挙げられる。最終的には治療有効量は担当の医師又は獣医が判断すると考えられる。当業者は有効量を決定できる。式(I)で表される化合物の腫瘍成長(結腸癌、乳癌等)治療用の1日有効量は、対象(哺乳動物)の体重1kgあたり通常は0.1〜100mgであり、より一般的には1〜10mgであると考えられる。即ち、対象が70kgの成体哺乳動物の場合、実際の1日用量は通常70〜700mgであると考えられる。1日総投与量を1回で投与してよいが、より一般的には同じ量を複数回(2回、3回、4回、5回、又は6回)に分けて投与してもよい。塩、溶媒和物、又は生理的機能性誘導体の有効量は、式(I)の化合物自体の有効量との割合で決定できる。上述した他の症状を治療する場合も、適切な用量は類似していると予想される。
【0119】
本発明の化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、それぞれ単独で使用してもよく、或いは上記症状用の他の治療薬と組み合わせて使用してもよい。特に抗癌治療では、外科的治療や放射線治療のほか、化学療法、ホルモン剤、抗体等との併用が考えられる。即ち、本発明による併用療法は、少なくとも1種の式(I)で表される化合物(或いはその薬学的に許容される塩、溶媒和物、生理的機能性誘導体)の投与と、少なくとも1種の他の癌治療法の使用を含む。好ましくは、本発明の併用療法では、少なくとも1種の式(I)で表される化合物(或いはその薬学的に許容される塩、溶媒和物、生理的機能性誘導体)と、少なくとも1種の薬学的に活性な薬剤(好ましくは抗腫瘍薬)とを投与する。1種以上の式(I)の化合物と1種以上の他の薬学的に活性な薬剤とを、一緒に又は別々に投与してよい。別々に投与する場合は、同時に投与してよく、またいかなる順序で連続的に投与してもよい。式(I)の化合物と他の薬学的に活性な薬剤の量、及びその投与時期は、所望の併用治療効果が得られるように選択すればよい。
【0120】
ある実施形態では、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、1種以上の式(III)で表されるアルキル−アシル−ホスファチジン酸(AAPA)化合物と併用することができる。アルキル−アシル−ホスファチジン酸(AAPA)化合物の例としては、AAPA1(1−O−アルキル(18:0)−2−O−アシル−(18:0)−sn−グリセロール−ホスフェート)、AAPA2(1−O−アルキル(18:0)−2−O−アシル−(20:4)−sn−グリセロール−ホスフェート)、及びAAPA3(1−O−アルキル(18:0)−2−O−アシル−(22:4)−sn−グリセロール−ホスフェート)が挙げられるが、これらに限定されない。好ましい実施形態では、この併用によって相乗効果が得られる。本発明は、1種以上の親油性イノシトールグリカン化合物及び/又は1種以上のアルキル−アシル−ホスファチジン酸(AAPA)化合物からなる組成物の患者への投与を包含する。
【0121】
式(I)及び/又は(II)で表される化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、少なくとも1種の更なる癌治療法と組み合わせて、付随的に又は連続的に使用してもよい。治療上適当であれば、いかなる抗癌治療との組み合わせも利用できる。ある実施形態では、式(I)の化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、少なくとも1種のAAPA化合物及び少なくとも1種の付加的癌治療法の両方と併用することができる。ある実施形態では、この他の抗癌治療が、少なくとも1種の抗腫瘍薬を投与する少なくとも1種の付加的化学療法を含む。式(I)の化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)と他の抗腫瘍薬を併用する場合、(1)両方の化合物を含有する単一の医薬組成物、又は(2)それぞれ一方の化合物を含有する分離した医薬組成物の形態で、付随的に投与してよい。また、まず一方の抗腫瘍薬を投与し続いて他方を投与するという手法、又はその逆の手法で、この組み合わせを別々に連続して投与してもよい。このような連続的投与の時間的間隔は長くても短くてもよい。
【0122】
抗腫瘍薬は細胞周期特異的に抗腫瘍作用をもたらす場合がある。即ち、ある抗腫瘍薬は周期特異的であり細胞周期における特別な周期に作用する。或いは、抗腫瘍薬はDNAに結合して非細胞周期特異的に作用する場合がある。即ち、ある抗腫瘍薬は非細胞周期特異的であり、他のメカニズムで作用する。
【0123】
式Iの化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)との併用に適した抗腫瘍薬として以下のものが挙げられるが、それらに限定されない。
【0124】
(1)細胞周期特異的抗腫瘍薬
パクリタキセル、その類似体ドセタキセル等のジテルペノイド類;ビンブラスチン、ビンクリスチン、ビンデシン、ビノレルビン等のビンカアルカロイド類;エトポシド、テニポシド等のエピポドフィロトキシン類;5−フルオロウラシル、フルオロデオキシウリジン等のフルオロピリミジン類;アロプリノール、フルダラビン、メトトレキサート、クラドラビン、シタラビン、メルカプトプリン、チオグアニン等の代謝拮抗物質;及び9−アミノカンプトセシン、イリノテカン、CPT−11、7−(4−メチルピペラジノメチレン)−10,11−エチレンジオキシ−20−カンプトセシンの種々の光学形態等のカンプトセシン類が挙げられるが、これらに限定されない。
【0125】
(2)細胞毒性化学療法剤
メルファラン、クロラムブシル、シクロホスファミド、メクロレタミン、ヘキサメチルメラミン、ブスルファン、カルムスチン、ロムスチン、ダカルバジン等のアルキル化剤;ドキソルビシン、ダウノマイシン、エピルビシン、イダルビシン、マイトマイシン−C、ダクチノマイシン、ミトラマイシン等の抗腫瘍抗生物質;及びシスプラチン、カルボプラチン、オキサリプラチン等の白金配位錯体が挙げられるが、これらに限定されない。
【0126】
(3)他の化学療法剤
タモキシフェン、トレミフェン、ラロキシフェン、ドロロキシフェン、ヨードキシフェン等の抗エストロゲン剤;酢酸メゲストロール等のプロゲストロゲン剤;アナストロゾール、レトラゾール、ボラゾール、エキセメスタン等のアロマターゼ阻害剤;フルタミド、ニルタミド、ビカルタミド、酢酸シプロテロン等の抗アンドロゲン剤;酢酸ゴセレリン、ロイプロリド等のLHRH作動剤及び拮抗剤;フィナステライド等のテストステロン−5−アルファ−ジヒドロリダクターゼ阻害剤;マリマスタット等のメタロプロテイナーゼ阻害剤;抗プロゲストゲン剤;ウロキナーゼプラスミノーゲン活性化因子受容体機能阻害剤;セレコキシブ等の2型シクロオキシゲナーゼ(COX−2)阻害剤;本明細書に記載のもの以外のVEGFR阻害剤、TIE−2阻害剤等の他の血管形成阻害剤;肝細胞成長因子機能阻害剤等の成長因子機能阻害剤;erb−B2、erb−B4、上皮細胞成長因子受容体(EGFr)、血小板由来成長因子受容体(PDGFr)、本発明に記載のもの以外の血管内皮成長因子受容体(VEGFR)、TIE−2;及びサイクリン依存性阻害剤(CDK2阻害剤、CDK4阻害剤等)等の他のチロシンキナーゼ阻害剤が挙げられるが、これらに限定されない。
【0127】
本発明の化合物は、特にある種の癌治療にも利用できる。更に、本発明の化合物を用いることで、現在の癌の化学療法や放射線療法と付加的又は相乗的な効果を得ることができ、且つ/或いは化学療法や放射線療法の効果を回復させることができる。
【0128】
式(I)及び/又は式(II)で表される親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、要求される治療的又は予防的効果が得られる限りいかなる方法で投与してもよい。本発明の化合物の治療的又は予防的に効果のある1回用量は、類似の薬理活性を示すと知られている類似化合物に関する動物又は人間のデータを用いて決定できる。投与した化合物の生体利用効率、効能、及び生体内半減期を他の薬剤の場合と比較して、その結果に基づいて1回用量を調整してよい。
【0129】
当業者であれば、上述した方法や他の公知の方法によって1回用量を調整し、人間に使用した際に最大の効果を得ることが可能である。
【0130】
本発明の化合物は、細胞増殖を特徴とする1以上の哺乳動物の疾患の治療にも有用である。このような疾患としては、血管増殖性疾患(関節炎、再狭窄等)、線維症(肝硬変、粥状動脈硬化症等)、メサンギウム細胞増殖性疾患(糸球体腎炎、糖尿病性腎症、悪性腎硬化症、血栓性微小血管症、増殖性網膜症、移植臓器拒絶、糸球体症等)、代謝異常、グルコース代謝障害、乾癬、真性糖尿病、慢性創傷治癒、炎症、神経変性疾患等が挙げられる。
【0131】
上述した実施形態に基づき、当業者は本発明の更なる特性及び利点を理解するであろう。即ち、本発明は既に詳細に示した記載及び以下に述べる例によって限定されるものではない。例えば特許文献(発行特許、登録特許、均等物等)、特許出願公報、非特許文献、他の原資料など、本出願に記載の出版物及び参考文献は全て、少なくとも部分的には本出願の開示に矛盾していない限りは、参照することにより個別に本出願に組み込まれるかのように全体が開示に含まれる。例えば、部分的に矛盾している文献は、その矛盾している部分を除いて、参照により開示に組み込まれる。
【0132】
本出願において置換基群を開示する際には、当然ながら、当該群及びその下位群の個々の置換基、それらの異性体及びエナンチオマー、並びにその置換基を用いて形成できる化合物群がそれぞれ開示されることになる。本出願でマーカッシュ群又は他の群を用いる場合、当該群の個々の要素、並びにその群で可能な組合せ及び下位の組合せは全て開示に含まれるよう意図している。本出願で化合物を記載する際に、その化合物の特定の異性体又はエナンチオマーが(例えば化学式又は化学名で)明確に指定されていない場合、該化合物の異性体、エナンチオマー、及びその組み合わせは、それぞれ当該記載に含まれる。本出願で原子を(例えば組成中に)記載する場合、該原子の同位体はいずれも当該記載に含まれる。当業者が同じ化合物を異なる名称で呼ぶことがあることが知られており、従って本出願で特定の化合物名を記載する場合はその名称は例示にすぎない。特に明記しない限り、本出願で記載又は例示した成分の処方又は組み合わせは全て本発明を実施するために使用できる。本明細書において範囲(温度範囲、時間範囲、組成範囲等)を記載する場合、その中間の範囲及び部分的範囲、並びにその範囲に含まれる全ての個々の値は、常に本開示に含まれる。
【0133】
本発明において、「含有する」や「含む」といった語(comprise、comprises、comprised、又はcomprising)は、記載した特性、整数値、工程、又は要素の存在を明記していると解釈するべきだが、他の特性、整数値、工程、要素、又はその群の存在又は追加を排除するものではない。
【0134】
本発明を多くの具体的/好適な実施形態及び技術により説明したが、当然ながら、本発明の趣旨及び範囲から逸脱しない限り多くの変更又は修正を加えてよい。本明細書では過度の実験を行うことなく広く開示したが、具体的に記載していない方法、装置、装置要素、物質、手順、及び技術も本発明を実施するために利用できることは当業者には明らかであると考えられる。本明細書に記載した方法、装置、装置要素、物質、手順、及び技術の機能的均等物は全て本発明に含まれる。範囲を開示した場合、その部分範囲及び個々の値は全て本発明に含まれる。開示した実施形態(図面に示した実施形態及び明細書で例示した実施形態を含む)は単なる例示にすぎず、限定的なものではない。即ち、本発明はこれら実施形態によって限定されるものではない。
【実施例】
【0135】
実施例に示すとおり、本発明は、親油性イノシトールグリカン化合物の新規合成法、並びに該化合物を癌及びグルコース代謝障害(糖尿病、肥満、及びメタボリック症候群が挙げられるが、これらに限定されない)の治療に用いる方法を提供する。
【0136】
I.典型的な親油性イノシトールグリカン化合物の合成:
文献に記載されているとおりグルコサミンドナー65aを調製した(ディートリッヒ(Dietrich, H.)、エスピノーサ(Espinosa, J. F.)、キアラ(Chiara, J. L.)、ヒメネス・バルベロ(Jimenez-Barbero, J.)、レオン(Leon, Y.)、バレラ・ニエト(Varela-Nieto, I.)、マト(Mato, J. M.)、カノ(Cano, F. H.)、フォーセス・フォーセス(Foces-Foces, C.)、マルティン・ロマス(Martin-Lomas, M.)、ケミストリー・ア・ヨーロピアン・ジャーナル(Chem. Eur. J.)、1999、320〜336;キンジー(Kinzy, W.)、シュミット(Schmidt, R. R.)、リービッヒ・アナーレン・デル・ケミー(Liebigs Ann. Chem.)、1985、1537〜1545)。CCl3CN(neat)を用いるとアノマー比は1:1であった。CH2Cl2中で5〜10当量のCCl3CNを用いると、約1:3のα/β比が得られた。文献記載の手順に従ってパルミトニトリルからトリメチルオルトパルミテート80を調製した(プレソヴァ(Pressova, M.)、スマルト(Smrt, J.)、コレクション・オブ・チェコスロバキア・ケミカル・コミュニケーションズ(Collect. Czech. Chem. Commun.)、1989、54、487〜497)。パルミトニトリルは市販の塩化パルミトイルから合成した(ペーン(Pern, R. B.)、グリブル(Gribble, G.)、オーガニック・プレパレーションズ・アンド・プロシージャーズ・インターナショナル(Org. Prep. Proced. Int.)、1983、15、297〜302)。文献に記載のとおりp−トルエンスルホン酸ピリジニウムを調製した(ミヤシタ(Miyashita, M.)、ヨシコシ(Yoshikoshi, A.)、グリエコ(Grieco, P. A.)、ジャーナル・オブ・オーガニック・ケミストリー(J. Org. Chem.)、1977、42、3772〜3774)。三塩化リン、ベンジルアルコール、及びジイソプロピルアミンから2工程でO,O−ジベンジル−N,N−ジイソプロピルアミノホスホロアミダイトを調製した(タナカ(Tanaka, T.)、タマツクリ(Tamatsukuri, S.)、イケハラ(Ikehara, M.)、テトラヘドロン・レターズ(Tetrahedron Lett.)、1986、27、199〜202;ウールマン(Uhlmann, E.)、エンゲルス(Engels, J.)、テトラヘドロン・レターズ(Tetrahedron Lett.)、1986、27、1023〜1026)。以下の例外を除き、市販の試薬は更なる精製を行うことなく使用した。THF、トルエン、及び塩化メチレンは、アルミナ精製系を用いて精製した(パングボーン(Pangborn, A. B.)、ジャデーロ(Giardello, M. A.)、グラブス(Grubbs, R. H.)、ローゼン(Rosen, R. K.)、ティマース(Timmers, F. J.)、オルガノメタリックス(Organometallics)、1996、15、1518〜1520)。ベンジルアルコール及びジイソプロピルアミンをCaH2から蒸留した。三塩化リンを2時間還流し、再蒸留した。BF3・Et2Oは、文献に記載のとおり水素化カルシウムから真空蒸留して精製した(ヅヴァイフェル(Zweifel, G.)、ブラウン(Brown, H. C.)、「Hydration of Olefins, Dienes, and Acetylenes via Hydroboration」、オーガニック・リアクションズ(Organic Reactions)、コープ(Cope, A. C.)編、ジョン・ワイリー・アンド・サンズ(John Wiley & Sons)、ニューヨーク、1963、第13号、142〜144頁)。HPLC等級のクロロホルムを濃H2SO4(3回)と振り、水で洗浄し、CaCl2で乾燥し、P2O5で蒸留した。出発物質を乾燥し、トルエンと共に蒸発させた。2〜10Torr、23℃で回転蒸発を行った。ベーカーガラス背面を有するシリカゲル板TLCを用いて、254nm蛍光指示薬、又は2.5%p−アニスアルデヒド、3.5%H2SO4、及び1%AcOHを含むエタノール溶液での染色によって、反応を観察した。NMRについては、1Hは300MHz、13Cは75MHz、19Fは283MHz、31Pは121MHzでデータを得、DISNMR又はXWinNMRソフトウェア環境で処理した。CDCl3溶液の内部標準としてTMS(0.03%)を用いた。d4−MeOH又はd3−MeCNに溶解した化合物の化学シフトについては、対応する残留溶媒のピークを基準とした。LR−MSは、ESIインレットを用いてサーモ・フィニガン(Thermo Finnigan)LTQ装置に記録した。陽イオン化方式では1%の酢酸を含む50%メタノール水溶液を使用し、陰イオン化方式では0.2%のトリエチルアミンを含む50%メタノール水溶液を使用した。
【0137】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−D−myo−イノシトール−1,2−環状カーボネート(78α/β)及び
N−(2−アジド−3,4,6−トリ−O−ベンジル−1,2−ジデオキシ−α−D−グルコピラノシル)トリクロロアセトアミド(79)
【化22】

【0138】
Ar雰囲気下、ドナー65a(34.5mg、55.8μmol)、アクセプター66(25mg、5.25μmol)、及び粉砕した活性モレキュラーシーブ(55mg)の混合物に、無水エーテル(2mL)を加えた。この反応混合物を−20℃に冷却し、TfOH(0.0704MのEt2O溶液を75μL、0.1当量)を滴下し、−20℃で1時間攪拌した後、20℃まで昇温した。固体のNaHCO3(100mg)を加え、反応混合物を15分間攪拌し、ろ過した。ろ液を冷却した5%Na2CO3水溶液(3×0.5mL)、水(2×0.5mL)、及び食塩水(2×0.5mL)で順次洗浄し、Na2SO4で乾燥し、蒸発させた。未精製の反応混合物をフラッシュクロマトグラフィー(EtOAc/ヘキサン体積比1:9→1:6→1:4.5→1:4)で分離して、79(6.5mg、20%)、78β(11mg、22.4%)、及び78α(20.5mg、42%)を得た。
79:Rf=0.65(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ3.57−3.73(m,3H,H−3,H−5,H−6)、3.78−3.96(m,3H,H−6’,H−4,H−2)、4.49(d,J=11.94,1H,PhCH2O)、4.58(d,J=10.63,1H,PhCH2O)、4.65(d,J=11.95,1H,PhCH2O)、4.77(d,J=10.62,1H,PhCH2O)、4.85(d,J=10.66,1H,PhCH2O)、4.92(d,J=10.67,1H,PhCH2O)、5.66(dd,J=6.55,5.37Hz,1H,H−1)、7.00(d,J=6.48,1H,NH)、7.1−7.2(m,2H,PhCH2O)、7.2−7.4(m,15H,PhCH2O(13H)+CHCl3)。
アノマー78のNMRデータは簡潔に示す(ジャオレック(Jaworek, C. H.)、「Synthesis of Inositol phosphate Glycans」、タフツ大学博士論文、マサチューセッツ州メドフォード、2000年5月)。
78β:Rf=0.36(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ3.38−3.53(m,3H)、3.65−3.78(m,3H)、3.83(ψt,J=3.57Hz,1H,Ino−H)、3.9−3.95(m,1H)、4.35(d,J=11.68Hz,1H,PhCH2O)、4.4(d,J=11.64Hz,1H,PhCH2O)、4.55−4.74(m,8H,PhCH2O(6H),GluN−H−1,Ino−H)、4.74−4.95(m,6H,PhCH2O(4H),Ino−H(2H))、7.18−7.45(m,36.3H,PhCH2O(30H)+CHCl3)。
78α:Rf=0.31(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ3.33(dd,J=11.07,1.82Hz,1H,GluN−H−6)、3.38−3.49(m,2H,GluN−H−2,GluN−H−6’)、3.58(dd,J=9.98,3.64Hz,1H,Ino−H)、3.74(dd,J=9.87,8.99Hz,1H,GluN−H−4)、3.8(ψt,J=3.39Hz,1H,Ino−H)、3.85−3.95(m,2H,GluN−H−6,Ino−H)、3.97−4.09(m,1H,GluN−H−5)、4.1(d,J=12.06Hz,PhCH2O)、4.07(s,2H,PhCH2O)、4.44−4.62(m,6H,PhCH2O(5H),Ino−H(1H))、4.67(d,J=12.19Hz,1H,PhCH2O)、4.74−4.93(m,5H,PhCH2O(3H),Ino−H(2H))、5.32(d,J=3.61Hz,1H,GluN−H−1)、7.18−7.45(m,34.2H,PhCH2O(30H)+CHCl3)。
【0139】
3,4,5,6−テトラ−O−ベンジル−2−O−パルミトイル−myo−イノシトール(81)及び
3,4,5,6−テトラ−O−ベンジル−1−O−パルミトイル−myo−イノシトール(82)
【化23】

【0140】
方法A
Ar雰囲気下、ジオール17(20mg、37μmol)及び3mLのMeCNからなる溶液に、トリメチルオルトパルミテート80(137μL、117mg、0.37mmol、10当量)をシリンジで加えた。Ar注入口を素早く取り除き、固体の(+)−CSA(9mg、37μmol、1当量)を迅速に加え、反応フラスコにAr注入口を再度取り付け、反応混合物を23℃で30分間攪拌した。TLCではRf=0.32、0.42、0.76、0.95(EtOAc/ヘキサン体積比1:3)に4つのスポットが見られた。反応混合物中に出発物質17は残存していなかった。揮発性成分を真空下で蒸発させ、残渣をAr雰囲気下でCH2Cl2に再溶解し、氷浴(0℃)中で冷却した。Ar注入口を素早く取り除き、固体のYb(OTf)3(23mg、37μmol、1当量)を一気に加え、Ar注入口を再度連結し、反応混合物を0℃で1時間攪拌した。TLCではRf=0.3、0.62、0.8、0.95(EtOAc/ヘキサン体積比1:5)に基本的には同じスポットが見られた。水(1滴)を加え、反応混合物を0℃で30分間攪拌した。TLCではRf=0.3、0.5、及び0.95に3つのスポットが見られた。反応混合物にトリエチルアミン(0.5mL)を加え、揮発性成分を真空下で蒸発させた。生成物をフラッシュクロマトグラフィー(EtOAc/ヘキサン体積比1:7→1:6)で分離し、純粋な81(21mg)、81とカンファースルホン酸のメチルエステル(MeCSA)との混合物(7mg)、及びほぼ純粋な82(4mg、14%)を得た。81とMeCSAの混合物をPTLCで分離し、純粋な81を4mg得た(合計収率86%)。
【0141】
方法B
Ar雰囲気下、ジオール17(22.6mg、41.9μmol)を入れたフラスコに、トリメチルオルトパルミテート80(0.2MのMeCN溶液を314μL、1.5当量)をシリンジで加え、得られた混合物を5分間攪拌した。(+)−CSA(1.9mg、8.18μmol、0.2当量)及び1mLのCH2Cl2からなる溶液を滴下し、反応混合物を23℃で30分間攪拌した。水(1滴)を0℃で加え、この温度で反応混合物を30分間攪拌し、方法Aと同様に反応を停止して、81(22mg、73%)及び82(6mg、20%)を得た。
【0142】
方法C
Ar雰囲気下、ジオール17(22.5mg、41.7μmol)を入れたフラスコに、トリメチルオルトパルミテート80(0.2MのMeCN溶液を600μL、3当量)をシリンジで加え、得られた混合物を5分間攪拌した。Ar注入口を素早く取り除き、固体のPPTS(2mg、8.34μmol、0.2当量)を迅速に加え、Ar注入口を反応フラスコに再度取り付け、反応混合物を23℃で25分間攪拌した。水(2.1MのMeCN溶液を100μL、210μmol、5当量)を0℃で加え、この温度で反応混合物を40分間攪拌し、方法Aと同様に反応を停止して、81(27.3mg、84%)及び82(3.3mg、10%)を得た。
81:Rf=0.32(EtOAc/ヘキサン体積比1:3);1H−NMRスペクトルは文献の記載と完全に一致(シュリューター(Schlueter, U.)、ルー(Lu, J.)、フレーザーレイド(Fraser-Raid, B.)、オーガニック・レターズ(Org. Lett.)、2003、5、255〜257)
MeCSA:Rf=0.42(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ0.88(s,3H)、1.11(s,3H)、1.45(ddd,J=12.67,9.24,3.77Hz,1H)、1.68(ddd,J=13.85,9.28,4.51Hz,1H)、1.96(d,J=18.53Hz)、2.1−2.17(m,2H)、2.35−2.55(m,2H)、2.95(d,J=15.13Hz,1H)、3.62(d,J=15.13Hz,1H)、3.96(s,3H)。
82:Rf=0.6(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ0.88(m,3H,CH2CH2(CH2)12CH3)、1.17−1.35(m,24H,CH2CH2(CH2)12CH3)、1.53−1.65(m,8H,CH2CH2(CH2)12CH3(2H),“H2O”(6H))、2.2−2.41(m,2H,CH2CH2(CH2)12CH3)、2.42(s,1H,OH)、3.5−3.59(m,2H,H−3,H−5)、3.94(ψt,J=9.51Hz,1H,H−4)、4.07(ψt,J=9.67,1H,H−6)、4.29(ψt,J=2.65Hz,1H,H−2)、4.67(d,J=11.61Hz,1H,PhCH2O)、4.71(d,J=11.61Hz,1H,PhCH2O)、4.72(d,J=11.21Hz,1H,PhCH2O)、4.8−4.92(m,6H,PhCH2O(5H)、H−1)、7.2−7.4(m,23.4H,PhCH2O(20H)+CHCl3)。
【0143】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−2−パルミトイル−D−myo−イノシトール(63)及び2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−0−ベンジル−1−パルミトイル−D−myo−イノシトール(83)
【化24】

【0144】
Ar雰囲気下、ジオール64(15.5mg、17.1μmol)をCH2Cl2(150μL)に溶解した。攪拌しながらトリメチルオルトパルミテート80(0.114MのMeCN溶液を450μL、3当量)を加えた。反応混合物を0℃に冷却し、(+)−CSA(0.0144M溶液を0.3mL、0.25当量)を加えた。反応混合物を0℃で15分間攪拌し、2.5mgの(+)−CSA、500μLのMeCN、100μLのCH2Cl2、及び30μLのH2Oからなる溶液(32μL、5当量のH2Oに相当)を加えた。反応混合物を0℃で30分間攪拌し、Et3N(0.1mL)で反応停止させた。揮発性成分を真空下で蒸発させた。生成物をフラッシュクロマトグラフィー(EtOAc/PhH体積比1:14)で分離し、83と63の混合物及び主画分(63のみを含む)を得た。2つの異性体をPTLC(EtOAc/ヘキサン体積比1:3)で分離して、純粋な83(4mg、20.4%)及び付加的な量の63(14mg、合計収率71.4%)を得た。
63:Rf=0.22(EtOAc/PhH体積比1:14);1H−NMRスペクトルは文献の記載と完全に一致した(リュー(Liu X.)、シーバーガー(Seeberger, P.)、ケミカル・コミュニケーションズ(Chem. Commun.)、2004、1708〜1709)。
83:Rf=0.41(EtOAc/PhH体積比1:14);1H−NMR(CDCl3)δ0.88(m,3.6H,CH2CH2(CH2)12CH3(3H))、1.19−1.4(m,29.2H,CH2CH2(CH2)12CH3(3H))、1.6−1.75(m,2H,CH2CH2(CH2)12CH3(2H))、2.32(s,1H,OH)、2.42(t,J=7.64Hz,2H,CH2CH2(CH2)12CH3)、3.03(dd,J=11.2,2.07Hz,1H,GluN−H−6)、3.11(dd,J=11.28,1.72Hz,1H,GluN−H−6’)、3.29(dd,J=10.3,3.73Hz,1H,GluN−H−2)、3.46(ψt,J=9.44Hz,1H,Ino−H−5)、3.6(dd,J=9.51,2.63Hz,1H,Ino−H−3)、3.7(dd,J=10.06,9.00,1H,GluN−H−4)、3.87−4.05(m,3H,GluN−H−3,GluN−H−5,Ino−H−4)、4.18−4.41(m,4H,PhCH2O(2H),Ino−H−2,Ino−H−6)、4.5(d,J=12.05Hz,PhCH2O)、4.6−4.74(m,4H,PhCH2O)、4.8−4.98(m,5H,PhCH2O(4H),Ino−H−1)、5.05(d,J=10.9Hz,1H,PhCH2O)、5.34(d,J=3.69Hz,1H,GluN−H−1)、7.05−7.15(m,4H,PhCH2O)、7.15−7.4(m,32H,PhCH2O(30H)+CHCl3);{1H}13C−NMR(CDCl3)δ173.5、138.8、18.7、138.4、138.38、138.3、137.8、129.0、128.9、128.8、128.7、128.6、128.55、128.5、128.45、128.4、128.3、128.1、128.06、128.0、127.9、127.8、98.6、82.0、81.0、80.4、80.2、78.6、76.4、76.1、75.7、75.1、74.7、74.68、73.8、73.2、70.9、68.1、67.8、63.5、34.8、32.4、30.15、30.1、30.05、29.9、29.8、29.7、29.6、25.1、23.1、14.6。
【0145】
3,4,5,6−テトラ−O−ベンジル−1−O−(ジベンジルホスホノ)−2−O−パルミトイル−myo−イノシトール(85)
【化25】

【0146】
アルコール81(8.3mg、10.6μmol)及びテトラゾール(4.5mg、64μmol、6当量)をトルエンと共に真空下で蒸発させた。Ar雰囲気下、反応物にCH2Cl2(0.7mL)を加え、続いてアミダイト84(0.2MのCH2Cl2溶液を160μL、3当量)を加えた。反応混合物を23℃で30分間攪拌した。TLC解析(EtOAc/ヘキサン体積比1:3)によって出発物質(Rf=0.22)の消失を確認した。反応混合物を−42℃に冷却し、mCPBA(0.095MのCH2Cl2溶液を0.5mL、47.7μmol、4.5当量)を加えた。反応混合物を−42℃で5分間攪拌し、更に0℃で30分間攪拌した。ジクロロメタン(1mL)を加え、Na2S2O3(1M溶液を1mL)により0℃で反応混合物を反応停止させた。有機層を分離し、1MのNa2S2O3(3×0.5mL)、水(1×0.5mL)、5%NaHCO3(3×0.5mL)、水(1×0.5mL)、及び食塩水(2×1mL)で順次洗浄した。有機相をNa2SO4で乾燥し、蒸発させた。残渣をPTLC(EtOAc/ヘキサン体積比1:3)で精製して、純粋な85(10.4mg、95%)を得た。
85:Rf=0.46(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ0.88(m,3H,CH2CH2(CH2)12CH3)、1.15−1.38(m,25.7H,CH2CH2(CH2)12CH3(24H))、1.55−1.67(m,4.16H,CH2CH2(CH2)12CH3(2H),“H2O”)、2.38(m,2H,CH2CH2(CH2)12CH3)、3.47−3.57(m,2H,H−3,H−5)、3.83(ψt,J=9.58Hz,1H,H−4)、3.83(ψt,J=9.65Hz,1H,H−6)、4.36−4.45(m,2H,H−1(1H),PhCH2O(1H))、4.7(d,J=10.88Hz,1H,PhCH2O)、4.73−5.08(m,10H,PhCH2O)、5.94(ψt,J=2.68Hz,1H,H−2)、7.15−7.4(m,33.26H,PhCH2O(30H)+CHCl3);{1H}13C−NMR(CDCl3)δ173.0、138.7、138.45、138.4、137.7、136.1、136.0、135.95、135.9、128.75、128.7、128.6、128.55、128.5、128.3、128.2、128.0、127.9、127.7、82.8、81.4、80.3、80.2、78.4、76.6、76.5、76.2、75.8、72.4、69.7、69.6、69.4、69.3、68.5、34.6、32.1、29.9、29.7、29.6、29.2、25.5、22.9、14.4;{1H}31P−NMR(CDCl3)δ0.14。
【0147】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1−O−(ジベンジルホスホノ)−2−パルミトイル−D−myo−イノシトール(68)
【化26】

【0148】
アルコール63(2.7mg、2.36μmol)及びテトラゾール(2.6mg、37.7μmol、16当量)をトルエンと共に真空下で蒸発させた。Ar雰囲気下、反応物にCH2Cl2(0.5mL)を加え、続いてアミダイト84(0.2MのCH2Cl2溶液を95μL、8当量)を加えた。反応混合物を23℃で20分間攪拌した。TLC解析(EtOAc/ヘキサン体積比1:3)によって出発物質(Rf=0.35)の消失を確認した。反応混合物を−42℃に冷却し、mCPBA(0.057MのCH2Cl2溶液を0.5mL、28.3μmol、12当量)を加えた。反応混合物を−42℃で5分間攪拌し、更に0℃で40分間攪拌した。ジクロロメタン(1mL)を加え、Na2S2O3(1M溶液を1mL)により0℃で反応混合物を反応停止させた。有機層を分離し、1MのNa2S2O3(3×0.5mL)、水(1×0.5mL)、5%NaHCO3(3×0.5mL)、水(1×0.5mL)、及び食塩水(2×1mL)で順次洗浄した。有機相をNa2SO4で乾燥し、蒸発させた。残渣をフラッシュクロマトグラフィー(EtOAc/ヘキサン体積比1:5)で精製して、25mol%(NMRで測定)の不純物(BnO)2P(O)N(iPr)2を含む生成物を2.4mg得た。これを、10当量のテトラゾール、5当量の84、及び7.5当量のmCPBAを用いて63をホスホリル化した第2バッチの生成物と併せ、得られた混合物をPTLC(Et2O/ヘキサン/EtOH体積比150:100:2)で精製して、68を5.4mg得た。第1バッチから2.25mg(68%)得られ、第2バッチから3.15mg(64%)得られた。
68:Rf=0.53(Et2O/ヘキサン/EtOH体積比150:100:2);1H−NMR(CDCl3)δ0.88(m,3H,CH2CH2(CH2)12CH3)、1.15−1.35(m,26H,CH2CH2(CH2)12CH3(24H))、1.53−1.65(m,7.5H,CH2CH2(CH2)12CH3(2H),“H2O”)、2.25−2.45(m,2H,CH2CH2(CH2)12CH3)、3.2(dd,J=10.33,3.77Hz,1H,GluN−H−2)、2.25(dd,J=11.1,2.14Hz,1H,GluN−H−6)、3.32(m,1H,GluN−H−6’)、3.44(ψt,J=9.44Hz,1H,Ino−H−5)、3.51(dd,J=9.8,2.65Hz,1H,Ino−H−3)、3.68(ψt,J=9.92Hz,1H,GluN−H−4)、3.81(ψt,J=9.56Hz,1H,Ino−H−4)、3.98(ψt,J=10.18Hz,1H,GluN−H−3)、4.08(m,1H,GluN−H−5)、4.21(ψt,J=9.63Hz,1H,Ino−H−6)、4.25(d,J=11.96Hz,1H,PhCH2O)、4.37(d,J=11.01Hz,1H,PhCH2O)、4.40(d,J=10.74Hz,1H,PhCH2O)、4.52(m,1H,Ino−H−1)、4.53(d,J=12.06Hz,1H,PhCH2O)、4.65−4.78(m,4H,PhCH2O)、4.85(s,2H,PhCH2O)、4.90(d,J=10.59Hz,1H,PhCH2O)、4.96(d,J=10.63Hz,1H,PhCH2O)、5.0(d,3JP−H=8.43Hz,2H,PhCH2O)、5.05(d,3JP−H=8.47Hz,2H,PhCH2O)、5.52(d,J=3.72Hz,GluN−H−1)、5.98(ψt,J=2.54Hz,1H,Ino−H−2)、7.0−7.1(m,4H,PhCH2O)、7.1−7.4(m,43.5H,PhCH2O(40H)+CHCl3);{1H}13C−NMR(CDCl3)δ172.7、138.6、138.2、137.9、137.7、136.1、136、135.9、135.8、128.8、128.7、128.64、128.6、128.52、128.5、128.4、128.3、128.2、128.1、128.0、127.9、127.8、127.7、97.6、81.7、80.8、80.0、78.6、78.4、77.8(CHCl3により隠されている、HMQCから抽出)、76.5、75.9、75.4、75.05、74.5、74.4、73.6、72.4、70.7、69.96、69.88、69.7、69.64、68.6、68.1、63.4、34.5、34.2、29.9、29.8、29.6、29.58、29.3、25.4、22.9、14.3;{1H}31P−NMR(CDCl3)δ−0.23;LR−MS m/z 1406.24(M+H+)、1428.7(M+Na+)、C84H100N3O14Pの計算値1405.69;HRMS m/z 1428.6834(M+Na+)、C84H100N3NaO14P+の計算値1428.6835;誤差(ppm)−0.1。
【0149】
2−アミノ−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1−O−(ホスホノ)−2−パルミトイル−D−myo−イノシトール−ラクタム(86)及び
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1−O−(ジベンジルホスホノ)−2−パルミトイル−D−myo−イノシトール(68)
【化27】

【0150】
化合物63(10mg、8.72μmol)及びテトラゾール(2.4mg、34.9μmol、4当量)をトルエンと共に真空下で蒸発させた。Ar雰囲気下、反応物にCH2Cl2(0.5mL)を加え、続いてアミダイト84(0.2MのCH2Cl2溶液を87μL、2当量)を加えた。反応混合物を23℃で1時間攪拌した。TLC解析(EtOAc/ヘキサン体積比1:4)によって出発物質(Rf=0.24)の存在を確認した。ホスホリル化剤84(0.2MのCH2Cl2溶液を87μL、2当量)を追加し、反応混合物を1時間攪拌した。TLC解析(EtOAc/ヘキサン体積比1:4)によって出発物質(Rf=0.24)がまだ存在していることを確認した。テトラゾール(4当量)及び84(4当量)を加え、反応混合物を更に30分間攪拌したところ、TLCで出発物質の消失が確認された。更に1.5時間後、反応混合物を−42℃に冷却し、mCPBA(0.087MのCH2Cl2溶液を1mL、12当量)を加えた。反応混合物を−42℃で5分間攪拌し、更に0℃で45分間攪拌した。ジクロロメタン(1mL)を加え、Na2S2O3(1M溶液を1mL)により0℃で反応混合物を反応停止させた。有機層を分離し、1MのNa2S2O3(3×0.5mL)、水(1×0.5mL)、5%NaHCO3(3×0.5mL)、水(1×0.5mL)、及び食塩水(2×1mL)で順次洗浄した。有機相をNa2SO4で乾燥し、蒸発させた。残渣をPTLCで分離して、ラクタム86(5mg、45%)及び68(3mg、24%)を得た。
86:Rf=0.66(EtOAc/ヘキサン体積比2:3);1H−NMR(CDCl3)δ0.88(m,3.4H,CH2CH2(CH2)12CH3(3H))、1.12−1.35(m,27.4H,CH2CH2(CH2)12CH3(24H))、1.5−1.7(m,14.62H,CH2CH2(CH2)12CH3(2H),“H2O”)、2.34(m,2H,CH2CH2(CH2)12CH3)、3.2(m,1H,GluN−H−2)、3.22(dd,J=10.74,1.76Hz,1H,GluN−H−6)、3.33(dd,2JH−P=7.7Hz,3JNH−GluN−H−2=2.89Hz,1H,NH)、3.49(ψt,J=9.15,1H,Ino−H−5)、3.53−3.61(m,2H,Ino−H−3,GluN−H−6’)、3.72(ψt,J=9.1Hz,1H,GluN−H−4)、3.79−3.87(m,2H,GluN−H−5,Ino−H−4)、3.97(ψt,J=9.86Hz,1H,GluN−H−3)、4.03(ψt,J=9.51Hz,1H,Ino−H−6)、4.3(d,J=12.11Hz,1H,PhCH2O)、4.36(ψtd,3JH−P=9.73Hz,3JIno−H−6−Ino−H−1=9.73Hz,3JIno−H−2−Ino−H−1=2.67Hz)、4.45−4.55(m,3H,PhCH2O)、4.67−4.88(m,7H,PhCH2O)、4.96(dd,3JH−P=7.69Hz,2JH−H=11.74Hz,1H,PhCH2O−P)、4.98(d,J=9.3Hz,1H,PhCH2O)、5.06(dd,3JH−P=6.78Hz,2JH−H=11.78Hz,1H,PhCH2O−P)、5.33(d,J=3.71Hz,1H,GluN−H−1)、5.87(ψt,J=2.57Hz,1H,Ino−H−2)、7.07−7.17(m,2H,PhCH2O)、7.2−7.4(m,41H,PhCH2O(33H)+CHCl3);{1H}31P−NMR(CDCl3)δ7.91;LR−MS m/z 1272.68(M+H+)、1294.72(M+Na+)、C77H94NO13Pの計算値1271.65。
【0151】
IG−1(13)の合成:
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール(13)
【化28】

【0152】
1mLのクロロホルム及び1mLのメタノールに、化合物63(6mg、5.24μmol)を溶解した。6mgの10%Pd/Cを加えた。反応混合物を70バールのH2下で4時間攪拌し、その後3mgの10%Pd/Cを加え、反応混合物を同じ水素圧力下で4時間攪拌した。得られたスラリーをセライトパッド(高さ5mm)でろ過し、このパッドを洗い(4×0.5mL、メタノール−クロロホルム体積比5:1)、溶液を蒸発させて、純粋な13(3.5mg、定量的)を得た。
1H−NMR(d4−MeOH)δ0.9(m,3H,CH2CH2(CH2)12CH3)、1.21−1.45(m,26H,CH2CH2(CH2)12CH3(24H),グリース)、1.58−1.7(m,2H,CH2CH2(CH2)12CH3)、2.35−2.5(m,2H,CH2CH2(CH2)12CH3)、3.1(dd,J=10.58,3.67Hz,1H,GluN−H−2)、3.27−3.37(m,3.6H,Ino−H(1H),CHD2OD)、4.43(ψt,J=9.43,1H,GluN−H−4)、3.48−3.61(m,2H,Ino−H(2H))、3.63−3.86(m,5H,Ino−H(2H),GluN−H−3,GluN−H−6,GluN−H−6’)、4.08(ddd,J=2.48,4.21,9.71Hz,1H,GluN−H−5)、5.33(d,J=3.67Hz,1H,GluN−H−1)、5.42(ψt,J=2.48Hz,1H,Ino−H−2);{1H}13C−NMR(d4−MeOH)δ175.3、98.1、82.3、75.8、75.0、74.7、74.1、72.1、71.6、71.5、62.0、56.5、35.3、33.2、31.0、30.8、30.71、30.7、30.4、26.1、24.0、14.6;LR−MS m/z 580.36(M+H+)、602.45(M+Na+)、C28H53NO11の計算値579.36。
【0153】
IG−2(14)の合成:
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール−1−ホスフェート(14)
【化29】

【0154】
1mLのクロロホルム、1mLのメタノール、及び0.3mLのH2Oに、化合物68(5.4mg、3.84μmol)を溶解した。6mgの10%Pd/Cを加え、反応混合物を70バールのH2下で5時間攪拌した。得られたスラリーをセライトパッド(高さ5mm)でろ過し、このパッドを洗い(4×0.5mL、メタノール−クロロホルム−水の体積比3:3:1)、溶液を蒸発させて、14(2.7mg、定量的)を得た。
1H−NMR(d4−MeOH)δ0.9(m,4H,CH2CH2(CH2)12CH3(3H))、1.21−1.45(m,31H,CH2CH2(CH2)12CH3(24H))、1.58−1.2(m,2H,CH2CH2(CH2)12CH3)、3.4(ψt,J=6.76Hz,2H,CH2CH2(CH2)12CH3)、3.11(dd,J=10.31,3.51Hz,1H,GluN−H−2)、3.27−3.47(m,5.59H,Ino−H−6,GluN−H−4,CHD2OD)、3.51−3.66(m,2H,Ino−H−3,Ino−H−4)、3.7−3.88(m,3H,GluN−H−6,GluN−H−6’,GluN−H−3)、3.94(ψt,J=9.23,1H,Ino−H−6)、4.16(m,1H,GluN−H−5)、4.13(ψt,J=8.97Hz,1H,Ino−H−1)、5.53(d,J=3.81Hz,1H,GluN−H−1)、5.6(br.s.,1H,Ino−H−2);{1H}13C−NMR(d4−MeOH)δ174.8、96.6、79.2、76.7、74.9、74.8、74.6、74.0、72.4、72.1、71.6、71.2、62.1、55.8、35.4、33.2、30.9、30.8、30.6、30.4、30.0、26.2、23.9、14.6;{1H}31P−NMR(d4−MeOH)δ1.26;LR−MS m/z 658.50(M−H+)、C28H54NO14Pの計算値659.3284。
【0155】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1,2−ジデヒドロ−1,2−ジデオキシ−D−myo−イノシトール(73α/β)及び
2−アジド−3,4,6−トリ−O−ベンジル−1−フルオロ−1,2−ジデオキシ−α−D−グルコピラノ−ス(87)
【化30】

【0156】
Ar雰囲気下、ドナー65a(16.5mg、26.7μmol)、アクセプター66(13mg、32μmol)、及び粉砕した活性モレキュラーシーブ(150mg)の混合物に、無水CH2Cl2(1mL)を加えた。この反応混合物を−20℃に冷却し、BF3・Et2O(0.05MのCH2Cl2溶液を75μL、0.15当量)を滴下し、−20℃で2時間攪拌した。更にBF3・Et2O(0.05MのCH2Cl2溶液を300μL、0.5当量)を滴下し、反応混合物を−20℃で更に1時間攪拌した後、20℃まで昇温した。固体のNaHCO3(100mg)を加え、反応混合物を15分間攪拌し、ろ過した。ろ液を冷却した5%Na2CO3水溶液(3×0.5mL)、水(2×0.5mL)、及び食塩水(2×0.5mL)で順次洗浄し、Na2SO4で乾燥し、蒸発させた。未精製の反応混合物をフラッシュクロマトグラフィー(EtOAc/ヘキサン体積比1:6→1:4.5→1:3)で分離して、87(3mg、24%)、73β(8mg、34%)、及び73α(4mg、17%)を得た。
87:Rf=0.66(EtOAc/ヘキサン体積比1:4);1H−NMR(CDCl3)δ3.49(ddd,3JH2−F=26Hz,3JH2−H3=10.08Hz,3JH2−H1=2.6Hz),1H,H−2)、3.68(dd,J=10.98,1.85Hz,1H,H−6)、3.75−3.87(m,2H,H−4,H−6’)、3.91−4.01(m,2H,H−3,H−5)、4.5(d,J=12.47Hz,1H,PhCH2O)、4.55(d,J=10.9Hz,1H,PhCH2O)、4.63(d,J=12.08Hz,1H,PhCH2O)、4.82(d,J=12.47Hz,1H,PhCH2O)、4.85(d,J=10.84Hz,1H,PhCH2O)、4.91(d,J=10.69Hz,1H,PhCH2O)、5.67(dd,2JH1−F=52.8Hz,3JH2−H1=2.67Hz,1H,H−1)、7.15−7.21(m,2H,PhCH2O)、7.28−7.4(m,13H,PhCH2O);{1H}13C−NMR(CDCl3)δ138、137.9、137.8、128.7、128.69、128.3、128.2、128.1、128.08、128.0、107.9、104.9、78.4、75.9、75.4、73.8、73.5、73.4、67.9、63.9、63.6;19F−NMR(CDCl3)δ−146.4(dd,J=52.7,25.8Hz)。
73β:Rf=0.61(EtOAc/ヘキサン体積比1:4);1H−NMR(CDCl3)δ3.3−3.49(m,3H,GluN−H−2,GluN−H−3,GluN−H−5)、3.59−3.82(m,5H,GluN−H−4,GluN−H−6,GluN−H−6’,Ino−H(2H))、4.25(m,1H,Ino−H)、4.45(m,1H,Ino−H)、4.47−4.62(m,3H,PhCH2O)、4.64(d,J=7.6Hz,1H,GluN−H−1)、4.65−4.75(m,2H,PhCH2O)、4.75−4.92(m,6H,PhCH2O)、4.97(d,J=10.16Hz,1H,PhCH2O)、5.68−5.8(m,2H,Ino−H(2H))、7.15−7.21(m,2H,PhCH2O)、7.21−7.41(m,33.3H,PhCH2O(28H)+CHCl3);{1H}13C−NMR(CDCl3)δ139.0、138.9、138.6、138.4、138.3、138.2、129.3、128.9、128.9、128.8、128.8、128.6、128.5、128.4、128.3、128.3、128.3、128.2、128.0、102.9、84.3、84.1、83.6、80.5、80.2、78.2、76.0、75.5、75.3、73.9、72.9、68.8、67.0。
73α:Rf=0.53(EtOAc/ヘキサン体積比1:4);1H−NMR(CDCl3)δ3.34(dd,J=10.9,1.9Hz,1H,GluN−H−6)、3.4(d,J=11.1,2.7,1H,GluN−H−6’)、3.45(dd,J=10.5,3.5Hz,1H,GluN−H−2)、3.65−3.79(m,3H,GluN−H−4,Ino−H(2H))、3.96(dd,J=10.1,9Hz,1H,GluN−H−3)、4.02(m,1H,GluN−H−5)、4.25(m,1H,Ino−H)、4.3(d,J=11.9Hz,1H,PhCH2O)、4.4(m,1H,Ino−H)、4.45(d,J=11Hz,1H,PhCH2O)、4.55(d,J=12Hz,1H,PhCH2O)、4.63−4.75(m,3H,PhCH2O)、4.77(d,J=11Hz,1H,PhCH2O)、4.82−5.0(m,5H,PhCH2O)、5.1(d,J=3.6Hz,1H,GluN−H−l)、5.7−5.83(m,2H,Ino−H(2H))、7.1−7.45(m,33.3H,PhCH2O(30H)+CHCl3);{1H}13C−NMR(CDCl3)138.7、138.4、138.3、138.3、138.0、137.9、128.9、128.7、128.6、128.5、128.5、128.3、128.2、128.1、128.1、128.0、127.9、127.8、127.8、127.7、125.3、95.2、84.1、82.3、80.6、80.4、78.3、76.1、76.0、78.5、75.6、75.1、73.6、72.7、70.8、67.9、63.4。
【0157】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1,2−ジデヒドロ−1,2−ジデオキシ−D−myo−イノシトール(73α/β)
【化31】

【0158】
Ar雰囲気下、ドナー65a(90mg、145μmol)、アクセプター67(70mg、168μmol)、及び粉砕した4Å活性モレキュラーシーブ(100mg)の混合物に、無水エーテル(6mL)を加えた。この反応混合物を−5℃に冷却し、TfOH(0.0626MのEt2O溶液を232μL、0.1当量)を滴下し、−5℃で1時間攪拌した後、20℃まで昇温した。固体のNaHCO3(100mg)を加え、反応混合物を15分間攪拌し、ろ過した。ろ液を冷却した5%Na2CO3水溶液(3×0.5mL)、水(2×0.5mL)、及び食塩水(2×0.5mL)で順次洗浄し、Na2SO4で乾燥し、蒸発させた。未精製の反応混合物をフラッシュクロマトグラフィー(EtOAc/ヘプタン体積比1:10→1:7→1:6→1:5→1:3)で分離して、純粋なカップリング生成物を含む画分を得た。純粋でない73α及び73βを含む画分をそれぞれ併せて蒸発させた。生成物をPTLC(EtOAc/ヘプタン体積比1:3)で分離し、上記画分と併せて74mgの73α(58%)及び26.5mgの73β(21%)を得た。
【0159】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−2−パルミトイル−D−myo−イノシトール(63)、
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1−パルミトイル−D−myo−イノシトール(83)、
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→3)−3,4,5−トリ−O−ベンジル−2−パルミトイル−D−myo−イノシトール(89)、及び
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1−パルミトイル−D−myo−イノシトール(90)
【0160】
【化32】

【0161】
THF(0.7mL)及びtBuOH(0.8mL)の混合物にアルケン73(44.4mg、50.8μmol)を溶解し、得られた溶液を25mLナシ型フラスコに移した。水(500μL)を加え、続いて激しく攪拌しながらK3[Fe(CN)6](50mg、152μmol、3当量)、K2CO3(1M水溶液を152μL、3当量)、DABCO(0.089M水溶液を170μL、15.2μmol、0.3当量)、及びOsO4(0.056M水溶液を90μL、0.1当量)を加えた。最後にMeSO2NH2(9.6mg、102μmol)及びH2O(0.5mL)からなる溶液を加えた。反応混合物を23℃で激しく攪拌し、TLCで観察した(EtOAc/ヘプタン体積比3:4、73のRf=0.76、64及び88のRf=0.36〜0.42)。TLCによると12時間後の変換率は約60〜70%であった。NaOH(1M水溶液を76μL)を攪拌しながら加えた。反応混合物を更に8時間攪拌し、Na2SO3を添加して反応停止させた。有機相は黄色から無色へ変色し、水相は黒色へと変色した。反応混合物を15分間激しく攪拌し、有機層を分離した。水層からトルエン(3×0.5mL)で抽出し、有機液を併せて1MのNaOH(2×1mL)、水(2×0.5mL)、1MのNa2S2O3(3×0.5mL)、水(1×0.5mL)、及び食塩水(2×1mL)で順次洗浄した。有機相をNa2SO4で乾燥し、蒸発させて、ジオール64と88の混合物(44mg)を得た。Ar雰囲気下、ジオールの混合物(68mg、74.9μmol)をCH2Cl2(400μL)に溶解した。攪拌しながらトリメチルオルトパルミテート80(0.114MのMeCN溶液を1.6mL、2.5当量)を加えた。反応混合物を0℃に冷却し、(+)−CSA(0.0422MのMeCN溶液を443μL、0.25当量)を加えた。反応混合物を0℃で25分間攪拌し、2mgの(+)−CSA、500μLのMeCN、100μLのCH2Cl2、及び30μLのH2Oからなる溶液(142μL、5当量のH2Oに相当)を加えた。反応混合物を0℃で30分間攪拌し、Et3N(0.1mL)で反応停止させた。揮発性成分を真空下で蒸発させた。生成物をフラッシュクロマトグラフィー(PhH/EtOAc体積比96:4→14:1→8:1→7:1)で分離し、3つの画分を得た。
画分A:90、83、及び63の混合物
画分B:純粋な63
画分C:純粋な89(30mg)
画分Aの異性体をPTLC(EtOAc/ヘキサン体積比1:3)により分離し、90(6mg)、83(8mg)、及び63(28mg)を得た。パルミチン酸エステルの収率は合計で85%であり、比率は90/89=1/4.9、83/63=1/3.5であった。
90:Rf=0.57(EtOAc/PhH体積比1:14);1H−NMR(CDCl3)δ0.88(m,3.3H,CH2CH2(CH2)12CH3)、1.15−1.37(m,28.3H,CH2CH2(CH2)12CH3(24H))、1.52−1.65(m,7.6H,CH2CH2(CH2)12CH3(2H),“H2O”(5.6H))、2.2−2.43(m,2H,CH2CH2(CH2)12CH3)、2.96(br.s,1H,OH)、2.9(dd,J=11.26,1.77Hz,1H,GluN−H−6)、3.37(dd,J=11.22,2.61Hz,1H,GluN−H−6’)、3.53(ψt,J=9.43Hz,1H,Ino−H−5)、3.58(dd,1H,J=9.99Hz,1H,GluN−H−2)、3.7(dd,J=9.42,2.58Hz,1H,Ino−H−3)、3.75(ψt,J=9.25Hz,GluN−H−4)、3.86−3.99(m,3H,Ino−H−4,GluN−H−3,GluN−H−5)、4.1(ψt,J=9.87Hz,1H,Ino−H−6)、4.24(m,1H,Ino−H−2)、4.31(d,J=12.01Hz,1H,PhCH2O)、4.44−4.54(m,2H,PhCH2O)、4.67(d,J=10.62Hz,1H,PhCH2O)、4.72−4.79(m,2H,PhCH2O)、4.8−4.97(m,8H,PhCH2O(6H),Ino−H−1,GluN−H−1)、7.08−7.2(m,5H,PhCH2O)、7.2−7.4(m,33H,PhCH2O(25H)+CHCl3);{1H}13C−NMR(CDCl3)δ173.5、138.7、138.6、138.5、138.3、138.1、137.9、128.7、128.6、128.55、128.4、128.1、128.12、128.0、127.9、127.8、127.7、94.4、83.5、81.1、79.8、79.3、78.4、78.0、76.3、76.1、75.8、75.75、75.0、73.6、72.8、71.4、67.9、66.5、64.0、34.5、32.1、29.91、29.9、29.7、29.6、29.5、29.4、25.0、22.9、14.3。
89:Rf=0.08(EtOAc/PhH体積比1:14);1H−NMR(CDCl3)δ0.87(m,3.2H,CH2CH2(CH2)12CH3(3H))、1.17−1.43(m,27H,CH2CH2(CH2)12CH3(24H))、1.62−1.73(m,2H,CH2CH2(CH2)12CH3)、2.17(d,J=2.89Hz,1H,OH)、2.35−2.52(m,2H,CH2CH2(CH2)12CH3)、3.32(dd,J=10.24,3.6Hz,1H,GluN−H−2)、3.44−3.83(m,7H,Ino−H−1,Ino−H−3,Ino−H−5,Ino−H−6,GluN−H−4,GluN−H−6,GluN−H−6’)、3.87−4.08(m,3H,Ino−H−4,GluN−H−3,GluN−H−5)、4.38(d,J=12.06Hz,1H,PhCH2O)、4.47(d,J=10.99Hz,1H,PhCH2O)、4.58(d,J=12.05Hz,1H,PhCH2O)、4.7−4.9(m,8H,PhCH2O)、4.95(d,1H,PhCH2O)、5.22(d,J=3.72Hz,1H,GluN−H−1)、5.71(ψt,J=2.64Hz,1H,Ino−H−2)、7.0−7.17(m,5H,PhCH2O)、7.2−7.37(m,30H,PhCH2O(25H)+CHCl3);{1H}13C−NMR(CDCl3)δ173.6、138.5、138.4、138.0、137.9、128.9、128.7、128.65、128.6、128.5、128.48、128.3、128.25、128.2、128.1、127.94、127.9、127.8、93.9、83.6、81.61、81.23、80.1、78.3、76.1、75.8、75.4、75.1、73.4、72.7、70.7、70.4、68.2、67.1、63.0、34.36、32.14、29.9、29.87、29.81、29.62、29.6、29.36、25.1、22.9、14.4。
【0162】
IG−13の合成:
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−1−パルミトイル−D−myo−イノシトール(91)
【化33】

【0163】
0.7mLのクロロホルム及び0.7mLのメタノールに、化合物83(3mg、2.62μmol)を溶解した。4mgの10%Pd/Cを加えた。反応混合物を70バールのH2下で3.5時間攪拌した。得られたスラリーをセライトパッド(高さ5mm)でろ過し、このパッドを洗い(4×0.5mL、メタノール−クロロホルム体積比5:1)、溶液を蒸発させて、純粋な91(1.5mg、定量的)を得た。
1H−NMR(d4−MeOH)δ0.9(m,3.8H,CH2CH2(CH2)12CH3(3H),グリース)、1.21−1.45(m,31H,CH2CH2(CH2)12CH3(24H),グリース)、1.58−1.72(m,2H,CH2CH2(CH2)12CH3)、2.3−2.52(m,2H,CH2CH2(CH2)12CH3)、3.13(dd,J=10.71,3.84Hz,GluN−H−2)、3.23−3.49(m,3H,Ino−H−3,Ino−H−5,GluN−H−4)、3.63−3.85(m,4H,Ino−4,GluN−H−3,GluN−H−6,GluN−H−6’)、4.0−4.1(m,2H,Ino−H−6,GluN−H−5)、4.19(ψt,J=2.55Hz,1H,Ino−H−2)、4.71(dd,J=10.22,2.58Hz,1H,Ino−H−1)、5.26(d,J=3.76Hz,1H,GluN−H−1);{1H}13C−NMR(d4−MeOH)δ175.0、97.0、79.5、76.4、74.8、74.5、74.3、72.6、71.6、71.2、71.1、61.9、56.3、35.3、33.2、30.9、30.8、30.7、30.6、30.5、25.9、23.9、14.6;LR−MS m/z 580.34(M+H+)、602.44(M+Na+)、C28H53NO11の計算値579.36。
【0164】
IG−14の合成:
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−2−パルミトイル−D−myo−イノシトール(92)
【化34】

【0165】
0.7mLのクロロホルム及び0.7mLのメタノールに、化合物89(3mg、2.62μmol)を溶解した。4mgの10%Pd/Cを加えた。反応混合物を70バールのH2下で3.5時間攪拌した。得られたスラリーをセライトパッド(高さ5mm)でろ過し、このパッドを洗い(4×0.5mL、メタノール−クロロホルム体積比5:1)、溶液を蒸発させて、純粋な92(1.5mg、定量的)を得た。
1H−NMR(d4−MeOH)δ0.9(m,3.9H,CH2CH2(CH2)12CH3(3H),グリース)、1.21−1.44(m,31H,CH2CH2(CH2)12CH3(24H),グリース)、1.58−1.72(m,2H,CH2CH2(CH2)12CH3)、2.35−2.52(m,2H,CH2CH2(CH2)12CH3)、3.13(dd,J=10.67,3.58Hz,1H,GluN−H−2)、3.25(ψt,J=9.01Hz,1H,Ino−H)、3.38(m,1H,Ino−H)、3.54(dd,J=9.91,2.86Hz,1H,Ino−H)、3.58−3.72(m,3H,Ino−H(2H),GluN−H−6)、3.75,3.87(m,3H,Ino−H,GluN−H−3,GluN−H−6’)、4.2(ddd,J=2.2,5.13,10.16Hz,1H,GluN−H−5)、5.38(d,J=3.55Hz,1H,GluN−H−1)、5.45(ψt,J=2.32Hz,1H,Ino−H−2);{1H}13C−NMR(d4−MeOH)δ177、94.6、76.8、76.7、74.7、74.3、73.1、72.9、71.8、71.4、71.2、62.2、55.9、35.5、33.2、30.9、30.8、30.7、30.6、30.5、26.1、23.9、14.6;LR−MS m/z 580.30(M+H+)、602.34(M+Na+)、C28H53NO11の計算値579.36。
【0166】
IG−15の合成:
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−1−パルミトイル−D−myo−イノシトール(93)
【化35】

【0167】
0.7mLのクロロホルム及び0.7mLのメタノールに、化合物90(3mg、2.62μmol)を溶解した。4mgの10%Pd/Cを加えた。反応混合物を90バールのH2下で5.5時間攪拌した。得られたスラリーをセライトパッド(高さ5mm)でろ過し、このパッドを洗い(4×0.5mL、メタノール−クロロホルム体積比5:1)、溶液を蒸発させて、純粋な92(1.5mg、定量的)を得た。
1H−NMR(d4−MeOH)δ0.9(m,3.5H,CH2CH2(CH2)12CH3(3H),グリース)、1.21−1.4(m,30H,CH2CH2(CH2)12CH3(24H),グリース)、1.58−1.7(m,2H,CH2CH2(CH2)12CH3)、2.38−2.5(m,2H,CH2CH2(CH2)12CH3)、3.16(dd,J=10.52,3.62Hz,1H,GluN−H−2)、3.28(ψt,J=9.06,1H,Ino−H−5)、3.4(dd,J=9.98,8.94Hz,1H,GluN−H−4)、3.56−3.89(m,6H,Ino−H−3,Ino−H−4,Ino−H−6,GluN−H−3,GluN−H−6,GluN−H−6’)、4.04(ddd,J=9.59,5.21,2.5Hz,1H,GluN−H−5)、4.18(ψt,J=2.45Hz,1H,Ino−H−2)、4.65(dd,J=10.25,2.5Hz,1H,Ino−H−1)、5.18(d,J=3.62Hz,1H,GluN−H−1);{1H}13C−NMR(d4−MeOH)δ175.2、93.8、77.1、76.6、75.4、74.4、72.5、71.8、71.6、71.4、68.0、62.1、55.9、35.1、33.2、31.0、30.9、30.8、30.6、30.4、26.1、23.9、14.58;LR−MS m/z 580.45(M+H+)、602.45(M+Na+)、C28H53NO11の計算値579.36。
【0168】
II.親油性イノシトールグリカン化合物は癌細胞増殖を抑制し、担癌対象の生存期間を長期化する。
以下の実施例では、本発明の親油性イノシトールグリカン化合物が癌細胞の死亡を誘導し、担癌マウスの生存を改善できることを示す。
【0169】
細胞株
ヒト膵臓癌細胞株(Panc−1、MiaPaca2、BXPC3、Aspc1)、ヒト肝臓癌細胞株(HuH7)、ヒト胃癌細胞株(AGS、MKN45)、ヒト結腸癌細胞株(CoCM−1)、ヒト乳癌細胞株(MCF−7)、ヒト神経芽腫細胞(SH−SY5Y)、ヒト前立腺癌細胞(PC3)、マウスエールリッヒ腹水癌細胞、及びマウス3T3−L1線維芽細胞が、アメリカン・タイプ・カルチャー・コレクション(American Type Culture Collection、米国メリーランド州ロックビル)から得られた。これら癌細胞を10%ウシ胎仔血清を含むRPMI1640中で培養した。培地はCO25%の湿潤環境で37℃に保った。
【0170】
ヒト初代培養細胞、皮膚線維芽細胞、表皮角化細胞、及び臍帯静脈内皮細胞をセル・アプリケーションズ社(Cell Applications、米国カリフォルニア州サンディエゴ)から購入し、製造者の使用説明書に従って培養した。
【0171】
細胞増殖分析
試験キットCellTiter 96 AQueous One Solution Cell Proliferation Assay kit(プロメガ株式会社、米国ウィスコンシン州マディソン)を用いて、製造者の使用説明書に従って細胞増殖試験を行った。簡潔に述べると、96ウェルの培養皿中、培地に1ウェルあたり5×103個の細胞を播種した。この細胞培養系に、最終濃度が0、1、10、及び100μMとなるようにIGを加えた。得られた系を3日間又は7日間培養した後、テトラゾリウム化合物の3−(4,5−ジメチルチアゾール−2−イル)−5−(3−カルボキシメトキシフェニル)−2−(4−スルホフェニル)−2H−テトラゾリウム塩、及びMTSを含有する試薬であるCellTiter 96 AQueous One Solution Reagentを培地に20μL/ウェル加えた。この培養皿をCO2インキュベーターで1時間培養した後、96ウェル培養皿読取機で490nmの吸収を記録した。
【0172】
動物生存分析
雄ddyマウスに標準食及び水を随意に与え続け、体重を20〜30gとした。エールリッヒ腹水癌細胞(5×106個)をマウスの腹腔内に注射した。その7日後から、7日の間、毎日マウスにIG1又はIG1+アルキル−アシル−ホスファチジン酸(AAPA)を腹腔内注射した。動物が自然死した時点で実験を終了した。
【0173】
癌研究結果
本実施例で用いた親油性イノシトールグリカン化合物は、上述した新規化学合成法によって調製した。それら合成化合物は幾つかのヒト腫瘍細胞株に対して細胞毒性を示すことが分かっている。そのような腫瘍細胞としては、ヒト膵臓癌細胞(Panc−1、MiaPaca2、BXPC3、Aspc1)、ヒト肝臓癌細胞(HuH7)、ヒト胃癌細胞(AGS、MKN45)、ヒト結腸癌細胞(CoCM−1)、ヒト乳癌細胞(MCF−7)、ヒト神経芽腫細胞(SH−SY5Y)、ヒト前立腺癌細胞(PC3)、及びマウスエールリッヒ腹水癌細胞が挙げられるが、これらに限定されない。これら化合物は、後述するヒト臍帯静脈内皮細胞(図8)を例外として、ヒト正常細胞(ヒト皮膚線維芽細胞、ヒト表皮角化細胞等が挙げられるが、これらに限定されない)に対しては細胞毒性を示さない。図4〜6に示すデータから、該化合物は癌細胞中で固有の細胞死メカニズムを活性化し、その結果細胞毒性を示すことが分かる。
【0174】
図3に示すように、親油性イノシトールグリカンをPanc−1細胞の無血清培地中に10μMの濃度で用いると(1時間培養)、ATP量に影響することなく好気的解糖を正常化できる。培地にIG−1を10〜100μMの濃度で加えたところ、添加から1時間以内にヒト膵臓癌細胞Panc−1が迅速死した(図4A、4B、及び4C)。他の癌細胞についても同様のIG1濃度(10〜100μM)を用いたところ、ヒト膵臓癌細胞(MiaPaca2、BXPC3、Aspc1)、ヒト肝臓癌細胞(HuH7)、ヒト胃癌細胞(AGS、MKN45)、ヒト結腸癌細胞(CoCM−1)、ヒト乳癌細胞(MCF−7)、ヒト神経芽腫細胞(SH−SY5Y)、ヒト前立腺癌細胞(PC3)、及びマウスエールリッヒ腹水癌細胞といった全ての癌細胞株において同様の癌細胞迅速死が見られた。しかしながら、IG−1を1〜100μMの濃度で用いると、HUVEC(図8)を除いて、培養ヒト正常細胞の増殖には作用しなかった(データは図示せず)。
【0175】
一方、IG−2の場合は、処置後24時間以内にヒト前立腺癌細胞(PC3)(図5)、ヒト神経芽腫細胞(SH−SY5Y)、及びヒト肝臓癌細胞(HuH7)中で細胞死が見られた。IG−2を1〜100μMの濃度で用いた場合も、培養ヒト正常細胞の増殖には作用しなかった(データは図示せず)。
【0176】
IG13、IG14、及びIG15の3種のIG1類似体も、処置後72時間以内にヒト膵臓癌細胞(Panc−1)の死を誘起した(図6)。IG13、IG14、及びIG15を1〜100μMの濃度で用いた場合も、培養ヒト正常細胞の増殖には作用しなかった(データは図示せず)。
【0177】
IG1の生体内での抗癌活性を評価するために、エールリッヒ腹水癌細胞担癌ddyマウスにIG−1を7日間腹腔内投与し、マウスの生存期間を調べた。DMSOのみの場合と比較して、IG−1処置は生存期間に影響しなかった。IG1のグリコシルホスファチジルイノシトール(GPI)前駆体をGPI特異的ホスホリパーゼD(GPI−PLD)で加水分解することによって、アルキル−アシル−ホスファチジン酸(AAPA)が得られると推測できる。3種のAAPA、即ちAAPA1(1−O−アルキル−(18:0)−2−O−アシル−(18:0)−sn−グリセロール−ホスフェート)、AAPA2(1−O−アルキル(18:0)−2−O−アシル−(20:4)−sn−グリセロール−ホスフェート)、及びAAPA3(1−O−アルキル−(18:0)−2−O−アシル(22:4)−sn−グリセロール−ホスフェート)を上述した化学合成法により調製し、IG1+AAPA化合物で治療した場合の癌マウスの生存期間を調べた。IG1のみ又はIG1+他のAAPAの組み合わせを用いた場合と比較して、IG1+AAPA2を用いると癌マウスの生存期間が有意に長くなった(図7)。エールリッヒ腹水癌細胞担癌ddyマウスにIG1及びアルキル−アシル−ホスファチジン酸を7日間毎日投与した後のカプラン・マイヤー生存曲線を図7に示す。IG1は1時間以内にヒト臍帯静脈内皮細胞(HUVEC)の迅速死を誘起するが、AAPA2はこのHUVEC細胞迅速死を阻害する(図8)。即ち、IG1のGPI前駆体をGPI−PLDで加水分解することによって生じると考えられるAAPAは、細胞内シグナル伝達において親油性イノシトールグリカンと相互作用する可能性がある。
【0178】
II.親油性イノシトールグリカン化合物はインスリン様生物活性を有し、耐糖能を改善でき、グルコース代謝障害を治療又は抑制できる。
他の態様では、本発明の組成物及び方法を用いて血糖を調節できる。式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、血糖調節に使用できる。即ち、本発明の組成物及び方法は、グルコース代謝障害の発病を予防又は抑制するため、或いはグルコース代謝障害を治療するために使用できる。親油性イノシトールグリカン化合物をグルコース代謝障害の治療的処置及び予防的処置に用いることができる。一実施形態においては、親油性イノシトールグリカン化合物又はその機能性類似体を投与することによって、血糖を調節できる。親油性イノシトールグリカン化合物及び機能性類似体はインスリンの分泌を調節でき、そのため血糖を調節できる。グルコース代謝障害とは、グルコースの取り込み又は放出、或いはインスリンの発現、産生、分泌、又は使用に関連する疾患である。ここでグルコース代謝障害は肥満、糖尿病、インスリン抵抗症、高血糖症、耐糖能障害、高インスリン血症、X症候群、高コレステロール血症、高リポタンパク血症、高トリグリセリド血症、粥状動脈硬化症、及び糖尿病性腎症からなる群から選ぶことができるが、これらに限定されない。
【0179】
以下の実施例では、本発明の親油性イノシトールグリカン化合物がインスリン様生物活性を有し、当該技術分野で承認されているマウス病態モデルのI型糖尿病、II型糖尿病、肥満、又はメタボリック症候群の耐糖能を改善できることを示す。
【0180】
材料及び方法:
3T3−L1脂肪細胞中のグリコーゲン合成及び脂質生成
3T3−L1線維芽細胞を、25mMグルコース+10%ウシ胎仔血清(FBS)を含むダルベッコ変法イーグル培地(DMEM)内に保持した。2日後、併せて10%のFBS、167nMのインスリン、0.25μmol/リットルのデキサメタゾン、及び0.5mMのイソブチルメチルキサンチンを含有するDMEMを添加して分化を開始した。3日後、培地をDMEM+10%FBS+167nMインスリンに置換した。更に2日後、培地をDMEM+10%ウシ胎仔血清に置換した。細胞の>90%が脂肪細胞表現型を示し分化操作が完了した後、含脂肪細胞を6〜14日間使用した。実験に先立って、5mMのグルコース、0.2%のウシ血清アルブミン、25mMのHepes(pH7.4)、100ユニット/mlのペニシリン、100ユニット/mlのストレプトマイシン、及び0.29mg/mlのグルタミンを含有するDMEM培地で細胞を2回洗浄し、同じ培地で2時間インキュベートした。24ウェルの皿でグリコーゲン及び脂質の合成を測定した。DMSO中、IGを様々な濃度で用いて30分間前治療した後、1〜100nMインスリンの存在下及び非存在下で細胞を30分間活性化した。次に、全てのウェルに1μCiの[14C]−グルコース(約220cpm/nmol)を加えた。37℃で60分間培養した後、氷上で細胞をPBSで3回洗浄し、脂肪細胞を1mlの蒸留水中に回収した。400μlのPBSに400μlの細胞懸濁液を加えた。5mlのベータフルオー(Betafluor、ナショナルダイアグノスティクス社(National Diagnostics))で脂質を一晩抽出し、シンチレーション計測によって脂質へのグルコース混入を測定した。600μlの50%KOHに400μlの細胞懸濁液を加え、グリコーゲンを沈殿させ、放射能を液体シンチレーションカウンターで計測した。
【0181】
天然ラット脂肪細胞内の脂質生成の測定
雄ロング−エバンスラットを解剖して得た副睾丸脂肪パッドから含脂肪細胞を単離し、イノシトールグリカン又はインスリンによる処置に反応して起こるトリグリセリドへの[6−3H]−グルコースの混入を従来法により測定した(チャクラボルティ(Chakraborty, N.)及びダラルカオ(M. d'Alarcao)、バイオオーガニック・アンド・メディシナル・ケミストリー(Bioorganic & Medicinal Chemistry)、13、2005、6732〜6741)。図10に示すように、この測定ではIG−1とIG−2の両方が脂質生成を促進した。このデータを受容体結合モデルと照合すると(チャクラボルティ(Chakraborty, N.)及びダラルカオ(M. d'Alarcao)、バイオオーガニック・アンド・メディシナル・ケミストリー(Bioorganic & Medicinal Chemistry)、13、2005、6732〜6741)、IG−1及びIG−2の脂質生成活性化のEC50値はそれぞれ14μM及び2.5μMであった。一方、40μMのIG−13、IG−14、又はIG−15を用いた場合は、この試験において脂質生成活性化は殆ど又は全く起こらなかった(図11)。
【0182】
動物実験
生後5週間の雄C57BL/6マウスを個別に収容し、標準食(65%の炭水化物、4%の脂肪、及び24%のタンパク質を含む)又は高脂肪食(60.2%の炭水化物、15.3%の脂肪、及び24.5%のタンパク質を含むクイックファット(Quick Fat、日本クレア株式会社、東京))を自由に摂取できるように5週間飼育した。Db/dbマウスも個別に収容し、標準食を自由に摂取できるように飼育した。生後5週間のC57BL/6マウスには、体重1gあたり75μgのストレプトゾトシン(STZ)を数回投与した。注射から7日間後、空腹時血漿グルコース濃度が400mg/dlを超えるマウスを、STZ糖尿病マウスとして使用した。東北大学の動物実験規則ガイドラインに従って動物実験を行った。
【0183】
肝臓中のトリグリセリド量及びグリコーゲン量
冷凍肝臓を均質化し、CHCl3:CH3OH(体積比2:1)でトリグリセリドを抽出し、乾燥し、2−プロパノール中に懸濁させた(17)。リピドス液(Lipidos、東洋紡績株式会社、大阪)を用いてトリグリセリド量を測定した。30%水酸化カリウムを含む飽和Na2SO4溶液に組織を100℃で30分間溶解し、続いてエタノール沈殿を行って、30〜50mgの冷凍肝臓からグリコーゲンを単離した。グリコーゲン量は490nmでフェノール−硫酸分光光度法によって決定し(18)、肝臓1ミリグラムあたりのグリコーゲンのマイクログラム数で表した。
【0184】
血液分析
グルコースエース(Glucose Ace、株式会社三和化学研究所、名古屋)を用いて血糖を測定した。血清中のインスリン及びレプチンは、ELISAキット(森永生科学研究所、横浜)を用いて決定した。血清中のアディポネクチン濃度及び腫瘍壊死因子α(TNF−α)濃度は、それぞれELISAキット(大塚製薬株式会社、東京)及びTNF−α分析キット(アマシャムバイオサイエンス社、スウェーデン国ウプサラ)を用いて測定した。血清中の総コレステロール濃度、トリグリセリド濃度、及びFFA濃度は、それぞれコレスカラー液及びリピドス液(Cholescolor及びLipidos、東洋紡績株式会社、大阪)、並びにNEFA−Cキット(和光純薬工業株式会社、大阪)を用いて決定した。
【0185】
耐糖能(糖負荷)試験
耐糖能については腹腔内耐糖能で評価した。耐糖能試験は、16時間絶食マウスを用いて行った。マウスには体重1kgあたり2gのグルコースを腹腔内投与し、その投与の直前、並びに15、30、60、及び120分後に血糖を測定した。
【0186】
IG−1の静脈内投与
随意に摂餌させたマウスにIG−1を静脈内投与した。IG1又はヒトレギュラーインスリン(標準食マウスには体重1kgあたり1ユニット;高脂肪食マウス、db/dbマウス、及びSTZ糖尿病マウスには体重1kgあたり2ユニット;イーライリリー社、神戸)をマウスに尾静脈注射し、注射の直前、並びに30、60、90、120、180、240、及び300分後に血糖を測定した。
【0187】
統計分析
対応のないスチューデントt検定(unpaired Student's t-test)によって有意な統計的相違を評価した。<0.05のp値は有意であるとみなした。
【0188】
グルコース代謝障害の動物モデル実験の結果
本発明の式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、グリコーゲン合成及び脂質生成を活性化できる。既に記載したとおり、10〜1000μMの濃度でIG1を用いると、3T3−L1脂肪細胞中でグリコーゲン合成及び脂質生成が活性化される(図9A及び図9B)。IG1及びIG2はラットから単離した脂肪細胞の脂質生成を促進する(図10及び図11)。IG15も100μMの濃度で使用すると3T3−L1脂肪細胞中でグリコーゲン合成及び脂質生成を促進する(図12A及び図12B)。
【0189】
本発明の式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、当該分野で認められているグルコース代謝障害モデルにおいて血漿グルコース濃度を低減できる。IG1を静脈内投与(マウス1匹あたり0.3〜1mg)することにより、投与後90〜300分間で、高脂肪食を与えたC57B/6マウス及びメタボリック症候群動物モデルの血漿グルコース濃度が有意に低下した(図13)。IG1を用いると、高脂肪食を与えたC57B/6マウスの肝臓及び筋肉のグリコーゲン量が有意に増加した(データは図示せず)。IG1を静脈内投与(マウス1匹あたり0.3mg)することにより、投与後120〜300分間で、ストレプトゾトシン(STZ)糖尿病マウス及びインスリン欠乏I型糖尿病動物モデルの血漿グルコース濃度が有意に低下した(図14)。また、IG1を用いるとSTZ糖尿病マウスの肝臓及び筋肉のグリコーゲン合成も増加する(データは図示せず)。IG1を静脈内投与すると、標準食を与えたC57B/6マウス(正常マウス)、db/dbマウス、及び肥満〜糖尿病のマウス(II型糖尿病モデル)の血漿グルコース濃度が低下した。IG1を用いると標準食を与えたC57B/6マウス及びdb/dbマウスの肝臓及び筋肉のグリコーゲン合成も増加する(データは図示せず)。
【0190】
本発明の式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、当該分野で認められているグルコース代謝障害モデルにおいて、有意に耐糖能を改善でき、空腹時血漿グルコース濃度を低下させることができ、肝臓及び筋肉のグリコーゲン合成を増加させることができ、1日摂食量を低下させることができ、体重を低下させることができ、且つインスリン、トリグリセリド、遊離脂肪酸、及びレプチンの空腹時血漿濃度を低下させることができる。IG1を7日間毎日腹腔内投与すると(マウス1匹あたり1mg)、高脂肪食を与えたC57B/6マウスの耐糖能が有意に改善される(図15)。高脂肪食を与えたC57B/6マウスにIG1を静脈内投与することによって血漿グルコース濃度が経時的に低下する様子を図13に示す。STZ糖尿病マウスにIG1を7日間腹腔内投与することによって空腹時血漿グルコース濃度が改善される様子を図16に示す。高脂肪食を与えたC57B/6マウスにIG−1を処置すると、7日後に肝臓及び筋肉のグリコーゲン量が増加し、肝臓トリグリセリド量が減少する(データは図示せず)。STZ糖尿病マウスにIG1を7日間毎日腹腔内投与すると(マウス1匹あたり0.3mg)、空腹時血漿グルコース濃度が有意に低下する(図14)。また、IG−1を投与するとSTZ糖尿病マウスの肝臓及び筋肉のグリコーゲン合成が増加する(データは図示せず)。標準食を与えたC57B/6マウス及びdb/dbマウスにIG1を7日間毎日腹腔内投与すると、耐糖能が改善され、肝臓及び筋肉のグリコーゲン合成が増加する(データは図示せず)。図16に示すように、STZ糖尿病マウスにIG1を7日間腹腔内投与すると、空腹時血漿グルコース濃度が改善される。高脂肪食を与えたC57B/6マウス及びメタボリック症候群動物モデルにIG1を7日間投与することによって、1日摂食量、体重、並びにインスリン、トリグリセリド、遊離脂肪酸、及びレプチンの空腹時血漿濃度が有意に低下する(表2)。
【0191】
【表2】

【0192】
即ち、IG1は、標準摂食C57B/6マウス、高脂肪摂食C57B/6マウス、db/dbマウス、及びSTZ糖尿病マウスの耐糖能、インスリン感受性、及び脂質代謝を改善する。IG1を用いて28日間治療すると、ob/ob肥満マウス(表3参照)及び高脂肪摂食C57B/6マウス(データは図示せず)において、1日摂食量、体重、並びにインスリン、トリグリセリド、遊離脂肪酸、及びレプチンの空腹時血漿濃度が有意に低下する。
【0193】
本実施例から、本発明の式(I)及び式(II)で表される親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、3T3−L1脂肪細胞においてインスリン様生物活性を示すことが分かる(図6〜9)。例えば、正常マウス、並びにI型糖尿病、II型糖尿病、肥満、及びメタボリック症候群のマウスモデルにおいて、IG1は低血糖性活性を示す(図10〜11)。図10の濃度効果関係曲線に示すように、IG−1は14μMのEC50(半数影響濃度)及び24%のAmax(最大作用)を有し、IG−2は2.5μMのEC50及び37%のAmaxを有する。この親油性イノシトールグリカン化合物を用いて長期治療を行うと、正常マウス及びグルコース代謝障害(I型糖尿病、II型糖尿病、肥満、メタボリック症候群等)のマウスモデルにおいて、耐糖能が改善される(図12〜16)。例えば既に示したとおり、IG1により7日間又は28日間治療を行ったところ、当該分野で認められているグルコース代謝障害マウスモデルにおいて、1日摂食量、体重、肝臓トリグリセリド量、並びにグルコース、インスリン、トリグリセリド、及び遊離脂肪酸の空腹時血漿濃度が有意に低下した(表2及び3)。
【0194】
【表3】

【技術分野】
【0001】
本発明は、親油性イノシトールグリカン化合物を合成するための物質及び方法、並びに該化合物を癌及びグルコース代謝障害(糖尿病、肥満、メタボリック症候群等)の治療に使用する方法に関する。
【背景技術】
【0002】
米国では癌は2番目に多い死亡原因となっている。2000年には、世界中の様々な原因による5600万人近くの死亡例のうち12パーセントが悪性腫瘍に関連していた。2020年までに世界の癌罹患率は50%増加し、1500万に達する可能性がある。癌の発見及び治療は進歩しているが、ワクチンや他の広く効果的な予防/治療方法は未だ得られていない。
【0003】
女性では乳癌が最も多く、これに肺癌と結腸・直腸癌が続く。現在は早期診断と積極的治療(外科処置、放射線療法、化学療法、ホルモン療法等の様々な治療のうち1種以上)の組み合わせにより癌に対応している。
【0004】
男性の場合は前立腺癌が最も多く、50歳を超える男性における発現率は30%と推定される。ヒト前立腺癌は骨へと転移する傾向がある。通常、外科処置及び/又は放射線療法に基づいて治療を行うが、これらの方法は効果が無い場合も多い。従って、当分野では幅広いヒト癌を治療するための新たな抗癌剤や治療法が強く求められている。
【0005】
世界の全年齢層の糖尿病有病率は2000年には2.8%と推定され、2030年には4.4%に達すると予期されている。糖尿病患者の総数は2000年の1億7100万人から、2030年には3億6600万人に増加すると予想されている。II型糖尿病の約90%が過剰体重に起因しているので、II型糖尿病有病率の増加は肥満の急増と密接に関連している。更に、世界で約1億9700万人が耐糖能障害を有し、その最も一般的な原因は肥満とそれに関連するメタボリック症候群である。この数は2025年までに約4億2000万人に増加すると予想されている。
【0006】
メタボリック症候群は、心臓病、卒中、及び閉塞性動脈硬化症を誘発し得る多くの心臓病危険因子を内包する中心性肥満である。国民健康調査によると、アメリカ人は5人に1人以上がメタボリック症候群に該当する。メタボリック症候群や糖尿病の根本的原因は主に運動不足と過剰体重であるため、生活様式の改善(健康食、運動増進、体重減少等)によって、メタボリック症候群に関連する合併症の低減又は予防、並びに糖尿病の制御が可能となる。
【0007】
しかしながら、糖尿病及びメタボリック症候群を患う多くの人にとって生活様式改善は困難であり、従来の治療法に従うことになる。最近の抗糖尿病薬(経口血糖降下薬、インスリン等)では完全には疾患を制御することができず、したがって完全には糖尿病性合併症を予防できない。従って、糖尿病及びメタボリック症候群の新たな治療法が必要とされている。
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、一つには、癌、糖尿病、肥満、及びメタボリック症候群の治療に用いられる新種の化合物に関する。特に本発明では、親油性イノシトールグリカン化合物からなる抗癌剤を提供し、これを単独で又は他の抗癌剤又は癌治療法と組み合わせて使用する。また、本発明は親油性イノシトールグリカン化合物からなる抗糖尿病剤を提供し、これを単独で又は他の抗糖尿病剤又は抗糖尿病療法と組み合わせて使用する。更に、メタボリック症候群の治療に用いられる親油性イノシトールグリカン化合物を提供し、これを単独で又は肥満抑制やメタボリック症候群治療に用いられる他の薬剤又は治療法と組み合わせて使用する。
【課題を解決するための手段】
【0009】
上記親油性イノシトールグリカン(IG)化合物は、式I:
A−O1−B(I)
[式中、Aはグルコサミン及びガラクトサミンからなる群から選ばれるヘキソサミンであり;O1はアルファ1,6結合、アルファ1,3結合、又はアルファ1,2結合であり;Bはイノシトール、myo−イノシトール、chiro−イノシトール、scyllo−イノシトール、epi−イノシトール、cis−イノシトール、neo−イノシトール、muco−イノシトール、及びallo−イノシトールからなる群から選ばれる]で表される1以上の化合物から選択できる。B部分は互いに独立して任意にホスフェート、チオホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)で一置換又は二置換されていてよい。ある実施形態では、本発明の親油性イノシトールグリカン化合物は、1種以上の式II:
【化1】

[式中、O1はアルファ1,6結合及びアルファ1,3結合を表し;R1はホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)であり;R2はアルキル基(C1−22)又はアシル残基(O=C−C0−21)である]で表される化合物、並びにその機能性類似体及び異性体を包含する。本発明の治療的及び/又は機能的に活性な化合物として、式I及び式IIで表されるもの、並びにその異性体、塩、エステル、及び水和物等が含まれる。
【0010】
本発明のある実施形態では、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、他の薬剤又は治療法と併用する。他の態様においては、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、1種以上のアルキル−アシル−ホスファチジン酸(AAPA)化合物と併用することができる。アルキル−アシル−ホスファチジン酸(AAPA)は、IG−1のグリコシルホスファチジルイノシトール(GPI)前駆体を、GPI特異的ホスホリパーゼD(GPI−PLD)で加水分解することによって得られると考えられる物質である。好ましい実施形態では、AAPA化合物は、式III:
1−アルキル(C1−22)−2−アシル(O=C−C0−21)−sn−グリセロール−ホスフェート(III)
で表される化合物から選ばれる。AAPA化合物は、その塩、溶媒和物、及び生理的機能性誘導体も包含する。アルキル−アシル−ホスファチジン酸(AAPA)化合物の例としては、AAPA1(1−O−アルキル(18:0)−2−O−アシル−(18:0)−sn−グリセロール−ホスフェート)、AAPA2(1−O−アルキル(18:0)−2−O−アシル−(20:4)−sn−グリセロール−ホスフェート)、及びAAPA3(1−O−アルキル(18:0)−2−O−アシル−(22:4)−sn−グリセロール−ホスフェート)が挙げられるが、これらに限定されない。好ましい実施形態では、併用は相乗効果を示す。
【0011】
本発明の態様では、1種以上の親油性イノシトールグリカン化合物及び/又は1種以上のアルキル−アシル−ホスファチジン酸(AAPA)化合物を含む組成物を患者に投与することを含む。本発明の実施形態では、癌細胞の処置において相乗的な治療効果を示す、1種以上の親油性イノシトールグリカン化合物と1種以上のAAPA化合物との組み合わせを投与する方法を含む。「相乗的」とは、各薬剤を単剤療法で用いた場合の治療効果を足した合計よりも、優れた治療効果が得られることを示す。
【0012】
本発明の他の態様では、式I、II、及びIIIで表される化合物の合成方法を提供する。
【0013】
他の態様では、本発明は、有効量の親油性イノシトールグリカン化合物(或いはその機能性類似体又は異性体)を細胞に暴露して細胞増殖を抑制する方法を提供する。この細胞増殖は癌に関連するものであってよい。好ましい実施形態では、該細胞は対象の生体内に存在する。他の態様では、癌細胞の異常増殖を遅くする又は改善するために、本発明の化合物を1種以上使用してよい。
【0014】
本発明の他の態様では、治療有効量の本発明の化合物を、処置を必要とする対象に投与することによって、細胞増殖異常を治療、抑制、及び/又は改善する。この細胞増殖異常は良性腫瘍又は悪性腫瘍であってよい。特に細胞増殖異常は、癌腫(carcinoma)、肉腫(sarcoma)、リンパ腫、又は白血病であってよい。この方法の一実施形態においては、細胞増殖異常は癌であり、癌としては肺癌、骨癌、膵臓癌、皮膚癌、頭部又は頸部の癌、皮膚又は眼内の黒色腫、子宮癌、卵巣癌、直腸癌、肛門部癌、胃癌、結腸癌、乳癌、子宮癌、卵管癌、子宮内膜癌、頸部癌、膣癌、外陰癌、ホジキン病、食道癌、小腸癌、内分泌系癌、甲状腺癌、副甲状腺癌、副腎癌、軟組織肉腫、尿道癌、陰茎癌、前立腺癌、慢性又は急性の白血病、リンパ球性リンパ腫、膀胱癌、腎臓又は尿管の癌、腎細胞癌、腎盂癌、中枢神経系(CNS)の腫瘍、CNS原発リンパ腫、脊髄軸腫瘍、脳幹グリオーマ、下垂体アデノーマ、並びにこれら1種以上の組み合わせが挙げられるが、これらに限定されない。
【0015】
また、本発明の方法は、小細胞肺癌、非小細胞肺癌、食道癌、腎臓癌、膵臓癌、悪性黒色腫、膀胱癌、乳癌、結腸癌、肝臓癌、肺癌、肉腫、胃癌、胆管癌、中皮腫、又は前立腺癌からなる群から選ばれる癌の患者を治療することを包含する。この方法の他の実施形態においては、細胞増殖異常が良性増殖性疾患であり、該疾患としては乾癬、前立腺肥大症、及び再狭窄が挙げられるが、これらに限定されない。本発明の方法及び組成物を用いた治療に適する癌の例としては、前立腺癌、乳癌、膵臓癌、皮膚癌、結腸癌、前立腺癌、及び神経芽細胞腫が挙げられる。
【0016】
本発明の他の態様によれば、少なくとも1つの式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を細胞に暴露して、細胞増殖を抑制する方法が提供される。ある実施形態では、該細胞増殖は癌に関連する。この細胞は対象(好ましくは哺乳動物)の生体内に存在してよい。癌は例えば膵臓癌、乳癌、結腸癌、皮膚癌、又は前立腺癌であってよい。ある実施形態では、抗増殖特性を有する更なる第2の化合物を、同時又は連続的に細胞に暴露する。抗増殖特性を有する化合物の例としては、抗腫瘍薬、癌化学療法剤、及び抗増殖剤(レスベラトロール、ブチレート等)が挙げられるが、これらに限定されない。
【0017】
本発明は、更に式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を含有する治療用組成物を提供する。該組成物は、癌又は血管形成異常疾患を患う対象、或いはこれら疾患の疑いがある対象に投与できるように構成されている。好ましい実施形態では、親油性イノシトールグリカンを医薬組成物として調製する。この組成物は更に第2の抗増殖化合物を含有してよい。
【0018】
抗癌剤は癌細胞のアポトーシスを誘導する能力を有するのが望ましい。最小限の副作用で正常細胞に作用することなく癌細胞のアポトーシスを誘導する能力は、新規抗癌剤の開発において主要な目標である。本発明の開発過程で行った実験では、親油性イノシトールグリカンは細胞増殖を抑制し、癌細胞(ヒト膵臓癌細胞、ヒト肝臓癌細胞、ヒト胃癌細胞、ヒト結腸癌細胞、ヒト乳癌細胞等)の迅速死を誘導することが示された。一方で親油性イノシトールグリカンは正常細胞には作用しない。
【0019】
他の実施形態では、本発明は、治療有効量又は予防有効量の式I又は式IIの化合物を、薬学的に許容される添加剤、担体、又は賦形剤と共に、処置を要する患者に投与して、該患者の癌を治療又は予防する方法を包含する。
【0020】
他の態様では、本発明は、治療有効量又は予防有効量の式I又は式IIの化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、少なくとも1つの付加的な治療薬と共に、処置を要する患者に投与して、該患者の癌を治療又は予防する方法を包含する。好ましい実施形態では、治療有効量又は予防有効量の式I又は式IIの化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、1種以上の式(III)のAAPA化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)と併用する。この併用により相乗効果が得られる。他の実施形態では、この併用に、更に少なくとも1つの付加的治療薬を組み合わせて用いる。
【0021】
本発明の方法は、特に、1種以上の親油性イノシトールグリカン化合物と1種以上のAAPA化合物との組み合わせを癌患者に投与して、該患者を治療する方法を包含する。ある実施形態においては、投与する量は「有効量」であると考えてよい。当然ながら、「有効量」は、患者に1)親油性イノシトールグリカン化合物と2)AAPA化合物の両方を投与した際に、治療的有用性が得られるような量を意味する。勿論、患者には親油性イノシトールグリカンとAAPAを共に治療効果が得られると考えられる量だけ投与する。
【0022】
他の態様では、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)をグルコース代謝障害の治療に用いることができる。グルコース代謝障害としては、肥満、糖尿病、メタボリック症候群、インスリン抵抗症、耐糖能障害、高インスリン血症、X症候群、高コレステロール血症、高リポタンパク血症、高トリグリセリド血症、粥状動脈硬化症、及び糖尿病性腎症が挙げられるが、これらに限定されない。例えば、親油性イノシトールグリカン化合物はII型糖尿病の治療に有用である。II型糖尿病は、末梢組織のインスリン抵抗、膵臓ベータ細胞からのグルコース刺激によるインスリン分泌の障害、及び肝臓内グルコース新生の増加に関連する疾患である。実施例では、高脂肪食を与えたマウス及びSTZ糖尿病マウスにおける、親油性イノシトールグリカン化合物による脂肪細胞内の脂質生成の増加と血漿グルコース濃度の低下について示されている。更に、グルコース恒常性を制御するために親油性イノシトールグリカン化合物を使用することもできる。実施例に示すとおり、高脂肪食を与えたob/ob肥満マウス及びC57B/6マウスに親油性イノシトールグリカン化合物を与えて28日間処置を行った結果、1日摂食量、体重、並びにインスリン、トリグリセリド、遊離脂肪酸、及びレプチンの空腹時血漿濃度が大幅に低下した。
【図面の簡単な説明】
【0023】
【図1】本発明の親油性イノシトールグリカン化合物の一般式を示す図である。
【図2】本発明のアルキル−アシル−ホスファチジン酸化合物の一般式を示す図である。
【図3】図3Aは、無血清培地で1時間培養したPanc−1細胞中でIG−1(2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール)の乳酸産生阻害を示す棒グラフである。図3Bは、無血清培地で1時間培養したPanc−1細胞(ヒト膵臓癌細胞)中でIG−1がATP量に影響しない様子を示す棒グラフである。
【図4A】Panc−1細胞(ヒト膵臓癌細胞)に対するIG−1、レスベラトロール、及びブチレートの効果の比較、並びに1時間後にIG−1がPanc−1細胞の迅速死を誘起した様子を示す棒グラフである。
【図4B】Panc−1細胞(ヒト膵臓癌細胞)に対するIG−1、レスベラトロール、及びブチレートの効果の比較、並びに24時間後にIG−1がPanc−1細胞の迅速死を誘導した様子を示す棒グラフである。
【図4C】Panc−1細胞(ヒト膵臓癌細胞)に対するIG−1、レスベラトロール、及びブチレートの効果の比較、並びに3日後にIG−1がPanc−1細胞の迅速死を誘導した様子を示す棒グラフである。
【図5】PC3細胞(ヒト前立腺癌細胞)に対するIG−2(2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール−1−ホスフェート)、レスベラトロール、及びブチレートの効果の比較、並びに24時間後にIG−2がPC3細胞の迅速死を誘導した様子を示す棒グラフである。
【図6】3日間の処置後のヒト膵臓癌細胞(Panc−1)の死に対するIG−13(2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−1−パルミトイル−D−myo−イノシトール)、IG−14(2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−2−パルミトイル−D−myo−イノシトール)、IG−15(2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−1−パルミトイル−D−myo−イノシトール)、レスベラトロール、及びブチレートの効果を比較した棒グラフである。
【図7】エールリッヒ腹水癌細胞担癌ddYマウスにIG1及びアルキル−アシル−ホスファチジン酸(AAPA2)を7日間毎日投与した後のカプラン・マイヤー生存曲線である。
【図8】IG−1による1時間以内のヒト臍帯静脈内皮細胞迅速死に対するAAPA2の阻害効果を示す図である。
【図9】図9AはIG1を用いてインキュベートした3T3−L1脂肪細胞中のグリコーゲン合成の活性化を示す図である。図9BはIG1を用いてインキュベートした3T3−L1脂肪細胞中の脂質生成の活性化を示す図である。
【図10】IG−1及びIG−2の濃度に対する、ラットから単離した脂肪細胞中の脂質生成活性の関係を百分率で示した図である。
【図11】40μMのIG−1、IG−2、IG−13、IG−14、及びIG15を用いてインキュベートしたラット脂肪細胞の脂質生成活性化を示す図である。
【図12】図12AはIG15を用いてインキュベートした3T3−L1脂肪細胞中のグリコーゲン合成の活性化を示す図である。図12BはIG15を用いてインキュベートした3T3−L1脂肪細胞中の脂質生成の活性化を示す図である。
【図13】高脂肪食を与えたC57B/6マウスにIG1を静脈内投与した後、血漿グルコース濃度が経時的に低下する様子を示す図である。
【図14】ストレプトゾトシン(STZ)糖尿病マウスにIG1を静脈内投与した後、血漿グルコース濃度が経時的に低下する様子を示す図である。
【図15】高脂肪食を与えたC57B/6マウスにIG1を7日間腹腔内投与した後、耐糖能が経時的に改善される様子を示す図である。
【図16】STZ糖尿病マウスにIG1を7日間腹腔内投与した後、空腹時血漿グルコース濃度が経時的に改善される様子を示す図である。
【発明を実施するための形態】
【0024】
本発明の理解をより容易にするために、まず用語を定義する。
【0025】
本発明において、「癌の疑いがある対象(subject suspected of having cancer)」は、1種以上の癌の兆候(顕著なしこりや腫瘤等)を示す対象、又は癌の検査中(例えば定期検診中)の対象を表す。癌の疑いがある対象は1種以上の危険因子を有する場合がある。通常、癌の疑いがある対象は癌の検査を受けていない。しかしながら、「癌の疑いがある対象」は、予備的診断を受けて、例えばCTスキャンで腫瘤を示したが、確認検査(生検及び/又は組織検査等)を受けていない、或いは癌の病期が明らかでない個人を包含する。この語は、更にかつて癌を患った人(例えば寛解期の人)を包含する。「癌の疑いがある対象」は、時には癌と診断されることがあり、また癌ではないと判断される場合もある。
【0026】
本発明において、「癌と診断された対象(subject diagnosed with a cancer)」は、検査により癌性細胞を有すると判明した対象を表す。癌の診断にはいかなる適切な方法も用いてよく、その例としては生検、X線、血液検査、及び本発明の診断法が挙げられるが、これらに限定されない。「予備的診断」は、目視検査(例えば、CTスキャンやしこりの有無の確認)及び抗原検査の1つのみによるものである。
【0027】
本発明において、「対象(subject)」は免疫反応が誘発された生体を包含する。好ましい対象は哺乳動物である。対象の例としては、人間、猿、犬、猫、マウス、ラット、雌牛、馬、豚、山羊、及び羊が挙げられるが、これらに限定されない。
【0028】
本発明において、「親油性イノシトールグリカン」とは、式I:A−O1−B(I)で表される化合物、並びにその塩、溶媒和物、機能性類似体、及び生理的機能性誘導体を包含する。式I中、Aはグルコサミン及びガラクトサミンからなる群から選ばれるヘキソサミンであり;O1はアルファ1,6結合、アルファ1,3結合、又はアルファ1,2結合であり;Bはイノシトール、myo−イノシトール、chiro−イノシトール、scyllo−イノシトール、epi−イノシトール、cis−イノシトール、neo−イノシトール、muco−イノシトール、及びallo−イノシトールからなる群から選ばれる。B部分は互いに独立して任意にホスフェート、チオホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)で一置換又は二置換されていてよい。ある実施形態では、本発明の親油性イノシトールグリカン化合物は、1種以上の式IIで表される化合物、並びにその機能性類似体、塩、溶媒和物、及び生理的機能性誘導体を包含する。
【0029】
【化2】

式II中、O1はアルファ1,6結合及びアルファ1,3結合を表し;R1はホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)であり;R2はアルキル基(C1−22)又はアシル残基(O=C−C0−21)である。以下、本発明の親油性イノシトールグリカン化合物の典型例を表1に示す。
【0030】
【表1】

【0031】
本発明において、「アルキル」は脂肪族炭化水素基を表し、直鎖状であっても分岐鎖状であってもよい。鎖中に約1〜22個の炭素原子を含む。好ましいアルキル基は鎖中に1〜約14個の炭素原子を含む。「分岐鎖」は1つ以上の低級アルキル基(メチル、エチル、プロピル等)がアルキル直鎖に結合したものを意味する。「低級アルキル」は1〜約6個の炭素原子を含む直鎖又は分岐鎖を意味する。アルキルには1以上の「アルキル置換基」が置換していてよい。アルキル置換基は同じであっても異なっていてもよく、例としてはハロゲン、シクロアルキル、ヒドロキシ、アルコキシ、アミノ、カルバモイル、アシルアミノ、アロイルアミノ、カルボキシ、アルコキシカルボニル、アラルキルオキシカルボニル、又はヘテロアラルキルオキシカルボニル等が挙げられる。典型的なアルキル基としては、メチル、トリフルオロメチル、シクロプロピルメチル、シクロペンチルメチル、エチル、n−プロピル、イソプロピル、n−ブチル、1−ブチル、n−ペンチル、3−ペンチル、メトキシエチル、カルボキシメチル、メトキシカルボニルエチル、ベンジルオキシカルボニルメチル、及びピリジルメチルオキシカルボニルメチル等が挙げられる。
【0032】
本発明において、「アシル」はH−CO−基又はアルキル−CO−基を表す。好ましいアシル基としては、パルミトイル、低級アルキル、ホルミル、アセチル、プロパノイル、2−メチルプロパノイル、及びブタノイルが挙げられる。
【0033】
本発明において、「任意に(optionally)」とは、それに続けて述べる事象が生じてもよく、また生じる必要はないということを表し、その記載は当該事象が生じる場合及び生じない場合を共に包含する。
【0034】
本発明において、「生理的機能性誘導体」とは、本発明の化合物の薬学的に許容される誘導体を表し、例えば、哺乳動物に投与すると(直接的又は間接的に)本発明の化合物又はその活性代謝産物を供給できるエステル又はアミドが挙げられる。このような誘導体は、必要以上に実験を行わなくても、「Burger's Medicinal Chemistry and Drug Discovery」、第5版、第1巻「Principles and Practice」の教示を参照すれば当業者には明確である。該文献はこの参照により開示に含まれる。
【0035】
本発明において、「溶媒和物」は、様々な化学量論の溶媒と溶質(本発明では、式(I)又は式(II)の化合物、或いはその塩又は生理的機能性誘導体)の複合体を表す。本発明の目的に用いる溶媒は、溶質の生物学的活性を阻害しないと考えられる。適当な溶媒の例としては、水、メタノール、エタノール、及び酢酸が挙げられるが、これらに限定されない。好ましくは薬学的に許容される溶媒を用いる。適当な薬学的に許容される溶媒の例としては、水、エタノール、及び酢酸が挙げられる。最も好ましい溶媒は水である。
【0036】
式(I)又は式(II)の化合物は、複数の形態に結晶化できる性質を有してよい。このような性質は結晶多形と呼ばれ、全ての形態の結晶多形が式(I)、式(II)、式(III)、及び式(IV)の範囲に含まれる。通常、結晶多形は、温度、圧力、又はその両方の変化に応答して惹起され、また様々な結晶化プロセスの結果として生じることもある。結晶多形は当分野で知られる様々な物理的特性(X線回折像、溶解度、融点等)によって識別できる。
【0037】
本発明において、「置換(substituted)」は、単一又は複数の命名された置換基による置換を表し、特に明記しない限り多置換であってもよい。
【0038】
本発明において、「グルコース代謝障害」とは、グルコースの取り込み又は放出、更にはインスリンの発現、産生、分泌、又は使用に関連する疾患を表す。グルコース代謝障害は、肥満、糖尿病、メタボリック症候群、インスリン抵抗症、耐糖能障害、高インスリン血症、X症候群、高コレステロール血症、高リポタンパク血症、高トリグリセリド血症、粥状動脈硬化症、及び糖尿病性腎症からなる群から選択できるが、これらに限定されない。
【0039】
「類似体」とは、親化合物に似た構造を持ち、親化合物と同じ化学的性質又は薬理活性を有する化合物を表す。類似体としては、ホモログ(即ち、1個以上の炭素原子が親化合物と異なる類似体)、位置異性体、1個以上の原子を異なるものに変更した化合物(例えば、炭素原子を酸素原子、硫黄原子、又は窒素原子で置換したもの)、並びに1以上の官能基が異なる化合物(例えば、1以上の適当な置換基の有無が親化合物と異なる類似体)が挙げられるが、これらに限定されない。
【0040】
本発明において、「薬学的に許容される塩」は、標的対象(例えば、哺乳動物、及び/又は生体内若しくは生体外の細胞、組織、若しくは器官)において生理学的に許容される。本発明の化合物の塩(例えば酸又は塩基との反応で得られる)を表す。本発明の化合物の「塩」は、無機又は有機の酸や塩基から調製してよい。酸の例としては、塩酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、p−トルエンスルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、エタンスルホン酸、ギ酸、安息香酸、マロン酸、スルホン酸、2−ナフタレンスルホン酸、ベンゼンスルホン酸等が挙げられるが、これらに限定されない。本来それ自体は薬学的に許容されない他の酸(シュウ酸等)も、本発明の化合物又はその薬学的に許容される酸付加塩を得るための中間体として有用な塩の調製のために使用してよい。
【0041】
塩の例としては、酢酸塩、アジピン酸塩、アルギン酸塩、アスパラギン酸塩、安息香酸塩、ベンゼンスルホン酸塩、重硫酸塩、酪酸塩、クエン酸塩、樟脳酸塩、カンファースルホン酸塩、シクロペンタンプロピオン酸塩、二グルコン酸塩、ドデシル硫酸塩、エタンスルホン酸塩、フマル酸塩、フルコヘプタン酸塩、グリセロリン酸塩、ヘミ硫酸塩、ヘプタン酸塩、ヘキサン酸塩、塩化物、臭化物、ヨウ化物、2−ヒドロキシエタンスルホン酸塩、乳酸塩、マレイン酸塩、メタンスルホン酸塩、2−ナフタレンスルホン酸塩、ニコチン酸塩、シュウ酸塩、パモ酸塩、ペクチン酸塩、過硫酸塩、フェニルプロピオン酸塩、ピクリン酸塩、ピバル酸塩、プロピオン酸塩、コハク酸塩、酒石酸塩、チオシアン酸塩、トシル酸塩、ウンデカン酸塩等が挙げられるが、これらに限定されない。本発明の化合物の塩を治療に用いる場合、薬学的に許容されるように設計する。しかしながら、薬学的に許容されない酸と塩基の塩を使用してもよく、例えば薬学的に許容される化合物の調製又は精製に用いてよい。
【0042】
本発明において、「有効量」は、例えば研究者又は臨床医が求める、組織、器官、動物、又は人間の生物学的又は医学的な反応を誘発するような、薬物又は薬剤の量を意味する。例えば、有益又は望ましい結果をもたらすに十分な量を表す。更に、「治療有効量」は、そのような量を投与していない対象と比較して、疾病、障害、又は副作用の治療、治癒、予防、又は改善が向上するような、或いは疾患又は障害の進行速度を低下させるような、量を意味する。また、この語は、正常な生理的機能を増強するのに有効な量も包含する。有効量を1回又は複数回投与することができる。
【0043】
本発明において、「予防的有効量」は、癌等の病気や疾患、或いは癌の再発や転移を予防するのに十分な、本発明の化合物又は他の活性成分の量を表す。予防的有効量は、初期疾患又は疾患の再発や拡大を予防するのに十分な量を表す場合もある。この語は、好ましくは、予防効果全体を改善するような、或いは他の予防薬や治療薬の予防効果又は相乗効果を強化するような、毒性を示さない量を包含する。
【0044】
本発明において、「投与」は、薬物、プロドラッグ、又は他の薬剤、或いは治療法(放射線療法等)を、生体内、試験管内、又は生体外で、生理的な系(対象、細胞、組織、器官等)に与える行為を表す。例えば人体に投与する場合は、目(眼内)、口(経口)、皮膚(経皮)、鼻(経鼻)、肺(吸入)、口腔粘膜(口腔内)、耳、注射(静脈内、皮下、腫瘍内、腹腔内等)等の経路から投与してよい。
【0045】
「併用」は、複数の化学物質又は治療法を、生体内、試験管内、又は生体外で、生理系(対象、細胞、組織、器官等)に投与することを表す。化学物質や治療法を「併用」する際には、各々を同時に投与してもよく、いかなる時間的順序や物理的組み合わせで投与してもよい。各々の効果が相加的又は相乗的に発揮されるように薬剤を選択して投与してよい。
【0046】
親油性イノシトールグリカンの合成
親油性IG類:脂肪酸でアシル化されたイノシトール残基を有するグリコシルホスファチジルイノシトール(GPI)アンカーが動物から発見されている。このアンカーは、イノシトールがアシル化された遊離GPIと同様に、アシル化IG類(ホスフェート残基を持たないイノシトールグリカン)の前駆体として利用できる。GPI−PLCはアシル化イノシトール環を有するGPI類を開裂できないが、GPI−PLDはそれができる。更に、グリコシルホスファチジルイノシトール特異的ホスホリパーゼD(GPI−PLD)は、遊離GPI類を、GPI−PLC(ホスホリパーゼC)によって生成するIPG類に類似の生物学的活性を有するIGへと変換できる。例えば、これらは試験管内でPKA(プロテインキナーゼA)を阻害できる。しかしながら、IG又はGPIの構造(例えばアシル化イノシトール環の有無等)は、本発明以前には知られていなかった。
【0047】
【化3】

【0048】
13のような典型的なアシル化IG化合物、及びアシル化IPG化合物14を合成し、図面及び実施例に示すような生物学的活性を評価した。
【0049】
標的化合物13及び14の逆合成解析
典型的IG化合物13及び14は、完全に保護された化合物63及び68から得られる。糖化学分野では、ベンジルエーテルをアルコールの保護基として用いる。アミンの保護基としてはアジドを用いる。リン酸エステル68は63から順次得られる。
【0050】
スキーム1.化合物13及び14の逆合成解析
【化4】

【0051】
パルミチン酸エステル63の合成については既に報告されているが、本発明は、パルミトイル基を導入するために保護基の操作を含む異なるアプローチを開示する。解析により、ジオール64のアキシャルヒドロキシ基の選択的パルミトイル化を計画した。ジオール64も公知の化合物である。化合物64は、フッ化グリコシル65bとイノシトール残基ドナーである環状炭酸エステル66から合成した(カップリング反応の収率40%、ジオール脱保護の収率87%)。この炭酸エステルは容易に入手できるD−キシロース69から11工程で調製するが、クロマトグラフ精製は4回で済み、全収率は16%で、全ての反応をグラム量までスケールアップできた。
【0052】
スキーム2.イノシトール残基ドナー66の合成
【化5】

【0053】
既に報告されている公知のジオール64の合成方法は、多くの欠点を有する。
【0054】
スキーム3.ジオール64の最短合成
【化6】

【0055】
例えば、マーティン・ロマス(Martin-Lomas)合成では、第1中間体であるイノシトールとL−カンファーの光学活性ケタール(スキームには図示せず)の精製に手間がかかる(ディートリッヒ(Dietrich, H.)、エスピノーサ(Espinosa, J. F.)、キアラ(Chiara, J. L.)、ヒメネス・バルベロ(Jimenez-Barbero, J.)、レオン(Leon, Y.)、バレラ・ニエト(Varela-Nieto, I.)、マト(Mato, J. M.)、カノ(Cano, F. H.)、フォーセス・フォーセス(Foces-Foces, C.)、マルティン・ロマス(Martin-Lomas, M.)、ケミストリー・ア・ヨーロピアン・ジャーナル(Chem. Eur. J.)、1999、320〜336)。報告された他の合成法は更に不利である。目的のイノシトールドナーはいくつかの保護基の操作を必要とする工程を経て調製されるものである(コタズ(Cottaz, S.)、ブリマコブ(Brimacombe, J. S.)、ファーガソン(Ferguson, M. A. J.)、カーボハイドレート・リサーチ(Carbohydr. Res.)、1995、271、85〜91)。
【0056】
環状炭酸エステル66及びトリクロロアセチルイミデート65aを用いることとした。イノシトールドナー66を数種のフッ化グリコシルとカップリングしたところ、カップリング生成物(α及びβアノマー)のみが総収率50〜60%で得られた。また、6−S−ベンジル−6−チオ−6−デオキシ置換基を有するトリクロロアセトイミデートドナー65cを蛍光性IPG類似体の合成に用いて、カップリング生成物を得た。即ち、我々はトリクロロアセトイミデートドナーと環状炭酸エステルアクセプターのカップリングを拡張し、ドナー65aの反応性を確認した。
【0057】
更に他の方法では、ジエン72から容易に得られるアクセプター67を、カップリングドナー65aと反応させてジオール64を調製する。カップリング生成物73の二重結合をジヒドロキシル化できた。cis−アルケンは不斉ジヒドロキシル化反応の基質として理想的ではないと考えられる。しかし、アルケンにキラル置換基が存在すると、ある程度のジアステレオ選択性が得られると考えた。この方法は反応工程が少ないという利点がある。
【0058】
スキーム4.ジオール64の代替調製法
【化7】

【0059】
このように計画したイノシトールグリカン13及び14の合成が成功するか否かは、ジオール64のアキシャルヒドロキシル基の選択的パルミトイル化次第である。
【0060】
隣接ジオールの選択的モノアシル化方法
モノ−O−アシル化ジオール74の調製方法をスキーム5に要約して示す。上記3つの方法とは異なり、非対称ジオールのアキシャルヒドロキシ基のエステル化に方法D及びEを用いた。実際に方法Dを用いて、パルミトイル化GPI−アンカーの合成に用いるアシル化イノシトール構成要素を調製した。この合成では、エカトリアルヒドロキシル基の保護(アルキル化、75に類似の中間体を生成)、残存アルコールのエステル化、並びに脱保護を行った。方法Eでは、アルキル化により75を調製せず、中間体O−スタンニレン76を直接アシル化する。しかしながら、アキシャルヒドロキシル基のエステル化は、少数の例でしか観測されず、イノシトールの場合は起こらなかった。
【0061】
スキーム5.隣接ジオールの選択的モノアシル化
【化8】

【0062】
方法Eは、6員環が縮合したオルトエステル(77等)の加水分解が高い位置選択性を示すという観測結果に基づくものである。更に、この方法は非環式ジオールの位置選択的モノアシル化に適用できると考えられる。従って、64のパルミトイル化には環状オルトエステル法を選択したが、当業者はモノ−O−アシル化ジオールの調製に他の方法を選ぶこともできる。
【0063】
イノシトールグリカン13及びイノシトールホスフェートグリカン14の合成
トリクロロアセトイミデートドナー65aと環状炭酸エステル66のカップリングを行った。カップリング反応でTMSOTfを用いてアクセプターをシリル化できることが知られているため、促進剤としてTfOHを選択した。また、TfOHをより弱いドナー(即ち、より電子吸引性が高い基を有するドナー)と共に用いると、カップリング反応で高いα選択性が得られるという前例があった。
【0064】
スキーム6.トリクロロアセトイミデートドナー65aとアクセプター66のカップリング
【化9】

【0065】
2:1の適度なα:βアノマー比の二糖78を計62%の収率で得た。65cを用いた場合と比べて収率は高かった。しかしながら、フッ化物65bに替えてトリクロロアセトイミデートを用いても、カップリング生成物の収率は向上しなかった。65cを用いた場合はおそらく硫黄原子が副反応を引き起こしたと判断した。興味深いことに、79のような構造と考えられる化合物が反応混合物から単離された。なお、二糖78の各アノマーの分離は非常に困難であることが分かった。しかしながら、環状炭酸エステルの加水分解(スキーム7)によって得られる、対応するジオール64α(以下、本明細書において64と表す)と64βは分離しやすい。加水分解はアノマーを分離しなくても行うことができる。貴重な64のエステル化を試す前に、モデル化合物17をトリメチルオルトパルミテート80と反応させた。ジオール17は、ほぼ定量的な収率で81と82の6:1混合物へと変換された(スキーム8の方法A)。環状オルトエステル中間体の加水分解における(+)−カンファースルホン酸単独での効果(MeCN−DCM混合物中)についても詳細に調べた(方法B)。
【0066】
スキーム7.環状炭酸エステル78α及び78βの加水分解
【化10】

【0067】
スキーム8.モデルジオール17のパルミトイル化
【化11】

【0068】
このような条件下で、パルミチン酸エステルの位置異性体を収率93%、異性体比は3.6:1で得た。また、副生成物(カンファースルホン酸メチルと判明)から主要な異性体(81)を分離する際に問題が生じることが分かった。他の触媒としてp−トルエンスルホン酸ピリジニウムを使用したところ(方法C)、81と82が計94%の収率で得られた。パルミチン酸エステルのアキシャル:エカトリアル比は、8.2:1と最も高かった。
【0069】
PPTS触媒によるジオール64のパルミトイル化を試したところ、出発物質の変換は非常に遅かった。(+)−CSAによって反応を加速させることができる。他の実験ではカンファースルホン酸のみを触媒として用いた。この反応では、63と83の混合物が92%の収率で得られた。生成物の比は3.6:1で得られた。上述のモデルジオール17を出発物質として用いた場合と同じ比が得られたことから、グルコサミン残基は位置選択性に影響しなかったと考えられる。様々なアゾール誘導体の酸性塩による加水分解を行って、位置選択性を調べることができる。これは、酸/アゾール複合体がホスホロアミダイトとアルコールの縮合の効率に及ぼす効果の研究に類似している。
【0070】
スキーム9.ジオール64のパルミトイル化
【化12】

【0071】
化合物81をモデル物質として用いて、ホスホロアミダイト法を用いたO,O−ジベンジル−N,N−ジイソプロピルアミノホスホロアミダイトによるホスホリル化反応(及びそれに続く亜リン酸エステルのリン酸エステルへの酸化)を行った。この反応の成否は反応溶媒に強く依存する。オリゴ糖の合成では、亜リン酸エステル形成を促進するために通常はテトラゾールのアセトニトリル溶液を用いる。しかしながら、市販又は自作のテトラゾールアセトニトリル溶液を用いて81のホスホリル化を行ったところ、アルコールはある程度しか亜リン酸エステルへ変換されなかった。反応混合物から完全にアセトニトリルを除去すると、完全に変換された。市販のテトラゾールMeCN溶液には水が残留している。本研究では、テトラゾール溶液調製用のアセトニトリルを活性化Al2O3カラムを通して乾燥した。
【0072】
スキーム10.モデル81のリン酸エステル化
【化13】

【0073】
アルコール63を同様の条件下で反応させた。予想外に、所望のリン酸エステル68の収率は良くなかった(65%)。形成されたリン酸エステルとアジドとの分子内環化が進行した可能性がある。亜リン酸エステル形成後にたまたま反応混合物を23℃で5時間放置したところ、実際に45%の収率で環化生成物(ジアステレオマーの1つ)が単離された(68の収率は24%)。これは環化速度が非常に遅いことを意味し、68の収率が低いことの説明となる。活性化された84がイノシトール環のOH基と反応するのとほぼ同じ速度で、63のアジド基がホスホロアミデート84と反応した可能性がある。
【0074】
スキーム11.63のリン酸エステル化の生成物
【化14】

【0075】
最終的に63のベンジル基を全体的に除去するのは困難であることが分かった。ベンゼン環の水素化が観測されたり、多量のN−メチル化生成物が検出されたりといった失敗(データは図示せず)を何度か繰り返した後、適当な条件を発見した。高い水素圧力(70バール)下、クロロホルムメタノール中で、Pd/C触媒下で化合物63を13へと完全に変換した。脱ベンジル化を十分に行うためには溶媒比及び溶媒/基質比と同様に非常に重要であることが分かった。幸運なことに、新たに発見した条件下で化合物68は完全に脱保護され、純粋な14を得た。
【0076】
スキーム12.イノシトールグリカン13及び14の合成の最終工程
【化15】

【0077】
63の合成:ジヒドロキシル化法
スキーム4に示す計画に従って、アリルアルコール67とトリクロロアセトイミデート65aのカップリングを検討した。トリクロロアセトイミデート法を用いたアノマー結合形成の選択性を制御する方法としては、(隣接基の関与の他に)少なくとも2つの方法が考えられる。
【0078】
スキーム13:67のグリコシル化
【化16】

【0079】
通常、Et2O溶媒中でTMSOTfを触媒として用いてカップリング反応を行うと、α−アノマーの選択的形成が観測される。実際にエントリー番号1の結果はこれに一致している。
【0080】
特にα−トリクロロアセトイミデートには他の立体制御法を用いる。アルコールとの反応は非極性溶媒中でBF3・Et2O触媒を用いて行い、この反応はSN2的経路で進行し、高いβ選択性を示す。本発明より前には、α−グリコシド結合を選択的に形成する目的でβ−トリクロロアセトイミデートを用いた例は無かった。このような変更を試みた結果をエントリー番号2に示す。この反応条件はβ異性体の形成に適していることが分かった。興味深いことに、生成した73βの量(モル)は、反応に用いたβ−イミデートの量(27.7モル%)よりも僅かに多い。α−イミデートの多くは73βに変換され、このイミデート異性体から過剰のβ生成物が得られたと考えられる。同時に、生成した73の量は、反応に用いたβ−イミデートの量よりもかなり少ない(17対72.3モル%)。更にかなりの量のフッ化物87が生成した。この反応のメカニズムについては殆ど解っていないが、フッ化物イオン源はBF3・Et2O中のHF不純物ではないと考えた。これら結果を総合すると、β−65aをBF3・Et2O触媒によるSN2型グリコシル化に用いるのは好ましくないことが分かる。
【0081】
TMSOTfに替えてTfOHを用いた場合の結果をエントリー番号3〜5に示す。この場合は僅かに収率が向上した。低温では73の収率が低下した(エントリー番号5)ことから、加熱により収率が向上する可能性がある。
【0082】
グリコシル化の収率を最適化した後、化合物73のジヒドロキシル化を試みた(スキーム14)。当初用いた触媒条件下ではジヒドロキシル化は進行しなかった(エントリー番号1〜3)。OsO4とアミンの複合体(アミン=ピリジン又は(DHQ)2PHAL)をアルケン73に添加すると反応が容易に進行することが分かった。しかしながら、形成されたオスミウム酸エステルの加水分解は、不斉ジヒドロキシル化に通常用いられる条件下(K2CO3、tBuOH/H2O)では非常に遅かった。出発物質のtBuOHへの溶解度が限られているため反応性が低くなったと考えられる。約30mgのスケールで反応を試みた際に(エントリー番号2)、このことが明らかとなった。他の実験では反応混合物に共溶媒としてTHFを加えた(エントリー番号3)。効果は同様であった。形成されたオスミウム酸エステルを加水分解する際の良好な条件を得るために、1当量のOsO4及び小過剰のアミン配位子を用いてジヒドロキシル化反応を化学量論的に検討した。NaHSO3/Py/H2O混合物は、親油性ジオールのオスミウム酸エステル(ピリジンと複合体を形成)の加水分解に有効である。実際は、(DHQ)2PHAL及びピリジンと複合体を形成したオスミウム酸エステルの加水分解には有効であったが、ジオールジアステレオマーの収率は変動が大きかった(エントリー番号4及び5)。アジドが部分的に還元されたと考えられる。亜硫酸水素ナトリウム自体は非常に有効であった(エントリー番号6)。より強い塩基性条件(LiOH/MeOH/THF、myo−イノシトールに添加)で加水分解を行うと、反応は非常に速かったものの、ジオールの収率はあまり良くなかった(エントリー番号7)。立体障害のあるアルケンの触媒的ジヒドロキシル化を加速する目的では、キヌクリジン((DHQ)2PHALの親化合物)よりもDABCOが好ましい場合がある。エントリー番号8は、塩基による加水分解においてDABCOを添加すると反応が加速したことを示す。
【0083】
スキーム14.アルケン73のジヒドロキシル化
【化17】

【0084】
細部をもう一点検討した。反応混合物のpH低下に比例してジヒドロキシル化が遅くなると予想されたため、実験番号3では過剰量のK2CO3を使用した。対して実験番号9ではK2CO3を3当量のみ使用した。この条件下でのジヒドロキシル化が最も有効であった。炭酸カリウムを3当量のみ添加した場合に反応結果が変化するか否かを確認するために、事例番号3に似た条件での対照実験を行った。約20時間後、約60%の変換が観測された。この時点で1当量のNaOHを加えた。TLCにより更なる反応の進行が観測されたが、アミン、四酸化オスミウム、及びNaOHを追加しても出発物質が完全に変換されることはなかった。従って、この触媒的ジヒドロキシル化には、適切な溶媒の組み合わせと反応溶媒のイオン強度が重要であると考えられる。
【0085】
生成したジオールを互いに分離するのは困難であった。従って、純粋な64のエステル化と同じ条件下で、64と88の混合物をパルミトイル化した。4種のパルミチン酸エステルの分離には非常に手間がかかることが分かった。ある程度純粋な63(カンファースルホン酸メチルエステルが混入している場合がある)と89を1本のフラッシュクロマトグラフィーカラムで分離することができたが、2種の少量異性体83及び90の分離には更なる精製が必要であった。63と83をそれぞれ別に合成したため、生成物中のこれら化合物は容易に同定できた。化合物89及び90は、1H−NMRスペクトル中の特徴的なイノシトール環水素原子の信号に基づいて互いに区別した。化合物89では、エカトリアル水素原子H−2(スキーム15に太字で示す)と同じ炭素に結合したヒドロキシル基がエステル化されている。その結果、H−2の信号は高磁場(δ=5.72)側にシフトする。対称的に、90ではH−2の信号は4.24ppmに見られる。
【0086】
スキーム15.単一化合物からの4−パルミトイル化IG前駆体の合成
【化18】

【0087】
スキーム16.イノシトールグリカン13の異性体の合成
【化19】

【0088】
全てのパルミチン酸エステルを分離したことで、73のジヒドロキシル化のジアステレオ選択性をはっきりと決定することが可能となった。89及び90に対する63及び83の比率は1に非常に近かった。73のキラル中心がジアステレオ選択性を誘導することはなかった。
【0089】
63と同じ条件下でパルミチン酸エステル83、89、及び90を脱ベンジル化することに成功し、化合物63の異性体を得た(スキーム16)。
【0090】
典型的親油性イノシトールグリカン化合物の合成を達成した。パルミチン酸エステル残基の存在によって、63及び68の脱ベンジル化には高圧や適当な溶媒及び基質濃度といった特別な条件が必要とされた。
【0091】
環状オルトエステル(スキーム5の77等)の位置選択的開裂にPPTSは用いなかった。17を出発物質として用いた場合にはPPTS触媒により最も高い選択性が得られたが、この触媒は二糖64の反応には効果的ではなかった。
【0092】
IG前駆体63を得るための新規経路を開発した。2つの重要工程であるグリコシル化及びジヒドロキシル化を最適化した。ここで、所望のジオール64を得るのに適したジヒドロキシル化は本質的にはジアステレオ選択的ではないが、共通前駆体72からの64の収率は上述した目的物質志向の合成と比較してやや高い(23%対17%)。とはいえジアステレオ選択性の改善の余地はある。例えば、他のキラルアミン(特にDHQ−IND又はDHQD−IND)を用いてジヒドロキシル化するのが望ましい。cis−アルケンにこのようなアミンを用いると、他の配位子と比較して最も高いeeが得られることが分かっている。DABCO自体は73のジヒドロキシル化に非常に有効であった。このアミンによりある程度のエナンチオ選択性が得られた(約25%)。
【0093】
スキーム17.ジオール64調製の代替法の開発
【化20】

【0094】
スキーム18.脱ヒドロキシル化用に選択したキラル配位子
【化21】

【0095】
chiro−イノシトールを含むイノシトールグリカンの前駆体として、アルケン73を使用できる。本発明で開示する化学技術は、単一又は複数のマンノースで置換されたグルコサミンを含むパルミトイル化オリゴ糖の合成に使用できる。例えば、開示の方法を用いてβ−(1→46結合)グリコシド結合構造を有するパルミトイル化二糖(即ち13のβ異性体等)を合成できる。
【0096】
医薬組成物
本発明の式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、実質的に如何なる方法でも投与でき、また同時又は連続的に投与できる。他の実施形態では、親油性イノシトールグリカン化合物を、経皮貼布剤を用いて経皮投与できる。
【0097】
式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、癌に関連する細胞増殖を治療又は予防する、或いはその進行を遅くする目的で、治療的に投与できる。また、癌に関連する細胞増殖から保護する、或いは他の疾患に関連する細胞増殖の発現を避ける又は未然に防ぐ目的で、予防的に投与できる。例えば、癌と診断された患者又は癌発症の危険性がある患者における癌の進行を抑制又は停止するために、親油性イノシトールグリカン組成物を予防的に投与することができる。
【0098】
式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、様々な経路又は方法により対象に投与できる。適当な投与方法としては、経口吸入投与、経鼻吸入投与、経皮投与、経口投与、直腸投与、経粘膜投与、腸内投与、並びに非経口投与(筋内注射、皮下注射、静脈内注射等)が挙げられるが、これらに限定されない。式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、同じ又は異なる方法で投与できる。例えば、親油性イノシトールグリカン化合物と薬学的に許容される塩又は水和物を経口投与することができる。また、経皮貼布やエアロゾル製剤を用いて経鼻吸入によって投与することができ、ナノカプセル又はマイクロカプセル製剤として投与することもできる。親油性イノシトールグリカン化合物をクモ膜下投与又は脳室内投与することもできる。
【0099】
式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を様々に組み合わせて投与できる。例えば、IG1とその類似体の組み合わせ、IG2とその類似体の組み合わせ、IG1とIG2の組み合わせ、それらの様々な類似体の組み合わせを投与してよい。加えて、この化合物を他の治療薬と組み合わせて投与することもできる。勿論、本発明の組成物と併用可能な治療薬は、治療する症状に応じて選択される。例えば、本発明の化合物を、癌や関連する他の症状や副作用に用いられる他の薬剤との混合物の形態で投与することができる。
【0100】
式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、各化合物単独で製剤することができ、同種の化合物(例えば2種の異なる類似体又は異性体)の混合物として製剤することもできる。また、異なる親油性イノシトールグリカン化合物(例えばIG1、IG2、IG13、IG14、及びIG15のうち1種以上)の混合物として製剤することもできる。通常、このような組成物は、薬学的に許容される塩又は水和物として調製した親油性イノシトールグリカン化合物を含有する。
【0101】
本発明で用いる医薬組成物は、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)の効果を更に促進する生理学的に許容される担体、添加剤、希釈剤、又は賦形剤のうち1以上を用いて、従来法により調製できる。製剤の形態は投与経路に応じて選択する。
【0102】
このような製剤は、埋め込み(implantation)又は皮膚下送達(皮下、筋内等)、筋内注射、又は経皮投与できる。例えば、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、適当なポリマー材料又は疎水性材料(使用可能な油中の乳剤等)或いはイオン交換樹脂と共に製剤化してよい。
【0103】
化合物の経皮投与に適した製剤については、米国特許第5,725,876号、同第5,716,635号、同第5,633,008号、同第5,603,947号、同第5,411,739号、同第5,364,630号、同第5,230,896号、同第5,004,610号、同第4,943,435号、同第4,908,213号、及び同第4,839,174号に記載されており、これら特許はこの参照により開示に含まれる。薬学的に許容される塩又は水和物は、親油性イノシトールグリカン化合物として容易に吸収され、細胞膜及び血液脳関門を通過する。このような製剤はいずれも通常の方法により経皮投与に適した形態とすることができる。
【0104】
注射する場合は、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、生理学的に適切な水溶液の形態(ハンクス液、リンゲル液、又は生理食塩水緩衝液等)で用いてよい。経粘膜投与する場合は、透過すべき障壁に適した浸透剤を製剤に用いる。このような浸透剤は当該分野で広く公知である。
【0105】
経口投与する場合は、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、当該分野で広く知られている薬学的に許容される担体と組み合わせて製剤してよい。このような担体を用いることで、本発明の化合物を患者の経口摂取に適した錠剤、丸薬、ガム、糖衣錠、カプセル、液体、ゲル、シロップ、スラリー、懸濁液等の製剤に使用できる。或いは、化合物をキャンディー、クッキー、又は他の食品の形態に製剤化することもできる。経口用薬剤は、本発明の化合物を固体賦形剤と混合し、得られた混合物を任意にすり潰し、必要に応じて他の適当な助剤を加え、粒状混合物を錠剤や糖衣錠核部に加工して調製できる。適当な賦形剤としては、増量剤(乳糖、スクロース、マンニトール、ソルビトールのような糖類等)、セルロース類(トウモロコシデンプン、小麦デンプン、米デンプン、ジャガイモデンプン、ゼラチン、トラガカントゴム、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム等)、及びポリビニルピロリドン(PVP)が挙げられるが、これらに限定されない。必要に応じて、架橋ポリビニルピロリドン、寒天、アルギン酸、これらの塩(アルギン酸ナトリウム等)のような崩壊剤を加えてもよい。
【0106】
濃縮糖溶液を使用してよく、該溶液は任意にアラビアゴム、タルク、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコール、又は二酸化チタン、ラッカー溶液、及び適当な有機溶媒又は混合溶媒を含有してよい。活性化合物を識別するため、又は異なる組み合わせの活性化合物服用物を特徴付けるために、錠剤や被覆物に染料又は顔料を加えてもよい。
【0107】
経口使用可能な医薬組成物として、ゼラチンからなる押し込み型カプセルや、ゼラチン及び可塑剤(グリセロール、ソルビトール等)からなるソフト封入カプセルが挙げられる。押し込み型カプセルは本発明の化合物を含む混合物を含有してよく、更に充てん剤(乳糖等)、結合剤(デンプン等)、滑沢剤(タルク、ステアリン酸マグネシウム等)、又は安定化剤を含有してよい。ソフトカプセル内では、本発明の化合物が適当な液体(脂肪油、液体パラフィン、液体ポリエチレングリコール類等)中に溶解又は懸濁していてよい。ソフトカプセル製剤には安定化剤を加えてもよい。経口投与用製剤はいずれも投与に適した用量で製剤するべきである。
【0108】
口腔投与する場合は、公知の方法で調製した経口スプレー、錠剤、ガム、又はトローチ剤の形態の組成物を使用できる。治療用化合物(或いは薬学的に許容される塩又は水和物)の経口投与又は口腔投与に適したキャンディー型の製剤については米国特許第6,083,962号に記載されており、該文献はこの参照により開示に含まれる。治療用化合物の経口投与又は口腔投与に適した他の製剤については、米国特許第5,939,100号、同第5,799,633号、同第5,662,920号、同第5,603,947号、同第5,549,906号、同第D358,683号、同第5,326,563号、同第5,293,883号、同第5,147,654号、同第5,035,252号、同第4,967,773号、同第4,907,606号、同第4,848,376号、及び同第4,776,353号に記載されており、これらはこの参照により開示に含まれる。これら製剤はいずれも通常の方法により親油性イノシトールグリカン化合物(或いは薬学的に許容される塩又は水和物)の投与に適した形態とすることができる。
【0109】
吸入又は注入(inhalation又はinsufflation)用の組成物としては、薬学的に許容される水性溶媒、有機溶媒、又はそれらの混合物を用いた溶液及び懸濁液、並びに粉末が挙げられる。組成物を呼吸器経路(経口又は経鼻)で投与し、局所的又は全身的に作用させるのが好ましい。吸入により経口又は経鼻投与する場合は、本発明の化合物をエアロゾルスプレーの形態で簡便に送達する。エアロゾルスプレーは、加圧パック又は噴霧器を用いて適当な噴射剤(二酸化炭素や他のガス等)と共に使用してよい。加圧エアロゾルの場合、一回服用量測定バルブを用いて用量単位を制御できる。本発明の化合物と適当な粉末基材(乳糖、デンプン等)の混合粉末を含有する、ゼラチン等からなるカプセルやカートリッジを調製し、吸入器(inhaler又はinsufflator)に用いてもよい。経鼻吸入に適した製剤は当該分野で広く知られている。例えば、式(I)又は式(II)の親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)、水溶性希釈剤(有機酸等)、及び増粘剤(天然ポリマー、合成ポリマー、乳剤の油相を有する油状物質等)を含有する経鼻エアロゾルスプレーを使用してよい。気化器を用いて、本発明の式(I)又は式(II)の親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を大量に含む蒸気を送達して投与してもよい。この気化器は電池で駆動でき、細胞(肺細胞等)の増殖を抑制する効果を示す親油性イノシトールグリカン化合物を一定量だけ送達できるように設計できる。薬学的に許容される無菌溶媒中の本発明の化合物を、不活性ガスを用いて噴霧してもよい。霧状になった溶液を噴霧器から直接吸ってよく、また噴霧器をフェイスマスク、テント、又は間欠的陽圧呼吸器に取り付けてもよい。
【0110】
注射により投与する場合は、本発明の化合物を界面活性剤(又は湿潤剤若しくは界面活性剤)と共に製剤化してよく、或いは乳剤(油中水型乳剤又は水中油型乳剤)の形態で使用してもよい。適当な界面活性剤としては、ポリオキシエチレンソルビタン類(Tween(商標)20、40、60、80、85等)や他のソルビタン類(Span20、40、60、80、85等)のような非イオン性界面活性剤が挙げられるが、これらに限定されない。界面活性剤を用いた組成物は、0.05〜5%、好ましくは0.1〜2.5%の界面活性剤を含有してよい。勿論、必要に応じてマンニトールや他の薬学的に許容される賦形剤といった他の成分を添加してもよい。
【0111】
市販の脂肪乳剤を用いて適切な乳剤を調製することができる。市販の脂肪乳剤としては、イントラリピド(Intralipid)、リポシン(Liposyn)、インフォニュトロール(Infonutrol)、リポファンジン(Lipofundin)、リピフィサン(Lipiphysan)等がある。活性成分を予混合乳剤組成物に溶解してよく、油(大豆油、紅花油、綿実油、胡麻油、トウモロコシ油、扁桃油等)に溶解してもよく、或いは水及びリン脂質(卵リン脂質、大豆リン脂質、大豆レシチン等)を混合して調製した乳剤に溶解してもよい。勿論、乳剤の粘張力を調整するために、グリセロールやグルコース等の他の成分を添加してもよい。通常、適当な乳剤は20%以下、例えば5〜20%の油を含む。脂肪乳剤は0.1〜1.0μm(特に0.1〜0.5μm)の脂肪滴を含有するのが好ましく、5.5〜8.0のpHを有するのが好ましい。
【0112】
式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、大量投与注射、持続注入等の非経口注射投与用の製剤に用いてもよい。注射用の製剤は、例えばアンプルや複数回投与用容器中に単位用量に分け、任意に保存料を加えたものであってよい。このような組成物は油性又は水性の賦形剤を用いた懸濁液、溶液、又は乳剤であってよく、また懸濁剤、安定化剤、分散剤等の製剤材料を含有してよい。
【0113】
非経口投与用の医薬組成物においては、本発明の化合物を水溶性の形態で使用し、これを水溶液に用いてよい。また、本発明の化合物の油性注射懸濁液を調製してもよい。適当な親油性の溶媒又は賦形剤としては、脂肪油(胡麻油等)、合成脂肪酸エステル(オレイン酸エチル、トリグリセリド類等)、リポソーム等が挙げられる。水性注射懸濁液は、カルボキシメチルセルロースナトリウム、ソルビトール、デキストランといった、懸濁液の粘度を増加させる物質を含有してよい。また、懸濁液は適当な安定化剤又は本発明の化合物の溶解性を増加させ高濃度溶液の調製を可能とする薬剤を任意に含有してよい。
【0114】
必要に応じて、経口投与用の用量単位製剤をマイクロカプセル化してよい。例えば粒子材料をポリマーやワックス等で被覆又は包埋することによって、放出を延長又は持続する製剤を調製することができる。
【0115】
或いは、使用前の式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を粉末の状態とし、適当な賦形剤(発熱物質を含まない滅菌水等)と共に製剤化してもよい。
【0116】
式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、坐剤や停留かん腸剤等の直腸投与用組成物として製剤してもよい。このような組成物は、例えばココアバター、他のグリセリド類等の従来の坐剤基材を含有する。
【0117】
医薬組成物は適当な固体相又はゲル相の担体又は賦形剤を含有してもよい。このような担体又は賦形剤の例としては、炭酸カルシウム、リン酸カルシウム、種々の糖類、デンプン類、セルロース誘導体、ゼラチン、ポリマー(ポリエチレングリコール等)等が挙げられるが、これらに限定されない。
【0118】
有効用量
本発明で好適に用いられる医薬組成物は、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、有効量、即ち目的(例えば細胞増殖又は癌の治療、予防、又は抑制)を達成するに十分な量だけ含有する。本発明の化合物の治療有効量は多くの要因に依存すると考えられ、このような要因としては、動物の年齢及び体重、治療を要する正確な症状及び重篤性、製剤の特性、投与経路等が挙げられる。最終的には治療有効量は担当の医師又は獣医が判断すると考えられる。当業者は有効量を決定できる。式(I)で表される化合物の腫瘍成長(結腸癌、乳癌等)治療用の1日有効量は、対象(哺乳動物)の体重1kgあたり通常は0.1〜100mgであり、より一般的には1〜10mgであると考えられる。即ち、対象が70kgの成体哺乳動物の場合、実際の1日用量は通常70〜700mgであると考えられる。1日総投与量を1回で投与してよいが、より一般的には同じ量を複数回(2回、3回、4回、5回、又は6回)に分けて投与してもよい。塩、溶媒和物、又は生理的機能性誘導体の有効量は、式(I)の化合物自体の有効量との割合で決定できる。上述した他の症状を治療する場合も、適切な用量は類似していると予想される。
【0119】
本発明の化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、それぞれ単独で使用してもよく、或いは上記症状用の他の治療薬と組み合わせて使用してもよい。特に抗癌治療では、外科的治療や放射線治療のほか、化学療法、ホルモン剤、抗体等との併用が考えられる。即ち、本発明による併用療法は、少なくとも1種の式(I)で表される化合物(或いはその薬学的に許容される塩、溶媒和物、生理的機能性誘導体)の投与と、少なくとも1種の他の癌治療法の使用を含む。好ましくは、本発明の併用療法では、少なくとも1種の式(I)で表される化合物(或いはその薬学的に許容される塩、溶媒和物、生理的機能性誘導体)と、少なくとも1種の薬学的に活性な薬剤(好ましくは抗腫瘍薬)とを投与する。1種以上の式(I)の化合物と1種以上の他の薬学的に活性な薬剤とを、一緒に又は別々に投与してよい。別々に投与する場合は、同時に投与してよく、またいかなる順序で連続的に投与してもよい。式(I)の化合物と他の薬学的に活性な薬剤の量、及びその投与時期は、所望の併用治療効果が得られるように選択すればよい。
【0120】
ある実施形態では、式(I)又は式(II)で表される親油性イノシトールグリカン化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、1種以上の式(III)で表されるアルキル−アシル−ホスファチジン酸(AAPA)化合物と併用することができる。アルキル−アシル−ホスファチジン酸(AAPA)化合物の例としては、AAPA1(1−O−アルキル(18:0)−2−O−アシル−(18:0)−sn−グリセロール−ホスフェート)、AAPA2(1−O−アルキル(18:0)−2−O−アシル−(20:4)−sn−グリセロール−ホスフェート)、及びAAPA3(1−O−アルキル(18:0)−2−O−アシル−(22:4)−sn−グリセロール−ホスフェート)が挙げられるが、これらに限定されない。好ましい実施形態では、この併用によって相乗効果が得られる。本発明は、1種以上の親油性イノシトールグリカン化合物及び/又は1種以上のアルキル−アシル−ホスファチジン酸(AAPA)化合物からなる組成物の患者への投与を包含する。
【0121】
式(I)及び/又は(II)で表される化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、少なくとも1種の更なる癌治療法と組み合わせて、付随的に又は連続的に使用してもよい。治療上適当であれば、いかなる抗癌治療との組み合わせも利用できる。ある実施形態では、式(I)の化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)を、少なくとも1種のAAPA化合物及び少なくとも1種の付加的癌治療法の両方と併用することができる。ある実施形態では、この他の抗癌治療が、少なくとも1種の抗腫瘍薬を投与する少なくとも1種の付加的化学療法を含む。式(I)の化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)と他の抗腫瘍薬を併用する場合、(1)両方の化合物を含有する単一の医薬組成物、又は(2)それぞれ一方の化合物を含有する分離した医薬組成物の形態で、付随的に投与してよい。また、まず一方の抗腫瘍薬を投与し続いて他方を投与するという手法、又はその逆の手法で、この組み合わせを別々に連続して投与してもよい。このような連続的投与の時間的間隔は長くても短くてもよい。
【0122】
抗腫瘍薬は細胞周期特異的に抗腫瘍作用をもたらす場合がある。即ち、ある抗腫瘍薬は周期特異的であり細胞周期における特別な周期に作用する。或いは、抗腫瘍薬はDNAに結合して非細胞周期特異的に作用する場合がある。即ち、ある抗腫瘍薬は非細胞周期特異的であり、他のメカニズムで作用する。
【0123】
式Iの化合物(或いはその塩、溶媒和物、又は生理的機能性誘導体)との併用に適した抗腫瘍薬として以下のものが挙げられるが、それらに限定されない。
【0124】
(1)細胞周期特異的抗腫瘍薬
パクリタキセル、その類似体ドセタキセル等のジテルペノイド類;ビンブラスチン、ビンクリスチン、ビンデシン、ビノレルビン等のビンカアルカロイド類;エトポシド、テニポシド等のエピポドフィロトキシン類;5−フルオロウラシル、フルオロデオキシウリジン等のフルオロピリミジン類;アロプリノール、フルダラビン、メトトレキサート、クラドラビン、シタラビン、メルカプトプリン、チオグアニン等の代謝拮抗物質;及び9−アミノカンプトセシン、イリノテカン、CPT−11、7−(4−メチルピペラジノメチレン)−10,11−エチレンジオキシ−20−カンプトセシンの種々の光学形態等のカンプトセシン類が挙げられるが、これらに限定されない。
【0125】
(2)細胞毒性化学療法剤
メルファラン、クロラムブシル、シクロホスファミド、メクロレタミン、ヘキサメチルメラミン、ブスルファン、カルムスチン、ロムスチン、ダカルバジン等のアルキル化剤;ドキソルビシン、ダウノマイシン、エピルビシン、イダルビシン、マイトマイシン−C、ダクチノマイシン、ミトラマイシン等の抗腫瘍抗生物質;及びシスプラチン、カルボプラチン、オキサリプラチン等の白金配位錯体が挙げられるが、これらに限定されない。
【0126】
(3)他の化学療法剤
タモキシフェン、トレミフェン、ラロキシフェン、ドロロキシフェン、ヨードキシフェン等の抗エストロゲン剤;酢酸メゲストロール等のプロゲストロゲン剤;アナストロゾール、レトラゾール、ボラゾール、エキセメスタン等のアロマターゼ阻害剤;フルタミド、ニルタミド、ビカルタミド、酢酸シプロテロン等の抗アンドロゲン剤;酢酸ゴセレリン、ロイプロリド等のLHRH作動剤及び拮抗剤;フィナステライド等のテストステロン−5−アルファ−ジヒドロリダクターゼ阻害剤;マリマスタット等のメタロプロテイナーゼ阻害剤;抗プロゲストゲン剤;ウロキナーゼプラスミノーゲン活性化因子受容体機能阻害剤;セレコキシブ等の2型シクロオキシゲナーゼ(COX−2)阻害剤;本明細書に記載のもの以外のVEGFR阻害剤、TIE−2阻害剤等の他の血管形成阻害剤;肝細胞成長因子機能阻害剤等の成長因子機能阻害剤;erb−B2、erb−B4、上皮細胞成長因子受容体(EGFr)、血小板由来成長因子受容体(PDGFr)、本発明に記載のもの以外の血管内皮成長因子受容体(VEGFR)、TIE−2;及びサイクリン依存性阻害剤(CDK2阻害剤、CDK4阻害剤等)等の他のチロシンキナーゼ阻害剤が挙げられるが、これらに限定されない。
【0127】
本発明の化合物は、特にある種の癌治療にも利用できる。更に、本発明の化合物を用いることで、現在の癌の化学療法や放射線療法と付加的又は相乗的な効果を得ることができ、且つ/或いは化学療法や放射線療法の効果を回復させることができる。
【0128】
式(I)及び/又は式(II)で表される親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、要求される治療的又は予防的効果が得られる限りいかなる方法で投与してもよい。本発明の化合物の治療的又は予防的に効果のある1回用量は、類似の薬理活性を示すと知られている類似化合物に関する動物又は人間のデータを用いて決定できる。投与した化合物の生体利用効率、効能、及び生体内半減期を他の薬剤の場合と比較して、その結果に基づいて1回用量を調整してよい。
【0129】
当業者であれば、上述した方法や他の公知の方法によって1回用量を調整し、人間に使用した際に最大の効果を得ることが可能である。
【0130】
本発明の化合物は、細胞増殖を特徴とする1以上の哺乳動物の疾患の治療にも有用である。このような疾患としては、血管増殖性疾患(関節炎、再狭窄等)、線維症(肝硬変、粥状動脈硬化症等)、メサンギウム細胞増殖性疾患(糸球体腎炎、糖尿病性腎症、悪性腎硬化症、血栓性微小血管症、増殖性網膜症、移植臓器拒絶、糸球体症等)、代謝異常、グルコース代謝障害、乾癬、真性糖尿病、慢性創傷治癒、炎症、神経変性疾患等が挙げられる。
【0131】
上述した実施形態に基づき、当業者は本発明の更なる特性及び利点を理解するであろう。即ち、本発明は既に詳細に示した記載及び以下に述べる例によって限定されるものではない。例えば特許文献(発行特許、登録特許、均等物等)、特許出願公報、非特許文献、他の原資料など、本出願に記載の出版物及び参考文献は全て、少なくとも部分的には本出願の開示に矛盾していない限りは、参照することにより個別に本出願に組み込まれるかのように全体が開示に含まれる。例えば、部分的に矛盾している文献は、その矛盾している部分を除いて、参照により開示に組み込まれる。
【0132】
本出願において置換基群を開示する際には、当然ながら、当該群及びその下位群の個々の置換基、それらの異性体及びエナンチオマー、並びにその置換基を用いて形成できる化合物群がそれぞれ開示されることになる。本出願でマーカッシュ群又は他の群を用いる場合、当該群の個々の要素、並びにその群で可能な組合せ及び下位の組合せは全て開示に含まれるよう意図している。本出願で化合物を記載する際に、その化合物の特定の異性体又はエナンチオマーが(例えば化学式又は化学名で)明確に指定されていない場合、該化合物の異性体、エナンチオマー、及びその組み合わせは、それぞれ当該記載に含まれる。本出願で原子を(例えば組成中に)記載する場合、該原子の同位体はいずれも当該記載に含まれる。当業者が同じ化合物を異なる名称で呼ぶことがあることが知られており、従って本出願で特定の化合物名を記載する場合はその名称は例示にすぎない。特に明記しない限り、本出願で記載又は例示した成分の処方又は組み合わせは全て本発明を実施するために使用できる。本明細書において範囲(温度範囲、時間範囲、組成範囲等)を記載する場合、その中間の範囲及び部分的範囲、並びにその範囲に含まれる全ての個々の値は、常に本開示に含まれる。
【0133】
本発明において、「含有する」や「含む」といった語(comprise、comprises、comprised、又はcomprising)は、記載した特性、整数値、工程、又は要素の存在を明記していると解釈するべきだが、他の特性、整数値、工程、要素、又はその群の存在又は追加を排除するものではない。
【0134】
本発明を多くの具体的/好適な実施形態及び技術により説明したが、当然ながら、本発明の趣旨及び範囲から逸脱しない限り多くの変更又は修正を加えてよい。本明細書では過度の実験を行うことなく広く開示したが、具体的に記載していない方法、装置、装置要素、物質、手順、及び技術も本発明を実施するために利用できることは当業者には明らかであると考えられる。本明細書に記載した方法、装置、装置要素、物質、手順、及び技術の機能的均等物は全て本発明に含まれる。範囲を開示した場合、その部分範囲及び個々の値は全て本発明に含まれる。開示した実施形態(図面に示した実施形態及び明細書で例示した実施形態を含む)は単なる例示にすぎず、限定的なものではない。即ち、本発明はこれら実施形態によって限定されるものではない。
【実施例】
【0135】
実施例に示すとおり、本発明は、親油性イノシトールグリカン化合物の新規合成法、並びに該化合物を癌及びグルコース代謝障害(糖尿病、肥満、及びメタボリック症候群が挙げられるが、これらに限定されない)の治療に用いる方法を提供する。
【0136】
I.典型的な親油性イノシトールグリカン化合物の合成:
文献に記載されているとおりグルコサミンドナー65aを調製した(ディートリッヒ(Dietrich, H.)、エスピノーサ(Espinosa, J. F.)、キアラ(Chiara, J. L.)、ヒメネス・バルベロ(Jimenez-Barbero, J.)、レオン(Leon, Y.)、バレラ・ニエト(Varela-Nieto, I.)、マト(Mato, J. M.)、カノ(Cano, F. H.)、フォーセス・フォーセス(Foces-Foces, C.)、マルティン・ロマス(Martin-Lomas, M.)、ケミストリー・ア・ヨーロピアン・ジャーナル(Chem. Eur. J.)、1999、320〜336;キンジー(Kinzy, W.)、シュミット(Schmidt, R. R.)、リービッヒ・アナーレン・デル・ケミー(Liebigs Ann. Chem.)、1985、1537〜1545)。CCl3CN(neat)を用いるとアノマー比は1:1であった。CH2Cl2中で5〜10当量のCCl3CNを用いると、約1:3のα/β比が得られた。文献記載の手順に従ってパルミトニトリルからトリメチルオルトパルミテート80を調製した(プレソヴァ(Pressova, M.)、スマルト(Smrt, J.)、コレクション・オブ・チェコスロバキア・ケミカル・コミュニケーションズ(Collect. Czech. Chem. Commun.)、1989、54、487〜497)。パルミトニトリルは市販の塩化パルミトイルから合成した(ペーン(Pern, R. B.)、グリブル(Gribble, G.)、オーガニック・プレパレーションズ・アンド・プロシージャーズ・インターナショナル(Org. Prep. Proced. Int.)、1983、15、297〜302)。文献に記載のとおりp−トルエンスルホン酸ピリジニウムを調製した(ミヤシタ(Miyashita, M.)、ヨシコシ(Yoshikoshi, A.)、グリエコ(Grieco, P. A.)、ジャーナル・オブ・オーガニック・ケミストリー(J. Org. Chem.)、1977、42、3772〜3774)。三塩化リン、ベンジルアルコール、及びジイソプロピルアミンから2工程でO,O−ジベンジル−N,N−ジイソプロピルアミノホスホロアミダイトを調製した(タナカ(Tanaka, T.)、タマツクリ(Tamatsukuri, S.)、イケハラ(Ikehara, M.)、テトラヘドロン・レターズ(Tetrahedron Lett.)、1986、27、199〜202;ウールマン(Uhlmann, E.)、エンゲルス(Engels, J.)、テトラヘドロン・レターズ(Tetrahedron Lett.)、1986、27、1023〜1026)。以下の例外を除き、市販の試薬は更なる精製を行うことなく使用した。THF、トルエン、及び塩化メチレンは、アルミナ精製系を用いて精製した(パングボーン(Pangborn, A. B.)、ジャデーロ(Giardello, M. A.)、グラブス(Grubbs, R. H.)、ローゼン(Rosen, R. K.)、ティマース(Timmers, F. J.)、オルガノメタリックス(Organometallics)、1996、15、1518〜1520)。ベンジルアルコール及びジイソプロピルアミンをCaH2から蒸留した。三塩化リンを2時間還流し、再蒸留した。BF3・Et2Oは、文献に記載のとおり水素化カルシウムから真空蒸留して精製した(ヅヴァイフェル(Zweifel, G.)、ブラウン(Brown, H. C.)、「Hydration of Olefins, Dienes, and Acetylenes via Hydroboration」、オーガニック・リアクションズ(Organic Reactions)、コープ(Cope, A. C.)編、ジョン・ワイリー・アンド・サンズ(John Wiley & Sons)、ニューヨーク、1963、第13号、142〜144頁)。HPLC等級のクロロホルムを濃H2SO4(3回)と振り、水で洗浄し、CaCl2で乾燥し、P2O5で蒸留した。出発物質を乾燥し、トルエンと共に蒸発させた。2〜10Torr、23℃で回転蒸発を行った。ベーカーガラス背面を有するシリカゲル板TLCを用いて、254nm蛍光指示薬、又は2.5%p−アニスアルデヒド、3.5%H2SO4、及び1%AcOHを含むエタノール溶液での染色によって、反応を観察した。NMRについては、1Hは300MHz、13Cは75MHz、19Fは283MHz、31Pは121MHzでデータを得、DISNMR又はXWinNMRソフトウェア環境で処理した。CDCl3溶液の内部標準としてTMS(0.03%)を用いた。d4−MeOH又はd3−MeCNに溶解した化合物の化学シフトについては、対応する残留溶媒のピークを基準とした。LR−MSは、ESIインレットを用いてサーモ・フィニガン(Thermo Finnigan)LTQ装置に記録した。陽イオン化方式では1%の酢酸を含む50%メタノール水溶液を使用し、陰イオン化方式では0.2%のトリエチルアミンを含む50%メタノール水溶液を使用した。
【0137】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−D−myo−イノシトール−1,2−環状カーボネート(78α/β)及び
N−(2−アジド−3,4,6−トリ−O−ベンジル−1,2−ジデオキシ−α−D−グルコピラノシル)トリクロロアセトアミド(79)
【化22】

【0138】
Ar雰囲気下、ドナー65a(34.5mg、55.8μmol)、アクセプター66(25mg、5.25μmol)、及び粉砕した活性モレキュラーシーブ(55mg)の混合物に、無水エーテル(2mL)を加えた。この反応混合物を−20℃に冷却し、TfOH(0.0704MのEt2O溶液を75μL、0.1当量)を滴下し、−20℃で1時間攪拌した後、20℃まで昇温した。固体のNaHCO3(100mg)を加え、反応混合物を15分間攪拌し、ろ過した。ろ液を冷却した5%Na2CO3水溶液(3×0.5mL)、水(2×0.5mL)、及び食塩水(2×0.5mL)で順次洗浄し、Na2SO4で乾燥し、蒸発させた。未精製の反応混合物をフラッシュクロマトグラフィー(EtOAc/ヘキサン体積比1:9→1:6→1:4.5→1:4)で分離して、79(6.5mg、20%)、78β(11mg、22.4%)、及び78α(20.5mg、42%)を得た。
79:Rf=0.65(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ3.57−3.73(m,3H,H−3,H−5,H−6)、3.78−3.96(m,3H,H−6’,H−4,H−2)、4.49(d,J=11.94,1H,PhCH2O)、4.58(d,J=10.63,1H,PhCH2O)、4.65(d,J=11.95,1H,PhCH2O)、4.77(d,J=10.62,1H,PhCH2O)、4.85(d,J=10.66,1H,PhCH2O)、4.92(d,J=10.67,1H,PhCH2O)、5.66(dd,J=6.55,5.37Hz,1H,H−1)、7.00(d,J=6.48,1H,NH)、7.1−7.2(m,2H,PhCH2O)、7.2−7.4(m,15H,PhCH2O(13H)+CHCl3)。
アノマー78のNMRデータは簡潔に示す(ジャオレック(Jaworek, C. H.)、「Synthesis of Inositol phosphate Glycans」、タフツ大学博士論文、マサチューセッツ州メドフォード、2000年5月)。
78β:Rf=0.36(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ3.38−3.53(m,3H)、3.65−3.78(m,3H)、3.83(ψt,J=3.57Hz,1H,Ino−H)、3.9−3.95(m,1H)、4.35(d,J=11.68Hz,1H,PhCH2O)、4.4(d,J=11.64Hz,1H,PhCH2O)、4.55−4.74(m,8H,PhCH2O(6H),GluN−H−1,Ino−H)、4.74−4.95(m,6H,PhCH2O(4H),Ino−H(2H))、7.18−7.45(m,36.3H,PhCH2O(30H)+CHCl3)。
78α:Rf=0.31(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ3.33(dd,J=11.07,1.82Hz,1H,GluN−H−6)、3.38−3.49(m,2H,GluN−H−2,GluN−H−6’)、3.58(dd,J=9.98,3.64Hz,1H,Ino−H)、3.74(dd,J=9.87,8.99Hz,1H,GluN−H−4)、3.8(ψt,J=3.39Hz,1H,Ino−H)、3.85−3.95(m,2H,GluN−H−6,Ino−H)、3.97−4.09(m,1H,GluN−H−5)、4.1(d,J=12.06Hz,PhCH2O)、4.07(s,2H,PhCH2O)、4.44−4.62(m,6H,PhCH2O(5H),Ino−H(1H))、4.67(d,J=12.19Hz,1H,PhCH2O)、4.74−4.93(m,5H,PhCH2O(3H),Ino−H(2H))、5.32(d,J=3.61Hz,1H,GluN−H−1)、7.18−7.45(m,34.2H,PhCH2O(30H)+CHCl3)。
【0139】
3,4,5,6−テトラ−O−ベンジル−2−O−パルミトイル−myo−イノシトール(81)及び
3,4,5,6−テトラ−O−ベンジル−1−O−パルミトイル−myo−イノシトール(82)
【化23】

【0140】
方法A
Ar雰囲気下、ジオール17(20mg、37μmol)及び3mLのMeCNからなる溶液に、トリメチルオルトパルミテート80(137μL、117mg、0.37mmol、10当量)をシリンジで加えた。Ar注入口を素早く取り除き、固体の(+)−CSA(9mg、37μmol、1当量)を迅速に加え、反応フラスコにAr注入口を再度取り付け、反応混合物を23℃で30分間攪拌した。TLCではRf=0.32、0.42、0.76、0.95(EtOAc/ヘキサン体積比1:3)に4つのスポットが見られた。反応混合物中に出発物質17は残存していなかった。揮発性成分を真空下で蒸発させ、残渣をAr雰囲気下でCH2Cl2に再溶解し、氷浴(0℃)中で冷却した。Ar注入口を素早く取り除き、固体のYb(OTf)3(23mg、37μmol、1当量)を一気に加え、Ar注入口を再度連結し、反応混合物を0℃で1時間攪拌した。TLCではRf=0.3、0.62、0.8、0.95(EtOAc/ヘキサン体積比1:5)に基本的には同じスポットが見られた。水(1滴)を加え、反応混合物を0℃で30分間攪拌した。TLCではRf=0.3、0.5、及び0.95に3つのスポットが見られた。反応混合物にトリエチルアミン(0.5mL)を加え、揮発性成分を真空下で蒸発させた。生成物をフラッシュクロマトグラフィー(EtOAc/ヘキサン体積比1:7→1:6)で分離し、純粋な81(21mg)、81とカンファースルホン酸のメチルエステル(MeCSA)との混合物(7mg)、及びほぼ純粋な82(4mg、14%)を得た。81とMeCSAの混合物をPTLCで分離し、純粋な81を4mg得た(合計収率86%)。
【0141】
方法B
Ar雰囲気下、ジオール17(22.6mg、41.9μmol)を入れたフラスコに、トリメチルオルトパルミテート80(0.2MのMeCN溶液を314μL、1.5当量)をシリンジで加え、得られた混合物を5分間攪拌した。(+)−CSA(1.9mg、8.18μmol、0.2当量)及び1mLのCH2Cl2からなる溶液を滴下し、反応混合物を23℃で30分間攪拌した。水(1滴)を0℃で加え、この温度で反応混合物を30分間攪拌し、方法Aと同様に反応を停止して、81(22mg、73%)及び82(6mg、20%)を得た。
【0142】
方法C
Ar雰囲気下、ジオール17(22.5mg、41.7μmol)を入れたフラスコに、トリメチルオルトパルミテート80(0.2MのMeCN溶液を600μL、3当量)をシリンジで加え、得られた混合物を5分間攪拌した。Ar注入口を素早く取り除き、固体のPPTS(2mg、8.34μmol、0.2当量)を迅速に加え、Ar注入口を反応フラスコに再度取り付け、反応混合物を23℃で25分間攪拌した。水(2.1MのMeCN溶液を100μL、210μmol、5当量)を0℃で加え、この温度で反応混合物を40分間攪拌し、方法Aと同様に反応を停止して、81(27.3mg、84%)及び82(3.3mg、10%)を得た。
81:Rf=0.32(EtOAc/ヘキサン体積比1:3);1H−NMRスペクトルは文献の記載と完全に一致(シュリューター(Schlueter, U.)、ルー(Lu, J.)、フレーザーレイド(Fraser-Raid, B.)、オーガニック・レターズ(Org. Lett.)、2003、5、255〜257)
MeCSA:Rf=0.42(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ0.88(s,3H)、1.11(s,3H)、1.45(ddd,J=12.67,9.24,3.77Hz,1H)、1.68(ddd,J=13.85,9.28,4.51Hz,1H)、1.96(d,J=18.53Hz)、2.1−2.17(m,2H)、2.35−2.55(m,2H)、2.95(d,J=15.13Hz,1H)、3.62(d,J=15.13Hz,1H)、3.96(s,3H)。
82:Rf=0.6(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ0.88(m,3H,CH2CH2(CH2)12CH3)、1.17−1.35(m,24H,CH2CH2(CH2)12CH3)、1.53−1.65(m,8H,CH2CH2(CH2)12CH3(2H),“H2O”(6H))、2.2−2.41(m,2H,CH2CH2(CH2)12CH3)、2.42(s,1H,OH)、3.5−3.59(m,2H,H−3,H−5)、3.94(ψt,J=9.51Hz,1H,H−4)、4.07(ψt,J=9.67,1H,H−6)、4.29(ψt,J=2.65Hz,1H,H−2)、4.67(d,J=11.61Hz,1H,PhCH2O)、4.71(d,J=11.61Hz,1H,PhCH2O)、4.72(d,J=11.21Hz,1H,PhCH2O)、4.8−4.92(m,6H,PhCH2O(5H)、H−1)、7.2−7.4(m,23.4H,PhCH2O(20H)+CHCl3)。
【0143】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−2−パルミトイル−D−myo−イノシトール(63)及び2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−0−ベンジル−1−パルミトイル−D−myo−イノシトール(83)
【化24】

【0144】
Ar雰囲気下、ジオール64(15.5mg、17.1μmol)をCH2Cl2(150μL)に溶解した。攪拌しながらトリメチルオルトパルミテート80(0.114MのMeCN溶液を450μL、3当量)を加えた。反応混合物を0℃に冷却し、(+)−CSA(0.0144M溶液を0.3mL、0.25当量)を加えた。反応混合物を0℃で15分間攪拌し、2.5mgの(+)−CSA、500μLのMeCN、100μLのCH2Cl2、及び30μLのH2Oからなる溶液(32μL、5当量のH2Oに相当)を加えた。反応混合物を0℃で30分間攪拌し、Et3N(0.1mL)で反応停止させた。揮発性成分を真空下で蒸発させた。生成物をフラッシュクロマトグラフィー(EtOAc/PhH体積比1:14)で分離し、83と63の混合物及び主画分(63のみを含む)を得た。2つの異性体をPTLC(EtOAc/ヘキサン体積比1:3)で分離して、純粋な83(4mg、20.4%)及び付加的な量の63(14mg、合計収率71.4%)を得た。
63:Rf=0.22(EtOAc/PhH体積比1:14);1H−NMRスペクトルは文献の記載と完全に一致した(リュー(Liu X.)、シーバーガー(Seeberger, P.)、ケミカル・コミュニケーションズ(Chem. Commun.)、2004、1708〜1709)。
83:Rf=0.41(EtOAc/PhH体積比1:14);1H−NMR(CDCl3)δ0.88(m,3.6H,CH2CH2(CH2)12CH3(3H))、1.19−1.4(m,29.2H,CH2CH2(CH2)12CH3(3H))、1.6−1.75(m,2H,CH2CH2(CH2)12CH3(2H))、2.32(s,1H,OH)、2.42(t,J=7.64Hz,2H,CH2CH2(CH2)12CH3)、3.03(dd,J=11.2,2.07Hz,1H,GluN−H−6)、3.11(dd,J=11.28,1.72Hz,1H,GluN−H−6’)、3.29(dd,J=10.3,3.73Hz,1H,GluN−H−2)、3.46(ψt,J=9.44Hz,1H,Ino−H−5)、3.6(dd,J=9.51,2.63Hz,1H,Ino−H−3)、3.7(dd,J=10.06,9.00,1H,GluN−H−4)、3.87−4.05(m,3H,GluN−H−3,GluN−H−5,Ino−H−4)、4.18−4.41(m,4H,PhCH2O(2H),Ino−H−2,Ino−H−6)、4.5(d,J=12.05Hz,PhCH2O)、4.6−4.74(m,4H,PhCH2O)、4.8−4.98(m,5H,PhCH2O(4H),Ino−H−1)、5.05(d,J=10.9Hz,1H,PhCH2O)、5.34(d,J=3.69Hz,1H,GluN−H−1)、7.05−7.15(m,4H,PhCH2O)、7.15−7.4(m,32H,PhCH2O(30H)+CHCl3);{1H}13C−NMR(CDCl3)δ173.5、138.8、18.7、138.4、138.38、138.3、137.8、129.0、128.9、128.8、128.7、128.6、128.55、128.5、128.45、128.4、128.3、128.1、128.06、128.0、127.9、127.8、98.6、82.0、81.0、80.4、80.2、78.6、76.4、76.1、75.7、75.1、74.7、74.68、73.8、73.2、70.9、68.1、67.8、63.5、34.8、32.4、30.15、30.1、30.05、29.9、29.8、29.7、29.6、25.1、23.1、14.6。
【0145】
3,4,5,6−テトラ−O−ベンジル−1−O−(ジベンジルホスホノ)−2−O−パルミトイル−myo−イノシトール(85)
【化25】

【0146】
アルコール81(8.3mg、10.6μmol)及びテトラゾール(4.5mg、64μmol、6当量)をトルエンと共に真空下で蒸発させた。Ar雰囲気下、反応物にCH2Cl2(0.7mL)を加え、続いてアミダイト84(0.2MのCH2Cl2溶液を160μL、3当量)を加えた。反応混合物を23℃で30分間攪拌した。TLC解析(EtOAc/ヘキサン体積比1:3)によって出発物質(Rf=0.22)の消失を確認した。反応混合物を−42℃に冷却し、mCPBA(0.095MのCH2Cl2溶液を0.5mL、47.7μmol、4.5当量)を加えた。反応混合物を−42℃で5分間攪拌し、更に0℃で30分間攪拌した。ジクロロメタン(1mL)を加え、Na2S2O3(1M溶液を1mL)により0℃で反応混合物を反応停止させた。有機層を分離し、1MのNa2S2O3(3×0.5mL)、水(1×0.5mL)、5%NaHCO3(3×0.5mL)、水(1×0.5mL)、及び食塩水(2×1mL)で順次洗浄した。有機相をNa2SO4で乾燥し、蒸発させた。残渣をPTLC(EtOAc/ヘキサン体積比1:3)で精製して、純粋な85(10.4mg、95%)を得た。
85:Rf=0.46(EtOAc/ヘキサン体積比1:3);1H−NMR(CDCl3)δ0.88(m,3H,CH2CH2(CH2)12CH3)、1.15−1.38(m,25.7H,CH2CH2(CH2)12CH3(24H))、1.55−1.67(m,4.16H,CH2CH2(CH2)12CH3(2H),“H2O”)、2.38(m,2H,CH2CH2(CH2)12CH3)、3.47−3.57(m,2H,H−3,H−5)、3.83(ψt,J=9.58Hz,1H,H−4)、3.83(ψt,J=9.65Hz,1H,H−6)、4.36−4.45(m,2H,H−1(1H),PhCH2O(1H))、4.7(d,J=10.88Hz,1H,PhCH2O)、4.73−5.08(m,10H,PhCH2O)、5.94(ψt,J=2.68Hz,1H,H−2)、7.15−7.4(m,33.26H,PhCH2O(30H)+CHCl3);{1H}13C−NMR(CDCl3)δ173.0、138.7、138.45、138.4、137.7、136.1、136.0、135.95、135.9、128.75、128.7、128.6、128.55、128.5、128.3、128.2、128.0、127.9、127.7、82.8、81.4、80.3、80.2、78.4、76.6、76.5、76.2、75.8、72.4、69.7、69.6、69.4、69.3、68.5、34.6、32.1、29.9、29.7、29.6、29.2、25.5、22.9、14.4;{1H}31P−NMR(CDCl3)δ0.14。
【0147】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1−O−(ジベンジルホスホノ)−2−パルミトイル−D−myo−イノシトール(68)
【化26】

【0148】
アルコール63(2.7mg、2.36μmol)及びテトラゾール(2.6mg、37.7μmol、16当量)をトルエンと共に真空下で蒸発させた。Ar雰囲気下、反応物にCH2Cl2(0.5mL)を加え、続いてアミダイト84(0.2MのCH2Cl2溶液を95μL、8当量)を加えた。反応混合物を23℃で20分間攪拌した。TLC解析(EtOAc/ヘキサン体積比1:3)によって出発物質(Rf=0.35)の消失を確認した。反応混合物を−42℃に冷却し、mCPBA(0.057MのCH2Cl2溶液を0.5mL、28.3μmol、12当量)を加えた。反応混合物を−42℃で5分間攪拌し、更に0℃で40分間攪拌した。ジクロロメタン(1mL)を加え、Na2S2O3(1M溶液を1mL)により0℃で反応混合物を反応停止させた。有機層を分離し、1MのNa2S2O3(3×0.5mL)、水(1×0.5mL)、5%NaHCO3(3×0.5mL)、水(1×0.5mL)、及び食塩水(2×1mL)で順次洗浄した。有機相をNa2SO4で乾燥し、蒸発させた。残渣をフラッシュクロマトグラフィー(EtOAc/ヘキサン体積比1:5)で精製して、25mol%(NMRで測定)の不純物(BnO)2P(O)N(iPr)2を含む生成物を2.4mg得た。これを、10当量のテトラゾール、5当量の84、及び7.5当量のmCPBAを用いて63をホスホリル化した第2バッチの生成物と併せ、得られた混合物をPTLC(Et2O/ヘキサン/EtOH体積比150:100:2)で精製して、68を5.4mg得た。第1バッチから2.25mg(68%)得られ、第2バッチから3.15mg(64%)得られた。
68:Rf=0.53(Et2O/ヘキサン/EtOH体積比150:100:2);1H−NMR(CDCl3)δ0.88(m,3H,CH2CH2(CH2)12CH3)、1.15−1.35(m,26H,CH2CH2(CH2)12CH3(24H))、1.53−1.65(m,7.5H,CH2CH2(CH2)12CH3(2H),“H2O”)、2.25−2.45(m,2H,CH2CH2(CH2)12CH3)、3.2(dd,J=10.33,3.77Hz,1H,GluN−H−2)、2.25(dd,J=11.1,2.14Hz,1H,GluN−H−6)、3.32(m,1H,GluN−H−6’)、3.44(ψt,J=9.44Hz,1H,Ino−H−5)、3.51(dd,J=9.8,2.65Hz,1H,Ino−H−3)、3.68(ψt,J=9.92Hz,1H,GluN−H−4)、3.81(ψt,J=9.56Hz,1H,Ino−H−4)、3.98(ψt,J=10.18Hz,1H,GluN−H−3)、4.08(m,1H,GluN−H−5)、4.21(ψt,J=9.63Hz,1H,Ino−H−6)、4.25(d,J=11.96Hz,1H,PhCH2O)、4.37(d,J=11.01Hz,1H,PhCH2O)、4.40(d,J=10.74Hz,1H,PhCH2O)、4.52(m,1H,Ino−H−1)、4.53(d,J=12.06Hz,1H,PhCH2O)、4.65−4.78(m,4H,PhCH2O)、4.85(s,2H,PhCH2O)、4.90(d,J=10.59Hz,1H,PhCH2O)、4.96(d,J=10.63Hz,1H,PhCH2O)、5.0(d,3JP−H=8.43Hz,2H,PhCH2O)、5.05(d,3JP−H=8.47Hz,2H,PhCH2O)、5.52(d,J=3.72Hz,GluN−H−1)、5.98(ψt,J=2.54Hz,1H,Ino−H−2)、7.0−7.1(m,4H,PhCH2O)、7.1−7.4(m,43.5H,PhCH2O(40H)+CHCl3);{1H}13C−NMR(CDCl3)δ172.7、138.6、138.2、137.9、137.7、136.1、136、135.9、135.8、128.8、128.7、128.64、128.6、128.52、128.5、128.4、128.3、128.2、128.1、128.0、127.9、127.8、127.7、97.6、81.7、80.8、80.0、78.6、78.4、77.8(CHCl3により隠されている、HMQCから抽出)、76.5、75.9、75.4、75.05、74.5、74.4、73.6、72.4、70.7、69.96、69.88、69.7、69.64、68.6、68.1、63.4、34.5、34.2、29.9、29.8、29.6、29.58、29.3、25.4、22.9、14.3;{1H}31P−NMR(CDCl3)δ−0.23;LR−MS m/z 1406.24(M+H+)、1428.7(M+Na+)、C84H100N3O14Pの計算値1405.69;HRMS m/z 1428.6834(M+Na+)、C84H100N3NaO14P+の計算値1428.6835;誤差(ppm)−0.1。
【0149】
2−アミノ−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1−O−(ホスホノ)−2−パルミトイル−D−myo−イノシトール−ラクタム(86)及び
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1−O−(ジベンジルホスホノ)−2−パルミトイル−D−myo−イノシトール(68)
【化27】

【0150】
化合物63(10mg、8.72μmol)及びテトラゾール(2.4mg、34.9μmol、4当量)をトルエンと共に真空下で蒸発させた。Ar雰囲気下、反応物にCH2Cl2(0.5mL)を加え、続いてアミダイト84(0.2MのCH2Cl2溶液を87μL、2当量)を加えた。反応混合物を23℃で1時間攪拌した。TLC解析(EtOAc/ヘキサン体積比1:4)によって出発物質(Rf=0.24)の存在を確認した。ホスホリル化剤84(0.2MのCH2Cl2溶液を87μL、2当量)を追加し、反応混合物を1時間攪拌した。TLC解析(EtOAc/ヘキサン体積比1:4)によって出発物質(Rf=0.24)がまだ存在していることを確認した。テトラゾール(4当量)及び84(4当量)を加え、反応混合物を更に30分間攪拌したところ、TLCで出発物質の消失が確認された。更に1.5時間後、反応混合物を−42℃に冷却し、mCPBA(0.087MのCH2Cl2溶液を1mL、12当量)を加えた。反応混合物を−42℃で5分間攪拌し、更に0℃で45分間攪拌した。ジクロロメタン(1mL)を加え、Na2S2O3(1M溶液を1mL)により0℃で反応混合物を反応停止させた。有機層を分離し、1MのNa2S2O3(3×0.5mL)、水(1×0.5mL)、5%NaHCO3(3×0.5mL)、水(1×0.5mL)、及び食塩水(2×1mL)で順次洗浄した。有機相をNa2SO4で乾燥し、蒸発させた。残渣をPTLCで分離して、ラクタム86(5mg、45%)及び68(3mg、24%)を得た。
86:Rf=0.66(EtOAc/ヘキサン体積比2:3);1H−NMR(CDCl3)δ0.88(m,3.4H,CH2CH2(CH2)12CH3(3H))、1.12−1.35(m,27.4H,CH2CH2(CH2)12CH3(24H))、1.5−1.7(m,14.62H,CH2CH2(CH2)12CH3(2H),“H2O”)、2.34(m,2H,CH2CH2(CH2)12CH3)、3.2(m,1H,GluN−H−2)、3.22(dd,J=10.74,1.76Hz,1H,GluN−H−6)、3.33(dd,2JH−P=7.7Hz,3JNH−GluN−H−2=2.89Hz,1H,NH)、3.49(ψt,J=9.15,1H,Ino−H−5)、3.53−3.61(m,2H,Ino−H−3,GluN−H−6’)、3.72(ψt,J=9.1Hz,1H,GluN−H−4)、3.79−3.87(m,2H,GluN−H−5,Ino−H−4)、3.97(ψt,J=9.86Hz,1H,GluN−H−3)、4.03(ψt,J=9.51Hz,1H,Ino−H−6)、4.3(d,J=12.11Hz,1H,PhCH2O)、4.36(ψtd,3JH−P=9.73Hz,3JIno−H−6−Ino−H−1=9.73Hz,3JIno−H−2−Ino−H−1=2.67Hz)、4.45−4.55(m,3H,PhCH2O)、4.67−4.88(m,7H,PhCH2O)、4.96(dd,3JH−P=7.69Hz,2JH−H=11.74Hz,1H,PhCH2O−P)、4.98(d,J=9.3Hz,1H,PhCH2O)、5.06(dd,3JH−P=6.78Hz,2JH−H=11.78Hz,1H,PhCH2O−P)、5.33(d,J=3.71Hz,1H,GluN−H−1)、5.87(ψt,J=2.57Hz,1H,Ino−H−2)、7.07−7.17(m,2H,PhCH2O)、7.2−7.4(m,41H,PhCH2O(33H)+CHCl3);{1H}31P−NMR(CDCl3)δ7.91;LR−MS m/z 1272.68(M+H+)、1294.72(M+Na+)、C77H94NO13Pの計算値1271.65。
【0151】
IG−1(13)の合成:
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール(13)
【化28】

【0152】
1mLのクロロホルム及び1mLのメタノールに、化合物63(6mg、5.24μmol)を溶解した。6mgの10%Pd/Cを加えた。反応混合物を70バールのH2下で4時間攪拌し、その後3mgの10%Pd/Cを加え、反応混合物を同じ水素圧力下で4時間攪拌した。得られたスラリーをセライトパッド(高さ5mm)でろ過し、このパッドを洗い(4×0.5mL、メタノール−クロロホルム体積比5:1)、溶液を蒸発させて、純粋な13(3.5mg、定量的)を得た。
1H−NMR(d4−MeOH)δ0.9(m,3H,CH2CH2(CH2)12CH3)、1.21−1.45(m,26H,CH2CH2(CH2)12CH3(24H),グリース)、1.58−1.7(m,2H,CH2CH2(CH2)12CH3)、2.35−2.5(m,2H,CH2CH2(CH2)12CH3)、3.1(dd,J=10.58,3.67Hz,1H,GluN−H−2)、3.27−3.37(m,3.6H,Ino−H(1H),CHD2OD)、4.43(ψt,J=9.43,1H,GluN−H−4)、3.48−3.61(m,2H,Ino−H(2H))、3.63−3.86(m,5H,Ino−H(2H),GluN−H−3,GluN−H−6,GluN−H−6’)、4.08(ddd,J=2.48,4.21,9.71Hz,1H,GluN−H−5)、5.33(d,J=3.67Hz,1H,GluN−H−1)、5.42(ψt,J=2.48Hz,1H,Ino−H−2);{1H}13C−NMR(d4−MeOH)δ175.3、98.1、82.3、75.8、75.0、74.7、74.1、72.1、71.6、71.5、62.0、56.5、35.3、33.2、31.0、30.8、30.71、30.7、30.4、26.1、24.0、14.6;LR−MS m/z 580.36(M+H+)、602.45(M+Na+)、C28H53NO11の計算値579.36。
【0153】
IG−2(14)の合成:
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール−1−ホスフェート(14)
【化29】

【0154】
1mLのクロロホルム、1mLのメタノール、及び0.3mLのH2Oに、化合物68(5.4mg、3.84μmol)を溶解した。6mgの10%Pd/Cを加え、反応混合物を70バールのH2下で5時間攪拌した。得られたスラリーをセライトパッド(高さ5mm)でろ過し、このパッドを洗い(4×0.5mL、メタノール−クロロホルム−水の体積比3:3:1)、溶液を蒸発させて、14(2.7mg、定量的)を得た。
1H−NMR(d4−MeOH)δ0.9(m,4H,CH2CH2(CH2)12CH3(3H))、1.21−1.45(m,31H,CH2CH2(CH2)12CH3(24H))、1.58−1.2(m,2H,CH2CH2(CH2)12CH3)、3.4(ψt,J=6.76Hz,2H,CH2CH2(CH2)12CH3)、3.11(dd,J=10.31,3.51Hz,1H,GluN−H−2)、3.27−3.47(m,5.59H,Ino−H−6,GluN−H−4,CHD2OD)、3.51−3.66(m,2H,Ino−H−3,Ino−H−4)、3.7−3.88(m,3H,GluN−H−6,GluN−H−6’,GluN−H−3)、3.94(ψt,J=9.23,1H,Ino−H−6)、4.16(m,1H,GluN−H−5)、4.13(ψt,J=8.97Hz,1H,Ino−H−1)、5.53(d,J=3.81Hz,1H,GluN−H−1)、5.6(br.s.,1H,Ino−H−2);{1H}13C−NMR(d4−MeOH)δ174.8、96.6、79.2、76.7、74.9、74.8、74.6、74.0、72.4、72.1、71.6、71.2、62.1、55.8、35.4、33.2、30.9、30.8、30.6、30.4、30.0、26.2、23.9、14.6;{1H}31P−NMR(d4−MeOH)δ1.26;LR−MS m/z 658.50(M−H+)、C28H54NO14Pの計算値659.3284。
【0155】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1,2−ジデヒドロ−1,2−ジデオキシ−D−myo−イノシトール(73α/β)及び
2−アジド−3,4,6−トリ−O−ベンジル−1−フルオロ−1,2−ジデオキシ−α−D−グルコピラノ−ス(87)
【化30】

【0156】
Ar雰囲気下、ドナー65a(16.5mg、26.7μmol)、アクセプター66(13mg、32μmol)、及び粉砕した活性モレキュラーシーブ(150mg)の混合物に、無水CH2Cl2(1mL)を加えた。この反応混合物を−20℃に冷却し、BF3・Et2O(0.05MのCH2Cl2溶液を75μL、0.15当量)を滴下し、−20℃で2時間攪拌した。更にBF3・Et2O(0.05MのCH2Cl2溶液を300μL、0.5当量)を滴下し、反応混合物を−20℃で更に1時間攪拌した後、20℃まで昇温した。固体のNaHCO3(100mg)を加え、反応混合物を15分間攪拌し、ろ過した。ろ液を冷却した5%Na2CO3水溶液(3×0.5mL)、水(2×0.5mL)、及び食塩水(2×0.5mL)で順次洗浄し、Na2SO4で乾燥し、蒸発させた。未精製の反応混合物をフラッシュクロマトグラフィー(EtOAc/ヘキサン体積比1:6→1:4.5→1:3)で分離して、87(3mg、24%)、73β(8mg、34%)、及び73α(4mg、17%)を得た。
87:Rf=0.66(EtOAc/ヘキサン体積比1:4);1H−NMR(CDCl3)δ3.49(ddd,3JH2−F=26Hz,3JH2−H3=10.08Hz,3JH2−H1=2.6Hz),1H,H−2)、3.68(dd,J=10.98,1.85Hz,1H,H−6)、3.75−3.87(m,2H,H−4,H−6’)、3.91−4.01(m,2H,H−3,H−5)、4.5(d,J=12.47Hz,1H,PhCH2O)、4.55(d,J=10.9Hz,1H,PhCH2O)、4.63(d,J=12.08Hz,1H,PhCH2O)、4.82(d,J=12.47Hz,1H,PhCH2O)、4.85(d,J=10.84Hz,1H,PhCH2O)、4.91(d,J=10.69Hz,1H,PhCH2O)、5.67(dd,2JH1−F=52.8Hz,3JH2−H1=2.67Hz,1H,H−1)、7.15−7.21(m,2H,PhCH2O)、7.28−7.4(m,13H,PhCH2O);{1H}13C−NMR(CDCl3)δ138、137.9、137.8、128.7、128.69、128.3、128.2、128.1、128.08、128.0、107.9、104.9、78.4、75.9、75.4、73.8、73.5、73.4、67.9、63.9、63.6;19F−NMR(CDCl3)δ−146.4(dd,J=52.7,25.8Hz)。
73β:Rf=0.61(EtOAc/ヘキサン体積比1:4);1H−NMR(CDCl3)δ3.3−3.49(m,3H,GluN−H−2,GluN−H−3,GluN−H−5)、3.59−3.82(m,5H,GluN−H−4,GluN−H−6,GluN−H−6’,Ino−H(2H))、4.25(m,1H,Ino−H)、4.45(m,1H,Ino−H)、4.47−4.62(m,3H,PhCH2O)、4.64(d,J=7.6Hz,1H,GluN−H−1)、4.65−4.75(m,2H,PhCH2O)、4.75−4.92(m,6H,PhCH2O)、4.97(d,J=10.16Hz,1H,PhCH2O)、5.68−5.8(m,2H,Ino−H(2H))、7.15−7.21(m,2H,PhCH2O)、7.21−7.41(m,33.3H,PhCH2O(28H)+CHCl3);{1H}13C−NMR(CDCl3)δ139.0、138.9、138.6、138.4、138.3、138.2、129.3、128.9、128.9、128.8、128.8、128.6、128.5、128.4、128.3、128.3、128.3、128.2、128.0、102.9、84.3、84.1、83.6、80.5、80.2、78.2、76.0、75.5、75.3、73.9、72.9、68.8、67.0。
73α:Rf=0.53(EtOAc/ヘキサン体積比1:4);1H−NMR(CDCl3)δ3.34(dd,J=10.9,1.9Hz,1H,GluN−H−6)、3.4(d,J=11.1,2.7,1H,GluN−H−6’)、3.45(dd,J=10.5,3.5Hz,1H,GluN−H−2)、3.65−3.79(m,3H,GluN−H−4,Ino−H(2H))、3.96(dd,J=10.1,9Hz,1H,GluN−H−3)、4.02(m,1H,GluN−H−5)、4.25(m,1H,Ino−H)、4.3(d,J=11.9Hz,1H,PhCH2O)、4.4(m,1H,Ino−H)、4.45(d,J=11Hz,1H,PhCH2O)、4.55(d,J=12Hz,1H,PhCH2O)、4.63−4.75(m,3H,PhCH2O)、4.77(d,J=11Hz,1H,PhCH2O)、4.82−5.0(m,5H,PhCH2O)、5.1(d,J=3.6Hz,1H,GluN−H−l)、5.7−5.83(m,2H,Ino−H(2H))、7.1−7.45(m,33.3H,PhCH2O(30H)+CHCl3);{1H}13C−NMR(CDCl3)138.7、138.4、138.3、138.3、138.0、137.9、128.9、128.7、128.6、128.5、128.5、128.3、128.2、128.1、128.1、128.0、127.9、127.8、127.8、127.7、125.3、95.2、84.1、82.3、80.6、80.4、78.3、76.1、76.0、78.5、75.6、75.1、73.6、72.7、70.8、67.9、63.4。
【0157】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1,2−ジデヒドロ−1,2−ジデオキシ−D−myo−イノシトール(73α/β)
【化31】

【0158】
Ar雰囲気下、ドナー65a(90mg、145μmol)、アクセプター67(70mg、168μmol)、及び粉砕した4Å活性モレキュラーシーブ(100mg)の混合物に、無水エーテル(6mL)を加えた。この反応混合物を−5℃に冷却し、TfOH(0.0626MのEt2O溶液を232μL、0.1当量)を滴下し、−5℃で1時間攪拌した後、20℃まで昇温した。固体のNaHCO3(100mg)を加え、反応混合物を15分間攪拌し、ろ過した。ろ液を冷却した5%Na2CO3水溶液(3×0.5mL)、水(2×0.5mL)、及び食塩水(2×0.5mL)で順次洗浄し、Na2SO4で乾燥し、蒸発させた。未精製の反応混合物をフラッシュクロマトグラフィー(EtOAc/ヘプタン体積比1:10→1:7→1:6→1:5→1:3)で分離して、純粋なカップリング生成物を含む画分を得た。純粋でない73α及び73βを含む画分をそれぞれ併せて蒸発させた。生成物をPTLC(EtOAc/ヘプタン体積比1:3)で分離し、上記画分と併せて74mgの73α(58%)及び26.5mgの73β(21%)を得た。
【0159】
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−2−パルミトイル−D−myo−イノシトール(63)、
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1−パルミトイル−D−myo−イノシトール(83)、
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→3)−3,4,5−トリ−O−ベンジル−2−パルミトイル−D−myo−イノシトール(89)、及び
2−アジド−3,4,6−トリ−O−ベンジル−2−デオキシ−α−D−グルコピラノシル−(1→6)−3,4,5−トリ−O−ベンジル−1−パルミトイル−D−myo−イノシトール(90)
【0160】
【化32】

【0161】
THF(0.7mL)及びtBuOH(0.8mL)の混合物にアルケン73(44.4mg、50.8μmol)を溶解し、得られた溶液を25mLナシ型フラスコに移した。水(500μL)を加え、続いて激しく攪拌しながらK3[Fe(CN)6](50mg、152μmol、3当量)、K2CO3(1M水溶液を152μL、3当量)、DABCO(0.089M水溶液を170μL、15.2μmol、0.3当量)、及びOsO4(0.056M水溶液を90μL、0.1当量)を加えた。最後にMeSO2NH2(9.6mg、102μmol)及びH2O(0.5mL)からなる溶液を加えた。反応混合物を23℃で激しく攪拌し、TLCで観察した(EtOAc/ヘプタン体積比3:4、73のRf=0.76、64及び88のRf=0.36〜0.42)。TLCによると12時間後の変換率は約60〜70%であった。NaOH(1M水溶液を76μL)を攪拌しながら加えた。反応混合物を更に8時間攪拌し、Na2SO3を添加して反応停止させた。有機相は黄色から無色へ変色し、水相は黒色へと変色した。反応混合物を15分間激しく攪拌し、有機層を分離した。水層からトルエン(3×0.5mL)で抽出し、有機液を併せて1MのNaOH(2×1mL)、水(2×0.5mL)、1MのNa2S2O3(3×0.5mL)、水(1×0.5mL)、及び食塩水(2×1mL)で順次洗浄した。有機相をNa2SO4で乾燥し、蒸発させて、ジオール64と88の混合物(44mg)を得た。Ar雰囲気下、ジオールの混合物(68mg、74.9μmol)をCH2Cl2(400μL)に溶解した。攪拌しながらトリメチルオルトパルミテート80(0.114MのMeCN溶液を1.6mL、2.5当量)を加えた。反応混合物を0℃に冷却し、(+)−CSA(0.0422MのMeCN溶液を443μL、0.25当量)を加えた。反応混合物を0℃で25分間攪拌し、2mgの(+)−CSA、500μLのMeCN、100μLのCH2Cl2、及び30μLのH2Oからなる溶液(142μL、5当量のH2Oに相当)を加えた。反応混合物を0℃で30分間攪拌し、Et3N(0.1mL)で反応停止させた。揮発性成分を真空下で蒸発させた。生成物をフラッシュクロマトグラフィー(PhH/EtOAc体積比96:4→14:1→8:1→7:1)で分離し、3つの画分を得た。
画分A:90、83、及び63の混合物
画分B:純粋な63
画分C:純粋な89(30mg)
画分Aの異性体をPTLC(EtOAc/ヘキサン体積比1:3)により分離し、90(6mg)、83(8mg)、及び63(28mg)を得た。パルミチン酸エステルの収率は合計で85%であり、比率は90/89=1/4.9、83/63=1/3.5であった。
90:Rf=0.57(EtOAc/PhH体積比1:14);1H−NMR(CDCl3)δ0.88(m,3.3H,CH2CH2(CH2)12CH3)、1.15−1.37(m,28.3H,CH2CH2(CH2)12CH3(24H))、1.52−1.65(m,7.6H,CH2CH2(CH2)12CH3(2H),“H2O”(5.6H))、2.2−2.43(m,2H,CH2CH2(CH2)12CH3)、2.96(br.s,1H,OH)、2.9(dd,J=11.26,1.77Hz,1H,GluN−H−6)、3.37(dd,J=11.22,2.61Hz,1H,GluN−H−6’)、3.53(ψt,J=9.43Hz,1H,Ino−H−5)、3.58(dd,1H,J=9.99Hz,1H,GluN−H−2)、3.7(dd,J=9.42,2.58Hz,1H,Ino−H−3)、3.75(ψt,J=9.25Hz,GluN−H−4)、3.86−3.99(m,3H,Ino−H−4,GluN−H−3,GluN−H−5)、4.1(ψt,J=9.87Hz,1H,Ino−H−6)、4.24(m,1H,Ino−H−2)、4.31(d,J=12.01Hz,1H,PhCH2O)、4.44−4.54(m,2H,PhCH2O)、4.67(d,J=10.62Hz,1H,PhCH2O)、4.72−4.79(m,2H,PhCH2O)、4.8−4.97(m,8H,PhCH2O(6H),Ino−H−1,GluN−H−1)、7.08−7.2(m,5H,PhCH2O)、7.2−7.4(m,33H,PhCH2O(25H)+CHCl3);{1H}13C−NMR(CDCl3)δ173.5、138.7、138.6、138.5、138.3、138.1、137.9、128.7、128.6、128.55、128.4、128.1、128.12、128.0、127.9、127.8、127.7、94.4、83.5、81.1、79.8、79.3、78.4、78.0、76.3、76.1、75.8、75.75、75.0、73.6、72.8、71.4、67.9、66.5、64.0、34.5、32.1、29.91、29.9、29.7、29.6、29.5、29.4、25.0、22.9、14.3。
89:Rf=0.08(EtOAc/PhH体積比1:14);1H−NMR(CDCl3)δ0.87(m,3.2H,CH2CH2(CH2)12CH3(3H))、1.17−1.43(m,27H,CH2CH2(CH2)12CH3(24H))、1.62−1.73(m,2H,CH2CH2(CH2)12CH3)、2.17(d,J=2.89Hz,1H,OH)、2.35−2.52(m,2H,CH2CH2(CH2)12CH3)、3.32(dd,J=10.24,3.6Hz,1H,GluN−H−2)、3.44−3.83(m,7H,Ino−H−1,Ino−H−3,Ino−H−5,Ino−H−6,GluN−H−4,GluN−H−6,GluN−H−6’)、3.87−4.08(m,3H,Ino−H−4,GluN−H−3,GluN−H−5)、4.38(d,J=12.06Hz,1H,PhCH2O)、4.47(d,J=10.99Hz,1H,PhCH2O)、4.58(d,J=12.05Hz,1H,PhCH2O)、4.7−4.9(m,8H,PhCH2O)、4.95(d,1H,PhCH2O)、5.22(d,J=3.72Hz,1H,GluN−H−1)、5.71(ψt,J=2.64Hz,1H,Ino−H−2)、7.0−7.17(m,5H,PhCH2O)、7.2−7.37(m,30H,PhCH2O(25H)+CHCl3);{1H}13C−NMR(CDCl3)δ173.6、138.5、138.4、138.0、137.9、128.9、128.7、128.65、128.6、128.5、128.48、128.3、128.25、128.2、128.1、127.94、127.9、127.8、93.9、83.6、81.61、81.23、80.1、78.3、76.1、75.8、75.4、75.1、73.4、72.7、70.7、70.4、68.2、67.1、63.0、34.36、32.14、29.9、29.87、29.81、29.62、29.6、29.36、25.1、22.9、14.4。
【0162】
IG−13の合成:
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−1−パルミトイル−D−myo−イノシトール(91)
【化33】

【0163】
0.7mLのクロロホルム及び0.7mLのメタノールに、化合物83(3mg、2.62μmol)を溶解した。4mgの10%Pd/Cを加えた。反応混合物を70バールのH2下で3.5時間攪拌した。得られたスラリーをセライトパッド(高さ5mm)でろ過し、このパッドを洗い(4×0.5mL、メタノール−クロロホルム体積比5:1)、溶液を蒸発させて、純粋な91(1.5mg、定量的)を得た。
1H−NMR(d4−MeOH)δ0.9(m,3.8H,CH2CH2(CH2)12CH3(3H),グリース)、1.21−1.45(m,31H,CH2CH2(CH2)12CH3(24H),グリース)、1.58−1.72(m,2H,CH2CH2(CH2)12CH3)、2.3−2.52(m,2H,CH2CH2(CH2)12CH3)、3.13(dd,J=10.71,3.84Hz,GluN−H−2)、3.23−3.49(m,3H,Ino−H−3,Ino−H−5,GluN−H−4)、3.63−3.85(m,4H,Ino−4,GluN−H−3,GluN−H−6,GluN−H−6’)、4.0−4.1(m,2H,Ino−H−6,GluN−H−5)、4.19(ψt,J=2.55Hz,1H,Ino−H−2)、4.71(dd,J=10.22,2.58Hz,1H,Ino−H−1)、5.26(d,J=3.76Hz,1H,GluN−H−1);{1H}13C−NMR(d4−MeOH)δ175.0、97.0、79.5、76.4、74.8、74.5、74.3、72.6、71.6、71.2、71.1、61.9、56.3、35.3、33.2、30.9、30.8、30.7、30.6、30.5、25.9、23.9、14.6;LR−MS m/z 580.34(M+H+)、602.44(M+Na+)、C28H53NO11の計算値579.36。
【0164】
IG−14の合成:
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−2−パルミトイル−D−myo−イノシトール(92)
【化34】

【0165】
0.7mLのクロロホルム及び0.7mLのメタノールに、化合物89(3mg、2.62μmol)を溶解した。4mgの10%Pd/Cを加えた。反応混合物を70バールのH2下で3.5時間攪拌した。得られたスラリーをセライトパッド(高さ5mm)でろ過し、このパッドを洗い(4×0.5mL、メタノール−クロロホルム体積比5:1)、溶液を蒸発させて、純粋な92(1.5mg、定量的)を得た。
1H−NMR(d4−MeOH)δ0.9(m,3.9H,CH2CH2(CH2)12CH3(3H),グリース)、1.21−1.44(m,31H,CH2CH2(CH2)12CH3(24H),グリース)、1.58−1.72(m,2H,CH2CH2(CH2)12CH3)、2.35−2.52(m,2H,CH2CH2(CH2)12CH3)、3.13(dd,J=10.67,3.58Hz,1H,GluN−H−2)、3.25(ψt,J=9.01Hz,1H,Ino−H)、3.38(m,1H,Ino−H)、3.54(dd,J=9.91,2.86Hz,1H,Ino−H)、3.58−3.72(m,3H,Ino−H(2H),GluN−H−6)、3.75,3.87(m,3H,Ino−H,GluN−H−3,GluN−H−6’)、4.2(ddd,J=2.2,5.13,10.16Hz,1H,GluN−H−5)、5.38(d,J=3.55Hz,1H,GluN−H−1)、5.45(ψt,J=2.32Hz,1H,Ino−H−2);{1H}13C−NMR(d4−MeOH)δ177、94.6、76.8、76.7、74.7、74.3、73.1、72.9、71.8、71.4、71.2、62.2、55.9、35.5、33.2、30.9、30.8、30.7、30.6、30.5、26.1、23.9、14.6;LR−MS m/z 580.30(M+H+)、602.34(M+Na+)、C28H53NO11の計算値579.36。
【0166】
IG−15の合成:
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−1−パルミトイル−D−myo−イノシトール(93)
【化35】

【0167】
0.7mLのクロロホルム及び0.7mLのメタノールに、化合物90(3mg、2.62μmol)を溶解した。4mgの10%Pd/Cを加えた。反応混合物を90バールのH2下で5.5時間攪拌した。得られたスラリーをセライトパッド(高さ5mm)でろ過し、このパッドを洗い(4×0.5mL、メタノール−クロロホルム体積比5:1)、溶液を蒸発させて、純粋な92(1.5mg、定量的)を得た。
1H−NMR(d4−MeOH)δ0.9(m,3.5H,CH2CH2(CH2)12CH3(3H),グリース)、1.21−1.4(m,30H,CH2CH2(CH2)12CH3(24H),グリース)、1.58−1.7(m,2H,CH2CH2(CH2)12CH3)、2.38−2.5(m,2H,CH2CH2(CH2)12CH3)、3.16(dd,J=10.52,3.62Hz,1H,GluN−H−2)、3.28(ψt,J=9.06,1H,Ino−H−5)、3.4(dd,J=9.98,8.94Hz,1H,GluN−H−4)、3.56−3.89(m,6H,Ino−H−3,Ino−H−4,Ino−H−6,GluN−H−3,GluN−H−6,GluN−H−6’)、4.04(ddd,J=9.59,5.21,2.5Hz,1H,GluN−H−5)、4.18(ψt,J=2.45Hz,1H,Ino−H−2)、4.65(dd,J=10.25,2.5Hz,1H,Ino−H−1)、5.18(d,J=3.62Hz,1H,GluN−H−1);{1H}13C−NMR(d4−MeOH)δ175.2、93.8、77.1、76.6、75.4、74.4、72.5、71.8、71.6、71.4、68.0、62.1、55.9、35.1、33.2、31.0、30.9、30.8、30.6、30.4、26.1、23.9、14.58;LR−MS m/z 580.45(M+H+)、602.45(M+Na+)、C28H53NO11の計算値579.36。
【0168】
II.親油性イノシトールグリカン化合物は癌細胞増殖を抑制し、担癌対象の生存期間を長期化する。
以下の実施例では、本発明の親油性イノシトールグリカン化合物が癌細胞の死亡を誘導し、担癌マウスの生存を改善できることを示す。
【0169】
細胞株
ヒト膵臓癌細胞株(Panc−1、MiaPaca2、BXPC3、Aspc1)、ヒト肝臓癌細胞株(HuH7)、ヒト胃癌細胞株(AGS、MKN45)、ヒト結腸癌細胞株(CoCM−1)、ヒト乳癌細胞株(MCF−7)、ヒト神経芽腫細胞(SH−SY5Y)、ヒト前立腺癌細胞(PC3)、マウスエールリッヒ腹水癌細胞、及びマウス3T3−L1線維芽細胞が、アメリカン・タイプ・カルチャー・コレクション(American Type Culture Collection、米国メリーランド州ロックビル)から得られた。これら癌細胞を10%ウシ胎仔血清を含むRPMI1640中で培養した。培地はCO25%の湿潤環境で37℃に保った。
【0170】
ヒト初代培養細胞、皮膚線維芽細胞、表皮角化細胞、及び臍帯静脈内皮細胞をセル・アプリケーションズ社(Cell Applications、米国カリフォルニア州サンディエゴ)から購入し、製造者の使用説明書に従って培養した。
【0171】
細胞増殖分析
試験キットCellTiter 96 AQueous One Solution Cell Proliferation Assay kit(プロメガ株式会社、米国ウィスコンシン州マディソン)を用いて、製造者の使用説明書に従って細胞増殖試験を行った。簡潔に述べると、96ウェルの培養皿中、培地に1ウェルあたり5×103個の細胞を播種した。この細胞培養系に、最終濃度が0、1、10、及び100μMとなるようにIGを加えた。得られた系を3日間又は7日間培養した後、テトラゾリウム化合物の3−(4,5−ジメチルチアゾール−2−イル)−5−(3−カルボキシメトキシフェニル)−2−(4−スルホフェニル)−2H−テトラゾリウム塩、及びMTSを含有する試薬であるCellTiter 96 AQueous One Solution Reagentを培地に20μL/ウェル加えた。この培養皿をCO2インキュベーターで1時間培養した後、96ウェル培養皿読取機で490nmの吸収を記録した。
【0172】
動物生存分析
雄ddyマウスに標準食及び水を随意に与え続け、体重を20〜30gとした。エールリッヒ腹水癌細胞(5×106個)をマウスの腹腔内に注射した。その7日後から、7日の間、毎日マウスにIG1又はIG1+アルキル−アシル−ホスファチジン酸(AAPA)を腹腔内注射した。動物が自然死した時点で実験を終了した。
【0173】
癌研究結果
本実施例で用いた親油性イノシトールグリカン化合物は、上述した新規化学合成法によって調製した。それら合成化合物は幾つかのヒト腫瘍細胞株に対して細胞毒性を示すことが分かっている。そのような腫瘍細胞としては、ヒト膵臓癌細胞(Panc−1、MiaPaca2、BXPC3、Aspc1)、ヒト肝臓癌細胞(HuH7)、ヒト胃癌細胞(AGS、MKN45)、ヒト結腸癌細胞(CoCM−1)、ヒト乳癌細胞(MCF−7)、ヒト神経芽腫細胞(SH−SY5Y)、ヒト前立腺癌細胞(PC3)、及びマウスエールリッヒ腹水癌細胞が挙げられるが、これらに限定されない。これら化合物は、後述するヒト臍帯静脈内皮細胞(図8)を例外として、ヒト正常細胞(ヒト皮膚線維芽細胞、ヒト表皮角化細胞等が挙げられるが、これらに限定されない)に対しては細胞毒性を示さない。図4〜6に示すデータから、該化合物は癌細胞中で固有の細胞死メカニズムを活性化し、その結果細胞毒性を示すことが分かる。
【0174】
図3に示すように、親油性イノシトールグリカンをPanc−1細胞の無血清培地中に10μMの濃度で用いると(1時間培養)、ATP量に影響することなく好気的解糖を正常化できる。培地にIG−1を10〜100μMの濃度で加えたところ、添加から1時間以内にヒト膵臓癌細胞Panc−1が迅速死した(図4A、4B、及び4C)。他の癌細胞についても同様のIG1濃度(10〜100μM)を用いたところ、ヒト膵臓癌細胞(MiaPaca2、BXPC3、Aspc1)、ヒト肝臓癌細胞(HuH7)、ヒト胃癌細胞(AGS、MKN45)、ヒト結腸癌細胞(CoCM−1)、ヒト乳癌細胞(MCF−7)、ヒト神経芽腫細胞(SH−SY5Y)、ヒト前立腺癌細胞(PC3)、及びマウスエールリッヒ腹水癌細胞といった全ての癌細胞株において同様の癌細胞迅速死が見られた。しかしながら、IG−1を1〜100μMの濃度で用いると、HUVEC(図8)を除いて、培養ヒト正常細胞の増殖には作用しなかった(データは図示せず)。
【0175】
一方、IG−2の場合は、処置後24時間以内にヒト前立腺癌細胞(PC3)(図5)、ヒト神経芽腫細胞(SH−SY5Y)、及びヒト肝臓癌細胞(HuH7)中で細胞死が見られた。IG−2を1〜100μMの濃度で用いた場合も、培養ヒト正常細胞の増殖には作用しなかった(データは図示せず)。
【0176】
IG13、IG14、及びIG15の3種のIG1類似体も、処置後72時間以内にヒト膵臓癌細胞(Panc−1)の死を誘起した(図6)。IG13、IG14、及びIG15を1〜100μMの濃度で用いた場合も、培養ヒト正常細胞の増殖には作用しなかった(データは図示せず)。
【0177】
IG1の生体内での抗癌活性を評価するために、エールリッヒ腹水癌細胞担癌ddyマウスにIG−1を7日間腹腔内投与し、マウスの生存期間を調べた。DMSOのみの場合と比較して、IG−1処置は生存期間に影響しなかった。IG1のグリコシルホスファチジルイノシトール(GPI)前駆体をGPI特異的ホスホリパーゼD(GPI−PLD)で加水分解することによって、アルキル−アシル−ホスファチジン酸(AAPA)が得られると推測できる。3種のAAPA、即ちAAPA1(1−O−アルキル−(18:0)−2−O−アシル−(18:0)−sn−グリセロール−ホスフェート)、AAPA2(1−O−アルキル(18:0)−2−O−アシル−(20:4)−sn−グリセロール−ホスフェート)、及びAAPA3(1−O−アルキル−(18:0)−2−O−アシル(22:4)−sn−グリセロール−ホスフェート)を上述した化学合成法により調製し、IG1+AAPA化合物で治療した場合の癌マウスの生存期間を調べた。IG1のみ又はIG1+他のAAPAの組み合わせを用いた場合と比較して、IG1+AAPA2を用いると癌マウスの生存期間が有意に長くなった(図7)。エールリッヒ腹水癌細胞担癌ddyマウスにIG1及びアルキル−アシル−ホスファチジン酸を7日間毎日投与した後のカプラン・マイヤー生存曲線を図7に示す。IG1は1時間以内にヒト臍帯静脈内皮細胞(HUVEC)の迅速死を誘起するが、AAPA2はこのHUVEC細胞迅速死を阻害する(図8)。即ち、IG1のGPI前駆体をGPI−PLDで加水分解することによって生じると考えられるAAPAは、細胞内シグナル伝達において親油性イノシトールグリカンと相互作用する可能性がある。
【0178】
II.親油性イノシトールグリカン化合物はインスリン様生物活性を有し、耐糖能を改善でき、グルコース代謝障害を治療又は抑制できる。
他の態様では、本発明の組成物及び方法を用いて血糖を調節できる。式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、血糖調節に使用できる。即ち、本発明の組成物及び方法は、グルコース代謝障害の発病を予防又は抑制するため、或いはグルコース代謝障害を治療するために使用できる。親油性イノシトールグリカン化合物をグルコース代謝障害の治療的処置及び予防的処置に用いることができる。一実施形態においては、親油性イノシトールグリカン化合物又はその機能性類似体を投与することによって、血糖を調節できる。親油性イノシトールグリカン化合物及び機能性類似体はインスリンの分泌を調節でき、そのため血糖を調節できる。グルコース代謝障害とは、グルコースの取り込み又は放出、或いはインスリンの発現、産生、分泌、又は使用に関連する疾患である。ここでグルコース代謝障害は肥満、糖尿病、インスリン抵抗症、高血糖症、耐糖能障害、高インスリン血症、X症候群、高コレステロール血症、高リポタンパク血症、高トリグリセリド血症、粥状動脈硬化症、及び糖尿病性腎症からなる群から選ぶことができるが、これらに限定されない。
【0179】
以下の実施例では、本発明の親油性イノシトールグリカン化合物がインスリン様生物活性を有し、当該技術分野で承認されているマウス病態モデルのI型糖尿病、II型糖尿病、肥満、又はメタボリック症候群の耐糖能を改善できることを示す。
【0180】
材料及び方法:
3T3−L1脂肪細胞中のグリコーゲン合成及び脂質生成
3T3−L1線維芽細胞を、25mMグルコース+10%ウシ胎仔血清(FBS)を含むダルベッコ変法イーグル培地(DMEM)内に保持した。2日後、併せて10%のFBS、167nMのインスリン、0.25μmol/リットルのデキサメタゾン、及び0.5mMのイソブチルメチルキサンチンを含有するDMEMを添加して分化を開始した。3日後、培地をDMEM+10%FBS+167nMインスリンに置換した。更に2日後、培地をDMEM+10%ウシ胎仔血清に置換した。細胞の>90%が脂肪細胞表現型を示し分化操作が完了した後、含脂肪細胞を6〜14日間使用した。実験に先立って、5mMのグルコース、0.2%のウシ血清アルブミン、25mMのHepes(pH7.4)、100ユニット/mlのペニシリン、100ユニット/mlのストレプトマイシン、及び0.29mg/mlのグルタミンを含有するDMEM培地で細胞を2回洗浄し、同じ培地で2時間インキュベートした。24ウェルの皿でグリコーゲン及び脂質の合成を測定した。DMSO中、IGを様々な濃度で用いて30分間前治療した後、1〜100nMインスリンの存在下及び非存在下で細胞を30分間活性化した。次に、全てのウェルに1μCiの[14C]−グルコース(約220cpm/nmol)を加えた。37℃で60分間培養した後、氷上で細胞をPBSで3回洗浄し、脂肪細胞を1mlの蒸留水中に回収した。400μlのPBSに400μlの細胞懸濁液を加えた。5mlのベータフルオー(Betafluor、ナショナルダイアグノスティクス社(National Diagnostics))で脂質を一晩抽出し、シンチレーション計測によって脂質へのグルコース混入を測定した。600μlの50%KOHに400μlの細胞懸濁液を加え、グリコーゲンを沈殿させ、放射能を液体シンチレーションカウンターで計測した。
【0181】
天然ラット脂肪細胞内の脂質生成の測定
雄ロング−エバンスラットを解剖して得た副睾丸脂肪パッドから含脂肪細胞を単離し、イノシトールグリカン又はインスリンによる処置に反応して起こるトリグリセリドへの[6−3H]−グルコースの混入を従来法により測定した(チャクラボルティ(Chakraborty, N.)及びダラルカオ(M. d'Alarcao)、バイオオーガニック・アンド・メディシナル・ケミストリー(Bioorganic & Medicinal Chemistry)、13、2005、6732〜6741)。図10に示すように、この測定ではIG−1とIG−2の両方が脂質生成を促進した。このデータを受容体結合モデルと照合すると(チャクラボルティ(Chakraborty, N.)及びダラルカオ(M. d'Alarcao)、バイオオーガニック・アンド・メディシナル・ケミストリー(Bioorganic & Medicinal Chemistry)、13、2005、6732〜6741)、IG−1及びIG−2の脂質生成活性化のEC50値はそれぞれ14μM及び2.5μMであった。一方、40μMのIG−13、IG−14、又はIG−15を用いた場合は、この試験において脂質生成活性化は殆ど又は全く起こらなかった(図11)。
【0182】
動物実験
生後5週間の雄C57BL/6マウスを個別に収容し、標準食(65%の炭水化物、4%の脂肪、及び24%のタンパク質を含む)又は高脂肪食(60.2%の炭水化物、15.3%の脂肪、及び24.5%のタンパク質を含むクイックファット(Quick Fat、日本クレア株式会社、東京))を自由に摂取できるように5週間飼育した。Db/dbマウスも個別に収容し、標準食を自由に摂取できるように飼育した。生後5週間のC57BL/6マウスには、体重1gあたり75μgのストレプトゾトシン(STZ)を数回投与した。注射から7日間後、空腹時血漿グルコース濃度が400mg/dlを超えるマウスを、STZ糖尿病マウスとして使用した。東北大学の動物実験規則ガイドラインに従って動物実験を行った。
【0183】
肝臓中のトリグリセリド量及びグリコーゲン量
冷凍肝臓を均質化し、CHCl3:CH3OH(体積比2:1)でトリグリセリドを抽出し、乾燥し、2−プロパノール中に懸濁させた(17)。リピドス液(Lipidos、東洋紡績株式会社、大阪)を用いてトリグリセリド量を測定した。30%水酸化カリウムを含む飽和Na2SO4溶液に組織を100℃で30分間溶解し、続いてエタノール沈殿を行って、30〜50mgの冷凍肝臓からグリコーゲンを単離した。グリコーゲン量は490nmでフェノール−硫酸分光光度法によって決定し(18)、肝臓1ミリグラムあたりのグリコーゲンのマイクログラム数で表した。
【0184】
血液分析
グルコースエース(Glucose Ace、株式会社三和化学研究所、名古屋)を用いて血糖を測定した。血清中のインスリン及びレプチンは、ELISAキット(森永生科学研究所、横浜)を用いて決定した。血清中のアディポネクチン濃度及び腫瘍壊死因子α(TNF−α)濃度は、それぞれELISAキット(大塚製薬株式会社、東京)及びTNF−α分析キット(アマシャムバイオサイエンス社、スウェーデン国ウプサラ)を用いて測定した。血清中の総コレステロール濃度、トリグリセリド濃度、及びFFA濃度は、それぞれコレスカラー液及びリピドス液(Cholescolor及びLipidos、東洋紡績株式会社、大阪)、並びにNEFA−Cキット(和光純薬工業株式会社、大阪)を用いて決定した。
【0185】
耐糖能(糖負荷)試験
耐糖能については腹腔内耐糖能で評価した。耐糖能試験は、16時間絶食マウスを用いて行った。マウスには体重1kgあたり2gのグルコースを腹腔内投与し、その投与の直前、並びに15、30、60、及び120分後に血糖を測定した。
【0186】
IG−1の静脈内投与
随意に摂餌させたマウスにIG−1を静脈内投与した。IG1又はヒトレギュラーインスリン(標準食マウスには体重1kgあたり1ユニット;高脂肪食マウス、db/dbマウス、及びSTZ糖尿病マウスには体重1kgあたり2ユニット;イーライリリー社、神戸)をマウスに尾静脈注射し、注射の直前、並びに30、60、90、120、180、240、及び300分後に血糖を測定した。
【0187】
統計分析
対応のないスチューデントt検定(unpaired Student's t-test)によって有意な統計的相違を評価した。<0.05のp値は有意であるとみなした。
【0188】
グルコース代謝障害の動物モデル実験の結果
本発明の式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、グリコーゲン合成及び脂質生成を活性化できる。既に記載したとおり、10〜1000μMの濃度でIG1を用いると、3T3−L1脂肪細胞中でグリコーゲン合成及び脂質生成が活性化される(図9A及び図9B)。IG1及びIG2はラットから単離した脂肪細胞の脂質生成を促進する(図10及び図11)。IG15も100μMの濃度で使用すると3T3−L1脂肪細胞中でグリコーゲン合成及び脂質生成を促進する(図12A及び図12B)。
【0189】
本発明の式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、当該分野で認められているグルコース代謝障害モデルにおいて血漿グルコース濃度を低減できる。IG1を静脈内投与(マウス1匹あたり0.3〜1mg)することにより、投与後90〜300分間で、高脂肪食を与えたC57B/6マウス及びメタボリック症候群動物モデルの血漿グルコース濃度が有意に低下した(図13)。IG1を用いると、高脂肪食を与えたC57B/6マウスの肝臓及び筋肉のグリコーゲン量が有意に増加した(データは図示せず)。IG1を静脈内投与(マウス1匹あたり0.3mg)することにより、投与後120〜300分間で、ストレプトゾトシン(STZ)糖尿病マウス及びインスリン欠乏I型糖尿病動物モデルの血漿グルコース濃度が有意に低下した(図14)。また、IG1を用いるとSTZ糖尿病マウスの肝臓及び筋肉のグリコーゲン合成も増加する(データは図示せず)。IG1を静脈内投与すると、標準食を与えたC57B/6マウス(正常マウス)、db/dbマウス、及び肥満〜糖尿病のマウス(II型糖尿病モデル)の血漿グルコース濃度が低下した。IG1を用いると標準食を与えたC57B/6マウス及びdb/dbマウスの肝臓及び筋肉のグリコーゲン合成も増加する(データは図示せず)。
【0190】
本発明の式(I)及び式(II)の親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、当該分野で認められているグルコース代謝障害モデルにおいて、有意に耐糖能を改善でき、空腹時血漿グルコース濃度を低下させることができ、肝臓及び筋肉のグリコーゲン合成を増加させることができ、1日摂食量を低下させることができ、体重を低下させることができ、且つインスリン、トリグリセリド、遊離脂肪酸、及びレプチンの空腹時血漿濃度を低下させることができる。IG1を7日間毎日腹腔内投与すると(マウス1匹あたり1mg)、高脂肪食を与えたC57B/6マウスの耐糖能が有意に改善される(図15)。高脂肪食を与えたC57B/6マウスにIG1を静脈内投与することによって血漿グルコース濃度が経時的に低下する様子を図13に示す。STZ糖尿病マウスにIG1を7日間腹腔内投与することによって空腹時血漿グルコース濃度が改善される様子を図16に示す。高脂肪食を与えたC57B/6マウスにIG−1を処置すると、7日後に肝臓及び筋肉のグリコーゲン量が増加し、肝臓トリグリセリド量が減少する(データは図示せず)。STZ糖尿病マウスにIG1を7日間毎日腹腔内投与すると(マウス1匹あたり0.3mg)、空腹時血漿グルコース濃度が有意に低下する(図14)。また、IG−1を投与するとSTZ糖尿病マウスの肝臓及び筋肉のグリコーゲン合成が増加する(データは図示せず)。標準食を与えたC57B/6マウス及びdb/dbマウスにIG1を7日間毎日腹腔内投与すると、耐糖能が改善され、肝臓及び筋肉のグリコーゲン合成が増加する(データは図示せず)。図16に示すように、STZ糖尿病マウスにIG1を7日間腹腔内投与すると、空腹時血漿グルコース濃度が改善される。高脂肪食を与えたC57B/6マウス及びメタボリック症候群動物モデルにIG1を7日間投与することによって、1日摂食量、体重、並びにインスリン、トリグリセリド、遊離脂肪酸、及びレプチンの空腹時血漿濃度が有意に低下する(表2)。
【0191】
【表2】

【0192】
即ち、IG1は、標準摂食C57B/6マウス、高脂肪摂食C57B/6マウス、db/dbマウス、及びSTZ糖尿病マウスの耐糖能、インスリン感受性、及び脂質代謝を改善する。IG1を用いて28日間治療すると、ob/ob肥満マウス(表3参照)及び高脂肪摂食C57B/6マウス(データは図示せず)において、1日摂食量、体重、並びにインスリン、トリグリセリド、遊離脂肪酸、及びレプチンの空腹時血漿濃度が有意に低下する。
【0193】
本実施例から、本発明の式(I)及び式(II)で表される親油性イノシトールグリカン化合物(並びにその塩、溶媒和物、及び生理的機能性誘導体)は、3T3−L1脂肪細胞においてインスリン様生物活性を示すことが分かる(図6〜9)。例えば、正常マウス、並びにI型糖尿病、II型糖尿病、肥満、及びメタボリック症候群のマウスモデルにおいて、IG1は低血糖性活性を示す(図10〜11)。図10の濃度効果関係曲線に示すように、IG−1は14μMのEC50(半数影響濃度)及び24%のAmax(最大作用)を有し、IG−2は2.5μMのEC50及び37%のAmaxを有する。この親油性イノシトールグリカン化合物を用いて長期治療を行うと、正常マウス及びグルコース代謝障害(I型糖尿病、II型糖尿病、肥満、メタボリック症候群等)のマウスモデルにおいて、耐糖能が改善される(図12〜16)。例えば既に示したとおり、IG1により7日間又は28日間治療を行ったところ、当該分野で認められているグルコース代謝障害マウスモデルにおいて、1日摂食量、体重、肝臓トリグリセリド量、並びにグルコース、インスリン、トリグリセリド、及び遊離脂肪酸の空腹時血漿濃度が有意に低下した(表2及び3)。
【0194】
【表3】

【特許請求の範囲】
【請求項1】
細胞増殖を抑制する方法であって、有効量の親油性イノシトールグリカン化合物を細胞に投与することを特徴とする方法。
【請求項2】
前記親油性イノシトールグリカン化合物が、式:
A−O1−B
[式中、Aはグルコサミン及びガラクトサミンからなる群から選ばれるヘキソサミンであり;O1はアルファ1,6結合、アルファ1,3結合、及びアルファ1,2結合からなる群から選ばれ;Bはイノシトール、myo−イノシトール、chiro−イノシトール、scyllo−イノシトール、epi−イノシトール、cis−イノシトール、neo−イノシトール、muco−イノシトール、及びallo−イノシトールからなる群から選ばれ、B部分は互いに独立して任意にホスフェート、チオホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)で一置換又は二置換される]で表される化合物から選ばれることを特徴とする請求項1に記載の方法。
【請求項3】
前記親油性イノシトールグリカン化合物が、式II:
【化1】

[式中、O1はアルファ1,6結合及びアルファ1,3結合からなる群から選ばれ;R1はホスフェート、アルキル基(C1−22)、及びアシル残基(O=C−C0−21)からなる群から選ばれ;R2はアルキル基(C1−22)及びアシル残基(O=C−C0−21)からなる群から選ばれる]で表される化合物から選ばれることを特徴とする請求項1に記載の方法。
【請求項4】
R1及びR2の少なくとも1つがパルミトイルであることを特徴とする請求項1に記載の方法。
【請求項5】
R1がホスフェートであることを特徴とする請求項1に記載の方法。
【請求項6】
前記細胞増殖が癌に関連するものであることを特徴とする請求項1に記載の方法。
【請求項7】
前記細胞が対象の生体内に存在することを特徴とする請求項1に記載の方法。
【請求項8】
前記化合物が、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール(13)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール−1−ホスフェート(14)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−1−パルミトイル−D−myo−イノシトール(91)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−2−パルミトイル−D−myo−イノシトール(92)、及び2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−1−パルミトイル−D−myo−イノシトール(93)からなる群から選ばれることを特徴とする請求項1に記載の方法。
【請求項9】
癌細胞が、ヒト膵臓癌細胞、ヒト胃癌細胞、ヒト乳癌細胞、ヒト肝臓癌細胞、及びヒト結腸癌細胞からなる群から選ばれることを特徴とする請求項1に記載の方法。
【請求項10】
式:
A−O1−B
[式中、Aはグルコサミン及びガラクトサミンからなる群から選ばれるヘキソサミンであり;O1はアルファ1,6結合、アルファ1,3結合、及びアルファ1,2結合からなる群から選ばれ;Bはイノシトール、myo−イノシトール、chiro−イノシトール、scyllo−イノシトール、epi−イノシトール、cis−イノシトール、neo−イノシトール、muco−イノシトール、及びallo−イノシトールからなる群から選ばれ、B部分は互いに独立して任意にホスフェート、チオホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)で一置換又は二置換される]で表される実質的に精製された親油性イノシトールグリカン化合物。
【請求項11】
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール(13)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール−1−ホスフェート(14)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−1−パルミトイル−D−myo−イノシトール(91)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−2−パルミトイル−D−myo−イノシトール(92)、及び2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−1−パルミトイル−D−myo−イノシトール(93)からなる群から選ばれることを特徴とする請求項10に記載の実質的に精製された親油性イノシトールグリカン化合物。
【請求項12】
請求項10に記載の化合物を含有する治療用組成物であって、前記化合物が癌の対象又は癌の疑いがある対象に投与できるように構成されていることを特徴とする組成物。
【請求項13】
癌細胞の増殖を抑制する方法であって、有効量の請求項10に記載の化合物又はその医薬製剤を、前記癌細胞に接触させることを特徴とする方法。
【請求項14】
式:1−アルキル(C1−22)−2−アシル(O=C−C0−21)−sn−グリセロール−ホスフェートで表される化合物を併用することを特徴とする請求項13に記載の方法。
【請求項15】
AAPA1(1−O−アルキル(18:0)−2−O−アシル−(18:0)−sn−グリセロール−ホスフェート)、AAPA2(1−O−アルキル(18:0)−2−O−アシル−(20:4)−sn−グリセロール−ホスフェート)、及びAAPA3(1−O−アルキル(18:0)−2−O−アシル−(22:4)−sn−グリセロール−ホスフェート)からなる群から選ばれる化合物を併用することを特徴とする請求項13に記載の方法。
【請求項16】
更に、患者に他の抗癌治療を施すことを特徴とする請求項14に記載の方法。
【請求項17】
前記抗癌治療が、化学療法又は放射線治療であることを特徴とする請求項16に記載の方法。
【請求項18】
癌細胞のアポトーシスを誘導する方法であって、前記癌細胞に、1種以上の式:
【化2】

[式中、O1はアルファ1,6結合及びアルファ1,3結合からなる群から選ばれ;R1はホスフェート、アルキル基(C1−22)、及びアシル残基(O=C−C0−21)からなる群から選ばれ;R2はアルキル基(C1−22)及びアシル残基(O=C−C0−21)からなる群から選ばれる]で表される化合物と、式:1−アルキル(C1−22)−2−アシル(O=C−C0−21)−sn−グリセロール−ホスフェートで表される1種以上の化合物との組み合わせで有効量投与し、前記細胞がアポトーシスを起こすことを特徴とする方法。
【請求項19】
前記細胞に前記化合物を複数回投与することを特徴とする請求項18に記載の方法。
【請求項20】
癌を治療する方法であって、癌の疑いがある患者に、治療有効量の請求項10に記載の化合物又はその医薬製剤を投与することを特徴とする方法。
【請求項21】
下式の1以上の化合物の治療有効量からなる医薬組成物であって、治療有効量の式:
【化3】

[式中、O1はアルファ1,6結合及びアルファ1,3結合からなる群から選ばれ;R1はホスフェート、アルキル基(C1−22)、及びアシル残基(O=C−C0−21)からなる群から選ばれ;R2はアルキル基(C1−22)及びアシル残基(O=C−C0−21)からなる群から選ばれる]で表される化合物又はその塩と、薬学的に許容される添加剤、希釈剤、及び賦形剤のうち1つ以上とを含有することを特徴とする医薬組成物。
【請求項22】
更に、式:1−アルキル(C1−22)−2−アシル(O=C−C0−21)−sn−グリセロール−ホスフェートで表される化合物を少なくとも1つ含有することを特徴とする請求項21に記載の医薬組成物。
【請求項23】
更に、抗腫瘍薬を少なくとも1つ含有することを特徴とする請求項21に記載の医薬組成物。
【請求項24】
対象の血糖を調節する方法であって、前記対象に、グリコーゲン合成を促進する親油性イノシトールグリカン化合物を治療有効量投与して、血糖値を調節することを特徴とする方法。
【請求項25】
対象のグルコース代謝障害を調節することを更に特徴とする請求項24に記載の方法。
【請求項26】
前記グルコース代謝障害が、糖尿病、メタボリック症候群、肥満、インスリン抵抗症、耐糖能障害、高インスリン血症、X症候群、高コレステロール血症、高リポタンパク血症、高トリグリセリド血症、粥状動脈硬化症、及び糖尿病性腎症からなる群から選ばれることを特徴とする請求項24に記載の方法。
【請求項27】
前記グルコース代謝障害が糖尿病であることを特徴とする請求項24に記載の方法。
【請求項28】
前記グルコース代謝障害が肥満であることを特徴とする請求項24に記載の方法。
【請求項29】
前記化合物が前記対象の細胞内の脂質生成を促進することを特徴とする請求項24に記載の方法。
【請求項30】
請求項10に記載の化合物、その薬学的に有用な誘導体、塩、溶媒和物、又は立体異性体、或いはこれらの混合物(いかなる混合比であってもよい)の、細胞増殖異常及び/又はグルコース代謝異常に関連する疾患の治療に用いられる薬剤の調製のための使用。
【請求項31】
前記疾患が癌であることを特徴とする請求項30に記載の使用。
【請求項32】
前記疾患が、膵臓癌、結腸癌、肝臓癌、脳癌、肺癌、扁平上皮癌、膀胱癌、胃癌、膵臓癌、前立腺癌、腎臓癌、結腸直腸癌、乳癌、頭部癌、頸部癌、食道癌、婦人科癌、甲状腺癌、リンパ腫、慢性白血病、及び急性白血病からなる群から選ばれることを特徴とする請求項30に記載の使用。
【請求項33】
前記疾患がグルコース代謝障害であることを特徴とする請求項30に記載の使用。
【請求項34】
前記疾患が、糖尿病、メタボリック症候群、肥満、インスリン抵抗症、耐糖能障害、高インスリン血症、X症候群、高コレステロール血症、高リポタンパク血症、高トリグリセリド血症、粥状動脈硬化症、及び糖尿病性腎症からなる群から選ばれることを特徴とする請求項33に記載の使用。
【請求項35】
哺乳動物の増殖関連疾患を治療する方法であって、処置を必要とする哺乳動物に、治療有効量の請求項10に記載の化合物を投与することを特徴とする方法。
【請求項36】
前記疾患が細胞増殖異常であることを特徴とする請求項35に記載の方法。
【請求項37】
前記疾患が癌であることを特徴とする請求項35に記載の方法。
【請求項1】
細胞増殖を抑制する方法であって、有効量の親油性イノシトールグリカン化合物を細胞に投与することを特徴とする方法。
【請求項2】
前記親油性イノシトールグリカン化合物が、式:
A−O1−B
[式中、Aはグルコサミン及びガラクトサミンからなる群から選ばれるヘキソサミンであり;O1はアルファ1,6結合、アルファ1,3結合、及びアルファ1,2結合からなる群から選ばれ;Bはイノシトール、myo−イノシトール、chiro−イノシトール、scyllo−イノシトール、epi−イノシトール、cis−イノシトール、neo−イノシトール、muco−イノシトール、及びallo−イノシトールからなる群から選ばれ、B部分は互いに独立して任意にホスフェート、チオホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)で一置換又は二置換される]で表される化合物から選ばれることを特徴とする請求項1に記載の方法。
【請求項3】
前記親油性イノシトールグリカン化合物が、式II:
【化1】

[式中、O1はアルファ1,6結合及びアルファ1,3結合からなる群から選ばれ;R1はホスフェート、アルキル基(C1−22)、及びアシル残基(O=C−C0−21)からなる群から選ばれ;R2はアルキル基(C1−22)及びアシル残基(O=C−C0−21)からなる群から選ばれる]で表される化合物から選ばれることを特徴とする請求項1に記載の方法。
【請求項4】
R1及びR2の少なくとも1つがパルミトイルであることを特徴とする請求項1に記載の方法。
【請求項5】
R1がホスフェートであることを特徴とする請求項1に記載の方法。
【請求項6】
前記細胞増殖が癌に関連するものであることを特徴とする請求項1に記載の方法。
【請求項7】
前記細胞が対象の生体内に存在することを特徴とする請求項1に記載の方法。
【請求項8】
前記化合物が、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール(13)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール−1−ホスフェート(14)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−1−パルミトイル−D−myo−イノシトール(91)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−2−パルミトイル−D−myo−イノシトール(92)、及び2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−1−パルミトイル−D−myo−イノシトール(93)からなる群から選ばれることを特徴とする請求項1に記載の方法。
【請求項9】
癌細胞が、ヒト膵臓癌細胞、ヒト胃癌細胞、ヒト乳癌細胞、ヒト肝臓癌細胞、及びヒト結腸癌細胞からなる群から選ばれることを特徴とする請求項1に記載の方法。
【請求項10】
式:
A−O1−B
[式中、Aはグルコサミン及びガラクトサミンからなる群から選ばれるヘキソサミンであり;O1はアルファ1,6結合、アルファ1,3結合、及びアルファ1,2結合からなる群から選ばれ;Bはイノシトール、myo−イノシトール、chiro−イノシトール、scyllo−イノシトール、epi−イノシトール、cis−イノシトール、neo−イノシトール、muco−イノシトール、及びallo−イノシトールからなる群から選ばれ、B部分は互いに独立して任意にホスフェート、チオホスフェート、アルキル基(C1−22)、又はアシル残基(O=C−C0−21)で一置換又は二置換される]で表される実質的に精製された親油性イノシトールグリカン化合物。
【請求項11】
2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール(13)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−2−パルミトイル−D−myo−イノシトール−1−ホスフェート(14)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→6)−1−パルミトイル−D−myo−イノシトール(91)、2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−2−パルミトイル−D−myo−イノシトール(92)、及び2−アミノ−2−デオキシ−α−D−グルコピラノシル−(1→3)−1−パルミトイル−D−myo−イノシトール(93)からなる群から選ばれることを特徴とする請求項10に記載の実質的に精製された親油性イノシトールグリカン化合物。
【請求項12】
請求項10に記載の化合物を含有する治療用組成物であって、前記化合物が癌の対象又は癌の疑いがある対象に投与できるように構成されていることを特徴とする組成物。
【請求項13】
癌細胞の増殖を抑制する方法であって、有効量の請求項10に記載の化合物又はその医薬製剤を、前記癌細胞に接触させることを特徴とする方法。
【請求項14】
式:1−アルキル(C1−22)−2−アシル(O=C−C0−21)−sn−グリセロール−ホスフェートで表される化合物を併用することを特徴とする請求項13に記載の方法。
【請求項15】
AAPA1(1−O−アルキル(18:0)−2−O−アシル−(18:0)−sn−グリセロール−ホスフェート)、AAPA2(1−O−アルキル(18:0)−2−O−アシル−(20:4)−sn−グリセロール−ホスフェート)、及びAAPA3(1−O−アルキル(18:0)−2−O−アシル−(22:4)−sn−グリセロール−ホスフェート)からなる群から選ばれる化合物を併用することを特徴とする請求項13に記載の方法。
【請求項16】
更に、患者に他の抗癌治療を施すことを特徴とする請求項14に記載の方法。
【請求項17】
前記抗癌治療が、化学療法又は放射線治療であることを特徴とする請求項16に記載の方法。
【請求項18】
癌細胞のアポトーシスを誘導する方法であって、前記癌細胞に、1種以上の式:
【化2】

[式中、O1はアルファ1,6結合及びアルファ1,3結合からなる群から選ばれ;R1はホスフェート、アルキル基(C1−22)、及びアシル残基(O=C−C0−21)からなる群から選ばれ;R2はアルキル基(C1−22)及びアシル残基(O=C−C0−21)からなる群から選ばれる]で表される化合物と、式:1−アルキル(C1−22)−2−アシル(O=C−C0−21)−sn−グリセロール−ホスフェートで表される1種以上の化合物との組み合わせで有効量投与し、前記細胞がアポトーシスを起こすことを特徴とする方法。
【請求項19】
前記細胞に前記化合物を複数回投与することを特徴とする請求項18に記載の方法。
【請求項20】
癌を治療する方法であって、癌の疑いがある患者に、治療有効量の請求項10に記載の化合物又はその医薬製剤を投与することを特徴とする方法。
【請求項21】
下式の1以上の化合物の治療有効量からなる医薬組成物であって、治療有効量の式:
【化3】

[式中、O1はアルファ1,6結合及びアルファ1,3結合からなる群から選ばれ;R1はホスフェート、アルキル基(C1−22)、及びアシル残基(O=C−C0−21)からなる群から選ばれ;R2はアルキル基(C1−22)及びアシル残基(O=C−C0−21)からなる群から選ばれる]で表される化合物又はその塩と、薬学的に許容される添加剤、希釈剤、及び賦形剤のうち1つ以上とを含有することを特徴とする医薬組成物。
【請求項22】
更に、式:1−アルキル(C1−22)−2−アシル(O=C−C0−21)−sn−グリセロール−ホスフェートで表される化合物を少なくとも1つ含有することを特徴とする請求項21に記載の医薬組成物。
【請求項23】
更に、抗腫瘍薬を少なくとも1つ含有することを特徴とする請求項21に記載の医薬組成物。
【請求項24】
対象の血糖を調節する方法であって、前記対象に、グリコーゲン合成を促進する親油性イノシトールグリカン化合物を治療有効量投与して、血糖値を調節することを特徴とする方法。
【請求項25】
対象のグルコース代謝障害を調節することを更に特徴とする請求項24に記載の方法。
【請求項26】
前記グルコース代謝障害が、糖尿病、メタボリック症候群、肥満、インスリン抵抗症、耐糖能障害、高インスリン血症、X症候群、高コレステロール血症、高リポタンパク血症、高トリグリセリド血症、粥状動脈硬化症、及び糖尿病性腎症からなる群から選ばれることを特徴とする請求項24に記載の方法。
【請求項27】
前記グルコース代謝障害が糖尿病であることを特徴とする請求項24に記載の方法。
【請求項28】
前記グルコース代謝障害が肥満であることを特徴とする請求項24に記載の方法。
【請求項29】
前記化合物が前記対象の細胞内の脂質生成を促進することを特徴とする請求項24に記載の方法。
【請求項30】
請求項10に記載の化合物、その薬学的に有用な誘導体、塩、溶媒和物、又は立体異性体、或いはこれらの混合物(いかなる混合比であってもよい)の、細胞増殖異常及び/又はグルコース代謝異常に関連する疾患の治療に用いられる薬剤の調製のための使用。
【請求項31】
前記疾患が癌であることを特徴とする請求項30に記載の使用。
【請求項32】
前記疾患が、膵臓癌、結腸癌、肝臓癌、脳癌、肺癌、扁平上皮癌、膀胱癌、胃癌、膵臓癌、前立腺癌、腎臓癌、結腸直腸癌、乳癌、頭部癌、頸部癌、食道癌、婦人科癌、甲状腺癌、リンパ腫、慢性白血病、及び急性白血病からなる群から選ばれることを特徴とする請求項30に記載の使用。
【請求項33】
前記疾患がグルコース代謝障害であることを特徴とする請求項30に記載の使用。
【請求項34】
前記疾患が、糖尿病、メタボリック症候群、肥満、インスリン抵抗症、耐糖能障害、高インスリン血症、X症候群、高コレステロール血症、高リポタンパク血症、高トリグリセリド血症、粥状動脈硬化症、及び糖尿病性腎症からなる群から選ばれることを特徴とする請求項33に記載の使用。
【請求項35】
哺乳動物の増殖関連疾患を治療する方法であって、処置を必要とする哺乳動物に、治療有効量の請求項10に記載の化合物を投与することを特徴とする方法。
【請求項36】
前記疾患が細胞増殖異常であることを特徴とする請求項35に記載の方法。
【請求項37】
前記疾患が癌であることを特徴とする請求項35に記載の方法。
【図1】


【図2】


【図3】


【図4A】


【図4B】


【図4C】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4A】


【図4B】


【図4C】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公表番号】特表2010−514701(P2010−514701A)
【公表日】平成22年5月6日(2010.5.6)
【国際特許分類】
【出願番号】特願2009−543256(P2009−543256)
【出願日】平成19年12月21日(2007.12.21)
【国際出願番号】PCT/US2007/088562
【国際公開番号】WO2008/080064
【国際公開日】平成20年7月3日(2008.7.3)
【出願人】(399127843)トラスティーズ・オブ・タフツ・カレッジ (12)
【氏名又は名称原語表記】TRUSTEES OF TUFTS COLLEGE
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
【公表日】平成22年5月6日(2010.5.6)
【国際特許分類】
【出願日】平成19年12月21日(2007.12.21)
【国際出願番号】PCT/US2007/088562
【国際公開番号】WO2008/080064
【国際公開日】平成20年7月3日(2008.7.3)
【出願人】(399127843)トラスティーズ・オブ・タフツ・カレッジ (12)
【氏名又は名称原語表記】TRUSTEES OF TUFTS COLLEGE
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
[ Back to top ]

