国際特許分類[C07B57/00]の内容
化学;冶金 (1,075,549) | 有機化学 (230,229) | 有機化学の一般的方法あるいはそのための装置 (13,008) | 光学活性有機化合物の分離 (332)
国際特許分類[C07B57/00]に分類される特許
281 - 290 / 332
O,O−ジ−p−アロイル酒石酸を用いてのメフロキンの分割
分割剤としてO,O−ジ−p−アロイル酒石酸の実質的に単一の鏡像異性体を使用する、メフロキンの鏡像異性体混合物の光学純度を高める方法。 (もっと読む)
アミドアセトニトリル化合物のラセミ体からのアミドアセトニトリル化合物の鏡像異性体の調製方法
本発明は、純粋な鏡像異性体を、式(I)のアミドアセトニトリル化合物のラセミ体から調製するための新しい方法を目的とし、それらの純粋な鏡像体は、温血動物類内の、特に畜産動物類および家畜類内のおよび温血動物類への、並びに植物類への内寄生生物類および外寄生生物類の防除において有用である。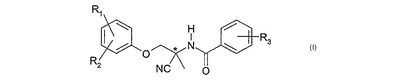
 (もっと読む)
(もっと読む)
環状ノナペプチドアミド
本発明は、環状ノナペプチドアミドおよびその製造方法並びに疾患、特に細菌性感染疾患を処置および/または予防する薬剤の製造のためのその使用に関する。 (もっと読む)
(S)−3−[(1−ジメチルアミノ)エチル]−フェニル−N−エチル−N−メチル−カルバミン酸の効率的製造方法
本発明は、置換フェニルカルバミン酸および医薬学上許容し得るその塩類の製造方法に関する。これら化合物は現在医薬学的に注目される。置換フェニルカルバミン酸および医薬学上許容し得るその塩類は、中枢神経系においてコリン作用を起こすのに有用で、アルツハイマー病、ダウン症候群、ハンチントン舞踏病、フリードリヒの運動失調等の疾病の治療に有用である。(S)−3−[(1−ジメチルアミノ)エチル]−フェニル−N−エチル−N−メチル−カルバミン酸(I)は、米国特許第5,602,176号明細書で参照された医薬品組成物の活性成分である。この化合物もまた、脳におけるアセチルコリンエステラーゼ活動の選択的抑制を誘導するために使用される。  (もっと読む)
(もっと読む)
(ビフェニル)カルボン酸およびその誘導体
本発明は、一般式(I)(A、X、R1〜R6の定義は下記)を有する化合物、および/またはその塩もしくはエステルに関する。さらに、本発明は、アルツハイマー病治療のための化合物の使用およびγ-セクレターゼ活性調節のためのそれらの使用に関する。 (もっと読む)
抗癌活性を有するピリミド[4,5−D]ピリミジン誘導体
KDR及びFGFRキナーゼの選択的インヒビターであり、そしてLCKに選択的である、式(I)(式中、R1〜R9は本明細書に定義される通りである)で表される新規ピリミド化合物が開示される。それらの化合物及びそれらの医薬的に許容できる塩は、固形腫瘍、特に乳癌、結腸癌、肺癌及び前立腺癌の処理又は制御において有用な抗−増殖剤である。それらの化合物を含む医薬組成物及び癌の処理のためへの使用が開示される。
【化1】
 (もっと読む)
(もっと読む)
スピロ−ヒダントイン化合物の結晶形および製造方法
式(II):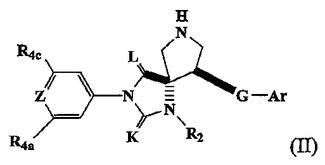
[式中、
ZはNまたはCR4bであり;
KおよびLは独立して、OまたはSであり;
Arは適宜置換されたアリールまたはヘテロアリールであり;
A2はリンカーであり、G’はリンカーであり;
Qはリンカーであり;並びに
R2、R4a、R4c、およびRhは本明細書中で定義される]
のスピロ−ヒダントイン化合物を製造するための方法が提供される。本方法には中間体のエナンチオマー分割が適宜含まれ、式IIのスピロ−ヒダントイン化合物のエナンチオマーを製造する。置換スピロ−ヒダントイン化合物は、式(II)のスピロ−ヒダントイン化合物から製造されうる。式(II)のスピロ−ヒダントイン化合物およびその置換スピロ−ヒダントイン化合物は、免疫疾患または炎症性疾患の治療に有益である。本発明の方法によって製造される生成物および置換スピロ−ヒダントイン化合物、5−[(5S,9R)−9−(4−シアノフェニル)−3−(3,5−ジクロロフェニル)−l−メチル−2,4−ジオキソ−l,3,7−トリアザスピロ[4.4]ノン−7−イルメチル]−チオフェン−3−カルボン酸、並びにその溶媒和化合物および塩の結晶形(いずれの方法によっても製造される)もまた提供され、並びにその使用方法も提供される。特定の中間体の結晶形も提供される。 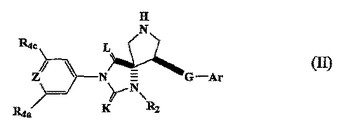 (もっと読む)
(もっと読む)
(4E)−5−クロロ−2−イソプロピル−4−ペンテン酸エステルおよびその光学活性体の製造方法
本発明は、医農薬の中間体として有用な(4E)−5−クロロ−2−イソプロピル−4−ペンテン酸エステルおよびその光学活性体の製造方法を提供する。すなわち、下式(2)で表される化合物を、非プロトン性溶媒(II)の存在下で、塩基(II)と反応させ、つぎに(1E)−1,3−ジクロロ−1−プロペンと反応させることによって、下式(3)で表される化合物を得て、つぎに該下式(3)で表される化合物のエステルの一方を脱アルコキシカルボニル化することを特徴とする、下式(4)で表される(4E)−5−クロロ−2−イソプロピル−4−ペンテン酸エステルの製造方法を提供する。また前記の製造方法によって得た式(4)で表される(4E)−5−クロロ−2−イソプロピル−4−ペンテン酸エステルを光学分割することを特徴とする下式(5)で表される(S)−(4E)−5−クロロ−2−イソプロピル−4−ペンテン酸エステルの製造方法を提供する(ただし、Rは低級アルキル基またはアルアルキル基を示す。)。
 (もっと読む)
(もっと読む)
ラセミ体シタロプラムジオール(racemiccitalopramdiol)および/またはS−もしくはR−シタロプラムジオールの製造方法、およびラセミ体シタロプラム、R−シタロプラムおよび/またはS−シタロプラムを製造するために、上記ジオールを使用する方法。
以下の記載において、シタロプラムジオールは、遊離塩基および/または酸付加塩としての4-[4-(ジメチルアミノ)-1-(4-フルオロフェニル)-1-ヒドロキシブチル]-3-(ヒドロキシメチル)-ベンゾニトリルを意味する。
本発明は、エナンチオマーのうちの一方を50%よりも多く有する、R−およびS−シタロプラムジオールの非ラセミ体混合物を、S−またはR−シタロプラムジオールで富化された留分およびR−シタロプラムジオール:S−シタロプラムジオールの比が1:1に等しいか、またはR−およびS−シタロプラムジオールの最初の混合物におけるR−シタロプラムジオール:S−シタロプラムジオールの比よりも1:1に近いRS−シタロプラムジオールを含む留分に分離することからなる、ラセミ体シタロプラムジオールおよび/またはR−またはS−シタロプラムジオールの製造方法に関する。上記方法は、i) RS−シタロプラムジオールを、最初の非ラセミ体混合物の溶液から沈殿させる、またはR−もしくはS−シタロプラムジオールを最初の非ラセミ体混合物を溶解している溶剤に溶解させ、RS−シタロプラムジオールの残留物を残す、および、ii) 形成された残留物/沈殿物を最終の溶液相から分離して、引き続き反復、再結晶化、精製、単離ならびに遊離塩基および塩間の転化のうち任意の工程を行うことを特徴とする。本発明はまた、上記方法に引き続いて行われる閉環を含む、RS−シタロプラム、S−シタロプラム、R−シタロプラム(すべてが遊離塩基および/または酸付加塩としての)の製造方法に関する。
(もっと読む)
モダフィニルの光学異性体の調製方法及び結晶形
本発明は、モダフィニルの光学異性体の結晶形を調製する方法に関し、各段階が:
i)エタノール以外の溶媒に、モダフィニルの光学異性体の1種を溶解させること、
ii)モダフィニルの異性体を晶出させること、
iii)そのようにして得られるモダフィニルの異性体の結晶形を回収すること、
を含む。
本発明は、モダフィニルの光学異性体を調製する方法にも関する。
(もっと読む)
281 - 290 / 332
[ Back to top ]

