国際特許分類[G01N21/65]の内容
物理学 (1,541,580) | 測定;試験 (294,940) | 材料の化学的または物理的性質の決定による材料の調査または分析 (128,275) | 光学的手段,すなわち.赤外線,可視光線または紫外線を使用することによる材料の調査または分析 (28,618) | 調査される材料が励起され,それにより光を発しまたは入射光の波長に変化を生ずるシステム (4,647) | 光学的励起 (4,229) | ラマン散乱 (680)
国際特許分類[G01N21/65]に分類される特許
641 - 650 / 680
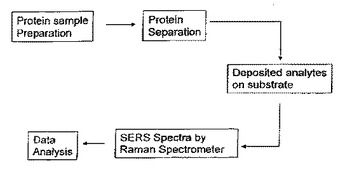
ラマン分光法を使用して生物試料のタンパク質プロファイルを得る方法
本発明は、例えば、特定の個人によって提供される試料のタンパク質プロファイルを得るために、生物試料のタンパク質含有量を分析するための方法を提供する。試料中のタンパク質およびタンパク質断片を化学的および/または物理的特性に基づいて分離し、固体基板上または流動中の液体の流れの離散的な位置に分離された状態で維持する。次いで、離散的な位置からのスペクトルが、離散的な位置の1つ以上の特定のタンパク質または断片の構造または識別についての情報を提供するように、離散的な位置において分離された状態のタンパク質または断片によって形成されるのでラマンスペクトルが検出される。離散的な位置のタンパク質または断片は、金または銀などの金属をコーティングされてもよいおよび/または分離されたタンパク質は、SERSスペクトルを提供するように化学的エンハンサーと接触されてもよい。本発明を実施する方法およびキットも提供されている。
 (もっと読む)
(もっと読む)
多孔性バイオセンサーおよびラマン分光法を用いる生体分子の検出
本発明は、カスケードラマンセンシングによって、血清のような生体試料の内容物を分析するために用いられる方法を提供する。公知の分析物に対して特異的に結合するプローブを有する、蛍光を発生させるナノ多孔性バイオセンサーを、生体試料に接触させて、多孔性の半導体構造に共役させた一つまたはそれ以上の結合複合体を形成する。結合した複合体を、結合複合体に特異的に結合するラマン活性プローブに接触させて、バイオセンサーに光を照射するとバイオセンサーからの蛍光放出が得られる。これらの蛍光の放出は結合複合体からのラマンシグナルを生成する。結合複合体から生成されたラマンシグナルを検出して、結合したタンパク質含有分析物に関連するラマンシグナルが、試料中のタンパク質含有化合物の存在を示している。本発明の方法は、患者の試料のタンパク質プロフィールを提供するために有用である。本発明はまた、本発明の方法を実践するために有用な検出系を提供する。 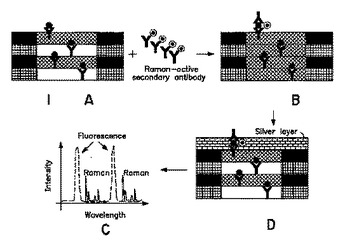 (もっと読む)
(もっと読む)
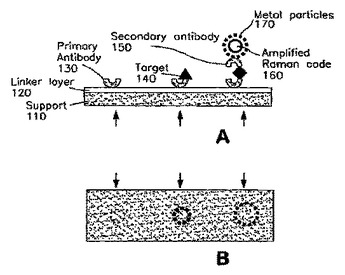
生体試料をアッセイするためにラマン活性プローブ構築物を使用するための方法および装置
体液中のタンパク質含有分析物などの生体試料中の分析物を検出するためのラマン活性またはSERS活性プローブ構築物を使用する種々の方法が提供される。本発明の方法が、試料中のタンパク質含有分析物または断片のアミノ酸組成についての情報を提供できるように、ラマン活性構築物におけるプローブ部分は、生体試料中の特定の公知の分析物に結合し、同定するように選択されるか、またはプローブ部分は、一定のアミノ酸に共通に見いだされる官能基と化学的に相互作用するようにデザインされる。患者試料のタンパク質プロフィールを作製することができるように、場合によっては、ラマン活性またはSERS活性プローブ構築物は、本発明の方法に使用したときに、特定のタンパク質含有分析物またはこのような分析物の型を同定することができる。ラマンのデータベースまたは正常な試料のSERSスペクトルと比較したときに、開示された方法を使用して患者の疾病状態を同定することができる。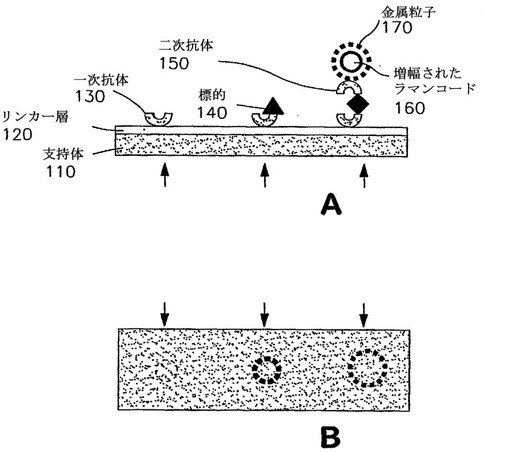
 (もっと読む)
(もっと読む)
分子複製中のヌクレオチドの取り込みのラマン・モニタリングによる核酸配列決定
本明細書に開示された方法および装置は、ヌクレオチド、ヌクレオシド、および塩基の検出、ならびに核酸配列決定のために有用である。本方法は、表面増強ラマン分光法(SERS)を使用した、ヌクレオチド、ヌクレオシド、または塩基の検出を含む。検出は、核酸配列決定反応のような核酸重合反応の間のデオキシヌクレオチド三リン酸の取り込みを検出する核酸配列決定反応の一部であり得る。合成された新生鎖の核酸配列および鋳型鎖の相補配列が、重合反応の間のヌクレオチドの取り込みの順序を追跡することにより決定され得る。 (もっと読む)
分子複製中のヌクレオチドの取り込みのラマン・モニタリングによる核酸配列決定
本明細書に開示された方法および装置は、ヌクレオチド、ヌクレオシド、および塩基の検出、ならびに核酸配列決定のために有用である。本方法は、表面増強ラマン分光法(SERS)または表面増強コヒーレント・アンチ・ストークス・ラマン分光法(SECARS)を使用した、ヌクレオチド、ヌクレオシド、または塩基の検出を含む。検出は、核酸配列決定反応のような核酸重合反応の間のデオキシヌクレオチド三リン酸の取り込みを検出する核酸配列決定反応の一部であり得る。合成された新生鎖の核酸配列および鋳型鎖の相補配列が、重合反応の間のヌクレオチドの取り込みの順序を追跡することにより決定され得る。塩基を糖部分から切断することによるヌクレオチドまたはヌクレオシドのSERSシグナルを増強する方法が提供される。さらに、単一塩基の繰り返しを検出する方法が提供される。 (もっと読む)
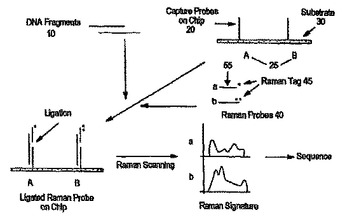
ヌクレオチド配列情報決定法
オリゴヌクレオチド・プローブのラマン・サインの検出に基づく核酸配列決定法が本発明において提供される。ラマン標識又は正の電荷を有するエンハンサーにより任意で標識された個々に捕獲された核酸プローブのラマン・サインが検出される。捕獲されたプローブの配列は、捕獲されたプローブ及び相補的な標的核酸のヌクレオチド配列を同定するために使用され、次いで、それが整列化され、核酸配列情報を入手するために使用される。もう一つの態様において、標的核酸に結合する標識されたオリゴヌクレオチド・プローブ(標識されたオリゴヌクレオチド・プローブは、第一標識及び第二標識を含んでおり、第一標識は、第二標識の光学的特性に影響を与えることができる)との標的核酸の結合を利用する、標的核酸の標的ヌクレオチド位置におけるヌクレオチド存在を決定するための方法が提供される。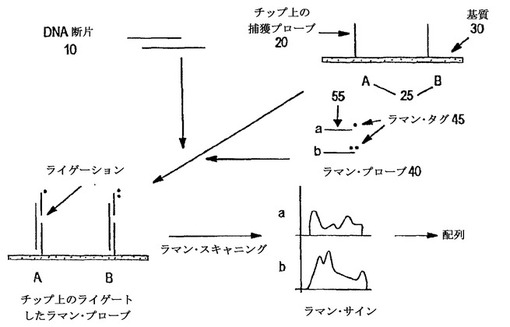
 (もっと読む)
(もっと読む)
表面増強ラマン分光法(SERS)活性複合体ナノ粒子、前記の製造の方法及び前記の使用の方法
ナノ粒子、これを準備する方法及びナノ粒子の実施形態を使用してターゲット分子を検出する方法が開示される。例示するナノ粒子の一つの実施形態は、とりわけ、表面増強ラマン分光法活性複合体ナノ構造を含む。表面増強ラマン分光法活性複合体ナノ構造は、コアと、少なくとも一つのレポーター分子と、カプセル化物質を含む。レポーター分子は、コアに結合されている。レポーター分子は、イソチオシアン酸塩染料、多硫化有機染料、多ヘテロ硫化有機染料、ベンゾトリアゾール染料及びこれらの組み合わせから選択される。カプセル化物質はコア及びレポーター分子の上に配置される。カプセル化物質によるカプセル化の後に、レポーター分子は測定可能な表面増強ラマン分光法形跡を有する。  (もっと読む)
(もっと読む)
光学分析系、血液分析系、及び主成分の振幅を決定する方法
光学分析系(20)は、光信号の主成分の振幅を決定するように、配置される。その光学分析系(20)は、スペクトルの重み付けの関数によってその光信号を重み付けするための多変量光学素子(5,6)及びその重み付けされた光信号を検出するための検出器(7,8)を含む。その光信号は、その主成分及びそのスペクトルの重み付けの関数を設計するとき占められなかったさらなる成分を含む。従って、その検出された重み付けされた光信号は、その主成分の振幅に関係する部分及びそのさらなる成分のさらなる振幅に関係するさらなる部分を含む。その光学分析系(20)は、その検出された重み付けされた光信号を変調するための変調器素子(13)をさらに含む。その変調された検出された重み付けされた光信号とその検出された重み付けされた光信号との間の差は、その主成分の振幅に関係すると共に、このように、正確な方式でその主成分の振幅を決定することを許容する。血液分析系(40)は、このような光学分析系(20)を含む。主成分の振幅を決定する方法は、その光学分析系(20)を使用する。 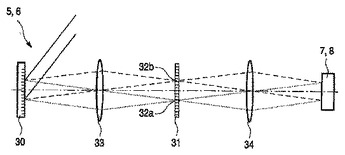 (もっと読む)
(もっと読む)
多変量光学素子を使用する光学分析系
本発明は、光信号の主成分の振幅を決定するための光学分析系を提供する。その主成分は、分光学的な分析を受ける物質の特定の化合物又は様々な化合物の濃度を示す。その光信号は、重み付けの関数によって指定された、波長選択的な重み付け及び波長選択的な空間的な分離を受ける。その光信号は、好ましくは、それぞれその重み付けの関数の正の及び負のスペクトルの帯域に対応する二個の部分に分離される。その分離は、強度の顕著な損失無しにその光信号の分離された部分の別個の検出を提供し、それによって、決定された主成分の改善された信号対雑音比を提供する。その光信号の分離及び重み付けは、二個の多変量光学素子によって実現される。 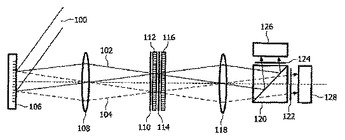 (もっと読む)
(もっと読む)
病原微生物検出のための広視野法
病原微生物は、当該病原微生物からのラマン光分散光と供にそのスペクトル・パターンのデジタル・パターン認識により、広視野で検出され、そして分類される。 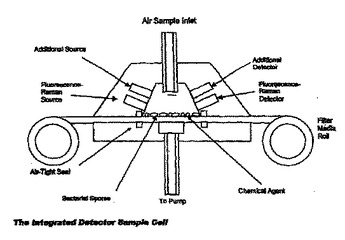 (もっと読む)
(もっと読む)
641 - 650 / 680
[ Back to top ]

