AMPKの脱リン酸化酵素作用を持つプロテインホスファターゼ2Cε(PP2Cε)の使用。
【課題】AMPキナーゼの活性化及び非活性化の制御方法を提供する。
【解決手段】プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として含む薬。前記薬はAMPKが介在するシグナル由来の病気の予防治療に用いられること、またAMPKの脱リン酸化調整に用いられることを特徴とする薬。プロテインホスファターゼ2Cε(PP2Cε)とAMPキナーゼ(AMPK)の会合を阻害することを特徴とするAMPKが介在するシグナル由来の非ヒト哺乳動物に対する病気の治療方法。
【解決手段】プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として含む薬。前記薬はAMPKが介在するシグナル由来の病気の予防治療に用いられること、またAMPKの脱リン酸化調整に用いられることを特徴とする薬。プロテインホスファターゼ2Cε(PP2Cε)とAMPキナーゼ(AMPK)の会合を阻害することを特徴とするAMPKが介在するシグナル由来の非ヒト哺乳動物に対する病気の治療方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、AMPKに対する脱リン酸化酵素作用を持つプロテインホスファターゼ2Cε(PP2Cε)の用途に関する。さらに詳しくは、2型糖尿病、メタボリック症候群、癌、動脈硬化症、肝臓病、膵臓病のような病気の治療に使用可能な薬に関する。
【背景技術】
【0002】
AMPキナーゼ(AMPK)とは、細胞内エネルギー量の低下(AMP/ATP比の上昇)を感知して活性化するセリン・スレオニンリン酸化酵素をいう。骨格筋収縮や低酸素などのさまざまなストレス刺激がAMPKを活性化することが知られている。またインスリン感受性増強作用を有するホルモンであるレプチンやアディポネクチン、さらには抗糖尿病薬として使用されているチアゾリジン誘導体やメトフォルミンまでもがAMPKを活性化することが最近明らかとなった。
【0003】
AMPKの活性化は、骨格筋や肝臓での脂肪酸β酸化を促進し、細胞内脂肪含量を減少させる結果、これらの臓器に生じたインスリン抵抗性を改善する。さらに肝臓での糖新生抑制、脂肪酸合成低下および骨格筋によるグルコース利用の促進など、多彩な代謝調節作用を併せもつことから、AMPKは2型糖尿病の新たな分子標的因子として脚光を浴びている。
【0004】
AMPKはエネルギー代謝調節において中心的役割を果たしていることから、2型糖尿病の新たな分子標的因子の他にも、メタボリック症候群や癌の発生に関係することで関心を集めている。AMPKの活性化剤としては現在AICAR (5’-aminoimidasole-4-carbox-amide-1-β-D-ribofaranoside)とメトホルミンとチアゾリジン誘導体(TZD)が知られている(非特許文献1参照)。いずれもAMPKのリン酸化を亢進させAMPKの活性化亢進を狙ったものである。
【0005】
しかしながら、血糖値はある程度下げるが、AMPKが本来有している体重減少の効果はみられず、AMPK活性化剤としては改善の余地が多かった。また、飽食の時代におけるAMPKの不活性化が、メタボリック症候群や癌を引き起こすとの報告もあり(非特許文献2参照)、これまでのAMPK活性化剤では、こうした疾病対策の要望に十分に応えているとはいえなかった。
【非特許文献1】「医学のあゆみ」第208巻、第5号(2004)、pp313-317
【非特許文献2】「トレンド・ファーマコル・サイエンス(Trends Pharmacol Sci.)、第26巻(2005)、pp69-76
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明はAMPKの活性化及び非活性化の制御方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明は以下の発明に関する。
プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として含む薬。
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターを含む薬。
プロテインホスファターゼ2Cε(PP2Cε)とAMPキナーゼ(AMPK)の会合を阻害するAMPKが介在するシグナル由来の非ヒト哺乳動物に対する病気の治療方法。
標本中のPP2Cε遺伝子活性の変化を検出するAMPKが介在するシグナル由来の病気細胞の検出方法。
PP2CεのmRNAの遺伝学的配列に相補的な分子プローブと、分子プローブとmRNAのハイブリダイゼーションを検出する手段と、PP2Cε遺伝子の活性を示す検出手段と、を含むPP2Cε活性を検出するキット。
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたタンパク質もしくはペプチド。
PP2Cεのための発現可能な遺伝学的核酸配列が導入されたタンパク質もしくはペプチド。
AMPKの脱リン酸化酵素作用を持つプロテインホスファターゼ2Cε(PP2Cε)の使用。
【発明の効果】
【0008】
本発明によれば、AMPKの活性化及び非活性化の制御方法が提供される。
【発明を実施するための最良の形態】
【0009】
以下に、実施形態を挙げて本発明の説明を行うが、本発明は以下の実施形態に限定されるものではない。尚、図中同一の機能又は類似の機能を有するものについては、同一又は類似の符号を付して説明を省略する。
【0010】
[AMPKとタンパク質ホスファターゼ−2Cε(PP2Cε)の関係]
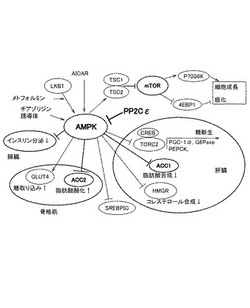
図20はAMPK周辺のシグナル図を示す。図20中の略記号の意味は符号の説明の欄に記載の通りである:
PP2Cε:プロテインホスファターゼ2Cε(protein phosphatase 2Cε)、
AMPK:AMPキナーゼ(adenosine mono phosphate (AMP)-activated protein kinase)、
CREB:環状AMP応答要素結合タンパク(cAMP response element-binding protein)、
TORC2:transducer of regulated CREB activity 2、
PGC-1α:peroxisome proliferative activated receptor-γ co-activator 1α、
G6Pase:グルコース6リン酸脱リン酸化酵素(glucose-6-phosphatase)、
PEPCK:ホスフォエノールピルビン酸脱リン酸化酵素(phosphoenolpyruvate carboxykinase)、
ACC1:アセチルCoAカルボキシラーゼ1(acetyle-CoA carboxylases 1)、
HMGR:HMG-CoA還元酵素(3-hydroxy-3-methylglutaryl-CoA reductase)、
SREBP-1:sterol regulatory element-binding protein 1、
ACC2:アセチルCoAカルボキシラーゼ2(acetyle-CoA carboxylases 2)、
GLUT4:インスリン反応性4型糖輸送担体(glucose transporter 4)、
LKB1:Peutz-Jeghers症候群原因遺伝子(Peutz-Jeghers syndrome gene)、
AICAR:5-aminoimidazole-4-carboxamide-1-β-D-ribofuranoside、
TSC1:結節性硬化症複合体1 (The tuberous sclerosis complex 1)、
TSC2:結節性硬化症複合体2(The tuberous sclerosis complex 2)、
mTOR:ラパマイシンの哺乳類標的遺伝子(The mammalian target of rapamycin)、
p70S6K:p70S6キナーゼ(p70 ribosomal S6 kinase)、
4E-BP1:eukaryotic initiation factor 4E-binding protein 1。
【0011】
図20に示すように、AMPKの下流には肝臓における脂肪酸合成に寄与するACC1、骨格筋における脂肪酸酸化に寄与するACC2、骨格筋における糖の取り込みに寄与するGLUT4、細胞成長に寄与するmTORが存在する。このようにAMPKはエネルギー代謝調節において中心的役割を果たしており、メタボリック症候群や癌の発生に関係することで関心を集めている(「トレンド・ファーマコル・サイエンス(Trends Pharmacol Sci.)」第26巻(2005)、pp69-76参照)。そして、PP2Cファミリメンバー(サブタイプは不明)が、AMP-activated protein kinase α(AMPKα)のThr172を脱リン酸化し不活性化させることが報告されて以来、いくつかの研究グループにより、PP2CファミリーがAMPKの負の制御因子であることを示唆する報告が行われてきた。
【0012】
例えば、1991年にPP2Cファミリーメンバー(サブタイプ不明)がAMP-activated protein kinaseα(AMPKα)のThr172を脱リン酸化し、不活性化させることを示唆する報告が行われた(「ユーロジャーナルバイオケミストリー(Eur. J. Biochem)」第199巻(1991), pp691-697参照)。また、1995年と1996年には大腸菌によるin vitro kinase assayによりAMPKがヒトPP2Cαによって脱リン酸化され、不活性化されることが報告された(FEBS Letters 第377巻(1995), pp421-425、「バイオケミストリージャーナル(Biochem. J.)」第320巻(1996), pp801-806参照)。さらに、2004年には、ラット心臓においてヒトPP2CαがAMPKの活性化を阻害することが報告されている(「ユーロジャーナルバイオケミストリー(Eur. J. Biochem.)」第271巻(2004), pp2215-2224参照)。2005年には、肥満したラット心筋細胞においてPP2Cの発現が増大しAMPKのリン酸化が抑制されていることが示された(AJP-Endo. 第288巻(2005), pp216-221参照)。また、この肥満ラットにチアゾリジン誘導体であるトリグリタゾン(Triglitazone)を投与することにより、心筋細胞におけるPP2Cの発現が低下し、AMPKのリン酸化が亢進するという、AMPKとPP2Cの逆相関を示す報告が行われた(AJP-Endo. 第288巻(2005), pp216-221参照)。
【0013】
ACC2のノックアウトマウスは、高脂肪高カロリー食を与えても、体重や血糖値の上昇がほとんどなく(サイエンス(Science)第291巻(2001), pp2613-2616、ピーナス(PNAS)第100巻(2003), pp10207-10212参照)、ACC1のノックアウトマウスでは、胎生致死が報告されている(ピーナス(PNAS)第102巻(2005), pp12011-12016参照)。また、mTORは細胞成長や癌化に関係している(「トレンド・ファーマコル・サイエンス(Trends Pharmacol Sci.)」第26巻(2005)、pp69-76、遺伝子と開発(Genes & Dev.)第16巻(2002), pp1472-1487参照)。「ユーロジャーナルバイオケミストリー(Eur. J. Biochem.)」第271巻(2004), pp2215-2224は、ラットの心臓由来のPP2Cαによるin vitroでの不活性化をみたもので、後に実施例の欄で説明するPP2Cεノックアウトマウスの解析と比較して、生理的変化および影響力はみられていない。AJP-Endo. 第288巻(2005), pp216-221は、チアゾリジン誘導体に属するトリグリタゾン(triglitazone/TGZ)を肥満モデルマウスに投与後、心筋細胞におけるPP2Cの発現低下とAMPKのリン酸化亢進を観察したものである。そしてFEBS Letters 第377巻(1995), pp421-425の引用により、TGZがPP2Cの発現を低下させ、これによりAMPKの活性化が引き起こされるとしている。しかし、PP2Cの発現低下とAMPKの活性化亢進の関連性は証明されていない。
【0014】
PP2Cファミリーメンバーの内、どのメンバーが細胞内で生理的なAMPKの抑制因子としての役割を担うのかについてはこれまで不明であった。そのため、PP2Cの発現低下とAMPKの活性化亢進の関連性を生理学的に証明する報告が待たれていた。
【0015】
本発明者は鋭意研究の結果、後に実施例の欄で説明するように、PP2Cε欠損のノックアウトマウスを解析したところ、PP2Cεが細胞内においてAMPKの負の制御因子として機能することを知見した。即ち本発明者は、PP2Cεノックアウトマウスに観察された低体重や低血糖などのフェノタイプがPP2CεがAMPKの脱リン酸化酵素によるものであることを知見した。かかる実施例においてPP2Cεノックアウトマウスは、AMPKの活性化を亢進し、低体重、低血糖および低インスリン値を示し、高脂肪高カロリー食の下でも肥満にならない特徴を有していた。この結果から生理活性が示された。また分子細胞生物学的レベルでもPP2CεによるAMPKの脱リン酸化が濃度依存的に起こり、PP2CεとAMPKの結合も示された。PP2CεはAMPKの脱リン酸化酵素であることが示された。しかも生体内での生理活性についても十分な影響を及ぼすことにより、AMPKを活性化する上で、PP2Cεの発現あるいはPP2CεとAMPKの結合抑制はメトフォルミン、AICARおよびチアゾリジン誘導体を遥かに凌ぐと考える。
【0016】
本発明者の上記知見により、図20に示すように、PP2Cεが欠損することにより、AMPKがリン酸化の亢進により活性化され、下流のACC1、ACC2、mTORの不活性化とGLUT4の活性化が起こる。かかるPP2CεとAMPKの相互作用を活用すれば、AMPK周辺のシグナルに関与する薬、治療方法、バイオキット等を提供することができる。以下実施形態を挙げて本発明をより詳しく説明する。
【0017】
[薬及び治療方法]
本実施形態によれば、以下の薬や治療方法が提供される。
プロテインホスファターゼ2Cε(PP2Cε)とAMPキナーゼ(AMPK)の会合を阻害する成分を含む薬。プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として含む薬。PP2Cεに対するRNA干渉としては、RNAi, siRNA, shRNAが挙げられる。PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターを含む薬。PP2Cεに対するRNA干渉を含むSNALPカプセル剤。PP2Cεに対するRNA干渉が組み込まれたベクター。PP2Cεに対するRNA干渉がセンダイウイルスに組み込まれたベクター。
【0018】
プロテインホスファターゼ2Cε(PP2Cε)とAMPキナーゼ(AMPK)の会合を阻害するAMPKが介在するシグナル由来の病気の治療方法。プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として用いるAMPKが介在するシグナル由来の病気の治療方法。PP2Cεに対するRNA干渉としては、RNAi, siRNA, shRNAからなる群から選択されるものであるAMPKが介在するシグナル由来の病気の治療方法。PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターを患部に適用するAMPKが介在するシグナル由来の病気の治療方法。
【0019】
上記の薬、SNALPカプセル剤、ベクター、治療方法は、AMPKの脱リン酸化酵素としてのPP2Cεの作用の抑制を行うことができるため、AMPKの脱リン酸化を調整することができる。そのため上記の薬、SNALPカプセル剤、ベクター、治療方法は、AMPKが介在するシグナル由来の病気に用いられる。
【0020】
具体的には本実施形態にかかる薬は、AMPKの活性化亢進をAICAR(5-aminoimidazole-4-carboxamide-1-β-D-ribofuranoside)、メトフォルミンおよびチアゾリジン誘導体(TZD)などの従来の薬物以上に亢進させるため、2型糖尿病の治療薬として使用することができる。またメタボリック症候群や癌の予防薬、さらに動脈硬化症の予防治療薬としても使用することができる。その他にも、本実施形態にかかる薬は、肝臓病、膵臓病等にも用いることができる。SNALPカプセル剤、ベクター、治療方法についても薬と同様に種々の病気に用いることができる。
【0021】
ここで、「メタボリック・シンドローム(代謝異常症候群)」とは、シンドロームX(リーベン(Reaven), 1988)、死の四重奏(カプラン(Kaplan), 1989)、インスリン抵抗性症候群(デ・フロンゾ(De Fronzo),1991)、内臓脂肪症候群とも呼ばれる複合生活習慣病をいう。1つ1つは病気ではなくても、複数合わせると「立派な病気」とされるのが「メタボリック・シンドローム」である。メタボリック・シンドロームは、動脈硬化の危険因子である「肥満」、「高血圧」、「高血糖」、「高脂血症」を重複して発症していることがある。この人達は心筋梗塞や脳梗塞になり易い傾向がある。肥満に関しては、上半身肥満のうち内臓脂肪型肥満をいう。また、高インスリン血症もみられる。
【0022】
メタボリック・シンドロームの診断基準としては、主に米国高脂血症治療ガイドラインと世界保健機構(WHO)による診断基準の2種類がある。米国高脂血症治療ガイドライン(ATPIII:Adult Treatment Panel III, NCEP National Cholesterol Education Program)では、以下の5項目のうち3項目が該当するとメタボリック・シンドロームと診断できるとされている:1)ウエスト(腹囲)が男性で102cm以上(日本人では85cm以上)、女性で88cm以上(日本人では90cm以上)、2)中性脂肪が150mg/dl以上、3)HDLコレステロールが男性で40mg/dl未満、女性で50mg/dl未満、4)血圧が最大血圧で130mmHg以上または最小血圧で85mmHg以上、5)空腹時血糖値が110mg/dl以上。
【0023】
WHOによる診断基準では、高インスリン血症(非糖尿病患者の上位25%)または空腹時血糖110mg/dl以上に加え、以下の2項目に該当するとメタボリック・シンドロームと診断できるとされている:1)内臓肥満ウエスト/ヒップ比>0.9(男性)、>0.85(女性)またはBMI30以上または腹囲94cm以上、2)脂質代謝異常:中性脂肪150mg/dl以上またはHDLコレステロール35mg/dl未満(男性)、39mg/dl未満(女性)、3)高血圧140/90mmHg以上か降圧剤内服中、4)マイクロアルブミン尿症(尿中アルブミン排泄率20μg/min以上か尿中アルブミン/クレアチニン比30mg/g.Cr以上)。
【0024】
上記基準の他に、日本動脈硬化学会、日本糖尿病学会、日本高血圧学会、日本循環器学会、日本腎臓病学会、日本血栓止血学会、日本肥満学会、日本内科学会の委員で構成される「メタボリックシンドローム診断基準検討委員会」が定めた、日本におけるメタボリックシンドロームの診断基準では、以下の1)の要件を満たし、さらに以下の2)、3)、4)のうち2つ以上があてはまる場合に、メタボリックシンドロームと診断できるとされている:1)ウエスト周囲:男性 85cm以上、女性 90cm以上、2)血中脂質(脂質代謝異常):中性脂肪(トリグリセリド)値が150mg/dL以上、又はHDLコレステロール(善玉コレステロール)値が40mg/dL未満のいずれか、又は両方、3)血圧:収縮期血圧が130mmHg以上、拡張期血圧が85mmHg以上、4)血糖(糖代謝)空腹時血糖値:110mg/dL以上。
【0025】
メタボリック・シンドロームが複合生活習慣病であるがゆえに、診断基準は必ずとも一義的ではないが、人種や居住地域等に基づいて、上記判断基準のうちから選ばれた判断基準に基いて判断されるものである。
【0026】
(肝臓病治療薬及び肝臓病治療方法)
PP2Cεに対するRNA干渉(RNAi, siRNA, shRNAなど)を肝臓に導入することにより肝臓病治療を行うことができる。例えば安定な核酸脂質粒子(SNALP)カプセル中にPP2Cεに対するRNA干渉(RNAi, siRNA, shRNAなど)を封入し静脈投与する方法が挙げられる。この技術はすでに安定なアポリポタンパク質B(ApoB)のサイレンシングを起こすために、安定な核酸脂質粒子(SNALP)カプセル中にApoBにsiRNAを封入し、1または2.5 mg/kgの投与量でカニクイザルに静脈投与を行った研究で報告されている(ネーチャー(Nature)第441巻(2006), pp111-114参照)。
【0027】
(骨格筋治療薬及び骨格筋治療方法)
PP2Cεに対するRNA干渉(RNAi, siRNA, shRNAなど)を骨格筋、脂肪組織へ導入することにより骨格筋治療を行うことができる。例えばPP2Cεに対するRNA干渉をウィルスベクターに組み込み、骨格筋や脂肪組織に直接注射で注入する方法が挙げられる。この技術はすでにHGF(hepatocyte growth factor)遺伝子をセンダイウイルス(Sendai virus)に組み込んで大腿筋に注入し、閉塞性動脈硬化症の治療として森下竜一氏によって開発され、臨床応用されている(「脈管学」第44巻(2004)、第3号、pp85-98、「脈管学」第44巻(2004)、第4号、pp145-150参照)。
【0028】
本実施形態にかかる薬を予防・治療剤として使用する場合は、少なくとも90%、好ましくは95%以上、より好ましくは98%以上、さらに好ましくは99%以上に精製されたものを使用するのが好ましい。
【0029】
本実施形態にかかる薬は、例えば、必要に応じて糖衣を施した錠剤、カプセル剤、エリキシル剤、マイクロカプセル剤などとして経口的に、あるいは水もしくはそれ以外の薬学的に許容し得る液との無菌性溶液、または懸濁液剤などの注射剤の形で非経口的に使用できる。例えば、本実施形態にかかる薬を生理学的に認められる担体、香味剤、賦形剤、ベヒクル、防腐剤、安定剤、結合剤などとともに一般に認められた製剤実施に要求される単位用量形態で混和することによって製造することができる。これら製剤における有効成分量は指示された範囲の適当な用量が得られるようにするものである。
【0030】
錠剤、カプセル剤などに混和することができる添加剤としては、例えば、ゼラチン、コーンスターチ、トラガント、アラビアゴムのような結合剤、結晶性セルロースのような賦形剤、コーンスターチ、ゼラチン、アルギン酸などのような膨化剤、ステアリン酸マグネシウムのような潤滑剤、ショ糖、乳糖またはサッカリンのような甘味剤、ペパーミント、アカモノ油またはチェリーのような香味剤などが用いられる。調剤単位形態がカプセルである場合には、上記タイプの材料にさらに油脂のような液状担体を含有することができる。注射のための無菌組成物は注射用水のようなベヒクル中の活性物質、胡麻油、椰子油などのような天然産出植物油などを溶解または懸濁させるなどの通常の製剤実施に従って処方することができる。
【0031】
注射用の水性液としては、例えば、生理食塩水、ブドウ糖やその他の補助薬を含む等張液(例えば、D−ソルビトール、D−マンニトール、塩化ナトリウムなど)などが挙げられ、適当な溶解補助剤、例えば、アルコール(例えば、エタノールなど)、ポリアルコール(例えば、プロピレングリコール、ポリエチレングリコールなど)、非イオン性界面活性剤(例えば、ポリソルベート80TM、HCO−50など)などと併用してもよい。油性液としては、例えば、ゴマ油、大豆油などが挙げられ、溶解補助剤として安息香酸ベンジル、ベンジルアルコールなどと併用してもよい。また、緩衝剤(例えば、リン酸塩緩衝液、酢酸ナトリウム緩衝液など)、無痛化剤(例えば、塩化ベンザルコニウム、塩酸プロカインなど)、安定剤(例えば、ヒト血清アルブミン、ポリエチレングリコールなど)、保存剤(例えば、ベンジルアルコール、フェノールなど)、酸化防止剤などと配合してもよい。調製された注射液は、通常、適当なアンプルに充填される。
【0032】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターも上記と同様に製剤化され、通常、非経口的に使用される。
【0033】
このようにして得られる製剤は、安全で低毒性であるので、例えば、温血動物(例えば、ヒト、ラット、マウス、モルモット、ウサギ、トリ、ヒツジ、ブタ、ウシ、ウマ、ネコ、イヌ、サル、チンパンジーなど)に対して投与することができる。
【0034】
本実施形態にかかる薬の投与量は、対象疾患、投与対象、投与ルートなどにより差異はあるが、例えば、動脈硬化性疾患の治療目的で本実施形態にかかる薬を経口投与する場合、一般的に成人(体重60kgとして)においては、一日につき薬を約0.1〜100mg、好ましくは約1.0〜50mg、より好ましくは約1.0〜20mg投与する。非経口的に投与する場合は、本実施形態にかかる薬の1回投与量は投与対象、対象疾患などによっても異なるが、例えば、動脈硬化性疾患の治療目的で本実施形態にかかる薬を注射剤の形で成人(体重60kgとして)に投与する場合、一日につき薬を約0.01〜30mg、好ましくは約0.1〜20mg、より好ましくは約0.1〜10mgを患部に注射することにより投与するのが好都合である。他の動物の場合も、体重60kg当たりに換算した量を投与することができる。
【0035】
本実施形態にかかる薬を治療・予防剤として製剤化して使用することができる。例えば、経口投与のための組成物としては、固体または液体の剤形、具体的には錠剤(糖衣錠、フィルムコーティング錠を含む)、丸剤、顆粒剤、散剤、カプセル剤(ソフトカプセル剤を含む)、シロップ剤、乳剤、懸濁剤などが挙げられる。かかる組成物は自体公知の方法によって製造され、製剤分野において通常用いられる担体、希釈剤もしくは賦形剤を含有するものである。例えば、錠剤用の担体、賦形剤としては、乳糖、でんぷん、蔗糖、ステアリン酸マグネシウムなどが用いられる。
【0036】
非経口投与のための組成物としては、例えば、注射剤、坐剤などが用いられ、注射剤は静脈注射剤、皮下注射剤、皮内注射剤、筋肉注射剤、点滴注射剤、関節内注射剤などの剤形を包含する。かかる注射剤は、自体公知の方法に従って、例えば、上記薬を通常注射剤に用いられる無菌の水性もしくは油性液に溶解、懸濁または乳化することによって調製する。注射用の水性液としては、例えば、生理食塩水、ブドウ糖やその他の補助薬を含む等張液などが用いられ、適当な溶解補助剤、例えば、アルコール(例、エタノール)、ポリアルコール(例、プロピレングリコール、ポリエチレングリコール)、非イオン界面活性剤〔例、ポリソルベート80、HCO−50(polyoxyethylene(50mol)adduct of hydrogenated castor oil)〕などと併用してもよい。油性液としては、例えば、ゴマ油、大豆油などが用いられ、溶解補助剤として安息香酸ベンジル、ベンジルアルコールなどを併用してもよい。調製された注射液は、通常、適当なアンプルに充填される。直腸投与に用いられる坐剤は、上記薬を通常の坐薬用基剤に混合することによって調製される。
【0037】
経口用または非経口用医薬組成物は、活性成分の投与量に適合するような投薬単位の剤形に調製されることが好都合である。かかる投薬単位の剤形としては、錠剤、丸剤、カプセル剤、注射剤(アンプル)、坐剤などが例示され、それぞれの投薬単位剤形当たり通常5〜500mg、とりわけ注射剤では5〜100mg、その他の剤形では10〜250mgの上記化合物が含有されていることが好ましい。
【0038】
尚、各組成物は、化合物との配合により好ましくない相互作用を生じない限り他の活性成分を含有してもよい。
【0039】
[検出方法]
本発明の実施形態としては、患者から単離された標本中のPP2Cε遺伝子活性の変化を検出するAMPKが介在するシグナル由来の病気細胞の検出方法が提供される。
標本としては、組織の生検および体液のいずれか一方を用いることができる。標本の例としては、尿、血液、脳脊髄液および唾液が挙げられる。変化としては、正常コントロールと比べたPP2Cε遺伝子活性の増加が挙げられる。検出工程が、その多形性を含むPP2CεDNAに相補的なmRNAについて、インシツ(in situ)ハイブリダイゼーション、ノザンブロッティングおよび逆転写酵素−ポリメラーゼ連鎖反応からなる群から選ばれるアッセイを用いて、標本をアッセイすることが好ましい。
【0040】
また検出工程が、その多形性およびそのペプチドフラグメントを含むPP2Cε遺伝子産物について、免疫組織化学的および免疫細胞化学的染色、ELISA、RIA、免疫ブロット、免疫沈降反応、ウェスタンブロッティング、機能アッセイ並びに蛋白短縮テストからなる群から選ばれるアッセイを用いて標本をアッセイすることが好ましい。
【0041】
標本中のPP2Cε遺伝子活性の検出が、PP2Cε遺伝子産物によって影響を受ける蛋白の燐酸化パターンにおける変化を決定することが好ましい。AMPKが介在するシグナル由来の病気としては、2型糖尿病、メタボリック症候群、癌、動脈硬化症、肝臓病、膵臓病が挙げられるがこれらには限定されない。
【0042】
[バイオキット]
本発明の実施形態としては、以下のバイオキットが提供される。
PP2CεのmRNAの遺伝学的配列に相補的な分子プローブと、分子プローブとmRNAのハイブリダイゼーションを検出する手段と、PP2Cε遺伝子の活性を示す検出手段と、を含むPP2Cε活性を検出するキット。PP2Cε遺伝子産物と結合する天然の蛋白を模倣する薬剤と、薬剤の結合を検出し遺伝子産物の存在を示す検出手段と、を含むPP2Cε遺伝子活性に付随する遺伝子産物を検出するキット。
【0043】
[ノックアウトタンパク質等]
本発明の実施形態としては、以下のようなノックアウトタンパク質等が提供される。
【0044】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたタンパク質もしくはペプチド。PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた非ヒト哺乳類又は細胞株。PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクター。PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたマウス。
【0045】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた非ヒト哺乳類又は細胞株とは、上記非ヒト哺乳動物が有する本実施形態のDNAに人為的に変異を加えることにより、DNAの発現能を抑制するか、もしくは上記DNAがコードしている本実施形態のタンパク質の活性を実質的に喪失させることにより、DNAが実質的に本実施形態のタンパク質の発現能を有さない(以下、本実施形態のノックアウトDNAと称することがある)非ヒト哺乳動物の胚幹細胞(以下、ES細胞と略記する)をいう。
【0046】
非ヒト哺乳動物としては、例えば、ウシ、ブタ、ヒツジ、ヤギ、ウサギ、イヌ、ネコ、モルモット、ハムスター、マウス、ラットなどが用いられる。なかでも、病体動物モデル系の作成の面から個体発生および生物サイクルが比較的短く、また、繁殖が容易なゲッ歯動物、とりわけマウス(例えば、純系として、C57BL/6系統,DBA2系統など、交雑系として、B6C3F1系統,BDF1系統,B6D2F1系統,BALB/c系統,ICR系統など)またはラット(例えば、Wistar,SDなど)などが好ましい。
【0047】
哺乳動物において発現しうる組換えベクターにおける「哺乳動物」としては、上記の非ヒト哺乳動物の他にヒトなどが挙げられる。
【0048】
本実施形態にかかるDNAに人為的に変異を加える方法としては、例えば、遺伝子工学的手法により上記DNA配列の一部又は全部の削除、他DNAを挿入または置換させることによって行なうことができる。これらの変異により、例えば、コドンの読み取り枠をずらしたり、プロモーターあるいはエキソンの機能を破壊することにより本実施形態のノックアウトDNAを作製すればよい。
【0049】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列が不活性化された非ヒト哺乳動物胚幹細胞(以下、本実施形態のDNA不活性化ES細胞または本実施形態のノックアウトES細胞と略記する)の具体例としては、例えば、目的とする非ヒト哺乳動物が有する本実施形態のDNAを単離し、そのエキソン部分にネオマイシン耐性遺伝子、ハイグロマイシン耐性遺伝子を代表とする薬剤耐性遺伝子、あるいはlactZ(β−ガラクトシダーゼ遺伝子)、cat(クロラムフェニコールアセチルトランスフェラーゼ遺伝子)を代表とするレポーター遺伝子等を挿入することによりエキソンの機能を破壊するか、あるいはエキソン間のイントロン部分に遺伝子の転写を終結させるDNA配列(例えば、polyA付加シグナルなど)を挿入し、完全なメッセンジャーRNAを合成できなくすることによって、結果的に遺伝子を破壊するように構築したDNA配列を有するDNA鎖(以下、ターゲッティングベクターと略記する)を、例えば相同組換え法により上記動物の染色体に導入し、得られたES細胞について本実施形態のDNA上あるいはその近傍のDNA配列をプローブとしたサザンハイブリダイゼーション解析あるいはターゲッティングベクター上のDNA配列とターゲッティングベクター作製に使用した本実施形態のDNA以外の近傍領域のDNA配列をプライマーとしたPCR法により解析し、本実施形態のノックアウトES細胞を選別することにより得ることができる。
【0050】
また、相同組換え法等により本実施形態のDNAを不活化させる元のES細胞としては、例えば、前述のような既に樹立されたものを用いてもよく、また公知 EvansとKaufmaの方法に準じて新しく樹立したものでもよい。例えば、マウスのES細胞の場合、現在、一般的には129系のES細胞が使用されているが、免疫学的背景がはっきりしていないので、これに代わる純系で免疫学的に遺伝的背景が明らかなES細胞を取得するなどの目的で例えば、C57BL/6マウスやC57BL/6の採卵数の少なさをDBA/2との交雑により改善したBDF1マウス(C57BL/6とDBA/2とのF1)を用いて樹立したものなども良好に用いうる。BDF1マウスは、採卵数が多く、かつ、卵が丈夫であるという利点に加えて、C57BL/6マウスを背景に持つので、これを用いて得られたES細胞は病態モデルマウスを作出したとき、C57BL/6マウスとバッククロスすることでその遺伝的背景をC57BL/6マウスに代えることが可能である点で有利に用い得る。
【0051】
また、ES細胞を樹立する場合、一般には受精後3.5日目の胚盤胞を使用するが、これ以外に8細胞期胚を採卵し胚盤胞まで培養して用いることにより効率よく多数の初期胚を取得することができる。
【0052】
また、雌雄いずれのES細胞を用いてもよいが、通常雄のES細胞の方が生殖系列キメラを作出するのに都合が良い。また、煩雑な培養の手間を削減するためにもできるだけ早く雌雄の判別を行なうことが望ましい。
【0053】
ES細胞の雌雄の判定方法としては、例えば、PCR法によりY染色体上の性決定領域の遺伝子を増幅、検出する方法が、その1例としてあげることができる。この方法を使用すれば、従来、核型分析をするのに約106個の細胞数を要していたのに対して、1コロニー程度のES細胞数(約50個)で済むので、培養初期におけるES細胞の第一次セレクションを雌雄の判別で行なうことが可能であり、早期に雄細胞の選定を可能にしたことにより培養初期の手間は大幅に削減できる。
【0054】
また、第二次セレクションとしては、例えば、G−バンディング法による染色体数の確認等により行うことができる。得られるES細胞の染色体数は正常数の100%が望ましいが、樹立の際の物理的操作等の関係上困難な場合は、ES細胞の遺伝子をノックアウトした後、正常細胞(例えば、マウスでは染色体数が2n=40である細胞)に再びクローニングすることが望ましい。
【0055】
このようにして得られた胚幹細胞株は、通常その増殖性は大変良いが、個体発生できる能力を失いやすいので、注意深く継代培養することが必要である。例えば、STO繊維芽細胞のような適当なフィーダー細胞上でLIF(1−10000U/ml)存在下に炭酸ガス培養器内(好ましくは、5%炭酸ガス、95%空気または5%酸素、5%炭酸ガス、90%空気)で約37℃で培養するなどの方法で培養し、継代時には、例えば、トリプシン/EDTA溶液(通常0.001−0.5%トリプシン/0.1−5mM EDTA、好ましくは約0.1%トリプシン/1mM EDTA)処理により単細胞化し、新たに用意したフィーダー細胞上に播種する方法などがとられる。このような継代は、通常1〜3日毎に行うが、この際に細胞の観察を行い、形態的に異常な細胞が見受けられた場合はその培養細胞は放棄することが望まれる。
【0056】
ES細胞は、適当な条件により、高密度に至るまで単層培養するか、または細胞集塊を形成するまで浮遊培養することにより、頭頂筋、内臓筋、心筋などの種々のタイプの細胞に分化させることが可能である(M. J. Evans及びM. H. Kaufman, ネイチャー(Nature)第292巻、154頁、1981年;G. R. Martin プロシーディングス・オブ・ナショナル・アカデミー・オブ・サイエンス・ユーエスエー(Proc. Natl. Acad. Sci. U.S.A.)第78巻、7634頁、1981年;T. C. Doetschman ら、ジャーナル・オブ・エンブリオロジー・アンド・エクスペリメンタル・モルフォロジー、第87巻、27頁、1985年)。
【0057】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた非ヒト哺乳類は、上記動物のmRNA量を公知方法を用いて測定して間接的にその発現量を比較することにより、正常動物と区別することが可能である。上記非ヒト哺乳類としては、上記と同様のものが用いられる。
【0058】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた非ヒト哺乳類は、例えば、前述のようにして作製したターゲッティングベクターをマウス胚幹細胞またはマウス卵細胞に導入し、導入によりターゲッティングベクターの本実施形態のDNAが不活性化されたDNA配列が遺伝子相同組換えにより、マウス胚幹細胞またはマウス卵細胞の染色体上のPP2Cεのための発現可能な遺伝学的核酸配列と入れ換わる相同組換えをさせることにより、PP2Cεの発現をノックアウトさせることができる。
【0059】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた細胞は、PP2Cεのための発現可能な遺伝学的核酸配列またはその近傍のDNA配列をプローブとしたサザンハイブリダイゼーション解析またはターゲッティングベクター上のDNA配列と、ターゲッティングベクターに使用したマウス由来の本実施形態のDNA以外の近傍領域のDNA配列とをプライマーとしたPCR法による解析で判定することができる。非ヒト哺乳動物胚幹細胞を用いた場合は、遺伝子相同組換えにより、PP2Cεのための発現可能な遺伝学的核酸配列が不活性化された細胞株をクローニングし、その細胞を適当な時期、例えば、8細胞期の非ヒト哺乳動物胚または胚盤胞に注入し、作製したキメラ胚を偽妊娠させた上記非ヒト哺乳動物の子宮に移植する。作出された動物は正常な本実施形態のDNA座をもつ細胞と人為的に変異した本実施形態のDNA座をもつ細胞との両者から構成されるキメラ動物である。
【0060】
上記キメラ動物の生殖細胞の一部が変異した本実施形態のDNA座をもつ場合、このようなキメラ個体と正常個体を交配することにより得られた個体群より、全ての組織が人為的に変異を加えた本実施形態のDNA座をもつ細胞で構成された個体を、例えば、コートカラーの判定等により選別することにより得られる。このようにして得られた個体は、通常、本実施形態のタンパク質のヘテロ発現不全個体であり、本実施形態のタンパク質のヘテロ発現不全個体同志を交配し、それらの産仔から本実施形態のタンパク質のホモ発現不全個体を得ることができる。
【0061】
卵細胞を使用する場合は、例えば、卵細胞核内にマイクロインジェクション法でDNA溶液を注入することによりターゲッティングベクターを染色体内に導入したトランスジェニック非ヒト哺乳動物を得ることができ、これらのトランスジェニック非ヒト哺乳動物に比べて、遺伝子相同組換えにより本実施形態のDNA座に変異のあるものを選択することにより得られる。
【0062】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた個体は、交配により得られた動物個体も上記DNAがノックアウトされていることを確認して通常の飼育環境で飼育継代を行なうことができる。
【0063】
さらに、生殖系列の取得および保持についても常法に従えばよい。すなわち、PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたDNAを保有する雌雄の動物を交配することにより、上記不活化DNAを相同染色体の両方に持つホモザイゴート動物を取得しうる。得られたホモザイゴート動物は、母親動物に対して、正常個体1,ホモザイゴート複数になるような状態で飼育することにより効率的に得ることができる。ヘテロザイゴート動物の雌雄を交配することにより、上記不活化DNAを有するホモザイゴートおよびヘテロザイゴート動物を繁殖継代する。
【0064】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた非ヒト哺乳類又は細胞株は、AMPKの生物活性を欠失するため、AMPKが介在するシグナル由来の病気のモデルとなり得るので、これらの疾病の原因究明及び治療法の検討に有用である。
【0065】
PP2Cεのための発現可能な遺伝学的核酸配列を備えるタンパク質の発現量が増加している場合、例えば、動脈硬化性疾患などの種々の疾患が発症する。
【0066】
したがって、PP2Cεのための発現可能な遺伝学的核酸配列をコードするタンパク質が上昇している患者がいる場合、本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたタンパク質を患者に投与し、生体内で本実施形態にかかるタンパク質を発現させて患者のAMPKの脱リン酸化を調整することができる。
【0067】
本実施形態にかかるタンパク質を上記の予防・治療剤として使用する場合は、本実施形態にかかるタンパク質を単独あるいはレトロウィルスベクター、アデノウィルスベクター、アデノウィルスアソシエーテッドウィルスベクターなどの適当なベクターに挿入した後、常套手段に従って、ヒトまたは温血動物に投与することができる。本実施形態にかかるタンパク質は、そのままで、あるいは摂取促進のための補助剤などの生理学的に認められる担体とともに製剤化し、遺伝子銃やハイドロゲルカテーテルのようなカテーテルによって投与できる。
【0068】
(その他の実施形態)
上記のように、本発明は実施形態によって記載したが、この開示の一部をなす論述及び図面はこの発明を限定するものであると理解すべきではない。この開示から当業者には様々な代替実施の形態、実施例及び運用技術が明らかとなろう。
【0069】
例えば、実施形態の変形例としては、以下の発明が提供される。PP2Cεのための発現可能な遺伝学的核酸配列が導入されたタンパク質もしくはペプチド。PP2Cεのための発現可能な遺伝学的核酸配列が導入された遺伝子導入非ヒト哺乳類又は細胞株。PP2Cεのための発現可能な遺伝学的核酸配列が導入されたベクター。PP2Cεのための発現可能な遺伝学的核酸配列が導入されたマウス。またAMPKの脱リン酸化酵素作用を持つプロテインホスファターゼ2Cε(PP2Cε)の使用が提供される。
【0070】
このように、本発明はここでは記載していない様々な実施の形態等を含むことは勿論である。したがって、本発明の技術的範囲は上記の説明から妥当な特許請求の範囲に係る発明特定事項によってのみ定められるものである。
【実施例】
【0071】
(実施例1)
(PP2Cεノックアウトマウスの作製)
図1はターゲット(Targeting Vector/TV)構築および相同組換え図を示す。図1に示すようにPP2Cε遺伝子のEX1領域を、配列番号5のプロモーターレスのlacZ遺伝子と、配列番号6のポジティブセレクションマーカーであるネオマイシン耐性遺伝子とで置き換えて、PP2Cε遺伝子座を破壊した配列番号1のPP2Cεノックアウトマウスを作製した。
【0072】
相同組み換えESクローンにおけるサザンブロット(Southen blot)解析を以下の条件で行った。EcoRIを用いて消化されたDNAに対して5’プローブ(Prove)を用い、BglIIを用いて消化されたDNAに対して3’プローブ(Prove)を用い、Aseを用いて消化されたDNAに対してネオマイシン( Neo )プローブを用いた。ES細胞はTT2株を用いた。図2にサザンブロット解析図を示す。図2に示す野生型(+/+)および変異型ES細胞(+/-)におけるDNAはそれぞれ期待された位置にシグナルが確認された。
【0073】
EcoRIを用いて消化されたDNAについて5’プローブを用いて、マウスの尻尾(mouse tail)から精製したゲノムDNAにおけるサザンブロット解析を行った。図3にサザンブロット解析図を示す。野生型( PP2C+/+ ), ヘテロ( PP2C+/-) およびホモ( PP2C-/-)マウスにおけるDNAはそれぞれ期待された位置にシグナルが確認された。
【0074】
(実施例2)
(PP2Cεノックアウトマウスの表現型観察)
PP2Cεノックアウトマウスの表現型を確認するため、野生型(PP2Cε+/+)マウスとホモ( PP2C-/-)マウスの表現型の比較を行った。図4は生後24時間以内、図5は1週齢、図6は4週齢、図7は1年齢の同腹兄弟間の野生型( PP2Cε+/+ )およびホモ( PP2Cε-/- )マウス雄をそれぞれ示す。図4〜図7において、図面向かって左側が野生型( PP2Cε+/+ )および図面向かって右側がホモ( PP2Cε-/- )マウス雄を示す。図4〜図7に示すように、作製したホモ(PP2Cε-/-)マウスは、同腹野生型(PP2Cε+/+)マウスと比べ出生時より体重が軽かった。
【0075】
図8に示すように、ホモ( PP2Cε-/- )マウスの生存率は著しく低く、大多数は24時間以内に死亡した。生存可能であった1年齢のPP2Cε-/-マウス(3例)は、生殖能力は正常であったが、図9、図10、図11、図12に示すように、野生型に比べて体重、血糖値およびインスリン値が低かった。
【0076】
(実施例3)
(PP2CεがAMPKの活性化へ及ぼす影響(In vitro assay))
PP2CεがAMPKの活性化へ及ぼす影響(In vitro assay)を調べた。まずAMPK反応溶液にAMPK, active (upstate)のタンパク質10μl(20-100mU)とATP溶液10μlを入れ、30℃で15分振とうを行った。その後、PP2Cεタンパク質を入れたもの(0.8, 1.6, 2.4μg)と入れないものそれぞれ30℃、15振とうした。SDS化した後、ウエスタンブロッド(Western blot)解析を行った。得られた結果を図13に示す。図13よりPP2CεがAMPKの活性化に影響することが示された。
【0077】
(実施例4)
(PP2CεとAMPKの相互作用)
図14はマウス肝臓における内因性PP2CεとAMPKの相互作用を示す。
高脂肪高カロリー食を3週間与えた野生型C57BL/6雄マウスの摂食時及び24時間空腹時の肝臓を用いた抽出液を抗AMPKα抗体により免疫沈降し、抗PP2Cε抗体で検出した。第1及び第2レーンは高脂肪高カロリー食を与えた摂食時の野生型C57BL/6雄マウスの肝臓組織抽出液を示す。第3及び第4レーンは高脂肪高カロリー食を与えた空腹時の野生型C57BL/6雄マウスの肝臓組織抽出液を示す。
【0078】
図14の第4レーン上段より、PP2CεとAMPKが会合していることが示された。また図14の第2レーン上段及び第4レーン上段より、摂食時よりも空腹時のときのほうが、より強くPP2CεとAMPKが会合していることが示された。
【0079】
(実施例5)
図15はマウス肝臓におけるPP2CεのmRNA発現変化を示す。野生型C57BL/6マウスへ通常食( CE-2)または高脂肪高カロリー食( HFD 32 )をそれぞれ3ヶ月間与えた肝臓におけるPP2CεのmRNA発現レベルをRT-PCR法により検定した。
【0080】
図16はPP2CεのmRNA発現レベルを質量分析したグラフを示す。野生型C57BL/68週齢の雄に通常食 (CE-2) または高脂肪食 (HFD32) を3週間与えた。それぞれの肝臓抽出液からキアゲン (QIAGEN) RNeasyを用いてmRNAを抽出し、東洋紡積株式会社 (TOYOBO)の逆転写酵素 (ReverTra Ace) を用いて逆転写反応を行った後、作製したPP2CεおよびGAPDHのプライマーを用いてRT-PCRを行った。RT-PCRの質量分析にはロッシュ社 (Roche)のLightCycler器を使用した。
【0081】
以上の結果より、通常食( CE-2)を与え続けたときよりも高脂肪高カロリー食( HFD 32 )を与え続けたときのほうがより強くPP2Cεが発現することが示された。
【0082】
(実施例6)
ホモ(PP2Cε-/-)マウスの表現型を臓器レベルで解析するため、同腹の野生型(PP2Cε+/+)マウスとホモ(PP2Cε-/-)マウスの新生児肝臓についてウェスタンブロッド(Western blot)解析を行った。抗体としてはセルシグナリング社製 (Cell Signaling TECHNOLOGY )のAMPK-α Antibody, Phospho-AMPK-α(Thr172) Antibody, AMPK-α Antibody, Phospho-Acetyl-CoA Carboxylase (Ser79) Antibody, Acetyl CoA Carboxylase Antibody, Phospho-mTOR (Ser2448) Antibody, mTOR Antibodyoおよびサンタクルズ社製(Santa Cruz Biotechnology)のActin (C-2)を使用した。
【0083】
図17はAMPKαのThr 172のリン酸化レベル(上段)、AMPKαのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。図17上段より、野生型( PP2Cε+/+ )マウスよりもホモ( PP2Cε-/- )マウスのAMPKαのタンパク発現レベルが高かったことから、AMPKの活性が高いことが示された。
【0084】
図18はAcetyl CoA Carboxylase(ACC)のSer 79のリン酸化レベル(上段)、ACCのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。図18中段より、野生型( PP2Cε+/+ )マウスよりもホモ( PP2Cε-/- )マウスのACCのタンパク発現レベルが低いことが示された。ホモ( PP2Cε-/- )マウスではAMPKが活性化されたことによりACCが抑制されたことが言えた。
【0085】
図19はmammalian target of rapamycin ( mTOR )のSer 2448のリン酸化レベル(上段)、mTORのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。
【0086】
図17〜図19より、AMPKαのThr172のリン酸化の亢進、acetyl CoA carboxylase (ACC)の発現低下とリン酸化の亢進およびmammalian target of rapamycin (mTOR)のリン酸化の抑制が示された。
【0087】
実施例より、PP2Cεの欠損によって、AMPKがリン酸化の亢進により活性化され、図20に示す下流のACC1、ACC2、mTORの不活性化とGLUT4の活性化が起こったことが示された。したがって、PP2Cε-/-マウスの出生時低体重と生存率の低さは、ACC1とmTOR経路の活性低下によるものであり、1年齢における体重、血糖値およびインスリン値の低さは、ACC2とTORC2の活性化抑制とGLUT4の活性化亢進およびmTOR活性化抑制によるものと考えられる。また、高脂肪高カロリー食摂取によるPP2Cεの発現上昇から、AMPKに対するフィードバック調節機構の存在が示唆された。
【0088】
PP2Cεは母体内における胎児期においては成長に必須であるが、生後の高脂肪・高カロリー食のもとでは、PP2Cεの発現が上昇し、これによりAMPKを不活性化し、肥満、糖代謝異常をはじめとするメタボリック症候群や癌の発生に関係するものと考えられる。今後、アデノウィルスまたは、昨年開発されたSNALPを用いたPP2Cε発現抑制は、AMPK活性化上昇へつながり、肥満抑制および糖尿病改善を引き起こすことが期待され、AMPK活性化分子標的薬を創る上で大きく貢献できることを期待する。
【0089】
PP2CεはAMPKの脱リン酸化酵素であり不活性化作用を有している。PP2Cεの発現抑制あるいはAMPKとPP2Cεの結合抑制はAMPKのリン酸化をAICAR、メトフォルミンおよびチアゾリジン誘導体(TZD)よりも亢進し活性化させ、体重減少、2型糖尿病の治療、メタボリックシンドロームの抑制、さらには癌発生の抑制に寄与するものと考えられる(「トレンド・ファーマコル・サイエンス(Trends Pharmacol Sci.)」第26巻(2005)、pp69-76参照)。
【0090】
高脂肪高カロリー食を与えた状態で、野生型(PP2Cε+/+)マウスに比しホモ(PP2Cε-/-)マウスは体重も血糖値もそれほど上昇しなかった。また、1歳齢のホモ(PP2Cε-/-)マウスにおいて野生型(PP2Cε+/+)マウスに比し、体重および血糖値がともに低く、インスリン値が著明に低かった。このことにより、PP2CεのAMPKの脱リン酸化酵素としての作用を消滅させれば、2型糖尿病の治療薬としてばかりでなく、メタボリック症候群や癌の予防薬としても十分期待できる。
【0091】
本明細書の配列表の配列番号は、以下の配列を示す。
〔配列番号:1〕実施例1のPP2Cεノックアウトマウスの塩基配列を示す。
〔配列番号:2〕実施例1で用いたマウス・プライマーを示す。
〔配列番号:3〕実施例1で用いたマウス・プライマーを示す。
〔配列番号:4〕実施例1で用いたマウス・プライマーを示す。
〔配列番号:5〕実施例1で用いたlacZ遺伝子を示す。
〔配列番号:6〕実施例1で用いたネオマイシン耐性遺伝子を示す。
本明細書において、塩基を略号で表示する場合、IUPAC-IUB Commision on Biochemical Nomenclatureによる略号あるいは当該分野における慣用略号に基づくものであり、その例を下記する。
a:アデニン、t:チミン、g:グアニン、c:シトシン
【図面の簡単な説明】
【0092】
【図1】図1はターゲット(Targeting Vector/TV)構築および相同組換え図を示す。
【図2】図2は相同組み換えESクローンにおけるサザンブロット(Southen blot)解析図を示す。
【図3】図3はマウスの尻尾(mouse tail)から精製したゲノムDNAにおけるサザンブロット解析図を示す。
【図4】図4の図面左側は生後24時間以内の同腹兄弟間の野生型( PP2Cε+/+ )を示し、図面右側はホモ( PP2Cε-/- )マウス雄を示す。
【図5】図5の図面左側は生後1週齢の同腹兄弟間の野生型( PP2Cε+/+ )を示し、図面右側はホモ( PP2Cε-/- )マウス雄を示す。
【図6】図6の図面左側は生後4週齢の同腹兄弟間の野生型( PP2Cε+/+ )を示し、図面右側はホモ( PP2Cε-/- )マウス雄を示す。
【図7】図7の図面左側は生後1年齢の同腹兄弟間の野生型( PP2Cε+/+ )を示し、図面右側はホモ( PP2Cε-/- )マウス雄を示す。
【図8】図8はホモ( PP2Cε-/- )マウスの生存率( n = 100)を示す。
【図9】図9は同腹兄弟間の野生型( PP2C+/+ )およびホモ( PP2C-/- )マウス雄における1年齢までの体重変化を示す。
【図10】図10は4週齢における同腹兄弟間の野生型( PP2Cε+/+ )およびホモ( PP2Cε-/- )マウス雄による随時血糖値および随時インスリン値を示す。
【図11】図11は1年齢における同腹兄弟間の野生型( PP2Cε+/+ )およびホモ( PP2Cε-/- )マウス雄による随時血糖値を示す。
【図12】図12は1年齢における同腹兄弟間の野生型( PP2Cε+/+ )およびホモ( PP2Cε-/- )マウス雄による随時インスリン値を示す。
【図13】図13はPP2CεがAMPKの活性化へ及ぼす影響(In vitro assay)を示す。
【図14】図14はマウス肝臓における内因性PP2CεおよびAMPKの相互作用を示す。
【図15】図15はマウス肝臓におけるPP2CεのmRNA発現変化を示す。
【図16】図16はPP2CεのmRNA発現レベルを質量分析したグラフを示す。
【図17】図17はAMPKαのThr 172のリン酸化レベル(上段)、AMPKαのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。
【図18】図18はAcetyl CoA Carboxylase(ACC)のSer 79のリン酸化レベル(上段)、ACCのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。
【図19】図19はmammalian target of rapamycin ( mTOR )のSer 2448のリン酸化レベル(上段)、mTORのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。
【図20】図20はAMPK周辺のシグナル図を示す。
【技術分野】
【0001】
本発明は、AMPKに対する脱リン酸化酵素作用を持つプロテインホスファターゼ2Cε(PP2Cε)の用途に関する。さらに詳しくは、2型糖尿病、メタボリック症候群、癌、動脈硬化症、肝臓病、膵臓病のような病気の治療に使用可能な薬に関する。
【背景技術】
【0002】
AMPキナーゼ(AMPK)とは、細胞内エネルギー量の低下(AMP/ATP比の上昇)を感知して活性化するセリン・スレオニンリン酸化酵素をいう。骨格筋収縮や低酸素などのさまざまなストレス刺激がAMPKを活性化することが知られている。またインスリン感受性増強作用を有するホルモンであるレプチンやアディポネクチン、さらには抗糖尿病薬として使用されているチアゾリジン誘導体やメトフォルミンまでもがAMPKを活性化することが最近明らかとなった。
【0003】
AMPKの活性化は、骨格筋や肝臓での脂肪酸β酸化を促進し、細胞内脂肪含量を減少させる結果、これらの臓器に生じたインスリン抵抗性を改善する。さらに肝臓での糖新生抑制、脂肪酸合成低下および骨格筋によるグルコース利用の促進など、多彩な代謝調節作用を併せもつことから、AMPKは2型糖尿病の新たな分子標的因子として脚光を浴びている。
【0004】
AMPKはエネルギー代謝調節において中心的役割を果たしていることから、2型糖尿病の新たな分子標的因子の他にも、メタボリック症候群や癌の発生に関係することで関心を集めている。AMPKの活性化剤としては現在AICAR (5’-aminoimidasole-4-carbox-amide-1-β-D-ribofaranoside)とメトホルミンとチアゾリジン誘導体(TZD)が知られている(非特許文献1参照)。いずれもAMPKのリン酸化を亢進させAMPKの活性化亢進を狙ったものである。
【0005】
しかしながら、血糖値はある程度下げるが、AMPKが本来有している体重減少の効果はみられず、AMPK活性化剤としては改善の余地が多かった。また、飽食の時代におけるAMPKの不活性化が、メタボリック症候群や癌を引き起こすとの報告もあり(非特許文献2参照)、これまでのAMPK活性化剤では、こうした疾病対策の要望に十分に応えているとはいえなかった。
【非特許文献1】「医学のあゆみ」第208巻、第5号(2004)、pp313-317
【非特許文献2】「トレンド・ファーマコル・サイエンス(Trends Pharmacol Sci.)、第26巻(2005)、pp69-76
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明はAMPKの活性化及び非活性化の制御方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明は以下の発明に関する。
プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として含む薬。
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターを含む薬。
プロテインホスファターゼ2Cε(PP2Cε)とAMPキナーゼ(AMPK)の会合を阻害するAMPKが介在するシグナル由来の非ヒト哺乳動物に対する病気の治療方法。
標本中のPP2Cε遺伝子活性の変化を検出するAMPKが介在するシグナル由来の病気細胞の検出方法。
PP2CεのmRNAの遺伝学的配列に相補的な分子プローブと、分子プローブとmRNAのハイブリダイゼーションを検出する手段と、PP2Cε遺伝子の活性を示す検出手段と、を含むPP2Cε活性を検出するキット。
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたタンパク質もしくはペプチド。
PP2Cεのための発現可能な遺伝学的核酸配列が導入されたタンパク質もしくはペプチド。
AMPKの脱リン酸化酵素作用を持つプロテインホスファターゼ2Cε(PP2Cε)の使用。
【発明の効果】
【0008】
本発明によれば、AMPKの活性化及び非活性化の制御方法が提供される。
【発明を実施するための最良の形態】
【0009】
以下に、実施形態を挙げて本発明の説明を行うが、本発明は以下の実施形態に限定されるものではない。尚、図中同一の機能又は類似の機能を有するものについては、同一又は類似の符号を付して説明を省略する。
【0010】
[AMPKとタンパク質ホスファターゼ−2Cε(PP2Cε)の関係]
図20はAMPK周辺のシグナル図を示す。図20中の略記号の意味は符号の説明の欄に記載の通りである:
PP2Cε:プロテインホスファターゼ2Cε(protein phosphatase 2Cε)、
AMPK:AMPキナーゼ(adenosine mono phosphate (AMP)-activated protein kinase)、
CREB:環状AMP応答要素結合タンパク(cAMP response element-binding protein)、
TORC2:transducer of regulated CREB activity 2、
PGC-1α:peroxisome proliferative activated receptor-γ co-activator 1α、
G6Pase:グルコース6リン酸脱リン酸化酵素(glucose-6-phosphatase)、
PEPCK:ホスフォエノールピルビン酸脱リン酸化酵素(phosphoenolpyruvate carboxykinase)、
ACC1:アセチルCoAカルボキシラーゼ1(acetyle-CoA carboxylases 1)、
HMGR:HMG-CoA還元酵素(3-hydroxy-3-methylglutaryl-CoA reductase)、
SREBP-1:sterol regulatory element-binding protein 1、
ACC2:アセチルCoAカルボキシラーゼ2(acetyle-CoA carboxylases 2)、
GLUT4:インスリン反応性4型糖輸送担体(glucose transporter 4)、
LKB1:Peutz-Jeghers症候群原因遺伝子(Peutz-Jeghers syndrome gene)、
AICAR:5-aminoimidazole-4-carboxamide-1-β-D-ribofuranoside、
TSC1:結節性硬化症複合体1 (The tuberous sclerosis complex 1)、
TSC2:結節性硬化症複合体2(The tuberous sclerosis complex 2)、
mTOR:ラパマイシンの哺乳類標的遺伝子(The mammalian target of rapamycin)、
p70S6K:p70S6キナーゼ(p70 ribosomal S6 kinase)、
4E-BP1:eukaryotic initiation factor 4E-binding protein 1。
【0011】
図20に示すように、AMPKの下流には肝臓における脂肪酸合成に寄与するACC1、骨格筋における脂肪酸酸化に寄与するACC2、骨格筋における糖の取り込みに寄与するGLUT4、細胞成長に寄与するmTORが存在する。このようにAMPKはエネルギー代謝調節において中心的役割を果たしており、メタボリック症候群や癌の発生に関係することで関心を集めている(「トレンド・ファーマコル・サイエンス(Trends Pharmacol Sci.)」第26巻(2005)、pp69-76参照)。そして、PP2Cファミリメンバー(サブタイプは不明)が、AMP-activated protein kinase α(AMPKα)のThr172を脱リン酸化し不活性化させることが報告されて以来、いくつかの研究グループにより、PP2CファミリーがAMPKの負の制御因子であることを示唆する報告が行われてきた。
【0012】
例えば、1991年にPP2Cファミリーメンバー(サブタイプ不明)がAMP-activated protein kinaseα(AMPKα)のThr172を脱リン酸化し、不活性化させることを示唆する報告が行われた(「ユーロジャーナルバイオケミストリー(Eur. J. Biochem)」第199巻(1991), pp691-697参照)。また、1995年と1996年には大腸菌によるin vitro kinase assayによりAMPKがヒトPP2Cαによって脱リン酸化され、不活性化されることが報告された(FEBS Letters 第377巻(1995), pp421-425、「バイオケミストリージャーナル(Biochem. J.)」第320巻(1996), pp801-806参照)。さらに、2004年には、ラット心臓においてヒトPP2CαがAMPKの活性化を阻害することが報告されている(「ユーロジャーナルバイオケミストリー(Eur. J. Biochem.)」第271巻(2004), pp2215-2224参照)。2005年には、肥満したラット心筋細胞においてPP2Cの発現が増大しAMPKのリン酸化が抑制されていることが示された(AJP-Endo. 第288巻(2005), pp216-221参照)。また、この肥満ラットにチアゾリジン誘導体であるトリグリタゾン(Triglitazone)を投与することにより、心筋細胞におけるPP2Cの発現が低下し、AMPKのリン酸化が亢進するという、AMPKとPP2Cの逆相関を示す報告が行われた(AJP-Endo. 第288巻(2005), pp216-221参照)。
【0013】
ACC2のノックアウトマウスは、高脂肪高カロリー食を与えても、体重や血糖値の上昇がほとんどなく(サイエンス(Science)第291巻(2001), pp2613-2616、ピーナス(PNAS)第100巻(2003), pp10207-10212参照)、ACC1のノックアウトマウスでは、胎生致死が報告されている(ピーナス(PNAS)第102巻(2005), pp12011-12016参照)。また、mTORは細胞成長や癌化に関係している(「トレンド・ファーマコル・サイエンス(Trends Pharmacol Sci.)」第26巻(2005)、pp69-76、遺伝子と開発(Genes & Dev.)第16巻(2002), pp1472-1487参照)。「ユーロジャーナルバイオケミストリー(Eur. J. Biochem.)」第271巻(2004), pp2215-2224は、ラットの心臓由来のPP2Cαによるin vitroでの不活性化をみたもので、後に実施例の欄で説明するPP2Cεノックアウトマウスの解析と比較して、生理的変化および影響力はみられていない。AJP-Endo. 第288巻(2005), pp216-221は、チアゾリジン誘導体に属するトリグリタゾン(triglitazone/TGZ)を肥満モデルマウスに投与後、心筋細胞におけるPP2Cの発現低下とAMPKのリン酸化亢進を観察したものである。そしてFEBS Letters 第377巻(1995), pp421-425の引用により、TGZがPP2Cの発現を低下させ、これによりAMPKの活性化が引き起こされるとしている。しかし、PP2Cの発現低下とAMPKの活性化亢進の関連性は証明されていない。
【0014】
PP2Cファミリーメンバーの内、どのメンバーが細胞内で生理的なAMPKの抑制因子としての役割を担うのかについてはこれまで不明であった。そのため、PP2Cの発現低下とAMPKの活性化亢進の関連性を生理学的に証明する報告が待たれていた。
【0015】
本発明者は鋭意研究の結果、後に実施例の欄で説明するように、PP2Cε欠損のノックアウトマウスを解析したところ、PP2Cεが細胞内においてAMPKの負の制御因子として機能することを知見した。即ち本発明者は、PP2Cεノックアウトマウスに観察された低体重や低血糖などのフェノタイプがPP2CεがAMPKの脱リン酸化酵素によるものであることを知見した。かかる実施例においてPP2Cεノックアウトマウスは、AMPKの活性化を亢進し、低体重、低血糖および低インスリン値を示し、高脂肪高カロリー食の下でも肥満にならない特徴を有していた。この結果から生理活性が示された。また分子細胞生物学的レベルでもPP2CεによるAMPKの脱リン酸化が濃度依存的に起こり、PP2CεとAMPKの結合も示された。PP2CεはAMPKの脱リン酸化酵素であることが示された。しかも生体内での生理活性についても十分な影響を及ぼすことにより、AMPKを活性化する上で、PP2Cεの発現あるいはPP2CεとAMPKの結合抑制はメトフォルミン、AICARおよびチアゾリジン誘導体を遥かに凌ぐと考える。
【0016】
本発明者の上記知見により、図20に示すように、PP2Cεが欠損することにより、AMPKがリン酸化の亢進により活性化され、下流のACC1、ACC2、mTORの不活性化とGLUT4の活性化が起こる。かかるPP2CεとAMPKの相互作用を活用すれば、AMPK周辺のシグナルに関与する薬、治療方法、バイオキット等を提供することができる。以下実施形態を挙げて本発明をより詳しく説明する。
【0017】
[薬及び治療方法]
本実施形態によれば、以下の薬や治療方法が提供される。
プロテインホスファターゼ2Cε(PP2Cε)とAMPキナーゼ(AMPK)の会合を阻害する成分を含む薬。プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として含む薬。PP2Cεに対するRNA干渉としては、RNAi, siRNA, shRNAが挙げられる。PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターを含む薬。PP2Cεに対するRNA干渉を含むSNALPカプセル剤。PP2Cεに対するRNA干渉が組み込まれたベクター。PP2Cεに対するRNA干渉がセンダイウイルスに組み込まれたベクター。
【0018】
プロテインホスファターゼ2Cε(PP2Cε)とAMPキナーゼ(AMPK)の会合を阻害するAMPKが介在するシグナル由来の病気の治療方法。プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として用いるAMPKが介在するシグナル由来の病気の治療方法。PP2Cεに対するRNA干渉としては、RNAi, siRNA, shRNAからなる群から選択されるものであるAMPKが介在するシグナル由来の病気の治療方法。PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターを患部に適用するAMPKが介在するシグナル由来の病気の治療方法。
【0019】
上記の薬、SNALPカプセル剤、ベクター、治療方法は、AMPKの脱リン酸化酵素としてのPP2Cεの作用の抑制を行うことができるため、AMPKの脱リン酸化を調整することができる。そのため上記の薬、SNALPカプセル剤、ベクター、治療方法は、AMPKが介在するシグナル由来の病気に用いられる。
【0020】
具体的には本実施形態にかかる薬は、AMPKの活性化亢進をAICAR(5-aminoimidazole-4-carboxamide-1-β-D-ribofuranoside)、メトフォルミンおよびチアゾリジン誘導体(TZD)などの従来の薬物以上に亢進させるため、2型糖尿病の治療薬として使用することができる。またメタボリック症候群や癌の予防薬、さらに動脈硬化症の予防治療薬としても使用することができる。その他にも、本実施形態にかかる薬は、肝臓病、膵臓病等にも用いることができる。SNALPカプセル剤、ベクター、治療方法についても薬と同様に種々の病気に用いることができる。
【0021】
ここで、「メタボリック・シンドローム(代謝異常症候群)」とは、シンドロームX(リーベン(Reaven), 1988)、死の四重奏(カプラン(Kaplan), 1989)、インスリン抵抗性症候群(デ・フロンゾ(De Fronzo),1991)、内臓脂肪症候群とも呼ばれる複合生活習慣病をいう。1つ1つは病気ではなくても、複数合わせると「立派な病気」とされるのが「メタボリック・シンドローム」である。メタボリック・シンドロームは、動脈硬化の危険因子である「肥満」、「高血圧」、「高血糖」、「高脂血症」を重複して発症していることがある。この人達は心筋梗塞や脳梗塞になり易い傾向がある。肥満に関しては、上半身肥満のうち内臓脂肪型肥満をいう。また、高インスリン血症もみられる。
【0022】
メタボリック・シンドロームの診断基準としては、主に米国高脂血症治療ガイドラインと世界保健機構(WHO)による診断基準の2種類がある。米国高脂血症治療ガイドライン(ATPIII:Adult Treatment Panel III, NCEP National Cholesterol Education Program)では、以下の5項目のうち3項目が該当するとメタボリック・シンドロームと診断できるとされている:1)ウエスト(腹囲)が男性で102cm以上(日本人では85cm以上)、女性で88cm以上(日本人では90cm以上)、2)中性脂肪が150mg/dl以上、3)HDLコレステロールが男性で40mg/dl未満、女性で50mg/dl未満、4)血圧が最大血圧で130mmHg以上または最小血圧で85mmHg以上、5)空腹時血糖値が110mg/dl以上。
【0023】
WHOによる診断基準では、高インスリン血症(非糖尿病患者の上位25%)または空腹時血糖110mg/dl以上に加え、以下の2項目に該当するとメタボリック・シンドロームと診断できるとされている:1)内臓肥満ウエスト/ヒップ比>0.9(男性)、>0.85(女性)またはBMI30以上または腹囲94cm以上、2)脂質代謝異常:中性脂肪150mg/dl以上またはHDLコレステロール35mg/dl未満(男性)、39mg/dl未満(女性)、3)高血圧140/90mmHg以上か降圧剤内服中、4)マイクロアルブミン尿症(尿中アルブミン排泄率20μg/min以上か尿中アルブミン/クレアチニン比30mg/g.Cr以上)。
【0024】
上記基準の他に、日本動脈硬化学会、日本糖尿病学会、日本高血圧学会、日本循環器学会、日本腎臓病学会、日本血栓止血学会、日本肥満学会、日本内科学会の委員で構成される「メタボリックシンドローム診断基準検討委員会」が定めた、日本におけるメタボリックシンドロームの診断基準では、以下の1)の要件を満たし、さらに以下の2)、3)、4)のうち2つ以上があてはまる場合に、メタボリックシンドロームと診断できるとされている:1)ウエスト周囲:男性 85cm以上、女性 90cm以上、2)血中脂質(脂質代謝異常):中性脂肪(トリグリセリド)値が150mg/dL以上、又はHDLコレステロール(善玉コレステロール)値が40mg/dL未満のいずれか、又は両方、3)血圧:収縮期血圧が130mmHg以上、拡張期血圧が85mmHg以上、4)血糖(糖代謝)空腹時血糖値:110mg/dL以上。
【0025】
メタボリック・シンドロームが複合生活習慣病であるがゆえに、診断基準は必ずとも一義的ではないが、人種や居住地域等に基づいて、上記判断基準のうちから選ばれた判断基準に基いて判断されるものである。
【0026】
(肝臓病治療薬及び肝臓病治療方法)
PP2Cεに対するRNA干渉(RNAi, siRNA, shRNAなど)を肝臓に導入することにより肝臓病治療を行うことができる。例えば安定な核酸脂質粒子(SNALP)カプセル中にPP2Cεに対するRNA干渉(RNAi, siRNA, shRNAなど)を封入し静脈投与する方法が挙げられる。この技術はすでに安定なアポリポタンパク質B(ApoB)のサイレンシングを起こすために、安定な核酸脂質粒子(SNALP)カプセル中にApoBにsiRNAを封入し、1または2.5 mg/kgの投与量でカニクイザルに静脈投与を行った研究で報告されている(ネーチャー(Nature)第441巻(2006), pp111-114参照)。
【0027】
(骨格筋治療薬及び骨格筋治療方法)
PP2Cεに対するRNA干渉(RNAi, siRNA, shRNAなど)を骨格筋、脂肪組織へ導入することにより骨格筋治療を行うことができる。例えばPP2Cεに対するRNA干渉をウィルスベクターに組み込み、骨格筋や脂肪組織に直接注射で注入する方法が挙げられる。この技術はすでにHGF(hepatocyte growth factor)遺伝子をセンダイウイルス(Sendai virus)に組み込んで大腿筋に注入し、閉塞性動脈硬化症の治療として森下竜一氏によって開発され、臨床応用されている(「脈管学」第44巻(2004)、第3号、pp85-98、「脈管学」第44巻(2004)、第4号、pp145-150参照)。
【0028】
本実施形態にかかる薬を予防・治療剤として使用する場合は、少なくとも90%、好ましくは95%以上、より好ましくは98%以上、さらに好ましくは99%以上に精製されたものを使用するのが好ましい。
【0029】
本実施形態にかかる薬は、例えば、必要に応じて糖衣を施した錠剤、カプセル剤、エリキシル剤、マイクロカプセル剤などとして経口的に、あるいは水もしくはそれ以外の薬学的に許容し得る液との無菌性溶液、または懸濁液剤などの注射剤の形で非経口的に使用できる。例えば、本実施形態にかかる薬を生理学的に認められる担体、香味剤、賦形剤、ベヒクル、防腐剤、安定剤、結合剤などとともに一般に認められた製剤実施に要求される単位用量形態で混和することによって製造することができる。これら製剤における有効成分量は指示された範囲の適当な用量が得られるようにするものである。
【0030】
錠剤、カプセル剤などに混和することができる添加剤としては、例えば、ゼラチン、コーンスターチ、トラガント、アラビアゴムのような結合剤、結晶性セルロースのような賦形剤、コーンスターチ、ゼラチン、アルギン酸などのような膨化剤、ステアリン酸マグネシウムのような潤滑剤、ショ糖、乳糖またはサッカリンのような甘味剤、ペパーミント、アカモノ油またはチェリーのような香味剤などが用いられる。調剤単位形態がカプセルである場合には、上記タイプの材料にさらに油脂のような液状担体を含有することができる。注射のための無菌組成物は注射用水のようなベヒクル中の活性物質、胡麻油、椰子油などのような天然産出植物油などを溶解または懸濁させるなどの通常の製剤実施に従って処方することができる。
【0031】
注射用の水性液としては、例えば、生理食塩水、ブドウ糖やその他の補助薬を含む等張液(例えば、D−ソルビトール、D−マンニトール、塩化ナトリウムなど)などが挙げられ、適当な溶解補助剤、例えば、アルコール(例えば、エタノールなど)、ポリアルコール(例えば、プロピレングリコール、ポリエチレングリコールなど)、非イオン性界面活性剤(例えば、ポリソルベート80TM、HCO−50など)などと併用してもよい。油性液としては、例えば、ゴマ油、大豆油などが挙げられ、溶解補助剤として安息香酸ベンジル、ベンジルアルコールなどと併用してもよい。また、緩衝剤(例えば、リン酸塩緩衝液、酢酸ナトリウム緩衝液など)、無痛化剤(例えば、塩化ベンザルコニウム、塩酸プロカインなど)、安定剤(例えば、ヒト血清アルブミン、ポリエチレングリコールなど)、保存剤(例えば、ベンジルアルコール、フェノールなど)、酸化防止剤などと配合してもよい。調製された注射液は、通常、適当なアンプルに充填される。
【0032】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターも上記と同様に製剤化され、通常、非経口的に使用される。
【0033】
このようにして得られる製剤は、安全で低毒性であるので、例えば、温血動物(例えば、ヒト、ラット、マウス、モルモット、ウサギ、トリ、ヒツジ、ブタ、ウシ、ウマ、ネコ、イヌ、サル、チンパンジーなど)に対して投与することができる。
【0034】
本実施形態にかかる薬の投与量は、対象疾患、投与対象、投与ルートなどにより差異はあるが、例えば、動脈硬化性疾患の治療目的で本実施形態にかかる薬を経口投与する場合、一般的に成人(体重60kgとして)においては、一日につき薬を約0.1〜100mg、好ましくは約1.0〜50mg、より好ましくは約1.0〜20mg投与する。非経口的に投与する場合は、本実施形態にかかる薬の1回投与量は投与対象、対象疾患などによっても異なるが、例えば、動脈硬化性疾患の治療目的で本実施形態にかかる薬を注射剤の形で成人(体重60kgとして)に投与する場合、一日につき薬を約0.01〜30mg、好ましくは約0.1〜20mg、より好ましくは約0.1〜10mgを患部に注射することにより投与するのが好都合である。他の動物の場合も、体重60kg当たりに換算した量を投与することができる。
【0035】
本実施形態にかかる薬を治療・予防剤として製剤化して使用することができる。例えば、経口投与のための組成物としては、固体または液体の剤形、具体的には錠剤(糖衣錠、フィルムコーティング錠を含む)、丸剤、顆粒剤、散剤、カプセル剤(ソフトカプセル剤を含む)、シロップ剤、乳剤、懸濁剤などが挙げられる。かかる組成物は自体公知の方法によって製造され、製剤分野において通常用いられる担体、希釈剤もしくは賦形剤を含有するものである。例えば、錠剤用の担体、賦形剤としては、乳糖、でんぷん、蔗糖、ステアリン酸マグネシウムなどが用いられる。
【0036】
非経口投与のための組成物としては、例えば、注射剤、坐剤などが用いられ、注射剤は静脈注射剤、皮下注射剤、皮内注射剤、筋肉注射剤、点滴注射剤、関節内注射剤などの剤形を包含する。かかる注射剤は、自体公知の方法に従って、例えば、上記薬を通常注射剤に用いられる無菌の水性もしくは油性液に溶解、懸濁または乳化することによって調製する。注射用の水性液としては、例えば、生理食塩水、ブドウ糖やその他の補助薬を含む等張液などが用いられ、適当な溶解補助剤、例えば、アルコール(例、エタノール)、ポリアルコール(例、プロピレングリコール、ポリエチレングリコール)、非イオン界面活性剤〔例、ポリソルベート80、HCO−50(polyoxyethylene(50mol)adduct of hydrogenated castor oil)〕などと併用してもよい。油性液としては、例えば、ゴマ油、大豆油などが用いられ、溶解補助剤として安息香酸ベンジル、ベンジルアルコールなどを併用してもよい。調製された注射液は、通常、適当なアンプルに充填される。直腸投与に用いられる坐剤は、上記薬を通常の坐薬用基剤に混合することによって調製される。
【0037】
経口用または非経口用医薬組成物は、活性成分の投与量に適合するような投薬単位の剤形に調製されることが好都合である。かかる投薬単位の剤形としては、錠剤、丸剤、カプセル剤、注射剤(アンプル)、坐剤などが例示され、それぞれの投薬単位剤形当たり通常5〜500mg、とりわけ注射剤では5〜100mg、その他の剤形では10〜250mgの上記化合物が含有されていることが好ましい。
【0038】
尚、各組成物は、化合物との配合により好ましくない相互作用を生じない限り他の活性成分を含有してもよい。
【0039】
[検出方法]
本発明の実施形態としては、患者から単離された標本中のPP2Cε遺伝子活性の変化を検出するAMPKが介在するシグナル由来の病気細胞の検出方法が提供される。
標本としては、組織の生検および体液のいずれか一方を用いることができる。標本の例としては、尿、血液、脳脊髄液および唾液が挙げられる。変化としては、正常コントロールと比べたPP2Cε遺伝子活性の増加が挙げられる。検出工程が、その多形性を含むPP2CεDNAに相補的なmRNAについて、インシツ(in situ)ハイブリダイゼーション、ノザンブロッティングおよび逆転写酵素−ポリメラーゼ連鎖反応からなる群から選ばれるアッセイを用いて、標本をアッセイすることが好ましい。
【0040】
また検出工程が、その多形性およびそのペプチドフラグメントを含むPP2Cε遺伝子産物について、免疫組織化学的および免疫細胞化学的染色、ELISA、RIA、免疫ブロット、免疫沈降反応、ウェスタンブロッティング、機能アッセイ並びに蛋白短縮テストからなる群から選ばれるアッセイを用いて標本をアッセイすることが好ましい。
【0041】
標本中のPP2Cε遺伝子活性の検出が、PP2Cε遺伝子産物によって影響を受ける蛋白の燐酸化パターンにおける変化を決定することが好ましい。AMPKが介在するシグナル由来の病気としては、2型糖尿病、メタボリック症候群、癌、動脈硬化症、肝臓病、膵臓病が挙げられるがこれらには限定されない。
【0042】
[バイオキット]
本発明の実施形態としては、以下のバイオキットが提供される。
PP2CεのmRNAの遺伝学的配列に相補的な分子プローブと、分子プローブとmRNAのハイブリダイゼーションを検出する手段と、PP2Cε遺伝子の活性を示す検出手段と、を含むPP2Cε活性を検出するキット。PP2Cε遺伝子産物と結合する天然の蛋白を模倣する薬剤と、薬剤の結合を検出し遺伝子産物の存在を示す検出手段と、を含むPP2Cε遺伝子活性に付随する遺伝子産物を検出するキット。
【0043】
[ノックアウトタンパク質等]
本発明の実施形態としては、以下のようなノックアウトタンパク質等が提供される。
【0044】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたタンパク質もしくはペプチド。PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた非ヒト哺乳類又は細胞株。PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクター。PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたマウス。
【0045】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた非ヒト哺乳類又は細胞株とは、上記非ヒト哺乳動物が有する本実施形態のDNAに人為的に変異を加えることにより、DNAの発現能を抑制するか、もしくは上記DNAがコードしている本実施形態のタンパク質の活性を実質的に喪失させることにより、DNAが実質的に本実施形態のタンパク質の発現能を有さない(以下、本実施形態のノックアウトDNAと称することがある)非ヒト哺乳動物の胚幹細胞(以下、ES細胞と略記する)をいう。
【0046】
非ヒト哺乳動物としては、例えば、ウシ、ブタ、ヒツジ、ヤギ、ウサギ、イヌ、ネコ、モルモット、ハムスター、マウス、ラットなどが用いられる。なかでも、病体動物モデル系の作成の面から個体発生および生物サイクルが比較的短く、また、繁殖が容易なゲッ歯動物、とりわけマウス(例えば、純系として、C57BL/6系統,DBA2系統など、交雑系として、B6C3F1系統,BDF1系統,B6D2F1系統,BALB/c系統,ICR系統など)またはラット(例えば、Wistar,SDなど)などが好ましい。
【0047】
哺乳動物において発現しうる組換えベクターにおける「哺乳動物」としては、上記の非ヒト哺乳動物の他にヒトなどが挙げられる。
【0048】
本実施形態にかかるDNAに人為的に変異を加える方法としては、例えば、遺伝子工学的手法により上記DNA配列の一部又は全部の削除、他DNAを挿入または置換させることによって行なうことができる。これらの変異により、例えば、コドンの読み取り枠をずらしたり、プロモーターあるいはエキソンの機能を破壊することにより本実施形態のノックアウトDNAを作製すればよい。
【0049】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列が不活性化された非ヒト哺乳動物胚幹細胞(以下、本実施形態のDNA不活性化ES細胞または本実施形態のノックアウトES細胞と略記する)の具体例としては、例えば、目的とする非ヒト哺乳動物が有する本実施形態のDNAを単離し、そのエキソン部分にネオマイシン耐性遺伝子、ハイグロマイシン耐性遺伝子を代表とする薬剤耐性遺伝子、あるいはlactZ(β−ガラクトシダーゼ遺伝子)、cat(クロラムフェニコールアセチルトランスフェラーゼ遺伝子)を代表とするレポーター遺伝子等を挿入することによりエキソンの機能を破壊するか、あるいはエキソン間のイントロン部分に遺伝子の転写を終結させるDNA配列(例えば、polyA付加シグナルなど)を挿入し、完全なメッセンジャーRNAを合成できなくすることによって、結果的に遺伝子を破壊するように構築したDNA配列を有するDNA鎖(以下、ターゲッティングベクターと略記する)を、例えば相同組換え法により上記動物の染色体に導入し、得られたES細胞について本実施形態のDNA上あるいはその近傍のDNA配列をプローブとしたサザンハイブリダイゼーション解析あるいはターゲッティングベクター上のDNA配列とターゲッティングベクター作製に使用した本実施形態のDNA以外の近傍領域のDNA配列をプライマーとしたPCR法により解析し、本実施形態のノックアウトES細胞を選別することにより得ることができる。
【0050】
また、相同組換え法等により本実施形態のDNAを不活化させる元のES細胞としては、例えば、前述のような既に樹立されたものを用いてもよく、また公知 EvansとKaufmaの方法に準じて新しく樹立したものでもよい。例えば、マウスのES細胞の場合、現在、一般的には129系のES細胞が使用されているが、免疫学的背景がはっきりしていないので、これに代わる純系で免疫学的に遺伝的背景が明らかなES細胞を取得するなどの目的で例えば、C57BL/6マウスやC57BL/6の採卵数の少なさをDBA/2との交雑により改善したBDF1マウス(C57BL/6とDBA/2とのF1)を用いて樹立したものなども良好に用いうる。BDF1マウスは、採卵数が多く、かつ、卵が丈夫であるという利点に加えて、C57BL/6マウスを背景に持つので、これを用いて得られたES細胞は病態モデルマウスを作出したとき、C57BL/6マウスとバッククロスすることでその遺伝的背景をC57BL/6マウスに代えることが可能である点で有利に用い得る。
【0051】
また、ES細胞を樹立する場合、一般には受精後3.5日目の胚盤胞を使用するが、これ以外に8細胞期胚を採卵し胚盤胞まで培養して用いることにより効率よく多数の初期胚を取得することができる。
【0052】
また、雌雄いずれのES細胞を用いてもよいが、通常雄のES細胞の方が生殖系列キメラを作出するのに都合が良い。また、煩雑な培養の手間を削減するためにもできるだけ早く雌雄の判別を行なうことが望ましい。
【0053】
ES細胞の雌雄の判定方法としては、例えば、PCR法によりY染色体上の性決定領域の遺伝子を増幅、検出する方法が、その1例としてあげることができる。この方法を使用すれば、従来、核型分析をするのに約106個の細胞数を要していたのに対して、1コロニー程度のES細胞数(約50個)で済むので、培養初期におけるES細胞の第一次セレクションを雌雄の判別で行なうことが可能であり、早期に雄細胞の選定を可能にしたことにより培養初期の手間は大幅に削減できる。
【0054】
また、第二次セレクションとしては、例えば、G−バンディング法による染色体数の確認等により行うことができる。得られるES細胞の染色体数は正常数の100%が望ましいが、樹立の際の物理的操作等の関係上困難な場合は、ES細胞の遺伝子をノックアウトした後、正常細胞(例えば、マウスでは染色体数が2n=40である細胞)に再びクローニングすることが望ましい。
【0055】
このようにして得られた胚幹細胞株は、通常その増殖性は大変良いが、個体発生できる能力を失いやすいので、注意深く継代培養することが必要である。例えば、STO繊維芽細胞のような適当なフィーダー細胞上でLIF(1−10000U/ml)存在下に炭酸ガス培養器内(好ましくは、5%炭酸ガス、95%空気または5%酸素、5%炭酸ガス、90%空気)で約37℃で培養するなどの方法で培養し、継代時には、例えば、トリプシン/EDTA溶液(通常0.001−0.5%トリプシン/0.1−5mM EDTA、好ましくは約0.1%トリプシン/1mM EDTA)処理により単細胞化し、新たに用意したフィーダー細胞上に播種する方法などがとられる。このような継代は、通常1〜3日毎に行うが、この際に細胞の観察を行い、形態的に異常な細胞が見受けられた場合はその培養細胞は放棄することが望まれる。
【0056】
ES細胞は、適当な条件により、高密度に至るまで単層培養するか、または細胞集塊を形成するまで浮遊培養することにより、頭頂筋、内臓筋、心筋などの種々のタイプの細胞に分化させることが可能である(M. J. Evans及びM. H. Kaufman, ネイチャー(Nature)第292巻、154頁、1981年;G. R. Martin プロシーディングス・オブ・ナショナル・アカデミー・オブ・サイエンス・ユーエスエー(Proc. Natl. Acad. Sci. U.S.A.)第78巻、7634頁、1981年;T. C. Doetschman ら、ジャーナル・オブ・エンブリオロジー・アンド・エクスペリメンタル・モルフォロジー、第87巻、27頁、1985年)。
【0057】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた非ヒト哺乳類は、上記動物のmRNA量を公知方法を用いて測定して間接的にその発現量を比較することにより、正常動物と区別することが可能である。上記非ヒト哺乳類としては、上記と同様のものが用いられる。
【0058】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた非ヒト哺乳類は、例えば、前述のようにして作製したターゲッティングベクターをマウス胚幹細胞またはマウス卵細胞に導入し、導入によりターゲッティングベクターの本実施形態のDNAが不活性化されたDNA配列が遺伝子相同組換えにより、マウス胚幹細胞またはマウス卵細胞の染色体上のPP2Cεのための発現可能な遺伝学的核酸配列と入れ換わる相同組換えをさせることにより、PP2Cεの発現をノックアウトさせることができる。
【0059】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた細胞は、PP2Cεのための発現可能な遺伝学的核酸配列またはその近傍のDNA配列をプローブとしたサザンハイブリダイゼーション解析またはターゲッティングベクター上のDNA配列と、ターゲッティングベクターに使用したマウス由来の本実施形態のDNA以外の近傍領域のDNA配列とをプライマーとしたPCR法による解析で判定することができる。非ヒト哺乳動物胚幹細胞を用いた場合は、遺伝子相同組換えにより、PP2Cεのための発現可能な遺伝学的核酸配列が不活性化された細胞株をクローニングし、その細胞を適当な時期、例えば、8細胞期の非ヒト哺乳動物胚または胚盤胞に注入し、作製したキメラ胚を偽妊娠させた上記非ヒト哺乳動物の子宮に移植する。作出された動物は正常な本実施形態のDNA座をもつ細胞と人為的に変異した本実施形態のDNA座をもつ細胞との両者から構成されるキメラ動物である。
【0060】
上記キメラ動物の生殖細胞の一部が変異した本実施形態のDNA座をもつ場合、このようなキメラ個体と正常個体を交配することにより得られた個体群より、全ての組織が人為的に変異を加えた本実施形態のDNA座をもつ細胞で構成された個体を、例えば、コートカラーの判定等により選別することにより得られる。このようにして得られた個体は、通常、本実施形態のタンパク質のヘテロ発現不全個体であり、本実施形態のタンパク質のヘテロ発現不全個体同志を交配し、それらの産仔から本実施形態のタンパク質のホモ発現不全個体を得ることができる。
【0061】
卵細胞を使用する場合は、例えば、卵細胞核内にマイクロインジェクション法でDNA溶液を注入することによりターゲッティングベクターを染色体内に導入したトランスジェニック非ヒト哺乳動物を得ることができ、これらのトランスジェニック非ヒト哺乳動物に比べて、遺伝子相同組換えにより本実施形態のDNA座に変異のあるものを選択することにより得られる。
【0062】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた個体は、交配により得られた動物個体も上記DNAがノックアウトされていることを確認して通常の飼育環境で飼育継代を行なうことができる。
【0063】
さらに、生殖系列の取得および保持についても常法に従えばよい。すなわち、PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたDNAを保有する雌雄の動物を交配することにより、上記不活化DNAを相同染色体の両方に持つホモザイゴート動物を取得しうる。得られたホモザイゴート動物は、母親動物に対して、正常個体1,ホモザイゴート複数になるような状態で飼育することにより効率的に得ることができる。ヘテロザイゴート動物の雌雄を交配することにより、上記不活化DNAを有するホモザイゴートおよびヘテロザイゴート動物を繁殖継代する。
【0064】
本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされた非ヒト哺乳類又は細胞株は、AMPKの生物活性を欠失するため、AMPKが介在するシグナル由来の病気のモデルとなり得るので、これらの疾病の原因究明及び治療法の検討に有用である。
【0065】
PP2Cεのための発現可能な遺伝学的核酸配列を備えるタンパク質の発現量が増加している場合、例えば、動脈硬化性疾患などの種々の疾患が発症する。
【0066】
したがって、PP2Cεのための発現可能な遺伝学的核酸配列をコードするタンパク質が上昇している患者がいる場合、本実施形態にかかるPP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたタンパク質を患者に投与し、生体内で本実施形態にかかるタンパク質を発現させて患者のAMPKの脱リン酸化を調整することができる。
【0067】
本実施形態にかかるタンパク質を上記の予防・治療剤として使用する場合は、本実施形態にかかるタンパク質を単独あるいはレトロウィルスベクター、アデノウィルスベクター、アデノウィルスアソシエーテッドウィルスベクターなどの適当なベクターに挿入した後、常套手段に従って、ヒトまたは温血動物に投与することができる。本実施形態にかかるタンパク質は、そのままで、あるいは摂取促進のための補助剤などの生理学的に認められる担体とともに製剤化し、遺伝子銃やハイドロゲルカテーテルのようなカテーテルによって投与できる。
【0068】
(その他の実施形態)
上記のように、本発明は実施形態によって記載したが、この開示の一部をなす論述及び図面はこの発明を限定するものであると理解すべきではない。この開示から当業者には様々な代替実施の形態、実施例及び運用技術が明らかとなろう。
【0069】
例えば、実施形態の変形例としては、以下の発明が提供される。PP2Cεのための発現可能な遺伝学的核酸配列が導入されたタンパク質もしくはペプチド。PP2Cεのための発現可能な遺伝学的核酸配列が導入された遺伝子導入非ヒト哺乳類又は細胞株。PP2Cεのための発現可能な遺伝学的核酸配列が導入されたベクター。PP2Cεのための発現可能な遺伝学的核酸配列が導入されたマウス。またAMPKの脱リン酸化酵素作用を持つプロテインホスファターゼ2Cε(PP2Cε)の使用が提供される。
【0070】
このように、本発明はここでは記載していない様々な実施の形態等を含むことは勿論である。したがって、本発明の技術的範囲は上記の説明から妥当な特許請求の範囲に係る発明特定事項によってのみ定められるものである。
【実施例】
【0071】
(実施例1)
(PP2Cεノックアウトマウスの作製)
図1はターゲット(Targeting Vector/TV)構築および相同組換え図を示す。図1に示すようにPP2Cε遺伝子のEX1領域を、配列番号5のプロモーターレスのlacZ遺伝子と、配列番号6のポジティブセレクションマーカーであるネオマイシン耐性遺伝子とで置き換えて、PP2Cε遺伝子座を破壊した配列番号1のPP2Cεノックアウトマウスを作製した。
【0072】
相同組み換えESクローンにおけるサザンブロット(Southen blot)解析を以下の条件で行った。EcoRIを用いて消化されたDNAに対して5’プローブ(Prove)を用い、BglIIを用いて消化されたDNAに対して3’プローブ(Prove)を用い、Aseを用いて消化されたDNAに対してネオマイシン( Neo )プローブを用いた。ES細胞はTT2株を用いた。図2にサザンブロット解析図を示す。図2に示す野生型(+/+)および変異型ES細胞(+/-)におけるDNAはそれぞれ期待された位置にシグナルが確認された。
【0073】
EcoRIを用いて消化されたDNAについて5’プローブを用いて、マウスの尻尾(mouse tail)から精製したゲノムDNAにおけるサザンブロット解析を行った。図3にサザンブロット解析図を示す。野生型( PP2C+/+ ), ヘテロ( PP2C+/-) およびホモ( PP2C-/-)マウスにおけるDNAはそれぞれ期待された位置にシグナルが確認された。
【0074】
(実施例2)
(PP2Cεノックアウトマウスの表現型観察)
PP2Cεノックアウトマウスの表現型を確認するため、野生型(PP2Cε+/+)マウスとホモ( PP2C-/-)マウスの表現型の比較を行った。図4は生後24時間以内、図5は1週齢、図6は4週齢、図7は1年齢の同腹兄弟間の野生型( PP2Cε+/+ )およびホモ( PP2Cε-/- )マウス雄をそれぞれ示す。図4〜図7において、図面向かって左側が野生型( PP2Cε+/+ )および図面向かって右側がホモ( PP2Cε-/- )マウス雄を示す。図4〜図7に示すように、作製したホモ(PP2Cε-/-)マウスは、同腹野生型(PP2Cε+/+)マウスと比べ出生時より体重が軽かった。
【0075】
図8に示すように、ホモ( PP2Cε-/- )マウスの生存率は著しく低く、大多数は24時間以内に死亡した。生存可能であった1年齢のPP2Cε-/-マウス(3例)は、生殖能力は正常であったが、図9、図10、図11、図12に示すように、野生型に比べて体重、血糖値およびインスリン値が低かった。
【0076】
(実施例3)
(PP2CεがAMPKの活性化へ及ぼす影響(In vitro assay))
PP2CεがAMPKの活性化へ及ぼす影響(In vitro assay)を調べた。まずAMPK反応溶液にAMPK, active (upstate)のタンパク質10μl(20-100mU)とATP溶液10μlを入れ、30℃で15分振とうを行った。その後、PP2Cεタンパク質を入れたもの(0.8, 1.6, 2.4μg)と入れないものそれぞれ30℃、15振とうした。SDS化した後、ウエスタンブロッド(Western blot)解析を行った。得られた結果を図13に示す。図13よりPP2CεがAMPKの活性化に影響することが示された。
【0077】
(実施例4)
(PP2CεとAMPKの相互作用)
図14はマウス肝臓における内因性PP2CεとAMPKの相互作用を示す。
高脂肪高カロリー食を3週間与えた野生型C57BL/6雄マウスの摂食時及び24時間空腹時の肝臓を用いた抽出液を抗AMPKα抗体により免疫沈降し、抗PP2Cε抗体で検出した。第1及び第2レーンは高脂肪高カロリー食を与えた摂食時の野生型C57BL/6雄マウスの肝臓組織抽出液を示す。第3及び第4レーンは高脂肪高カロリー食を与えた空腹時の野生型C57BL/6雄マウスの肝臓組織抽出液を示す。
【0078】
図14の第4レーン上段より、PP2CεとAMPKが会合していることが示された。また図14の第2レーン上段及び第4レーン上段より、摂食時よりも空腹時のときのほうが、より強くPP2CεとAMPKが会合していることが示された。
【0079】
(実施例5)
図15はマウス肝臓におけるPP2CεのmRNA発現変化を示す。野生型C57BL/6マウスへ通常食( CE-2)または高脂肪高カロリー食( HFD 32 )をそれぞれ3ヶ月間与えた肝臓におけるPP2CεのmRNA発現レベルをRT-PCR法により検定した。
【0080】
図16はPP2CεのmRNA発現レベルを質量分析したグラフを示す。野生型C57BL/68週齢の雄に通常食 (CE-2) または高脂肪食 (HFD32) を3週間与えた。それぞれの肝臓抽出液からキアゲン (QIAGEN) RNeasyを用いてmRNAを抽出し、東洋紡積株式会社 (TOYOBO)の逆転写酵素 (ReverTra Ace) を用いて逆転写反応を行った後、作製したPP2CεおよびGAPDHのプライマーを用いてRT-PCRを行った。RT-PCRの質量分析にはロッシュ社 (Roche)のLightCycler器を使用した。
【0081】
以上の結果より、通常食( CE-2)を与え続けたときよりも高脂肪高カロリー食( HFD 32 )を与え続けたときのほうがより強くPP2Cεが発現することが示された。
【0082】
(実施例6)
ホモ(PP2Cε-/-)マウスの表現型を臓器レベルで解析するため、同腹の野生型(PP2Cε+/+)マウスとホモ(PP2Cε-/-)マウスの新生児肝臓についてウェスタンブロッド(Western blot)解析を行った。抗体としてはセルシグナリング社製 (Cell Signaling TECHNOLOGY )のAMPK-α Antibody, Phospho-AMPK-α(Thr172) Antibody, AMPK-α Antibody, Phospho-Acetyl-CoA Carboxylase (Ser79) Antibody, Acetyl CoA Carboxylase Antibody, Phospho-mTOR (Ser2448) Antibody, mTOR Antibodyoおよびサンタクルズ社製(Santa Cruz Biotechnology)のActin (C-2)を使用した。
【0083】
図17はAMPKαのThr 172のリン酸化レベル(上段)、AMPKαのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。図17上段より、野生型( PP2Cε+/+ )マウスよりもホモ( PP2Cε-/- )マウスのAMPKαのタンパク発現レベルが高かったことから、AMPKの活性が高いことが示された。
【0084】
図18はAcetyl CoA Carboxylase(ACC)のSer 79のリン酸化レベル(上段)、ACCのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。図18中段より、野生型( PP2Cε+/+ )マウスよりもホモ( PP2Cε-/- )マウスのACCのタンパク発現レベルが低いことが示された。ホモ( PP2Cε-/- )マウスではAMPKが活性化されたことによりACCが抑制されたことが言えた。
【0085】
図19はmammalian target of rapamycin ( mTOR )のSer 2448のリン酸化レベル(上段)、mTORのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。
【0086】
図17〜図19より、AMPKαのThr172のリン酸化の亢進、acetyl CoA carboxylase (ACC)の発現低下とリン酸化の亢進およびmammalian target of rapamycin (mTOR)のリン酸化の抑制が示された。
【0087】
実施例より、PP2Cεの欠損によって、AMPKがリン酸化の亢進により活性化され、図20に示す下流のACC1、ACC2、mTORの不活性化とGLUT4の活性化が起こったことが示された。したがって、PP2Cε-/-マウスの出生時低体重と生存率の低さは、ACC1とmTOR経路の活性低下によるものであり、1年齢における体重、血糖値およびインスリン値の低さは、ACC2とTORC2の活性化抑制とGLUT4の活性化亢進およびmTOR活性化抑制によるものと考えられる。また、高脂肪高カロリー食摂取によるPP2Cεの発現上昇から、AMPKに対するフィードバック調節機構の存在が示唆された。
【0088】
PP2Cεは母体内における胎児期においては成長に必須であるが、生後の高脂肪・高カロリー食のもとでは、PP2Cεの発現が上昇し、これによりAMPKを不活性化し、肥満、糖代謝異常をはじめとするメタボリック症候群や癌の発生に関係するものと考えられる。今後、アデノウィルスまたは、昨年開発されたSNALPを用いたPP2Cε発現抑制は、AMPK活性化上昇へつながり、肥満抑制および糖尿病改善を引き起こすことが期待され、AMPK活性化分子標的薬を創る上で大きく貢献できることを期待する。
【0089】
PP2CεはAMPKの脱リン酸化酵素であり不活性化作用を有している。PP2Cεの発現抑制あるいはAMPKとPP2Cεの結合抑制はAMPKのリン酸化をAICAR、メトフォルミンおよびチアゾリジン誘導体(TZD)よりも亢進し活性化させ、体重減少、2型糖尿病の治療、メタボリックシンドロームの抑制、さらには癌発生の抑制に寄与するものと考えられる(「トレンド・ファーマコル・サイエンス(Trends Pharmacol Sci.)」第26巻(2005)、pp69-76参照)。
【0090】
高脂肪高カロリー食を与えた状態で、野生型(PP2Cε+/+)マウスに比しホモ(PP2Cε-/-)マウスは体重も血糖値もそれほど上昇しなかった。また、1歳齢のホモ(PP2Cε-/-)マウスにおいて野生型(PP2Cε+/+)マウスに比し、体重および血糖値がともに低く、インスリン値が著明に低かった。このことにより、PP2CεのAMPKの脱リン酸化酵素としての作用を消滅させれば、2型糖尿病の治療薬としてばかりでなく、メタボリック症候群や癌の予防薬としても十分期待できる。
【0091】
本明細書の配列表の配列番号は、以下の配列を示す。
〔配列番号:1〕実施例1のPP2Cεノックアウトマウスの塩基配列を示す。
〔配列番号:2〕実施例1で用いたマウス・プライマーを示す。
〔配列番号:3〕実施例1で用いたマウス・プライマーを示す。
〔配列番号:4〕実施例1で用いたマウス・プライマーを示す。
〔配列番号:5〕実施例1で用いたlacZ遺伝子を示す。
〔配列番号:6〕実施例1で用いたネオマイシン耐性遺伝子を示す。
本明細書において、塩基を略号で表示する場合、IUPAC-IUB Commision on Biochemical Nomenclatureによる略号あるいは当該分野における慣用略号に基づくものであり、その例を下記する。
a:アデニン、t:チミン、g:グアニン、c:シトシン
【図面の簡単な説明】
【0092】
【図1】図1はターゲット(Targeting Vector/TV)構築および相同組換え図を示す。
【図2】図2は相同組み換えESクローンにおけるサザンブロット(Southen blot)解析図を示す。
【図3】図3はマウスの尻尾(mouse tail)から精製したゲノムDNAにおけるサザンブロット解析図を示す。
【図4】図4の図面左側は生後24時間以内の同腹兄弟間の野生型( PP2Cε+/+ )を示し、図面右側はホモ( PP2Cε-/- )マウス雄を示す。
【図5】図5の図面左側は生後1週齢の同腹兄弟間の野生型( PP2Cε+/+ )を示し、図面右側はホモ( PP2Cε-/- )マウス雄を示す。
【図6】図6の図面左側は生後4週齢の同腹兄弟間の野生型( PP2Cε+/+ )を示し、図面右側はホモ( PP2Cε-/- )マウス雄を示す。
【図7】図7の図面左側は生後1年齢の同腹兄弟間の野生型( PP2Cε+/+ )を示し、図面右側はホモ( PP2Cε-/- )マウス雄を示す。
【図8】図8はホモ( PP2Cε-/- )マウスの生存率( n = 100)を示す。
【図9】図9は同腹兄弟間の野生型( PP2C+/+ )およびホモ( PP2C-/- )マウス雄における1年齢までの体重変化を示す。
【図10】図10は4週齢における同腹兄弟間の野生型( PP2Cε+/+ )およびホモ( PP2Cε-/- )マウス雄による随時血糖値および随時インスリン値を示す。
【図11】図11は1年齢における同腹兄弟間の野生型( PP2Cε+/+ )およびホモ( PP2Cε-/- )マウス雄による随時血糖値を示す。
【図12】図12は1年齢における同腹兄弟間の野生型( PP2Cε+/+ )およびホモ( PP2Cε-/- )マウス雄による随時インスリン値を示す。
【図13】図13はPP2CεがAMPKの活性化へ及ぼす影響(In vitro assay)を示す。
【図14】図14はマウス肝臓における内因性PP2CεおよびAMPKの相互作用を示す。
【図15】図15はマウス肝臓におけるPP2CεのmRNA発現変化を示す。
【図16】図16はPP2CεのmRNA発現レベルを質量分析したグラフを示す。
【図17】図17はAMPKαのThr 172のリン酸化レベル(上段)、AMPKαのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。
【図18】図18はAcetyl CoA Carboxylase(ACC)のSer 79のリン酸化レベル(上段)、ACCのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。
【図19】図19はmammalian target of rapamycin ( mTOR )のSer 2448のリン酸化レベル(上段)、mTORのタンパク発現レベル(中段)およびActinタンパク発現レベル(下段)におけるウェスタンブロッド解析結果を示す。
【図20】図20はAMPK周辺のシグナル図を示す。
【特許請求の範囲】
【請求項1】
プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として含むことを特徴とする薬。
【請求項2】
PP2Cεに対するRNA干渉は、RNAi, siRNA, shRNAからなる群から選択されるものであることを特徴とする請求項1記載の薬。
【請求項3】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターを含むことを特徴とする薬。
【請求項4】
前記薬はAMPKが介在するシグナル由来の病気の予防治療に用いられることを特徴とする請求項1〜3のいずれかに記載の薬。
【請求項5】
前記薬は、AMPKの脱リン酸化調整に用いられることを特徴とする請求項1〜3のいずれかに記載の薬。
【請求項6】
プロテインホスファターゼ2Cε(PP2Cε)とAMPキナーゼ(AMPK)の会合を阻害することを特徴とするAMPKが介在するシグナル由来の非ヒト哺乳動物に対する病気の治療方法。
【請求項7】
プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として用いることを特徴とする請求項6記載の治療方法。
【請求項8】
PP2Cεに対するRNA干渉は、RNAi, siRNA, shRNAからなる群から選択されるものであることを特徴とする請求項7記載の治療方法。
【請求項9】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターを患部に適用することを特徴とする請求項6〜8のいずれかに記載の治療方法。
【請求項10】
標本中のPP2Cε遺伝子活性の変化を検出することを特徴とするAMPKが介在するシグナル由来の病気細胞の検出方法。
【請求項11】
前記変化が正常コントロールと比べてPP2Cε遺伝子活性の増加であることを特徴とする請求項10記載の病気細胞の検出方法。
【請求項12】
前記検出工程が、その多形性を含むPP2CεDNAに相補的なmRNAについて、インシツハイブリダイゼーション、ノザンブロッティングおよび逆転写酵素−ポリメラーゼ連鎖反応からなる群から選ばれるアッセイを用いて、前記標本をアッセイすることを特徴とする請求項10記載の病気細胞の検出方法。
【請求項13】
前記検出工程が、その多形性およびそのペプチドフラグメントを含むPP2Cε遺伝子産物について、免疫組織化学的および免疫細胞化学的染色、ELISA、RIA、免疫ブロット、免疫沈降反応、ウェスタンブロッティング、機能アッセイ並びに蛋白短縮テストからなる群から選ばれるアッセイを用いて前記標本をアッセイすることを特徴とする請求項10記載の病気細胞の検出方法。
【請求項14】
前記標本中のPP2Cε遺伝子活性の検出が、PP2Cε遺伝子産物によって影響を受ける蛋白の燐酸化パターンにおける変化を決定することを特徴とする請求項10記載の病気細胞の検出方法。
【請求項15】
PP2CεのmRNAの遺伝学的配列に相補的な分子プローブと、
前記分子プローブとnRNAのハイブリダイゼーションを検出する手段と、
PP2Cε遺伝子の活性を示す検出手段と、
を含むことを特徴とするPP2Cε活性を検出するキット。
【請求項16】
PP2Cε遺伝子産物と結合する天然の蛋白を模倣する薬剤と、
前記薬剤の結合を検出し前記遺伝子産物の存在を示す検出手段と、
を含むことを特徴とするPP2Cε遺伝子活性に付随する遺伝子産物を検出するキット。
【請求項17】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたことを特徴とするタンパク質もしくはペプチド。
【請求項18】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたことを特徴とする非ヒト哺乳類又は細胞株。
【請求項19】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたことを特徴とするベクター。
【請求項20】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたことを特徴とするマウス。
【請求項21】
PP2Cεのための発現可能な遺伝学的核酸配列が導入されたことを特徴とするタンパク質もしくはペプチド。
【請求項22】
PP2Cεのための発現可能な遺伝学的核酸配列が導入されたことを特徴とする遺伝子導入非ヒト哺乳類又は細胞株。
【請求項23】
PP2Cεのための発現可能な遺伝学的核酸配列が導入されたことを特徴とするベクター。
【請求項24】
PP2Cεのための発現可能な遺伝学的核酸配列が導入されたことを特徴とするマウス。
【請求項25】
PP2Cεに対するRNA干渉を含むことを特徴とするSNALPカプセル剤。
【請求項26】
PP2Cεに対するRNA干渉が組み込まれたことを特徴とするベクター。
【請求項27】
PP2Cεに対するRNA干渉がセンダイウイルスに組み込まれたことを特徴とするベクター。
【請求項28】
AMPKの脱リン酸化酵素作用を持つプロテインホスファターゼ2Cε(PP2Cε)の使用。
【請求項1】
プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として含むことを特徴とする薬。
【請求項2】
PP2Cεに対するRNA干渉は、RNAi, siRNA, shRNAからなる群から選択されるものであることを特徴とする請求項1記載の薬。
【請求項3】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターを含むことを特徴とする薬。
【請求項4】
前記薬はAMPKが介在するシグナル由来の病気の予防治療に用いられることを特徴とする請求項1〜3のいずれかに記載の薬。
【請求項5】
前記薬は、AMPKの脱リン酸化調整に用いられることを特徴とする請求項1〜3のいずれかに記載の薬。
【請求項6】
プロテインホスファターゼ2Cε(PP2Cε)とAMPキナーゼ(AMPK)の会合を阻害することを特徴とするAMPKが介在するシグナル由来の非ヒト哺乳動物に対する病気の治療方法。
【請求項7】
プロテインホスファターゼ2Cε(PP2Cε)に対するRNA干渉を有効成分として用いることを特徴とする請求項6記載の治療方法。
【請求項8】
PP2Cεに対するRNA干渉は、RNAi, siRNA, shRNAからなる群から選択されるものであることを特徴とする請求項7記載の治療方法。
【請求項9】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたベクターを患部に適用することを特徴とする請求項6〜8のいずれかに記載の治療方法。
【請求項10】
標本中のPP2Cε遺伝子活性の変化を検出することを特徴とするAMPKが介在するシグナル由来の病気細胞の検出方法。
【請求項11】
前記変化が正常コントロールと比べてPP2Cε遺伝子活性の増加であることを特徴とする請求項10記載の病気細胞の検出方法。
【請求項12】
前記検出工程が、その多形性を含むPP2CεDNAに相補的なmRNAについて、インシツハイブリダイゼーション、ノザンブロッティングおよび逆転写酵素−ポリメラーゼ連鎖反応からなる群から選ばれるアッセイを用いて、前記標本をアッセイすることを特徴とする請求項10記載の病気細胞の検出方法。
【請求項13】
前記検出工程が、その多形性およびそのペプチドフラグメントを含むPP2Cε遺伝子産物について、免疫組織化学的および免疫細胞化学的染色、ELISA、RIA、免疫ブロット、免疫沈降反応、ウェスタンブロッティング、機能アッセイ並びに蛋白短縮テストからなる群から選ばれるアッセイを用いて前記標本をアッセイすることを特徴とする請求項10記載の病気細胞の検出方法。
【請求項14】
前記標本中のPP2Cε遺伝子活性の検出が、PP2Cε遺伝子産物によって影響を受ける蛋白の燐酸化パターンにおける変化を決定することを特徴とする請求項10記載の病気細胞の検出方法。
【請求項15】
PP2CεのmRNAの遺伝学的配列に相補的な分子プローブと、
前記分子プローブとnRNAのハイブリダイゼーションを検出する手段と、
PP2Cε遺伝子の活性を示す検出手段と、
を含むことを特徴とするPP2Cε活性を検出するキット。
【請求項16】
PP2Cε遺伝子産物と結合する天然の蛋白を模倣する薬剤と、
前記薬剤の結合を検出し前記遺伝子産物の存在を示す検出手段と、
を含むことを特徴とするPP2Cε遺伝子活性に付随する遺伝子産物を検出するキット。
【請求項17】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたことを特徴とするタンパク質もしくはペプチド。
【請求項18】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたことを特徴とする非ヒト哺乳類又は細胞株。
【請求項19】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたことを特徴とするベクター。
【請求項20】
PP2Cεのための発現可能な遺伝学的核酸配列がノックアウトされたことを特徴とするマウス。
【請求項21】
PP2Cεのための発現可能な遺伝学的核酸配列が導入されたことを特徴とするタンパク質もしくはペプチド。
【請求項22】
PP2Cεのための発現可能な遺伝学的核酸配列が導入されたことを特徴とする遺伝子導入非ヒト哺乳類又は細胞株。
【請求項23】
PP2Cεのための発現可能な遺伝学的核酸配列が導入されたことを特徴とするベクター。
【請求項24】
PP2Cεのための発現可能な遺伝学的核酸配列が導入されたことを特徴とするマウス。
【請求項25】
PP2Cεに対するRNA干渉を含むことを特徴とするSNALPカプセル剤。
【請求項26】
PP2Cεに対するRNA干渉が組み込まれたことを特徴とするベクター。
【請求項27】
PP2Cεに対するRNA干渉がセンダイウイルスに組み込まれたことを特徴とするベクター。
【請求項28】
AMPKの脱リン酸化酵素作用を持つプロテインホスファターゼ2Cε(PP2Cε)の使用。
【図1】


【図8】


【図9】


【図10】


【図11】


【図12】


【図16】


【図20】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図13】


【図14】


【図15】


【図17】


【図18】


【図19】




【図8】


【図9】


【図10】


【図11】


【図12】


【図16】


【図20】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図13】


【図14】


【図15】


【図17】


【図18】


【図19】


【公開番号】特開2008−131918(P2008−131918A)
【公開日】平成20年6月12日(2008.6.12)
【国際特許分類】
【出願番号】特願2006−321835(P2006−321835)
【出願日】平成18年11月29日(2006.11.29)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年5月29日 東北大学主催の「第3回東北大学バイオサイエンスシンポジウム」において文書をもって発表、2006年6月18日〜6月23日 国際生化学・分子生物学連合 日本学術会議 社団法人日本生化学会 日本分子生物学会 アジア・オセアニア生化学者・分子生物学者連合主催の「第20回国際生化学・分子生物学会議」において文書をもって発表
【出願人】(506397349)
【Fターム(参考)】
【公開日】平成20年6月12日(2008.6.12)
【国際特許分類】
【出願日】平成18年11月29日(2006.11.29)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年5月29日 東北大学主催の「第3回東北大学バイオサイエンスシンポジウム」において文書をもって発表、2006年6月18日〜6月23日 国際生化学・分子生物学連合 日本学術会議 社団法人日本生化学会 日本分子生物学会 アジア・オセアニア生化学者・分子生物学者連合主催の「第20回国際生化学・分子生物学会議」において文書をもって発表
【出願人】(506397349)

【Fターム(参考)】
[ Back to top ]

