Fターム[4H006EA03]の内容
有機低分子化合物及びその製造 (186,529) | ハロゲン化炭化水素 (946) | 環を有しない化合物 (446) | 不飽和化合物 (229)
Fターム[4H006EA03]に分類される特許
201 - 220 / 229
ノナフルオロペンテンとフッ化水素とを含む共沸組成物およびその使用
1,2,3,3,3−ペンタフルオロプロペンとフッ化水素とを含む共沸組成物が本明細書において開示されている。この共沸組成物は、1,2,3,3,3−ペンタフルオロプロペンを生成するプロセスおよび精製するプロセスにおいて有用である。更に、1,1,1,2,3,4,4,5,5,5−デカフルオロペンタンとフッ化水素とを含む共沸組成物および近共沸組成物が本明細書において開示されている。  (もっと読む)
(もっと読む)
E−1,3,3,3−テトラフルオロプロペンとフッ化水素とを含む共沸混合物組成物およびその使用
E−1,3,3,3−テトラフルオロプロペンとフッ化水素とを含む共沸混合物および擬共沸混合物組成物が本明細書に開示される。これらの共沸混合物および擬共沸混合物組成物は、E−1,3,3,3−テトラフルオロプロペンの製造方法、およびE−1,3,3,3−テトラフルオロプロペンと1,1,1,3,3−ペンタフルオロプロパンとのおよび/またはフッ化水素との混合物からのE−1,3,3,3−テトラフルオロプロペンの精製方法に有用である。  (もっと読む)
(もっと読む)
1−ハロ−E,Z−4,6−ヘキサデカジエン及びその製造方法並びにこれを用いた性フェロモン化合物の製造方法
【課題】 カキノヘタムシガの3種の性フェロモンの合成に共通に適応可能な中間体である1−ハロ−E,Z−4,6−ヘキサデカジエンを短い工程で、効率良く、かつ純度良く合成でき、これを用いてカキノヘタムシガでは3種の性フェロモンを効率的に合成できる製造方法を提供する。
【解決手段】 6−ハロ−E−2−ヘキセナールとホスホニウム塩とのウイティッヒ(Wittig)反応により、1−ハロ−E,Z−4,6−ヘキサデカジエン化合物を製造することができ、更にこれを用いてカキノヘタムシガでは3種の性フェロモンを効率的に製造することができる。
(もっと読む)
塩化ビニルモノマーの貯蔵方法
【課題】塩化ビニルモノマーをタンク等の貯蔵設備において貯蔵するにあたり、重合等による変性がなく長期にわたって安定して貯蔵することができ、しかも、良好な重合性能を維持している塩化ビニルモノマーの貯蔵方法を提供する。
【解決手段】 塩化ビニルモノマーを貯蔵するに際し、アルカリ金属及びアルカリ土類金属の濃度を、該塩化ビニルモノマーをフィルターに通過させたり、吸着剤とを接触させることにより低減させて、合計で10ppbw以下に調整すること特徴とする塩化ビニルモノマーの貯蔵方法である。
(もっと読む)
クロロフルオロブタンの製造方法
【課題】環境に対する負荷が小さく、選択的に、かつ収率よく、高純度の含フッ素有機化合物を製造する新規な製造方法を提供する。
【解決手段】下式(1)で表される化合物を液相中でフッ素と反応させることによってフッ素化し、下式(A)で表される化合物を得る方法。次に、下式(A)で表される化合物を脱塩素化することにより、下式(B)で表される化合物を得る方法。さらに、下式(A)で表される化合物の、液相フッ素化法における溶媒またはフッ素化原料の希釈剤としての用途。
CClX1X2−CClX3−CClX4−CClX5X6・・・(1)
CF2Cl−CFCl−CFCl−CF2Cl・・・(A)
CF2=CF−CF=CF2・・・(B)
ただし、X1〜X6は、それぞれ独立に水素原子またはフッ素原子を示し、少なくとも1つは水素原子である。
(もっと読む)
フッ化有機化合物の製造方法
少なくとも1種のフッ化オレフィンを、気相中及びルイス酸触媒の存在下で、フッ化メチルと反応させることにより、少なくとも3個の炭素原子を有する少なくとも1種の生成物を形成するフッ化有機化合物の製造方法。 (もっと読む)
フルオロブテン誘導体およびその製造方法
本発明は、新規化合物2,4,4,4−テトラフルオロ−1−ブテンと(E)−および(Z)−1,1,1,3−テトラフルオロ−2−ブテンを提供する。また本発明は、2,4,4,4−テトラフルオロ−1−ブテン、(E)−および(Z)−1,1,1,3−テトラフルオロ−2−ブテン、1,1,3−トリフルオロブタジエンを製造する次の新規な第1及び第2方法を提供する。第1方法は1,1,1,3,3−ペンタフルオロブタンを約200℃〜約700℃で加熱することにより2,4,4,4−テトラフルオロ−1−ブテンを製造する方法である。第2方法は1,1,1,3,3−ペンタフルオロブタンを、塩基と接触させることにより(E)−および(Z)−1,1,1,3−テトラフルオロ−2−ブテンを製造する方法である。第1及び第2方法によれば、それぞれ目的とするフルオロブテンが高選択率をもって得られる。第3から第5の方法では、触媒の存在下で、1,1,1,3,3−ペンタフルオロブタンを加熱することにより2,4,4,4−テトラフルオロ−1−ブテン、 (E)−および(Z)−1,1,1,3−テトラフルオロ−2−ブテン、さらには1,1,3−トリフルオロブタジエンを製造できる。この触媒は、第6の方法において、ハロゲン含有ガスに接触させることによって再生できる。 (もっと読む)
1−クロロ−1、3、3、3−テトラフルオロプロパン及び1、2−ジクロロ−3、3、3−トリフルオロプロペンの共沸類組成物
【解決手段】 HFC−245faの製造における中間生成物として有用な1−クロロ−1、3、3、3−テトラフルオロプロパンと1、2−ジクロロ−3、3、3−トリフルオロプロペンの共沸及び共沸類混合物を提供している。HFC−245faは、無毒で、オゾンを損耗させることの無いフッ化炭化水素であり、溶剤、発泡剤、冷媒、洗浄剤、エアゾール噴射剤、伝熱媒体、気体誘電体、消火剤組成物及びパワーサイクル作動流体として役立つ。 (もっと読む)
有機塩素化合物の分解処理方法および装置
【課題】クロロ酢酸類などの分解副生成物を分解することができ、分解で生成した塩素を有効に利用することができ、酸性廃液の発生を抑制できる、効率的な有機塩素化合物の分解処理方法および装置を提供することである。
【解決手段】塩素ガスの存在下で光を照射することで分解しうる気体状の有機塩素化合物の分解処理方法であって、気体状の有機塩素化合物と塩素ガスを含む混合ガスをつくる混合ガス製造工程;混合ガスに光を照射して前記有機塩素化合物を分解する有機塩素化合物分解工程;有機塩素化合物分解工程から得られるガスから、有機塩素化合物分解工程で生じた分解副生成物を分離する分離工程;分離工程で分離された分解副生成物を電気分解により分解する電気分解工程;電気分解工程で発生した塩素ガスを、該混合ガス製造工程に供給する工程を有する有機塩素化合物の分解処理方法。このための装置。
(もっと読む)
1,1−ジフルオロエテンおよび1,1,1−トリフルオロエタンの製造方法
【課題】 1,1−ジフルオロエテンおよび1,1,1−トリフルオロエタンを併産可能な製造方法を提供する。
【解決手段】 第1反応域(1)にて1−クロロ−1,1−ジフルオロエタンを触媒存在下で加熱して第1反応混合物を得、第1反応混合物から1,1−ジフルオロエテンを含む第1フラクションと、1,1,1−トリフルオロエタンを含む第2フラクションと、1−クロロ−1−フルオロエテンを含む第3フラクションおよび1,1−ジクロロエテンを含む第4フラクションの少なくとも一方とを分離し、そして第3および第4フラクションの少なくとも一方を第2反応域(5)に送り、第2反応域(5)にて1−クロロ−1−フルオロエテンおよび1,1−ジクロロエテンの少なくとも一方をフッ化水素と共に触媒存在下で加熱して第2反応混合物を得、および第2反応混合物から1,1,1−トリフルオロエタンを含む第5フラクションを分離する。
(もっと読む)
フルオロカーボンの変換
フルオロカーボンを有用なモノマーまたは他の化学的前駆体であるフッ素化不飽和化合物、例えばC2H2F2、に変換する方法を開示する。その方法は、炭化水素原料(20)とフルオロカーボン原料(10)を高温反応装置(26)で十分高い温度かつ十分短い滞留時間で反応させ、主反応生成物としてフッ素化不飽和化合物を有する反応生成物混合体(28)を作ること、その不飽和化合物が重合しないほど十分に低い温度に冷却すること(18)を含む。反応生成物は次に、より高い分子量の化合物(35)および酸(32)を除去処理することが可能であり、随意的に生成物成分に分離すること(44)が可能である。  (もっと読む)
(もっと読む)
製造プロセス、製造システム、および触媒組成物
開示内容の実施例は、基板、クロム、および少なくとも一つのアルカリ金属を有することができる触媒組成物を提供する。製造プロセスは、アルカリ金属組成物と基板を有する触媒組成物を備えた溶液から触媒組成物を取り出すために提供される。触媒組成物の存在下で化合物を試薬に接触させることを有することができる製造プロセスも提供される。反応物容器と試薬容器の両方に接続した反応器を有し、反応器がクロムと少なくとも一つのアルカリ金属を含む触媒組成物を有することができる製造システムも提供される。  (もっと読む)
(もっと読む)
1,1,3,3,3−ペンタフルオロプロペンの製造方法
【課題】工業的規模での製造に適した1,1,3,3、3−ペンタフルオロプロペンの合成方法を提供する。
【解決手段】3−クロロ−1,1,1,3,3−ペンタフルオロプロパンを、気相にて活性炭と接触させることにより、脱塩化水素反応目的とする1,1,3,3,3−ペンタフルオロプロペンを効率的に得ることができる。この脱塩化水素反応は、通常反応温度200℃〜350℃、活性炭との接触時間1秒〜300秒で実施でき、反応温度220℃〜320℃、活性炭との接触時間20秒〜150秒で特に好ましく実施できる。これらの反応はほぼ選択的に進行するものであり、容易な操作で、高い収率を以って、99.5%以上の純度の目的物を得ることもできる。
(もっと読む)
1,2−ジクロロエタンの製造方法
炭化水素源から出発して、1,2-ジクロロエタンを製造する方法であって、a) 該炭化水素源を、第一の分解工程、即ち分解炉内で実施される、熱分解工程に付して、分解生成物の混合物を製造する工程、b) 該分解生成物の混合物を、エチレン及び他の成分を含む、生成物の混合物を得ることを可能とする、一連の処理段階に掛ける工程、ここで該処理段階としては、水性急冷段階、少なくとも大部分の二酸化炭素を除去し、アルカリ性の溶液を生成するための、アルカリ洗浄段階、及び該分解生成物の混合物中に含まれる、硫化水素の除去を目的とする、酸化段階を含む工程、c) 該工程b)から導かれた、エチレンを含む該分解生成物の混合物を、エチレンを含む少なくとも一つの画分と、重質画分とに分離する工程、d) 該エチレンを含む画分を、塩素化反応器及び/又はオキシ塩素化反応器に搬送し、該反応器内で、存在するエチレンの殆どを、1,2-ジクロロエタンに転化する工程、及びe) 該得られた1,2-ジクロロエタンを、該塩素化及びオキシ塩素化反応器から導かれる生成物の流れから、分離する工程、を含む。 (もっと読む)
ハイドロフルオロアルカノールのハイドロフルオロアルケンへの接触転化
2,2,3,3,3−ペンタフルオロ−1−プロパノールから2,3,3,3−テトラフルオロ−1−プロペン(R1234yf)を生成するための選択的脱水剤としてメタンを使用する。この反応を高活性で行うために担持遷移金属触媒を調製して使用する。触媒として非担持Ni−メッシュを用いて、60%のアルコール転化レベルにて、得られるR1234yfへの選択率はおよそ58%である。Pd及びPtは殆ど同様の転化レベルを示す;しかし、所望の生成物への選択率は低い。金属触媒の活性は担持材料のタイプの働きによるものであることが分かっており、活性炭はアルミナより良好な活性を示す。本方法を最適化するために、温度、圧力及び接触時間などの異なる重要なプロセスパラメータを検討する。高温及び高圧は1234yf形成の速度に悪影響を及ぼす;しかし、494℃にて接触時間23秒で反応を行うと、1234yfへの高い収率が得られる。 (もっと読む)
化合物生成方法及び化合物生成システム
化合物生成方法及び化合物生成システム。不飽和ヒドロハロカーボンを生成するために不飽和ハロカーボンのハロゲンを置換するステップを含んだ化合物生成方法が提供される。化合物生成システムは第1貯蔵槽と第2貯蔵槽に連結された反応領域を含んでおり、第1貯蔵槽は不飽和ハロカーボンを収容し、第2貯蔵槽は水素化試薬を収容する。システムは第1貯蔵槽の不飽和ハロカーボンを反応領域内で第2貯蔵槽の水素化剤に曝露するように設計されている。  (もっと読む)
(もっと読む)
不飽和ハロゲン炭化水素を製造するための方法および該方法での使用に適するデバイス
本発明は、飽和脂肪族ハロゲン炭化水素の熱開裂によりエチレン不飽和脂肪族ハロゲン炭化水素を製造する方法に関する。該方法によれば、生成物のガス流が、反応器に向かって開いている少なくとも1つの供給導管を含む反応器に導入される。供給導管は、開裂促進剤および基から生成した加熱ガスを反応器に供給する。本方法は、開裂反応の収率における増加を可能ならしめる。  (もっと読む)
(もっと読む)
フルオロオレフィンの製造方法
電気化学的フッ化によって、少なくとも1個の炭素結合水素を含む出発原料をペルフルオロ化するステップと、この分離された流出物を熱分解で解離するステップと、この流出物を急冷し、かつ分離して、テトラフルオロエチレンおよび/またはヘキサフルオロプロピレンを生成するステップと、を含むフルオロオレフィンの製造方法。 (もっと読む)
化合物生成方法およびシステム
金属含有オレフィンを反応させて共役オレフィンを形成すること;ヘテロハロゲン化オレフィンを反応させて、共役オレフィンを形成すること;ハロゲン化アルカンを反応させて、共役オレフィンを形成すること;および/またはヒドロハロゲン化オレフィンを反応させて、共役オレフィンを形成することを含む化合物生成方法を提供する。過ハロゲン化オレフィンを収納するために設計された第一の反応体リザーバー;触媒混合物を収納するために設計された第二の反応体リザーバー;第一および第二のリサーバーの両方に結合した第一の反応器を含み、金属含有混合物を収納し、そして両方の過ハロゲン化オレフィンを受けるように設計されたその第一の反応器は、第一の反応体リザーバーの過ハロゲン化オレフィン形態(form)、および第二の反応体リザーバーから得られる反応体混合物の両方を受け;および第一の反応器に結合し、そして共役オレフィンを収納するように設計された生成物収集リザーバーを含むことが可能な化合物生成システムも提供する。 (もっと読む)
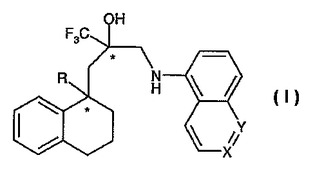
グルココルチコイド受容体調節剤としてのテトラヒドロ−ナフタレン誘導体
本発明は、式(I)の化合物(ここで、Rはメチルまたはエチル基を表し、XはN、C-HまたはC-CH3を表し、XがC-HまたはC-CH3を表すとき、YはNを表し、XがNを表すとき、YはC-Hを表す)およびその生理学的に機能性の誘導体、その化合物を含む医薬組成物、その化合物を、特に炎症および/またはアレルギー状態の治療用の薬剤の製造のために使用すること、その化合物の製造方法ならびに、その化合物の製造方法における化学的中間体に関する。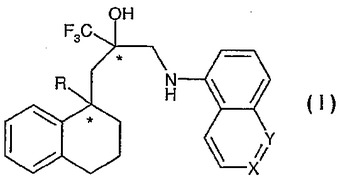
 (もっと読む)
(もっと読む)
201 - 220 / 229
[ Back to top ]