神経性ニコチン受容体リガンドによるL−ドーパ誘発性ジスキネジアの回復
本発明は、L-ドーパ誘発性ジスキネジアを治療又は予防する方法、使用、及び化合物を含む。
【発明の詳細な説明】
【背景技術】
【0001】
ジスキネジア、又は異常不随意運動(abnormal involuntary movement: AIM)は、L-ドーパを長期間使用しているパーキンソン病(Parkinson's disease: PD)患者の大部分において発症し、PDそのものと同程度に弱らせるものであり得る。最近、Quikらは、ニコチンが、パーキンソン病のヒト以外の霊長類及びげっ歯類の双方においてL-ドーパ誘発性ジスキネジア様運動を約50%低減させることを示した。L-ドーパ誘発性AIMに利用できる治療は、現在、非常に限定されている。したがって、ニコチン療法がこれらの運動を低減するという観察は、新規な治療オプションを与えることができ、これは、特に、ニコチンがL-ドーパの抗パーキンソン病作用を損なわないためである。
【0002】
一般に、ニコチンは、神経性ニコチン受容体(neuronal nicotinic receptors: NNR)を刺激することによってその効果を発揮する。しかしながら、ニコチンは、中枢神経系及び末梢神経系、並びに骨格筋において複数のNNRを標的とする。これは、任意の所望の応答に加えて、副作用をもたらす。したがって、L-ドーパ誘発性ジスキネジアを低減させるNNRサブタイプ選択的薬物を同定することが有利となる。
【0003】
下記の引用文献を参照する: Carta, M., Carlsson, T., Munoz, A., Kirik, D. & Bjorklund, A.,「Serotonin-Dopamine Interaction In The Induction And Maintenance Of L-Dopa-lnduced Dyskinesias」, Prog Brain Res, 172: 465〜78 (2008); Cenci, M.A. & Lundblad, M.,「Ratings Of L-Dopa-lnduced Dyskinesia In The Unilateral 6-OHDA Lesion Model Of Parkinson's Disease In Rats And Mice」, Curr Protoc Neurosci, Chapter 9, Unit 9: 25 (2007); Cox, H.ら,「The Selective Kappa-Opioid Receptor Agonist U50,488 Reduces L-Dopa-lnduced Dyskinesias But Worsens Parkinsonism In MPTP-Treated Primates」, Exp Neurol, (2007);. Dani, J.A. & Bertrand, D.,「Nicotinic Acetylcholine Receptors And Nicotinic Cholinergic Mechanisms Of The Central Nervous System」, Annu Rev Pharmacol Toxicol, 47: 699〜729 (2007); Dekundy, A., Lundblad, M., Danysz, W. & Cenci, M.A,「Modulation Of L-Dopa-lnduced Abnormal Involuntary Movements By Clinically Tested Compounds: Further Validation Of The Rat Dyskinesia Model」, Behav Brain Res, 179: 76〜89 (2007); Exley, R. & Cragg, S.J.,「Presynaptic Nicotinic Receptors: A Dynamic And Diverse Cholinergic Filter Of Striatal Dopamine Neurotransmission」, Br J Pharmacol, 153 Suppl 1: S283〜97 (2008); Fox, S.H., Lang, A.E. & Brotchie, J.M.,「Translation Of Nondopaminergic Treatments For Levodopa- Induced Dyskinesia From MPTP-Lesioned Nonhuman Primates To Phase IIA Clinical Studies: Keys To Success And Roads To Failure」, Mov Disord, 21, 1578〜94 (2006); Gotti, C.ら,「Heterogeneity And Complexity Of Native Brain Nicotinic Receptors」, Biochem Pharmacol, 74: 1102〜11 (2007); Grady, S.R.ら,「The Subtypes Of Nicotinic Acetylcholine Receptors On Dopaminergic Terminals Of Mouse Striatum」, Biochem Pharmacol, 74: 1235〜46 (2007); Guigoni, C.ら,「Pathogenesis Of Levodopa-lnduced Dyskinesia: Focus On D1 And D3 Dopamine Receptors」, Parkinsonism Relat Disord, 11 Suppl 1: S25〜9 (2005); Guigoni, C.ら,「Involvement Of Sensorimotor, Limbic, and Associative Basal Ganglia Domains In L-3,4-Dihydroxyphenylalanine-lnduced Dyskinesia」, J Neurosci, 25: 2102〜7 (2005); Hsu, A.ら,「Effect Of The D3 Dopamine Receptor Partial Agonist BP-897 [N-[4-(4-(2-Methoxyphenyl)Piperazinyl)Butyl]-2-Naphthamide] On L-3,4-Dihydroxyphenylalanine-lnduced Dyskinesias And Parkinsonism In Squirrel Monkeys」, J Pharmacol Exp Ther, 311: 770〜7 (2004); Linazasoro, G.,「New Ideas On The Origin Of L-Dopa-lnduced Dyskinesias: Age, Genes And Neural Plasticity」, Trends Pharmacol Sci, 26: 391〜7 (2005); Linazasoro, G., Van Blercom, N., Ugedo, L. & Ruiz Ortega, J.A.,「Pharmacological Treatment Of Parkinson's Disease: Life Beyond Dopamine D2/D3 Receptors?」J Neural Transm, 115: 431〜41 (2008); Mercuri, N.B. & Bemardi, G.,「The 'Magic' Of L-Dopa: Why Is It The Gold Standard Parkinson's Disease Therapy?」Trends Pharmacol Sci, 26: 341〜4 (2005); Quik, M., Police, S., He, L., Di Monte, D.A. & Langston, J.W.,「Expression Of D(3) Receptor Messenger RNA And Binding Sites In Monkey Striatum And Substantia Nigra After Nigrostriatal Degeneration: Effect Of Levodopa Treatment」, Neuroscience, 98: 263〜73 (2000); Quik, M., Police, S., Langston, J.W. & Di Monte, D.A.,「Increases In Striatal Preproenkephalin Gene Expression Are Associated With Nigrostriatal Damage But Not L-Dopa-lnduced Dyskinesias In The Squirrel Monkey」, Neuroscience, 113: 213〜20 (2002); Quik, M., Polonskaya, Y., Mcintosh, J.M. & Kulak, J.M.,「Differential Nicotinic Receptor Expression In Monkey Basal Ganglia: Effects Of Nigrostriatal Damage」, Neuroscience, 112: 619〜30 (2002); Quik, M.ら,「L-Dopa Treatment Modulates Nicotinic Receptors In Monkey Striatum」, Mol Pharmacol, 64: 619〜28 (2003); Quik, M.ら,「Chronic Oral Nicotine Treatment Protects Against Striatal Degeneration In MPTP-Treated Primates」, J Neurochem, 98: 1866〜75 (2006); Quik, M., O'leary, K. & Tanner, C.M.,「Nicotine and Parkinson's Disease: Implications For Therapy」, Mov Disord, 23: 1641〜52 (2008), Samadi, P., Bedard, P.J. & Rouillard, C,「Opioids And Motor Complications In Parkinson's Disease」, Trends Pharmacol Sci, 27: 512〜7 (2006); Togasaki, D.M.ら,「Levodopa Induces Dyskinesias In Normal Squirrel Monkeys」,. Ann Neurol, 50: 254〜7. (2001).
【発明の概要】
【0004】
本発明の一態様は、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療する方法を含む。別の態様は、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させる方法を含む。別の態様は、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させる方法を含む。別の態様は、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、パーキンソニズムを改善する方法を含む。別の態様は、L-ドーパ及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を用いて、L-ドーパに応答性の疾患を治療する方法を含む。一実施形態では、L-ドーパに応答性の疾患はパーキンソン病である。別の態様は、α4β2* NNR及びα6β2* NNRの双方を標的とする化合物を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させる方法を含む。
【0005】
同様に、本発明の一態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療するための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用を含む。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させるための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用を含む。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させるための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用を含む。別の態様は、パーキンソニズムを改善するための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用を含む。別の態様は、L-ドーパに応答性の疾患を治療するための薬剤の製造におけるL-ドーパ及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の各々の使用を含む。一実施形態では、L-ドーパに応答性の疾患はパーキンソン病である。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させるための薬剤の製造におけるα4β2* NNR及びα6β2* NNRの双方を標的とする化合物の使用を含む。
【0006】
同様に、本発明の一態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療するための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させるための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させるための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む。別の態様は、パーキンソニズムを改善するための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む。別の態様は、L-ドーパに応答性の疾患を治療するための、L-ドーパを併用する、化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む。一実施形態では、L-ドーパに応答性の疾患はパーキンソン病である。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させるための、α4β2* NNR及びα6β2* NNRの双方を標的とする化合物を含む。
【0007】
本発明の別の態様は、L-ドーパ; (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩;及びL-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその発症若しくは進行を遅延させるための治療計画に関する一つ又は複数の使用説明書を含むキットを含む。一実施形態では、このようなキットはまた、ブリスター包装などのパッケージを含んでもよい。或いは、このようなキットは、L-ドーパ及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の各々の個々の処方及び投薬を提供することができるが、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその発症若しくは進行を遅延させるための治療計画に関する使用説明書と組み合わせた場合、このようなものは本発明の範囲内にあることが意図される。
【0008】
別の態様は、L-ドーパ; (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩;及び一つ又は複数の医薬上許容される担体を含む医薬組成物を含む。一実施形態では、医薬組成物は単位投薬形態であってもよい。
【0009】
別の態様は、L-ドーパ;及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む組合せを含む。一実施形態では、組合せは、各有効成分を含む別々の投薬形態であって、一緒に又は別々に、逐次的に又は同時に、さらに互いに時間的に接近して又は時間的に離れて投与される投薬形態として存在してもよい。
【0010】
別の態様は、L-ドーパ;及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む治療計画を含み、ここで、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩は、L-ドーパと同時に投与される。
【0011】
本発明は、本明細書全体に記載されているように、態様及び実施形態の組合せ、並びに好ましい例を含む。
【0012】
図面は、本発明の特定の実施形態に従って得られた結果を示し、本発明の態様を例示するが、限定するものとして考えるべきではない。
【図面の簡単な説明】
【0013】
【図1】ラットにおけるL-ドーパ誘発性ジスキネジア試験のための治療スケジュールのレンダリングである。図1は、時間、化合物A(アゴニスト#PD1とも呼ばれる)治療、L-ドーパ投薬、及び行動試験を示す。
【図2】化合物A(再び、PD1とも呼ばれる)の二つの別々の投薬量がパーキンソン病ラットにおいていくつかの評価の経過全体でL-ドーパ誘発性AIMを低減することを示す図解である。各値は、十匹のラットの平均+SEMである。対照からの有意差; P < 0.05。
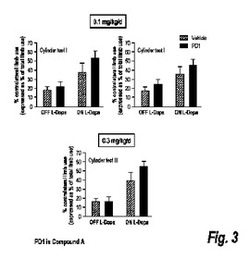
【図3】化合物A(再び、PD1とも呼ばれる)の二つの別々の投薬量が、試験の経過中のいくつかの事象に対する非対称前肢又は円筒試験を用いて評価されたオフL-ドーパ(非存在)又はオンL-ドーパ(存在)でのパーキンソニズムを悪化させないことを示す図解である。各値は、九匹〜十匹のラットの平均+SEMである。
【発明を実施するための形態】
【0014】
パーキンソン病を含むが、それに限定されないで、運動障害のためのL-ドーパ治療の長期使用によるジスキネジアの発症に関するよく認識された問題点がある。ジスキネジアは、L-ドーパ治療の一般に知られ、よく認識された臨床の副作用である。例えば、Brotchie, J.M., Lee, J. & Venderova, K.,「Levodopa- Induced Dyskinesia in Parkinson's Disease」, J Neural Transm, 112: 359〜91 (2005); Fabbrini, G., Brotchie, J.M., Grandas, F., Nomoto, M. & Goetz, C.G,.「Levodopa-lnduced Dyskinesias」, Mov Disord (2007); Olanow, C.W., Obeso, J.A. & Stocchi, F.,「Continuous Dopamine-Receptor Treatment of Parkinson's Disease: Scientific Rationale and Clinical Implications」, Lancet Neurol, 5: 677〜87 (2006); Stacy, M. & Galbreath, A.,「Optimizing Long-Term Therapy For Parkinson Disease: Options For Treatment-Associated Dyskinesia」,. Clin Neuropharmacol, 31 : 120〜5 (2008); Stacy, M. & Galbreath, A.,「Optimizing Long-Term Therapy For Parkinson Disease: Levodopa, Dopamine Agonists, And Treatment-Associated Dyskinesia」, Clin Neuropharmacol, 31: 51〜6 (2008);及びThanvi, B., Lo, N. & Robinson, T.,「Levodopa-lnduced Dyskinesia In Parkinson's Disease: Clinical Features, Pathogenesis, Prevention And Treatment」, Postgrad Med J, 83: 384〜8 (2007)を参照されたい。
【0015】
2007年に、公開された研究は、パーキンソン病の動物モデルにおいてL-ドーパ誘発性ジスキネジアの緩和に使用するための原型的なニコチン性アセチルコリンアゴニストニコチンの具体的な関連性を実証した。Bordia, T., Campos, C, Huang, L.Z. & Quik, M.,「Continuous And Intermittent Nicotine Treatment Reduces L-3,4-Dihydroxyphenylalanine (L-DOPA)-lnduced Dyskinesias In A Rat Model Of Parkinson's Disease」, J Pharmacol Exp Ther, 327: 239〜47 (2008); Quik, M.ら,「Nicotine Reduces Levodopa-lnduced Dyskinesias in Lesioned Monkeys」, Annals of Neurology, G2; 588〜96 (2007);及びQuik, M., Bordia, T. & O'leary, K.,「Nicotinic Receptors As CNS Targets For Parkinson's Disease」,. Biochem Pharmacol, 74: 1224〜1234 (2007)を参照されたい。
【0016】
データは非常に説得力があったが、いくつかの望ましくない副作用は、ヒトにおけるニコチンの使用及び投与と相関し、具体的には、末梢、すなわち筋肉及び神経節におけるその効果と関連する。したがって、より選択的な神経性ニコチン受容体相互作用を有する代替化合物が、患者コンプライアンス及び治療指数に関して利点を提供するものと考えられる。
【0017】
末梢神経系ではなく、線条体における主要なNNRは、α4β2* NNR、α6β2* NNR及びα7 NNRであり、この場合、アスタリスクは受容体複合体における他のNNRサブユニットの存在の可能性を示す。したがって、これらのNNRサブタイプ指向性の薬物は、ニコチンを上回るL-ドーパ誘発性ジスキネジアの緩和に対する改善された代替物を提供するべきである。
【0018】
以下の定義は、定義される用語を詳細に説明することを意味し、限定されるものではない。本明細書において使用される特定の用語が具体的に定義されていない場合、このような用語は不明確なものであると考えるべきではない。むしろ、これらの用語は通義の範囲において使用される。
【0019】
本明細書で使用するとき、「アゴニスト」は、その結合パートナー、典型的には受容体を刺激する物質である。刺激は、特定のアッセイとの関連で定義されるか、又は当業者に理解されるように、実質的に類似した状況下で特定の結合パートナーの「アゴニスト」若しくは「アンタゴニスト」として認められた因子又は物質との比較を行っている本明細書中の考察から文献において明らかな場合がある。刺激は、アゴニスト又は部分アゴニストと結合パートナーとの相互作用によって誘導され、且つアロステリック効果を含み得る特定の効果又は機能の増大に関して定義することができる。
【0020】
本明細書で使用するとき、「アンタゴニスト」は、その結合パートナー、典型的には受容体を阻害する物質である。阻害は、特定のアッセイとの関連で定義されるか、又は当業者に理解されるように、実質的に類似した状況下で特定の結合パートナーの「アゴニスト」若しくは「アンタゴニスト」として認められた因子又は物質との比較を行っている本明細書中の考察から文献において明らかな場合がある。阻害は、アンタゴニストと結合パートナーとの相互作用によって誘導され、且つアロステリック効果を含み得る特定の効果若しくは機能の低下に関して定義することができる。
【0021】
本明細書で使用するとき、「部分アゴニスト」又は「部分アンタゴニスト」は、それぞれ、その結合パートナーに対して、各々十分又は完全にはアゴニスト又はアンタゴニストではないレベルの刺激又は阻害を提供する物質である。刺激、故に阻害は、アゴニスト、アンタゴニスト、又は部分アゴニストとして定義されるあらゆる物質又は物質カテゴリーに関して本質的に定義されることが理解されよう。
【0022】
本明細書で使用するとき、「固有の活性」又は「効力」は、結合パートナー複合体の生物学的有効性のある尺度に関係する。受容体の薬理学に関して、固有の活性又は効力を定義すべき状況は、結合パートナー(例えば、受容体/リガンド)複合体の状況、及び特定の生物学的成果に関連する活性を考慮することによって決まる。例えば、ある状況においては、固有の活性は、関与する特定の第2のメッセンジャー系によって変動する可能性がある。このような教示に関して、参照により本明細書に援用されるHoyer, D.及びBoddeke, H., Trends Pharmacol. Sci. 14(7): 270〜5 (1993)を参照されたい。このような前後関係的な特定の評価がどのような場合に関連し、またそれらが本発明の状況とどのように関連し得るかは、当業者には明らであろう。
【0023】
本明細書で使用するとき、受容体のモジュレーションには、受容体のアゴニズム、部分的アゴニズム、アンタゴニズム、部分的アンタゴニズム、又は逆アゴニズムが含まれる。
【0024】
本明細書全体を通じて使用するとき、化合物A(生物学的試験においてPD1とも呼ばれる)は、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩であり、以下に例証される。化合物Aは、以下の構造式:
【化1】

【0025】
又は医薬上許容されるその塩を有する。(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン、そのラセミ合成、及びそのガラクタル酸塩及びヘミガラクタル酸塩形態は、各々が化合物Aの調製の開示について参照により本明細書に援用される、公開された国際公開第04/078752号及び米国特許第7,098,331号に開示されている。
【0026】
ジスキネジアの確証されたパーキンソン病動物モデル(L-ドーパ治療された片側6-ヒドロキシドーパミン傷害ラット)においてCNSサブタイプを標的とするNNR薬物の効果を評価する研究を開始した。α4β2* NNR及びα6β2* NNRの双方を標的とする化合物A(皮下ミニポンプを介した0.1又は0.3mg/kg/日)は、全L-ドーパ誘発性AIMSを約25%まで低減させ、軸性AIMよりも経口においてより顕著に低減させた。
【0027】
さらに、化合物Aは、傷害を受けたラットにおけるパーキンソニズムの改善傾向を実証した。このようにして、選択的NNR薬物は、現在、非常に限定された治療であるL-ドーパ療法の問題のある合併症であるパーキンソン病におけるジスキネジアの管理に有用であり得る。
【0028】
本明細書で使用するとき、「医薬上許容される」という用語は、製剤の他の成分と適合可能であって、医薬組成物の服用者にとって有害ではない、本発明の化合物の担体、希釈剤、賦形剤又は塩形態を意味する。
【0029】
本明細書で使用するとき、「医薬組成物」という用語は、一つ若しくは複数の医薬上許容される担体、希釈剤、又は賦形剤と場合により混合される本発明の化合物を意味する。医薬組成物は、それらを製造する目的及び商品化する目的に適し得るように、環境条件に対する安定性の程度を示すのが好ましい。
【0030】
本明細書で使用するとき、「有効量」、「治療量」、及び「有効投薬量」という用語は、所望の薬理効果又は治療効果を引き出し、それによって障害の有効な治療に至るのに十分な本発明の化合物の量を意味する。障害の治療は、障害の発症又は進行、並びに障害に関連した症状の発症又は進行を遅延又は予防することによって明らかにされてもよい。また、障害の治療は、症状の減少又は消失、障害の進行の回復、並びに患者の健康状態への任意の他の寄与によって明らかにされてもよい。
【0031】
有効投薬量は、因子、例えば、患者の状態、障害の症状の重症度、及び医薬組成物が投与される様式に応じて変化させることができる。有効投薬量で投与するために、化合物は、0.1mg/kg患者体重程度の低さの量で投与されてもよい。一実施形態では、化合物は、約1mg/kg患者体重未満から約100μg/kg患者体重未満の量、さらには約1μg/kgから100μg/kg患者体重未満の間の量で投与されてもよい。前述の有効投薬量は、典型的には、単回投薬量として、又は24時間の期間中に投与されてもよい一回若しくは複数回の投薬量として投与されてもよい量を表す。一実施形態では、約1mgから約100mg、好ましくは1mgから約50mg、好ましくは約5mgから約30mg、好ましくは約5mgから約20mgの化合物Aの一日投薬量が投与されてもよい。投薬量は、一日一回であってもよく、一日二回(BID)、一日三回(QD)、一日四回(QID)、又はより多くの投薬量を与えるように分割されてもよい。
【0032】
化合物A又は医薬上許容されるその塩は、多形として知られる特徴である二つ以上の形態で結晶化されてもよく、このような多形の形態(「多形体」)は本発明の範囲内である。多形は、一般に、温度、圧力、又はその双方の変化の応答として生じる場合がある。また、多形は、結晶化過程の変更に起因する場合もある。多形体は、X線回折パターン、溶解度、及び融点などの当技術分野において知られている様々な物理的特徴によって区別することができる。
【0033】
化合物Aは、不斉中心を含み、したがって複数の立体異性体として存在することができる。本発明の範囲は、立体異性体の混合物、並びに精製された鏡像異性体又は鏡像異性的/ジアステレオマー的に富んだ混合物を含む。また、本発明の式によって表される化合物の個々の異性体、並びに任意の全体的又は部分的に平衡化されたそれらの混合物が、本発明の範囲内に含まれる。さらに、本発明は、上記式によって表される化合物の個々の異性体を、一つ又は複数の不斉中心が反転するその異性体を含む混合物として含む。化合物が単一の鏡像異性体として望まれる場合、このようなものは、立体特異的合成によって、最終生成物若しくは任意の都合のよい中間体の分解によって、又は当技術分野において知られているようなキラルクロマトグラフィー法によって得られてもよい。最終生成物、中間体、又は出発材料の分解は、当技術分野において知られている任意の適切な方法によって行うことができる。例えば、Stereochemistry of Organic Compounds (Wiley-Interscience, 1994)を参照されたい。
【0034】
本発明は、本明細書に記載されている化合物の塩又は溶媒和物を含み、塩の溶媒和物などのそれらの組合せを含む。本発明の化合物は、溶媒和形態、例えば、水和形態、並びに非溶媒和形態で存在してもよく、本発明はこのような全ての形態を包含する。典型的には、絶対的ではないが、本発明の塩は、医薬上許容される塩である。用語「医薬上許容される塩」に包含される塩は、本発明の化合物の非毒性塩を意味する。適切な医薬上許容される塩の例には、無機酸付加塩、例えば、塩化物、臭化物、硫酸塩、リン酸塩、及び硝酸塩;有機酸付加塩、例えば、酢酸塩、ガラクタル酸塩、プロピオン酸塩、コハク酸塩、乳酸塩、グリコール酸塩、リンゴ酸塩、酒石酸塩、クエン酸塩、マレイン酸塩、フマル酸塩、メタンスルホン酸塩、p-トルエンスルホン酸、及びアスコルビン酸塩;酸性アミノ酸を有する塩、例えば、アルパラギン酸塩及びグルタミン酸塩;アルカリ金属塩、例えば、ナトリウム塩及びカリウム塩;アルカリ土類金属、例えば、マグネシウム塩及びカルシウム塩;アンモニウム塩;有機塩基性塩、例えば、トリメチルアミン塩、トリエチルアミン塩、ピリジン酸塩、ピコリン塩、ジシクロヘキシルアミン塩、及びN,N'-ジベンジルエチレンジアミン塩;並びに塩基性アミノ酸との塩、例えば、リジン塩及びアルギニン塩が挙げられる。これらの塩は、ある場合には、水和物又はエタノール溶媒和物であってもよい。
【0035】
本発明の化合物をバルク活性化合物の形態で投与することは可能であるが、医薬組成物又は製剤の形態で化合物を投与することが好ましい。したがって、本発明の一態様は、式Iの一つ若しくは複数の化合物、及び/又は医薬上許容されるその塩、並びに一つ若しくは複数の医薬上許容される担体、希釈剤又は賦形剤を含む医薬組成物を含む。本発明の別の態様は、式Iの一つ若しくは複数の化合物、及び/又は医薬上許容されるその塩と、一つ若しくは複数の医薬上許容される担体、希釈剤又は賦形剤とを混合することを含む、医薬組成物を調製する方法を提供する。
【0036】
本発明の化合物を投与する様式を変えることができる。本発明の化合物は、好ましくは、経口投与される。経口投与用の好ましい医薬組成物には、錠剤、カプセル、カプレット、シロップ、溶液、及び懸濁液が挙げられる。本発明の医薬組成物は、持続放出錠剤及びカプセル製剤などの放出調節投薬形態で提供されてもよい。
【0037】
また、医薬組成物は、注射を介して、すなわち静脈内、筋内、皮下、腹腔内、動脈内、髄腔内、及び脳室内に投与され得る。静脈内投与は、好ましい注射の方法である。注射に適した担体は、当業者に周知であり、5%デキストロース溶液、生理食塩水、及びリン酸緩衝生理食塩水が挙げられる。
【0038】
また、製剤は、他の手段、例えば、直腸投与を用いて投与されてもよい。坐薬などの直腸投与に有用な製剤は、当業者に周知である。さらに、化合物は、吸入によって、例えば、エアロゾルの形態で;局所的に、例えば、ローションの形態で;経皮的に、例えば、経皮パッチを用いて(例えば、Novartis及びAlza Corporationから市販されている技術を用いることによる)、粉末注入によって、又は口腔、舌下、若しくは鼻腔内吸収によって、投与することができる。
【0039】
医薬組成物は、単位投薬量の形態、又は複数回若しくはサブユニット投薬量で製剤化されてもよい。
【0040】
本明細書に記載されている医薬組成物の投与は、断続的であってもよく、又は段階的、連続的、一定の若しくは調節された速度であってもよい。医薬組成物は、温血動物、例えば、マウス、ラット、ネコ、ウサギ、イヌ、ブタ、ウシ、若しくはサルなどの哺乳動物に投与されてもよいが;有利には、ヒトに投与される。さらに、医薬組成物が投与される一日の時間帯、及び一日あたりの回数を変化させることができる。
【0041】
化合物A又は医薬上許容されるその塩は、障害若しくは状態の治療又は予防に有用な様々な他の適切な治療薬と併用して用いることができる。したがって、本発明の一実施形態は、他の治療用化合物と併用した本発明の化合物の投与を含む。例えば、本発明の化合物は、他のNNRリガンド(例えば、バレニクリン)、NNRのアロステリック調節因子、抗酸化剤(例えば、フリーラジカル消去剤)、抗菌剤(例えば、ペニシリン系抗生物質)、抗ウイルス薬(例えば、ジドブジン及びアシクロビルのようなヌクレオシド類似体)、抗凝血剤(例えば、ワーファリン)、抗炎症剤(例えば、NSAID)、解熱剤、鎮痛薬、麻酔薬(例えば、手術で用いるもの)、アセチルコリンエステラーゼ阻害剤(例えば、ドネペジル及びガランタミン)、抗精神病薬(例えば、ハロペリドール、クロザピン、オランザピン、及びクエチアピン)、免疫抑制剤(例えば、シクロスポリン及びメトトレキセート)、神経保護剤、ステロイド(例えば、ステロイドホルモン)、コルチコステロイド(例えば、デキサメタゾン、プレドニゾン及びヒドロコルチゾン)、ビタミン、ミネラル、栄養補助食品、抗うつ薬(例えば、イミプラミン、フルオキセチン、パロキセチン、エスシタロプラム、セルトラリン、ベンラファキシン及びデュロキセチン)、抗不安薬(例えば、アルプラゾラム及びバスピロン)、抗てんかん薬(例えば、フェニトイン及びガバペンチン)、血管拡張薬(例えば、プラゾシン及びシルデナフィル)、気分安定剤(例えば、バルプロ酸塩及びアリピプロゾール)、抗癌薬(例えば、抗増殖薬)、抗高血圧薬(例えば、アテノロール、クロニジン、アムロピジン、ベラパミル、及びオルメサルタン)、下剤、便秘薬、利尿薬(例えば、フロセミド)、鎮痙薬(例えば、ジサイクロミン)、抗ジスキネジア薬、並びに抗潰瘍薬(例えば、エソメプラゾール)、と併用して用いられてもよい。医薬として活性な薬物のこのような組合せは一緒に又は別々に投与されてもよく、別々に投与される場合には、投与は、同時に又は逐次的に任意の順序で行ってもよい。化合物又は薬物の量、及び相対的な投与タイミングは、所望の治療効果を達成するために選択される。本発明の化合物と他の治療薬との併用投与は、(1)双方の化合物を含む単一の医薬組成物、又は(2)一方の化合物をそれぞれ含む別個の医薬組成物、として同時に投与することによる併用であってもよい。或いは、組合せは、一方の治療薬を最初に投与し、他方を2番目に投与する逐次的様式で、別々に投与されてもよい。このような逐次的投与は時間的に接近していてもよく、又は時間的に離れていてもよい。本発明の別の態様は、治療的に又は予防的に有効量の本発明の化合物を対象に投与すること、及び化学療法、放射線療法、遺伝子治療、又は免疫療法を含む一つ若しくは複数の他の療法を含む併用療法を含む。
【0042】
本発明の化合物は、有効量で用いられる場合、α4β2及びα6β2*の活性を調節すると考えられ、α7で効果が全くかほとんどなく、ヒト神経節を特徴付けるニコチンサブタイプとの感知できる程度の相互作用もなく、これは、副腎クロム親和性組織、又は骨格筋においてニコチン機能を発揮する能力の欠如によって実証され、さらに、筋肉型ニコチン受容体を発現する細胞調製物においてニコチン機能を発揮する能力の欠如によって実証される。したがって、これらの化合物は、神経節部位及び神経筋部位での活性と関連した有意な副作用を発揮せずに、疾患、障害及び状態を治療又は予防することができると考えられる。このようにして、本化合物の投与は、ある種の疾患、障害及び状態の治療が与えられ、ある種の副作用が避けられる治療濃度域を与えると考えられる。すなわち、化合物の有効投薬量は、疾患、障害又は状態に対する所望の効果を与えるのに十分であると考えられるが、望ましくない副作用を与えるには不十分である、つまり十分に高いレベルではないと考えられる。
【0043】
化合物は、特に適切な標識を含むように修飾される場合、プローブなどの診断用組成物において用いることができる。この目的のため、最も好ましくは、本発明の化合物は、11C、18F、76Br、123I又は125Iなどの放射性同位体部分を用いて標識される。投与された化合物は、用いられる標識に適した、既知の検出方法を用いて検出することができる。検出方法の例には、ポジション放出トポグラフィー(position emission topography (PET))、及び単光子放射型コンピュータ断層撮影法(single-photon emission computed tomography: SPECT)が挙げられる。上記される放射性標識は、PET(例えば、11C、18F又は76Br)、及びSPECT(例えば、123I)画像化に有用であり、半減期は、11Cでは約20.4分、18Fでは約109分、123Iでは約13時間、及び76Brでは約16時間である。高い比活性は、不飽和濃度で選択された受容体サブタイプを視覚化するために望まれる。投与された投薬量は、典型的には、毒性範囲を下回り、高いコントラスト画像を与える。化合物は、非毒性レベルで投与を可能にすることが期待される。投薬量の決定は、放射性標識画像化の当業者に知られている様式で実施される。例えば、Londonらによる米国特許第5,969,144号を参照されたい。
【0044】
化合物は、既知の技術を用いて投与することができる。例えば、上記のLondonらによる米国特許第5,969,144号を参照されたい。化合物は、他の成分、例えば、診断用組成物の製剤化に有用であるそれらタイプの成分を組み込む製剤組成物において投与され得る。本発明の実施に従って有用な化合物は、最も好ましくは、高純度の形態で用いられる。例えば、Elmalchらによる米国特許第5,853,696号を参照されたい。
【0045】
化合物を対象(例えば、ヒト対象)に投与後、対象内におけるその化合物の存在は、その存在、量、及び機能性を示すために適切な技術によって画像化され、定量化され得る。ヒトに加えて、化合物はまた、マウス、ラット、イヌ、及びサルなどの動物に投与されてもよい。SPECT及びPET画像化は、任意の適切な技術及び装置を用いて実行され得る。代表的な画像化技術の開示について、各々が参照により本明細書に援用されるVillemagneら, Arnericら(編集)Neuronal Nicotinic Receptors: Pharmacology and Therapeutic Opportunities, 235〜250 (1998)及びElmalchらによる米国特許第5,853,696号を参照されたい。
【0046】
一態様では、診断用組成物は、ヒト患者などの対象において疾患を診断する方法において用いることができる。この方法は、本明細書に記載されている検出可能に標識された化合物をその患者に投与すること、及び選択されたNNRサブタイプ(例えば、α4β2及びα6β2*受容体サブタイプ)に対するその化合物の立体的機構を検出することを伴う。PET及びSPECTなどの診断ツールを用いる当業者は、本明細書に記載されている放射性標識された化合物を用いて、中枢神経系及び自律神経系の機能障害と関連した状態及び障害を含む幅広い種類の状態及び障害を診断することができる。このような障害には、幅広い種類のCNS疾患及び障害が含まれ、アルツハイマー病、パーキンソン病、及び統合失調症が挙げられる。評価され得るこれらの及び代表的な疾患及び障害は、Bencherifらによる米国特許第5,952,339号に記載されるものが含まれる。
【0047】
別の態様では、診断用組成物は、ヒト患者などの対象の選択的ニコチン受容体サブタイプを監視する方法において用いることができる。この方法は、本明細書に記載されている検出可能に標識された化合物をその患者に投与すること、及び選択されたニコチン受容体サブタイプ、すなわち、α4β2及びα6β2*受容体サブタイプに対するその化合物のイオン束衝突を検出することを伴う。
【0048】
化合物Aは、十分に確立された合成法を含む様々な方法によって製造されてもよい。例証的な一般合成法は以下に示され、次に本発明の具体的な化合物は実施例において調製される。
【0049】
後述される実施例では、感受性基又は反応基のための保護基は、必要に応じて、合成化学の一般的な原理に従って用いられる。保護基は、有機合成の標準的な方法に従って操作される(T. W. Green及びP. G. M. Wuts (1999) Protecting Groups in Organic Synthesis, 3版, John Wiley & Sons,保護基に関して参照により本明細書に援用される)。これらの基は、当業者に容易に分かる方法を用いて、化合物合成の都合の良い段階で除去される。プロセスの選択、並びに反応条件及びそれらの実行の順序は、本発明の化合物の調製と一致させるべきである。
【0050】
化合物Aは、容易に利用可能な出発材料及び試薬を用いて、以下に記載される方法に従って調製され得る。これらの反応では、当業者にそれ自体知られているが、本明細書に詳細に記載されていない変形を用いてもよい。
【0051】
他に記載がなければ、本明細書に示されている構造はまた、一つ又は複数の同位体に富んだ原子の存在下においてのみ異なる化合物を含むことを意味する。デューテリウム若しくはトリチウムによる水素原子の置換、又は13C若しくは14Cに富んだ炭素による炭素原子の置換を除いて、本構造を有する化合物は、本発明の範囲内である。例えば、デューテリウムは、生物学的に活性な化合物の薬物動態及び代謝を調べるために幅広く使用されている。デューテリウムは化学的観点から水素に類似して振る舞うが、デューテリウム-炭素結合と水素-炭素結合との間の結合エネルギー及び結合長において有意な相違が存在する。結果として、生物学的に活性な化合物におけるデューテリウムによる水素の置換は、一般には、その生化学的潜在力及び選択性を保持するが、その同位体不含の対応物と比較して、有意に異なる吸収、分布、代謝、及び/又は排出(absorption, distribution, metabolism, and/or excretion: ADME)特性を明示する化合物に至る場合がある。このようにして、デューテリウム置換は、いくつかの生物学的に活性な化合物について、改善された薬物効力、安全性、及び/又は認容性をもたらすことがある。
【0052】
有機合成の当業者には、本発明の化合物を製造するための手段、並びに様々な使用に適した放射性同位体を用いて標識される本発明の化合物を製造するための手段が複数あることが理解されよう。例えば、上述されるように、11C-若しくは18F-標識されたアリール又はヘテロアリールボロン酸を用いたカップリング、続く保護基の除去は、ポジトロン放出断層撮影における使用に適した化合物を製造する。同様に、上述されるように、3H-若しくは14C-標識されたアリール又はヘテロアリールボロン酸を用いたカップリング、続く保護基の除去は、機能及び代謝研究における使用に適した同位体で修飾された化合物、又は代替の治療用化合物を製造する。
【実施例1】
【0053】
【化2】

【0054】
tert-ブチル(R)-3-(メチルスルホニルオキシ)ピロリジン-1-カルボキシレート(2)の合成
手順A:-20から-30℃のトルエン(700ml)中のtert-ブチル(R)-3-ヒドロキシピロリジン-1-カルボキシレート(200g、1.07mol)及びトリエチルアミン(167g、1.63mol)の溶液に、塩化メタンスルホニル(156g、1.36mol)を-10から-20℃に温度を維持しながら滴下した。この溶液を周囲温度に温め、撹拌した。反応溶液を1時間毎にサンプリングし、HPLCによって分析して、反応の完了を確認した。反応の完了直後、懸濁液をろ過し、トリエチルアミン塩酸塩を除去した。ろ液を約600mLの重炭酸ナトリウムの希釈水溶液で洗浄した。有機層を乾燥させ、減圧下で濃縮して、粘性油として2を得た(260g、92%)。これをさらに精製せずに用いる。1H NMR (CDCl3, 400 MHz) δ 5.27 (m, 1H), 3.44 - 3.76 (m, 4H), 3.05 (s, 3H), 2.26 (m, 1H), 2.15 (m, 1H), 1.47 (s, 9H)。
【0055】
手順B:リアクターをtert-ブチル(R)-3-ヒドロキシピロリジン-1-カルボキシレート(2.00kg、10.7mol)、トルエン(8.70kg)及びトリエチルアミン(1.75kg、17.3mol)で充たした。リアクターに窒素を15分間流した。混合物を撹拌し、3℃に冷却した。連続して氷浴冷却しながら塩化メタンスルホニル(1.72kg、mol)を徐々に(2時間かけて)添加した(発熱反応)(添加完了後は、温度が14℃であった)。混合物は、この時点で、沈殿したトリエチルアミン塩酸塩のため粘性があり、それを20℃に温めながら12時間撹拌した。GC及びTLC分析(ニンヒドリン染色)の双方により、出発材料は残っていないことが示された。混合物をろ過し、トリエチルアミン塩酸塩を除去し、ろ液をリアクターに戻した。次に、5%の重炭酸ナトリウム水溶液(2×3kg)でろ液を洗浄し、各洗浄については15分の撹拌時間及び15分の沈降時間を用いた。得られた有機層を無水硫酸ナトリウム上で乾燥させ、ろ過した。最初に50℃にて4時間、次に周囲温度にて10時間の真空下で揮発性物質をろ液から除いた。残渣の重量は3.00kg(収率106%)であり、クロマトグラフィー及びNMRの分析により、トルエンを含有することを除いて、先に調製された試料と同一であった。
【0056】
ジエチル(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロネート(3)の合成
調製A:1-メチル-2-ピロリジノン(1.19L)中のカリウムtert-ブトキシド(187g、1.62mol)の溶液にマロン酸ジエチル(268g、1.67mol)を温度を35℃未満に維持しながら添加した。この溶液を40℃に加熱し、20〜30分間撹拌した。tert-ブチル(R)-3-(メチルスルホニルオキシル)ピロリジン-1-カルボキシレート(112g、420mmol)を添加し、この溶液を65℃に加熱し、6時間撹拌した。反応溶液を2時間毎にサンプリングし、HPLCによって分析して、反応の完了を確認した。反応の完了(10〜12時間)直後、混合物を約25℃に冷却した。脱イオン水(250mL)をこの溶液に添加し、2Nの塩酸(650mL)を添加してpHを3〜4に調整した。得られた懸濁液をろ過し、水(1.2L)とクロロホルム(1.4L)を添加した。この溶液を十分に混合し、クロロホルム層を回収し、減圧下で蒸発させて、黄色の油を得た。この油をヘキサン(2.00L)に溶解し、脱イオン水(2×1.00L)で洗浄した。減圧下で50〜55℃にて有機層を濃縮して、淡黄色の油(252g)を得た。1H NMR分析により、3が49.1%(123.8g)であり、マロン酸ジエチルが48.5%(122g)であり、1-メチル-2-ピロリジノンが2%(5g)であることが示される。この材料をさらに精製せずに次の工程に進めた。1H NMR (CDCl3, 400 MHz) δ 4.20 (q, 4H), 3.63 (m, 1H), 3.48 (m, 1H), 3.30 (m, 1H), 3.27 (d, J = 10 Hz, 1H), 3.03 (m, 1H), 2.80 (m, 1H), 2.08 (m, 1H), 1.61 (m,1H), 1.45 (s, 9H), 1.27 (t, 6H)。
【0057】
調製B:リアクターは、窒素雰囲気下で維持され、200プルーフのエタノール(5.50kg)、及びエタノール中の21%(重量比)のナトリウムエトキシド(7.00kg、21.6mol)で充たされた。混合物を撹拌し、30℃に温めた。マロン酸ジエチル(3.50kg、21.9mol)を20分かけて添加した。次に、反応混合物を40℃にて1.5時間温めた。200プルーフのエタノール(5.50kg)中のtert-ブチル(R)-3-(メチルスルホニルオキシル)ピロリジン-1-カルボキシレート(実施例2、手順Bから得た3.00kgの生成物、10.7mol)の溶液を添加し、得られた混合物を2時間、加熱還流(78℃)した。GC及びTLC分析(ニンヒドリン染色)の双方により、出発材料は残っていないことが示された。次に、撹拌混合物を25℃に冷却し、水(2.25kg)で希釈し、水(5.44kg)中の濃塩酸(1.27kg、12.9mol)溶液でゆっくり処理した。この混合物をメチルtert-ブチルエーテル(MTBE)(14.2kgと11.4kg)で二回洗浄し、各洗浄については15分の撹拌時間及び15分の沈降時間を用いた。合わせたMTBE洗浄物を無水硫酸ナトリウム(1kg)上で乾燥し、ろ過し、真空下、50℃にて6時間濃縮した。残渣(赤色の油)の重量は4.45kgであり、GC分析により所望生成物は49%であった(tert-ブチル(R)-3-ヒドロキシピロリジン-1-カルボキシレートからは全体で収率62%であった)。
【0058】
(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロン酸(4)の合成
手順A:テトラヒドロフラン(1.2L)中の123.8g(380mmol)の3及び121.8g(760mmol)のマロン酸ジエチルを含有する、実施例3、手順Aにより得られた生成物(232g)の溶液に、21%の水酸化カリウム溶液(0.50Lの脱イオン水中、450g)を温度を25℃未満に維持しながら添加した。反応混合物を45℃に加熱し、1時間撹拌した。反応溶液を1時間毎にサンプリングし、HPLCによって分析して、反応の完了を確認した。反応の完了(2〜3時間)直後、混合物を約25℃に冷却した。水層を回収し、5℃に冷却した。4Nの塩酸(750mL)の添加により、pHを2に調整し、得られた懸濁液を5〜10℃にて30分間保持した。混合物をろ過し、ろ過ケーキをヘキサン(1L)で洗浄した。ろ液をクロロホルム(1L)で抽出し、クロロホルム層を別にしておいた。ろ過工程で回収された固体をクロロホルム(1L)中で40℃に加熱することによって再溶解した。この溶液をろ過し、溶解していない無機固体を除去した。クロロホルム層を合わせ、減圧下で50〜55℃にて濃縮して、オフホワイト色の固体(15g)を得た。この固体を合わせ、酢酸エチル(350mL)に溶解して、懸濁液を得て、この懸濁液を50〜60℃に2時間温めた。熱いうちに懸濁液をろ過し、得られたケーキを酢酸エチル(2×150mL)及びヘキサン(2×250mL)で洗浄して、83.0g(80.1%)の4を白色の固体として得て、これをさらに精製せずに次の工程に用いた。1H NMR (d4-CH3OH, 400 MHz) δ 3.60 (m, 1H), 3.46 (m, 1H), 3.29-3.32 (m, 2H), 2.72 (m, 1H), 2.09 (m, 1H), 1.70 (m, 1H), 1.45 (s, 9H)。
【0059】
手順B:テトラヒドロフラン(13.9kg)中の2.13kg(6.47mol)の3を含有する、実施例3、手順Bの生成物(4.35kg)の溶液は、温度を35℃未満に維持しながら、窒素雰囲気下で、脱イオン水(2.00kg)中の撹拌冷却した水酸化カリウム(1.60kg、40.0mol)の溶液に添加された。反応混合物を加熱し、40〜45℃にて24時間維持し、その時点で、GC及びTLC分析により、反応が完了したことが示された。混合物25℃に冷却し、MTBE(34kg)で洗浄し、15分の撹拌時間及び15分の沈降時間を用いた。水層を回収し、1℃に冷却した。次に、脱イオン水(2.18kg)中の濃塩酸(2.61kg、26.5mol)の混合物をゆっくり添加し、その添加中及び添加後の15分間は、混合物の温度を15℃未満に保持した。塩酸をさらに添加することによって、溶液のpHを3.7に調整した。白色の固体をろ過により回収し、水(16kg)で洗浄し、周囲温度で6時間真空乾燥した。乾燥した固体の重量は1.04kgであった。ろ液を10℃未満に冷却し、さらなる塩酸(1.6Lの6Nを用いた;9.6 mol;最終pH=2)の添加によりpHを下げながらその温度に保持した。白色の固体をろ過により回収し、水(8L)で洗浄し、40℃にて三日間真空乾燥した。乾燥した固体の重量は0.25kgであった。合わせた固体(1.29kg、収率73%)は、クロマトグラフィーにより、先に調製された試料と同一であった。
【0060】
(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)酢酸(5)の合成
手順A:1-メチル-2-ピロリジン(0.42L)中の(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロン酸(83g)の溶液を窒素下で110〜112℃にて2時間撹拌した。反応溶液を1時間毎にサンプリングし、HPLCによって分析して、反応の完了を確認した。反応の完了直後、反応溶液を20〜25℃に冷却した。この溶液を脱イオン水(1.00L)と混合し、MTBE(1.00L)を添加した。この相を分離させ、有機層を回収した。水相をMTBE(1.00L)、次にクロロホルム(1.00L)で抽出した。有機層を合わせ、減圧下で50〜55℃にて濃縮して、油を得た。この油をMTBE(2.00L)に溶解し、0.6N塩酸(2×1.00L)で二回洗浄した。有機層を回収し、減圧下で50〜55℃にて濃縮して、半固体を得た。この半固体を1:4の酢酸エチル/ヘキサン(100mL)に懸濁し、50℃に加熱し、30分間保持し、-10℃に冷却し、ろ過した。ろ液を減圧下で濃縮して、油を得て、それをMTBE(250mL)に溶解し、0.6N塩酸(2×100mL)で二回洗浄した。有機層を減圧下で50〜55℃にて濃縮して、半固体を得て、それを1:4の酢酸エチル/ヘキサン(50mL)に懸濁し、50℃に加熱し、30分間保持し、-10℃に冷却し、ろ過した。この固体を集め、ヘキサン(200mL)に懸濁し、ろ過により回収して、54.0g(77.6%)の5を得た。1H NMR (CDCl3, 400 MHz) δ 11.00 (br s, 1H), 3.63 (m, 1H), 3.45 (M, 1H), 3.30 (M, 1H), 2.97 (m, 1H), 2.58 (m, 1H), 2.44 (m, 2H), 2.09 (m, 1H), 1.59 (M, 1H), 1.46 (s, 9H)。
【0061】
手順B:1-メチル-2-ピロリジン(6.49kg)中の(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロン酸(1.04kg, 3.81mol)の溶液を窒素下で110℃にて5時間撹拌し、その時点で、TLC及びHPLC分析により、反応が完了したことが示された。反応混合物を25℃(4時間)に冷却し、水(12.8kg)及びMTBE(9.44kg)と合わせた。混合物を20分間激しく撹拌し、この相を放置して分離させた(10時間)。有機相を回収し、水相をMTBE(9.44kg)と合わせ、15分間撹拌し、沈降させた(45分間)。有機相を回収し、水相をMTBE(9.44kg)と合わせ、15分間撹拌し、沈降させた(15分間)。三つの有機相を合わせ、1N塩酸(8.44kgずつ)で三回洗浄し、水(6.39kg)で一回洗浄し、各洗浄については15分の撹拌時間及び15分の沈降時間を用いた。得られた溶液を無水硫酸ナトリウム(2.0kg)上で乾燥し、ろ過した。ろ液を減圧下で31℃(2時間)にて濃縮して、固体を得た。この固体を真空下、39℃にて4時間、及び25℃にて16時間加熱し、704g(81%)の5(GCによる純度99.7%)を得た。
【0062】
手順C(出発材料として2を用いた5の合理化合成):エタノール中のナトリウムエトキシド(21重量パーセント、343g、1.05mol)、エタノール(無水、300mL)及びマロン酸ジエチル(168g、1.05mol)の撹拌混合物を40℃に1.5時間加熱した。この混合物にエタノール(100mL)中の(R)-tert-ブチル3-(メチルスホニルオキシ)ピロリジン-1-カルボキシレート(138g、0.592mol)の溶液を添加し、反応混合物を78℃に8時間加熱した。冷却した反応混合物を水(2.0L)で希釈し、6MのHCl(100mL)を用いてpH=3へと酸性にした。水性エタノール混合物をトルエン(1.0L)で抽出し、有機相を真空下で濃縮して、230gの赤色の油を得た。赤色の油を85℃にて22.5重量パーセントの水酸化カリウム(748g、3.01mol)水溶液に添加した。添加が完了した後、反応温度をゆっくり102℃に上昇させるのと同時に、エタノールの蒸留を確実に行った。反応温度が102℃に達し、蒸留が収まってきたとき、さらに90分間、加熱を続けた。反応混合物を周囲温度に冷却し、トルエン(2×400mL)で洗浄した。内部温度を20℃未満に保持しながら、水層に600mLの6M塩酸を添加した。これにより、pHが約4〜5から、沈殿物が形成した。懸濁液をろ過し、ろ過ケーキを300mLの水で洗浄した。この固体を真空下で乾燥して、77gの(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロン酸をオフホワイト色の固体として得た((R)-tert-ブチル3-(メチルスルホニルオキシ)ピロリジン-1-カルボキシレートに対して54%収率)。1H NMR (DMSO-d6, 400 MHz): δ 3.47 (m, 1H); 3.32 (m, 1H); 3.24 (m, 1H); 3.16 (m, 1H); 3.92 (m, 1H); 2.86 (m, 1H); 1.95 (m, 1H); 1.59 (m, 1H); 1.39 (s, 9H)。
【0063】
トルエン(150mL)及びジメチルスルホキシド(2mL)中の(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロン酸(15g、55mmol)の懸濁液を2時間加熱還流した。混合物を周囲に達するようにし、MTBE(150mL)で希釈した。有機溶液を10%クエン酸水溶液(2×200mL)で洗浄し、溶媒を真空下で除去して、オフホワイト色の固体として11.6gの(R)-2-(1-(tert-ブトキシカルボニル)-ピロリジン-3-イル)酢酸を得た(収率92%)。1H NMR (DMSO-d6, 400 MHz): δ 12.1 (s, 1H); 3.36-3.48 (m, 1H); 3.20-3.34 (m, 1H); 3.05-3.19 (m, 1H; 2.72-2.84 (m, 1H); 2.30-2.42 (m, 1H), 2.22-2.30 (m, 2H); 1.85-2.00 (m, 1H); 1.38-1.54 (m, , 1H), 1.35 (2, 9H)。
【0064】
tert-ブチル(R)-3-(2-ヒドロキシエチル)ピロリジン-1-カルボキシレート(6)の合成
手順A:テトラヒドロフラン(THF)(200mL)中の(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)酢酸(49.0g、214mmol)の溶液を-10℃に冷却した。温度を0℃未満に維持しながら、THF溶液中の250mL(250mmol)の1Mボランをフラスコにゆっくり添加した。溶液を周囲温度に温め、1時間撹拌した。1時間毎に溶液をサンプリングし、HPLCにより分析して、反応の完了を確認した。反応の完了直後、この溶液を0℃に冷却し、10%水酸化ナトリウム水溶液(80mL)を30分かけて滴下して、気体発生を調節した。この溶液を500mLの1:1のヘキサン/酢酸エチル溶液で抽出した。有機層を飽和塩化ナトリウム溶液で洗浄し、10gのシリカゲルで乾燥した。シリカゲルをろ過によって除去し、100mLの1:1のヘキサン/酢酸エチルで洗浄した。有機層を合わせ、真空下で濃縮して、明るいオレンジ色の油として6(42g、9.13%)を得て、この油を放置により固化させた。1H NMR (CDCl3, 400 MHz) δ 3.67 (m, 2H), 3.38-3.62 (m, 2H), 3.25 (m, 1H), 2.90 (m, 1H), 2.25 (m, 1H), 1.98-2.05 (m, 1H), 1.61-1.69 (m, 2H), 1.48-1.59 (m, 2H), 1.46 (s, 9H)。
【0065】
手順B:窒素ガス下で保持し、水浴を使用して温度を23から28℃の間に保持しながら、ボラン-THF複合体(THF中の1Mの3.90kg又はL、mol)をTHF(2.5kg)中(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)酢酸(683g、3.03mol)の撹拌溶液にゆっくり添加した。添加には1.75時間を要した。25℃での撹拌を1時間継続し、その時点以降、GC分析は完全な反応を示した。反応混合物を10℃未満に冷却し、10%水酸化ナトリウム(1.22kg)水溶液をゆっくり添加しながら、25℃未満に維持した。添加には40分を要した。混合物を1時間25℃にて撹拌し、次に1:1(v/v)のヘプタン/酢酸エチル(7L)と合わせた。混合物を15分間撹拌し、放置して相に分離させた(1時間)。有機相を取り除き、水相を1:1のヘプタン/酢酸エチルの第2の7L部分と合わせた。これを15分間撹拌し、放置して相に分離させた(20分間)。再び有機相を取り除き、合わせた有機相を飽和塩化ナトリウム(4.16kg)水溶液で洗浄し、15分の混合時間及び1時間の沈降時間を用いた。有機相をシリカゲル(140g)と合わせ、1時間撹拌した。無水硫酸ナトリウム(700g)を添加し、混合物を1.5時間撹拌した。混合物をろ過し、ろ過ケーキを1:1のヘプタン/酢酸エチル(2L)で洗浄した。ろ液を真空下で40℃未満にて6時間濃縮した。得られた油の重量は670g(収率103%)であった。この油は微量のヘプタンを含むが、他には、NMR分析によって、先に調製された試料の6と同一である。
【0066】
tert-ブチル(R)-3-(2-(メチルスルホニルオキシ)エチル)ピロリジン-1-カルボキシレート(7)の合成
手順A:トルエン(380mL)中のトリエチルアミン(40mL)をtert-ブチル(R)-3-(2-ヒドロキシメチル)ピロリジン-1-カルボキシレート(41.0g、190mmol))の溶液に添加し、-10℃に冷却した。温度を約-5から0℃に維持するように、塩化メタンスルホニル(20.0mL、256mmol)をゆっくり添加した。この溶液を周囲温度に温め、1時間撹拌した。溶液を1時間毎にサンプリングし、HPLCによって分析して、反応の完了を確認した。反応の完了直後、溶液をろ過し、ろ液を5%重炭酸ナトリウム水溶液(250ml)で洗浄した。有機層を回収し、飽和塩化ナトリウム水溶液(250mL)で洗浄した。有機層を回収し、シリカゲル(10g)上で乾燥させ、真空下で濃縮して、淡黄色の粘性油として7を得た(53.0g、92.8%)。1H NMR (CDCl3, 400 MHz) δ 4.26 (t, J = 6.8 Hz, 2H), 3.41-3.63 (m, 2H),3.27 (m, 1H), 3.02 (s, 3H), 2.92 (m, 1H), 2.28 (m, 1H), 2.05 (m, 1H), 1.83 (m, 2H), 1.50-1.63 (m, 1H), 1.46 (s, 9H)。
【0067】
手順B:窒素雰囲気下で、トルエン(5.20kg)中のトリエチルアミン(460g、4.55mol)及びtert-ブチル(R)-3-(2-ヒドロキシメチル)ピロリジン-1-カルボキシレート(実施例7の手順Bから得た全試料、3.03mol)の溶液を撹拌し、5℃に冷却した。氷浴冷却を用いて温度を15℃未満に保持しながら、塩化メタンスルホニル(470g、4.10mol)を1.25時間かけてゆっくり添加した。混合物を穏やかに(1.5時間かけて)35℃に温め、この温度を1.25時間維持し、その時点で、GC分析により、反応が完了していることが示された。混合物を25℃に冷却し、固体をろ過して取り出し、ろ過ケーキをトルエン(1.28kg)で洗浄した。ろ液を10%の重炭酸ナトリウム水溶液(4.0kg)と共に15分間撹拌し、この相を30分間放置して分離させた。次に、有機相を飽和塩化ナトリウム(3.9kg)水溶液と共に30分間撹拌し、この相を20分間放置して分離させた。有機相をシリカゲル(160g)と合わせ、1時間撹拌した。無水硫酸ナトリウム(540g)を添加し、混合物をさらに40分間撹拌した。次に、混合物をろ過し、ろ過ケーキをトルエン(460g)で洗浄した。ろ液を真空下で50℃にて5時間濃縮し、得られた油を真空下で23℃にてさらに8時間保持した。これにより789gの7を得て、GC分析により93%純度であった。
【0068】
tert-ブチル(R)-3-ビニルピロリジン-1-カルボキシレート(9)の合成
手順A:tert-ブチル(R)-3-((メチルスルホニルオキシ)エチル)ピロリジン-1-カルボキシレート(49.0g、167mmol)、ヨウ化ナトリウム(30.0g、200mmol)及び1,2-ジメトキシエタン(450ml)の溶液を50〜60℃にて4時間撹拌した。この溶液を1時間毎にサンプリングし、HPLCにより分析して、反応の完了を確認した。反応の完了直後、溶液を-10℃に冷却し、温度を0℃未満に維持しながら、固体のカルシウムtert-ブトキシド(32.0g、288mmol)を添加した。反応混合物を周囲温度に温め、1時間撹拌した。混合物を1時間毎にサンプリングし、HPLCにより分析して、反応の完了を確認した。反応の完了直後、珪藻土(25gの乾燥ベース)のパッドを介して混合物をろ過した。このケーキを1,2-ジメトキシエタン(100mL)で洗浄した。合わせたろ液を真空下で濃縮して、懸濁した固体を含むオレンジ色の油を得た。この油をヘキサン(400mL)に溶解し、30分間撹拌し、ろ過して、固体を除去した。有機層をシリカゲル(10g)上で乾燥させ、真空下で濃縮して、無色の油として9(26.4g、82.9%)を得た。1H NMR (CDCl3, 400 MHz) δ 5.77 (m, 1H), 5.10 (dd, J = 1.2 Hz, J = 16 Hz, 1H), 5.03 (dd, J = 1.2 Hz, J = 8.8 Hz, 1H), 3.41-3.59 (m, 2H), 3.29 (m, 1H), 3.05 (m, 1H), 2.78 (m, 1H), 2.01 (m, 1H), 1.62-1.73 (m, 1H), 1.46 (m, 9H)。
【0069】
手順B:tert-ブチル(R)-3-(2-(メチルスルホニルオキシ)エチル)ピロリジン-1-カルボキシレート(実施例7、手順Bの生成物の792g、約2.5mol)、ヨウ化ナトリウム(484g、3.27mol)及び1,2-ジメトキシエタン(7.2L)の溶液を55℃にて4.5時間、窒素下で撹拌し、その時点でのGC分析により、反応が完了したことが示された。この溶液を10℃未満に冷却し、温度を15℃未満に維持しながら、固体のカリウムtert-ブトキシド(484g、4.32mol)を分けて添加した(1.25時間の添加時間)。反応混合物を1時間5℃にて撹拌し、20℃にゆっくり(6時間)温め、20℃にて1時間撹拌した。溶液を珪藻土(400gの乾燥ベース)のパッドを介して混合物をろ過した。ろ過ケーキを1,2-ジメトキシエタン(1.6kg)で洗浄した。合わせたろ液を真空下で濃縮し、半固体の残渣をヘプタン(6.0L)と共に2時間撹拌した。固体をろ過によって除去し(ろ過ケーキを440mLのヘプタンで洗浄した)、ろ液を真空下で20℃にて濃縮して、455gの9(純度90.7%)を得た。この材料(350g)の試料を20〜23トールで分画して蒸留して、296gの精製された9(沸点130〜133℃)(GC分析により純度99%未満)を得た。
【0070】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン(11)の合成
N,N-ジメチルアセトアミド(250mL)中の(R)-tert-ブチル3-ビニルピロリジン-1-カルボキシレート(25g、127mmol)、5-ブロモピリミジン(30.3g、190mmol)、1,1'-ビス(ジフェニルホスフィノ)フェロセン(2.11g、3.8mmol)、及び酢酸ナトリウム(18.8gr、229mmol)の溶液に1時間、窒素を泡立てて通過させ、酢酸パラジウム(850mg、3.8mmol)を添加した。反応混合物を40℃/時の速度で150℃に加熱し、16時間撹拌した。混合物を10℃に冷却し、内部温度を20℃未満に維持しながら、水(750mL)でクエンチさせた。MTBE(300mL)を添加し、次に珪藻土(40g、乾燥ベース)を添加した。懸濁液を1時間、周囲温度にて撹拌し、珪藻土の床を介してろ過した。残渣をMTBE(2×100mL)で洗浄し、オーバーヘッドスターラーを備え、活性炭(40g)で充たされた2Lの容器にろ液を移した。懸濁液を2時間、周囲温度にて撹拌し、珪藻土を介してろ過した。残渣をMTBE(2×100mL)で洗浄し、ろ液を真空中で濃縮して、28.6gのオレンジ色の油を得た。この油をMTBE(100mL)に溶解し、Si-Thiol(登録商標)(2.0g、1.46mmolのチロール/g、Silicycle Inc.)を添加した。懸濁液を窒素下で周囲温度にて3時間撹拌し、微細フィルターを介してろ過し、ガラス容器内で保持した。
【0071】
6MのHCl(70mL)の溶液に、内部温度を20℃から23℃の間に維持しながら、30分間かけてろ液を添加した。混合物を1時間激しく撹拌し、有機層を除去した。残りの水層を45wt%のKOH(50mL)で塩基性にし、得られた懸濁液を一回、クロロホルム(300mL)で抽出した。真空中で溶媒を蒸発させて(浴温45℃)、赤色の油として、16.0g(71.8%)の(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン遊離塩基を得た。これは即座にイソプロパノール(50mL)に溶解し、塩形成のために使用する。
【0072】
塩
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン遊離塩基(10mg、0.057mmol)を酢酸イソプロピル又はアセトニトリルのいずれかに溶解した。溶液を0.5(ヘミ)から1.1(モノ)当量の対応する酸で処理し、50℃に温め、一晩、周囲温度にゆっくり冷却した。次に、溶媒を加熱せずに真空下で蒸発させた。
【実施例2】
【0073】
インビボ法:L-ドーパ誘発性ジスキネジア
サブタイプ選択的NNRアゴニスト化合物Aはα4β2* NNRを刺激し、より少ない程度でα6* NNRを刺激する。毒性学的試験は、げっ歯類、イヌ、及び霊長類において、低い発症率で末梢副作用があり、合理的な治療指数は主としてα4β2*ニコチン性受容体及びα6*ニコチン性受容体でのその相互作用と一致することを示す。ラットでの安全性試験において、これらの例のPD1としてコードされている化合物Aは、最大30mg/kgの遊離塩基の急性経口投薬量を用いたとき、いずれの有意な有害作用とも関連しなかった。行動感作はなく、化合物A(PD1)は、ラットにおいて自発運動を増大させず、乱用の傾向が低いことを示唆した。実験は、先に記載されたように(Cenciら, 1998; Cenci, 2002)、6-OHDA(Sigma Chemical Co.、ミズーリ州セントルイス)で片側に傷害を受けた雄性スプラーグドーリー(Sprague-Dawley)ラットを用いて行われた。3μg/μl濃度で0.02%アスコルビン酸/生理食塩水に6-OHDAを溶解した。化合物Aを浸透圧ミニポンプ(Alzetモデル2006; Durect Corporation、カリフォルニア州クパチーノ、米国)を介して全身に点滴し、薬物を3.6μl/日の速度で6週間送達した。この経路を介して連続的に与えられた場合、ニコチンがラットにおいてL-ドーパ誘発性AIMを最も効果的に低減させたのでこの経路が選択された(Bordia, T., Campos, C, Huang, L.Z. & Quik, M.,「Continuous And Intermittent Nicotine Treatment Reduces L-3,4-Dihydroxyphenylalanine (L-Dopa)-lnduced Dyskinesias In A Rat Model Of Parkinson's Disease」, J Pharmacol Exp Ther 327: 239〜47 (2008))。所要の投薬量(0.03、0.1、0.3mg/kg/日)を与えるために、ポンプを滅菌水、又は水(pH7.0)中の化合物A塩基のいずれかで予め満たした。イソフルオラン麻酔下で、製造業者の使用説明書に従って、肩甲骨間の首の背側面に沿ってミニポンプを皮下に移植した。移植後、術後疼痛のためにラットにブプレノルフィン(0.02mg/kg sc)を投与した。薬物治療を開始して二週間後、ラットは、6〜8mg/kgのL-ドーパメチルエステル+15mg/kgのベンセラジドを一日一回皮下注射された。2μlの分注液を右上行ドーパミン繊維束に全8から12μgについて二部位の各々に定位的に注射した。標的領域への6-OHDAの点滴は2分間にわたり、カニューレを注射部位でさらに2分間維持した。傷害の二から三週間後、ラットは、自動化された行動測定装置(ROTOMAX、AccuScan Instruments Inc.、オハイオ州コロンバス、米国)において、薬物誘発性の回旋行動について試験した。各ラットは、順応させるために、円筒状のガラスチャンバーに30分間置き、その後、4.0mg/kgのアンフェタミン(Sigma Chemical Co.、ミズーリ州セントルイス)を腹腔内(ip)投与した。アンフェタミン誘発の回旋行動を90分間監視し、90分間あたり少なくとも二百回の同側回旋を行うラットをさらなる試験に使用した。
【0074】
L-ドーパ誘発性AIMを図示されているように決定した。実験的投薬及び試験治療計画について図1を参照されたい。行動試験は、午前9時から10時の間に開始し、午前中に行った。(1)軸性ジストニア、首及び上半身の対側の捻じれ曲がった姿勢;(2)異常口舌運動、定型的顎運動及び対側性挺舌;並びに(3)異常前肢運動、反復性周期性運動又は対側前肢のジストニア姿勢及び/若しくは対側手足の掴み(grabbing)運動、を含む三つの異なるAIMサブタイプを測定した。例えば、Carta M, Lindgren HS, Lundblad M, Stancampiano R, Fadda F, Cenci MA (2006), Role of Striatal L-DOPA in the Production of Dyskinesia in 6-hydroxydopamine Lesioned Rats. J Neurochem 96:1718〜172; Cenci MA, Lee CS, Bjorklund A (1998) L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA; Eur J Neurosci 10:2694〜2706; Cenci MA, Whishaw IQ, Schallert T (2002) Animal models of neurological deficits: how relevant is the rat? Nat Rev Neurosci 3:574〜579; Bordia, T., Campos, C, Huang, L.Z. & Quik, M.,「Continuous And Intermittent Nicotine Treatment Reduces L-3,4-Dihydroxyphenylalanine (L-Dopa)-lnduced Dyskinesias In A Rat Model Of Parkinson's Disease」, J Pharmacol Exp Ther 327: 239〜47 (2008))を参照されたい。これらの三つのAIMサブタイプの各々について、以下のように0から4の等級でラットのスコアを記録した: 1=時折、2=頻繁、3=連続的であるが、感覚注意散漫によって中断された;及び4=連続的であり、重篤であり、感覚注意散漫によって中断されない。初期の20分の基準期間、及びL-ドーパ注射後の3時間、AIMについて動物を予備知識のない評価者によって評価した。AIMの異なるサブタイプの評価は、20分のセッション全体で行われ、このようにして動物あたり全九回のセッションの試験を行った。したがって、各動物について最大可能スコアは108であった(セッション一回あたりの最大スコア=12; 3時間全体でのセッション回数=9)。
【0075】
全ての統計学的分析は、GraphPad Prism(登録商標)(GraphPad Software,Inc、カリフォルニア州サンディエゴ)を用いて行われた。値は、示された数のラットの平均±SEMであり、一つから二つの別々の試験期間のデータを表す。グループ間の評価スコアにおける差異は、ノンパラメトリック検定(マン-ホイットニー(Mann-Whitney)検定)を用いて分析された。経時的試験については、反復測定分散分析(analysis of variance: ANOVA)、続いてボンフェローニ(Bonferroni)多重比較試験を用いた。0.05のレベルは有意であると考えられた。
【0076】
興味深いことに、0.1及び0.3mg/kg/日の投薬量の化合物A(PD1)は、多重評価の全体で、L-ドーパ誘発性AIMの全体又はいくつかのサブセット(軸、口及び/又は前肢)における有意な低減をもたらした(図2参照)。これは、第2及び第3の評価(0.1mg/kg/日)中、並びに第4の評価(0.3mg/kg/日)中の全AIMにおいて有意な減少を含み、第1及び第5のAIM評価中の全AIMにおいて減少する傾向にあった。重要なことには、化合物A(PD1)は、(すなわち、体重、体温、毛繕い、排尿、排便、分泌に対して)検出可能な有害影響をもたらさなかった。
【実施例3】
【0077】
運動機能
AIMを低減する薬物はパーキンソニズムを悪化させる可能性があるため、化合物A(PD1)の効果もまた、肢使用の非対照試験又は円筒試験を用いて、パーキンソン病ラットにおける運動機能について試験された(図3参照)。円筒試験は、片側黒質線条体損傷後の行動機能の指標として用い、先に記載したように探索的行動を分析した。動物を透明な円筒(20cm直径×30cm高さ)又は透明なケージに入れ、五分間評価した。円筒/ケージの後ろに鏡を置いて、評価者が、ラットが評価者から目を背けたときに前肢の運動を見ることができるようにした。壁探索(wall exploration)は、肢使用運動の総数と比較した障害のある前肢(傷害とは対側)の使用のパーセンテージに関して表した。二人の評価者が評価を行い、一人はラットの治療状況について予備知識がなかった。相関分析により、高い評価者間信頼性を得られた(R=0.99)。また、この試験は、異常を検出するためのドーパミン作動薬(すなわち、アンフェタミン)の使用を必要としないという利点を提供する。ラットを透明な円筒に入れ、それは、垂直探索、並びに評価された円筒に対する損傷を受けていない及び損傷を受けた前肢の接触のパーセンテージをもたらす(Cenci, M.A.及びM. Lundblad,「Post- Versus Presynaptic Plasticity In L-Dopa-lnduced Dyskinesia」,. J Neurochem, 99: 381〜392 (2006); Tillerson, J.L.ら,「Forced Limb-Use Effects On The Behavioral And Neurochemical Effects Of 6-Hydroxydopamine」, J Neurosci 21, 4427〜35 (2001);及びMeredith, G.E. & U.J. Kang,「Behavioral Models Of Parkinson's Disease In Rodents: A New Look At An Old Problem」, Mov Disord, 21: 1595〜606 (2006)。
【0078】
これらの結果は、化合物A(PD1)が、基準の運動機能を悪化させることもなく(オフL-ドーパ)、実験経過の全体で試験されたいずれかの投薬量でのL-ドーパ治療による肢使用の増大を悪化させることもないことを示す。実際に、改善の僅かな傾向が見られた。全体として、化合物A(PD1)は、パーキンソニズムを悪化させることなく、L-ドーパ誘発性AIMを低減させる有望な候補となる可能性がある(図3参照)。
【0079】
他に言及がなければ、化合物A、PD1、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジンは、そのヘミガラクタル酸塩として投薬したが、しかしながら、投薬量は遊離塩基当量として計算された。
【0080】
観察された特定の薬理学的応答は、選択された特定の活性化合物、又は医薬としての担体が存在するかどうか、並びに製剤の種類及び採用される投与様式に従って及びそれに依存して変化する場合があり、これらの結果におけるこのように期待される変化又は差異は本発明の実施に従って考慮される。
【0081】
本発明の具体的な実施形態を本明細書に詳細に説明し、記載したが、本発明はこれに限定されるものでない。上記の詳細な説明は本発明の例示として与えられたものであって、本発明になんらかの限定を課するものとみなすべきではない。改変形態は当業者には明らかであり、本発明の精神から逸脱しない全ての改変形態は添付した特許請求の範囲内に含まれると意図している。
【背景技術】
【0001】
ジスキネジア、又は異常不随意運動(abnormal involuntary movement: AIM)は、L-ドーパを長期間使用しているパーキンソン病(Parkinson's disease: PD)患者の大部分において発症し、PDそのものと同程度に弱らせるものであり得る。最近、Quikらは、ニコチンが、パーキンソン病のヒト以外の霊長類及びげっ歯類の双方においてL-ドーパ誘発性ジスキネジア様運動を約50%低減させることを示した。L-ドーパ誘発性AIMに利用できる治療は、現在、非常に限定されている。したがって、ニコチン療法がこれらの運動を低減するという観察は、新規な治療オプションを与えることができ、これは、特に、ニコチンがL-ドーパの抗パーキンソン病作用を損なわないためである。
【0002】
一般に、ニコチンは、神経性ニコチン受容体(neuronal nicotinic receptors: NNR)を刺激することによってその効果を発揮する。しかしながら、ニコチンは、中枢神経系及び末梢神経系、並びに骨格筋において複数のNNRを標的とする。これは、任意の所望の応答に加えて、副作用をもたらす。したがって、L-ドーパ誘発性ジスキネジアを低減させるNNRサブタイプ選択的薬物を同定することが有利となる。
【0003】
下記の引用文献を参照する: Carta, M., Carlsson, T., Munoz, A., Kirik, D. & Bjorklund, A.,「Serotonin-Dopamine Interaction In The Induction And Maintenance Of L-Dopa-lnduced Dyskinesias」, Prog Brain Res, 172: 465〜78 (2008); Cenci, M.A. & Lundblad, M.,「Ratings Of L-Dopa-lnduced Dyskinesia In The Unilateral 6-OHDA Lesion Model Of Parkinson's Disease In Rats And Mice」, Curr Protoc Neurosci, Chapter 9, Unit 9: 25 (2007); Cox, H.ら,「The Selective Kappa-Opioid Receptor Agonist U50,488 Reduces L-Dopa-lnduced Dyskinesias But Worsens Parkinsonism In MPTP-Treated Primates」, Exp Neurol, (2007);. Dani, J.A. & Bertrand, D.,「Nicotinic Acetylcholine Receptors And Nicotinic Cholinergic Mechanisms Of The Central Nervous System」, Annu Rev Pharmacol Toxicol, 47: 699〜729 (2007); Dekundy, A., Lundblad, M., Danysz, W. & Cenci, M.A,「Modulation Of L-Dopa-lnduced Abnormal Involuntary Movements By Clinically Tested Compounds: Further Validation Of The Rat Dyskinesia Model」, Behav Brain Res, 179: 76〜89 (2007); Exley, R. & Cragg, S.J.,「Presynaptic Nicotinic Receptors: A Dynamic And Diverse Cholinergic Filter Of Striatal Dopamine Neurotransmission」, Br J Pharmacol, 153 Suppl 1: S283〜97 (2008); Fox, S.H., Lang, A.E. & Brotchie, J.M.,「Translation Of Nondopaminergic Treatments For Levodopa- Induced Dyskinesia From MPTP-Lesioned Nonhuman Primates To Phase IIA Clinical Studies: Keys To Success And Roads To Failure」, Mov Disord, 21, 1578〜94 (2006); Gotti, C.ら,「Heterogeneity And Complexity Of Native Brain Nicotinic Receptors」, Biochem Pharmacol, 74: 1102〜11 (2007); Grady, S.R.ら,「The Subtypes Of Nicotinic Acetylcholine Receptors On Dopaminergic Terminals Of Mouse Striatum」, Biochem Pharmacol, 74: 1235〜46 (2007); Guigoni, C.ら,「Pathogenesis Of Levodopa-lnduced Dyskinesia: Focus On D1 And D3 Dopamine Receptors」, Parkinsonism Relat Disord, 11 Suppl 1: S25〜9 (2005); Guigoni, C.ら,「Involvement Of Sensorimotor, Limbic, and Associative Basal Ganglia Domains In L-3,4-Dihydroxyphenylalanine-lnduced Dyskinesia」, J Neurosci, 25: 2102〜7 (2005); Hsu, A.ら,「Effect Of The D3 Dopamine Receptor Partial Agonist BP-897 [N-[4-(4-(2-Methoxyphenyl)Piperazinyl)Butyl]-2-Naphthamide] On L-3,4-Dihydroxyphenylalanine-lnduced Dyskinesias And Parkinsonism In Squirrel Monkeys」, J Pharmacol Exp Ther, 311: 770〜7 (2004); Linazasoro, G.,「New Ideas On The Origin Of L-Dopa-lnduced Dyskinesias: Age, Genes And Neural Plasticity」, Trends Pharmacol Sci, 26: 391〜7 (2005); Linazasoro, G., Van Blercom, N., Ugedo, L. & Ruiz Ortega, J.A.,「Pharmacological Treatment Of Parkinson's Disease: Life Beyond Dopamine D2/D3 Receptors?」J Neural Transm, 115: 431〜41 (2008); Mercuri, N.B. & Bemardi, G.,「The 'Magic' Of L-Dopa: Why Is It The Gold Standard Parkinson's Disease Therapy?」Trends Pharmacol Sci, 26: 341〜4 (2005); Quik, M., Police, S., He, L., Di Monte, D.A. & Langston, J.W.,「Expression Of D(3) Receptor Messenger RNA And Binding Sites In Monkey Striatum And Substantia Nigra After Nigrostriatal Degeneration: Effect Of Levodopa Treatment」, Neuroscience, 98: 263〜73 (2000); Quik, M., Police, S., Langston, J.W. & Di Monte, D.A.,「Increases In Striatal Preproenkephalin Gene Expression Are Associated With Nigrostriatal Damage But Not L-Dopa-lnduced Dyskinesias In The Squirrel Monkey」, Neuroscience, 113: 213〜20 (2002); Quik, M., Polonskaya, Y., Mcintosh, J.M. & Kulak, J.M.,「Differential Nicotinic Receptor Expression In Monkey Basal Ganglia: Effects Of Nigrostriatal Damage」, Neuroscience, 112: 619〜30 (2002); Quik, M.ら,「L-Dopa Treatment Modulates Nicotinic Receptors In Monkey Striatum」, Mol Pharmacol, 64: 619〜28 (2003); Quik, M.ら,「Chronic Oral Nicotine Treatment Protects Against Striatal Degeneration In MPTP-Treated Primates」, J Neurochem, 98: 1866〜75 (2006); Quik, M., O'leary, K. & Tanner, C.M.,「Nicotine and Parkinson's Disease: Implications For Therapy」, Mov Disord, 23: 1641〜52 (2008), Samadi, P., Bedard, P.J. & Rouillard, C,「Opioids And Motor Complications In Parkinson's Disease」, Trends Pharmacol Sci, 27: 512〜7 (2006); Togasaki, D.M.ら,「Levodopa Induces Dyskinesias In Normal Squirrel Monkeys」,. Ann Neurol, 50: 254〜7. (2001).
【発明の概要】
【0004】
本発明の一態様は、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療する方法を含む。別の態様は、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させる方法を含む。別の態様は、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させる方法を含む。別の態様は、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、パーキンソニズムを改善する方法を含む。別の態様は、L-ドーパ及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を用いて、L-ドーパに応答性の疾患を治療する方法を含む。一実施形態では、L-ドーパに応答性の疾患はパーキンソン病である。別の態様は、α4β2* NNR及びα6β2* NNRの双方を標的とする化合物を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させる方法を含む。
【0005】
同様に、本発明の一態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療するための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用を含む。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させるための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用を含む。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させるための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用を含む。別の態様は、パーキンソニズムを改善するための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用を含む。別の態様は、L-ドーパに応答性の疾患を治療するための薬剤の製造におけるL-ドーパ及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の各々の使用を含む。一実施形態では、L-ドーパに応答性の疾患はパーキンソン病である。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させるための薬剤の製造におけるα4β2* NNR及びα6β2* NNRの双方を標的とする化合物の使用を含む。
【0006】
同様に、本発明の一態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療するための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させるための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させるための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む。別の態様は、パーキンソニズムを改善するための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む。別の態様は、L-ドーパに応答性の疾患を治療するための、L-ドーパを併用する、化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む。一実施形態では、L-ドーパに応答性の疾患はパーキンソン病である。別の態様は、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させるための、α4β2* NNR及びα6β2* NNRの双方を標的とする化合物を含む。
【0007】
本発明の別の態様は、L-ドーパ; (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩;及びL-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその発症若しくは進行を遅延させるための治療計画に関する一つ又は複数の使用説明書を含むキットを含む。一実施形態では、このようなキットはまた、ブリスター包装などのパッケージを含んでもよい。或いは、このようなキットは、L-ドーパ及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の各々の個々の処方及び投薬を提供することができるが、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその発症若しくは進行を遅延させるための治療計画に関する使用説明書と組み合わせた場合、このようなものは本発明の範囲内にあることが意図される。
【0008】
別の態様は、L-ドーパ; (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩;及び一つ又は複数の医薬上許容される担体を含む医薬組成物を含む。一実施形態では、医薬組成物は単位投薬形態であってもよい。
【0009】
別の態様は、L-ドーパ;及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む組合せを含む。一実施形態では、組合せは、各有効成分を含む別々の投薬形態であって、一緒に又は別々に、逐次的に又は同時に、さらに互いに時間的に接近して又は時間的に離れて投与される投薬形態として存在してもよい。
【0010】
別の態様は、L-ドーパ;及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を含む治療計画を含み、ここで、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩は、L-ドーパと同時に投与される。
【0011】
本発明は、本明細書全体に記載されているように、態様及び実施形態の組合せ、並びに好ましい例を含む。
【0012】
図面は、本発明の特定の実施形態に従って得られた結果を示し、本発明の態様を例示するが、限定するものとして考えるべきではない。
【図面の簡単な説明】
【0013】
【図1】ラットにおけるL-ドーパ誘発性ジスキネジア試験のための治療スケジュールのレンダリングである。図1は、時間、化合物A(アゴニスト#PD1とも呼ばれる)治療、L-ドーパ投薬、及び行動試験を示す。
【図2】化合物A(再び、PD1とも呼ばれる)の二つの別々の投薬量がパーキンソン病ラットにおいていくつかの評価の経過全体でL-ドーパ誘発性AIMを低減することを示す図解である。各値は、十匹のラットの平均+SEMである。対照からの有意差; P < 0.05。
【図3】化合物A(再び、PD1とも呼ばれる)の二つの別々の投薬量が、試験の経過中のいくつかの事象に対する非対称前肢又は円筒試験を用いて評価されたオフL-ドーパ(非存在)又はオンL-ドーパ(存在)でのパーキンソニズムを悪化させないことを示す図解である。各値は、九匹〜十匹のラットの平均+SEMである。
【発明を実施するための形態】
【0014】
パーキンソン病を含むが、それに限定されないで、運動障害のためのL-ドーパ治療の長期使用によるジスキネジアの発症に関するよく認識された問題点がある。ジスキネジアは、L-ドーパ治療の一般に知られ、よく認識された臨床の副作用である。例えば、Brotchie, J.M., Lee, J. & Venderova, K.,「Levodopa- Induced Dyskinesia in Parkinson's Disease」, J Neural Transm, 112: 359〜91 (2005); Fabbrini, G., Brotchie, J.M., Grandas, F., Nomoto, M. & Goetz, C.G,.「Levodopa-lnduced Dyskinesias」, Mov Disord (2007); Olanow, C.W., Obeso, J.A. & Stocchi, F.,「Continuous Dopamine-Receptor Treatment of Parkinson's Disease: Scientific Rationale and Clinical Implications」, Lancet Neurol, 5: 677〜87 (2006); Stacy, M. & Galbreath, A.,「Optimizing Long-Term Therapy For Parkinson Disease: Options For Treatment-Associated Dyskinesia」,. Clin Neuropharmacol, 31 : 120〜5 (2008); Stacy, M. & Galbreath, A.,「Optimizing Long-Term Therapy For Parkinson Disease: Levodopa, Dopamine Agonists, And Treatment-Associated Dyskinesia」, Clin Neuropharmacol, 31: 51〜6 (2008);及びThanvi, B., Lo, N. & Robinson, T.,「Levodopa-lnduced Dyskinesia In Parkinson's Disease: Clinical Features, Pathogenesis, Prevention And Treatment」, Postgrad Med J, 83: 384〜8 (2007)を参照されたい。
【0015】
2007年に、公開された研究は、パーキンソン病の動物モデルにおいてL-ドーパ誘発性ジスキネジアの緩和に使用するための原型的なニコチン性アセチルコリンアゴニストニコチンの具体的な関連性を実証した。Bordia, T., Campos, C, Huang, L.Z. & Quik, M.,「Continuous And Intermittent Nicotine Treatment Reduces L-3,4-Dihydroxyphenylalanine (L-DOPA)-lnduced Dyskinesias In A Rat Model Of Parkinson's Disease」, J Pharmacol Exp Ther, 327: 239〜47 (2008); Quik, M.ら,「Nicotine Reduces Levodopa-lnduced Dyskinesias in Lesioned Monkeys」, Annals of Neurology, G2; 588〜96 (2007);及びQuik, M., Bordia, T. & O'leary, K.,「Nicotinic Receptors As CNS Targets For Parkinson's Disease」,. Biochem Pharmacol, 74: 1224〜1234 (2007)を参照されたい。
【0016】
データは非常に説得力があったが、いくつかの望ましくない副作用は、ヒトにおけるニコチンの使用及び投与と相関し、具体的には、末梢、すなわち筋肉及び神経節におけるその効果と関連する。したがって、より選択的な神経性ニコチン受容体相互作用を有する代替化合物が、患者コンプライアンス及び治療指数に関して利点を提供するものと考えられる。
【0017】
末梢神経系ではなく、線条体における主要なNNRは、α4β2* NNR、α6β2* NNR及びα7 NNRであり、この場合、アスタリスクは受容体複合体における他のNNRサブユニットの存在の可能性を示す。したがって、これらのNNRサブタイプ指向性の薬物は、ニコチンを上回るL-ドーパ誘発性ジスキネジアの緩和に対する改善された代替物を提供するべきである。
【0018】
以下の定義は、定義される用語を詳細に説明することを意味し、限定されるものではない。本明細書において使用される特定の用語が具体的に定義されていない場合、このような用語は不明確なものであると考えるべきではない。むしろ、これらの用語は通義の範囲において使用される。
【0019】
本明細書で使用するとき、「アゴニスト」は、その結合パートナー、典型的には受容体を刺激する物質である。刺激は、特定のアッセイとの関連で定義されるか、又は当業者に理解されるように、実質的に類似した状況下で特定の結合パートナーの「アゴニスト」若しくは「アンタゴニスト」として認められた因子又は物質との比較を行っている本明細書中の考察から文献において明らかな場合がある。刺激は、アゴニスト又は部分アゴニストと結合パートナーとの相互作用によって誘導され、且つアロステリック効果を含み得る特定の効果又は機能の増大に関して定義することができる。
【0020】
本明細書で使用するとき、「アンタゴニスト」は、その結合パートナー、典型的には受容体を阻害する物質である。阻害は、特定のアッセイとの関連で定義されるか、又は当業者に理解されるように、実質的に類似した状況下で特定の結合パートナーの「アゴニスト」若しくは「アンタゴニスト」として認められた因子又は物質との比較を行っている本明細書中の考察から文献において明らかな場合がある。阻害は、アンタゴニストと結合パートナーとの相互作用によって誘導され、且つアロステリック効果を含み得る特定の効果若しくは機能の低下に関して定義することができる。
【0021】
本明細書で使用するとき、「部分アゴニスト」又は「部分アンタゴニスト」は、それぞれ、その結合パートナーに対して、各々十分又は完全にはアゴニスト又はアンタゴニストではないレベルの刺激又は阻害を提供する物質である。刺激、故に阻害は、アゴニスト、アンタゴニスト、又は部分アゴニストとして定義されるあらゆる物質又は物質カテゴリーに関して本質的に定義されることが理解されよう。
【0022】
本明細書で使用するとき、「固有の活性」又は「効力」は、結合パートナー複合体の生物学的有効性のある尺度に関係する。受容体の薬理学に関して、固有の活性又は効力を定義すべき状況は、結合パートナー(例えば、受容体/リガンド)複合体の状況、及び特定の生物学的成果に関連する活性を考慮することによって決まる。例えば、ある状況においては、固有の活性は、関与する特定の第2のメッセンジャー系によって変動する可能性がある。このような教示に関して、参照により本明細書に援用されるHoyer, D.及びBoddeke, H., Trends Pharmacol. Sci. 14(7): 270〜5 (1993)を参照されたい。このような前後関係的な特定の評価がどのような場合に関連し、またそれらが本発明の状況とどのように関連し得るかは、当業者には明らであろう。
【0023】
本明細書で使用するとき、受容体のモジュレーションには、受容体のアゴニズム、部分的アゴニズム、アンタゴニズム、部分的アンタゴニズム、又は逆アゴニズムが含まれる。
【0024】
本明細書全体を通じて使用するとき、化合物A(生物学的試験においてPD1とも呼ばれる)は、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩であり、以下に例証される。化合物Aは、以下の構造式:
【化1】

【0025】
又は医薬上許容されるその塩を有する。(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン、そのラセミ合成、及びそのガラクタル酸塩及びヘミガラクタル酸塩形態は、各々が化合物Aの調製の開示について参照により本明細書に援用される、公開された国際公開第04/078752号及び米国特許第7,098,331号に開示されている。
【0026】
ジスキネジアの確証されたパーキンソン病動物モデル(L-ドーパ治療された片側6-ヒドロキシドーパミン傷害ラット)においてCNSサブタイプを標的とするNNR薬物の効果を評価する研究を開始した。α4β2* NNR及びα6β2* NNRの双方を標的とする化合物A(皮下ミニポンプを介した0.1又は0.3mg/kg/日)は、全L-ドーパ誘発性AIMSを約25%まで低減させ、軸性AIMよりも経口においてより顕著に低減させた。
【0027】
さらに、化合物Aは、傷害を受けたラットにおけるパーキンソニズムの改善傾向を実証した。このようにして、選択的NNR薬物は、現在、非常に限定された治療であるL-ドーパ療法の問題のある合併症であるパーキンソン病におけるジスキネジアの管理に有用であり得る。
【0028】
本明細書で使用するとき、「医薬上許容される」という用語は、製剤の他の成分と適合可能であって、医薬組成物の服用者にとって有害ではない、本発明の化合物の担体、希釈剤、賦形剤又は塩形態を意味する。
【0029】
本明細書で使用するとき、「医薬組成物」という用語は、一つ若しくは複数の医薬上許容される担体、希釈剤、又は賦形剤と場合により混合される本発明の化合物を意味する。医薬組成物は、それらを製造する目的及び商品化する目的に適し得るように、環境条件に対する安定性の程度を示すのが好ましい。
【0030】
本明細書で使用するとき、「有効量」、「治療量」、及び「有効投薬量」という用語は、所望の薬理効果又は治療効果を引き出し、それによって障害の有効な治療に至るのに十分な本発明の化合物の量を意味する。障害の治療は、障害の発症又は進行、並びに障害に関連した症状の発症又は進行を遅延又は予防することによって明らかにされてもよい。また、障害の治療は、症状の減少又は消失、障害の進行の回復、並びに患者の健康状態への任意の他の寄与によって明らかにされてもよい。
【0031】
有効投薬量は、因子、例えば、患者の状態、障害の症状の重症度、及び医薬組成物が投与される様式に応じて変化させることができる。有効投薬量で投与するために、化合物は、0.1mg/kg患者体重程度の低さの量で投与されてもよい。一実施形態では、化合物は、約1mg/kg患者体重未満から約100μg/kg患者体重未満の量、さらには約1μg/kgから100μg/kg患者体重未満の間の量で投与されてもよい。前述の有効投薬量は、典型的には、単回投薬量として、又は24時間の期間中に投与されてもよい一回若しくは複数回の投薬量として投与されてもよい量を表す。一実施形態では、約1mgから約100mg、好ましくは1mgから約50mg、好ましくは約5mgから約30mg、好ましくは約5mgから約20mgの化合物Aの一日投薬量が投与されてもよい。投薬量は、一日一回であってもよく、一日二回(BID)、一日三回(QD)、一日四回(QID)、又はより多くの投薬量を与えるように分割されてもよい。
【0032】
化合物A又は医薬上許容されるその塩は、多形として知られる特徴である二つ以上の形態で結晶化されてもよく、このような多形の形態(「多形体」)は本発明の範囲内である。多形は、一般に、温度、圧力、又はその双方の変化の応答として生じる場合がある。また、多形は、結晶化過程の変更に起因する場合もある。多形体は、X線回折パターン、溶解度、及び融点などの当技術分野において知られている様々な物理的特徴によって区別することができる。
【0033】
化合物Aは、不斉中心を含み、したがって複数の立体異性体として存在することができる。本発明の範囲は、立体異性体の混合物、並びに精製された鏡像異性体又は鏡像異性的/ジアステレオマー的に富んだ混合物を含む。また、本発明の式によって表される化合物の個々の異性体、並びに任意の全体的又は部分的に平衡化されたそれらの混合物が、本発明の範囲内に含まれる。さらに、本発明は、上記式によって表される化合物の個々の異性体を、一つ又は複数の不斉中心が反転するその異性体を含む混合物として含む。化合物が単一の鏡像異性体として望まれる場合、このようなものは、立体特異的合成によって、最終生成物若しくは任意の都合のよい中間体の分解によって、又は当技術分野において知られているようなキラルクロマトグラフィー法によって得られてもよい。最終生成物、中間体、又は出発材料の分解は、当技術分野において知られている任意の適切な方法によって行うことができる。例えば、Stereochemistry of Organic Compounds (Wiley-Interscience, 1994)を参照されたい。
【0034】
本発明は、本明細書に記載されている化合物の塩又は溶媒和物を含み、塩の溶媒和物などのそれらの組合せを含む。本発明の化合物は、溶媒和形態、例えば、水和形態、並びに非溶媒和形態で存在してもよく、本発明はこのような全ての形態を包含する。典型的には、絶対的ではないが、本発明の塩は、医薬上許容される塩である。用語「医薬上許容される塩」に包含される塩は、本発明の化合物の非毒性塩を意味する。適切な医薬上許容される塩の例には、無機酸付加塩、例えば、塩化物、臭化物、硫酸塩、リン酸塩、及び硝酸塩;有機酸付加塩、例えば、酢酸塩、ガラクタル酸塩、プロピオン酸塩、コハク酸塩、乳酸塩、グリコール酸塩、リンゴ酸塩、酒石酸塩、クエン酸塩、マレイン酸塩、フマル酸塩、メタンスルホン酸塩、p-トルエンスルホン酸、及びアスコルビン酸塩;酸性アミノ酸を有する塩、例えば、アルパラギン酸塩及びグルタミン酸塩;アルカリ金属塩、例えば、ナトリウム塩及びカリウム塩;アルカリ土類金属、例えば、マグネシウム塩及びカルシウム塩;アンモニウム塩;有機塩基性塩、例えば、トリメチルアミン塩、トリエチルアミン塩、ピリジン酸塩、ピコリン塩、ジシクロヘキシルアミン塩、及びN,N'-ジベンジルエチレンジアミン塩;並びに塩基性アミノ酸との塩、例えば、リジン塩及びアルギニン塩が挙げられる。これらの塩は、ある場合には、水和物又はエタノール溶媒和物であってもよい。
【0035】
本発明の化合物をバルク活性化合物の形態で投与することは可能であるが、医薬組成物又は製剤の形態で化合物を投与することが好ましい。したがって、本発明の一態様は、式Iの一つ若しくは複数の化合物、及び/又は医薬上許容されるその塩、並びに一つ若しくは複数の医薬上許容される担体、希釈剤又は賦形剤を含む医薬組成物を含む。本発明の別の態様は、式Iの一つ若しくは複数の化合物、及び/又は医薬上許容されるその塩と、一つ若しくは複数の医薬上許容される担体、希釈剤又は賦形剤とを混合することを含む、医薬組成物を調製する方法を提供する。
【0036】
本発明の化合物を投与する様式を変えることができる。本発明の化合物は、好ましくは、経口投与される。経口投与用の好ましい医薬組成物には、錠剤、カプセル、カプレット、シロップ、溶液、及び懸濁液が挙げられる。本発明の医薬組成物は、持続放出錠剤及びカプセル製剤などの放出調節投薬形態で提供されてもよい。
【0037】
また、医薬組成物は、注射を介して、すなわち静脈内、筋内、皮下、腹腔内、動脈内、髄腔内、及び脳室内に投与され得る。静脈内投与は、好ましい注射の方法である。注射に適した担体は、当業者に周知であり、5%デキストロース溶液、生理食塩水、及びリン酸緩衝生理食塩水が挙げられる。
【0038】
また、製剤は、他の手段、例えば、直腸投与を用いて投与されてもよい。坐薬などの直腸投与に有用な製剤は、当業者に周知である。さらに、化合物は、吸入によって、例えば、エアロゾルの形態で;局所的に、例えば、ローションの形態で;経皮的に、例えば、経皮パッチを用いて(例えば、Novartis及びAlza Corporationから市販されている技術を用いることによる)、粉末注入によって、又は口腔、舌下、若しくは鼻腔内吸収によって、投与することができる。
【0039】
医薬組成物は、単位投薬量の形態、又は複数回若しくはサブユニット投薬量で製剤化されてもよい。
【0040】
本明細書に記載されている医薬組成物の投与は、断続的であってもよく、又は段階的、連続的、一定の若しくは調節された速度であってもよい。医薬組成物は、温血動物、例えば、マウス、ラット、ネコ、ウサギ、イヌ、ブタ、ウシ、若しくはサルなどの哺乳動物に投与されてもよいが;有利には、ヒトに投与される。さらに、医薬組成物が投与される一日の時間帯、及び一日あたりの回数を変化させることができる。
【0041】
化合物A又は医薬上許容されるその塩は、障害若しくは状態の治療又は予防に有用な様々な他の適切な治療薬と併用して用いることができる。したがって、本発明の一実施形態は、他の治療用化合物と併用した本発明の化合物の投与を含む。例えば、本発明の化合物は、他のNNRリガンド(例えば、バレニクリン)、NNRのアロステリック調節因子、抗酸化剤(例えば、フリーラジカル消去剤)、抗菌剤(例えば、ペニシリン系抗生物質)、抗ウイルス薬(例えば、ジドブジン及びアシクロビルのようなヌクレオシド類似体)、抗凝血剤(例えば、ワーファリン)、抗炎症剤(例えば、NSAID)、解熱剤、鎮痛薬、麻酔薬(例えば、手術で用いるもの)、アセチルコリンエステラーゼ阻害剤(例えば、ドネペジル及びガランタミン)、抗精神病薬(例えば、ハロペリドール、クロザピン、オランザピン、及びクエチアピン)、免疫抑制剤(例えば、シクロスポリン及びメトトレキセート)、神経保護剤、ステロイド(例えば、ステロイドホルモン)、コルチコステロイド(例えば、デキサメタゾン、プレドニゾン及びヒドロコルチゾン)、ビタミン、ミネラル、栄養補助食品、抗うつ薬(例えば、イミプラミン、フルオキセチン、パロキセチン、エスシタロプラム、セルトラリン、ベンラファキシン及びデュロキセチン)、抗不安薬(例えば、アルプラゾラム及びバスピロン)、抗てんかん薬(例えば、フェニトイン及びガバペンチン)、血管拡張薬(例えば、プラゾシン及びシルデナフィル)、気分安定剤(例えば、バルプロ酸塩及びアリピプロゾール)、抗癌薬(例えば、抗増殖薬)、抗高血圧薬(例えば、アテノロール、クロニジン、アムロピジン、ベラパミル、及びオルメサルタン)、下剤、便秘薬、利尿薬(例えば、フロセミド)、鎮痙薬(例えば、ジサイクロミン)、抗ジスキネジア薬、並びに抗潰瘍薬(例えば、エソメプラゾール)、と併用して用いられてもよい。医薬として活性な薬物のこのような組合せは一緒に又は別々に投与されてもよく、別々に投与される場合には、投与は、同時に又は逐次的に任意の順序で行ってもよい。化合物又は薬物の量、及び相対的な投与タイミングは、所望の治療効果を達成するために選択される。本発明の化合物と他の治療薬との併用投与は、(1)双方の化合物を含む単一の医薬組成物、又は(2)一方の化合物をそれぞれ含む別個の医薬組成物、として同時に投与することによる併用であってもよい。或いは、組合せは、一方の治療薬を最初に投与し、他方を2番目に投与する逐次的様式で、別々に投与されてもよい。このような逐次的投与は時間的に接近していてもよく、又は時間的に離れていてもよい。本発明の別の態様は、治療的に又は予防的に有効量の本発明の化合物を対象に投与すること、及び化学療法、放射線療法、遺伝子治療、又は免疫療法を含む一つ若しくは複数の他の療法を含む併用療法を含む。
【0042】
本発明の化合物は、有効量で用いられる場合、α4β2及びα6β2*の活性を調節すると考えられ、α7で効果が全くかほとんどなく、ヒト神経節を特徴付けるニコチンサブタイプとの感知できる程度の相互作用もなく、これは、副腎クロム親和性組織、又は骨格筋においてニコチン機能を発揮する能力の欠如によって実証され、さらに、筋肉型ニコチン受容体を発現する細胞調製物においてニコチン機能を発揮する能力の欠如によって実証される。したがって、これらの化合物は、神経節部位及び神経筋部位での活性と関連した有意な副作用を発揮せずに、疾患、障害及び状態を治療又は予防することができると考えられる。このようにして、本化合物の投与は、ある種の疾患、障害及び状態の治療が与えられ、ある種の副作用が避けられる治療濃度域を与えると考えられる。すなわち、化合物の有効投薬量は、疾患、障害又は状態に対する所望の効果を与えるのに十分であると考えられるが、望ましくない副作用を与えるには不十分である、つまり十分に高いレベルではないと考えられる。
【0043】
化合物は、特に適切な標識を含むように修飾される場合、プローブなどの診断用組成物において用いることができる。この目的のため、最も好ましくは、本発明の化合物は、11C、18F、76Br、123I又は125Iなどの放射性同位体部分を用いて標識される。投与された化合物は、用いられる標識に適した、既知の検出方法を用いて検出することができる。検出方法の例には、ポジション放出トポグラフィー(position emission topography (PET))、及び単光子放射型コンピュータ断層撮影法(single-photon emission computed tomography: SPECT)が挙げられる。上記される放射性標識は、PET(例えば、11C、18F又は76Br)、及びSPECT(例えば、123I)画像化に有用であり、半減期は、11Cでは約20.4分、18Fでは約109分、123Iでは約13時間、及び76Brでは約16時間である。高い比活性は、不飽和濃度で選択された受容体サブタイプを視覚化するために望まれる。投与された投薬量は、典型的には、毒性範囲を下回り、高いコントラスト画像を与える。化合物は、非毒性レベルで投与を可能にすることが期待される。投薬量の決定は、放射性標識画像化の当業者に知られている様式で実施される。例えば、Londonらによる米国特許第5,969,144号を参照されたい。
【0044】
化合物は、既知の技術を用いて投与することができる。例えば、上記のLondonらによる米国特許第5,969,144号を参照されたい。化合物は、他の成分、例えば、診断用組成物の製剤化に有用であるそれらタイプの成分を組み込む製剤組成物において投与され得る。本発明の実施に従って有用な化合物は、最も好ましくは、高純度の形態で用いられる。例えば、Elmalchらによる米国特許第5,853,696号を参照されたい。
【0045】
化合物を対象(例えば、ヒト対象)に投与後、対象内におけるその化合物の存在は、その存在、量、及び機能性を示すために適切な技術によって画像化され、定量化され得る。ヒトに加えて、化合物はまた、マウス、ラット、イヌ、及びサルなどの動物に投与されてもよい。SPECT及びPET画像化は、任意の適切な技術及び装置を用いて実行され得る。代表的な画像化技術の開示について、各々が参照により本明細書に援用されるVillemagneら, Arnericら(編集)Neuronal Nicotinic Receptors: Pharmacology and Therapeutic Opportunities, 235〜250 (1998)及びElmalchらによる米国特許第5,853,696号を参照されたい。
【0046】
一態様では、診断用組成物は、ヒト患者などの対象において疾患を診断する方法において用いることができる。この方法は、本明細書に記載されている検出可能に標識された化合物をその患者に投与すること、及び選択されたNNRサブタイプ(例えば、α4β2及びα6β2*受容体サブタイプ)に対するその化合物の立体的機構を検出することを伴う。PET及びSPECTなどの診断ツールを用いる当業者は、本明細書に記載されている放射性標識された化合物を用いて、中枢神経系及び自律神経系の機能障害と関連した状態及び障害を含む幅広い種類の状態及び障害を診断することができる。このような障害には、幅広い種類のCNS疾患及び障害が含まれ、アルツハイマー病、パーキンソン病、及び統合失調症が挙げられる。評価され得るこれらの及び代表的な疾患及び障害は、Bencherifらによる米国特許第5,952,339号に記載されるものが含まれる。
【0047】
別の態様では、診断用組成物は、ヒト患者などの対象の選択的ニコチン受容体サブタイプを監視する方法において用いることができる。この方法は、本明細書に記載されている検出可能に標識された化合物をその患者に投与すること、及び選択されたニコチン受容体サブタイプ、すなわち、α4β2及びα6β2*受容体サブタイプに対するその化合物のイオン束衝突を検出することを伴う。
【0048】
化合物Aは、十分に確立された合成法を含む様々な方法によって製造されてもよい。例証的な一般合成法は以下に示され、次に本発明の具体的な化合物は実施例において調製される。
【0049】
後述される実施例では、感受性基又は反応基のための保護基は、必要に応じて、合成化学の一般的な原理に従って用いられる。保護基は、有機合成の標準的な方法に従って操作される(T. W. Green及びP. G. M. Wuts (1999) Protecting Groups in Organic Synthesis, 3版, John Wiley & Sons,保護基に関して参照により本明細書に援用される)。これらの基は、当業者に容易に分かる方法を用いて、化合物合成の都合の良い段階で除去される。プロセスの選択、並びに反応条件及びそれらの実行の順序は、本発明の化合物の調製と一致させるべきである。
【0050】
化合物Aは、容易に利用可能な出発材料及び試薬を用いて、以下に記載される方法に従って調製され得る。これらの反応では、当業者にそれ自体知られているが、本明細書に詳細に記載されていない変形を用いてもよい。
【0051】
他に記載がなければ、本明細書に示されている構造はまた、一つ又は複数の同位体に富んだ原子の存在下においてのみ異なる化合物を含むことを意味する。デューテリウム若しくはトリチウムによる水素原子の置換、又は13C若しくは14Cに富んだ炭素による炭素原子の置換を除いて、本構造を有する化合物は、本発明の範囲内である。例えば、デューテリウムは、生物学的に活性な化合物の薬物動態及び代謝を調べるために幅広く使用されている。デューテリウムは化学的観点から水素に類似して振る舞うが、デューテリウム-炭素結合と水素-炭素結合との間の結合エネルギー及び結合長において有意な相違が存在する。結果として、生物学的に活性な化合物におけるデューテリウムによる水素の置換は、一般には、その生化学的潜在力及び選択性を保持するが、その同位体不含の対応物と比較して、有意に異なる吸収、分布、代謝、及び/又は排出(absorption, distribution, metabolism, and/or excretion: ADME)特性を明示する化合物に至る場合がある。このようにして、デューテリウム置換は、いくつかの生物学的に活性な化合物について、改善された薬物効力、安全性、及び/又は認容性をもたらすことがある。
【0052】
有機合成の当業者には、本発明の化合物を製造するための手段、並びに様々な使用に適した放射性同位体を用いて標識される本発明の化合物を製造するための手段が複数あることが理解されよう。例えば、上述されるように、11C-若しくは18F-標識されたアリール又はヘテロアリールボロン酸を用いたカップリング、続く保護基の除去は、ポジトロン放出断層撮影における使用に適した化合物を製造する。同様に、上述されるように、3H-若しくは14C-標識されたアリール又はヘテロアリールボロン酸を用いたカップリング、続く保護基の除去は、機能及び代謝研究における使用に適した同位体で修飾された化合物、又は代替の治療用化合物を製造する。
【実施例1】
【0053】
【化2】

【0054】
tert-ブチル(R)-3-(メチルスルホニルオキシ)ピロリジン-1-カルボキシレート(2)の合成
手順A:-20から-30℃のトルエン(700ml)中のtert-ブチル(R)-3-ヒドロキシピロリジン-1-カルボキシレート(200g、1.07mol)及びトリエチルアミン(167g、1.63mol)の溶液に、塩化メタンスルホニル(156g、1.36mol)を-10から-20℃に温度を維持しながら滴下した。この溶液を周囲温度に温め、撹拌した。反応溶液を1時間毎にサンプリングし、HPLCによって分析して、反応の完了を確認した。反応の完了直後、懸濁液をろ過し、トリエチルアミン塩酸塩を除去した。ろ液を約600mLの重炭酸ナトリウムの希釈水溶液で洗浄した。有機層を乾燥させ、減圧下で濃縮して、粘性油として2を得た(260g、92%)。これをさらに精製せずに用いる。1H NMR (CDCl3, 400 MHz) δ 5.27 (m, 1H), 3.44 - 3.76 (m, 4H), 3.05 (s, 3H), 2.26 (m, 1H), 2.15 (m, 1H), 1.47 (s, 9H)。
【0055】
手順B:リアクターをtert-ブチル(R)-3-ヒドロキシピロリジン-1-カルボキシレート(2.00kg、10.7mol)、トルエン(8.70kg)及びトリエチルアミン(1.75kg、17.3mol)で充たした。リアクターに窒素を15分間流した。混合物を撹拌し、3℃に冷却した。連続して氷浴冷却しながら塩化メタンスルホニル(1.72kg、mol)を徐々に(2時間かけて)添加した(発熱反応)(添加完了後は、温度が14℃であった)。混合物は、この時点で、沈殿したトリエチルアミン塩酸塩のため粘性があり、それを20℃に温めながら12時間撹拌した。GC及びTLC分析(ニンヒドリン染色)の双方により、出発材料は残っていないことが示された。混合物をろ過し、トリエチルアミン塩酸塩を除去し、ろ液をリアクターに戻した。次に、5%の重炭酸ナトリウム水溶液(2×3kg)でろ液を洗浄し、各洗浄については15分の撹拌時間及び15分の沈降時間を用いた。得られた有機層を無水硫酸ナトリウム上で乾燥させ、ろ過した。最初に50℃にて4時間、次に周囲温度にて10時間の真空下で揮発性物質をろ液から除いた。残渣の重量は3.00kg(収率106%)であり、クロマトグラフィー及びNMRの分析により、トルエンを含有することを除いて、先に調製された試料と同一であった。
【0056】
ジエチル(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロネート(3)の合成
調製A:1-メチル-2-ピロリジノン(1.19L)中のカリウムtert-ブトキシド(187g、1.62mol)の溶液にマロン酸ジエチル(268g、1.67mol)を温度を35℃未満に維持しながら添加した。この溶液を40℃に加熱し、20〜30分間撹拌した。tert-ブチル(R)-3-(メチルスルホニルオキシル)ピロリジン-1-カルボキシレート(112g、420mmol)を添加し、この溶液を65℃に加熱し、6時間撹拌した。反応溶液を2時間毎にサンプリングし、HPLCによって分析して、反応の完了を確認した。反応の完了(10〜12時間)直後、混合物を約25℃に冷却した。脱イオン水(250mL)をこの溶液に添加し、2Nの塩酸(650mL)を添加してpHを3〜4に調整した。得られた懸濁液をろ過し、水(1.2L)とクロロホルム(1.4L)を添加した。この溶液を十分に混合し、クロロホルム層を回収し、減圧下で蒸発させて、黄色の油を得た。この油をヘキサン(2.00L)に溶解し、脱イオン水(2×1.00L)で洗浄した。減圧下で50〜55℃にて有機層を濃縮して、淡黄色の油(252g)を得た。1H NMR分析により、3が49.1%(123.8g)であり、マロン酸ジエチルが48.5%(122g)であり、1-メチル-2-ピロリジノンが2%(5g)であることが示される。この材料をさらに精製せずに次の工程に進めた。1H NMR (CDCl3, 400 MHz) δ 4.20 (q, 4H), 3.63 (m, 1H), 3.48 (m, 1H), 3.30 (m, 1H), 3.27 (d, J = 10 Hz, 1H), 3.03 (m, 1H), 2.80 (m, 1H), 2.08 (m, 1H), 1.61 (m,1H), 1.45 (s, 9H), 1.27 (t, 6H)。
【0057】
調製B:リアクターは、窒素雰囲気下で維持され、200プルーフのエタノール(5.50kg)、及びエタノール中の21%(重量比)のナトリウムエトキシド(7.00kg、21.6mol)で充たされた。混合物を撹拌し、30℃に温めた。マロン酸ジエチル(3.50kg、21.9mol)を20分かけて添加した。次に、反応混合物を40℃にて1.5時間温めた。200プルーフのエタノール(5.50kg)中のtert-ブチル(R)-3-(メチルスルホニルオキシル)ピロリジン-1-カルボキシレート(実施例2、手順Bから得た3.00kgの生成物、10.7mol)の溶液を添加し、得られた混合物を2時間、加熱還流(78℃)した。GC及びTLC分析(ニンヒドリン染色)の双方により、出発材料は残っていないことが示された。次に、撹拌混合物を25℃に冷却し、水(2.25kg)で希釈し、水(5.44kg)中の濃塩酸(1.27kg、12.9mol)溶液でゆっくり処理した。この混合物をメチルtert-ブチルエーテル(MTBE)(14.2kgと11.4kg)で二回洗浄し、各洗浄については15分の撹拌時間及び15分の沈降時間を用いた。合わせたMTBE洗浄物を無水硫酸ナトリウム(1kg)上で乾燥し、ろ過し、真空下、50℃にて6時間濃縮した。残渣(赤色の油)の重量は4.45kgであり、GC分析により所望生成物は49%であった(tert-ブチル(R)-3-ヒドロキシピロリジン-1-カルボキシレートからは全体で収率62%であった)。
【0058】
(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロン酸(4)の合成
手順A:テトラヒドロフラン(1.2L)中の123.8g(380mmol)の3及び121.8g(760mmol)のマロン酸ジエチルを含有する、実施例3、手順Aにより得られた生成物(232g)の溶液に、21%の水酸化カリウム溶液(0.50Lの脱イオン水中、450g)を温度を25℃未満に維持しながら添加した。反応混合物を45℃に加熱し、1時間撹拌した。反応溶液を1時間毎にサンプリングし、HPLCによって分析して、反応の完了を確認した。反応の完了(2〜3時間)直後、混合物を約25℃に冷却した。水層を回収し、5℃に冷却した。4Nの塩酸(750mL)の添加により、pHを2に調整し、得られた懸濁液を5〜10℃にて30分間保持した。混合物をろ過し、ろ過ケーキをヘキサン(1L)で洗浄した。ろ液をクロロホルム(1L)で抽出し、クロロホルム層を別にしておいた。ろ過工程で回収された固体をクロロホルム(1L)中で40℃に加熱することによって再溶解した。この溶液をろ過し、溶解していない無機固体を除去した。クロロホルム層を合わせ、減圧下で50〜55℃にて濃縮して、オフホワイト色の固体(15g)を得た。この固体を合わせ、酢酸エチル(350mL)に溶解して、懸濁液を得て、この懸濁液を50〜60℃に2時間温めた。熱いうちに懸濁液をろ過し、得られたケーキを酢酸エチル(2×150mL)及びヘキサン(2×250mL)で洗浄して、83.0g(80.1%)の4を白色の固体として得て、これをさらに精製せずに次の工程に用いた。1H NMR (d4-CH3OH, 400 MHz) δ 3.60 (m, 1H), 3.46 (m, 1H), 3.29-3.32 (m, 2H), 2.72 (m, 1H), 2.09 (m, 1H), 1.70 (m, 1H), 1.45 (s, 9H)。
【0059】
手順B:テトラヒドロフラン(13.9kg)中の2.13kg(6.47mol)の3を含有する、実施例3、手順Bの生成物(4.35kg)の溶液は、温度を35℃未満に維持しながら、窒素雰囲気下で、脱イオン水(2.00kg)中の撹拌冷却した水酸化カリウム(1.60kg、40.0mol)の溶液に添加された。反応混合物を加熱し、40〜45℃にて24時間維持し、その時点で、GC及びTLC分析により、反応が完了したことが示された。混合物25℃に冷却し、MTBE(34kg)で洗浄し、15分の撹拌時間及び15分の沈降時間を用いた。水層を回収し、1℃に冷却した。次に、脱イオン水(2.18kg)中の濃塩酸(2.61kg、26.5mol)の混合物をゆっくり添加し、その添加中及び添加後の15分間は、混合物の温度を15℃未満に保持した。塩酸をさらに添加することによって、溶液のpHを3.7に調整した。白色の固体をろ過により回収し、水(16kg)で洗浄し、周囲温度で6時間真空乾燥した。乾燥した固体の重量は1.04kgであった。ろ液を10℃未満に冷却し、さらなる塩酸(1.6Lの6Nを用いた;9.6 mol;最終pH=2)の添加によりpHを下げながらその温度に保持した。白色の固体をろ過により回収し、水(8L)で洗浄し、40℃にて三日間真空乾燥した。乾燥した固体の重量は0.25kgであった。合わせた固体(1.29kg、収率73%)は、クロマトグラフィーにより、先に調製された試料と同一であった。
【0060】
(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)酢酸(5)の合成
手順A:1-メチル-2-ピロリジン(0.42L)中の(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロン酸(83g)の溶液を窒素下で110〜112℃にて2時間撹拌した。反応溶液を1時間毎にサンプリングし、HPLCによって分析して、反応の完了を確認した。反応の完了直後、反応溶液を20〜25℃に冷却した。この溶液を脱イオン水(1.00L)と混合し、MTBE(1.00L)を添加した。この相を分離させ、有機層を回収した。水相をMTBE(1.00L)、次にクロロホルム(1.00L)で抽出した。有機層を合わせ、減圧下で50〜55℃にて濃縮して、油を得た。この油をMTBE(2.00L)に溶解し、0.6N塩酸(2×1.00L)で二回洗浄した。有機層を回収し、減圧下で50〜55℃にて濃縮して、半固体を得た。この半固体を1:4の酢酸エチル/ヘキサン(100mL)に懸濁し、50℃に加熱し、30分間保持し、-10℃に冷却し、ろ過した。ろ液を減圧下で濃縮して、油を得て、それをMTBE(250mL)に溶解し、0.6N塩酸(2×100mL)で二回洗浄した。有機層を減圧下で50〜55℃にて濃縮して、半固体を得て、それを1:4の酢酸エチル/ヘキサン(50mL)に懸濁し、50℃に加熱し、30分間保持し、-10℃に冷却し、ろ過した。この固体を集め、ヘキサン(200mL)に懸濁し、ろ過により回収して、54.0g(77.6%)の5を得た。1H NMR (CDCl3, 400 MHz) δ 11.00 (br s, 1H), 3.63 (m, 1H), 3.45 (M, 1H), 3.30 (M, 1H), 2.97 (m, 1H), 2.58 (m, 1H), 2.44 (m, 2H), 2.09 (m, 1H), 1.59 (M, 1H), 1.46 (s, 9H)。
【0061】
手順B:1-メチル-2-ピロリジン(6.49kg)中の(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロン酸(1.04kg, 3.81mol)の溶液を窒素下で110℃にて5時間撹拌し、その時点で、TLC及びHPLC分析により、反応が完了したことが示された。反応混合物を25℃(4時間)に冷却し、水(12.8kg)及びMTBE(9.44kg)と合わせた。混合物を20分間激しく撹拌し、この相を放置して分離させた(10時間)。有機相を回収し、水相をMTBE(9.44kg)と合わせ、15分間撹拌し、沈降させた(45分間)。有機相を回収し、水相をMTBE(9.44kg)と合わせ、15分間撹拌し、沈降させた(15分間)。三つの有機相を合わせ、1N塩酸(8.44kgずつ)で三回洗浄し、水(6.39kg)で一回洗浄し、各洗浄については15分の撹拌時間及び15分の沈降時間を用いた。得られた溶液を無水硫酸ナトリウム(2.0kg)上で乾燥し、ろ過した。ろ液を減圧下で31℃(2時間)にて濃縮して、固体を得た。この固体を真空下、39℃にて4時間、及び25℃にて16時間加熱し、704g(81%)の5(GCによる純度99.7%)を得た。
【0062】
手順C(出発材料として2を用いた5の合理化合成):エタノール中のナトリウムエトキシド(21重量パーセント、343g、1.05mol)、エタノール(無水、300mL)及びマロン酸ジエチル(168g、1.05mol)の撹拌混合物を40℃に1.5時間加熱した。この混合物にエタノール(100mL)中の(R)-tert-ブチル3-(メチルスホニルオキシ)ピロリジン-1-カルボキシレート(138g、0.592mol)の溶液を添加し、反応混合物を78℃に8時間加熱した。冷却した反応混合物を水(2.0L)で希釈し、6MのHCl(100mL)を用いてpH=3へと酸性にした。水性エタノール混合物をトルエン(1.0L)で抽出し、有機相を真空下で濃縮して、230gの赤色の油を得た。赤色の油を85℃にて22.5重量パーセントの水酸化カリウム(748g、3.01mol)水溶液に添加した。添加が完了した後、反応温度をゆっくり102℃に上昇させるのと同時に、エタノールの蒸留を確実に行った。反応温度が102℃に達し、蒸留が収まってきたとき、さらに90分間、加熱を続けた。反応混合物を周囲温度に冷却し、トルエン(2×400mL)で洗浄した。内部温度を20℃未満に保持しながら、水層に600mLの6M塩酸を添加した。これにより、pHが約4〜5から、沈殿物が形成した。懸濁液をろ過し、ろ過ケーキを300mLの水で洗浄した。この固体を真空下で乾燥して、77gの(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロン酸をオフホワイト色の固体として得た((R)-tert-ブチル3-(メチルスルホニルオキシ)ピロリジン-1-カルボキシレートに対して54%収率)。1H NMR (DMSO-d6, 400 MHz): δ 3.47 (m, 1H); 3.32 (m, 1H); 3.24 (m, 1H); 3.16 (m, 1H); 3.92 (m, 1H); 2.86 (m, 1H); 1.95 (m, 1H); 1.59 (m, 1H); 1.39 (s, 9H)。
【0063】
トルエン(150mL)及びジメチルスルホキシド(2mL)中の(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)マロン酸(15g、55mmol)の懸濁液を2時間加熱還流した。混合物を周囲に達するようにし、MTBE(150mL)で希釈した。有機溶液を10%クエン酸水溶液(2×200mL)で洗浄し、溶媒を真空下で除去して、オフホワイト色の固体として11.6gの(R)-2-(1-(tert-ブトキシカルボニル)-ピロリジン-3-イル)酢酸を得た(収率92%)。1H NMR (DMSO-d6, 400 MHz): δ 12.1 (s, 1H); 3.36-3.48 (m, 1H); 3.20-3.34 (m, 1H); 3.05-3.19 (m, 1H; 2.72-2.84 (m, 1H); 2.30-2.42 (m, 1H), 2.22-2.30 (m, 2H); 1.85-2.00 (m, 1H); 1.38-1.54 (m, , 1H), 1.35 (2, 9H)。
【0064】
tert-ブチル(R)-3-(2-ヒドロキシエチル)ピロリジン-1-カルボキシレート(6)の合成
手順A:テトラヒドロフラン(THF)(200mL)中の(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)酢酸(49.0g、214mmol)の溶液を-10℃に冷却した。温度を0℃未満に維持しながら、THF溶液中の250mL(250mmol)の1Mボランをフラスコにゆっくり添加した。溶液を周囲温度に温め、1時間撹拌した。1時間毎に溶液をサンプリングし、HPLCにより分析して、反応の完了を確認した。反応の完了直後、この溶液を0℃に冷却し、10%水酸化ナトリウム水溶液(80mL)を30分かけて滴下して、気体発生を調節した。この溶液を500mLの1:1のヘキサン/酢酸エチル溶液で抽出した。有機層を飽和塩化ナトリウム溶液で洗浄し、10gのシリカゲルで乾燥した。シリカゲルをろ過によって除去し、100mLの1:1のヘキサン/酢酸エチルで洗浄した。有機層を合わせ、真空下で濃縮して、明るいオレンジ色の油として6(42g、9.13%)を得て、この油を放置により固化させた。1H NMR (CDCl3, 400 MHz) δ 3.67 (m, 2H), 3.38-3.62 (m, 2H), 3.25 (m, 1H), 2.90 (m, 1H), 2.25 (m, 1H), 1.98-2.05 (m, 1H), 1.61-1.69 (m, 2H), 1.48-1.59 (m, 2H), 1.46 (s, 9H)。
【0065】
手順B:窒素ガス下で保持し、水浴を使用して温度を23から28℃の間に保持しながら、ボラン-THF複合体(THF中の1Mの3.90kg又はL、mol)をTHF(2.5kg)中(R)-2-(1-(tert-ブトキシカルボニル)ピロリジン-3-イル)酢酸(683g、3.03mol)の撹拌溶液にゆっくり添加した。添加には1.75時間を要した。25℃での撹拌を1時間継続し、その時点以降、GC分析は完全な反応を示した。反応混合物を10℃未満に冷却し、10%水酸化ナトリウム(1.22kg)水溶液をゆっくり添加しながら、25℃未満に維持した。添加には40分を要した。混合物を1時間25℃にて撹拌し、次に1:1(v/v)のヘプタン/酢酸エチル(7L)と合わせた。混合物を15分間撹拌し、放置して相に分離させた(1時間)。有機相を取り除き、水相を1:1のヘプタン/酢酸エチルの第2の7L部分と合わせた。これを15分間撹拌し、放置して相に分離させた(20分間)。再び有機相を取り除き、合わせた有機相を飽和塩化ナトリウム(4.16kg)水溶液で洗浄し、15分の混合時間及び1時間の沈降時間を用いた。有機相をシリカゲル(140g)と合わせ、1時間撹拌した。無水硫酸ナトリウム(700g)を添加し、混合物を1.5時間撹拌した。混合物をろ過し、ろ過ケーキを1:1のヘプタン/酢酸エチル(2L)で洗浄した。ろ液を真空下で40℃未満にて6時間濃縮した。得られた油の重量は670g(収率103%)であった。この油は微量のヘプタンを含むが、他には、NMR分析によって、先に調製された試料の6と同一である。
【0066】
tert-ブチル(R)-3-(2-(メチルスルホニルオキシ)エチル)ピロリジン-1-カルボキシレート(7)の合成
手順A:トルエン(380mL)中のトリエチルアミン(40mL)をtert-ブチル(R)-3-(2-ヒドロキシメチル)ピロリジン-1-カルボキシレート(41.0g、190mmol))の溶液に添加し、-10℃に冷却した。温度を約-5から0℃に維持するように、塩化メタンスルホニル(20.0mL、256mmol)をゆっくり添加した。この溶液を周囲温度に温め、1時間撹拌した。溶液を1時間毎にサンプリングし、HPLCによって分析して、反応の完了を確認した。反応の完了直後、溶液をろ過し、ろ液を5%重炭酸ナトリウム水溶液(250ml)で洗浄した。有機層を回収し、飽和塩化ナトリウム水溶液(250mL)で洗浄した。有機層を回収し、シリカゲル(10g)上で乾燥させ、真空下で濃縮して、淡黄色の粘性油として7を得た(53.0g、92.8%)。1H NMR (CDCl3, 400 MHz) δ 4.26 (t, J = 6.8 Hz, 2H), 3.41-3.63 (m, 2H),3.27 (m, 1H), 3.02 (s, 3H), 2.92 (m, 1H), 2.28 (m, 1H), 2.05 (m, 1H), 1.83 (m, 2H), 1.50-1.63 (m, 1H), 1.46 (s, 9H)。
【0067】
手順B:窒素雰囲気下で、トルエン(5.20kg)中のトリエチルアミン(460g、4.55mol)及びtert-ブチル(R)-3-(2-ヒドロキシメチル)ピロリジン-1-カルボキシレート(実施例7の手順Bから得た全試料、3.03mol)の溶液を撹拌し、5℃に冷却した。氷浴冷却を用いて温度を15℃未満に保持しながら、塩化メタンスルホニル(470g、4.10mol)を1.25時間かけてゆっくり添加した。混合物を穏やかに(1.5時間かけて)35℃に温め、この温度を1.25時間維持し、その時点で、GC分析により、反応が完了していることが示された。混合物を25℃に冷却し、固体をろ過して取り出し、ろ過ケーキをトルエン(1.28kg)で洗浄した。ろ液を10%の重炭酸ナトリウム水溶液(4.0kg)と共に15分間撹拌し、この相を30分間放置して分離させた。次に、有機相を飽和塩化ナトリウム(3.9kg)水溶液と共に30分間撹拌し、この相を20分間放置して分離させた。有機相をシリカゲル(160g)と合わせ、1時間撹拌した。無水硫酸ナトリウム(540g)を添加し、混合物をさらに40分間撹拌した。次に、混合物をろ過し、ろ過ケーキをトルエン(460g)で洗浄した。ろ液を真空下で50℃にて5時間濃縮し、得られた油を真空下で23℃にてさらに8時間保持した。これにより789gの7を得て、GC分析により93%純度であった。
【0068】
tert-ブチル(R)-3-ビニルピロリジン-1-カルボキシレート(9)の合成
手順A:tert-ブチル(R)-3-((メチルスルホニルオキシ)エチル)ピロリジン-1-カルボキシレート(49.0g、167mmol)、ヨウ化ナトリウム(30.0g、200mmol)及び1,2-ジメトキシエタン(450ml)の溶液を50〜60℃にて4時間撹拌した。この溶液を1時間毎にサンプリングし、HPLCにより分析して、反応の完了を確認した。反応の完了直後、溶液を-10℃に冷却し、温度を0℃未満に維持しながら、固体のカルシウムtert-ブトキシド(32.0g、288mmol)を添加した。反応混合物を周囲温度に温め、1時間撹拌した。混合物を1時間毎にサンプリングし、HPLCにより分析して、反応の完了を確認した。反応の完了直後、珪藻土(25gの乾燥ベース)のパッドを介して混合物をろ過した。このケーキを1,2-ジメトキシエタン(100mL)で洗浄した。合わせたろ液を真空下で濃縮して、懸濁した固体を含むオレンジ色の油を得た。この油をヘキサン(400mL)に溶解し、30分間撹拌し、ろ過して、固体を除去した。有機層をシリカゲル(10g)上で乾燥させ、真空下で濃縮して、無色の油として9(26.4g、82.9%)を得た。1H NMR (CDCl3, 400 MHz) δ 5.77 (m, 1H), 5.10 (dd, J = 1.2 Hz, J = 16 Hz, 1H), 5.03 (dd, J = 1.2 Hz, J = 8.8 Hz, 1H), 3.41-3.59 (m, 2H), 3.29 (m, 1H), 3.05 (m, 1H), 2.78 (m, 1H), 2.01 (m, 1H), 1.62-1.73 (m, 1H), 1.46 (m, 9H)。
【0069】
手順B:tert-ブチル(R)-3-(2-(メチルスルホニルオキシ)エチル)ピロリジン-1-カルボキシレート(実施例7、手順Bの生成物の792g、約2.5mol)、ヨウ化ナトリウム(484g、3.27mol)及び1,2-ジメトキシエタン(7.2L)の溶液を55℃にて4.5時間、窒素下で撹拌し、その時点でのGC分析により、反応が完了したことが示された。この溶液を10℃未満に冷却し、温度を15℃未満に維持しながら、固体のカリウムtert-ブトキシド(484g、4.32mol)を分けて添加した(1.25時間の添加時間)。反応混合物を1時間5℃にて撹拌し、20℃にゆっくり(6時間)温め、20℃にて1時間撹拌した。溶液を珪藻土(400gの乾燥ベース)のパッドを介して混合物をろ過した。ろ過ケーキを1,2-ジメトキシエタン(1.6kg)で洗浄した。合わせたろ液を真空下で濃縮し、半固体の残渣をヘプタン(6.0L)と共に2時間撹拌した。固体をろ過によって除去し(ろ過ケーキを440mLのヘプタンで洗浄した)、ろ液を真空下で20℃にて濃縮して、455gの9(純度90.7%)を得た。この材料(350g)の試料を20〜23トールで分画して蒸留して、296gの精製された9(沸点130〜133℃)(GC分析により純度99%未満)を得た。
【0070】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン(11)の合成
N,N-ジメチルアセトアミド(250mL)中の(R)-tert-ブチル3-ビニルピロリジン-1-カルボキシレート(25g、127mmol)、5-ブロモピリミジン(30.3g、190mmol)、1,1'-ビス(ジフェニルホスフィノ)フェロセン(2.11g、3.8mmol)、及び酢酸ナトリウム(18.8gr、229mmol)の溶液に1時間、窒素を泡立てて通過させ、酢酸パラジウム(850mg、3.8mmol)を添加した。反応混合物を40℃/時の速度で150℃に加熱し、16時間撹拌した。混合物を10℃に冷却し、内部温度を20℃未満に維持しながら、水(750mL)でクエンチさせた。MTBE(300mL)を添加し、次に珪藻土(40g、乾燥ベース)を添加した。懸濁液を1時間、周囲温度にて撹拌し、珪藻土の床を介してろ過した。残渣をMTBE(2×100mL)で洗浄し、オーバーヘッドスターラーを備え、活性炭(40g)で充たされた2Lの容器にろ液を移した。懸濁液を2時間、周囲温度にて撹拌し、珪藻土を介してろ過した。残渣をMTBE(2×100mL)で洗浄し、ろ液を真空中で濃縮して、28.6gのオレンジ色の油を得た。この油をMTBE(100mL)に溶解し、Si-Thiol(登録商標)(2.0g、1.46mmolのチロール/g、Silicycle Inc.)を添加した。懸濁液を窒素下で周囲温度にて3時間撹拌し、微細フィルターを介してろ過し、ガラス容器内で保持した。
【0071】
6MのHCl(70mL)の溶液に、内部温度を20℃から23℃の間に維持しながら、30分間かけてろ液を添加した。混合物を1時間激しく撹拌し、有機層を除去した。残りの水層を45wt%のKOH(50mL)で塩基性にし、得られた懸濁液を一回、クロロホルム(300mL)で抽出した。真空中で溶媒を蒸発させて(浴温45℃)、赤色の油として、16.0g(71.8%)の(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン遊離塩基を得た。これは即座にイソプロパノール(50mL)に溶解し、塩形成のために使用する。
【0072】
塩
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン遊離塩基(10mg、0.057mmol)を酢酸イソプロピル又はアセトニトリルのいずれかに溶解した。溶液を0.5(ヘミ)から1.1(モノ)当量の対応する酸で処理し、50℃に温め、一晩、周囲温度にゆっくり冷却した。次に、溶媒を加熱せずに真空下で蒸発させた。
【実施例2】
【0073】
インビボ法:L-ドーパ誘発性ジスキネジア
サブタイプ選択的NNRアゴニスト化合物Aはα4β2* NNRを刺激し、より少ない程度でα6* NNRを刺激する。毒性学的試験は、げっ歯類、イヌ、及び霊長類において、低い発症率で末梢副作用があり、合理的な治療指数は主としてα4β2*ニコチン性受容体及びα6*ニコチン性受容体でのその相互作用と一致することを示す。ラットでの安全性試験において、これらの例のPD1としてコードされている化合物Aは、最大30mg/kgの遊離塩基の急性経口投薬量を用いたとき、いずれの有意な有害作用とも関連しなかった。行動感作はなく、化合物A(PD1)は、ラットにおいて自発運動を増大させず、乱用の傾向が低いことを示唆した。実験は、先に記載されたように(Cenciら, 1998; Cenci, 2002)、6-OHDA(Sigma Chemical Co.、ミズーリ州セントルイス)で片側に傷害を受けた雄性スプラーグドーリー(Sprague-Dawley)ラットを用いて行われた。3μg/μl濃度で0.02%アスコルビン酸/生理食塩水に6-OHDAを溶解した。化合物Aを浸透圧ミニポンプ(Alzetモデル2006; Durect Corporation、カリフォルニア州クパチーノ、米国)を介して全身に点滴し、薬物を3.6μl/日の速度で6週間送達した。この経路を介して連続的に与えられた場合、ニコチンがラットにおいてL-ドーパ誘発性AIMを最も効果的に低減させたのでこの経路が選択された(Bordia, T., Campos, C, Huang, L.Z. & Quik, M.,「Continuous And Intermittent Nicotine Treatment Reduces L-3,4-Dihydroxyphenylalanine (L-Dopa)-lnduced Dyskinesias In A Rat Model Of Parkinson's Disease」, J Pharmacol Exp Ther 327: 239〜47 (2008))。所要の投薬量(0.03、0.1、0.3mg/kg/日)を与えるために、ポンプを滅菌水、又は水(pH7.0)中の化合物A塩基のいずれかで予め満たした。イソフルオラン麻酔下で、製造業者の使用説明書に従って、肩甲骨間の首の背側面に沿ってミニポンプを皮下に移植した。移植後、術後疼痛のためにラットにブプレノルフィン(0.02mg/kg sc)を投与した。薬物治療を開始して二週間後、ラットは、6〜8mg/kgのL-ドーパメチルエステル+15mg/kgのベンセラジドを一日一回皮下注射された。2μlの分注液を右上行ドーパミン繊維束に全8から12μgについて二部位の各々に定位的に注射した。標的領域への6-OHDAの点滴は2分間にわたり、カニューレを注射部位でさらに2分間維持した。傷害の二から三週間後、ラットは、自動化された行動測定装置(ROTOMAX、AccuScan Instruments Inc.、オハイオ州コロンバス、米国)において、薬物誘発性の回旋行動について試験した。各ラットは、順応させるために、円筒状のガラスチャンバーに30分間置き、その後、4.0mg/kgのアンフェタミン(Sigma Chemical Co.、ミズーリ州セントルイス)を腹腔内(ip)投与した。アンフェタミン誘発の回旋行動を90分間監視し、90分間あたり少なくとも二百回の同側回旋を行うラットをさらなる試験に使用した。
【0074】
L-ドーパ誘発性AIMを図示されているように決定した。実験的投薬及び試験治療計画について図1を参照されたい。行動試験は、午前9時から10時の間に開始し、午前中に行った。(1)軸性ジストニア、首及び上半身の対側の捻じれ曲がった姿勢;(2)異常口舌運動、定型的顎運動及び対側性挺舌;並びに(3)異常前肢運動、反復性周期性運動又は対側前肢のジストニア姿勢及び/若しくは対側手足の掴み(grabbing)運動、を含む三つの異なるAIMサブタイプを測定した。例えば、Carta M, Lindgren HS, Lundblad M, Stancampiano R, Fadda F, Cenci MA (2006), Role of Striatal L-DOPA in the Production of Dyskinesia in 6-hydroxydopamine Lesioned Rats. J Neurochem 96:1718〜172; Cenci MA, Lee CS, Bjorklund A (1998) L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA; Eur J Neurosci 10:2694〜2706; Cenci MA, Whishaw IQ, Schallert T (2002) Animal models of neurological deficits: how relevant is the rat? Nat Rev Neurosci 3:574〜579; Bordia, T., Campos, C, Huang, L.Z. & Quik, M.,「Continuous And Intermittent Nicotine Treatment Reduces L-3,4-Dihydroxyphenylalanine (L-Dopa)-lnduced Dyskinesias In A Rat Model Of Parkinson's Disease」, J Pharmacol Exp Ther 327: 239〜47 (2008))を参照されたい。これらの三つのAIMサブタイプの各々について、以下のように0から4の等級でラットのスコアを記録した: 1=時折、2=頻繁、3=連続的であるが、感覚注意散漫によって中断された;及び4=連続的であり、重篤であり、感覚注意散漫によって中断されない。初期の20分の基準期間、及びL-ドーパ注射後の3時間、AIMについて動物を予備知識のない評価者によって評価した。AIMの異なるサブタイプの評価は、20分のセッション全体で行われ、このようにして動物あたり全九回のセッションの試験を行った。したがって、各動物について最大可能スコアは108であった(セッション一回あたりの最大スコア=12; 3時間全体でのセッション回数=9)。
【0075】
全ての統計学的分析は、GraphPad Prism(登録商標)(GraphPad Software,Inc、カリフォルニア州サンディエゴ)を用いて行われた。値は、示された数のラットの平均±SEMであり、一つから二つの別々の試験期間のデータを表す。グループ間の評価スコアにおける差異は、ノンパラメトリック検定(マン-ホイットニー(Mann-Whitney)検定)を用いて分析された。経時的試験については、反復測定分散分析(analysis of variance: ANOVA)、続いてボンフェローニ(Bonferroni)多重比較試験を用いた。0.05のレベルは有意であると考えられた。
【0076】
興味深いことに、0.1及び0.3mg/kg/日の投薬量の化合物A(PD1)は、多重評価の全体で、L-ドーパ誘発性AIMの全体又はいくつかのサブセット(軸、口及び/又は前肢)における有意な低減をもたらした(図2参照)。これは、第2及び第3の評価(0.1mg/kg/日)中、並びに第4の評価(0.3mg/kg/日)中の全AIMにおいて有意な減少を含み、第1及び第5のAIM評価中の全AIMにおいて減少する傾向にあった。重要なことには、化合物A(PD1)は、(すなわち、体重、体温、毛繕い、排尿、排便、分泌に対して)検出可能な有害影響をもたらさなかった。
【実施例3】
【0077】
運動機能
AIMを低減する薬物はパーキンソニズムを悪化させる可能性があるため、化合物A(PD1)の効果もまた、肢使用の非対照試験又は円筒試験を用いて、パーキンソン病ラットにおける運動機能について試験された(図3参照)。円筒試験は、片側黒質線条体損傷後の行動機能の指標として用い、先に記載したように探索的行動を分析した。動物を透明な円筒(20cm直径×30cm高さ)又は透明なケージに入れ、五分間評価した。円筒/ケージの後ろに鏡を置いて、評価者が、ラットが評価者から目を背けたときに前肢の運動を見ることができるようにした。壁探索(wall exploration)は、肢使用運動の総数と比較した障害のある前肢(傷害とは対側)の使用のパーセンテージに関して表した。二人の評価者が評価を行い、一人はラットの治療状況について予備知識がなかった。相関分析により、高い評価者間信頼性を得られた(R=0.99)。また、この試験は、異常を検出するためのドーパミン作動薬(すなわち、アンフェタミン)の使用を必要としないという利点を提供する。ラットを透明な円筒に入れ、それは、垂直探索、並びに評価された円筒に対する損傷を受けていない及び損傷を受けた前肢の接触のパーセンテージをもたらす(Cenci, M.A.及びM. Lundblad,「Post- Versus Presynaptic Plasticity In L-Dopa-lnduced Dyskinesia」,. J Neurochem, 99: 381〜392 (2006); Tillerson, J.L.ら,「Forced Limb-Use Effects On The Behavioral And Neurochemical Effects Of 6-Hydroxydopamine」, J Neurosci 21, 4427〜35 (2001);及びMeredith, G.E. & U.J. Kang,「Behavioral Models Of Parkinson's Disease In Rodents: A New Look At An Old Problem」, Mov Disord, 21: 1595〜606 (2006)。
【0078】
これらの結果は、化合物A(PD1)が、基準の運動機能を悪化させることもなく(オフL-ドーパ)、実験経過の全体で試験されたいずれかの投薬量でのL-ドーパ治療による肢使用の増大を悪化させることもないことを示す。実際に、改善の僅かな傾向が見られた。全体として、化合物A(PD1)は、パーキンソニズムを悪化させることなく、L-ドーパ誘発性AIMを低減させる有望な候補となる可能性がある(図3参照)。
【0079】
他に言及がなければ、化合物A、PD1、(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジンは、そのヘミガラクタル酸塩として投薬したが、しかしながら、投薬量は遊離塩基当量として計算された。
【0080】
観察された特定の薬理学的応答は、選択された特定の活性化合物、又は医薬としての担体が存在するかどうか、並びに製剤の種類及び採用される投与様式に従って及びそれに依存して変化する場合があり、これらの結果におけるこのように期待される変化又は差異は本発明の実施に従って考慮される。
【0081】
本発明の具体的な実施形態を本明細書に詳細に説明し、記載したが、本発明はこれに限定されるものでない。上記の詳細な説明は本発明の例示として与えられたものであって、本発明になんらかの限定を課するものとみなすべきではない。改変形態は当業者には明らかであり、本発明の精神から逸脱しない全ての改変形態は添付した特許請求の範囲内に含まれると意図している。
【特許請求の範囲】
【請求項1】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療する方法。
【請求項2】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させる方法。
【請求項3】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させる方法。
【請求項4】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、パーキンソニズムを改善する方法。
【請求項5】
L-ドーパ及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を用いて、L-ドーパに応答性の疾患を治療する方法。
【請求項6】
L-ドーパに応答性の疾患がパーキンソン病である、請求項5に記載の方法。
【請求項7】
α4β2* NNR及びα6β2* NNRの双方を標的とする化合物を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させる方法。
【請求項8】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療するための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用。
【請求項9】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させるための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用。
【請求項10】
L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させるための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用。
【請求項11】
パーキンソニズムを改善するための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用。
【請求項12】
L-ドーパに応答性の疾患を治療するための薬剤の製造におけるL-ドーパ及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の各々の使用。
【請求項13】
L-ドーパに応答性の疾患がパーキンソン病である、請求項12に記載の使用。
【請求項14】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させるための薬剤の製造における、α4β2* NNR及びα6β2* NNRの双方を標的とする化合物の使用。
【請求項15】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療するための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩。
【請求項16】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させるための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩。
【請求項17】
L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させるための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩。
【請求項18】
パーキンソニズムを改善するための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩。
【請求項19】
L-ドーパに応答性の疾患を治療するための、L-ドーパと併用する、化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩。
【請求項20】
L-ドーパに応答性の疾患がパーキンソン病である、請求項19に記載の化合物。
【請求項21】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させるための、α4β2* NNR及びα6β2* NNRの双方を標的とする化合物。
【請求項22】
a. L-ドーパ;
b. (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩;及び
c. L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその発症若しくは進行を遅延させるための治療計画に関する使用説明書
を含むキット。
【請求項23】
a. L-ドーパ;
b. (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩;及び
c. 一つ又は複数の医薬上許容される担体
を含む医薬組成物。
【請求項24】
a. L-ドーパ;及び
b. (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩、
を含む組合せ。
【請求項25】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩がL-ドーパと同時に投与される、
a. L-ドーパ;及び
b. (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩
を含む治療計画。
【請求項1】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療する方法。
【請求項2】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させる方法。
【請求項3】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させる方法。
【請求項4】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を投与することによって、パーキンソニズムを改善する方法。
【請求項5】
L-ドーパ及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩を用いて、L-ドーパに応答性の疾患を治療する方法。
【請求項6】
L-ドーパに応答性の疾患がパーキンソン病である、請求項5に記載の方法。
【請求項7】
α4β2* NNR及びα6β2* NNRの双方を標的とする化合物を投与することによって、L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させる方法。
【請求項8】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療するための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用。
【請求項9】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させるための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用。
【請求項10】
L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させるための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用。
【請求項11】
パーキンソニズムを改善するための薬剤の製造における(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の使用。
【請求項12】
L-ドーパに応答性の疾患を治療するための薬剤の製造におけるL-ドーパ及び(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩の各々の使用。
【請求項13】
L-ドーパに応答性の疾患がパーキンソン病である、請求項12に記載の使用。
【請求項14】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させるための薬剤の製造における、α4β2* NNR及びα6β2* NNRの双方を標的とする化合物の使用。
【請求項15】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療するための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩。
【請求項16】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を低減させるための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩。
【請求項17】
L-ドーパ誘発性ジスキネジア又は異常不随意運動の発症又は進行を遅延させるための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩。
【請求項18】
パーキンソニズムを改善するための化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩。
【請求項19】
L-ドーパに応答性の疾患を治療するための、L-ドーパと併用する、化合物(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩。
【請求項20】
L-ドーパに応答性の疾患がパーキンソン病である、請求項19に記載の化合物。
【請求項21】
L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその進行を遅延させるための、α4β2* NNR及びα6β2* NNRの双方を標的とする化合物。
【請求項22】
a. L-ドーパ;
b. (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩;及び
c. L-ドーパ誘発性ジスキネジア又は異常不随意運動を治療、低減、又はその発症若しくは進行を遅延させるための治療計画に関する使用説明書
を含むキット。
【請求項23】
a. L-ドーパ;
b. (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩;及び
c. 一つ又は複数の医薬上許容される担体
を含む医薬組成物。
【請求項24】
a. L-ドーパ;及び
b. (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩、
を含む組合せ。
【請求項25】
(R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩がL-ドーパと同時に投与される、
a. L-ドーパ;及び
b. (R)-5-((E)-2-ピロリジン-3-イルビニル)ピリミジン又は医薬上許容されるその塩
を含む治療計画。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2012−530707(P2012−530707A)
【公表日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−516189(P2012−516189)
【出願日】平成22年6月15日(2010.6.15)
【国際出願番号】PCT/US2010/038605
【国際公開番号】WO2010/147938
【国際公開日】平成22年12月23日(2010.12.23)
【出願人】(501054735)ターガセプト,インコーポレイテッド (37)
【Fターム(参考)】
【公表日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成22年6月15日(2010.6.15)
【国際出願番号】PCT/US2010/038605
【国際公開番号】WO2010/147938
【国際公開日】平成22年12月23日(2010.12.23)
【出願人】(501054735)ターガセプト,インコーポレイテッド (37)
【Fターム(参考)】
[ Back to top ]

