GATA阻害剤を有効成分とする有機イオントランスポーター発現増強剤及びGATA発現抑制剤
【課題】本発明者らは、腎機能の評価であるeGFRの低下と共に蓄積する尿毒症物質を同定し、尿毒症物質のひとつであるインドキシル硫酸(IS)が、GATA3の発現を増強すること及びSLCO4C1トランスポーターの発現を抑制することにより、エリスロポエチン産生を抑制し、CKDの病態に関与していることを明らかにしていた。そこで、本発明の課題は、有機イオントランスポーターの発現を増強することや、GATAの発現を抑制することによる尿毒症の予防・治療剤を開発することにある。
【解決手段】本発明者らは、GATA阻害剤であるN,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジンが、SLCO4C1トランスポーター遺伝子の発現を増強することや、GATA3遺伝子の発現を抑制することを見いだし、本発明を完成するに至った。
【解決手段】本発明者らは、GATA阻害剤であるN,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジンが、SLCO4C1トランスポーター遺伝子の発現を増強することや、GATA3遺伝子の発現を抑制することを見いだし、本発明を完成するに至った。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、GATA阻害剤を有効成分とすることを特徴とする有機イオントランスポーター発現増強剤及び尿毒症治療・予防薬、並びに有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法などに関する。また、GATA阻害剤を有効成分とすることを特徴とするGATA発現抑制剤及び尿毒症治療・予防薬、並びにGATA遺伝子の発現抑制剤のスクリーニング方法などに関する。
【背景技術】
【0002】
腎不全患者等の腎疾患を有する患者、特に腎透析を受ける患者の数は年々増加の一途を辿っている。腎臓の機能の一つは、血液中に流れている薬物や尿毒症物質などを取り込み、尿中に送り出して体外に排泄する排泄作用である。そのため腎機能が低下すると、薬物や尿毒症物質が体内に蓄積しやすくなり、腎臓の細胞が傷害され腎機能のさらなる低下を引き起こす。また、腎機能の低下した人は、正常の人と較べて何倍も脳卒中や心筋梗塞になりやすいことが知られている。したがって尿毒症物質などを排泄する機能を維持することは、腎障害を悪化させない上で非常に重要な意味を持つと同時に、脳卒中や心臓病の予防という点でも重要である。現在20万人の患者が、尿毒症物質などを人工的に除去するために透析治療を行っており、さらに毎年3万人以上が新たに透析導入に至っている。透析療法には、一人あたり年間約500万円の費用がかかるため、20万人に対して約1兆円の医療費が恒常的に必要となり社会的な問題でもある。
【0003】
近年、慢性腎臓病(Chronic Kidney Disease:CKD)という疾患概念が提唱され、その予防・治療の重要性に対する認識が高まりを見せている。CKDとは、腎障害を示す所見や腎機能低下が慢性的に続く状態で、適切な治療を行わずにいると末期腎不全となり、人工透析や腎移植を受けなければ生きられなくなる疾患である。末期腎不全は全世界的に増え続けている。現在、日本には約1,330万人のCKD患者がいるといわれており、成人の約8人に1人にあたる数である。また、人工透析を受けている患者も、前述したように増え続けているのが現状であり、CKDの早期発見、早期治療が急務の課題となっている。このような状況下において、腎不全やCKD等の腎疾患の症状の予防法や、そのような症状を緩和し、透析導入を遅らせる治療法が開発されれば、患者のQOL(クオリティオブライフ)に資するだけでなく、医療費の大幅な削減が可能となり社会に大きく貢献することが期待されている。
【0004】
CKDにおいて腎性貧血は主要な合併症の一つであり、腎性貧血の病態は、内因性エリスロポエチン(Epo)産生の低下を基盤とすることが知られている。腎機能の低下がどのようにエリスロポエチン産生に影響を及ぼすかは明らかになっていないが、血液透析によって腎性貧血が改善したという報告があることから、尿毒症物質がその原因の一つである可能性が示唆されている。エリスロポエチンは赤血球の産生を促進する造血促進因子の一つであり、エリスロポエチンの欠乏は貧血の一因となる。エリスロポエチンは主に腎臓で生成されるため、慢性腎不全によりエリスロポエチンの発現量が低下し、貧血が起こる。そのため、腎性貧血の主な治療法はエリスロポエチンの投与であるが、エリスロポエチン製剤は高価で、頻回の注射が必要であるなどの問題が指摘されている。
【0005】
エリスロポエチンの発現は、エリスロポエチン遺伝子の上流のGATA配列にGATA転写因子結合することにより、負に制御されている。N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン(K−7174ともいう)はGATAのGATA配列への結合活性を阻害する、GATA阻害剤として使用されている。N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンはGATAの脱アセチル化を特異的に抑制するため、GATAの転写因子としての活性が抑制されると考えられており、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンによりGATA結合活性が抑制されることでエリスロポエチン遺伝子発現が促進されることが知られている。そして、腎不全で蓄積されるL−NMMA(NG-monomethyl L-arginine)により、GATA結合活性が亢進することにより、エリスロポエチン遺伝子発現が抑制されて腎性貧血が発症するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンによりこのエリスロポエチン遺伝子発現抑制が解除されることが示唆されている(非特許文献1、2)。
【0006】
N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン、その酸付加塩、又はこれらの水和物は、阻害剤脳保護剤(特許文献1)や細胞接着阻害剤、細胞浸潤阻害剤、抗アレルギー剤、抗喘息剤及び抗炎症剤(特許文献2)、エリスロポエチン産生促進剤(特許文献3)、前駆脂肪細胞分化抑制剤(特許文献4)などとして有用であることが知られている。しかしながら、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンが有機イオントランスポーターの発現やGATAの発現にどのような作用をするかは全く知られていなかった。
【0007】
これまで本発明者らは、ヒト腎臓近位尿細管血管側にのみ発現する有機アニオントランスポーターSLCO4C1(solute carrier organic anion transporter family, member 4C1;別名OATP(organic anion transport- ing polypeptide)−Rとも呼ばれる)が尿毒症物質の排泄に関わっていることを明らかにし、SLCO4C1の発現を調節することで尿毒症物質排泄を制御するという新たなCKD治療の可能性を報告した(非特許文献3)。
【0008】
また、本発明者らは、キャピラリー電気泳動質量分析計(CE−MS)を用いてCKD患者41名の血清を解析し、腎機能の評価である推定糸球体濾過量(estimated glomerular filtration rate:eGFR)の低下とともに有意に蓄積する物質を検出したことを報告している(非特許文献4)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開平3−2144号公報
【特許文献2】特開平9−143075号公報
【特許文献3】WO/2004/002493号パンフレット
【特許文献4】特開2009−51796号公報
【非特許文献】
【0010】
【非特許文献1】Imagawa S. et al., Kidney International. 61. 396-404 (2002)
【非特許文献2】今川 重彦、赤血球産生阻害 −腎性貧血の新規治療− 臨牀透析 Vol.21 No.9(14) 2005年
【非特許文献3】Toyohara T. et al., J Am Soc Nephrol., 20: 2546-2555 (2009)
【非特許文献4】Toyohara T. et al., Hypertens Res. 2010 Sep;33(9):944-52. (2010)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明者らは、腎機能の評価であるeGFRの低下と共に蓄積する尿毒症物質を同定し(特願2009−205033、非特許文献4)、尿毒症物質のひとつであるインドキシル硫酸(IS;Indoxyl Sulfate)が、GATA3の発現を増強すること及びSLCO4C1トランスポーターの発現を抑制することにより、エリスロポエチン産生を抑制し、CKDの病態に関与していることを明らかにした(特願2010−231709)。そこで、本発明の課題は、有機イオントランスポーターの発現増強や、GATAの発現抑制などによる、腎性貧血の予防・治療剤を開発することにある。
【課題を解決するための手段】
【0012】
本発明者らは、GATA阻害剤であるN,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジン(以下、K−7174ということもある)が、有機イオントランスポーターの発現を増加させることや、尿毒症物質による有機イオントランスポーターの発現抑制作用を解除することや、GATA発現を抑制することや、尿毒症物質によるGATA発現増強作用を解除することを見いだし、本発明を完成するに至った。
【0013】
すなわち、本発明は[1]GATA阻害剤を有効成分とすることを特徴とする有機イオントランスポーター発現増強剤や、[2]尿毒症物質による有機イオントランスポーター発現抑制の解除作用を有することを特徴とする前記[1]記載の有機イオントランスポーター発現増強剤や、[3]GATA阻害剤が、N,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジンであることを特徴とする前記[1]又は[2]記載の有機イオントランスポーター発現増強剤や、[4]有機イオントランスポーターが、ヒト有機アニオントランスポーターSLCO4C1であることを特徴とする前記[1]〜[3]のいずれか記載の有機イオントランスポーター発現増強剤や、[5]前記[1]〜[4]のいずれか記載の有機イオントランスポーター発現増強剤を含むことを特徴とする尿毒症治療・予防薬に関する。
【0014】
また、本発明は、[6]以下の(a)〜(e)の工程を備えたことを特徴とする有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法;(a)GATA結合配列を含む有機イオントランスポーター遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;(b)構築したレポータープラスミドを、有機イオントランスポーター遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;(c)調製した形質転換細胞株に被検物質を接触させる工程;(d)レポーター遺伝子の発現の程度を測定する工程;(e)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が大きい場合、被検物質を有機イオントランスポーター遺伝子の発現を増強する活性を有する物質と判定する工程;や、[7]有機イオントランスポーターが、ヒト有機アニオントランスポーターSLCO4C1であることを特徴とする前記[6]記載のスクリーニング方法や、[8]工程(b)において、構築したレポータープラスミドに加えてGATA発現プラスミドを用いることを特徴とする前記[6]又は[7]記載のスクリーニング方法や、[9]工程(c)において、尿毒症物質又はGATA結合促進物質の存在下で、被験物質を接触させることを特徴とする前記[6]〜[8]のいずれか記載のスクリーニング方法や、[10]レポーター遺伝子がルシフェラーゼ遺伝子であることを特徴とする前記[6]〜[9]のいずれかに記載のスクリーニング方法に関する。
【0015】
また、本発明は[11]GATA阻害剤を有効成分とすることを特徴とするGATA発現抑制剤や、[12]尿毒症物質によるGATA発現増強の解除作用を有することを特徴とする前記[11]記載のGATA発現抑制剤や、[13]GATA阻害剤が、N,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジンであることを特徴とする前記[11]又は[12]記載のGATA発現抑制剤や、[14]前記[11]〜[13]のいずれか記載のGATA発現抑制剤を含むことを特徴とする尿毒症治療・予防薬に関する。
【0016】
また、本発明は[15]以下の(a’)〜(e’)のステップを備えたことを特徴とするGATA遺伝子の発現抑制剤のスクリーニング方法;(a’)GATA遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;(b’)構築したレポータープラスミドを、GATA遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;(c’)調製した形質転換細胞株に被検物質を接触させる工程;(d’)レポーター遺伝子の発現の程度を測定する工程;(e’)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が小さい場合、被検物質をGATA遺伝子の発現を抑制する活性を有する物質と判定する工程;や、[16]工程(c’)において、尿毒症物質の存在下に被験物質を接触させることを特徴とする前記[15]記載のGATA遺伝子の発現抑制剤のスクリーニング方法や、[17]レポーター遺伝子がルシフェラーゼ遺伝子であることを特徴とする前記[15]又は[16]に記載のGATA遺伝子の発現抑制剤のスクリーニング方法に関する。
【発明の効果】
【0017】
本発明のGATA阻害剤を有効成分とする有機イオントランスポーター発現増強剤によれば、有機イオントランスポーターの発現を増強し、尿毒症を治療及び/又は予防することができ、本発明の有機イオントランスポーター遺伝子の発現増強剤スクリーニング方法を用いて新規の有機イオントランスポーター遺伝子発現増強剤を同定することができる。また、本発明のGATA阻害剤を有効成分とするGATA発現抑制剤によれば、GATA3発現を抑制し、尿毒症を治療及び/又は予防することができ、本発明のGATA遺伝子の発現抑制剤スクリーニング方法を用いて新規のGATA遺伝子発現抑制剤を同定することができる。
【図面の簡単な説明】
【0018】
【図1】ACHN細胞においてGATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)がSLCO4C1のmRNA発現を増強することを示す図である。
【図2】HK−2細胞においてGATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)がSLCO4C1のmRNA発現を増強することを示す図である。
【図3】ACHN細胞においてインドキシル硫酸(IS)がSLCO4C1のmRNA発現を抑制し、GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はそのインドキシル硫酸によるSLCO4C1のmRNA発現抑制作用を解除することを示す図である。
【図4】HK−2細胞においてインドキシル硫酸(IS)がSLCO4C1のmRNA発現を抑制し、GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はそのインドキシル硫酸によるSLCO4C1のmRNA発現抑制作用を解除することを示す図である。
【図5】HK−2細胞においてGATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)がGATA3のmRNA発現を抑制し、インドキシル硫酸(IS)がGATA3のmRNA発現を増強する。そしてGATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はインドキシル硫酸によるGATA3のmRNA発現増強作用を解除することを示す図である。
【図6】ACHN細胞においてインドキシル硫酸(IS)がGATA3のmRNA発現を増強し、GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はそのインドキシル硫酸によるGATA3のmRNA発現増強作用を解除することを示す図である。
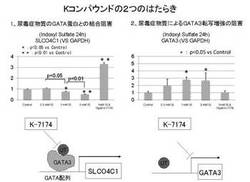
【図7】GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)がGATA3の発現及び機能の阻害を介して、SLCO4C1の発現を増強するというGATA仮説を表す図である。
【図8】Kコンパウンド(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)が、GATA3によるSLCO4C1の発現抑制を阻害すること、及びGATA3の発現を抑制することの2つの働きを有することを表す図である。
【図9】インドキシル硫酸はSLCO4C1の発現を抑制し、GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はインドキシル硫酸によるSLCO4C1発現抑制作用を解除することをレポーターアッセイにより調べた結果を示す図である(左のグラフ)。インドキシル硫酸はGATA3の発現を増強し、GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はインドキシル硫酸によるGATA3発現増強作用を解除することをレポーターアッセイにより調べた結果を示す図である(右のグラフ)。
【図10】Kコンパウンド(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)が、インドキシル硫酸や1−メチルアデノシンによるエリスロポイエチンやSLCO4C1の転写抑制を解除することを表す図である。
【発明を実施するための形態】
【0019】
本発明の有機イオントランスポーター発現増強剤やGATA発現抑制剤としては、GATA阻害剤を有効成分とするものであれば特に制限されず、ここでGATA阻害剤としては、GATAの転写因子としての機能を阻害、好ましくは特異的に阻害する物質であれば特に制限されず、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンもしくはそれらの酸付加塩、又はこれらの溶媒和物を挙げることができ、好ましくはGATA特異的阻害剤であるN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンを挙げることができる(化1)。化合物がGATA阻害剤であるかどうかは、SLCO4C1のレポーターアッセイにおいて、コントロールと比べてSLCO4C1のレポーター活性を増強する、あるいはGATA3のレポーターアッセイにおいて、コントロールと比べてGATA3のレポーター活性を抑制することにより判定することができる。本発明のGATA阻害剤N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、市販されている物質を用いてもよいし、適当な化学物質を原料として公知の反応を用いて合成してもよい(例えば、特開平9−143075に記載の方法などを利用することができる)。
【0020】
【化1】

【0021】
上記GATAとしては、GATA1、GATA2、GATA3、GATA4、GATA5、GATA6を挙げることができ、中でもGATA3を好適に示すことができる。かかるGATA3としては、例えばヒトGATA3遺伝子(NM_001002295;GenBankアクセッション番号)、マウスGATA3遺伝子(NM_008091)やラットGATA3遺伝子(NM_133293)等から発現するタンパク質などを挙げることができる。またこれらの配列情報に基づいて、適当なプライマーを設計することによって、これらの遺伝子を単離することもできるし、単離したこれらの遺伝子を適当な発現ベクターに組み込んで該ベクターを適当な細胞に導入して発現させたり、それによりGATAタンパク質を入手することもできる。
【0022】
本発明の有機イオントランスポーター発現増強剤としては、尿毒症物質による有機イオントランスポーター発現抑制の解除作用を有するものが好ましく、また本発明のGATA発現抑制剤としては、尿毒症物質によるGATA発現増強の解除作用を有するものが好ましい。
【0023】
本発明の尿毒症治療・予防薬としては、上記本発明の有機イオントランスポーター発現増強剤やGATA発現抑制剤を含むもの、すなわちN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン等のGATA阻害剤を有効成分として含むものであれば特に制限されず、その有効量をヒトを含む哺乳動物に投与することによって、有機イオントランスポーターの発現量を増強したり、尿毒症物質による有機イオントランスポーター発現抑制を解除したり、GATA発現を抑制したり、尿毒症物質によるGATA発現増強を解除することができるものであり、賦形剤等の担体と併用することにより薬剤やサプリメントとすることができる。この薬剤やサプリメントを腎不全のヒトを含む哺乳動物に投与することによって、生体内の有機イオントランスポーターの発現量を増加させることにより、尿毒症物質の排出を増加させ、尿毒症を治療及び/又は予防に利用することができる。なお、本明細書において「尿毒症を治療・予防薬」とは、尿毒症治療及び/又は予防薬を意味し、また、GATA阻害剤を有効成分とする有機イオントランスポーター発現増強剤の有効量と担体とを投与することを特徴とする尿毒症を治療及び/又は予防方法や、GATA阻害剤を有効成分とするGATA発現抑制剤の有効量と担体とを投与することを特徴とする尿毒症を治療及び/又は予防方法や、GATA阻害剤を有効成分とする有機イオントランスポーター発現増強剤を尿毒症の治療及び/又は予防薬を製造するために用いる方法や、GATA阻害剤を有効成分とするGATA発現抑制剤を尿毒症の治療及び/又は予防薬を製造するために用いる方法を、本発明とすることもできる。
【0024】
本発明における有機イオントランスポーターとしては、SLCO4C1(solute carrier organic anion transporter family, member 4C1;別名OATP(organic anion transport- ing polypeptide)−Rとも呼ばれる)、OCT(organic cation transporter)1、OCT2及びOCT3、OCTN(novel organic cation transporter)1やOCTN2、OAT(organic anion transporter)1、OAT2及びOAT3を挙げることができ、中でも有機アニオントランスポーターであるSLCO4C1を好適に示すことができる。かかるSLCO4C1としては、例えばヒトSLCO4C1遺伝子(NM_180991;GenBankアクセッション番号)、マウスSLCO4C1遺伝子(NM_172658)、ラットSLCO4C1遺伝子(NM_001002024)及びこれらから発現するタンパク質などを挙げることができる。上記SLCO4C1は、腎臓において胆汁酸、ビリルビン、ジゴキシンやウアバイン、cAMP等の尿毒症物質を体外に排出するトランスポーターであるため、本発明のGATA阻害剤を有効成分とする有機イオントランスポーターSLCO4C1の発現増強剤は、尿毒症の治療・予防薬として有利に用いることができる。
【0025】
本発明の有機イオントランスポーターの発現増強剤やGATA発現抑制剤や尿毒症治療・予防薬は、有機イオントランスポーター遺伝子の発現を増強する活性やGATAの発現を抑制する活性や尿毒症治療・予防効果を阻害しない限り、他に任意の成分を配合することができる。例えば本発明の尿毒症治療・予防薬の場合、GATA阻害剤以外に公知の尿毒症治療・予防薬を配合してもよいし、さらにこれら公知の尿毒症治療・予防薬との併用療法も可能である。また、本発明の有機イオントランスポーター遺伝子の発現増強剤の場合、GATA阻害剤以外の有機イオントランスポーター遺伝子の発現増強剤を配合してもよいし、有機イオントランスポーター遺伝子の発現増強手段と併用してもよい。また、GATA遺伝子の発現抑制剤の場合、GATA阻害剤以外のGATA遺伝子の発現抑制剤を配合してもよいし、ATA遺伝子の発現抑制手段と併用してもよい。
【0026】
本発明の有機イオントランスポーターの発現増強剤やGATA発現抑制剤や尿毒症治療・予防薬の投与形態は特に制限されず、経口的又は非経口的に投与することができ、例えば粉末、顆粒、錠剤、糖衣錠、カプセル剤、スティック剤、シロップ剤、懸濁液等の剤型で経口的に投与することができ、あるいは、例えば溶液、乳剤、懸濁液等の剤型にしたものを注射の型で投与する他、スプレー剤の型で鼻孔内投与したり坐剤等により非経口投与することもできるが、投与の簡便性の観点から経口的に投与することが好ましい。有効成分であるGATA阻害剤の配合量は、尿毒症の予防効果や治療効果が得られる限り特に制限されず、製剤の投与量等の条件に応じて適切な配合量を選択することが可能である。
【0027】
本発明の尿毒症予防・治療剤は、有効成分であるGATA阻害剤に通常薬学的に許容される担体、結合剤、安定化剤、賦形剤、希釈剤、pH緩衝剤、崩壊剤、可溶化剤、溶解補助剤、等張剤などの各種調剤用配合成分を配合して製剤の形態で提供される。例えば、経口投与する場合、微晶質セルロース、クエン酸ナトリウム、炭酸カルシウム、リン酸ジカリウム、グリシンのような種々の賦形剤を、澱粉、好適にはとうもろこし、じゃがいも又はタピオカの澱粉、及びアルギン酸やある種のケイ酸複塩のような種々の崩壊剤、及びポリビニルピロリドン、蔗糖、ゼラチン、アラビアゴムのような顆粒形成結合剤と共に使用することができる。また、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム、タルク等の滑沢剤も錠剤形成に非常に有効であることが多い。同種の固体組成物をゼラチンカプセルに充填して使用することもできる。これに関連して好適な物質としてラクトース又は乳糖の他、高分子量のポリエチレングリコールを挙げることができる。経口投与用として水性懸濁液とする場合、GATA阻害剤を各種の甘味料、香味料、着色料、乳化剤、懸濁化剤と併用し、水、エタノール、プロピレングリコール、グリセリン等の希釈剤と共に使用することもできる。
【0028】
本発明の尿毒症治療・予防薬の投与量は、対象の種類(動物又はヒト)、対象の年齢、個人差、病状、投与形態等により適宜選定することができる。本発明の有機イオントランスポーター発現増強剤やGATA発現抑制剤の投与量についても、有機イオントランスポーター遺伝子の発現が増強、あるいはGATA遺伝子の発現が抑制され得る限り特に制限はされず、種々の条件に応じて適切な投与量を選択することが可能である。例えば、細胞や組織などにインビトロで適用する場合は、培養液などに有効成分であるN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンを、最終濃度が0.01〜1000μM、好ましくは0.1〜500μM、さらに好ましくは1〜50μMとなるように添加し、0.01〜120時間、好ましくは1〜96時間、さらに好ましくは6〜84時間、もっとも好ましくは12〜72時間インキュベートすることができる。またヒトに経口投与する場合の投与量は、例えば、有効成分であるN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンを一日0.01〜1000mg、好ましくは0.1〜500mg、さらに好ましくは1〜100mgを1〜3回に分けて投与するのが好ましく、また症状により投与量を適宜増減してもよい。なお、本明細書における尿毒症治療・予防薬の投与対象は、ヒトだけでなく、他の非ヒト動物含むが、ヒト及び非ヒト哺乳動物が好ましく、ヒトがより好ましい。
【0029】
本発明の尿毒症の予防・治療剤の対象となる尿毒症としては、GATA阻害剤を投与することにより、尿毒症の予防効果や治療効果を発揮する限り特に制限はなく、例えば、急性腎不全、急性尿細管壊死、腎性貧血、慢性腎不全、尿細管間質障害、急性腎炎、慢性腎炎、ネフローゼ、腎機能障害、糖尿病性腎症、動脈硬化性腎症などが挙げられるが、なかでも腎性貧血に対して優れた予防効果や治療効果を発揮する。
【0030】
本発明の有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法としては、(a)GATA結合配列を含む有機イオントランスポーター遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;(b)構築したレポータープラスミドを、有機イオントランスポーター遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;(c)調製した形質転換細胞株に被検物質を接触させる工程;(d)レポーター遺伝子の発現の程度を測定する工程;(e)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が大きい場合、被検物質を有機イオントランスポーター遺伝子の発現を増強する活性を有する物質と判定する工程;を備えていれば特に制限されない。
【0031】
上記工程(a)におけるGATA結合配列を含む有機イオントランスポーター遺伝子の5’上流転写領域としては、ヒト有機イオントランスポーター遺伝子の転写開始点より上流−4000塩基から下流のGATA結合配列(5’−(A又はT)GATA(A又はG)−3’)を含む領域を例示することができる。かかる配列の下流にインフレームでレポーター遺伝子を連結したレポーター遺伝子を組み込んだプラスミドは、有機イオントランスポーター遺伝子の転写活性を反映してレポーター遺伝子を発現するため、レポーター遺伝子の発現を検出することにより有機イオントランスポーター遺伝子の転写レベルを測定することができる。上記有機イオントランスポーター遺伝子を発現し得るヒト細胞株としては、本来有機イオントランスポーターを発現しているヒト細胞株の他、転写制御領域と一緒に有機イオントランスポーター遺伝子を発現ベクターに導入し、人工的に有機イオントランスポーターを発現し得るヒト細胞株を挙げることができる。なお、有機イオントランスポーターを発現し得るように形質転換する際に用いるヒト由来の細胞株は、本来有機イオントランスポーターを発現していないヒト細胞株であってもよいし、本来有機イオントランスポーターを発現しているヒト細胞株であってもよい。有機イオントランスポーター遺伝子が組み込まれた発現ベクターを、本来有機イオントランスポーターを発現しているヒト細胞株に導入すると、有機イオントランスポーターがより安定的に発現する点で好ましい。
【0032】
例えば、有機イオントランスポーターがSLCO4C1の場合は、工程(a)におけるGATA結合配列を含むSLCO4C1遺伝子の5’上流転写領域としては、ヒトSLCO4C1遺伝子の転写開始点より上流−4000塩基から下流のGATA結合配列(5’−(A又はT)GATA(A又はG)−3’)を含む領域、好適にはヒトSLCO4C1遺伝子の翻訳開始点より上流−3886塩基から下流+110塩基までの配列などを例示することができる。かかる配列の下流にインフレームでレポーター遺伝子を連結したレポーター遺伝子を組み込んだプラスミドは、SLCO4C1遺伝子の転写活性を反映してレポーター遺伝子を発現するため、レポーター遺伝子の検出することによりSLCO4C1遺伝子の転写レベルを測定することができる。また、SLCO4C1遺伝子を発現し得るヒト細胞株としては、本来SLCO4C1を発現しているヒト細胞株の他、転写制御領域と一緒にSLCO4C1遺伝子を発現ベクターに導入し、人工的にSLCO4C1を発現し得るヒト細胞株を挙げることができ、より具体的には、ヒト胎児腎臓由来細胞(HEK293細胞)や本来SLCO4C1を発現しているACHN細胞株等の腎癌由来のヒト細胞株や、ヒト近位尿細管由来細胞(HK−2)等のヒト由来の細胞株の他、SLCO4C1を発現し得るように形質転換されたヒト由来の細胞株を挙げることができるが、ACHN細胞やHK−2細胞等のヒト細胞株をより好ましく挙げることができる。なお、SLCO4C1を発現し得るように形質転換する際に用いるヒト由来の細胞株は、本来SLCO4C1を発現していないヒト細胞株であってもよいし、本来SLCO4C1を発現しているヒト細胞株であってもよい。SLCO4C1遺伝子が組み込まれた発現ベクターを、本来SLCO4C1を発現しているヒト細胞株に導入すると、SLCO4C1がより安定的に発現する点で好ましい。GATA結合配列を含むヒトSLCO4C1遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子は、哺乳動物細胞等で発現するプラスミドベクターにインテグレートされ、公知の方法で細胞株に導入され、形質転換細胞株を調製することができる。
【0033】
本発明の有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法においては、レポータープラスミドに加えて、GATA発現プラスミドを細胞内に導入してスクリーニングを行うこともできる。かかるGATA発現プラスミドとしては、哺乳動物細胞株においてGATAタンパク質の全長あるいは一部を発現するものであれば特に制限されず、GATAとしては、GATA1、GATA2、GATA3、GATA4、GATA5、GATA6を挙げることができ、中でもGATA3を好適に示すことができる。かかるGATA3としては、例えばヒトGATA3遺伝子(NM_001002295;GenBankアクセッション番号)、マウスGATA3遺伝子(NM_008091)やラットGATA3遺伝子(NM_133293)から発現するタンパク質などを挙げることができる。これらの配列情報に基づいて、適当なプライマーを設計することによって、これらの遺伝子を単離することができ、単離したこれらの遺伝子の配列を適当な発現ベクターに組み込んで該ベクターを適当な細胞に導入して発現させることができる。
【0034】
本発明の有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法においては、尿毒症物質を細胞培養液に添加して、尿毒症物質の存在下でスクリーニングを行うこともできる。かかる尿毒症物質としては、腎臓の機能低下とともに有意に蓄積する物質であれば特に制限されず、例えば腎機能のマーカーのひとつである推定糸球体濾過量(estimated glomerular filtration rate:eGFR)の低下とともに有意に蓄積する物質、クレアチニン(creatinine)、シンメトリックジメチルアルギニン(SDMA)、グアジニノコハク酸(guanidino succinate)、シトルリン(citrulline)、1−メチルアデノシン(1-methyladenosine)、N−アセチルグルコサミン(N-acetylgulusosamine)、γ−ブチロベタイン(γ-butyrobetaine)、オフタルム酸(ophthalmate)、3−メチルヒスチジン(3-methylhistidine)、ヒドロキシプロリン(hydroxyproline)、トリメチルアミン−N−オキシド(trimethylamine N-oxide)、アラントイン(allantoin)、アシンメトリックジメチルアルギニン(ADMA)、N−ε−アセチルリジン(N-epsilon-acetyllysine)、キヌレニン(kynurenine)、シトシン(cytosine)、インドール−3−酢酸(indole-3-acetate)、ヒポタウリン(hypotaurine)、N,N−ジメチルグリシン(n,n-dimethylglycine)、7−メチルグアニン(7-methylguanine)、メチオニンスルホキシド(methionine sulfoxide)、アスパラギン(Asn)、イセチオン酸(isethionate)、グルコン酸(gluconate)、トランス−アコニット酸(trans-aconitate)、ピメリン酸(pimelate)、3−インドキシル硫酸(3-indoxyl sulfate)、イソクエン酸(isocitrate)、N−アセチル−β−アラニン(N-acetyl-beta-alanine)、N−アセチルグルタミン酸(N-acetylglutamate)、セバシン酸(sebacate)、4−オキソペンタン酸(4-oxopentanoate)、シス−アコニット酸(cis-aconitate)、ホモバニリン酸(homovanillate)、アジピン酸(adipate)、シトラマレイン酸(citramalate)、2−イソプロピルマレイン酸(2-isopropylmalate)、トレオン酸(threonate)、馬尿酸(hippurate)、N−アセチルアスパラギン酸(N-acetylaspartate)、4−ヒドロキシ−3−メトキシマンデル酸(4-hydroxy-3-methoxymandelate)、オキサミン酸(oxamate)、グルタル酸(glutarate)、アゼテート(azetate)、フタル酸(phthalate)、クエン酸(citrate)、マロン酸(malonate)、シトラコン酸(citraconate)、キナ酸(quinate)、コハク酸(succinate)、システイン−S−硫酸(cysteine S-sulfate)、4−ヒドロキシ−3−メトキシ安息香酸(4-hydroxy-3-methoxybenzoate)、胆汁酸、ビリルビン、ジゴキシンやウアバイン、cAMPなどを挙げることができ、その中でも3−インドキシル硫酸(インドキシル硫酸、ISということもある)及び1−メチルアデノシンを好適に例示することができる。また、GATA結合促進物質としてはGATAのGATA結合配列への結合を促進する物質であれば特に制限されず、例えばインドキシル硫酸及び1−メチルアデノシンを例示することができる。
【0035】
次に、本発明のGATA遺伝子の発現増強剤のスクリーニング方法としては、(a’)GATA遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;(b’)構築したレポータープラスミドを、GATA遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;(c’)調製した形質転換細胞株に被検物質を接触させる工程;(d’)レポーター遺伝子の発現の程度を測定する工程;(e’)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が小さい場合、被検物質をGATA遺伝子の発現を抑制する活性を有する物質と判定する工程;を備えていれば特に制限されない。
【0036】
上記工程(a’)におけるGATA遺伝子の5’上流転写領域としては、ヒトGATA遺伝子のプロモーター領域、好適にはヒトGATA遺伝子の翻訳開始点より上流−4000塩基から下流の配列などを例示することができる。かかる配列の下流にインフレームでレポーター遺伝子を連結したレポーター遺伝子を組み込んだプラスミドは、GATA遺伝子の転写活性を反映してレポーター遺伝子を発現するため、レポーター遺伝子の発現を検出することによりGATA遺伝子の転写レベルを測定することができる。上記GATA遺伝子を発現し得るヒト細胞株としては、本来GATAを発現しているヒト細胞株の他、転写制御領域と一緒にGATA遺伝子を発現ベクターに導入し、人工的にGATAを発現し得るヒト細胞株を挙げることができる。なお、GATAを発現し得るように形質転換する際に用いるヒト由来の細胞株は、本来GATAを発現していないヒト細胞株であってもよいし、本来GATAを発現しているヒト細胞株であってもよい。GATA遺伝子が組み込まれた発現ベクターを、本来GATAを発現しているヒト細胞株に導入すると、GATAがより安定的に発現する点で好ましい。
【0037】
なおGATAがGATA3の場合は、工程(a’)GATA3遺伝子の5’上流転写領域としては、ヒトGATA3遺伝子の転写開始点より上流−4000塩基から下流、好ましくは翻訳開始点より上流−3500塩基から下流+110塩基までの配列などを例示することができる。かかる配列の下流にインフレームでレポーター遺伝子を連結したレポーター遺伝子を組み込んだプラスミドは、GATA3遺伝子の転写活性を反映してレポーター遺伝子を発現するため、レポーター遺伝子の発現を検出することによりGATA3遺伝子の転写レベルを測定することができる。そしてGATA3遺伝子を発現し得るヒト細胞株としては、本来GATA3を発現しているヒト細胞株の他、転写制御領域と一緒にGATA3遺伝子を発現ベクターで導入し、人工的にGATA3を発現し得るヒト細胞株を挙げることができ、より具体的には、ヒト胎児腎臓由来細胞(HEK293細胞)や本来GATA3を発現しているヒトACHN細胞株等の腎癌由来のヒト細胞株や、ヒト近位尿細管由来細胞(HK−2)等のヒト由来の細胞株の他、GATA3を発現し得るように形質転換されたヒト由来の細胞株を挙げることができるが、ヒトACHN細胞やHK−2細胞等のヒト細胞株をより好ましく挙げることができる。なお、GATA3を発現し得るように形質転換する際に用いるヒト由来の細胞株は、本来GATA3を発現していないヒト細胞株であってもよいし、本来GATA3を発現しているヒト細胞株であってもよい。GATA3遺伝子が組み込まれた発現ベクターを、本来GATA3を発現しているヒト細胞株に導入すると、GATA3がより安定的に発現する点で好ましい。ヒトGATA3遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子は、哺乳動物細胞等で発現するプラスミドベクターにインテグレートされ、公知の方法で前記GATA3遺伝子を発現し得るヒト細胞株に導入され、形質転換細胞株を調製することができる。
【0038】
また、上記レポーター遺伝子としては、ルシフェラーゼ遺伝子、抗生物質耐性遺伝子、重金属耐性遺伝子等、より具体的には、ホタルルシフェラーゼ遺伝子、細菌ルシフェラーゼ遺伝子、レニーラ(Renilla)ルシフェラーゼ遺伝子、フォチヌス(Photinus)ルシフェラーゼ遺伝子、緑色蛍光タンパク質(GFP)遺伝子、強化緑色蛍光タンパク質(EGFP)遺伝子、クロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子、ネオマイシン耐性遺伝子、ピューロマイシン耐性遺伝子、ハイグロマイシン耐性遺伝子、ジフテリアトキシン耐性遺伝子、ペルオキシダーゼ遺伝子、ウレアーゼ遺伝子、カタラーゼ遺伝子、β−グルクロニダーゼ遺伝子、アルカリホスファターゼ遺伝子、β−ガラクトシダーゼ遺伝子等を挙げることができる。
【0039】
本発明におけるレポーター遺伝子の発現の程度を測定する方法としては、レポーター遺伝子の発現を検出又は定量し得る限り制限されないが、ホタルルシフェラーゼ遺伝子をレポーター遺伝子として用いた場合は、ルシフェラーゼの酵素活性を反応産物の蛍光を検出することにより測定する方法が好ましい。さらに好ましくは、ホタルルシフェラーゼレポータープラスミドと同時に導入したコントロールプラスミドから発現したレニーラルシフェラーゼを内部コントロールとして利用するシステム、例えばDual-Luciferase(商標登録)Reporter Assay System(プロメガ社製)などを特に好適に例示することができる。
【0040】
本発明の有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法においては、被検物質を投与した場合の細胞内におけるレポーター遺伝子の発現の程度が、該被検物質を投与しなかった場合の細胞内におけるレポーター遺伝子の発現の程度よりも高いときには、その被検物質はSLCO4C1遺伝子等の有機イオントランスポーター遺伝子の発現増強剤、又は尿毒症治療・予防薬であると判定し、被検物質を投与した場合の細胞内におけるレポーター遺伝子の発現の程度が、該被検物質を投与しなかった場合の細胞内におけるレポーター遺伝子の発現の程度と同等、もしくは低いときには、その被検物質は有機イオントランスポーター遺伝子の発現増強剤、又は尿毒症治療・予防薬でないと判定することができる。
【0041】
また、本発明のGATA遺伝子の発現抑制剤のスクリーニング方法においては、被検物質を投与した場合の細胞内におけるレポーター遺伝子の発現の程度が、該被検物質を投与しなかった場合の細胞内におけるレポーター遺伝子の発現の程度よりも低いときには、その被検物質はGATA遺伝子の発現抑制剤、又は尿毒症治療・予防薬であると判定し、被検物質を投与した場合の細胞内におけるレポーター遺伝子の発現の程度が、該被検物質を投与しなかった場合の細胞内におけるレポーター遺伝子の発現の程度と同等、もしくは高いときには、その被検物質はGATA遺伝子の発現増強剤、又は尿毒症治療・予防薬でないと判定することができる。
【0042】
本発明における被検物質としては、任意の物質を使用することができ、例えば、個々の低分子合成化合物でもよいし、天然物抽出物中に存在する化合物でもよく、あるいは化合物ライブラリー、ファージディスプレーライブラリー、コンビナトリアルライブラリーでもよい。化合物ライブラリーの構築は当業者に公知であり、また市販の化合物ライブラリーを使用することもできる。
【実施例】
【0043】
以下、実施例によって本発明を具体的に説明するが、これらは本発明の範囲を限定するものではない。
【0044】
ACHN細胞及びHK−2細胞(ATCC(American Type Culture Collection)より入手)はRPMI1640培地(GIBCO社製)に最終濃度で10%ウシ胎児血清(FBS)(GIBCO社製)、100IU/mlペニシリンと10μg/mlストレプトマイシン(GIBCO社製)となるように添加し、37℃、5%CO2濃度の条件で培養した。
【0045】
[N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンはSLCO4C1の発現を増強する]
N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンがACHN細胞やHK−2細胞におけるSLCO4C1のmRNA発現へ与える影響を調べた。6穴細胞培養プレートに5×105個のACHN細胞又はHK−2細胞を蒔いた後、24時間インキュベーションした。その後、各試薬(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン 1、3、10、30μM、又は0.1%DMSO)を含んだ培地に交換し、24時間インキュベーションした後にRNAを抽出した。N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンを含んだ培地は、まず、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンをDMSOで1mM、3mM、10mM、30mMの溶液に調整したものを、培地に1/1000量加えて調整した。0.1%DMSOは、コントロールである。SuperScript III(Invitrogen社製)を用いてcDNAを作製したのち、GAPDH(glyceraldehyde-3-phosphate dehydrogenase、グリセルアルデヒド3リン酸脱水素酵素)を内部標準としてSLCO4C1のmRNAの発現を定量PCRで測定した。細胞培養培地には腎上皮細胞培養キット(Lonza社製)を用い、定量PCRはTaqMan(登録商標)Gene Expression Assaysを使用し(GAPDH;Assay ID: Rn99999916_s1、SLCO4C1;Assay ID: Rn01427754_m1のTaqMan(登録商標)プローブ(Applied Biosystems社製)を使用)、Step One Plus Real-Time PCR System(Applied Biosystems社製)により行った。その結果、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、ACHN細胞及びHK−2細胞においてSLCO4C1の発現を増強することが示された(図1、2)。
【0046】
[N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンはインドキシル硫酸によるSLCO4C1の発現抑制作用を解除する]
次に、インドキシル硫酸及びN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンがACHN細胞やHK−2細胞におけるSLCO4C1のmRNA発現へ与える影響を調べた。6穴細胞培養プレートに5×105個のACHN細胞又はHK−2細胞を蒔いた後、24時間インキュベーションした。その後、各試薬(インドキシル硫酸(0.3、1、又は3mM)、インドキシル硫酸 1mM及びN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン 10μM、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン 10μM、又はDMSO 0.1%)を含んだ培地に交換し、24時間インキュベーションした後にRNAを抽出した。SuperScript III(Invitrogen社製)を用いてcDNAを作製したのち、GAPDH(glyceraldehyde-3-phosphate dehydrogenase、グリセルアルデヒド3リン酸脱水素酵素)を内部標準としてSLCO4C1のmRNAの発現を定量PCRで測定した。細胞培養培地には腎上皮細胞培養キット(Lonza社製)を用い、定量PCRはTaqMan(登録商標)Gene Expression Assaysを使用し(GAPDH;Assay ID: Rn99999916_s1、SLCO4C1;Assay ID: Rn01427754_m1のTaqMan(登録商標)プローブ(Applied Biosystems社製)を使用)、Step One Plus Real-Time PCR System(Applied Biosystems社製)により行った。その結果、尿毒症物質のひとつであるインドキシル硫酸はSLCO4C1の発現を抑制するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、ACHN細胞及びHK−2細胞において、インドキシル硫酸により低下したSLCO4C1の発現を回復させることが示された(図3、4)。
【0047】
[N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンはGATA3の発現を抑制し、インドキシル硫酸によるGATA3の発現増強作用を解除する]
次に、インドキシル硫酸及びN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンがACHN細胞やHK−2細胞におけるGATA3のmRNA発現へ与える影響を調べた。6穴細胞培養プレートに5×105個のACHN細胞又はHK−2細胞を蒔いた後、24時間インキュベーションした。その後各試薬(インドキシル硫酸(0.3、1、又は3mM)、インドキシル硫酸 1mM及びN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン 10μM、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン 10μM、又はDMSO DMSO 0.1%)を含んだ培地に交換し、24時間インキュベーションした後にRNAを抽出した。SuperScript III(Invitrogen社製)を用いてcDNAを作製したのち、GAPDH(glyceraldehyde-3-phosphate dehydrogenase、グリセルアルデヒド3リン酸脱水素酵素)を内部標準としてGATA3のmRNAの発現を定量PCRで測定した。細胞培養培地には腎上皮細胞培養キット(Lonza社製)を用い、定量PCRはTaqMan(登録商標)Gene Expression Assaysを使用し(GAPDH;Assay ID: Rn99999916_s1、GATA3;Assay ID: Hs00231122_m1のTaqMan(登録商標)プローブ(Applied Biosystems社製)を使用)、Step One Plus Real-Time PCR System(Applied Biosystems社製)により行った。その結果、HK−2細胞においてN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンはGATA3の発現を抑制し、また尿毒症物質のひとつであるインドキシル硫酸はGATA3の発現を増強するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、インドキシル硫酸により増加したGATA3の発現を減少させることが示された(図5)。また、ACHN細胞において尿毒症物質のひとつであるインドキシル硫酸はGATA3の発現を増強するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、インドキシル硫酸により増加したGATA3の発現を減少させることが示された(図6)。
【0048】
以上より、SLCO4C1の発現は、スタチンにより促進され、GATA3などにより抑制されるが、GATA阻害剤N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、このGATA3を介した制御を阻害することにより、SLCO4C1の発現を増強するというGATA仮説が考えられた(図7)。また、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンが、(1)尿毒症物質とGATAタンパク質の結合阻害によるSLCO4C1転写抑制を阻害すること及び、(2)尿毒症物質によるGATA3転写増強を阻害することの2つのはたらきにより、GATA3を介した制御を阻害することが考えられた(図8)。
【0049】
[N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、インドキシル硫酸による転写レベルでのSLCO4C1遺伝子発現の抑制作用及びGATA3遺伝子発現の増強作用を解除する]
次に、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン及びインドキシル硫酸がSLCO4C1及びGATA3遺伝子の転写活性へ与える影響を調べるため、ヒトSLCO4C1遺伝子の5’上流転写調節領域及びGATA3遺伝子の5’上流転写調節領域のプロモーター活性を調べる、ルシフェラーゼレポーターアッセイを以下の方法で行った。
【0050】
(プラスミドDNA)
SLCO4C1遺伝子の5’上流転写調節領域のプロモーター活性ルシフェラーゼアッセイ用のプラスミドベクターSLCO4C1-3886/+110-pGL3cは、翻訳開始点より−3886から+110bpの長さの領域を、ゲノムDNAをテンプレートに、配列番号1及び配列番号2のプライマーを用いて、PCR法を用いて増幅し、pGL3 basic luciferase expression vector(Promega社製)に挿入して作製した。GATA3遺伝子の5’上流転写調節領域のプロモーター活性ルシフェラーゼアッセイ用のプラスミドベクターpGATA3-lucは、GATA3プロモーター領域の3.5kbを、ゲノムDNAをテンプレートに、配列番号3及び配列番号4のプライマーを用いて、PCR法を用いて増幅し、制限酵素BamHIとNcoIで切り出し、ホタルルシフェラーゼタンパク質をコードする2kbの遺伝子カセットとインフレームで連続してpBluscriptSK+(Novagen社製)ベクターに挿入することで作製した。
【0051】
(トランスフェクションとルシフェラーゼレポーターアッセイ)
24穴細胞培養プレートにACHN細胞を1穴あたり20×104個の細胞数で調整して継代し、検鏡下で70−80%の細胞密度となったACHN細胞に対してルシフェラーゼレポーターアッセイ用のプラスミドDNAのトランスフェクションを施行した。トランスフェクション用の溶液組成は、1穴あたりFire fly luciferase vector(SLCO4C1-3886/+110-pGL 1.2μg又はpGATA3-luc 2μg)、Renilla Luciferase Reporter VectorとしてpRh-TK (Promega社製)50ng、トランスフェクション試薬としてLipofectamine2000(Invitrogen社製)2μlを無血清培地のOptiMEM−I(GIBCO社製)100μlに混合してから室温で20分インキュベーションして調製した。このトランスフェクション用溶液を、無血清のOptiMEM−I培地0.5mlでプレインキュベーションした24穴細胞培養プレートのACHN細胞に添加し、37℃、5%CO2にて無血清かつ抗生物質添加無しで4時間インキュベーションした。その後、培地を各試薬(インドキシル硫酸(100μM)、インドキシル硫酸(100μM)及びN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン(10μM)、又はDMSO(0.1%))を添加した通常培地(10%FBS、100IU/mlペニシリン、10μg/mlストレプトマイシンを含むRPMI1640培地)に交換し、さらに37℃、5%CO2にて44時間インキュベーションした。その後に、培地を無血清のPBS0.5mlに置換して細胞を穏やかに洗浄しPBSを吸引除去する作業を2回施行してから、passive lysis buffer(Promega社製)100μl加えて20分室温にて混和し溶解した。ルシフェラーゼレポーターアッセイはDual Luciferase Reporter Assay System(Promega社製)にて、ルミノメーターLumat LB9507(NERTHOLD TECHNOLOGIES社製)を用いてホタルルシフェラーゼ及びレニーラルシフェラーゼ量を測定した。そして、ホタルルシフェラーゼ量をレニーラルシフェラーゼ量で割ることにより、SLCO4C1及びGATA3遺伝子の転写活性を算出した。
【0052】
DMSOを添加したコントロールサンプルの転写活性を1とした場合の、インドキシル硫酸を添加した場合のSLCO4C1遺伝子又はGATA3遺伝子の転写活性を図9に示す。その結果、インドキシル硫酸添加によりSLCO4C1遺伝子の転写活性はコントロールの56%まで減少するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンの添加によりSLCO4C1遺伝子の転写活性はコントロールの85%に回復した(図9左グラフ)。また、インドキシル硫酸添加によりGATA3遺伝子の転写活性はコントロールの138%まで増加するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンの添加によりGATA3遺伝子の転写活性はコントロールの83%に減少した(図9右グラフ)。すなわち、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、インドキシル硫酸による、転写レベルでのSLCO4C1遺伝子発現の抑制作用及びGATA3遺伝子発現の増強作用を、解除することが示された。
【0053】
以上の結果より、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンが尿毒症物質によるSLCO4C1及びエリスロポエチンの発現の抑制を阻害することが示唆された(図10)。
【産業上の利用可能性】
【0054】
本発明は、有機イオントランスポーター発現増強剤やGATA発現抑制剤、尿毒症治療・予防薬の分野に好適に利用することができる。また、有機イオントランスポーター発現増強剤やGATA発現抑制剤のスクリーニング方法の分野に好適に利用することができる。
【技術分野】
【0001】
本発明は、GATA阻害剤を有効成分とすることを特徴とする有機イオントランスポーター発現増強剤及び尿毒症治療・予防薬、並びに有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法などに関する。また、GATA阻害剤を有効成分とすることを特徴とするGATA発現抑制剤及び尿毒症治療・予防薬、並びにGATA遺伝子の発現抑制剤のスクリーニング方法などに関する。
【背景技術】
【0002】
腎不全患者等の腎疾患を有する患者、特に腎透析を受ける患者の数は年々増加の一途を辿っている。腎臓の機能の一つは、血液中に流れている薬物や尿毒症物質などを取り込み、尿中に送り出して体外に排泄する排泄作用である。そのため腎機能が低下すると、薬物や尿毒症物質が体内に蓄積しやすくなり、腎臓の細胞が傷害され腎機能のさらなる低下を引き起こす。また、腎機能の低下した人は、正常の人と較べて何倍も脳卒中や心筋梗塞になりやすいことが知られている。したがって尿毒症物質などを排泄する機能を維持することは、腎障害を悪化させない上で非常に重要な意味を持つと同時に、脳卒中や心臓病の予防という点でも重要である。現在20万人の患者が、尿毒症物質などを人工的に除去するために透析治療を行っており、さらに毎年3万人以上が新たに透析導入に至っている。透析療法には、一人あたり年間約500万円の費用がかかるため、20万人に対して約1兆円の医療費が恒常的に必要となり社会的な問題でもある。
【0003】
近年、慢性腎臓病(Chronic Kidney Disease:CKD)という疾患概念が提唱され、その予防・治療の重要性に対する認識が高まりを見せている。CKDとは、腎障害を示す所見や腎機能低下が慢性的に続く状態で、適切な治療を行わずにいると末期腎不全となり、人工透析や腎移植を受けなければ生きられなくなる疾患である。末期腎不全は全世界的に増え続けている。現在、日本には約1,330万人のCKD患者がいるといわれており、成人の約8人に1人にあたる数である。また、人工透析を受けている患者も、前述したように増え続けているのが現状であり、CKDの早期発見、早期治療が急務の課題となっている。このような状況下において、腎不全やCKD等の腎疾患の症状の予防法や、そのような症状を緩和し、透析導入を遅らせる治療法が開発されれば、患者のQOL(クオリティオブライフ)に資するだけでなく、医療費の大幅な削減が可能となり社会に大きく貢献することが期待されている。
【0004】
CKDにおいて腎性貧血は主要な合併症の一つであり、腎性貧血の病態は、内因性エリスロポエチン(Epo)産生の低下を基盤とすることが知られている。腎機能の低下がどのようにエリスロポエチン産生に影響を及ぼすかは明らかになっていないが、血液透析によって腎性貧血が改善したという報告があることから、尿毒症物質がその原因の一つである可能性が示唆されている。エリスロポエチンは赤血球の産生を促進する造血促進因子の一つであり、エリスロポエチンの欠乏は貧血の一因となる。エリスロポエチンは主に腎臓で生成されるため、慢性腎不全によりエリスロポエチンの発現量が低下し、貧血が起こる。そのため、腎性貧血の主な治療法はエリスロポエチンの投与であるが、エリスロポエチン製剤は高価で、頻回の注射が必要であるなどの問題が指摘されている。
【0005】
エリスロポエチンの発現は、エリスロポエチン遺伝子の上流のGATA配列にGATA転写因子結合することにより、負に制御されている。N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン(K−7174ともいう)はGATAのGATA配列への結合活性を阻害する、GATA阻害剤として使用されている。N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンはGATAの脱アセチル化を特異的に抑制するため、GATAの転写因子としての活性が抑制されると考えられており、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンによりGATA結合活性が抑制されることでエリスロポエチン遺伝子発現が促進されることが知られている。そして、腎不全で蓄積されるL−NMMA(NG-monomethyl L-arginine)により、GATA結合活性が亢進することにより、エリスロポエチン遺伝子発現が抑制されて腎性貧血が発症するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンによりこのエリスロポエチン遺伝子発現抑制が解除されることが示唆されている(非特許文献1、2)。
【0006】
N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン、その酸付加塩、又はこれらの水和物は、阻害剤脳保護剤(特許文献1)や細胞接着阻害剤、細胞浸潤阻害剤、抗アレルギー剤、抗喘息剤及び抗炎症剤(特許文献2)、エリスロポエチン産生促進剤(特許文献3)、前駆脂肪細胞分化抑制剤(特許文献4)などとして有用であることが知られている。しかしながら、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンが有機イオントランスポーターの発現やGATAの発現にどのような作用をするかは全く知られていなかった。
【0007】
これまで本発明者らは、ヒト腎臓近位尿細管血管側にのみ発現する有機アニオントランスポーターSLCO4C1(solute carrier organic anion transporter family, member 4C1;別名OATP(organic anion transport- ing polypeptide)−Rとも呼ばれる)が尿毒症物質の排泄に関わっていることを明らかにし、SLCO4C1の発現を調節することで尿毒症物質排泄を制御するという新たなCKD治療の可能性を報告した(非特許文献3)。
【0008】
また、本発明者らは、キャピラリー電気泳動質量分析計(CE−MS)を用いてCKD患者41名の血清を解析し、腎機能の評価である推定糸球体濾過量(estimated glomerular filtration rate:eGFR)の低下とともに有意に蓄積する物質を検出したことを報告している(非特許文献4)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開平3−2144号公報
【特許文献2】特開平9−143075号公報
【特許文献3】WO/2004/002493号パンフレット
【特許文献4】特開2009−51796号公報
【非特許文献】
【0010】
【非特許文献1】Imagawa S. et al., Kidney International. 61. 396-404 (2002)
【非特許文献2】今川 重彦、赤血球産生阻害 −腎性貧血の新規治療− 臨牀透析 Vol.21 No.9(14) 2005年
【非特許文献3】Toyohara T. et al., J Am Soc Nephrol., 20: 2546-2555 (2009)
【非特許文献4】Toyohara T. et al., Hypertens Res. 2010 Sep;33(9):944-52. (2010)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明者らは、腎機能の評価であるeGFRの低下と共に蓄積する尿毒症物質を同定し(特願2009−205033、非特許文献4)、尿毒症物質のひとつであるインドキシル硫酸(IS;Indoxyl Sulfate)が、GATA3の発現を増強すること及びSLCO4C1トランスポーターの発現を抑制することにより、エリスロポエチン産生を抑制し、CKDの病態に関与していることを明らかにした(特願2010−231709)。そこで、本発明の課題は、有機イオントランスポーターの発現増強や、GATAの発現抑制などによる、腎性貧血の予防・治療剤を開発することにある。
【課題を解決するための手段】
【0012】
本発明者らは、GATA阻害剤であるN,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジン(以下、K−7174ということもある)が、有機イオントランスポーターの発現を増加させることや、尿毒症物質による有機イオントランスポーターの発現抑制作用を解除することや、GATA発現を抑制することや、尿毒症物質によるGATA発現増強作用を解除することを見いだし、本発明を完成するに至った。
【0013】
すなわち、本発明は[1]GATA阻害剤を有効成分とすることを特徴とする有機イオントランスポーター発現増強剤や、[2]尿毒症物質による有機イオントランスポーター発現抑制の解除作用を有することを特徴とする前記[1]記載の有機イオントランスポーター発現増強剤や、[3]GATA阻害剤が、N,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジンであることを特徴とする前記[1]又は[2]記載の有機イオントランスポーター発現増強剤や、[4]有機イオントランスポーターが、ヒト有機アニオントランスポーターSLCO4C1であることを特徴とする前記[1]〜[3]のいずれか記載の有機イオントランスポーター発現増強剤や、[5]前記[1]〜[4]のいずれか記載の有機イオントランスポーター発現増強剤を含むことを特徴とする尿毒症治療・予防薬に関する。
【0014】
また、本発明は、[6]以下の(a)〜(e)の工程を備えたことを特徴とする有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法;(a)GATA結合配列を含む有機イオントランスポーター遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;(b)構築したレポータープラスミドを、有機イオントランスポーター遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;(c)調製した形質転換細胞株に被検物質を接触させる工程;(d)レポーター遺伝子の発現の程度を測定する工程;(e)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が大きい場合、被検物質を有機イオントランスポーター遺伝子の発現を増強する活性を有する物質と判定する工程;や、[7]有機イオントランスポーターが、ヒト有機アニオントランスポーターSLCO4C1であることを特徴とする前記[6]記載のスクリーニング方法や、[8]工程(b)において、構築したレポータープラスミドに加えてGATA発現プラスミドを用いることを特徴とする前記[6]又は[7]記載のスクリーニング方法や、[9]工程(c)において、尿毒症物質又はGATA結合促進物質の存在下で、被験物質を接触させることを特徴とする前記[6]〜[8]のいずれか記載のスクリーニング方法や、[10]レポーター遺伝子がルシフェラーゼ遺伝子であることを特徴とする前記[6]〜[9]のいずれかに記載のスクリーニング方法に関する。
【0015】
また、本発明は[11]GATA阻害剤を有効成分とすることを特徴とするGATA発現抑制剤や、[12]尿毒症物質によるGATA発現増強の解除作用を有することを特徴とする前記[11]記載のGATA発現抑制剤や、[13]GATA阻害剤が、N,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジンであることを特徴とする前記[11]又は[12]記載のGATA発現抑制剤や、[14]前記[11]〜[13]のいずれか記載のGATA発現抑制剤を含むことを特徴とする尿毒症治療・予防薬に関する。
【0016】
また、本発明は[15]以下の(a’)〜(e’)のステップを備えたことを特徴とするGATA遺伝子の発現抑制剤のスクリーニング方法;(a’)GATA遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;(b’)構築したレポータープラスミドを、GATA遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;(c’)調製した形質転換細胞株に被検物質を接触させる工程;(d’)レポーター遺伝子の発現の程度を測定する工程;(e’)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が小さい場合、被検物質をGATA遺伝子の発現を抑制する活性を有する物質と判定する工程;や、[16]工程(c’)において、尿毒症物質の存在下に被験物質を接触させることを特徴とする前記[15]記載のGATA遺伝子の発現抑制剤のスクリーニング方法や、[17]レポーター遺伝子がルシフェラーゼ遺伝子であることを特徴とする前記[15]又は[16]に記載のGATA遺伝子の発現抑制剤のスクリーニング方法に関する。
【発明の効果】
【0017】
本発明のGATA阻害剤を有効成分とする有機イオントランスポーター発現増強剤によれば、有機イオントランスポーターの発現を増強し、尿毒症を治療及び/又は予防することができ、本発明の有機イオントランスポーター遺伝子の発現増強剤スクリーニング方法を用いて新規の有機イオントランスポーター遺伝子発現増強剤を同定することができる。また、本発明のGATA阻害剤を有効成分とするGATA発現抑制剤によれば、GATA3発現を抑制し、尿毒症を治療及び/又は予防することができ、本発明のGATA遺伝子の発現抑制剤スクリーニング方法を用いて新規のGATA遺伝子発現抑制剤を同定することができる。
【図面の簡単な説明】
【0018】
【図1】ACHN細胞においてGATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)がSLCO4C1のmRNA発現を増強することを示す図である。
【図2】HK−2細胞においてGATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)がSLCO4C1のmRNA発現を増強することを示す図である。
【図3】ACHN細胞においてインドキシル硫酸(IS)がSLCO4C1のmRNA発現を抑制し、GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はそのインドキシル硫酸によるSLCO4C1のmRNA発現抑制作用を解除することを示す図である。
【図4】HK−2細胞においてインドキシル硫酸(IS)がSLCO4C1のmRNA発現を抑制し、GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はそのインドキシル硫酸によるSLCO4C1のmRNA発現抑制作用を解除することを示す図である。
【図5】HK−2細胞においてGATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)がGATA3のmRNA発現を抑制し、インドキシル硫酸(IS)がGATA3のmRNA発現を増強する。そしてGATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はインドキシル硫酸によるGATA3のmRNA発現増強作用を解除することを示す図である。
【図6】ACHN細胞においてインドキシル硫酸(IS)がGATA3のmRNA発現を増強し、GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はそのインドキシル硫酸によるGATA3のmRNA発現増強作用を解除することを示す図である。
【図7】GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)がGATA3の発現及び機能の阻害を介して、SLCO4C1の発現を増強するというGATA仮説を表す図である。
【図8】Kコンパウンド(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)が、GATA3によるSLCO4C1の発現抑制を阻害すること、及びGATA3の発現を抑制することの2つの働きを有することを表す図である。
【図9】インドキシル硫酸はSLCO4C1の発現を抑制し、GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はインドキシル硫酸によるSLCO4C1発現抑制作用を解除することをレポーターアッセイにより調べた結果を示す図である(左のグラフ)。インドキシル硫酸はGATA3の発現を増強し、GATA阻害剤(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)はインドキシル硫酸によるGATA3発現増強作用を解除することをレポーターアッセイにより調べた結果を示す図である(右のグラフ)。
【図10】Kコンパウンド(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン;K−7174)が、インドキシル硫酸や1−メチルアデノシンによるエリスロポイエチンやSLCO4C1の転写抑制を解除することを表す図である。
【発明を実施するための形態】
【0019】
本発明の有機イオントランスポーター発現増強剤やGATA発現抑制剤としては、GATA阻害剤を有効成分とするものであれば特に制限されず、ここでGATA阻害剤としては、GATAの転写因子としての機能を阻害、好ましくは特異的に阻害する物質であれば特に制限されず、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンもしくはそれらの酸付加塩、又はこれらの溶媒和物を挙げることができ、好ましくはGATA特異的阻害剤であるN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンを挙げることができる(化1)。化合物がGATA阻害剤であるかどうかは、SLCO4C1のレポーターアッセイにおいて、コントロールと比べてSLCO4C1のレポーター活性を増強する、あるいはGATA3のレポーターアッセイにおいて、コントロールと比べてGATA3のレポーター活性を抑制することにより判定することができる。本発明のGATA阻害剤N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、市販されている物質を用いてもよいし、適当な化学物質を原料として公知の反応を用いて合成してもよい(例えば、特開平9−143075に記載の方法などを利用することができる)。
【0020】
【化1】

【0021】
上記GATAとしては、GATA1、GATA2、GATA3、GATA4、GATA5、GATA6を挙げることができ、中でもGATA3を好適に示すことができる。かかるGATA3としては、例えばヒトGATA3遺伝子(NM_001002295;GenBankアクセッション番号)、マウスGATA3遺伝子(NM_008091)やラットGATA3遺伝子(NM_133293)等から発現するタンパク質などを挙げることができる。またこれらの配列情報に基づいて、適当なプライマーを設計することによって、これらの遺伝子を単離することもできるし、単離したこれらの遺伝子を適当な発現ベクターに組み込んで該ベクターを適当な細胞に導入して発現させたり、それによりGATAタンパク質を入手することもできる。
【0022】
本発明の有機イオントランスポーター発現増強剤としては、尿毒症物質による有機イオントランスポーター発現抑制の解除作用を有するものが好ましく、また本発明のGATA発現抑制剤としては、尿毒症物質によるGATA発現増強の解除作用を有するものが好ましい。
【0023】
本発明の尿毒症治療・予防薬としては、上記本発明の有機イオントランスポーター発現増強剤やGATA発現抑制剤を含むもの、すなわちN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン等のGATA阻害剤を有効成分として含むものであれば特に制限されず、その有効量をヒトを含む哺乳動物に投与することによって、有機イオントランスポーターの発現量を増強したり、尿毒症物質による有機イオントランスポーター発現抑制を解除したり、GATA発現を抑制したり、尿毒症物質によるGATA発現増強を解除することができるものであり、賦形剤等の担体と併用することにより薬剤やサプリメントとすることができる。この薬剤やサプリメントを腎不全のヒトを含む哺乳動物に投与することによって、生体内の有機イオントランスポーターの発現量を増加させることにより、尿毒症物質の排出を増加させ、尿毒症を治療及び/又は予防に利用することができる。なお、本明細書において「尿毒症を治療・予防薬」とは、尿毒症治療及び/又は予防薬を意味し、また、GATA阻害剤を有効成分とする有機イオントランスポーター発現増強剤の有効量と担体とを投与することを特徴とする尿毒症を治療及び/又は予防方法や、GATA阻害剤を有効成分とするGATA発現抑制剤の有効量と担体とを投与することを特徴とする尿毒症を治療及び/又は予防方法や、GATA阻害剤を有効成分とする有機イオントランスポーター発現増強剤を尿毒症の治療及び/又は予防薬を製造するために用いる方法や、GATA阻害剤を有効成分とするGATA発現抑制剤を尿毒症の治療及び/又は予防薬を製造するために用いる方法を、本発明とすることもできる。
【0024】
本発明における有機イオントランスポーターとしては、SLCO4C1(solute carrier organic anion transporter family, member 4C1;別名OATP(organic anion transport- ing polypeptide)−Rとも呼ばれる)、OCT(organic cation transporter)1、OCT2及びOCT3、OCTN(novel organic cation transporter)1やOCTN2、OAT(organic anion transporter)1、OAT2及びOAT3を挙げることができ、中でも有機アニオントランスポーターであるSLCO4C1を好適に示すことができる。かかるSLCO4C1としては、例えばヒトSLCO4C1遺伝子(NM_180991;GenBankアクセッション番号)、マウスSLCO4C1遺伝子(NM_172658)、ラットSLCO4C1遺伝子(NM_001002024)及びこれらから発現するタンパク質などを挙げることができる。上記SLCO4C1は、腎臓において胆汁酸、ビリルビン、ジゴキシンやウアバイン、cAMP等の尿毒症物質を体外に排出するトランスポーターであるため、本発明のGATA阻害剤を有効成分とする有機イオントランスポーターSLCO4C1の発現増強剤は、尿毒症の治療・予防薬として有利に用いることができる。
【0025】
本発明の有機イオントランスポーターの発現増強剤やGATA発現抑制剤や尿毒症治療・予防薬は、有機イオントランスポーター遺伝子の発現を増強する活性やGATAの発現を抑制する活性や尿毒症治療・予防効果を阻害しない限り、他に任意の成分を配合することができる。例えば本発明の尿毒症治療・予防薬の場合、GATA阻害剤以外に公知の尿毒症治療・予防薬を配合してもよいし、さらにこれら公知の尿毒症治療・予防薬との併用療法も可能である。また、本発明の有機イオントランスポーター遺伝子の発現増強剤の場合、GATA阻害剤以外の有機イオントランスポーター遺伝子の発現増強剤を配合してもよいし、有機イオントランスポーター遺伝子の発現増強手段と併用してもよい。また、GATA遺伝子の発現抑制剤の場合、GATA阻害剤以外のGATA遺伝子の発現抑制剤を配合してもよいし、ATA遺伝子の発現抑制手段と併用してもよい。
【0026】
本発明の有機イオントランスポーターの発現増強剤やGATA発現抑制剤や尿毒症治療・予防薬の投与形態は特に制限されず、経口的又は非経口的に投与することができ、例えば粉末、顆粒、錠剤、糖衣錠、カプセル剤、スティック剤、シロップ剤、懸濁液等の剤型で経口的に投与することができ、あるいは、例えば溶液、乳剤、懸濁液等の剤型にしたものを注射の型で投与する他、スプレー剤の型で鼻孔内投与したり坐剤等により非経口投与することもできるが、投与の簡便性の観点から経口的に投与することが好ましい。有効成分であるGATA阻害剤の配合量は、尿毒症の予防効果や治療効果が得られる限り特に制限されず、製剤の投与量等の条件に応じて適切な配合量を選択することが可能である。
【0027】
本発明の尿毒症予防・治療剤は、有効成分であるGATA阻害剤に通常薬学的に許容される担体、結合剤、安定化剤、賦形剤、希釈剤、pH緩衝剤、崩壊剤、可溶化剤、溶解補助剤、等張剤などの各種調剤用配合成分を配合して製剤の形態で提供される。例えば、経口投与する場合、微晶質セルロース、クエン酸ナトリウム、炭酸カルシウム、リン酸ジカリウム、グリシンのような種々の賦形剤を、澱粉、好適にはとうもろこし、じゃがいも又はタピオカの澱粉、及びアルギン酸やある種のケイ酸複塩のような種々の崩壊剤、及びポリビニルピロリドン、蔗糖、ゼラチン、アラビアゴムのような顆粒形成結合剤と共に使用することができる。また、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム、タルク等の滑沢剤も錠剤形成に非常に有効であることが多い。同種の固体組成物をゼラチンカプセルに充填して使用することもできる。これに関連して好適な物質としてラクトース又は乳糖の他、高分子量のポリエチレングリコールを挙げることができる。経口投与用として水性懸濁液とする場合、GATA阻害剤を各種の甘味料、香味料、着色料、乳化剤、懸濁化剤と併用し、水、エタノール、プロピレングリコール、グリセリン等の希釈剤と共に使用することもできる。
【0028】
本発明の尿毒症治療・予防薬の投与量は、対象の種類(動物又はヒト)、対象の年齢、個人差、病状、投与形態等により適宜選定することができる。本発明の有機イオントランスポーター発現増強剤やGATA発現抑制剤の投与量についても、有機イオントランスポーター遺伝子の発現が増強、あるいはGATA遺伝子の発現が抑制され得る限り特に制限はされず、種々の条件に応じて適切な投与量を選択することが可能である。例えば、細胞や組織などにインビトロで適用する場合は、培養液などに有効成分であるN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンを、最終濃度が0.01〜1000μM、好ましくは0.1〜500μM、さらに好ましくは1〜50μMとなるように添加し、0.01〜120時間、好ましくは1〜96時間、さらに好ましくは6〜84時間、もっとも好ましくは12〜72時間インキュベートすることができる。またヒトに経口投与する場合の投与量は、例えば、有効成分であるN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンを一日0.01〜1000mg、好ましくは0.1〜500mg、さらに好ましくは1〜100mgを1〜3回に分けて投与するのが好ましく、また症状により投与量を適宜増減してもよい。なお、本明細書における尿毒症治療・予防薬の投与対象は、ヒトだけでなく、他の非ヒト動物含むが、ヒト及び非ヒト哺乳動物が好ましく、ヒトがより好ましい。
【0029】
本発明の尿毒症の予防・治療剤の対象となる尿毒症としては、GATA阻害剤を投与することにより、尿毒症の予防効果や治療効果を発揮する限り特に制限はなく、例えば、急性腎不全、急性尿細管壊死、腎性貧血、慢性腎不全、尿細管間質障害、急性腎炎、慢性腎炎、ネフローゼ、腎機能障害、糖尿病性腎症、動脈硬化性腎症などが挙げられるが、なかでも腎性貧血に対して優れた予防効果や治療効果を発揮する。
【0030】
本発明の有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法としては、(a)GATA結合配列を含む有機イオントランスポーター遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;(b)構築したレポータープラスミドを、有機イオントランスポーター遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;(c)調製した形質転換細胞株に被検物質を接触させる工程;(d)レポーター遺伝子の発現の程度を測定する工程;(e)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が大きい場合、被検物質を有機イオントランスポーター遺伝子の発現を増強する活性を有する物質と判定する工程;を備えていれば特に制限されない。
【0031】
上記工程(a)におけるGATA結合配列を含む有機イオントランスポーター遺伝子の5’上流転写領域としては、ヒト有機イオントランスポーター遺伝子の転写開始点より上流−4000塩基から下流のGATA結合配列(5’−(A又はT)GATA(A又はG)−3’)を含む領域を例示することができる。かかる配列の下流にインフレームでレポーター遺伝子を連結したレポーター遺伝子を組み込んだプラスミドは、有機イオントランスポーター遺伝子の転写活性を反映してレポーター遺伝子を発現するため、レポーター遺伝子の発現を検出することにより有機イオントランスポーター遺伝子の転写レベルを測定することができる。上記有機イオントランスポーター遺伝子を発現し得るヒト細胞株としては、本来有機イオントランスポーターを発現しているヒト細胞株の他、転写制御領域と一緒に有機イオントランスポーター遺伝子を発現ベクターに導入し、人工的に有機イオントランスポーターを発現し得るヒト細胞株を挙げることができる。なお、有機イオントランスポーターを発現し得るように形質転換する際に用いるヒト由来の細胞株は、本来有機イオントランスポーターを発現していないヒト細胞株であってもよいし、本来有機イオントランスポーターを発現しているヒト細胞株であってもよい。有機イオントランスポーター遺伝子が組み込まれた発現ベクターを、本来有機イオントランスポーターを発現しているヒト細胞株に導入すると、有機イオントランスポーターがより安定的に発現する点で好ましい。
【0032】
例えば、有機イオントランスポーターがSLCO4C1の場合は、工程(a)におけるGATA結合配列を含むSLCO4C1遺伝子の5’上流転写領域としては、ヒトSLCO4C1遺伝子の転写開始点より上流−4000塩基から下流のGATA結合配列(5’−(A又はT)GATA(A又はG)−3’)を含む領域、好適にはヒトSLCO4C1遺伝子の翻訳開始点より上流−3886塩基から下流+110塩基までの配列などを例示することができる。かかる配列の下流にインフレームでレポーター遺伝子を連結したレポーター遺伝子を組み込んだプラスミドは、SLCO4C1遺伝子の転写活性を反映してレポーター遺伝子を発現するため、レポーター遺伝子の検出することによりSLCO4C1遺伝子の転写レベルを測定することができる。また、SLCO4C1遺伝子を発現し得るヒト細胞株としては、本来SLCO4C1を発現しているヒト細胞株の他、転写制御領域と一緒にSLCO4C1遺伝子を発現ベクターに導入し、人工的にSLCO4C1を発現し得るヒト細胞株を挙げることができ、より具体的には、ヒト胎児腎臓由来細胞(HEK293細胞)や本来SLCO4C1を発現しているACHN細胞株等の腎癌由来のヒト細胞株や、ヒト近位尿細管由来細胞(HK−2)等のヒト由来の細胞株の他、SLCO4C1を発現し得るように形質転換されたヒト由来の細胞株を挙げることができるが、ACHN細胞やHK−2細胞等のヒト細胞株をより好ましく挙げることができる。なお、SLCO4C1を発現し得るように形質転換する際に用いるヒト由来の細胞株は、本来SLCO4C1を発現していないヒト細胞株であってもよいし、本来SLCO4C1を発現しているヒト細胞株であってもよい。SLCO4C1遺伝子が組み込まれた発現ベクターを、本来SLCO4C1を発現しているヒト細胞株に導入すると、SLCO4C1がより安定的に発現する点で好ましい。GATA結合配列を含むヒトSLCO4C1遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子は、哺乳動物細胞等で発現するプラスミドベクターにインテグレートされ、公知の方法で細胞株に導入され、形質転換細胞株を調製することができる。
【0033】
本発明の有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法においては、レポータープラスミドに加えて、GATA発現プラスミドを細胞内に導入してスクリーニングを行うこともできる。かかるGATA発現プラスミドとしては、哺乳動物細胞株においてGATAタンパク質の全長あるいは一部を発現するものであれば特に制限されず、GATAとしては、GATA1、GATA2、GATA3、GATA4、GATA5、GATA6を挙げることができ、中でもGATA3を好適に示すことができる。かかるGATA3としては、例えばヒトGATA3遺伝子(NM_001002295;GenBankアクセッション番号)、マウスGATA3遺伝子(NM_008091)やラットGATA3遺伝子(NM_133293)から発現するタンパク質などを挙げることができる。これらの配列情報に基づいて、適当なプライマーを設計することによって、これらの遺伝子を単離することができ、単離したこれらの遺伝子の配列を適当な発現ベクターに組み込んで該ベクターを適当な細胞に導入して発現させることができる。
【0034】
本発明の有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法においては、尿毒症物質を細胞培養液に添加して、尿毒症物質の存在下でスクリーニングを行うこともできる。かかる尿毒症物質としては、腎臓の機能低下とともに有意に蓄積する物質であれば特に制限されず、例えば腎機能のマーカーのひとつである推定糸球体濾過量(estimated glomerular filtration rate:eGFR)の低下とともに有意に蓄積する物質、クレアチニン(creatinine)、シンメトリックジメチルアルギニン(SDMA)、グアジニノコハク酸(guanidino succinate)、シトルリン(citrulline)、1−メチルアデノシン(1-methyladenosine)、N−アセチルグルコサミン(N-acetylgulusosamine)、γ−ブチロベタイン(γ-butyrobetaine)、オフタルム酸(ophthalmate)、3−メチルヒスチジン(3-methylhistidine)、ヒドロキシプロリン(hydroxyproline)、トリメチルアミン−N−オキシド(trimethylamine N-oxide)、アラントイン(allantoin)、アシンメトリックジメチルアルギニン(ADMA)、N−ε−アセチルリジン(N-epsilon-acetyllysine)、キヌレニン(kynurenine)、シトシン(cytosine)、インドール−3−酢酸(indole-3-acetate)、ヒポタウリン(hypotaurine)、N,N−ジメチルグリシン(n,n-dimethylglycine)、7−メチルグアニン(7-methylguanine)、メチオニンスルホキシド(methionine sulfoxide)、アスパラギン(Asn)、イセチオン酸(isethionate)、グルコン酸(gluconate)、トランス−アコニット酸(trans-aconitate)、ピメリン酸(pimelate)、3−インドキシル硫酸(3-indoxyl sulfate)、イソクエン酸(isocitrate)、N−アセチル−β−アラニン(N-acetyl-beta-alanine)、N−アセチルグルタミン酸(N-acetylglutamate)、セバシン酸(sebacate)、4−オキソペンタン酸(4-oxopentanoate)、シス−アコニット酸(cis-aconitate)、ホモバニリン酸(homovanillate)、アジピン酸(adipate)、シトラマレイン酸(citramalate)、2−イソプロピルマレイン酸(2-isopropylmalate)、トレオン酸(threonate)、馬尿酸(hippurate)、N−アセチルアスパラギン酸(N-acetylaspartate)、4−ヒドロキシ−3−メトキシマンデル酸(4-hydroxy-3-methoxymandelate)、オキサミン酸(oxamate)、グルタル酸(glutarate)、アゼテート(azetate)、フタル酸(phthalate)、クエン酸(citrate)、マロン酸(malonate)、シトラコン酸(citraconate)、キナ酸(quinate)、コハク酸(succinate)、システイン−S−硫酸(cysteine S-sulfate)、4−ヒドロキシ−3−メトキシ安息香酸(4-hydroxy-3-methoxybenzoate)、胆汁酸、ビリルビン、ジゴキシンやウアバイン、cAMPなどを挙げることができ、その中でも3−インドキシル硫酸(インドキシル硫酸、ISということもある)及び1−メチルアデノシンを好適に例示することができる。また、GATA結合促進物質としてはGATAのGATA結合配列への結合を促進する物質であれば特に制限されず、例えばインドキシル硫酸及び1−メチルアデノシンを例示することができる。
【0035】
次に、本発明のGATA遺伝子の発現増強剤のスクリーニング方法としては、(a’)GATA遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;(b’)構築したレポータープラスミドを、GATA遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;(c’)調製した形質転換細胞株に被検物質を接触させる工程;(d’)レポーター遺伝子の発現の程度を測定する工程;(e’)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が小さい場合、被検物質をGATA遺伝子の発現を抑制する活性を有する物質と判定する工程;を備えていれば特に制限されない。
【0036】
上記工程(a’)におけるGATA遺伝子の5’上流転写領域としては、ヒトGATA遺伝子のプロモーター領域、好適にはヒトGATA遺伝子の翻訳開始点より上流−4000塩基から下流の配列などを例示することができる。かかる配列の下流にインフレームでレポーター遺伝子を連結したレポーター遺伝子を組み込んだプラスミドは、GATA遺伝子の転写活性を反映してレポーター遺伝子を発現するため、レポーター遺伝子の発現を検出することによりGATA遺伝子の転写レベルを測定することができる。上記GATA遺伝子を発現し得るヒト細胞株としては、本来GATAを発現しているヒト細胞株の他、転写制御領域と一緒にGATA遺伝子を発現ベクターに導入し、人工的にGATAを発現し得るヒト細胞株を挙げることができる。なお、GATAを発現し得るように形質転換する際に用いるヒト由来の細胞株は、本来GATAを発現していないヒト細胞株であってもよいし、本来GATAを発現しているヒト細胞株であってもよい。GATA遺伝子が組み込まれた発現ベクターを、本来GATAを発現しているヒト細胞株に導入すると、GATAがより安定的に発現する点で好ましい。
【0037】
なおGATAがGATA3の場合は、工程(a’)GATA3遺伝子の5’上流転写領域としては、ヒトGATA3遺伝子の転写開始点より上流−4000塩基から下流、好ましくは翻訳開始点より上流−3500塩基から下流+110塩基までの配列などを例示することができる。かかる配列の下流にインフレームでレポーター遺伝子を連結したレポーター遺伝子を組み込んだプラスミドは、GATA3遺伝子の転写活性を反映してレポーター遺伝子を発現するため、レポーター遺伝子の発現を検出することによりGATA3遺伝子の転写レベルを測定することができる。そしてGATA3遺伝子を発現し得るヒト細胞株としては、本来GATA3を発現しているヒト細胞株の他、転写制御領域と一緒にGATA3遺伝子を発現ベクターで導入し、人工的にGATA3を発現し得るヒト細胞株を挙げることができ、より具体的には、ヒト胎児腎臓由来細胞(HEK293細胞)や本来GATA3を発現しているヒトACHN細胞株等の腎癌由来のヒト細胞株や、ヒト近位尿細管由来細胞(HK−2)等のヒト由来の細胞株の他、GATA3を発現し得るように形質転換されたヒト由来の細胞株を挙げることができるが、ヒトACHN細胞やHK−2細胞等のヒト細胞株をより好ましく挙げることができる。なお、GATA3を発現し得るように形質転換する際に用いるヒト由来の細胞株は、本来GATA3を発現していないヒト細胞株であってもよいし、本来GATA3を発現しているヒト細胞株であってもよい。GATA3遺伝子が組み込まれた発現ベクターを、本来GATA3を発現しているヒト細胞株に導入すると、GATA3がより安定的に発現する点で好ましい。ヒトGATA3遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子は、哺乳動物細胞等で発現するプラスミドベクターにインテグレートされ、公知の方法で前記GATA3遺伝子を発現し得るヒト細胞株に導入され、形質転換細胞株を調製することができる。
【0038】
また、上記レポーター遺伝子としては、ルシフェラーゼ遺伝子、抗生物質耐性遺伝子、重金属耐性遺伝子等、より具体的には、ホタルルシフェラーゼ遺伝子、細菌ルシフェラーゼ遺伝子、レニーラ(Renilla)ルシフェラーゼ遺伝子、フォチヌス(Photinus)ルシフェラーゼ遺伝子、緑色蛍光タンパク質(GFP)遺伝子、強化緑色蛍光タンパク質(EGFP)遺伝子、クロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子、ネオマイシン耐性遺伝子、ピューロマイシン耐性遺伝子、ハイグロマイシン耐性遺伝子、ジフテリアトキシン耐性遺伝子、ペルオキシダーゼ遺伝子、ウレアーゼ遺伝子、カタラーゼ遺伝子、β−グルクロニダーゼ遺伝子、アルカリホスファターゼ遺伝子、β−ガラクトシダーゼ遺伝子等を挙げることができる。
【0039】
本発明におけるレポーター遺伝子の発現の程度を測定する方法としては、レポーター遺伝子の発現を検出又は定量し得る限り制限されないが、ホタルルシフェラーゼ遺伝子をレポーター遺伝子として用いた場合は、ルシフェラーゼの酵素活性を反応産物の蛍光を検出することにより測定する方法が好ましい。さらに好ましくは、ホタルルシフェラーゼレポータープラスミドと同時に導入したコントロールプラスミドから発現したレニーラルシフェラーゼを内部コントロールとして利用するシステム、例えばDual-Luciferase(商標登録)Reporter Assay System(プロメガ社製)などを特に好適に例示することができる。
【0040】
本発明の有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法においては、被検物質を投与した場合の細胞内におけるレポーター遺伝子の発現の程度が、該被検物質を投与しなかった場合の細胞内におけるレポーター遺伝子の発現の程度よりも高いときには、その被検物質はSLCO4C1遺伝子等の有機イオントランスポーター遺伝子の発現増強剤、又は尿毒症治療・予防薬であると判定し、被検物質を投与した場合の細胞内におけるレポーター遺伝子の発現の程度が、該被検物質を投与しなかった場合の細胞内におけるレポーター遺伝子の発現の程度と同等、もしくは低いときには、その被検物質は有機イオントランスポーター遺伝子の発現増強剤、又は尿毒症治療・予防薬でないと判定することができる。
【0041】
また、本発明のGATA遺伝子の発現抑制剤のスクリーニング方法においては、被検物質を投与した場合の細胞内におけるレポーター遺伝子の発現の程度が、該被検物質を投与しなかった場合の細胞内におけるレポーター遺伝子の発現の程度よりも低いときには、その被検物質はGATA遺伝子の発現抑制剤、又は尿毒症治療・予防薬であると判定し、被検物質を投与した場合の細胞内におけるレポーター遺伝子の発現の程度が、該被検物質を投与しなかった場合の細胞内におけるレポーター遺伝子の発現の程度と同等、もしくは高いときには、その被検物質はGATA遺伝子の発現増強剤、又は尿毒症治療・予防薬でないと判定することができる。
【0042】
本発明における被検物質としては、任意の物質を使用することができ、例えば、個々の低分子合成化合物でもよいし、天然物抽出物中に存在する化合物でもよく、あるいは化合物ライブラリー、ファージディスプレーライブラリー、コンビナトリアルライブラリーでもよい。化合物ライブラリーの構築は当業者に公知であり、また市販の化合物ライブラリーを使用することもできる。
【実施例】
【0043】
以下、実施例によって本発明を具体的に説明するが、これらは本発明の範囲を限定するものではない。
【0044】
ACHN細胞及びHK−2細胞(ATCC(American Type Culture Collection)より入手)はRPMI1640培地(GIBCO社製)に最終濃度で10%ウシ胎児血清(FBS)(GIBCO社製)、100IU/mlペニシリンと10μg/mlストレプトマイシン(GIBCO社製)となるように添加し、37℃、5%CO2濃度の条件で培養した。
【0045】
[N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンはSLCO4C1の発現を増強する]
N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンがACHN細胞やHK−2細胞におけるSLCO4C1のmRNA発現へ与える影響を調べた。6穴細胞培養プレートに5×105個のACHN細胞又はHK−2細胞を蒔いた後、24時間インキュベーションした。その後、各試薬(N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン 1、3、10、30μM、又は0.1%DMSO)を含んだ培地に交換し、24時間インキュベーションした後にRNAを抽出した。N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンを含んだ培地は、まず、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンをDMSOで1mM、3mM、10mM、30mMの溶液に調整したものを、培地に1/1000量加えて調整した。0.1%DMSOは、コントロールである。SuperScript III(Invitrogen社製)を用いてcDNAを作製したのち、GAPDH(glyceraldehyde-3-phosphate dehydrogenase、グリセルアルデヒド3リン酸脱水素酵素)を内部標準としてSLCO4C1のmRNAの発現を定量PCRで測定した。細胞培養培地には腎上皮細胞培養キット(Lonza社製)を用い、定量PCRはTaqMan(登録商標)Gene Expression Assaysを使用し(GAPDH;Assay ID: Rn99999916_s1、SLCO4C1;Assay ID: Rn01427754_m1のTaqMan(登録商標)プローブ(Applied Biosystems社製)を使用)、Step One Plus Real-Time PCR System(Applied Biosystems社製)により行った。その結果、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、ACHN細胞及びHK−2細胞においてSLCO4C1の発現を増強することが示された(図1、2)。
【0046】
[N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンはインドキシル硫酸によるSLCO4C1の発現抑制作用を解除する]
次に、インドキシル硫酸及びN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンがACHN細胞やHK−2細胞におけるSLCO4C1のmRNA発現へ与える影響を調べた。6穴細胞培養プレートに5×105個のACHN細胞又はHK−2細胞を蒔いた後、24時間インキュベーションした。その後、各試薬(インドキシル硫酸(0.3、1、又は3mM)、インドキシル硫酸 1mM及びN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン 10μM、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン 10μM、又はDMSO 0.1%)を含んだ培地に交換し、24時間インキュベーションした後にRNAを抽出した。SuperScript III(Invitrogen社製)を用いてcDNAを作製したのち、GAPDH(glyceraldehyde-3-phosphate dehydrogenase、グリセルアルデヒド3リン酸脱水素酵素)を内部標準としてSLCO4C1のmRNAの発現を定量PCRで測定した。細胞培養培地には腎上皮細胞培養キット(Lonza社製)を用い、定量PCRはTaqMan(登録商標)Gene Expression Assaysを使用し(GAPDH;Assay ID: Rn99999916_s1、SLCO4C1;Assay ID: Rn01427754_m1のTaqMan(登録商標)プローブ(Applied Biosystems社製)を使用)、Step One Plus Real-Time PCR System(Applied Biosystems社製)により行った。その結果、尿毒症物質のひとつであるインドキシル硫酸はSLCO4C1の発現を抑制するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、ACHN細胞及びHK−2細胞において、インドキシル硫酸により低下したSLCO4C1の発現を回復させることが示された(図3、4)。
【0047】
[N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンはGATA3の発現を抑制し、インドキシル硫酸によるGATA3の発現増強作用を解除する]
次に、インドキシル硫酸及びN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンがACHN細胞やHK−2細胞におけるGATA3のmRNA発現へ与える影響を調べた。6穴細胞培養プレートに5×105個のACHN細胞又はHK−2細胞を蒔いた後、24時間インキュベーションした。その後各試薬(インドキシル硫酸(0.3、1、又は3mM)、インドキシル硫酸 1mM及びN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン 10μM、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン 10μM、又はDMSO DMSO 0.1%)を含んだ培地に交換し、24時間インキュベーションした後にRNAを抽出した。SuperScript III(Invitrogen社製)を用いてcDNAを作製したのち、GAPDH(glyceraldehyde-3-phosphate dehydrogenase、グリセルアルデヒド3リン酸脱水素酵素)を内部標準としてGATA3のmRNAの発現を定量PCRで測定した。細胞培養培地には腎上皮細胞培養キット(Lonza社製)を用い、定量PCRはTaqMan(登録商標)Gene Expression Assaysを使用し(GAPDH;Assay ID: Rn99999916_s1、GATA3;Assay ID: Hs00231122_m1のTaqMan(登録商標)プローブ(Applied Biosystems社製)を使用)、Step One Plus Real-Time PCR System(Applied Biosystems社製)により行った。その結果、HK−2細胞においてN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンはGATA3の発現を抑制し、また尿毒症物質のひとつであるインドキシル硫酸はGATA3の発現を増強するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、インドキシル硫酸により増加したGATA3の発現を減少させることが示された(図5)。また、ACHN細胞において尿毒症物質のひとつであるインドキシル硫酸はGATA3の発現を増強するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、インドキシル硫酸により増加したGATA3の発現を減少させることが示された(図6)。
【0048】
以上より、SLCO4C1の発現は、スタチンにより促進され、GATA3などにより抑制されるが、GATA阻害剤N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、このGATA3を介した制御を阻害することにより、SLCO4C1の発現を増強するというGATA仮説が考えられた(図7)。また、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンが、(1)尿毒症物質とGATAタンパク質の結合阻害によるSLCO4C1転写抑制を阻害すること及び、(2)尿毒症物質によるGATA3転写増強を阻害することの2つのはたらきにより、GATA3を介した制御を阻害することが考えられた(図8)。
【0049】
[N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、インドキシル硫酸による転写レベルでのSLCO4C1遺伝子発現の抑制作用及びGATA3遺伝子発現の増強作用を解除する]
次に、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン及びインドキシル硫酸がSLCO4C1及びGATA3遺伝子の転写活性へ与える影響を調べるため、ヒトSLCO4C1遺伝子の5’上流転写調節領域及びGATA3遺伝子の5’上流転写調節領域のプロモーター活性を調べる、ルシフェラーゼレポーターアッセイを以下の方法で行った。
【0050】
(プラスミドDNA)
SLCO4C1遺伝子の5’上流転写調節領域のプロモーター活性ルシフェラーゼアッセイ用のプラスミドベクターSLCO4C1-3886/+110-pGL3cは、翻訳開始点より−3886から+110bpの長さの領域を、ゲノムDNAをテンプレートに、配列番号1及び配列番号2のプライマーを用いて、PCR法を用いて増幅し、pGL3 basic luciferase expression vector(Promega社製)に挿入して作製した。GATA3遺伝子の5’上流転写調節領域のプロモーター活性ルシフェラーゼアッセイ用のプラスミドベクターpGATA3-lucは、GATA3プロモーター領域の3.5kbを、ゲノムDNAをテンプレートに、配列番号3及び配列番号4のプライマーを用いて、PCR法を用いて増幅し、制限酵素BamHIとNcoIで切り出し、ホタルルシフェラーゼタンパク質をコードする2kbの遺伝子カセットとインフレームで連続してpBluscriptSK+(Novagen社製)ベクターに挿入することで作製した。
【0051】
(トランスフェクションとルシフェラーゼレポーターアッセイ)
24穴細胞培養プレートにACHN細胞を1穴あたり20×104個の細胞数で調整して継代し、検鏡下で70−80%の細胞密度となったACHN細胞に対してルシフェラーゼレポーターアッセイ用のプラスミドDNAのトランスフェクションを施行した。トランスフェクション用の溶液組成は、1穴あたりFire fly luciferase vector(SLCO4C1-3886/+110-pGL 1.2μg又はpGATA3-luc 2μg)、Renilla Luciferase Reporter VectorとしてpRh-TK (Promega社製)50ng、トランスフェクション試薬としてLipofectamine2000(Invitrogen社製)2μlを無血清培地のOptiMEM−I(GIBCO社製)100μlに混合してから室温で20分インキュベーションして調製した。このトランスフェクション用溶液を、無血清のOptiMEM−I培地0.5mlでプレインキュベーションした24穴細胞培養プレートのACHN細胞に添加し、37℃、5%CO2にて無血清かつ抗生物質添加無しで4時間インキュベーションした。その後、培地を各試薬(インドキシル硫酸(100μM)、インドキシル硫酸(100μM)及びN,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジン(10μM)、又はDMSO(0.1%))を添加した通常培地(10%FBS、100IU/mlペニシリン、10μg/mlストレプトマイシンを含むRPMI1640培地)に交換し、さらに37℃、5%CO2にて44時間インキュベーションした。その後に、培地を無血清のPBS0.5mlに置換して細胞を穏やかに洗浄しPBSを吸引除去する作業を2回施行してから、passive lysis buffer(Promega社製)100μl加えて20分室温にて混和し溶解した。ルシフェラーゼレポーターアッセイはDual Luciferase Reporter Assay System(Promega社製)にて、ルミノメーターLumat LB9507(NERTHOLD TECHNOLOGIES社製)を用いてホタルルシフェラーゼ及びレニーラルシフェラーゼ量を測定した。そして、ホタルルシフェラーゼ量をレニーラルシフェラーゼ量で割ることにより、SLCO4C1及びGATA3遺伝子の転写活性を算出した。
【0052】
DMSOを添加したコントロールサンプルの転写活性を1とした場合の、インドキシル硫酸を添加した場合のSLCO4C1遺伝子又はGATA3遺伝子の転写活性を図9に示す。その結果、インドキシル硫酸添加によりSLCO4C1遺伝子の転写活性はコントロールの56%まで減少するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンの添加によりSLCO4C1遺伝子の転写活性はコントロールの85%に回復した(図9左グラフ)。また、インドキシル硫酸添加によりGATA3遺伝子の転写活性はコントロールの138%まで増加するが、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンの添加によりGATA3遺伝子の転写活性はコントロールの83%に減少した(図9右グラフ)。すなわち、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンは、インドキシル硫酸による、転写レベルでのSLCO4C1遺伝子発現の抑制作用及びGATA3遺伝子発現の増強作用を、解除することが示された。
【0053】
以上の結果より、N,N’−ビス[5−(3,4,5−トリメトキシフェニル)−4−ペンテニル]ホモピペラジンが尿毒症物質によるSLCO4C1及びエリスロポエチンの発現の抑制を阻害することが示唆された(図10)。
【産業上の利用可能性】
【0054】
本発明は、有機イオントランスポーター発現増強剤やGATA発現抑制剤、尿毒症治療・予防薬の分野に好適に利用することができる。また、有機イオントランスポーター発現増強剤やGATA発現抑制剤のスクリーニング方法の分野に好適に利用することができる。
【特許請求の範囲】
【請求項1】
GATA阻害剤を有効成分とすることを特徴とする有機イオントランスポーター発現増強剤。
【請求項2】
尿毒症物質による有機イオントランスポーター発現抑制の解除作用を有することを特徴とする請求項1記載の有機イオントランスポーター発現増強剤。
【請求項3】
GATA阻害剤が、N,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジンであることを特徴とする請求項1又は2記載の有機イオントランスポーター発現増強剤。
【請求項4】
有機イオントランスポーターが、ヒト有機アニオントランスポーターSLCO4C1であることを特徴とする請求項1〜3のいずれか記載の有機イオントランスポーター発現増強剤。
【請求項5】
請求項1〜4のいずれか記載の有機イオントランスポーター発現増強剤を含むことを特徴とする尿毒症治療・予防薬。
【請求項6】
以下の(a)〜(e)の工程を備えたことを特徴とする有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法。
(a)GATA結合配列を含む有機イオントランスポーター遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;
(b)構築したレポータープラスミドを、有機イオントランスポーター遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;
(c)調製した形質転換細胞株に被検物質を接触させる工程;
(d)レポーター遺伝子の発現の程度を測定する工程;
(e)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が大きい場合、被検物質を有機イオントランスポーター遺伝子の発現を増強する活性を有する物質と判定する工程;
【請求項7】
有機イオントランスポーターが、ヒト有機アニオントランスポーターSLCO4C1であることを特徴とする請求項6記載のスクリーニング方法。
【請求項8】
工程(b)において、構築したレポータープラスミドに加えてGATA発現プラスミドを用いることを特徴とする請求項6又は7記載のスクリーニング方法。
【請求項9】
工程(c)において、尿毒症物質又はGATA結合促進物質の存在下で、被験物質を接触させることを特徴とする請求項6〜8のいずれか記載のスクリーニング方法。
【請求項10】
レポーター遺伝子がルシフェラーゼ遺伝子であることを特徴とする請求項6〜9のいずれかに記載のスクリーニング方法。
【請求項11】
GATA阻害剤を有効成分とすることを特徴とするGATA発現抑制剤。
【請求項12】
尿毒症物質によるGATA発現増強の解除作用を有することを特徴とする請求項11記載のGATA発現抑制剤。
【請求項13】
GATA阻害剤が、N,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジンであることを特徴とする請求項11又は12記載のGATA発現抑制剤。
【請求項14】
請求項11〜13のいずれか記載のGATA発現抑制剤を含むことを特徴とする尿毒症治療・予防薬。
【請求項15】
以下の(a’)〜(e’)のステップを備えたことを特徴とするGATA遺伝子の発現抑制剤のスクリーニング方法。
(a’)GATA遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;
(b’)構築したレポータープラスミドを、GATA遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;
(c’)調製した形質転換細胞株に被検物質を接触させる工程;
(d’)レポーター遺伝子の発現の程度を測定する工程;
(e’)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が小さい場合、被検物質をGATA遺伝子の発現を抑制する活性を有する物質と判定する工程;
【請求項16】
工程(c’)において、尿毒症物質の存在下に被験物質を接触させることを特徴とする請求項15記載のGATA遺伝子の発現抑制剤のスクリーニング方法。
【請求項17】
レポーター遺伝子がルシフェラーゼ遺伝子であることを特徴とする請求項15又は16に記載のGATA遺伝子の発現抑制剤のスクリーニング方法。
【請求項1】
GATA阻害剤を有効成分とすることを特徴とする有機イオントランスポーター発現増強剤。
【請求項2】
尿毒症物質による有機イオントランスポーター発現抑制の解除作用を有することを特徴とする請求項1記載の有機イオントランスポーター発現増強剤。
【請求項3】
GATA阻害剤が、N,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジンであることを特徴とする請求項1又は2記載の有機イオントランスポーター発現増強剤。
【請求項4】
有機イオントランスポーターが、ヒト有機アニオントランスポーターSLCO4C1であることを特徴とする請求項1〜3のいずれか記載の有機イオントランスポーター発現増強剤。
【請求項5】
請求項1〜4のいずれか記載の有機イオントランスポーター発現増強剤を含むことを特徴とする尿毒症治療・予防薬。
【請求項6】
以下の(a)〜(e)の工程を備えたことを特徴とする有機イオントランスポーター遺伝子の発現増強剤のスクリーニング方法。
(a)GATA結合配列を含む有機イオントランスポーター遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;
(b)構築したレポータープラスミドを、有機イオントランスポーター遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;
(c)調製した形質転換細胞株に被検物質を接触させる工程;
(d)レポーター遺伝子の発現の程度を測定する工程;
(e)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が大きい場合、被検物質を有機イオントランスポーター遺伝子の発現を増強する活性を有する物質と判定する工程;
【請求項7】
有機イオントランスポーターが、ヒト有機アニオントランスポーターSLCO4C1であることを特徴とする請求項6記載のスクリーニング方法。
【請求項8】
工程(b)において、構築したレポータープラスミドに加えてGATA発現プラスミドを用いることを特徴とする請求項6又は7記載のスクリーニング方法。
【請求項9】
工程(c)において、尿毒症物質又はGATA結合促進物質の存在下で、被験物質を接触させることを特徴とする請求項6〜8のいずれか記載のスクリーニング方法。
【請求項10】
レポーター遺伝子がルシフェラーゼ遺伝子であることを特徴とする請求項6〜9のいずれかに記載のスクリーニング方法。
【請求項11】
GATA阻害剤を有効成分とすることを特徴とするGATA発現抑制剤。
【請求項12】
尿毒症物質によるGATA発現増強の解除作用を有することを特徴とする請求項11記載のGATA発現抑制剤。
【請求項13】
GATA阻害剤が、N,N’−ビス[5−(3,4,5−トリメトキシメトキシフェニル)−4−ペンテニル]ホモピペラジンであることを特徴とする請求項11又は12記載のGATA発現抑制剤。
【請求項14】
請求項11〜13のいずれか記載のGATA発現抑制剤を含むことを特徴とする尿毒症治療・予防薬。
【請求項15】
以下の(a’)〜(e’)のステップを備えたことを特徴とするGATA遺伝子の発現抑制剤のスクリーニング方法。
(a’)GATA遺伝子の5’上流転写領域の下流にインフレームで連結したレポーター遺伝子をプラスミドに組み込みレポータープラスミドを構築する工程;
(b’)構築したレポータープラスミドを、GATA遺伝子を発現し得る細胞株に導入して形質転換細胞株を調製する工程;
(c’)調製した形質転換細胞株に被検物質を接触させる工程;
(d’)レポーター遺伝子の発現の程度を測定する工程;
(e’)被検物質不存在下の対照と比較してレポーター遺伝子の発現の程度が小さい場合、被検物質をGATA遺伝子の発現を抑制する活性を有する物質と判定する工程;
【請求項16】
工程(c’)において、尿毒症物質の存在下に被験物質を接触させることを特徴とする請求項15記載のGATA遺伝子の発現抑制剤のスクリーニング方法。
【請求項17】
レポーター遺伝子がルシフェラーゼ遺伝子であることを特徴とする請求項15又は16に記載のGATA遺伝子の発現抑制剤のスクリーニング方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2012−111733(P2012−111733A)
【公開日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願番号】特願2010−263955(P2010−263955)
【出願日】平成22年11月26日(2010.11.26)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
【公開日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願日】平成22年11月26日(2010.11.26)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
[ Back to top ]

