Fターム[4B063QS03]の内容
酵素、微生物を含む測定、試験 (178,766) | 処理,操作 (34,251) | 試薬の作製,保存 (2,111) | 化学反応,酵素反応によるもの (2,024) | 標識,発色団等の導入 (974)
Fターム[4B063QS03]に分類される特許
821 - 840 / 974
核酸調製方法、並びに、それを用いた核酸増幅方法、核酸標識方法及び核酸検出方法
【課題】 検体が非標的核酸と標的核酸との混合物である場合に、効果的かつ感度の良い標的核酸に対するPCR増幅、標的核酸の標識、ハイブリダイゼーションによる標的核酸の検出を可能とする検体の前処理として有用な核酸調製方法を提供することにある。
【解決手段】 非標的核酸と標的核酸との混合物に対して非標的核酸に特異的な分離用プローブを作用させて非標的核酸と標的核酸とを分離し、分離された標的核酸をPCR増幅、標識及び検出に用いる。
(もっと読む)
細胞プロセスを観察するための生細胞法
細胞事象の間の化合物、細胞、および細胞成分の活性を観察するための方法が提供される。このような生細胞観察は、その事象を担う生化学的経路に対する種々の化合物および他の分子の機能および影響を評価することを可能にする。本発明の実施形態は、有糸分裂の間のPTTGに対する化合物の影響(特に、このような影響が、異数性および/または癌を処置することに対して有し得る波及)の生細胞観察を記載する。本発明の代替の実施形態は、細胞事象に対する所望の効果に関して化合物(例えば、異数性または癌の処置において有効であり得る化合物)を効率的に同定および検査するための、生細胞法とハイスループットスクリーニングとの組み合わせを記載する。 (もっと読む)
疾患を検出するための、DNAユークロマチンを同定し評価する方法
本発明は、生物学的細胞中のDNAユークロマチンを同定し評価する方法である。DNAユークロマチンの量及び/又は分布状態は、RNA/タンパク質合成と一般に関係があり、疾患、且つ/或いは環境及び/又は化学物質に対する細胞応答などの、いくつかの条件において変化する可能性がある。本発明は、表面上は正常な細胞中のDNAユークロマチンを評価することによって、疾患の潜在的な存在を検出し、治療応答性をモニターし評価するための手段を同様に提供する。本発明を使用して、環境、放射、化学物質、薬剤、薬草、ビタミンなどの、影響を加える(或いは除去する)ことがどのように相互作用して、細胞に影響を与えるかを評価し、健康状態の調査及び薬理学的スクリーニングの際の使用を確立させることもできる。 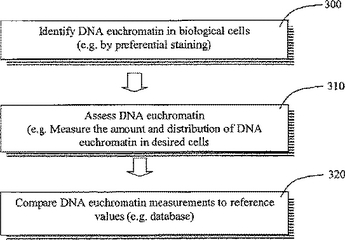 (もっと読む)
(もっと読む)
バイオマーカープロフィールを用いた敗血症またはSIRSの診断
敗血症の早期予測または診断により、疾患が初期段階を超えて迅速に進行し、高い死亡率と関連する重篤な敗血症または敗血症性ショックなどのより重篤な段階となる前に臨床行為を有利に行うことができる。早期予測または診断は、個体のバイオマーカーの発現のプロフィールを、敗血症を発生する集団を含み得る1つまたは複数の対照すなわち参照集団から得たプロフィールと比較することを含む分子診断学的手法によって行う。敗血症の発症に特徴的な個体のバイオマーカープロフィールの特性を認識することにより、臨床医が単一時点の個体の単離した体液から敗血症の発症を診断することが可能になる。したがって、患者を経時的に監視する必要性が回避され、敗血症の重大な症状が発症する前に臨床行為を行うことが有利に可能となる。 (もっと読む)
プロテインキナーゼ活性の解析方法
【課題】安価な物質を用いて迅速でしかも特別な技術を必要としない簡易な手法により基質ペプチドのリン酸化を検出することにより、特に種々のプロテインキナーゼにおける動態を網羅的にプロファイリングできる方法を提供する。
【解決手段】少なくとも1種のプロテインキナーゼの基質となる対応する少なくとも1種のペプチドが基板の金属薄膜上に固定化されてなるアレイ上における該ペプチドのリン酸化を検出する方法であって、リン酸化の検出に際してビオチンにより修飾された例えば式(I)に示すような、分子量が500〜1000の範囲のポリアミン亜鉛錯体を作用させ、好ましくはその後アビジンもしくはストレプトアビジンを作用させることを特徴とするプロテインキナーゼ活性の解析方法。
【化1】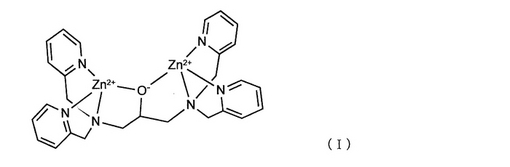 (もっと読む)
(もっと読む)
蛍光ポリマーと消光剤−連結鎖−リガンド・バイオコンジュゲートとを使用するバイオセンシング法
ビオチン化蛍光ポリマーとビオチン結合タンパク質との複合体および該蛍光ポリマー複合体でコートされた固体支持体が述べられる。この複合体は生物学的認識事象(たとえば、核酸ハイブリダイゼーション反応または酵素誘導ポリペプチド開裂)の検出センサとして使用することができる。この複合体の作製方法ならびに試料中の標的検体の存在および/または量を検出するためのこの複合体の使用方法も述べられる。標的検体は酵素(たとえば、β−セクレターゼ)または核酸(たとえば、1本鎖または2本鎖核酸)であってよい。  (もっと読む)
(もっと読む)
抗体または好中球を介するオゾン生成
本発明は、活性酸素種を生じ得る抗体および好中球の検出方法を提供する。 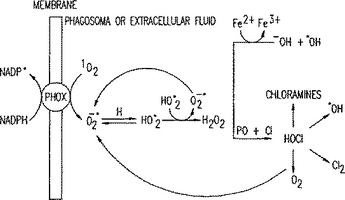 (もっと読む)
(もっと読む)
非オワンクラゲヒドロ虫種由来の蛍光たんぱく質および色素たんぱく質、並びにそれらの使用方法
本発明は、蛍光および色素たんぱく質並びにその変異体、変形体および誘導体をコード化する核酸分子、並びにこれらの核酸によってコード化されたたんぱく質およびペプチドを提供する。興味ある核酸分子およびたんぱく質は、非オワンクラゲヒドロ虫網種から分離する。興味あるたんぱく質としては、コザラクラゲ種由来の黄色蛍光たんぱく質、phiYFP;花水母亜目のヒドロ虫クラゲ由来の緑色蛍光たんぱく質、hydr1GFPおよび紫色色素たんぱく質、hm2CPがある。また、上述の特定のたんぱく質と実質的に同様なたんぱく質、またはその誘導体、相同物もしくは変異体も興味がある。また、上記核酸のフラグメントおよびそれによってコード化されるペプチド、並びに本発明のたんぱく質およびペプチドに対し特異性の抗体も提供する。さらに、上述の核酸分子を含む宿主細胞、安定な細胞系およびトランスジェニック生物体も提供する。本発明のたんぱく質および核酸組成物は、種々の異なる用途および方法における、とりわけ生体分子、細胞または細胞オルガネラの標識化においての使用を見出している。最後に、そのような方法および用途において使用するキットも提供する。 (もっと読む)
多様な癌の治療および検出のための組成物および方法
本発明は、癌細胞の増殖を抑制するための方法、さらには脳、肺、乳房、前立腺および結腸の癌を含むさまざまな癌の検出および治療のための方法を提供する。本方法は、癌細胞を、GDOX分子の生物活性を妨げる分子と接触させることを含む。1つの態様において、この分子はGDOXペプチドに対する抗体である。また別の態様において、この分子はGDOX核酸分子に対するアンチセンスヌクレオチド、またはGDOXペプチドもしくはGDOXペプチドをコードするポリヌクレオチドを含むワクチンである。本発明はさらに、GDOX関連分子を用いる癌の検出および治療のための方法も提供する。 (もっと読む)
糖尿病の迅速スクリーニングのアッセイ方法およびキット
本発明は、糖尿病の迅速スクリーニング用の生体内スクリーニングアッセイおよび生体外スクリーニングアッセイを提供する。本発明の方法は、患者の眼液中の第一のグルコース濃度を測定すること;炭水化物の負荷を患者に経口的に投与すること;炭水化物の負荷を経口的に投与した後、50分未満の時間に、患者の眼液中の第二のグルコース濃度を測定すること;第二のグルコース濃度を第一のグルコース濃度と比較して、患者が糖尿病患者である可能性を決定することを含む。本発明の方法は、本発明のキットを用いることにより行われる。キットは、(1)グルコース感知性眼用デバイスおよびグルコース感知性眼用デバイスを使用して糖尿病をスクリーニングするための使用説明書、または(2)2以上の涙液収集デバイス、およびグルコースと特異的に反応して検知可能なシグナルを形成する試験剤組成物を含む。グルコース感知性眼用デバイスは、特異的に且つ可逆的にグルコースと相互作用し、濃度依存的に変化する検知可能な光学的シグナルを形成する試験剤組成物を含む。  (もっと読む)
(もっと読む)
単一の反応槽において処理される生体試料中に存在する、標的の核酸の標識及び精製方法
【課題】単一の反応槽において処理される生体試料中に存在する、標的の核酸の標識及び精製方法の提供。
【解決手段】本発明は、処理される生体試料中に存在する標的の核酸の標識及び精製方法であって、
以下:
・単一の反応槽の使用、
・生体試料、核酸用の少なくとも1つの標識試薬、上記核酸を吸着できる少なくとも1つの固体支持体、並びに、核酸の標識及び/又は支持体上への上記核酸の固定に必要な任意の成分の、反応槽中への導入、
・反応槽内容物のインキュベート、並びに、
・上記で標識された核酸の分離:を含むことを特徴とする方法に関する。
本発明は、診断分野で使用されることが好ましい。
(もっと読む)
リアルタイムRT−PCRによるHDVの定量的検出
HDVの定量アッセイ用の、より具体的には慢性的に感染した患者においてHDVウイルス量を追跡するための特異的試薬、及びそのような定量的アッセイ。 (もっと読む)
βアミロイド前駆体タンパク質の構造およびプロセシングを調節する薬剤の同定のための方法
本発明はアミロイド前駆体タンパク質(AP)の切断を改変できる分子構造の大型のライブラリから薬剤をスクリーニングして発見するための方法を提供する。APPの切断を変化させる本発明の方法により発見される薬剤は、アルツハイマー病の治療および予防のために使用できる。更にまた、方法はAPPプロセシングのための条件と同じか同一である生理学的条件を可能にするインビボの系において実施される薬剤は、特にペプチド薬剤は、アルツハイマー病または他の何れかのアミロイド関連またはプリオン関連の疾患を治療するための、ペプチドミメティック、等配電子置換化合物、D−アミノ酸類縁体、または、非ペプチジル化合物に変換される。薬剤またはその誘導体は静脈内、非経腸、局所、除放性、鼻内または吸入の用途のために製剤できる。 (もっと読む)
Wnt16シグナル伝達を阻害する因子を使用して癌を治療するための方法
本発明は、細胞、特にWnt16タンパク質を過剰発現する癌細胞の増殖を阻害する方法に関する。本方法は、Wnt16 mRNAまたはWnt16タンパク質に結合し、Wnt16シグナル伝達を妨害し、または別のタンパク質、例えば、フリッツルド(Frizzled)受容体などへのWnt16タンパク質の結合を阻害する因子と細胞を接触させる工程を含む。
 (もっと読む)
(もっと読む)
バイオマーカーを用いたアッセイおよび方法
哺乳動物組織または細胞試料における一ないし複数のバイオマーカーの発現を検査する方法およびアッセイを提供する。開示した方法およびアッセイによって、一ないし複数のバイオマーカーの発現の検出が、該組織または細胞試料がApo2L/TRAILおよび抗DR5アゴニスト抗体などのアポトーシス誘導剤に対して感受性があるか否かを予測するものである。試験しうる特定のバイオマーカーには、フコシルトランスフェラーゼ、特にフコシルトランスフェラーゼ3(FUT3)および/またはフコシルトランスフェラーゼ6(FUT6)、並びにシアリルルイスAおよび/またはX抗原が含まれる。また、キットおよび製造品も提供される。 (もっと読む)
プリオン蛋白質に特異的に結合する核酸分子
【課題】 正常型プリオンから異常型プリオンへの変化に必要と推測されるオクタリピートを含む正常型プリオン蛋白質(PrPc)のN末端23-89はグリシンに富み、安定な3次構造を構成しているとは考えられず、N末端23-89の部分のみを薬剤のターゲットとすることは困難である。プリオン病の診断、予防および治療に使用しうる、プリオン蛋白質に特異的に結合する分子を選択する際には、全長プリオン蛋白質を標的とする必要がある。
【解決手段】 プリオン蛋白質を識別可能な核酸分子の同定および分離のための方法、ならびにこの方法により得られる核酸分子を記載する。さらに、プリオン蛋白質に特異的に結合する核酸分子を含む医薬組成物および診断用組成物、ならびに係る分子を用いる診断方法が記載される。
(もっと読む)
核酸検出方法
複数の核酸分子の中で既知の配列を有する標的核酸分子を検出するための方法を開示する。該方法は、標的核酸分子上の隣接したヌクレオチド配列に2つのオリゴヌクレオチドをハイブリダイズさせること、2つのオリゴヌクレオチドを互いに連結すること、および標的核酸分子上の5’ヌクレオチド配列にハイブリダイズしたオリゴヌクレオチドの3’末端にハイブリダイズしたプライマーを伸長させることを含む。標的核酸分子が存在する(および、それによって2つのオリゴヌクレオチドが連結される)場合、プライマーの伸長によって、標的核酸分子上の3’ヌクレオチド配列にハイブリダイズしたオリゴヌクレオチドの5’末端にハイブリダイズした検出プローブが除去される。本発明の方法を実施するためのキットも提供される。 (もっと読む)
糖たん白質糖鎖の分析方法及び非標識糖鎖の製造方法
【課題】 糖たん白質糖鎖の分析方法であって、操作が簡便で迅速な分析を可能にするとともに、糖鎖混合物の分離に優れかつ感度及び定量性の面で優れ、かつ装置上の問題もない分析方法、及び、構造が既知の非標識糖鎖を、実用上の問題もなく安定的に製造、供給することができる製造技術を提供する。
【解決手段】 pH6−9に保たれた水溶液中で、糖たん白質よりN−結合型糖鎖を遊離し、遊離されたグリコシルアミン型糖鎖のアミノ基に対し蛍光標識を行う工程、この蛍光標識されたグリコシルアミン型糖鎖をHPLC−FLDにより分析する工程を有することを特徴とする糖たん白質糖鎖の分析方法、及びHPLC−FLDにより分析するとともに分取し、分取された所定フラクション中のグリコシルアミン型糖鎖の蛍光性官能基を脱離することを特徴とする非標識糖鎖の製造方法。
(もっと読む)
生物活性化合物
一般式(I)の化合物(ZはCR3R4であり、R3およびR4は独立してC0−7−アルキルから選択され、P1はCR5R6であり、P2はO、CR7R8またはNR9であり、YはCR10R11−C(O)またはCR10R11−S(O)またはCR10R11−SO2であり、(X)oはCR16R17であり、(W)nはO、S、C(O)、S(O)、もしくはS(O)2またはNR18であり、(V)mはC(O)、C(S)、S(O)、S(O)2、S(O)2NH、OC(O)、NHC(O)、NHS(O)、NHS(O)2、OC(O)NH、C(O)NHもしくはCR19R20、C=N−C(O)−OR19またはC=N−C(O)NHR19であり、Uは安定な、飽和または不飽和の、0〜4個のヘテロ原子を含有する5〜7員の単環または8〜11員の二環である)、並びにその塩、水和物、溶媒和物、錯体およびプロドラッグは、カテプシンKの阻害剤および他のシステインプロテアーゼの阻害剤であり、例えば、骨粗鬆症、パジェット病、歯肉炎および歯周炎のような歯肉疾患、悪性腫瘍の高カルシウム血症、代謝性骨疾患、マトリックスまたは軟骨の分解を伴う疾患、特に、変形性関節症および関節リウマチ、並びに腫瘍性疾患において、治療剤として有用である。前記化合物はまた、治療標的化合物のバリデーションにも有用である。
【化1】
 (もっと読む)
(もっと読む)
アルツハイマー病で使用するためのSrcキナーゼの阻害剤
本発明は、Srcキナーゼ阻害剤の同定、このような同定に有用な分析および方法、ならびに、アルツハイマー病を治療するための医薬を製造するためのSrc阻害剤の使用に関する。  (もっと読む)
(もっと読む)
821 - 840 / 974
[ Back to top ]


