Fターム[4C050CC04]の内容
Fターム[4C050CC04]に分類される特許
321 - 340 / 849
増殖性疾患の治療において使用するためのイミダゾリル−ピリミジン化合物
【課題】細胞周期阻害活性を保有するの化合物の提供。
【解決手段】式(I)の化合物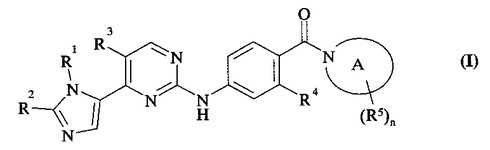
R1は、エチル、プロピル、イソプロピル、ブチル等、R2は、メチル、エチル、イソプロピル、フルオロメチル、ジフルオロメチル等、R3は、水素又はハロであり、R4は、水素、エチニル、ハロ、ニトロ、シアノ、ヒドロキシ、アミノ等、環Aは、一つの更なる窒素、酸素又は硫黄原子を所望により含有していてもよい窒素連結の4−7員の飽和の環等で、R5は、炭素上の置換基であり、ハロ、ニトロ、シアノ、ヒドロキシ、アミノ等で、nは、0−2であり;ここにおいてR5の意義は、同一又は異なっていることができる。
(もっと読む)
キナーゼ阻害剤としての5−アルキル/アルケニル−3−シアノピリジン
式Iの化合物が記載されている[式中、Gは、薬学的に許容できるその塩であり、J、X、R1、R2、R11、R12’およびpは、本明細書で定義される通りである]。また、式Iの化合物を製造する方法および哺乳動物においてタンパク質キナーゼに関連するか、それにより媒介される病状または障害を阻害または治療するためにこれらの化合物を使用する方法が提供されている。
【化1】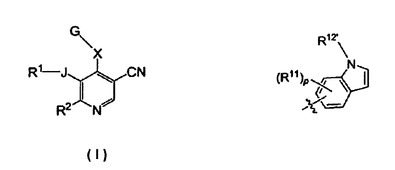
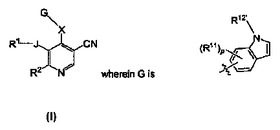 (もっと読む)
(もっと読む)
シクロプロピルアミド化合物の製造方法
【課題】 工業的生産に適した、3−アミノ−2−ヒドロキシヘキサン酸シクロプロピルアミドの効率的な製造方法、該製造方法に有用な中間体化合物及び該中間体化合物の製造方法の提供。
【解決手段】 3−プロピルオキシランカルボン酸シクロプロピルアミドを、金属アジドと反応させ、3−アジド−2−ヒドロキシヘキサン酸シクロプロピルアミドを得た後、これを還元し、3−アミノ−2−ヒドロキシヘキサン酸シクロプロピルアミドを製造する。3−プロピルオキシランカルボン酸シクロプロピルアミドは、3−プロピルオキシランカルボン酸とシクロプロピルアミンと反応させることにより製造する。光学活性な3−アミノ−2−ヒドロキシヘキサン酸シクロプロピルアミドを製造するには、ジアステレオマー法で得られる光学活性な(2S,3R)−3−プロピルオキシランカルボン酸を出発原料とする。
(もっと読む)
有機化合物
遊離または塩または溶媒和物形態の、式I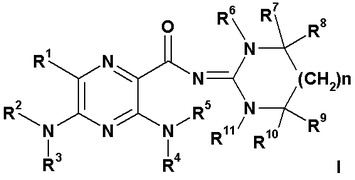
〔式中、R1、R2、R3、R4、R5、R6、R7、R8、R9、R10およびR11は明細書において定義した意味を有する。〕
の化合物は、上皮性ナトリウムチャネルの遮断に応答する疾患の処置に有用である。本化合物を含む医薬組成物および本化合物の製造方法も記載する。  (もっと読む)
(もっと読む)
ヘミシアニンスチリルチオール/ジスルフィド染料、この染料を含む染料組成物、この染料を使用するケラチン物質を明色化するための方法
【課題】ケラチン物質、特にヒトケラチン線維、特に暗色の毛髪を染色するための、既存の漂白方法の欠点を有さない新システムを提供すること。
【解決手段】本発明は、ヘミシアニンスチリルチオールおよびジスルフィド染料を使用するケラチン物質の染色に関する。
本発明は、ヘミシアニンスチリルクロモフォアチオールまたはジスルフィド染料を含む染料組成物に関し、ケラチン物質、特にケラチン線維、特に毛髪などのヒトケラチン線維に対する明色化効果を伴う、前記組成物を用いる染色方法に関する。本発明は、同様に、新規ヘミシアニンスチリルクロモフォアチオール染料およびケラチン物質を明色化することにおけるその使用に関する。
本組成物は、特に暗色のケラチン線維において耐久性がありかつ可視的である明色化効果を伴う着色を得ることを可能にする。
(もっと読む)
殺菌性二環式ピラゾール
式1および1a
【化1】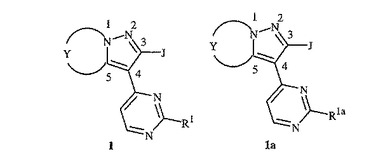
(式中、
R1、R1a、YおよびJは開示中に定義されているとおりである)
の化合物、そのN−オキシドおよび塩が開示されている。式1の化合物を含有する組成物、および、有効量の本発明の化合物または組成物を施用する工程を含む菌類病原体により引き起こされる植物病害を防除する方法もまた開示されている。式1の化合物を式1aの化合物から調製する方法がさらに開示されている。 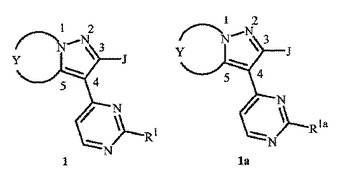 (もっと読む)
(もっと読む)
2−(第一級/第二級アミノ)ヒドロカルビル)−カルバモイル−7−オキソ−2,6−ジアザ−ビシクロ[3.2.0]ヘプタン−6−スルホン酸誘導体の調製方法
式(I)[式中、ALINKERBは、式(V):A[G1−G2*−G3]Bで示されるリンカー部分表し、ここで、A及びBは、式(I)において式(V)で示される基の配向を示し;G1、G2及びG3は、本明細書に記載する特定の意味を有し、存在しても不在であってもよいが、G1又はG3の少なくとも一方が存在することを条件とし;そのリンカー基は、さらに、場合により一つ又は複数の式(VI)で示される基;及び/又は他の置換基を有してもよく;そしてR1は、水素又はC1−C4−アルキル基を表し;R2は、水素又はC1−C4−アルキル基を表し;R3は、その都度独立して水素又はC1−C4−アルキル基を表し;xは、0又は1であり;yは、0又は1であり;zは、その都度独立して、0又は1であり;(−−)は、部分ALINKERBの第一級、第二級又は第三級炭素原子と隣接窒素原子の間の単結合を表す]で示される化合物の製造方法であって、その方法では、(A)式(II)で示される化合物と、式(III)[式中、Prは、t−ブチルオキシカルボニル(t−Boc)、1−メチル−1−(4−ビフェニリル)エチルオキシカルボニル(Bpoc)、1−(1−アダマンチル)−1−メチルエチルオキシカルボニル(Adpoc)、1−(3,5−ジ−t−ブチルフェニル)−1−メチルエチルオキシカルボニル(t−Bumeoc)、1−アダマンチルオキシカルボニル(Adoc)、p−メトキシベンジルオキシカルボニル(Moz)、及びo,p−ジメトキシベンジルオキシカルボニルより選択されるアミノ保護基を表し、ALINKERBは、式(I)と同じ意味を有するが、式(VII)で示される一つ又は複数の随意の基を式(VII)で示される基に置き換えてもよいことを例外とし;R1;R2;R3;x;y;z及び(−−)は、その都度式(I)と同じ意味を有し、Prは上記と同義である]で示される化合物を双極性非プロトン性溶媒中で塩基の存在下で反応させて、式(IV)[式中、Pr;ALINKERB;R1;R2;R3;x;y;z及び(−−)は、その都度、式(III)と同じ意味を有する]で示される化合物を得て、次に、(B)ギ酸又はギ酸若しくは酢酸と塩酸若しくは臭化水素酸との混合物を用いた反応によりその化合物を脱保護し、式(I)で示される化合物及び前記式(IV)で示される化合物を得る。  (もっと読む)
(もっと読む)
禁煙を促進するための化合物及び方法
【課題】禁煙及びその他の疾患を治療するための化合物及び方法を提供する。
【解決手段】式(I)〜(III)で表される化合物及び医薬として許容可能なその塩を活性化合物として用いる。
(もっと読む)
有機トランジスタ
【課題】高い移動度、大きな電流オン/オフ比を有し、保存安定性に優れた有機トランジスタを提供する。
【解決手段】有機半導体層を有する有機トランジスタにおいて、該有機半導体層に一般式(1)で表される化合物を少なくとも1種含有してなる有機トランジスタ。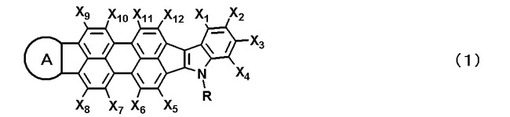
(式中、X1〜X12はそれぞれ独立に、水素原子、ハロゲン原子、直鎖、分岐または環状のアルキル基、直鎖、分岐または環状のアルコキシ基、あるいは置換または未置換のアリール基を表し、Rは水素原子、直鎖、分岐または環状のアルキル基、直鎖、分岐または環状のアルコキシアルキル基、あるいは置換または未置換のアリール基を表し、環Aは置換または未置換のインドール環を表す)
(もっと読む)
複素環化合物及びそれを利用した有機電界発光装置
【課題】複素環化合物及びそれを利用した有機電界発光装置の提供。
【解決手段】化学式1の複素環化合物。(化1)
(Xは、窒素、ホウ素またはリンのうちから選択され、Ar1、Ar2、Ar3及びAr4は、置換または非置換のアリール基、置換または非置換のアリールオキシ基、置換または非置換の複素環基、または置換または非置換の縮合多環基を表す。)本発明の複素環化合物は、高い電気的安定性及び高色純度の青色発光を表して、色純度に優れた青色蛍光発光材料として有用であり、色再現率に優れたトップエミッション型及びボトムエミッション型の有機電界発光装置を提供することができる。
(もっと読む)
ビアリール置換ジアザビシクロアルカン誘導体
本発明は、式(I)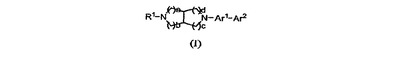
のビアリール置換ジアザビシクロアルカンに関し、より詳細には、ビシクロヘテロアリール置換縮合ジアザビシクロアルカン誘導体、当該化合物を含む組成物、ならびにα7およびα4β2 nAChR活性の両方に関連する状態および障害を治療または予防するのに使用される当該化合物に関する。式(I) 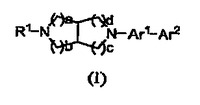 (もっと読む)
(もっと読む)
蛍光標識としてのスルホン化ジアリールローダミン色素
【課題】スルホン化ジアリールローダミン化合物として、ヌクレオシド、ヌクレオチド、ポリヌクレオチド、およびポリペプチドの蛍光標識として有用であるものを提供すること。
【解決手段】本発明の化合物は、蛍光核酸分析(例えば、自動化DNA配列決定)およびフラグメント分析、ハイブリダイゼーションアレイにおけるプローブハイブリダイゼーションの検出、核酸増幅産物の検出などの分野における特定の用途を見出している。本発明の別の局面は、エネルギー移動色素化合物を包含し、この化合物は、第一の波長において光を吸収し、かつそれに応答して励起エネルギーを放射し得る、ドナー色素;このドナー色素によって放射された励起エネルギーを吸収し、かつそれに応答して第二の波長において蛍光を発し得る、アクセプター色素;ならびに、このドナー色素およびアクセプター色素を連結するためのリンカー、を含有する。
(もっと読む)
ペプチドデホルミラーゼ阻害剤
本発明は、ある種の{2−(アルキル)−3−[2−(5−フルオロ−4−ピリミジニル)ヒドラジノ]−3−オキソプロピル}ヒドロキシホルムアミド誘導体、ならびにそれを含む組成物、細菌性ペプチドデホルミラーゼ(PDF)活性の阻害における、および細菌感染症の治療におけるかかる化合物の使用に関する。特に、本発明は、式(I)で示される化合物に関する。  (もっと読む)
(もっと読む)
ロイコトリエンA4ヒドロラーゼのモジュレーターとしてのアリール置換架橋又は縮合ジアミン
アリール置換架橋又は縮合ジアミン化合物、それらを含む医薬組成物、及び受容体A4ヒドロラーゼ(LTA4H又はLTA4H)の調節、並びにアレルギー、喘息、自己免疫性疾病、掻痒症、炎症性大腸疾患、潰瘍性大腸炎、及びアテローム性動脈硬化症と心筋梗塞の予防とを含む心臓血管疾患などのLTA4H活性により媒介される病態、障害及び疾患の治療のために前記化合物及び前記医薬組成物を使用する方法。 (もっと読む)
GPR119の活性のモジュレーターとしての二環式ヘテロ環誘導体およびその使用
本発明は、二環式ヘテロ環誘導体、二環式ヘテロ環誘導体を含む組成物、および患者における肥満症、糖尿病、代謝異常、心血管疾患またはGPR119の活性関連障害を治療または予防するために二環式ヘテロ環誘導体を使用する方法に関する。式(I)、(II)、(III)および(IV)の化合物およびその薬学的に許容される塩、溶媒和物、エステルまたはプロドラッグ(本明細書において「二環式ヘテロ環誘導体」と総称的に呼ばれる)は、患者の肥満症、糖尿病、糖尿病合併症、代謝症候群、心血管疾患またはGPR119の活性関連障害(それぞれは「病状」である)を治療または予防するために有用であり得る。 (もっと読む)
PARP阻害剤としてのキノリノン誘導体
【化1】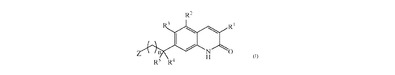
式(I)の化合物(式中、R1、R2、R3、R4、R5、Zおよびnは定めた意味を有する)、そのN−オキシド形、製薬学的に許容され得る付加塩、四級アンモニウム塩および立体化学的異性体、およびそれらのPARP媒介型障害の処置のための使用。
(もっと読む)
ジケトピロロピロール混晶
本発明は、コハク酸ジエステルの1モルと、ニトリルA−CNとニトリルB−CNの混合物の2モルとを反応させることによって得られる次式(I)、(II)および(III)の化合物から成る混晶に関する。
ここで、上記ニトリル混合物中のA−CNとB−CNとは互いに90:10〜30:70のモル比にあり、そしてその際、A−CNが2−クロロベンゾニトリルを意味し、かつ、B−CNが4−X−ベンゾニトリル(式中、Xは、塩素、メチル又はニトリルである。)を意味する。 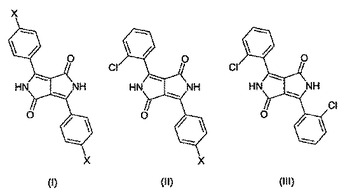 (もっと読む)
(もっと読む)
ピロロピロール誘導体、その製造及び使用
本発明は、式(I)で示され、その式中、置換基が請求項1に定義されるとおりである化合物並びに該化合物を、有機デバイス、例えばダイオード、有機電界効果トランジスタ及び/又は太陽電池における有機半導体として用いる使用に関する。式Iの化合物は、有機溶剤中での優れた可溶性を有する。前記の化合物を半導体デバイスもしくは有機光起電性(PV)デバイス(太陽電池)で使用した場合に、高い効率のエネルギー変換、優れた電界効果移動度、良好なオン/オフ電流比及び/又は優れた安定性を観察できる。  (もっと読む)
(もっと読む)
架橋モノバクタム中間体の製造方法
cisコンホメーションを有する式(I)[式中、R1は、1−フェニル−C1−C4アルキル又は1−ナフチル−C1−C4アルキル基(ここで、R1のフェニル又はナフチル残基は、非置換であるか、又は1個以上のC1−C4アルコキシ基で置換されており、そしてR1のアルキル部分の2位、3位、及び/又は4位にある炭素原子は、R1のフェニル又はナフチル残基とは独立に、かつ互いに独立に、非置換であるか、又はC1−C4アルコキシ及び/又はシリルオキシで置換されているか、あるいは好ましくは非置換であるか、又は炭素原子当たり1個のC1−C4アルコキシ基及び/又はシリルオキシ基で置換されている)を表し、そしてR2は、C1−C6アルキル基又は非置換若しくは置換ベンジル基を表す]の化合物の製造方法であって、式(II)[式中、R3は、C1−C6アルキル基又は非置換若しくは置換ベンジル基を表し、そしてR1及びR2は、式(I)中と同義を有する]の化合物を、0℃以下の温度で液体非プロトン性溶媒中で式(I)の化合物を得るのに充分な時間、塩基で処理する方法。 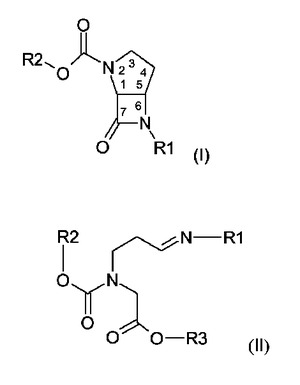 (もっと読む)
(もっと読む)
オクタヒドロ−ピロロ[3,4−B]ピロールN−オキシド
本発明は、CNS−活性化合物のプロドラッグとしてのオクタヒドロ−ピロロ[3,4−b]ピロールN−オキシド、かかる化合物を含む組成物、該化合物、塩および多形体の製造方法、ならびにかかる化合物および組成物を使用して状態および障害を治療する方法に関する。式(I)のオクタヒドロ−ピロロ[3,4−b]ピロールN−オキシドは、ヒスタミン−3アンタゴニストのプロドラッグであり、ヒスタミン−3受容体リガンドによって予防または緩和される状態または障害の治療に有用である。オクタヒドロ−ピロロ[3,4−b]ピロールN−オキシド化合物、かかる化合物の使用方法、それらを製造するための組成物、およびかかる化合物の調製方法が、本明細書に開示される。 (もっと読む)
321 - 340 / 849
[ Back to top ]



