Fターム[4C085BB44]の内容
抗原、抗体含有医薬:生体内診断剤 (92,173) | ハプテン抗原又は抗体 (10,241) | 免疫グロブリン (4,174) | Fc部分を欠くもの (342)
Fターム[4C085BB44]に分類される特許
281 - 300 / 342
子癇前症または子癇の診断方法および治療方法
本明細書に開示されているのは、子癇前症または子癇を診断するための方法である。また本明細書に開示されているのは、VEGFまたはPlGFレベルを増加させる化合物、またはsFlt−1レベルを減少させる化合物を使用する、子癇前症または子癇を治療するための方法である。sFlt−1に対するVEGFまたはPlGFの結合を阻害する化合物もまた、子癇前症または子癇の治療のために本明細書に開示されている。 (もっと読む)
哺乳動物の排卵機能および排卵頻度を改変する新しいGDF−9およびGDF−9B(BMP−15)配列
本発明は、ヒトを含むメスの哺乳動物で、排卵頻度およびそれによる生殖能力を調整する組成物および方法を提供する。本発明は、生殖能力の変化に関連するGDF−9およびGDF−9B遺伝子での新規な変異にも関する。 (もっと読む)
哺乳動物Prickle遺伝子
本発明により哺乳動物のPSD画分に存在する蛋白質をコードするmPrickle遺伝子が提供される。mPrickle蛋白質は、シナプスに局在し、骨格蛋白質PSD−95と結合する。また、抗mPrickle抗体を用いてmPrickleを生体内より沈澱させるとNMDA受容体も一緒に沈澱されることから、NMDA受容体を標的としたドラッグデリバリーシステムにおいてmPrickleを利用することができる。NMDA受容体は学習及び記憶と密接に関連し、精神疾患との関係も指摘されていることから、将来的には、mPrickleを利用したボケ、痴呆等の学習・記憶に関連した神経変性疾患の診断・治療も可能と考えられる。 (もっと読む)
癌性疾患修飾性抗体
ヒトにおいて腫瘍を治療するための癌性疾患修飾性抗体(CDMAB)10A304.7の使用並びにCDMABの単離方法及び製造方法。モノクローナル抗体10A304.7(ATTC受入番号PTA−5065)は、癌細胞に対して細胞傷害性であり、その際、細胞傷害性には、抗体依存性細胞介在性の細胞傷害性(ADCC)及び補体依存性の細胞傷害性(CDC)が介在する。モノクローナル抗体10A304.7は、ヒト腫瘍の疾患の進行を遅延させるのに有用である。 (もっと読む)
アクチビンβCのレベルの調節によって特徴付けられる状態のための診断方法、治療方法、および有用な薬剤
本発明は一般的に、アクチビン発現のレベルの調節によって特徴付けられる状態の発生または進行を診断、予測、またはモニターする方法に関し、より詳細には、アクチビンβCサブユニットの発現のレベルの調節によって特徴付けられる状態の発生または進行を診断、予測、またはモニターする方法に関する。本発明はなおさらに、異常な、望ましくない、またはそうでなければ不適切なアクチビン発現によって特徴付けられる状態、例えば、アクチビンの過剰発現または発現の不足によって特徴付けられる状態、および最も詳細には、アクチビンβCサブユニットの過剰発現または発現の不足によって特徴付けられる状態の、治療的または予防的処置のための方法を提供する。本発明のさらなる局面は、本発明の方法における使用のための薬剤に拡張される。 (もっと読む)
置換体活性化配列を有する修飾されたヘプシン分子及びその使用
本発明は、修飾されたヘプシン分子、又はそのフラグメント又は誘導体、例えば置換体活性化配列を有するそれらを提供する。修飾されたヘプシン分子は、置換体活性化配列で切断され、それにより、天然に存在する野生型ヘプシン分子の機能的活性を示す、修飾されたヘプシン分子、又はそのフラグメント又は誘導体を生成する。 (もっと読む)
治療剤としての免疫毒素及びその利用
本発明は、過増殖性疾患状態のような疾患状態における免疫毒素の作用機序への識見をさらに提供するものである。本発明は、免疫毒素療法によって調節される遺伝子を同定するために、免疫毒素及び遺伝子発現プロファイリングを用いて疾患を治療する新規な方法を提供する。 (もっと読む)
RTP801阻害剤の治療への使用
本発明は微小血管障害、眼疾患および呼吸器障害を治療するための、RTP801遺伝子および/またはタンパク質の阻害を基礎とした、新規な分子、組成物、方法および使用を提供する。 (もっと読む)
Tヘルパー(TH)細胞の発生および機能を調節するための方法および組成物
IL−21(例えば、ヒトIL−21)活性またはレベルのモジュレーターを用いてTヘルパー(Th)細胞の発達および機能を調節する方法および組成物。本発明は、部分的には、サイトカインインターロイキン−21(IL−21)がTヘルパー(Th)細胞のサブセット(Th2細胞)によって発現され、そして、Th1細胞発生の間に、選択的にインターフェロンγ(IFNγ)レベルを阻害するという発見に、一部基づく。より具体的には、本明細書において、IL−21が、インビトロおよびインビボにおいて生成されたTh2細胞によって優先的に発現されることが、示された。1つの実施形態において、発生中のTh細胞のIL−21への暴露は、発生中のTh1細胞からのIFNγレベルを特異的に減少し、従って、Th2応答を増強する。 (もっと読む)
活性酸素種を産生する抗体の抗微生物活性
本発明は、一重項酸素に暴露したときに活性酸素種を産生できる抗体を有する組成物、ならびにその組成物の、例えば、微生物感染を処置するための使用を提供する。 (もっと読む)
mAbCL1−R2から得られる抗CD160特異的化合物の血管新生と免疫の用途
【課題】本発明は、抗CDモノクローナル抗体(CL1−R2 CNCM I−3204)及びその保存的均等物に関する。
【解決手段】更に、特にEC血管新生、NK、及びTサイトカイン生成の分野におけるこれらの抗CD160化合物の適用に関する。
(もっと読む)
VEGF媒介性活性をブロックすることによるI型糖尿病を処置する方法
VEGF媒介性活性をブロックまたは阻害することによって、哺乳動物、特にヒトにおける糖尿病を処置する方法。VEGF媒介性活性の好ましいインヒビターは、VEGFに結合および阻害し得る配列番号2のVEGF融合タンパク質トラップのようなVEGFアンタゴニストである。本発明の方法は、インスリン治療法のような他の治療法と組み合わせられ得る。特定の実施形態において、本発明の処置する方法は、血清グルコースレベルの低下、グルコース耐性の改善、および/または血糖コントロールの改善を生じる。 (もっと読む)
DKK−1に対する抗体
本発明は、Dkk−1ポリペプチド類に特異的に結合する抗体およびその免疫機能性フラグメントを提供する。対象の抗体およびフラグメントは、Dkk−1タンパク質のカルボキシ領域に位置する配座エピトープに高親和性で結合する。このような抗体またはそのフラグメント、ならびに抗体またはそのフラグメントを含有する生理的に受容可能な組成物を調製する方法もまた提供する。骨疾患、炎症性疾患、神経系疾患、眼疾患、腎疾患、肺疾患および皮膚疾患など、種々の疾患を治療するための抗体およびフラグメントの使用法もまた開示する。  (もっと読む)
(もっと読む)
新規な抗IGF−IR抗体及びその使用
本発明は、ヒトインスリン様成長因子I受容体IGF−IRと特異的に結合することができ、且つ/又はそのIGF−IRのチロシンキナーゼ活性を特異的に阻害することができる新規な抗体、特にマウスのモノクローナル抗体、キメラモノクローナル抗体及びヒト化モノクローナル抗体、並びにこれらの抗体をコードするアミノ酸配列及び核酸配列に関する。本発明はまた、IGF−IRを過剰発現する癌又はその受容体の過剰発現に関連した病状の予防的処置及び/又は治療的処置を目的とした薬剤としての、並びにIGF−IRの過剰発現に関連した疾患の診断のための方法又はキットにおけるこれら抗体の使用を含む。本発明は最後に、このような抗体と、抗EGFR抗体、及び/又は抗VEGF抗体、及び/又は腫瘍進行もしくは転移に関与する他の成長因子に対する抗体、及び/又は化合物、及び/又は抗癌剤、又は毒素と共役した物質とを組み合わせて含む、製品及び/又は組成物、並びに特定の癌の予防及び/又は治療のためのその使用に関する。
【配列表】
SEQUENCE LISTING
<110> PIERRE FABRE MEDICAMENT
<120> Novel anti-IGF-IR antibodies and uses thereof
<130> D22514
<140> PCT/IB2005/002619
<141> 2005-07-27
<150> US 60/591 932
<151> 2004-07-29
<150> FR 04/08379
<151> 2004-07-29
<160> 26
<170> PatentIn version 3.1
<210> 1
<211> 16
<212> PRT
<213> Mus musculus
<400> 1
Arg Ser Ser Gln Thr Ile Ile His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> Mus musculus
<400> 2
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 3
<211> 10
<212> PRT
<213> Mus musculus
<400> 3
Phe Gln Gly Ser His Val Pro Tyr Thr Phe
1 5 10
<210> 4
<211> 5
<212> PRT
<213> Mus musculus
<400> 4
Asp Tyr Trp Met Asn
1 5
<210> 5
<211> 17
<212> PRT
<213> Mus musculus
<400> 5
Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe Tyr
1 5 10 15
Asp
<210> 6
<211> 13
<212> PRT
<213> Mus musculus
<400> 6
Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Mus musculus
<400> 7
Lys Ala Ser Gln Asn Val Val Thr Asn Val Ala
1 5 10
<210> 8
<211> 7
<212> PRT
<213> Mus musculus
<400> 8
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> Mus musculus
<400> 9
His Gln Tyr Asn Asn Phe Pro Leu Thr
1 5
<210> 10
<211> 5
<212> PRT
<213> Mus musculus
<400> 10
Glu Tyr Gly Val Ser
1 5
<210> 11
<211> 16
<212> PRT
<213> Mus musculus
<400> 11
Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
<210> 12
<211> 6
<212> PRT
<213> Mus musculus
<400> 12
His Glu Gly Met Asp Tyr
1 5
<210> 13
<211> 11
<212> PRT
<213> Mus musculus
<400> 13
Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn
1 5 10
<210> 14
<211> 7
<212> PRT
<213> Mus musculus
<400> 14
Glu Gly Asn Thr Leu Arg Pro
1 5
<210> 15
<211> 9
<212> PRT
<213> Mus musculus
<400> 15
Leu Gln Ser Asp Lys Met Pro Leu Thr
1 5
<210> 16
<211> 5
<212> PRT
<213> Mus musculus
<400> 16
Asn Tyr Ala Met Ser
1 5
<210> 17
<211> 16
<212> PRT
<213> Mus musculus
<400> 17
Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys Gly
1 5 10 15
<210> 18
<211> 9
<212> PRT
<213> Mus musculus
<400> 18
Glu Gly Gly Leu Val Trp Phe Ala Tyr
1 5
<210> 19
<211> 112
<212> PRT
<213> Mus musculus
<400> 19
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Ile Ile His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 20
<211> 123
<212> PRT
<213> Mus musculus
<400> 20
Gln Ala Gln Leu Gln Gln Pro Gly Ala Val Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Ser Tyr Ser Phe Thr Asp Tyr
20 25 30
Trp Met Asn Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Gln Trp Ile
35 40 45
Gly Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Phe Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 21
<211> 107
<212> PRT
<213> Mus musculus
<400> 21
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Val Thr Asn
20 25 30
Val Ala Trp Tyr Gln His Lys Pro Gly His Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys His Gln Tyr Asn Asn Phe Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 22
<211> 114
<212> PRT
<213> Mus musculus
<400> 22
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 23
<211> 114
<212> PRT
<213> Mus musculus
<400> 23
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 24
<211> 107
<212> PRT
<213> Mus musculus
<400> 24
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Val Ala Thr Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Leu Thr Ile Glu Asn Thr Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Lys Met Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 25
<211> 117
<212> PRT
<213> Mus musculus
<400> 25
Glu Val Asn Leu Val Glu Ser Gly Gly Ile Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Arg Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Gly Leu Val Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 26
<211> 16
<212> PRT
<213> Mus musculus
<400> 26
Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
(もっと読む)
細胞死誘導剤
本発明者らは、2D7抗体の抗原を同定することを目的として、2D7抗原のクローニングを行った。その結果、2D7抗原はHLA class I分子であることが示唆された。本発明者らは、この知見に基づき、2D7抗体が細胞死誘導活性を有するか否かを検討した。その結果、2D7抗体をさらに別の抗体でクロスリンクすることで核の断片化が観察され、細胞死が誘導されることが分かった。さらに、2D7抗体のDiabodyは、さらに別の抗体を添加しなくても非常に強力な細胞死誘導活性を有することが判明した。以上の結果は、HLAを認識する抗体の低分子化抗体が細胞死誘導剤として利用できることを示している。 (もっと読む)
抗体又はその断片の結晶化
本開示は抗体又はその断片の結晶化及び/又は濃縮の方法に関する。本方法は、二価カチオンの塩を含有する溶液に抗体又はその断片を接触させることを含む。抗体又はその断片の結晶及び/又はタンパク質ゲルは組成物又は製剤において有用である。 (もっと読む)
TDF関連化合物およびその類似体
本発明は、一般的に、組織分化因子(TDF)類似体に関する。より詳細には、本発明は、TDF様受容体の機能的モジュレーターとして働く分子を設計、同定、および製造する際に有用である、構造に基づく方法および組成物に関する。本発明はさらに、TDF関連障害を検出、予防、および治療する方法に関する。 (もっと読む)
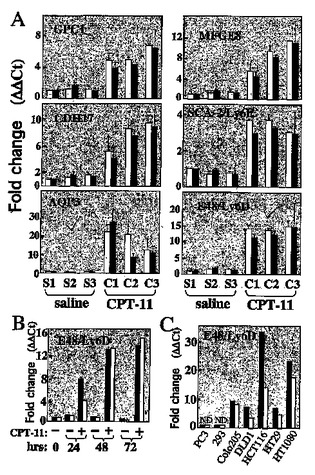
腫瘍の治療
本発明は、化学療法剤と、その化学療法剤によって発現がアップレギュレートされる遺伝子産物のアンタゴニストとを併用する、癌を含む腫瘍を治療するための改善された方法に関する。本発明は更に腫瘍の診断と分類、及び腫瘍の治療の結果と特定の治療モダリティに対する患者の反応の予測のための方法と手段に関する。
 (もっと読む)
(もっと読む)
抗CD20抗体およびその融合タンパク質ならびに使用法
本発明は、B細胞悪性腫瘍および自己免疫疾患などのB細胞疾患の治療および診断に有用な、CD20と呼ばれるヒトB細胞マーカーに結合する、ヒト化、キメラおよびヒト抗CD20抗体、およびCD20抗体融合タンパク質、ならびに治療方法および診断方法に関する。 (もっと読む)
新規なモノクローナル甲状腺刺激または阻害抗体、その可変領域に相当するペプチド配列、ならびに診断用医薬、予防用医薬および治療用医薬におけるそれらの使用
マウスの遺伝子免疫によって得られる、甲状腺刺激活性(TSAb)、特に完全もしくは相当なアゴニスト活性、もしくは甲状腺阻害活性(TBAb)を有するモノクローナル抗体(mAb)、またはこのようなモノクローナル抗体の断片(F(ab')2、FabもしくはFv)もしくはヒト化型またはこのような断片の一本鎖型(SCA、scFv)であって、ヒトTSHrのエピトープに対してウシTSHと競合し、ヒトTSHrのエピトープに対してグレーブス病患者の血清から得た自己抗体と、および阻害性自己抗体を有する患者から得た血清由来の自己抗体と競合し、ヒトTSHrの最初の281アミノ酸に位置するヒトTSHrの立体構造エピトープと結合し、かつ通常、種々の動物由来のTSFR受容体(TSHr)とも結合する抗体またはその断片。このような抗体の、またはこのような抗体の可変領域に相当するペプチドの種々の使用も記載され、特許請求される。 (もっと読む)
281 - 300 / 342
[ Back to top ]


