Fターム[4C085GG08]の内容
抗原、抗体含有医薬:生体内診断剤 (92,173) | 適用部位 (8,178) | 経口 (1,161)
Fターム[4C085GG08]に分類される特許
1,041 - 1,060 / 1,161
抗原性ヘテロ複合体を含む安定な免疫原性産物
【課題】対象者において一種または複数の抗原蛋白に対する抗体を誘発する安定な免疫原性産物。
【解決方法】(i)抗原蛋白分子と(ii)担体蛋白分子との組合せで形成され、抗原蛋白(i)の40%以下が担体蛋白分子(ii)と共有結合している免疫原性蛋白のヘテロ複合体からなる。
(もっと読む)
新規な抗IGF−IR抗体及びその使用
本発明は、ヒトインスリン様成長因子I受容体IGF−IRと特異的に結合することができ、且つ/又はそのIGF−IRのチロシンキナーゼ活性を特異的に阻害することができる新規な抗体、特にマウスのモノクローナル抗体、キメラモノクローナル抗体及びヒト化モノクローナル抗体、並びにこれらの抗体をコードするアミノ酸配列及び核酸配列に関する。本発明はまた、IGF−IRを過剰発現する癌又はその受容体の過剰発現に関連した病状の予防的処置及び/又は治療的処置を目的とした薬剤としての、並びにIGF−IRの過剰発現に関連した疾患の診断のための方法又はキットにおけるこれら抗体の使用を含む。本発明は最後に、このような抗体と、抗EGFR抗体、及び/又は抗VEGF抗体、及び/又は腫瘍進行もしくは転移に関与する他の成長因子に対する抗体、及び/又は化合物、及び/又は抗癌剤、又は毒素と共役した物質とを組み合わせて含む、製品及び/又は組成物、並びに特定の癌の予防及び/又は治療のためのその使用に関する。
【配列表】
SEQUENCE LISTING
<110> PIERRE FABRE MEDICAMENT
<120> Novel anti-IGF-IR antibodies and uses thereof
<130> D22514
<140> PCT/IB2005/002619
<141> 2005-07-27
<150> US 60/591 932
<151> 2004-07-29
<150> FR 04/08379
<151> 2004-07-29
<160> 26
<170> PatentIn version 3.1
<210> 1
<211> 16
<212> PRT
<213> Mus musculus
<400> 1
Arg Ser Ser Gln Thr Ile Ile His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> Mus musculus
<400> 2
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 3
<211> 10
<212> PRT
<213> Mus musculus
<400> 3
Phe Gln Gly Ser His Val Pro Tyr Thr Phe
1 5 10
<210> 4
<211> 5
<212> PRT
<213> Mus musculus
<400> 4
Asp Tyr Trp Met Asn
1 5
<210> 5
<211> 17
<212> PRT
<213> Mus musculus
<400> 5
Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe Tyr
1 5 10 15
Asp
<210> 6
<211> 13
<212> PRT
<213> Mus musculus
<400> 6
Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Mus musculus
<400> 7
Lys Ala Ser Gln Asn Val Val Thr Asn Val Ala
1 5 10
<210> 8
<211> 7
<212> PRT
<213> Mus musculus
<400> 8
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> Mus musculus
<400> 9
His Gln Tyr Asn Asn Phe Pro Leu Thr
1 5
<210> 10
<211> 5
<212> PRT
<213> Mus musculus
<400> 10
Glu Tyr Gly Val Ser
1 5
<210> 11
<211> 16
<212> PRT
<213> Mus musculus
<400> 11
Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
<210> 12
<211> 6
<212> PRT
<213> Mus musculus
<400> 12
His Glu Gly Met Asp Tyr
1 5
<210> 13
<211> 11
<212> PRT
<213> Mus musculus
<400> 13
Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn
1 5 10
<210> 14
<211> 7
<212> PRT
<213> Mus musculus
<400> 14
Glu Gly Asn Thr Leu Arg Pro
1 5
<210> 15
<211> 9
<212> PRT
<213> Mus musculus
<400> 15
Leu Gln Ser Asp Lys Met Pro Leu Thr
1 5
<210> 16
<211> 5
<212> PRT
<213> Mus musculus
<400> 16
Asn Tyr Ala Met Ser
1 5
<210> 17
<211> 16
<212> PRT
<213> Mus musculus
<400> 17
Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys Gly
1 5 10 15
<210> 18
<211> 9
<212> PRT
<213> Mus musculus
<400> 18
Glu Gly Gly Leu Val Trp Phe Ala Tyr
1 5
<210> 19
<211> 112
<212> PRT
<213> Mus musculus
<400> 19
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Ile Ile His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 20
<211> 123
<212> PRT
<213> Mus musculus
<400> 20
Gln Ala Gln Leu Gln Gln Pro Gly Ala Val Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Ser Tyr Ser Phe Thr Asp Tyr
20 25 30
Trp Met Asn Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Gln Trp Ile
35 40 45
Gly Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Phe Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 21
<211> 107
<212> PRT
<213> Mus musculus
<400> 21
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Val Thr Asn
20 25 30
Val Ala Trp Tyr Gln His Lys Pro Gly His Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys His Gln Tyr Asn Asn Phe Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 22
<211> 114
<212> PRT
<213> Mus musculus
<400> 22
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 23
<211> 114
<212> PRT
<213> Mus musculus
<400> 23
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 24
<211> 107
<212> PRT
<213> Mus musculus
<400> 24
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Val Ala Thr Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Leu Thr Ile Glu Asn Thr Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Lys Met Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 25
<211> 117
<212> PRT
<213> Mus musculus
<400> 25
Glu Val Asn Leu Val Glu Ser Gly Gly Ile Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Arg Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Gly Leu Val Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 26
<211> 16
<212> PRT
<213> Mus musculus
<400> 26
Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
(もっと読む)
立体構造及び直鎖状エピトープに対する抗体を用いたHCV感染の予防及び治療
C型肝炎ウイルス(HCV)のエンベロープタンパク質E1及びE2の立体構造エピトープについて、HCV感染者由来のモノクローナル抗体群を用いて同定し特徴を調べた。HCVタンパク質E1又はE2のこれらの保存立体構造及び直鎖状エピトープは、HCVに対するヒトの免疫応答において重要であり、ウイルスの中和に特に重要であると考えられる。これら立体構造エピトープの同定に基づいて、完全立体構造エピトープを有するペプチド及びミモトープを含むワクチンを調製し、HCV感染予防及び/又は治療のために患者に投与することができる。それぞれ特定のE1又はE2エピトープに対する、4種の異なるモノクローナル抗体グループを同定することで、HCVに対する感染者の応答に基づいて感染者を分類することができ、適当な治療投与計画を決めることができる。 (もっと読む)
HIF−1アルファのsiRNA阻害に関する組成物及び方法
【解決手段】 HIF−1アルファmRNAを標的とする低分子干渉RNAを使用するRNA干渉は、HIF−1アルファ遺伝子の発現を抑制する。HIF−1アルファがVEGFの転写調節因子であるとき、VEGFの発現もまた抑制される。HIF−1アルファのsiRNA媒介下方制御を介したVEGF産物の調節は血管新生、特に糖尿病性網膜症、加齢性黄斑変性、及び種々の癌腫等の疾患における血管新生を阻害するために用いられ得る。 (もっと読む)
歯周炎を治療又は予防するための組成物
【課題】 経口投与により、歯周炎を効果的に治療又は予防することができる食品又は医薬組成物を提供する。
【解決手段】 Porphyromonas gingivalisに由来するプロテアーゼ、トリプシン、血球凝集素又はヘモグロビンレセプターで免疫した鳥類が産生した卵又はその処理物を含む、歯周炎を治療又は予防するための食品又は医薬組成物。
(もっと読む)
ハプテン担体抱合体およびその用法
本発明は、規則的で反復性のアレイの形を取る、ハプテンと担体から成る抱合体を含む組成物、そのような組成物の製造法を提供する。本発明の抱合体および組成物は、真核細胞性のウィルスまたはバクテリオファージから得られたウィルス様粒子を担体として含み、この担体は、ホルモン、毒素および薬物、特に、ニコチンのような依存性薬物を含む各種ハプテンと結合される。本発明の組成物および抱合体は、ハプテンに対して免疫反応を誘発するのに有用であり、これらの組成物および抱合体は、各種治療、予防および診断処方において有用である可能性がある。いくつかの実施態様では、本発明の抱合体、組成物および方法によって生成された免疫反応は、乱用薬剤の依存症、および、薬物依存と関連して起こる病気を予防または治療するのに有用である。  (もっと読む)
(もっと読む)
DKK−1に対する抗体
本発明は、Dkk−1ポリペプチド類に特異的に結合する抗体およびその免疫機能性フラグメントを提供する。対象の抗体およびフラグメントは、Dkk−1タンパク質のカルボキシ領域に位置する配座エピトープに高親和性で結合する。このような抗体またはそのフラグメント、ならびに抗体またはそのフラグメントを含有する生理的に受容可能な組成物を調製する方法もまた提供する。骨疾患、炎症性疾患、神経系疾患、眼疾患、腎疾患、肺疾患および皮膚疾患など、種々の疾患を治療するための抗体およびフラグメントの使用法もまた開示する。  (もっと読む)
(もっと読む)
神経系疾患及び癌における非定型プロテインキナーゼCアイソフォーム
本発明は、変化したaPKC機能と、アルツハイマー病(AD)及び神経芽細胞腫などの神経系疾患及び癌との間の関連性を確立する。神経系疾患及び癌における診断、薬剤スクリーニング及び遺伝子治療において、aPKCを使用する方法を提供する。 (もっと読む)
免疫抗原付着剤とその製造及び使用方法
家禽卵抗体の形式の微生物付着阻害剤が、その製造方法並びに使用方法と共に開示される。阻害剤は、宿主食品用動物の第一胃及び腸管内のコロニー形成免疫抗原の接着又は付着を実質的に防ぐことにより機能する。阻害剤は、雌鳥に免疫抗原を接種し、免疫抗原に対する抗体を含む卵を収穫し、卵の内容物を乾燥して形成され、宿主動物のための飼料又は水へ与えられる。雌鳥に接種される特定の免疫抗原に依存して、卵抗体は、或るコロニー形成生物の存在により生ずる食用動物に於ける食餌性タンパク質の浪費を低減して飼料の変換率を改善することにより動物の成長を促進することに用いられ、また、食用動物由来の食肉及びその他の食物に於ける或る種の病気を引き起すコロニー形成免疫抗原、例えば、大腸菌0157:H7の存在により生ずる病気の発生を実質的に低減し又は除去する。 (もっと読む)
抗体又はその断片の結晶化
本開示は抗体又はその断片の結晶化及び/又は濃縮の方法に関する。本方法は、二価カチオンの塩を含有する溶液に抗体又はその断片を接触させることを含む。抗体又はその断片の結晶及び/又はタンパク質ゲルは組成物又は製剤において有用である。 (もっと読む)
びまん型胃癌を診断する方法
びまん型胃癌(DGC)を検出および診断する客観的な方法を本明細書において記述する。一つの態様において、本診断法は、DGC細胞と正常細胞とを識別するDGC関連遺伝子の発現レベルを決定する段階を含む。本発明は、DGCの治療において有用な治療薬剤をスクリーニングする方法、DGCを治療する方法、およびDGCに対するワクチンを被験者に接種する方法をさらに提供する。 (もっと読む)
陽イオン性カルジオリピン類似体およびその使用
本発明は陽イオン性カルジオリピン化合物、並びにそれらをリポソーム調製、遺伝子トランスフェクションなどにおいて合成および使用する方法を提供する。特に、本発明は、ヒトおよび動物の疾患を治療する為に活性な薬剤を送達すること、および/または診断分析における、陽イオン性カルジオリピン類似体を含むリポソーム、陽イオン性カルジオリピン類似体を含む医薬組成物、並びにかかるリポソームおよび組成物の使用方法を提供する。 (もっと読む)
新脈管形成に関与する医学的状態の診断および治療のための組成物および方法
E−セレクチンの発現に付随する新脈管形成を含む、医学的状態の診断もしくは治療のため、または組織工学のための組成物および方法が提供される。より具体的には、P−セレクチンに有意に結合する能力がない、E−セレクチン結合に対して選択的な化合物が使用される。本発明の方法はまた、新脈管形成を必要とする状態または関連する状態をインビボでスクリーニングする方法を提供し、この方法は、(a)温血動物に対して診断有効量の図1の化合物1〜15のいずれか1つを投与する工程;および(b)該動物において該化合物を検出する工程を包含する。 (もっと読む)
蛋白間相互作用を調節することによる新規アポトーシス調節方法と、それを用いる医薬
本発明は、Omiを介するカスパーゼ非依存性アポトーシス機構の優れた調節法、即ち、WARTS蛋白質とOmi蛋白質の相互作用を亢進または抑制することを含む、細胞の新規アポトーシス調節方法、例えば(1)細胞に外部よりOmiおよび/またはWARTS、またはそれらに実質的に同質な蛋白質を加えること、(2)Omiおよび/またはWARTSをコードするDNAで組換えた組換えベクターを与えて細胞を形質転換すること、(3)Omiおよび/またはWARTSをコードするDNAで形質転換した細胞を被検患者に戻すこと、等によってWARTSとOmiの相互作用を亢進または抑制することを特徴とする、前記アポトーシス調節方法、を提供するとともに、アポトーシスが関与する各種疾患の治療または予防に有効な新規医薬組成物を提供する。  (もっと読む)
(もっと読む)
TDF関連化合物およびその類似体
本発明は、一般的に、組織分化因子(TDF)類似体に関する。より詳細には、本発明は、TDF様受容体の機能的モジュレーターとして働く分子を設計、同定、および製造する際に有用である、構造に基づく方法および組成物に関する。本発明はさらに、TDF関連障害を検出、予防、および治療する方法に関する。 (もっと読む)
低量の抗体の投与を含む神経障害状態に関連する症状を軽減する方法
本発明は、効果的な量の抗グルタミン酸脱炭酸酵素(抗GAD)抗体を含む医薬品組成物で神経障害状態の症状を軽減する方法及び組成物を提供する。 (もっと読む)
ヒト・パピローマウイルスに対するワクチン用ベクターおよび同ベクターによって形質転換された微生物
【課題】パピローマウイルスの表面カプシド抗原または癌誘発関連抗原に対するワクチンを発現させるベクター、前記ベクターによって形質転換された微生物、および前記形質転換された微生物またはその抽出精製物を用いたワクチンを提供する。
【解決手段】ポリ−γ−グルタミン酸合成酵素複合体をコードする遺伝子pgsB、pgsC、pgsAのうちのいずれか1つまたは2つ以上と、ヒト・パピローマウイルス(HPV)の表面カプシド抗原タンパク質または癌誘発関連抗原タンパク質遺伝子を含むワクチン製造用表面発現ベクターを提供する。 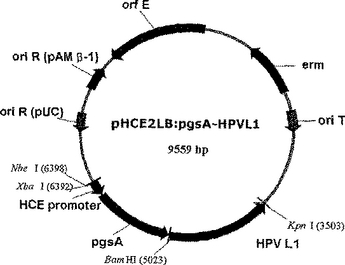 (もっと読む)
(もっと読む)
健康維持食品
【課題】 複合体であり、生体内で膵臓酵素群と密接な関係があり、物質の成分と酵素が生体内触媒作用を起こし、癌細胞を死滅させる健康維持食品の提案にかかる。
【解決手段】 ニトロ・サイド化合物で、分子式C20H27NO11・3H2O、融点200℃、酵素エルムシン、あるいは酸で加水分解することによりベンズアルデヒド(1単位)、青酸(1単位)、Dグルコース(2単位)とし、酵素アミグダラーゼによりプルナミンとDグルコースとし、これにジクロロ酢酸・ジイソプロピルアミン(ビタミンB−15、パンガミン酸カルシウム)、カリウム、ナトリウム、マグネシウムで構成されている構成体からなる健康維持食品。
(もっと読む)
バイオコンフォーマティック(bioconformatic)分析のためのモノクローナル抗体
関心対象のタンパク質の1つの配座異性体に識別的に結合するモノクローナル抗体を製造する方法を記載する。これらの抗体を使用する受動免疫および疾患の予後(outcome)、薬物の有効性または薬物感受性に関する患者集団を層別化する目的のための診断試薬としての配座異性体特異的抗体の用途並びにタンパク質の配座異性体による能動免疫も開示されている。スクリーニング技法において、検出は、例えば、組織免疫染色ウェスタンブロット法または溶液IPによってもよい。pHおよび銅濃度の特定のアッセイ条件下において神経変性を誘導するプリオンタンパク質配座異性体である、CtmPrPに立体配座特異性を示す7VCと名づけられる特異的なmabを記載する。19B10と名づけられる第2の特異的な抗体は、総PrP発現をダウンレギュレーションし、細胞分化を実施させるプリオンタンパク質配座異性体である、NtMPrPに立体配座特異性を示す。 (もっと読む)
遺伝子操作したP30抗原、改善された抗原カクテル及びそれらの使用
本発明は、トキソプラスマ(Toxoplasma gondii)に対するIgM及び/又はIgG抗体の検出において使用しうる遺伝子操作したP30抗原及び抗原の組合せ又は混合物(例えば遺伝子操作したP30抗原及びP35)に関する。さらに、本発明はまた、遺伝子操作したP30抗原及び抗原の組合せを使用する方法、この遺伝子操作したP30抗原及び抗原の組合せに対して惹起される抗体、ならびに遺伝子操作したP30抗原及び組合せ中に存在する抗原を含むキット及びワクチンに関する。 (もっと読む)
1,041 - 1,060 / 1,161
[ Back to top ]

