CathepsinHタンパク質由来のCD8+細胞傷害性Tリンパ球mHAエピトープペプチド及びその用途
【課題】 同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するのに有用なCD8+細胞傷害性Tリンパ球エピトープペプチドの提供。
【解決手段】 Cathepsin Hタンパク質の部分ペプチドであって、かつ、ヒト主要組織適合性抗原(HLA)と結合してCD8+細胞傷害性Tリンパ球によって認識され得るマイナー組織適合性抗原(mHA)エピトープペプチド。
【解決手段】 Cathepsin Hタンパク質の部分ペプチドであって、かつ、ヒト主要組織適合性抗原(HLA)と結合してCD8+細胞傷害性Tリンパ球によって認識され得るマイナー組織適合性抗原(mHA)エピトープペプチド。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、Cathepsin Hタンパク質の部分ペプチドであって、かつ、ヒト主要組織適合性抗原(HLA)と結合してCD8+細胞傷害性Tリンパ球(cytotoxic T lymphocyte、以下、CTLと称する)によって認識され得るマイナー組織適合性抗原(mHA)エピトープペプチド、該ペプチドを用いた同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するためのワクチン及び受動免疫療法剤、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+細胞傷害性Tリンパ球の定量方法、並びに該ペプチドを用いた同種造血細胞移植適合性診断方法に関する。
【背景技術】
【0002】
同種造血細胞移植(hematopoietic stem cell transplantation, 以下、HCTと称する)は、化学療法だけでは予後不良な白血病等の造血器腫瘍に治癒をもたらしうる治療法として確立されてきた。さらに最近になって、固形腫瘍に対してもミニ移植と称するHCTが試みられるようになり、一部の固形腫瘍(例えば腎細胞癌、悪性黒色種等)で腫瘍縮小効果が見られつつある。実際、一部の固形腫瘍では、本来、造血器細胞に特異的な遺伝子が異常に発現しているという報告がある。例えば、Cathepsin H遺伝子に関しては、胃癌細胞や悪性黒色種で異常発現し、HA-1遺伝子に関しては肺癌等で異常発現している(例えば、非特許文献1〜3参照)。しかし、進行期の造血器腫瘍や固形腫瘍は、HCTを行ったにもかかわらずしばしば再発し、必ずしも予後は良好ではない。
【0003】
HCTは、ヒト主要組織適合抗原(以下、HLAと称する)が適合した造血幹細胞提供者(以下、ドナーと称する)から患者に造血幹細胞が提供されるが、ドナーと患者間でHLAが一致していても、さまざまな遺伝子の多型に由来するマイナー組織適合性抗原(minor histocompatibility antigen, 以下、mHAと称する)には多くの不一致が起こり、それが標的となってドナー由来のTリンパ球を主体とする免疫反応が患者体内で起こる。この免疫反応が患者の造血器腫瘍又は固形腫瘍に対して抗腫瘍性効果を発揮すると原疾患の治癒をもたらすこととなり再発が回避される。これを移植片対腫瘍(graft-versus-tumor, 以下、GVTと称する)効果と呼んでいる。
【0004】
HCT後再発を来す患者においては、このGVT効果が不十分であると考えられる。このため、ドナー由来のTリンパ球の作用を強め、GVT効果を高めることを目的として、拒絶予防に用いる免疫抑制剤を減量する治療を行うことがあるが、その場合、ドナー由来のTリンパ球が患者の身体中の細胞を非自己とみなし強く排除するようになり、移植片対宿主病(graft-versus-host disease, 以下、GVHDと称する)と呼ばれる致死的な合併症がしばしば起こる。このためGVHDを回避しつつ、GVT効果のみを積極的に取り出して利用しようとするような有効な治療法が望まれている。
【0005】
HCT後の造血器腫瘍又は固形腫瘍の再発を制御している主な免疫担当細胞は、ドナーのTリンパ球由来のCD8+CTLである。ドナー由来CD8+CTLは、患者体内で残存する造血器腫瘍細胞又は固形腫瘍細胞を発見するとそれを非自己と認識して破壊する能力を持っている。従って、CD8+CTLのその傷害機能を有効に活性化すれば、GVT効果が高まるとともにGVHDの発症を回避することができ、新たな造血器腫瘍又は固形腫瘍の再発予防法や再発時の治療法の開発につながる可能性が高い。
【0006】
CD8+CTLが造血器腫瘍細胞や固形腫瘍細胞を認識する際、以下のような特徴がある。
(1) CTLはドナーのTリンパ球由来である。
(2) CTLは、個人に固有な遺伝子多型を有する遺伝子によってコードされる患者の造血器腫瘍細胞又は固形腫瘍細胞内の各種タンパク質(以下、mHAタンパク質と称する)の部分ペプチド(以下、mHAエピトープペプチドと称する)、例えば、Cathepsin Hタンパク質中のドナーと患者間で異なる個人に固有な遺伝子多型を有する遺伝子によってコードされる9〜10個のアミノ酸からなるペプチドを認識して、造血器腫瘍細胞又は固形腫瘍細胞を傷害(破壊)する。
(3) このmHAエピトープペプチドは、造血器腫瘍細胞又は固形腫瘍細胞の表面にあるHLAに結合してCTLに提示されることによって認識される。
(4) HLAは人種間、個人間によって異なり、HLAが異なるとmHAエピトープとなるペプチドが異なるため、CTLへの提示そのものが出来なくなることがある。
【0007】
以上の(1)から(4)で述べたことから明らかなように、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLのmHAエピトープペプチドとなり得るペプチドを含むmHAタンパク質を同定し、該エピトープペプチドのアミノ酸配列を過不足なく決定することは、そのドナーがHCTを受ける患者又は受けた患者に有効なGVT効果をもたらし得るか否かを診断し、さらには、特異的免疫治療法を施す際の必須の確認事項となり得る。
【0008】
しかしながら、日本人の多くが保有するHLA 型(HLA-A24型、64%;HLA-A33型、25%;HLA-A11型、22%;HLA-A2.1型、21%;HLA-A31型、18%;HLA-B44型、24%;HLA-B52型、20%;HLA-B35型、15%;HLA-B54型、14%;HLA-Cw1型、34%;HLA-Cw*14型、24%;HLA-Cw*0304型、22%;HLA-Cw*0702型、22%;HLA-Cw*0801、21%;HLA-Cw*1202、21%等)について、特にHLA-A33型、HLA-A31型等については、CD8+CTLが認識するmHAエピトープペプチドの報告は極めて少なく、HCT後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又はHCT後の造血器腫瘍あるいは固形腫瘍の再発を予防するのに有用なmHAエピトープペプチドの開発が求められている。
【0009】
【非特許文献1】Choi ら著、Oncogene誌 第11巻9号、1693-8頁、1995年
【非特許文献2】Kenny ら著、Oncogene誌 第14巻8号、997-1001頁、1997年
【非特許文献3】Fujiiら著、Transplantation誌 第73巻7号、1137-1141頁、2002年
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明は、Cathepsin Hタンパク質のアミノ酸残基数9〜10個からなる部分ペプチドであって、かつ、HLAと結合してCD8+CTLによって認識され得るmHAエピトープペプチド、該ペプチドを用いた同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するためのワクチン及び受動免疫療法剤、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLの定量方法、並びに該ペプチドを用いた同種造血細胞移植適合性診断方法を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者らは、上記課題を解決するため鋭意研究を行った結果、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLが認識し得るmHAエピトープペプチドを見い出し、本発明を完成するに至った。
【0012】
すなわち、本発明は、以下の(1)〜(19)を提供する。
(1) Cathepsin Hタンパク質の部分ペプチドであって、かつ、ヒト主要組織適合性抗原(HLA)と結合してCD8+細胞傷害性Tリンパ球によって認識され得るマイナー組織適合性抗原(mHA)エピトープペプチド。
(2) Cathepsin Hタンパク質の部分ペプチドのアミノ酸残基数が5〜20個である(1)に記載のマイナー組織適合性抗原(mHA)エピトープペプチド。
【0013】
(3) Cathepsin Hタンパク質の部分ペプチドのアミノ酸残基数が9〜10個である(2)に記載のマイナー組織適合性抗原(mHA)エピトープペプチド。
(4) Cathepsin Hタンパク質の部分ペプチドが、配列番号1で表されるアミノ酸配列において、第19番目、第39番目又は第82番目のアミノ酸を含んでなる部分ペプチドである、(1)〜(3)のいずれかに記載のペプチド。
【0014】
(5) HLAがHLA-A33である、(1)〜(4)のいずれかに記載のペプチド。
(6) 配列番号3又は4で示されるアミノ酸配列からなるペプチドである、(5)に記載のペプチド。
(7) HLAがHLA-A31である、(1)〜(4)のいずれかに記載のペプチド。
【0015】
(8) 配列番号4〜7で示されるアミノ酸配列からなる群から選択されるペプチドである、(7)に記載のペプチド。
(9) HLAがHLA-A2である、(1)〜(4)のいずれかに記載のペプチド。
(10) 配列番号8〜15で示されるアミノ酸配列からなる群から選択されるペプチドである、(9)に記載のペプチド。
【0016】
(11) CD8+細胞傷害性Tリンパ球が、造血器腫瘍細胞又は固形腫瘍細胞を傷害するものである、(1)〜(10)のいずれかに記載のペプチド。
(12) 造血器腫瘍が白血病、骨髄異形成症候群、悪性リンパ腫又は多発性骨髄腫である、(11)に記載のペプチド。
(13) 固形腫瘍が腎細胞癌、悪性黒色腫、乳癌、胃癌、肺癌又は前立腺癌である、(11)に記載のペプチド。
【0017】
(14) (1)〜(13)のいずれかに記載のペプチド又は該ペプチドをパルスした抗原提示細胞を有効成分として含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するためのワクチン。
(15) (1)〜(13)のいずれかに記載のペプチド又は該ペプチドをパルスした抗原提示細胞により末梢血リンパ球を刺激して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【0018】
(16) (1)〜(13)のいずれかに記載のペプチドから調製した主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーと末梢血リンパ球とを反応させ、該主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体から単離して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【0019】
(17) (1)〜(13)のいずれかに記載のペプチドから調製した主要組織適合抗原複合体−標識磁気ビーズと末梢血リンパ球とを反応させ、主要組織適合抗原複合体−標識磁気ビーズにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体から単離して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【0020】
(18) (1)〜(13)のいずれかに記載のペプチドで末梢血を刺激してCD8+細胞傷害性Tリンパ球を得、該CD8+細胞傷害性Tリンパ球が産生するサイトカイン及び/又はケモカインを測定することを特徴とする、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+細胞傷害性Tリンパ球の定量方法。
【0021】
(19) (1)〜(13)のいずれかに記載のペプチドから主要組織適合性複合体及び/又は主要組織適合性複合体−テトラマーを調製し、該主要組織適合性複合体及び/又は主要組織適合性複合体−テトラマーと末梢血とを反応させる、該末梢血中の造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+細胞傷害性Tリンパ球の定量方法。
(20) 同種造血細胞移植におけるドナー及び患者由来のDNAを配列番号2に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列を用いて遺伝子タイピングを行うことを含む、同種造血細胞移植適合性診断方法。
【0022】
(21) 同種造血細胞移植におけるドナー及び患者由来のDNAを配列番号2に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列を用いてPCR法により増幅し、得られたPCR増幅産物についてドナー及び患者間の遺伝子タイピングを行うことを含む、(20)に記載の同種造血細胞移植適合性診断方法。
(22) Cathepsin H遺伝子の多型部位を含む領域の塩基配列の塩基長が18〜30merである、(20)または(21)に記載の同種造血細胞移植適合性診断方法。
【0023】
(23) 配列番号1に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列が、請求項1に記載のmHAエピトープペプチドをコードする塩基配列である、(20)〜(23)のいずれかに記載の診断方法。
(24) (1)〜(13)のいずれかに記載のペプチドの少なくとも1種類のペプチドでパルスされ、表面に発現しているHLAに上記ペプチドが結合している単離した抗原提示細胞。
(25) 抗原提示細胞を(1)〜(13)のいずれかに記載のペプチドの少なくとも1種類のペプチドとともにin vitroで培養することを含む、抗原提示細胞の活性化法であって、活性化された抗原提示細胞がCD8+細胞傷害性Tリンパ球を刺激し得る、活性化法。
【0024】
(26) 以下の(a)〜(c)のいずれかの方法により、造血器腫瘍又は固形腫瘍の予防及び治療に用いることができるCD8+細胞傷害性Tリンパ球を調製する方法。
(a) (1)〜(13)のいずれかに記載のペプチド又は該ペプチドでパルスした抗原提示細胞を用いて、in vitro で末梢血リンパ球を刺激することを含む方法、
(b) (1)〜(13)のいずれかに記載のペプチドから調製した主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーと末梢血リンパ球とを反応させ、該主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体からCD8+細胞傷害性Tリンパ球を単離することを含む方法、及び
(c) (1)〜(13)のいずれかに記載のペプチドから調製した主要組織適合抗原複合体−標識磁気ビーズと末梢血リンパ球とを反応させ、主要組織適合抗原複合体−標識磁気ビーズにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体からCD8+細胞傷害性Tリンパ球を単離することを含む方法
(27) (26)に記載の方法により得られた、造血器腫瘍又は固形腫瘍の予防及び治療に用いることができる単離されたCD8+細胞傷害性Tリンパ球。
【発明の効果】
【0025】
本発明により、Cathepsin Hタンパク質の部分ペプチドであって、かつ、ヒト主要組織適合性抗原(HLA)と結合してCD8+CTLによって認識され得るmHAエピトープペプチドを提供することができる。また、該ペプチドを用いて、HCTを受けた患者の造血器腫瘍又は固形腫瘍を治療又は予防することができる。さらに、HCT後の患者体内の造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLを定量することができる。また、該ペプチドを用いた同種造血細胞移植適合性診断方法を提供することが可能である。
【発明を実施するための最良の形態】
【0026】
本発明についてさらに詳細に説明する。
1.CD8+CTLによって認識され得るmHAエピトープペプチド
本発明におけるペプチドとは、生理活性を有し、隣接するアミノ酸残基のα−アミノ基とカルボキシル基間のペプチド結合により相互に結合した線状のアミノ酸の分子鎖を意味する。ペプチドは特定長のものを意味するものではなく、種々の長さであり得る。また、無電荷又は塩の形態であってもよく、場合によっては、グリコシル化、アミド化、ホスホリル化、カルボキシル化、リン酸化等により修飾されていてもよい。さらには、本発明のエピトープの生理活性及び免疫活性を実質的に改変せず、投与した場合に有害な活性を有するものでない限り、1個又は数個(例えば、1〜8個、好ましくは1〜3個)のアミノ酸の挿入、付加、置換等が生じたペプチドも本発明に含まれる。例えば、ペプチドのN末端又はC末端に付加的アミノ酸配列が介在するものも含まれる。また、本発明のペプチドは、糖類、ポリエチレングリコール、脂質等が付加された複合体、放射性同位元素等による誘導体、あるいは重合体等の形態として用いることができる。
【0027】
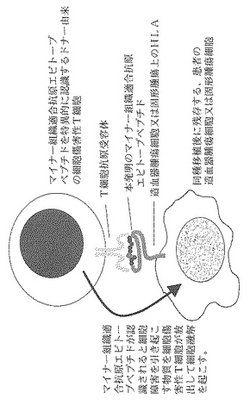
また、本発明におけるCD8+CTLによって認識され得るmHAエピトープペプチドとは、造血器腫瘍細胞又は固形腫瘍細胞の表面にあるHLAに結合して提示され、ドナー由来のCD8+CTLのT細胞抗原受容体(TCR)と結合することによってCD8+CTLに認識され得る、造血器腫瘍細胞又は固形腫瘍細胞内に存在するmHAタンパク質の部分ペプチドであって、個人に固有な遺伝子多型を有する遺伝子によってコードされる、多型部位を含むペプチドを意味する。該ペプチドは、好ましくは5〜20個のアミノ酸からなり、さらに好ましくは5〜15個、7〜12個または8〜11個のアミノ酸からなり、特に好ましくは9〜10個のアミノ酸からなる。従って、該ペプチドは、mHAタンパク質を発現するHLAの特定の型の造血器腫瘍細胞又は固形腫瘍細胞を直接に傷害(破壊)し、排除し得る、CD8+CTLの細胞性免疫機構を活性化する抗原基である。なお、CD8+CTLとは、ヒトリンパ球上に存在する表面抗原分子の一つであるCD8を発現しているCD8+細胞傷害性Tリンパ球を意味する。図1にその機構を示す。
【0028】
本発明において、造血器腫瘍には、白血病、骨髄異形成症候群、悪性リンパ腫、多発性骨髄腫、等の造血関係の組織又は細胞に発生した腫瘍が含まれる。また、本発明において、固形腫瘍とはCathepsin H遺伝子を異常発現する固形腫瘍であればいかなる固形腫瘍をも含むが、具体的には、腎細胞癌、悪性黒色腫、乳癌、胃癌、肺癌、前立腺癌などが挙げられる。
【0029】
mHAタンパク質の候補になりうるものは、造血器腫瘍細胞又は固形腫瘍細胞内にのみ存在し、かつ個人に固有な遺伝子多型を有する遺伝子によってコードされる各種タンパク質である。このうち造血関係の細胞及び一部の固形臓器においてのみその遺伝子が発現されることから、Cathepsin Hタンパク質が本発明のmHAエピトープペプチドの特定に特に有用である。
【0030】
Cathepsin Hタンパク質は、リゾチームのシステインタンパク分解酵素であり、リゾチーム内のタンパクの分解に重要である。このタンパク質をコードする遺伝子の発現が前立腺がんにおいて亢進することが報告されている(Waghrayら著、J Biol Chem誌 第277巻、11533-11538頁、2002年)。本遺伝子の発現は、造血系細胞の他、肺、腎臓、肝臓でも認められるが、本発明のmHAエピトープペプチドに特異的なCTLは少なくとも皮膚線維芽細胞、骨髄のストローマ細胞は傷害しないため、遺伝子の発現とmHAエピトープの生成は平行しない可能性が高い。
【0031】
なお、Cathepsin Hタンパク質をコードする遺伝子の塩基配列(配列番号1)及び該タンパク質のアミノ酸配列(配列番号2)はhttp://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?val=23110954&db=Nucleotide&dopt=GenBankに報告されている。
【0032】
また、Cathepsin Hタンパク質のアミノ酸配列の第11番目の多型(配列番号3)については、米国のNational Institute of Health(NIH)のNational Center for Biotechnology Information(NCBI)のhttp://www.ncbi.nlm.nih.gov/SNP/snp_ref.cgi?rs=2289702で確認することができる。前記アミノ酸配列の第11番目の多型は、Cathepsin-H遺伝子の塩基配列(配列番号1)の126番目の塩基(Cathepsin-Hタンパク質をコードするDNAの31番目の塩基の一塩基多型により、野生型がgであるのに対して、変異型はAであり、野生型のアミノ酸GlyがArgに変異する。
【0033】
なお、個人に固有な遺伝子多型とは、多数の個人(例えば50人)から得たDNAに対し、Cathepsin H遺伝子につき塩基配列決定をして、各個人間で配列に差があるか否かを調べ、各個人間で配列に差があった場合には、それが複数の個人で見つかる普遍的なものかどうかを決定し、人口の何%に各多型が存在するかを推測することによって検索することができる個人に固有の遺伝子多型である。
【0034】
本発明のmHAエピトープペプチドは、HLAの型によって好適なものが異なるため、各HLAの型において結合し得るペプチドをスクリーニングすることによって同定することができる。具体的には、Cathepsin Hタンパク質のアミノ酸配列において、第11番目のアミノ酸を含んでなる部分ペプチドについて、HLAの各型(例えば、HLA-A33、A31、A2等)の結合モチーフを有する、9〜10個のアミノ酸よりなるエピトープペプチドを検索し得る照合媒体、例えば、インターネット上に公開されているBioInformatics & Molecular Analysis Section (BIMAS)のHLA Peptide Binding Predictions (http://bimas.dcrt.nih.gov/molbio/hla_bind/index.html)によって照合し、mHAエピトープペプチドとなり得るペプチド(以下、mHAエピトープ候補ペプチドと称する)をスクリーニングすることができる。
【0035】
mHAエピトープ候補ペプチドは、通常の化学合成により得ることができる。例えば、固相ペプチド合成法等の有機化学的合成法、あるいは、ペプチドをコードするDNAを調製し、組換えDNA技術を用いて調製することも可能である。また、市販の化学合成装置(例えば、アプライドバイオシステムズ社のペプチド合成装置)による合成も可能である。
【0036】
得られたmHAエピトープ候補ペプチドについて、例えば、以下に示すようないずれかの方法を実施することによって、CD8+CTLによって認識され得るmHAエピトープペプチドであるか否かを決定することができる。
【0037】
(1)mHAエピトープペプチド決定方法1
10%ヒト血清含有RPMI1640培地に2×106/mlの細胞濃度で、予めCathepsin H遺伝子多型を検索しておいた成人から分離したリンパ球を浮遊させ、該リンパ球を同じ人からあらかじめ分離培養しておいた樹状細胞(1×105/ml)あるいは活性化B細胞(1×106/ml)と混合し、これにmHAエピトープ候補ペプチドの中の任意の1種を1μg/mlの濃度で加える。炭酸ガス恒温槽にて37℃で10日間培養する。10日目にIL-2を添加し、以後、前記候補ペプチドとIL-2による刺激を週に1度くり返すことにより、Cathepsin Hタンパク質多型部位に特異的なCD8+CTLを誘導する。このようにして誘導したCD8+CTLに対してmHAエピトープ候補ペプチドが刺激するか否かについて、エリスポットアッセイ等で判定する。エリスポットアッセイは、Miyahira Y, 他著、Journal of Immunological Methods、 181巻:45-54頁、1995等で報告されている。判定により、誘導したCD8+CTLに対して刺激が認められた候補ペプチドを本発明のmHAエピトープペプチドとして決定する。
【0038】
(2)mHAエピトープペプチド決定方法2
Cathepsin Hタンパク質のアミノ酸配列において、第11番目のアミノ酸を含む部分ペプチドのペプチドライブラリーを常法により合成する。該部分ペプチドのアミノ酸残基数は、好ましくは5〜20個、さらに好ましくは5〜15個、7〜12個または8〜11個であり、特に好ましくは9〜10個である。合成したペプチドに対して、エリスポット法や細胞内IFNγ産生細胞定量法によりCD8+CTLが反応するようなmHAエピトープペプチドを選択して本発明のエピトープペプチドとする。
【0039】
本発明の配列番号4〜15のアミノ酸配列を有するペプチドは、上記のようなスクリーニング及び決定方法の結果、mHAエピトープペプチドとして確認されたものである。本発明の配列番号4〜15に示されるmHAエピトープペプチドは、従来の各種のペプチド合成方法によって調製され得る。
【0040】
2.ワクチン
本発明のmHAエピトープペプチドは、能動免疫ペプチドワクチン療法においてワクチンとして用いることができる。すなわち、本発明のmHAエピトープペプチドを含んでなるワクチンをHCT後の患者に投与することによって、該ペプチドを認識するCD8+CTLを体内で増殖させ、造血器腫瘍又は固形腫瘍の予防及び治療に役立てることができる。使用するmHA エピトープペプチドは、患者のHLA及びmHAの型に対応するペプチドを1種若しくは2種以上使用してもよく、また、組み合わせ、混合して使用することができる。例えば、mHAエピトープペプチドを提示しうるようなHLAが複数存在する場合、2種以上のペプチドを組み合わせて使用することができる。また、例えば、HLAの特定の型に結合するペプチドとして、2種以上の異なるmHAエピトープペプチド(第11番目アミノ酸を含む開始部位の異なった部分ペプチド)が存在する場合、それらの2種以上のペプチドを組み合わせて使用することができる。また、抗原提示細胞(例えば、樹状突起細胞、B細胞、マクロファージ等)に本発明のmHAエピトープペプチドをパルスしたもの(以下、mHAエピトープペプチドパルス細胞と称する)を含むワクチンも使用することができる。ここで、抗原提示細胞とは、該ペプチドが結合し得るHLAをその表面上に発現する細胞の中でCD8+CTL刺激能を有するものを意味し、パルスするとは、例えば、適当な培養液中で、抗原提示細胞と該ペプチドを30分から1時間程度混合することを意味する。抗原提示細胞は、末梢血や臍帯血から公知の方法で得ることができる。例えば、抗原提示細胞である樹状細胞、B細胞、マクロファージ等はそれぞれの細胞に特異的な抗原を細胞表面に有しているので、該抗原に対する抗体を利用して、抗原提示細胞を単離することもできるし、また抗原提示細胞以外の細胞を除去することによっても抗原提示細胞を単離することができる。この際、フローサイトメーターを用いることもできる。このように、mHAエピトープペプチドをパルスした抗原提示細胞は、その表面に発現するHLAにmHAエピトープペプチドが結合しており、CD8+細胞傷害性Tリンパ球を刺激することができる。
【0041】
本発明のmHAエピトープペプチド又はmHAエピトープペプチドパルス細胞を含んでなるワクチンは、当分野において公知の方法を用いて調製することができる。例えば、かかるワクチンとしては、本発明のmHAエピトープペプチド又はmHAエピトープペプチドパルス細胞を有効成分として含有する注射剤又は固形剤等がある。mHAエピトープペプチドは、中性又は塩の形態で処方することができ、例えば、薬学上許容され得る塩としては、塩酸、リン酸などの無機塩、又は、酢酸、酒石酸などの有機酸が挙げられる。また、本発明のmHAエピトープペプチド又はmHAエピトープペプチドパルス細胞は、製薬上許容され、該ペプチド又は該細胞の活性と相容性を有する賦形剤、例えば、水、食塩水、デキストロース、エタノール、グリセロール、DMSO、及びその他のアジュバント等、又はこれらの組み合わせと混合して用いることができる。さらに、必要に応じて、アルブミン、湿潤剤、乳化剤等の補助剤を添加してもよい。
【0042】
本発明のワクチンは、非経口投与及び経口投与により投与することができるが、一般には非経口投与が好ましい。非経口投与としては皮下注射、筋肉内注射、静脈内注射等の注射剤、座薬等がある。また、経口投与としては、スターチ、マンニトール、ラクトース、ステアリン酸マグネシウム、セルロース等の賦形剤との混合物として調製することができる。
【0043】
本発明のワクチンは、治療上有効な量で投与する。投与される量は、治療対象、免疫系に依存し、必要とする投与量は臨床医の判断により決定される。通常、適当な投与量は、患者一人当たり、mHAエピトープペプチドでは1〜100mg、mHAエピトープペプチドパルス細胞では106〜109個の含有量とする。また、投与間隔は、対象、目的により設定することができる。
【0044】
3.受動免疫療法剤
本発明のmHAエピトープペプチドは、HCT後の造血器腫瘍の再発に対する予防的または治療的受動免疫治療剤の調製に用いることができる。すなわち、1)末梢血リンパ球を該ペプチドで刺激して得られるCD8+CTL、2)末梢血リンパ球を該ペプチドから調製した主要組織適合抗原複合体(major histocompatibility complex、以下、MHCと称する)又はMHC−テトラマーと反応させ、MHC又はMHC−テトラマーにCD8+CTLが結合した結合体を形成させ、該結合体から単離して得られるCD8+CTL、又は、3)末梢血リンパ球を該ペプチドから調製したMHC−テトラマー−標識磁気ビーズと反応させ、MHC−テトラマー−標識磁気ビーズにCD8+CTLが結合した結合体を形成させ、該結合体から単離して得られるCD8+CTL、を含む、受動免疫療法剤を得ることができる。ここで、磁気ビーズは、酸化鉄などの磁性体を核に持ち、表面を他の材料で被覆された直径数十nmから数十μmの球状粒子をいう。本発明において、公知の磁気ビーズを用いることができる。磁気ビーズへの、MHC-テトラマーの結合は、吸着、官能基を利用した共有結合による結合等、公知の手法で行うことができる。mHAエピトープペプチドを使用したMHC及びMHC-テトラマーは、例えば、以下のように調製することができる。タンパク質発現用の大腸菌から精製したHLA重鎖、β2ミクログロブリン及び本発明のmHAエピトープペプチドの複合体であるMHCをバッファー内で形成させる。組換えHLA重鎖タンパク質のC末端には予めビオチン結合部位を付加しておき、MHC形成後、この部位にビオチンを付加する。市販の標識色素ストレプトアビジンとビオチン化MHCをモル比1:4で混合することによってMHC-テトラマーを作製する。図2及び図3に得られたMHC-テトラマーとその反応機構をそれぞれ示す。なお、各ステップにおいて、ゲル濾過によるタンパク質精製を行うのが好ましい。
【0045】
受動免疫療法剤に含まれる、本発明のmHAエピトープペプチドを認識し得るCD8+CTLは、以下のような調製方法によって得ることができる。
(1)CD8+CTL調製方法1
リンパ球をHCT後の患者又はHCTドナーの末梢血から分離し、これを、上記のようにして調製した適当な濃度のMHC又はMHC-テトラマーと37℃、15分間反応させる。MHC又はMHC-テトラマー中のmHAエピトープペプチドと結合したCD8+CTLは標識色素により染色されるので、フローサイトメーターなどを用いて染色されたCD8+CTLのみを単離する。あるいは、予め無菌プレートなどに固相化したMHC及び/又はMHC-テトラマーに反応させることもできる。プレートに固相化されたMHC及び/又はMHC-テトラマー中のmHAエピトープペプチドに結合したCD8+CTLを単離するためには、結合せずに浮遊している他の細胞を洗い流した後に、プレート上に残ったCD8+CTLだけを新しい培養液に懸濁する。このようにして単離されたCD8+CTLは造血器腫瘍細胞又は固形腫瘍細胞を傷害し得るので、抗CD3抗体、PHA、IL-2等のT細胞刺激薬剤で刺激増殖させ、受動免疫療法に必要な細胞数を確保する(図6を参照)。
【0046】
(2)CD8+CTL調製方法2
前述のように調製したビオチン化MHCをストレプトアビジン標識磁気ビーズと結合させ、結合体(以下、MHC-磁気ビーズと称する)を作製する。MHC-磁気ビーズを図4に示す。リンパ球をHCT後の患者又はHCTドナーの末梢血等から分離し、適当な濃度の前記MHC-磁気ビーズをリンパ球:ビーズ比、1:10で反応させる。MHC-磁気ビーズ中のMHC/mHAエピトープペプチドに結合したCD8+CTLと結合したCD8+CTLの入った試験管を磁場におくと、ビーズと結合したCD8+CTLは磁石のある側の試験管内壁に寄せられる。その機構を図5に示す。その後、それ以外の細胞を洗い流した後に、試験管を磁場からはずし、試験管内壁に残った抗原特異的CD8+CTLだけを新しい培養液に懸濁する。このように単離されたCD8+CTLは造血器腫瘍細胞又は固形腫瘍細胞を傷害し得るので、抗CD3抗体、PHA、IL-2等のT細胞刺激薬剤で刺激増殖させ、受動免疫療法に必要な細胞数を確保する(図6を参照)。
【0047】
(3)CD8+CTL調製方法3
HCT後の患者又はHCTドナーの末梢血から分離したリンパ球を本発明のmHAエピトープペプチドで直接刺激するか、該ペプチドをパルスした抗原提示細胞(例えば、樹状突起細胞、B細胞、マクロファージ等)で刺激する。刺激によって誘導されたCD8+CTLを炭酸ガス恒温槽にて37℃で7〜10日培養する。その後IL-2を添加し、mHAエピトープペプチドとIL-2、又は該抗原提示細胞とIL-2による刺激を週に1度くり返すことによって受動免疫療法に必要な細胞数のCD8+CTLを確保する(図6を参照)。
【0048】
上記のようにして得られたCD8+CTLは造血器腫瘍細胞又は固形腫瘍細胞を傷害し得るので、ヒトアルブミン含有PBS等に懸濁させて、HCT後の造血器腫瘍又は固形腫瘍の再発に対する予防的または治療的受動免疫療法剤とすることができる。
【0049】
4.CD8+CTLの定量
本発明のmHAエピトープペプチドを認識し得るCD8+CTLが、HCT後の造血器腫瘍又は固形腫瘍の再発ハイリスクの患者(原疾患である造血器腫瘍又は固形腫瘍の悪性度が高く、HCT後に強力な免疫抑制剤の投与を受けている患者)のHCT後の末梢血に存在するか否かを知ることは、免疫抑制剤の適正な使用量の決定や再発リスクの予測を含め、HCT後の患者管理の上で重要な情報である。本発明のmHAエピトープペプチドを認識し、造血器腫瘍細胞又は固形腫瘍細胞を傷害し得るCD8+CTLの定量は、本発明のmHAエピトープペプチドを用いた以下の2つの方法によって行うことができる。
【0050】
第1の定量方法は、HCT患者の移植後の末梢血から分離されたリンパ球を本発明のmHAエピトープペプチドで刺激することによって誘導されるCD8+CTLが産生するインターフェロンガンマ(IFNγ)、インターロイキン等のサイトカイン及び/又はケモカインを定量する方法である。本発明で定量し得るサイトカイン、ケモカインは限定されず、サイトカインとしては上記のように、IFNγ、インターロイキンやコロニー刺激因子等を含み、ケモカインとしてはCXCケモカイン、CCケモカイン、Cケモカイン、CX3Cケモカイン等を含む。以下にIFNγを例にとり具体的に方法を示す。
【0051】
(1)サイトカイン定量による方法1(細胞内IFNγ産生細胞定量);
HCT後の患者あるいはHCTドナーの末梢血から分離したリンパ球を10%ヒト血清含有RPMI1640培地に2×106/mlの細胞濃度で浮遊させ、本発明のmHAエピトープペプチドを1μg/mlの濃度で加える。さらに細胞内蛋白輸送阻止剤であるBrefeldin A等を加え、炭酸ガス恒温槽にて37℃で5〜6時間培養する。培養後、細胞を固定、膜透過処理を行い、色素標識抗IFNγ抗体、抗CD8抗体と反応させる。フローサイトメーター等を用いて、CD8+リンパ球中のIFNγ陽性細胞%を定量する。
【0052】
(2)サイトカイン定量による方法2(エリスポットアッセイ);
96穴MultiScreen-HAプレート(Mi11ipore)を抗IFNγモノクローナル抗体で一晩、4℃でコーティングし各穴をPBSで洗浄した後、HCT後の患者あるいはHCTドナーの末梢血から分離したリンパ球を各穴にまく。mHAエピトープペプチドを各穴に入れ37℃の5% CO2培養器にて20時間培養する。翌日、0.05%Tween‐20添加PBSでプレートを洗浄した後、抗IFNγウサギ血清、ペルオキシダーゼ標識抗ウサギIgGヤギ血清の順で各々90分ずつ室温で反応させる。さらに3-amino-9-ethylcarbasole (Sigma)と0.015%のH2O2を含む0.1M 酢酸ナトリウムバッファー(pH 5.0)を各穴に入れ、室温で40分反応させる。IFNγスポットを可視化し、実体顕微鏡でカウントする。
【0053】
(3)サイトカイン定量による方法3(培養上清中に分泌されたIFNγを定量する方法);
末梢血から分離したHCT後の患者あるいはHCTドナーの末梢血(を10%ヒト血清含有RPMI1640培地に2×106/mlの細胞濃度で浮遊させ、本発明のmHAエピトープペプチドを1μg/mlの濃度で加える。炭酸ガス恒温槽にて37℃で24-48時間培養する。培養後、上清を回収し、その中に含まれるIFNγ濃度を市販のELISAキット(例えばENDOGEN社のHUMAN IFN gamma ELISA)を使用して定量する。
【0054】
第2の定量方法としては、本発明のmHAエピトープペプチドを使用して作製したMHC-テトラマーを用いて、mHAエピトープペプチドを認識し、造血器腫瘍細胞又は固形腫瘍細胞を傷害し得るCD8+CTLを定量することができる。MHC-テトラマーの調製は前述のとおりである。定量は、例えば、以下のようにして実施することができる。HCT後の患者あるいはHCTドナーの末梢血からリンパ球を分離し、適当な濃度のMHC-テトラマーと37℃、15分反応させる。該テトラマーと結合したCD8+CTLは標識色素により染色されるので、フローサイトメーター等を用いてカウントする。
【0055】
例えば、以下のようにしてmHAエピトープペプチドから調製したMHC-テトラマーを用いてHCT後患者末梢血中の造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLを定量することができる。
【0056】
1.MHC-テトラマーの調製
(1)MHCの調製
大腸菌による組換蛋白発現系を用いてHLA A*3303重鎖およびβ2ミクログロブリンを大量に作成、精製する。なお、HLA A*3303重鎖C末端には、ビオチンリガーゼが認識するアミノ酸配列を予め付加しておく。精製HLA A*3303重鎖およびβ2ミクログロブリンをそれぞれ8M尿素に溶解した。200 ml の refolding buffer (pH8.0 ; 100 mM Tris-HCl, 400 mM L-arginine-HCl, 2 mM EDTA, 0.5 mM oxidative glutathione, 5 mM reduced glutathione)内に、配列番号4のペプチド12mg、HLA A*3303重鎖18.6mg、β2ミクログロブリン13.2mgそれぞれを27ゲージ針の付いた注射器を用いて注射した。10℃恒温槽において48〜72時間撹拌し、MHCの形成を促した後、MHCを含むrefolding bufferを1.8Lの蒸留水に対して24時間、4℃恒温槽において透析し、透析後のrefolding bufferをセントリプレップ10(MILLIPORE, Bedford, MA)を用いて2mlに濃縮する。Superdex 200 HR (Amersham Pharmacia Biotech AB, Uppsala, Sweden)カラムを用いたゲル濾過クロマトグラフィーにて分子量45KDあたりに流出するMHCを単離する。
【0057】
(2)ビオチン化MHCの調製
ビオチンリガーゼ(AVIDITY, Denver, CO)を用いて、HLA A*3303重鎖C末端の特異的部位にビオチンを結合させる。Superdex 200 HRカラムを用いたゲル濾過クロマトグラフィーにてビオチンを付加したMHCを精製する。
【0058】
(3)MHC-テトラマーの調製
PE標識ストレプトアビジン (Molecular Probe, Eugene, OR)と精製ビオチン化MHCをモル比1:4で混合する。Superdex 200 HRカラムを用いたゲル濾過クロマトグラフィーにて分子量480KDあたりに流出する配列番号5のペプチドを含むMHC-テトラマーを単離する。セントリコン10(MILLIPORE)を用いて約3mg/mlに濃縮し、4℃に保存する。保存剤としては、Na-Azide、EDTA、Leupeptin、Pepstatinを添加すればよい。
【0059】
2.MHC-テトラマーを用いた造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLの定量
Cathepsin Hタンパク質のHLA-A33で提示されるmHAエピトープペプチドが不適合なドナーとのHCTを受けたHLA-A33を有する患者からHCT後31日目に分離した末梢血リンパ球(1×106)、あるいは前記患者の末梢血リンパ球を配列番号4に示すペプチドで2週間刺激した後増殖してきたリンパ球(1×106)を1.5mlエッペンドルフチューブ内で50μLの2%FCS含有PBSに懸濁する。これに、配列番号4のペプチドを含むMHC-テトラマー、FITC標識抗CD8抗体(CALTAG, Burlingame, CA)を各1μLずつ添加し、37℃恒温槽に15分静置し反応させる。反応後の細胞を2% FCS含有PBS 1mlで3回洗浄し、次いで、0.5%パラホルムアルデヒド含有PBS(1ml)に懸濁した。前記MHC-テトラマーと結合したCD8+CTLは標識色素により染色され、FACS Calibur(ベクトン・デイッキンソン)を用いてFITC-CD8+T細胞中のテトラマー陽性細胞をカウントし、その割合を計算する。
【0060】
この結果、MHC-テトラマーに結合した、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLは染色されるので右に移動する。このことから、前記MHC-テトラマーが配列番号4のmHAエピトープペプチドで刺激されて増殖してきたCD8+CTLを特異的に染色していることを示すことができる。
【0061】
5.適合性の遺伝子診断
Cathepsin H遺伝子の該多型部位を含む領域を利用し、公知のPCR法等を実施することによって、HCT療法におけるドナーと患者の適合性を遺伝学的に診断し、GVTを強化する免疫療法に有用な組み合わせか否かの診断を行うことができる。すなわち、ドナーと患者のCathepsin-H遺伝子の一塩基多型(SNP)のタイピングを行うことにより、両者の適合性を診断することができる。なお、PCR法で用いる少なくとも一方のオリゴヌクレオチドプライマー及び/又はプローブの塩基配列は、Cathepsin H遺伝子の該多型部位を含み、かつドナーと患者が保有する該多型部位がPCR法によって確認され得る限り、そのオリゴヌクレオチドプライマー及び/又はプローブの塩基数は、一般的に用いられる18〜30merの範囲内において適宜設定することができる。そのようなオリゴヌクレオチドプライマー及び/又はプローブの塩基配列として利用し得る塩基配列の一例に、本発明のmHAエピトープペプチドをコードする塩基配列が含まれる。診断には、以下のような方法が挙げられる。
【0062】
(1)TaqMan PCRによる方法
Cathepsin H遺伝子の各多型部位を挟む領域を増幅するようにPCRプライマーを設計する。また、Cathepsin H遺伝子の該多型部位を含む領域の塩基配列に特異的なプローブに異なった蛍光物質(FAMやVIC等の蛍光レポーター色素)及び消光物質を結合したものを準備し、前記PCRプライマーと共に試料DNA(患者およびドナーの末梢血約1mlから市販のDNA抽出キット(例えば、キアゲン社のQIAamp DNA Blood Mini Kit)等を用いてDNAを分離精製したもの)に対しPCR反応を行うと、該当する塩基配列が存在する場合のみ対応するプローブが分解されて蛍光を発生するようになる。なお、PCR反応は、試料DNAの塩基配列とプローブの塩基配列間で1個のミスマッチが存在する場合にハイブリダイズしないストリンジェンシー条件を用いて両配列をハイブリダイズさせる。ストリンジェンシー条件は、実施されるハイブリダイゼーションの条件によって異なるが、当業者であればハイブリダイゼーションのプロトコルに基づいて、温度、塩濃度、界面活性剤濃度等の溶媒組成等の条件を適宜設定することができる。発生した蛍光を測定することで、ドナー及び患者のCathepsin Hタンパク質の第11番目のアミノ酸のパターンを判読する。ドナーと患者間でタイピングを施行することにより、該mHAエピトープペプチドが適合であるか、あるいは不適合であるかを確認し、不適合である場合にはGVTを強化する免疫療法に有用な組み合わせであるか否かを診断することが可能となる。
【0063】
(2)アリル特異的PCRによる方法
PCRプライマーの一方の3’側がCathepsin H遺伝子の該多型部位を含む領域の各塩基配列に特異的となるようにプライマーを設計する。他方のプライマーは両アリル共通とする。PCR反応を上記のようにして調製した試料DNAに対して個々に行うと、Cathepsin H遺伝子の該多型部位を含む領域の塩基配列に適合するプライマーが存在する場合のみPCR反応で増幅が起こるため、HCT療法におけるドナーと患者の適合性の判定が可能となる。
【0064】
(3)PCR-RFLPによる方法
Cathepsin H遺伝子の該多型部位を含む領域を増幅するようにPCRプライマーを設計する。PCR反応を上記のように調製した試料DNAに対して個々に行った後に、各Cathepsin H遺伝子の各多型部位を含む領域の塩基配列を特異的に認識するような制限酵素を用いて消化した後ゲル上で電気泳動して、切断の有無により試料中のCathepsin H遺伝子の各多型部位を含む領域の有無を確認し、HCT療法におけるドナーと患者の適合性を判定する。
【0065】
(4)直接塩基配列決定による方法
Cathepsin H遺伝子の該多型部位を含む領域を増幅するようにPCRプライマーを設定し、PCR反応を上記のように調製した試料DNAに対して個々に行う。PCR増幅産物を精製後鋳型として用い、PCRに使用したプライマーを使って直接塩基配列決定を行い、Cathepsin H遺伝子の該多型部位を含む領域の増幅部分の塩基配列を直接読みとる。その配列の結果をもとに、HCT療法におけるドナーと患者の適合性を判定する。
【0066】
その他、Invador法、MALDI-TOF/MS法等の質量分析法、PCR-SSCP(single strand conformation polymorphism)、RCA法を用いても診断することができる。さらに、Cathepsin H遺伝子の該多型部位を含む領域を固定したDNAチップを用いて診断することもできる。これらの方法は、公知であり、例えば、ポストシークエンスのゲノム化学1 SNP遺伝子多型の戦略 松原謙一他編集 中山書店 2000年6月30日発行 等の記載に従い行うことができる。
【0067】
以上のようなPCRを用いた各種方法による結果によって、HCT療法におけるドナー及び患者由来のCathepsin Hタンパク質の多型部位及び/又はCathepsin Hタンパク質のmHAエピトープペプチドをコードする塩基配列を確認してHCT療法におけるドナーと患者の適合性を判定し、GVTを強化する免疫療法に有用な組み合わせか否かの診断を行うことができる。以下に、得られたPCR増幅産物についてドナー及び患者間の遺伝子タイピングを行った結果に基づいた判定の一例を示す。ただし、これに限定されるものではない。
【0068】
HLA-A33またはA31を有するドナー及び患者間において、Cathepsin Hタンパク質の適合性を確認し、患者のGVTを強化する免疫療法が有効であるかを判定する有用なCathepsin H遺伝子の多型部位を含む領域としては、一例として、配列番号4及び/又は配列番号5のmHAエピトープペプチドが利用可能である。
【0069】
例えば、前記各種PCR法による結果、(1)ドナーから調製したDNA試料中に配列番号4のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在し、(2)患者から調製したDNA試料中に配列番号5のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在する場合は、両者のCathepsin Hタンパク質が不適合であり、この場合、ドナー由来のCD8+CTLは患者のGVTを強化し得る。
【0070】
また、逆に、(1)ドナーから調製したDNA試料中に配列番号5のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在し、(2)患者から調製したDNA試料中に、配列番号4のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在する場合にも、両者のCathepsin Hタンパク質は不適合であり、ドナー由来のCD8+CTLは患者のGVTを強化し得る。
【0071】
さらに、(1)ドナーから調製したDNA試料中に配列番号4または5のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在し(すなわちドナーが配列番号4または5の塩基配列のホモ接合である場合)、(2)患者から調製したDNA試料中に、配列番号4および5のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在する場合(すなわち患者が配列番号4および5の塩基配列のヘテロ接合である場合)にも、両者のCathepsin Hタンパク質は不適合であり、ドナー由来のCD8+CTLは患者のGVTを強化し得る。
【0072】
しかしながら、ドナーから調製したDNA試料及び患者から調製したDNA試料に、配列番号4又は5(すなわち配列番号4又は5の塩基配列のホモ接合である場合)あるいは4及び5(すなわち配列番号4及び5の塩基配列のヘテロ接合である場合)の同じ配列番号のmHAエピトープペプチドをコードする塩基配列がハイブリダイズする塩基配列が存在する場合には、両者のCathepsin Hタンパク質は適合しており、ドナー由来のCD8+CTLは患者のGVTを強化するのに適当ではない。
【0073】
なお、これらの組み合わせのペプチドをコードする塩基配列のうち、いずれかのペプチドをコードする塩基配列の単独使用によりPCR法を実施することもできるが、判定の結果の精度を高め、DNA断片の由来を確実に確認するために、これらのペプチドをコードする塩基配列は組み合わせて使用することが望ましい。
【0074】
一方、GVT反応の反対の反応が宿主対移植片反応であり、これはHCTの際に輸注したドナーの造血細胞の拒絶に結びつく危険な反応であるが、輸血歴の長い再生不良性貧血や骨髄異形成症候群の患者において比較的発生しやすい移植造血細胞の拒絶リスクの予測にも本発明のペプチドを利用できる可能性がある。
【実施例】
【0075】
以下に実施例を示し、本発明を具体的に説明するが、本発明はこれらに限定されるものではない。
[実施例1] 造血器腫瘍細胞を傷害し得るCD8+CTLエピトープペプチドの同定
1.各種材料の調製
(1)血液の入手
造血器腫瘍である白血病(2症例の急性骨髄性白血病(HLA-A33およびHLA-A31))に対しHLA一致同胞からHCTを受ける患者の移植前および移植後末梢血及びHCTドナーの末梢血から単核球細胞を分離した。HLA型はDNAタイピング法を用いて測定した。
【0076】
(2)EBV感染B細胞株
HCTドナーおよび移植前の患者末梢血単核球細胞にEBV産生細胞株であるB95-8細胞の上清(生EBVウイルスを含む)を感染させて、EBV感染B細胞株(Lymphoblastoid cell line、以下、EBV感染LCLと称する)を樹立した。
また、HLA-A33又はHLA-A31を持った健常人の末梢血単核球細胞に、同様にEBV産生細胞株であるB95-8細胞の上清を感染させて、EBV感染LCLを樹立した。
【0077】
2.mHAエピトープペプチドに特異的なCD8+CTLの培養樹立
(1) mHAエピトープペプチドに特異的なCD8+CTL
前記1.(1)で取得したHCT後の患者末梢血単核球細胞を、細胞致死量の放射線を照射しておいたHCT前の患者末梢血単核球細胞とともにフラスコ内で混合培養した。ドナーと患者間にはmHAエピトープペプチドの不適合があり、患者のmHAエピトープペプチド(抗原)に反応したドナーリンパ球由来のCD8+CTLが増殖を開始した。CD8+CTLの増殖を助けるために、培養液にはIL-2を添加した。
【0078】
(2) 患者のmHAエピトープペプチドに特異的なCD8+CTLクローンの樹立と細胞傷害性試験
2.(1)で増殖した2症例より得た2つのCD8+CTL株から、限界希釈法を用いてCD8+CTLクローンを樹立した。各々のCD8+CTL株から複数のCTLクローンが得られたが、健常人より作成したEBV感染LCLに対する反応パターンが同等であったので、同一の細胞に起源する娘クローンと考えられた。従って、各々のCD8+CTL株より増殖の良好なCTLクローンを1つずつ選び、以下の実験に供した。選択された2種類のCTLクローンは、51Cr遊離法を用いた細胞傷害性試験において、HCTドナーのEBV感染LCL は傷害しないが、患者のEBV感染LCL は傷害したため、患者のmHAエピトープペプチドに特異的と考えられた。またHLA-A33またはHLA-A31を持った健常人より作成しておいた複数のEBV感染LCLに対する反応性から、2種類のCD8+CTLクローンは、各々、HLA-A33及びHLA-A31によって提示されるmHAエピトープペプチドを認識していることが判明した(以下、HLA-A33拘束性CD8+CTLクローン、HLA-A31拘束性CD8+CTLクローンと称する)。
【0079】
さらに、図7に示すように1例の造血器腫瘍患者(急性骨髄性白血病FAB分類M5b型で、HLA-A31拘束性CD8+CTLクローンを移植後末梢血から樹立した患者で、HLA-A33も併せ持つ)から初発時の白血病細胞を採取し、HLA-A33拘束性CD8+CTLクローンの細胞傷害性を検討したところ、同じ患者より樹立したEBV感染LCLのみならず急性骨髄性白血病細胞を傷害したことより、造血器腫瘍細胞を実際に傷害することが示された。なお、HLA-A33を導入したU937白血病細胞株、同患者より樹立した正常T細胞・B細胞芽球も強く傷害されず、これらの細胞種ではもともとCathepsin H遺伝子の発現が弱い可能性が示唆された。
【0080】
3.リンケージ解析によるmHAをコードする遺伝子の同定
(1) 細胞パネルの作成と細胞傷害性試験
国際組織適合ワークショップよりCEPH(Centre d'Etude du Polymorphisme Humain)家系のEBV感染LCLを入手し、これら各EBV感染LCLにHLA-A33およびHLA-A31遺伝子を各々導入して、HLA-A33又はHLA-A31を細胞表面に発現する各細胞パネルを作成した。これらを標的細胞とし、2. (2)で得られたHLA-A33拘束性CD8+CTLクローン及びHLA-A31拘束性CD8+CTLクローンを用いて51Cr遊離法を用いた細胞傷害性試験を行い、どのEBV感染LCLに、造血器腫瘍患者と同じ多型性を持つmHAエピトープペプチドが存在しているか検討した。その結果、HLA-A33拘束性CD8+CTLクローン及びHLA-A31拘束性CD8+CTLクローンに全く同一の細胞傷害性パターンが示された。HLA-A33拘束性CD8+CTLクローン及びHLA-A31拘束性CD8+CTLクローンの結果を図8に示す。
【0081】
(2) 2点連鎖解析
インターネット上に公開されているFASTLINKソフトウエアおよびCEPH家系の遺伝子解析データベースを、それぞれftp://fastlink.nih.gov/pub/fastlinkおよびhttp://www.cephb.fr/cephdb/より入手し、3.(1)で得た細胞傷害性試験の成績と組み合わせ、2 (1)で得られたHLA-A33拘束性CD8+CTLクローン及びHLA-A31拘束性CD8+CTLクローンが認識している遺伝子座を特定したところ、第15番染色体長腕24-25付近と判明した。この遺伝子座にある34種類の遺伝子のうち、1箇所以上の多型性部位を有し、HLA-A33およびHLA-A31の双方に提示される複数のmHAエピトープペプチドをコードし得る遺伝子を検索したが複数の候補が挙がり、遺伝子の同定には至らなかった。そこでHLA-A33拘束性CD8+CTLクローンを樹立したHLA-A33をもつ患者のEBV感染LCLからメッセンジャーRNAを分離、相補性DNAライブラリーを作成し、発現クローニング法にて遺伝子を検索したところ、第15番染色体長腕24-25に存在するCathepsin Hが同定された。
【0082】
4.HLA-A33又はHLA-A31に結合し得るmHAエピトープペプチドの同定
配列番号1に示すCathepsin Hタンパク質のアミノ酸配列上には遺伝子多型を検索し得る、インターネット上に公開されている米国のNational Institute of Health(NIH)のNational Center for Biotechnology Information(NCBI)のhttp://www.ncbi.nlm.nih.gov/SNP/snp_ref.cgi?rs=2289702によって、3箇所のアミノ酸置換をともなう遺伝子多型の存在が公表されている。これらのうちmHAエピトープペプチドの生成に関わっている多型部位をHLA-A33拘束性CD8+CTLクローンが傷害するかしない複数のEBV感染LCLから得たDNAのCathepsin H遺伝子の塩基配列を比較することで 検索したところ、第11番アミノ酸の多型がHLA-A33拘束性CD8+CTLクローンの細胞傷害性の有無をコントロールしていることが分かった。この部位のペプチド配列をBioInformatics & Molecular Analysis Section (BIMAS)のHLA Peptide Binding Predictions(http://bimas.dcrt.nih.gov/molbio/hla_bind/index.html.)によって照合し、HLA-A33又はHLA-A31の結合モチーフを有する9〜10個のアミノ酸よりなるmHAエピトープ候補ペプチドを多数スクリーニングし、4種のmHAエピトープ候補ペプチドを合成した。これを51Crで放射線ラベルしておいたmHA陰性のHCTドナーの細胞に添加して30分室温で静置した後、適当な数の2.(2)で得られたHLA-A33拘束性CD8+CTLクローン又はHLA-A31拘束性CD8+CTLクローンと混合し、細胞傷害性試験を行った。
【0083】
また、CD8+CTL mHAエピトープペプチドが内因性にプロセスされていることを確認するためにCathepsin H遺伝子の各多型部位をコードするミニ遺伝子を作成し、mHA陰性で拘束性HLAをあらかじめ発現させておいた293T細胞に導入し、これを抗原提示細胞としたインターフェロンγ遊離試験を行った(図9)。ここで、内因性にプロセスされているとは、ミニ遺伝子導入細胞内で新規に作られたCathepsin Hタンパク質が、細胞が本来持つ抗原処理機構により正しい長さの抗原ペプチドに切断され、HLA重鎖とβ2ミクログロブリンと複合体を形成しCathepsin Hミニ遺伝子導入細胞表面に提示されている状態のことを意味する。
【0084】
上記の試験方法に従って、CD8+CTL、またそのCD8+CTLクローンが反応した、以下の配列番号4〜7で表されるmHAエピトープペプチドを得た。これらのペプチドのうち配列番号4及び5は、HLA-A33結合モチーフを有するペプチド配列であり、配列番号4〜7はHLA-A31結合モチーフを有するペプチド配列である。すなわちHLA-A31は9または10個のアミノ酸双方を結合し提示できる。
【0085】
また、配列番号4〜7のmHAエピトープペプチドは配列番号2で表されるCathepsin Hタンパク質のアミノ酸配列において、第11番目のアミノ酸を含んでなる部分ペプチドである(配列番号3)。
Trp Ala Thr Leu Pro Leu Leu Cys Ala Arg(配列番号4)
Trp Ala Thr Leu Pro Leu Leu Cys Ala Gly(配列番号5)
Ala Thr Leu Pro Leu Leu Cys Ala Arg(配列番号6)
Ala Thr Leu Pro Leu Leu Cys Ala Gly(配列番号7)
【0086】
[実施例2] HLA-A2に結合し得るmHAエピトープペプチドの同定
前記の配列番号4〜7に示されるペプチドは、Cathepsin Hタンパク質の第11番目のアミノ酸を各々含む部分ペプチドであって、かつ、HLA-A33又はHLA-A31に結合するmHAエピトープペプチドであったが、さらに、HLA-A2に結合し得るmHAエピトープペプチドを検討するために、Cathepsin Hタンパク質のアミノ酸配列について、インターネット上に公開されているBioInformatics & Molecular Analysis Section(BIMAS)のHLA Peptide Binding Predictions(http://bimas.dcrt.nih.gov/molbio/hla_bind/index.html.)によって照合した結果、HLA-A2結合モチーフを有する9〜10個のアミノ酸よりなるmHAエピトープが存在することが判明し、次の8種のエピトープ候補ペプチドを同定した。
【0087】
これらの配列のうち、配列番号8〜15で表されるペプチドは、Cathepsin Hタンパク質のアミノ酸配列において、第11番目アミノ酸を含む部分ペプチドである。
Leu Leu Cys Ala Arg Ala Trp Leu Leu(配列番号8)
Leu Leu Cys Ala Arg Ala Trp Leu Leu(配列番号9)
Pro Leu Leu Cys Ala Arg Ala Trp Leu(配列番号10)
Pro Leu Leu Cys Ala Gly Ala Trp Leu(配列番号11)
Arg Ala Trp Leu Leu Gly Val Pro Val(配列番号12)
Gly Ala Trp Leu Leu Gly Val Pro Val(配列番号13)
Pro Leu Leu Cys Ala Arg Ala Trp Leu Leu(配列番号14)
Pro Leu Leu Cys Ala Gly Ala Trp Leu Leu(配列番号15)
【0088】
[実施例3]ワクチン注射剤
DMSOに、配列番号4〜17のペプチドを最終濃度20mg/mlとなるように各々溶解し、ろ過滅菌した。得られたペプチド含有溶液を滅菌バイアル瓶に1mlずつ分注密栓し、ワクチン注射剤とした。
【図面の簡単な説明】
【0089】
【図1】CD8+CTLによる造血器腫瘍細胞又は固形腫瘍細胞の認識機構を示す図である。
【図2】MHC-テトラマーの調製方法を示す図である。
【図3】MHC-テトラマーとCD8+CTLの結合を示す図である。
【図4】MHC−磁気ビーズの調製方法を示す図である。
【図5】MHC−磁気ビーズによるCD8+CTLの単離を示す図である。
【図6】mHAエピトープペプチド、及びその後の抗CD3抗体、IL-2による刺激による、CD8+CTLの増殖を示す図である。
【図7】HLA-A24拘束性クローンと結合するCD8+CTLによる白血病細胞株を含む種々の標的細胞に対する細胞傷害性を示す図である。
【図8】HLA-A33拘束性クローン、HLA-A31拘束性クローンが、CEPH家系(家系番号1347番および1413番)より樹立したEBV感染LCLに各々HLA-A33、HLA-A31を発現させたものに対して、全く同様なパターンで傷害するのを示す図である。
【図9】各CTLクローンが認識するエピトープペプチドの同定の結果を示す図である。
【技術分野】
【0001】
本発明は、Cathepsin Hタンパク質の部分ペプチドであって、かつ、ヒト主要組織適合性抗原(HLA)と結合してCD8+細胞傷害性Tリンパ球(cytotoxic T lymphocyte、以下、CTLと称する)によって認識され得るマイナー組織適合性抗原(mHA)エピトープペプチド、該ペプチドを用いた同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するためのワクチン及び受動免疫療法剤、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+細胞傷害性Tリンパ球の定量方法、並びに該ペプチドを用いた同種造血細胞移植適合性診断方法に関する。
【背景技術】
【0002】
同種造血細胞移植(hematopoietic stem cell transplantation, 以下、HCTと称する)は、化学療法だけでは予後不良な白血病等の造血器腫瘍に治癒をもたらしうる治療法として確立されてきた。さらに最近になって、固形腫瘍に対してもミニ移植と称するHCTが試みられるようになり、一部の固形腫瘍(例えば腎細胞癌、悪性黒色種等)で腫瘍縮小効果が見られつつある。実際、一部の固形腫瘍では、本来、造血器細胞に特異的な遺伝子が異常に発現しているという報告がある。例えば、Cathepsin H遺伝子に関しては、胃癌細胞や悪性黒色種で異常発現し、HA-1遺伝子に関しては肺癌等で異常発現している(例えば、非特許文献1〜3参照)。しかし、進行期の造血器腫瘍や固形腫瘍は、HCTを行ったにもかかわらずしばしば再発し、必ずしも予後は良好ではない。
【0003】
HCTは、ヒト主要組織適合抗原(以下、HLAと称する)が適合した造血幹細胞提供者(以下、ドナーと称する)から患者に造血幹細胞が提供されるが、ドナーと患者間でHLAが一致していても、さまざまな遺伝子の多型に由来するマイナー組織適合性抗原(minor histocompatibility antigen, 以下、mHAと称する)には多くの不一致が起こり、それが標的となってドナー由来のTリンパ球を主体とする免疫反応が患者体内で起こる。この免疫反応が患者の造血器腫瘍又は固形腫瘍に対して抗腫瘍性効果を発揮すると原疾患の治癒をもたらすこととなり再発が回避される。これを移植片対腫瘍(graft-versus-tumor, 以下、GVTと称する)効果と呼んでいる。
【0004】
HCT後再発を来す患者においては、このGVT効果が不十分であると考えられる。このため、ドナー由来のTリンパ球の作用を強め、GVT効果を高めることを目的として、拒絶予防に用いる免疫抑制剤を減量する治療を行うことがあるが、その場合、ドナー由来のTリンパ球が患者の身体中の細胞を非自己とみなし強く排除するようになり、移植片対宿主病(graft-versus-host disease, 以下、GVHDと称する)と呼ばれる致死的な合併症がしばしば起こる。このためGVHDを回避しつつ、GVT効果のみを積極的に取り出して利用しようとするような有効な治療法が望まれている。
【0005】
HCT後の造血器腫瘍又は固形腫瘍の再発を制御している主な免疫担当細胞は、ドナーのTリンパ球由来のCD8+CTLである。ドナー由来CD8+CTLは、患者体内で残存する造血器腫瘍細胞又は固形腫瘍細胞を発見するとそれを非自己と認識して破壊する能力を持っている。従って、CD8+CTLのその傷害機能を有効に活性化すれば、GVT効果が高まるとともにGVHDの発症を回避することができ、新たな造血器腫瘍又は固形腫瘍の再発予防法や再発時の治療法の開発につながる可能性が高い。
【0006】
CD8+CTLが造血器腫瘍細胞や固形腫瘍細胞を認識する際、以下のような特徴がある。
(1) CTLはドナーのTリンパ球由来である。
(2) CTLは、個人に固有な遺伝子多型を有する遺伝子によってコードされる患者の造血器腫瘍細胞又は固形腫瘍細胞内の各種タンパク質(以下、mHAタンパク質と称する)の部分ペプチド(以下、mHAエピトープペプチドと称する)、例えば、Cathepsin Hタンパク質中のドナーと患者間で異なる個人に固有な遺伝子多型を有する遺伝子によってコードされる9〜10個のアミノ酸からなるペプチドを認識して、造血器腫瘍細胞又は固形腫瘍細胞を傷害(破壊)する。
(3) このmHAエピトープペプチドは、造血器腫瘍細胞又は固形腫瘍細胞の表面にあるHLAに結合してCTLに提示されることによって認識される。
(4) HLAは人種間、個人間によって異なり、HLAが異なるとmHAエピトープとなるペプチドが異なるため、CTLへの提示そのものが出来なくなることがある。
【0007】
以上の(1)から(4)で述べたことから明らかなように、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLのmHAエピトープペプチドとなり得るペプチドを含むmHAタンパク質を同定し、該エピトープペプチドのアミノ酸配列を過不足なく決定することは、そのドナーがHCTを受ける患者又は受けた患者に有効なGVT効果をもたらし得るか否かを診断し、さらには、特異的免疫治療法を施す際の必須の確認事項となり得る。
【0008】
しかしながら、日本人の多くが保有するHLA 型(HLA-A24型、64%;HLA-A33型、25%;HLA-A11型、22%;HLA-A2.1型、21%;HLA-A31型、18%;HLA-B44型、24%;HLA-B52型、20%;HLA-B35型、15%;HLA-B54型、14%;HLA-Cw1型、34%;HLA-Cw*14型、24%;HLA-Cw*0304型、22%;HLA-Cw*0702型、22%;HLA-Cw*0801、21%;HLA-Cw*1202、21%等)について、特にHLA-A33型、HLA-A31型等については、CD8+CTLが認識するmHAエピトープペプチドの報告は極めて少なく、HCT後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又はHCT後の造血器腫瘍あるいは固形腫瘍の再発を予防するのに有用なmHAエピトープペプチドの開発が求められている。
【0009】
【非特許文献1】Choi ら著、Oncogene誌 第11巻9号、1693-8頁、1995年
【非特許文献2】Kenny ら著、Oncogene誌 第14巻8号、997-1001頁、1997年
【非特許文献3】Fujiiら著、Transplantation誌 第73巻7号、1137-1141頁、2002年
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明は、Cathepsin Hタンパク質のアミノ酸残基数9〜10個からなる部分ペプチドであって、かつ、HLAと結合してCD8+CTLによって認識され得るmHAエピトープペプチド、該ペプチドを用いた同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するためのワクチン及び受動免疫療法剤、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLの定量方法、並びに該ペプチドを用いた同種造血細胞移植適合性診断方法を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者らは、上記課題を解決するため鋭意研究を行った結果、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLが認識し得るmHAエピトープペプチドを見い出し、本発明を完成するに至った。
【0012】
すなわち、本発明は、以下の(1)〜(19)を提供する。
(1) Cathepsin Hタンパク質の部分ペプチドであって、かつ、ヒト主要組織適合性抗原(HLA)と結合してCD8+細胞傷害性Tリンパ球によって認識され得るマイナー組織適合性抗原(mHA)エピトープペプチド。
(2) Cathepsin Hタンパク質の部分ペプチドのアミノ酸残基数が5〜20個である(1)に記載のマイナー組織適合性抗原(mHA)エピトープペプチド。
【0013】
(3) Cathepsin Hタンパク質の部分ペプチドのアミノ酸残基数が9〜10個である(2)に記載のマイナー組織適合性抗原(mHA)エピトープペプチド。
(4) Cathepsin Hタンパク質の部分ペプチドが、配列番号1で表されるアミノ酸配列において、第19番目、第39番目又は第82番目のアミノ酸を含んでなる部分ペプチドである、(1)〜(3)のいずれかに記載のペプチド。
【0014】
(5) HLAがHLA-A33である、(1)〜(4)のいずれかに記載のペプチド。
(6) 配列番号3又は4で示されるアミノ酸配列からなるペプチドである、(5)に記載のペプチド。
(7) HLAがHLA-A31である、(1)〜(4)のいずれかに記載のペプチド。
【0015】
(8) 配列番号4〜7で示されるアミノ酸配列からなる群から選択されるペプチドである、(7)に記載のペプチド。
(9) HLAがHLA-A2である、(1)〜(4)のいずれかに記載のペプチド。
(10) 配列番号8〜15で示されるアミノ酸配列からなる群から選択されるペプチドである、(9)に記載のペプチド。
【0016】
(11) CD8+細胞傷害性Tリンパ球が、造血器腫瘍細胞又は固形腫瘍細胞を傷害するものである、(1)〜(10)のいずれかに記載のペプチド。
(12) 造血器腫瘍が白血病、骨髄異形成症候群、悪性リンパ腫又は多発性骨髄腫である、(11)に記載のペプチド。
(13) 固形腫瘍が腎細胞癌、悪性黒色腫、乳癌、胃癌、肺癌又は前立腺癌である、(11)に記載のペプチド。
【0017】
(14) (1)〜(13)のいずれかに記載のペプチド又は該ペプチドをパルスした抗原提示細胞を有効成分として含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するためのワクチン。
(15) (1)〜(13)のいずれかに記載のペプチド又は該ペプチドをパルスした抗原提示細胞により末梢血リンパ球を刺激して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【0018】
(16) (1)〜(13)のいずれかに記載のペプチドから調製した主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーと末梢血リンパ球とを反応させ、該主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体から単離して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【0019】
(17) (1)〜(13)のいずれかに記載のペプチドから調製した主要組織適合抗原複合体−標識磁気ビーズと末梢血リンパ球とを反応させ、主要組織適合抗原複合体−標識磁気ビーズにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体から単離して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【0020】
(18) (1)〜(13)のいずれかに記載のペプチドで末梢血を刺激してCD8+細胞傷害性Tリンパ球を得、該CD8+細胞傷害性Tリンパ球が産生するサイトカイン及び/又はケモカインを測定することを特徴とする、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+細胞傷害性Tリンパ球の定量方法。
【0021】
(19) (1)〜(13)のいずれかに記載のペプチドから主要組織適合性複合体及び/又は主要組織適合性複合体−テトラマーを調製し、該主要組織適合性複合体及び/又は主要組織適合性複合体−テトラマーと末梢血とを反応させる、該末梢血中の造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+細胞傷害性Tリンパ球の定量方法。
(20) 同種造血細胞移植におけるドナー及び患者由来のDNAを配列番号2に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列を用いて遺伝子タイピングを行うことを含む、同種造血細胞移植適合性診断方法。
【0022】
(21) 同種造血細胞移植におけるドナー及び患者由来のDNAを配列番号2に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列を用いてPCR法により増幅し、得られたPCR増幅産物についてドナー及び患者間の遺伝子タイピングを行うことを含む、(20)に記載の同種造血細胞移植適合性診断方法。
(22) Cathepsin H遺伝子の多型部位を含む領域の塩基配列の塩基長が18〜30merである、(20)または(21)に記載の同種造血細胞移植適合性診断方法。
【0023】
(23) 配列番号1に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列が、請求項1に記載のmHAエピトープペプチドをコードする塩基配列である、(20)〜(23)のいずれかに記載の診断方法。
(24) (1)〜(13)のいずれかに記載のペプチドの少なくとも1種類のペプチドでパルスされ、表面に発現しているHLAに上記ペプチドが結合している単離した抗原提示細胞。
(25) 抗原提示細胞を(1)〜(13)のいずれかに記載のペプチドの少なくとも1種類のペプチドとともにin vitroで培養することを含む、抗原提示細胞の活性化法であって、活性化された抗原提示細胞がCD8+細胞傷害性Tリンパ球を刺激し得る、活性化法。
【0024】
(26) 以下の(a)〜(c)のいずれかの方法により、造血器腫瘍又は固形腫瘍の予防及び治療に用いることができるCD8+細胞傷害性Tリンパ球を調製する方法。
(a) (1)〜(13)のいずれかに記載のペプチド又は該ペプチドでパルスした抗原提示細胞を用いて、in vitro で末梢血リンパ球を刺激することを含む方法、
(b) (1)〜(13)のいずれかに記載のペプチドから調製した主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーと末梢血リンパ球とを反応させ、該主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体からCD8+細胞傷害性Tリンパ球を単離することを含む方法、及び
(c) (1)〜(13)のいずれかに記載のペプチドから調製した主要組織適合抗原複合体−標識磁気ビーズと末梢血リンパ球とを反応させ、主要組織適合抗原複合体−標識磁気ビーズにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体からCD8+細胞傷害性Tリンパ球を単離することを含む方法
(27) (26)に記載の方法により得られた、造血器腫瘍又は固形腫瘍の予防及び治療に用いることができる単離されたCD8+細胞傷害性Tリンパ球。
【発明の効果】
【0025】
本発明により、Cathepsin Hタンパク質の部分ペプチドであって、かつ、ヒト主要組織適合性抗原(HLA)と結合してCD8+CTLによって認識され得るmHAエピトープペプチドを提供することができる。また、該ペプチドを用いて、HCTを受けた患者の造血器腫瘍又は固形腫瘍を治療又は予防することができる。さらに、HCT後の患者体内の造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLを定量することができる。また、該ペプチドを用いた同種造血細胞移植適合性診断方法を提供することが可能である。
【発明を実施するための最良の形態】
【0026】
本発明についてさらに詳細に説明する。
1.CD8+CTLによって認識され得るmHAエピトープペプチド
本発明におけるペプチドとは、生理活性を有し、隣接するアミノ酸残基のα−アミノ基とカルボキシル基間のペプチド結合により相互に結合した線状のアミノ酸の分子鎖を意味する。ペプチドは特定長のものを意味するものではなく、種々の長さであり得る。また、無電荷又は塩の形態であってもよく、場合によっては、グリコシル化、アミド化、ホスホリル化、カルボキシル化、リン酸化等により修飾されていてもよい。さらには、本発明のエピトープの生理活性及び免疫活性を実質的に改変せず、投与した場合に有害な活性を有するものでない限り、1個又は数個(例えば、1〜8個、好ましくは1〜3個)のアミノ酸の挿入、付加、置換等が生じたペプチドも本発明に含まれる。例えば、ペプチドのN末端又はC末端に付加的アミノ酸配列が介在するものも含まれる。また、本発明のペプチドは、糖類、ポリエチレングリコール、脂質等が付加された複合体、放射性同位元素等による誘導体、あるいは重合体等の形態として用いることができる。
【0027】
また、本発明におけるCD8+CTLによって認識され得るmHAエピトープペプチドとは、造血器腫瘍細胞又は固形腫瘍細胞の表面にあるHLAに結合して提示され、ドナー由来のCD8+CTLのT細胞抗原受容体(TCR)と結合することによってCD8+CTLに認識され得る、造血器腫瘍細胞又は固形腫瘍細胞内に存在するmHAタンパク質の部分ペプチドであって、個人に固有な遺伝子多型を有する遺伝子によってコードされる、多型部位を含むペプチドを意味する。該ペプチドは、好ましくは5〜20個のアミノ酸からなり、さらに好ましくは5〜15個、7〜12個または8〜11個のアミノ酸からなり、特に好ましくは9〜10個のアミノ酸からなる。従って、該ペプチドは、mHAタンパク質を発現するHLAの特定の型の造血器腫瘍細胞又は固形腫瘍細胞を直接に傷害(破壊)し、排除し得る、CD8+CTLの細胞性免疫機構を活性化する抗原基である。なお、CD8+CTLとは、ヒトリンパ球上に存在する表面抗原分子の一つであるCD8を発現しているCD8+細胞傷害性Tリンパ球を意味する。図1にその機構を示す。
【0028】
本発明において、造血器腫瘍には、白血病、骨髄異形成症候群、悪性リンパ腫、多発性骨髄腫、等の造血関係の組織又は細胞に発生した腫瘍が含まれる。また、本発明において、固形腫瘍とはCathepsin H遺伝子を異常発現する固形腫瘍であればいかなる固形腫瘍をも含むが、具体的には、腎細胞癌、悪性黒色腫、乳癌、胃癌、肺癌、前立腺癌などが挙げられる。
【0029】
mHAタンパク質の候補になりうるものは、造血器腫瘍細胞又は固形腫瘍細胞内にのみ存在し、かつ個人に固有な遺伝子多型を有する遺伝子によってコードされる各種タンパク質である。このうち造血関係の細胞及び一部の固形臓器においてのみその遺伝子が発現されることから、Cathepsin Hタンパク質が本発明のmHAエピトープペプチドの特定に特に有用である。
【0030】
Cathepsin Hタンパク質は、リゾチームのシステインタンパク分解酵素であり、リゾチーム内のタンパクの分解に重要である。このタンパク質をコードする遺伝子の発現が前立腺がんにおいて亢進することが報告されている(Waghrayら著、J Biol Chem誌 第277巻、11533-11538頁、2002年)。本遺伝子の発現は、造血系細胞の他、肺、腎臓、肝臓でも認められるが、本発明のmHAエピトープペプチドに特異的なCTLは少なくとも皮膚線維芽細胞、骨髄のストローマ細胞は傷害しないため、遺伝子の発現とmHAエピトープの生成は平行しない可能性が高い。
【0031】
なお、Cathepsin Hタンパク質をコードする遺伝子の塩基配列(配列番号1)及び該タンパク質のアミノ酸配列(配列番号2)はhttp://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?val=23110954&db=Nucleotide&dopt=GenBankに報告されている。
【0032】
また、Cathepsin Hタンパク質のアミノ酸配列の第11番目の多型(配列番号3)については、米国のNational Institute of Health(NIH)のNational Center for Biotechnology Information(NCBI)のhttp://www.ncbi.nlm.nih.gov/SNP/snp_ref.cgi?rs=2289702で確認することができる。前記アミノ酸配列の第11番目の多型は、Cathepsin-H遺伝子の塩基配列(配列番号1)の126番目の塩基(Cathepsin-Hタンパク質をコードするDNAの31番目の塩基の一塩基多型により、野生型がgであるのに対して、変異型はAであり、野生型のアミノ酸GlyがArgに変異する。
【0033】
なお、個人に固有な遺伝子多型とは、多数の個人(例えば50人)から得たDNAに対し、Cathepsin H遺伝子につき塩基配列決定をして、各個人間で配列に差があるか否かを調べ、各個人間で配列に差があった場合には、それが複数の個人で見つかる普遍的なものかどうかを決定し、人口の何%に各多型が存在するかを推測することによって検索することができる個人に固有の遺伝子多型である。
【0034】
本発明のmHAエピトープペプチドは、HLAの型によって好適なものが異なるため、各HLAの型において結合し得るペプチドをスクリーニングすることによって同定することができる。具体的には、Cathepsin Hタンパク質のアミノ酸配列において、第11番目のアミノ酸を含んでなる部分ペプチドについて、HLAの各型(例えば、HLA-A33、A31、A2等)の結合モチーフを有する、9〜10個のアミノ酸よりなるエピトープペプチドを検索し得る照合媒体、例えば、インターネット上に公開されているBioInformatics & Molecular Analysis Section (BIMAS)のHLA Peptide Binding Predictions (http://bimas.dcrt.nih.gov/molbio/hla_bind/index.html)によって照合し、mHAエピトープペプチドとなり得るペプチド(以下、mHAエピトープ候補ペプチドと称する)をスクリーニングすることができる。
【0035】
mHAエピトープ候補ペプチドは、通常の化学合成により得ることができる。例えば、固相ペプチド合成法等の有機化学的合成法、あるいは、ペプチドをコードするDNAを調製し、組換えDNA技術を用いて調製することも可能である。また、市販の化学合成装置(例えば、アプライドバイオシステムズ社のペプチド合成装置)による合成も可能である。
【0036】
得られたmHAエピトープ候補ペプチドについて、例えば、以下に示すようないずれかの方法を実施することによって、CD8+CTLによって認識され得るmHAエピトープペプチドであるか否かを決定することができる。
【0037】
(1)mHAエピトープペプチド決定方法1
10%ヒト血清含有RPMI1640培地に2×106/mlの細胞濃度で、予めCathepsin H遺伝子多型を検索しておいた成人から分離したリンパ球を浮遊させ、該リンパ球を同じ人からあらかじめ分離培養しておいた樹状細胞(1×105/ml)あるいは活性化B細胞(1×106/ml)と混合し、これにmHAエピトープ候補ペプチドの中の任意の1種を1μg/mlの濃度で加える。炭酸ガス恒温槽にて37℃で10日間培養する。10日目にIL-2を添加し、以後、前記候補ペプチドとIL-2による刺激を週に1度くり返すことにより、Cathepsin Hタンパク質多型部位に特異的なCD8+CTLを誘導する。このようにして誘導したCD8+CTLに対してmHAエピトープ候補ペプチドが刺激するか否かについて、エリスポットアッセイ等で判定する。エリスポットアッセイは、Miyahira Y, 他著、Journal of Immunological Methods、 181巻:45-54頁、1995等で報告されている。判定により、誘導したCD8+CTLに対して刺激が認められた候補ペプチドを本発明のmHAエピトープペプチドとして決定する。
【0038】
(2)mHAエピトープペプチド決定方法2
Cathepsin Hタンパク質のアミノ酸配列において、第11番目のアミノ酸を含む部分ペプチドのペプチドライブラリーを常法により合成する。該部分ペプチドのアミノ酸残基数は、好ましくは5〜20個、さらに好ましくは5〜15個、7〜12個または8〜11個であり、特に好ましくは9〜10個である。合成したペプチドに対して、エリスポット法や細胞内IFNγ産生細胞定量法によりCD8+CTLが反応するようなmHAエピトープペプチドを選択して本発明のエピトープペプチドとする。
【0039】
本発明の配列番号4〜15のアミノ酸配列を有するペプチドは、上記のようなスクリーニング及び決定方法の結果、mHAエピトープペプチドとして確認されたものである。本発明の配列番号4〜15に示されるmHAエピトープペプチドは、従来の各種のペプチド合成方法によって調製され得る。
【0040】
2.ワクチン
本発明のmHAエピトープペプチドは、能動免疫ペプチドワクチン療法においてワクチンとして用いることができる。すなわち、本発明のmHAエピトープペプチドを含んでなるワクチンをHCT後の患者に投与することによって、該ペプチドを認識するCD8+CTLを体内で増殖させ、造血器腫瘍又は固形腫瘍の予防及び治療に役立てることができる。使用するmHA エピトープペプチドは、患者のHLA及びmHAの型に対応するペプチドを1種若しくは2種以上使用してもよく、また、組み合わせ、混合して使用することができる。例えば、mHAエピトープペプチドを提示しうるようなHLAが複数存在する場合、2種以上のペプチドを組み合わせて使用することができる。また、例えば、HLAの特定の型に結合するペプチドとして、2種以上の異なるmHAエピトープペプチド(第11番目アミノ酸を含む開始部位の異なった部分ペプチド)が存在する場合、それらの2種以上のペプチドを組み合わせて使用することができる。また、抗原提示細胞(例えば、樹状突起細胞、B細胞、マクロファージ等)に本発明のmHAエピトープペプチドをパルスしたもの(以下、mHAエピトープペプチドパルス細胞と称する)を含むワクチンも使用することができる。ここで、抗原提示細胞とは、該ペプチドが結合し得るHLAをその表面上に発現する細胞の中でCD8+CTL刺激能を有するものを意味し、パルスするとは、例えば、適当な培養液中で、抗原提示細胞と該ペプチドを30分から1時間程度混合することを意味する。抗原提示細胞は、末梢血や臍帯血から公知の方法で得ることができる。例えば、抗原提示細胞である樹状細胞、B細胞、マクロファージ等はそれぞれの細胞に特異的な抗原を細胞表面に有しているので、該抗原に対する抗体を利用して、抗原提示細胞を単離することもできるし、また抗原提示細胞以外の細胞を除去することによっても抗原提示細胞を単離することができる。この際、フローサイトメーターを用いることもできる。このように、mHAエピトープペプチドをパルスした抗原提示細胞は、その表面に発現するHLAにmHAエピトープペプチドが結合しており、CD8+細胞傷害性Tリンパ球を刺激することができる。
【0041】
本発明のmHAエピトープペプチド又はmHAエピトープペプチドパルス細胞を含んでなるワクチンは、当分野において公知の方法を用いて調製することができる。例えば、かかるワクチンとしては、本発明のmHAエピトープペプチド又はmHAエピトープペプチドパルス細胞を有効成分として含有する注射剤又は固形剤等がある。mHAエピトープペプチドは、中性又は塩の形態で処方することができ、例えば、薬学上許容され得る塩としては、塩酸、リン酸などの無機塩、又は、酢酸、酒石酸などの有機酸が挙げられる。また、本発明のmHAエピトープペプチド又はmHAエピトープペプチドパルス細胞は、製薬上許容され、該ペプチド又は該細胞の活性と相容性を有する賦形剤、例えば、水、食塩水、デキストロース、エタノール、グリセロール、DMSO、及びその他のアジュバント等、又はこれらの組み合わせと混合して用いることができる。さらに、必要に応じて、アルブミン、湿潤剤、乳化剤等の補助剤を添加してもよい。
【0042】
本発明のワクチンは、非経口投与及び経口投与により投与することができるが、一般には非経口投与が好ましい。非経口投与としては皮下注射、筋肉内注射、静脈内注射等の注射剤、座薬等がある。また、経口投与としては、スターチ、マンニトール、ラクトース、ステアリン酸マグネシウム、セルロース等の賦形剤との混合物として調製することができる。
【0043】
本発明のワクチンは、治療上有効な量で投与する。投与される量は、治療対象、免疫系に依存し、必要とする投与量は臨床医の判断により決定される。通常、適当な投与量は、患者一人当たり、mHAエピトープペプチドでは1〜100mg、mHAエピトープペプチドパルス細胞では106〜109個の含有量とする。また、投与間隔は、対象、目的により設定することができる。
【0044】
3.受動免疫療法剤
本発明のmHAエピトープペプチドは、HCT後の造血器腫瘍の再発に対する予防的または治療的受動免疫治療剤の調製に用いることができる。すなわち、1)末梢血リンパ球を該ペプチドで刺激して得られるCD8+CTL、2)末梢血リンパ球を該ペプチドから調製した主要組織適合抗原複合体(major histocompatibility complex、以下、MHCと称する)又はMHC−テトラマーと反応させ、MHC又はMHC−テトラマーにCD8+CTLが結合した結合体を形成させ、該結合体から単離して得られるCD8+CTL、又は、3)末梢血リンパ球を該ペプチドから調製したMHC−テトラマー−標識磁気ビーズと反応させ、MHC−テトラマー−標識磁気ビーズにCD8+CTLが結合した結合体を形成させ、該結合体から単離して得られるCD8+CTL、を含む、受動免疫療法剤を得ることができる。ここで、磁気ビーズは、酸化鉄などの磁性体を核に持ち、表面を他の材料で被覆された直径数十nmから数十μmの球状粒子をいう。本発明において、公知の磁気ビーズを用いることができる。磁気ビーズへの、MHC-テトラマーの結合は、吸着、官能基を利用した共有結合による結合等、公知の手法で行うことができる。mHAエピトープペプチドを使用したMHC及びMHC-テトラマーは、例えば、以下のように調製することができる。タンパク質発現用の大腸菌から精製したHLA重鎖、β2ミクログロブリン及び本発明のmHAエピトープペプチドの複合体であるMHCをバッファー内で形成させる。組換えHLA重鎖タンパク質のC末端には予めビオチン結合部位を付加しておき、MHC形成後、この部位にビオチンを付加する。市販の標識色素ストレプトアビジンとビオチン化MHCをモル比1:4で混合することによってMHC-テトラマーを作製する。図2及び図3に得られたMHC-テトラマーとその反応機構をそれぞれ示す。なお、各ステップにおいて、ゲル濾過によるタンパク質精製を行うのが好ましい。
【0045】
受動免疫療法剤に含まれる、本発明のmHAエピトープペプチドを認識し得るCD8+CTLは、以下のような調製方法によって得ることができる。
(1)CD8+CTL調製方法1
リンパ球をHCT後の患者又はHCTドナーの末梢血から分離し、これを、上記のようにして調製した適当な濃度のMHC又はMHC-テトラマーと37℃、15分間反応させる。MHC又はMHC-テトラマー中のmHAエピトープペプチドと結合したCD8+CTLは標識色素により染色されるので、フローサイトメーターなどを用いて染色されたCD8+CTLのみを単離する。あるいは、予め無菌プレートなどに固相化したMHC及び/又はMHC-テトラマーに反応させることもできる。プレートに固相化されたMHC及び/又はMHC-テトラマー中のmHAエピトープペプチドに結合したCD8+CTLを単離するためには、結合せずに浮遊している他の細胞を洗い流した後に、プレート上に残ったCD8+CTLだけを新しい培養液に懸濁する。このようにして単離されたCD8+CTLは造血器腫瘍細胞又は固形腫瘍細胞を傷害し得るので、抗CD3抗体、PHA、IL-2等のT細胞刺激薬剤で刺激増殖させ、受動免疫療法に必要な細胞数を確保する(図6を参照)。
【0046】
(2)CD8+CTL調製方法2
前述のように調製したビオチン化MHCをストレプトアビジン標識磁気ビーズと結合させ、結合体(以下、MHC-磁気ビーズと称する)を作製する。MHC-磁気ビーズを図4に示す。リンパ球をHCT後の患者又はHCTドナーの末梢血等から分離し、適当な濃度の前記MHC-磁気ビーズをリンパ球:ビーズ比、1:10で反応させる。MHC-磁気ビーズ中のMHC/mHAエピトープペプチドに結合したCD8+CTLと結合したCD8+CTLの入った試験管を磁場におくと、ビーズと結合したCD8+CTLは磁石のある側の試験管内壁に寄せられる。その機構を図5に示す。その後、それ以外の細胞を洗い流した後に、試験管を磁場からはずし、試験管内壁に残った抗原特異的CD8+CTLだけを新しい培養液に懸濁する。このように単離されたCD8+CTLは造血器腫瘍細胞又は固形腫瘍細胞を傷害し得るので、抗CD3抗体、PHA、IL-2等のT細胞刺激薬剤で刺激増殖させ、受動免疫療法に必要な細胞数を確保する(図6を参照)。
【0047】
(3)CD8+CTL調製方法3
HCT後の患者又はHCTドナーの末梢血から分離したリンパ球を本発明のmHAエピトープペプチドで直接刺激するか、該ペプチドをパルスした抗原提示細胞(例えば、樹状突起細胞、B細胞、マクロファージ等)で刺激する。刺激によって誘導されたCD8+CTLを炭酸ガス恒温槽にて37℃で7〜10日培養する。その後IL-2を添加し、mHAエピトープペプチドとIL-2、又は該抗原提示細胞とIL-2による刺激を週に1度くり返すことによって受動免疫療法に必要な細胞数のCD8+CTLを確保する(図6を参照)。
【0048】
上記のようにして得られたCD8+CTLは造血器腫瘍細胞又は固形腫瘍細胞を傷害し得るので、ヒトアルブミン含有PBS等に懸濁させて、HCT後の造血器腫瘍又は固形腫瘍の再発に対する予防的または治療的受動免疫療法剤とすることができる。
【0049】
4.CD8+CTLの定量
本発明のmHAエピトープペプチドを認識し得るCD8+CTLが、HCT後の造血器腫瘍又は固形腫瘍の再発ハイリスクの患者(原疾患である造血器腫瘍又は固形腫瘍の悪性度が高く、HCT後に強力な免疫抑制剤の投与を受けている患者)のHCT後の末梢血に存在するか否かを知ることは、免疫抑制剤の適正な使用量の決定や再発リスクの予測を含め、HCT後の患者管理の上で重要な情報である。本発明のmHAエピトープペプチドを認識し、造血器腫瘍細胞又は固形腫瘍細胞を傷害し得るCD8+CTLの定量は、本発明のmHAエピトープペプチドを用いた以下の2つの方法によって行うことができる。
【0050】
第1の定量方法は、HCT患者の移植後の末梢血から分離されたリンパ球を本発明のmHAエピトープペプチドで刺激することによって誘導されるCD8+CTLが産生するインターフェロンガンマ(IFNγ)、インターロイキン等のサイトカイン及び/又はケモカインを定量する方法である。本発明で定量し得るサイトカイン、ケモカインは限定されず、サイトカインとしては上記のように、IFNγ、インターロイキンやコロニー刺激因子等を含み、ケモカインとしてはCXCケモカイン、CCケモカイン、Cケモカイン、CX3Cケモカイン等を含む。以下にIFNγを例にとり具体的に方法を示す。
【0051】
(1)サイトカイン定量による方法1(細胞内IFNγ産生細胞定量);
HCT後の患者あるいはHCTドナーの末梢血から分離したリンパ球を10%ヒト血清含有RPMI1640培地に2×106/mlの細胞濃度で浮遊させ、本発明のmHAエピトープペプチドを1μg/mlの濃度で加える。さらに細胞内蛋白輸送阻止剤であるBrefeldin A等を加え、炭酸ガス恒温槽にて37℃で5〜6時間培養する。培養後、細胞を固定、膜透過処理を行い、色素標識抗IFNγ抗体、抗CD8抗体と反応させる。フローサイトメーター等を用いて、CD8+リンパ球中のIFNγ陽性細胞%を定量する。
【0052】
(2)サイトカイン定量による方法2(エリスポットアッセイ);
96穴MultiScreen-HAプレート(Mi11ipore)を抗IFNγモノクローナル抗体で一晩、4℃でコーティングし各穴をPBSで洗浄した後、HCT後の患者あるいはHCTドナーの末梢血から分離したリンパ球を各穴にまく。mHAエピトープペプチドを各穴に入れ37℃の5% CO2培養器にて20時間培養する。翌日、0.05%Tween‐20添加PBSでプレートを洗浄した後、抗IFNγウサギ血清、ペルオキシダーゼ標識抗ウサギIgGヤギ血清の順で各々90分ずつ室温で反応させる。さらに3-amino-9-ethylcarbasole (Sigma)と0.015%のH2O2を含む0.1M 酢酸ナトリウムバッファー(pH 5.0)を各穴に入れ、室温で40分反応させる。IFNγスポットを可視化し、実体顕微鏡でカウントする。
【0053】
(3)サイトカイン定量による方法3(培養上清中に分泌されたIFNγを定量する方法);
末梢血から分離したHCT後の患者あるいはHCTドナーの末梢血(を10%ヒト血清含有RPMI1640培地に2×106/mlの細胞濃度で浮遊させ、本発明のmHAエピトープペプチドを1μg/mlの濃度で加える。炭酸ガス恒温槽にて37℃で24-48時間培養する。培養後、上清を回収し、その中に含まれるIFNγ濃度を市販のELISAキット(例えばENDOGEN社のHUMAN IFN gamma ELISA)を使用して定量する。
【0054】
第2の定量方法としては、本発明のmHAエピトープペプチドを使用して作製したMHC-テトラマーを用いて、mHAエピトープペプチドを認識し、造血器腫瘍細胞又は固形腫瘍細胞を傷害し得るCD8+CTLを定量することができる。MHC-テトラマーの調製は前述のとおりである。定量は、例えば、以下のようにして実施することができる。HCT後の患者あるいはHCTドナーの末梢血からリンパ球を分離し、適当な濃度のMHC-テトラマーと37℃、15分反応させる。該テトラマーと結合したCD8+CTLは標識色素により染色されるので、フローサイトメーター等を用いてカウントする。
【0055】
例えば、以下のようにしてmHAエピトープペプチドから調製したMHC-テトラマーを用いてHCT後患者末梢血中の造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLを定量することができる。
【0056】
1.MHC-テトラマーの調製
(1)MHCの調製
大腸菌による組換蛋白発現系を用いてHLA A*3303重鎖およびβ2ミクログロブリンを大量に作成、精製する。なお、HLA A*3303重鎖C末端には、ビオチンリガーゼが認識するアミノ酸配列を予め付加しておく。精製HLA A*3303重鎖およびβ2ミクログロブリンをそれぞれ8M尿素に溶解した。200 ml の refolding buffer (pH8.0 ; 100 mM Tris-HCl, 400 mM L-arginine-HCl, 2 mM EDTA, 0.5 mM oxidative glutathione, 5 mM reduced glutathione)内に、配列番号4のペプチド12mg、HLA A*3303重鎖18.6mg、β2ミクログロブリン13.2mgそれぞれを27ゲージ針の付いた注射器を用いて注射した。10℃恒温槽において48〜72時間撹拌し、MHCの形成を促した後、MHCを含むrefolding bufferを1.8Lの蒸留水に対して24時間、4℃恒温槽において透析し、透析後のrefolding bufferをセントリプレップ10(MILLIPORE, Bedford, MA)を用いて2mlに濃縮する。Superdex 200 HR (Amersham Pharmacia Biotech AB, Uppsala, Sweden)カラムを用いたゲル濾過クロマトグラフィーにて分子量45KDあたりに流出するMHCを単離する。
【0057】
(2)ビオチン化MHCの調製
ビオチンリガーゼ(AVIDITY, Denver, CO)を用いて、HLA A*3303重鎖C末端の特異的部位にビオチンを結合させる。Superdex 200 HRカラムを用いたゲル濾過クロマトグラフィーにてビオチンを付加したMHCを精製する。
【0058】
(3)MHC-テトラマーの調製
PE標識ストレプトアビジン (Molecular Probe, Eugene, OR)と精製ビオチン化MHCをモル比1:4で混合する。Superdex 200 HRカラムを用いたゲル濾過クロマトグラフィーにて分子量480KDあたりに流出する配列番号5のペプチドを含むMHC-テトラマーを単離する。セントリコン10(MILLIPORE)を用いて約3mg/mlに濃縮し、4℃に保存する。保存剤としては、Na-Azide、EDTA、Leupeptin、Pepstatinを添加すればよい。
【0059】
2.MHC-テトラマーを用いた造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLの定量
Cathepsin Hタンパク質のHLA-A33で提示されるmHAエピトープペプチドが不適合なドナーとのHCTを受けたHLA-A33を有する患者からHCT後31日目に分離した末梢血リンパ球(1×106)、あるいは前記患者の末梢血リンパ球を配列番号4に示すペプチドで2週間刺激した後増殖してきたリンパ球(1×106)を1.5mlエッペンドルフチューブ内で50μLの2%FCS含有PBSに懸濁する。これに、配列番号4のペプチドを含むMHC-テトラマー、FITC標識抗CD8抗体(CALTAG, Burlingame, CA)を各1μLずつ添加し、37℃恒温槽に15分静置し反応させる。反応後の細胞を2% FCS含有PBS 1mlで3回洗浄し、次いで、0.5%パラホルムアルデヒド含有PBS(1ml)に懸濁した。前記MHC-テトラマーと結合したCD8+CTLは標識色素により染色され、FACS Calibur(ベクトン・デイッキンソン)を用いてFITC-CD8+T細胞中のテトラマー陽性細胞をカウントし、その割合を計算する。
【0060】
この結果、MHC-テトラマーに結合した、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+CTLは染色されるので右に移動する。このことから、前記MHC-テトラマーが配列番号4のmHAエピトープペプチドで刺激されて増殖してきたCD8+CTLを特異的に染色していることを示すことができる。
【0061】
5.適合性の遺伝子診断
Cathepsin H遺伝子の該多型部位を含む領域を利用し、公知のPCR法等を実施することによって、HCT療法におけるドナーと患者の適合性を遺伝学的に診断し、GVTを強化する免疫療法に有用な組み合わせか否かの診断を行うことができる。すなわち、ドナーと患者のCathepsin-H遺伝子の一塩基多型(SNP)のタイピングを行うことにより、両者の適合性を診断することができる。なお、PCR法で用いる少なくとも一方のオリゴヌクレオチドプライマー及び/又はプローブの塩基配列は、Cathepsin H遺伝子の該多型部位を含み、かつドナーと患者が保有する該多型部位がPCR法によって確認され得る限り、そのオリゴヌクレオチドプライマー及び/又はプローブの塩基数は、一般的に用いられる18〜30merの範囲内において適宜設定することができる。そのようなオリゴヌクレオチドプライマー及び/又はプローブの塩基配列として利用し得る塩基配列の一例に、本発明のmHAエピトープペプチドをコードする塩基配列が含まれる。診断には、以下のような方法が挙げられる。
【0062】
(1)TaqMan PCRによる方法
Cathepsin H遺伝子の各多型部位を挟む領域を増幅するようにPCRプライマーを設計する。また、Cathepsin H遺伝子の該多型部位を含む領域の塩基配列に特異的なプローブに異なった蛍光物質(FAMやVIC等の蛍光レポーター色素)及び消光物質を結合したものを準備し、前記PCRプライマーと共に試料DNA(患者およびドナーの末梢血約1mlから市販のDNA抽出キット(例えば、キアゲン社のQIAamp DNA Blood Mini Kit)等を用いてDNAを分離精製したもの)に対しPCR反応を行うと、該当する塩基配列が存在する場合のみ対応するプローブが分解されて蛍光を発生するようになる。なお、PCR反応は、試料DNAの塩基配列とプローブの塩基配列間で1個のミスマッチが存在する場合にハイブリダイズしないストリンジェンシー条件を用いて両配列をハイブリダイズさせる。ストリンジェンシー条件は、実施されるハイブリダイゼーションの条件によって異なるが、当業者であればハイブリダイゼーションのプロトコルに基づいて、温度、塩濃度、界面活性剤濃度等の溶媒組成等の条件を適宜設定することができる。発生した蛍光を測定することで、ドナー及び患者のCathepsin Hタンパク質の第11番目のアミノ酸のパターンを判読する。ドナーと患者間でタイピングを施行することにより、該mHAエピトープペプチドが適合であるか、あるいは不適合であるかを確認し、不適合である場合にはGVTを強化する免疫療法に有用な組み合わせであるか否かを診断することが可能となる。
【0063】
(2)アリル特異的PCRによる方法
PCRプライマーの一方の3’側がCathepsin H遺伝子の該多型部位を含む領域の各塩基配列に特異的となるようにプライマーを設計する。他方のプライマーは両アリル共通とする。PCR反応を上記のようにして調製した試料DNAに対して個々に行うと、Cathepsin H遺伝子の該多型部位を含む領域の塩基配列に適合するプライマーが存在する場合のみPCR反応で増幅が起こるため、HCT療法におけるドナーと患者の適合性の判定が可能となる。
【0064】
(3)PCR-RFLPによる方法
Cathepsin H遺伝子の該多型部位を含む領域を増幅するようにPCRプライマーを設計する。PCR反応を上記のように調製した試料DNAに対して個々に行った後に、各Cathepsin H遺伝子の各多型部位を含む領域の塩基配列を特異的に認識するような制限酵素を用いて消化した後ゲル上で電気泳動して、切断の有無により試料中のCathepsin H遺伝子の各多型部位を含む領域の有無を確認し、HCT療法におけるドナーと患者の適合性を判定する。
【0065】
(4)直接塩基配列決定による方法
Cathepsin H遺伝子の該多型部位を含む領域を増幅するようにPCRプライマーを設定し、PCR反応を上記のように調製した試料DNAに対して個々に行う。PCR増幅産物を精製後鋳型として用い、PCRに使用したプライマーを使って直接塩基配列決定を行い、Cathepsin H遺伝子の該多型部位を含む領域の増幅部分の塩基配列を直接読みとる。その配列の結果をもとに、HCT療法におけるドナーと患者の適合性を判定する。
【0066】
その他、Invador法、MALDI-TOF/MS法等の質量分析法、PCR-SSCP(single strand conformation polymorphism)、RCA法を用いても診断することができる。さらに、Cathepsin H遺伝子の該多型部位を含む領域を固定したDNAチップを用いて診断することもできる。これらの方法は、公知であり、例えば、ポストシークエンスのゲノム化学1 SNP遺伝子多型の戦略 松原謙一他編集 中山書店 2000年6月30日発行 等の記載に従い行うことができる。
【0067】
以上のようなPCRを用いた各種方法による結果によって、HCT療法におけるドナー及び患者由来のCathepsin Hタンパク質の多型部位及び/又はCathepsin Hタンパク質のmHAエピトープペプチドをコードする塩基配列を確認してHCT療法におけるドナーと患者の適合性を判定し、GVTを強化する免疫療法に有用な組み合わせか否かの診断を行うことができる。以下に、得られたPCR増幅産物についてドナー及び患者間の遺伝子タイピングを行った結果に基づいた判定の一例を示す。ただし、これに限定されるものではない。
【0068】
HLA-A33またはA31を有するドナー及び患者間において、Cathepsin Hタンパク質の適合性を確認し、患者のGVTを強化する免疫療法が有効であるかを判定する有用なCathepsin H遺伝子の多型部位を含む領域としては、一例として、配列番号4及び/又は配列番号5のmHAエピトープペプチドが利用可能である。
【0069】
例えば、前記各種PCR法による結果、(1)ドナーから調製したDNA試料中に配列番号4のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在し、(2)患者から調製したDNA試料中に配列番号5のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在する場合は、両者のCathepsin Hタンパク質が不適合であり、この場合、ドナー由来のCD8+CTLは患者のGVTを強化し得る。
【0070】
また、逆に、(1)ドナーから調製したDNA試料中に配列番号5のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在し、(2)患者から調製したDNA試料中に、配列番号4のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在する場合にも、両者のCathepsin Hタンパク質は不適合であり、ドナー由来のCD8+CTLは患者のGVTを強化し得る。
【0071】
さらに、(1)ドナーから調製したDNA試料中に配列番号4または5のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在し(すなわちドナーが配列番号4または5の塩基配列のホモ接合である場合)、(2)患者から調製したDNA試料中に、配列番号4および5のmHAエピトープペプチドをコードする塩基配列とハイブリダイズする塩基配列が存在する場合(すなわち患者が配列番号4および5の塩基配列のヘテロ接合である場合)にも、両者のCathepsin Hタンパク質は不適合であり、ドナー由来のCD8+CTLは患者のGVTを強化し得る。
【0072】
しかしながら、ドナーから調製したDNA試料及び患者から調製したDNA試料に、配列番号4又は5(すなわち配列番号4又は5の塩基配列のホモ接合である場合)あるいは4及び5(すなわち配列番号4及び5の塩基配列のヘテロ接合である場合)の同じ配列番号のmHAエピトープペプチドをコードする塩基配列がハイブリダイズする塩基配列が存在する場合には、両者のCathepsin Hタンパク質は適合しており、ドナー由来のCD8+CTLは患者のGVTを強化するのに適当ではない。
【0073】
なお、これらの組み合わせのペプチドをコードする塩基配列のうち、いずれかのペプチドをコードする塩基配列の単独使用によりPCR法を実施することもできるが、判定の結果の精度を高め、DNA断片の由来を確実に確認するために、これらのペプチドをコードする塩基配列は組み合わせて使用することが望ましい。
【0074】
一方、GVT反応の反対の反応が宿主対移植片反応であり、これはHCTの際に輸注したドナーの造血細胞の拒絶に結びつく危険な反応であるが、輸血歴の長い再生不良性貧血や骨髄異形成症候群の患者において比較的発生しやすい移植造血細胞の拒絶リスクの予測にも本発明のペプチドを利用できる可能性がある。
【実施例】
【0075】
以下に実施例を示し、本発明を具体的に説明するが、本発明はこれらに限定されるものではない。
[実施例1] 造血器腫瘍細胞を傷害し得るCD8+CTLエピトープペプチドの同定
1.各種材料の調製
(1)血液の入手
造血器腫瘍である白血病(2症例の急性骨髄性白血病(HLA-A33およびHLA-A31))に対しHLA一致同胞からHCTを受ける患者の移植前および移植後末梢血及びHCTドナーの末梢血から単核球細胞を分離した。HLA型はDNAタイピング法を用いて測定した。
【0076】
(2)EBV感染B細胞株
HCTドナーおよび移植前の患者末梢血単核球細胞にEBV産生細胞株であるB95-8細胞の上清(生EBVウイルスを含む)を感染させて、EBV感染B細胞株(Lymphoblastoid cell line、以下、EBV感染LCLと称する)を樹立した。
また、HLA-A33又はHLA-A31を持った健常人の末梢血単核球細胞に、同様にEBV産生細胞株であるB95-8細胞の上清を感染させて、EBV感染LCLを樹立した。
【0077】
2.mHAエピトープペプチドに特異的なCD8+CTLの培養樹立
(1) mHAエピトープペプチドに特異的なCD8+CTL
前記1.(1)で取得したHCT後の患者末梢血単核球細胞を、細胞致死量の放射線を照射しておいたHCT前の患者末梢血単核球細胞とともにフラスコ内で混合培養した。ドナーと患者間にはmHAエピトープペプチドの不適合があり、患者のmHAエピトープペプチド(抗原)に反応したドナーリンパ球由来のCD8+CTLが増殖を開始した。CD8+CTLの増殖を助けるために、培養液にはIL-2を添加した。
【0078】
(2) 患者のmHAエピトープペプチドに特異的なCD8+CTLクローンの樹立と細胞傷害性試験
2.(1)で増殖した2症例より得た2つのCD8+CTL株から、限界希釈法を用いてCD8+CTLクローンを樹立した。各々のCD8+CTL株から複数のCTLクローンが得られたが、健常人より作成したEBV感染LCLに対する反応パターンが同等であったので、同一の細胞に起源する娘クローンと考えられた。従って、各々のCD8+CTL株より増殖の良好なCTLクローンを1つずつ選び、以下の実験に供した。選択された2種類のCTLクローンは、51Cr遊離法を用いた細胞傷害性試験において、HCTドナーのEBV感染LCL は傷害しないが、患者のEBV感染LCL は傷害したため、患者のmHAエピトープペプチドに特異的と考えられた。またHLA-A33またはHLA-A31を持った健常人より作成しておいた複数のEBV感染LCLに対する反応性から、2種類のCD8+CTLクローンは、各々、HLA-A33及びHLA-A31によって提示されるmHAエピトープペプチドを認識していることが判明した(以下、HLA-A33拘束性CD8+CTLクローン、HLA-A31拘束性CD8+CTLクローンと称する)。
【0079】
さらに、図7に示すように1例の造血器腫瘍患者(急性骨髄性白血病FAB分類M5b型で、HLA-A31拘束性CD8+CTLクローンを移植後末梢血から樹立した患者で、HLA-A33も併せ持つ)から初発時の白血病細胞を採取し、HLA-A33拘束性CD8+CTLクローンの細胞傷害性を検討したところ、同じ患者より樹立したEBV感染LCLのみならず急性骨髄性白血病細胞を傷害したことより、造血器腫瘍細胞を実際に傷害することが示された。なお、HLA-A33を導入したU937白血病細胞株、同患者より樹立した正常T細胞・B細胞芽球も強く傷害されず、これらの細胞種ではもともとCathepsin H遺伝子の発現が弱い可能性が示唆された。
【0080】
3.リンケージ解析によるmHAをコードする遺伝子の同定
(1) 細胞パネルの作成と細胞傷害性試験
国際組織適合ワークショップよりCEPH(Centre d'Etude du Polymorphisme Humain)家系のEBV感染LCLを入手し、これら各EBV感染LCLにHLA-A33およびHLA-A31遺伝子を各々導入して、HLA-A33又はHLA-A31を細胞表面に発現する各細胞パネルを作成した。これらを標的細胞とし、2. (2)で得られたHLA-A33拘束性CD8+CTLクローン及びHLA-A31拘束性CD8+CTLクローンを用いて51Cr遊離法を用いた細胞傷害性試験を行い、どのEBV感染LCLに、造血器腫瘍患者と同じ多型性を持つmHAエピトープペプチドが存在しているか検討した。その結果、HLA-A33拘束性CD8+CTLクローン及びHLA-A31拘束性CD8+CTLクローンに全く同一の細胞傷害性パターンが示された。HLA-A33拘束性CD8+CTLクローン及びHLA-A31拘束性CD8+CTLクローンの結果を図8に示す。
【0081】
(2) 2点連鎖解析
インターネット上に公開されているFASTLINKソフトウエアおよびCEPH家系の遺伝子解析データベースを、それぞれftp://fastlink.nih.gov/pub/fastlinkおよびhttp://www.cephb.fr/cephdb/より入手し、3.(1)で得た細胞傷害性試験の成績と組み合わせ、2 (1)で得られたHLA-A33拘束性CD8+CTLクローン及びHLA-A31拘束性CD8+CTLクローンが認識している遺伝子座を特定したところ、第15番染色体長腕24-25付近と判明した。この遺伝子座にある34種類の遺伝子のうち、1箇所以上の多型性部位を有し、HLA-A33およびHLA-A31の双方に提示される複数のmHAエピトープペプチドをコードし得る遺伝子を検索したが複数の候補が挙がり、遺伝子の同定には至らなかった。そこでHLA-A33拘束性CD8+CTLクローンを樹立したHLA-A33をもつ患者のEBV感染LCLからメッセンジャーRNAを分離、相補性DNAライブラリーを作成し、発現クローニング法にて遺伝子を検索したところ、第15番染色体長腕24-25に存在するCathepsin Hが同定された。
【0082】
4.HLA-A33又はHLA-A31に結合し得るmHAエピトープペプチドの同定
配列番号1に示すCathepsin Hタンパク質のアミノ酸配列上には遺伝子多型を検索し得る、インターネット上に公開されている米国のNational Institute of Health(NIH)のNational Center for Biotechnology Information(NCBI)のhttp://www.ncbi.nlm.nih.gov/SNP/snp_ref.cgi?rs=2289702によって、3箇所のアミノ酸置換をともなう遺伝子多型の存在が公表されている。これらのうちmHAエピトープペプチドの生成に関わっている多型部位をHLA-A33拘束性CD8+CTLクローンが傷害するかしない複数のEBV感染LCLから得たDNAのCathepsin H遺伝子の塩基配列を比較することで 検索したところ、第11番アミノ酸の多型がHLA-A33拘束性CD8+CTLクローンの細胞傷害性の有無をコントロールしていることが分かった。この部位のペプチド配列をBioInformatics & Molecular Analysis Section (BIMAS)のHLA Peptide Binding Predictions(http://bimas.dcrt.nih.gov/molbio/hla_bind/index.html.)によって照合し、HLA-A33又はHLA-A31の結合モチーフを有する9〜10個のアミノ酸よりなるmHAエピトープ候補ペプチドを多数スクリーニングし、4種のmHAエピトープ候補ペプチドを合成した。これを51Crで放射線ラベルしておいたmHA陰性のHCTドナーの細胞に添加して30分室温で静置した後、適当な数の2.(2)で得られたHLA-A33拘束性CD8+CTLクローン又はHLA-A31拘束性CD8+CTLクローンと混合し、細胞傷害性試験を行った。
【0083】
また、CD8+CTL mHAエピトープペプチドが内因性にプロセスされていることを確認するためにCathepsin H遺伝子の各多型部位をコードするミニ遺伝子を作成し、mHA陰性で拘束性HLAをあらかじめ発現させておいた293T細胞に導入し、これを抗原提示細胞としたインターフェロンγ遊離試験を行った(図9)。ここで、内因性にプロセスされているとは、ミニ遺伝子導入細胞内で新規に作られたCathepsin Hタンパク質が、細胞が本来持つ抗原処理機構により正しい長さの抗原ペプチドに切断され、HLA重鎖とβ2ミクログロブリンと複合体を形成しCathepsin Hミニ遺伝子導入細胞表面に提示されている状態のことを意味する。
【0084】
上記の試験方法に従って、CD8+CTL、またそのCD8+CTLクローンが反応した、以下の配列番号4〜7で表されるmHAエピトープペプチドを得た。これらのペプチドのうち配列番号4及び5は、HLA-A33結合モチーフを有するペプチド配列であり、配列番号4〜7はHLA-A31結合モチーフを有するペプチド配列である。すなわちHLA-A31は9または10個のアミノ酸双方を結合し提示できる。
【0085】
また、配列番号4〜7のmHAエピトープペプチドは配列番号2で表されるCathepsin Hタンパク質のアミノ酸配列において、第11番目のアミノ酸を含んでなる部分ペプチドである(配列番号3)。
Trp Ala Thr Leu Pro Leu Leu Cys Ala Arg(配列番号4)
Trp Ala Thr Leu Pro Leu Leu Cys Ala Gly(配列番号5)
Ala Thr Leu Pro Leu Leu Cys Ala Arg(配列番号6)
Ala Thr Leu Pro Leu Leu Cys Ala Gly(配列番号7)
【0086】
[実施例2] HLA-A2に結合し得るmHAエピトープペプチドの同定
前記の配列番号4〜7に示されるペプチドは、Cathepsin Hタンパク質の第11番目のアミノ酸を各々含む部分ペプチドであって、かつ、HLA-A33又はHLA-A31に結合するmHAエピトープペプチドであったが、さらに、HLA-A2に結合し得るmHAエピトープペプチドを検討するために、Cathepsin Hタンパク質のアミノ酸配列について、インターネット上に公開されているBioInformatics & Molecular Analysis Section(BIMAS)のHLA Peptide Binding Predictions(http://bimas.dcrt.nih.gov/molbio/hla_bind/index.html.)によって照合した結果、HLA-A2結合モチーフを有する9〜10個のアミノ酸よりなるmHAエピトープが存在することが判明し、次の8種のエピトープ候補ペプチドを同定した。
【0087】
これらの配列のうち、配列番号8〜15で表されるペプチドは、Cathepsin Hタンパク質のアミノ酸配列において、第11番目アミノ酸を含む部分ペプチドである。
Leu Leu Cys Ala Arg Ala Trp Leu Leu(配列番号8)
Leu Leu Cys Ala Arg Ala Trp Leu Leu(配列番号9)
Pro Leu Leu Cys Ala Arg Ala Trp Leu(配列番号10)
Pro Leu Leu Cys Ala Gly Ala Trp Leu(配列番号11)
Arg Ala Trp Leu Leu Gly Val Pro Val(配列番号12)
Gly Ala Trp Leu Leu Gly Val Pro Val(配列番号13)
Pro Leu Leu Cys Ala Arg Ala Trp Leu Leu(配列番号14)
Pro Leu Leu Cys Ala Gly Ala Trp Leu Leu(配列番号15)
【0088】
[実施例3]ワクチン注射剤
DMSOに、配列番号4〜17のペプチドを最終濃度20mg/mlとなるように各々溶解し、ろ過滅菌した。得られたペプチド含有溶液を滅菌バイアル瓶に1mlずつ分注密栓し、ワクチン注射剤とした。
【図面の簡単な説明】
【0089】
【図1】CD8+CTLによる造血器腫瘍細胞又は固形腫瘍細胞の認識機構を示す図である。
【図2】MHC-テトラマーの調製方法を示す図である。
【図3】MHC-テトラマーとCD8+CTLの結合を示す図である。
【図4】MHC−磁気ビーズの調製方法を示す図である。
【図5】MHC−磁気ビーズによるCD8+CTLの単離を示す図である。
【図6】mHAエピトープペプチド、及びその後の抗CD3抗体、IL-2による刺激による、CD8+CTLの増殖を示す図である。
【図7】HLA-A24拘束性クローンと結合するCD8+CTLによる白血病細胞株を含む種々の標的細胞に対する細胞傷害性を示す図である。
【図8】HLA-A33拘束性クローン、HLA-A31拘束性クローンが、CEPH家系(家系番号1347番および1413番)より樹立したEBV感染LCLに各々HLA-A33、HLA-A31を発現させたものに対して、全く同様なパターンで傷害するのを示す図である。
【図9】各CTLクローンが認識するエピトープペプチドの同定の結果を示す図である。
【特許請求の範囲】
【請求項1】
Cathepsin Hタンパク質の部分ペプチドであって、かつ、ヒト主要組織適合性抗原(HLA)と結合してCD8+細胞傷害性Tリンパ球によって認識され得るマイナー組織適合性抗原(mHA)エピトープペプチド。
【請求項2】
Cathepsin Hタンパク質の部分ペプチドのアミノ酸残基数が5〜20個である請求項1記載のマイナー組織適合性抗原(mHA)エピトープペプチド。
【請求項3】
Cathepsin Hタンパク質の部分ペプチドのアミノ酸残基数が9〜10個である請求項2記載のマイナー組織適合性抗原(mHA)エピトープペプチド。
【請求項4】
Cathepsin Hタンパク質の部分ペプチドが、配列番号1で表されるアミノ酸配列において、第11番目のアミノ酸を含んでなる部分ペプチドである、請求項1〜3のいずれか1項に記載のペプチド。
【請求項5】
HLAがHLA-A33である、請求項1〜4のいずれか1項に記載のペプチド。
【請求項6】
配列番号3又は4で示されるアミノ酸配列からなるペプチドである、請求項5に記載のペプチド。
【請求項7】
HLAがHLA-A31である、請求項1〜4のいずれか1項に記載のペプチド。
【請求項8】
配列番号4〜7で示されるアミノ酸配列からなる群から選択されるペプチドである、請求項7に記載のペプチド。
【請求項9】
HLAがHLA-A2である、請求項1〜4のいずれか1項に記載のペプチド。
【請求項10】
配列番号8〜15で示されるアミノ酸配列からなる群から選択されるペプチドである、請求項9に記載のペプチド。
【請求項11】
CD8+細胞傷害性Tリンパ球が、造血器腫瘍細胞又は固形腫瘍細胞を傷害するものである、請求項1〜10のいずれか1項に記載のペプチド。
【請求項12】
造血器腫瘍が白血病、骨髄異形成症候群、悪性リンパ腫又は多発性骨髄腫である、請求項11に記載のペプチド。
【請求項13】
固形腫瘍が腎細胞癌、悪性黒色腫、乳癌、胃癌、肺癌又は前立腺癌である、請求項11に記載のペプチド。
【請求項14】
請求項1〜13のいずれか1項に記載のペプチド又は該ペプチドをパルスした抗原提示細胞を有効成分として含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するためのワクチン。
【請求項15】
請求項1〜13のいずれか1項に記載のペプチド又は該ペプチドをパルスした抗原提示細胞により末梢血リンパ球を刺激して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【請求項16】
請求項1〜13のいずれか1項に記載のペプチドから調製した主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーと末梢血リンパ球とを反応させ、該主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体から単離して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【請求項17】
請求項1〜13のいずれか1項に記載のペプチドから調製した主要組織適合抗原複合体−標識磁気ビーズと末梢血リンパ球とを反応させ、主要組織適合抗原複合体−標識磁気ビーズにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体から単離して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【請求項18】
請求項1〜13のいずれか1項に記載のペプチドで末梢血を刺激してCD8+細胞傷害性Tリンパ球を得、該CD8+細胞傷害性Tリンパ球が産生するサイトカイン及び/又はケモカインを測定することを特徴とする、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+細胞傷害性Tリンパ球の定量方法。
【請求項19】
請求項1〜13のいずれか1項に記載のペプチドから主要組織適合性複合体及び/又は主要組織適合性複合体−テトラマーを調製し、該主要組織適合性複合体及び/又は主要組織適合性複合体−テトラマーと末梢血とを反応させる、該末梢血中の造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+細胞傷害性Tリンパ球の定量方法。
【請求項20】
同種造血細胞移植におけるドナー及び患者由来のDNAを配列番号2に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列を用いて遺伝子タイピングを行うことを含む、同種造血細胞移植適合性診断方法。
【請求項21】
同種造血細胞移植におけるドナー及び患者由来のDNAを配列番号2に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列を用いてPCR法により増幅し、得られたPCR増幅産物についてドナー及び患者間の遺伝子タイピングを行うことを含む、請求項20記載の同種造血細胞移植適合性診断方法。
【請求項22】
Cathepsin H遺伝子の多型部位を含む領域の塩基配列の塩基長が18〜30merである、請求項20または21に記載の同種造血細胞移植適合性診断方法。
【請求項23】
配列番号1に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列が、請求項1に記載のmHAエピトープペプチドをコードする塩基配列である、請求項20〜22のいずれか1項に記載の診断方法。
【請求項24】
請求項1〜13のいずれか1項に記載のペプチドの少なくとも1種類のペプチドでパルスされ、表面に発現しているHLAに上記ペプチドが結合している単離した抗原提示細胞。
【請求項25】
抗原提示細胞を請求項1〜13のいずれか1項に記載のペプチドの少なくとも1種類のペプチドとともにin vitroで培養することを含む、抗原提示細胞の活性化法であって、活性化された抗原提示細胞がCD8+細胞傷害性Tリンパ球を刺激し得る、活性化法。
【請求項26】
以下の(a)〜(c)のいずれかの方法により、造血器腫瘍又は固形腫瘍の予防及び治療に用いることができるCD8+細胞傷害性Tリンパ球を調製する方法。
(a) 請求項1〜13のいずれか1項に記載のペプチド又は該ペプチドでパルスした抗原提示細胞を用いて、in vitro で末梢血リンパ球を刺激することを含む方法、
(b) 請求項1〜13のいずれかに1項に記載のペプチドから調製した主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーと末梢血リンパ球とを反応させ、該主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体からCD8+細胞傷害性Tリンパ球を単離することを含む方法、及び
(c) 請求項1〜13のいずれか1項に記載のペプチドから調製した主要組織適合抗原複合体−標識磁気ビーズと末梢血リンパ球とを反応させ、主要組織適合抗原複合体−標識磁気ビーズにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体からCD8+細胞傷害性Tリンパ球を単離することを含む方法
【請求項27】
請求項26記載の方法により得られた、造血器腫瘍又は固形腫瘍の予防及び治療に用いることができる単離されたCD8+細胞傷害性Tリンパ球。
【請求項1】
Cathepsin Hタンパク質の部分ペプチドであって、かつ、ヒト主要組織適合性抗原(HLA)と結合してCD8+細胞傷害性Tリンパ球によって認識され得るマイナー組織適合性抗原(mHA)エピトープペプチド。
【請求項2】
Cathepsin Hタンパク質の部分ペプチドのアミノ酸残基数が5〜20個である請求項1記載のマイナー組織適合性抗原(mHA)エピトープペプチド。
【請求項3】
Cathepsin Hタンパク質の部分ペプチドのアミノ酸残基数が9〜10個である請求項2記載のマイナー組織適合性抗原(mHA)エピトープペプチド。
【請求項4】
Cathepsin Hタンパク質の部分ペプチドが、配列番号1で表されるアミノ酸配列において、第11番目のアミノ酸を含んでなる部分ペプチドである、請求項1〜3のいずれか1項に記載のペプチド。
【請求項5】
HLAがHLA-A33である、請求項1〜4のいずれか1項に記載のペプチド。
【請求項6】
配列番号3又は4で示されるアミノ酸配列からなるペプチドである、請求項5に記載のペプチド。
【請求項7】
HLAがHLA-A31である、請求項1〜4のいずれか1項に記載のペプチド。
【請求項8】
配列番号4〜7で示されるアミノ酸配列からなる群から選択されるペプチドである、請求項7に記載のペプチド。
【請求項9】
HLAがHLA-A2である、請求項1〜4のいずれか1項に記載のペプチド。
【請求項10】
配列番号8〜15で示されるアミノ酸配列からなる群から選択されるペプチドである、請求項9に記載のペプチド。
【請求項11】
CD8+細胞傷害性Tリンパ球が、造血器腫瘍細胞又は固形腫瘍細胞を傷害するものである、請求項1〜10のいずれか1項に記載のペプチド。
【請求項12】
造血器腫瘍が白血病、骨髄異形成症候群、悪性リンパ腫又は多発性骨髄腫である、請求項11に記載のペプチド。
【請求項13】
固形腫瘍が腎細胞癌、悪性黒色腫、乳癌、胃癌、肺癌又は前立腺癌である、請求項11に記載のペプチド。
【請求項14】
請求項1〜13のいずれか1項に記載のペプチド又は該ペプチドをパルスした抗原提示細胞を有効成分として含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するためのワクチン。
【請求項15】
請求項1〜13のいずれか1項に記載のペプチド又は該ペプチドをパルスした抗原提示細胞により末梢血リンパ球を刺激して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【請求項16】
請求項1〜13のいずれか1項に記載のペプチドから調製した主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーと末梢血リンパ球とを反応させ、該主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体から単離して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【請求項17】
請求項1〜13のいずれか1項に記載のペプチドから調製した主要組織適合抗原複合体−標識磁気ビーズと末梢血リンパ球とを反応させ、主要組織適合抗原複合体−標識磁気ビーズにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体から単離して得られるCD8+細胞傷害性Tリンパ球を含む、同種造血細胞移植後に残存又は再発した造血器腫瘍あるいは固形腫瘍を治療するか、又は同種造血細胞移植後の造血器腫瘍あるいは固形腫瘍の再発を予防するための受動免疫療法剤。
【請求項18】
請求項1〜13のいずれか1項に記載のペプチドで末梢血を刺激してCD8+細胞傷害性Tリンパ球を得、該CD8+細胞傷害性Tリンパ球が産生するサイトカイン及び/又はケモカインを測定することを特徴とする、造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+細胞傷害性Tリンパ球の定量方法。
【請求項19】
請求項1〜13のいずれか1項に記載のペプチドから主要組織適合性複合体及び/又は主要組織適合性複合体−テトラマーを調製し、該主要組織適合性複合体及び/又は主要組織適合性複合体−テトラマーと末梢血とを反応させる、該末梢血中の造血器腫瘍細胞又は固形腫瘍細胞を傷害するCD8+細胞傷害性Tリンパ球の定量方法。
【請求項20】
同種造血細胞移植におけるドナー及び患者由来のDNAを配列番号2に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列を用いて遺伝子タイピングを行うことを含む、同種造血細胞移植適合性診断方法。
【請求項21】
同種造血細胞移植におけるドナー及び患者由来のDNAを配列番号2に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列を用いてPCR法により増幅し、得られたPCR増幅産物についてドナー及び患者間の遺伝子タイピングを行うことを含む、請求項20記載の同種造血細胞移植適合性診断方法。
【請求項22】
Cathepsin H遺伝子の多型部位を含む領域の塩基配列の塩基長が18〜30merである、請求項20または21に記載の同種造血細胞移植適合性診断方法。
【請求項23】
配列番号1に示すCathepsin H遺伝子の多型部位を含む領域の塩基配列が、請求項1に記載のmHAエピトープペプチドをコードする塩基配列である、請求項20〜22のいずれか1項に記載の診断方法。
【請求項24】
請求項1〜13のいずれか1項に記載のペプチドの少なくとも1種類のペプチドでパルスされ、表面に発現しているHLAに上記ペプチドが結合している単離した抗原提示細胞。
【請求項25】
抗原提示細胞を請求項1〜13のいずれか1項に記載のペプチドの少なくとも1種類のペプチドとともにin vitroで培養することを含む、抗原提示細胞の活性化法であって、活性化された抗原提示細胞がCD8+細胞傷害性Tリンパ球を刺激し得る、活性化法。
【請求項26】
以下の(a)〜(c)のいずれかの方法により、造血器腫瘍又は固形腫瘍の予防及び治療に用いることができるCD8+細胞傷害性Tリンパ球を調製する方法。
(a) 請求項1〜13のいずれか1項に記載のペプチド又は該ペプチドでパルスした抗原提示細胞を用いて、in vitro で末梢血リンパ球を刺激することを含む方法、
(b) 請求項1〜13のいずれかに1項に記載のペプチドから調製した主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーと末梢血リンパ球とを反応させ、該主要組織適合抗原複合体及び/又は主要組織適合抗原複合体−テトラマーにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体からCD8+細胞傷害性Tリンパ球を単離することを含む方法、及び
(c) 請求項1〜13のいずれか1項に記載のペプチドから調製した主要組織適合抗原複合体−標識磁気ビーズと末梢血リンパ球とを反応させ、主要組織適合抗原複合体−標識磁気ビーズにCD8+細胞傷害性Tリンパ球が結合した結合体を形成させ、該結合体からCD8+細胞傷害性Tリンパ球を単離することを含む方法
【請求項27】
請求項26記載の方法により得られた、造血器腫瘍又は固形腫瘍の予防及び治療に用いることができる単離されたCD8+細胞傷害性Tリンパ球。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2006−129832(P2006−129832A)
【公開日】平成18年5月25日(2006.5.25)
【国際特許分類】
【出願番号】特願2004−325328(P2004−325328)
【出願日】平成16年11月9日(2004.11.9)
【出願人】(304031427)愛知県 (36)
【Fターム(参考)】
【公開日】平成18年5月25日(2006.5.25)
【国際特許分類】
【出願日】平成16年11月9日(2004.11.9)
【出願人】(304031427)愛知県 (36)
【Fターム(参考)】
[ Back to top ]

